Спосіб одержання гідроксамових кислот
Формула / Реферат
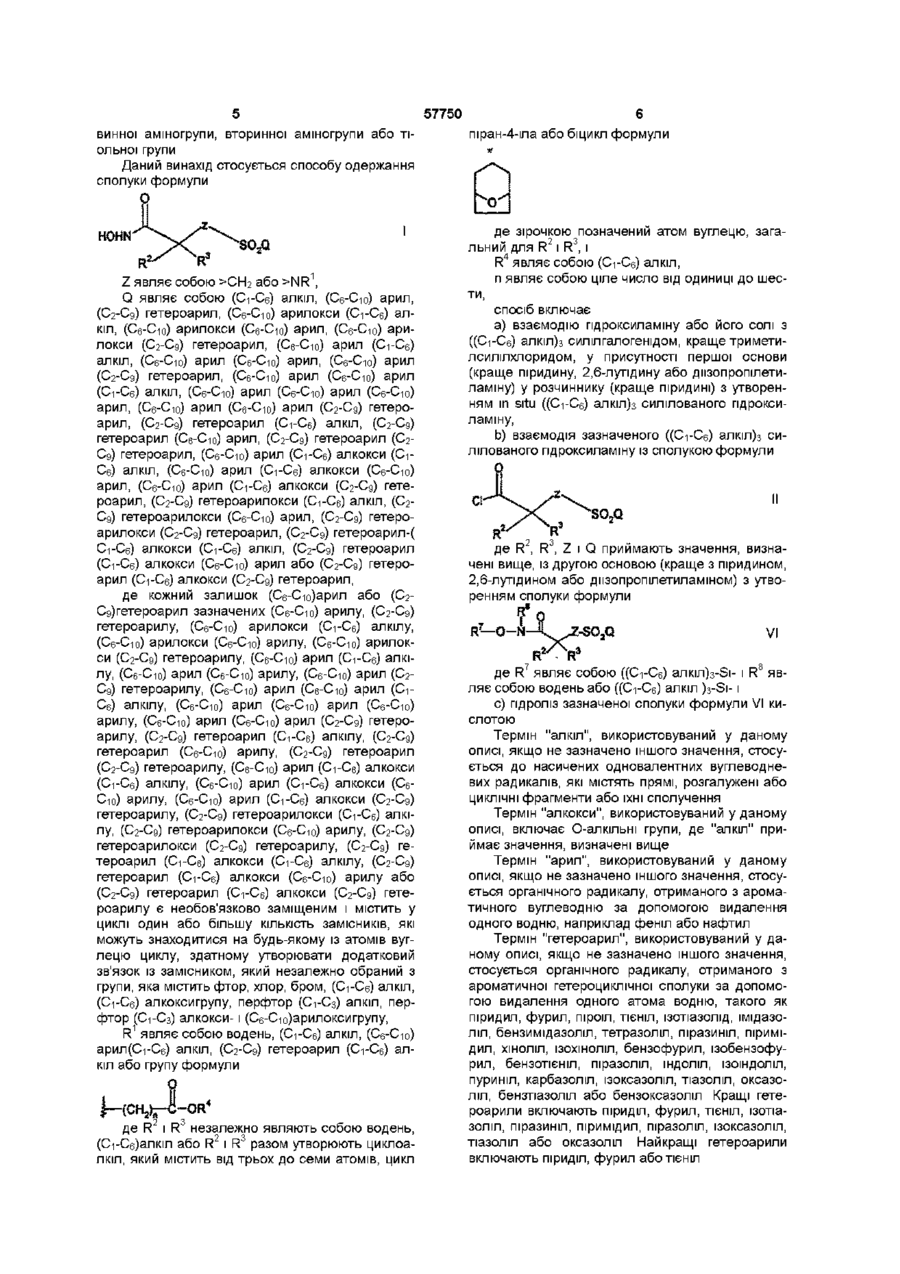
1. Спосіб одержання сполуки формули
(I),
де Z є СН2 або NR1;
Q є С1-6-алкіл, С6-10-арил, С2-9-гетероарил, С6-10-арилоксі-С1-6-алкіл, С6-10-арилоксі-С6-10-арил, С6-10-арилокси-С2-9-гетероарил, С6-10-арил-С1-6-алкіл, С6-10-арил-С6-10-арил, С6-10-арил-С2-9-гетероарил, С6-10-арил-С6-10-арил-С1-6-алкіл, С6-10-арил-С6-10-арил-С6-10-арил, С6-10-арил-С6-10-арил-С2-9-гетероарил, С2-9-гетероарил-С1-6-алкіл, С2-9-гетероарил-С6-10-арил, С2-9-гетероарил-С2-9-гетероарил, С6-10-арил-С1-6-алкоксі-С1-6-алкіл, С6-10-арил-С1-6-алкоксі-С6-10-арил, С6-10-арил-С1-6-алкокси-С2-9-гетероарил, С2-9-гетероарилоксі-С1-6-алкіл, С2-9-гетероарилоксі-С6-10-арил, С2-9-гетероарилокси-С2-9-гетероарил, С2-9-гетероарил-С1-6-алкоксі-С1-6-алкіл, С2-9-гетероарил-С1-6-алкоксі-С6-10-арил або С2-9-гетероарил-С1-6-алкокси-С2-9-гетероарил,
де кожен із залишків С6-10-арил або С2-9-гетероарил зазначених С6-10-арилу, С2-9-гетероарилу, С6-10-арилоксі-С1-6-алкілу, С6-10-арилоксі-С6-10-арилу, С6-10-арилокси-С2-9-гетероарилу, С6-10-арил-С1-6-алкілу, С6-10-арил-С6-10-арилу, С6-10-арил-С2-9-гетероарилу, С6-10-арил-С6-10-арил-С1-6-алкілу, С6-10-арил-С6-10-арил-С6-10-арилу, С6-10-арил-С6-10-арил-С2-9-гетероарилу, С2-9-гетероарил-С1-6-алкілу, С2-9-гетероарил-С6-10-арилу, С2-9-гетероарил-С2-9-гетероарилу, С6-10-арил-С1-6-алкоксі-С1-6-алкілу,С6-10-арил-С1-6-алкоксі-С6-10-арилу, С6-10-арил-С1-6-алкокси-С2-9-гетероарилу, С2-9-гетероарилоксі-С1-6-алкілу, С2-9-гетероарилоксі-С6-10-арилу, С2-9-гетероарилокси-С2-9-гетероарилу, С2-9-гетероарил-С1-6-алкоксі-С1-6-алкілу, С2-9-гетероарил-С1-6-алкоксі-С6-10-арилу або С2-9-гетероарил-С1-6-алкокси-С2-9-гетероарилу є необов'язково заміщеним та має в циклі один або більше замісників, які можуть знаходитися біля будь-якого з атомів вуглецю циклу, що здатен утворювати додатковий зв'язок із замісником, який незалежно обраний з групи: фтор, хлор, бром, С1-6-алкіл, С1-6-алкокси, перфтор-С1-3-алкіл, перфтор-С1-3-алкокси та С6-10-арилокси;
R1 є водень, С1-6-алкіл, С6-10-арил-С1-6-алкіл, С2-9-гетероарил-С1-6-алкіл або група формули
;
R2 та R3 незалежно один від одного є водень, С1-6-алкіл або
R2 та R3 разом утворюють циклоалкіл, який містить від трьох до семи атомів, піран-4-іл або біцикл формули
,
де зірочкою позначено атом вуглецю, загальний для R2 та R3;
R4 є С1-6-алкіл;
n ціле число від 1 до 6,
що включає:
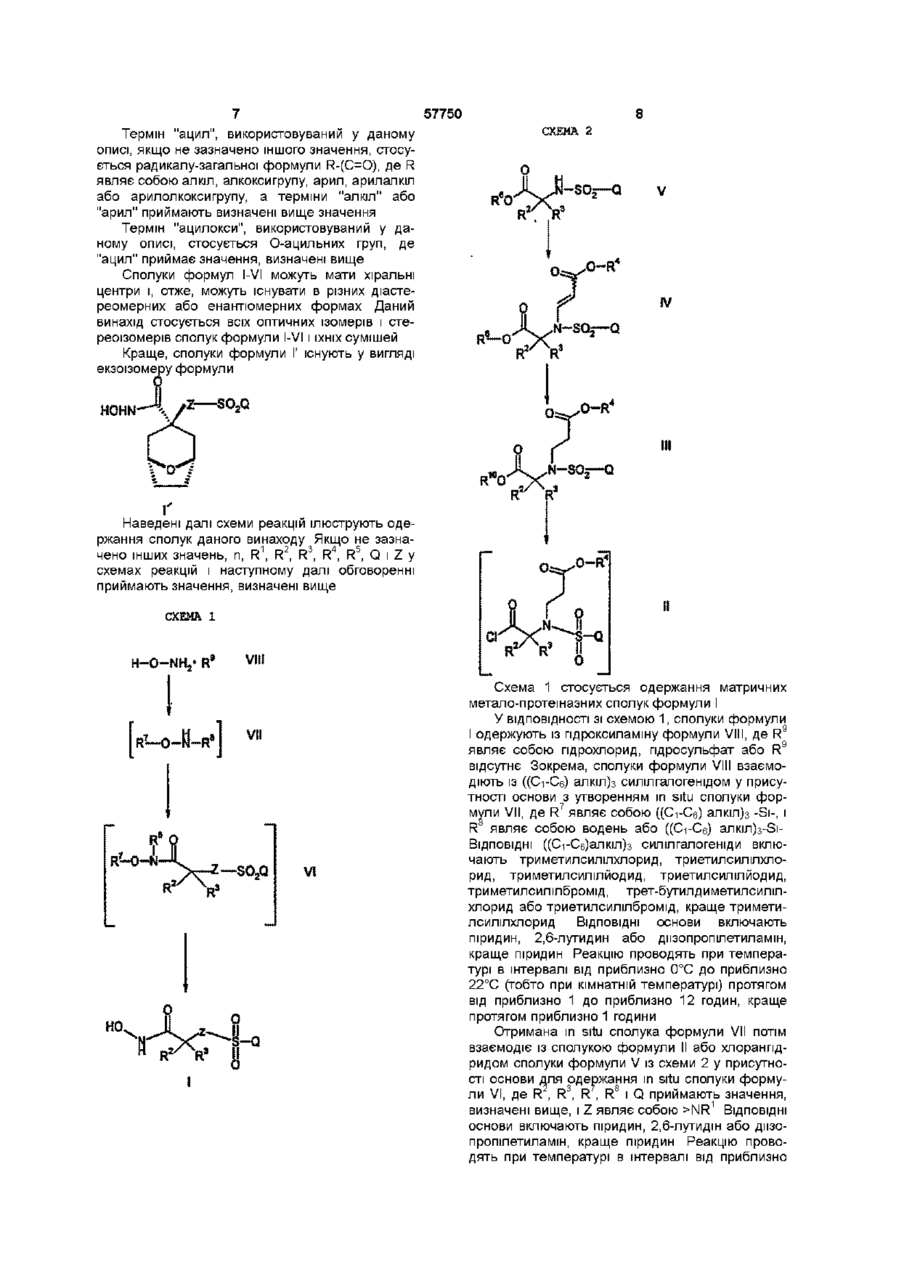
a) взаємодію гідроксиламіну або його солі з (С1-6-алкіл)3-силілгалогенідом у присутності першої основи з утворенням in situ (С1-6-алкіл)3-силілованого гідроксиламіну;
b) взаємодію зазначеного (С1-6-алкіл)3-силілованого гідроксиламіну зі сполукою формули
(II),
де R2, R3, Z та Q мають значення, вказані вище, із другою основою з утворенням сполуки формули
(VI),
де R7 є (С1-6-алкіл)3-Si- та R8 є водень або (С1-6-алкіл)3-Si-;
с) гідроліз сполуки формули VI кислотою.
2. Спосіб за п. 1, де першою основою є піридин, 2,6-лутидин або діізопропілетиламін.
3. Спосіб за п. 1, де першою основою є піридин.
4. Спосіб за п. 1, де (С1-6-алкіл)3-силілгалогенідом є триметилсилілхлорид.
5. Спосіб за п. 1, де другою основою є піридин, 2,6-лутидин або діізопропілетиламін.
6. Спосіб за п. 1, де другою основою є піридин.
7. Спосіб за п. 1, де розчинником є піридин.
Текст
1 Спосіб одержання сполуки формули О HOHN fleZeCH2a6oNR1 Q є Сі 6-алкіл, Сє ю-арил, _ g-гетероарил, Сє юю-арилоксі-Сб ю-арил, Сє юарилоксі-Сі 6-алкіл, арилокси-Сг g-гетероарил, Сє ю-арил-Сі є-алкіл, CQ ю-арил-Сб ю-арил, CQ ю-арил-Сг д-гетероарил, Сє ю-арил-Сб ю-арил-Сі є-алкіл, CQ ю-арил-Сє ю-арилСє ю-арил, Сє ю-арил-Сб ю-арил-Сг д-гетероарил, Сг д-гетероарил-Сі є-алкіл, C-z д-гетероарил-Сє юарил, Сг д-гетероарил-Сг д-гетероарил, CQ ю-арилСі 6-алкоксі-Сі 6-алкіл, Сє ю-арил-Сі є-алкоксі-Сє юарил, Сє ю-арил-Сі є-алкокси-Сг д-гетероарил, C-z gгетероарилоксі-Сі є-алкіл, C-z д-гетероарилоксі-Сє ю-арил, Сг д-гетероарилокси-Сг д-гетероарил, C-z gгетероарил-Сі 6-алкоксі-Сі є-алкіл, C-z д-гетероарилСі 6-алкоксі-Сб ю-арил або C-z д-гетероарил-Сі єалкокси-Сг д-гетероарил, де кожен із залишків Сє-ю-арил або C-z gгетероарил зазначених Сє ю-арилу, C-z gгетероарилу, Сє ю-арилоксі-Сі є-алкілу, Сє юарилоксі-Сє ю-арилу, Сє-ю-арилокси-Сг дгетероарилу, Сє ю-арил-Сі є-алкілу, Сє ю-арил-Сє ю-арилу, Сє ю-арил-Сг д-гетероарилу, Сє ю-арилСє ю-арил-Сі 6-алкілу, Сє ю-арил-Сє ю-арил-Сє ю арилу, Сє ю-арил-Сб ю-арил-Сг д-гетероарилу, C-z gгетероарил-Сі 6-алкілу, C-z д-гетероарил-Сє юарилу, Сг д-гетероарил-Сг д-гетероарилу, Сє юарил-Сі 6-алкоксі-Сі є-алкілу, Сє ю-арил-Сі єалкоксі-Сє ю-арилу, Сє ю-арил-Сі є-алкокси-Сг дгетероарилу, Сг д-гетероарилоксі-Сі є-алкілу, C-z gгетероарилоксі-Сє ю-арилу, C-z д-гетероарилоксиСг д-гетероарилу, C-z д-гетероарил-Сі є-алкоксі-Сі єалкілу, Сг д-гетероарил-Сі є-алкоксі-Сє ю-арилу або Сг д-гетероарил-Сі є-алкокси-Сг д-гетероарилу є необов'язково заміщеним та має в циклі один або більше замісників, які можуть знаходитися біля будь-якого з атомів вуглецю циклу, що здатен утворювати додатковий зв'язок із замісником, який незалежно обраний з групи фтор, хлор, бром, Сі б-алкіл, Сі 6-алкокси, перфтор-Сі з-алкіл, перфторСі з-алкокси та Сє ю-арилокси, R1 є водень, Сі 6-алкіл, Сє ю-арил-Сі є-алкіл, C-z gгетероарил-Сі 6-алкіл або група формули — і ( О R та R незалежно один від одного є водень, Сі єалкіл або R 2 Ta R3 разом утворюють циклоалкіл, який містить від трьох до семи атомів, піран-4-іл або біцикл формули де зірочкою позначено атом вуглецю, загальний для R2 та R3, R4 є Сі 6-алкіл, п ціле число від 1 до 6, що включає a) взаємодію пдроксиламшу або його солі з (Сі єалкіл)з-силілгалогенідом у присутності першої основи з утворенням in situ (Сі б-алкіл)з-силілованого пдроксиламіну, b) взаємодію зазначеного (Сі є-алкіл)зсилілованого пдроксиламіну зі сполукою формули SO,Q о ю 1 ю 57750 де R , R , Z та Q мають значення, вказані вище, із другою основою з утворенням сполуки формули Ra (VI) ' 8 де R є (Сі б-алкіл)з-3і- та R є водень або (Сі єалкіл)з-3і-, с) гідроліз сполуки формули VI кислотою Даний винахід стосується способу одержання пдроксамових кислот із проміжних карбонових кислот, у якому проміжна карбонова кислота не містить реакційно-здатних замісників, таких як гідроксильні або аміногрупи Добре відомо, що інгібітори матричної метало-протеїнази (ММР) корисні для лікування стану, обраного з групи, що включає артрити (у тому числі остеоартрит і ревматоїдний артрит), запалення кишечнику, хворобу Крона, емфізему, гострий респіраторний дистрес-синдром, астму, хронічне захворювання, пов'язане з закупоркою легень, хворобу Альцгеймера, токсичність органічних трансплантатів, кахексію, алерпйні реакції, алерпйну підвищену контактну чутливість, рак, тканинні виразки, рестеноз, перюдонтальне захворювання, уроджений бульозний епідермоліз, остеопороз, ослаблення штучних суглобних імплантатів, атеросклероз (у тому числі розрив, викликаний атеросклеротичною бляшкою), аневризму аорти (у тому числі черевну аневризму аорти і мозкову аневризму аорти), застійну серцеву недостатність, інфаркт міокарда, удар, церебральну ішемію, травму голови, ушкодження спинного мозку, нервово-дегенеративні розлади (гострі і хронічні), аутоімунні розлади, хворобу Хантінгтона, хворобу Паркінсона, мігрень, депресію, периферичну невропатію, біль, церебральну амілоїд ну анпопатію, феномен ноотропної або пізнавальної активації, бічний амютрофічний склероз, розсіяний склероз, анпогенез очних кровоносних судин, ушкодження рогівки, дегенерацію жовтої плями, патологічне загоєння рани, опіки, діабет, інвазію пухлини, ріст пухлини, метастаз пухлини, рубцювання рогівки, склерит, СНІД, сепсис, септичний шок і ІНШІ захворювання, що "характеризуються інгібуванням металопротеінази або експресією ADAM (включаючи TNF-a) Крім того, продукти, які можуть бути отримані за допомогою сполук і способів даного винаходу, можуть використовуватися в комбінованій терапії зі стандартними нестероідними протизапальними ліками (що далі позначаються як NSAID), інгібіторами СОХ-2 і аналгетиками для лікування артриту і у сполученні з цитотоксичними лікарськими засобами, такими як адріаміцин, дауноміцин, цисплатина, етопозид, таксол, таксотер, і алкалоїдами, такими як вшкрістин, при лікуванні раку Інгібітори матричної металопротеїнази описані в літературі Наприклад, у міжнародній заяв 3 Спосіб за п 1 , де першою основою є піридин, 2,6-лутидин або дмзопропілетиламін 4 Спосіб за п 1, де першою основою є піридин 5 Спосіб за п 1, де (Сі б-алкіл)з-силілгалогенідом є триметилсилілхлорид 6 Спосіб за п 1, де другою основою є піридин, 2,6лутидин або дмзопропілетиламін 7 Спосіб за п 1, де другою основою є піридин 8 Спосіб за п 1, де розчинником є піридин ці РСТ WO 96/33172, опублікованій 24 жовтня 1996 року, описуються ЦИКЛІЧНІ арилсульфоніламшопдроксамові кислоти, які є корисними як інгібітори ММР У Патенті США 5 672 615, в опублікованих Міжнародних заявках РСТ WO 97/20824, WO 98/08825, WO 98/27069 і РСТ WO 98/34918, опублікованій 13 серпня 1998 року під назвою "ПОХІДНІ арилсульфоніл пдроксамових кислот", описуються ЦИКЛІЧНІ пдроксамові кислоти, які є корисними як інгібітори ММР В опублікованих Міжнародних заявках РСТ WO 96/27583 і WO 98/07697, опублікованих 7 березня 1996 року і 26 лютого 1998 року, ВІДПОВІДНО, описуються арилсульфоніл пдроксамові кислоти У Міжнародній заявці РСТ WO 98/03516, опублікованій 20 січня 1998 року, описуються фосфінати з ММР активністю У Міжнародній заявці РСТ WO 98/34915, опублікованій 13 серпня 1998 року під назвою "ПОХІДНІ N-пдрокси-р-сульфоніл-пропюнаміду", описуються пропюнілпдроксаміди, корисні як інпбіторш ММР У Міжнародній заявці РСТ WO 98/33768, опублікованій 6 серпня 1998 року під назвою «ПОХІДНІ арилсульфоніламшопдроксамових кислот", описуються N-незаміщені арилсульфоніламшопдроксамові кислоти У Міжнародній заявці PCTWO 98/30566, опублікованій 16 липня 1998 року під назвою "ПОХІДНІ ЦИКЛІЧНИХ сульфонів", описуються ЦИКЛІЧНІ сульфонпдроксамові кислоти як інгібітори ММР У публікації United States Provisional Patent Application 60/55208, яка видана 8 серпня 1997 року, описуються біарилпдроксамові кислоти як інпбіторш ММР У публікації United States Provisional Patent Application Serial 60/55207 - "ПОХІДНІ арилоксиарилсульфоніламінопдроксамових кислот", поданої 8 серпня 1997 року, описуються арилоксиарилсульфонілпдроксамові кислоти, які використовуються як інгібітори ММР Кожна із зазначених вище публікацій і заявок уведена в даний опис за допомогою посилання у всій повноті Даний винахід стосується способу одержання молекули, яка містить групу пдроксамової кислоти, що включає взаємодію пдроксиламшу або його солі з ((Сі-Сє)алкіл)з, силілгалогенідом, краще з ((С-і-Сб)алкіл)з силілхлоридом, у присутності основи з наступною взаємодією з молекулою, яка містить галогенанпдрид карбонової кислоти, і наступною взаємодією з кислотою за умови, що молекула, яка містить галогенанпдрид карбонової кислоти, не містить гідроксильної групи, пер 57750 винної аміногрупи, вторинної аміногрупи або тіольної групи Даний винахід стосується способу одержання сполуки формули H 0 H N SO^Q Z являє собою >СЬІ2 або >NR1, Q являє собою (С-і-Сб) алкіл, (Сє-Сю) арил, (Сг-Cg) гетероарил, (Сє-Сю) арилокси (Сі-Сє) алкіл, (Сб-С-ю) арилокси (Сє-Сю) арил, (Сє-Сю) арилокси (Сг-Сд) гетероарил, (Сє-Сю) арил (Сі-Сє) алкіл, (Сб-Сю) арил (Сє-Сю) арил, (Сє-Сю) арил (Сг-Сд) гетероарил, (Сє-Сю) арил (Сє-Сю) арил (Сі-С6) алкіл, (Се-Сю) арил (С6-Сю) арил (С6-Сю) арил, (Сб-Сю) арил (Сє-Сю) арил (Сг-Сд) гетероарил, (Сг-Сд) гетероарил (Сі-Сє) алкіл, (Сг-Сд) гетероарил (Сб-Сю) арил, (Сг-Сд) гетероарил (СгСд) гетероарил, (Сб-Сю) арил (С-і-Сє) алкокси ( d Сє) алкіл, (Сб-С-ю) арил (С-і-Сє) алкокси (Сє-Сю) арил, (Сб-Сю) арил (С-і-Сє) алкокси (Сг-Сд) гетероарил, (Сг-Сд) гетероарилокси (Сі-Сє) алкіл, (СгСд) гетероарилокси (Сб-С-ю) арил, (Сг-Сд) гетероарилокси (Сг-Сд) гетероарил, (Сг-Сд) гетероарил-( С-і-Сб) алкокси (Сі-Сє) алкіл, (Сг-Сд) гетероарил (Сі-Сє) алкокси (Сб-Сю) арил або (Сг-Сд) гетероарил (Сі-Сє) алкокси (Сг-Сд) гетероарил, де кожний залишок (Сб-Сю)арил або (СгСд)гетероарил зазначених (Сє-Сю) арилу, (Сг-Сд) гетероарилу, (Сб-С-ю) арилокси (С-і-Сє) алкілу, (Сб-Сю) арилокси (Сє-Сю) арилу, (Сє-Сю) арилокси (Сг-Сд) гетероарилу, (Сє-Сю) арил (Сі-Сє) алкілу, (Се-Сю) арил (Се-Сю) арилу, (С6-Сю) арил (С2Сд) гетероарилу, (Сб-Сю) арил (Сє-Сю) арил ( d С6) алкілу, (Се-Сю) арил (С6-Сю) арил (С6-Сю) арилу, (Сб-С-ю) арил (Сє-Сю) арил (Сг-Сд) гетероарилу, (Сг-Сд) гетероарил (Сі-Сє) алкілу, (Сг-Сд) гетероарил (Сб-Сю) арилу, (Сг-Сд) гетероарил (Сг-Сд) гетероарилу, (Сє-Сю) арил (С-і-Сє) алкокси (Сі-Сє) алкілу, (Сб-Сю) арил (Сі-Сє) алкокси (СєС-ю) арилу, (Сб-Сю) арил (Сі-Сє) алкокси (Сг-Сд) гетероарилу, (Сг-Сд) гетероарилокси (С-і-Сє) алкілу, (Сг-Сд) гетероарилокси (Сє-Сю) арилу, (Сг-Сд) гетероарилокси (Сг-Сд) гетероарилу, (Сг-Сд) гетероарил (Сі-Сє) алкокси (Сі-Сє) алкілу, (Сг-Сд) гетероарил (С-і-Сб) алкокси (Сє-Сю) арилу або (Сг-Сд) гетероарил (Сі-Сє) алкокси (Сг-Сд) гетероарилу є необов'язково заміщеним і містить у циклі один або більшу КІЛЬКІСТЬ замісників, які можуть знаходитися на будь-якому із атомів вуглецю циклу, здатному утворювати додатковий зв'язок із замісником, який незалежно обраний з групи, яка містить фтор, хлор, бром, (С-і-Сє) алкіл, (С-і-Сб) алкоксигрупу, перфтор (С-і-Сз) алкіл, перфтор (С-і-Сз) алкокси-1 (Сб-Сю)арилоксигрупу, R1 являє собою водень, (С-і-Сб) алкіл, (Сє-Сю) арил(Сі-Сє) алкіл, (Сг-Сд) гетероарил (Сі-Сє) алкіл або групу формули О -OR де R2 і R3 незалежно являють собою водень, (Сі-Сє)алкіл або R2 і R3 разом утворюють циклоалкіл, який містить від трьох до семи атомів, цикл 'її піран-4-іла або біцикл формули де зірочкою позначений атом вуглецю, загальний для R21 R3, і R4 являє собою (С-і-Сб) алкіл, п являє собою ціле число від одиниці до шести, спосіб включає a) взаємодію гідроксиламіну або його солі з ((С-і-Сб) алкіл)з силілгалогенідом, краще триметилсилілхлоридом, у присутності першої основи (краще піридину, 2,6-лутідину або дизопропілетиламіну) у розчиннику (краще піридині) з утворенням in situ ((С-і-Сб) алкіл)з силілованого гідроксиламіну, b) взаємодія зазначеного ((Сі-Сє) алкіл)з силілованого гідроксиламіну із сполукою формули SO2Q де R , R , Z і Q приймають значення, визначені вище, із другою основою (краще з піридином, 2,6-лутідином або дмзопропілетиламіном) з утворенням сполуки формули RB R7— О-ї :-SO Q VI 2 J • R де R являє собою ((С-і-Сб) алкіл)з-3і- і R являє собою водень або ((С-і-Сє) алкіл )3-Si-1 с) гідроліз зазначеної сполуки формули VI кислотою Термін "алкіл", використовуваний у даному описі, якщо не зазначено іншого значення, стосується до насичених одновалентних вуглеводневих радикалів, які містять прямі, розгалужені або ЦИКЛІЧНІ фрагменти або їхні сполучення Термін "алкокси", використовуваний у даному описі, включає О-алкільні групи, де "алкіл" приймає значення, визначені вище Термін "арил", використовуваний у даному описі, якщо не зазначено іншого значення, стосується органічного радикалу, отриманого з ароматичного вуглеводню за допомогою видалення одного водню, наприклад феніл або нафтил Термін "гетероарил", використовуваний у даному описі, якщо не зазначено іншого значення, стосується органічного радикалу, отриманого з ароматичної гетероциклічної сполуки за допомогою видалення одного атома водню, такого як піридил, фурил, піроїл, ТІЄНІЛ, ізотіазолід, імідазоліл, бензимідазоліл, тетразоліл, піразиніл, піримідил, ХІНОЛІЛ, ІЗОХІНОЛІЛ, бензофурил, ізобензофурил, бензотієніл, піразоліл, ІНДОЛІЛ, ІЗОІНДОЛІЛ, пуриніл, карбазоліл, ізоксазоліл, тіазоліл, оксазоліл, бензтіазоліл або бензоксазоліл Кращі гетероарили включають піриділ, фурил, ТІЄНІЛ, ізотіазоліл, піразиніл, піримідил, піразоліл, ізоксазоліл, тіазоліл або оксазоліл Найкращі гетероарили включають піриділ, фурил або ТІЄНІЛ 57750 Термін "ацил", використовуваний у даному описі, якщо не зазначено іншого значення, стосується радикалу-загальної формули R-(C=O), де R являє собою алкіл, алкоксигрупу, арил, арилалкіл або арилолкоксигрупу, а терміни "алкіл" або "арил" приймають визначені вище значення Термін "ацилокси", використовуваний у даному описі, стосується О-ацильних груп, де "ацил" приймає значення, визначені вище Сполуки формул I-VI можуть мати хіральні центри і, отже, можуть існувати в різних діастереомерних або енантюмерних формах Даний винахід стосується всіх оптичних ізомерів і стереоізомерів сполук формули I-VI і їхніх сумішей Краще, сполуки формули Г існують у вигляді екзоізомеру формули СХЕЙА 2 SQ—Q IV SO,Q HOHN НІ Наведені далі схеми реакцій ілюструють одержання сполук даного винаходу Якщо не зазначено інших значень, n, R1, R2, R3, R4, R5, Q і Z у схемах реакцій і наступному далі обговоренні приймають значення, визначені вище СХЕМА 1 H-O-NH VI Схема 1 стосується одержання матричних метало-протеїназних сполук формули І У ВІДПОВІДНОСТІ зі схемою 1, сполуки формули І одержують із гідроксиламіну формули VIII, де R9 являє собою пдрохлорид, гідросульфат або R9 відсутнє Зокрема, сполуки формули VIII взаємодіють із ((Сі-Сє) алкіл)з силілгалогенідом у присутності основи з утворенням in situ сполуки формули VII, де R7 являє собою ((Сі-Сє) алкіл)з -Si-, і R являє собою водень або ((Сі-Сє) алкіл)з-3іВІДПОВІДНІ ((Сі-Сє)алкіл)з сил іл галогенід и включають триметилсилілхлорид, триетилсилілхлорид, триметилсиліл йодид, триетилсиліл йодид, триметилсилілбромід, трет-бутилдиметилсилілхлорид або триетилсилілбромід, краще триметилсилілхлорид ВІДПОВІДНІ ОСНОВИ включають піридин, 2,6-лутидин або дмзопропілетиламін, краще піридин Реакцію проводять при температурі в інтервалі від приблизно 0°С до приблизно 22°С (тобто при кімнатній температурі) протягом від приблизно 1 до приблизно 12 годин, краще протягом приблизно 1 години HQ Q Отримана in situ сполука формули VII потім взаємодіє із сполукою формули II або хлорангідридом сполуки формули V із схеми 2 у присутності основи для одержання in situ сполуки формули VI, де R , R3, R , R8 і Q приймають значення, визначені вище, і Z являє собою >NR1 ВІДПОВІДНІ основи включають піридин, 2,6-лутидш або дмзопропілетиламін, краще піридин Реакцію проводять при температурі в інтервалі від приблизно 57750 0°С до приблизно 22°С (тобто при кімнатній температурі) протягом від приблизно 1 до приблизно 12 годин, краще протягом приблизно 1 години Сполуку формули VI перетворюють у сполуку 1 формули І, де Z являє собою >NR , за допомогою кислотного гідролізу ВІДПОВІДНІ КИСЛОТИ включають соляну або сірчану кислоту, краще застосування соляної кислоти Реакцію проводять при температурі в інтервалі від приблизно 0°С до приблизно 22°С (тобто при кімнатній температурі) протягом від приблизно 1 години до приблизно 12 годин, краще протягом приблизно 1 години Як альтернатива сполуки формули І, де Z являє собою -(СНг)-, можуть бути отримані за допомогою взаємодії сполуки формули О SO2Q IX R де R і R і Q приймають значення, визначені вище, із сполукою формули VII Сполуки формули IX можуть бути отримані способами, добре відомими кваліфікованому фахівцю Схема 2 стосується одержання сполук формули II, які являють собою проміжні продукти, використовувані при одержанні сполук формули І згідно із способами Схеми 1 У ВІДПОВІДНОСТІ зі Схемою 2, сполуки формули II одержують із сполук формули III, де R1 являє собою водень, взаємодією з оксалілхлоридом або тюнілхлоридом, краще з оксалілхлоридом, і каталізатором, краще застосування приблизно 2% N.N-диметилформаміду, в інертному розчиннику, такому як метиленхлорид або толуол Описану вище реакцію проводять при температурі в інтервалі від приблизно 0°С (тобто кімнатної температури) до приблизно 70°С, краще в інтервалі від приблизно 20°С до приблизно 50°С, найбільш краще при приблизно 20°С Тривалість зазначеної реакції складає приблизно від 1 до 7 годин, краще приблизно 2 години Сполуки формули III, де R10 являє собою водень можуть бути отримані із сполук формули IV, де R являє собою необов'язково заміщений бензил, відновленням у полярному розчиннику ВІДПОВІДНІ відновлювачі включають паладієві реагенти, відновлювальні за допомогою каталітичних реакцій, такі як водень над паладієм, водень над паладієм на вуглеці або гідроксидом паладію на вуглеці, краще водень над паладієм на вуглеці ВІДПОВІДНІ розчинники включають тетрапдрофуран, метанол, етанол і ізопропанол і їхні суміші, краще етанол Зазначену реакцію, проводять при температурі приблизно 22°С (тобто при кімнатній температурі) протягом від 1 до 7 днів, краще протягом приблизно 2 днів Сполуки формули III, де R10 ВІДМІННИЙ ВІД ВОДНЮ, наприклад, протонований амін (такий як протонований первинний амін, вторинний амін або третинний амін), лужний метал або лужноземельний метал, можуть бути отримані із сполук формули III, де R10 являє собою водень, оброблений водним або алканольним розчином, який містить прийнятний катіон (наприклад, натрій, калій, дициклогексиламін, кальцій і магній, краще дициклогексиламш), із наступним упарюванням 10 розчину, який утворюється, досуха, краще під зниженим тиском, або виділенням осаду фільтруванням, краще осаду дициклогексиламінової солі Сполуки формули IV можуть бути отримані із 6 сполук формули V, де R являє собою необов'язково заміщений бензил, реакцією приєднання Міхаеля до складного пропюлатового ефіру у присутності основи у полярному розчиннику ВІДПОВІДНІ протопати являють собою сполуки фор4 4 мули Н-С=С-СО2 R , де R являє собою ((С Г С 6 ) алкіл ВІДПОВІДНІ ОСНОВИ включають фторид тетрабутиламонію, карбонат калію, третинні аміни і карбонат цезію, краще фторид тетрабути л амонію ВІДПОВІДНІ розчинники включають тетрапдрофуран, ацетонітрил, третбутанол, трет-амілові спирти і N,N- диметилформамід, краще тетрапдрофуран Зазначену реакцію проводять при температурі в інтервалі від приблизно -10°С до приблизно 60°С, краще в інтервалі від 0°С до приблизно 22° С (тобто при кімнатній температурі) Сполуки формули IV одержують у вигляді сумішей геометричних Ізомерів відносно подвійного олефінового зв'язку, поділ ізомерів не обов'язковий Сполуки формули V, де R2 і R3 являють собою тетрапдропіран-4-іл або біцикл формули де зірочкою позначений атом вуглецю, загальний для R2 і R3, можуть бути отримані у ВІДПОВІДНОСТІ ЗІ способами, аналогічними способам, описаним у прикладах 3 і 4 Сполуки формули V, де R6 являє собою необов'язково заміщений бензил, можуть бути отримані у ВІДПОВІДНОСТІ зі способами, відомими в літературі Приклади таких способів одержання включають наступні публікації і заявки Інгібітори матричної метапопротеїнази добре ВІДОМІ І описані в літературі Зокрема, у Міжнародній заявці РСТ WO 96/33172, опублікованій 24 жовтня 1996 року, описуються ЦИКЛІЧНІ арилсульфоніламшопдроксамові кислоти, які корисні як інгібітори ММР У Патенті США 5 672 615, в опублікованих Міжнародних заявках РСТ WO 97/20824, WO 98/08825, WO 98/27069 і WO 98/34918, опублікованій 13 серпня 1998 року під назвою "ПОХІДНІ арилсульфонілпдроксамових кислот" описуються ЦИКЛІЧНІ пдроксамові кислоти, які корисні як інгібітори ММР У Міжнародних заявках РСТ WO 96/27583 і WO 98/07697, опублікованих 7 березня 1996 року і 26 лютого 1998 року, ВІДПОВІДНО, описуються арилсульфонілпдроксамові кислоти У Міжнародній заявці РСТ WO 98/03516, опублікованій 29 січня 1998 року, описуються фосфінати з ММР активністю У Міжнародній заявці РСТ WO 98/34915, опублікованій 13 серпня 1998 року під назвою "ПОХІДНІ N-пдрокси-р-сульфонілпропюнаміду" описуються пропюнілпдроксаміди як корисні інгібітори ММР У Міжнародній заявці РСТ WO 98/33768, опублікованій 6 серпня 1998 року під назвою "ПОХІДНІ арилсульфоніламшопдроксамових кислот" описуються N-незаміщені арилсуль 57750 12 11 фоніламшопдроксамові кислоти У Міжнародній ням отриманого розчину досуха, краще при знизаявці PCTWO 98/30566, опублікованій 16 липня женому тиску У якості альтернативи, вони мо1998 року під назвою "ПОХІДНІ ЦИКЛІЧНИХ сульфожуть бути отримані також змішанням розчинів нів", описуються ЦИКЛІЧНІ сульфонпдроксамові кислотних сполук в нижчих алканолах із необхідкислоти як інгібітори ММР У публікації United ними алкоксидами лужних металів із наступним States Provisional Application 60/55208, заявленій упарюванням отриманого розчину досуха спосо8 серпня 1997 року, описуються біарилпдроксабом, описаним вище У будь-якому випадку для мові кислоти як інпбіторш ММР У публікації забезпечення повноти реакції і максимальних United States Provisional Patent Application Serial виходів продукту використовують краще стехіо№60/55207, заявленій 8 серпня 1997 року під метричні КІЛЬКОСТІ реагентів назвою "ПОХІДНІ арилоксиарилсульфоніламшопЗдатність сполук формули І і їх фармацевтидроксамових кислот", описуються арилоксиарилчно прийнятних солей (далі називаних також аксульфонілпдроксамові кислоти як інгібітори ММР тивними сполуками) інгібувати матричні металоКожна із зазначених публікацій і заявок уведена в протеїнази або продукувати чинник некрозу пухопис за допомогою посилання у всій повноті лини (TNF) (і таким чином показати їхню ефективність для лікування захворювань, які характеСполуки формули І, які є основними по приризуються матричною металопротеїназою або роді, здатні утворювати велику КІЛЬКІСТЬ різних виробленням чинника некрозу пухлини) можна солей із різними неорганічними і органічними кивизначити згідно з тестами оцінки in vitro, добре слотами Хоча такі солі повинні бути фармацеввідомими кваліфікованому в даній області фахівтично прийнятними для уведення тваринам, найцю частіше на практиці необхідно спочатку виділити сполуку формули І із реакційної суміші у вигляді Наведені далі приклади ілюструють одерфармацевтично неприйнятної солі, потім просто жання сполук даного винаходу Температури перетворити останню у вільну основу обробкою плавлення не коректувалися Дані ЯМР-аналізу лужним реагентом і після цього перетворити вінаводяться у мільйонних частках (5) і відносяться льну основу у фармацевтично прийнятну кислотдо сигналу захоплення дейтерію із типового розно-адитивну сіль Кислотно-адитивні солі основчину (звичайно дейтерюхлороформу, якщо не них сполук даного винаходу легко одержують зазначений інший розчинник) Комерційні реагенобробкою основної сполуки власне кажучи еквіти використовувалися без додаткового очищенвалентній КІЛЬКОСТІ обраної мінеральної або орня Абревіатурою THF позначається тетрапдроганічної кислоти у середовищі водного розчиннифуран Абревіатурою DMF позначається N,Nка або у відповідному органічному розчиннику, диметилформамід Термін "хроматографія" стотакому як метанол або етанол Після обережного сується колоночної хроматографії, виконаної з упарювання розчинника одержують цільову сіль у використанням 32-63мм силікагелю і проведеної вигляді твердої речовини під тиском азоту (флеш-хроматографія) Термін "кімнатна температура" або "температура навкоКислоти, які застосовують для одержання лишнього середовища" стосується до температуфармацевтично прийнятних кислотно-адитивних ри в інтервалі 20-25°С Усі безводні реакції просолей основних сполук даного винаходу, являють водять під атмосферою азоту для зручності і собою кислоти, які утворюють нетоксичні кислотодержання максимальних виходів Термін "упано-адитивні солі, тобто солі, які містять фармакорювання під зниженим тиском" означає, що викологічно прийнятні аніони, такі як пдрохлориди, ристовувався роторний випарник пдроброміди, пдройодиди, нітрати, сульфати або бісульфати, фосфати або кислі фосфати, ацетати, лактати, цитрати або кислі цитрати, тартрати або бітартрати, сукцинати, малеати, фумарати, глюконати, сахарати, бензоати, метансульфонати і памоати [тобто 1,1'-метилен-біс-(2-пдрокси-3нафтоати)] Ті сполуки формули І, які є також кислотними по природі, здатні утворювати основні солі з різними фармакологічно прийнятними катіонами Приклади таких солей включають солі лужних або лужноземельних металів, зокрема, натрієвої і калієвої солі Усі ЦІ СОЛІ одержують загальновідомими методами ХІМІЧНІ ОСНОВИ, ЯКІ використовуються в якості реагентів для одержання фармацевтично прийнятних основних солей даного винаходу, є основами, які утворюють нетоксичні основні солі з описаними у даній заявці кислотними сполуками формули І Ці нетоксичні основні солі включають солі, отримані з таких фармакологічно прийнятних катіонів, як натрій, калій, кальцій і магній і т д Ці солі легко можуть бути отримані обробкою ВІДПОВІДНИХ КИСЛОТНИХ сполук водним розчином, який містить необхідні фармакологічно прийнятні катіони, і потім випарюван Приклад 1 3-[[4-(4ФТОРФЕНОКСИ)БЕНЗОЛСУЛЬФОНІЛ]-(1ГІДРОКСИКАРБАМОІЛЦИКЛОПЕНТИЛ)АМІНО]ПРОПЮНОВА КИСЛОТА А) Бензиловий ефір 1 -[4-(4-фторфенокси)бензолсульфоніламшо] циклопентанкарбоновоі кислоти До суміші 12,41г (0,032моля) толуол-4-сульфонатної солі бензилового ефіру 1-амшоциклопентанкарбонової кислоти (може бути отримана згідно з методами, описаними в Патенті США 4 745 124) і 10г (0,035молі, 1,1 еквівалент) 4-(4фторфенокси)бензолсульфонілхлориду в 113мл толуолу додають 11,0мл (0,079моля, 2,5 еквіваленти) триетиламшу Отриману суміш перемішують протягом ночі при кімнатній температурі, промивають 2 N соляною кислотою (2 х ЮОмл) і насиченим сольовим розчином (ЮОмл), сушать над сульфатом натрію і упарюють до ЗОмл Протягом 3 годин по краплях додають гексан (149мл), одержуючи твердий осад, який залишають гранулюватися при 0°С протягом години, потім фільтрують, в результаті одержують 12,59г 57750 14 13 (85%) бензилового ефіру 1-[4-(4-фторфенокси) ПМР (CDCI3) 5 7,78-7,82 (м, 2Н) , 6,94-7,09 (м, бензолсульфоніламіно] циклопентанкарбонової 6Н) , 4,09 (кв , J=7,2Hz, 2Н), 3,56-3,60 (м, 2Н), кислоти 2,75-2,79 (м, 2Н), 2,33-2,39 (м, 2Н) , 1,93-2,03 (м, 2Н) , 1,69-1,76 (м, 2Н), 1,56-1,63 (м, 2Н), 1,22 (т, ПМР (CDCI3) 5 7,78-7,82 (м, 2Н) , 7,30-7,39 (м, J=7,2Hz, ЗН) 5Н) , 7,06-7,12 (м, 2Н) , 6,99-7,04 (м, 2Н) , 6,936,97 (м, 2Н), 5,15 (с, 1Н) , 5,02 (с, 2Н) , 2,04-2,13 D) 1-{(2-етоксикарбонілетил)-[4-(4-фторфено(м, 2Н), 1,92-1,98 (м, 2Н), 1,62-1,69 (м, 4Н) кси) бензол-сульфоніл] амшо}циклопентанкарбонова кислота, дициклогексиламонієва сіль Зразок масою 4,0г перекристалізовують із суміші 4мл етилацетату і 40мл гексану протягом Розчин 3,10г (6,5ммоля) технічної 1-{(2ночі, одержують 3,72г (93% вихід) бензилового етоксикарбонілетил) - [4- (4-фторфенокси) бенефіру 1 -[4-(4-фторфенокси)бензол-сульфоніламізолсульфоніл] зміно} цикло-пентанкарбонової но]циклопентанкарбоновоі кислоти у вигляді твекислоти в ЗОмл етанолу обробляють 1,28мл рдої речовини світлого жовтувато-коричнюватого (6,5ммоля, 1 еквівалент) дициклогексиламшу при кольору, т пл 97,0-97,5°С кімнатній температурі, в результаті протягом п'яти хвилин утворюється твердий осад Суміш пеB) Бензиловий ефір 1-{(2-етоксикарбонілвіремішують при кімнатній температурі протягом ніл)-[4-(4-фторфенокси) бензолсульфоніл]аміночі, потім при 0°С протягом п'яти годин Білий но}циклопентанкарбоновоі кислоти твердий осад виділяють фільтруванням, промиРозчин 25,0г (53,2ммоля) бензилового ефіру вають Юмл охолодженого етанолу і сушать на 1-[4-(4-фторфенокси) бензолсульфоніламшо]цикповітрі, в результаті одержують 2,89г (67%) дицилопентанкарбонової кислоти і 10,8мл (Юбммоля, клогексиламонієвої солі 1-{(2-етоксикарбоніл2 еквіваленти) етилпропюлату у 200мл сухого етил)-[4-(4-фторфенокси) бензолсульфоніл]амітетрапдрофурану при 1 °С обробляють 53,2мл но}циклопентанкарбоновоі кислоти (53,2ммоля, 1 еквівалент) розчину фториду тетрабутиламонію в тетрапдрофурані (1М) протягом ПМР (CDCI3) 5 7,86-7,91 (м, 2Н), 6,99-7,09 (м, 45 хвилин Отриманому розчину дають повільно 4Н), 6,90-6,94 (м, 2Н), 5,3 (уш с, 2Н) , 4,07 (кв , нагрітися до кімнатної температури і перемішуJ=7,1Hz, 2Н), 3,54-3,59 (м, 2Н), 2,88-2,95 (м, 4Н) , ють його протягом ночі Тетрапдрофуран замі2,31-2,38 (м, 2Н), 1,95-2,22 (м, 6Н), 1,68-1,77 (м, щають толуолом при зниженому тиску, толуоль6Н), 1,53-1,60 (м, 4Н), 1,40-1,50 (м, 4Н), 1,21 (т, ний розчин промивають водою і насиченим соJ=7,1Hz, ЗН), 1,14-1,22 (м, 6Н) Т пл 164,5льовим розчином, додають толуол до об'єму 165,9°С 600мл, змішують з 90г силікагелю і продовжують E) 1-{(2-Етоксикарбонілетил)-[4-(4-фторфеноперемішування протягом трьох годин, потім фількси) бензолсульфоніл] аміно} циклопентанкарботрують і упарюють, в результаті одержують нова кислота 25,14г (83%) бензилового ефіру 1-{(2-етоксикарРозчин 3,0г (4,5ммоля) дициклогексиламонієбонілвшіл)-{4-(4-фторфенокси)бензолсульфовоі солі 1-{(2-етоксикарбонілетил)- [4-(4-фторфеніл]аміно}-циклопентанкарбоновоі кислоти у винокси)бензолсульфоніл]-амшо} циклопентанкаргляді масла жовтогарячого кольору ПМР (CDCI3) бонової кислоти в ЗОмл дихлорметану обробля5 вказує, що співвідношення транс/цис ізомерів ють ЗОмл 2 N соляної кислоти при кімнатній темскладає 1,5 5 пературі, що викликає негайне випадання твердого осаду Суміш перемішують при кімнатній Транс 5 7,74-7,78 (м, 2Н), 7,72 (д, J=14Hz, температурі протягом трьох годин Твердий осад 1Н), 7,26-7,36 (м, 5Н) , 6,96-7,12 (м, 4Н), 6,78-6,84 відфільтровують, водну фазу екстрагують дихло(м, 2Н), 5,44 (д, J=14Hz, 1H), 5,11 (с, 2Н), 4,12 рметаном, сполучені органічні фази промивають (кв, J=7,1Hz, 2Н), 2,08-2,43 (м, 4Н), 1,63-1,80 (м, водою, сушать над сульфатом натрію і упарюють 4Н), 1,24 (т, J=7,1Hz, ЗН) під вакуумом, в результаті одержують 2,2г (100%) Цис 5 7,68-7,72 (м, 2Н), 7,26-7,36 (м, 5Н), 1-{(2-етоксикарбонілетил)-[4-(4-фторфеноси)бен6,96-7,12 (м, 4Н), 6,86-6,91 (м, 2Н), 6,47 (д, золсульфоніл]аміно}циклопентанкарбоновоі кисJ=8,1Hz, 1Н), 5,90 (д, J=8,1Hz, 1Н), 5,11 (с, 2Н), лоти у вигляді прозорого масла 3,93 (кв , J=7,2Hz, 2Н), 2,08-2,43 (м, 4Н), 1,63-1,80 (м, 4Н), 1,17 (т, J=7,2Hz, ЗН) ПМР (DMSO-d6) 5 12,68 (уш с 1Н), 7,76-7,80 (м, 2Н), 7,25-7,31 (м, 2Н), 7,16-7,21 (м, 2Н), 7,03C) 1-{(2-Етоксикарбонілетил)-[4-(4-фторфено7,08 (м, 2Н), 4,01 (кв, J=7,1Hz, 2Н), 4,48-3,54 (м, кси) бензолсульфоніл] аміно} циклопентанкарбо2Н), 2,64-2,70 (м, 2Н), 2,13-2,21 (м, 2Н), 1,90-1,98 нова кислота (м, 2Н), 1,52-1,59 (м, 4Н), 1,14 (т, J=7,1Hz, ЗН) Розчин 2,50г (4,4ммоля) бензилового ефіру F) Етиловий ефір 3-{(1-хлоркарбонілцикло1-{(2-етоксикарбонілвшіл)-[4-(4пентил)- [4-(4-фторфенокси) бензолсульфоніл] фторфенокси)бензолсульфоніл]амшо}аміно} пропюнової кислоти циклопентанкарбонової кислоти у 25мл етанолу обробляють 2,5г 10% паладію на вуглеці, який Розчин 7,26г (15,1ммоля) 1-{(2-етоксикарбомістить 50% водної вологи, і піддають вібрації під нілетил) - [4-(4-фторфенокси) бензолсульфоніл] атмосферою водню 53псі протягом 21 години амшо}циклопентанкарбоновоі кислоти в 73мл Каталізатор відфільтровують і промивають етадихлорметану обробляють 1,4мл (17ммоля,1,1 нолом (4 х 25мл) Фільтрат і промивні розчини еквівалента) оксалілхлориду і 0,02мл (О.Зммоля, з'єднують і упарюють, під вакуумом, в результаті 0,02 еквівалента) диметилформаміду при кімнатодержують 1,74г (82%) неочищеної 1-{(2ній температурі, що викликає утворення і видіетоксикарбонілетил)-[4-(4-фторфенокси) бензолення деякої КІЛЬКОСТІ пухирців, і перемішують лсульфоніл]амшо}-циклопентанкарбоновоі киспротягом ночі Отриманий розчин етилового ефілоти у вигляді в'язкого масла ру 3-{(1 -хлоркарбонілциклопентил)-[4-(4-фторфе 57750 16 15 нокси) бензолсульфоніл] аміно} пропюнової кисі обробляють 6,05г (151ммоля, 10 еквівалентів) лоти використовують для одержання етилового гідроксиду натрію в гранулах протягом 10 хвилин ефіру 3-[[4-(4-фторфенокси)бензолсульфоніл]-(1 при енергійному перемішуванні Цю суміш перепдроксикарбамоілциклопентил)аміно] пропюнової мішують протягом 15 хвилин і нагрівають до кімкислоти без виділення цільового продукту натної температури протягом однієї години Водну фазу відокремлюють, розбавляють 7,5мл тетАналогічно отриманий розчин етилового ефірапдрофурану, охолоджують до 0°С и обробляру 3-{(1-хлоркарбонілциклопентил)- [4-(4-фторють ЗЗмл 6 N водної соляної кислоти протягом 20 фенокси) бензолсульфоніламіно} циклопентанкахвилин Отриману суміш змішують із 75мл етиларбонової кислоти упарюють під вакуумом до масцетату при температурі в інтервалі від 0°С до ла кімнатної температури, етилацетат відокремлюПМР (CDCI3) 5 7,84-7,87 (м, 24), 6,97-7,12 (м, ють і промивають водою Етилацетатний розчин 64), 4,10 (кв, J=7,2Hz, 2Н) , 3,55-3,59 (м, 2Н), повільно обробляють 150мл гексанів при кімнат2,68-2,72 (м, 2Н), 2,47-2,53 (м, 2Н), 1,95-2,02 (м, ній температурі, що призводить до випадання 2Н) , 1,71-1,76 (м,4Н),1,24 (т, J=7,2Hz, ЗН) твердого осаду, і перемішують протягом ночі G) Етиловий ефір 3-[[4(4-фторфенокси)бенОсад відфільтровують, в результаті одержують золсульфоніл]-(1-пдроксикарбамоілциклопентил) 5,01 г 3-[[4-(4-фторфенокси)бензолсульфоніл]-(1 аміно] пропюнової кислоти пдроксикарбамоілциклопентил) аміно] пропюноРозчин 1,37г (19,7ммоля, 1,3 еквіваленти) пвої кислоти у вигляді твердої білої речовини (видроксиламшу пдрохлориду у 9,2мл (114ммоля, хід 7 1 % із 1-{(2-етоксикарбонілетил)-[[4-(4-фтор7,5 еквівалента) сухого піридину при 0°С обробфенокси)бензолсульфоніл]амшо]} циклопентанляють 5,8мл (45ммолей, 3,0 еквівалента) тримекарбонової кислоти тилсилілхлориду, що викликає випадання твердого білого осаду, і дають суміші нагрітися до ПМР (DMSO-d6) 5 12,32 (с, 1Н), 10,43 (с, 1Н), кімнатної температури протягом ночі Суміш охо8,80 (с, 1Н), 7,82 (д, J=8,6Hz, 2Н), 7,28-7,35 (м, лоджують до 0°С и обробляють розчином 7,54г 2Н), 7,20-7,26 (м, 2Н), 7,08 (д, J=8,9Hz, 2H), 3,44(15,1ммоля) етилового ефіру 3-{(1-хлоркарбоніл3,49 (м, 2Н), 2,61-2,66 (м, 2Н), 2,74-2,29 (м, 2Н), циклопентил)-[4-(4-фторфенокси) бензолсульфо1,86-1,90 (м, 2Н), 1,54-1,55 (м, 4Н) Т пл 162,9ніл] амшо}пропюновоі кислоти у 73мл дихлорме163,5°С (різн) тану, отриманого, як описано вище, без виділенПриклад 2 ня, що викликає нагрів суміші до 8°С Цю суміш 3[[4-(4перемішують при 0°С протягом ЗО хвилин і при ФТОРФЕНОКСИ)БЕНЗОЛСУЛЬФОНІЛ]-(4кімнатній температурі протягом однієї години, ПДРОКСИКАРБАМОІЛ-ТЕТРАПДРОПІРАН-4потім обробляють 50мл 2 N водної соляної кисІЛ)АМІНО]ПРОПЮНОВА КИСЛОТА лоти і перемішують при кімнатній температурі A) Бензиловий ефір 4-[І\І-(дифенілметипротягом однієї години Водну фазу екстрагують лен)амшо]тетрапдропіран-4-карбоновоі кислоти дихлорметаном і сполучені органічні фази проДо суспензії гідриду натрію (6,56г, 0,164моля) мивають 2 N водною соляною кислотою (2 х у диметиловому ефірі етиленгліколю (150мл) при 50мл) і водою (50мл) Цей розчин етилового ефі0°С по краплях за допомогою краплинної лійки ру 3-[[4-(4-фторфенокси)-бензолсульфоніл]-(1додають розчин бензилового ефіру І\І-(дифенілпдроксикарбамоілциклопентил)аміно] пропюнової метилен)гліцину (0,07398моля) у диметиловому кислоти в дихлорметані використовують для одеефірі етиленгліколю (50мл) Потім у цей розчин ржання 3-[[4-(4-фторфенокси)бензолсульфоніл]додають розчин простого 2-брометилового ефіру (1-пдроксикарбамоілциклопентил) аміно] пропю(23,21г, 0,090моля) у диметиловому ефірі етиленової кислоти без виділення цільового продукту нгліколю (50мл) порціями по Юмл протягом приАліквоту упарюють до піни близно 5 хвилин Крижану баню видаляють і реакційну масу перемішують при кімнатній темпераПМР (DMSO-d6) 5 10,37 (с, 1Н) , 8,76 (с, 1Н) , турі протягом 16 годин Суміш розбавляють діе7,74-7,79 (м, 2Н), 7,24-7,30 (м, 2Н), 7,14-7,20 (м, тиловим ефіром і промивають водою Водний 2Н), 7,01-7,05 (м, 2Н), 3,99 (кв , J=7,1Hz, 2H), шар екстрагують діетиловим ефіром Сполучені 3,42-3,47 (м, 2Н), 2,62-2,67 (м, 2Н) , 2,16-2,23 (м, органічні екстракти промивають насиченим со2Н), 1,77-1,85 (м, 2Н), 1,43-1,52 (м, 4Н), 1,13 (т, льовим розчином, сушать над сульфатом магнію J=7,1Hz, ЗН) і упарюють, в результаті одержують технічний Аналогічно отриманий розчин упарюють під продукт Після хроматографії на силікагелі з вивакуумом, в результаті одержують 6,71г (89%) користанням як елюенту спочатку 4л 5% суміші етилового ефіру 3-[[4-(4-фторфенокси)бензолетилацетат/гексан, а потім 4л 10% суміші етиласульфоніл]-(1-пдроксикарбамоілциклопентил)цет/гексан одержують бензиловий ефір 4-[Nамшо]пропюновоі кислоти у вигляді твердої сухої (дифенілметилен)амшо]-тетрапдропіран-4-карбоПІНИ нової кислоти у вигляді прозорого масла жовтого Н) 3-[[4-(4-Фторфенокси)бензолсульфоніл]-(1 кольору пдроксикарбамоіл-циклопентил) аміно] пропюноB) Бензиловий ефір 4-амшотетрапдропіранва кислота 4-карбоновоі кислоти Розчин 7,48г (15,1ммоля) етилового ефіру 3До розчину бензилового ефіру 4-[І\І-(дифеніл[[4-(4-фторфенокси) бензолсульфоніл]- (1-пдрометилен)амшо]-тетрапдропіран-4-карбоновоі кисксикарбамоілциклопентил)-аміно]пропюновоі кислоти (16,0г, 0,047моля) у діетиловому ефірі лоти в дихлорметані упарюють на роторному (120мл) додають 1 N водного розчину соляної випарнику з додаванням 75мл толуолу Цей розкислоти (ЮОмл) Суміш енергійно перемішують чин обробляють 75мл води, охолоджують до 0°С 57750 18 17 при кімнатній температурі протягом 16 годин ропіран-4-іл)-[4- (4-фторфенокси) бензолсульфоФракції розділяють і водний шар промивають ніл]аміно}пропюновоі кислоти діетиловим ефіром рН водного шару доводять Розчин продукту стадії Е (15,1ммоля) у 73мл до 10 за допомогою розведеного водного розчину дихлорметану обробляють 1,4мл (17ммолей, 1,1 гідроксиду амонію і водний шар екстрагують дихеквівалентів) оксалілхлориду і 0,02мл (О.Зммоля, лорметаном Органічний екстракт сушать над 0,02 еквівалента) диметилформаміду при кімнатсульфатом натрію і упарюють, в результаті оденій температурі, що призводить до утворення і ржують бензиловий ефір 4-амшотетрапдропіранвиділення деякої КІЛЬКОСТІ пухирців, і перемішу4-карбоновоі кислоти ють протягом ночі Утворений розчин цільової сполуки використовують у наступній стадії без C) Бензиловий ефір 4-[4-(4-(фторфенокси) виділення цільової сполуки бензолсульфоніламіно] тетрапдропіран-4-карбонової кислоти G) Етиловий ефір 3- [[4- (4-фторфенокси) бензолсульфоніл] - (4-пдроксикарбамоілтетрапдДо розчину бензилового ефіру 4-амшотетраропіран-4-іл) амшо]пропюновоі кислоти пдропіран-4-карбоновоі кислоти (0,0404моля) у N.N-диметилформаміді (40мл) додають триетиРозчин пдроксиламшу пдрохлориду ламін (5,94мл, 0,043моля) До отриманого розчи(19,7ммоля, 1,3 еквівалента) у 9,2мл (114ммолей, ну порціями додають твердий 4-(4-фторфенокси)7,5 еквівалента) сухого піридину при 0°С оброббензолсулфонілхлорид (12,165г, 0,0424моля) ляють 5,8мл (45ммоля, 3,0 еквівалента) триметиОтриману суміш перемішують при кімнатній темлсилілхлориду, що призводить до утворення пературі протягом 16 годин і потім більшу частитвердого білого осаду Суміші дають нагрітися до ну розчинника відганяють під вакуумом Залишок кімнатної температури протягом ночі Потім сурозподіляють між насиченим розчином бікарбоміш охолоджують до 0°С и обробляють розчином нату натрію і дихлорметаном Водний шар відопродукту Стадії F (15,1ммоля) у 73мл дихлормекремлюють і екстрагують дихлорметаном Спотану, що призводить до екзотермічного нагріванлучені органічні фракції промивають насиченим ня приблизно до 8°С Суміш перемішують при сольовим розчином і сушать над сульфатом на0°С протягом ЗО хвилин і при кімнатній температрію Після відгону розчинника під вакуумом одетурі протягом приблизно 1 години Потім реакційржують неочищений бензиловий ефір 4-[4-(4ну масу обробляють 50мл 2 N водної соляної фторфенокси)бензолсульфоніламшо]-тетрапдрокислоти і перемішують при кімнатній температурі піран-4-карбоновоі кислоти Флеш-хроматографія протягом години Водну фазу екстрагують дихлона силікагелі (елюент 25% етилацетат/гексан, рметаном, сполучені органічні фази промивають потім 50% етил ацетат/гексан) призводить до 2 N водною соляною кислотою (2 х 50мл) і водою одержання бензилового ефіру 4-[4-(4-фторфе(50мл) Цей розчин цільової сполуки в дихлорменокси)бензолсульфоніламшо]тетрапдропіран-4тані використовують у наступній стадії карбонової кислоти (Н) 3-[[4-(4-Фторфенокси)бензолсульфоніл]D) Бензиловий ефір 4-[(2-етоксикарбонілВІ(4-пдроксикарбамоілтетрапдропіран-4-іл)аміНІЛ) - [4-(4 фторфенокси) бензолсульфоніламіно] но]пропюнова кислота тетрапдроліран-4 -карбонової кислоти Розчин продукту Стадії G (15,1ммоля) у дихлорметані упарюють за допомогою роторного Розчин (53,2ммоля) продукту попередньої випарника з додаванням 75мл толуолу Цей розстадії і 10,8мл (Юбммолей, 2 еквіваленти) етилпчин обробляють 75мл води, охолоджують до 0°С ропюлату у 200мл сухого тетрапдрофурану при и обробляють 6,05г (151ммоль, 10 еквівалентів) 1°С обробляють 53,2мл (53,2ммоля, 1 еквівагідроксиду натрію у вигляді гранул протягом 10 лент) розчину фториду тетрабутиламонію в тетхвилин при енергійному перемішуванні Отримарапдрофурані (1М) протягом 45 хвилин Отриману суміш перемішують протягом 15 хвилин при ному розчину дають повільно нагрітися до кімна0°С і нагрівають до кімнатної температури протятної температури і перемішують його протягом гом однієї години Водну фазу відокремлюють, ночі Тетрапдрофуран заміщають толуолом при розбавляють 7,5мл тетрапдрофурану, охолозниженому тиску, і толуольний розчин промиваджують до 0°С і обробляють ЗЗмл 6 N водною ють водою і насиченим сольовим розчином, досоляною кислотою протягом 20 хвилин Цю суміш дають толуол, доводячи толуолом об'єм суміші змішують із 75мл етилацетату, перемішують при до 600мл, змішують із 90г силікагелю, перемішутемпературі в інтервалі від 0°С до кімнатної темють ще три години, фільтрують і упарюють, в ператури, і етилацетатну фазу відокремлюють і результаті одержують цільову сполуку промивають водою Етилацетатний розчин упаE) 4-1 (2-етоксикарбонілетил)-[4-(4-фторфенорюють, в результаті одержують цільову сполуку кси)бензолсульфоніламшо] тетрапдропіран-4карбонова кислота Розчин (4,4ммоля) продукту стадії D у 25мл етанолу обробляють 2,5г каталізатора - 10% паладію на вуглеці, який містить 50% водної вологи, піддають вібрації під атмосферою водню 53псі протягом 21 години Каталізатор відфільтровують, промивають етанолом (4 х 25мл), фільтрат і промивні розчини сполучають і упарюють під вакуумом, в результаті одержують неочищений продукт F) Етиловий ефір 3-{(4-хлоркарбонілтетрапд Приклад З 3-[[4-(4ФТОРФЕНОКСИ)БЕНЗОЛСУЛЬФОНІЛ]-(3ПДРОКСИКАРБАМОІЛ-8ОКСАБІЦИКЛО[3 2 1]ОКТ-3ІЛ)АМІНО]ПРОПЮНОВА КИСЛОТА А) Бензиловий ефір З-(бензпдриліденамшо)8-оксабіцикло-[3 2 1]октан-3-карбоновоі кислоти До суспензії гідриду натрію (0,41г, 17,1ммоля) у N.N-диметилформаміді (50мл) при 0°С краплями додають розчин 19 складного бензилового ефіру N-дифенілметиленгліцину (7,8ммоля) у N.N-диметилформаміді (50мл) Після перемішування протягом ЗО хвилин при кімнатній температурі по краплях додають розчин цис-2,5-біс(пдроксиметил)тетрапдрофурану дитозилату (4,1г, 9,3ммоля) (одержують методами, описаними в літературі, наприклад, в публікації JOC, 47, 2429-2435 (1982)) у N.Nдиметилформаміді (50мл) Реакційну суміш поступово нагрівають на масляній бані до 100°С и перемішують при цій температурі протягом ночі Розчинник відганяють під вакуумом, залишок переносять у воду і ДВІЧІ екстрагують діетиловим ефіром Сполучені органічні екстракти промивають насиченим сольовим розчином, сушать над сульфатом магнію і упарюють, в результаті одержують неочищений продукт B) Бензиловий ефір З-амшо-8-оксабіцикло[3 2 1]октан-3-карбоновоі кислоти Двофазну суміш бензилового ефіру 3 (бензпдриліден-амшо)-8-оксабіцикло[3 2 1]октан-3-карбонової кислоти (3,9ммоля) у водному 1 N розчині соляної кислоти (ЮОмл) і діетилового ефіру (ЮОмл) перемішують при кімнатній температурі протягом ночі Водний шар упарюють, в результаті одержують цільову сполуку C) Бензиловий ефір 3-екзо-[4-(4-фторфенокси)бензол-сульфоніламіно]-8оксабіцикло[3 2 1]октан-3-карбоновоі кислоти Розчин бензилового ефіру З-амшо-8-оксабіцикло-[3 21]октан-3-карбоновоі кислоти пдрохлориду (2,9ммоля), 4-(4-фторфенокси)бензолсульфонілхлориду (923мг, 3,2ммоля) і триетиламіну (0,9мл, 6,5ммоля) у N.N-диметилформаміді (45мл) перемішують при кімнатній температурі протягом ночі Розчинник відганяють під вакуумом і залишок переносять у насичений водний розчин бікарбонату натрію Після дворазового екстрагування метиленхлоридом сполучені органічні фракції промивають насиченим сольовим розчином, сушать над сульфатом магнію і упарюють до коричневого масла Цільову сполуку виділяють хроматографією на дюксиді кремнію, використовуючи як елюент 1% розчин метанолу в метиленхлориді D) Бензиловий ефір 3-{(2-етоксикарбонілвініл)-[4-(4-фторфенокси) бензолсульфоніл)амшо}8-оксабіцикло[3 2 1]октан-3-карбоновоі кислоти Розчин продукту попередньої стадії (53,2ммоля) і 10,8мл (Юбммоля, 2 еквіваленти) етилпропіолату в 200мл сухого теграгідрофурану при 1°С обробляють 53,2мл (53,2ммоля, 1 еквівалент) розчину фториду тетрабутиламонію в тетрапдрофурані (1М) протягом 45 хвилин Отриманому розчину дають повільно нагрітися до кімнатної температури і перемішують його протягом ночі Тетрапдрофуран заміщають толуолом при зниженому тиску, толуольний розчин промивають водою і насиченим сольовим розчином, додають толуол, доводячи об'єм до 600мл, змішують із 90г силікагелю, перемішують протягом трьох годин, фільтрують і упарюють, в результаті одержують цільову сполуку E) 3-{(2-Етоксикарбонілетил)-[4-(4-фторфенокси)бензол-сульфоніл)амшо}-8-оксабіцикло[3 2 1]октан -3-карбонова кислота 57750 20 Розчин продукту Стадії D (4,4ммоля) у 25мл етанолу обробляють 2,5г каталізатору -10% паладію на вуглеці, який містить 50% водної вологи, і піддають вібрації під атмосферою водню 53псі протягом 48 годин Каталізатор відфільтровують і промивають етанолом (4 х 25мл) Фільтрат і промивні розчини з'єднують і упарюють під вакуумом, в результаті одержують неочищений цільовий продукт F) Етиловий ефір 3-{(3-хлоркарбоніл-8-оксабіцикло-[3 2 1]окт-3-іл) - [4- (4-фторфенокси) бензолсульфоніл]аміно} -пропюнової кислоти Розчин продукту Стадії Е (15,1ммоля) D 73мл дихлорметану обробляють 1,4мл (17ммоля, 1,1 еквівалента) оксалілхлориду і 0,02мл (О.Зммоля, 0,02 еквівалента) диметилформаміду при кімнатній температурі, що викликає утворення і виділення деякої КІЛЬКОСТІ пухирців, і перемішують протягом ночі Отриманий розчин цільової сполуки використовують у наступній стадії без виділення цільового продукту G) Етиловий ефір 3-[[4-(4-фторфенокси)бензолсульфоніл]-(3-пдрокси-карбамоіл -8-оксабіцикло[3 2 1]окт-3-іл)амшо]-пропюновоі кислоти Розчин пдроксиламшу пдрохлориду (19,7ммоля, 1,3 еквівалента) у 9,2мл (114ммоля, 7,5 еквівалента) сухого піридину при 0°С обробляють 5,8мл (45ммоля, 3,0 еквіваленти) триметилсилілхлориду, що призводить до утворення твердого білого осаду Суміші дають нагрітися до кімнатної температури протягом ночі Потім суміш охолоджують до 0°С і обробляють розчином продукту Стадії F (15,1ммоля) у 73мл дихлорметану, що викликає екзотермічний нагрів приблизно до 8°С Суміш перемішують при 0°С протягом ЗО хвилин і при кімнатній температурі протягом приблизно 1 години Потім реакційну масу обробляють 50мл 2 N водної соляної кислоти і перемішують при кімнатній температурі протягом години Водну фазу екстрагують дихлорметаном і сполучені органічні фази промивають 2 N водною соляною кислотою (2 х 50мл) і водою (50мл) Цей розчин цільової сполуки в дихлорметані використовують у наступній стадії (Н) 3-[[4-(4-фторфенокси)бензолсульфоніл](З-пдроксикарбамоіл-8-оксабіцикло [3 2 1] окт-3іл) амшо]пропюнова кислота Розчин продукту зі стадії G (15,1ммоля) у дихлорметані упарюють на роторному випарнику з додаванням 75мл толуолу Цей розчин обробляють 75мл води, охолоджують до 0°С и обробляють 6,05г (151ммоль, 10 еквівалентів) гідроксиду натрію у вигляді гранул протягом 10 хвилин при енергійному перемішуванні Суміш перемішують протягом 15 хвилин при 0°С и нагрівають до кімнатної температури протягом години Водну фазу відокремлюють, розбавляють 7,5мл тетрапдрофурану, охолоджують до 0°С и обробляють ЗЗмл 6 N водної соляної кислоти протягом 20 хвилин Суміш змішують із 75мл етилацетату при 0°С и перемішують при ЗМІНІ температури від 0°С до кімнатної температури, етилацетатну фазу відокремлюють і промивають водою Етилацетатний розчин упарюють, в результаті одержують цільову сполуку Приклад 4 57750 22 21 ГІДРОКСИАМІД 3-ЕКЗО-[4-(4риді (50мл) при 0°С Суміш перемішують при 0°С протягом 1 години, розбавляють метиленхлориФТОРФЕНОКСИ)БЕНЗОЛСУЛЬФОНІЛМЕТИЛ]--8дом і промивають водним 1 N розчином соляної ОКСАБІЦИКЛО[3 2 1]ОКТАН-3-КАРБОНОВОІ кислоти, насиченим водним розчином бікарбонаКИСЛОТИ ту натрію і насиченим сольовим розчином Після A) Діетиловий ефір 8-оксабіцикло[3 2 1]октансушіння над сульфатом магнію розчинник упа3,3- дикарбонової кислоти рюють, і в результаті одержують цільову сполуку Гідрид натрію (2,28г, 95ммолей) додають при перемішуванні порціями у розчин діетилмалонату E) 3-екзо-[[4-(4-Фторфенокси) фенілсульфо(15мл, 99ммолей) у N.N-диметилформаміді нілметил]-8-окса-біцикло [3 2 1 ]октан-3-карбоно(400мл) Суміш перемішують протягом 45 хвилин, ва кислота в процесі чого виділення водню завершується Розчин 4-(4-фторфенокси)тюфенолу Після ЦЬОГО краплями додають розчин цис-2,5(Юммолей) у тетрапдрофурані (Юмл) краплями біс(пдроксиметил)тетрапдрофурану дитозилату додають у суспензію гідриду натрію (11,3ммоля) (19г, 43ммоля) у N.N-диметилформаміді (400мл) у тетрапдрофурані (20мл) при 10°С Суміші даСуміш нагрівають на масляній бані до темперають нагрітися до кімнатної температури при петури 140°С и витримують при цій температурі ремішуванні протягом ЗО хвилин Після охолопротягом ночі Після охолодження до кімнатної дження знову до -10°С краплями додають розчин температури суміш гасять насиченим водним 3',8-дюксаспіро[біцикло[3 2 1]октан-3,1'-циклобурозчином хлориду амонію і упарюють під вакуутан]-2'-она (Юммолей) у тетрапдрофурані (20мл) мом Залишок у вигляді масла переносять у воду Охолоджувальну баню видаляють і продовжують і екстрагують діетиловим ефіром Органічний перемішування при кімнатній температурі протяекстракт промивають водою і насиченим сольогом 2 годин, після чого суміш гасять водним 1 N вим розчином, сушать над сульфатом магнію і розчином соляної кислоти і ДВІЧІ екстрагують меупарюють до масла тиленхлоридом Сполучені органічні екстракти промивають водою і насиченим сольовим розчиB) Етиловий ефір З-екзо-пдроксиметил-8ном, сушать над сульфатом магнію і упарюють до оксабіцикло [3 2 1] октан-3-карбоновоі кислоти одержання твердого залишку 1,2М розчин гідриду дизобутилалюмінію в толуолі (75мл) краплями додають до розчину діетилового ефіру 8-оксабіцикло[3 2 1]октан-3,3дикарбонової кислоти (ЗОммолей) у толуолі (80мл) при -40°С Суміші дають нагрітися до 0°С при перемішуванні протягом 3 годин Потім суміш охолоджують до -15°С и повільно, підтримуючи цю температуру, додають етанол (8мл) Після перемішування при 15°С протягом 1 години додають борпдрид натрію (1,1г, ЗОммолей) Суміш перемішують при кімнатній температурі протягом ночі і гасять, додаючи краплями насичений водний розчин сульфату натрію Додають етилацетат і після перемішування протягом 20 хвилин нерозчинний матеріал виділяють фільтруванням крізь целіт (Cehte™) Фільтрат промивають насиченим сольовим розчином, сушать над сульфатом магнію і упарюють, в результаті одержують цільову сполуку у вигляді прозорого масла C) З-екзо-пдроксиметил-8оксабіцикло[3 2 1]октан-3-карбонова кислота Гідроксид ЛІТІЮ гідрат (59,5ммоля) додають у розчин етилового ефіру З-екзо-пдроксиметил-8оксабіцикло[3 2 1]октан-3-карбоновоі кислоти (23,8ммоля) у суміші метанолу (25мл), тетрапдрофурану (25мл) і води (2,5мл) Суміш кип'ятять із зворотним холодильником протягом ночі, охолоджують і гасять, додаючи іонно-обмінну смолу Amberhte IR-120™ Після перемішування протягом 20 хвилин смолу видаляють фільтруванням, промиваючи тетрапдрофураном ВІДГІН розчинників і розтирання залишку з діетиловим ефіром призводить до одержання цільової сполуки D) 3'8-Дюксаспіро[біцикло[3 2 1]октан-3,1'циклобутан-2'-он Бензолсульфонілхлорид (13,5ммоля) по краплях додають у розчин З-екзо-пдроксиметил-8оксабіцикло[3 2 1]октан-3-карбоновоі кислоти (12,3ммоля), триетиламшу (24,7ммоля) і 4диметиламшопіридину (2,5ммоля) у метиленхло F) Хлорангідрид 3-[4-(4-фторфенокси)фенілсульфонілметил] -8-оксабіцикло [3 2 1]октан-3карбонової кислоти Розчин продукту зі стадії Е (15,1ммоля) у 73мл дихлорметану обробляють 1,4мл (17ммолей, 1,1 еквівалента) оксалілхлориду і 0,02мл (О.Зммоля, 0,02 еквівалента) диметилформаміду при кімнатній температурі, що призводить до утворення і виділення деякої КІЛЬКОСТІ пухирців, і перемішують протягом ночі Отриманий розчин цільової сполуки використовують у наступній стадії без виділення цільової сполуки G) Гідроксиамід 3-[4-(4-фторфенокси) фенілсульфонілметил] -8-оксабіцикло [3 2 1]октан-3карбонової кислоти Розчин пдроксиламшу пдрохлориду (19,7ммоля, 1,3 еквіваленти) у 9,2мл (114ммолей, 7,5 еквівалента) сухого піридину при 0°С обробляють 5,8мл (45ммолей, 3,0 еквіваленти} триметилсилілхлориду, що викликає випадання твердого білого осаду Суміші дають нагрітися до кімнатної температури протягом ночі Отриману суміш охолоджують до 0°С и обробляють розчином продукту Стадії F (15,1ммоля) у 73мл дихлорметану, що викликає екзотермічний нагрів до приблизно 8°С Цю суміш перемішують при 0°С протягом ЗО хвилин і при кімнатній температурі протягом приблизно 1 години Потім реакційну суміш обробляють 50мл 2 N водної соляної кислоти і перемішують при кімнатній температурі одну годину Водну фазу екстрагують дихлорметаном і сполучені органічні фази промивають 2 N водної соляної кислоти (2 х 50мл) і водою (50мл) Органічну фазу упарюють, в результаті одержують цільову сполуку (Н) Гідроксамід 3-[4- (4-фто рфе но кси) бензолсульфонілметил]-8-оксабіцикло [3 2 1]октан-3карбонової кислоти У розчин продукту попередньої стадії 23 (З.бЗммоля) у суміші води (30мл), метанолу (40мл) і тетрапдрофурану (12мл) додають Охоп™ (8,63ммоля) Отриману суміш перемішують при кімнатній температурі протягом ночі, розбавляють водою і ДВІЧІ екстрагують етилацетатом Сполучені органічні екстракти промивають насиченим сольовим розчином, сушать над сульфатом магнію і упарюють, в результаті одержують цільову сполуку Приклад 5 ПДРОКСИАМІД4-[4-(4ФТОРФЕНОКСИ)БЕНЗОЛСУЛЬФОНІЛАМІНО] ТЕТРАПДРОПІРАН-4-КАРБОНОВОІ КИСЛОТИ A) Бензиловий ефір 4-[І\І-(дифеніл метилен)амшо]тетрапдропіран-4-карбоновоі кислоти До суспензії гідриду натрію (6,56г, 0,164моля) у диметиловому ефірі етиленгліколю (150мл) при 0°С по краплях із краплинної лійки додають розчин бензилового ефіру І\І-(дифенілметилен)гліцину (0,07398моля) у диметиловому ефірі етиленгліколю (50мл) Після ЦЬОГО у цей розчин додають порціями по Юмл протягом приблизно 5 хвилин розчин простого 2-брометилового ефіру (23,21г, 0,090моля) у диметиловому ефірі етиленгліколю (50мл) Крижану баню видаляють і реакційну суміш перемішують при кімнатній температурі протягом 16 годин Суміш розбавляють діетиловим ефіром і промивають водою Водний шар екстрагують діетиловим ефіром Сполучені органічні екстракти промивають насиченим сольовим розчином, сушать над сульфатом магнію і упарюють, в результаті одержують неочищений продукт Після очищення методом хроматографії на силікагелі, елюючи спочатку 4л 5% суміші етилацетат/гексан, а потім 4 літрами 10% суміші етилацетат/гексан, одержують бензиловий ефір 4-[N(дифенілметилен)-амшо]тетрапдропіран-4-карбонової кислоти у вигляді прозорого жовтого масла B) Бензиловий ефір 4-амшотетрапдропіран4-карбоновоі кислоти До розчину бензилового ефіру 4-[ІЧ-(дифенілметилен)-амшо]тетрапдропіран-4-карбоновоі кислоти (16,0г, 0,047моля) у діетиловому ефірі (120мл) додають 1 N водний розчин соляної кислоти (ЮОмл) Суміш енергійно перемішують при кімнатній температурі протягом 16 годин Фракції розділяють, водну фракцію промивають діетиловим ефіром Значення рН водного шару доводять до 10 за допомогою водного розчину гідроксиду амонію і екстрагують дихлорметаном Органічний екстракт сушать над сульфатом натрію і упарюють, в результаті одержують бензиловий ефір 4амшотетрапдропіран-4-карбоновоі кислоти C) Бензиловий ефір 4-[4-(4-фторфенокси)бензолсульфоніламшо] тетрапдропіран-4карбонової кислоти До розчину бензилового ефіру 4-амшотетрапдропіран-4-карбоновоі кислоти (0,0404моля) у N.N-диметилформаміді (40мл) додають триетиламін (5,94мол , 0,043моля) В отриману суміш порціями додають твердий 4-(4фторфенокси)бензолсульфонілхлорид (12,165г, 0,0424моля) Отриману суміш перемішують при кімнатній температурі протягом 16 годин і потім велику частину розчинника відганяють під вакуумом Залишок розподіляють між насиченим роз 57750 24 чином бікарбонату натрію і дихлорметаном Водний шар відокремлюють і екстрагують дихлорметаном Сполучені органічні фракції промивають насиченим сольовим розчином і сушать над сульфатом натрію Після відгону розчинника під вакуумом одержують технічний бензиловий ефір 4-[4-(4-фторфенокси)бензолсульфоніламшо]тетрапдропіран-4-карбоновоі кислоти Після очищення методом флеш-хроматографм (елюент 25% етилацетат/гексан, 50% етил ацетат/гексан) одержують бензиловий ефір 4-[4-(4-фторфенокси) бензолсульфоніламно]тетрапдропіран-4карбонової кислоти D) Бензиловий ефір 4-{(2-етоксикарбонілвшіл)-[4-(4-фторфенокси) бензолсульфоніл] аміно}тетрапдропіран-4-карбоновоі кислоти Розчин продукту попередньої стадії (53,2ммоля) і 10,8мл (Юбммоля, 2 еквіваленти) етилпропюлату в 200мл тетрапдрофурану при 1°С обробляють 53,2мл (53,2 ммоля, 1 еквівалент) розчину фториду тетрабутиламонію у тетрапдрофурані (1М) протягом 45 хвилин Отриманому розчину дають повільно нагрітися до кімнатної температури і перемішують протягом ночі Тетрапдрофуран заміняють толуолом при зниженому тиску, толуольний розчин промивають водою і насиченим сольовим розчином, додають толуол, доводячи об'єм до 600мл, змішують із 90г силікагелю, перемішування продовжують протягом трьох годин, фільтрують, і фільтрат упарюють з одержанням цільової сполуки E) Хлорангідрид 4-[4-(4-фторфенокси)бензолсульфоніламіно] тетрапдропіран-4-карбоновоі кислоти Розчин 4,40кг (11,13молі) 4-[4-(4-фторфенокси)бензол-сульфоніламіно] тетрапдропіран-4карбонової кислоти у 40л дихлорметану обробляють 19мл диметилформаміду і 1,075л (12,32моля, 1,1 еквівалента) оксалілхлориду при кімнатній температурі і перемішують протягом 16 годин Отриманий розчин цільової сполуки використовують у Стадії F без виділення цільового продукту F) Гідроксиамід 4-[4-(4-фторфенокси)бензолсульфоніламіно] тетрапдропіран -4-карболовоі кислоти Розчин 1,160кг (16,69ммоля, 1,5 еквівалента) пдроксиламіну пдрохлориду у 6,8л (84,08моля, 7,5 еквівалента) піридину при 0-10°С обробляють 2,8л (22,06моля, 2,0 еквіваленти) триметилсилілхлориду, що призводить до утворення твердого білого осаду Суміш перемішують протягом 4 годин при 0-2°С, потім обробляють розчином продукту Стадії Е у дихлорметані, що призводить до виділення теплоти Реакційну суміш перемішують протягом 1 години при 0-2°С, потім протягом 1,5 години при 20°С Потім реакційну суміш обробляють 132л 2 N водної соляної кислоти і перемішують при кімнатній температурі протягом однієї години Водну фазу екстрагують етилацетатом (З х 100л) і сполучені органічні фази промивають водою (2 х 130л) і упарюють до об'єму 17л Отриману суспензію перемішують при 0°С протягом 3 годин і фільтрують, в результаті одержують 4,068кг (89%) цільової сполуки у вигляді твердої білої речовини 25 Комп'ютерна верстка Е Гапоненко 57750 26 Підписано до друку 05 08 2003 Тираж 39 прим Міністерство освіти і науки України Державний департамент інтелектуальної власності, Львівська площа, 8, м Київ, МСП, 04655, Україна ТОВ "Міжнародний науковий комітет", вул Артема, 77, м Київ, 04050, Україна
ДивитисяДодаткова інформація
Назва патенту англійськоюA process for preparing hydroxamic acids
Назва патенту російськоюСпособ получения гидроксамовых кислот
МПК / Мітки
МПК: C07D 309/14, C07D 309/04, C07D 311/94, C07C 311/29, C07C 315/00, C07C 303/00, C07D 493/08, C07C 317/44
Мітки: кислот, спосіб, гідроксамових, одержання
Код посилання
<a href="https://ua.patents.su/13-57750-sposib-oderzhannya-gidroksamovikh-kislot.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання гідроксамових кислот</a>
Попередній патент: Похідні піперазину, спосіб їх одержання, фармацевтична композиція та спосіб її одержання
Наступний патент: Спосіб виміру фігури людини
Випадковий патент: Спосіб лікування дисбіотичних порушень піхви