Спосіб одержання протисудомних похідних топірамату
Номер патенту: 81657
Опубліковано: 25.01.2008
Автори: Данкан Скотт, Беркнер Йоахім Ернст, Міллс Джон
Формула / Реферат
1. Спосіб одержання сполуки формули (І)
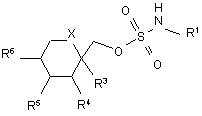 , (I)
, (I)
де
X вибраний з СН2 або О;
R1 є воднем;
R3, R4, R5 та R6 кожний незалежно вибраний з водню або нижчого алкілу та, коли X являє собою СН2, R5 та R6 можуть бути алкеновими групами, приєднаними, утворюючи бензольне кільце, та, коли X є О, R3 та R4 та/або R5 та R6 разом можуть бути метилендіоксигрупою формули:
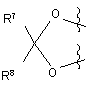 ,
,
де
R7 та R8 є однаковими або різними та є воднем, нижчим алкілом або є алкілом та приєднані, утворюючи циклопентильне або циклогексильне кільце;
де
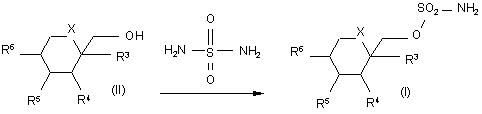
проводять реакцію сполуки формули (II) з сульфурилдіамідом при підвищеній температурі в присутності до 10% води, одержуючи відповідну сполуку формули (І).
2. Спосіб за п. 1, який відрізняється тим, що сполука формули (II) є діацетоном фруктози.
3. Спосіб за п. 2, який відрізняється тим, що сульфурилдіамід присутній в кількості, більшій ніж 0,9 еквівалента.
4. Спосіб за п. 3, який відрізняється тим, що сульфурилдіамід присутній в кількості, рівній 1,5 - 3 еквіваленти.
5. Спосіб за п. 2, який відрізняється тим, що сполуку формули (II) піддають реакції з сульфурилдіамідом в присутності неводної органічної або неорганічної основи.
6. Спосіб за п. 5, який відрізняється тим, що неводна органічна або неорганічна основа є третинним аміном.
7. Спосіб за п. 6, який відрізняється тим, що третинний амін є піридином.
8. Спосіб за п. 5, який відрізняється тим, що неводна органічна або неорганічна основа присутня в кількості, більшій ніж 1 еквівалент.
9. Спосіб за п. 8, який відрізняється тим, що неводну органічну або неорганічну основу використовують в кількості, рівній 3 - 5 еквівалентів.
10. Спосіб за п. 2, який відрізняється тим, що сполуку формули (II) піддають реакції з сульфурилдіамідом в апротонному органічному розчиннику.
11. Спосіб за п. 10, який відрізняється тим, що апротонний органічний розчинник є неводною органічною основою.
12. Спосіб за п. 11, який відрізняється тим, що неводна органічна основа є піридином.
13. Спосіб за п. 2, який відрізняється тим, що підвищену температуру підтримують в діапазоні від 90 °С до 170 °С.
14. Спосіб за п. 13, який відрізняється тим, що підвищену температуру підтримують в діапазоні від 120 °С до 140 °С.
15. Спосіб за п. 2, який відрізняється тим, що сполуку формули (II) піддають реакції з сульфурилдіамідом в присутності до 3% води.
16. Спосіб одержання сполуки формули (Іа)
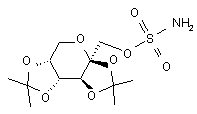 , (Ia)
, (Ia)
де
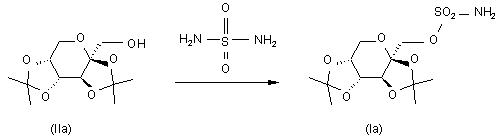
проводять реакцію сполуки формули (IIа) з сульфурилдіамідом при підвищеній температурі в присутності до 10% води, одержуючи відповідну сполуку формули (Іа).
17. Спосіб за п. 16, який відрізняється тим, що сульфурилдіамід використовують в кількості, більшій ніж 0,9 еквівалента.
18. Спосіб за п. 17, який відрізняється тим, що сульфурилдіамід використовують в кількості, рівній 1,5 - 3 еквіваленти.
19. Спосіб за п. 16, який відрізняється тим, що сполуку формули (IIа) піддають реакції з сульфурилдіамідом в присутності неводної органічної або неорганічної основи.
20. Спосіб за п. 19, який відрізняється тим, що неводна органічна або неорганічна основа є третинним аміном.
21. Спосіб за п. 20, який відрізняється тим, що третинний амін є піридином.
22. Спосіб за п. 21, який відрізняється тим, що неводну органічну або неорганічну основу використовують в кількості, більшій ніж 1 еквівалент.
23. Спосіб за п. 22, який відрізняється тим, що неводну органічну або неорганічну основу використовують в кількості, рівній 3 - 5 еквівалентів.
24. Спосіб за п. 16, який відрізняється тим, що сполуку формули (IIа) піддають реакції з сульфурилдіамідом в апротонному органічному розчиннику.
25. Спосіб за п. 24, який відрізняється тим, що апротонний органічний розчинник є неводною органічною основою.
26. Спосіб за п. 25, який відрізняється тим, що неводна органічна основа є піридином.
27. Спосіб за п. 16, який відрізняється тим, що підвищену температуру підтримують в діапазоні від 90 °С до 170 °С.
28. Cпосіб за п. 27, який відрізняється тим, що підвищену температуру підтримують в діапазоні від 120 °С до 140 °С.
29. Спосіб за п. 16, який відрізняється тим, що сполуку формули (IIа) піддають реакції з сульфурилдіамідом в присутності до 3% води.
Текст
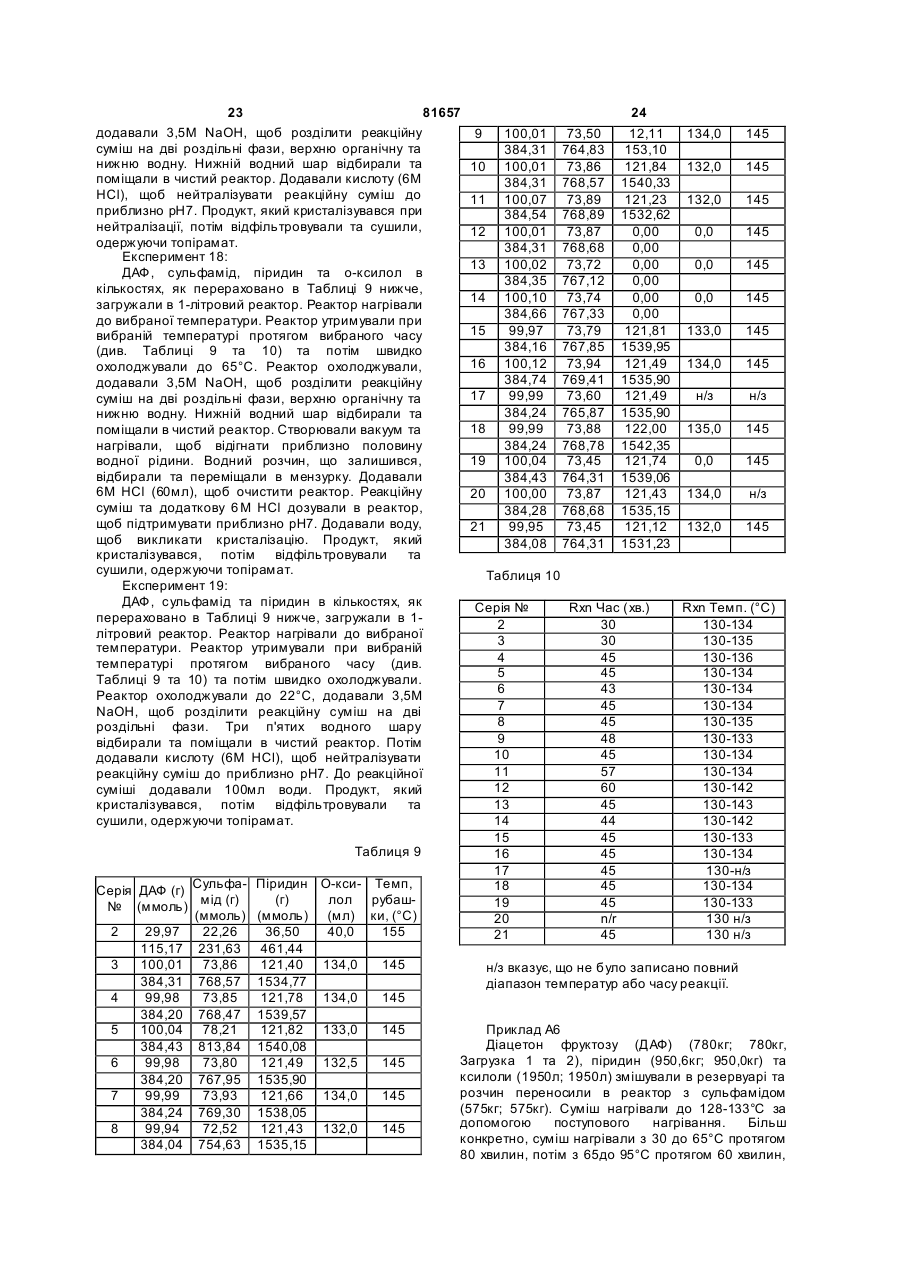
1. Спосіб одержання сполуки формули (І) (19) 1 3 81657 4 14. Спосіб за п. 13, який відрізняється тим, що 19. Спосіб за п. 16, який відрізняється тим, що підвищену температуру підтримують в діапазоні сполуку формули (IIа) піддають реакції з від 120 °С до 140 °С. сульфурилдіамідом в присутності неводної 15. Спосіб за п. 2, який відрізняється тим, що органічної або неорганічної основи. сполуку формули (II) піддають реакції з 20. Спосіб за п. 19, який відрізняється тим, що сульфурилдіамідом в присутності до 3% води. неводна органічна або неорганічна основа є 16. Спосіб одержання сполуки формули (Іа) третинним аміном. 21. Спосіб за п. 20, який відрізняється тим, що третинний амін є піридином. O 22. Спосіб за п. 21, який відрізняється тим, що NH2 неводну органічну або неорганічну основу O S використовують в кількості, більшій ніж 1 OO O еквівалент. O 23. Спосіб за п. 22, який відрізняється тим, що неводну органічну або неорганічну основу O O використовують в кількості, рівній 3 - 5 , (Ia) еквівалентів. 24. Спосіб за п. 16, який відрізняється тим, що де сполуку формули (IIа) піддають реакції з сульфурилдіамідом в апротонному органічному O SO NH розчиннику. O O H N NH O S OH 25. Спосіб за п. 24, який відрізняється тим, що O O O O O апротонний органічний розчинник є неводною O O O O органічною основою. 26. Спосіб за п. 25, який відрізняється тим, що (IIa) (Ia) неводна органічна основа є піридином. 27. Спосіб за п. 16, який відрізняється тим, що проводять реакцію сполуки формули (IIа) з підвищену температуру підтримують в діапазоні сульфурилдіамідом при підвищеній температурі в від 90 °С до 170 °С. присутності до 10% води, одержуючи відповідну 28. Cпосіб за п. 27, який відрізняється тим, що сполуку формули (Іа). підвищену температуру підтримують в діапазоні 17. Спосіб за п. 16, який відрізняється тим, що від 120 °С до 140 °С. сульфурилдіамід використовують в кількості, 29. Спосіб за п. 16, який відрізняється тим, що більшій ніж 0,9 еквівалента. сполуку формули (IIа) піддають реакції з 18. Спосіб за п. 17, який відрізняється тим, що сульфурилдіамідом в присутності до 3% води. сульфурилдіамід використовують в кількості, рівній 1,5 - 3 еквіваленти. 2 2 2 2 Ця заявка претендує на переваги попередньої [заявки US 60/451,863, поданої 4 березня 2003], яка повністю включена в дану заявку за допомогою посилання. Даний винахід відноситься до одностадійного способу одержання сполук формули (І) в якій X, R1, R3, R4 , R5 та R6 є такими, як визначено далі. Сполуки формули (І) є корисними при лікуванні епілепсії. Сполуки формули (І) в якій R1 вибрані з групи, яка містить водень та С1-4 алкіл, та в якій X, R3, R4, R 5 та R6 є такими, як визначено далі, є відомими сполуками, для яких було знайдено, що вони проявляють протисудомну активність та які, таким чином, є корисними при лікуванні станів, таких як епілепсія. Ці сполуки розкриті в [патентах US 4,582,916 та US 4,513,006], в яких також розкрито способи одержання згаданих сполук; та які включені в дану заявку за допомогою посилання. Перший спосіб, розкритий в патентах, на які було посилання вище, являє собою спосіб одержання сполук формули (І), який включає взаємодію спирту формули RCH2OH з хлорсуль фаматом формули CISO2NH2 або CISO2NHR1 в присутності основи, такої як третбутоксид калію або гідрид натрію, при температурі в діапазоні приблизно від -20°С до 25°С та в розчиннику, такому як толуол, тетрагідрофуран або диметилформамід, де R являє собою фрагмент формули (II) 5 81657 6 Цей спосіб має два основних недоліки. Одним відокремлений продукт повторно розчиняють в недоліком є те, що спосіб передбачає комбінацію другому розчиннику, а потім піддають реакції з NaH та ДМФА, яка має неконтрольовану одержанням кінцевого продукту. Це призводить до екзотермію та яка, таким чином, являє собою способу, який потребує відокремлення потенційно вибухову речовину. [Ди в. J. Buckley et напівстійкої, термічно нестабільної проміжної al., Chemical & Engineering News, July 12, 1982, сполуки ROSO2Cl. Додатково цей спосіб вимагає page 5; та G. DeWail, Chemical & Engineering News, обробки різних розчинників та різних способів Sept. 13, 1982]. Іншим недоліком є те, що в способі утилізації розчинників для повторного також використовують надзвичайно токсичний та використання або очистки, що призводить до корозійний хлорсульфоніл ізоціанат (ХСІ) для того, способу, який є як затратним, так і трудомістким. щоб одержати комерційно недоступний сульфаміл Об'єктом даного винаходу є хлорид (CISO2NH2). ХСІ є не лише важким при одностадійний спосіб одержання сполук формули роботі з ним через його токсичність та корозійну (І), спосіб, в якому використовують легко доступні активність, але він також доступний від лише матеріали, може бути проведений без обмеженого числа постачальників. відокремлення проміжних сполук, та/або який дає Інший спосіб одержання сполуки формули (І), відносно високі виходи, таким чином розкритий у згаданому ви ще [патенті US передбачаючи комерційне одержання сполук 4,513,006], включає взаємодію спирту формули формули (І). RCH2OH з сульфурил хлоридом формули SO2CI2 в Даний винахід відноситься до одностадійного присутності основи, такої як триетиламін або способу одержання сполук формули (І) піридин при температурі в діапазоні приблизно від -40°С до 25°С в діетиловому ефірі або метилен хлориді, як розчиннику, з одержанням хлорсуль фату формули RCH2OSO2CI2. Хлорсуль фат формули RCH2OSO2CI 2 потім може бути підданий взаємодії з аміном формули R1NH2 при температурі в діапазоні приблизно від -40°С в якій до 25°С в метилен хлориді або ацетонітрилі, як X вибраний з СН2 або О; розчиннику, з одержанням сполуки формули (І). R1 вибраний з групи, що складається з водню Цей спосіб, в якому використовують діетиловий та С1-4 алкілу; ефір, метилен хлорид та ацетонітрил, як R3, R4, R 5 та R6 кожний незалежно вибраний з розчинники, дає відносно низькі виходи бажаного водню або нижчого алкілу та, коли X являє собою кінцевого продукту формули (І). СН2, R5 та R6 можуть бути алкеновими групами, Третій спосіб, розкритий в двох патентах, приєднаними, утворюючи бензольне кільце, та, згаданих вище, включає взаємодію хлорсульфату коли X являє собою О, R3 та R4 та/або R5 та R6 формули RCH2OSO2CI2, одержаного, як було разом можуть бути метилендіокси групою попередньо описано, з азидом металу, таким як формули: азид натрію, в розчиннику, такому як метилен хлорид або ацетонітрил, з одержанням азидосульфату формули RCH2OSO3N3. Азидосульфат потім відновлюють до сполуки формули (І), в якій R1 являє собою водень, за в якій допомогою каталітичної гідрогенізації. R7 та R8 є однаковими або різними та являють Недоліком цього способу є те, що при собою водень, нижчий алкіл або являють собою роботі з азидними сполуками можуть відбуватися алкіл та приєднані, утворюючи циклопентильне вибухи. Також спосіб містить додаткове хімічне або циклогексильне кільце; перетворення, що включає в себе відновлення в якому азиду до фрагменту NH2. Maryanoff та інші в [US 5,387,700] розкривають спосіб одержання сполук формули (І), який включає взаємодію спирту формули RCH2OH з сульфурил хлоридом в присутності основи, в проводять реакцію сполуки формули (II) з розчиннику, який вибраний з групи, що містить толуол, трет-бутил метиловий ефір га сульфурил діамідом (також відомим як сульфамід) тетрагідрофуран, з одержанням проміжної сполуки при підвищеній температурі в присутності від 0 до хлорсуль фату формули RCH2OSO2CI2. приблизно 10% води, одержуючи відповідну Хлорсуль фат формули RCH2OSO2CI2 піддають сполуку формули (І). Даний винахід, крім того, відноситься до реакції з аміном формули R1NH2 в розчиннику, який вибраний з групи, що містить способу одержання сполуки формули (Іа) тетрагідрофуран, трет-бутил метиловий ефір та нижчі алканоли (наприклад метанол або етанол), з одержанням сполуки формули (І). Одним недоліком цього способу є те, що сполуку формули (І) одержують в гр уповому способі, в якому проводять першу реакцію, розчинник видаляють, продукт відокремлюють, 7 також відомої як топірамат, в якому 81657 проводять реакцію сполуки формули (ІІа) (також відомої як діацетон фруктоза або ДАФ) з сульфурил діамідом (також відомим як сульфамід) при підвищеній температурі в присутності від 0 до приблизно 10% води, одержуючи відповідну сполуку формули (Іа). Даний винахід, крім того, відноситься до сполуки, одержаної відповідно до будь-якого зі способів, описаних в даній заявці. Прикладом винаходу є фармацевтична композиція, яка містить фармацевтично прийнятний носій та сполуку, одержану відповідно до будь-якого зі способів, описаних вище. Прикладом винаходу є фармацевтична композиція, одержана за допомогою змішування фармацевтично прийнятного носія та сполуки, одержаної відповідно до будь-якого зі способів, описаних вище. Прикладом винаходу є спосіб одержання фармацевтичної композиції, який включає змішування фармацевтично прийнятного носія та сполуки, одержаної відповідно до будь-якого зі способів, описаних ви ще. Іншим прикладом винаходу є застосування сполуки, одержаної відповідно до будь-якого зі способів, описаних в даній заявці, при одержанні лікарського засобу для лікування епілепсії. У втіленні даного винаходу сполука формули (І) являє собою топірамат, сполуку формули (Іа) Як використовується в даній заявці, під термінами "діацетон фруктоза" та "ДАФ" слід мати на увазі діацетон-р-D-фруктозу, сполуку формули (IIа) Як використовується в даній заявці, термін "алкіл", сам по собі чи як частина заміщеної групи, повинен включати лінійні та розгалужені вуглецеві ланцюги. Наприклад, алкільні групи включають метил, етил, пропіл, ізопропіл, бутил, ізобутил, втор-бутил, трет-бутил, пентил та подібні. Якщо не зазначено інше, під терміном "нижчий", коли він використовується з алкілом, слід мати на увазі, що вуглецевий ланцюг містить від одного до чотирьох атомів вуглецю. 8 Як використовується в даній заявці, позначення "*" означає наявність стереогенного центру. Як використовується в даній заявці, під терміном "підвищена температура" слід мати на увазі температуру вищу, ніж приблизно 90°С, переважно температуру вищу ніж або рівну температурі кипіння зі зворотним холодильником розчинника реакційної суміші, більш переважно температуру в діапазоні від приблизно 90°С до приблизно 170°С, ще більш переважно температуру в діапазоні від приблизно 110°С до приблизно 160°С, ще більш переважно температуру в діапазоні від приблизно 120°С до приблизно 140°С. Як використовується в даній заявці, якщо не зазначено інше, під терміном "в присутності від 0 до приблизно 10% води" слід мати на увазі, що загальна молярна кількість води щодо молярної кількості ДАФ знаходиться в діапазоні від 0 до приблизно 10%. Як використовується в даній заявці, під терміном "апротонний органічний розчинник" слід мати на увазі будь-який органічний розчинник, який не дає протон при реакційних умовах. Відповідні приклади включають, але не обмежуються, ксилол (наприклад о-ксилол, пксилол, м-ксилол або їх суміш), е тил бензол, мезитилен, тетрагідронафталін, піридин, 1-метил2-піролідинон, толуол, 4-метил-2-пентанон, бензонітрил, диметилформамід, сульфолан, дифеніловий ефір та подібні. Термін "суб'єкт", як використовується в даній заявці, відноситься до тварини, переважно ссавця, більш переважно людини, яка є або була об'єктом лікування, нагляду або експерименту. Термін "терапевтично ефективна кількість", як використовується в даній заявці, означає ту кількість активної сполуки або фармацевтичного агента, яка викликає біологічну або лікарську реакцію в тканинній системі, тварині або людині, яку шукає дослідник, ветеринар, медичний лікар або інший клінічній лікар, яка включає полегшення симптомів хвороби або розладу, що лікують. Як використовується в даній заявці, термін "композиція" включає продукт, який містить вказані інгредієнти у вказаних кількостях, а також будьякий продукт, який виникає, безпосередньо або опосередковано, з комбінацій вказаних інгредієнтів у вказаних кількостях. Фахівець в даній галузі техніки визнає, що сполуки формули (І) мають декілька стереогенних центрів, як позначено нижче зірочками. Крім того, фахівець в даній галузі техніки визнає, що способи за даним винаходом можуть бути використані для одержання рацемічних сумішей сполуки формули (І) або будь-якого стереоізомеру сполуки формули (І) виділенням та заміною відповідних рацемічних сумішей або стереоізомерів реагентів. 9 81657 10 Даний винахід відноситься до одностадійного приблизно 160°С; ще більш переважно при способу одержання сполуки формули (І), як температурі в діапазоні від приблизно 120°С до наведено на Схемі 1. приблизно 140°С; одержуючи відповідну сполуку формули (І). Переважно, сполуку формули (II) піддають взаємодії з сульфурил діамідом відповідно до способу, наведеному вище на С хемі 1, за відсутності будь-якого іншого спирту (тобто спирту відмінного від сполуки формули (II)). Відповідно, прийнятну заміщену сполуку Сполука формули (Іа) може бути одержана формули (II), відому сполуку або сполуку, відповідно до способу, наведеного на Схемі 2 одержану за допомогою відомих способів, піддають взаємодії з сульфурил діамідом (також відомим як сульфамід), де сульфурил діамід переважно присутній в кількості більшій, ніж або рівній приблизно 0,9 еквівалентам; більш переважно в кількості в діапазоні від приблизно 1,5 до приблизно 3 еквівалентів; ще більш переважно в кількості рівній до приблизно 2 Відповідно, сполуку формули (IIа), відому еквівалентів; сполуку, також відому як діацетон фруктоза (ДАФ), переважно в присутності неводної органічної піддають взаємодії з сульфурил діамідом (також основи, такої як органічний третинний амін, такий відомим як сульфамід), де сульфурил діамід як піридин, 4-піколін, ізохінолін, диметилбутиламін, переважно присутній в кількості більшій, ніж або 4-диметиламінопіридин, 4-трет-бутилпіридин, рівній до приблизно 0,9 еквівалентів; більш імідазол, трибутиламін, диметилбензиламін та переважно в кількості в діапазоні від приблизно подібні; або неводної неорганічної основи, такої як 1,5 до приблизно 3 еквівалентів; ще більш К2СО3, КНСО3 , Nа2СО3, NaHCO3 та подібні; більш переважно в кількості рівній до приблизно 2 переважно, в присутності неводного органічного еквівалентів; третинного аміну; ще більш переважно в переважно в присутності неводної органічної присутності піридину; основи, такої як органічний третинний амін, такий де неводна органічна або неорганічна основа як піридин, 4-піколін, ізохінолін, диметилбутиламін, переважно присутня в кількості більшій, ніж 4-диметиламінопіридин, 4-трет-бутилпіридин, приблизно 1 еквівалент; більш переважно, в імідазол, трибутиламін, диметилбензиламін та кількості в діапазоні від приблизно 3 до приблизно подібні; або неводної неорганічної основи, такої як 6 еквівалентів; ще більш переважно в кількості К2СО3, КНСО3 , Na3СО3, NaHCO3 та подібні; більш рівній до приблизно 4 еквівалентів; переважно, в присутності неводного органічного в присутності від 0% до приблизно 10% води, третинного аміну; ще більш переважно в переважно від 0% до приблизно 5% води, більш присутності піридину; переважно від 0% до приблизно 3% води; де неводна органічна або неорганічна основа переважно в апротонному органічному переважно присутня в кількості, більшій, ніж розчиннику, такому як ксилол (наприклад оприблизно 1 еквівалент; більш переважно в ксилол, п-ксилол, м-ксилол або їх суміш), етил кількості в діапазоні від приблизно 3 до приблизно бензол, мезитилен, тетрагідронафталін, піридин, 6 еквівалентів; ще більш переважно в кількості 1-метил-2-піролідинон, толуол, 4-метил-2,рівній до приблизно 4 еквівалентів; пентанон, бензонітрил, диметилформамід, в присутності від 0% до приблизно 10% води, сульфолан, дифеніловий ефір та подібні; або переважно від 0% до приблизно 5% води, більш суміш апротонних органічних розчинників, таких як переважно від 0% до приблизно 3% води; дифеніловий ефір:біфеніл, ксилол:толуол, переважно в апротонному органічному технічно чисті змішані ксилоли та подібні; більш розчиннику, такому як ксилол (наприклад опереважно в о-ксилолі, п-ксилолі, м-ксилолі, їх ксилол, п-ксилол, м-ксилол або їх суміш), етил суміші або технічно чисти х змішаних ксилолах; бензол, мезитилен, тетрагідронафталін, піридин, альтернативно, розчинник може бути 1-метил-2-піролідинон, толуол, 4-метил-2вибраний з неводної органічної основи, такої як пентанон, бензонітрил, диметилформамід, органічний третинний амін, наприклад, піридин, 4сульфолан, дифеніловий ефір та подібні; або піколін, ізохінолін, диметилбутиламін, 4суміш апротонних органічних розчинників, таким як диметиламінопіридин, 4-трет-бутилпіридин, дифеніловий ефір:біфеніл, ксилол:толуол, імідазол, трибутиламін, диметилбензиламін та технічно чисті змішані ксилоли та подібні; більш подібні; переважно, неводний органічний переважно в о-ксилолі, п-ксилолі, м-ксилолі, їх третинний амін; більш переважно піридин; суміші або технічно чисти х змішаних ксилолах; більш альтернативно, коли сполуку формули альтернативно, розчинник може бути (II) піддають взаємодії в присутності неводної вибраний з неводної органічної основи, такої як органічної основи, неводна органічна основа може органічний третинний амін, наприклад, піридин, 4виконувати функції розчинника; піколін, ізохінолін, диметилбутиламін, 4при підвищеній температурі, переважно при диметиламінопіридин, 4-трет-бутилпіридин, температурі в діапазоні від приблизно 90°С до імідазол, трибутиламін, диметилбензиламін та приблизно 170°С; більш переважно при температурі в діапазоні від приблизно 110°С до 11 81657 12 подібні; переважно, неводний органічний подальшій стадії, використовуючи способи, відомі третинний амін; більш переважно піридин; з рівня техніки. більш альтернативно, коли сполуку формули Наступні приклади описують винахід більш (II) піддають взаємодії в присутності неводної детально та призначені для ілюстрації винаходу, органічної основи, неводна органічна основа може не обмежуючи його. виконувати функції розчинника; Приклад А1 при підвищеній температурі, переважно при Експериментальні серії №101-116: температурі в діапазоні від приблизно 90°С до В реактор завантажували ДАФ, сульфамід, приблизно 170°С; більш переважно при основу та розчинник, як описано в Таблиці 1. При температурі в діапазоні від приблизно 110°С до перемішуванні реакційну суміш нагрівали та приблизно 160°С; ще більш переважно при утримували при бажаній температурі та протягом температурі в діапазоні від приблизно 120°С до вибраного проміжку часу (як перераховано в приблизно 140°С; Таблиці 2). одержуючи відповідну сполуку формули (Іа). Для експериментальних серій 101, 102, 103 Переважно, сполуку формули (IIа) піддають суміш переганяли при 41°С під вакуумом протягом взаємодії з сульфурил діамідом відповідно до 30, 35 та 20 хвилин, відповідно. способу, наведеному вище на С хемі 2, за Реакційні суміші охолоджували до кімнатної відсутності будь-якого іншого спирту (тобто спирту температури, потім двічі екстрагували приблизно відмінного від сполуки формули (IIа)). 50мл 1М водного розчину NaOH (0,3М розчин Якщо сполуки за даним винаходом мають, водного NaOH використовували для принаймні, один хіральний (або стереогенний) експериментальних серій №101-108). Одержаний центр, вони можуть відповідно існувати у формі розчин основного продукту нейтралізували, енантіомерів. Якщо сполуки мають два або більше використовуючи 6 М водний розчин НСl. Після хіральних (або стереогенних) центри, вони кристалізації розчин продукту відфільтровували та додатково можуть існувати у формі вологий осад сушили протягом 16-20 годин діастереомерів. Слід розуміти, що всі такі ізомери (приблизно 22 години для експериментальних та їх суміші включені в межі даного винаходу. До серій №106 та 107) при приблизно 50°С під того ж, деякі з кристалічних форм сполук можуть вакуумом, одержуючи продукт топірамат. Сухий існувати як поліморфи, та як такі, що зазначені тут, продукт аналізували за допомогою ВЕРХ. включені в даний винахід. Крім того, деякі зі сполук Експериментальні серії №117-139: можуть утворювати сольвати з водою (наприклад В реактор завантажували ДАФ, сульфамід, гідрати) або зі звичайними органічними основу та розчинник, як описано в Таблиці 1. При розчинниками, та такі сольвати також, мається на перемішуванні реакційну суміш нагрівали та увазі, входять в межі даного винаходу. утримували протягом періоду приблизно 60 Якщо способи одержання сполук за даним хвилин при бажаній температурі (як перераховано винаходом дають суміш стереоізомерів, ці ізомери в Таблиці 2). Після охолодження до кімнатної можуть бути розділені традиційними способами, температури реакційну суміш двічі екстрагували такими як, препаративна хроматографія. Сполуки приблизно 75мл 1М водного розчину NaOH. можуть бути одержані у рацемічній формі, чи Одержаний розчин основного продукту індивідуальні енантіомери можуть бути одержані нейтралізували, використовуючи 6 М водний або за допомогою енантіоспецифічних синтезів, розчин НСl. Після кристалізації розчин продукту або за допомогою розділення. Сполуки можуть, відфільтровували та вологий осад сушили наприклад, бути розділені на їх складові протягом 16-20 годин (~24 години для енантіомери за допомогою стандартних методів, експериментальних серій 129, 134, 137 та ~ 48 таких як утворення діастереомерних пар шляхом годин для експериментальних серій №126, 128, одержання солі з оптично активною кислотою, 130, 131, 136) при приблизно 50°С під вакуумом, такою як (-) -ди-п-толуол-D-винна кислота та/або одержуючи продукт топірамат. В (+) -ди-п-толуол-L-винна кислота, з подальшою експериментальних серіях №123, 125 та 135 фракційною кристалізацією та відновленням очікували одержання продукту, але від них вільної основи. Сполуки можуть також бути відмовилися внаслідок труднощів протягом розділені утворенням діастереомерних ефірів або екстракції або кристалізації. Сухий продукт амідів, з подальшим хроматографічним аналізували за допомогою ВЕРХ. розділенням та видаленням хіральної допоміжної Описані вище процедури виконували речовини. Альтернативно, сполуки можуть бути відповідно до умов серій, як перераховано в розділені, використовуючи хіральну колонку ВЕРХ. Таблиці 1 та 2 нижче. Продукт топірамат Протягом будь-якого зі способів одержання одержували в усі х експериментальних серіях, сполук за даним винаходом може бути необхідним окрім випадків, зазначених ви ще. та/або бажаним захистити чутливі або хімічно активні групи на будь-якій з молекул, яких це стосується. Це може бути досягнуто за допомогою традиційних захисних гр уп, таких як групи, описані Серія ДАФ Сульфамід Основа в [Protective Groups in Organic Chemistry, під № редакцією J.F.W. McOmie, Plenum Press, 1973; та 101 10,05г 7,43г піридин T.W. Greene & P.G.M. Wuts, Protective Groups in 38,62ммоль 77,32ммоль Organic Synthesis, John Wiley & Sons, 1991]. 102 10,0г 7,39г піридин Захисні групи можуть бути видалені на придатній 38,43ммоль 76,9ммоль О 153 153 13 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 131 132 133 10,0г 38,43ммоль 10,0г 38,43ммоль 10,01г 38,47ммоль 10,01г 38,47ммоль 10,01г 38,47ммоль 10,02г 38,50ммоль 14,98г 57,56ммоль 9,99г 38,39ммоль 10,04г 38,58ммоль 10,03г 38,54ммоль 10,02г 38,50ммоль 9,98г38,35ммоль 10,02г, 38,5ммоль 10,0г 38,43ммоль 29,92г 114,98ммоль 30,06г 115,51ммоль 30,07г 115,55ммоль 30,03г 115,4ммоль 30,04г 115,44ммоль 29,98г 115,09ммоль 30,02г 115,36ммоль 30,09г 115,63ммоль 30,01г 115,32ммоль 30,01 г 115,32ммоль 29,99г 115,24ммоль 30,02г 115,36ммоль 29,95г 115,09ммоль 30,02г 115,36ммоль 29,99г 115,24ммоль 30,03г 115,4ммоль 10,04г 7,33г 76,27ммоль 7,43г 77,32ммоль 7,39г 76,9ммоль 7,39г 76,9ммоль 7,44г 77,42ммоль 7,38г 76,8ммоль 11,08г 115,3ммоль 7,39г 76,9ммоль 7,31г 76,07ммоль 7,39г 76,9ммоль 7,39г 76,9ммоль 7,38г 76,8ммоль 7,36г 76,59ммоль 7,36г 76,59ммоль 22,31г 232,15ммоль 22,3г 232,05ммоль 22,34г 232,47ммоль 22,22г 231,22ммоль 22,23г 231,32ммоль 22,18г 230,8 моль 22,34г 232,47ммоль 22,24г 231,43ммоль 22,18г 230,8ммоль 22,17г 230,7ммоль 22,34г 232,47ммоль 22,22г 231,22ммоль 22,32г 232,26ммоль 22,34г 232,47ммоль 22,24г 231,43ммоль 22,5г 234,31ммоль 7,38г 81657 14 38,58ммоль 12,18г 76,8ммоль ксилоли змішані 134 153,98ммоль 30,05г 22,21г 100мл 4-трет-бутил-піридин піридин 115,47ммоль 231,11ммоль ксилоли 12,34г змішані 135 156,01моль 30,08 г 22,45г 100мл ізохінолін піридин 115,59ммоль 233,61моль ксилоли 12,17г змішані 136 153,86ммоль 60,08 г 44,28г 101мл 4-піколін піридин 230,87ммоль 460,77ммоль ксилоли 12,45г змішані 137 157,4ммоль 59,99г 44,44г 101мл піридин піридин 230,53ммоль 462,43ммоль ксилоли 12,15г змішані 138 153,6ммоль 30,04г 22,5г 51мл 4-трет-бутил-піридин 4-піколін 12,54г мезитилен Таблиця 2 134,65ммоль 50мл піридин 18,33г змішані ксилоли Серія № Темп. (°С) 231,73ммольЧас (хв.) 150мл 101 12,14г ~65 о-ксилол 128-140 піридин 102 135-136 153,48ммоль 60 99мл 103 12,14г 65 о-ксилол 132-136 піридин 104 138-139 153,48ммоль 60 100мл 105 12,22г 60 о-ксилол 134-137 піридин 106 130-136 154,49ммоль 65 100мл 107 12,22г 60 о-ксилол 124-133 піридин 108 не 130-140 154,49ммоль доступний 100мл 109 12,25г 80 о-ксилол 99-114 піридин 110 133-135 154,87ммоль 55 100мл 111 45 о-ксилол 130-133 піридин 12,4г 112 130-134 156,76ммоль 50 99мл 113 12,16г 60 о-ксилол 135-137 піридин 114 134-136 153,73ммоль 60 100мл 115 36,52г 62 о-ксилол 133-137 піридин 116 134-135 461,49ммоль 60 302мл 117 62 135-139 піридин 36,68г о-ксилол 118 60 134-136 463,72ммоль 150мл 119 62 141-146 4-піколін 42,48г 1:1 о-ксилол: 4-піколін 120 62 130-135 456,14ммоль 150мл 121 60 131-133 піридин 36,58г о-ксилол 122 69 132-134 462,45ммоль 60 75мл 123 150-156 піридин 124 36,55г 62 о-ксилол 142-144 462,07ммоль 62 40,0мл 125 153-157 піридин 126 36,37г 55 не має 130-140 127459,8ммоль 60 109-112 4-піколін 128 42,91г 61 не має 137-141 460,75ммоль 58 129 139-145 ізохінолін 130 58,11г 67 не має 136-140 449,91ммоль 62 131 134-144 4-піколін 132 42,92г 60 тетрагідро-нафталін 130-138 460,86ммоль 60 40мл 133 140-135 4-піколін 42,8г 134 64 тетрагідро-нафталін 133-132 459,57ммоль 57 41мл 135 130-134 диметил бутиламін 136 59,95г 64 тетрагідро-нафталін 130-138 137757,9ммоль 60 40мл 130-132 піридин 138 36,56г 34 тетрагідро-нафталін 130-149 139462,2ммоль 41 40мл 25-120 піридин 36,45г дифеніловий ефір Приклад А2 460,81ммоль 41мл Експериментальні серії №140-147; Основа 4-піколін 43,03г дифеніловий ефір Піридин:462,04ммоль 40,5мл Вісім експериментів виконували для оцінки 4-піколін 42,94г о-ксилол спільного впливу об'єму розчинника, часу реакції 461,08ммоль 40мл та температури реакції нао-ксилол одностадійний синтез піридин 36,12г топірамату, ви ходячи з діацетон фруктози (ДАФ). 456,64ммоль 40мл ДАФ об'єднували з сульфамідом, піридином та ізохінолін 20,05г о-ксилолу, як розчинником, (в о-ксилол вибраним об'ємом піридин 155 460 461 922 923 15 81657 16 кількостях як перераховано в Таблиці 3) в 1л круглодонній колбі. Наповнену колбу потім Приклад A3 занурювали в попередньо нагріту масляну баню Експериментальні серії №148-156: Основа при вибраній зовнішній температурі, та реакційну трет-бутилпіридин: суміш перемішували та нагрівали до вибраної Дев'ять експериментів виконували для оцінки температури реакції, де її утримували протягом спільного впливу еквівалентних основ, вибраного часу перед тим, як колбу видаляли з температури реакції та часу реакції на масляної бані та охолоджували до кімнатної одностадійний синтез топірамату, використовуючи температури. Реакційну суміш потім двічі 4-трет-бутилпіридин та виходячи з діацетон екстрагували 1М NaOH (75мл порціями). Водні фр уктози (ДАФ). екстракти об'єднували та нейтралізували 6М НСl, ДАФ об'єдн ували з сульфамідом, 4-третщоб викликати кристалізацію продукту. В усіх бутилпіридином (в кількостях як перераховано в випадках продукт осаджувався у вигляді масла. Таблиці 4) та 40мл о-ксилолу в 500мл Масло перемішували протягом ночі до утворення круглодонній колбі. Реакційну суміш перемішували кристалів, які можна відфільтрувати. Одержану та нагрівали до вибраної температури реакції на тверду речовину сушили під вакуумом протягом масляній бані протягом приблизно 19-23 хвилин. 16-18 годин при 50°С. Сухий продукт аналізували Реакційну суміш підтримували при вибраній за допомогою ВЕРХ. температурі реакції протягом вибраного часу, а Далі згадані вище процедури восьми потім швидко охолоджували до 25°С. Реакційну експериментів виконували відповідно до суміш двічі екстрагували 1М NaOH (75мл експериментальних умов, як перераховано в порціями). Водні екстракти об'єднували та Таблиці 3 та 4 нижче. В усіхекспериментальних нейтралізували, використовуючи 6М НСl, щоб серіях одержували продукт топірамат. викликати кристалізацію продукту. В усі х випадках продукт осаджувався у вигляді масла, яке Таблиця 3 перемішували протягом ночі до утворення кристалів, які можна відфільтрувати. Кристали Основа піридин сушили під вакуумом протягом 16-18 годин при Серія О50°С. Сухий продукт аналізували за допомогою ДАФ Сульфамід Основа № ксилол ВЕРХ. Далі згадані вище процедури дев'яти 140 30,01г 22,24г 36,56г 75мл експериментів виконували відповідно до 115,32мм 231,43ммол 462,2ммоль експериментальних умов, як перераховано в оль ь Таблиці 5 та 6 нижче. В усіх експериментальних 141 30,03г 22,37г 36,78г 75,5мл серіях одержували продукт топірамат. 115,4ммо 232,78ммол 464,98ммол ль ь ь 142 30,01г 22,58г 36,5г 75,5мл 115,32мм 234,96ммол 461,44ммол Основа 4-трет-бутилпіридин оль ь ь Серія № ДАФ Сульфамід 143 30,12г 22,44г 36,68г 75мл 148 30,16г 22,42г 115,74мм 233,51ммол 463,72ммол 115,9ммоль 231,4ммоль оль ь ь 149 30,20г 22,21г 144 30г 22,34г 36,88г 40мл 115,28мм 232,47ммол 466,25ммол 116,05ммоль 231,1ммоль оль ь ь 150 30,12г 22,16г 145 30,05г 22,31г 36,51г 40мл 115,7ммоль 230,6ммоль 115,47мм 232,15ммол 461,57ммол 151 30,23г 22,12г оль ь ь 116,2ммоль 230,2ммоль 146 30,03г 22,24г 36,6г 40мл 152 30,10г 22,75г 115,4ммо 231,43ммол 462,71ммол 115,7ммоль 236,8ммоль ль ь ь 153 30,03г 22,42г 147 30,07г 22,34г 36,61г 40мл 115,4ммоль 233,3ммоль 115,55мм 232,47ммол 462,83ммол 154 30,23г 22,24г оль ь ь 116,2ммоль 231,5ммоль 155 30,15г 22,49г Таблиця 4 115,9ммоль 234,1ммоль 156 30,08г 22,24г Серія № Час (хв.) Темп. (°С) 115,6ммоль 231,5ммоль 140 60 130,0-133,4 141 142 143 144 145 146 147 зо 60 зо зо 60 60 зо 130,0-132,7 130,0-134,3 130,0-134,7 130,0-130,3 130,0-134,9 130,0-132,8 130,0-133,9 Таблиця 6 Серія № 148 149 150 Час (хв.) 44 60 60 Темп. (°С) 130,0-150,5 110,0-126,6 110,0-129,0 151 152 153 154 155 156 17 28 29 15 30 15 30 81657 130,1-146,6 130,0-151,6 130,0-141,5 130,1-143,4 110,1-117,4 110,1-113,7 Приклад А4 Численні експерименти були виконані для оцінки впливу розчинника та основи на одностадійний спосіб одержання топірамату. Експериментальні умови були такими, як перераховано в Таблицях 7 та 8, з експериментальними процедурами для окремих стадій, як описано нижче. Стадія №157, 158, 160, 164-166: ДАФ та сульфамід (в кількостях, як в Таблиці 8) переносили до пробірки. Потім до суміші ДАФ/сульфамід додавали вибраний розчинник та вибрану основу (в кількостях, як перераховано в Таблиці 7). Реакційну суміш потім перемішували та нагрівали з реакційною сумішшю, яку підтримували при вибраній температурі (див. Таблицю 8) протягом вибраного часу (див. Таблицю 8), після сплину зазначеного часу верхній шар досліджували та аналізували за допомогою ВЕРХ. Серія №159, 188-198: ДАФ, сульфамід, о-ксилол та визначену кількість вибраної основи (див. Таблиці 7 та 8) переносили до 500мл круглодонної колби. Реакційну суміш потім перемішували та нагрівали з реакційною сумішшю, яку підтримували при вибраній температурі протягом вибраного часу (див. Таблицю 8) на масляній бані. Реакційну суміш видаляли з гарячого масла, охолоджували до приблизно кімнатної температури, а потім двічі екстрагували 1М NaOH (75мл порціями). Водні екстракти об'єднували та нейтралізували, використовуючи 6 М НСl, щоб викликати кристалізацію продукту. Одержану тверду речовину сушили під вакуумом протягом 16-18 годин при 50°С. Сухий продукт аналізували за допомогою ВЕРХ. Стадія №161-163 ДАФ, суль фамід, 4-піколін та вибраний розчинник (в кількостях, як в Таблиці 7 та 8) переносили до 250мл круглодонної колби. Колбу занурювали в нагріту масляну баню та суміш перемішували при вибраній підтриманій температурі протягом вибраного часу реакції (див. Таблицю 8). Реакційну суміш потім охолоджували до кімнатної температури та двічі екстрагували 1М NaOH (75мл порціями). Водні екстракти нейтралізували 6М НСl та потім утримували при кімнатній температурі протягом ночі, щоб дати продукту кристалізуватися. Одержану кристалічну тверду речовину відфільтровували та сушили протягом 16-18 годин у вакуум-сушильній шафі при 50°С. Потім продукт аналізували за допомогою ВЕРХ. Примітка: Хоча очікували одержати продукт в серії №162, продукт не кристалізувався та, таким чином, не був проаналізований; продукт серії №163 був у вигляді клейкої твердої речовини. Серії №167-172: 18 Вибраний розчинник у вибраній кількості (див. Таблицю 7) переносили до 125мл пробірки разом з піридином (в кількостях, як в Таблиці 7) та одержаний розчин нагрівали до вибраної температури. Потім додавали попередньо зважену суміш ДАФ та сульфаміду (в кількостях, як в Таблиці 8) разом з трансфертними промиваннями розчинника (приблизно 2мл). Реакційну суміш перемішували при вибраній температурі протягом вибраного часу (див. Таблицю 8), після сплину зазначеного часу верхній шар досліджували (деякі суміші утворювали невеликий, темний другий шар) та аналізували за допомогою ВЕРХ. Серія №173 ДАФ, сульфамід, піридин та змішані ксилоли (в кількостях, як перераховано в Таблицях 7 та 8) поміщали в 1000мл круглодонну колбу в попередньо нагрітій (140°С) масляній бані. Реакційну суміш перемішували при вибраній температурі реакції протягом 90 хвилин. Колбу видаляли з масляної бані та залишкове тепловиділення використовували для відгонки приблизно 22г рідини з реакційної суміші. Реакційну суміш екстрагували трьома порціями (90мл, 30мл та 10мл) 0,35М NaOH. 1н НСl (50мл) додавали до водних екстрактів, що призводило до утворення масла. Суміш перемішували до перетворення масла в кристали, які можна відфільтрува ти. Кристали збирали фільтруванням, промивали водою та сушили у вакуум-сушильній шафі протягом 16 годин при 50°С. Потім продукт аналізували за допомогою ВЕРХ. Серії №174-180: ДАФ, сульфамід, піридин та вибраний розчинник (в кількостях, як перераховано в Таблицях 7 та 8) переносили до 500мл круглодонної колби. Реакційну суміш потім перемішували та нагрівали в масляній ванні до цільової температури. Реакційну суміш витримували при приблизно цільовій температурі (перераховано в Таблиці 8) протягом вибраного часу (див. Таблицю 8), видаляли з гарячого масла та охолоджували до кімнатної температури. До реакційної суміші потім додавали воду (100мл) та/або інші розчинники (МеОН, 0,5М NaOH або реакційний розчинник), за необхідності, щоб досягти гетерогенної суміші, яка складається з двох прозорих рідких шарів. Потім виконували ГХ аналіз обох шарів. Серія №181-183 ДАФ, сульфамід, 4-трет-бутилпіридин та вибраний розчинник (в кількостях, як перераховано в Таблицях 7 та 8) переносили до 500мл круглодонної колби. Реакційну суміш поміщали в масляну баню та перемішували, поки нагрівали при вибраній температурі реакції протягом вибраного часу (див. Таблицю 8). Реакційній суміші потім дозволяли охолонути до кімнатної температури. Реакційну суміш потім екстрагували відповідними розчинниками, одержуючи два прозорих рідких шари (Для серії 181 екстрагуючими розчинниками були вода (125мл) та змішані ксилоли (25мл); для серії 182 екстрагуючими розчинниками були вода (150мл) та метанол (25мл); для серії 183 екстрагуючими 19 81657 20 розчинниками були 0,3М NaOH (100мл)). 168 піридин 1,14 Виконували ГХ аналіз рідких зразків з обох шарів. 169 піридин 1,15 Серія №184 170 піридин 1,15 ДАФ, сульфамід, диметилбутиламін та 1,2,3,4171 піридин 1,15 тетрагідронафталін (в кількостях, як перераховано 172 піридин 1,17 в Таблицях 7 та 8) переносили до 250мл 173 піридин 17,29 круглодонної колби. Колбу поміщали в нагріту 174 піридин 18,23 масляну баню (136°С) та суміш перемішували, 175 піридин 18,22 поки нагрівали при вибраній температурі протягом 176 піридин 18,22 вибраного часу (див. Таблицю 8). Реакційну суміш 177 піридин 18,22 охолоджували до приблизно кімнатної 178 піридин 18,20 температури, та потім двічі екстрагували 1М NaOH 179 піридин 18,23 (75мл порціями). Водні екстракти нейтралізували, 180 піридин 12,17 використовуючи 6 М НСl та перемішували протягом 2 годин, щоб дозволити кристалізацію. 181 4-трет-бутилпіридин 31,17 Кристали збирали фільтруванням та потім сушили 182 4-трет-бутилпіридин протягом приблизно 17 годин 45 хвилин у вакуум183 4-трет-бутилпіридин 20,78 сушильній шафі при 52°С. Потім продукт 184 диметилбутиламін 59,95 аналізували за допомогою ВЕРХ. 185 ізохінолін 58,11 Серії №185-187 186 ізохінолін 20,05 ДАФ, сульфамід, ізохінолін та вибраний 187 ізохінолін 59,65 розчинник (в кількостях, як перераховано в 188 трибутиламін 85,49 Таблицях 7 та 8) поміщали в 250мл круглодонну 189 диметил-бензиламін 62,33 колбу. Реакційну суміш потім поміщали в масляну 190 диметилдодецил-амін 98,42 баню та перемішували, поки нагрівали при 191 гексадециламін 83,62 вибраній температурі реакції протягом вибраного 192 диметилтетрадецил-амін 111,22 часу (ди в. Таблицю 8). Реакційну суміш 193 диметилгексадецил-амін 124,30 охолоджували до приблизно кімнатної 194 диметилоктадецил-амін 137,13 температури та потім двічі екстрагували 1М NaOH (75мл порціями). Водні екстракти нейтралізували 195 морфолін 30,30 6М НСl та дозволяли знаходитися при кімнатній 196 піролідин 25,74 температурі протягом декількох днів, щоб 197 сечовина 20,29 полегшити кристалізацію. Кристали збирали 198 не має фільтруванням та потім сушили протягом 16-18 годин у вакуум-сушильній шафі при 50°С. Сухий Таблиця 8 продукт аналізували за допомогою ВЕРХ. Примітка: В усі х експериментальних серіях Серія № ДАФ(г) Сульфамід Час (хв.) Цільова одержували продукт топірамат, крім випадків (г) Темп, (°С) зазначених тут. Спостерігали утворення емульсії 157 0,76 0,84 30 115 під час екстракції в експериментальний серії 158 0,74 0,84 30 115 №187, та хоча очікували продукт топірамат, проте 159 30,21 22,21 30 130 продукт не був виділений. Передбачали, що 160 0,76 0,84 30 115 продукт, виділений в експериментальних серіях 161 30,07 22,34 62 140 №187, 191, 194 та 197, буде топіраматом, але це 162 30,01 22,18 62 150 не аналізували. 163 30,02 22,34 67 140 В таблицях 7 та 8 нижче перераховані умови 164 0,75 0,84 30 115 серій для експериментальних методик, які описані 165 0,76 0,84 30 115 вище. Крім того, як зазначено вище, в усіх 166 0,74 0,84 30 115 експериментальних серіях одержували продукт 167 0,73 0,83 31 115 топірамат. 168 0,75 0,85 30 115 169 0,75 0,84 30 Таблиця 7 115 170 0,76 0,85 30 115 Серія № Основа Основа (г) Розчинник115 (мл) 171 Розчинник 0,85 0,77 30 157 імідазол 1,01 п-ксилол 172 0,76 0,83 30 15,1 115 158 4-(диметиламіно)-піридин 1,77 п-ксилол 173 15,02 19,46 90 15,2 130 159 4-(диметиламіно)-піридин 42,08 о-ксилол 40 130 174 15,02 11,08 60 160 4-піколін 1,38 п-ксилол 15 130 175 15,05 11,07 60 161 4-піколін 42,48 о-ксилол 176 15,01 11,08 60 150 130 162 4-піколін 42,92 тетрагідро-нафталін 11,08 40 130 177 15,04 60 163 4-піколін 43,03 дифеніловий ефір 178 15,02 11,08 60 40,5 130 164 2,6-літидин 1,55 п-ксилол 15 130 179 15,03 11,07 60 165 піридин 1,15 п-ксилол 180 10,03 7,38 60 15 140 166 піридин 14,7 піридин 15 130 181 15,03 11,08 60 167 піридин 1,17 1-метил-2-піролідинон 5,53 15 130 182 7,49 60 толуол 4-метил-2-пен бензонітрил п-ксилол диметил-фор змішані ксило мезитилен о-ксилол тетраметилен біфеніл тетрагідро-на дифеніловий 3:1 дифеніло змішані ксило 4-трет-бутилп мезитилен тетрагідро-на ізохінолін о-ксилол дифеніловий о-ксилол о-ксилол о-ксилол о-ксилол о-ксилол о-ксилол о-ксилол о-ксилол о-ксилол о-ксилол о-ксилол 81657 22 до вибраної температури. Реактор утримувався при максимальній температурі протягом вибраного періоду часу (див. Таблиці 9 та 10) та потім швидко охолоджували до 65°С. Реактор охолоджували, створювали вакуум, що призводило до відгонки деякої кількості органічних рідин. Температуру протягом відгонки підтримували між 55°С та 75°С. Після відгонки додавали 3,5М NaOH, щоб розділити реакційну суміш на дві роздільні фази, верхню органічну та нижню водну. Нижній водний шар відбирали та поміщали в чистий реактор. До реактору потім додавали піридин (40мл). Додавали кислоту (6М НСl), щоб нейтралізувати реакційну суміш до приблизно рН7. Продукт, який кристалізувався при нейтралізації, потім відфільтровували та сушили, одержуючи топірамат. Експерименти 10, 15-17: Приклад А5 ДАФ, сульфамід, піридин та о-ксилол в Топірамат одержували відповідно до способу кількостях, як перераховано в Таблиці 9 нижче, за даним винаходом. Нижче наведені загружали в 1-літровий реактор. Реактор нагрівали експериментальні методики для експериментів. В до вибраної температури. Реактор утримувався таблицях 9 та 10 далі детально перераховані при вибраній температурі протягом вибраного експериментальні умови. часу (див. Таблиці 9 та 10) та потім швидко Експеримент 2: охолоджували до 65°С. Реактор охолоджували, ДАФ, сульфамід, піридин та о-ксилол в додавали 3,5М NaOH, щоб розділити реакційну кількостях, як перераховано в Таблиці 9 нижче, суміш на дві роздільні фази, верхню органічну та загружали в 1-літровий реактор. Реактор нагрівали нижню водну. Нижній водний шар відбирали та до температури рубашки приблизно 155°С та поміщали в чистий реактор. Створювали вакуум та підтримували при цій температурі протягом 30 нагрівали, щоб відігнати водну рідину. Додавали хвилин. Реактор охолоджували до 60°С та кислоту (6М НСl), щоб нейтралізувати реакційну починали перегонку під вакуумом, дистиляцію суміш до приблизно рН7. Якщо продукт не продовжували, поки рідина не переставала кристалізувався після нейтралізації, додавали відганятися. Додавали 1М NaOH, щоб розділити додаткову воду: в експерименті №15 додавали реакційну суміш на шари. Нижній водний шар 350мл води; в експерименті №16 додавали 390мл відбирали та переносили до ділильної лійки. води; в експерименті №17 додавали 120мл води. Додавали 1М NaOH, щоб далі розділити шари. Коли продукт кристалізувався, його Знову, більш низький, водний шар відбирали та відфільтровували та сушили, одержуючи поміщали в чистий реактор. Додавали 6М НСl, топірамат. щоб нейтралізувати розчин до рН7. Продукт, який Експеримент 11: кристалізувався, відфільтровували та потім ДАФ, сульфамід, піридин та о-ксилол в сушили, одержуючи топірамат. кількостях, як перераховано в Таблиці 9 нижче, Експерименти 3-8, 19-21: загружали в 1-літровий реактор. Реактор нагрівали ДАФ, сульфамід, піридин та о-ксилол в до вибраної температури, утримували при цій кількостях, як перераховано в Таблиці 9 нижче, температурі протягом вибраного часу (див. загружали в 1-літровий реактор. Реактор нагрівали Таблиці 9 та 10) та потім швидко охолоджували до та утримували при вибраній температурі протягом 65°С. Реактор охолоджували, додавали 3,5М вибраного часу (див. Таблицю 10), потім швидко NaOH, щоб розділити реакційну суміш на дві охолоджували до 65°С. Реактор охолоджували, роздільні фази, верхню органічну та нижню водну. створювали вакуум, що призводило до відгонки Нижній водний шар відбирали та поміщали в деякої кількості органічних рідин. Температуру чистий реактор. Створювали вакуум та нагрівали, протягом відгонки підтримували між 55°С та 75°С. що призводило до відгонки частини водної рідини. Після відгонки додавали деяку кількість (від 0 до Реактор нагрівали до 60°С та додавали кислоту 200мл) NaOH (з концентрацією від 1М до 3,5М), (6М НСl), щоб нейтралізувати реакційну суміш до щоб розділити реакційну суміш на дві роздільні рН7. Реактор охолоджували до 15°С та потім фази, верхню органічну та нижню водну. Нижній додавали воду до утворення кристалів. Продукт, водний шар відбирали та поміщали в чистий який кристалізувався, потім відфільтровували та реактор. Додавали кислоту (6 М НСl), щоб сушили, одержуючи топірамат. нейтралізувати реакційну суміш до рН7. Продукт, Експерименти 12-14: який кристалізувався при нейтралізації, ДАФ та сульфамід в кількостях, як відфільтровували та потім сушили, одержуючи перераховано в Таблиці 9 нижче, загружали в 1топірамат. літровий реактор. Реактор нагрівали до вибраної Експеримент 9: температури. Реактор утримувався при вибраній ДАФ, сульфамід, піридин та о-ксилол в температурі протягом вибраного часу (див. кількостях, як перераховано в Таблиці 9 нижче, Таблиці 9 та 10) та потім швидко охолоджували до загружали в 1-літровий реактор. Реактор нагрівали кімнатної температури. Реактор охолоджували, 183 184 185 186 187 188 189 190 191 192 193 194 195 196 197 198 10 29,99 30,09 10,04 30,08 30,05 30,03 30,17 30,09 30,1 30,11 30,18 30,06 30,01 30,13 30,02 21 7,38 22,34 22,24 7,38 22,45 22,31 22,22 22,26 22,04 22,21 22,28 22,33 22,26 22,26 22,32 22,16 60 60 62 60 57 30 30 30 30 30 30 30 30 30 30 30 150 110 140 140 130 130 140 130 130 130 130 130 130 130 130 130 23 81657 додавали 3,5М NaOH, щоб розділити реакційну суміш на дві роздільні фази, верхню органічну та нижню водну. Нижній водний шар відбирали та поміщали в чистий реактор. Додавали кислоту (6М НСl), щоб нейтралізувати реакційну суміш до приблизно рН7. Продукт, який кристалізувався при нейтралізації, потім відфільтровували та сушили, одержуючи топірамат. Експеримент 18: ДАФ, сульфамід, піридин та о-ксилол в кількостях, як перераховано в Таблиці 9 нижче, загружали в 1-літровий реактор. Реактор нагрівали до вибраної температури. Реактор утримували при вибраній температурі протягом вибраного часу (див. Таблиці 9 та 10) та потім швидко охолоджували до 65°С. Реактор охолоджували, додавали 3,5М NaOH, щоб розділити реакційну суміш на дві роздільні фази, верхню органічну та нижню водну. Нижній водний шар відбирали та поміщали в чистий реактор. Створювали вакуум та нагрівали, щоб відігнати приблизно половину водної рідини. Водний розчин, що залишився, відбирали та переміщали в мензурку. Додавали 6М НСl (60мл), щоб очистити реактор. Реакційну суміш та додаткову 6 М НСl дозували в реактор, щоб підтримувати приблизно рН7. Додавали воду, щоб викликати кристалізацію. Продукт, який кристалізувався, потім відфільтровували та сушили, одержуючи топірамат. Експеримент 19: ДАФ, сульфамід та піридин в кількостях, як перераховано в Таблиці 9 нижче, загружали в 1літровий реактор. Реактор нагрівали до вибраної температури. Реактор утримували при вибраній температурі протягом вибраного часу (див. Таблиці 9 та 10) та потім швидко охолоджували. Реактор охолоджували до 22°С, додавали 3,5М NaOH, щоб розділити реакційну суміш на дві роздільні фази. Три п'ятих водного шару відбирали та поміщали в чистий реактор. Потім додавали кислоту (6М НСl), щоб нейтралізувати реакційну суміш до приблизно рН7. До реакційної суміші додавали 100мл води. Продукт, який кристалізувався, потім відфільтровували та сушили, одержуючи топірамат. Таблиця 9 Серія ДАФ (г) Сульфа№ (ммоль) мід (г) (ммоль) 2 29,97 22,26 115,17 231,63 3 100,01 73,86 384,31 768,57 4 99,98 73,85 384,20 768,47 5 100,04 78,21 384,43 813,84 6 99,98 73,80 384,20 767,95 7 99,99 73,93 384,24 769,30 8 99,94 72,52 384,04 754,63 Піридин О-кси- Темп, (г) лол рубаш(ммоль) (мл) ки, (°С) 36,50 40,0 155 461,44 121,40 134,0 145 1534,77 121,78 134,0 145 1539,57 121,82 133,0 145 1540,08 121,49 132,5 145 1535,90 121,66 134,0 145 1538,05 121,43 132,0 145 1535,15 9 10 11 12 13 14 15 16 17 18 19 20 21 100,01 384,31 100,01 384,31 100,07 384,54 100,01 384,31 100,02 384,35 100,10 384,66 99,97 384,16 100,12 384,74 99,99 384,24 99,99 384,24 100,04 384,43 100,00 384,28 99,95 384,08 73,50 764,83 73,86 768,57 73,89 768,89 73,87 768,68 73,72 767,12 73,74 767,33 73,79 767,85 73,94 769,41 73,60 765,87 73,88 768,78 73,45 764,31 73,87 768,68 73,45 764,31 24 12,11 153,10 121,84 1540,33 121,23 1532,62 0,00 0,00 0,00 0,00 0,00 0,00 121,81 1539,95 121,49 1535,90 121,49 1535,90 122,00 1542,35 121,74 1539,06 121,43 1535,15 121,12 1531,23 134,0 145 132,0 145 132,0 145 0,0 145 0,0 145 0,0 145 133,0 145 134,0 145 н/з н/з 135,0 145 0,0 145 134,0 н/з 132,0 145 Таблиця 10 Серія № 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 Rxn Час (хв.) 30 30 45 45 43 45 45 48 45 57 60 45 44 45 45 45 45 45 n/r 45 Rxn Темп. (°С) 130-134 130-135 130-136 130-134 130-134 130-134 130-135 130-133 130-134 130-134 130-142 130-143 130-142 130-133 130-134 130-н/з 130-134 130-133 130 н/з 130 н/з н/з вказує, що не було записано повний діапазон температур або часу реакції. Приклад А6 Діацетон фруктозу (ДАФ) (780кг; 780кг, Загрузка 1 та 2), піридин (950,6кг; 950,0кг) та ксилоли (1950л; 1950л) змішували в резервуарі та розчин переносили в реактор з сульфамідом (575кг; 575кг). Суміш нагрівали до 128-133°С за допомогою поступового нагрівання. Більш конкретно, суміш нагрівали з 30 до 65°С протягом 80 хвилин, потім з 65до 95°С протягом 60 хвилин, 25 81657 з наступним нагріванням з 95 до 113°С протягом 60 хвилин та зі 113 до 125°С протягом 85 хвилин. Температуру рубашки реактора поступово підвищували на 5°С, щоб нагріти загрузку до 128133°С протягом 30 хвилин та потім утримували при температурі протягом 30 хвилин. Реакційну суміш потім охолоджували зі швидкістю 30°С за годину до 40°С. До суміші потім додавали очищену воду (1243л; 1240л). Суміш охолоджували до 20°С перед тим як додавали 50% розчин NaOH (436кг; 437кг). Органічні та водні шари (шари продукту) відокремлювали та водний шар відфільтровували і переміщали в інший реактор. Органічний шар відкидали. Очищену воду (1400л; 1400л) додавали до водної суміші та залишкові органічні речовини (піридин та ксилол) і воду відганяли під вакуумом. Дистиляцію зупиняли після відгонки відомого об'єму (784л; 784л). Додавали льодяну оцтову кислоту (214,5кг; 224,4кг), щоб нейтралізувати розчин до рН7. В суміш вносили затравку кристалів топірамату (1,0кг; 1,0кг) та охолоджували до 0-5°С, щоб кристалізувався неочищений топірамат. Неочищений вологий топірамат (730кг; 803,8кг) центрифугували та збирали. Тоді як вищенаведений опис викладає принципи даного винаходу, з прикладами, наведеними з метою ілюстрації, слід розуміти, що застосування винаходу включає всі звичайні варіації, адаптації та/або модифікації, які входять в межі наступної формули винаходу, та їх еквіваленти.«. 26
ДивитисяДодаткова інформація
Назва патенту англійськоюNormal;heading 1;heading 2;process for the preparation of anticonvulsant derivatives of topiramate
Автори англійськоюBerkner Joachim Ernst, Duncan Scott, Mills John
Назва патенту російськоюСпособ получения противосудорожных производных топирамата
Автори російськоюБеркнер Йоахим Эрнст, Данкан Скотт, Миллс Джон
МПК / Мітки
МПК: C07H 9/00
Мітки: похідних, одержання, спосіб, протисудомних, топірамату
Код посилання
<a href="https://ua.patents.su/13-81657-sposib-oderzhannya-protisudomnikh-pokhidnikh-topiramatu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання протисудомних похідних топірамату</a>
Попередній патент: Спосіб нейтралізації кислих та лужних водних стоків та установка для його здійснення
Наступний патент: Заміщені піримідинони
Випадковий патент: Пристрій для вимірювання температури