Спосіб визначення кількості мікробіологічних об’єктів у процесі іх культивування
Номер патенту: 82756
Опубліковано: 12.05.2008
Автори: Білий Олександр Іванович, Кушнір Ігор Михайлович, Білий Ростислав Олександрович, Коцюмбас Ігор Ярославович, Гетьман Василь Богданович
Формула / Реферат
Спосіб визначення кількості мікробіологічних об’єктів у процесі їх культивування, який включає подачу з постійною швидкістю потоку рідини, що містить досліджувані об’єкти, проходження монохроматичного когерентного світлового променя через потік рідини, калібрування шляхом побудови двомірного розподілу реєстрованих імпульсів у вибраному об’ємі від сферичних часток заданого розміру r і відомим показником заломлення у вигляді функції виду K(U,t,r) за значеннями нормованих амплітуд U та тривалостей t, зондування потоку рідини з досліджуваними об’єктами тим же монохроматичним когерентним світлом у тому ж об’ємі, в якому проводиться калібрування, реєстрацію імпульсів розсіяного світла від зондуючих часток під заданим кутом в інтервалі від 1 до 360 градусів, визначення функції n(r) розмірного розподілу досліджуваних часток шляхом реєстрації імпульсів від зондуючих частинок, сортування реєстрованих імпульсів для побудови двомірного розподілу їх амплітуд та тривалостей у піддіапазонах з межами, як у випадку зондування часток, вибраних для калібрування, нормування чисельних значень величин амплітуди та тривалості імпульсів у кожному з піддіапазонів, побудови за нормованими значеннями функції виду F(U,t), яка визначає розмірний розподіл досліджуваних об’єктів у інтервалі розмірів від rmin до rmax:
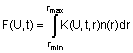 ,
,
який відрізняється тим, що відібрані для досліджень мікробіологічні об’єкти культивують у рідкому живильному середовищі, визначають залежність зміни кількості мікробіологічних об’єктів та фонових часток у рідкому живильному середовищі у часі, для цього досліджуване рідке живильне середовище з мікробіологічними об’єктами і без них розводять у однакових пропорціях в одній із високочистих рідин: фізіологічний розчин, 5 % розчин глюкози або деіонізована вода, окремо визначають загальну кількість мікробіологічних об’єктів і фонових часток у високочистій рідині, яка містить мікробіологічні об’єкти, та загальний розмірний розподіл фонових часток у високочистій рідині, яка не містить мікробіологічних об’єктів, визначають кількість мікробіологічних об’єктів у заданому інтервалі розмірів, визначають відносний вміст мікробіологічних об’єктів у заданому інтервалі розмірів шляхом розрахунку відношення кількості мікробіологічних об’єктів у заданому інтервалі розмірів до загальної кількості мікробіологічних об’єктів, будують залежності змін кількості мікробіологічних об’єктів та їх відносного вмісту у заданому інтервалі розмірів від часу культивування.
Текст
Спосіб визначення кількості мікробіологічних об’єктів у процесі їх культивування, який включає подачу з постійною швидкістю потоку рідини, що містить досліджувані об’єкти, проходження монохроматичного когерентного світлового променя через потік рідини, калібрування шляхом побудови двомірного розподілу реєстрованих імпульсів у вибраному об’ємі від сферичних часток заданого розміру r і відомим показником заломлення у вигляді функції виду K(U,t,r) за значеннями нормованих амплітуд U та тривалостей t, зондування потоку рідини з досліджуваними об’єктами тим же монохроматичним когерентним світлом у тому ж об’ємі, в якому проводиться калібрування, реєстрацію імпульсів розсіяного світла від зондуючих часток під заданим кутом в інтервалі від 1 до 360 градусів, визначення функції n(r) розмірного розподілу досліджуваних часток шляхом реєстрації імпульсів від зондуючих частинок, сортування реєстрованих імпульсів для побудови двомірного розподілу їх амплітуд та тривалостей у піддіапазонах з межами, як у випадку зондування часток, вибраних для калібрування, нормування чисельних значень величин амплітуди та тривалості імпульсів у кожному з піддіапазонів, побудови за нормованими значеннями функції виду F(U,t), яка визначає розмірний розподіл досліджуваних об’єктів у інтервалі розмірів від rmin до rmax: Винахід відноситься до області клітинної біології, зокрема, до оптичних способів визначення кількості змін мікробіологічних об'єктів таких як клітини бактерій, дріжджів, грибів у процесі їх куль rmax F(U, t ) = ò K(U, t, r )n(r )dr , (19) UA (11) 82756 (13) C2 rmin який відрізняється тим, що відібрані для досліджень мікробіологічні об’єкти культивують у рідкому живильному середовищі, визначають залежність зміни кількості мікробіологічних об’єктів та фонових часток у рідкому живильному середовищі у часі, для цього досліджуване рідке живильне середовище з мікробіологічними об’єктами і без них розводять у однакових пропорціях в одній із високочистих рідин: фізіологічний розчин, 5 % розчин глюкози або деіонізована вода, окремо визначають загальну кількість мікробіологічних об’єктів і фонових часток у високочистій рідині, яка містить мікробіологічні об’єкти, та загальний розмірний розподіл фонових часток у високочистій рідині, яка не містить мікробіологічних об’єктів, визначають кількість мікробіологічних об’єктів у заданому інтервалі розмірів, визначають відносний вміст мікробіологічних об’єктів у заданому інтервалі розмірів шляхом розрахунку відношення кількості мікробіологічних об’єктів у заданому інтервалі розмірів до загальної кількості мікробіологічних об’єктів, будують залежності змін кількості мікробіологічних об’єктів та їх відносного вмісту у заданому інтервалі розмірів від часу культивування. 3 82756 4 тивування, і може знайти застосування для діагнополягає в наступному. Занурюючи два або три стичних цілей в медицині та протікання біотехноелектроди в рідке живильне середовище з культилогічних процесів. вуючими клітинами мікроорганізмів, вимірюють Відомо, що оцінка кількості мікробіологічних напругу при постійному струмі. Із ростом концентоб'єктів у процесі їх культивування базується на рації клітин комплексна діелектрична прониклитак званих кривих росту, функціональній часовій вість середовища зростає, що приводить до зміни залежності зміни кількості клітин у процесі їх росту. ємності конденсатора, утвореного зануреними Для бактерійних клітин на кривій росту виділяють електродами, а це в свою чергу зміщує резонансну чотири ділянки, названі відповідно лаг- фаза, лочастоту та часто ту нульового значення реактивногарифмічна фаза, стаціонарна фаза і фаза загиго опору. Визначаючи нові значення вказаних часбелі [Albert G.Moat, John W.Foster, Michael тот можна визначити величину зміни концентрації P.Spector. Microbial Physiology. 4th ed.- New York .клітин мікроорганізмів у процесі їх культивування Copyright by Wiley-Liss, Inc.- 2002-714 pp]. При [Патент US20040009572 США від 15.01. 2004, МПК цьому, кількісна оцінка зміни бактерійних клітин у С12М 1/00. Apparatus for the analysis of процесі їх культивування здійснюється, як правиmicroorganisms growth and procedure for the ло, у логарифмічній фазі [ ВагапуІ J., Pin C. quantifycation of microorganisms concentration; K.G. Estimating bacterial growth parameters by means of Ong, J. Wang, R.S. Singh, L.G. Bachas, CA. Grimes / detection times. / ApI. En vironmen. Microbiol. -1999.Monitoring of bacteria growth using a wireless, VoI. 65 -.№2. P.732-336]. Відомий спосіб визначенremote query resonant-circuit sensor: application to ня кількості мікробіологічних об'єктів у процесі їх environmental sensing // Biosensors & Bioelectronics культивування, який базується на змінах каламут2001- Vol. 16 - P. 305-312]. ності рідкого живильного середовища у процесі Недоліком даного способу визначення кількоскультивування в ньому клітин мікроорганізмів ті мікробіологічних об'єктів у процесі їх культиву[Microbiology Reader Bioscreen C and Software вання є тривалість аналізу та значні похибки виміResearch Express - Microbiological Growth Curves рювань. Даний метод дозволяє надійно http://www.bionewsonline.com/b/5/growth_cxuves.ht реєструвати лише клітини мікроорганізмів при їх m]. Зміна каламутності рідкого живильного сереконцентрації в розчині 107 клітин/мл. Крім того, на довища вимірюється оптичним спектрофотометточність вимірювань у даному методі можуть ром, і являє собою графічну залежність параметру впливати зовнішні чинники, які у процесі вимірів оптична густина розчину від часу, який у свою черміняють' потенціал електроду та ємність між елекгу включає дві складові: каламутність розчину, тродного конденсатора. Такими чинниками є позумовлену зміною кількості клітин мікроорганізмів ляризація електродів у процесі дослідження, утвоу процесі їх культивування; каламутність розчину, рення бульбашок газу на поверхні електроду. зумовлену зміною фізико-хімічних параметрів рідВідомий спосіб визначення кількості мікробіокого живильного середовища. З отриманої таким логічних об'єктів у процесі їх культивування, який чином кривої зміни каламутності ростового серебазується на аналізі зміни інтенсивності свічення довища, шляхом її математичної екстраполяції, флуоресцентних молекул-мар-керів, які поєднані із можна визначити загальну концентрацію клітин, фрагментами молекулярної будови клітини. Так, час, за який подвоюється кількість клітин у процесі на зовнішній мембрані клітини є порядку 10 різних культивування, та часові залежності змін даних біологічних рецепторів, при біохімічній взаємодії з параметрів. якими флуоресцентних молекул-маркерів можлива Недоліком даного способу визначення кількосїх реєстрація. Такими молекулами-маркерами є, ті мікробіологічних об'єктів у процесі їх культивунаприклад, молекули флуоресцеїн діацетату, торвання є тривалість аналізу та значні похибки вимігова марка OREGON GREEN [Патент WO рювань у випадку, коли вихідна концентрація 02/057482 від 17.01.2002.Method for differential клітин мікроорганізмів на початок їх культивування analysis of bacteria in sample], метиламбеліферон є малою. Точність даного методу аналізу визнача[Патент США US2003/0138906 від 24.07. 2003. ється необхідністю надійної реєстрації оптичної Fluorescence test for measuring heterotrophic густини розчину в інтервалі 0.3-1.0, яка в свою bacteria in water] та ряд інших складних сполук чергу визначається концентрацією бактерійних [Патент США US 6632632 від 14.10.2003. Rapid клітин 106-108 клітин/мл досліджуваного розчину. method of detection and enumeration of sulfldeВідомий спосіб визначення кількості мікробіоproducing bacteria in food products; Патент WO логічних об'єктів у процесі їх культивування, який 99/10533 від 17.04.1999. Rapid detection and базується на розрахунках діелектричної прониклиidentification of microorganisms]. Оцінка кількісних вості із вимірів спектрів імпедансу рідкого ростовозмін клітин мікроорганізмів у процесі їх культивуго середовища у процесі культивування у ньому вання за змінами інтенсивності свічення молекулклітин мікроорганізмів. Діелектрична проникливість маркерів полягає в наступному [Brian J. Mailloux, середовища - комплексна величина, дійсну і уявну Mark E. Fuller. Determination of in situ bacterial частину якої розраховують з частотних залежносgrowth rates in aquifers and aquifer sediments.// тей опору та реактивного опору в спектрах імпеApplied and Eenvironmental Microbiology. - 2003.дансу. Дійсну частину розраховують із значення Vol. 69, No. 7.- P. 3798-3808]. У процесі культивучастоти резонансу, на якій спостерігається максивання клітин із зростанням їх концентрації середня мум частотної залежності опору в спектрах імпеінтенсивність свічення молекул-маркерів дослідансу, а уявну частину із значення частоти, на якій джуваних клітин падає. Причому, кожного разу, реактивний опір в спектрах імпедансу має нульове коли концентрація клітин подвоюється, інтенсивзначення. Процес вимірювання спектрів імпедансу ність флуоресценції, із врахуванням фонового 5 82756 6 свічення зменшується вдвічі. Тому вважають, якщо живильного середовища у процесі культивування в процесі флуоресцентного аналізу інтенсивність досліджуваних мікробіологічних об'єктів. флуоресценції молекул-маркерів клітин падає на В основу винаходу поставлено завдання удополовину, то число клітин у процесі культивування сконалити спосіб визначення розподілу за розміподвоїлось. Визначивши на початку проведення рами завислих мікрочасток в потоці рідини шляхом аналізу середню інтенсивність флуоресценції винезалежної реєстрації мікрочасток у процесі кульхідних клітин Ір і середню інтенсивність фонового тивування мікробіологічних об'єктів у живильному свічення клітин, які не містять молекул-маркерів Іb, середовищі, яке містить досліджувані клітини, та та врахувавши, що в момент часу t середня інтенживильному середовищі, у якому досліджувані сивність свічення молекул-маркерів Іt у процесі клітини відсутні, що дозволить забезпечити кількікультивування клітин концентрації Ct при вихідній сну оцінку змін мікробіологічних об'єктів у окремо концентрації Co міняється за законом вибраному інтервалі розмірів у процесі їх культивування. Таким чином виключаються похибки, зумовлені появою сторонніх часток - продуктів розЗа вимірами зміни інтенсивності свідчення паду живильного середовища у процесі можна розрахувати величини зміни концентрацію культивування досліджуваних мікробіологічних клітин мікроорганізмів та час, за який спостерігаоб'єктів. ється подвоєння клітин внаслідок культивування. Поставлене завдання вирішується тим, що у Недоліком даного способу визначення кількосспособі визначення кількості мікробіологічних об'ті мікробіологічних об'єктів у процесі їх культивуєктів у процесі їх культивування, що включає повання є складність та велика собівартість аналізу. дачу з постійною швидкістю потоку рідини, що місЙого проведення передбачає попередній пошук тить досліджувані об'єкти, проходження відповідних молекул-маркерів, поєднання яких із монохроматичного когерентного світлового профрагментами молекулярної будови клітин досліменя через потік рідини, калібрування шляхом джуваних об'єктів у процесі культивування останпобудови двомірного розподілу реєстрованих імніх не приводить до змін їх спектральних властипульсів у вибраному об'ємі від сферичних часток востей. Спектри збудження флуоресценції заданого розміру r і відомим показником заломмолекул-маркерів як правило є вузькими, а тому лення у вигляді функції виду K(U,t,r) за значеннявимагають інтенсивних монохроматичних джерел ми нормованих амплітуд U та тривалостей t, зонсвітла, якими є лазери. Крім того, асортимент дування потоку рідини з досліджуваними об'єктами флуоресціюючих молекул-маркерів обмежений, тим же монохроматичним когерентним світлом у вони є дорогі, і у більшості випадків - шкідливі для тому ж об'ємі, в якому проводиться калібрування, людського організму. реєстрацію імпульсів розсіяного світла від зондуюНайбільш близьким за технічною суттю до зачих часток під заданим кутом в інтервалі від 1 до пропонованого є спосіб для визначення розподілу 360 градусів, визначення функції n(r) розмірного по розмірах завислих мікрочасток в потоці рідини розподілу досліджуваних часток шля хом реєстра[Патент на винахід України UA 49164 від ції імпульсів від зондуючих часток, сортування 10.09.2003. Спосіб і пристрій для визначення розреєстрованих імпульсів для побудови двомірного поділу по розмірах завислих мікрочасток в потоці розподілу їх амплітуд та тривалостей у підціапазорідини]. Спосіб базується на реєстрації змін інтеннах з межами, як у випадку зондування часток, сивності розсіяного ними світла шляхом статистивибраних для калібрування, нормування чисельчного набору змін амплітуди та тривалостей імпуних значень величин амплітуди та тривалості імльсів для часток заданого розміру, побудові на пульсів у кожному з піддіапазонів, побудови за основі одержаних даних вимірювання кореляційної нормованими значеннями функції виду F(U,t), яка функції виду F(U,t), яка виражає статистичні харавизначає розмірний розподіл досліджуваних об'єкктеристики інтенсивності розсіяння світла дослітів у інтервалі розмірів від rmin до r mах: джуваними частинками, і одержання розподілу часток за розмірами, шляхом розв'язку інтегрального рівняння Фредгольма першого роду: де rmin і rmах - вер хня й нижня межа діапазону розмірів часток, що реєструються; n (r) - функція розподілу часток за розмірами; K (U, t, r) - функція розподілу нормованих значень амплітуд і тривалостей реєстрованих імпульсів розсіяного світла калібрувальних часток, яка є результатом попереднього зондування потоку рідини монохроматичним когерентним світлом полімерних латексів заданого розміру і відомим показником заломлення. Даний спосіб дає великі похибки при визначенні кількісних змін мікробіологічних об'єктів у процесі їх культивування із-за похибок, зумовлених появою сторонніх часток -продуктів розпаду згідно з винаходом, відібранідля досліджень мікробіологічні об'єкти культивують у рідкому живильному середовищі, визначають залежність зміни кількості мікробіологічних об'єктів та фонових часток у рідкому живильному середовищі у часі, для цього досліджуване рідке живильне середовище з мікробіологічними об'єктами і без них розводять у однакових пропорціях в одній із високо чистих рідин: фізіологічний розчин, 5% розчин глюкози або деіонізована вода, окремо визначають загальну кількість мікробіологічних об'єктів і фонових часток у високо чистій рідині, яка містить мікробіологічні об'єкти, та загальний розмірний розподіл фонових часток у високо чистій рідині, яка не містить мікробіологічних об'єктів, визначають кількість мікробіологічних об'єктів у заданому 7 82756 8 інтервалі розмірів, визначають відносний вміст них параметрів, та подальшого знаходження їх мікробіологічних об'єктів у заданому інтервалі розмірного розподілу шляхом розв'язку інтегральрозмірів шляхом розрахунку відношення кількості ного рівняння Френгольма першого роду. Процес мікробіологічних об'єктів у заданому інтервалі культивування клітин мікроорганізмів у рідкому розмірів до загальної кількості мікробіологічних живильному розчині супроводжується змінами об'єктів, будують залежності змін кількості мікробірозмірного розподілу часток, зумовлених, як поологічних об'єктів та їх відносного вмісту у задаявою в розчині нової популяції клітин внаслідок їх ному інтервалі розмірів від часу культивування. росту, так і продуктів деструкції живильного сереЗ літературних джерел відомо, що кількісні довища. Для розділення вмісту клітин мікроорганізміни мікробіологічних об'єктів у процесі їх культизмів від загальної кількості часток автори проповування найактивніше проявляються у логарифмінують за змінами інтенсивності розсіяного світла чній фазі росту, при якій всі клітини діляться пороздільне знаходження розмірного розподілу фостійно шляхом двійкового розщеплення. Так на нових часток у рідкому живильному середовищі та даній фазі розвитку ріст клітин відбувається за розмірного розподілу фонових часток і клітин мікгеометричною прогресією, а поділ - із сталою роорганізмів у рідкому живильному середовищі швидкістю. Дані параметри залежать від складу шляхом виміру, в обох випадках, двох параметрів: живильного середовища, умов інкубації - темпераамплітуди та тривалості імпульсу розсіяного часттура, показник ступені кислотності середовища рН, кою світла. При цьому живильні середовища, з і т.п. Швидкість росту клітин в логарифмічній фазі клітинами мікроорганізмів і без них, культивуються розвитку визначається часом появи нового покоодночасно при однакових умовах. За статистичління клітин, або інакше часом, за який подвоюними даними вимірів амплітуди та тривалості імється клітинна популяція. В залежності від виду пульсів розсіяного частками світла шляхом розв'яклітин, час генерації появи нового покоління клітин зку двох інтегральних рівнянь Френгольма бактерій'є в межах від 12 хвилин до 24 годин або першого роду можна розрахувати дійсну кількість більше. Надійність реєстрації клітин мікроорганізклітин мікроорганізмів заданого морфологічного мів інструментальним пристроєм включає в себе складу, визначити їх відносний вміст до загальної ту нижню концентрацію клітин у розчині, яку може кількості клітин та отримати часові залежності дазафіксувати прилад. Для способу, який базується них параметрів. на змінах каламутності рідкого живильного сереНа Фіг.1 зображено часову залежність зміни довища у процесі культивування у ньому клітин концентрації часток бактерійних клітин Е.соlі та мікроорганізмів, нижня межа їх реєстрації 106 кліпродуктів розпаду рідкого живильного середовища тин/мл. Спосіб, який базується на розрахунках №1 (крива (+)) у фізіологічному розчині. Верхня (□) діелектричної проникливості із вимірів спектрів і нижня (о) криві задають межі довірчого інтервалу. імпедансу рідкого живильного середовища у проНа Фіг.2 зображено часову залежність зміни цесі культивування у ньому них клітин мікроорганіконцентрації часток бактерійних клітин Е.соІі та змів, нижня межа їх реєстрації також є на рівні 10 продуктів розпаду рідкого живильного середовища клітин/мл. Якщо вважати, що час появи нового №3 (крива (+)) у фізіологічному розчині. Верхня (□) покоління клітин є 24 хвилини, а початкова концеі нижня (о) криві задають межі довірчого інтервалу. нтрація клітин в розчині 100 клітин/мл, надійно На Фіг.3 зображено розподіл за розмірами чареєструвати даний вид клітин мікроорганізмів вкасток бактерійних клітин Е.соІі та продуктів розпаду заними методами можна принаймні через 5,5 горідкого живильного середовища №3 в інтервалі дин від часу їх росту. Найбільш чутли ві на даний розмірів 0,2-2,0мкм у фізіологічному розчині. Крива час флуоресцентні методи аналізу базуються на (о) - суспензія часток, яка містить живі бактерійні аналізі зміни інтенсивності свічення складових клітини Е.Соlі із посудини, яка не була піддана біологічних молекул клітин мікроорганізмів при їх стерилізації; крива (+) - суспензія часток, яка місвзаємодії із молекулами-маркерами. Відомо, що тить бактерійні клітини Е.соІі із посудини, підданої для вимірювання флюоресценції оптимальне чисстерилізації. ло молекул-маркерів на одну клітину є в межах від На Фіг.4 зображено розподіл за розмірами ча1000 до 100000 одиниць. Тому флуоресцентні месток бактерійних клітин Е.соlі та продуктів розпаду тоди при певному підборі молекул-маркерів дорідкого живильного середовища №3 в інтервалі зволяють реєструвати клітини мікроорганізмів на розмірів 0,2-2,0мкм у фізіологічному розчині. Крива рівні 10 клітин/мл. Недоліком вказаних вище мето(о) - суспензія часток, яка містить живі бактерійні дів є те, що вони реєструють загальний вміст кліклітини Е.соlі із посудини, яка не була стерилізотин мікроорганізмів у розчині, не розділяючи їх за вана; крива (□)- суспензія часток, яка містить живі морфологічними ознаками. Авторами вперше забактерійні клітини Е.соlі із посудини, яка не була пропоновано для визначення кількісних змін клітин стерилізована, після 24 годин. мікроорганізмів у процесі їх культивування викориНа Фіг.5 зображено розподіл за розмірами частати морфологічні зміни клітин шляхом визначенсток бактерійних клітин Е.соlі та продуктів розпаду ня розмірного розподілу клітин мікроорганізмів у рідкого живильного середовища №3 в інтервалі рідкому живильному середовищі за змінами інтенрозмірів 0,2-2,0мкм у фізіологічному розчині. Крива сивності розсіяного ними світла. У відому способі (*) - суспензія часток, яка містить бактерійні клітивизначення розподілу за розмірами часток у потоці ни Е.соlі із посудини, яка була попередньо стерирідини про розмір мікрочастки судять за інтенсивлізована; крива (+) - суспензія часток, яка містить ністю розсіяного нею світла шляхом виміру двох бактерійні клітини Е.соlі із посудини, яка була попараметрів: амплітуди та тривалості імпульсу розпередньо стерилізована через 24 години. сіяного часткою світла, статистичного набору да 9 82756 10 На Фіг.6 зображено відносний вміст часток амплітудою і тривалістю, для чого інтервал ампліпродуктів розпаду рідкого живильного середовища туд поділяється на m піддіапазонів і обмежуються №3, в інтервалі розмірів 0,2-2,0мкм у фізіологічнознизу напругою рівня шумів фотоелектричної сисму розчині. Крива 1 -суспензія часток на початок теми реєстрації, а зверху напругою насичення вхіпроцесу культивування, крива 2 - суспензія часток дного підсилювача, а інтервал тривалостей подіпісля інкубування у термостаті протягом часу 4 ляється на n піддіапазонів і обмежується часом годин, крива 3 - суспензія часток після інкубування проходження поперечного перерізу лазерного у термостаті часу 5 годин, крива 4 - суспензія часпроменя. Процедура знаходження розмірного розток після інкубування у термостаті протягом часу 6 поділу клітин в потоці рідини полягає у забезпегодин. ченні проведення вимірювань за однакових умов, На Фіг.7 зображено відносний вміст часток як у випадку процедури калібрування, побудові на бактерійних клітин Е.соlі та продуктів розпаду рідоснові результатів вимірювань функції, яка б викого живильного середовища №3, в інтервалі роззначала статистичні характеристики розсіяного мірів 0,2-2,0мкм у фізіологічному розчині. Крива 1 клітинами світла, і математичним способом розсуспензія часток на початок процесу культивуванкласти дану функцію на складові, одержані в реня, крива 2 - суспензія часток після інкубування у зультаті процедури калібрування. Для того щоб термостаті протягом часу 4 годин, крива 3 - сувиключити залежність кінцевих результатів від спензія часток після інкубування у термостаті прочасу вимірювання, проводиться операція нормутягом термостаті у проміжок часу 5 годин, крива 4 вання. У випадку, коли процедура вимірювання суспензія часток після інкубування у термостаті передбачає для одержання результату вимірюпротягом часу 6 годин. вання, проведення лише однієї операції заміру, На Фіг.8 зображено нормований розподіл відпроцедура нормування полягає в проведенні опеносних змін часток - бактерійних клітин Е.соlі, за рації ділення чисельного значення величини в відношенням до даних на початок процесу культикожному з піддіапазонів на суму чисельних знавування у процесі їх культивування у рідкому жичень величин в усіх піддіапазонах, на які розбиті вильному середовищі №3 в інтервалі розмірів 0,2інтервали амплітуд і тривалостей зареєстрованих 2,0мкм. Крива 1 - нормований вихідний розподіл імпульсів. У випадку, коли процедура вимірювання бактерійних клітин Е.соlі на початок процесу їх передбачає для одержання результату вимірюкультивування; крива 2 - нормований розподіл вання проведення принаймні двох операцій замібактерійних клітин Е.соlі по відношенню до нормору: основного і повірочного, процедура нормуванваного вихідного розподілу даних клітин у процесі ня полягає в операції ділення чисельних значень їх культивування у проміжок часу 4 годин; крива 3 величин в кожному з піддіапазонів, на які розбиті нормований розподіл бактерійних клітин Е.соlі по інтервали амплітуд і тривалостей зареєстрованих відношенню до нормованого вихідного розподілу імпульсів для операцій заміру основної і повірочданих клітин у процесі їх культивування у проміжок ної на час заміру даної операції, і подальшим відчасу 5 годин, крива 4 - нормований розподіл бакніманням в кожному підціапазоні чисельних знатерійних клітин Е.соlі по відношенню до нормовачень величин, отриманих для повірочного заміру ного вихідного розподілу даних клітин у процесі їх від контрольного заміру і проведенні операції дікультивування у проміжок часу 6 годин. лення чисельного значення величини в кожному з На Фіг.9 зображено відносний вміст часток піддіапазонів на суму чисельних значень величин гриба Mucor racemosus та продуктів розпаду рідков усіх піддіапазонах, на які розбиті інтервали ампго живильного середовища Сабуро у фізіологічнолітуд і тривалостей зареєстрованих імпульсів. За му розчині на 2 добу культивування в інтервалі нормованими значеннями чисельних величин амрозмірів 0,2-2,0мкм. плітуд та тривалостей реєстрованих імпульсів буСпосіб визначення кількості мікробіологічних дується матриця-стовбець виду Aj(m,n,), елемент об'єктів у процесі їх культивування передбачає якої aj(m,n,) рівний нормованому значенню амплізабезпечення подачі досліджуваних мікробіологічтуд та тривалостей реєстрованих імпульсів. Виних об'єктів у потоці рідини з постійною швидкістю, значення розподілу клітин за розмірами у потоці проходження променя лазера через потік рідини з рідини здійснюється шляхом побудови двомірного досліджуваними клітинами мікроорганізмів так, розподілу амплітуд і тривалостей зареєстрованих щоб поперечний переріз променя в місці перетину імпульсів розсіяного світла клітинами у піддіапазойого клітинами був більший, ніж поперечний перенах з межами, як у випадку зондування часток, різ досліджуваних клітин і в часі його могла перевибраних для калібрування, нормуванням чисельтинати лише одна клітина з подальшим визначенних значень величин амплітуди та тривалості імням розмірного розподілу клітин у процесі їх пульсів у кожному з піддіапазонів, побудовою за культивування. Для цього попередньо здійснюєтьнормованими значеннями матриці виду B(m,n). ся процедура калібрування пристрою. Вона поляРозподіл клітин за розмірами у потоці рідини вигає у побудові двомірного розподілу нормованих значається шляхом розв'язку рівняння значень амплітуд та тривалостей реєстрованих імпульсів для кожної окремо взятої для калібрування сферичної частки з відомим розміром і одде і - кількість вибраних для калібрування наковим показником заломлення, для чого з потосферичних синтетичних часток з відомими розміком рідини за вибраний проміжок часу всі частки рами і однаковим показником заломлення, j - попри перетині перерізу променя реєструються шлярядковий номер елементу та j £ і, Aij(m,n,) - квадхом вимірювання амплітуди і тривалості імпульсів, ратична матриця, елемент якої аij(m,n,) виражає після цього реєстровані імпульси сортуються за статистичні характеристики інтенсивності розсія 11 82756 12 ного світла для окремо вибраної сферичної частки цього на 1 літр м'ясної .води вносимо 10,0г пептону ферментативного сухого та 5,0г натрію хлориз заданим розміром і показником заломлення, jі ду, розчиняємо при нагріванні, вносимо 1,0г глюстала величина, в межах від 0 до 1. кози, установлюючи рН таким чином, щоб після Визначення кількості мікробіологічних об'єктів стерилізації його значення становило 7,3±0,2, та у процесі їх культивування досягається проведенкип'ятимо на протязі 1 хвилина. Середовище фільням почергових досліджень залежностей часових труємо через мембранний фільтр з порами змін світлорозсіюючих параметрів рідкого живиль0,2мкм, стерилізуємо у паровому стерилізаторі за ного середовища, у якому культивують досліджувані клітини мікроорганізмів, з клітинними об'єктатемператури 121°C протягом 15 хвилин. В середоми, і без них. Для підвищення точності вимірів вище вносимо бактерійні клітини Escherichia coli з досліджуване рідке живильне середовище, яке розрахунку, щоб вихідна концентрація становила містить клітинні об'єктами, і без них, розводять у 3300 клітин на мілілітр живильного середовища. однакових пропорціях в одній із високо чистій ріПідготовлений таким чином розчин досліджуваних динах: фізіологічний розчин, 5% розчин глюкози, бактерійних клітин розливаємо у стерильні пробірдеіонізована вода. Процедура виміру полягає у ки ємністю 5см 3, закриваємо їх ватно-марлевими наступному. Почергово визначають загальний пробками, і інкубуємо у термостаті за температури розмірний розподіл часток у'високо чистій рідині, 30°C. Досліджуємо зміни інтенсивності розсіюваняка містить рідке живильне середовище із клітиння світла частками у живильному середовищі №1 з ними об'єктами, та загальний розмірний розподіл інтервалом 1 година протягом семи годин. При часток у високо чистій рідині, яка містить рідке проведенні досліджень попередньо проводилась живильне середовище без клітинних об'єктів. Випідготовка проби, яка полягала у наступному. Роззначення кількості досліджуваних клітинних об'єкчин проби живильного середовища з бактерійними тів у вибраному інтервалі розмірів досягається культурами після фіксованого часу інкубації із шляхом розрахунку долі у даному інтервалі розміпробірки розводили у співвідношенні 1:100 у стерів відповідних компонент розподілів кількості часрильному фізіологічному розчині у посудиш ємністок у високо чистій рідині, яка містить рідке живитю 200см 3, герметично закритою гумовою пробкою льне середовище із клітинними об'єктами та з алюмінієвим ободом, який серійно випускається кількості часток у високо чистій рідині, яка містить фармацевтичною промисловістю України (у нашорідке живильне середовище без клітинних об'єктів. му випадку використовувався фізіологічний розчин Визначення відносних кількісних змін досліджувавиробництва ДП "Львівдіалік", м,Львів). Одержану них клітинних об'єктів у процесі їх культивування таким чином пробу досліджуваної культури бактедосягається шляхом розрахунку відношення у дарійних клітин набирали стерильним шприцом ємніному інтервалі розмірів відповідних компонент стю 50см 3, який поміщали у пристрій для дослірозподілів кількості досліджуваних клітинних об'єкджування змін інтенсивності розсіювання світла, тів на момент їх культивування до відповідних де проводили вимірювання. Вимірювання кожної компонент розподілів кількості досліджуваних кліпроби, яка містить досліджувані частки, проводили тинних об'єктів на початок процесу їх культивуван5-6 разів з подальшою статистичною обробкою ня. результатів вимірів. Між вимірами для кожної проДані виміри, для визначення розмірного розби, яке містить досліджувані частки, гідравлічний поділу часток, мають статистичний характер. Тому тракт і оптична кювета пристрою промивалась для отримання достовірних даних у процесі виміру деіонізованою водою. Для вибраного числа вимірів проводиться їх статистична обробка. Вимірювання r та довірчої ймовірності P=0,95 визначали коефідля кожної проби рідкого середовища, яке містить цієнт Стьюдента та визначали межі довірчого індосліджувані частки, проводиться не менше 5 ратервалу відносно середнього значення результату зів з подальшою статистичною обробкою резульзгідно формули (5). Результати вимірювання часотатів виміру шляхом визначення середнього знавої залежності зміни концентрації часток бактерійчення результату виміру, середньо-квадратичного них клітин Е.соlі та продуктів розпаду рідкого живідхилення середнього значення результату вимівильного середовища №1 (крива (+)) у фізіологічному розчині на пристрої, який був поперу s , та знаходження значення похибки вимірюредньо калібрований в інтервалі розмірів 0,1вання, яка визначає межі довірчого інтервалу А 2,0мкм за сферичними полістирольними латексавідносно середнього значення результату: ми з показником заломлення n = 1,56 наведені на Фіг.1. Верхня (□) і нижня (о) криві задають межі довірчого інтервалу відносно середнього значення де t - коефіцієнт Стьюдента для числа вимірів результату, які визначаються коефіцієнтами r та довірчої ймовірності P. Надалі, при розрахунСтьюдента t(5;0,95)=2,.77 та t(6;0,95)=2,57. З наках, приймається P = 0,95. Це означає, що в інтерведеної часової залежності зміни концентрації вал k - D < k< k +D потрапляє не менше 95% речасток бачимо, що в межах похибок, збільшення зультатів вимірювань. числа часток у процесі інкубації в середовищі не Можливість реалізації способу покажемо на спостерігається. Приклад 2. наступних прикладах. Готуємо для досліджень розчин з бактерійниПриклад 1. ми клітинами Escherichia coli у рідкому живильноГотуємо для досліджень розчин з бактерійниму середовищі №3 згідно вимог Державної Фармами клітинами Escherichia coli у рідкому живильнокопеї України. Для цього на 1 літр м'ясної води му середовищі №1 (м'ясо-пептонний бульйон) згівносимо 10,0г пептону ферментативного сухого, дно вимог Державної Фармакопеї України. Для 7,5г динатрію гідрофосфату та 2,5г калію дигідро 13 82756 14 фосфа ту, розчиняємо при нагріванні, вносимо 10,0г глюкози та 8мл 1% розчину фенолового чер10,0г глюкози та 8мл 1% розчину фенолового червоного і 3мл 0.5% розчину малахітового зеленого, воного і 3мл 0.5% розчину малахітового зеленого, встановлюючи рН таким чином, щоб після стерилівстановлюючи рН таким чином, щоб після стерилізації його значення становило 7,3±0,2. Середовизації його значення становило 7,3±0,2. Середовище фільтруємо через мембранний фільтр з діамеще фільтруємо через мембранний фільтр з діаметром пор 0,2мкм, стерилізуємо у паровому тром пор 0,2мкм, стерилізуємо у паровому стерилізаторі за температури 121°С протягом 15 стерилізаторі за температури 121°С протягом 15 хвилин. Стерилізоване середовище розливаємо у хвилин. В середовище вносимо бактерійні клітини рівних частинах у стерильну скляну посудину ємЕ.соlі з розрахунку 3000 клітин на мілілітр живильністю 500см 3, вносимо у кожну з посудин бактерійного середовища. Підготовлений таким чином ні клітини Е.соlі з розрахунку 10000 клітин на мірозчин досліджуваних бактерійних клітин розливалілітр живильного середовища. Підготовлений ємо у стерильні пробірки ємністю 5см 3, закриваємо таким чином розчин досліджуваних бактерійних їх ватно-марлевими пробками і інкубуємо у термоклітин однієї із скляних посудин розливаємо у стестаті за температури 40°С. Проводимо дослідженрильні пробірки ємністю 5см 3, закриваємо їх ватноня змін інтенсивності розсіювання світла частками марлевими пробками і інкубуємо у термостаті за у живильному середовищі протягом семи годин з температури 20°C. Другу посудину з розчином інтервалом 1 година. При проведенні досліджень досліджуваних бактерійними клітин Е.соіі поміщапопередньо проводилась підготовка проби, яка ємо у паровий стерилізатор, і стерилізуємо у паполягала у наступному. Розчин проби живильного ровому стерилізаторі за температури 121°C протясередовища з бактерійними культурами після фікгом 15 хвилин. Після стерилізації розчин сованого часу інкубації із пробірки розводили у досліджуваних бактерійних клітин з даної посудиспіввідношенні 1:100 у стерильному фізіологічному ни розливаємо у стерильні пробірки ємністю 5см 3, 3 розчині у посудині ємністю 200см , герметично закриваємо їх ватно-марлевими пробками і інкубузакритою гумовою пробкою з алюмінієвим ободом, ємо у термостаті за температури 20°С. Проводимо який серійно випускається фармацевтичною продослідження змін інтенсивності розсіювання світла мисловістю України (у нашому випадку використочастками кожної проби через 24 години інкубуванвувався фізіологічний розчин виробництва ДП ня. При проведенні досліджень попередньо про"Львівдіалік", м.Львів). Одержану таким чином водилась підготовка проби, яка полягала у наступпробу досліджуваної культури бактерійних клітин ному. Розчин досліджуваних бактерійних клітин 3 набирали стерильним шприцом ємністю 50см , кожної із пробірок розводили у співвідношенні який поміщали у пристрій для досліджування змін 1:100 у стерильному фізіологічному розчині у поінтенсивності розсіювання світла, де проводили судині ємністю 200см 3, герметично закритою гумовимірювання. Вимірювання кожної проби, яка місвою пробкою з алюмінієвим ободом, який серійно тить досліджувані частки, проводили 5-6 разів з випускається фармацевтичною промисловістю подальшою статистичною обробкою результатів України (у нашому випадку використовувався фізівимірів. Між вимірами для кожної проби гідравлічологічний розчин виробництва ДП "Львівдіалік", м. ний тракт і оптична кювета пристрою промивалась Львів). Одержану таким чином пробу досліджувадеіонізованою водою. Для вибраного числа вимірів ної культури бактерійних клітин набирали стериr та довірчої ймовірності P=0,95 визначали коефільним шприцом ємністю 50см 3, який поміщали у цієнт Стьюдента та визначали межі довірчого інпристрій для досліджування змін інтенсивності тервалу відносно середнього значення результату розсіювання світла, де проводили вимірювання. згідно формули (5). Результати вимірювання часоВимірювання кожної проби рідинного середовища вої залежності зміни концентрації часток бактерійпроводили 5-6 разів з подальшою статистичною них клітин Е.соlі та продуктів розпаду рідкого жиобробкою результатів вимірів. Між вимірами для вильного середовища №3 (крива (+)) у кожної проби рідинного середовища, яке містить фізіологічному розчині на пристрої, який був попедосліджувані частки, гідравлічний тракт і оптична редньо калібрований в інтервалі розмірів 0,1кювета пристрою промивалась деіонізованою во2,0мкм за сферичними полістирольними латексадою. Для вибраного числа вимірів r та довірчої ми з показником заломлення n = 1,56 наведені на ймовірності Р=0,95 визначали коефіцієнт СтьюдеФіг.2. Верхня (□) і нижня (о) криві задають межі нта та визначали межі довірчого інтервалу відносдовірчого інтервалу відносно середнього значення но середнього значення результату згідно формурезультату, які визначаються коефіцієнтами ли (5). Результати вимірювання розподілу за Стьюдента t(5;0,95)=2,77 та t(6;0,95)=2,57. З наверозмірами часток бактерійних клітин Е.соlі та проденої часової залежності зміни концентрації часток дуктів розпаду рідкого живильного середовища бачимо, що в межах похибок, збільшення числа №3 в інтервалі розмірів 0,2-2,0мкм у фізіологічночасток у процесі інкубації спостерігається, почиму розчині на пристрої, який був попередньо калінаючи з 5 годин. брований в інтервалі розмірів 0,1-2,0мкм за сфеПриклад 3. ричними полістирольними латексами з показником Готуємо для досліджень розчин з бактерійнизаломлення n = 1,56 наведені на Фіг.3. Крива (о) ми клітинами Escherichia coli у рідкому живильносуспензія часток, яка містить живі бактерійні клітиму середовищі №3 згідно вимог Державної Фармани Е.соlі із посудини, яка не була піддана стерилікопеї України. Для цього на 1 літр м'ясної води зації; крива (+) - суспензія часток, яка містить баквносимо 10,0г пептону ферментативного сухого, терійні клітини Е.соlі із посудини, підданої 7,5г динатрію гідрофосфату та 2,5г калію дигідростерилізації. З наведених залежностей зміни конфосфа ту, розчиняємо при нагріванні, вносимо центрації часток бачимо, що на кривій, яка відпо 15 82756 16 відає розподілу за розмірами часток бактерійних хвилин. Стерилізоване середовище розливаємо у клітин Е.соlі, які попередньо стерилізували, та рівних частинах в стерилізовану скляну посудину продуктів розпаду рідкого живильного середовища ємністю 0,5 літра, вносимо в.одну з посудин бак№3 в інтервалі розмірів 0,25-0,65мкм спостерігаєтерійні клітини Е.соlі з розрахунку, щоб вихідна мо збільшення відносного вмісту часток, а в інтерконцентрація клітин в середовищі була 10000 клівалі розмірів 0,65-2,0мкм відносний вміст часток тин на мілілітр живильного середовища. Підготовпадає до нуля. лені таким чином розчини рідкого живильного сеРезультати вимірювання розподілу за розміредовища №3 і досліджуваних бактерійних клітин рами часток бактерійних клітин Е.соlі та продуктів Е.соlі у рідкому живильному середовищі №3 розрозпаду рідкого живильного середовища №3 в ливаємо у стерильні пробірки ємністю 5см 3, закриінтервалі розмірів 0,2-2,0мкм у фізіологічному розваємо їх ватно-марлевими пробками і інкубуємо у чині на пристрої, який був попередньо каліброватермостаті за температури 37°С. Проводимо доний в інтервалі розмірів 0,1-2,0мкм за сферичними слідження змін інтенсивності розсіювання світла полістирольними латексами з показником заломчастинками у підготовлених таким чином розчинах лення n = 1,56 наведені на Фіг.4. Крива (о) - сурідкого живильного середовища №3 і досліджуваспензія часток, яка містить живі бактерійні клітини них бактерійних клітин Е.соlі у рідкому живильному Е.соlі із посудини, яка не була стерилізована; крисередовищі №3 протягом 6 годин з інтервалом 1 ва (о) - суспензія часток, яка містить живі бактегодина. При проведенні досліджень попередньо рійні клітини Е.соlі із посудини, яка не була стерипроводилась підготовка проби, яка полягала у налізована, після 24 годин культивування. З ступному. Вміст кожної із пробірок, яка містила наведених залежностей зміни концентрації часток рідке живильне середовище №3 або рідке живибачимо, що на кривій, яка відповідає розподілу за льне середовище №3 із досліджуваними бактерійрозмірами часток бактерійних клітин Е.соlі та проними клітинами Е.соlі, розводили у співвідношенні дуктів розпаду рідкого живильного середовища 1:100 у стерильному фізіологічному розчині у по№3 після 24 годин культивування в інтервалі розсудині ємністю 200см 3, герметично закритою гумомірів 0,25-0,6мкм спостерігаємо збільшення вою пробкою з алюмінієвим ободом, який серійно віднoсного вмісту часток, а в інтервалі розмірів випускається фармацевтичною промисловістю 0,6-2,0мкм відносний вміст часток на обох кривих України (у нашому випадку використовувався фізіоднаковий. ологічний розчин виробництва ДП "Львівдіалік", м. Результати вимірювання розподілу за розміЛьвів). Одержану таким чином пробу досліджуварами часток бактерійних клітин Е.соlі та продуктів ної суспензії часток набирали стерильним шприрозпаду рідкого живильного середовища №3 в цом ємністю 50см 3, який поміщали у пристрій для інтервалі розмірів 0,2-2,0мкм у фізіологічному роздосліджування змін інтенсивності розсіювання чині на пристрої, який був попередньо калібровасвітла, де проводили вимірювання. Вимірювання ний в інтервалі розмірів 0,1-2,0мкм за сферичними для кожної проби рідинного середовища, яке місполістирольними латексами з показником заломтить досліджувані частинки, проводили 5-6 разів з лення n = 1,56 наведені на Фіг.5. Крива (*) - суподальшою статистичною обробкою результатів спензія часток, яка містить бактерійні клітини Е.соlі вимірів. Між вимірами для кожної проби рідинного із посудини, яка попередньо стерилізована; крива середовища гідравлічний тракт і оптична кювета (+) - суспензія часток, яка містить бактерійні клітипристрою промивалась деіонізованою водою. Для ни Е.соlі із посудини, яка попередньо стерилізовавибраного числа вимірів r та довірчої ймовірності на через 24 години. З наведених залежностей зміP=0,95 визначали коефіцієнт Стьюдента та визнани концентрації часток бачимо, що на кривій, яка чали межі довірчого інтервалу відносно середньовідповідає розподілу за розмірами часток бактего значення результату згідно формули (5). Рерійних клітин Е.соlі та продуктів розпаду рідкого зультати вимірювання відносного вмісту часток живильного середовища №3 через 24 години після продуктів розпаду рідкого живильного середовища стерилізації в інтервалі розмірів 0,2-0,7мкм спо№3, в інтервалі розмірів 0,2-2,0мкм у фізіологічностерігаємо зменшення відносного вмісту часток, а му розчині на пристрої, який був попередньо калів інтервалі розмірів 0,7-2,0мкм незначне збільбрований в інтервалі розмірів 0,2-2,0мкм за сфешення відносного вмісту часток по відношенню до ричними полістирольними латексами з показником вихідних даних. заломлення n = 1,56 наведені на Фіг.6. Крива 1 Приклад 4. суспензія часток на початок процесу культивації, Готуємо для досліджень розчин з бактерійникрива 2 - суспензія часток після інкубації у термоми клітинами Escherichia coli у рідкому живильностаті протягом 4 години, крива 3 - суспензія часток му середовищі №3 згідно вимог Державної Фармапісля інкубації у термостаті протягом 5 годин, крикопеї України. Для цього на 1 літр м'ясної води ва 4 - суспензія часток після інкубації у термостаті вносимо 10,0г пептону ферментативного сухого, протягом 6 годин. З наведених кривих відносного 7,5г динатрію гідрофосфату та 2,5г калію дигідровмісту часток бачимо, що у вказаному вище інтерфосфа ту, розчиняємо при нагріванні, вносимо валі розмірів відносного вмісту часток - продуктів 10,0г глюкози та 8мл 1% розчину фенолового черрозпаду рідкого живильного середовища №3 сповоного і 3мл 0,5% розчину малахітового зеленого, стерігаються незначні зміни. установлюючи рН таким чином, щоб після стериліРезультати вимірювання відносного вмісту чазації його значення становило 7,3±0,2. Середовисток - бактерійних клітин Е.соlі та продуктів розпаще фільтруємо через мембранний фільтр з діамеду рідкого живильного середовища №3, у фізіолотром пор 0,2мкм, стерилізуємо у паровому гічному розчині на пристрої, який був попередньо стерилізаторі за температури 121°С протягом 15 калібрований в інтервалі розмірів 0,2-2,0мкм за 17 82756 18 сферичними полістирольними латексами з показ5,6±0,2. Середовище стерилізуємо у паровому ником заломлення п = 1,56 наведені на Фіг.7. Кристерилізаторі за температури 121°С протягом 15 ва 1 - суспензія часток на початок процесу культихвилин. В середовище вносимо клітини гриба вації, крива 2 - суспензія часток після інкубації у Mucor racemosus з розрахунку 10000 клітин на термостаті протягом 4 годин, крива 3 - суспензія мілілітр живильного середовища. Підготовлений часток після інкубації у термостаті протягом 5 готаким чином розчин досліджуваних бакте-, рійних дин, крива 4 - суспензія часток після інкубації у клітин розливаємо у стерильні пробірки ємністю термостаті протягом 6 годин. З наведених кривих 5см 3, закриваємо їх ватно-марлевими пробками і відносного вмісту часток бачимо, що в інтервалі інкубуємо у термостаті за температури 25°С. Пророзмірів 0,2-1,4мкм відносного вмісту часток - проводимо дослідження змін інтенсивності розсіювандуктів розпаду рідкого живильного середовища ня світла частками у живильному середовищі в №3 спостерігаються суттєві зміни. Із збільшенням інтервали часу 7, 20, 42 години після внесення. часу культивації одночасно зменшується відносПри проведенні досліджень попередньо проводиний вміст часток в інтервалі розмірів 0,2-0,3мкм і лась підготовка проби, яка полягала у наступному. зростає відносний вміст часток в інтервалі розмірів Розчин проб живильного середовища з клітинами 0,3-1,3мкм, та спостерігається максимум на кривій гриба після фіксованого часу інкубації із пробірки розводили у співвідношенні 1:100 у стерильному розподілу при » 0,68мкм. 5% розчині глюкози у посудині ємністю 200см 3, Результати величини відносних змін часток герметично закритою гумовою пробкою з алюмінібактерійних клітин Е.соlі, в інтервалі розмірів 0,2євим ободом, який серійно випускається фарма2,0мкм по відношенню до даних на початок процецевтичною промисловістю України (у нашому вису культивування у процесі їх культивування у рідпадку використовувався 5% розчин глюкози кому живильному середовищі №3 наведені на виробництва ДП "Львівдіалік", м. Львів). Одержану Фіг.8. Крива 1 - нормований вихідний розподіл бактаким чином пробу досліджуваної культури клітин терійних клітин Е.соlі на початок процесу їх кульгриба Mucor racemosus набирали стерильним тивування; крива 2 - нормований розподіл бактешприцом ємністю 50см 3, який поміщали у пристрій рійних клітин Е.соlі по відношенню до нормованого для досліджування змін інтенсивності розсіювання вихідного розподілу даних клітин у процесі їх кульсвітла, де проводили вимірювання. Вимірювання тивування у проміжку часу 4 годин; крива 3 - нордля кожної проби рідинного середовища, яке місмований розподіл бактерійних клітин Е.соlі по відтить досліджувані частинки, проводили 5-6 разів з ношенню до нормованого вихідного розподілу подальшою статистичною обробкою результатів даних клітин у процесі їх культивування у проміжку вимірів. Між вимірами для кожної проби рідинного часу 5 годин; крива 4 - нормований розподіл баксередовища гідравлічний тракт і оптична кювета терійних клітин Е.соlі по відношенню до нормовапристрою промивалась деіонізованою водою. Для ного вихідного розподілу даних клітин у процесі їх вибраного числа вимірів r та довірчої ймовірності культивування у проміжок часу 6 годин. З наведеР=0,95 визначали коефіцієнт Стьюдента та визнаних результатів величин відносних змін бактерійчали межі довірчого інтервалу відносно середньоних клітин Е.соlі у процесі їх культивування у рідго значення результату згідно формули (5). Рекому живильному середовищі №3 у проміжок часу зультати вимірювання відносного вмісту часток 6 годин кількість клітин розмірами 0,5мкм по відклітин гриба Mucor racemosus та продуктів розпаду ношенню на початок процесу їх к ультивування рідкого живильного середовища Сабуро у 5% роззросла в 3 рази, кількість клітин розмірами 0,6мкм чині глюкози на 2 добу після внесення наведені на по відношенню на початок процесу їх культивуФіг.9. Пристрій був попередньо калібрований в вання зросла в 7 разів, кількість клітин розмірами інтервалі розмірів 0,1-2,0мкм за сферичними полі0,7мкм по відношенню на початок процесу їх кульстирольними латексами з показником заломлення тивування зросла в 11,2 раз. n = 1,56. З наведеної кривої величини відносного Приклад 5. вмісту часток бачимо, що у процесі культивування Готуємо для досліджень розчин з клітинами клітин гриба Mucor racemosus у рідкому живильгриба Mucor racemosus у рідкому живильному сеному середовищі Сабуро у спектрах розподілу редовищі Сабуро згідно вимог Державної Фармачасток через 2 доби після внесення спостерігаєтькопеї України. Для цього на 1 літр очищеної води ся смуга з чітко виділеним максимумом при вносимо 10,0г пептону ферментативного сухого та 0,33мкм і слабо інтенсивним хвостом в інтервалі 40,0г глюкози, встановлюючи рН таким чином, щоб розмірів 0,7-1,9мкм. після стерилізації його значення становило 19 82756 20 21 82756 22 23 82756 24 25 Комп’ютерна в ерстка Л. Купенко 82756 Підписне 26 Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for the quantification of the microbiological objects during theirs cultivation
Автори англійськоюKushnir Ihor Mykhailovych, Kotsiumbas Ihor Yaroslavovych, Bilyi Oleksandr Ivanovych, Hetman Vasyl Bohdanovych, Bilyi Rostyslav Oleksandrovych
Назва патенту російськоюСпособ определения количества микробиологических объектов в процессе их культивирования
Автори російськоюКушнир Игорь Михайлович, Коцюмбас Игорь Ярославович, Белый Александр Иванович, Гетьман Василий Богданович, Билый Ростислав Александрович
МПК / Мітки
МПК: G01N 21/01, C12Q 1/02, C12Q 1/06, G01N 15/02
Мітки: кількості, культивування, спосіб, процесі, визначення, мікробіологічних, об'єктів
Код посилання
<a href="https://ua.patents.su/13-82756-sposib-viznachennya-kilkosti-mikrobiologichnikh-obehktiv-u-procesi-ikh-kultivuvannya.html" target="_blank" rel="follow" title="База патентів України">Спосіб визначення кількості мікробіологічних об’єктів у процесі іх культивування</a>
Попередній патент: Похідні арил- та гетероарилтрифторометилсульфонієвих солей та способи їх одержання
Наступний патент: Пилосистема маневреного котла
Випадковий патент: Рідкий теплоносій












