Похідні арил- та гетероарилтрифторометилсульфонієвих солей та способи їх одержання
Номер патенту: 82755
Опубліковано: 12.05.2008
Автори: Орлова Раїса Кузьмівна, Мацнєв Андрій Вікторович, Ягупольський Лев Мусійович, Ягупольський Юрій Львович
Формула / Реферат
1. Похідні арил- та гетероарилтрифторометилсульфонієвих солей загальної формули (I):
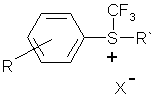 , I
, I
де R = H, 4-NO2, 2-NO2, 2-CF3, 4-CF3, 3,5-біс-CF3, 4-SO2CF3;
R` = C6H5, CF3, 4-NO2C6H4, 4-SO2CF3C6H4, пірол-2, індол-3;
X = BF4, CF3SO3,
за винятком сполуки, в якій одночасно R = H, R` = C6H5.
2. Спосіб одержання арилтрифторометилсульфонієвих солей загальної формули (I):
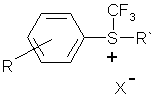 , I
, I
де R = H, 4-NO2, 2-NO2, 2-CF3, 4-CF3, 3,5-біс-CF3, 4-SO2CF3;
R` = C6H5, 4-NO2C6H4, 4-SO2CF3C6H4;
X = BF4,
який відрізняється тим що діарилсульфіди фторують, одержані діарилдифторосульфурани піддають взаємодії зі сполуками типу [CF3]‾[M]+, де M = K, Na, Cs, Alk4N, де Alk = алкіл, при охолодженні та наступному додаванні ефірату трифтористого бору, після чого виділяють цільовий продукт за відомими методиками.
3. Спосіб одержання діарилтрифторометилсульфонієвих солей формули (Ia):
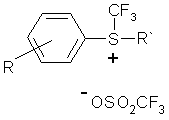 , Ia
, Ia
де R = H, 4-NO2, 2-NO2, 2-CF3, 4-CF3, 3,5-біс-CF3, 4-SO2CF3;
R` = C6H5, CF3, 4-NO2C6H4, 4-SO2CF3C6H4, пірол-2, індол-3,
за винятком, коли одночасно R = H і R` = C6H5,
який відрізняється тим, що відповідну похідну фенілтрифторометилсульфоксиду піддають взаємодії з ароматичними сполуками формули R`H в присутності надлишку ангідриду трифторометансульфокислоти при кімнатній температурі.
4. Спосіб одержання арилгетероарилтрифторометилсульфонієвої солі формули (I):
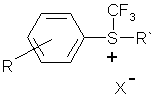 , I
, I
де R = H, 4-NO2, 2-NO2, 2-CF3, 4-CF3, 3,5-біс-CF3, 4-SO2CF3;
R` = пірол-2, індол-3;
X = BF4,
який відрізняється тим, що арилтрифторометилсульфід фторують фторуючим агентом, вибраним з групи, яка включає: елементарний фтор, дифторид ксенону, дифторойодозобензол, у присутності ефірату трифтористого бору і проводять наступну взаємодію з відповідними гетероциклічними сполуками.
Текст
1. Похідні арил- та гетероарилтрифторометилсульфонієвих солей загальної формули (I): CF3 3 82755 4 присутності надлишку ангідриду трифторометанде R = H, 4-NO2, 2-NO2, 2-CF3, 4-CF3, 3,5-біс-CF3, сульфокислоти при кімнатній температурі. 4-SO2CF3; 4. Спосіб одержання арилгетероарилтрифторомеR` = пірол-2, індол-3; тилсульфонієвої солі формули (I): X = BF4, який відрізняється тим, що арилтрифторометилCF3 сульфід фторують фторуючим агентом, вибраним S R` з групи, яка включає: елементарний фтор, дифто(I) + рид ксенону, дифторойодозобензол, у присутності R ефірату трифтористого бору і проводять наступну X , взаємодію з відповідними гетероциклічними сполуками. Винахід відноситься до органічної хімії, а саме до синтезу сполук загальної формули (І) Сполуки та способи їх одержання, що заявляються є новими і в літературі не описані. Синтез сполук, що містять трифторометильну групу набув великого значення, бо зараз цей напрям є одним з найважливіших для отримання стійких, ліпофільних, малотоксичних, важко метаболізуючих в організмі лікарських препаратів та пестицидів. Існує три методи безпосереднього введення групи CF3 в органічні сполуки - нуклеофільний за допомогою трифторометил аніону, радикальний - дією трифторометильного радикалу та електрофільного - за допомогою діарилтрифторометилсульфонієвих солей. Останній метод був винайдений у 1984р. в Інституті Органічної Хімії НАН України [1], що визнано світовою хімічною спільнотою [2-5]. В 1990р. японський хімік Умемото [2] синтезував структурні аналоги наших сполук - циклічні дібензотіофенові системи. У всіх цих синтезах вихідними сполуками виступають такі, в яких вже знаходиться трифторометильна група - арил- чи діарилтрифторометилсульфіди. Умемото та професор Шрів зробили це шляхом нітрування одержаних сполук сумішшю азотної та сірчаної кислот [3, 4], або азотної та ангідридом трифторометансульфокислоти. Але нітрогрупа входить у мета-положення до сірки, на якій знаходиться позитивний заряд. В такому випадку нітрогрупа може відтягувати електрони лише за індуктивним ефектом. Важливе завдання - знайти спосіб введення в ці молекули електроноакцепторних замісників, які б відтягували електронну густину від атому сірки, внаслідок чого, позитивний заряд на ній збільшиться і реакції електрофільного трифторометилювання полегшаться. Нами розроблені нові способи одержання діарилтрифторометилсульфонієвих солей, які дають можливість синтезувати сполуки з сильними електроноакцепторними замісниками в орто- чи пара положенні до групи -S+-CF3. Ці способи полягають у нуклеофільному заміщенні атома фтору у відповідних сульфуранах на трифторометильну групу. 5 82755 6 Для цього ми використовуємо діарилсульфіди, які вже містять електроноакцепторні групи в цих положеннях, наприклад, 4-нітрофеніл- або 4,4'-динітродіфенілсульфіди. Шляхом фторування їх різними фторуючими агентами — F2, XeF2, ArIF2 та іншими, отримуємо діарилдифторосульфурани, в яких заміщуємо один фтор на трифторометильну групу дією аніону CF3, який можна генерувати декількома шляхами, наприклад, дією на Me3SiCF3 фториданіоном. Дією ефірату трифтористого бору на одержану сполу ку, отримуємо борфториди діарилтрифторометилсульфонієвих солей. Таким чином можна отримати і інші сполуки з електроноакцепторними групами - CF3, SO2CF3, в орто- чи пара-положенні до сульфонієвої сірки. Сполуку (1) ми одержуємо також іншим шляхом, виходячи з синтезованого нами раніше 4нітрофенілтрифторометилсульфоксиду взаємодією в розчині бензолу з ангідридом трифторометансульфокислоти. Ми знайшли також спосіб одержання раніше невідомих арилгетарилтрифторометилсульфонієвих солей, наприклад, (III, IV), виходячи з доступного n-нітрофенілтрифторометилсульфіду по схемі Отримані сполуки типу І та II, є ефективними трифторометилюючими агентами, що ми встановили, вивчивши їх реакції з різними нуклеофіла ми. Раніше ми знайшли, що такого типу солі можуть реагувати з нуклеофілами, які містять аніонний заряд на атомі сірки. Синтезовані нами солі типу І та II можуть реагувати зі сполуками які не мають аніонного заря ду, а лише збільшену електронну густину на атомі сірки, наприклад: 7 82755 8 Солі типу (І) та (II) вступають в реакцію з Снуклеофілами та неорганічними солями, такими, як Nal. Було показано, що на відміну від реагенту Умемото, який реагує з Nal на протязі 3 діб та з виходом CF3I 70%, сіль 1 за 3 години при 80°С з кількісним виходом утворює йодотрифторометан. Ситезовані діарил трифторометилсульфонієві солі реагують, також з N, N-диметиланіліном, чи пірролом, та утворюють відповідні трифторометилпохідні з кількісним виходом. Приклад 1 S-(Трифторометил)-nнітрофенілфенілсульфоній тетрафторборат У кварцеву колбу вносять 1г (4 ммоль) nнітрофенілфенілсульфіду, нагрівають його до повного розтоплення і поступово додають 0,75г (4,2 ммоль) дифториду ксенону. Перемішують до закінчення виділення газу. Одержаний S(дифторо)-n-нітрофенілфенілсульфуран вводять у подальшу реакцію без очищення. У трьохгорлий реактор у струмі аргону вносять 0,4г (4 ммоль) тетра-метиламонійфториду і 10мл безводного гліму. Охолоджують реактор до -60°С та по краплям додають 1,23г (8 ммоль) (триметил)трифторометилсілану. Розмішують при температурі -50°С на протязі 0,5год. Охолоджують реакційну суміш до -60°С та покраплям додають S-(дифторо)-nнітрофенілфенілсульфуран. Премішують при -5560°С на протязі 1,5год. Додають 1г (8 ммоль) ефірату трифториду бору та поступово відігрівають до кімнатної температури. Відділяють осад центрифугуванням, розчин випаровують в вакуумі, залишок хроматографують з суміші ацетонітрил/дихлорометан (1/5). Одержують 0,83г (51%) S-(Трифторометил)n-нітрофенілфенілсульфоній тетрафторборату. Т.топл. 136-138°С Спектр ПМР: 8.05-8.78м (9Н). Спектр 19 F ЯМР: -49.5с (3F, CF3); -150.7 (4F, BF4). Знайдено, %: С 39.93; Η 2.32; S 8.23. Вирахувано, %: С 40.05; Η 2.32; S 8.23 Приклад 2 S-(Трифторометил)-n, n'динітрофенілсульфоній тетрафтороборат У кварцеву колбу вносять 1г (4 ммоль) n,n'динітрофенілсульфіду, нагрівають його до повно го розтоплення і поступово додають 0,75г (4,2 ммоль) дифториду ксенону. Перемішують до закінчення виділення газу. Одержаний S-(дифторо)n,n'-динітрофенілсульфуран вводять у подальшу реакцію без очищення. У трьохгорлий реактор у струмі аргону вносять 0,4г (4 ммоль) тетра-метиламонійфториду і 10мл безводного гліму. Охолоджують реактор до -60°С та по краплям додають 1,23г (8 ммоль) (триметил)трифторометилсілану. Розмішують при температурі -50°С на протязі 0,5год. Охолоджують реакційну суміш до -67°С та покраплям додають S-(дифторо)-n,n'динітрофенілсульфуран. Премішують при -6560°С на протязі 1,5год. Додають 1г (8 ммоль) ефірату трифториду бору та поступово відігрівають до кімнатної температури. Віддiляють осад центрифугуванням, розчин випаровують в вакуумі, залишок хроматографують з суміші ацетонітрил/дихлорометан (1/5). Одержують 0,57г (38%) S-(Трифторометил)n,n'-динітрофенілсульфоній тетрафтороборату. Т.топл. 145-146°С Спектр ПМР: 8.76с (8Н). Спектр 19F ЯМР: -46.9с (3F, CF3); -151.2 (4F, BF4). Знайдено, %: S 7.11. Вирахувано, %: S 7.39 Приклад 3. S-(Трифторометил)-nнітрофенілфенілсульфоній трифлат. У трьохгорлий реактор ємністю 100мл у струмі аргону вносять розчин 2г (8.37 ммоль) nнітрофенілтрифторометилсульфоксида в 22мл бензолу. Охолоджують до 2-3°С, додають 11.8г (41.84 ммоль) ангідриду трифторометансульфокислоти. Світло-жовтий розчин перемішують 1 9 82755 10 годину, а потім поступово доводять температуру 0.2 ммоль ефірату трифтористого бору. Поступодо кімнатної. Через 3 години розчин став темново відігрівають реакційну суміш до кімнатної темвишневого кольору. Реакційну суміш витримують ператури та перемішують до завершення виді24 години при кімнатній температурі. Випаровулення газу. Потім знову захолоджують до -30°С ють у вакуумі (20мм.рт.ст.) надлишок бензолу та та додають по краплям розчин 0.4 ммоль індолу у ангідриду трифторометансульфокислоти. Потім 2мл дихлорометану. Залишають на ніч. Розчиндодають 20мл СН2СІ2 і промивали 3 рази льодяник випаровують. Залишок хроматографують ною водою. Розчин сушать MgSO4. Випаровують сумішшю ацетонітрил/дихлорометан (1/7). Вихід основну частину розчинника, а залишок наносять 51%. Т.топл. 159-161°С. на SiO2. Хроматографують продукт сумішшю Спектр ПМР: 7.49т (1Н); 7.61т (1Н); 7,73 д ацетонітрил/дихлорометан (1/5). Розчинник ви(1Н); 7.97 д (1Н); 8,53 д (2Н); 8.71 д (2Н); 9.14 с паровують у вакуумі та одержують S(1Н); 12,68 с (1Н). (Трифторометил)-n-нітрофенілфенілсульфоній Спектр 19F HMP: -50.2 с (3F); -150.2 с (4F); трифлат з виходом 1.57г (42.5%), т. топл. 102Знайдено, %: С 40.74; Н3.92. 103°С. Вирахувано, % : С 42.25; Η 2.35. Спектр ПМР: 7.86-7.89 д (2Н); 8.36-8.39 д Приклад 6 Трифторойодометан (2Н); 8.65-8.75 м (5Н). В двогорлий реактор ємністю 5мл в струмі Спектр 19F ЯМР: -48.95 с (3F, CF3). аргону вміщують розчин 0.07г (0.16 ммоль) солі Знайдено, %: С 37.22; Η 2.29; Ν 3.15; S 13.65. (I) в 1мл безводного CH3CN та 0.05г (0.33 ммоль) Вирахувано, %: С 37.42; Η 2.00; Ν 3.12; S Nal. Розчин набуває коричнево-червоного кольо14.25. ру. Реакційну суміш перемішують 2 години при Приклад 4 S-(Трифторометил)-n-нітрофенілкімнатній температурі. Ход реакції контролюють 2-пірролілсульфоній тетра-фтороборат методом ТШХ (до зникнення вихідної солі). Після У кварцеву колбу в стумі аргону вміщують 0.2 закінчення реакції трифторойодометан збирають ммоль нітрофенілтрифторометил-сульфіду, 0.2 у зважену колбу, захолоджену рідким азотом, ммоль дифториду ксенону, та додають при -40°С підключену до масляного насосу, та відкачують 0.2 ммоль ефірату трифтористого бору. Поступо1год. Трифторойодометан аналізують за допомово відігрівають реакційну суміш до кімнатної темгою ГРХ та 19F ЯМР, порівнюючи з відомим зразператури та перемішують до завершення видіком. Вихід: 0.03г (99%) лення газу. Потім знову захолоджують до -30°С Спектр ЯМР19 F: -13.46с (3F, CF3). та додають по краплям 0.4 ммоль пірролу. Зали«Хром-5»: час утримання = 4хв. шають на ніч. Розчинник випаровують. Залишок Таким чином, ми пропонуємо нові зручні мехроматографують сумішшю ацетоніттоди одержання нових електрофільних трифторил/дихлорометан (1/7). Вихід 65%. Т.топл. 109рометилюючих реагентів, які містять в своєму 113°С. складі сильні акцепторні групи. Спектр ПМР: 4.03с (3Н); 4.24 с (3Н); 6.89 с Література (1H); 7.26 с (1H); 7.54 с (1H); 7.95 с (2Н); 8.40 с 1. Ягупольский Л.М., Кондратенко Н.В., Ти(1Н); 8.51 - 8.79 м (8Н). мофеева Г.Н // ЖОрХ. - 1984. -20. -1.-Р.115-118. Спектр 19F HMP: -54.2 с (3F); -54.5 с (3F); 2. Umemoto Т., Ishihara S. // J. Am. Chem. Soc. 149.6 с (8F); - 1993. - 115. - P.2156-2164. Знайдено, %: С 36.95; Η 2.43; Ν 7,20. 3. Umemoto T. - Chem. Rev. - 1996. - 96. Вирахувано, % : С 36.92; Η 2.56; Ν 7,18. P.1757-1777. Приклад 5 S-(Трифторометил)-n-нітрофеніл4. Yang J.J., Kirchmeier R.L., Shreeve J.M. // J. 3-індолілсульфоній тетра-фтороборат Org. Chem. - 1998. - 63. - P.2656-2660. У кварцеву колбу в струмі аргону вміщують 5. Magnier E., Blazejewski J.C., Tordeux M., розчин 0.2 ммоль нітрофенілтрифторометилсуWakselman C. // Angew. Chem. -2006. - 45. льфіду в 5мл безводного дихлорометану, 0.2 P.1279-1272. ммоль дифториду ксенону, та додають при -40°С Комп’ютерна верстка В. Мацело Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюAryl- and heteroaryltrifluoromethylsulfonium salts derivatives and processes for the preparation thereof
Автори англійськоюYahupolskyi Lev Musiiovych, Matsniev Andrii Viktorovych, Orlova Raisa Kuzmivna, Yahupolskyi Yurii Lvovych
Назва патенту російськоюПроизводные арил- и гетероарилтрифторометилсульфониевых солей и способы их получения
Автори російськоюЯгупольский Лев Мусийович, Мацнев Андрей Викторович, Орлова Раиса Кузьминична, Ягупольський Юрий Львович
МПК / Мітки
МПК: C07C 381/00, C07C 317/14, C07F 5/00, C07D 207/36, C07D 209/30
Мітки: способи, похідні, гетероарилтрифторометилсульфонієвих, одержання, солей, арил
Код посилання
<a href="https://ua.patents.su/5-82755-pokhidni-aril-ta-geteroariltriftorometilsulfoniehvikh-solejj-ta-sposobi-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Похідні арил- та гетероарилтрифторометилсульфонієвих солей та способи їх одержання</a>









