Застосування солей тіотропію для лікування персистуючої астми середньої тяжкості
Формула / Реферат
1. Застосування солей тіотропію 1
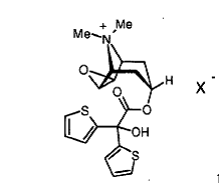 , 1
, 1
де X- означає однозарядний аніон, переважно аніон, вибраний із групи, що включає хлорид, бромід, йодид, сульфат, фосфат, метансульфонат, нітрат, малеат, ацетат, цитрат, фумарат, тартрат, оксалат, сукцинат, бензоат і n-толуолсульфонат, необов'язково у вигляді їхніх гідратів і/або сольватів, для приготування лікарського засобу, призначеного для лікування пацієнтів, що страждають астмою зі ступенем тяжкості 3 відповідно до класифікації Глобальної стратегії лікування й профілактики бронхіальної астми (GINA).
2. Застосування за п. 1 для приготування лікарського засобу, призначеного для лікування персистуючої астми середньої тяжкості в пацієнтів, у яких, незважаючи на лікування інгальованими кортикостероїдами, щодня проявляються симптоми астми або спостерігаються її напади.
3. Застосування за п. 1 або 2 для приготування лікарського засобу, призначеного для лікування персистуючої астми середньої тяжкості в пацієнтів з генотипом Arg/Arg кодона 16 гена ADRB2 (хромосома 5), у яких, незважаючи на лікування інгальованими β2-агоністами, постійно проявляються симптоми астми.
4. Застосування за п. 1 або 2 для приготування лікарського засобу, призначеного для лікування персистуючої астми середньої тяжкості в пацієнтів з генотипом Arg/Arg кодона 16 гена ADRB2 (хромосома 5), у яких, незважаючи на комбіноване лікування інгальованими кортикостероїдами й довгостроково діючими β2-агоністами, щодня проявляються симптоми астми або спостерігаються її напади.
5. Застосування за будь-яким з пп. 1-4 для приготування лікарського засобу, призначеного для лікування персистуючої астми середньої тяжкості в дітей-пацієнтів.
6. Застосування за будь-яким з пп. 1-5 для приготування лікарського засобу, призначеного для підтримуючої терапії при персистуючій астмі середньої тяжкості й для попередження прояву бронхо-обструктивних симптомів у пацієнтів з неадекватною реакцією на підтримуючу регуляторну терапію інгальованими кортикостероїдами й довгостроково діючими β2-агоністами.
7. Застосування за будь-яким з пп. 1-6 для приготування лікарського засобу, призначеного для третинної підтримуючої регуляторної терапії персистуючої астми середньої тяжкості.
8. Застосування за будь-яким з пп. 1-7, при якому солі тіотропію вводять в організм у дозуванні, що з розрахунку на один прийом переважно становить від 1 до 20 мкг тіотропію 1.
Текст
1. Застосування солей тіотропію 1 2 (19) 1 3 Даний винахід відноситься до застосування солей тіотропію для готування лікарського засобу, призначеного для лікування пацієнтів, що страждають персистуючою астмою середньої важкості. Передумови створення винаходу Астма є одним з найпоширеніших в усьому світі хронічних захворювань. Астма являє собою хронічне запальне захворювання дихальних шляхів. Астма викликає періодично повторювані напади стерторознего подиху, утрудненості подиху, задишки й кашлю. Напади (або загострення) астми наступають епізодично, тоді як запалення дихальних шляхів носять хронічний характер. Відомо кілька ступенів важкості астми. По ступенях важкості астма може бути інтермітуючою або ж персистуючою легкої, середньої важкості або важкої. Ступінь важкості астми варіюється серед індивідуумів, не обов'язково пов'язана із частотою або тривалістю прояву її симптомів і із часом може змінюватися в того самого індивідуума. Метод лікування астми вибирають на підставі ступеня її важкості й, навпаки, ступінь важкості астми класифікують на підставі фармакотерапії. Згідно загальновизнаним у світі рекомендаціям Глобальної стратегії лікування й профілактики бронхіальної астми (скорочено "GINA", від англ. "Global initiative for asthma") важкість астми можна підрозділити на так звані ступені 1-4 по класифікації GINA. Ступенем важкості астми визначаються необхідні заходи щодо її лікування (див. GINA Pocket guide for asthma management and prevention, переглянуте видання 2005 p.). Багато пацієнтів для боротьби із симптомами астми, для поліпшення діяльності легенів і для попередження нападів астми повинні щодня приймати відповідні протиастматичні лікарські засоби. Прийом протиастматичних засобів іноді потрібно й для ослаблення гострих астматичних нападів, таких як стерторозне дихання, утрудненість подиху й кашель. Астму зі ступенем важкості 1 по класифікації GINA називають також інтермітуючою. Її симптоми звичайно проявляються рідше одного разу в тиждень. Астма зі ступенем важкості 1 по класифікації GINA, як правило, не вимагає щоденної лікарської терапії. При легкій персистуючій астмі (ступінь важкості 2 по класифікації GINA) рекомендується лікування кортикостероїдами в низькій дозі шляхом їхньої інгаляції. При персистуючій астмі середньої важкості (ступінь важкості 3 по класифікації GINA) рекомендується застосування кортикостероїдів у дозах від низьких до середніх у сполученні з довгостроково діючими інгалюємими 2агоністами. Лікування важкої персистуючої астми (ступінь важкості 4 по класифікації GINA) звичайно полягає в застосуванні інгалюємих кортикостероїдів у високих дозах у сполученні з довгостроково діючими інгалюємими 2-агоністами й при необхідності з одним або декількома засобами із групи, що включає теофілін пролонгованої дії, модифікатор лейкотриєну, довгостроково діючий прийнятий усередину 2-агоніст і прийняті усередину кортикостероїди. В основу даного винаходу було покладене завдання запропонувати альтернативний шлях ліку 95271 4 вання пацієнтів, що страждають персистуючою астмою середньої важкості (ступінь важкості 3 по класифікації GINA). Ще одне завдання винаходу полягало в тому, щоб запропонувати фармацевтичні (лікарські) композиції, придатні для лікування таких пацієнтів. Докладний опис винаходу Даний винахід відноситься до застосування солей тіотропію 1 для готування лікарського засобу, призначеного для лікування пацієнтів, що страждають персистуючою астмою середньої важкості. Сполука тіотропійбромід відома із заявки ЕР 418716 A1 і має наступну хімічну структуру: де X позначає бромід. Згідно із даним винаходом під терміном "тіотропій" мається на увазі вільний катіон 1'. Під солями тіотропію 1, які можуть використатися в передбачених даним винаходом цілях, маються на увазі сполуки, які крім тіотропію 1' містять у якості протиіону однозарядний аніон X , переважно аніон, вибраний із групи, що включає хлорид, бромід, іодид, сульфат, фосфат, метансульфонат, нітрат, малеат, ацетат, цитрат, фумарат, тартрат, оксалат, сукцинат, бензоат і п-толуолсульфонат, серед яких кращі в якості протиіонів хлорид, бромід, іодид, сульфат, метансульфонат і птолуолсульфонат. Із числа всіх солей особливо кращі хлорид, бромід, іодид і метансульфонат. Особливе значення відповідно до винаходу має тіотропійбромід, переважно у вигляді його кристалічного моногідрату, описаного в WO 02/30928. В іншому кращому варіанті пропонується використати безводний тіотропійбромід, що описаний в WO 03/000265 або WO 05/042527. Серед цих двох безводних форм особливий інтерес представляє та з них, що описана в WO 05/042527. Згідно із даним винаходу під виразом "персистуюча астма середньої важкості" мається на увазі астма зі ступенем важкості 3 по класифікації GINA. Астма зі ступенем важкості 3 по класифікації GINA характеризується щоденними нападами або щоденним проявом її симптомів протягом тривалого періоду часу або нічних нападів астми частіше одного разу в тиждень. Пацієнт із вихідним показником максимальної швидкості видиху (МСВ) після попереднього лікування більше 60 відсотків, але менш 80 відсотків від прогнозованого або особистого кращого показника й варіабельністю МСВ у межах від 20 до 30 відсотків. Астма, що не піддається лікуванню шляхом інгаляції глюкокортикос 5 тероїдів у низькому дозуванні (ступінь важкості 2), також повинна розглядатися як персистуюча астма середньої важкості. Показники МСВ можна визначати за допомогою пневмотахометрів, відомих у даній галузі. Для визначення так званої форсованої життєвої ємності легенів за 1 секунду (ФЖЕЛ1с) використовують спірометри, відомі в даній галузі. Зазначені методи визначення МСВ і ФЖЕЛ1с добре зарекомендували себе в даній галузі. Винахід відноситься також до застосування солей тіотропію 1 для готування лікарського засобу, призначеного для лікування пацієнтів, що страждають астмою зі ступенем важкості 3 по класифікації GINA. Винахід відноситься далі до застосування солей тіотропію 1 для готування лікарського засобу, призначеного для лікування астми в пацієнтів, що страждають щоденними нападами астми або щоденним проявом її симптомів. Винахід відноситься, крім того, до застосування солей тіотропію 1 для готування лікарського засобу, призначеного для лікування астми в пацієнтів, що страждають її загостреннями. Винахід відноситься також до застосування солей тіотропію 1 для готування лікарського засобу, призначеного для лікування астми в пацієнтів, що страждають симптомами нічної астми або нічних нападів астми. Винахід відноситься крім цього до застосування солей тіотропію 1 для готування лікарського засобу, призначеного для лікування астми в пацієнтів з обмеженою фізичною активністю. Винахід відноситься далі до застосування солей тіотропію для готування лікарського засобу, призначеного для лікування астми в пацієнтів з показником МСВ у межах від 60 до 80%. Винахід відноситься також до застосування солей тіотропію 1 для готування лікарського засобу, призначеного для лікування астми в пацієнтів з показником ФЖЕЛ1с не вище 80%. Винахід відноситься, крім того, до застосування солей тіотропію 1 для готування лікарського засобу, призначеного для лікування астми в пацієнтів з варіабельністю МСВ у межах від 20 до 30%. Крім цього даний винахід відноситься до способу лікування пацієнтів, що страждають персистуючою астмою середньої важкості, що полягає у введенні в їхній організм солі тіотропію 1 у терапевтично ефективній кількості. Винахід відноситься також до способу лікування пацієнтів, що страждають астмою зі ступенем важкості 3 по класифікації GINA, що полягає у введенні в їхній організм солі тіотропію 1 у терапевтично ефективній кількості. Винахід відноситься далі до способу лікування пацієнтів, що страждають астмою із щоденними нападами або із щоденним проявом її симптомів, що полягає у введенні в їхній організм солі тіотропію 1 у терапевтично ефективній кількості. Винахід відноситься, крім того, до способу лікування пацієнтів, що страждають астмою з інтермітуючими загостреннями, що полягає у введенні в їхній організм солі тіотропію 1 у терапевтично ефективній кількості. Винахід відноситься також до способу лікування пацієнтів, що страждають астмою із симптомами нічної астми або нічних нападів, що полягає у введенні в їхній організм солі тіотропію 1 у терапевтично ефективній кількості. 95271 6 Винахід відноситься крім цього до способу лікування астми в пацієнтів з обмеженою фізичною активністю, що полягає у введенні в їхній організм солі тіотропію 1 у терапевтично ефективній кількості. Винахід відноситься також до способу лікування астми в пацієнтів показником МСВ не вище 80%, що полягає у введенні в їхній організм солі тіотропію 1 у терапевтично ефективній кількості. Винахід відноситься далі до способу лікування астми в пацієнтів з показником ФЖЕЛ1с не вище 80%, що полягає у введенні в їхній організм солі тіотропію 1 у терапевтично ефективній кількості. Винахід відноситься також до способу лікування астми в пацієнтів з варіабельністю МСВ у межах від 20 до 30%, що полягає у введенні в їхній організм солі тіотропію 1 у терапевтично ефективній кількості. Тіотропій особливо корисний при лікуванні хворих астмою, що мають гомозиготний генотип Arg/Arg кодона 16 гена 2-адренорецептора (ADRB2) у хромосомі 5, оскільки цей бетаміметик менш ефективний у лікуванні пацієнтів з генотипом "дикого типу" (наприклад, Gly/Gly). Відповідно до цього винахід відноситься також до способу лікування персистуючої астми середньої важкості (ступінь важкості 3 по класифікації GINA) у пацієнтів з гомозиготним генотипом Arg/Arg кодона 16 гена 2-адренорецептора (ADRB2) у хромосомі 5. В іншому кращому варіанті винахід відноситься до способу лікування персистуючої астми середньої важкості (ступінь важкості 3 по класифікації GINA) у пацієнтів з поліморфізмом одного нуклеотиду Arg/Arg. У наступному кращому, варіанті винахід відноситься до способу лікування персистуючої астми середньої важкості (ступінь важкості 3 по класифікації GINA) у пацієнтів з поліморфізмом одного нуклеотида Arg/Arg у якості вторинної регуляторної терапії. У наступному кращому варіанті винахід відноситься до способу лікування персистуючої астми середньої важкості 3 по класифікації GINA у пацієнтів з генотипом Arg/Arg. Вираження "гомозиготний генотип Arg/Arg кодона 16 гена 2-адренорецептора (ADRB2) у хромосомі 5" використовується для позначення популяції пацієнтів з мутацією одного нуклеотида, на частку яких доводиться приблизно 15-20% від всієї популяції. Результати цілого ряду досліджень свідчать про наявність зв'язку поліморфізму гена ADRB2 з астмою. За даними останніх досліджень було встановлено, що для пацієнтів, гомозиготних (тобто з ідентичними алелями в локусі) по аргініні в положенні 16 амінокислотної послідовності, характерна негативна реакція на регулярне застосування 2-агоністів. Пацієнти, що страждають астмою зі ступенем важкості 3 по класифікації GINA і які мають генотип Arg/Arg, являють собою пацієнтів, яким відповідно до існуючих рекомендацій як і раніше пропонується застосування інгалюємих глюкокортикостероїдів у дозуванні від низкого до середнього в сполученні з довгостроково діючим інгалюємим 2-агоністом. Пацієнти з поліморфізмом одного нуклеотида Arg/Arg являють собою пацієнтів, у яких імовірна неадекватна реакція на вторинну регуляторну те 7 рапію, наприклад, довгостроково діючими 2агоністами. Існують докази того, що тіотропійбромід у якості довгостроково діючого антихолінергічного засобу може додатково використатися для лікування пацієнтів з персистуючою астмою середньої важкості, яким його можна буде призначати в якості альтернативного лікарського засобу без небезпеки серйозних побічних ефектів. Вираження "у терапевтично ефективній кількості" означає та кількість лікарського засобу або лікарської речовини, що викликає необхідну дослідникові або практикуючому лікареві біологічну або медичну реакцію тканини, системи, тварину або людину. Персистуючу астму середньої важкості рекомендується лікувати кортикостероїдами. Однак у пацієнтів, що страждають персистуючою астмою середньої важкості, незважаючи на лікування інгалюємими кортикостероїдами часто спостерігаються щоденний прояв симптомів астми протягом тривалого періоду часу. Відповідно до цього в ще одному варіанті винахід відноситься до застосування солей тіотропію 1 для готування лікарського засобу, призначеного для лікування персистуючої астми середньої важкості в пацієнтів, у яких незважаючи на лікування інгалюємими кортикостероїдами проявляються постійні симптоми астми. Персистуючу астму середньої важкості рекомендується також лікувати 2-агоністами, зокрема інгалюємими довгостроково діючими 2агоністами. Однак у пацієнтів, що страждають персистуючою астмою середньої важкості, незважаючи на лікування інгалюємими 2-агоністами часто спостерігається щоденний прояв симптомів астми протягом тривалого періоду часу. Відповідно до цього в ще одному варіанті винахід відноситься до застосування солей тіотропію 1 для готування лікарського засобу, призначеного для лікування персистуючої астми середньої важкості в пацієнтів, у яких незважаючи на лікування інгалюємими 2агоністами постійно проявляються симптоми астми. Для фармакотерапії персистуючої астми середньої важкості в якості первинної регуляторної терапії рекомендується застосування кортикостероїдів у сполученні з довгостроково діючими 2агоністами. Однак у пацієнтів, що страждають персистуючою астмою середньої важкості, незважаючи на лікування інгалюємими кортикостероїдами в сполученні з довгостроково діючими 2агоністами часто спостерігається щоденний прояв симптомів астми. Відповідно до цього в ще одному варіанті винахід відноситься до застосування солей тіотропію 1 для готування лікарського засобу, призначеного для лікування персистуючої астми середньої важкості в пацієнтів, у яких незважаючи на комбіноване лікування інгалюємими кортикостероїдами й довгостроково діючими 2агоністами щодня проявляються симптоми астми. У наступному кращому варіанті винахід відноситься до застосування солей тіотропію 1 для готування лікарського засобу, призначеного для підтримуючої терапії при персистуючій астмі середньої важкості й для попередження прояву бронхо-обструктивних симптомів у пацієнтів з неа 95271 8 декватною реакцією на підтримуючу регуляторну терапію інгалюємими кортикостероїдами й довгостроково діючими 2-агоністами. У наступному кращому варіанті винахід відноситься до застосування солей тіотропію 1 для готування лікарського засобу, призначеного для підтримуючої терапії при астмі зі ступенем важкості 3 по класифікації GINA і для попередження прояву бронхо-обструктивних симптомів у пацієнтів з неадекватною реакцією на підтримуючу регуляторну терапію інгалюємими кортикостероїдами й довгостроково діючими 2-агоністами. У наступному кращому варіанті винахід відноситься до застосування солей тіотропію 1 для готування лікарського засобу, призначеного для вторинної підтримуючої регуляторної терапії при персистуючій астмі середньої важкості. У наступному кращому варіанті винахід відноситься до застосування солей тіотропію 1 для готування лікарського засобу, призначеного для підтримуючої терапії при персистуючій астмі середньої важкості й для попередження прояву бронхо-обструктивних симптомів у пацієнтів, які вже проходять курс підтримуючої регуляторної терапії інгалюємими кортикостероїдами. У наступному кращому варіанті винахід відноситься до застосування солей тіотропію 1 для готування лікарського засобу, призначеного для підтримуючої терапії при астмі зі ступенем важкості 3 по класифікації GINA і для попередження прояву бронхо-обструктивних симптомів у пацієнтів, які вже проходять курс підтримуючої регуляторної терапії інгалюємими кортикостероїдами. У наступному кращому варіанті винахід відноситься до застосування солей тіотропію 1 для готування лікарського засобу, призначеного для підтримуючої терапії при персистуючій астмі середньої важкості й для попередження прояву бронхо-обструктивних симптомів у пацієнтів, які вже проходять курс підтримуючої регуляторної терапії інгалюємими кортикостероїдами, обраними із групи, що включає преднізолон, преднізон, бутиксокортпропіонат, RPR-106541, флунісолід, беклометазон, тріамцинолон, будесонід, флутиказон, мометазон, циклесонід, рофлепонід, ST-126, дексаметазон, (S)-фторметиловий ефір 6,9дифтор-17-[(2-фуранілкарбоніл)окси]-11гідрокси-16-метил-3-оксоандроста-1,4-диєн-17карботіонової кислоти, (S)-(2оксотетрагідрофуран-3S-іловий) ефір 6,9дифтор-11-гідрокси-16-метил-3-оксо-17пропіонилоксиандроста-1,4-диєн-17-карботіонівої кислоти й етипреднолдихлорацетат (BNP-166), необов'язково у вигляді їхніх рацематів, енантиомерів або діастереомерів і необов'язково у вигляді їхніх солей і похідних, їхніх сольватів і/або гідратів. У наступному кращому варіанті винахід відноситься до застосування солей тіотропію 1 для готування лікарського засобу, призначеного для підтримуючої терапії при важкІЙ персистуючій астмі й для попередження прояву бронхо-обструктивних симптомів у пацієнтів, які вже проходять курс підтримуючої регуляторної терапії інгалюємими кортикостероїдами, обраними із групи, що включає флунісолід, беклометазон, тріамцинолон, будесо 9 нід, флутиказон, мометазон, циклесонід, рофлепонід, ST-126, дексаметазон, (S)-фторметиловий ефір 6,9-дифтор-17-[(2-фуранілкарбоніл)окси]11-гідрокси-16-метил-3-оксоандроста-1,4-диєн17-карботіонівої кислоти, (S)-(2оксотетрагідрофуран-3S-іловий) ефір 6,9дифтор-11-гідрокси-16-метил-3-оксо-17пропіонилоксиандроста-1,4-диєн-17-карботіонівої кислоти й етипреднолдихлорацетат, необов'язково у вигляді їхніх рацематів, енантиомерів або діастереомерів і необов'язково у вигляді їхніх солей і похідних, їхніх сольватів і/або гідратів. У наступному кращому варіанті винахід відноситься до застосування солей тіотропію 1 для готування лікарського засобу, призначеного для підтримуючої терапії при персистуючій астмі середньої важкості й для попередження прояву бронхо-обструктивних симптомів у пацієнтів, які вже проходять курс підтримуючої регуляторної терапії інгалюємими кортикостероїдами, обраними із групи, що включає будесонід, флутиказон, мометазон, циклесонід, (S)-фторметиловий ефір 6,9-дифтор-17-[(2-фуранілкарбоніл)окси]-11гідрокси-16-метил-3-оксоандроста-1,4-диєн-17карботіонівої кислоти й етипреднолдихлорацетат, необов'язково у вигляді їхніх рацематів, енантиомерів або діастереомерів і необов'язково у вигляді їхніх солей і похідних, їхніх сольватів і/або гідратів. При будь-якім згадуванні в даному описі стероїдів маються на увазі також їх можливо існуючі солі або похідні, гідрати або сольвати. Як приклади можливих солей і похідних стероїдів можна назвати солі з лужними металами, такі, наприклад, як натрієві або калієві солі, сульфобензоати, фосфати, ізонікотинати, ацетати, пропіонати, дигідрофосфати, пальмітати, півалати або ж фуроати. У наступному кращому варіанті винахід відноситься до застосування солей тіотропію 1 для готування лікарського засобу, призначеного для підтримуючої терапії при персистуючій астмі середньої важкості й для попередження прояву бронхо-обструктивних симптомів у пацієнтів з генотипом Arg/Arg кодона 16 (хромосома 5), які вже проходять курс підтримуючої регуляторної терапії інгалюємими кортикостероїдами й довгостроково діючими 2-агоністами, обраними із групи, що включає албутерол, бамбутерол, бітолтерол, броксатерол, карбутерол, кленбутерол, фенотерол, формотерол, гексопреналін, ібутерол, ізоетарин, ізопреналін, левосалбутамол, мабутерол, мелуадрин, метапротеренол, оркипреналін, пірбутерол, прокатерол, репротерол, TD 3327, ритодрин, салметерол, салмефамол, сотеренот, сульфонтерол, тіарамід, тербуталін, толубутерол, CHF-4226 (ТА 2005 або кармотерол), HOKU-81, KUL-1248, 3-(4{6-[2-гідрокси-2-(4-гідрокси-3гідроксиметилфеніл)етиламіно]гексилокси}бутил)бензолсульфонамі д, 5-[2-(5,6-диетиліндан-2-іламіно)-1-гідроксиетил]8-гідрокси-1Н-хінолін-2-он, 4-гідрокси-7-[2-{[2-{[3(2-фенілетокси)пропіл]сульфоніл}етил]аміно}етил]2(3Н)-бензотіазолон, 1-(2-фтор-4-гідроксифеніл)-2[4-(1-бензімідазоліл)-2-метил-2-бутиламіно] етанол, 1-[3-(4-метоксибензиламіно)-4-гідроксифеніл]2-[4-(1-бензімідазоліл)-2-метил-2 95271 10 бутиламіно]етанол, 1-[2Н-5-гідрокси-3-оксо-4Н-1,4бензоксазин-8-іл]-2-[3-(4-N,N-диметиламінофеніл)2-метил-2-пропіламіно] етанол, 1-[2Н-5-гідрокси-3оксо-4Н-1,4-бензоксазин-8-іл]-2-[3-(4метоксифеніл)-2-метил-2-пропіламіно]етанол, 1[2Н-5-гідрокси-3-оксо-4Н-1,4-бензоксазин-8-іл]-2[3-(4-н-бутилоксифеніл)-2-метил-2пропіламіно]етанол, 1-[2Н-5-гідрокси-3-оксо-4Н1,4-бензоксазин-8-іл]-2-{4-[3-(4-метоксифеніл)1,2,4-тріазол-3-іл]-2-метил-2-бутиламіно} етанол, 5-гідрокси-8-(1-гідрокси-2-ізопропіламінобутил)-2Н1,4-бензоксазин-3-(4Н)-он, 1-(4-аміно-3-хлор-5трифторметилфеніл)-2-трет-бутиламіно)етанол, 1(4-етоксикарбоніламіно-3-циано-5-фторфеніл)-2(трет-бутиламіно)етанол і N-[2-гідрокси-5-(1гідрокси-2-{2-[4-(2-гідрокси-2фенілетиламіно)феніл]етиламіно}етил)феніл] формамід, необов'язково у вигляді їхніх рацематів, енантиомерів, діастереомерів і необов'язково у вигляді фармакологічно прийнятних кислотноадитивних солей і гідратів. У наступному кращому варіанті винахід відноситься до застосування солей тіотропію 1 для готування лікарського засобу, призначеного для підтримуючої терапії при важкій персистуючій астмі й для попередження прояву бронхо-обструктивних симптомів у пацієнтів з генотипом Arg/Arg кодона 16 (хромосома 5), які вже проходять курс підтримуючої регуляторної терапії інгалюємими кортикостероїдами й довгостроково діючими 2агоністами, обраними із групи, що включає бамбутерол, бітолтерол, карбутерол, кленбутерол, фенотерол, формотерол, гексопреналін, ібутерол, пирбутерол, прокатерол, репротерол, TD 3327, салметерол, сульфонтерол, тербуталін, толубутерол, CHF-4226 (ТА 2005 або кармотерол), 3-(4-{6[2-гідрокси-2-(4-гідрокси-3гідроксиметилфеніл)етиламіно]гексилокси}бутил) бензолсульфонамід, 5-[2-(5,6-диетиліндан-2іламіно)-1-гідроксиетил]-8-гідрокси-1Н-хінолін-2-он, 4-гідрокси-7-[2-{[2-{[3-(2фенілетокси)пропіл]сульфоніл}етил]аміно}етил]2(3Н)-бензотіазолон, 1-(2-фтор-4-гідроксифеніл)-2[4-(1-бензімідазоліл)-2-метил-2-бутиламіно]етанол, 1-[3-(4-метоксибензиламіно)-4-гідроксифеніл]-2-[4(1-бензімідазоліл)-2-метил-2-бутиламіно]етанол, 1[2Н-5-гідрокси-3-оксо-4Н-1,4-бензоксазин-8-іл]-2[3-(4-N,N-диметиламінофеніл)-2-метил-2пропіламіно]етанол, 1-[2Н-5-гідрокси-3-оксо-4Н1,4-бензоксазин-8-іл]-2-[3-(4-метоксифеніл)-2метил-2-пропіламіно]етанол, 1-[2Н-5-гідрокси-3оксо-4Н-1,4-бензоксазин-8-іл]-2-[3-(4-нбутилоксифеніл)-2-метил-2-пропіламіно]етанол, 1[2Н-5-гідрокси-3-оксо-4Н-1,4-бензоксазин-8-іл]-2{4-[3-(4-метоксифеніл)-1,2,4-тріазол-3-іл]-2-метил2-бутиламіно}етанол, 5-гідрокси-8-(1-гідрокси-2ізопропіламінобутил)-2Н-1,4-бензоксазин-3-(4Н)он, 1-(4-аміно-3-хлор-5-трифторметилфеніл)-2трет-бутиламіно)етанол, 1-(4-етоксикарбоніламіно3-циано-5-фторфеніл)-2-(трет-бутиламіно)етанол і N-[2-гідрокси-5-(1-гідрокси-2-{2-[4-(2-гідрокси-2фенілетиламіно)феніл]етиламіно}етил)феніл]формамід, необов'язково у вигляді їхніх рацематів, енантиомерів, діастереомерів і необов'язково у 11 вигляді фармакологічно прийнятних кислотноадитивних солей і гідратів. У наступному кращому варіанті винахід відноситься до застосування солей тіотропію 1 для готування лікарського засобу, призначеного для підтримуючої терапії при персистуючій астмі середньої важкості й для попередження прояву бронхо-обструктивних симптомів у пацієнтів з генотипом Arg/Arg кодона 16 (хромосома 5), які вже проходять курс підтримуючої регуляторної терапії інгалюємими кортикостероїдами й довгостроково діючими 2-агоністами, обраними із групи, що включає фенотерол, формотерол, салметерол, CHF-4226 (ТА 2005 або кармотерол), 3-(4-{6-[2гідрокси-2-(4-гідрокси-3гідроксиметилфеніл)етиламіно]гексилокси}бутил)бензолсульфонамі д, 5-[2-(5,6-диетиліндан-2-іламіно)-1-гідроксиетил]8-гідрокси-1Н-хінолін-2-он, 1-[3-(4метоксибензиламіно)-4-гідроксифеніл]-2-[4-(1бензімідазоліл)-2-метил-2-бутиламіно]етанол, 1[2Н-5-гідрокси-3-оксо-4Н-1,4-бензоксазин-8-іл]-2[3-(4-N,N-диметиламінофеніл)-2-метил-2пропіламіно]етанол, 1-[2Н-5-гідрокси-3-оксо-4Н1,4-бензоксазин-8-іл]-2-[3-(4-метоксифеніл)-2метил-2-пропіламіно]етанол, 1-[2Н-5-гідрокси-3оксо-4Н-1,4-бензоксазин-8-іл]-2-[3-(4-нбутилоксифеніл)-2-метил-2-пропіламіно]етанол, 1 [2Н-5-гідрокси-3-оксо-4Н-1,4-бензоксазин-8-іл]-2{4-[3-(4-метоксифеніл)-1,2,4-тріазол-3-іл]-2-метил2-бутиламіно}етанол і N-[2-гідрокси-5-(1-гідрокси2-{2-[4-(2-гідрокси-2фенілетиламіно)феніл]етиламіно}етил)феніл] формамід, необов'язково у вигляді їхніх рацематів, енантиомерів, діастереомерів і необов'язково у вигляді фармакологічно прийнятних кислотноадитивних солей і гідратів. Серед вищевказаних бетаміметиків особливо кращі формотерол, салметерол, CHF-4226 (ТА 2005 або кармотерол), 3(4-{6-[2-гідрокси-2-(4-гідрокси-3гідроксиметилфеніл)етиламіно]гексилокси}бутил)бензолсульфонамі д, 5-[2-(5,6-диетиліндан-2-іламіно)-1-гідроксиетил]8-гідрокси-1Н-хінолін-2-он і N-[2-гідрокси-5-(1гідрокси-2-{2-[4-(2-гідрокси-2фенілетиламіно)феніл]етиламіно}етил)феніл]формамід, необов'язково у вигляді їхніх рацематів, енантиомерів, діастереомерів і необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей і їхніх гідратів. Як приклади фармакологічно прийнятних кислотно-адитивних солей 2-агоністів відповідно до винаходу можна назвати фармацевтично прийнятні солі, обрані із солей соляної кислоти, бромистоводневої кислоти, сірчаної кислоти, фосфорної кислоти, метансульфонової кислоти, оцтової кислоти, фумарової кислоти, бурштинової кислоти, молочної кислоти, лимонної кислоти, винної кислоти, 1-гідрокси-2-нафталінкарбонової кислоти, 4фенілкоричної кислоти, 5-(2,4дифторфеніл)саліцилові кислоти й малеїнової кислоти. У деяких випадках для одержання солей 2-агоністів можна також використати суміші зазначених кислот. 95271 12 Переважні відповідно до винаходу солі 2агоністів, обрані із групи, що включає гідрохлорид, гідробромід, сульфат, фосфат, фумарат, метансульфонат, 4-фенілцинамат, 5-(2,4дифторфеніл)салицилат, малеат і ксинафоат. У випадку салметерола до найбільш кращих його солей відносяться солі із групи, що включає гідрохлорид, сульфат, 4-фенілцинамат, 5-(2,4дифторфеніл)салицилат і ксинафоат, серед яких особливе значення мають 4-фенілцинамат, 5-(2,4дифторфеніл)салицилат і насамперед ксинафоат. У випадку формотерола до найбільш кращих його солей відносяться солі із групи, що включає гідрохлорид, сульфат, гемифумарат і фумарат, серед яких особливо кращі гідрохлорид, гемифумарат і фумарат. Особливе значення відповідно до винаходу має дигідрат фумарата формотерола або гідрат гемифумарата формотерола. При будь-якім згадуванні в даному описі 2агоністів маються на увазі також їх відповідні енантіомери або їхньої суміші. У ще одному варіанті винахід відноситься до застосування солей тіотропію 1 для готування лікарського засобу, призначеного для лікування персистуючої астми середньої важкості в дитятпацієнтів, переважно в дітей молодше 14 років, більш переважно молодше 10 років, особливо переважно молодше 8 років, найбільше переважно молодше 6 років. В особливо кращому варіанті вік дітей становить менш 5 років. Ще одним об'єктом даного винаходу є зазначене вище застосування солей тіотропію 1, при якому їх уводять в організм у дозуванні, що з розрахунку на один прийом у кращому варіанті становить від 1 до 20 мкг, більш переважно від 2 до 15 мкг, тіотропію 1'. Наступним об'єктом даного винаходу є зазначене вище застосування солей тіотропію 1, при якому їх уводять в організм у дозуванні, що з розрахунку на один прийом становить від 5 до 10 мкг тіотропію 1'. Іншим об'єктом даного винаходу є зазначене вище застосування, при якому солі тіотропію 1 уводять в організм однократно або двічі в день, переважно однократно в день. Наступним об'єктом даного винаходу є зазначене вище застосування, при якому солі тіотропію 1 уводять в організм ранком або ввечері. Пропоноване у винаході застосування солей тіотропію 1 передбачає також їхнє застосування у вигляді утворених ними сольватів і гідратів, переважно гідратів, найбільше переважно моногідратів. На підставі наведених вище кількостей тіотропію 1', що відповідають його вмісту як діюча речовина в разовій дозі, можна легко розрахувати відповідні кількості, наприклад, тіотропійброміду й/або моногідрату тіотропійброміду. Золі тіотропію 1 відповідно до винаходу переважно вводити в організм шляхом інгаляції. Для цього солі тіотропію 1 необхідно переробляти в інгалюємі лікарські форми. Як приклад таких інгалюємих лікарських форм можна назвати інгаляційні порошки, дозовані аерозолі із пропелентом або інгаляційні розчини без пропелента. Інгаляційні порошки відповідно до винаходу містять солі тіотропію 1 необов'язково в суміші з фізіологічно не 13 шкідливими допоміжними речовинами. Відповідно до даного винаходу під вираженням "інгаляційні розчини без пропелента" маються на увазі також концентрати або стерильні, готові до застосування інгаляційні розчини. Подібні використовувані згідно із даним винаходом лікарські форми більш докладно розглянуті в наступній частині опису. Кращі відповідно до винаходу інгаляційні порошки зі вмістом тіотропію від 0,01 до 2%. Більше кращі для пропонованого у винаході застосування інгаляційні порошки, що містять тіотропій у кількості від приблизно 0,03 до 1%, переважно від 0,05 до 0,6%, найбільше переважно від 0,06 до 0,3%. Особливе значення відповідно до винаходу мають далі інгаляційні порошки зі вмістом тіотропію приблизно від 0,08 до 0,22%. Зазначені вище дані про вміст тіотропію відносяться до кількості тіотропійкатіону, що втримується в порошку. Використовувані в передбачених даним винаходом цілях допоміжні речовини одержують шляхом відповідного розмелу й/або просівання традиційними, відомими з рівня техніки методами. У деяких випадках застосовувані відповідно до винаходу допоміжні речовини можуть також являти собою їхні суміші, одержувані змішанням між собою різних фракцій тієї самої допоміжної речовини з різним середнім розміром її часток. Як приклад фізіологічно нешкідливих допоміжних речовин, які можуть використовуватися для одержання інгаляційних порошків, застосовуваних для виготовлення утримуючих їх пропонованих у винаході капсул (інгалеток), можна назвати моносахариди (наприклад, глюкозу, фруктозу або арабінозу), дисахариди (наприклад, лактозу, сахарозу, мальтозу, трегалозу), оліго- і полісахариди (наприклад, декстрани, декстрини, мальтодекстрин, крохмаль, целюлозу), поліспирти (наприклад, сорбіт, маніт, ксиліт), циклодекстрини (наприклад, циклодекстрин, -циклодекстрин, -циклодекстрин, метил--циклодекстрин, гідроксипропіл-циклодекстрин), амінокислоти (наприклад, гідрохлорид аргініну) або ж солі (наприклад, хлорид натрію, карбонат кальцію) або суміші зазначених допоміжних речовин. Переважно застосовувати моно- або дисахариди, при цьому особливо переважно застосування лактози або глюкози, насамперед, але не винятково, у формі їхніх гідратів. Особливо переважно відповідно до винаходу застосовувати як допоміжну речовину лактозу. Максимальний середній розмір часток використовуваних у пропонованих у винаході інгаляційних порошках допоміжних речовин досягає 250 мкм, переважно становить від 10 до 150 мкм, найбільше переважно від 15 до 80 мкм. За певних умов може виявитися доцільним домішувати до зазначеного вище допоміжним речовинам їх же фракції з меншим середнім розміром часток, що становлять від 1 до 9 мкм. Подібні допоміжні речовини з меншим розміром часток також вибирають із описаної вище групи допоміжних речовин, застосовуваних в інгаляційних порошках. Середній розмір часток можна визначати відомими з рівня техніки методами (див., наприклад, WO 02/30389, розділи А і С). Після готування суміші допоміжних речовин до неї для одержання пропонованих у 95271 14 винаході інгаляційних порошків домішують мікронізований кристалічний ангідрат тіотропійброміду із середнім розміром часток переважно від 0,5 до 10 мкм, найбільше переважно від 1 до 5 мкм (див., наприклад, WO 02/30389, розділ В). Методи розмелу й мікронізації діючих речовин відомі з рівня техніки. Якщо як допоміжна речовина не використається спеціально приготовлена суміш допоміжних речовин, то найбільше переважно застосовувати допоміжні речовини у вигляді часток, середній розмір яких становить від 10 до 50 мкм і серед яких 10% доводиться на частку дрібної фракції, у якій крупність часток становить від 0,5 до 6 мкм. При цьому під середнім розміром (або середньою крупністю) часток у даному контексті мається на увазі розмір 50% всіх часток, об'ємний розподіл яких по крупності визначали за допомогою лазерного дифрактометра методом сухого диспергування. Середній розмір часток можна визначати відомими з рівня техніки методами (див., наприклад, WO 02/30389, розділи А і С). Аналогічним образом під дрібною фракцією, на частку якої доводиться 10%, у даному контексті мається на увазі фракція, складова 10% від усієї кількості часток, об'ємний розподіл яких по крупності визначали за допомогою лазерного дифрактометра. Іншими словами, під дрібною фракцією, на частку якої доводиться 10%, згідно із даним винаходом мається на увазі фракція часток з розміром, що мають не більше 10% часток від усього їхньої кількості (у перерахуванні на їхній об'ємний розподіл по крупності). Відповідно до даного винаходу наведені у відсотках дані у всіх випадках, якщо конкретно не зазначене інше, являють собою масові відсотки (мас. %). У найбільш кращих інгаляційних порошках використовують допоміжну речовину із середнім розміром часток від 12 до 35 мкм, особливо переважно від 13 до 30 мкм. Найбільш кращі далі насамперед ті інгаляційні порошки, у яких розмір часток допоміжної речовини в дрібній фракції, на частку якої доводиться 10% від усього кількості часток допоміжної речовини, становить приблизно від 1 до 4 мкм, переважно приблизно від 1,5 до 3 мкм. Одна з відмінних рис пропонованих у винаході інгаляційних порошків складається відповідно до покладеного в основу винаходу завдання у можливості їхнього введення в організм зі стабільно високою точністю однократного дозування. При цьому коливання вводять за один раз кількостей інгаляційного порошку становлять менш 8%, переважно менш 6%, найбільше переважно менш 4%, від номінальної кількості. Після відмірювання зважуванням необхідних порцій вихідних матеріалів з допоміжної речовини й діючої речовини з використанням відомих з рівня техніки методів наготовлюють інгаляційний порошок. При цьому можна послатися, наприклад, на публікацію WO 02/30390. Відповідно до цього пропоновані у винаході інгаляційні порошки можна одержувати, наприклад, описаним нижче методом. У розглянутих нижче методах одержання інгаляційних порошків зазначені компоненти застосову 15 ють у масових кількостях, які відповідають кількостям, зазначеним вище при описі складів інгаляційних порошків. Спочатку у відповідний змішувач завантажуються допоміжна речовина й діюча речовина. Середній розмір часток використовуваної діючої речовини становить від 0,5 до 10 мкм, переважно від 1 до 6 мкм, найбільше переважно від 2 до 5 мкм. Діючу речовину й допоміжну речовину переважно подавати в змішувач через сито або ситовий гранулятор з розміром отворів сита від 0,1 до 2 мм, більш переважно від 0,3 до 1 мм, найбільше переважно від 0,3 до 0,6 мм. При цьому в змішувач переважно спочатку завантажувати допоміжну речовину, а потім подавати в змішувач діючу речовину. При такій технології змішання обидва компоненти переважно подавати окремими порціями. При цьому найбільш кращим є почергова подача в змішувач обох компонентів шляхом їхнього пошарового просівання в нього. Допоміжну речовину можна змішувати з діючою речовиною вже в процесі подачі обох цих компонентів у змішувач. Більш переважно, однак, починати змішання обох компонентів тільки по завершенні їхнього пошарового просівання в змішувач. Даний винахід відноситься також до застосування пропонованих у ньому інгаляційних порошків для готування фармацевтичної композиції, призначеної для лікування зазначеної вище важкої персистуючої астми. Пропоновані у винаході інгаляційні порошки можна вводити в організм, наприклад, за допомогою інгаляторів, у яких разова доза з видаткової ємності видається за допомогою дозуючої камери (наприклад, згідно US 4570630) або за допомогою інших пристроїв (наприклад, згідно DE 3625685). Переважно, однак, розфасовувати пропоновані у винаході інгаляційні порошки в капсули (з одержанням так званих інгалеток), які застосовуються в інгаляторах, описаних, наприклад, в WO 94/28958. Для введення в організм пропонованих у винаході інгаляційних порошків з утримуючих їхніх капсул найбільше переважно використати інгалятор, показаний, наприклад, на фіг. 1 у публікації WO 03/084502 A1, що включена в даний опис як посилання. Подібний інгалятор відрізняється наявністю корпуса 1 із двома віконцями 2, пластинчастої перегородки 3, у якій передбачені впускні отвори для повітря і яка постачена сіткою 5, утримуваної в зібраному стані відповідним кріпильним елементом 4, з'єднаної із пластинчастою перегородкою 3 камери 6, у яку міститься капсула з інгаляційним порошком і збоку якої передбачена натискна кнопка 9, постачена двома заточеними голками 7 і виконана рухливою проти зусилля пружини 8, мундштука 12, що виконаний відкидним з можливістю повороту навколо осі 10, що з'єднує його з корпусом 1, пластинчастою перегородкою 3 і ковпачком 11, і наскрізних отворів 13 для проходу повітря, службовців для регулювання аерогідродинамічного опору. При розфасовуванні пропонованих у винаході, що містять кристалічний тіотропійбромід інгаляційних порошків у капсули найбільше переважно використати капсули, матеріал яких вибирають із 95271 16 групи синтетичних полімерів, особливо переважно із групи, що включає поліетилен, полікарбонат, складні поліефіри, поліпропілен і поліетилентерефталат. Найбільш кращим синтетичним полімером як матеріал для виготовлення капсул є поліетилен, полікарбонат або поліетилентерефталат. При виготовленні капсул з поліетилена, що є одним із кращих відповідно до винаходу матеріалів, переважно застосовувати поліетилен із щільністю від 3 900 до 1000 кг/м , більш переважно від 940 до 980 3 кг/м , найбільше переважно приблизно від 960 до 3 970 кг/м (поліетилен високої щільності). Подібні полімерні матеріали при виготовленні з них капсул можна відповідно до винаходу переробляти різноманітними, відомими з рівня техніки методами. Кращим відповідно до винаходу методом переробки полімерів є лиття під тиском. При виготовленні капсул литтям під тиском відповідно до найбільше кращого варіанта не використають антиадгезійні змащення для витягу капсул з форми. Для подібного методу виготовлення капсул характерна добре відпрацьована на практиці технологія й особливо висока відтворюваність. Ще одним об'єктом даного винаходу є описані вище капсули, що містять пропонований у винаході інгаляційний порошок, описаний вище. Вміст інгаляційного порошку в таких капсулах може становити приблизно від 1 до 20 мг, переважно приблизно від 3 до 15 мг, найбільше переважно приблизно від 4 до 12 мг. Кращі відповідно до винаходу капсули містять від 4 до 6 мг інгаляційного порошку. Так само кращі відповідно до винаходу й капсули для інгаляції, що містять пропоновані у винаході порошкові композиції в кількості від 8 до 12 мг. Даний винахід відноситься далі до застосування описаних вище капсул, що містять пропоновані у винаході інгаляційні порошки, для готування фармацевтичної композиції, призначеної для лікування описаної вище персистуючої астми середньої важкості. Заповнені пропонованими у винаході інгаляційними порошками капсули виготовляють відомими з рівня техніки методами шляхом розфасовування пропонованих у винаході інгаляційних порошків у порожні капсули. Приклади інгаляційних порошків Нижче винахід більш докладно розглянутий на прикладах, при цьому, однак, обсяг винаходу не обмежений представленими в цих прикладах конкретними варіантами його здійснення. У розглянутих нижче прикладах вміст діючої речовини в порошковій суміші зазначено в перерахуванні на її порцію масою 5,5 мг. Виходячи з концентрацій, наведених нижче в прикладах порошкових фармацевтичних композицій, можна також наготовлювати порошки з більшою масою однієї їхньої порції. Крім діючої речовини порошкова суміш містить тільки зазначену в прикладах допоміжну речовину. Порошки, склад яких зазначений у наведених нижче прикладах, можна розфасовувати в капсули для інгаляції з них за допомогою відповідних інгаляторів. В іншому варіанті для введення в організм порошків, склад яких зазначений у наведених нижче прикладах, можна 17 використати багатодозові інгалятори сухих порошків (МДІСП). Подібні МДІСП підрозділяються на інгалятори, у яких порошок утримується в попередньо розділеному на разові дози виді, і на дозуючі інгалятори, які самі дозують порошок з ємності, що перебуває в них, з ними. Відповідні пристрої відомі з рівня техніки. Приклад композиції 1 моногідрат тіотропійброміду 0,0225 мг моногідрат лактози до 5,5 мг Приклад композиції 2 тіотропійбромід 0,0226 мг моногідрат лактози до 5,5 мг Приклад композиції 3 ангідрат тіотропійброміду 0,0225 мг моногідрат лактози до 5,5 мг Приклад композиції 4 ангідрат тіотропійброміду 0,0111 мг моногідрат лактози до 5,5 мг Приклад композиції 5 ангідрат тіотропійброміду 0,0226 мг моногідрат лактози* до 5,5 мг * Лактоза містить 5% спеціально доданої до неї дрібної фракції мікронізованого моногідрату лактози із середнім розміром часток приблизно 4 мкм. Приклад композиції 6 моногідрат тіотропійброміду 0,0225 мг моногідрат лактози* до 5,5 мг * Лактоза містить 5% спеціально доданої до неї дрібної фракції мікронізованого моногідрату лактози із середнім розміром часток приблизно 4 мкм. Приклад композиції 7 ангідрат тіотропійброміду 0,0112 мг моногідрат лактози* до 5,5 мг * Лактоза містить 5% спеціально доданої до неї дрібної фракції мікронізованого моногідрату лактози із середнім розміром часток приблизно 4 мкм. Суспензії із пропелентом для аерозольної інгаляції Сіль тіотропію при необхідності можна також уводити в організм у складі утримуючих пропелент лікарських форм для аерозольної інгаляції. Для застосування в цих цілях найбільш придатні суспензії для аерозольної інгаляції. Відповідно до цього даний винахід відноситься також до суспензій пропонованого у винаході кристалічного тіотропійброміду в пропелентах HFA 227 і/або HFA 134а, необов'язково в суміші із ще одним або декількома іншими пропелентами, переважно обраними із групи, що включає пропан, бутан, пентан, диметиловий ефір, СНСl2, CH2F2, CF3CH3, ізобутан, ізопентан і неопентан. Згідно винаходу кращі суспензії, які в якості пропелента містять тільки HFA 227, суміш із HFA 227 і HFA 134а або тільки HFA 134а. При використанні в пропонованих у винаході композиціях у вигляді суспензій суміші пропелентів HFA 227 і HFA 134а співвідношення по масі між обома цими компонентами може варіюватися довільно. При використанні в пропонованих у винаході композиціях у вигляді суспензій поряд із пропелентами HFA 227 і/або HFA 134а ще одного або декількох інших пропелентів, обраних із групи, що включає пропан, бутан, пентан, диметиловий ефір, СНСl2, CH2F2, CF3CH3, ізобутан, ізопентан і неопентан, на 95271 18 частку цих інших пропелентів переважно повинно доводитися менш 50%, більш переважно менш 40%, найбільше переважно менш 30%. Пропоновані у винаході суспензії в кращому варіанті повинні містити тіотропійбромід у такій кількості, що відповідає вмісту тіотропій-катіону від 0,001 до 0,8%, більш переважно від 0,08 до 0,5%, найбільше переважно від 0,2 до 0,4%. Відповідно до даного винаходу наведені у відсотках дані, якщо не зазначене інше, завжди являють собою масові відсотки (мас. %). У деяких випадках у даному описі замість поняття "суспензія" використовується також поняття "композиція у вигляді суспензії". Обоє ці поняття відповідно до винаходу є рівнозначними. До складу пропонованих у винаході утримуючих пропелент композицій для аерозольної інгаляції, відповідно композицій у вигляді суспензій можуть входити й інші компоненти, такі як поверхнево-активні речовини (ПАВ), ад'юванти, антиокислювачі або смакові речовини. Поверхнево-активні речовини, що включають у деяких випадках у склад пропонованих у винаході суспензій переважно вибирати із групи, що включає полісорбат 20, полісорбат 80, мівацет (Myvacet) 9-45, мівацет 9-08, ізопропілмірістат, олеїнову кислоту, пропіленгліколь, поліетиленгліколь, бридж (Brij), етилолеат, гліцерилтриолеат, гліцерилмонолаурат, гліцерилмоноолеат, гліцерилмоностеарат, гліцерилмонорицинолеат, цетиловий спирт, стеариловий спирт, цетилпіридинійхлорид, блоксополімери, природне масло, етанол і ізопропанол. Із числа вищевказаних допоміжних речовин у суспензіях переважно використати полісорбат 20, полісорбат 80, мівацет 9-45, мівацет 908 або ізопропілмірістат. Найбільш краще застосування мівацета 9-45 або ізопропілмірістата. При включенні до складу пропонованих у винаході суспензій поверхнево-активних речовин їхній вміст переважно повинний становити від 0,0005 до 1%, найбільше переважно від 0,005 до 0,5%. Ад'юванти, що включають у деяких випадках у склад пропонованих у винаході суспензій, переважно вибирати із групи, що включає аланін, альбумін, аскорбінову кислоту, аспартам, бетаїн, цистеїн, фосфорну кислоту, азотну кислоту, соляну кислоту, сірчану кислоту й лимонну кислоту. Більш переважно при цьому використати аскорбінову кислоту, фосфорну кислоту, соляну кислоту або лимонну кислоту, серед яких найбільш краща соляна кислота або лимонна кислота. При включенні до складу пропонованих у винаході суспензій ад'ювантів їхній вміст переважно повинний становити від 0,0001 до 1,0%, більш переважно до 0,0005 до 0,1%, особливо переважно від 0,001 до 0,01%, а найбільш кращий відповідно до винаходу інтервал значень вмісту ад'ювантів становить від 0,001 до 0,005%. Що включають у деяких випадках у склад пропонованих у винаході суспензій антиокислювачі переважно вибирати із групи, що включає аскорбінову кислоту, лимонну кислоту, едетат натрію, едитинову кислоту, токофероли, бутилгідрокситолуол, бутилгідроксианізол і аскорбилпальмітат, із 19 числа яких найбільше переважно використати токофероли, бутилгідрокситолуол, бутилгідроксианізол або аскорбилпальмітат. Смакові речовини, що включають у деяких випадках у склад пропонованих у винаході суспензій або добавки переважно вибирати із групи, що включає м'яту перцеву, сахарин, Dentomint®, аспартам і ефірні масла (наприклад, коричне, ганусове, ментолове, камфорне), із числа яких найбільше переважно використати, наприклад, м'яту перцеву або Dentomint®. З огляду на те, що пропоновані у винаході суспензії передбачається вводити в організм шляхом інгаляції, що втримуються в них, діючі речовини повинні бути представлені у високодисперсній формі. Для цього пропонований у винаході кристалічний тіотропійбромід або піддають розмелу (мікронізують), або безпосередньо одержують у високодисперсній формі відомими з рівня техніки методами. Методи мікронізації діючих речовин відомі з рівня техніки. Середній розмір часток діючої речовини після його мікронізації переважно повинен становити від 0,5 до 10 мкм, більш переважно від 1 до 6 мкм, найбільше переважно від 1,5 до 5 мкм. У кращому варіанті розміри щонайменше 50%, більш переважно щонайменше 60%, найбільше переважно щонайменше 70%, часток діючої речовини повинні лежати в зазначеному вище інтервалі значень. У найбільш кращому варіанті розміри щонайменше 80%, особливо переважно щонайменше 90%, часток діючих речовин повинні лежати в зазначених вище інтервалах значень. Ще одним об'єктом винаходу є суспензії, які містять тільки одну із пропонованих у винаході діючих речовин і не містять ніяких інших добавок. Пропоновані у винаході суспензії можна одержувати відомими з рівня техніки методами. Відповідно до них компоненти суспензії змішують із пропелентом або пропелентами (при необхідності при низьких температурах) і потім отриману суспензію розфасовують у відповідні ємності. Для введення в організм описаних вище пропонованих у винаході суспензій із пропелентом можуть використатися відомі з рівня техніки інгалятори (що перебувають під тиском інгалятори з дозувальною шкалою). Відповідно до цього ще одним об'єктом даного винаходу є фармацевтичні композиції у вигляді описаних вище суспензій у сполученні з одним або декількома придатними для їхнього введення в організм інгаляторами. Ще одним об'єктом даного винаходу є інгалятори, що відрізняються тим, що вони містять описані вище пропоновані у винаході суспензії із пропелентом. Даний винахід відноситься також до ємностей (змінним балончикам), які будучи оснащені відповідним клапаном можуть використатися у відповідному інгаляторі і які містять одну з описаних вище пропонованих у винаході суспензій із пропелентом. Подібні ємності (змінні балончики) і способи їхнього заповнення пропонованими у винаході суспензіями із пропелентом відомі з рівня техніки. З урахуванням фармацевтичної ефективності тіотропію даний винахід відноситься далі до застосування пропонованих у ньому суспензій для 95271 20 одержання введеної в організм шляхом інгаляції або назально фармацевтичної композиції, переважно для одержання фармацевтичної композиції, призначеної для інгаляційного або назального лікування захворювань, при яких антихолінергічні засоби здатні проявляти терапевтичний ефект. В особливо кращому варіанті даний винахід відноситься далі до застосування пропонованих у ньому суспензій для одержання фармацевтичної композиції, призначеної для інгаляційного лікування описаної вище персистуючої астми середньої важкості. Нижче даний винахід більше докладно пояснюється на прикладах, які носять винятково ілюстративний характер і не обмежують його обсяг. Приклади композицій у вигляді суспензій для аерозольної інгаляції Нижче представлені приклади суспензій, що містять поряд з діючою речовиною й пропелентом інші компоненти. Приклад композиції 8 Концентрація Компоненти [мас. %] моногідрат тіотропійброміду 0,08 олеїнова кислота 0,005 HFA-227 до 100 Приклад композиції 9 Концентрація Компоненти [мас. %] моногідрат тіотропійброміду 0,04 олеїнова кислота 0,01 HFA-227 60,00 HFA-134a до 100 Прикладкомпозиції 10 Концентрація Компоненти [мас. %] моногідрат тіотропійброміду 0,04 ізопропілмірістат 1,00 HFA-227 до 100 Приклад композиції 11 Концентрація Компоненти [мас. %] моногідрат тіотропійброміду 0,04 мівацет 9-45 0,3 HFA-227 до 100 Приклад композиції 12 Концентрація Компоненти [мас. %] ангідрат тіотропійброміду 0,04 мівацет 9-45 0,1 HFA-227 60,00 HFA-134a до 100 Приклад композиції 13 Концентрація Компоненти [мас. %] ангідрат тіотропійброміду 0,04 полісорбат 80 0,04 HFA-227 до 100 Приклад композиції 14 Концентрація Компоненти [мас. %] ангідрат тіотропійброміду 0,02 полісорбат 20 0,20 HFA-227 до 100 Приклад композиції 15 21 Компоненти ангідрат тіотропійброміду мівацет 9-08 HFA-227 Приклад композиції 16 95271 Концентрація [мас. %] 0,04 01,00 до 100 Концентрація [мас. %] ангідрат тіотропійброміду 0,04 ізопропілмірістат 0,30 HFA-227 20,00 HFA-134a до 100 Нижче представлені приклади суспензій, що містять тільки діючу речовину й пропелент. Приклад композиції 17 Концентрація Компоненти [мас. %] ангідрат тіотропійброміду 0,03 HFA-227 60,00 HFA-134a до 100 Приклад композиції 18 Компоненти Концентрація [мас. %] ангідрат тіотропійброміду 0,04 HFA-227 до 100 Приклад композиції 19 Компоненти Концентрація [мас. %] ангідрат тіотропійброміду 0,04 HFA-134a до 100 Приклад композиції 20 Концентрація Компоненти [мас. %] ангідрат тіотропійброміду 0,04 HFA-227 до 100 Приклад композиції 21 Концентрація Компоненти [мас. %] ангідрат тіотропійброміду 0,04 HFA-134a до 100 Приклад композиції 22 Концентрація Компоненти [мас. %] ангідрат тіотропійброміду 0,02 HFA-227 20,00 HFA-134a 79,98 Композиції для аерозольної інгаляції без пропелента Пропоновані у винаході солі тіотропію 1 особливо переважно використати для готування на їхній основі інгаляційних розчинів і інгаляційних суспензій без пропелента. Як такі розчини можуть використовуватися водні або спиртові, переважно етанольні, розчини. Розчинником при цьому може служити тільки вода або суміш води з етанолом. Відносний вміст етанола в перерахуванні на кількість води не обмежено якими-небудь конкретними межами, переважно, однак, щоб максимальний вміст етанола становило до 70 об. %, насамперед до 60 об. %, найбільше переважно до 30 об. %. Інша кількість, що бракує до 100 об. %, доводиться на воду. Значення ρ розчинів або суспензій, що містять солі тіотропію 1, установлюють за допомогою придатних для цієї мети кислот на 2-7, переважно на 2-5. Більш переважно встановлювати Компоненти 22 значення ρ інгаляційних розчинів або суспензій на 2,8-3,05, переважно на 2,85-3,0, найбільше переважно на 2,9. Для регулювання значення ρ з метою його установки на зазначені вище значення можуть використовуватися кислоти із числа неорганічних або органічних кислот. Як приклад кращих щодо цього неорганічних кислот можна назвати соляну кислоту, бромистоводородную кислоту, азотну кислоту, сірчану кислоту й/або фосфорну кислоту. Як приклад найбільш придатних для застосування в зазначених цілях органічних кислот можна назвати аскорбінову кислоту, лимонну кислоту, яблучну кислоту, винну кислоту, малеїнову кислоту, бурштинову кислоту, фумарову кислоту, оцтову кислоту, мурашину кислоту й/або пропіонову кислоту, а також інші кислоти. Кращими неорганічними кислотами є соляна кислота й сірчана кислота. Можливо також використання кислот, які з одним з діючих речовин уже утворять кислотно-адитивну сіль. Серед органічних кислот кращі аскорбінова кислота, фумарова кислота й лимонна кислота. За певних умов припустимі використання й сумішей зазначених кислот, насамперед у випадку тих кислот, які поряд з їхньою підвищувальною кислотність властивостями володіють і іншими властивостями, наприклад, можуть використовуватися як смакові речовини, антиокислювачів або комплексоутворювачів, як, наприклад, лимонна кислота або аскорбінова кислота. Для регулювання значення ρ відповідно до винаходу найбільше переважно використати соляну кислоту. Відповідно до винаходу можна відмовитися від включення до складу інгаляційних розчинів або суспензій едитинової кислоти (ЕДТК) або однієї з її відомих солей, зокрема едетата натрію, як стабілізатора або комплексоутворювача. Однак в інших варіантах передбачається використання цього(-їх) сполуки(-ів). В одному з таких кращих варіантів, у якому передбачене застосування едетата натрію, його концентрація в розчині становить менш 100 мг на 100 мол, переважно менш 50 мг на 100 мол, найбільше переважно менш 20 мг на 100 мол. У цілому ж кращі інгаляційні розчини, у яких вміст едетата натрію становить від 0 до 10 мг на 100 мол. До інгаляційних розчинів без пропелента можна додавати сорозчинники й/або інші допоміжні речовини. У якості таких сорозчинників переважно використовувати такі, які містять гідроксильні групи або інші полярні групи, наприклад, спирти, насамперед ізопропіловий спирт, гліколи, насамперед пропіленгліколь, поліетиленгліколь, поліпропіленгліколь, гліколевий ефір, гліцерин, поліоксиетиленові спирти й ефіри поліоксиетилена й жирних кислот. Під допоміжними речовинами й добавками в даному контексті мається на увазі будь-яка фармакологічно прийнятна речовина, що не є діючою речовиною, але яку можна включати до складу препарату разом з діючим(-и) речовиною(-ами) у фармакологічно прийнятному розчиннику для поліпшення якісних характеристик такого препарату. Ці речовини не повинні проявляти ніякого або з обліком цільового терапевтичного ефекту ніякого скільки-небудь значного або що 23 95271 найменше ніякої небажаної фармакологічної дії. До подібних до допоміжних речовин і добавкам відносяться, наприклад, поверхнево-активні речовини, такі як соєвий лецитин, олеїнова кислота, сорбітановий ефір, зокрема полісорбати, полівінілпіролідон, інші стабілізатори, комплексоутворювачі, антиокислювачі й/або консерванти, що забезпечують схоронність готового лікарського препарату або що дозволяють продовжити строк його придатності, смакові речовини, вітаміни й/або інші відомі з рівня техніки добавки. До таких добавок відносяться також фармакологічно прийнятні солі, такі, наприклад, як хлорид натрію, у якості що надають ізотонічність агентів. До числа кращих допоміжних речовин відносяться антиокислювачі, такі, наприклад, як аскорбінова кислота, якщо тільки вона вже не використовується для регулювання значення pH, вітамін А, вітамін Е, токофероли й аналогічні вітаміни, що зустрічаються в організмі людини, і провітаміни. Консерванти можуть використовуватися для захисту лікарського препарату від зараження патогенними мікроорганізмами. Як подібні консерванти можуть використовуватися відомі з рівня техніки речовини, насамперед цетилпіридинійхлорид, бензалконійхлорид або бензойна кислота, відповідно бензоати, такі як бензоат натрію. Особливе значення має при цьому застосування бензалконійхлориду в концентраціях, що становлять до 50 мг на 100 мол розчину, більш переважно від 5 до 20 мг на 100 мол розчину, найбільше переважно від 8 до 15 мг на 100 мол розчину. Переважні лікарські препарати крім розчинника, яким є вода, і солей тіотропію 1 містять також тільки бензалконійхлорид і едетат натрію. В іншому кращому варіанті пропонується повністю відмовитися від застосування едетата натрію. Для введення в організм інгаляційних розчинів без пропелента, які можуть застосовуватися згідно із даним винаходом для лікування персистуючої астми середньої важкості, найбільш придатні такі інгалятори, які дозволяють протягом декількох секунд розпорошувати невелику кількість рідкого препарату в терапевтично необхідному дозуванні 24 у вигляді аерозолю, що вводять в організм інгаляцією в терапевтичних цілях. Згідно із даним винаходом кращі інгалятори, які в оптимальному випадку вже при однократному приведенні їх у дію (за один хід поршня) дозволяють видавати, що розпорошили у виді аерозолю із середнім розміром крапельок менш 20 мкм, переважно менш 10 мкм, розчин діючої речовини або діючих речовин порцією менш 100 мкл, переважно менш 50 мкл, найбільше переважно від 10 до 30 мкл, таким чином, щоб інгалюєма, тобто безпосередньо попадає в дихальні шляхи, частка аерозолю вже відповідала терапевтично ефективній кількості діючої речовини або діючих речовин. Подібний пристрій, призначений для інгаляційного введення в організм рідкої фармацевтичної композиції, що розпорошує в дозованих кількостях у вигляді аерозолю без допомоги пропелента, докладно розглянуто, наприклад, у публікації WO 91/14468, а також у публікації WO 97/12687 (зокрема, представлено на фіг. 6а і 6b прикладених до цієї публікації креслень). Описані в зазначених публікаціях розпилювачі або інгалятори (пристрої) відомі також за назвою Respimat®. Концентрація солі тіотропію в перерахуванні на частку тіотропію в готовому лікарському препараті залежить від необхідного терапевтичного ефекту. При більшості захворювань, що піддаються лікуванню тіотропієм, його використовують у концентрації від 0,01 до 0,06 м на 100 мол лікарського препарату. Більш переважно використати тіотропій у кількості від 0,015 до 0,055 м на 100 мол лікарського препарату, особливо переважно від 0,02 до 0,05 м на 100 мол лікарського препарату. Найбільше ж переважно згідно із даним винаходом використати тіотропій у кількості від 0,023(0,001 до 0,045(0,001 м на 100 мол лікарського препарату. Прикладикомпозицій для аерозольної інгаляції без пропелента У наведеній нижче таблиці вміст компонентів зазначений у перерахуванні на 100 мол лікарського препарату. Таблиця Приклад Тіотропій* Відповідність вмісту моногідрату тіотропію 23 24 25 26 27 28 29 30 31 32 22,624 мг 45,249 мг 22,624 мг 45,249 мг 22,624 мг 45,249 мг 22,624 мг 45,249 мг 22,624 мг 45,249 мг 28,267 мг 56,534 мг 28,267 мг 56,534 мг 28,267 мг 56,534 мг 28,267 мг 56,534 мг 28,267 мг 56,534 мг Вміст бензалконійхлорида Вміст динатрійедетата 10 мг 10 мг 10 мг 10 мг 10 мг 10 мг 10 мг 10 мг 10 мг 10 мг 10 мг 10 мг 10 мг 10 мг 10 мг 10 мг 10 мг 10 мг 10 мг 10 мг Значення pH, установлене за допомогою НСl (1н.) 2,9 2,9 2,8 2,8 3,0 3,0 2,7 2,7 3,1 3,1 *Примітка: зазначена кількість тіотропію відноситься до вмісту тіотропій-катіону, що представляє собою активний початок у складі тіотропійброміду, 1 мг тіотропію відповідає 1,2494 мг моногідрату тіотропійброміду 25 95271 Компонентом, що залишився, лікарських препаратів у прикладах 23-28 є очищена вода або 3 вода для ін'єкцій із щільністю 1, 00 г/см при температурі від 15 до 31°С. При використанні інгалятора Respimat® для введення в організм представлених вище лікарських препаратів видана при дворазовому його приведенні в дію порція лікарського препарату становить 22,1 мкл. Відповідно до цього доза тіотропію (у перерахуванні на тіотропій-катіон) при дворазовому аерозольному розпиленні лікарських препаратів із прикладів 23, 25 і 27 за допомогою такого інгалятора становить 5 мкг. При дворазовому ж аерозольному розпиленні лікарських препаратів із прикладів 24, 26 і 28 за допомогою подібного інгалятора доза тіотропію (у перерахуванні на тіотропій-катіон) становить 10 мкг. Залежно від стану пацієнта лікарський препарат можна також уводити в організм за допомогою Комп’ютерна верстка Л.Литвиненко 26 зазначеного інгалятора, наприклад, підряд 3-ма або 4-ма порціями. Додаткові приклади 33-42 Аналогічно прикладам 23-32, але зі вмістом едетата натрію 8 мг. Додаткові приклади 43-52 Аналогічно прикладам 23-32, але зі вмістом едетата натрію 12 мг. Додаткові приклади 53-62 Аналогічно прикладам 23-32, але зі вмістом бензалконійхлорида 8 мг. Додаткові приклади 63-72 Аналогічно прикладам 23-32, але зі вмістом бензалконійхлорида 12 мг. Серед лікарських препаратів (фармацевтичних композицій) із прикладів 23-32 особливий інтерес представляють лікарські препарати із прикладів 23-28, а найбільший інтерес представляють лікарські препарати із прикладів 23 і 24. Підписне Тираж 23 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of tiotropium salts in the treatment of moderate persistent asthma
Автори англійськоюEngel Michael, Heinrichs Stefan
Назва патенту російськоюПрименение солей тиотропия для лечения персистирующей астмы средней тяжести
Автори російськоюЭнгель Михаэль, Хайнрихс Штефан
МПК / Мітки
МПК: A61K 31/381, A61P 11/06
Мітки: тіотропію, середньої, тяжкості, солей, астми, персистуючої, лікування, застосування
Код посилання
<a href="https://ua.patents.su/13-95271-zastosuvannya-solejj-tiotropiyu-dlya-likuvannya-persistuyucho-astmi-seredno-tyazhkosti.html" target="_blank" rel="follow" title="База патентів України">Застосування солей тіотропію для лікування персистуючої астми середньої тяжкості</a>
Попередній патент: Продукт, що включає мікрокапсули, спосіб його одержання, застосування та спосіб боротьби із сільськогосподарськими шкідниками або їх контролю
Наступний патент: Щитове кріплення
Випадковий патент: Пристрій "штучна печінка"












