Анти-cd48 антитіло та його застосування
Номер патенту: 108514
Опубліковано: 12.05.2015
Автори: Дуан Ксунбао, Классон Брендан Дж., Костік Ана
Формула / Реферат
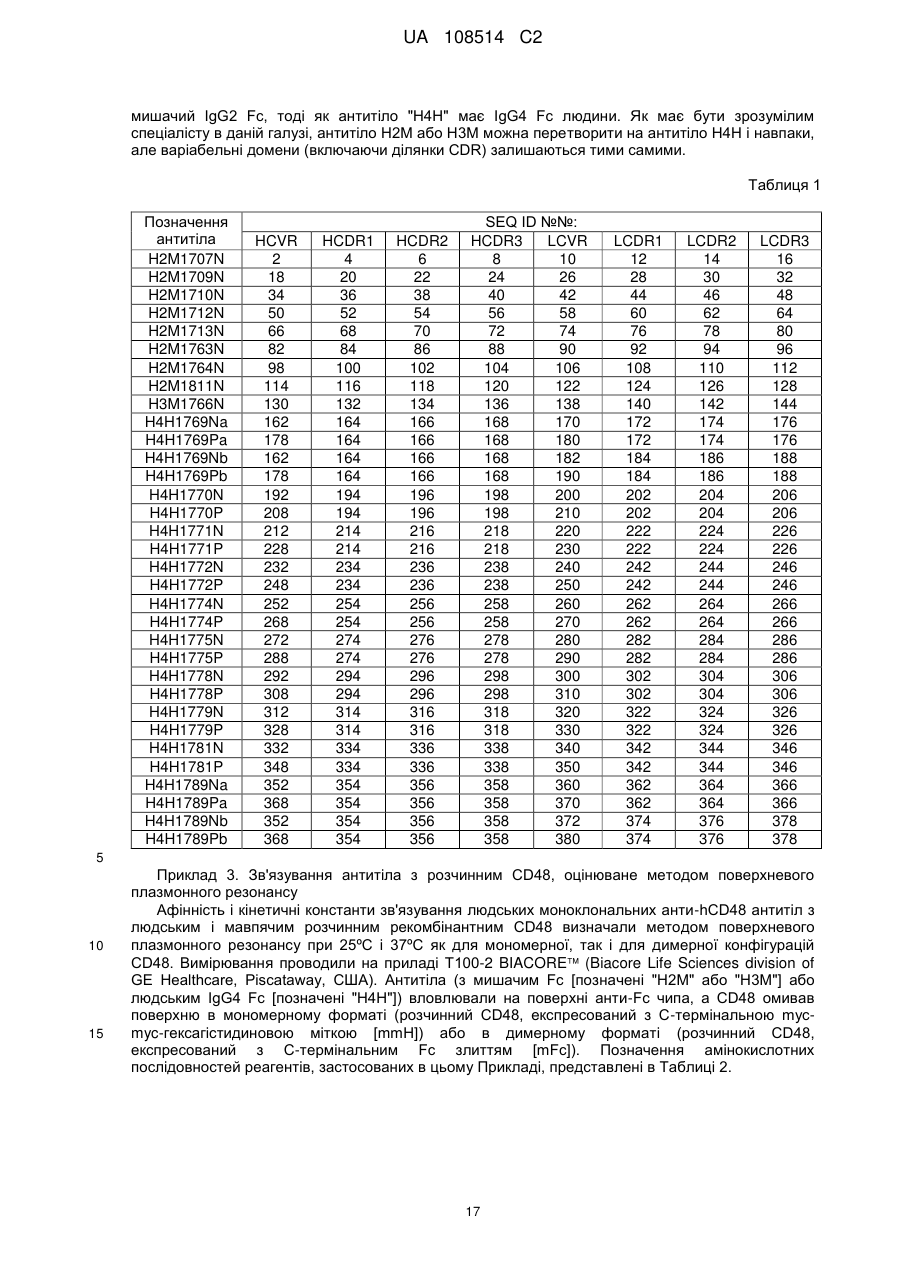
1. Виділене антитіло або його антигензв'язуючий фрагмент, що специфічно зв'язує людський CD48 (SEQ ID NO: 384) і блокує взаємодію між людським CD48 і рецептором CD48, де зазначене антитіло або його антигензв'язуючий фрагмент містить домени ділянки, що визначають комплементарність (CDR) важкого і легкого ланцюгів, що містяться в амінокислотній послідовності SEQ ID NO: 368 варіабельної ділянки важкого ланцюга (HCVR) та амінокислотній послідовності SEQ ID NO: 370 варіабельної ділянки легкого ланцюга (LCVR).
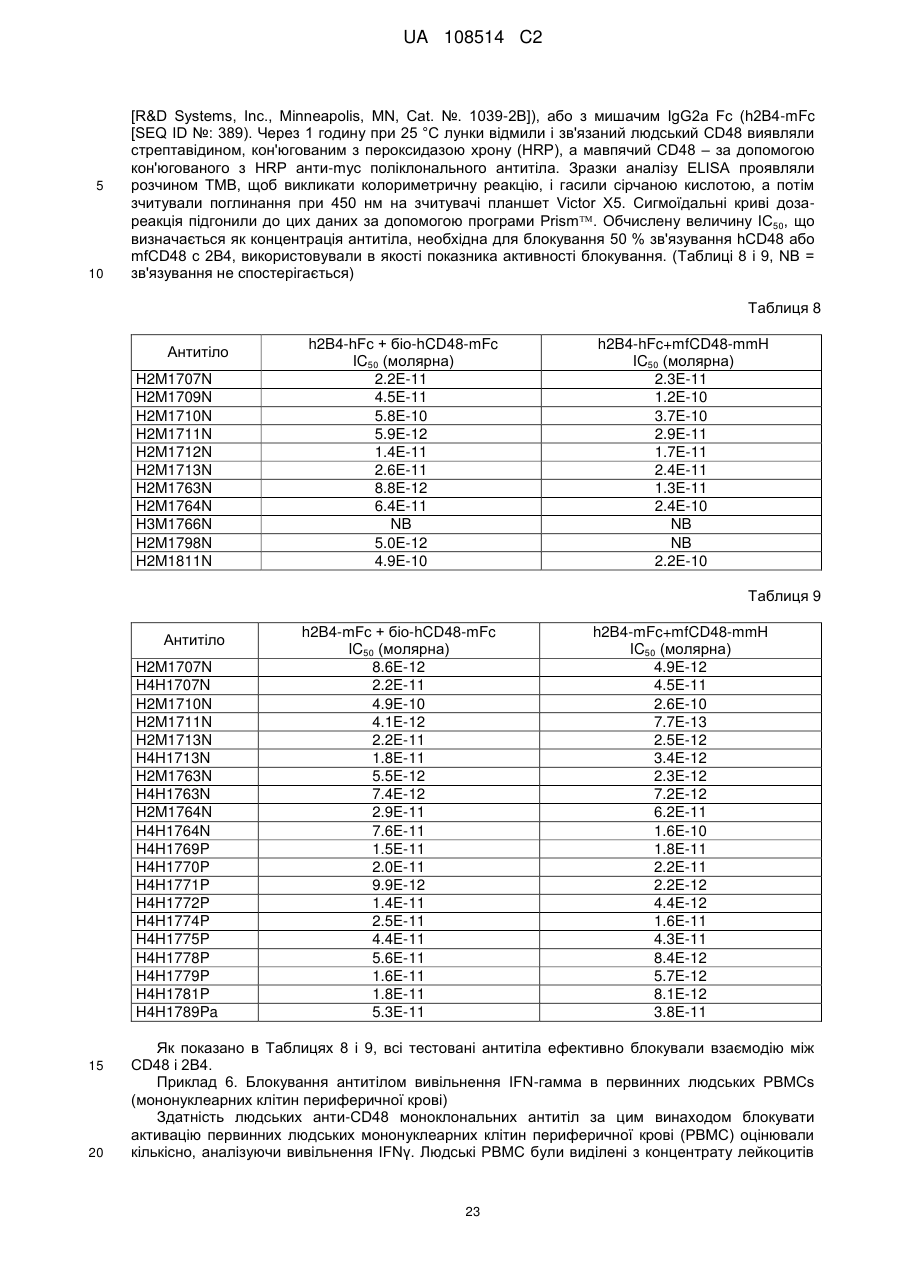
2. Антитіло або антигензв'язуючий фрагмент за п. 1, в якому рецептором CD48 є людський CD2 (SEQ ID NO: 392).
3. Антитіло або антигензв'язуючий фрагмент за п. 1, в якому рецептором CD48 є людський 2В4 (SEQ ID NO: 390).
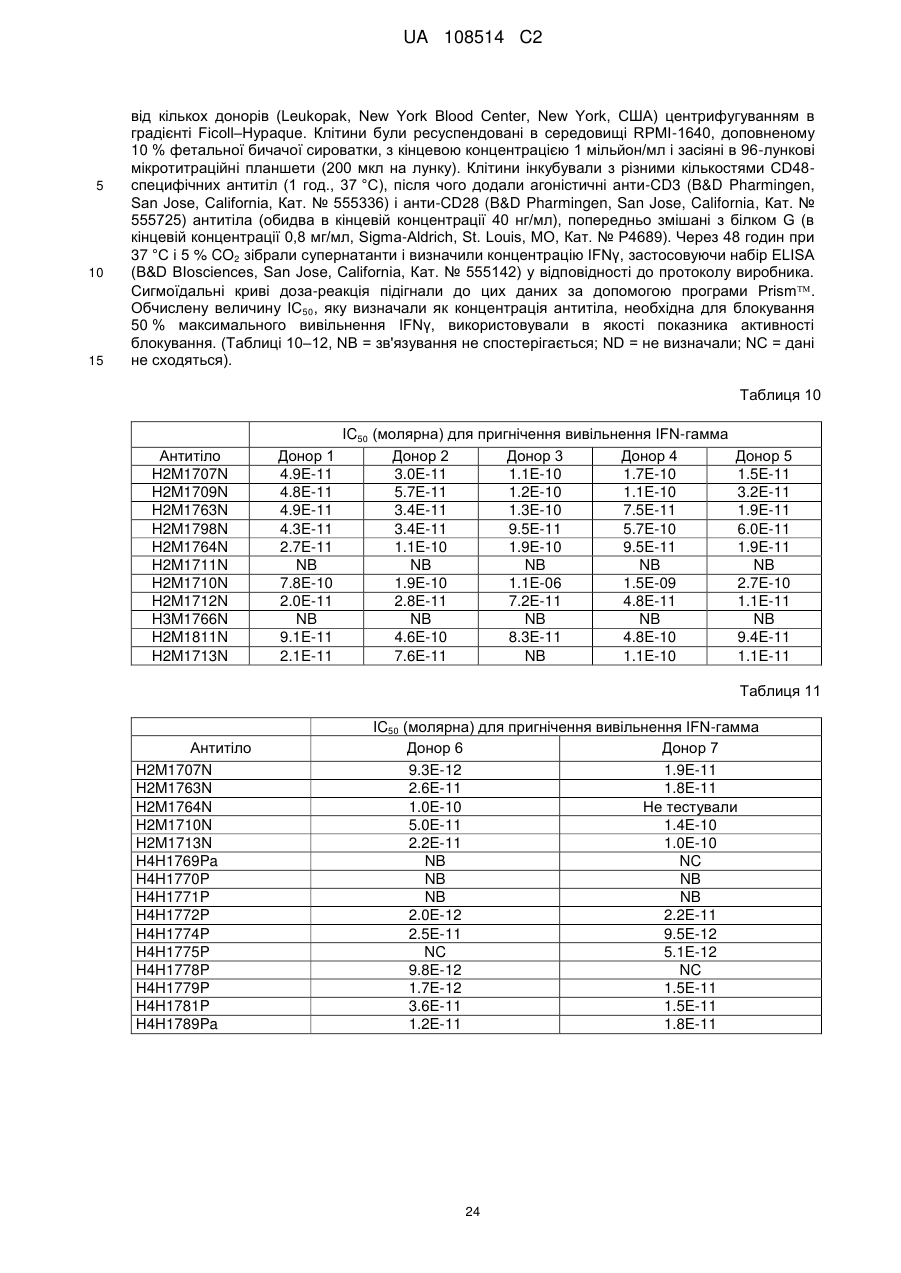
4. Антитіло або антигензв'язуючий фрагмент за будь-яким із пп. 1-3, в якому антитіло або антигензв'язуючий фрагмент пригнічує активацію первинних людських мононуклеарних клітин периферичної крові (PBMCs) in vitro.
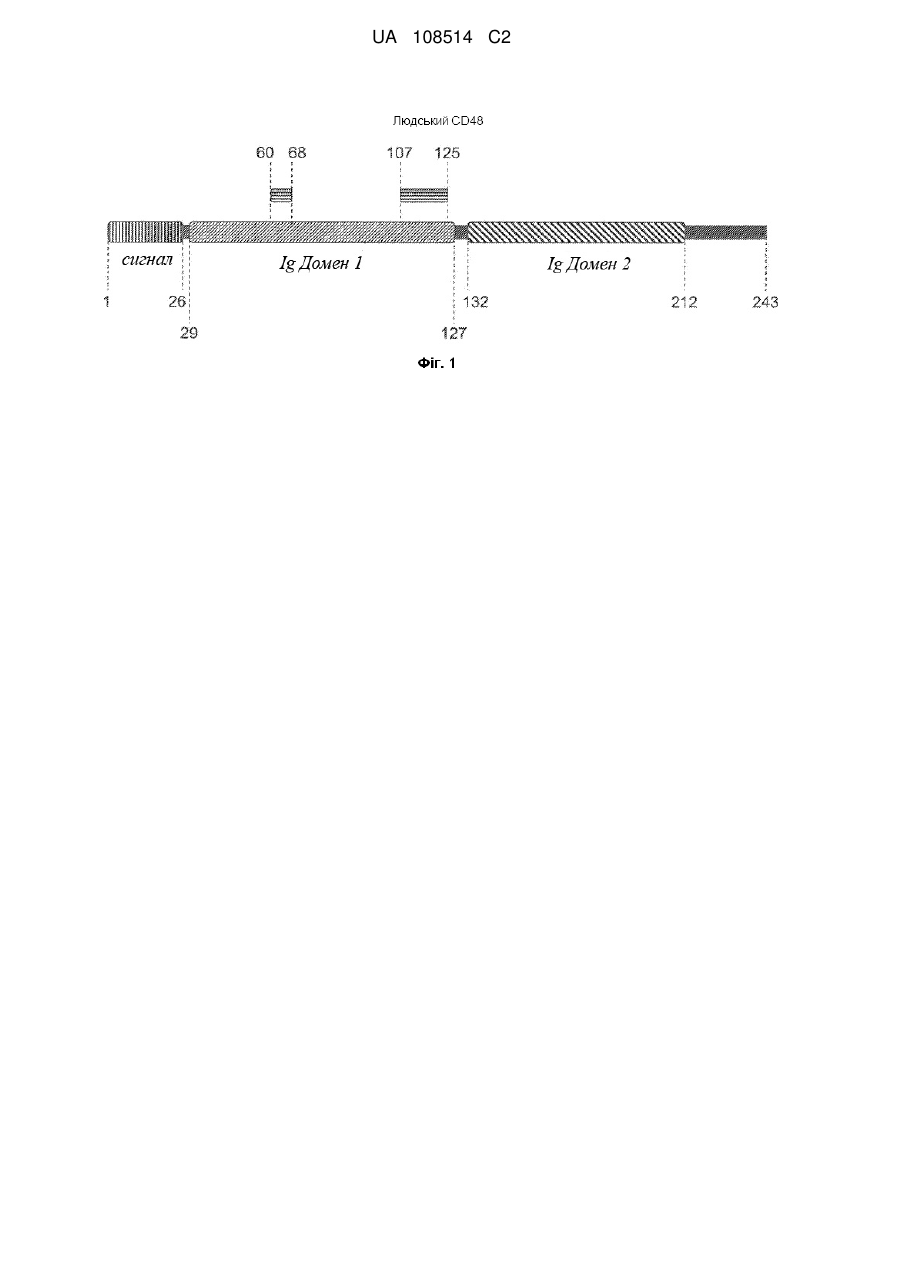
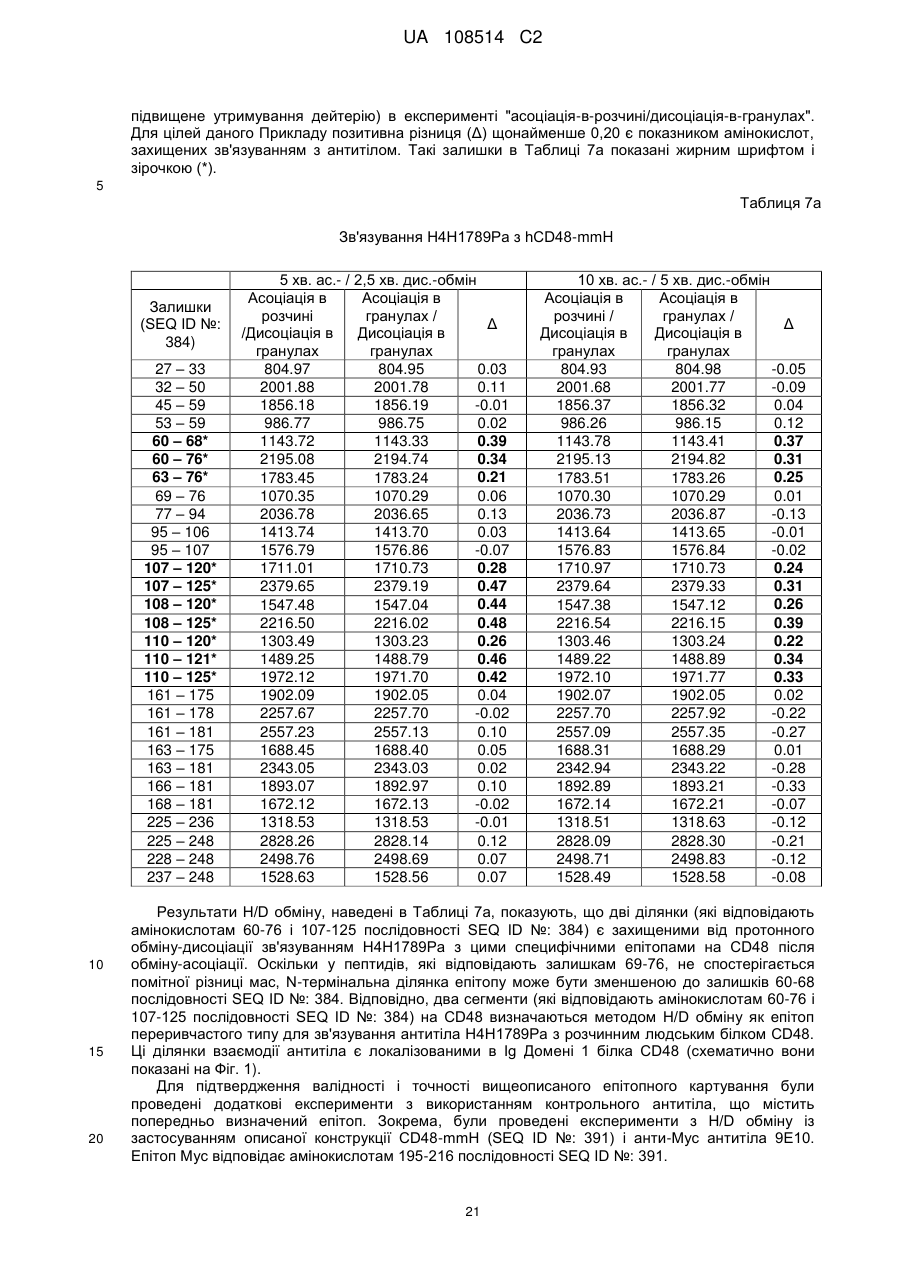
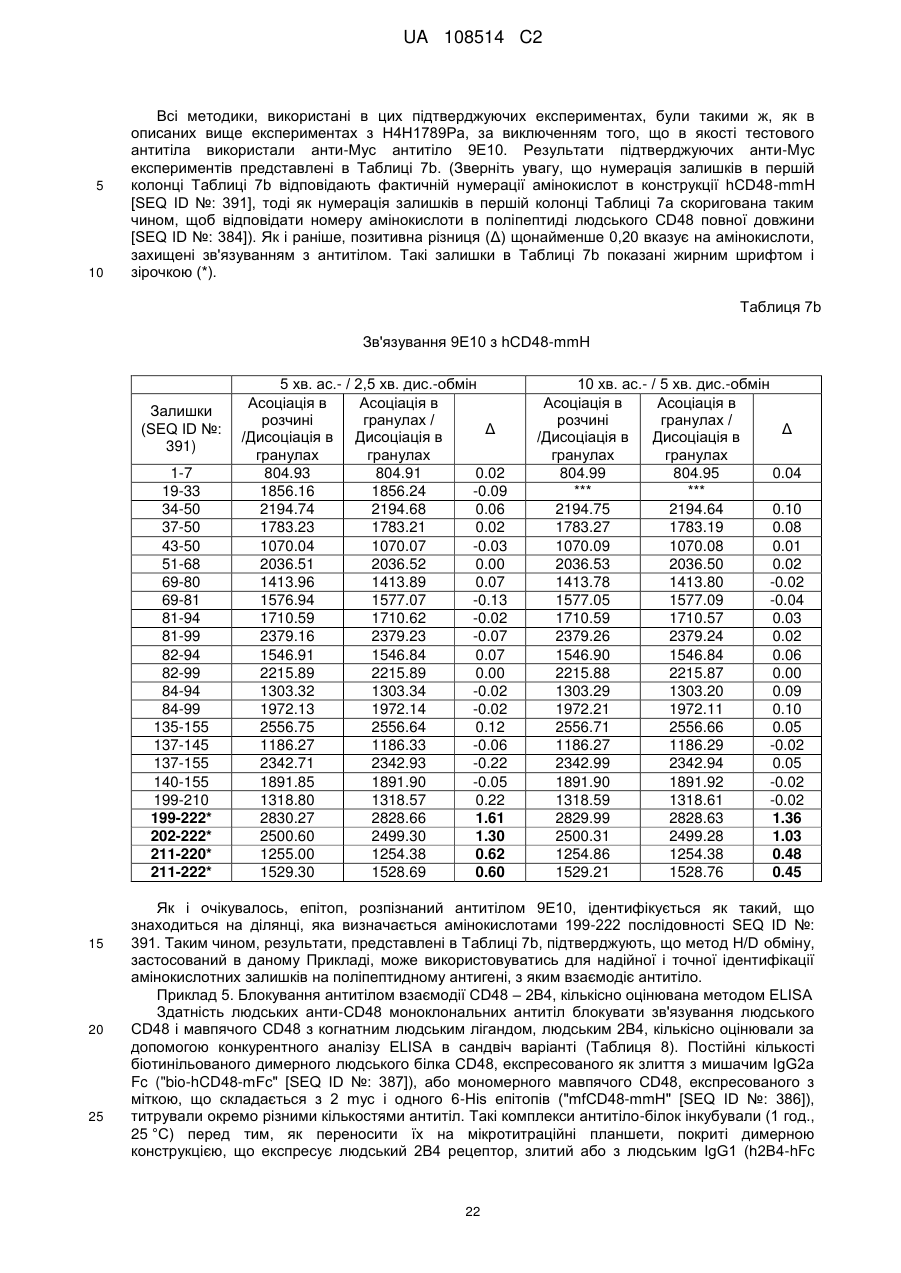
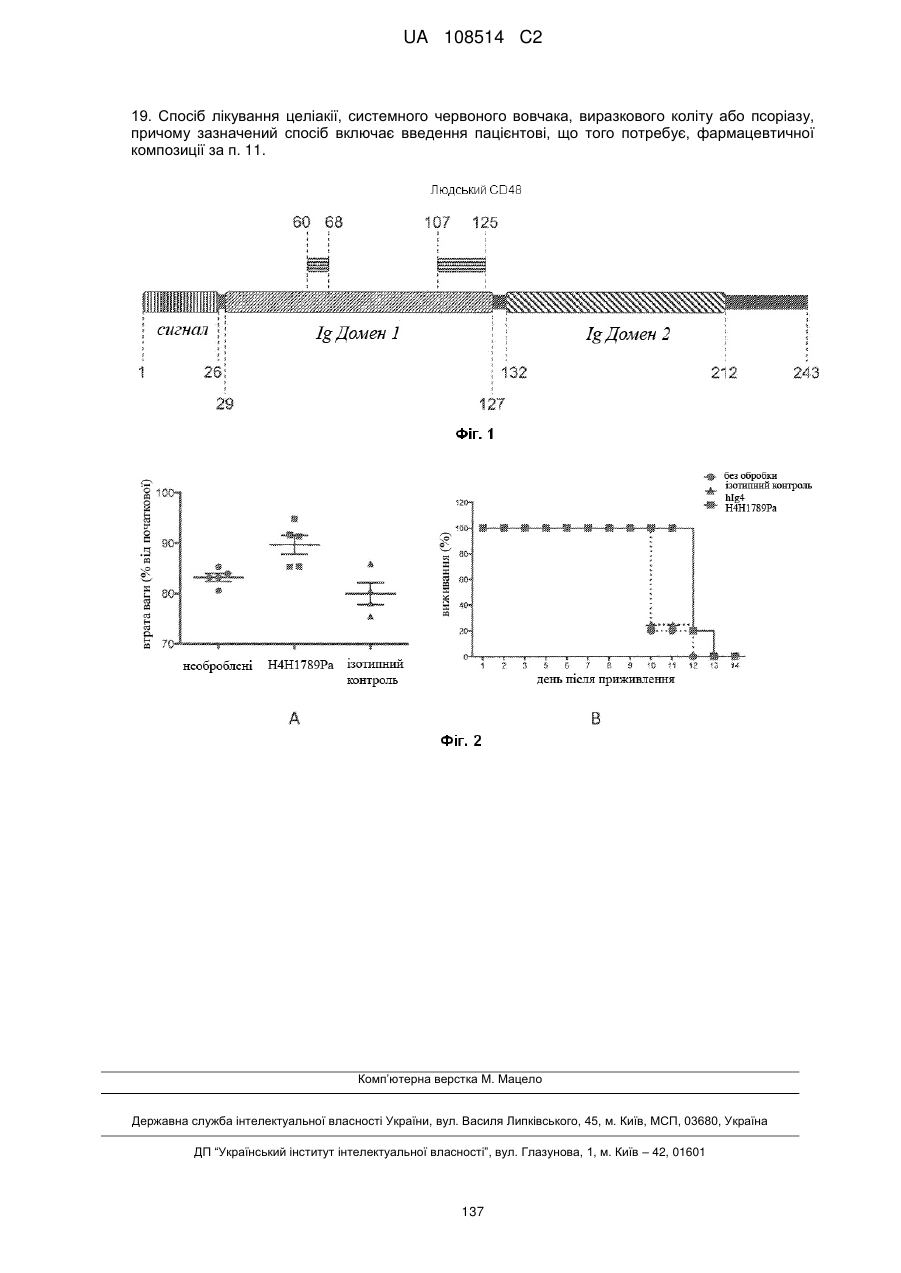
5. Антитіло або антигензв'язуючий фрагмент за будь-яким із пп. 1-4, де зазначене антитіло або антигензв'язуючий фрагмент зв'язує епітоп в Іg домені 1 людського CD48 (амінокислоти 29-127 послідовності SEQ ID NO: 384).
6. Антитіло або антигензв'язуючий фрагмент за п. 5, де зазначене антитіло або антигензв'язуючий фрагмент взаємодіє з однією або більше амінокислотами, що знаходяться в межах амінокислот 60-125 послідовності SEQ ID NO: 384.
7. Антитіло або антигензв'язуючий фрагмент за п. 6, де зазначене антитіло або антигензв'язуючий фрагмент взаємодіє з однією або більше амінокислотами, що знаходяться в межах амінокислот 60-68 послідовності SEQ ID NO: 384 та/або амінокислот 107-125 послідовності SEQ ID NO: 384.
8. Антитіло або антигензв'язуючий фрагмент за п. 7, де зазначене антитіло або антигензв'язуючий фрагмент взаємодіє з однією або більше амінокислотами, що знаходяться в межах амінокислот 60-68 послідовності SEQ ID NO: 384 та з однією або більше амінокислотами, що знаходяться в межах амінокислот 107-125 послідовності SEQ ID NO: 384.
9. Антитіло або антигензв'язуючий фрагмент за п. 1, де зазначене антитіло або антигензв'язуючий фрагмент містить ділянки, що визначають комплементарність, важкого і легкого ланцюгів HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 і LCDR3, відповідно, які мають амінокислотні послідовності SEQ ID NO: 354, 356, 358, 362, 364 та 366.
10. Антитіло або антигензв'язуючий фрагмент за п. 1, де зазначене антитіло або антигензв'язуючий фрагмент містить HCVR, що має амінокислотну послідовність SEQ ID NO: 368, та LCVR, що має амінокислотну послідовність SEQ ID NO: 370.
11. Фармацевтична композиція, яка містить антитіло або антигензв'язуючий фрагмент за будь-яким із пп. 1-10 та фармацевтично прийнятний носій або розріджувач.
12. Фармацевтична композиція за п. 11, яка призначена для застосування у лікуванні пацієнта, ураженого захворюванням або розладом, пацієнта, якому діагностовано або який має ризик бути ураженим захворюванням або розладом, що піддається лікуванню шляхом блокування взаємодії між CD48 та рецептором CD48.
13. Фармацевтична композиція за п. 12, де захворюванням або розладом, що піддається лікуванню шляхом блокування взаємодії між CD48 та рецептором CD48, є захворювання або розлад, що вибирається з групи, яка складається з целіакії, системного червоного вовчака, виразкового коліту і псоріазу.
14. Застосування виділеного антитіла або антигензв'язуючого фрагмента за будь-яким із пп. 1-10 для виготовлення лікарського засобу для застосування у лікуванні пацієнта, ураженого захворюванням або розладом, пацієнта, якому діагностовано або який має ризик бути ураженим захворюванням або розладом, що піддається лікуванню шляхом блокування взаємодії між CD48 та рецептором CD48.
15. Застосування за п. 14, де захворюванням або розладом, що піддається лікуванню шляхом блокування взаємодії між CD48 та рецептором CD48, є захворювання або розлад, що вибирається з групи, яка складається з целіакії, системного червоного вовчака, виразкового коліту і псоріазу.
16. Застосування фармацевтичної композиції за п. 13 для виготовлення лікарського засобу для застосування у лікуванні пацієнта, ураженого захворюванням або розладом, пацієнта, якому діагностовано або який має ризик бути ураженим захворюванням або розладом, що піддається лікуванню шляхом блокування взаємодії між CD48 та рецептором CD48.
17. Застосування за п. 16, де захворюванням або розладом, що піддається лікуванню шляхом блокування взаємодії між CD48 та рецептором CD48, є захворювання або розлад, що вибирається з групи, яка складається з целіакії, системного червоного вовчака, виразкового коліту і псоріазу.
18. Спосіб лікування целіакії, системного червоного вовчака, виразкового коліту або псоріазу, причому зазначений спосіб включає введення пацієнтові, що того потребує, антитіла або антигензв'язуючого фрагмента за будь-яким із пп. 1-10.
19. Спосіб лікування целіакії, системного червоного вовчака, виразкового коліту або псоріазу, причому зазначений спосіб включає введення пацієнтові, що того потребує, фармацевтичної композиції за п. 11.
Текст
Реферат: Винахід належить до виділеного антитіла або його антигензв'язуючого фрагмента, яке специфічно зв'язується з людським CD48 і блокує взаємодію між людським CD48 і рецептором CD48, фармацевтичної композиції, що містить виділене антитіло, застосування фармацевтичної композиції та способів лікування захворювання або розладу, що піддається лікуванню шляхом блокування взаємодії між CD48 та рецептором CD48 за допомогою виділеного антитіла або його антигензв'язуючого фрагмента, або фармацевтичної композиції, що містить виділене антитіло або його антигензв'язуючий фрагмент. UA 108514 C2 (12) UA 108514 C2 UA 108514 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки Даний винахід стосується антитіл та їх антигензв'язуючих фрагментів, які є специфічними для людського CD48. Рівень техніки CD48 – це ГФІ-фіксований білок (ГФІ = глікозилфосфатидилінозитол), який існує як у зв'язаній з мембраною, так і в розчинній формі. CD48 представляє собою ліганд високої афінності для 2В4 і ліганд низької афінності для CD2. В науковій літературі CD48 називають також "ТСТ.1" (Mami-Chouaib et al., J. Exp. Med. 172: 1071-1082 (1990)), "B-LAST 1" (ThorleyLawson et al., Cell 30: 415-425 (1982)) та SLAMF2 (Detre et al., Semin. Immunopathol. 32:157-171 (2010)). Було показано, що взаємодія між CD48 і 2B4 викликає активацію NK клітин (натуральних клітин-кілерів). Було показано також, що CD48 стимулює активацію Т-клітин in vitro, а CD48-нокаутні миші демонструють порушену реакцію проліферації Т-клітин. Певні наукові дані свідчать про учать CD48 в прогресуванні астми і в запальній хворобі кишечнику (IBD). Наприклад, було показано, що CD48 активується при експериментальній астмі (наприклад, в моделях індукованого овальбуміном і Aspergillus алергічного еозинофільного запалення дихальних шляхів). Дивись, наприклад, Munitz et al., Am. J. Respir. Crit. Care Med. 175: 911-918 (2007). Більше того, у CD48-нокаутних мишей не розвивався запальний коліт в адаптивній моделі перенесення IBD. Пізніше було показано, що CD48 антагонізм чинить сприятливий вплив на попередньо встановлений коліт. Про використання антагоністів CD48 в терапевтичних цілях йдеться в патентній заявці США 2007/0212353 і в Міжнародній патентній заявці WO 97/35614. Тим не менше, в цій галузі відчувається потреба в нових агентах, здатних модулювати CD48, включаючи анти-CD48 антитіла, які можуть бути застосовані для лікування захворювань і станів, опосередкованих CD48. Суть винаходу Даний винахід пропонує антитіла, які зв'язують людський CD48. Антитіла за цим винаходом є корисними, серед іншого, для пригнічення опосередкованої CD48 передачі сигналів і для лікування захворювань і розладів, викликаних або зв'язаних з активністю або передачею сигналів CD48. Антитіла за цим винаходом блокують взаємодію між CD48 і рецептором CD48 (наприклад, 2B4 та/або CD2) та/або пригнічують активацію первинних мононуклеарних клітин периферичної крові (PBMC) людини. У відповідності до певних варіантів здійснення, антитіла за цим винаходом зв'язують епітоп в першому імуноглобуліновому домені людського CD48. Антитіла за цим винаходом можуть бути повної довжини (наприклад, IgG1 або IgG4 антитіло) або можуть містити тільки антигензв'язуючу частину (наприклад, фрагмент Fab, F(ab")2 або scFv), і можуть бути модифікованими з метою впливу на функціональність, наприклад щоб усунути залишкові ефекторні функції (Reddy et al., 2000, J. Immunol. 164: 19251933). Даний винахід пропонує антитіло або антигензв'язуючий фрагмент антитіла, які містять варіабельну ділянку важкого ланцюга (HCVR), що має амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID №: 2, 18, 34, 50, 66, 82, 98, 114, 130, 162, 178, 192, 208, 212, 228, 232, 248, 252, 268, 272, 288, 292, 308, 312, 328, 332, 348, 352 і 368, або послідовність, суттєво подібну до неї, ступінь ідентичності якої становить щонайменше 90 %, щонайменше 95 %, щонайменше 98 % або щонайменше 99 %. Даний винахід пропонує також антитіло або антигензв'язуючий фрагмент антитіла, які містять варіабельну ділянку легкого ланцюга (LCVR), що має амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID №: 10, 26, 42, 58, 74, 90, 106, 122, 138, 146, 154, 170, 180, 182, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 372 і 380, або послідовність, суттєво подібну до неї, ступінь ідентичності якої становить щонайменше 90 %, щонайменше 95 %, щонайменше 98 % або щонайменше 99 %. Даний винахід пропонує також антитіло або антигензв'язуючий фрагмент антитіла, які містять пару послідовностей HCVR і LCVR (HCVR/LCVR), вибрану з групи, яка складається з SEQ ID №№: 2/10, 18/26, 34/42, 50/58, 66/74, 82/90, 98/106, 114/122, 130/138, 162/170, 178/180, 162/182, 178/190, 192/200, 208/210, 212/220, 228/230, 232/240, 248/250, 252/260, 268/270, 272/280, 288/290, 292/300, 308/310, 312/320, 328/330, 332/340, 348/350, 352/360, 368/370, 352/372 і 368/380. Даний винахід пропонує також антитіло або антигензв'язуючий фрагмент антитіла, які містять домен CDR3 важкого ланцюга (HCDR3), що має амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID №: 8, 24, 40, 56, 72, 88, 104, 120, 136, 168, 198, 218, 238, 258, 278, 298, 318, 338 і 358, або послідовність, суттєво подібну до неї, ступінь ідентичності якої 1 UA 108514 C2 5 10 15 20 25 30 35 40 45 50 55 60 становить щонайменше 90 %, щонайменше 95 %, щонайменше 98 % або щонайменше 99 %; і домен CDR3 легкого ланцюга (LCDR3), що має амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID №: 16, 32, 48, 64, 80, 96, 112, 128, 144, 152, 160, 176, 188, 206, 226, 246, 266, 286, 306, 326, 346, 366 і 378, або послідовність, суттєво подібну до неї, ступінь ідентичності якої становить щонайменше 90 %, щонайменше 95 %, щонайменше 98 % або щонайменше 99 %. В певних варіантах здійснення антитіло або антигензв'язуюча частина антитіла містить пару амінокислотних послідовностей HCDR3/LCDR3, вибрану з групи, яка складається з SEQ ID №№: 8/16, 24/32, 40/48, 56/64, 72/80, 88/96, 104/112, 120/128, 136/144, 168/176, 168/188, 198/206, 218/226, 238/246, 258/266, 278/286, 298/306, 318/326, 338/346, 358/366 і 358/378. Даний винахід пропонує також антитіло або його фрагмент, які додатково містять домен CDR1 важкого ланцюга (HCDR1), що має амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID №: 4, 20, 36, 52, 68, 84, 100, 116, 132, 164, 194, 214, 234, 254, 274, 294, 314, 334 і 354, або послідовність, суттєво подібну до неї, ступінь ідентичності якої становить щонайменше 90 %, щонайменше 95 %, щонайменше 98 % або щонайменше 99 %; домен CDR2 важкого ланцюга (HCDR2), що має амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID №: 6, 22, 38, 54, 70, 86, 102, 118, 134, 166, 196, 216, 236, 256, 276, 296, 316, 336 і 356, або послідовність, суттєво подібну до неї, ступінь ідентичності якої становить щонайменше 90 %, щонайменше 95 %, щонайменше 98 % або щонайменше 99 %; домен CDR1 легкого ланцюга (LCDR1), що має амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID №: 12, 28, 44, 60, 76, 92, 108, 124, 140, 148, 156, 172, 184, 202, 222, 242, 262, 282, 302, 322, 342, 362 і 374, або послідовність, суттєво подібну до неї, ступінь ідентичності якої становить щонайменше 90 %, щонайменше 95 %, щонайменше 98 % або щонайменше 99 %; та домен CDR2 легкого ланцюга (LCDR2), що має амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID №: 14, 30, 46, 62, 78, 94, 110, 126, 142, 150, 158, 174, 186, 204, 224, 244, 264, 284, 304, 324, 344, 364 і 376, або послідовність, суттєво подібну до неї, ступінь ідентичності якої становить щонайменше 90 %, щонайменше 95 %, щонайменше 98 % або щонайменше 99 %. Певні необмежуючі показові антитіла і антигензв'язуючі фрагменти за цим винаходом містять домени HCDR1-HCDR2-HCDR3-LCDR1-LCDR2-LCDR3, відповідно, що мають амінокислотні послідовності, вибрані з групи, яка складається з SEQ ID №№: 4-6-8-12-14-16 (наприклад, H2M1707N); 20-22-24-28-30-32 (наприклад, H2M1709N); 36-38-40-44-46-48 (наприклад, H2M1710N); 52-54-56-60-62-64 (наприклад, H2M1712N); 68-70-72-76-78-80 (наприклад, H2M1713N); 84-86-88-92-94-96 (наприклад, H2M1763N); 100-102-104-108-110-112 (наприклад, H2M1764N); 116-118-120-124-126-128 (наприклад, H2M1811N); 132-134-136-140142-144 (наприклад, H2M1766N); 164-166-168-172-174-176 (наприклад, H4H1769N-a); 164-166168-184-186-188 (наприклад, H4H1769N-b); 194-196-198-202-204-206 (наприклад, H4H1770N); 214-216-218-222-224-226 (наприклад, H4H1771N); 234-236-238-242-244-246 (наприклад, H4H1772N); 254-256-258-262-264-266 (наприклад, H4H1774N); 274-276-278-282-284-286 (наприклад, H4H1775N); 294-296-298-302-304-306 (наприклад, H4H1778N); 314-316-318-322324-326 (наприклад, H4H1779N); 334-336-338-342-344-346 (наприклад, H4H1781N); 354-356-358362-364-366 (наприклад, H4H1789Na та Pa); і 354-356-358-374-376-378 (наприклад, H4H1789Nb та Pb). Даний винахід пропонує також антитіла або їх антигензв'язуючі фрагменти, які містять домени HCDR1-HCDR2-HCDR3-LCDR1-LCDR2-LCDR3, відповідно, що мають наступні амінокислотні послідовності: HCDR1=GFTFSNYG (SEQ ID №: 254); HCDR2=IWYDDSXK, де X означає S або N (SEQ ID №: 381); HCDR3=ARDRWTYSHXFEY, де X означає Y або F (SEQ ID №: 382); LCDR1=QXISSW, де X означає D або G (SEQ ID №: 383); LCDR2=AAS (SEQ ID №: 264); і LCDR3=QQANSFPRT (SEQ ID №: 266). Необмежуючі показові антитіла за цим винаходом, які мають характеристики цих послідовностей, включають H4H1774N, H4H1775N, H4H1778N, H4H1779N і H4H1781N. В близькому варіанті здійснення цей винахід включає антитіло або антигензв'язуючий фрагмент антитіла, які специфічно зв'язують CD48, причому це антитіло або фрагмент включають домени CDR важкого і легкого ланцюгів, що містяться в послідовностях важкого і легкого ланцюгів, вибраних з групи, що складається з SEQ ID №№: 2/10, 18/26, 34/42, 50/58, 66/74, 82/90, 98/106, 114/122, 130/138, 162/170, 178/180, 162/182, 178/190, 192/200, 208/210, 212/220, 228/230, 232/240, 248/250, 252/260, 268/270, 272/280, 288/290, 292/300, 308/310, 312/320, 328/330, 332/340, 348/350, 352/360, 368/370, 352/372 і 368/380. Методи і методики для ідентифікації CDR в межах амінокислотних послідовностей HCVR і LCVR є загальновідомими в цій галузі і можуть застосовуватись для ідентифікації CDR в межах амінокислотних 2 UA 108514 C2 5 10 15 20 25 30 35 40 45 50 55 60 послідовностей HCVR та/або LCVR, описаних тут. Типові правила, які можуть використовуватись для ідентифікації меж ділянок CDR, включають, наприклад, дефініцію Kabat, дефініцію Chothia і дефініцію AbM. В загальних рисах, дефініція Kabat заснована на варіабельності послідовностей, дефініція Chothia заснована на локалізації структурних петель, а дефініція AbM представляє собою компроміс між підходами Kabat і Chothia. Дивись, наприклад, Kabat, "Sequences of Proteins of Immunological Interest, " National Institutes of Health, Bethesda, Md. (1991); Al-Lazikani et al., J. Mol. Biol. 273:927-948 (1997); та Martin et al., Proc. Natl. Acad. Sci. USA 86:9268-9272 (1989). Також для ідентифікації CDR послідовностей в межах антитіла є доступними публічні бази даних. В іншому аспекті даний винахід пропонує молекули нуклеїнової кислоти, кодуючі анти-CD48 антитіла або їх фрагменти. Рекомбінантні вектори експресії, що несуть нуклеїнові кислоти за цим винаходом, і клітини-хазяї, в які ці вектори були включені, також охоплюються цим винаходом, як і методи отримання таких антитіл шляхом культивування клітин-хазяїв в умовах, які сприяють продукуванню антитіл, і методи виділення отриманих антитіл. В одному варіанті здійснення цей винахід пропонує антитіло або його фрагмент, що містять послідовність HCVR, кодовану нуклеотидною послідовністю, вибраною з групи, яка складається з SEQ ID №: 1, 17, 33, 49, 65, 81, 97, 113, 129, 161, 177, 191, 207, 211, 227, 231, 247, 251, 267, 271, 287, 291, 307, 311, 327, 331, 347, 351 і 367, або суттєво ідентичною їй послідовністю, ступінь гомології якої становить щонайменше 90 %, щонайменше 95 %, щонайменше 98 % або щонайменше 99 %. Даний винахід пропонує також антитіло або його фрагмент, що містять послідовність LCVR, кодовану нуклеотидною послідовністю, вибраною з групи, яка складається з SEQ ID №: 9, 25, 41, 57, 73, 89, 105, 121, 137, 145, 153, 169, 179, 181, 189, 199, 209, 219, 229, 239, 249, 259, 269, 279, 289, 299, 309, 319, 329, 339, 349, 359, 369, 371 і 379, або суттєво ідентичною їй послідовністю, ступінь гомології якої становить щонайменше 90 %, щонайменше 95 %, щонайменше 98 % або щонайменше 99 %. Даний винахід пропонує також антитіло або його фрагмент, що містять домен HCDR3, кодований нуклеотидною послідовністю, вибраною з групи, яка складається з SEQ ID №: 7, 23, 39, 55, 71, 87, 103, 119, 135, 167, 197, 217, 237, 257, 277, 297, 317, 337 і 357, або суттєво ідентичною їй послідовністю, ступінь гомології якої становить щонайменше 90 %, щонайменше 95 %, щонайменше 98 % або щонайменше 99 %; і домен LCDR3, кодований нуклеотидною послідовністю, вибраною з групи, яка складається з SEQ ID №: 15, 31, 47, 63, 79, 95, 111, 127, 143, 151, 159, 175, 187, 205, 225, 245, 265, 285, 305, 325, 345, 365 і 377, або суттєво ідентичною їй послідовністю, ступінь гомології якої становить щонайменше 90 %, щонайменше 95 %, щонайменше 98 % або щонайменше 99 %. Даний винахід пропонує також антитіло або його фрагмент, що додатково містять домен HCDR1, кодований нуклеотидною послідовністю, вибраною з групи, яка складається з SEQ ID №: 3, 19, 35, 51, 67, 83, 99, 115, 131, 163, 193, 213, 233, 253, 273, 293, 313, 333 і 353 або суттєво ідентичною їй послідовністю, ступінь гомології якої становить щонайменше 90 %, щонайменше 95 %, щонайменше 98 % або щонайменше 99 %; домен HCDR2, кодований нуклеотидною послідовністю, вибраною з групи, яка складається з SEQ ID №: 5, 21, 37, 53, 69, 85, 101, 117, 133, 165, 195, 215, 235, 255, 275, 295, 315, 335 і 355, або суттєво ідентичною їй послідовністю, ступінь гомології якої становить щонайменше 90 %, щонайменше 95 %, щонайменше 98 % або щонайменше 99 %; домен LCDR1, кодований нуклеотидною послідовністю, вибраною з групи, яка складається з SEQ ID №: 11, 27, 43, 59, 75, 91, 107, 123, 139, 147, 155, 171, 183, 201, 221, 241, 261, 281, 301, 321, 341, 361 і 373, або суттєво ідентичною їй послідовністю, ступінь гомології якої становить щонайменше 90 %, щонайменше 95 %, щонайменше 98 % або щонайменше 99 %; і домен LCDR2, кодований нуклеотидною послідовністю, вибраною з групи, яка складається з SEQ ID №: 13, 29, 45, 61, 77, 93, 109, 125, 141, 149, 157, 173, 185, 203, 223, 243, 263, 283, 303, 323, 343, 363 і 375, або суттєво ідентичною їй послідовністю, ступінь гомології якої становить щонайменше 90 %, щонайменше 95 %, щонайменше 98 % або щонайменше 99 %. У відповідності до певних варіантів здійснення, антитіло або його фрагмент містять послідовності CDR важкого і легкого ланцюгів, кодовані нуклеотидними послідовностями SEQ ID №№: 1 і 9 (наприклад, H2M1707N), 17 і 25 (наприклад, H2M1709N), 33 і 41 (наприклад, H2M1710N), 49 і 57 (наприклад, H2M1712N), 65 і 73 (наприклад, H2M1713N), 81 і 89 (наприклад, H2M1763N), 97 і 105 (наприклад, H2M1764N), 113 і 121 (наприклад, H2M1811N), 129 і 137 (наприклад, H2M1766N), 161 і 169 (наприклад, H4H1769N-a), 177 і 179 (наприклад, H4H1769Pa), 161 і 181 (наприклад, H4H1769N-b), 177 і 189 (наприклад, H4H1769P-b), 191 і 199 (наприклад, H4H1770N), 207 і 209 (наприклад, H4H1770P), 211 і 219 (наприклад, H4H1771N), 227 і 229 3 UA 108514 C2 5 10 15 20 25 30 35 40 45 50 55 60 (наприклад, H4H1771P), 231 і 239 (наприклад, H4H1772N), 247 і 249 (наприклад, H4H1772P), 251 і 259 (наприклад, H4H1774N), 267 і 269 (наприклад, H4H1774P), 271 і 279 (і, H4H1775N), 287 і 289 (і, H4H1775P), 291 і 299 (наприклад, H4H1778N), 307 і 309 (наприклад, H4H1778P), 311 і 319 (наприклад, H4H1779N), 327 і 329 (наприклад, H4H1779P), 331 і 339 (наприклад, H4H1781N), 347 і 349 (наприклад, H4H1781P), 351 і 359 (наприклад, H4H1789Na), 367 і 369 (наприклад, H4H1789Pa), 351 і 371 (наприклад, H4H1789Nb) або 367 і 379 (наприклад, H4H1789Pb). Даний винахід включає анти-CD48 антитіла, що мають модифіковану структуру глікозилювання. В певних застосуваннях корисною може бути модифікація з метою видалення небажаних сайтів глікозилювання або антитіло без фрагменту фукози, присутнє в олігосахаридному ланцюгу, наприклад, для того, щоб посилити функцію антитіло-залежної клітинної цитотоксичності (ADCC) (дивись Shield et al. (2002) JBC 277: 26733). В інших застосуваннях можна здійснити модифікацію галактозилювання, щоб змінити комплементзалежну цитотоксичність (CDC). У відповідності до іншого свого аспекту, даний винахід пропонує фармацевтичну композицію, що містить рекомбінантне людське антитіло або його фрагмент, які специфічно зв'язують CD48, і фармацевтично прийнятний носій. В близькому аспекті даний винахід пропонує композицію, яка представляє собою комбінацію інгібітору CD48 і другого терапевтичного агента. В одному варіанті здійснення інгібітором CD48 є антитіло або його фрагмент. В одному варіанті здійснення другим терапевтичним агентом є будь-який агент, який переважно комбінується з інгібітором CD48. Показові агенти, які можуть переважно комбінуватись з інгібітором CD48, включають, не обмежуючись ними, інші агенти, які пригнічують активність CD48 (включаючи інші антитіла або їх антигензв'язуючі фрагменти, пептидні інгібітори, низькомолекулярні антагоністи і т.д.), та/або агенти, які перешкоджають передачі сигналів CD48 в зворотному або прямому напрямку. У відповідності до ще іншого аспекту, даний винахід пропонує способи пригнічення активності CD48 за допомогою анти-CD48 антитіла або антигензв'язуючої частини антитіла за цим винаходом, які включають введення терапевтично ефективної кількості фармацевтичної композиції, що містить антитіло або антигензв'язуючий фрагмент антитіла за цим винаходом. Розлад, що лікується, може бути будь-яким захворюванням або станом, які поліпшуються, ослабляються, пригнічуються або попереджаються в результаті усунення, пригнічення або зниження активності CD48. Анти-CD48 антитіло або фрагмент антитіла за цим винаходом можуть блокувати взаємодію між CD48 і рецептором CD48 (наприклад, 2B4 та/або CD2) або в інший спосіб пригнічувати процес передачі сигналів CD48. Даний винахід включає також використання анти-CD48 антитіла або антигензв'язуючої частини антитіла за цим винаходом для виготовлення лікарського засобу для лікування хвороби або розладу, пов'язаних з активністю CD48 у пацієнта або викликаних цією активністю. Інші варіанти здійснення стануть очевидними з наступного докладного опису. Короткий опис малюнків Фіг. 1. Лінійне зображення людського поліпептиду CD48 (SEQ ID №: 384). Частина, представлена амінокислотами 1-26, є сигнальною послідовністю; Частина, представлена амінокислотами 29-127, є Ig Домен 1; Частина, представлена амінокислотами 132-212, є Ig Домен 2. Ділянки SEQ ID №: 384, які відповідають амінокислотам 60-68 (YTFDQKIVE) і 107-125 (YIMRVLKKTGNEQEWKIKL), представляють епітоп, визначений для показового антитіла, позначеного H4H1789Pa (дивись Приклад 4). Фіг. 2. Графічні зображення ефектів лікування анти-CD48 антитілом на мишачій моделі хвороби трансплантат проти хазяїна. (дивись Приклад 9). На Панелі A показана втрата ваги, спостережувана у пролікованих і контрольних тварин; на Панелі B показаний відсоток виживання пролікованих і контрольних тварин. На обох панелях (●) означає відсутність лікування; (▲) означає контрольне лікування ізотипом hIgG4; і ( ) означає лікування показовим анти-CD48 антитілом H4H1789Pa. Докладний опис винаходу Перед тим, як описувати даний винахід, має бути зрозумілим, що цей винахід не обмежується конкретними описаними способами і експериментальними умовами, оскільки такі способи і умови можуть змінюватись. Має бути зрозумілим також, що використана тут термінологія призначена тільки для опису конкретних варіантів здійснення і не задумувалась як обмежуюча, оскільки об'єм даного винаходу обмежується тільки формулою винаходу, що додається. Коли не вказується інше, всі використані тут технічні і наукові терміни мають ті самі значення, які звичайно є зрозумілими для спеціаліста в галузі, до якої належить цей винахід. Як 4 UA 108514 C2 5 10 15 20 25 30 35 40 45 50 55 60 він тут використовується, термін "близько" по відношенню до конкретного наведеного числового значення означає, що це значення може відрізнятись від наведеного не більше ніж на 1 %. Наприклад, як він тут використовується, вираз "близько 100" включає 99 і 101 і всі значення між ними (наприклад, 99,1; 99,2; 99,3; 99,4 і т.д.). Хоча при практичному застосуванні або тестуванні даного винаходу можуть використовуватись будь-які методи і матеріали, аналогічні або еквівалентні методам і матеріалам, описаним тут, кращими методами і матеріалами є самі ті, що тут описані. Дефініції Вирази "CD48" і "фрагмент CD48", як вони тут використовуються, стосуються людського білка CD48 або його фрагменту, коли конкретно не вказано, що він не є людським, а відноситься до іншого виду (наприклад, "мишачий CD48", "фрагмент мишачого CD48", "мавпячий CD48", "фрагмент мавпячого CD48" і т.д.). Людський CD48 має амінокислотну послідовність SEQ ID №: 384. Амінокислотні послідовності молекул CD48 інших видів (наприклад, миші, мавпи, кроля, собаки, свині і т.д.) можна знайти в загальнодоступних джерелах, таких як GenBank (наприклад, GenBank номери доступу BAE96326.1 (миші); DAA31966.1 (жуйні тварини); EDL94663.1 (щурі); і т.д.). Термін "рецептор CD48", як він тут використовується, означає білок, з яким взаємодіє людський CD48 для передачі біологічного сигналу in vivo. Термін "рецептор CD48" включає людський 2B4 і людський CD2. Термін "людський 2B4", як він тут використовується, означає білок, що містить амінокислотну послідовність SEQ ID №: 390, або її частину, які є здатними взаємодіяти з CD48. Термін "людський CD2", як він тут використовується, означає білок, що містить амінокислотну послідовність SEQ ID №: 392 або її частину, які є здатними взаємодіяти з CD48. За задумкою, термін "антитіло", як він тут використовується, стосується молекул імуноглобуліну, що містять чотири поліпептидних ланцюги, два важких (H) ланцюги і два легких (L) ланцюги, взаємозв'язані дисульфідними зв'язками, а також їх мультимерів (наприклад, IgM). Кожний важкий ланцюг містить варіабельну ділянку важкого ланцюга (яка позначається тут як HCVR або VH) і постійну ділянку важкого ланцюга. Постійна ділянка важкого ланцюга містить три домени CH1, CH2 і CH3. Кожний легкий ланцюг містить варіабельну ділянку легкого ланцюга (яка позначається тут як LCVR або VL) і постійну ділянку легкого ланцюга. Постійна ділянка легкого ланцюга містить один домен (CL1). Ділянки VH і VL можна далі поділити на ділянки гіперваріабельності, які називають ділянками, що визначають комплементарність (CDR), перемежованими з ділянками, що є більше збереженими, які називають каркасними ділянками (FR). Кожна ділянка VH і VL складається з трьох CDR і чотирьох FR, розміщених від аміно-кінця до карбокси-кінця в наступному порядку: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. В різних варіантах здійснення цього винаходу FR анти-CD48 антитіла (або його антигензв'язуючої частини) можуть бути ідентичними послідовностям зародкової лінії людини або можуть бути природним або штучним шляхом модифікованими. Амінокислотну консенсусну послідовність можна визначити на основі одночасного аналізу двох або більше ділянок CDR. Термін "антитіло", як він тут використовується, включає також антигензв'язуючі фрагменти повних молекул антитіла. Терміни "антигензв'язуюча частина" антитіла, "антигензв'язуючий фрагмент" антитіла і т.п., як вони тут використовуються, включають будь-який природний, отримуваний ферментативним шляхом, синтетичний або створений методами генної інженерії поліпептид або глікопротеїн, який специфічно зв'язує антиген з утворенням комплексу. Антигензв'язуючі фрагменти антитіла можна отримувати, наприклад, з повних молекул антитіла з використанням будь-яких придатних стандартних методів, таких як протеолітичне розщеплення, або рекомбінантними методами генної інженерії, які включають обробку і експресію ДНК, кодуючої варіабельний і, можливо, постійний домени антитіла. Така ДНК є відомою та/або легко доступною, наприклад, з комерційних джерел, бібліотек ДНК (включаючи, наприклад, бібліотеки фагових антитіл) або її можна синтезувати. ДНК можна піддати секвенуванню і вивчати хімічними методами або методами молекулярної біології, наприклад розмістити один або більше варіабельних та/або постійних доменів у відповідній конфігурації або ввести кодони, створити цистеїнові залишки, модифікувати, додати або видалити амінокислоти і т.д. Необмежуючі приклади антигензв'язуючих фрагментів включають: (i) фрагменти Fab; (ii) фрагменти F(ab')2; (iii) фрагменти Fd; (iv) фрагменти Fv; (v) одноланцюгові молекули Fv (scFv); (vi) фрагменти dAb; і (vii) мінімальні одиниці розпізнавання, які складаються з амінокислотних залишків, що імітують гіперваріабельну ділянку антитіла (наприклад, виділену ділянку, що визначає комплементарність (CDR), таку як пептид CDR3), або обмежений пептид FR3-CDR3FR4. Інші сконструйовані молекули, такі як домен-специфічні антитіла, однодоменні антитіла, 5 UA 108514 C2 5 10 15 20 25 30 35 40 45 50 55 60 антитіла з делецією домену, химерні антитіла, CDR-пересаджені антитіла, діатіла, триатіла, тетратіла, мінітіла, нанотіла (наприклад, одновалентні нанотіла, двохвалентні нанотіла і т.д.), малі модульні імунофармацевтичні білки (SMIP) і варіабельні домени IgNAR (нового рецептору антигенів) акули також охоплюються виразом "антигензв'язуючий фрагмент", як він тут використовується. Антигензв'язуючий фрагмент антитіла, як правило, містить щонайменше один варіабельний домен. Цей варіабельний домен може бути будь-якого розміру і амінокислотного складу і звичайно містить щонайменше одну ділянку CDR, яка є суміжною з однією або більше каркасними послідовностями або знаходиться в рамці зчитування з ними. В антигензв'язуючих фрагментах, що мають домен VH, асоційований з доменом VL, домени VH і VL можуть розміщуватись один відносно одного будь-яким підходящим чином. Наприклад, варіабельна ділянка може бути димерною і містити димери VH-VH, VH-VL або VL-VL. Як варіант, антигензв'язуючий фрагмент антитіла може містити мономерний домен VH або VL. В певних варіантах здійснення антигензв'язуючий фрагмент антитіла може містити щонайменше один варіабельний домен, зв'язаний ковалентним зв'язком принаймні з одним постійним доменом. Необмежуючі показові конфігурації варіабельних і постійних доменів, які можуть знаходитись в антигензв'язуючому фрагменті антитіла, включають: (i) V H-CH1; (ii) VH-CH2; (iii) VH-CH3; (iv) VH-CH1-CH2; (v) VH-CH1-CH2-CH3; (vi) VH-CH2-CH3; (vii) VH-CL; (viii) VL-CH1; (ix) VLCH2; (x) VL-CH3; (xi) VL-CH1-CH2; (xii) VL-CH1-CH2-CH3; (xiii) VL-CH2-CH3; та (xiv) VL-CL. При будьякій конфігурації варіабельного і постійного доменів, включаючи вищенаведені показові конфігурації, варіабельні і постійні домени можуть бути або безпосередньо зв'язаними один з одним, або можуть зв'язуватись за допомогою повної або часткової шарнірної або лінкерної ділянки. Шарнірна ділянка може складатись щонайменше з 2 (наприклад, з 5, 10, 15, 20, 40, 60 або більше) амінокислот, що має своїм результатом гнучкий або напівгнучкий зв'язок між суміжними варіабельними та/або постійними доменами в одній поліпептидній молекулі. Більше того, антигензв'язуючий фрагмент антитіла за цим винаходом може містити гомодимер або гетеродимер (або інший мультимер) будь-якої з конфігурацій варіабельного і постійного доменів, перелічених вище, в нековалентному зв'язку один з одним та/або з одним або більше мономерним VH або VL доменом (наприклад, дисульфідним зв'язком (зв'язками)). Як і у випадку повних молекул антитіла, антигензв'язуючі фрагменти можуть бути моноспецифічними або мультиспецифічними (наприклад, біспецифічними). Мультиспецифічний антигензв'язуючий фрагмент антитіла типово містить щонайменше два різних варіабельних домени, причому кожний варіабельний домен є здатним специфічно зв'язуватись з окремим антигеном або з різними епітопами на одному антигені. Будь-який формат мультиспецифічного антитіла, включаючи типові формати біспецифічного антитіла за цим винаходом, можна адаптувати для використання в контексті антигензв'язуючого фрагмента антитіла за цим винаходом, за допомогою стандартних методів, що є в цій галузі. Антитіла за цим винаходом можуть функціонувати за механізмом комплемент-залежної цитотоксичності (CDC) або залежної від антитіла клітинно-опосередкованої цитотоксичності (ADCC). "Комплемент-залежна цитотоксичність" (CDC) стосується лізису клітин, що експресують антиген, антитілом за цим винаходом в присутності комплементу. "Залежна від антитіла клітинно-опосередкована цитотоксичність" (ADCC) стосується клітинно-опосередкованої реакції, в якій неспецифічні цитотоксичні клітини, що експресують Fc рецептори (FcRs) (наприклад, натуральні клітини-кілери (NK), нейтрофіли і макрофаги), розпізнають зв'язане антитіло на клітині-мішені і тим самим приводять до лізису клітини-мішені. CDC і ADCC можна оцінювати кількісно добре відомими в цій галузі і доступними методами аналізу. (Дивись, наприклад, патенти США 5500362 та 5821337, а також Clynes et al. (1998) Proc. Natl. Acad. Sci. (США) 95: 652-656). Постійна ділянка антитіла є важливою для здатності антитіла фіксувати комплемент і опосередковувати клітинно-залежну цитотоксичність. Таким чином, ізотип антитіла можна вибирати на основі того, або є бажаним для антитіла опосередковувати цитотоксичність. Термін "людське антитіло", як він тут використовується, включає антитіла, що мають варіабельні і постійні ділянки, які походять від імуноглобулінових послідовностей зародкової лінії людини. Людські антитіла за цим винаходом можуть включати амінокислотні залишки, не кодовані імуноглобуліновими послідовностями зародкової лінії людини (наприклад, мутації, введені випадковим або сайт-специфічним мутагенезом in vitro або за допомогою соматичної мутації in vivo), наприклад в ділянках CDR і, зокрема, в CDR3. Однак термін "людське антитіло", як він тут використовується, не включає антитіла, в яких послідовності CDR, що походять від зародкової лінії іншого виду ссавців, такого як миша, були підсаджені до людських каркасних послідовностей. Термін "рекомбінантне людське антитіло", як він тут використовується, включає всі людські 6 UA 108514 C2 5 10 15 20 25 30 35 40 45 50 55 60 антитіла, отримані, експресовані, створені або виділені рекомбінантними засобами, такі як антитіла, експресовані з використанням рекомбінантного вектору експресії, трансфікованого в клітину-хазяїна (докладніше описано далі), антитіла, виділені з бібліотеки комбінаторних рекомбінантних людських антитіл (докладніше описано далі), антитіла, виділені з тварини (наприклад, миші), що є трансгенною для генів імуноглобуліну людини (дивись, наприклад, Taylor et al. (1992) Nucl. Acids Res. 20:6287-6295), або антитіла, отримані, експресовані, створені або виділені будь-яким іншим способом, який включає сплайсинг послідовностей генів імуноглобуліну людини з іншими послідовностями ДНК. Такі рекомбінантні людські антитіла мають варіабельні і постійні ділянки, що походять від імуноглобулінових послідовностей зародкової лінії людини. Однак в певних варіантах здійснення такі рекомбінантні людські антитіла піддаються мутагенезу in vitro (або, коли використовується тварина, трансгенна по Ig послідовностям людини, соматичний мутагенез in vivo), в силу чого амінокислотні послідовності VH і VL ділянок рекомбінантних антитіл представляють собою послідовності, які, хоча і походять від послідовностей VH і VL зародкової лінії людини і є спорідненими з ними, можуть не існувати в природі в зародковому репертуарі антитіл людини in vivo. Людські антитіла можуть існувати в двох формах, які асоціюються з гетерогенністю шарнірної ділянки. В одній формі молекула імуноглобуліну представляє собою стабільну чотири-ланцюгову конструкцію з молекулярною масою близько 150-160 кДа, в якій димери утримуються вкупі за рахунок дисульфідного зв'язку між важкими ланцюгами. В другій формі димери не зв'язані дисульфідними зв'язками між ланцюгами, і утворюється молекула з молекулярною масою близько 75-80 кДа, що складається зі зв'язаних ковалентним зв'язком важкого і легкого ланцюгів (пів-антитіло). Ці форми дуже важко розділити, навіть за допомогою очистки методом афінної хроматографії. Частота, з якою зустрічається друга форма в різних ізотипах інтактного IgG, визначається, але без обмеження, за структурними відмінностями, асоційованими з ізотипом шарнірної ділянки антитіла. Заміщення однієї амінокислоти в шарнірній ділянці IgG4 людини може значно знизити частоту появи другої форми (Angal et al. (1993) Molecular Immunology 30: 105) до рівня, який звичайно спостерігається при використанні шарнірної ділянки IgG1 людини. Даний винахід охоплює антитіла, що мають одну або більше мутацій в шарнірній ділянці C H2 або CH3, яка може бути бажаною, наприклад, при отриманні, для збільшення виходу бажаної форми антитіла. "Виділене антитіло", як цей термін тут використовується, означає антитіло, яке було ідентифіковане і відділене та/або виділене з щонайменше одного компоненту його природного оточення. Наприклад, антитіло, яке було відділене від або видалене з щонайменше одного компоненту організму або з тканини або клітини, в яких це антитіло знаходиться або отримується в природних умовах, представляє собою "виділене антитіло" для цілей даного винаходу. Виділене антитіло включає також антитіло in situ в рекомбінантній клітині. Виділені антитіла представляють собою антитіла, які були піддані щонайменше одній стадії очистки або виділення. У відповідності до певних варіантів здійснення, виділене антитіло може бути суттєво вільним від іншого клітинного матеріалу та/або хімічних продуктів. Термін "специфічно зв'язує" або подібні терміни означають, що антитіло або його антигензв'язуючий фрагмент утворює комплекс з антигеном, який є відносно стабільним в фізіологічних умовах. Методи визначення того, або зв'язується антитіло специфічно з антигеном, є добре відомими в цій галузі і включають, наприклад, рівноважний діаліз, поверхневий плазмонний резонанс і т.п. Наприклад, антитіло, яке "специфічно зв'язує" людський CD48, як цей вираз використовується в контексті даного винаходу, включає антитіла, які зв'язують людський CD48 або його частину з визначеною методом поверхневого плазмонного резонансу величиною KD менше ніж близько 1000 нМ, менше ніж близько 500 нМ, менше ніж близько 300 нМ, менше ніж близько 200 нМ, менше ніж близько 100 нМ, менше ніж близько 90 нМ, менше ніж близько 80 нМ, менше ніж близько 70 нМ, менше ніж близько 60 нМ, менше ніж близько 50 нМ, менше ніж близько 40 нМ, менше ніж близько 30 нМ, менше ніж близько 20 нМ, менше ніж близько 10 нМ, менше ніж близько 5 нМ, менше ніж близько 4 нМ, менше ніж близько 3 нМ, менше ніж близько 2 нМ, менше ніж близько 1 нМ, менше ніж близько 0,5 нМ (дивись, наприклад, Приклад 3 в цьому описі). Виділене антитіло, яке специфічно зв'язує людський CD48, може, однак, проявляти перехресну реактивність по відношенню до інших антигенів, таких як молекули CD48 від іншого виду (не людини). "Нейтралізуюче" або "блокуюче" антитіло, як цей термін тут використовується, стосується антитіла, зв'язування якого з CD48: (i) перешкоджає взаємодії між CD48 або фрагментом CD48 і рецептором CD48 (наприклад, 2B4 та/або CD2), та/або (ii) приводить до пригнічення щонайменше однієї біологічної функції CD48. Пригнічення, викликане антитілом, яке 7 UA 108514 C2 5 10 15 20 25 30 35 40 45 50 55 60 нейтралізує або блокує CD48, не обов'язково є повним, оскільки він виявляється відповідним методом аналізу. Показові методи аналізу для виявлення пригнічення CD48 є описаними в цій заявці. Анти-CD48 антитіла за цим винаходом можуть містити одне або більше амінокислотних заміщень, вставок та/або делецій в каркасній та/або CDR ділянках варіабельних доменів важкого і легкого ланцюгів у порівнянні з відповідними послідовностями в клітинах зародкової лінії, з яких отримані ці антитіла. Такі мутації можна легко виявити, порівнюючи амінокислотні послідовності, описані в даному винаході, з послідовностями зародкової лінії, які можна знайти, наприклад, в загальнодоступних базах даних, що містять послідовності антитіл. Даний винахід включає антитіла та їх антигензв'язуючі фрагменти, які отримані з використанням будь-яких описаних тут амінокислотних послідовностей, в яких одна або більше амінокислот в одній або більше каркасних та/або CDR ділянках є мутованими у відповідних залишках зародкової послідовності, з якої вони отримані, або у відповідних залишках іншої зародкової послідовності людини, або в консервативному амінокислотному заміщенні відповідних залишків зародкової лінії (в даному описі такі зміни послідовності в цілому називаються "зародковими мутаціями"). Спеціаліст в цій галузі, виходячи з послідовностей варіабельної ділянки важкого і легкого ланцюгів за цим винаходом, може легко отримати численні антитіла і антигензв'язуючі фрагменти, які містять одну або більше індивідуальних зародкових мутацій або їх комбінації. В певних варіантах здійснення всі каркасні та/або CDR залишки в VH та/або VL доменах піддаються зворотній мутації до залишків оригінальної зародкової послідовності, з якої було отримане антитіло. В інших варіантах здійснення тільки певні залишки піддаються зворотній мутації до залишків оригінальної зародкової послідовності, наприклад тільки мутантні перші 8 амінокислот FR1 або останні 8 амінокислот FR4, або тільки мутантні залишки, що знаходяться в CDR1, CDR2 або CDR3. В інших варіантах здійснення один або більше каркасних та/або CDR залишків піддаються мутації до відповідних залишків іншої зародкової послідовності (наприклад, зародкової послідовності, відмінної від зародкової послідовності, з якої початково походить антитіло). Крім того, антитіла за цим винаходом можуть містити будь-яку комбінацію двох або більше зародкових мутацій в каркасних та/або CDR ділянках, наприклад, в яких певні індивідуальні залишки є мутованими до відповідного залишку конкретної зародкової послідовності, тоді як певні інші залишки, відмінні від оригінальної зародкової послідовності, зберігались або піддавались мутації до відповідного залишку іншої зародкової послідовності. Після отримання антитіла і антигензв'язуючі фрагменти, які містять одну або більше зародкових мутацій, можна легко тестувати у відношенні однієї або більше бажаних властивостей, таких як підвищена специфічність зв'язування, підвищена афінність до зв'язування, поліпшені або посилені антагоністичні або агоністичні біологічні властивості (в залежності от обставин), знижена імуногенність і т.д. Антитіла і антигензв'язуючі фрагменти, отримані у такий загальний спосіб, охоплюються даним винаходом. Даний винахід включає також анти-CD48 антитіла, що містять варіанти будь-якої з амінокислотних послідовностей HCVR, LCVR та/або CDR за цим винаходом, що мають одне або більше консервативних заміщень. Наприклад, даний винахід включає анти-CD48 антитіла, що мають амінокислотні послідовності HCVR, LCVR та/або CDR, наприклад з 10 або менше, 8 або менше, 6 або менше, 4 або менше і т.д. консервативними амінокислотними заміщеннями у порівнянні з будь-якою з амінокислотних послідовностей HCVR, LCVR та/або CDR, описаних в даній заявці. Термін "поверхневий плазмонний резонанс", як він тут використовується, стосується оптичного явища, яке дозволяє аналізувати взаємодії в реальному часі, шляхом виявлення змін концентрації білка в матриці біосенсора, наприклад за допомогою системи BIAcore™ (Biacore Life Sciences division of GE Healthcare, Piscataway, США). Термін "KD", як він тут використовується, стосується рівноважної константи дисоціації конкретної взаємодії антитіло-антиген. Термін "епітоп" стосується антигенної детермінанти, яка взаємодіє зі специфічним сайтом зв'язування антигену у варіабельній ділянці молекули антитіла, відомій як паратоп. Один антиген може мати більше одного епітопу. Таким чином, різні антитіла можуть зв'язуватись з різними ділянками на антигені і можуть проявляти різні біологічні ефекти. Епітопи можуть бути конформаційними або лінійними. Конформаційний епітоп утворюють просторово близькими амінокислотами з різних сегментів лінійного поліпептидного ланцюга. Лінійний епітоп представляє собою епітоп, утворений суміжними амінокислотними залишками в поліпептидному ланцюзі. В певних випадках епітоп може включати фрагменти сахаридів, фосфорильні групи або сульфонільні групи на антигені. Вираз "суттєва ідентичність" або "суттєво ідентичний", коли він стосується нуклеїнової 8 UA 108514 C2 5 10 15 20 25 30 35 40 45 50 55 60 кислоти або її фрагменту, вказує на те, що при оптимальному зіставленні відповідними нуклеотидними вставками або делеціями з іншою нуклеїновою кислотою (або її комплементарною ниткою) ступінь ідентичності нуклеотидних послідовностей, визначений за допомогою добре відомого алгоритму ідентичності послідовностей, такого як FASTA, BLAST або Gap, як буде описано далі, становить по щонайменше близько 95 %, а краще щонайменше близько 96 %, 97 %, 98 % або 99 % нуклеотидних основ. Молекула нуклеотидної кислоти, що має суттєву ідентичність з еталонною молекулою нуклеотидної кислоти, може, в певних випадках, кодувати поліпептид, який має таку саму або суттєво подібну амінокислотну послідовність, що й поліпептид, кодований еталонною молекулою нуклеотидної кислоти. У застосуванні до поліпептидів термін "суттєва подібність" або "суттєво подібний" означає, що дві пептидні послідовності при оптимальному зіставленні, наприклад із застосуванням програм GAP або BESTFIT, і при використанні ваги пропуску за умовчанням, поділяють щонайменше 95 % ідентичності послідовностей, а навіть краще щонайменше 98 % або 99 % ідентичності послідовностей. Переважно, позиції залишків, що не є ідентичними, відрізняються консервативними амінокислотними заміщеннями. "Консервативне амінокислотне заміщення" – це таке заміщення, коли амінокислотний залишок заміщується на інший амінокислотний залишок, що має бічний ланцюг (R групу) з подібними хімічними властивостями (наприклад, зарядом або гідрофобністю). Загалом, консервативне амінокислотне заміщення не буде суттєво змінювати функціональні властивості білка. У випадках, коли дві або більше амінокислотних послідовності відрізняються одна від одної консервативними заміщеннями, відсоток ідентичності послідовностей або ступінь подібності можна регулювати в бік підвищення, вводячи поправку на консервативну природу заміщення. Засоби для здійснення такого регулювання є добре відомими спеціалістам в даній галузі. Дивись, наприклад, Pearson (1994) Methods Mol. Biol. 24: 307-331. Приклади груп амінокислот, які мають бічні ланцюги з подібними хімічними властивостями, включають (1) аліфатичні бічні ланцюги: гліцин, аланін, валін, лейцин і ізолейцин; (2) аліфатичні бічні ланцюги, що містять гідроксил: серин і треонін; (3) бічні ланцюги, що містять амід: аспарагін і глютамін; (4) ароматичні бічні ланцюги: фенілаланін, тирозин і триптофан; (5) основні бічні ланцюги: лізин, аргінін і гістидин; (6) кислотні бічні ланцюги: аспартат і глутамат, і (7) бічні ланцюги, що містять сірку: цистеїн і метіонін. Кращими групами для консервативних амінокислотних заміщень є: валін-лейцин-ізолейцин, фенілаланін-тирозин, лізин-аргінін, аланін-валін, глутамат-аспартат і аспарагін-глютамін. Як варіант, консервативне заміщення представляє собою будь-яку зміну, що має позитивне значення в матриці логарифмічної правдоподібності PAM250, описаній в статті Gonnet et al. (1992) Science 256: 1443-1445. "Помірно консервативне заміщення" означає будь-яку зміну, що має не негативне значення в матриці логарифмічної правдоподібності PAM250. Подібність послідовностей для поліпептидів, яке називають також ідентичністю послідовностей, звичайно визначають кількісно за допомогою програми аналізу послідовностей. Програма аналізу білків порівнює подібні послідовності із застосуванням мір подібності, приписаних різним заміщенням, делеціям та іншим модифікаціям, включаючи консервативні амінокислотні заміщення. Наприклад, пакет програм GCG містить такі програми, як Gap і Bestfit, які можна застосовувати з параметрами за умовчанням для визначення гомології послідовностей або ідентичності послідовностей близько споріднених поліпептидів, таких як гомологічні поліпептиди від різних видів організмів, або між білком дикого типу і його мутеїном. Дивись, наприклад, GCG Version 6.1. Поліпептидні послідовності можна порівнювати також за допомогою програми FASTA, використовуючи параметри за умовчанням або рекомендовані параметри. Програма в GCG Version 6.1. FASTA (наприклад, FASTA2 і FASTA3) забезпечує зіставлення і відсоток ідентичності послідовностей ділянок з найкращим перекриванням між запитаною і шуканою послідовностями (Pearson (2000) supra). Іншим зручним алгоритмом для порівняння послідовностей за цим винаходом з базою даних, що містить велику кількість послідовностей від різних організмів, є комп'ютерна програма BLAST, зокрема BLASTP або TBLASTN, що використовує параметри за умовчанням. Дивись, наприклад, Altschul et al. (1990) J. Mol. Biol. 215: 403-410 та Altschul et al. (1997) Nucleic Acids Res. 25: 3389-402. Біологічні характеристики антитіл Антитіла за цим винаходом блокують взаємодію між людським CD48 і щонайменше одним рецептором CD48. Як він тут використовується, вираз "блокують взаємодію між людським CD48 і щонайменше одним рецептором CD48" означає, що в аналізі, в якому можна виявити та/або кількісно оцінити фізичну взаємодію між CD48 і рецептором CD48 (наприклад, людським 2B4 та/або людським CD2), додавання антитіла за цим винаходом знижує взаємодію між CD48 і рецептором CD48 щонайменше на 50 %. Необмежуючий типовий метод аналізу, яким можна скористатись для визначення того, або дійсно антитіло блокує взаємодію між людським CD48 і 9 UA 108514 C2 5 10 15 20 25 30 35 40 45 50 55 60 рецептором CD48 (наприклад, людським 2B4), ілюструється в Прикладі 5 даної заявки. В цьому Прикладі антитіла змішують з білком CD48, а потім суміш антитіло/CD48 наносять на поверхню з іммобілізованим 2B4 білком. Після відмивання незв'язаних молекул визначають кількість CD48, зв'язаного з покритою 2B4 поверхнею. Використовуючи різні кількості антитіла в цьому форматі аналізу, можна обчислити кількість антитіла, необхідну для того, щоб блокувати 50 % зв'язування CD48 з 2B4, і виразити її у вигляді величини IC 50. Даний винахід включає анти-CD48 антитіла, які демонструють величину IC50 меншу ніж близько 400 пМ при тестуванні зв'язування CD48/CD48 рецептор, описаному вище, або при використанні суттєво подібного аналізу. Наприклад, даний винахід включає анти-CD48 антитіла, які демонструють величину IC50 меншу ніж близько 400, 300, 290, 280, 270, 260, 250, 240, 230, 220, 210, 200, 190, 180, 170, 160, 150, 140, 130, 120, 110, 100, 90, 80, 70, 60, 50, 40, 30, 20, 10, 18, 16, 14, 12, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 пМ при тестуванні зв'язування CD48/CD48 рецептор, описаному вище, або при використанні суттєво подібного аналізу. Антитіла за цим винаходом здатні також пригнічувати активацію первинних мононуклеарних клітин периферичної крові (PBMC) людини. Як він тут використовується, вираз "пригнічує активацію первинних мононуклеарних клітин периферичної крові людини" означає, що в аналізі, в якому можна виявити та/або кількісно оцінити активацію PBMC (наприклад, по вивільненню IFN-гамма або іншого цитокіну), додавання антитіла за цим винаходом знижує кількість IFNгамма (або іншого цитокіну), що вивільнюється, щонайменше на 50 %. Необмежуючі типові методи аналізу, якими можна скористатись для визначення того, або дійсно антитіло пригнічує активацію PBMC, ілюструються в Прикладах 6 і 7 даного опису. В одному прикладі анти-CD48 антитіло додають до виділених PBMC людини перед активацією PBMC за допомогою агоністичних анти-CD3 і анти-CD28 антитіл. Після певного періоду інкубації визначають кількість IFN-гамма, що вивільнився. Використовуючи різні кількості антитіла в цьому форматі аналізу, можна обчислити кількість антитіла, необхідну для того, щоб досягти 50 % пригнічення максимального вивільнення IFN-гамма, і виразити її у вигляді величини IC 50. Даний винахід включає анти-CD48 антитіла, які демонструють величину IC50 меншу ніж близько 500 пМ при тестуванні активації PBMC, описаному вище, або при використанні суттєво подібного аналізу. Наприклад, даний винахід включає анти-CD48 антитіла, які демонструють величину IC50 меншу ніж близько 500, 400, 300, 290, 280, 270, 260, 250, 240, 230, 220, 210, 200, 190, 180, 170, 160, 150, 140, 130, 120, 110, 100, 90, 80, 70, 60, 50, 40, 30, 20, 10, 18, 16, 14, 12, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 пМ при тестуванні активації PBMC, описаному вище, або при використанні суттєво подібного аналізу. Картування епітопів і споріднені методи Людський білок CD48 містить два імуноглобулін-подібних домени, які тут називаються "Ig домен 1" і "Ig домен 2". Ig домен 1 має послідовність амінокислот, представлену амінокислотами від 29 по 127 послідовності SEQ ID №: 384, а Ig домен 2 має послідовність амінокислот, представлену амінокислотами від 132 по 212 послідовності SEQ ID №: 384 (дивись Фіг. 1). Даний винахід включає анти-CD48 антитіла, які специфічно зв'язуються з епітопом в Ig домені 1 людського CD48. Цей епітоп може складатись з однієї безперервної послідовності з 3 або більше (наприклад, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 або більше) амінокислот, локалізованих в Ig домені 1 білка CD48. Як варіант, цей епітоп може складатись з великої кількості не стичних амінокислот (або амінокислотних послідовностей), локалізованих в Ig домені 1 білка CD48. У відповідності до певних варіантів здійснення цього винаходу, пропонуються анти-CD48 антитіла, які взаємодіють з однією або більше амінокислот, локалізованих в межах амінокислот від 60 до 125 послідовності SEQ ID №: 384. Наприклад, даний винахід включає анти-CD48 антитіла, які взаємодіють з однією або більше амінокислот, локалізованих в межах амінокислот від 60 до 60 до 68 та/або від 107 до 125 послідовності SEQ ID №: 384. Різними методами, відомими спеціалісту в цій галузі, можна скористатись для визначення того, або дійсно антитіло "взаємодіє з однією або більше амінокислот" в поліпептиді або білку. Типові методи включають, наприклад, стандартний метод перехресного блокування, такий як описаний в Antibodies, Harlow and Lane (Cold Spring Harbor Press, Cold Spring Harb., NY), аланінскануючий мутагенез, блотинг пептидів (Reineke, 2004, Methods Mol Biol 248:443-463) і розщеплення пептидів. Крім того, можна скористатись такими методами, як виключення епітопу, екстракція епітопу і хімічна модифікація антигенів (Tomer, 2000, Protein Science 9: 487-496). Ще одним методом, який може бути застосований для ідентифікації амінокислот в поліпептиді, з якими взаємодіє антитіло, є обмін водень/дейтерій, що виявляється за допомогою масспектрометрії. (Дивись, наприклад, Приклад 4 в цій заявці). В загальних рисах, метод обміну 10 UA 108514 C2 5 10 15 20 25 30 35 40 45 50 55 60 водень/дейтерій включає мічення дейтерієм білку, що становить інтерес, з наступним зв'язуванням антитіла з цим білком, міченим дейтерієм. Потім комплекс білок/антитіло переносять у воду, щоб обмін водень-дейтерій міг здійснитись у всіх залишках, за виключенням залишків, захищених антитілом (які залишаються бути міченими дейтерієм). Після дисоціації антитіла цільовий білок розщепляють протеазами і піддають мас-спектрометричному аналізу, виявляючи мічені дейтерієм залишки, які відповідають специфічним амінокислотам, з якими взаємодіє дане антитіло. Дивись, наприклад, Ehring (1999) Analytical Biochemistry 267(2): 252259; Engen and Smith (2001) Anal. Chem. 73: 256A-265A. Даний винахід включає також анти-CD48 антитіла, які зв'язуються з тим самим епітопом, що й будь-яке з описаних тут специфічних показових антитіл (наприклад, H4H1789Pa, H4H1763N, H2M1707N, H2M1709N, H4H1770N, H4H1771N і т.д.). Крім того, даний винахід включає також анти-CD48 антитіла, які конкурують за зв'язування з CD48 або фрагментом CD48 з будь-яким з описаних тут специфічних показових антитіл (наприклад, H4H1789Pa, H4H1763N, H2M1707N, H2M1709N, H4H1770N, H4H1771N і т.д.). Стандартними методами, відомими в цій галузі, можна легко визначити, або дійсно антитіло зв'язується з тим самим епітопом, що й еталонне анти-CD48 антитіло, або або конкурує воно за зв'язування еталонним анти-CD48 антитілом. Наприклад, щоб визначити, або дійсно антитіло зв'язується з тим самим епітопом, що й еталонне анти-CD48 антитіло за цим винаходом, еталонному анти-CD48 антитілу дають зв'язатись з білком CD48 або пептидом в умовах насичення. Далі оцінюють здатність тестового антитіла зв'язуватись з молекулою CD48. Якщо тестове антитіло є здатним зв'язуватись з CD48 після насичення зв'язування з еталонним антиCD48 антитілом, можна зробити висновок, що тестове антитіло зв'язується з іншим епітопом, ніж еталонне анти-CD48 антитіло. З іншого боку, якщо тестове антитіло є нездатним зв'язуватись з CD48 після насичення зв'язування з еталонним анти-CD48 антитілом, тоді тестове антитіло може зв'язуватись з тим самим епітопом, що й еталонне анти-CD48 антитіло за цим винаходом. Потім можна провести додаткові стандартні експерименти (які передбачають, наприклад, мутацію пептидів і аналізи зв'язування), щоб підтвердити, або дійсно спостережувана відсутність зв'язування тестового антитіла викликана зв'язуванням з тим самим епітопом, що й еталонне анти-CD48 антитіло, або або є відповідальним за спостережувану відсутність зв'язування просторове блокування (або інше явище). Такі експерименти можна проводити з використанням методів ELISA (ІФА), RIA (РІА), Biacore, проточної цитометрії або будь-якого іншого кількісного або якісного аналізу зв'язування з антитілом, відомого в цій галузі. У відповідності до певних варіантів здійснення цього винаходу, два антитіла зв'язуються (або перекриваються) з тим самим епітопом, коли, наприклад, 1-, 5-, 10-, 20- або 100-кратний надлишок одного антитіла пригнічує зв'язування іншого щонайменше на 50 %, а краще на 75 %, 90 % або навіть на 99 %, як визначається методом конкурентного зв'язування (дивись, наприклад, Junghans et al., Cancer Res. 1990: 50: 1495-1502). Як варіант, вважають, що два антитіла зв'язуються з тим самим епітопом, коли суттєво всі мутації амінокислот в антигені, які зменшують або усувають зв'язування одного антитіла, зменшують або усувають зв'язування другого. Вважають, що два антитіла мають "епітопи, що перекриваються", коли тільки набір мутацій амінокислот, які зменшують або усувають зв'язування одного антитіла, зменшують або усувають зв'язування другого. Щоб визначити, або конкурує антитіло за зв'язування з еталонним анти-CD48 антитілом, вищеописану методику оцінки зв'язування здійснюють в двох орієнтаціях: в першій орієнтації еталонному антитілу дають зв'язуватись з молекулою CD48 в умовах насичення з наступною оцінкою зв'язування тестового антитіла з молекулою CD48. В другій орієнтації тестовому антитілу дають зв'язуватись з молекулою CD48 в умовах насичення з наступною оцінкою зв'язування еталонного антитіла з молекулою CD48. Коли, в обох орієнтаціях, тільки перше (насичуюче) антитіло є здатним зв'язуватись з молекулою CD48, робиться висновок про те, що тестове антитіло і еталонне антитіло конкурують за зв'язування з CD48. Як має бути зрозумілим спеціалісту в цій галузі, антитіло, яке конкурує за зв'язування з еталонним антитілом, може не обов'язково зв'язуватись з тим самим епітопом, що й еталонне антитіло, але може просторово блокувати зв'язування еталонного антитіла, завдяки зв'язуванню з суміжним епітопом або епітопом, що перекривається. Одержання людських антитіл Методи одержання моноклональних антитіл, включаючи повністю людські моноклональні антитіла, є відомими в цій галузі. Будь-якими такими відомими методами можна скористатись в контексті даного винаходу для одержання людських антитіл, які специфічно зв'язуються з людським CD48. Використовуючи технологію VELOCIMMUNE™ або будь-який інший відомий метод 11 UA 108514 C2 5 10 15 20 25 30 35 40 45 50 55 60 одержання моноклональних антитіл, спочатку виділяються химерні антитіла до CD48 високої афінності, що мають людську варіабельну ділянку і мишачу постійну ділянку. Як буде показано в експериментальній частині опису, такі антитіла характеризуються і відбираються за бажаними характеристиками, включаючи афінність, селективність, епітоп і т.д. Мишачі постійні ділянки замінюються бажаною людською постійною ділянкою, щоб одержати повністю людське антитіло за цим винаходом, наприклад дикого типу або модифікований IgG1 або IgG4. Тоді як вибрана постійна ділянка може змінюватись у відповідності до конкретного застосування, за такі характеристики як зв'язування з високою афінністю з антигеном і специфічність по відношенню до мішені, відповідає варіабельна ділянка. Біоеквіваленти Анти-CD48 антитіла і фрагменти антитіл за цим винаходом охоплюють білки, що мають амінокислотні послідовності, які відрізняються від послідовностей описаних антитіл, але зберігають здатність зв'язувати людський CD48. Такі варіантні антитіла і фрагменти антитіл містять одну або більше вставок, делецій або заміщень амінокислот у порівнянні з материнською послідовністю, але демонструють біологічну активність, яка є суттєво еквівалентною біологічній активності описаних антитіл. Подібним чином, послідовності ДНК за цим винаходом, кодуючі анти-CD48 антитіла, охоплюють послідовності, які містять одну або більше вставок, делецій або заміщень нуклеотидів у порівнянні з описаною послідовністю, але кодують анти-CD48 антитіло або фрагмент антитіла, що є суттєво біоеквівалентними анти-CD48 антитілу або фрагменту антитіла за цим винаходом. Приклади таких варіантних амінокислотних і ДНК послідовностей наводились тут раніше. Два антигензв'язуючі білки, або антитіла, вважаються біоеквівалентними, коли, наприклад, вони є фармацевтично еквівалентними або фармацевтично альтернативними антигензв'язуючими білками або антитілами, швидкість і ступінь всмоктування яких відрізняються суттєво при введенні в тій самій молярній дозі в аналогічних експериментальних умовах у вигляді одиничної дози або многократної дози. Певні антитіла будуть вважатись еквівалентами або фармацевтичними альтернативами, коли вони є еквівалентними у відношенні ступеня їх всмоктування, але не швидкості всмоктування, оскільки така різниця в швидкості всмоктування є умисною, відображеною на етикетці і несуттєвою для досягнення ефективних концентрацій препарату в організмі, наприклад при хронічному застосуванні, і вважається несуттєвою з медичної точки зору для конкретного досліджуваного лікарського продукту. В одному варіанті здійснення два антигензв'язуючих білки є біоеквівалентними, коли відсутня клінічно значима різниця у відношенні їх безпечності, чистоти і активності. В одному варіанті здійснення два антигензв'язуючих білки є біоеквівалентними, коли пацієнта можна переключати один або більше разів з еталонного продукту на біологічний продукт без очікуваного підвищення ризику несприятливих ефектів, включаючи клінічно значиму зміну імуногенності або знижену ефективність, у порівнянні з продовженою терапією без такого переключення. В одному варіанті здійснення два антигензв'язуючих білки є біоеквівалентними, коли вони обидва діють за спільним механізмом або механізмами дії на стан або стани, для яких вони використовуються, в тій мірі, в якій ці механізми є вивченими. Біоеквівалентність можна продемонструвати методами in vivo та in vitro. Методи кількісного визначення біоеквівалентності включають, наприклад, (a) тест in vivo на людях або інших ссавцях, в якому визначають концентрацію антитіла або його метаболітів у крові, плазмі, сироватці або іншій біологічній рідині як функцію часу; (б) тест in vitro, який корельовано з даними in vivo щодо біодоступності і який дозволяє обґрунтовано прогнозувати ці дані; (в) тест in vivo на людях або інших ссавцях, в якому відповідний гострий фармакологічний ефект антитіла (або його мішені) оцінюють як функцію часу; і (г) добре контрольоване клінічне випробування, в якому встановлюють безпечність, ефективність або біодоступність або біоеквівалентність антитіла. Біоеквівалентні варіанти анти-CD48 антитіл за цим винаходом можна створювати, наприклад, вводячи різні заміщення залишків або послідовностей або здійснюючи делецію термінальних або внутрішніх залишків або послідовностей, що не є обов'язковими з точки зору біологічної активності. Наприклад, цистеїнові залишки, які не є суттєвими для біологічної активності, можна видалити або замінити іншими амінокислотами, щоб попередити утворення необов'язкових або неправильних інтрамолекулярних дисульфідних містків після ренатурації. В інших контекстах біоеквівалентні антитіла можуть включати варіанти анти-CD48 антитіл, що містять амінокислотні заміщення, які модифікують характеристики глікозилювання антитіл, наприклад мутації, які виключають або усувають глікозилювання. 12 UA 108514 C2 5 10 15 20 25 30 35 40 45 50 55 60 Видова селективність і видова перехресна реактивність У відповідності до певних варіантів здійснення цього винаходу анти-CD48 антитіла зв'язуються з людським CD48, але не зв'язуються з CD48 від інших видів. Даний винахід включає також анти-CD48 антитіла, які зв'язуються з людським CD48 і з CD48 одного або більше видів, відмінних від людини. Наприклад, анти-CD48 антитіла за цим винаходом можуть зв'язуватись з людським CD48 і можуть зв'язуватись або не зв'язуватись, в залежності від ситуації, з одним або більше білком CD48 миші, щура, гвінейської свинки, хом'яка, піщанки, свині, кішки, собаки, кроля, кози, вівці, корови, коня, верблюда, яванського макаки, ігрунки, макаки резус або шимпанзе. Імунокон'югати Цей винахід охоплює анти-CD48 моноклональні антитіла, кон'юговані з терапевтичним агентом ("імунокон'югат"), таким як цитотоксин, хіміотерапевтичний препарат, імунодепресант або радіоізотоп. Цитотоксичні агенти включають будь-який препарат, що є шкідливим для клітин. Приклади цитотоксичних агентів і хіміотерапевтичних препаратів, придатних для утворення імунокон'югатів, є відомими в цій галузі (дивись, наприклад, Міжнародну заявку на патент WO 05/103081). Мультиспецифічні антитіла Антитіла за цим винаходом можуть бути моноспецифічними, біспецифічними або мультиспецифічними. Мультиспецифічні антитіла можуть бути специфічними до різних епітопів одного цільового поліпептиду або можуть містити антигензв'язуючі домени, специфічні до більше ніж одного поліпептиду. Дивись, наприклад, Tutt et al., 1991, J. Immunol. 147: 60-69; Kufer et al., 2004, Trends Biotechnol. 22: 238-244. Анти-CD48 антитіла за цим винаходом можуть бути зв'язані з іншою функціональною молекулою, наприклад іншим пептидом або білком, або можуть спільно експресуватись. Наприклад, антитіло або фрагмент антитіла можуть функціонально зв'язуватись (наприклад, хімічним зв'язком, шляхом генетичного злиття, нековалентним зв'язком або у інший спосіб) с однією або більше молекулярними утвореннями, такими як інше антитіло або фрагмент антитіла, що дає біспецифічне або мультиспецифічне антитіло з другою специфічністю зв'язування. Наприклад, даний винахід включає біспецифічні антитіла, в яких одне плече імуноглобуліну є специфічним до людського CD48 або його фрагменту, а друге плече імуноглобуліну є специфічним до другої терапевтичної мішені або кон'югованим з терапевтичним агентом, таким як інгібітор трипсину. Показовий формат біспецифічного антитіла, який можна використати в контексті цього винаходу, включає застосування першого домену CH3 імуноглобуліну (Ig) і другого домену CH3 Ig, де перший і другий домени CH3 Ig відрізняються один від одного щонайменше однією амінокислотою і де відмінність в щонайменше одній амінокислоті ослаблює зв'язування біспецифічного антитіла з Білком A у порівнянні з біспецифічним антитілом, в якому такої відмінності немає. В одному варіанті здійснення перший домен C H3 Ig зв'язує Білок А, а другий домен CH3 Ig містить мутацію, яка ослаблює або усуває зв'язування Білка А, таку як модифікація H95R (за нумерацією екзонів в IMGT; H435R за нумерацією EU). Другий домен C H3 може додатково містити модифікацію Y96F (за IMGT; Y436F за EU). Інші модифікації, які можуть бути в другому домені CH3, включають: D16E, L18M, N44S, K52N, V57M і V82I (за IMGT; D356E, L358M, N384S, K392N, V397M і V422I за EU) у випадку IgG1 антитіл; N44S, K52N і V82I (IMGT; N384S, K392N і V422I за EU) у випадку IgG2 антитіл; і Q15R, N44S, K52N, V57M, R69K, E79Q і V82I (за IMGT; Q355R, N384S, K392N, V397M, R409K, E419Q і V422I за EU) у випадку IgG4 антитіл. Варіації формату біспецифічних антитіл, описані вище, входять до об'єму даного винаходу. Терапевтичні препарати та їх введення Даний винахід пропонує фармацевтичні композиції, що містять анти-CD48 антитіла або їх антигензв'язуючі фрагменти за цим винаходом. Фармацевтичні композиції за цим винаходом готуються з відповідними носіями, допоміжними речовинами та іншими агентами, які забезпечують краще перенесення, доставку, переносимість і т.п. Величезне число відповідних лікарських форм можна знайти в фармакологічному довіднику, який відомий всім хімікамфармацевтам: Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, PA. Ці лікарські форми включають, наприклад, порошки, пасти, мазі, желе, воски, олії, ліпіди, везикули, що містять ліпіди (катіонні або аніонні) (такі як ЛІПОФЕКТИН™), ДНК-кон'югати, безводні пасти, що всмоктуються, емульсії олія-у-воді і вода-в-олії, емульсії карбовакс (поліетилен гліколі різної молекулярної маси), напівтверді гелі і напівтверді суміші, що містять карбовакс. Дивись також Powell et al. "Compendium of excipients for parenteral formulations" PDA (1998) J Pharm Sci Technol 52: 238-311. Доза антитіла, яку вводять пацієнту, може коливатись в залежності від віку і розмірів 13 UA 108514 C2 5 10 15 20 25 30 35 40 45 50 55 60 пацієнта, цільового захворювання, умов, шляху введення і т.п. Оптимальну дозу звичайно обчислюють з урахуванням маси тіла або площі поверхні тіла. Коли антитіло за цим винаходом використовується для лікування стану або захворювання, які асоціюються з активністю CD48, у дорослого пацієнта, звичайно доцільно вводити антитіло за цим винаходом внутрішньовенно у вигляді разової дози від близько 0,01 до близько 20 мг/кг маси тіла, а краще від близько 0,02 до близько 7, від близько 0,03 до близько 5 або від близько 0,05 до близько 3 мг/кг маси тіла. В залежності від тяжкості стану можна коригувати частоту введення антитіла і тривалість лікування. Ефективні дози і схеми введення анти-CD48 антитіл можуть визначатись емпірично; наприклад, можна контролювати перебіг захворювання у пацієнта за допомогою регулярного обстеження і у відповідності з цим коригувати дозу. Більше того, можна робити міжвидовий перерахунок доз, використовуючи методи, добре відомі в цій галузі (дивись, наприклад, Mordenti et al., 1991, Pharmaceut. Res. 8: 1351). Відомі різні системи доставки, які можуть застосовуватись для введення фармацевтичної композиції за цим винаходом, наприклад інкапсулювання в ліпосоми, мікрочастки, мікрокапсули, рекомбінантні клітини, здатні експресувати мутантні віруси, опосередкований рецептором ендоцитоз (дивись, наприклад, Wu et al., 1987, J. Biol. Chem. 262: 4429-4432). Методи введення включають, але без обмеження, інтрадермальний, внутрішньом'язовий, інтраперитонеальний, внутрішньовенний, підшкірний, інтраназальний, епідуральний і пероральний шляхи. Композицію можна вводити будь-яким звичайним способом, наприклад за допомогою інфузії або ін'єкції болюсом, шляхом всмоктування через епітеліальне або шкірно-слизове вистилання (наприклад, через слизову оболонку рота, ректальну і інтестинальну слизову оболонку і т.д.), і можна вводити разом з іншими біологічно активними агентами. Введення може бути системним або місцевим. Фармацевтичну композицію за цим винаходом можна доставляти підшкірно або внутрішньовенно за допомогою стандартної голки і шприца. Крім того, для підшкірної доставки фармацевтичної композиції за цим винаходом знаходить застосування шприц-ручки. Така шприц-ручка може бути багаторазового або одноразового користування. В шприц-ручці багаторазового користування звичайно застосовується змінний картридж, який містить фармацевтичну композицію. Коли вся фармацевтична композиція в картриджі використана і картридж стає порожнім, порожній картридж легко можна викинути і замінити на новий, що містить фармацевтичну композицію. Після цього шприц-ручку можна знову використовувати. В одноразовій шприц-ручці змінний картридж є відсутнім. Як правило, одноразова шприц-ручка поступає з попередньо заповненим фармацевтичною композицією резервуаром, що знаходиться в пристрої. Коли фармацевтична композиція в резервуарі витрачається, викидають весь пристрій. Численні багаторазові шприци-ручки і автоінжекторні пристрої для доставки знаходять застосування для підшкірного введення фармацевтичної композиції за цим винаходом. Приклади включають, не обмежуючись ними, шприц-ручку AUTOPEN™ (Owen Mumford, Inc., Woodstock, Велика Британія), шприц-ручку DISETRONIC™ (Disetronic Medical Systems, Bergdorf, Швейцарія), шприц-ручку HUMALOG MIX 75/25™, шприц-ручку HUMALOG™, шприц-ручку HUMALIN 70/30™ (Eli Lilly and Co., Indianapolis, США), NOVOPEN™ I, II і III (Novo Nordisk, Copenhagen, Данія), NOVOPEN JUNIOR™ (Novo Nordisk, Copenhagen, Данія), шприц-ручку BD™ (Becton Dickinson, Franklin Lakes, США), OPTIPEN™, OPTIPEN PRO™, OPTIPEN STARLET™ і OPTICLIK™ (sanofi-aventis, Frankfurt, Німеччина), і це тільки деякі. Приклади одноразових шприц-ручок, які застосовуються для підшкірного введення фармацевтичної композиції за цим винаходом, включають, не обмежуючись ними, шприц-ручку SOLOSTAR™ (sanofi-aventis), TM FLEXPEN™ (Novo Nordisk), і KWIKPEN™ (Eli Lilly), автоінжектор SURECLICK (Amgen, TM Thousand Oaks, США), PENLET (Haselmeier, Stuttgart, Німеччина), EPIPEN (Dey, L.P.) і шприцTM ручку HUMIRA (Abbott Labs, Abbott Park, США), і це тільки деякі. В певних ситуаціях фармацевтичну композицію можна доставляти у вигляді системи з контрольованим вивільненням. В одному варіанті здійснення може застосовуватись насос (дивись Langer, supra; Sefton, 1987, CRC Crit. Ref. Biomed. Eng. 14: 201). В іншому варіанті здійснення можуть застосовуватись полімерні матеріали; дивись Medical Applications of Controlled Release, Langer and Wise (eds.), 1974, CRC Pres., Boca Raton, Florida. В ще іншому варіанті здійснення система з контрольованим вивільненням може розміщуватись поблизу від мішені композиції, при цьому використовується тільки частина системної дози (дивись, наприклад, Goodson, 1984, в Medical Applications of Controlled Release, supra, vol. 2, pp. 115-138). Інші системи з контрольованим вивільненням розглядаються в огляді Langer, 1990, Science 249: 1527-1533. Ін'єкційні препарати можуть включати лікарські форми для внутрішньовенних, підшкірних, 14 UA 108514 C2 5 10 15 20 25 30 35 40 45 50 55 60 внутрішньошкірних і внутрішньом'язових ін'єкцій, крапельні інфузії і т.п. Ці ін'єкційні препарати можна приготувати загальновідомими методами. Наприклад, ін'єкційні препарати можна приготувати, шляхом розчинення, суспендування або емульгування антитіла або його солі, описаних вище, в стерильному водному середовищі або в олійному середовищі, які звичайно застосовуються для ін'єкцій. В якості водного середовища для ін'єкцій застосовують, наприклад, фізіологічний сольовий розчин, ізотонічний розчин, що містить глюкозу та інші добавки, і т.д., які можна використовувати в комбінації з відповідним агентом для солюбілізації, таким як спирт (наприклад, етиловий спирт), поліол (наприклад, пропілен гліколь, поліетилен гліколь), неіонний сурфактант [наприклад, полісорбат 80, HCO-50 (адукт гідрогенізованої рицинової олії/поліоксиетилену (50 моль))] і т.д. В якості олійного середовища застосовують, наприклад, кунжутну олію, соєву олію і т.п., які можна використовувати в комбінації з відповідним агентом для солюбілізації, таким як бензилбензоат, бензиловий спирт і т.п. Одержаний при цьому ін'єкційний препарат переважно поміщають у відповідну ампулу. Доцільно, щоб вищеописані фармацевтичні композиції для перорального або парентерального застосування готувались в лікарських формах як одноразова доза, яка відповідає дозі активних інгредієнтів. Такі лікарські форми у вигляді одноразової дози включають, наприклад, таблетки, пігулки, капсули, ампули для ін'єкцій, супозиторії і т.д. Кількість вищевказаного антитіла для одноразової дози звичайно становить від близько 5 до близько 500 мг на лікарську форму; зокрема у випадку ін'єкції, краще, щоб в лікарській формі для ін'єкційного препарату містилось від близько 5 до близько 100 мг, а для інших лікарських форм від близько 10 до близько 250 мг вищевказаного антитіла. Терапевтичне застосування антитіл Антитіла за цим винаходом є застосовними, серед іншого, для лікування, попередження та/або зменшення інтенсивності будь-якого захворювання або розладу, асоційованих з активністю CD48 або обумовлених нею, які піддаються лікуванню шляхом блокування взаємодії між CD48 і рецептором CD48. Типові захворювання і розлади, які можна лікувати анти-CD48 антитілами за цим винаходом, включають, наприклад, астму, алергію, атопічний дерматит, кон'юнктивіт, запальну хворобу кишечнику (наприклад, виразковий коліт), целіакію (глютенову хворобу) і рак (наприклад, рак клітин крові (гемобластоз), рак мозку, рак молочної залози, колоректальний рак, рак голови і шиї, рак печінки, рак легені, рак яєчника, рак підшлункової залози, рак передміхурової залози, рак шкіри, рак шлунку і т.д.). Анти-CD48 антитілами за цим винаходом можна вводити пацієнтам також для лікування псоріазу. Інші захворювання і розлади, які можна лікувати анти-CD48 антитілами за цим винаходом, включають, наприклад, системний червоний вовчак (SLE), ревматоїдний артрит, реакцію трансплантату проти хазяїна (GvHD) (наприклад, хронічну GvHD або гостру GvHD) і відторгнення трансплантату. Комбінаційна терапія Даний винахід включає терапевтичні схеми, які передбачають введення анти-CD48 антитіла за цим винаходом в комбінації щонайменше з одним додатковим терапевтично активним компонентом. Необмежуючі приклади таких додаткових терапевтично активних компонентів включають інші антагоністи CD48 (наприклад, друге анти-CD48 антитіло або низькомолекулярний інгібітор CD48), інгібітори цитокінів (наприклад, інгібітор інтерлейкіну-1 (IL1) (такий як рілонацепт або анакінра, низькомолекулярний антагоніст IL-1 або анти-IL-1 антитіло); інгібітор IL-18 (такий як низькомолекулярний антагоніст IL-18 або анти-IL-18 антитіло); інгібітор IL-4 (такий як низькомолекулярний антагоніст IL-4, анти-IL-4 антитіло або антитіло проти рецептору IL-4); інгібітор IL-6 (такий як низькомолекулярний антагоніст IL-6, анти-IL-6 антитіло або антитіло проти рецептору IL-6); аспірин; НСПВП (NSAIDs); стероїди (наприклад, преднізолон, метотрексат і т.д.); Циклоспорин A в низькій дозі; інгібітори фактору некрозу пухлини (TNF) або рецептору TNF (наприклад, низькомолекулярний антагоніст TNF або TNFR або анти-TNF або TNFR антитіло); інгібітори синтезу сечової кислоти (наприклад, алопуринол); промотори виділення сечової кислоти (наприклад, пробенецид, сульфінпіразон, бензбромарон і т.д.); інші інгібітори запалення (наприклад, інгібітори каспази-1, p38, IKK1/2, CTLA-4Ig і т.д.); та/або кортикостероїди. Такі додаткові терапевтично активні компоненти можна вводити до, одночасно або після введення анти-CD48 антитіла за цим винаходом (для цілей даного опису такі схеми введення розглядаються як введення анти-CD48 антитіла "в комбінації з" терапевтично активним компонентом за цим винаходом). Застосування антитіл в діагностиці Анти-CD48 антитіла за цим винаходом можуть також застосовуватись для виявлення та/або кількісного визначення CD48 у зразку, наприклад с метою діагностики. Наприклад, анти-CD48 антитіло або його фрагмент можна використати для діагностики стану або захворювання, які характеризуються аномальною експресією (наприклад, надекспресією, зниженою експресією 15 UA 108514 C2 5 10 15 20 25 30 35 40 45 50 55 60 або відсутністю експресії і т.д.) CD48. Приклади методів діагностики з використанням CD48 можуть включати, наприклад, контактування зразка, отриманого від пацієнта, з анти-CD48 антитілом за цим винаходом, коли анти-CD48 антитіло є міченим міткою або репортерною молекулою. Як варіант, для діагностики може використовуватись немічене анти-CD48 антитіло в комбінації з вторинним антитілом, яке саме по собі є міченим міткою. Така мітка або 3 14 32 35 125 репортерна молекула може представляти собою радіоізотоп, такий як H, C, P, S або I; флуоресцентну або хемілюмінесцентну молекулу, таку як молекула флуоресцеїну або родаміну; або фермент, такий як лужна фосфатаза, бета-галактозидаза, пероксидаза хрону або люцифераза. Конкретні приклади аналізів, якими можна скористатись для виявлення або кількісного визначення CD48 у зразку, включають твердофазний імуноферментний аналіз (ELISA), радіоімуноаналіз (RIA) і сортування флуоресцентно активованих клітин (FACS). Зразки, які можуть використовуватись в діагностиці CD48 за цим винаходом, включають будь-який зразок тканини або рідини, отриманий від пацієнта, який містить кількість білка CD48 або його фрагмента, що піддається виявленню. Загалом, рівні CD48 в конкретному зразку, отриманому від здорового пацієнта (наприклад, пацієнта, що не має захворювання або стану, асоційованих з аномальним рівнем або аномальною активністю CD48), визначають для того, щоб спочатку встановити базовий або стандартний, рівень CD48. Цей базовий рівень CD48 можна потім порівняти з рівнями CD48 в зразках, отриманих від індивідів з підозрою на захворювання або стан, пов'язані з CD48. ПРИКЛАДИ Наступні приклади наведені з метою забезпечити спеціалістів в даній галузі повним розкриттям і описом того, як отримати і застосувати композиції і методи за цим винаходом, без наміру обмежити об'єм того, що винахідники вважають своїм винаходом. Ми намагались забезпечити точність у відношенні наведених величин (наприклад, кількостей, температури і т.д.), але слід взяти до уваги можливість певних експериментальних похибок і відхилень. Коли не вказується інше, частини означають вагові частини, молекулярна маса означає середню молекулярну масу, температура дається в градусах Цельсія, а тиск відповідає атмосферному або є близьким до нього. Приклад 1. Отримання людських антитіл до людського CD48 Імуноген, що містить ектодомен людського CD48 (амінокислоти 27-220 послідовності SEQ ID №: 384), вводився безпосередньо, з ад'ювантом для стимуляції імунної відповіді, мишам ® VELOCIMMUNE , які мали ДНК, кодуючу варіабельні ділянки важкого і каппа легкого ланцюгів імуноглобуліну. Імунну відповідь антитіла контролювали за допомогою CD48-специфічного імунного аналізу. Коли досягалась бажана імунна відповідь, збирали спленоцити і зливали їх з клітинами мишачої мієломи, щоб зберегти їх життєздатність і утворити гібридомні клітинні лінії. Ці гібридомні клітинні лінії піддавали скринінгу і відбору з метою ідентифікувати клітинні лінії, які продукують CD48-специфічні антитіла. За допомогою цієї методики було отримано кілька химерних анти-CD48 антитіл (тобто, антитіл, що містять людські варіабельні домени і мишачі постійні домени); показові антитіла, отримані у такий спосіб, були позначені наступним чином: H2M1707N, H2M1709N, H2M1710N, H2M1712N, H2M1713N, H2M1763N, H2M1811N, H3M1766N, H2M1798N і H2M1711N. Анти-CD48 антитіла виділяли також безпосередньо з антиген-позитивних B-клітин без злиття з клітинами мієломи, як описано в заявці на патент США 2007/0280945A1. Цим методом було отримано кілька повністю людських анти-CD48 антитіл (тобто, антитіл, що містять людські варіабельні домени і людські постійні домени); показові антитіла, отримані у такий спосіб, були позначені наступним чином: H4H1769Na, H4H1769Pa, H4H1769Nb, H4H1769Pb, H4H1770N, H4H1770P, H4H1771N, H4H1771P, H4H1772N, H4H1772P, H4H1774N, H4H1774P, H4H1775N, H4H1775P, H4H1778N, H4H1778P, H4H1779N, H4H1779P, H4H1781N, H4H1781P, H4H1789Na, H4H1789Pa, H4H1789Nb, H4H1789Pb. Біологічні властивості показових анти-CD48 антитіл, отриманих у відповідності до методів цього Прикладу, докладно описані в Прикладах, наведених далі. Приклад 2. Амінокислотні послідовності варіабельної ділянки важкого і легкого ланцюгів В Таблиці 1 представлені пари амінокислотних послідовностей варіабельної ділянки важкого і легкого ланцюгів відібраних анти-CD48 антитіл і відповідні їх позначення. Позначення N, P і G стосуються антитіл, що мають важкий і легкий ланцюги з ідентичними послідовностями CDR, але з варіаціями послідовностей поза CDR послідовностями (тобто, на каркасних ділянках). Таким чином, варіанти N, P і G конкретного антитіла мають ідентичні CDR послідовності на варіабельних ділянках важкого і легкого ланцюгів, але відрізняються один від одного своїми каркасними ділянками. Використовувані тут префікси H2M, H3M, H4H в позначенні антитіл вказують на конкретну ділянку Fc антитіла. Наприклад, антитіло "H2M" має 16 UA 108514 C2 мишачий IgG2 Fc, тоді як антитіло "H4H" має IgG4 Fc людини. Як має бути зрозумілим спеціалісту в даній галузі, антитіло H2M або H3M можна перетворити на антитіло H4H і навпаки, але варіабельні домени (включаючи ділянки CDR) залишаються тими самими. Таблиця 1 Позначення антитіла H2M1707N H2M1709N H2M1710N H2M1712N H2M1713N H2M1763N H2M1764N H2M1811N H3M1766N H4H1769Na H4H1769Pa H4H1769Nb H4H1769Pb H4H1770N H4H1770P H4H1771N H4H1771P H4H1772N H4H1772P H4H1774N H4H1774P H4H1775N H4H1775P H4H1778N H4H1778P H4H1779N H4H1779P H4H1781N H4H1781P H4H1789Na H4H1789Pa H4H1789Nb H4H1789Pb HCVR 2 18 34 50 66 82 98 114 130 162 178 162 178 192 208 212 228 232 248 252 268 272 288 292 308 312 328 332 348 352 368 352 368 HCDR1 4 20 36 52 68 84 100 116 132 164 164 164 164 194 194 214 214 234 234 254 254 274 274 294 294 314 314 334 334 354 354 354 354 HCDR2 6 22 38 54 70 86 102 118 134 166 166 166 166 196 196 216 216 236 236 256 256 276 276 296 296 316 316 336 336 356 356 356 356 SEQ ID №№: HCDR3 LCVR 8 10 24 26 40 42 56 58 72 74 88 90 104 106 120 122 136 138 168 170 168 180 168 182 168 190 198 200 198 210 218 220 218 230 238 240 238 250 258 260 258 270 278 280 278 290 298 300 298 310 318 320 318 330 338 340 338 350 358 360 358 370 358 372 358 380 LCDR1 12 28 44 60 76 92 108 124 140 172 172 184 184 202 202 222 222 242 242 262 262 282 282 302 302 322 322 342 342 362 362 374 374 LCDR2 14 30 46 62 78 94 110 126 142 174 174 186 186 204 204 224 224 244 244 264 264 284 284 304 304 324 324 344 344 364 364 376 376 LCDR3 16 32 48 64 80 96 112 128 144 176 176 188 188 206 206 226 226 246 246 266 266 286 286 306 306 326 326 346 346 366 366 378 378 5 10 15 Приклад 3. Зв'язування антитіла з розчинним CD48, оцінюване методом поверхневого плазмонного резонансу Афінність і кінетичні константи зв'язування людських моноклональних анти-hCD48 антитіл з людським і мавпячим розчинним рекомбінантним CD48 визначали методом поверхневого плазмонного резонансу при 25ºC і 37ºC як для мономерної, так і для димерної конфігурацій CD48. Вимірювання проводили на приладі T100-2 BIACORE (Biacore Life Sciences division of GE Healthcare, Piscataway, США). Антитіла (з мишачим Fc [позначені "H2M" або "H3M"] або людським IgG4 Fc [позначені "H4H"]) вловлювали на поверхні анти-Fc чипа, а CD48 омивав поверхню в мономерному форматі (розчинний CD48, експресований з C-термінальною mycmyc-гексагістидиновою міткою [mmH]) або в димерному форматі (розчинний CD48, експресований з C-термінальним Fc злиттям [mFc]). Позначення амінокислотних послідовностей реагентів, застосованих в цьому Прикладі, представлені в Таблиці 2. 17 UA 108514 C2 Таблиця 2 Конструкція SEQ ID №: Мономерний людський CD48-mmH 385 Мономерний мавпячий CD48-mmH 386 Димерний людський CD48-mFc 387 Димерний мавпячий CD48-mFc 388 5 Розчинний CD48 подавали в проточну камеру в вигляді окремих інжекцій з різною концентрацією і визначали кінетичні константи швидкості асоціації (k a) і дисоціації (kd) шляхом підгонки до даних щодо кінетики зв'язування з використанням програмного забезпечення Biacore. Рівноважні константи дисоціації і півперіод дисоціації обчислювали за константами -1 -1 -1 швидкості: KD=kd / ka; t1/2 = (ln2/kd) (одиниці: ka=M *сек ; kd = сек ; KD=M; T½ = хв.) (Таблиці 3-6). Таблиця 3 (25ºC) Антитіло H2M1707N Мономерний людський CD48 ka kd KD T½ 1.31E+05 6.42E-04 4.92E-09 18 Димерний людський CD48 ka kd KD 7.14E+05 6.59E-05 9.23E-11 T½ 175 H4H1707N 1.68E+05 6.01E-04 3.57E-09 19 3.85E+05 2.83E-05 7.36E-11 408 H2M1709N 2.92E+05 5.80E-03 1.98E-08 2 9.28E+05 2.88E-04 3.11E-10 40 H2M1710N 3.73E+04 1.46E-03 3.91E-08 8 1.12E+05 9.38E-05 8.41E-10 123 H2M1711N 6.92E+05 1.13E-03 1.64E-09 10 1.64E+06 1.02E-04 6.23E-11 113 H2M1712N 5.24E+05 6.19E-03 1.18E-08 2 1.84E+06 5.30E-04 2.88E-10 22 H2M1713N 1.61E+05 2.17E-04 1.35E-09 53 8.26E+05 1.11E-05 1.34E-11 1043 H4H1713N 1.94E+05 1.74E-04 8.93E-10 67 8.94E+05 1.90E-05 2.12E-11 609 H2M1763N 5.48E+05 6.48E-03 1.18E-08 2 1.95E+06 4.99E-04 2.56E-10 23 H4H1763N 7.69E+05 6.31E-03 8.20E-09 2 2.05E+06 5.48E-05 2.68E-11 211 H2M1764N 1.21E+05 2.85E-03 2.35E-08 4 2.59E+05 2.66E-04 1.03E-09 43 H4H1764N 1.05E+05 2.48E-03 2.36E-08 5 2.68E+05 6.05E-05 2.26E-10 191 H3M1766N 6.34E+04 1.77E-04 2.79E-09 65 1.29E+05 6.57E-05 5.10E-10 176 H4H1769P 1.93E+05 7.79E-05 4.03E-10 148 9.69E+05 1.08E-05 1.11E-11 1071 H4H1770P 5.89E+05 1.53E-04 2.59E-10 76 1.71E+06 5.54E-06 3.25E-12 2084 H4H1771P 8.05E+05 2.09E-04 2.60E-10 55 2.07E+06 1.52E-05 7.36E-12 759 H4H1772P 1.27E+05 1.76E-04 1.38E-09 66 3.76E+05 1.29E-05 3.44E-11 894 H4H1774P 1.04E+05 4.72E-05 4.54E-10 245 3.11E+05 4.65E-06 1.49E-11 2486 H4H1775P 1.45E+05 4.92E-05 3.40E-10 235 7.34E+05 1.31E-05 1.79E-11 881 H4H1778P 9.86E+04 4.69E-05 4.76E-10 246 2.94E+05 8.95E-06 3.04E-11 1291 H4H1779P 1.58E+05 3.90E-05 2.46E-10 296 7.74E+05 1.17E-05 1.51E-11 990 H4H1781P 1.70E+05 3.30E-05 1.94E-10 351 8.54E+05 1.23E-05 1.44E-11 940 H4H1789Pa 1.43E+05 4.58E-04 3.20E-09 25 3.82E+05 3.66E-05 9.58E-11 315 H2M1798N 9.14E+05 2.47E-03 2.70E-09 5 2.05E+06 2.71E-04 1.32E-10 43 H2M1811N 5.00E+04 8.49E-04 1.70E-08 14 1.44E+05 2.30E-04 1.60E-09 50 10 18 UA 108514 C2 Таблиця 4 (37ºC) Антитіло H2M1707N H4H1707N H2M1709N H2M1710N H2M1711N H2M1712N H2M1713N H4H1713N H2M1763N H4H1763N H2M1764N H4H1764N H3M1766N H4H1769P H4H1770P H4H1771P H4H1772P H4H1774P H4H1775P H4H1778P H4H1779P H4H1781P H4H1789Pa H2M1798N H2M1811N Мономерний людський CD48 ka kd KD T½ 2.14E+05 3.14E-03 1.47E-08 4 2.84E+05 2.73E-03 9.63E-09 4 1.14E+06 4.00E-02 3.51E-08 0 3.40E+04 5.20E-03 1.53E-07 2 9.26E+05 3.02E-03 3.26E-09 4 8.46E+05 1.40E-02 1.66E-08 1 2.35E+05 6.44E-04 2.74E-09 18 2.86E+05 6.36E-04 2.23E-09 18 1.49E+06 2.01E-02 1.35E-08 1 1.33E+06 1.69E-02 1.27E-08 1 1.69E+05 1.60E-02 9.47E-08 1 1.05E+05 1.14E-02 1.09E-07 1 1.61E+05 6.20E-04 3.84E-09 19 2.25E+05 3.14E-04 1.40E-09 37 8.04E+05 5.33E-04 6.62E-10 22 1.12E+06 5.47E-04 4.88E-10 21 1.72E+05 1.02E-03 5.94E-09 11 1.30E+05 1.07E-04 8.24E-10 108 1.77E+05 9.48E-05 5.36E-10 122 1.35E+05 1.13E-04 8.37E-10 102 2.07E+05 1.02E-04 4.95E-10 113 2.26E+05 1.01E-04 4.48E-10 114 1.99E+05 1.79E-03 8.97E-09 6 1.41E+06 8.35E-03 5.94E-09 1 1.30E+05 2.95E-03 2.27E-08 4 Димерний людський CD48 ka kd KD 9.20E+05 2.27E-04 2.47E-10 9.81E+05 6.42E-05 6.54E-11 1.52E+06 3.77E-04 2.48E-10 4.81E+05 4.26E-04 8.85E-10 2.08E+06 2.39E-04 1.15E-10 2.72E+06 6.85E-04 2.52E-10 1.25E+06 8.27E-05 6.63E-11 1.26E+06 4.53E-05 3.60E-11 3.02E+06 8.83E-04 2.93E-10 2.35E+06 6.28E-05 2.67E-11 7.02E+05 4.12E-04 5.86E-10 3.01E+05 9.94E-05 3.30E-10 9.49E+05 3.24E-04 3.42E-10 1.21E+06 3.63E-05 3.01E-11 2.23E+06 3.08E-05 1.38E-11 2.89E+06 4.81E-05 1.66E-11 9.20E+05 5.98E-05 6.50E-11 3.63E+05 1.60E-05 4.39E-11 5.22E+05 2.27E-05 4.34E-11 4.73E+05 3.53E-05 7.46E-11 7.72E+05 4.59E-05 5.94E-11 8.12E+05 4.89E-05 6.03E-11 2.21E+05 3.57E-05 1.61E-10 2.91E+06 2.17E-04 7.47E-11 2.65E+05 2.56E-04 9.66E-10 T½ 51 180 31 27 48 17 140 255 13 184 28 116 36 319 375 240 193 724 509 327 252 236 324 53 45 Таблиця 5 (25ºC) Антитіло H4H1707N H4H1713N H4H1763N H4H1764N H4H1769P H4H1770P H4H1771P H4H1772P H4H1774P H4H1775P H4H1778P H4H1779P H4H1781P H4H1789Pa Мономерний мавпячий CD48 ka kd KD 2.89E+05 3.62E-04 1.25E-09 3.15E+05 2.65E-04 8.43E-10 5.27E+05 1.24E-03 2.34E-09 8.77E+04 2.06E-04 2.34E-09 5.88E+05 3.93E-04 6.69E-10 7.20E+05 2.15E-04 2.98E-10 1.05E+06 4.77E-04 4.53E-10 4.61E+05 5.08E-04 1.10E-09 2.63E+05 7.63E-05 2.89E-10 2.91E+05 4.07E-05 1.40E-10 2.76E+05 8.98E-05 3.25E-10 3.01E+05 1.13E-04 3.75E-10 2.98E+05 7.80E-05 2.62E-10 4.16E+05 1.38E-03 3.31E-09 19 T½ 32 44 9 56 29 54 24 23 151 284 129 102 148 8 Димерний мавпячий CD48 ka kd KD T½ 8.05E+05 1.19E-03 1.48E-09 10 8.61E+05 2.42E-04 2.81E-10 48 1.33E+06 6.88E-05 5.19E-11 168 2.51E+05 1.32E-04 5.25E-10 88 4.82E+05 2.56E-05 5.31E-11 451 8.58E+05 1.13E-04 1.31E-10 103 9.39E+05 5.51E-05 5.87E-11 210 5.19E+05 5.02E-05 9.68E-11 230 3.95E+05 2.07E-05 5.25E-11 558 4.88E+05 6.60E-06 1.35E-11 1750 3.84E+05 1.77E-05 4.60E-11 654 5.22E+05 3.17E-05 6.06E-11 364 5.99E+05 2.13E-05 3.56E-11 542 6.51E+05 2.76E-04 4.23E-10 42 UA 108514 C2 Таблиця 6 (37ºC) Антитіло H4H1707N H4H1713N H4H1763N H4H1764N H4H1769P H4H1770P H4H1771P H4H1772P H4H1774P H4H1775P H4H1778P H4H1779P H4H1781P H4H1789Pa 5 10 15 20 25 30 35 40 Мономерний мавпячий CD48 ka kd KD 3.27E+05 1.22E-03 3.72E-09 3.20E+05 3.82E-04 1.19E-09 5.34E+05 1.33E-03 2.49E-09 2.13E+05 6.20E-04 2.91E-09 2.80E+05 1.10E-03 3.92E-09 3.96E+05 1.74E-04 4.40E-10 6.57E+05 8.77E-04 1.34E-09 3.20E+05 1.45E-03 4.53E-09 1.97E+05 2.67E-04 1.36E-09 2.60E+05 1.29E-04 4.98E-10 1.89E+05 2.53E-04 1.34E-09 2.77E+05 2.89E-04 1.04E-09 3.50E+05 3.07E-04 8.75E-10 4.37E+05 2.06E-03 4.71E-09 T½ 9 30 9 19 11 66 13 8 43 90 46 40 38 6 Димерний мавпячий CD48 ka kd KD 1.64E+06 5.24E-03 3.20E-09 1.72E+06 5.16E-04 3.00E-10 2.42E+06 1.14E-04 4.70E-11 1.92E+05 1.42E-03 7.40E-09 6.97E+05 9.80E-05 1.41E-10 1.53E+06 1.39E-04 9.11E-11 1.64E+06 1.02E-04 6.21E-11 7.72E+05 7.31E-05 9.47E-11 5.08E+05 5.40E-05 1.07E-10 6.69E+05 3.97E-05 5.93E-11 5.25E+05 3.60E-05 6.86E-11 7.21E+05 5.98E-05 8.29E-11 8.75E+05 6.61E-05 7.55E-11 9.90E+05 7.68E-04 7.76E-10 T½ 2 22 101 8 118 83 113 158 214 291 321 193 175 15 Як показано в Таблицях 3-6, показові антитіла, тестовані в даному Прикладі, проявляли високу афінність зв'язування як з людським, так і з мавпячим розчинним білком CD48. Коли в якості аналіту в рідкій фазі застосовували двохвалентний CD48, спостерігалось помітне підвищення афінності зв'язування у порівнянні з одновалентним CD48. Приклад 4. Епітопне картування зв'язування H4H1789Pa з CD48 за допомогою обміну H/D Були проведені експерименти для визначення амінокислотних залишків CD48, з якими взаємодіє H4H1789Pa. З цією метою було здійснене епітопне картування з H/D обміном. Загальний опис методу H/D обміну є представленим, наприклад, в статтях Ehring (1999) Analytical Biochemistry 267(2): 252-259; та Engen and Smith (2001) Anal. Chem. 73: 256A-265A. З метою картування епітопу CD48 для зв'язування H4H1789Pa з використанням H/D обміну було застосовано злиту конструкцію CD48-myc-myc-his ("hCD48-mmH"; SEQ ID №: 391). hCD48mmH спочатку піддали деглікозилюванню з використанням PNGase F (ПНГ-ази F) (New England BioLabs) в нативних умовах. Потім H4H1789Pa приєднали ковалентним зв'язком до антитіла проти людського IgG, іммобілізованого на гранулах агарози (Sigma) за допомогою крослінкеру 3 BS (Thermo Scientific). В експерименті "асоціація-розчин/дисоціація-гранули" (обмін-асоціація в розчині с наступним обміном-дисоціацією в гранулах) ліганд (деглікозильований hCD48-mmH) дейтерували впродовж 5 хв. або 10 хв. в буфері PBS, приготовленому на D 2O, а потім зв'язали з H4H1789Pa гранулами під час 2-хвилинної інкубації. Гранули, зв'язані з CD48, промили водним буфером PBS (приготовленим з H2O) і інкубували впродовж половини часу обміну-асоціації). Після дисоціації зв'язаний CD48 змили з гранул охолодженим льодом розчином TFA з низьким рН. Далі змитий CD48 розщепили іммобілізованим пепсином (Thermo Scientific) впродовж 5 хв. Отримані пептиди виділили з використанням хроматографічної піпетки з наконечником ZipTip і відразу аналізували на час-прольотному іонізаційному лазерному мас-спектрометрі з матрицею UltrafleXtreme (MALDI-TOF)-TOF (MS). В експерименті "асоціація-в-гранулах/дисоціація-в-гранулах" (обмін з асоціацією в гранулах з наступним обміном-дисоціацією в гранулах) CD48 спочатку зв'язали з гранулами H4H1789Pa, а потім інкубували впродовж 5 хв. або 10 хв. в D 2O для обміну-асоціації. Наступні стадії (обміндисоціація, розщеплення пепсином і МС аналіз) провели так, як описано в методиці "асоціація в розчині/дисоціація в гранулах". Центроїдні значення всіх виявлених пептидів обчислили і порівняли для цих двох експериментів. Результати представлені в Таблиці 7a, яка забезпечує кількісне порівняння центроїдних відношень маси-до-заряду для всіх виявлених пептидів, ідентифікованих методом рідинної хроматографії-лазерної десорбції/іонізації з використанням матриці (LC-MALDI) MS після H/D обміну і розщеплення пепсином. Хоча для більшості отриманих в результаті розщеплення пепсином пептидів спостерігались подібні центроїдні відношення маси-до-заряду в обох експериментах (асоціація-в-розчині/дисоціація-в-гранулах і асоціація-в-гранулах/дисоціація-вгранулах), три різних отриманих при розщепленні пептиду пепсином, які відповідали залишкам 60–76 послідовності SEQ ID №: 384, і сім пептидів, які відповідали залишкам 107–125 послідовності SEQ ID №: 384, стабільно показували більш високі центроїдні значення (тобто, 20 UA 108514 C2 підвищене утримування дейтерію) в експерименті "асоціація-в-розчині/дисоціація-в-гранулах". Для цілей даного Прикладу позитивна різниця (Δ) щонайменше 0,20 є показником амінокислот, захищених зв'язуванням з антитілом. Такі залишки в Таблиці 7а показані жирним шрифтом і зірочкою (*). 5 Таблиця 7a Зв'язування H4H1789Pa з hCD48-mmH Залишки (SEQ ID №: 384) 27 – 33 32 – 50 45 – 59 53 – 59 60 – 68* 60 – 76* 63 – 76* 69 – 76 77 – 94 95 – 106 95 – 107 107 – 120* 107 – 125* 108 – 120* 108 – 125* 110 – 120* 110 – 121* 110 – 125* 161 – 175 161 – 178 161 – 181 163 – 175 163 – 181 166 – 181 168 – 181 225 – 236 225 – 248 228 – 248 237 – 248 10 15 20 5 хв. ас.- / 2,5 хв. дис.-обмін Асоціація в Асоціація в розчині гранулах / Δ /Дисоціація в Дисоціація в гранулах гранулах 804.97 804.95 0.03 2001.88 2001.78 0.11 1856.18 1856.19 -0.01 986.77 986.75 0.02 0.39 1143.72 1143.33 0.34 2195.08 2194.74 0.21 1783.45 1783.24 1070.35 1070.29 0.06 2036.78 2036.65 0.13 1413.74 1413.70 0.03 1576.79 1576.86 -0.07 0.28 1711.01 1710.73 0.47 2379.65 2379.19 0.44 1547.48 1547.04 0.48 2216.50 2216.02 0.26 1303.49 1303.23 0.46 1489.25 1488.79 0.42 1972.12 1971.70 1902.09 1902.05 0.04 2257.67 2257.70 -0.02 2557.23 2557.13 0.10 1688.45 1688.40 0.05 2343.05 2343.03 0.02 1893.07 1892.97 0.10 1672.12 1672.13 -0.02 1318.53 1318.53 -0.01 2828.26 2828.14 0.12 2498.76 2498.69 0.07 1528.63 1528.56 0.07 10 хв. ас.- / 5 хв. дис.-обмін Асоціація в Асоціація в розчині / гранулах / Δ Дисоціація в Дисоціація в гранулах гранулах 804.93 804.98 -0.05 2001.68 2001.77 -0.09 1856.37 1856.32 0.04 986.26 986.15 0.12 0.37 1143.78 1143.41 0.31 2195.13 2194.82 0.25 1783.51 1783.26 1070.30 1070.29 0.01 2036.73 2036.87 -0.13 1413.64 1413.65 -0.01 1576.83 1576.84 -0.02 0.24 1710.97 1710.73 0.31 2379.64 2379.33 0.26 1547.38 1547.12 0.39 2216.54 2216.15 0.22 1303.46 1303.24 0.34 1489.22 1488.89 0.33 1972.10 1971.77 1902.07 1902.05 0.02 2257.70 2257.92 -0.22 2557.09 2557.35 -0.27 1688.31 1688.29 0.01 2342.94 2343.22 -0.28 1892.89 1893.21 -0.33 1672.14 1672.21 -0.07 1318.51 1318.63 -0.12 2828.09 2828.30 -0.21 2498.71 2498.83 -0.12 1528.49 1528.58 -0.08 Результати H/D обміну, наведені в Таблиці 7a, показують, що дві ділянки (які відповідають амінокислотам 60-76 і 107-125 послідовності SEQ ID №: 384) є захищеними від протонного обміну-дисоціації зв'язуванням H4H1789Pa з цими специфічними епітопами на CD48 після обміну-асоціації. Оскільки у пептидів, які відповідають залишкам 69-76, не спостерігається помітної різниці мас, N-термінальна ділянка епітопу може бути зменшеною до залишків 60-68 послідовності SEQ ID №: 384. Відповідно, два сегменти (які відповідають амінокислотам 60-76 і 107-125 послідовності SEQ ID №: 384) на CD48 визначаються методом H/D обміну як епітоп переривчастого типу для зв'язування антитіла H4H1789Pa з розчинним людським білком CD48. Ці ділянки взаємодії антитіла є локалізованими в Ig Домені 1 білка CD48 (схематично вони показані на Фіг. 1). Для підтвердження валідності і точності вищеописаного епітопного картування були проведені додаткові експерименти з використанням контрольного антитіла, що містить попередньо визначений епітоп. Зокрема, були проведені експерименти з H/D обміну із застосуванням описаної конструкції CD48-mmH (SEQ ID №: 391) і анти-Myc антитіла 9E10. Епітоп Myc відповідає амінокислотам 195-216 послідовності SEQ ID №: 391. 21 UA 108514 C2 5 10 Всі методики, використані в цих підтверджуючих експериментах, були такими ж, як в описаних вище експериментах з H4H1789Pa, за виключенням того, що в якості тестового антитіла використали анти-Myc антитіло 9E10. Результати підтверджуючих анти-Myc експериментів представлені в Таблиці 7b. (Зверніть увагу, що нумерація залишків в першій колонці Таблиці 7b відповідають фактичній нумерації амінокислот в конструкції hCD48-mmH [SEQ ID №: 391], тоді як нумерація залишків в першій колонці Таблиці 7a скоригована таким чином, щоб відповідати номеру амінокислоти в поліпептиді людського CD48 повної довжини [SEQ ID №: 384]). Як і раніше, позитивна різниця (Δ) щонайменше 0,20 вказує на амінокислоти, захищені зв'язуванням з антитілом. Такі залишки в Таблиці 7b показані жирним шрифтом і зірочкою (*). Таблиця 7b Зв'язування 9E10 з hCD48-mmH Залишки (SEQ ID №: 391) 1-7 19-33 34-50 37-50 43-50 51-68 69-80 69-81 81-94 81-99 82-94 82-99 84-94 84-99 135-155 137-145 137-155 140-155 199-210 199-222* 202-222* 211-220* 211-222* 15 20 25 5 хв. ас.- / 2,5 хв. дис.-обмін Асоціація в Асоціація в розчині гранулах / Δ /Дисоціація в Дисоціація в гранулах гранулах 804.93 804.91 0.02 1856.16 1856.24 -0.09 2194.74 2194.68 0.06 1783.23 1783.21 0.02 1070.04 1070.07 -0.03 2036.51 2036.52 0.00 1413.96 1413.89 0.07 1576.94 1577.07 -0.13 1710.59 1710.62 -0.02 2379.16 2379.23 -0.07 1546.91 1546.84 0.07 2215.89 2215.89 0.00 1303.32 1303.34 -0.02 1972.13 1972.14 -0.02 2556.75 2556.64 0.12 1186.27 1186.33 -0.06 2342.71 2342.93 -0.22 1891.85 1891.90 -0.05 1318.80 1318.57 0.22 1.61 2830.27 2828.66 1.30 2500.60 2499.30 0.62 1255.00 1254.38 0.60 1529.30 1528.69 10 хв. ас.- / 5 хв. дис.-обмін Асоціація в Асоціація в розчині гранулах / Δ /Дисоціація в Дисоціація в гранулах гранулах 804.99 804.95 0.04 *** *** 2194.75 2194.64 0.10 1783.27 1783.19 0.08 1070.09 1070.08 0.01 2036.53 2036.50 0.02 1413.78 1413.80 -0.02 1577.05 1577.09 -0.04 1710.59 1710.57 0.03 2379.26 2379.24 0.02 1546.90 1546.84 0.06 2215.88 2215.87 0.00 1303.29 1303.20 0.09 1972.21 1972.11 0.10 2556.71 2556.66 0.05 1186.27 1186.29 -0.02 2342.99 2342.94 0.05 1891.90 1891.92 -0.02 1318.59 1318.61 -0.02 1.36 2829.99 2828.63 1.03 2500.31 2499.28 0.48 1254.86 1254.38 0.45 1529.21 1528.76 Як і очікувалось, епітоп, розпізнаний антитілом 9E10, ідентифікується як такий, що знаходиться на ділянці, яка визначається амінокислотами 199-222 послідовності SEQ ID №: 391. Таким чином, результати, представлені в Таблиці 7b, підтверджують, що метод H/D обміну, застосований в даному Прикладі, може використовуватись для надійної і точної ідентифікації амінокислотних залишків на поліпептидному антигені, з яким взаємодіє антитіло. Приклад 5. Блокування антитілом взаємодії CD48 – 2B4, кількісно оцінювана методом ELISA Здатність людських анти-CD48 моноклональних антитіл блокувати зв'язування людського CD48 і мавпячого CD48 з когнатним людським лігандом, людським 2B4, кількісно оцінювали за допомогою конкурентного аналізу ELISA в сандвіч варіанті (Таблиця 8). Постійні кількості біотинільованого димерного людського білка CD48, експресованого як злиття з мишачим IgG2a Fc ("bio-hCD48-mFc" [SEQ ID №: 387]), або мономерного мавпячого CD48, експресованого з міткою, що складається з 2 myc і одного 6-His епітопів ("mfCD48-mmH" [SEQ ID №: 386]), титрували окремо різними кількостями антитіл. Такі комплекси антитіло-білок інкубували (1 год., 25 °C) перед тим, як переносити їх на мікротитраційні планшети, покриті димерною конструкцією, що експресує людський 2B4 рецептор, злитий або з людським IgG1 (h2B4-hFc 22 UA 108514 C2 5 10 [R&D Systems, Inc., Minneapolis, MN, Cat. №. 1039-2B]), або з мишачим IgG2a Fc (h2B4-mFc [SEQ ID №: 389). Через 1 годину при 25 °C лунки відмили і зв'язаний людський CD48 виявляли стрептавідином, кон'югованим з пероксидазою хрону (HRP), а мавпячий CD48 – за допомогою кон'югованого з HRP анти-myc поліклонального антитіла. Зразки аналізу ELISA проявляли розчином TMB, щоб викликати колориметричну реакцію, і гасили сірчаною кислотою, а потім зчитували поглинання при 450 нм на зчитувачі планшет Victor X5. Сигмоїдальні криві дозареакція підгонили до цих даних за допомогою програми Prism. Обчислену величину IC50, що визначається як концентрація антитіла, необхідна для блокування 50 % зв'язування hCD48 або mfCD48 с 2B4, використовували в якості показника активності блокування. (Таблиці 8 і 9, NB = зв'язування не спостерігається) Таблиця 8 Антитіло H2M1707N H2M1709N H2M1710N H2M1711N H2M1712N H2M1713N H2M1763N H2M1764N H3M1766N H2M1798N H2M1811N h2B4-hFc + біо-hCD48-mFc IC50 (молярна) 2.2E-11 4.5E-11 5.8E-10 5.9E-12 1.4E-11 2.6E-11 8.8E-12 6.4E-11 NB 5.0E-12 4.9E-10 h2B4-hFc+mfCD48-mmH IC50 (молярна) 2.3E-11 1.2E-10 3.7E-10 2.9E-11 1.7E-11 2.4E-11 1.3E-11 2.4E-10 NB NB 2.2E-10 Таблиця 9 Антитіло H2M1707N H4H1707N H2M1710N H2M1711N H2M1713N H4H1713N H2M1763N H4H1763N H2M1764N H4H1764N H4H1769P H4H1770P H4H1771P H4H1772P H4H1774P H4H1775P H4H1778P H4H1779P H4H1781P H4H1789Pa 15 20 h2B4-mFc + біо-hCD48-mFc IC50 (молярна) 8.6E-12 2.2E-11 4.9E-10 4.1E-12 2.2E-11 1.8E-11 5.5E-12 7.4E-12 2.9E-11 7.6E-11 1.5E-11 2.0E-11 9.9E-12 1.4E-11 2.5E-11 4.4E-11 5.6E-11 1.6E-11 1.8E-11 5.3E-11 h2B4-mFc+mfCD48-mmH IC50 (молярна) 4.9E-12 4.5E-11 2.6E-10 7.7E-13 2.5E-12 3.4E-12 2.3E-12 7.2E-12 6.2E-11 1.6E-10 1.8E-11 2.2E-11 2.2E-12 4.4E-12 1.6E-11 4.3E-11 8.4E-12 5.7E-12 8.1E-12 3.8E-11 Як показано в Таблицях 8 і 9, всі тестовані антитіла ефективно блокували взаємодію між CD48 і 2B4. Приклад 6. Блокування антитілом вивільнення IFN-гамма в первинних людських PBMCs (мононуклеарних клітин периферичної крові) Здатність людських анти-CD48 моноклональних антитіл за цим винаходом блокувати активацію первинних людських мононуклеарних клітин периферичної крові (PBMC) оцінювали кількісно, аналізуючи вивільнення IFNγ. Людські PBMC були виділені з концентрату лейкоцитів 23 UA 108514 C2 5 10 15 від кількох донорів (Leukopak, New York Blood Center, New York, США) центрифугуванням в градієнті Ficoll–Hypaque. Клітини були ресуспендовані в середовищі RPMI-1640, доповненому 10 % фетальної бичачої сироватки, з кінцевою концентрацією 1 мільйон/мл і засіяні в 96-лункові мікротитраційні планшети (200 мкл на лунку). Клітини інкубували з різними кількостями CD48специфічних антитіл (1 год., 37 °C), після чого додали агоністичні анти-CD3 (B&D Pharmingen, San Jose, California, Кат. № 555336) і анти-CD28 (B&D Pharmingen, San Jose, California, Кат. № 555725) антитіла (обидва в кінцевій концентрації 40 нг/мл), попередньо змішані з білком G (в кінцевій концентрації 0,8 мг/мл, Sigma-Aldrich, St. Louis, MO, Кат. № P4689). Через 48 годин при 37 °C і 5 % CO2 зібрали супернатанти і визначили концентрацію IFNγ, застосовуючи набір ELISA (B&D BIosciences, San Jose, California, Кат. № 555142) у відповідності до протоколу виробника. Сигмоїдальні криві доза-реакція підігнали до цих даних за допомогою програми Prism. Обчислену величину IC50, яку визначали як концентрація антитіла, необхідна для блокування 50 % максимального вивільнення IFNγ, використовували в якості показника активності блокування. (Таблиці 10–12, NB = зв'язування не спостерігається; ND = не визначали; NC = дані не сходяться). Таблиця 10 Антитіло H2M1707N H2M1709N H2M1763N H2M1798N H2M1764N H2M1711N H2M1710N H2M1712N H3M1766N H2M1811N H2M1713N Донор 1 4.9E-11 4.8E-11 4.9E-11 4.3E-11 2.7E-11 NB 7.8E-10 2.0E-11 NB 9.1E-11 2.1E-11 IC50 (молярна) для пригнічення вивільнення IFN-гамма Донор 2 Донор 3 Донор 4 3.0E-11 1.1E-10 1.7E-10 5.7E-11 1.2E-10 1.1E-10 3.4E-11 1.3E-10 7.5E-11 3.4E-11 9.5E-11 5.7E-10 1.1E-10 1.9E-10 9.5E-11 NB NB NB 1.9E-10 1.1E-06 1.5E-09 2.8E-11 7.2E-11 4.8E-11 NB NB NB 4.6E-10 8.3E-11 4.8E-10 7.6E-11 NB 1.1E-10 Донор 5 1.5E-11 3.2E-11 1.9E-11 6.0E-11 1.9E-11 NB 2.7E-10 1.1E-11 NB 9.4E-11 1.1E-11 Таблиця 11 Антитіло H2M1707N H2M1763N H2M1764N H2M1710N H2M1713N H4H1769Pa H4H1770P H4H1771P H4H1772P H4H1774P H4H1775P H4H1778P H4H1779P H4H1781P H4H1789Pa IC50 (молярна) для пригнічення вивільнення IFN-гамма Донор 6 Донор 7 9.3E-12 1.9E-11 2.6E-11 1.8E-11 1.0E-10 Не тестували 5.0E-11 1.4E-10 2.2E-11 1.0E-10 NB NC NB NB NB NB 2.0E-12 2.2E-11 2.5E-11 9.5E-12 NC 5.1E-12 9.8E-12 NC 1.7E-12 1.5E-11 3.6E-11 1.5E-11 1.2E-11 1.8E-11 24 UA 108514 C2 Таблиця 12 IC50 (молярна) для пригнічення вивільнення IFN-гамма Донор 8 Донор 9 Донор 10 Донор 11 NC 5.10E-11 NC NC 8.60E-12 9.30E-12 1.00E-12 3.40E-12 5.30E-12 3.10E-11 5.10E-12 2.30E-11 NB 5.70E-12 NB 1.90E-11 NC NB NB 1.50E-11 NB NC 1.40E-12 8.60E-11 3.10E-12 2.30E-12 2.00E-11 NC 3.70E-11 1.60E-11 1.30E-11 1.30E-11 Антитіло H4H1707N H4H1763N H4H1764N H4H1769Pa H4H1771P H4H1772P H4H1775P H4H1789Pa 5 10 15 20 25 Як показано в Таблицях 10, 11 і 12, більшість тестованих антитіл ефективно блокували вивільнення IFNγ в первинних людських PBMC. Приклад 7. Блокування вивільнення IFN-гамма в аналізах реакції первинних людських змішаних лейкоцитів (MLR) Здатність людських анти-CD48 моноклональних антитіл за цим винаходом блокувати активацію первинних людських мононуклеарних клітин периферичної крові (PBMC) оцінювали кількісно з використанням реакції змішаних лейкоцитів (Таблиці 13 і 14). Людські PBMC виділяли з концентрату лейкоцитів (Leukopak, New York Blood Center, New York, США) або із зразків цільної крові (отриманих у відповідності до власної програми збирання крові) градієнтним центрифугуванням на Ficoll-Hypaque). Клітини ресуспендували в середовищі RPMI-1640, доповненому 10 % фетальної бичачої сироватки до кінцевої концентрації 1 мільйон/мл. Щойно виділені клітини змішували з попередньо опроміненими клітинами від іншого донора у співвідношенні 10:1 і засівали в 96-лункові мікротитраційні планшети (200 мкл на лунку). Відразу після засівання клітин додали антитіла до кінцевої концентрації від 0,01 нМ до 10 нМ. Клітини інкубували впродовж 7 днів при 37 °C і 5 % CO2. Супернатанти зібрали і визначили концентрацію IFNγ, застосовуючи набір ELISA (B&D BIosciences, San Jose, California, Кат. № 555142) у відповідності до протоколу виробника. Сигмоїдальні криві доза-реакція підганяли до цих даних за допомогою програми Prism. Рівень блокування IFNγ визначали як різницю між максимальними і мінімальними значеннями кривих, підігнаних за даними доза-реакція, нормалізовану за максимальним значенням («% блокади" в Таблицях 13 і 14; "nb" = зв'язування не спостерігається; NC = дані не сходяться). Обчислену величину IC50, яку визначали як концентрація антитіла, необхідна для блокування 50 % максимального вивільнення IFNγ, використовували в якості показника активності блокування. (Таблиця 14). Таблиця 13 Антитіло H4H1769Pa H4H1771P H4H1772P H4H1775P H4H1789Pa H4H1707N H4H1763N H4H1764N Orencia® Amevive® belatacept D1 nb 78 nb 42 65 66 59 69 nb 54 81 % блокування для дев'яти індивідуальних донорів (D1-D9) D2 D3 D4 D5 D6 D7 D8 60 39 nb 43 60 51 40 79 88 nb 47 50 36 nb 65 62 39 62 63 58 25 77 87 37 70 72 69 22 66 88 36 89 82 75 65 87 78 20 62 77 62 42 89 68 52 63 75 48 30 46 80 nb 75 59 48 nb 52 nb nb 68 80 53 58 53 76 66 78 40 79 nb 77 74 90 82 83 80 64 25 D9 nb 32 59 60 66 60 53 nb 75 nb 66 UA 108514 C2 Таблиця 14 Донор D1 D2 D3 D4 D5 D6 D7 D8 D9 D10 D11 D12 D13 D14 D15 D16 5 10 15 20 25 H4H1763N % блокування 59 89 68 52 63 75 48 30 53 79 72 79 72 90 82 90 IC50 (M) -11 ~1.0 × 10 NC -12 ~6.4 × 10 -10 2.1 × 10 -11 ~2.7 × 10 -11 2.3 × 10 NC -9 ~3.7 × 10 -9 ~4.1 × 10 -11 ~8.4 × 10 -11 7.3 × 10 -11 ~5.6 × 10 -11 9.2 × 10 -11 6.3 × 10 -14 ~5.9 × 10 -12 7.6 × 10 H4H1789Pa % блокування IC50 (M) -12 65 ~1.4 × 10 -12 66 ~9.3 × 10 88 NC -10 36 2.3 × 10 -11 89 ~9.0 × 10 -12 82 2.8 × 10 75 NC -11 65 2.9 × 10 -10 66 1.8 × 10 -11 77 ~5.0 × 10 -11 80 ~9.2 × 10 -10 55 ~3.0 × 10 -11 64 ~9.6 × 10 -10 83 2.0 × 10 -12 95 ~2.7 × 10 -11 85 ~1.2 × 10 Як показано в Таблицях 13 і 14, всі тестовані антитіла ефективно блокували вивільнення IFNγ в реакції первинних людських змішаних лімфоцитів (PBMC MLR). Здатність ймовірних анти-CD48 антитіл ефективно блокувати вивільнення IFNγ в первинних людських PBMC, продемонстрована в Прикладах 6 і 7, засвідчує, що ці антитіла можуть застосовуватись для блокування неадекватних автоімунних реакцій при таких захворюваннях і станах, як системний червоний вовчак, ревматоїдний артрит, хвороба трансплантату проти хазяїна, запальна хвороба кишечнику, алергія, целіакія (глютенова хвороба), псоріаз, астма і т.п. -/- -/Приклад 8. Блокування антитілом вивільнення людських цитокінів у мишей Rag2 γc , трансформованих людськими гематопоетичними стовбуровими клітинами Здатність людських анти-CD48 моноклональних антитіл за цим винаходом блокувати активацію людських імунних клітин in vivo визначали кількісно з використанням моделі на -/- -/химерних тваринах, які представляли собою імунодефіцитних мишей Rag2 γc , трансформованих людськими гематопоетичними стовбуровими клітинами. Тварин трансформували людськими стовбуровими клітинами невдовзі після народження і підтверджували трансформування за допомогою проточної цитометрії. Повністю трансформованим тваринам (віком 12–16 тижнів) вводили у вигляді інтраперитонеальної (ІР) ін'єкції 5 мг/кг CD48–специфічних антитіл або відповідний ізотипний контроль (людське IgG4(S108P) антитіло власного виготовлення), а через 24 години вводили агоністичне мишаче антитіло проти людського CD3 (OKT3, 1 мкг/тварину, IP ін'єкція, BioLegend, San Diego, California, Кат № 317315) або ізотипний контроль (мишаче IgG2a антитіло власного виготовлення). Зразки крові брали через 24 години після стимуляції і визначали кількісно рівні дев'яти людських цитокінів у сироватці з використанням набору для мультиплексного аналізу MSD (Human Proinflammatory 9-Plex Ultra-Sensitive Kit, MesoScale Discovery, Gaithersburg, Maryland, Кат. № K15007C-2) у відповідності до протоколу виробника. Обидва тестовані антитіла пригнічували продукування людських цитокінів (Таблиці 15 і 16). 26 UA 108514 C2 Таблиця 15 Експериментальна група IgG2a + hIgG4mut IgG2a + H4H1763N IgG2a + H4H1789Pa OKT3 OKT3 + hIgG4mut OKT3 + H4H1763N OKT3 + H4H1789Pa IFNγ Рівень цитокінів у сироватці (пг/мл) IL-6 IL-10 TNFα IL-2 206.5+30.1 145.9+18.5 394.0+37.8 261.0+25.6 173.2+21.4 166.3+9.8 153.9+13.7 343.8+15.0 301.2+16.8 194.7+11.5 185.6+14.5 169.1+13.1 380.1+11.5 326.3+27.3 184.9+15.5 8383.1+ 425.8 5967.7+ 1659.4 1144.1+ 120.6 1124.4+ 190.1 21128.3+ 1276.0 3853.8+ 742.3 1457.4+69.4 2900.6+ 209.7 2668.4+ 555.6 521.6+85.9 493.9+55.4 180.2+12.4 536.2+34.0 497.1+56.6 295.1+35.3 617.0+116.9 249.0+38.8 460.9+30.2 339.4+20.7 244.4+15.3 Таблиця 16 Експериментальна група IgG2a + hIgG4mut IgG2a + H4H1763N IgG2a + H4H1789Pa OKT3 OKT3 + hIgG4mut OKT3 + H4H1763N OKT3 + H4H1789Pa 5 10 15 20 IL-8 Рівень цитокінів у сироватці (пг/мл) IL-12 p70 IL-1β GM-CSF 2186.8+885.4 202.7+7.3 490.7+37.7 177.7+14.8 5808.0+926.0 217.9+10.4 437.4+26.7 175.6+10.3 2740+651 213.4+11.4 408.8+15.9 172.3+7.7 5241.8+ 1237.0 225.6+13.0 445.0+8.8 1107.7+90.9 19899.0+3138.1 279.0+18.2 603.9+41.4 676.3+59.2 3381.0+1169.0 182.1+10.5 410.4+22.4 243.3+10.4 1585.7+ 269.2 206.3+4.2 395.0+16.4 559.3+76.8 Як показано в Таблицях 15 і 16, обидва тестовані антитіла ефективно блокували вивільнення цитокінів, індуковане поліклональною стимуляцією людських імунних клітин в -/- -/химерній in vivo системі (миші Rag2 γc , трансформовані людськими гематопоетичними стовбуровими клітинами). Приклад 9. Пригнічення антитілом втрати ваги і пролонгованого виживання на ксеногенній моделі реакції трансплантат проти хазяїна (GvHD) Здатність людського анти-CD48 моноклонального антитіла, H4H1789Pa, блокувати активацію людських імунних клітин in vivo визначали з використанням ксеногенної моделі на тваринах реакції трансплантат-проти-хазяїна, GvHD, яку викликали у імунодефіцитних мишей -/- -/NOD/scid/ γc (NSG) пересадкою людських мононуклеарних клітин периферичної крові (PBMC). Восьмитижневим мишам внутрішньовенно вводили щойно виділені PBMC здорових нормальних добровольців (День 0). Швидкість приживлення трансплантату оцінювали як відсоток клітин, позитивних до поверхневого маркеру людських клітин CD45 (виявлених за допомогою проточної цитометрії), в периферичній крові через три дні після ін'єкції PBMC. Введена інтраперитонеально за 24 години до індукції людськими РВМС разова доза H4H1789Pa (10 мг/кг) повністю пригнічувала приживлення людських клітин (
ДивитисяДодаткова інформація
Назва патенту англійськоюAnti-cd48 antibodies and uses thereof
Автори англійськоюClasson, Brendan, J., Kostic, Ana, Duan, Xunbao
Автори російськоюКлассон Брендан Дж., Костик Ана, Дуан Ксунбао
МПК / Мітки
МПК: C07K 16/28, A61K 39/395, A61P 17/00
Мітки: антитіло, застосування, анти-cd48
Код посилання
<a href="https://ua.patents.su/139-108514-anti-cd48-antitilo-ta-jjogo-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Анти-cd48 антитіло та його застосування</a>
Наступний патент: Спосіб відділення супутника від ракети-носія і пристрій для здійснення способу
Випадковий патент: Газотурбінна установка