Засіб для збільшення виділення тgf-бета в головний мозок та для інгібування нейротоксичності, яка проводиться бета -амілоїдними пептидами
Формула / Реферат
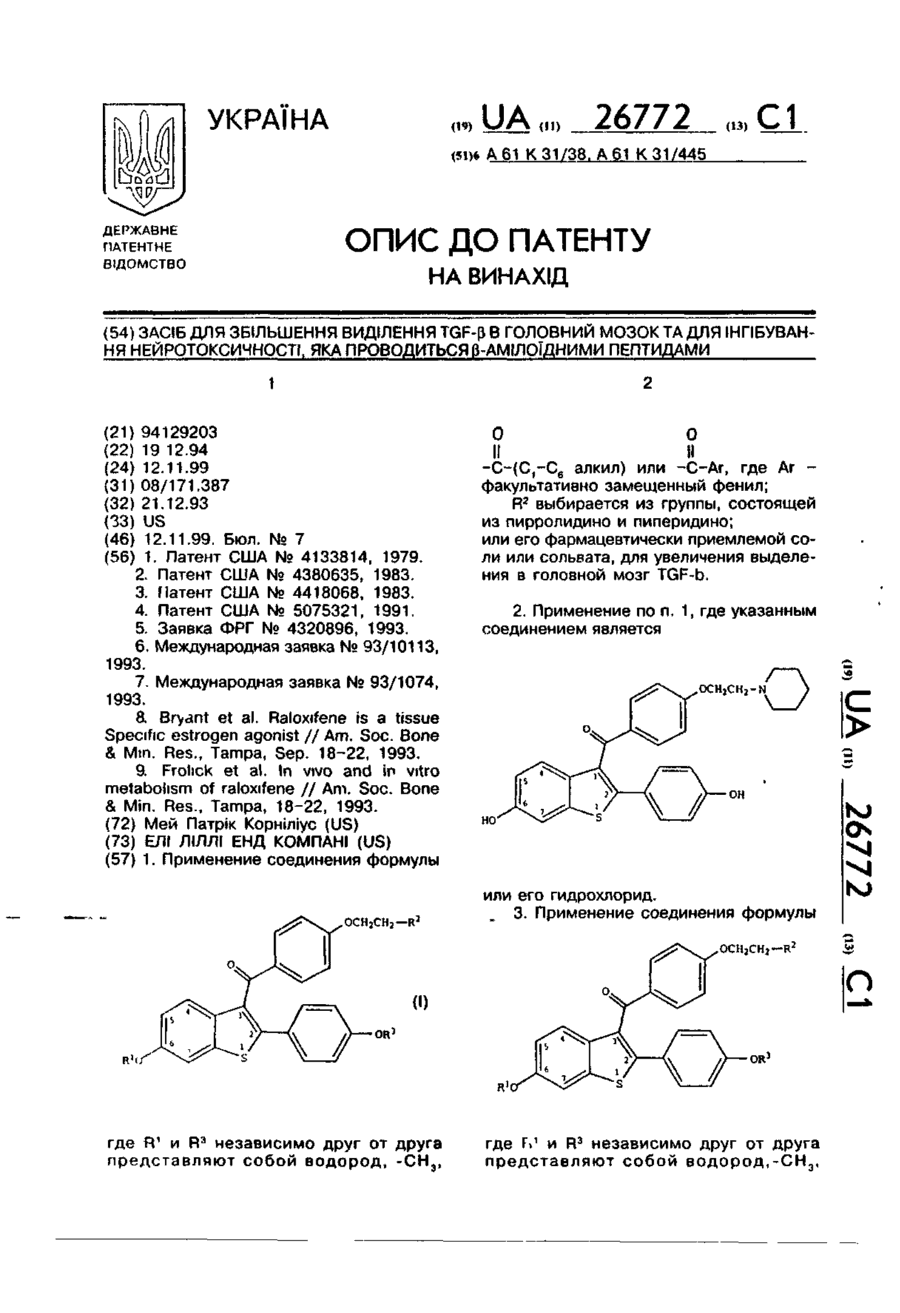
1. Применение соединения формулы
где R1 и R3 независимо друг от друга представляют собой водород, -CH3, или где Ar - факультативно замещенный фенил;
R2 выбирается из группы, состоящей из пирролидино и пиперидино;
или его фармацевтически приемлемой соли или сольвата, для увеличения выделения в головной мозг TGF-b.
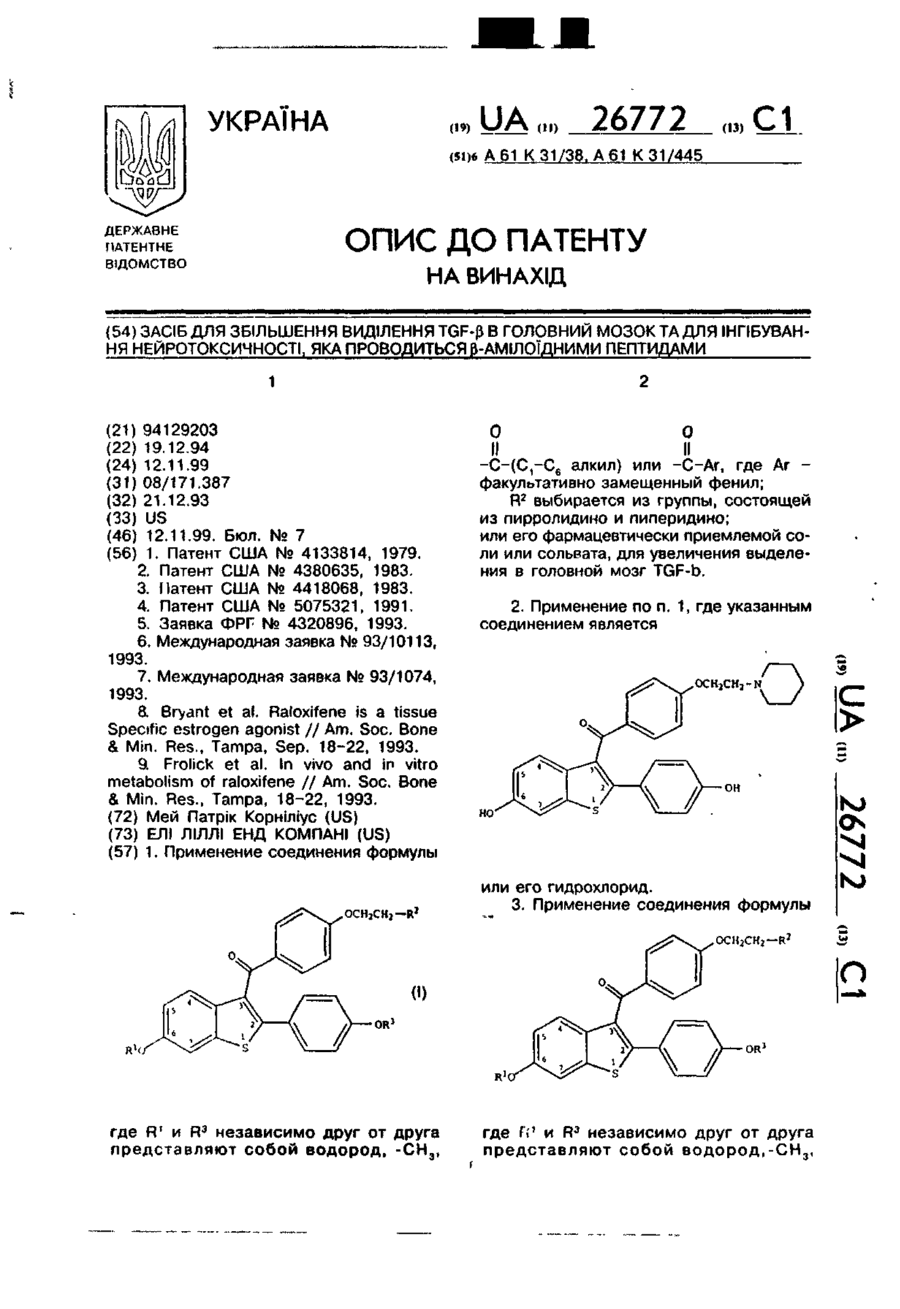
2. Применение по п.1, где указанным соединением является
или его гидрохлорид.
3. Применение соединения формулы
где R1 и R3 независимо друг от друга представляют собой водород, -CH3, или где Ar - факультативно замещенный фенил;
R2 выбирается из группы, состоящей из пирролидино и пиперидино;
или его фармацевтически приемлемой соли или сольвата, для ингибирования нейротоксичности, проводимой b-амилоидными пептидами.
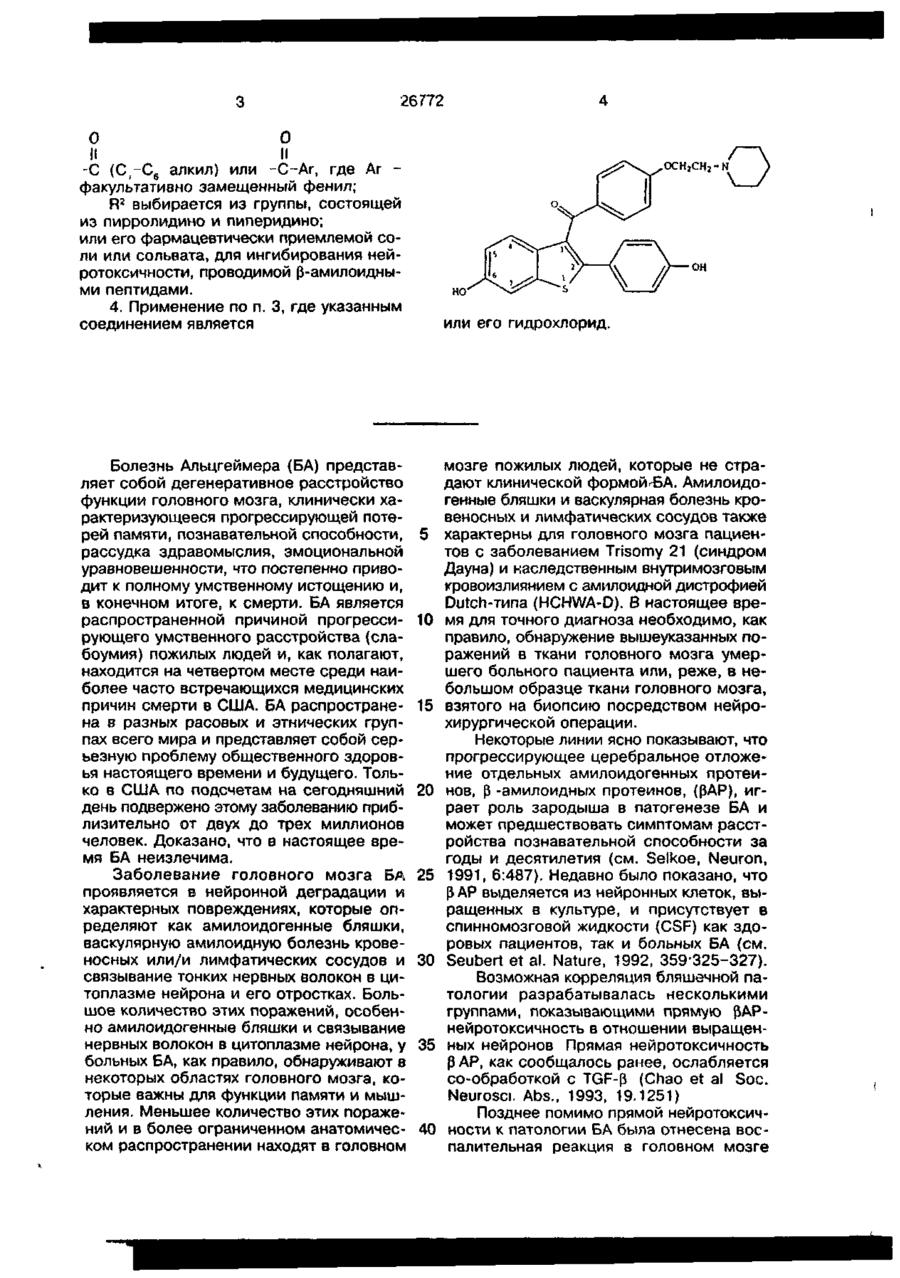
4. Применение по п.3, где указанным соединением является
или его гидрохлорид.
Текст
1. Применение соединения формулы ОСН 2 СН 2 —R 2 о - C - ^ - C g алкил) или -С-Ar, где Аг факультативно замещенный фенил; R2 выбирается из группы, состоящей из пирролидино и пиперидино; или его фармацевтически приемлемой соли или сольвата, для увеличения выделения в головной мозг TGF-b. 2. Применение по п. 1, где указанным соединением является он или его гидрохлорид. 3. Применение соединения формулы KJ о (I) где R' и R3 независимо друг от друга представляют собой водород, -СН3, KJ где П' и R3 независимо друг от друга представляют собой водород,-СН 3 , 26Г72 О О II II -С (С ( -С 6 алкил) или -С-Ar, где Аг факультативно замещенный фенил; R2 выбирается из группы, состоящей из пирролидино и пиперидино; или его фармацевтически приемлемой соли или сольвата, для ингибирования нейротоксичности, проводимой р-амилоидными пептидами. 4. Применение по п. 3, где указанным соединением является или его гидрохлорид. Болезнь Альцгеймера (БА) представляет собой дегенеративное расстройство функции головного мозга, клинически характеризующееся прогрессирующей потерей памяти, познавательной способности, рассудка здравомыслия, эмоциональной уравновешенности, что постепенно приводит к полному умственному истощению и, в конечном итоге, к смерти. БА является распространенной причиной прогрессирующего умственного расстройства (слабоумия) пожилых людей и, как полагают, находится на четвертом месте среди наиболее часто встречающихся медицинских причин смерти в США. БА распространена в разных расовых и этнических группах всего мира и представляет собой серьезную проблему общественного здоровья настоящего времени и будущего. Только в США по подсчетам на сегодняшний день подвержено этому заболеванию приблизительно от двух до трех миллионов человек. Доказано, что в настоящее время БА неизлечима. Заболевание головного мозга БА проявляется в нейронной деградации и характерных повреждениях, которые определяют как амилоидогенные бляшки, васкулярную амилоидную болезнь кровеносных или/и лимфатических сосудов и связывание тонких нервных волокон в цитоплазме нейрона и его отростках. Большое количество этих поражений, особенно амилоидогенные бляшки и связывание нервных волокон в цитоплазме нейрона, у больных БА, как правило, обнаруживают в некоторых областях головного мозга, которые важны для функции памяти и мышления. Меньшее количество этих поражений и в более ограниченном анатомическом распространении находят в головном мозге пожилых людей, которые не страдают клинической формой БА. Амилоидогенные бляшки и васкулярная болезнь кровеносных и лимфатических сосудов также характерны для головного мозга пациентов с заболеванием Trisomy 21 (синдром Дауна) и наследственным внутримозговым кровоизлиянием с амилоидной дистрофией Dutch-типа (HCHWA-D). В настоящее время для точного диагноза необходимо, как правило, обнаружение вышеуказанных поражений в ткани головного мозга умершего больного пациента или, реже, в небольшом образце ткани головного мозга, взятого на биопсию посредством нейрохирургической операции. Некоторые линии ясно показывают, что прогрессирующее церебральное отложение отдельных амилоидогенных протеинов, р -амилоидных протеинов, (РАР), играет роль зародыша в патогенезе БА и может предшествовать симптомам расстройства познавательной способности за годы и десятилетия (см. Selkoe, Neuron, 1991, 6:487). Недавно было показано, что р АР выделяется из нейронных клеток, выращенных в культуре, и присутствует в спинномозговой жидкости (CSF) как здоровых пациентов, так и больных БА (см. Seubert et al. Nature, 1992, 359325-327). Возможная корреляция бляшечной патологии разрабатывалась несколькими группами, показывающими прямую $АРнейротоксичность в отношении выращенных нейронов Прямая нейротоксичность Р АР, как сообщалось ранее, ослабляется со-обработкой с TGF-p (Chao et al Soc. Neurosci. Abs., 1993, 19.1251) Позднее помимо прямой нейротоксичности к патологии БА была отнесена воспалительная реакция в головном мозге 5 10 15 20 25 30 35 40 26772 больных БА, возможно обусловленная р АР Ограниченное клиническое испытание с NSAID-индометацином продемонстрировало замедление прогрессирования слабоумия Альцгеймера (Rogers et al. Science, 1993. 260:1719-1720). Несмотря на прогресс в изучении и объяснении механизма БА, сохраняется необходимость в разработке композиций и способов лечения этого заболевания. Способ лечения БА могли бы успешно основываться на лекарствах, которые способны увеличивать выработку в головном мозге TGF-p , снижая таким образом нейротоксичность, проводимую р -амилоидными пептидами, и уменьшая интенсивность воспалительной реакции, связанной с БА. Данное изобретение предлагает способы ингибирования болезни Альцгеймера, которые включают введение человеку при необходимости такого лечения эффективного количества соединения формулы (I) О С Н 2 С Н 2 — R' 5 10 15 20 25 30 где R1 и R3, независимо друг от друга, 35 водород, -СН3, -С-(С 1 ~С 6 алкил) или -СК -С-Ar, где Аг - необязательно замещен0 40 ный фенил; R2 выбирается из группы, состоящей из пирролидино, гексаметиленимино и пиперидино, 45 и его фармацевтически приемлемой соли и сольвата. Данное изобретение предлагает способ увеличения выделения TGF-p в головном мозге, включающий введение челове- 50 ку при необходимости лечения эффективного количества соединения формулы (I). Данное изобретение предлагает также способ ингибирования нейротоксичности, проводимой р-амилоидными пептида- 55 ми, и воспалительной реакции, связанной с болезнью Альцгеймера (БА), включающий введение человеку при необходимости лечения эффективного количества соединения формулы (I) 6 Данное изобретение связано с открытием того факта что выбранная группа бензотиофенов формулы (I), является полезной для ингибирования последствий болезни Альцгеймера, и в особенности того, что соединения, как полагают, ингибируют воспалительную реакцию, связанную с этой болезнью, посредством увеличения выделения TGF-p в головной мозг. Изобретение включает способы практического применения посредством введения человеку при необходимости лечения дозы соединения формулы (I) или фармацевтически приемлемой соли или сольвата, эффективной для ингибирования болезни Альцгеймера. Способы охватывают как терапевтическое, так и профилактическое применение. • Термин "ингибирование" используется в его общепринятом значении, которое включает запрещение, предупреждение, сдерживание, ослабление, остановку, реверсию прогрессирования, ослабления тяжести или симптома заболевания или его последствия. Термин "эффективное количество" оз-' начает количество соединения, необходимое для ингибирования болезни Альцгеймера или любого ее симптома, ингибирование нейротоксичности, проводимой рамилоидными пептидами или воспалительной реакции, связанной с болезнью Альцгеймера, или увеличения выделения TGFв головном мозге. Как правило, соединение включается в композицию с обычными носителями, наполнителями, разбавителями, и спрессовывается в таблетки или изготавливается в форме эликсиров или растворов для удобного перорального введения, лмбо для введения внутримышечно или внутривенно. Соединения могут быть введены трансдермально и могут быть изготовлены в форме с контролируемым выделением действующего вещества и т.п. Соединения, использованные в способах данного изобретения, могут быть получены согласно известным методикам или методами, схожими с ними, такими, как подробно описанные в Патентах США № 4133814, 4418068 и 4380635, которые включены в список литературных ссылок данного изобретения. Получение, как правило, начинается с исходного бензо(в)тиофена, имеющего в положении 6 гидроксильную группу, а в положении 2 - 4 г идроксифенил. В исходное вещество вводят защитную группу, ацилируют, после него защитную группу удаляют с получением соединений формулы (I). Примеры 26772 получения таких соединений приведены в патентах США, указанных выше, и в примерах данного изобретения. Необязательно замещенный фенил включает фенил и фенил, содержащий в качестве замести- 5 теля одну или две группы С^-Сз-алкил, СрСд-алкокси, гидрокси, нитро, хлор, фтор или три хлор или фторметил. Одним из соединений данного изобретения является рапоксифен (raioxifene), 10 строение которого представлено ниже: OCB}CHj-N 15 неї 20 Соединения, применяемые в способах данного изобретения образуют фармацевтически приемлемые кислотно-аддитивные и основно-аддитивные соли с широким спектром органических и неорганических кислот и оснований, которые включают физиологически приемлемые соли, часто используемые в фармахимии. Такие соли также являются частью данного изобретения. Обычные неорганические кислоты, используемые для таких солей, включают соляную бромводородную, йодводородную, азотную, серную, фосфорную, гипофосфорную и т.п. Соли, полученные из органических кислот, таких как алифатические моно- и дикарбоновые кислоты, фенилзамещенные алкановые кислоты, гидроксиалкановые кислоты и гидроксиалкандионовые кислоты, ароматические кислоты, алифатические и ароматические сульфокислоты, также могут использоваться. Эти фармацевтически приемлемые соли включают ацетат, фенилацетат, трифторацетат, акрилат, аскорбат, бензоат, хлорбензоат, динитробензоат, гидроксибензоат, метоксибензоат, метилбензоат, о-ацетоксибензоат, нафталин-2бензоат, бромид, изобутират фенил бутират, р-гидроксибутират, бутин-1,4-диоат, гексин~1,4-диоат, капрат, каприлат, хлорид, циннамат, цитрат, формиат, фумарат, гликолят, гептаноат, гиппурат, лактат, малат, малеат, гидроксималеат, малонат, манделат, мезилат, никотинат, изоникотинат, нитрат, оксалат, фталат, терафталат, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, пропиолат (propiolate), пропионат, фенилпропио 25 30 35 40 45 50 55 8 нат, салицилат, себацат, сукцинат, суберат, сульфат, бисульфат, пиросульфат, сульфит, бисульфит, сульфонат, бензолсульфонат, п-бромфенилсульфонат, хлорбензолсульфомат» этансульфонат, 2гидроксиэтансульфонат, метансульфонат, нафталин-1 -сульфонат, нафталин-2-сульфонат, п-толуолсульфонат, ксилолсульфонат, тартрат и т.п. Предпочтительной солью является гидрохлорид. Фармацевтически приемлемые кислотно-аддитивные соли обычно получают реакцией соединения формулы (I) с эквимолярным количеством или избытком кислоты. Реагенты соединяют в растворителе, взаимно приемлемом для обоих реагентов, таком как диэтиловый эфир или бензол. Соль обычно выпадает в осадок из раствора в пределах временного интервала от 1 до 10 ч и может быть выделена фильтрованием, или растворитель отгоняют общепринятыми способами. Основания, используемые обычно для получения основно-аддитивных солей, включают гидроокись аммония и гидроокиси щелочных и щелочноземельных металлов, карбонаты, а также алифатические первичные, вторичные и третичные амины, алифатические диамины. Основания, особенно полезные для получения аддитивных солей, включают гидроокись аммония, карбонат калия, метиламин, диэтиламин, этилендиамин и циклогексиламин. Фармацевтически приемлемые соли обычно обладают лучшими характеристиками растворимости по сравнению с соединениями, из которых они получены, и поэтому часто более удобны для приготовления композиций в виде растворов или эмульсий. Фармацевтические композиции могут быть изготовлены хорошо известными способами. Например, соединения могут быть введены в композиции с общепринятыми наполнителями, разбавителями или носителями, и изготовлены в форме таблеток, капсул, суспензий, порошков и т.п. Примерами наполнителей, разбавителей и носителей, пригодных для применения в таких композициях, является: наполнители или разбавители, такие как крахмал, сахара, маннитол и кремниевые производные; связующие агенты, такие как карбоксиметилцеллюлоза и другие производные целлюлозы, альгинаты, желатин и поливинилпирролидон; увлажнители, такие как глицерин; диспергаторы, такие как карбонат кальция и бикарбонат натрия; агенты замедления растворения, такие как парафин; ускорители ресорбции, такие как 26772 четвертичные аммониевые производные; поверхностно-активные агенты, такие как цетиловый спирт, моностеарат глицерина; адсорбционные носители, такие как каолин и бентонит; смазывающие агенты, такие как тальк, стеарат кальция и стеарат магния, твердые лолиэтиленгликоли. Соединения могут быть изготовлены в виде эликсиров или растворов для удобного перорального введения или в виде растворов для парентерального введения, например, внутримышечно, подкожно, или внутривенно. Кроме того, соединения пригодны для изготовления форм с контролируемым выделением действующего вещества и т.п. То есть композиции могут быть составлены таким образом, что они выделяют активный ингредиент только или предпочтительно отдельными частями, возможно, через какой-то период времени. Покрытия, обертки и защитные матрицы могут изготавливаться, например, из полимерных веществ или восков. Соединения формулы (I) могут вводиться для профилактики и/или для терапевтического лечения болезни Альцгеймера. При терапевтическом применении соединения вводятся пациенту, уже страдающему этим заболеванием. Конкретная доза соединения формулы (!) согласно данному изобретению будет зависеть от тяжести заболевания, способа введения и других факторов, которые будут учитываться лечащим врачом. В общем случае, приемлемые и эффективные ежедневные дозы будут составлять от приблизительно 0,1 до приблизительно 1000 мг/день, более типично от приблизительно 50 до приблизительно 200 мг/день. Такие дозы будут вводиться пациенту при необходимости лечения от одного до приблизительно трех раз в день или более часто для обеспечения эффективного лечения. Часто будет необходимо или обязательно вводить фармацевтические композиции прямо или опосредованно в головной мозг. Прямые методы обычно включают введение катетера с лекарством в вентрикулярную систему пациента для обхода гематоэнцефалического барьера. Непрямые методы, которые являются предпочтительными, включают изготовление композиций для обеспечения латентиирования лекарства путем конверсии гидрофильных лекарств в липид-растворимые лекарства. Латентиация достигается через блокирование гидроксильных, карбоксильных и первичных аминных групп, имеющихся в лекарстве, для повышения 5 10 15 20 25 30 35 40 45 50 55 10 липиднои растворимости лекарства и его способности преодолевать гематоэнцефалический барьер. Согласно другому способу, доставка гидрофильных лекарств может быть повышена внутриартериальным вливанием гипертонических растворов, которые могут временно снимать гематоэнцефалический барьер. Обычно предпочтительными для применения являются соединения формулы (І) в форме кислотно-аддитивной соли, которая наиболее распространена для лекарственных средств, имеющих основную группу, такую как пиперидиновый цикл. Для этих целей приемлемыми являются следующие формы. В приведенных ниже композициях термин "Активный ингредиент" означает соединение формулы (I). Композиция 1. Желатиновые капсулы. Твердые желатиновые капсулы получают с использованием следующих компонентов, мг/капсула: Активный ингредиент 0,1-1000 Крахмал, NF * 0-650 Крахмал в виде текучего порошка 0-650 Жидкий силикон 350 сСт 0-15 Ингредиенты смешивают, пропускают через сито размером 45 меш (США) и наполняют ими желатиновые капсулы. Примеры конкретных композиций в форме капсул, которые содержат соединение формулы (I), где R2 - пиперидино (ралоксифен), представлены ниже. Композиция 2. Капсула ралоксифена, содержащая, мг/капсула: Ралоксифен 1 Крахмал, NF 112 Крахмал в виде текучего порошка 225,3 Жидкий силикон 350 сСт 1,7 Композиция 3. Капсула ралоксифена, содержащая, мг/капсула: Ралоксифен 5 Крахмал, NF 108 Крахмал в виде текучего порошка 225,3 Жидкий силикон 350 сСт 1,7 Композиция 4. Капсула ралоксифена, содержащая, мг/капсула: Ралоксифен 10 Крахмал, NF 103 Крахмал в виде текучего порошка 225,3, Жидкий силикон 350 сСт 1,7 Композиция 5. Капсула ралоксифена, содержащая, мг/капсула: Ралоксифен 50 11 26772 12 Крахмал, NF 150 Сироп 1,25 мг Раствор бензойной Крахмал в виде текучего порошка 397 кислоты 0,10 мл Вкусовое вещество Го. Жидкий силикон Краситель Го. 350 сСт 3,0 Очищенная вода До 5 мл Конкретные композиции, представленЛекарственное средство пропускают ные выше, могут быть изменены в соотчерез сито размера 45 меш (США) и смеветствии с необходимостью. шивают с натриевой карбоксиметилцелКомпозицию в форме таблеток получают с использованием ингредиентов, 10 люлозой и сиропом с образованием густой пасты. Раствор бензойной кислоты, представленных ниже. вкусового вещества и красителя разводят Композиция 6. Таблетки, содержащие, в некотором количестве воды и добавм г/таблетка: ляют при перемешивании. После этого Активный ингредиент 0,1-1000 15 добавляют необходимое количество воды Микрокристаллическая до получения требуемого объема. целлюлоза 0-650 Испытания. Двуокись кремния 0-650 Для испытаний 1 и 2 предлагается Стеарат кислоты 0-15 следующий план эксперимента. Компоненты смешивают и спрессовы20 Амилины (amylins) могут быть куплевают в формы таблеток. ны в Bachem, Inc. (Torrance, California), Peninsula Laboratories, Inc. 3Belmont, Таблетки, содержащие каждая 0 , 1 California или могут быть синтезированы 1000 мг активного ингредиента, изготавкак описано ниже. Амилоид-(5(1-40) и проливают другим способом. Композиция 7. Таблетки, содержащие, 25 тивоположный р-амилоидный пептид (40мг/таблетка: 1) могут быть куплены в Bachem, Inc. (3,Активный ингредиент 0,1-1000 микроглобулин может быть получен из Sigma Chemicals (St. Louis, Missouri). Крахмал . 45 Микрокристаллическая Маточные растворы пептидов (1^М) целлюлоза 35 30 вновь приготавливают в стерильной очиПоливинилпирролидон щенной от пирогена воде и разбавляют (в виде 10%-ного растводо указанных концентраций в определенра в соде) 4 ных культуральных средах. Культуры гиНатриевая карбоксимепокампа крысы (10-14 дней in vitro) обтилцеллюлоза 4,5 35 рабатывают пептидами или растворитеСтеарат магния 0,5 лем в течение 4 дней. Жизнеспособность Тальк 1 кортикальных культур крысы визуально Активный ингредиент, крахмал и целоценивают фазово-контрастной микросколюлозу пропускают через сито размера пией и количественно оценивают измере45 меш (США) и тщательно смешивают. 40 нием количества лактатдегидрогеназы Раствор поливинилпирролидона смеши(LDH), выделенной в культурированную вают с полученным порошком, после чего среду. образованную смесь пропускают через сиИспытание 1. Первичные нейроны гито размера 14 меш (США). Полученные покампа крысы культурируют in vitro стантаким образом гранулы сушат при темпе- 45 дартными методами выращивания клеток. ратуре 50-60°С и пропускают через сито Амилоид-бета (Ар)-пептид добавляют к размера 18 меш (США). Карбоксиметилкультурированным клеткам при нормальцеллюлозу натрия, стеарат магния и тальк, ной токсичной концентрации 25-50 цМ. предварительно просеянные через сито Спустя 4 дня после обработки жизнеспоразмером 60 меш (США), добавляют к 50 собность культуры оценивают измерением гранулам, которые после смешения спколичества лактатдегидрогеназы, выделенрессовывают с получением таблеток. ной в культурированную среду. ЛактатдеСуспензии, содержащие 0,1-1000 мг гидрогеназу ^LDH) измеряют в 20 цл аликлекарственного средства в 5 мл, изготаввотах, выдержанных в DMEM, используя ливают следующим образом. 55 стандартную 340 пн кинетическую оценку Композиция 8 Суспензии, содержа(Sigma Catalog Number 228-20) в 96-ячеечщие, мг/5 мл: ном формате. Опыты осуществляют при Активный ингредиент 0,1-1000 мг 37°С в PC-управляемом считывающем устНатриевая карбоксимеройстве марки Microplate Bickinetics plate тилцеллюлоза 50 мг reader (Bio-Tek Instruments/ с использова 26772 13 ниєм Delta Soft II software (v. 3.30, Biomet. Inc.) для анализа данных. Качество контрольных стандартов, содержащих нормальный и повышенный уровни сыворотки LDH (например, Srgma Enzyme Controls 2N S 5 2E) просматривают с каждым испытанием. Результаты представлены в виде единицы (LDH) на литр, где 1 единица определяется как количество энзима, которое будет катализировать образование 1 мкмольни- 10 котинамидадениндинуклеотида в 1 мин в условиях испытания. Для защиты исследования соединение формулы (I) добавляют в культуры до и/или одновременно с амилиодом-р. 15 Активность соединений формулы (I) демонстрируется уменьшением выделения LDH в среду (индикатор нейротоксичности) по сравнению с контролем. Испытание 2. От пяти до пятидесяти 20 крыс подвергают окклюзии четырех сосудов на 15 мин .для индуцирования общей ишемии. Соединение данного изобретения вводят экспериментальным и контрольным животным до, в процессе окклю- 25 зии и/или в течение нескольких часов после 15-минутной окклюзии. Спустя 3 дня животных обезглавливают после ишемического инсульта и нейронного поражения в гиппокампусе и неостриатуме и 30 исследуют визуально стандартными гистологическими методами. Активность соединений формулы (I) демонстрируется уменьшением нейронного поражения. 35 Испытание 3. От 5 до 50 женщин выбирают для клинического исследования 14 Женщины являются постклимактерическими, то есть с прекращением менструации за 6-12 месяцев до начала исследования, с диагнозом легкой стадии болезни Альцгеймера (БА) и, как ожидается» с ухудшающимися симптомами БА в период исследования, но здоровые во всех других отношениях. Исследование проводят с плацебо-контрольной группой, то есть женщин делят на две группы, одна из которых принимает активный агент данного изобретения, а другая принимает плацебо. У пациентов отмечаются исходные симптомы, характерные для БА, то есть ухудшение памяти, познавательной способности, мыслительной способности и т.д. Женщины опытной группы получают от 50 до 200 мг активного агента в день перорально. Продолжительность курса терапевтического лечения составляет 6-36 месяцев. Точное регистрирование исходных симптомов сохраняется в продолжении изучения в обоих группах, а в конце изучения эти результаты сравниваются. Сравнение результатов проводят между членами каждой группы и для каждого пациента относительно уровня симптом до начала изучения. Активность исследуемого лекарства иллюстрируется замедлением типичного ослабления познавательной способности и/или нарушений в поведение связанных с БА Полезность соединений формулы (I) доказывается активностью по меньшей мере в одном из описанных выше испытаний. Упорядник Техред М. Келемеш Коректор М.Самборська Замовлення 529 Тираж Підписне Державне латентне відомство України 254655, ГСП, Київ-53, Пьвівська пл З Відкрите акціонерне товариствс "Патент" м Ужгород вул. Гагаріна. 101
ДивитисяДодаткова інформація
Автори англійськоюMay Patrick Cornelious
Автори російськоюМей Патрик Корнилиус
МПК / Мітки
МПК: A61K 31/435, A61K 31/38
Мітки: збільшення, засіб, нейротоксичності, головний, яка, інгібування, бета, тgf-бета, проводиться, амілоїдними, виділення, мозок, пептидами
Код посилання
<a href="https://ua.patents.su/14-26772-zasib-dlya-zbilshennya-vidilennya-tgf-beta-v-golovnijj-mozok-ta-dlya-ingibuvannya-nejjrotoksichnosti-yaka-provoditsya-beta-amilodnimi-peptidami.html" target="_blank" rel="follow" title="База патентів України">Засіб для збільшення виділення тgf-бета в головний мозок та для інгібування нейротоксичності, яка проводиться бета -амілоїдними пептидами</a>
Попередній патент: З’єднання деталей
Наступний патент: Орнітоптер
Випадковий патент: Склад масляної суміші