Аналоги гормонів-антагоністів lhrh і спосіб їх отримання
Формула / Реферат
1. Аналоги антагонистов LHRH формулы
[NAc-D2Nall-DpClPhe2-DPheз-Ser4-Arg5-DЗPalб-Leu7-Arg8-Pro9-DАla10]NH2
[NAc-D2Nall-DpClPhe2-DPheз-Ser4-Tyr5-DЗPalб-Leu7-Arg8-Pro9-DАla10]NH2
[NAc-D2Nall-pCl-DPhe2-DЗPalз-Ser4-Mop5-DЗPalб-Leu7-Arg8-Pro9-DАla10]NH2
[NAc-D2Nall-DPhe2-DЗPalз-Ser4-Mop5-DЗPalб-Leu7-Arg8-Pro9-DАla10]NH2
[NAc-D2Nall-pCl-DPhe2-DЗPalз-Ser4-Arg5-DЗPalб-Leu7-Pap8-Pro9 DАla10]NH2
в качестве физиологически активного вещества для лечения заболеваний
репродуктивной эндокринной системы и предстательной железы, рака молочных желез или для использования в качестве контрацептива, а также для диагностики и лечения бесплодия.
2. Способ получения аналогов антагонистов LHRH, включающий модифицирование участков молекулы исходного соединения, отличающийся тем, что щелочные и липофильные участки [NAc-D2Nall-DpClPhe2-DЗPal3-Ser4-Tyr5-Argб-Leu7-Arg8-Pro9-DAla]NH2 модифицируют путем замещения соответствующих аминокислот.
Текст
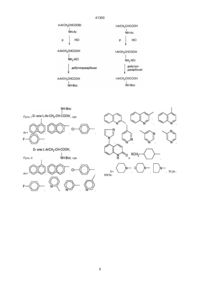
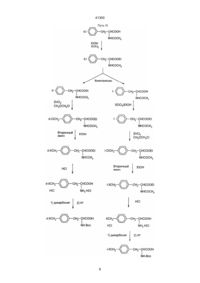
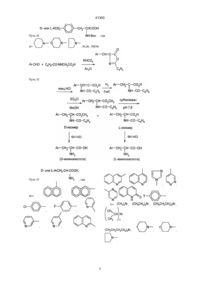
1. Аналоги антагонистов LHRH формулы [NAc-D2Nal1-DpClPhe2-DPhe3-Ser4-Arg5-D3Pal6Leu7-Arg8-Pro9-DAla10]NH2 [NAc-D2Nal1-DpClPhe2-DPhe3-Ser4-Tyr5-D3Pal6Leu7-Arg8-Pro9-DAla10]NH2 [NAc-D2Nal1-pCl-DPhe2-DЗPal3-Ser4-Mop5-DЗPal6Leu7-Arg8-Pro9-DAla10]NH2 41300 Нижеследующее также входит в методы и примеры этого изобретения. 1. Замещение D3PaL, которая является ароматической аминокислотой, имеющей подходящую щелочность, вместо DArg6 в (II) с получением аналога (III): (Nac-D2Nal1, DpCIPhe2, D3Pal3, Ser4, Tyr5, D3Pal6, Ser7, Arg8, Рго9, DAla10)NH2 2. Замещение Туг5 на Arg5 в (III) для получения (IV): -(Nac-D2Nal1, DpCIPhe2, D3Pal3, Ser4, Arg5, D3Pal6, Leu7, Arg8, Pro9, DAIa10)NH2 3. Замещение D3Pal3 в (IV) на DPhe3 или его производные DXCH2Phe, чтобы получить (V): (NAc-D2Nal1, DpCIPhe2, DPhe3, Ser4, Туг5, D3Pal6, Leu7, Arg8, Pro9, DAIa10)NH2 или его аналогов (DXCH2Phe3). 4. Замещение DPhe3 и его производными D3Pal3 в (III), чтобы получить (VI): (Nac-D2Nal1, DpCIPhe2, DPhe3, Ser4, Arg5, D3Pal6, Leu7, Arg8, Pro9, DAIa10)NH2 или его аналогов (DXCH2Phe3). Синтезированы серии новых антагонистов LHRH формулы: (NAc-D2Nal1, АА2, АА3, Ser4, AA5, AA6, Leu7, AA8, DAIa10)NH2, где АА являются природными или неприродными аминокислотами, которые представлены D- и L-ArAla. Более конкретно здесь: AA2 = D-pCIPhe, D-ArAla, DPhe, Ar-Ala, DXCH2Phe, AA3 = D3Pal, Ar-Ala, D-ArAla, DPhe, D-XCH2Phe, AA5 = Arg, DMap, Pip, Tyr, Pal, Mop, Тер, Map, Phe, Eap, Pap, Bap, DMop, AA6 = D3Pal, D-Ar-Ala, D-XCH2Phe, AA8 = Pip, Mop, Тер, Map, Eap, Pap, Bap, Arg, где: Ar= , , H, , , , , , , , , , , Антагонисты LHRH, полученные при использовании вышеописанного метода, как пептидные лекарственные препараты, могут использоваться при лечении заболеваний репродуктивной эндокринной системы, таких как эндометриоз, преждевременное половое созревание детей, и для лечения рака простаты и рака молочных желез, так же, как и в качестве мужских и женских контрацептивов для регулирования рождаемости, или же использоваться для диагностики и лечения бесплодия и т.п. Такой пептидный лекарственный препарат может быть приготовлен в виде обычных инъекционных форм, инъецируемых капсул или других лекарственных форм для практического применения. Дальнейшее описание этого изобретения состоит в следующем: При естественном пути выделения гистамина в организме очень важную роль играет нейропептидная субстанция II, ее ED50 для HRA равно 515 мкМ. Химическая структура SP представляет собой (Arg1, Pro2, Lys3, Pro4, Glu5, Glu6, Phe7, Phe8, Gly9, Leu10, Met11)NH2. Изучение взаимосвязи между ее структурой и HRA показало, что Аrg1-Pro2-Lys3 на N-конце молекулы SP существенно для HRA, так как при удалении этих трех аминокислот из молекулы полностью исчезает ее HRA. Для сравнения, при удалении одной, двух или трех аминокислот на С-конце HRA сохранялась на уровне одной четвертой от HRA первоначальной. Кроме того, удаление Phe8 и Phe7 снижает HRA на 1% и 6,5% таковой СП. Далее, удаление Glu5,6 не вызывает значительного изменения HRA. Вышеприведенные данные означают, что липофильная область вокруг Phe7,8 определяет уровень HRA, эта область участвует в связывании молекулы с рецептором тучной клетки. Как упомянуто ранее, аналоги (D2Nal1, DArg6) LHRH показали очень высокую HRA, их молекулярное строение имеет топологическое сходство с SP: DArg6-Leu7-Arg8 в первом, по-видимому, соответствует Arg1-Pro2-Lys3 в последнем, оба состоят из пары сильно щелочных аминокислотных остатков, между которыми только один нейтральный аминокислотный остаток, т.е. оба аналога LHRH D2Nal1, DArg и SP содержат два сильно щелочных аминокислотных остатка, которые располагаются один по отношению к другому в позициях 1,3. С другой стороны, разброс остатков ароматических аминокислот в первом, как считают, соответствует области Рhе7,8 в СП, с точки зрения определения величины HRA. Создание структуры этого изобретения состоит из двух аспектов: один состоит в модификации участка Tyr5-DArg6-Arg8 на С-конце, и другим является тонкий подбор ароматических кислот после оптимизации модификации щелочного участка на С-конце. (NAc-D2Nal1, DpCIPhe2, D3Pal3, Ser4, Tyr5, DArg6, Leu7, Arg8, Pro9, DAIa10)NH2 (II) использован как исходное вещество, которое показало АОА 100% при дозе 0,5 мкг в кукурузном масле, 5% при 0,25 мкг. В первую очередь, DArg6 в (II) мог быть замещен слабыми основными или нейтральными ароматическими кислотами, такими как D3Pal, D6Qal, , , , , и , где: X= , , и R'2N-. RR'N-, где: R' = СН3-, СН3СН2-, C3H7-, С4Н9-, Н-, R = СH3-, СН3СН2-, C3H7-, С4H9-, Н-. , 2 41300 подобные свойства, как (V) D3Pal, может привести к получению лучших антагонистов, чем (IV) или (V). Модификация природных липофильных ароматических аминокислот, например, фенилаланина, например, по методу, описанному ниже в разделе “Синтез неприродных аминокислот”, приводит к созданию серий новых аминокислот, которые соединяют свойства ароматических соединений, гидрофильность и щелочные свойства в одной молекуле и могут выражаться формулой: -R1R2NCH2C6H4CH2CH(NH)CO2H (VI), где: R1 и R2 могут быть одинаковыми или разными, могут быть представлены цепью или циклом, могут также содержать гетероатом. При изменении R1 и R2 могут быть получены серии аминокислот, которые постоянно системно измененные щелочность, гидрофильность и стереостроение. Введение этих аминокислот в положения 5,6,8 соединения (IV) позволило получить три серии новых антагонистов LHRH. Результаты биологического исследования показали, что каждая серия дала по крайней мере один новый антагонист, проявляющий 100% АОА при дозе 1 мкг, подобно (IV), в то же время была значительно снижена. Примером был (VII): (NAc-D2Nal1, DpCIPhe2, DPal3, Ser4, Mop5, D3Pal6, Leu7, Arg8, Pro9, DAIa10)NH2, который проявил 100% АОА при 1 мкг. ED50 по ГСА 14,7 мг/мл, явно лучше, чем у (V). При замещении Arg8 в (IV) на (VI) степень снижения HRA положительно коррелирует с длиной Р в (VI), так что ED50 по HRA могла бы быть выше 200 мкг/мл. Такие соединения могут легко растворяться в водном растворе и, как ожидается, будут использоваться в клинике без осложнений со стороны лекарственных форм. Результаты показали, что Аrg8 или Lys8 не существенны для антагонистов LHRH с высокой активностью; Соответствующий щелочной центр в положении 8 может обеспечить высокую АОА, между тем активность по индуцированию выработки гистамина тучными клетками заметно снижалась, когда встраивалась группа с основными свойствами, упомянутая выше, создающая значительное стереопрепятствие. Это изобретение, объединяя модификации как на конце N, так и на конце С, приводит к созданию лучших антагонистов LHRH. Процесс синтеза иллюстрируется следующим. 1. Синтез новых неприродных аминокислот Свыше 60 серий и несерийных D- или Lаминокислот созданы и синтезированы четырьмя путями синтеза, представленными на схеме ниже. Строение этих неприродных аминокислот показано в виде основных структурных формул, перечисленных в той же схеме. Некоторые из этих аминокислот обладают щелочностью, гидрофильностью и ароматическими свойствами соответственно, тогда как другие сочетают их все в одной молекуле. тетрагидротриптофан, метилтриптофан. (NAcD2Nal1, DpCIPhe2, D3Pal5,6, DAIa10) LHRH (III) было получено, когда D3Arg6 в (II) был замещен на D3Pal6. (Ill) показал АОА 100% при дозе 3 мкг, 83% при 1 мкг (в кукурузном масле), и его ED50 no HRA была равна 9,8 мкг/мл, что значительно лучше, чем у аналога «Nal-Arg», что ED50 по НРА была меньше, чем 1 мкг/мл. По-видимому, для того, чтобы получить высокую АОА, щелочность всей молекулы должна быть равной или близкой таковой пары аргинина. Поскольку позиция 5, как и позиция 6, не участвует в связывании с рецептором, в положение 5 может быть помещен широкий круг аминокислот, включая аргинин. Были созданы серии новых аналогов. Например, при замещении Tyr5 на Аrg5 в (III) получены (NAc-D2Nal1, DpCIPhe2, D3Pal3'6, Агд5, DAIa10)LHRH (IV). Оба (IV) и (II) содержали два аргининовых остатка, но расстояние между двумя аргининами в (IV), где их геометрическое взаиморасположение стало 1,4, т.е. между этими двумя аргининами были две другие аминокислоты, было больше, чем в (II). Поэтому, вероятно, HRA будет снижена и, с другой стороны, из-за наличия двух аргининов АОА не должна быть ниже, чем у (II). Результаты биологического исследования (IV) показали, что ED50 по HPA была равна 3,5 мкг/мл, тогда как АОА составила 60% при 0,12 мкг (кукурузное масло), 85% при 0,25 мкг, 100% при 0,5 мкг. Это было первым случаем для антагонистов LHRH, когда достигнутая ED50 для АОА была равна или менее 0,125 мкг. Поэтому дальнейшее создание структуры базировалось на структуре (IV). В молекуле (IV) присутствуют четыре остатка со щелочными ионами, D3Pal3,6 и Аrg5,8, тогда как (II) содержит только три щелочных остатка. Поэтому приемлемо заменить один D3Pal нейтральной аминокислотой; с другой стороны, (IV) проявил очень высокую гидрофильность, и снижение гидрофильности замещением DPal в (IV) на гидрофобную аминокислоту, вероятно, будет благоприятным для задержки лекарства в организме и увеличения продолжительности эффекта. Затем были созданы новые серии аналогов путем замещения вместо D3Pal3. (V) проявил 100% АОА при дозе 1 мкг (в физиологическом растворе), равную активности исходного вещества (IV), тогда как HRA снижена наполовину: ED50 по HPA была 7,4 мкг/мл. Дополнительное замещение DCIPhe2 на DPhe снизило липофильность этого участка молекулы и снизило HRA. Arg5-D3Pal6-Leu7-Arg8 на С-конце (IV), по-видимому, играют главную роль в пусковом механизме секреции гистамина. D3Pal соединяет в одной молекуле свойства ароматического строения, щелочность и гидрофильность, он также стереоприемлем в антагонистах LHRH для связывания с рецептором. Таким образом, создание новых серий неприродных аминокислот, используя 3 41300 4 41300 Путь I где , Ar= , , , Путь II , где , , , , и , , , , , Ar= , Х= RR'N , , , 5 , , , , , R'2N-, 41300 Путь III 6 41300 Путь III , где X= , , , R'2N-, RR'N Путь IV Путь IV , где , Ar= , , , , , , , Y= , , , , , , , , , , , , . 7 , , 41300 2. Синтез пептида Синтез с С-конца на бензгидриламин-гидрохлоридной смоле (ВНА-смола), с использованием твердофазного пептидного синтеза, предложенного Меррифили. Это трехфазный процесс, включающий прикрепление, взаимодействие и отщепление. Дихлорметан (DCM) является основным растворителем, используемым для отмывания перед каждой следующей стадии реакции, в то же время спирт изопропанол (IРА) и N,N-диметилформамид (DMF) также использовались, где необходимо. Реакция связывания осуществляется при катализе избытком циклогексилкарбодиимида (DCC) при добавлении достаточного количества 1-гидроксибензотриазола (НОВТ). Степень реакции связывания определялась по нингидриновому методу Кейзеса. Вторая реакция связывания должна проводиться, если она дает положительный результат в пробе Кейзеса. Пептидная цепь отщеплялась от смолы с использованием безводного фтористого водорода (HF) в присутствии анизола после завершения всех реакций, требующих связывания со смолой, в это же время удаляются все временные защищающие группы. После отмывания этилацетатом или эфиром сырые продукты LHRH-антагонистов получают путем экстракции водным раствором уксусной кислоты с последующей лиофилизацией. Выход свыше 50%. 3. Очистка пептида 1). Пептид очищают с помощью гельпроникающей хроматографии или распределительной хроматографии на двуокиси кремния в колонке высотой 60-100 см при контроле с помощью УФ/ТСХ. Очистку LHRH-антагонистов проводили однократно и продукт получали после лиофилизации основных фракций. Выход составляет 50-90% и чистота может быть свыше 90%, 2). Пептид затем очищали на аппарате для высокоэффективной жидкостной хроматографии (ВЭЖХ) Уотерса, используя колонку с обращением фазы С18 (7,8х300 мм) (m Bondapak 84176). Выход на этой стадии составляет 20-50%, при этом чистота не менее 99%. 4. Анализ чистоты пептида 1). Анализ ТСХ Он проводится на пластиковой пластинке, покрытой силикагелем 60Р254, длиной 5-10 см. Во всех случаях выявлялось одиночное пятно при работе с пятью разными системами растворителей. 2). Анализ ВЭЖХ Во всех случаях обнаружен единичный пик при элюировании двумя видами систем растворителей, соответственно, при использовании аппарата Уотерса для ВЭЖХ с аналитической колонкой (m Bondapak 27324) при УФ-детекции (l = 210). Величина образца составляла 10-200 мкг. 5. Аминокислотный анализ пептида: В соответствии с методом PICO-TAG, разработанной фирмой Уотерс, 50 мкг образца, который был высушен под вакуумом в течение 2 часов, точно отвешивают на чашечных весах с разрешением 10-5 г. После растворения в воде 10 мкг образца добавляют в реакционную пробирку, в которую, согласно руководству, добавлена соляная кислота 1:1 (содержащая 1% фенола). Реакция продолжается 20-24 часа при 105°С. Реакция про должается 20-24 часа при 105°С в герметически закрытом контейнере, который наполнен азотом и откачан под вакуумом, чтобы удалить кислород из реакционной пробирки. Изотиоцианат фенола добавляется, чтобы получить аминогруппы после выпаривания избыточных количеств соляной кислоты. Затем он анализировался с помощью жидкостного хроматографа, снабженного аминокислотной аналитической колонкой PICO-TAG с УФ-детектором (l = 254 нм). Содержание каждой аминокислоты и относительное молярное соотношение рассчитывали, чтобы выявить аминокислотный состав образца, основываясь на сравнении составной части каждой аминокислоты с таковой Н-стандартного образца Уотерса. Классический метод с ионообменным нингидриновым производным (IEN) был также использован как контрольный, который дал те же самые результаты. Но, чтобы получить удовлетворительные результаты, для этого метода необходимо в десять раз больше образца. 6. Оценка биологической активности Использован метод антиовуляции крыс Корбина. В этом эксперименте использованы здоровые взрослые самки крыс SD (вес 200-250 г). Всех животных содержали при 22-24°С и при режиме 14 часов/10 часов (свет/темнота). Они получали стандартное питание и воду по потребности. В этом эксперименте могли быть использованы крысы, у которых выявлено по крайней мере два последовательных четырехдневных цикла течки при исследовании вагинальных мазков. Крысам вводили пептиды (антагонисты LHRH) в разных дозах в физрастворе в середине стадии протечки. Крыс забивали на следующий день, их яйцеводы с двух сторон исследовали под препаративной лупой, чтобы определить число созревших яйцеклеток. Крысы были разделены на несколько групп по получаемым дозам, каждая группа состояла из около 10 животных, и контрольная группа, животным которой вводили равное количество физраствора, состояла из 9-10 крыс антиовуляторная активность (АОА) показана в следующем уравнении: AOA = число неоволирующих крыс ´ 100% общие число крыс, получавших препарат 7. Оценка активности по стимуляции выведения гистамина: 1). Определение секреции гистамина (HRT) В этом эксперименте использовали здоровых взрослых самцов крыс SD (вес 200-250 г), содержавшихся в вышеназванных условиях, после анестезии CO2 перитонеальную полость промывали 50 мл среды PIPASAC, содержащей 20 единиц гепарина. После последующего центрифугирования при 200×g в течение 8 мин. при 4°С клетки снова отмывали и окончательно ресуспендировали до концентрации от 8 до 24×105 общего числа лейкоцитов/мл PIPASAC. Эта суспензия содержит примерно 5-10% тучных клеток. Отмытые клетки использовались сразу же после отбора и предварительно нагревались в течение 5 минут при 37°С, перед тем как 0,3 мл пробы пипеткой помещались в полистирольные пробирки, содержащие 0,5 мл разведенного пептида. Смеси инкубировали в течение 15 мин. при 37°С и реакцию останавливали центрифугированием при 400×g в течение 15 мин. 8 41300 Некоторые примеры новых антагонистов LHRH, полученных таким путём, показаны в табл. 1. После завершения доклинических фармакологического и токсикологического изучения мы сможем применить эти новые антагонисты, которые обладают высокой терапевтической эффективностью и слабым побочным действием, в клинике так, чтобы разработать новое лекарство для лечения эндометриоза и других нарушений в репродуктивной эндокринной системе, включая преждевременное половое созревание у детей, рак простаты и рак молочных желез. Так как они подавляют секрецию гонадотропина путем конкурентного с эндогенным LHRH связывания с рецептором, и действуют быстро, обратимо и безопасно, они могут, кроме того, разрабатываться как новый тип контрацептивов для мужчин и женщин. Сверх того, они могут быть также использованы при лечении бесплодия и для селективного и обратимого устранения функции гипофиза по секреции гонадотропина. Являясь разновидностью лекарств пептидной природы, маловероятно, что антагонисты LHRH будут применяться перорально. Но они могут быть легко получены в виде лиофилизированного порошка, легко растворимого в физрастворе для инъекций внутривенно, подкожно или внутримышечно. Кроме того, изучаются длительно действующие системы подачи лекарственного вещества, такие как биодеградируемые, инъецируемые капсулы. Капсулы могут имплантироваться подкожно с помощью специального шприца и должны абсорбироваться тканью после выделения всего количества пептида, и не требуют хирургического удаления. Длительно действующие системы доставки особенно полезны для долговременного применения аналогов LHRH в клинике. Следующее представляет собой анализы результатов из примеров (используя три аналога IV, V, VII как типичные примеры): 1). Чистота Тонкослойная хроматография (ТСХ): На каждой из хроматограмм, полученных с пятью разными системами растворителей, присутствовало только одно пятно. Высокоэффективная жидкостная хроматография (ВЭЖХ): На каждой из хроматограмм при элюировании двумя разными системами растворителей присутствует только один пик. Значения Rf и времени удерживания (ТР) представлены в табл. 2, хроматограммы проиллюстрированы фиг. 1-4. Система растворителей 2: Раствор А - 0,01М КН2РO4 водный раствор (рН 3). Раствор В - 20% раствор А + 80% ацетонитрила. Системы растворов для ТСХ: 1. н-BuОН/ЕtOАс/НОАс/Н2O (5:5:1:1) 2. н-BuOH/н-BuOH/HOAc/H2О (2:8:2:8) 3. н-ВuОН/НОАс/Н2О (4:1:5), восходящая фаза 4. н-BuOH/HOAc/H2O(4:1:2) 5. н-BuOH/EtOAc/HOAc/H2O (1:1:1:1) 2). Аминокислотный анализ при 4°С. Супернатанты исследовали на содержание гистамина с помощью метода флюорометрического определения, проводимого вручную, после последовательной экстракции н-бутанолом и н-гептаном. содержание гистамина может быть установлено по стандартной гистаминовой кривой (см. ниже). Процесс секреции гистамина может быть рассчитан по следующему уравнению: Секреция гистамина (%) = Е-В ´ 100 % С-В где: Е является показанием флуорометрии для экспериментального образца, В - показание флуорометрии для образцов, содержащих только клетки и буфер, и С - показание флуорометрии “полного содержания” (клетки, обработанные НС104). Стандартная кривая может быть получена путем нанесения на график значений оптической плотности по показаниям флюориметра при 350 нм/450 нм (активация/флюоресценция) для концентраций серий разведения раствора точно взвешенного количества гидрохлорида гистамина. Относительный параметр стандартной гистаминовой кривой может быть 0,9998 и самая низкая определяемая концентрация гистамина равна 0,5 нг/мл. Значение ED50 для пептида может быть получено из кривых зависимости ответной реакции от дозы, путем нанесения на график уровня секреции гистамина в сравнении с концентрацией гистамина в полулогарифмическом масштабе. Все образцы пептидов должны быть испытаны с тучными клетками как минимум от 3 разных крыс. 2). Кожная проба на анафилактическую активность (CAT): В этом эксперименте использованы здоровые взрослые крысы-самки (вес (250 г). Крысам вводили внутривенно раствор синего Эванса (1 мл 0,05%). Сразу же после этого внутрикожно вводили раствор пептида (5, 0,5 и 0,05 мг/мл соответственно) или физраствор (контроль) в обритый сектор на спине животных. Через 30 минут после инъекции крыс забивали и кожу спины отгибали. Диаметр поражений измеряли в миллиметрах в двух перпендикулярных направлениях с помощью циркуля с нониусом. Диаметр в контроле обычно меньше 5,5 мм. Количество синего Эванса, проникающего в кожу из кровеносных сосудов, может быть тоже определено спектрофотометрически. Кожа, соответствующая области поражения, вырезалась и погружалась в смесь ацетона/физраствора (7:3, об./об.) на ночь. После центрифугирования на следующий день, содержание синего Эванса в супернатанте определялось на спектрофотометре (УФ-260) при 610 нм с раствором сравнения ацетон/физраствор (7:3). Каждый пептид испытывался как минимум на 3 разных крысах. С помощью метода, описанного выше, создано и синтезировано множество новых антагонистов LHRH. Кратко, антагонисты с новой структурой были получены путём одиночных или множественных замещений разными природными и неприродными аминокислотами, перечисленными в предыдущих разделах. 9 41300 Анализ проводился по методу классической IEN и новой PICO-TAG, результаты представлены в табл. 3 и на фиг. 5, 6. 3). Результаты биологических исследований Результаты биологических исследований, включая антиовуляторную активность при разных дозах и ED50 по активности стимуляции выделения гистамина in vitro, показаны в таблице 4, в которой перечислены 26 антагонистов в качестве примеров. Как показано и описано выше, антагонисты ГСЛГ, созданные и синтезированные в соответствии с этим изобретением, обнаруживают очень хорошие свойства. Они чисты по результатам анализа ТСХ или ВЭЖХ. Их структура правильна, т.е. она такая же, как запланирована. Их противозачаточная активность высока: они могут подавлять овуляцию у крыс при подкожной инъекции в дозе от 0,1 до 2,0 мкг в середине стадии предтечки. Их побочное действие, связанное с гистамином, низко: ED50 этих препаратов по активности стимуляции выделения гистамина in vitro (эффективная доза для тучных клеток крыс, стимулирующая выделение 50% гистамина) находится в пределах 5-300 мкг/мл; поражение, вызываемое ими при кожной анафилактической пробе у крыс, мало настолько, что удовлетворяет клиническим требованиям. Они очень хорошо растворяются в воде, все биоисследования проводились нами с растворами препаратов в физрастворе, так что их легко получить в виде инъекционных лекарственных форм для клинического применения. Их также легко приготовить в виде длительно действующих систем доставки, среди которых инъецируемые микрокапсулы наиболее удобны для длительного подавления гонадотропина и половых гормонов. Поэтому они могут быть использованы как эффективные, с обратным действием и безопасные контрацептивы как для мужчин, так и для женщин. Они могут быть также использованы для лечения различных заболеваний, связанных с расстройствами репродуктивной эндокринной сферы, таких как гормонозависимый рак простаты, рак грудных желез, эндометриоз, преждевременное половое созревание у детей. Они также полезны для лечения бесплодия. Новые антагонисты LHRH могут также использоваться при основополагающих физиологических и фармакологических исследованиях репродуктивной сферы, таких как при изучении функции гипофиза, по действию половых гормонов или гонадотропинов или LHRH на сексуальное поведение и т.п. Аббревиатуры В тексте этого патентного заявочного документа были использованы следующие аббревиатуры. Аlа Аланин АОА антиовуляторная активность Arg Вар BOC BuОАс CAT DCC DCM D2Nal D3Pal DpCIPhe DpFPhe D6Qal DMF Eap ED50 EtOAc FSH Glu Gly His HOBT ВЭЖХ HRA HRT IEN IPA LH LHRH Leu Lys Map Met Mop н-BuOH NS Pap Phe Pip Pipes Pro Rf SE Ser TFA TCX TR Trp Tyr Тер 10 Аргинин дибутиламинометилфенилаланин т-бутилоксикарбонил Бутилацетат кожная анафилактоидная проба дициклогексилкарбодиимид Дихлорметан D-b-(2-нафтил)аланин D-b-(3-пиридил)аланин п-хлор-D-фенилаланин п-фтор-D-фенилаланин D-b-(6-хинолил)аланин N, N-диметилформамид диэтиламинометилфенилаланин эффективная доза для 50% ответа Этилацетат фолликулостимулирующий гормон глютаминовая кислота Глицин Гистидин L-гидроксибензотриазол Высокоразрешающая жидкостная хроматография нингидриновое производное активность по стимуляции выделения гистамина определение выделения гистамина ионообменная хроматография с изопропиловый спирт лютеинизирующий гормон гормон, стимулирующий выделение лютеинизирующего гормона Лейцин Лизин диметиламинометилфенилаланин Метионин морфолинометилфенилаланин н-бутиловый спирт нормальный физиологический раствор дипропиламинометилфенилаланин Фенилаланин пиперидинометилфенилаланин пиперазин-, -бис(2-этансульфоновая кислота) Пролин степень смещения стандартная ошибка Серин трифторуксусная кислота тонкослойная хроматография время удержания Триптофан Тирозин тетрагидропирролилметилфенилаланин 41300 Таблица 1 Некоторые примеры, относящиеся к настоящему изобретению Аналог АА1 АА2 Исходное NAc-D2Na DpCIPhe ААЗ D3Pal AA4 Ser DPip DPhe DpCIPhe DPhe DpFPhe DPhe AA5 Tyr Arg Arg Arg Arg Mop Mop Arg Arg DFPhe Arg Arg Eap Тер Тер Тер Тер Тер Тер D3Pal Mop Тер Тер DpCIPhe DpCIPhe AA6 DArg DPhe DMop DPhe D3Pal DMop D3Pal D3Pal D3Pal DPip DMap DMop DPip D3Pal DMop DMap DEap DBap DPap DTep DMop DMop DPip DBap DMop DMop DTep DMop DTep AA7 Leu AA8 Arg Pip Pip Mop Pip Pap Pip Pap Eap Mop Map Map Mop Pep Mop Mop Eap Pap DMop DMop Mop Mop Arg Arg Arg DPhe DFPhe DFPhe DFPhe Мер Arg Arg Arg Arg Arg Arg Arg Arg Arg Arg Tep 11 D3Pal DMop DPip DTep D3Pal D3Pal D3Pal D3Pal D3Pal DTep DTep DTep DTep DTep DTep DPap Pip Pip Mop Тер Pap Pip Mop Тер Map Eap Pap Bap AA9 Pro AA10 DAIa-NH2 41300 Таблица 2 Результаты хроматографического анализа антагонистов ВЕЖХ Аналоги TR1 IV V VII ТСХ TR2 (мин.) 5,26 8,11 9,58 7,55 7,90 16,19 Rf1 Rf2 Rf3 Rf4 Rf5 0,23 0,32 0,17 0,21 0,30 0,08 0,31 0,35 0,16 0,19 0,30 0,40 0,65 0,69 0,12 Раствор А + 80% ацетонитрила Таблица 3 Аминокислотный состав антагонистов Аналоги IV V VI Методы IEN PICO-TAG IEN PICO-TAG IEN Ser 0,86 0,92 0,81 0,68 0,91 Arg 2,05 2,25 2,02 2,26 0,91 Ala 1,01 0,91 1,03 0,93 1,00 Pro 0,99 1,01 1,03 1,29 1,00 Leu 1,13 0,91 0,12 1,04 1,09 Phe + 0,99 1,00 Pal + + + + + pCIPhe + + + + + Nal НО + + + НО НО: не определялось Таблица 4 Результаты биологического исследования новых антагонистов, созданных на основе исходной структуры Замещающие аминокислоты 1. Исходное 2. DPhe 3. DPhe, DPhe 4. DTyr, Lys 5. D-Phe 6. Map 7.Eap 8. Pap 9. Вар 10.D-Map 11. Тер 12. Pip 13. Mop 14. D-Map 15. D-Eap 16. D-Tep 17. D-Pip 18. D-Mop 19. Map 20. Eap 21.Pap 22.Вар 23. Тер 24. Pip 25. Mop 26. D-Map % АОА/мкг 0,125 0,25 50 29 0,5 75 60 HRA (мкг/мл) 1,0 100 100 0 40 2,0 60 17 29 43 0 14 12,5 14 71 25 14 14 71 0 67 57 33 33 100 100 50 100 100 29 50 0 100 43 71 0 Исходной структурой является: (NAc-D2Nal1, DpCIPhe2, D3Pal3, Ser4, Arg5, D3Pal6, Leu7, Arg8, Pro9, DAIa10)NH2 12 57 88 ED50±SEM 3,5±0,38 7,4±0,98 18,5±7,00 5,1±2,15 35,0±5,05 24,8±4,47 12,0±0,50 9,6±0,19 23,5±5,78 18,3±2,38 36,8±5,68 9,4±1,63 14,7±2,70 19,5±2,50 13,0±1,00 22,5±3,25 7,6±2,48 >11 5,4±1,22 56,9±15,1 70,4±26,8 >235 6,6±2,13 27,5±2,50 52,5±17,5 28,0±9,00 41300 __________________________________________________________ ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 __________________________________________________________ Підписано до друку ________ 2002 р. Формат 60х84 1/8. Обсяг ______ обл.-вид. арк. Тираж 50 прим. Зам._______ 13 41300 ____________________________________________________________ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22 ___________________________________________________________ 14
ДивитисяДодаткова інформація
Назва патенту англійськоюAnalogs of hormones-antagonists of lhrh and a method for the preparation thereof
Автори англійськоюXIAO SHAOBO
Назва патенту російськоюАналоги гормонов-антагонистов lhrh и способ их получения
Автори російськоюКСИАО Шаобо
МПК / Мітки
МПК: C07K 7/23
Мітки: спосіб, отримання, аналоги, гормонів-антагоністів
Код посилання
<a href="https://ua.patents.su/14-41300-analogi-gormoniv-antagonistiv-lhrh-i-sposib-kh-otrimannya.html" target="_blank" rel="follow" title="База патентів України">Аналоги гормонів-антагоністів lhrh і спосіб їх отримання</a>
Попередній патент: Агрегат для пневмотранспортування зерна
Випадковий патент: Застосування оцту винного як інсектициду рослинного походження для боротьби з колорадським жуком