Сполука 1-феніл-3-диметиламінопропану, спосіб її одержання (варіанти), спосіб зняття болю і анальгетик
Номер патенту: 41345
Опубліковано: 17.09.2001
Автори: Фрідеріхс Ельмар, Штрассбургер Вольфганг, Бушманн Хельмут
Формула / Реферат
1. Соединение 1-фенил-3-диметиламинопропана формулы I
где
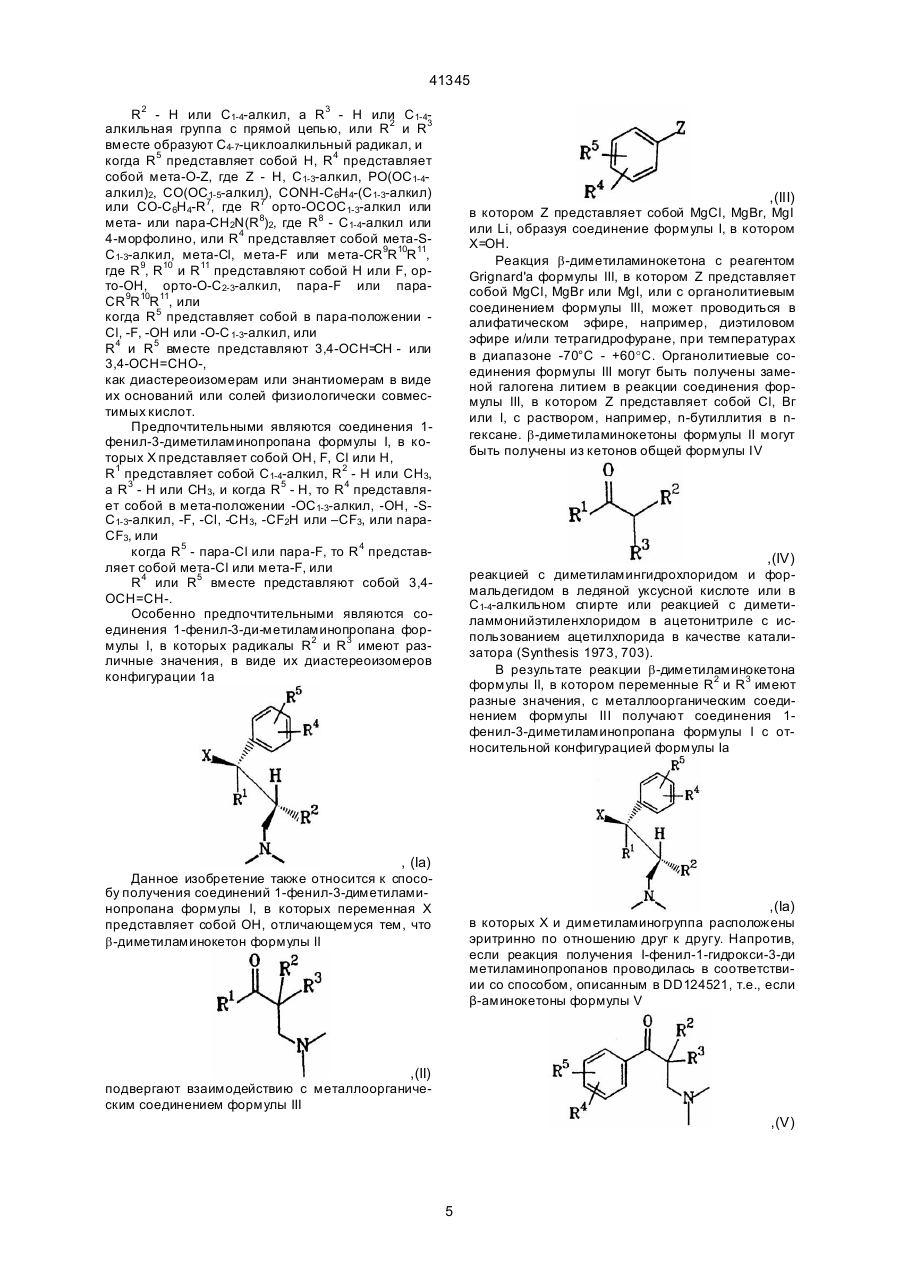
Х представляет собой ОН, F, Cl, Н или группу OCOR6, где R6 - C1-3-алкил, R1 представляет собой C1-4-алкильную группу, R2 представляет собой Н или C1-4-алкильную группу, а R3 представляет собой Н или C1-4-алкильную группу с прямой цепью, или R2 и R3 вместе образуют C4-7-циклоалкильный радикал, и, когда R5 представляет собой Н, R4 представляет собой мета-O-Z, где Z - это Н, C1-3-алкил, РО(О C1-4-алкил)2, СО(ОC1-5-алкил), СОNН-С6Н4-( C1-3-алкил) или CO-C6H4-R7, где R7 - орто-ОСОC1-3-алкил, или мета-, или пара- CH2N(R8)2, где R8-C1-4-алкил, или 4-морфолино, или R4 представляет собой мета-S-C1-3-алкил, мета-Cl, мета-F, или мета-СR9R10R11, где R9, R10 и R11 представляют собой Н или F, орто-ОН, орто-О- C2-3 -алкил, пара-F, или пapa-СR9R10R11, или, когда R5 представляет собой пара -C1, -F, -ОН или -О-C1-3-алкил, R4 представляет собой мета -C1, -F, -ОН или -O-C1-3 -алкил, или R4 и R5 вместе представляют собой 3,4-ОСН=СН- или 3,4-ОСН=СНО-, в виде диастереоизомеров или энантиомеров в форме их оснований или солей физиологически совместимых кислот, обладающее терапевтической активностью.
2. Соединение по п.1, отличающееся тем, что Х представляет собой ОН, F, C1 или Н, R1 представляет собой C1-4 -алкильную группу, R2 - Н или СН3, R3 - Н или СН3, и, когда R5 - Н, то R4 представляет собой мета-ОC1-3-алкил, мета-ОН, мета-S-C1-3-алкил, мета-F, мета-Cl, мета-СН3, мета-СF2Н или мета-СF3, или пара-СF3, или, когда R5-пара-Сl или пара- F, то R4 представляет собой мета-Cl, или мета-F, или R4 и R5 вместе представляют собой 3,4-ОСН=СН-.
3. Соединения по п.1 или п.2, отличающиеся тем, что соединения формулы I, в которых радикалы R2 и R3 имеют различные значения, находятся в виде их диастереоизомеров формулы Iа
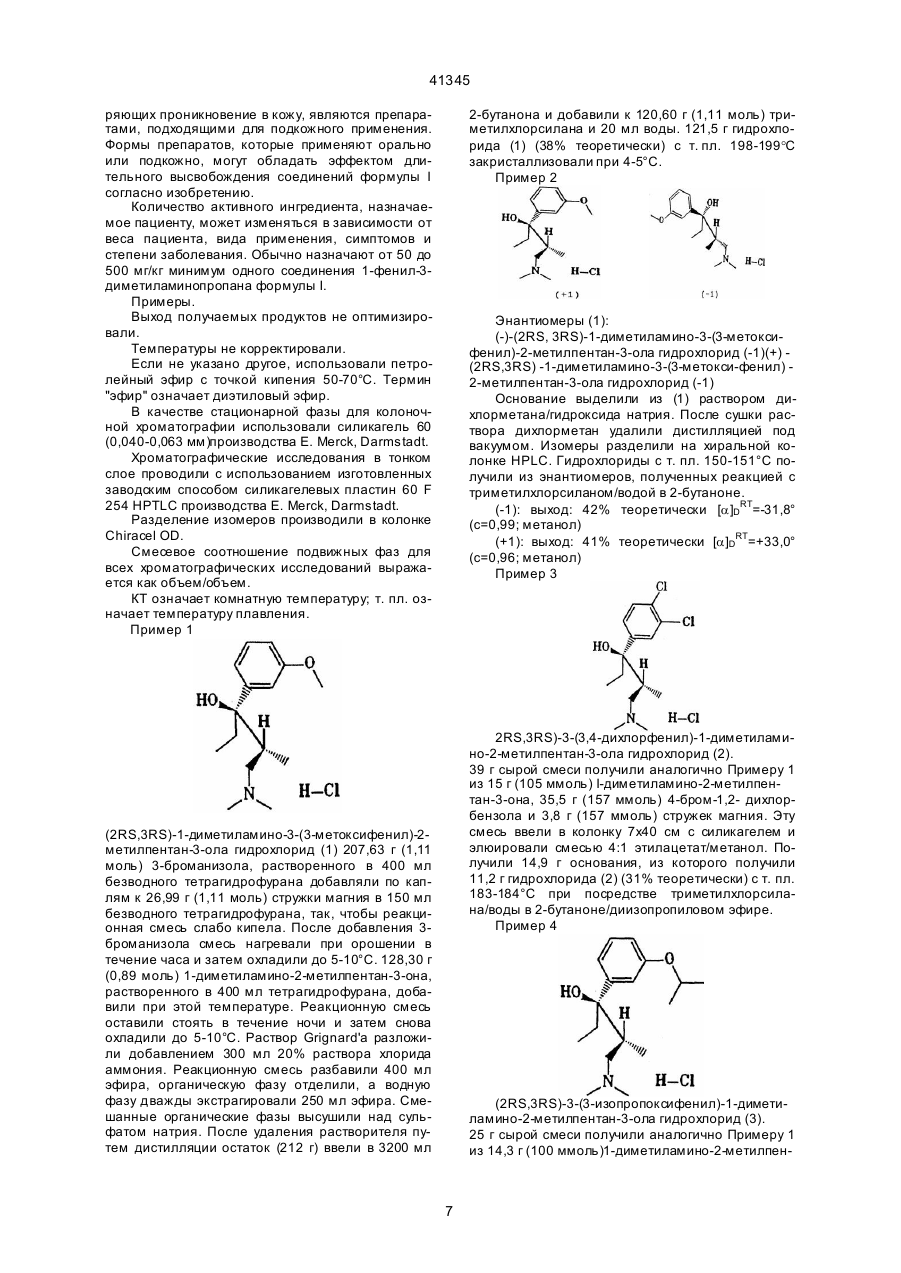
4. Способ получения соединений 1-фенил-3-диметиламинопропана формулы I, в которой Х представляет собой ОН, R1 представляет собой C1-4 -алкильную группу, R2 представляет собой Н или C1-4 - алкильную группу, а R3 представляет собой Н или C1-4-алкильную группу с прямой цепью, или R2 и R3 вместе образуют C4-7-циклоалкильный радикал, и, когда R5 представляет собой Н, R4 представляет собой мета-O-Z, где Z - это Н, C1-3-алкил, РО(ОC1-4-алкил)2, СО(ОC1-5-алкил), СОNН-С6Н4-(C1-3-алкил) или СО-С6Н4-R7, где R7- орто-ОСОC1-3-алкил, или мета-, или пара- CH2N(R8)2, где R8-C1-4-алкил или 4-морфолино, или R4 представляет собой мета-S-C1-3-алкил, мета-Cl, мета-F или мета- СR9R10R11, где R9, R10 и R11 представляют собой Н или F, орто-ОН, орто-О- C2-3 -алкил, пара-F или пapa-СR9R10R11, или, когда R5 представляет собой пара -Cl, -F, -ОН или -О-C1-3-алкил, R4 представляет собой мета -Cl, -F, -ОН или -O-C1-3 -алкил, или R4 и R5 вместе представляют собой 3,4-ОСН=СН- или 3,4-ОСН=СНО-, в виде диастереоизомеров или энантиомеров в форме их оснований или солей физиологически совместимых кислот, отличающийся тем, что -диметиламинокетон формулы II
подвергают взаимодействию с металлорганическим соединением формулы III
в котором Z представляет собой MgCl, MgBr, MgI или Li.
5. Способ по п.4, отличающийся тем, что R2 - Н или СН3, R3 - Н или СН3, и, когда R5 - Н, то R4 представляет собой мета-ОC1-3-алкил, мета-ОН, мета-S-C1-3-алкил, мета-F, мета-Cl, мета-СН3, мета- СF2Н, или мета-СF3, или пара-СF3, или, когда R5 - пара-Сl или пара- F, то R4 представляет собой мета-Сl или мета-F, или R4 и R5 вместе представляют собой 3,4-ОСН=СН-.
6. Способ по п.4 или п.5, отличающийся тем, что соединения формулы I, в которых радикалы R2 и R3 имеют различные значения, находятся в виде их диастереоизомеров формулы Iа.
7. Способ получения соединения 1-фенил-3-диметиламинопропана формулы I, в котором Х представляет собой Н, R1 представляет собой C1-4- алкильную группу, R2 представляет собой Н или C1-4-алкильную группу, а R3 представляет собой H или C1-4-алкильную группу с прямой цепью, или R2 и R3 вместе образуют C4-7-циклоалкильный радикал, и, когда R5 представляет собой Н, R4 представляет собой мета-O-Z, где Z - это Н, C1-3-алкил, РО(ОC1-4-алкил)2, СО(ОC1-5-алкил), СОNН-С6Н4-(C1-3-алкил) или СО-С6Н4-R7, где R7- орто-ОСОC1-3-алкил, или мета-, или пара- CH2N(R8)2, где R8-C1-4-алкил или 4-морфолино, или R4 представляет собой мета-S-C1-3-алкил, мета-Cl, мета-F или мета- СR9R10R11, где R9, R10 и R11 представляют собой Н или F, орто-ОН, орто-О-C2-3-алкил, пара-F или пара-СR9R10R11, или, когда R5 представляет собой пара -Cl, -F, -ОН или -О-C1-3-алкил, R4 представляет собой мета -Cl, -F, -ОН или -O-C1-3-алкил, или R4 и R5 вместе представляют собой 3,4-ОСН=СН- или 3,4-ОСН=СНО-, в виде диастереоизомеров или энантиомеров в форме их оснований или солей физиологически совместимых кислот, отличающийся тем, что соединение формулы I, в котором Х представляет собой Cl, R1 - R5 - как определено выше, подвергают взаимодействию с борогидридом цинка, цианоборогидридом цинка и/или цианоборогидридом олова.
8. Способ по п.7, отличающийся тем, что R2 - Н или СН3, R3 - Н или СН3, и, когда R5 - Н, то R4 представляет собой мета-ОC1-3-алкил, мета-ОН, мета-S-C1-3-алкил, мета-F, мета-Cl, мета-СН3, мета- СF2Н, или мета-СF3, или пара-СF3, или, когда R5 - пара-Сl или пара- F, то R4 представляет собой мета-Сl или мета-F, или R4 и R5 вместе представляют собой 3,4-ОСН=СН-.
9. Способ по п.7 или п.8, отличающийся тем, что соединения формулы I, в которых радикалы R2 и R3 имеют различные значения, находятся в виде их диастереоизомеров формулы Iа.
10. Способ получения соединения 1-фенил-3-диметиламинопропана формулы I, в котором Х представляет собой F, R1 представляет собой C1-4-алкильную группу, R2 представляет собой Н или C1-4-алкильную группу, а R3 представляет собой Н или C1-4-алкильную группу с прямой цепью, или R2 и R3 вместе образуют C4-7-циклоалкильный радикал, и, когда R5 представляет собой Н, R4 представляет собой мета-O-Z, где Z - это Н, C1-3-алкил, РО(ОC1-4 -алкил)2, СО(ОC1-5-алкил), СОNН-С6Н4-(C1-3-алкил) или СО-С6Н4-R7, где R7 - орто-ОСОC1-3-алкил, или мета-, или пара- CH2N(R8)2, где R8-C1-4-алкил или 4-морфолино, или R4 представляет собой мета-S-C1-3-алкил, мета-Cl, мета-F или мета-СR9R10R11, где R9, R10 и R11 представляют собой Н или F, орто-ОН, орто-O-C2-3-алкил, пара-F или пapa-CR9R10Rll, или, когда R5 представляет собой пара -Cl, -F, -ОН или -О-C1-3 -алкил, R4 представляет собой мета -Cl, -F, -ОН или -O-C1-3 -алкил, или R4 и R5 вместе представляют собой 3,4-ОСН=СН- или 3,4-ОСН=СНО-, в виде диастереоизомеров или энантиомеров в форме их оснований или солей физиологически совместимых кислот, отличающийся тем, что соединение формулы I, в котором Х представляет собой ОН, R1 - R5 - как определено выше, подвергают взаимодействию с трифторидом диметиламиносеры в растворителе.
11. Способ по п.10, отличающийся тем, что R2 - Н или СН3, R3 - Н или СН3, и, когда R5 - Н, то R4 представляет собой мета-ОC1-3 -алкил, мета-ОН, мета-S-C1-3 -алкил, мета-F, мета-Cl, мета-СН3, мета-СF2Н, или мета-СF3, или пара-СF3, или, когда R5 - пара- Cl или пара- F, то R4 представляет собой мета-Сl или мета-F, или R4 и R5 вместе представляют собой 3,4-ОСН=СН-.
12. Способ по п.10 или п.11, отличающийся тем, что соединения формулы I, в которых радикалы R2 и R3 имеют различные значения, находятся в виде их диастереоизомеров формулы Iа.
13. Способ получения соединения 1-фенил-3-диметиламинопропана формулы I, в котором Х = Cl, R1 представляет собой C1-4-алкильную группу, R2 представляет собой Н или C1-4-алкильную группу, a R3 представляет собой Н или C1-4-алкильную группу с прямой цепью, или R2 и R3 вместе образуют C4-7-циклоалкильный радикал, и, когда R5 представляет собой Н, R4 представляет собой мета-O-Z, где Z - это Н, C1-3-алкил, РО(ОC1-4 -алкил)2, СО(ОC1-5-алкил), СОNН-С6Н4-(C1-3-алкил) или СО-С6Н4-R7, где R7 - орто-ОСОC1-3-алкил, или мета-, или пара- CH2N(R8)2, где R8-C1-4-алкил или 4-морфолино, или R4 представляет собой мета-S-C1-3-алкил, мета-Cl, мета-F или мета-СR9R10R11, где R9, R10 и R11 представляют собой Н или F, орто-ОН, орто-O-C2-3-алкил, пара-F или пapa-CR9R10Rll, или, когда R5 представляет собой пара -Cl, -F, -ОН или -О-C1-3 -алкил, R4 представляет собой мета -Cl, -F, -ОН или -O-C1-3 -алкил, или R4 и R5 вместе представляют собой 3,4-ОСН=СН- или 3,4-ОСН=СНО-, в виде диастереоизомеров или энантиомеров в форме их оснований или солей физиологически совместимых кислот, отличающийся тем, что соединение формулы I, в котором Х представляет собой ОН, R1 - R5 - как определено выше, подвергают взаимодействию с тионилхлоридом.
14. Способ по п.13, отличающийся тем, что R2 - Н или СН3, R3 - Н или СН3, и, когда R5 - Н, то R4 представляет собой мета-ОC1-3 -алкил, мета-ОН, мета-S-C1-3 -алкил, мета-F, мета-Cl, мета-СН3, мета-СF2Н, или мета-СF3, или пара-СF3, или, когда R5 - пара- Cl или пара- F, то R4 представляет собой мета-Сl или мета-F, или R4 и R5 вместе представляют собой 3,4-ОСН=СН-.
15. Способ по п.13 или п.14, отличающийся тем, что соединения формулы I, в которых радикалы R2 и R3 имеют различные значения, находятся в виде их диастереоизомеров формулы Iа.
16. Способ получения соединения 1-фенил-3-диметиламинопропана формулы I, в котором Х представляет собой группу OCOR6, где R6 - C1-3-алкил, R1 представляет собой C1-4 - алкильную группу, R2 представляет собой Н или C1-4- алкильную группу, a R3 представляет собой Н или C1-4-алкильную группу с прямой цепью, или R2 и R3 вместе образуют С4-7-циклоалкильный радикал, и, когда R5 представляет собой Н, R4 представляет собой мета-O-Z, где Z - это Н, C1-3-алкил, РО(ОC1-4 -алкил)2, СО(ОC1-5-алкил), СОNН-С6Н4-(C1-3-алкил) или СО-С6Н4-R7, где R7 - орто-ОСОC1-3-алкил, или мета-, или пара- CH2N(R8)2, где R8-C1-4-алкил или 4-морфолино, или R4 представляет собой мета-S-C1-3-алкил, мета-Cl, мета-F или мета-СR9R10R11, где R9, R10 и R11 представляют собой Н или F, орто-ОН, орто-O-C2-3-алкил, пара-F или пapa-CR9R10Rll, или, когда R5 представляет собой пара -Cl, -F, -ОН или -О-C1-3 -алкил, R4 представляет собой мета -Cl, -F, -ОН или -О-C1-3-алкил, или R4 и R5 вместе представляют собой 3,4-ОСН=СН- или 3,4-ОСН=СНО в виде диастереоизомеров или энантиомеров в форме их оснований или солей физиологически совместимых кислот, отличающийся тем, что соединение формулы I, в котором Х представляет собой ОН, R1 - R5 - как определено выше, подвергают взаимодействию с хлоридом кислоты Cl-COOR6.
17. Способ по п.16, отличающийся тем, что соединения формулы I, в которых радикалы R2 и R3 имеют различные значения, находятся в виде их диастереоизомеров формулы Iа.
18. Способ снятия боли, включающий назначение терапевтически активного агента, отличающийся тем, что в качестве терапевтически активного агента назначают соединение 1-фенил-3-диметиламинопропана формулы I, где Х представляет собой группу ОН, F, С1, Н или OCOR6, где R6-C1-3-алкил, R1 представляет собой C1-4-алкильную группу, R2 представляет собой Н или C1-4-алкильную группу, а R3 представляет собой Н или C1-4-алкильную группу с прямой цепью, или R2 и R3 вместе образуют С4-7-циклоалкильный радикал, и, когда R5 представляет собой Н, R4 представляет собой мета-O-Z, где Z - это Н, C1-3-алкил, РО(ОC1-4 -алкил)2, СО(ОC1-5-алкил), СОNН-С6Н4-(C1-3-алкил) или СО-С6Н4-R7, где R7-орто-ОСОC1-3-алкил, или мета-, или пара- CH2N(R8)2, где R8-C1-4-алкил или 4-морфолино, или R4 представляет собой мета-S-C1-3-алкил, мета-Cl, мета-F или мета-СR9R10R11, где R9, R10 и R11 представляют собой Н или F, орто-ОН, орто-O-C2-3-алкил, пара-F или пapa-CR9R10Rll, или, когда R5 представляет собой пара -Cl, -F, -ОН или -О-C1-3 -алкил, R4 представляет собой мета -Cl, -F, -ОН или -O-C1-3 -алкил, или R4 и R5 вместе представляют собой 3,4-ОСН=СН- или 3,4-ОСН=СНО-, в виде диастереоизомеров или энантиомеров в форме их оснований или солей физиологически совместимых кислот.
19. Способ снятия боли по п.18, отличающийся тем, что в качестве активного агента назначают соединение формулы I, где Х представляет собой ОН, F, Cl или Н, R1 представляет собой C1-4 - алкильную группу, R2 - Н или СН3, R3 - Н или СН3, и, когда R5 - Н, то R4 представляет собой мета-ОC1-3-алкил, мета-ОН, мета-S-C1-3-алкил, мета-F, мета-Cl, мета-СН3, мета-СF2Н, или мета-СF3, или пара-СF3, или, когда R5 - пара-Сl или пара- F, то R4 представляет собой мета-Сl или мета-F, или R4 и R5 вместе представляют собой 3,4-ОСН=СН-.
20. Способ снятия боли по п.18 или п.19, отличающийся тем, что в качестве активного агента назначают соединение формулы I, в котором радикалы R2 и R3 имеют различные значения, и которое находится в виде его диастереоизомеров формулы Iа.
21. Анальгетик, содержащий активный ингредиент и как минимум одно вспомогательное вещество, отличающийся тем, что активный ингредиент представляет собой как минимум одно соединение 1-фенил-3-диметиламинопропана формулы I, где Х представляет собой ОН, F, Cl, Н или группу OCOR6, где R6 - C1-3-алкил, R1 представляет собой C1-4-алкильную группу, R2 представляет собой H или C1-4-алкильную группу, a R3 представляет собой Н или C1-4-алкильную группу с прямой цепью, или R2 и R3 вместе образуют C4-7 -циклоалкильный радикал, и, когда R5 представляет собой Н, R4 представляет собой мета-O-Z, где Z - это Н, C1-3-алкил, РО(ОC1-4 -алкил)2, СО(ОC1-5-алкил), СОNН-С6Н4-(C1-3-алкил) или СО-С6Н4-R7, где R7-орто-ОСОC1-3-алкил, или мета-, или пара- CH2N(R8)2, где R8-C1-4-алкил или 4-морфолино, или R4 представляет собой мета-S-C1-3-алкил, мета-Cl, мета-F или мета-СR9R10R11, где R9, R10 и R11 представляют собой Н или F, орто-ОН, орто-O-C2-3-алкил, пара-F или пapa-CR9R10Rll, или, когда R5 представляет собой пара -Cl, -F, -ОН или -О-C1-3-алкил, R4 представляет собой мета -Cl, -F, -ОН или -O-C1-3-алкил, или R4 и R5 вместе представляют собой 3,4-ОСН=СН- или 3,4-ОСН=СНО-, в виде диастереоизомеров или энантиомеров в форме их оснований или солей физиологически совместимых кислот.
22. Анальгетик по п.21, отличающийся тем, что Х представляет собой ОН, F, Cl или Н, R1 представляет собой C1-4-алкильную группу, R2 - Н или СН3, R3 - Н или СН3, и, когда R5 - Н, то R4 представляет собой мета-ОC1-3-алкил, мета-ОН, мета-S-C1-3-алкил, мета-F, мета-Cl, мета-СН3, мета- СF2Н или мета-СF3, или пара-СF3, или, когда R5 - пара- Cl или пара- F, то R4 представляет собой мета-Сl или мета-F, или R4 и R5 вместе представляют собой 3,4-ОСН=СН-.
23. Анальгетик по п.21 или п.22, отличающийся тем, что соединение формулы I, в котором радикалы R2 и R3 имеют различные значения, находится в виде его диастереоизомеров формулы Iа.
Текст
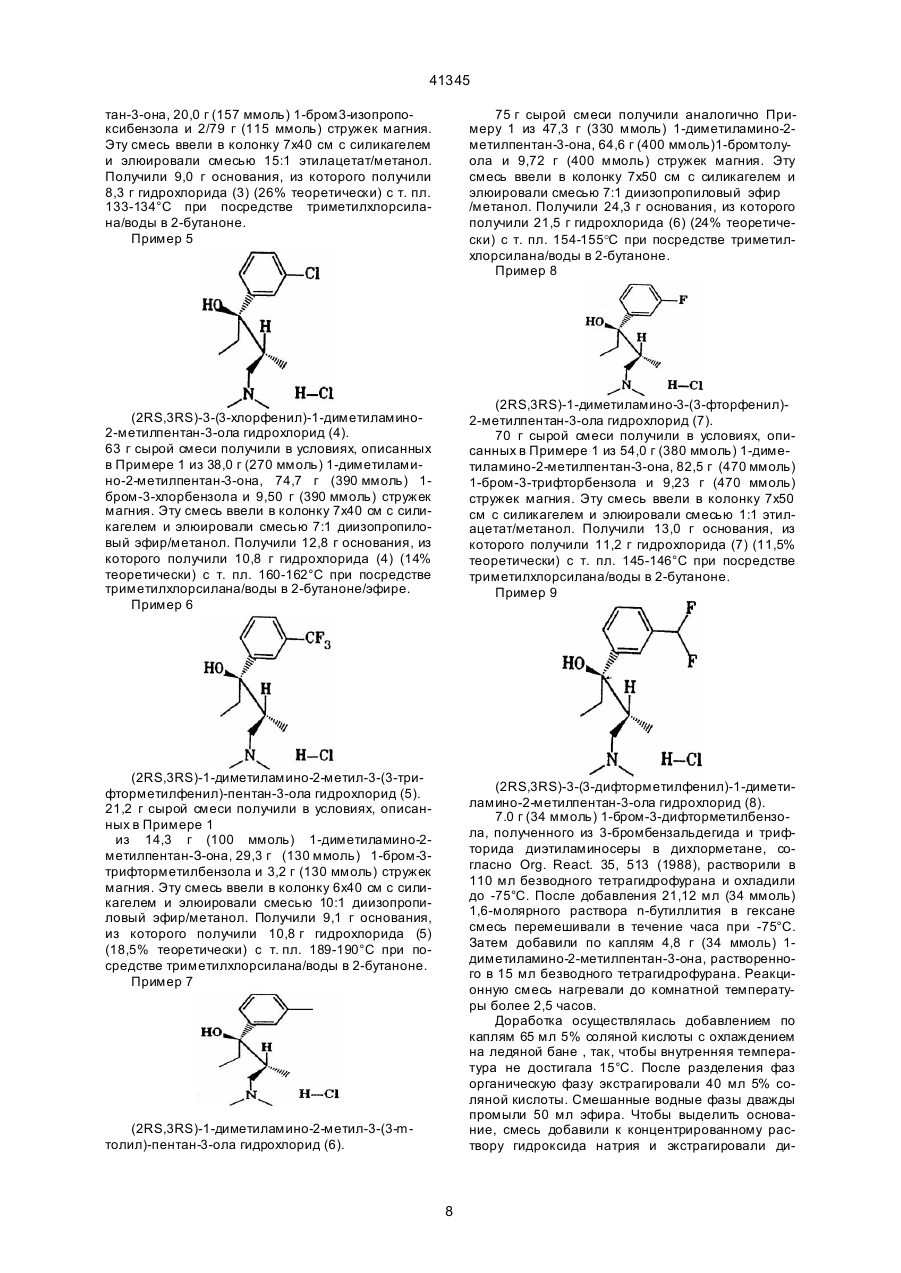
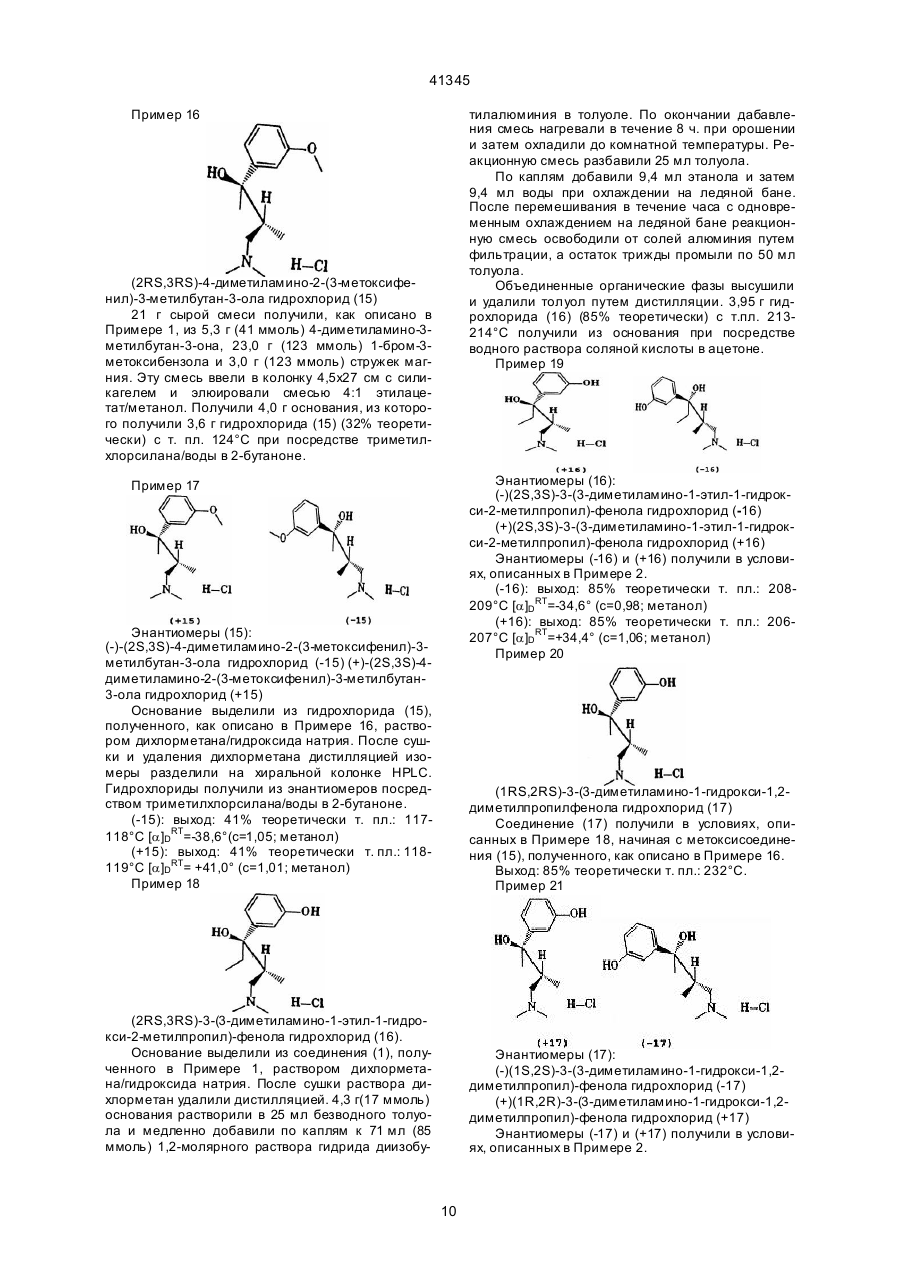
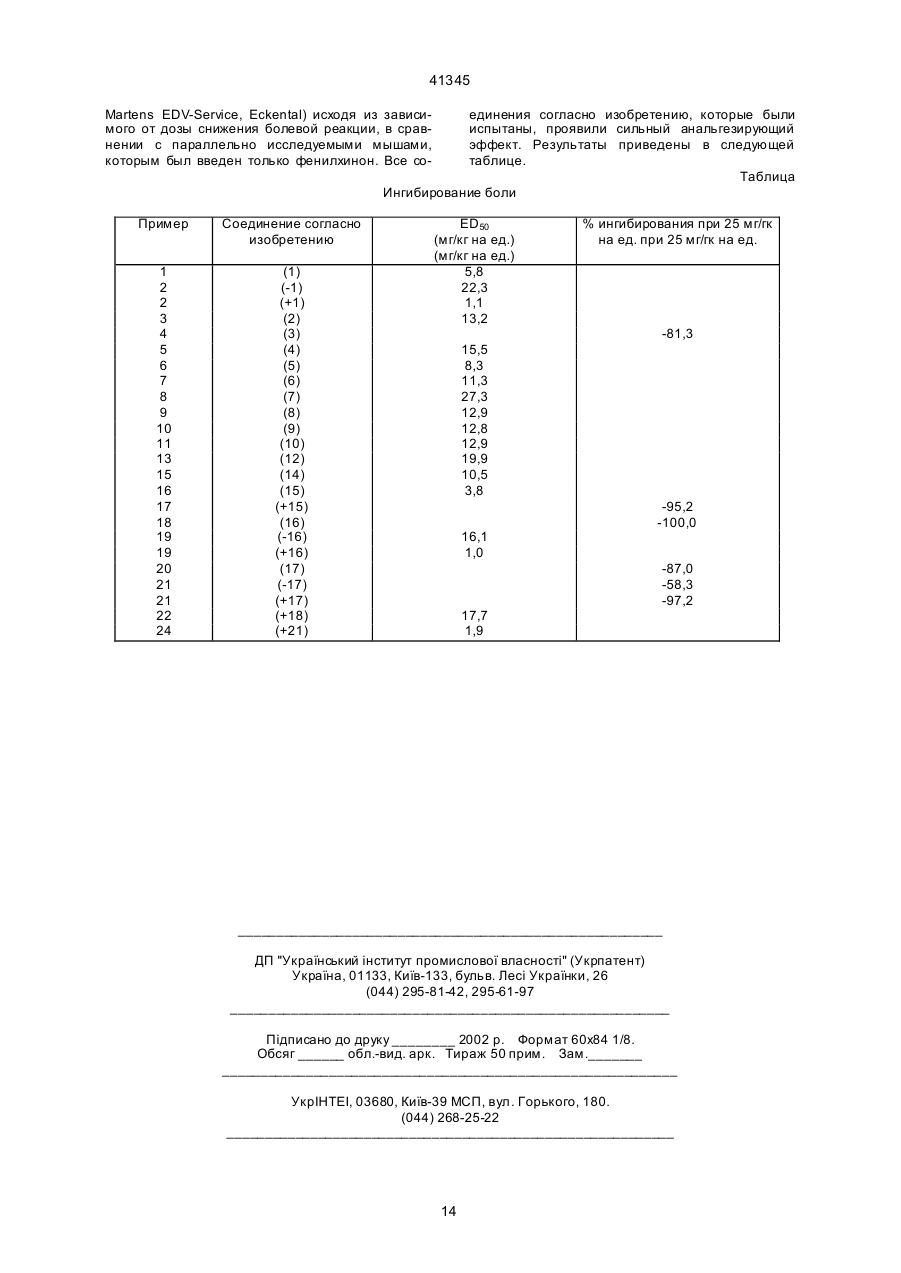
1. Соединение 1-фенил-3-диметиламинопропана формулы I C2 (54) СПОЛУКА 1-ФЕНІЛ-3-ДИМЕТИЛАМІНОПРОП АНУ, СПОСІБ ЇЇ ОДЕРЖАННЯ (ВАРІАНТИ), СПОСІБ ЗНЯТТЯ БОЛЮ І АНАЛЬГЕТИК 41345 РО(ОC1-4-алкил)2, СО(ОC1-5-алкил), СОNН-С6Н4(C1-3-алкил) или СО-С 6Н4-R7, где R7 - орто-ОСОC18 8 3-алкил или мета-, или пара-CH 2N(R )2, где R - C 14 4-алкил или 4-морфолино, или R представляет собой мета-S-C1-3-алкил, мета-Cl, мета-F или мета-СR9R10R11, где R9, R 10 и R11 представляют собой Н или F, орто-ОН, орто-О-C2-3-алкил, пара-F или пapa-СR9R10R11, или, когда R5 представляет собой пара-Cl, -F, -ОН или -О-C1-3-алкил, R4 представляет собой мета-Cl, -F, -ОН или -O-C1-3-алкил, или R4 и R5 вместе представляют собой 3,4-ОСН=СНили 3,4-ОСН=СНО-, в виде диастереоизомеров или энантиомеров в форме их оснований или солей физиологически совместимых кислот, отличающийся тем, что β-диметиламинокетон формулы II , орто-ОН, орто-О-C2-3-алкил, пара-F или параСR9R10R11, или, когда R5 представляет собой пара-Cl, -F, -ОН или -О-C1-3-алкил, R4 представляет собой мета-Cl, -F, -ОН или -O-C1-3-алкил, или R4 и R5 вместе представляют собой 3,4-ОСН=СНили 3,4-ОСН=СНО-, в виде диастереоизомеров или энантиомеров в форме их оснований или солей физиологически совместимых кислот, отличающийся тем, что соединение формулы I, в котором Х представляет собой Cl, R1-R5 - как определено выше, подвергают взаимодействию с борогидридом цинка, цианоборогидридом цинка и/или цианоборогидридом олова. 8. Способ по п. 7, отличающийся тем, что R2 - Н или СН 3, R3 - Н или СН3, и, когда R5 - Н, то R4 представляет собой мета-ОC1-3-алкил, мета-ОН, мета-S-C1-3-алкил, мета-F, мета-Cl, мета-СН3, мета-СF2Н, или мета-СF3, или пара-СF3, или, когда R5 - пара-Сl или пара-F, то R 4 представляет собой мета-Сl или мета-F, или R4 и R5 вместе представляют собой 3,4-ОСН=СН-. 9. Способ по п. 7 или п. 8, отличающийся тем, что соединения формулы I, в которых радикалы R2 и R3 имеют различные значения, находятся в виде их диастереоизомеров формулы Iа. 10. Способ получения соединения 1-фенил-3диметиламинопропана формулы I, в котором Х представляет собой F, R1 представляет собой C1-4-алкильную группу, R2 представляет собой Н или C1-4-алкильную группу, а R3 представляет собой Н или C1-4-алкильную группу с прямой цепью, или R2 и R3 вместе образуют C4- 7-циклоалкильный радикал, и, когда R5 представляет собой Н, R4 представляет собой мета-O-Z, где Z - это Н, C1-3-алкил, РО(ОC1-4-алкил)2, СО(ОC1-5-алкил), СОNН-С6Н4(C1-3-алкил) или СО-С 6Н4-R7, где R7 - ортоОСОC1-3-алкил, или мета-,или пара-CH2N(R8)2, где R8 - C1-4-алкил или 4-морфолино, или R4 представляет собой мета-S-C1-3-алкил, мета-Cl, мета-F или мета-СR9R10R11, где R9, R10 и R11 представляют собой Н или F, орто-ОН, орто-O-C2-3-алкил, пара-F или пapa-CR9R10R11, или, когда R5 представляет собой пара-Cl, -F, -ОН или -О-C1-3-алкил, R4 представляет собой мета-Cl, -F, -ОН или -O-C1-3-алкил, или R4 и R5 вместе представляют собой 3,4-ОСН=СНили 3,4-ОСН=СНО-, в виде диастереоиомеров или энантиомеров в форме их оснований или солей физиологически совместимых кислот, отличающийся тем, что соединение формулы I, в котором Х представляет собой ОН, R1-R5 - как определено выше, подвергают взаимодействию с трифторидом диметиламиносеры в растворителе. 11. Способ по п. 10, отличающийся тем, что R2 Н или СН 3, R3 - Н или СН3, и, когда R5 - Н, то R4 представляет собой мета-ОC1-3-алкил, мета-ОН, мета-S-C1-3-алкил, мета-F, мета-Cl, мета-СН3, мета-СF2Н, или мета-СF3, или пара-СF3, или, когда R5 - пара-Cl или пара-F, то R4 представляет собой мета-Сl или мета-F, или R4 и R5 вместе представляют собой 3,4-ОСН=СН-. (II) подвергают взаимодействию с металлорганическим соединением формулы III , (III) в котором Z представляет собой MgCl, MgBr, MgI или Li. 5. Способ по п. 4, отличающийся тем, что R2 - Н или СН 3, R3 - Н или СН3, и, когда R5 - Н, то R4 представляет собой мета-ОC1-3-алкил, мета-ОН, мета-S-C1-3-алкил, мета-F, мета-Cl, мета-СН3, мета-СF2Н, или мета-СF3, или пара-СF3, или, когда R5 - пара-Сl или пара-F, то R 4 представляет собой мета-Сl или мета-F, или R4 и R5 вместе представляют собой 3,4-ОСН=СН-. 6. Способ по п. 4 или п. 5, отличающийся тем, что соединения формулы I, в которых радикалы R2 и R3 имеют различные значения, находятся в виде их диастереоизомеров формулы Iа. 7. Способ получения соединения 1-фенил-3диметиламинопропана формулы I, в котором Х представляет собой Н, R1 представляет собой C1-4-алкильную группу, R2 представляет собой Н или C1-4-алкильную группу, а R3 представляет собой H или C1-4-алкильную группу с прямой цепью, или R2 и R3 вместе образуют C4- 7-циклоалкильный радикал, и, когда R5 представляет собой Н, R4 представляет собой мета-O-Z, где Z - это Н C1-3-алкил, РО(ОC1-4алкил)2, СО(ОC1-5-алкил), СОNН-С6Н4-(C1-3-алкил) или СО-С 6Н4-R7, где R7-орто-ОСОC1- 3-алкил, или мета-, или пара-CH2N(R8)2, где R8 - C1-4-алкил или 4-морфолино, или R4 представляет собой мета-SC1-3-алкил, мета-Cl, мета-F или мета-СR9R10R11, где R9, R10 и R11 представляют собой Н или F, 2 41345 когда R5 представляет собой пара-Cl, -F, -ОН или -О-C1-3-алкил, R4 представляет собой мета -Cl, -F, -ОН или -О-C1-3-алкил, или R4 и R5 вместе представляют собой 3,4-ОСН=СНили 3,4-ОСН=СНО-, в виде диастереоизомеров или энантиомеров в форме их оснований или солей физиологически совместимых кислот, отличающийся тем, что соединение формулы I, в котором Х представляет собой ОН, R1-R5 - как определено выше, подвергают взаимодействию с хлоридом кислоты ClCOOR6. 17. Способ по п. 16, отличающийся тем, что соединения формулы I, в которых радикалы R2 и R3 имеют различные значения, находятся в виде их диастереоизомеров формулы Iа. 18. Способ снятия боли, включающий назначение терапевтически активного агента, отличающийся тем, что в качестве терапевтически активного агента назначают соединение 1-фенил-3диметиламинопропана формулы I, где Х представляет собой группу ОН, F, Сl, Н или OCOR 6, где R6 - C1-3-алкил, R1 представляет собой C1-4-алкильную группу, R2 представляет собой Н или C1-4-алкильную группу, а R3 представляет собой Н или C1-4-алкильную группу с прямой цепью, или R2 и R3 вместе образуют С4- 7-циклоалкильный радикал, и, когда R5 представляет собой Н, R4 представляет собой мета-O-Z, где Z - это Н, C1-3-алкил, РО(ОC1-4-алкил)2, СО(ОC1-5-алкил), СОNН-С6Н4(C1-3-алкил) или СО-С 6Н4-R7, где R7 – ортоОСОC1-3-алкил, или мета, или пара-CH 2N(R8)2, где R8 - C1-4-алкил или 4-морфолино, или R4 представляет собой мета-S-C1-3-алкил, мета-Cl, мета-F или мета-СR9R10R11, где R9, R10 и R11 представляют собой Н или F, орто-ОН, орто-O-C2-3алкил, пара-F или пapa-CR9R10R11, или, когда R5 представляет собой пара-Cl, -F, -ОН или О-C1-3-алкил, R4 представляет собой мета-Cl, -F, -ОН или -O-C1-3-алкил, или R4 и R5 вместе представляют собой 3,4-ОСН=СНили 3,4-ОСН=СНО-, в виде диастереоизомеров или энантиомеров в форме их оснований или солей физиологически совместимых кислот. 19. Способ снятия боли по п. 18, отличающийся тем, что в качестве активного агента назначают соединение формулы I, где Х представляет собой ОН, F, Cl или Н, R1 представляет собой C1-4-алкильную группу,R2 Н или СН 3, R3 - Н или СН3, и, когда R5 - Н, то R4 представляет собой мета-ОC1-3-алкил, мета-ОН, мета-S-C1-3-алкил, мета-F, мета-Cl, мета-СН3, мета-СF2Н, или мета-СF3, или пара-СF3, или, когда R5 - пара-Сl или пара-F, то R 4 представляет собой мета-Сl или мета-F, или R4 и R5 вместе представляют собой 3,4ОСН= СН-. 20. Способ снятия боли по п. 18 или п. 19, отличающийся тем, что в качестве активного агента назначают соединение формулы I, в котором радикалы R2 и R3 имеют различные значения, и которое находится в виде его диастереоизомеров формулы Iа. 12. Способ по п. 10 или п. 11, отличающийся тем, что соединения формулы I, в которых радикалы R2 и R3 имеют различные значения, находятся в виде их диастереоизомеров формулы Iа. 13. Способ получения соединения 1-фенил-3диметиламинопропана формулы I, в котором Х = Cl, R1 представляет собой C1-4-алкильную группу, R2 представляет собой Н или C1-4-алкильную группу, a R3 представляет собой Н или C1-4-алкильную группу с прямой цепью, или R2 и R3 вместе образуют C4- 7-циклоалкильный радикал, и, когда R5 представляет собой Н, R4 представляет собой мета-O-Z, где Z – это Н, C1-3-алкил, РО(ОC1-4-алкил)2, СО(ОC1-5-алкил), СОNН-С6Н4(C1-3-алкил) или СО-С 6Н4-R7, где R7–орто- ОСОC1-3-алкил, или мета-, или пара-CH2N(R8)2,где R8 - C1-4-алкил или 4морфолино, или R4 представляет собой мета-SC1-3-алкил, мета-Cl, мета-F или мета-СR9R10R11, где R9, R10 и R11 представляют собой Н или F, орто-ОН, орто-O-C2-3-алкил, пара-F или пapaCR9R10R11, или, когда R5 представляет собой пара-Cl, -F, -ОН или -О-C1-3-алкил, R4 представляет собой мета-Cl, -F, -ОН или -O-C1-3-алкил, или R4 и R5 вместе представляют собой 3,4-ОСН=СНили 3,4-ОСН=СНО -, в виде диастереоизомеров или энантиомеров в форме их оснований или солей физиологически совместимых кислот, отличающийся тем, что соединение формулы I, в котором Х представляет собой ОН, R1-R5 - как определено выше, подвергают взаимодействию с тионилхлоридом. 14. Способ по п. 13, отличающийся тем, что R2 Н или СН 3, R3 - Н или СН3, и, когда R5 - Н, то R4 представляет собой мета-ОC1-3-алкил, мета-ОН, мета-S-C1-3-алкил, мета-F, мета-Cl, мета-СН3, мета-СF2Н, или мета-СF3, или пара-СF3, или, когда R5 - пара-Cl или пара-F, то R4 представляет собой мета-Сl или мета-F, или R4 и R5 вместе представляют собой 3,4-ОСН=СН-. 15. Способ по п. 13 или п. 14, отличающийся тем, что соединения формулы I, в которых радикалы R2 и R3 имеют различные значения, находятся в виде их диастереоизомеров формулы Iа. 16. Способ получения соединения 1-фенил-3диметиламинопропана формулы I, в котором Х представляет собой группу OCOR6, где R6 - C1-3алкил, R1 представляет собой C1-4-алкильную группу, R2 представляет собой Н или C1-4-алкильную группу, a R3 представляет собой Н или C1-4-алкильную группу с прямой цепью, или R2 и R3 вместе образуют С4- 7-циклоалкильный радикал, и, когда R5 представляет собой Н, R4 представляет собой мета-O-Z, где Z - это Н, C1-3-алкил, РО(ОC1-4-алкил)2, СО(ОC1-5-алкил), СОNН-С6Н4(C1-3-алкил) или СО-С 6Н4-R7, где R7 - ортоОСОC1-3-алкил, или мета-, или пара-CH2N(R8)2, где R8 - C1-4-алкил или 4-морфолино, или R4 представляет собой мета-S-C1-3-алкил, мета-Cl, мета-F или мета-СR9R10R11, где R9, R10 и R11 представляют собой Н или F, орто-ОН, орто-O-C2-3-алкил, пара-F или пapa-CR9R10R11, или, 3 41345 21. Анальгетик, содержащий активный ингредиент и как минимум одно вспомогательное вещество, отличающийся тем, что активный ингредиент представляет собой как минимум одно соединение 1-фенил-3-диметиламинопропана формулы I, где Х представляет собой ОН, F, Cl, Н или группу OCOR6, где R6 - C1- 3-алкил, R1 представляет собой C1-4-алкильную группу, R2 представляет собой H или C1-4-алкильную группу, a R3 представляет собой Н или C1-4-алкильную группу с прямой цепью, или R2 и R3 вместе образуют C4- 7-циклоалкильный радикал, и, когда R5 представляет собой Н, R4 представляет собой мета-O-Z, где Z - это Н, C1-3-алкил, РО(ОC1-4-алкил)2, СО(ОC1-5-алкил), СОNН-С6Н4(C1-3-алкил) или СО-С 6Н4-R7, где R7 - ортоОСОC1-3-алкил, или мета-, или пара-CH2N(R8)2, где R8 - C1-4-алкил или 4-морфолино, или R4 представляет собой мета-S-C1-3-алкил, мета-Cl, мета-F или мета-СR9R10R11, где R9, R10 и R11 представляют собой Н или F, орто-ОН, орто-O-C2-3-алкил, пара-F или пapa-CR9R10R11, или, когда R5 представляет собой пара-Cl, -F, -ОН или -О-C1-3-алкил, R4 представляет собой мета-Cl, -F, -ОН или -O-C1-3-алкил, или R4 и R5 вместе представляют собой 3,4-ОСН=СНили 3,4-ОСН=СНО-, в виде диастереоизомеров или энантиомеров в форме их оснований или солей физиологически совместимых кислот. 22. Анальгетик по п. 21, отличающийся тем, что Х представляет собой ОН, F, Cl или Н, R1 представляет собой C1-4-алкильную группу, R 2 - Н или СН3, R3 - Н или СН 3, и, когда R5 - Н, то R4 представляет собой мета-ОC1-3алкил, мета-ОН, мета-S-C1-3-алкил, мета-F, метаCl, мета-СН3, мета-СF2Н или мета-СF3, или параСF3, или, когда R5 - пара-Cl или пара-F, то R 4 представляет собой мета-Сl или мета-F, или R4 и R5 вместе представляют собой 3,4-ОСН=СН-. 23. Анальгетик по п. 21 или п. 22, отличающийся тем, что соединение формулы I, в котором радикалы R2 и R3 имеют различные значения, находится в виде его диастереоизомеров формулы Iа. Изобретение относится к 1-фенил-3диметиламинопропановым соединениям, способам их получения, к применению этих веществ в качестве фармацевтически активных ингредиентов и к анальгетику на их основе. Лечение хронических и нехронических болевых о щущений является одной из важнейших задач медицины. Это отражено в большом количестве публикаций. Так, например, 1-нафтил-3аминопропан-1-олы с анальгетико-наркотическим эффектом известны из ЕР 176 049. Вторичные и третичные спирты с g-аминогруппами описаны в J. Pharm. Sci. 59, 1038 (1970) и J. Prakt. Chem. 323, 793 (1981); фенил-диметиламинопропанолы, содержащие пара-замещенный фенильный радикал, описаны в Chem. Abstr. 54, 20936с (1960) и Chem. Abstr. 63, 6912е (1965). Эти соединения обладают также анальгезирующими свойствами. Напротив, 3-диметиламинопропан-1-олы, содержащие 2 фенильных радикала, описанные в DE 3242922, имеют успокаивающий эффект. 1-фенил-пропан1-олы, описанные в J. Pharm. Sci. 57, 1487 (1968), обладают различными фармакологическими эффектами в зависимости от g-аза-кольца. В течение многих лет в качестве анальгетиков при лечении боли использовались опиоиды, хотя они дают множество побочных эффектов, например, привыкание и зависимость от них, подавление респираторной деятельности, желудочнокишечной активности и запоры. Поэтому их можно применять в течение длительного времени или в повышенных дозах только в сочетании с особыми мерами предосторожности. (Goodman, Gilman, в "The Pharmacological Basis of Therapeutics", Pergamon Press, New York (1990)). Трамадола гидрохлорид - (1RS; 2RS)-2[(диметиламино)метил]-1-(3-метокси-фенил)циклогексанола гидрохлорид - занимает особое положение среди анальгетиков, действующих на центральную нервную систему, поскольку этот активный ингредиент повышает длительность притупления боли без побочных эффектов, известных для опиоидов (J. Pharmacol. Exptl. Ther. 267, 331 (1993)). Трамадол имеет разновидности и состоит из одинакового количества (+) и (-) энантиомеров. В живых организмах активный ингредиент образует метаболический O-дезметилтрамадол, который также присутствует в виде смеси энантиомеров. Исследования показали, что как энантиомеры трамадола, так и энантиомеры метаболитов трамадола оказывают анальгезирующее действие (J. Pharmacol. Exp. Ther. 260, 275 (1992)). В основу данного изобретения поставлена задача получения вещества с анальгетическим эффектом для лечения сильных болей без побочных эффектов, характерных для опиоидов. Полученные вещества также не должны проявлять таких побочных эффектов, как тошнота и рвота, которые иногда возникают при лечении трамадолом. Было обнаружено, что строгие требования, предъявляемые к получаемым веществам, выполняются для определенных 1-фенил-3диметиламинопропановых соединений. Эти вещества отличаются сильным анальгетическим эффектом, значительно увеличенным по сравнению с трамадолом. Таким образом, данное изобретение относится к соединениям 1-фенил-3-диметиламинопропана формулы I: ,(I) где Х представляет собой группу ОН, F, Cl, Н или OCOR6, где R6 – С1-3-алкил, R1 - С1-4-алкил, 4 41345 R2 - Н или С1-4-алкил, a R3 - Н или С1-4алкильная группа с прямой цепью, или R2 и R3 вместе образуют C4-7-циклоалкильный радикал, и когда R5 представляет собой Н, R4 представляет собой мета-O-Z, где Z - Н, С1-3-алкил, РО(ОС1-4алкил)2, СО(ОС 1-5-алкил), CONH-C6H4-(C1-3-алкил) или CO-C6H4-R7, где R7 орто-ОСОС1-3-алкил или мета- или napa-CH2N(R8)2, где R8 - С1-4-алкил или 4-морфолино, или R4 представляет собой мета-SС1-3-алкил, мета-Сl, мета-F или мета-CR9R10R11, где R9, R10 и R11 представляют собой Н или F, орто-ОН, орто-O-С2-3-алкил, пара-F или параCR9R10R11, или когда R5 представляет собой в пара-положении Cl, -F, -ОН или -O-С 1-3-алкил, или R4 и R5 вместе представляют 3,4-ОСН=СН - или 3,4-ОСН= СНО-, как диастереоизомерам или энантиомерам в виде их оснований или солей физиологически совместимых кислот. Предпочтительными являются соединения 1фенил-3-диметиламинопропана формулы I, в которых Х представляет собой ОН, F, Cl или Н, R1 представляет собой С 1-4-алкил, R2 - H или СН3, a R3 - H или CH3, и когда R5 - H, то R4 представляет собой в мета-положении -ОС1-3-алкил, -ОН, -SС1-3-алкил, -F, -Cl, -СН3, -CF2H или –CF3, или napaCF3, или когда R5 - пара-Сl или пара-F, то R 4 представляет собой мета-Сl или мета-F, или R4 или R5 вместе представляют собой 3,4ОСН= СН-. Особенно предпочтительными являются соединения 1-фенил-3-ди-метиламинопропана формулы I, в которых радикалы R2 и R3 имеют различные значения, в виде их диастереоизомеров конфигурации 1а ,(III) в котором Z представляет собой MgCl, MgBr, МgI или Li, образуя соединение формулы І, в котором Х=ОН. Реакция b-диметиламинокетона с реагентом Grignard'a формулы III, в котором Z представляет собой MgCl, MgBr или MgI, или с органолитиевым соединением формулы III, может проводиться в алифатическом эфире, например, диэтиловом эфире и/или тетрагидрофуране, при температурах в диапазоне -70°С - +60°С. Органолитиевые соединения формулы III могут быть получены заменой галогена литием в реакции соединения формулы III, в котором Z представляет собой Сl, Вг или I, с раствором, например, n-бутиллития в nгексане. b-диметиламинокетоны формулы II могут быть получены из кетонов общей формулы IV ,(IV) реакцией с диметиламингидрохлоридом и формальдегидом в ледяной уксусной кислоте или в С1-4-алкильном спирте или реакцией с диметиламмонийэтиленхлоридом в ацетонитриле с использованием ацетилхлорида в качестве катализатора (Synthesis 1973, 703). В результате реакции b-диметиламинокетона формулы II, в котором переменные R2 и R3 имеют разные значения, с металлоорганическим соединением формулы III получают соединения 1фенил-3-диметиламинопропана формулы I с относительной конфигурацией формулы Iа , (Ia) Данное изобретение также относится к способу получения соединений 1-фенил-3-диметиламинопропана формулы I, в которых переменная Х представляет собой ОН, отличающемуся тем, что b-диметиламинокетон формулы II ,(Ia) в которых Х и диметиламиногруппа расположены эритринно по отношению друг к другу. Напротив, если реакция получения І-фенил-1-гидрокси-3-ди метиламинопропанов проводилась в соответствиии со способом, описанным в DD124521, т.е., если β-аминокетоны формулы V ,(II) подвергают взаимодействию с металлоорганическим соединением формулы III ,(V) 5 41345 реагировали с алкильным реагентом Grignard'a R MgHal, в результате были получены соединения с относительной конфигурацией Ib Замещение ОН хлором осуществляют при сохранении конфигурации. Данное изобретение также относится к способу получения соединений 1-фенил-3-диметиламинопропана формулы I, в которых Х представляет собой группу OCOR6, где R6 - C1-3-алкил, отличающемуся тем, что соединение формулы I, в котором Х представляет собой ОН, подвергают взаимодействию с хлоридом кислоты Cl-COOR 6. Реакцию предпочтительно проводят в растворителе, например, дихлорметане, толуоле и/или тетрагидрофуране, при температуре в диапазоне -10°С - +30°С. Соединения 1-фенил-3-диметиламинопропана формулы I, в которых R5 - Н, a R4 - группы метафосфа та, карбоната, карбамата или карбоксилата, могут быть получены реакцией соответствующи х 1-(3-гидроксифенил)-3- диметиламинопропановых соединений формулы І в виде их основных солей с основной солью диалкилхлорфосфата, с алкилхлорформатом, с арилизоцианатом или с хлоридом карбоновой кислоты. Эти реакции обычно проводят в растворителе, например, толуоле, ди хлорметане, диэтиловом эфире и/или тетрагидрофуране, при температурах между -15°С и +110°С (Drugs of the Future 16, 443 (1991); J. Org. Chem. 43, 4797 (1978); Tetrahedron Lett. 1977, 1571; J. Pharm. Sci. 57, 774 (1968)). Соединения формулы I могут быть превращены в их соли известными способами при помощи физиологически совместимых кислот, например, хлористоводородной, бромистоводородной, серной, метансульфоновой, муравьиной, уксусной, щавелевой, сукциновой, винной, миндальной, фумаровой, молочной, лимонной, глутаминовой и/или аспарагиновой кислоты. Образование соли предпочтительно осуществляют в растворителе, например, диэтиловом эфире, диизопропиловом эфире, алкилацетатах, ацетоне и/или 2-бутаноне. Кроме того, для получения гидрохлоридов хорошо подходит водный раствор триметилхлорсилана. Соединения 1-фенил-3-диметиламинопропана формулы I являются токсикологически безвредными настолько, что могут применяться в качестве фармацевтически активных ингредиентов в лекарствах. Соединения формулы I предпочтительно используют для лечения болей. В дополнение к минимум одному соединению 1-фенил-3-диметил-аминопропана формулы I, анальгетики согласно изобретению содержат носители, наполнители, растворители, разжижители, красители и/или связующие. Выбор вспомогательных веществ и и х количеств зависит от того, предназначено ли лекарство для орального, внутривенного, внутрибрюшинного, кожного, внутримышечного, внутриносового или местного применения, например, при инфекциях кожи, слизистых оболочек или глаз. Препараты в виде таблеток, драже, капсул, гранул, капель, жидкостей или сиропов пригодны для орального применения. Растворы, суспензии, легко преобразуемые сухие препараты и аэрозоли пригодны для парентерального, местного и ингаляторного применения. Соединения формулы I согласно изобретению в качестве осадка в растворенном виде или в виде наклеек, возможно, с добавками веществ, уско ,(Ib) в которых ОН-группа и радикал диметиламина расположены эритрически по отношению друг к другу. Соединения 1-фенил-3-диметиламинопропана формулы I, в которых R4 и/или R5 представляют собой ОН-группу, могут быть получены из соответствующи х соединений 1-(4(5)-метоксифенил)3-диметил-аминопропанола избирательным эфирным разложением гидридом диизобутилалюминия в ароматическом углеводороде, например, толуоле, при температуре в диапазоне 60-130°С (Synthesis 1975, 617). Данное изобретение также относится к способу получения соединений 1-фенил-3-диметиламинопропана формулы I, в которых Х представляет собой Н, отличающемуся тем, что соединение формулы І, в котором Х представляет собой Сl, подвергают взаимодействию с борогидридом цинка, цианоборогидридом цинка и/или цианоборогидридом олова. Реакцию обычно проводят в растворителе, например, диэтиловом эфире и/или тетрагидрофуране, при температуре в диапазоне 0 - 30°С. Соединения формулы I, в которых Х - Н, a R4 и/или R5 представляют собой ОН-группу, могут быть получены из соответствующи х метоксифенильных соединений путем их нагрева в течение нескольких часов с концентрированной бромоводородной кислотой (Chem. Rev. 54, 615 (1954); J. Am. Chem. Soc. 74, 1316 (1952)). Данное изобретение, кроме того, относится к способу получения соединений 1-фенил-3диметиламинопропана формулы I, в которых Х представляет собой F, отличающемуся тем, что соединение формулы I, в котором Х представляет собой ОН, подвергают взаимодействию с трифторидом метиламиносеры в растворителе. Подходящие растворители включают дихлорметан, 1,1,2-трихлорэтан и/или толуол. Реакцию обычно проводят при температуре между -50°С и +30°С (Org. React. 35, 513 (1988)). Если используют соединение формулы I с Х представляет собой ОН, в котором R4 и/или R5 представляют собой ОН-группы, эти ОН-группы должны быть стабилизированы перед реакцией с соединением фтора, например, путем реакции с бензоилхлоридом. Данное изобретение также относится к способу получения соединений 1-фенил-3-диметиламинопропана формулы I, в которых Х представляет собой Сl, отличающемуся тем, что соединение формулы І, в котором Х представляет собой ОН, подвергают взаимодействию с тионилхлоридом. Реакцию обычно проводят в отсутствие растворителя при температуре в диапазоне 0-20°С. 6 41345 ряющих проникновение в кожу, являются препаратами, подходящими для подкожного применения. Формы препаратов, которые применяют орально или подкожно, могут обладать эффектом длительного высвобождения соединений формулы I согласно изобретению. Количество активного ингредиента, назначаемое пациенту, может изменяться в зависимости от веса пациента, вида применения, симптомов и степени заболевания. Обычно назначают от 50 до 500 мг/кг минимум одного соединения 1-фенил-3диметиламинопропана формулы I. Примеры. Выход получаемых продуктов не оптимизировали. Температуры не корректировали. Если не указано другое, использовали петролейный эфир с точкой кипения 50-70°С. Термин "эфир" означает диэтиловый эфир. В качестве стационарной фазы для колоночной хроматографии использовали силикагель 60 (0,040-0,063 мм)производства Е. Merck, Darmstadt. Хроматографические исследования в тонком слое проводили с использованием изготовленных заводским способом силикагелевых пластин 60 F 254 HPTLC производства Е. Merck, Darmstadt. Разделение изомеров производили в колонке Chiracel OD. Смесевое соотношение подвижных фаз для всех хроматографических исследований выражается как объем/объем. КТ означает комнатную температуру; т. пл. означает температуру плавления. Пример 1 2-бутанона и добавили к 120,60 г (1,11 моль) триметилхлорсилана и 20 мл воды. 121,5 г гидрохлорида (1) (38% теоретически) с т. пл. 198-199°С закристаллизовали при 4-5°С. Пример 2 Энантиомеры (1): (-)-(2RS, 3RS)-1-диметиламино-3-(3-метоксифенил)-2-метилпентан-3-ола гидрохлорид (-1)(+) (2RS,3RS) -1-диметиламино-3-(3-метокси-фенил) 2-метилпентан-3-ола гидрохлорид (-1) Основание выделили из (1) раствором дихлорметана/гидроксида натрия. После сушки раствора дихлорметан удалили дистилляцией под вакуумом. Изомеры разделили на хиральной колонке HPLC. Гидрохлориды с т. пл. 150-151°С получили из энантиомеров, полученных реакцией с триметилхлорсиланом/водой в 2-бутаноне. (-1): выход: 42% теоретически [a]DRT=-31,8° (с=0,99; метанол) (+1): выход: 41% теоретически [a]DRT=+33,0° (с=0,96; метанол) Пример 3 2RS,3RS)-3-(3,4-дихлорфенил)-1-диметиламино-2-метилпентан-3-ола гидрохлорид (2). 39 г сырой смеси получили аналогично Примеру 1 из 15 г (105 ммоль) І-диметиламино-2-метилпентан-3-она, 35,5 г (157 ммоль) 4-бром-1,2- дихлорбензола и 3,8 г (157 ммоль) стружек магния. Эту смесь ввели в колонку 7х40 см с силикагелем и элюировали смесью 4:1 этилацетат/метанол. Получили 14,9 г основания, из которого получили 11,2 г гидрохлорида (2) (31% теоретически) с т. пл. 183-184°С при посредстве триметилхлорсилана/воды в 2-бутаноне/диизопропиловом эфире. Пример 4 (2RS,3RS)-1-диметиламино-3-(3-метоксифенил)-2метилпентан-3-ола гидрохлорид (1) 207,63 г (1,11 моль) 3-броманизола, растворенного в 400 мл безводного тетрагидрофурана добавляли по каплям к 26,99 г (1,11 моль) стружки магния в 150 мл безводного тетрагидрофурана, так, чтобы реакционная смесь слабо кипела. После добавления 3броманизола смесь нагревали при орошении в течение часа и затем охладили до 5-10°С. 128,30 г (0,89 моль) 1-диметиламино-2-метилпентан-3-она, растворенного в 400 мл тетрагидрофурана, добавили при этой температуре. Реакционную смесь оставили стоять в течение ночи и затем снова охладили до 5-10°С. Раствор Grignard'a разложили добавлением 300 мл 20% раствора хлорида аммония. Реакционную смесь разбавили 400 мл эфира, органическую фазу отделили, а водную фазу дважды экстрагировали 250 мл эфира. Смешанные органические фазы высушили над сульфатом натрия. После удаления растворителя путем дистилляции остаток (212 г) ввели в 3200 мл (2RS,3RS)-3-(3-изопропоксифенил)-1-диметиламино-2-метилпентан-3-ола гидрохлорид (3). 25 г сырой смеси получили аналогично Примеру 1 из 14,3 г (100 ммоль)1-диметиламино-2-метилпен 7 41345 тан-3-она, 20,0 г (157 ммоль) 1-бром3-изопропоксибензола и 2/79 г (115 ммоль) стружек магния. Эту смесь ввели в колонку 7х40 см с силикагелем и элюировали смесью 15:1 этилацетат/метанол. Получили 9,0 г основания, из которого получили 8,3 г гидрохлорида (3) (26% теоретически) с т. пл. 133-134°С при посредстве триметилхлорсилана/воды в 2-бутаноне. Пример 5 75 г сырой смеси получили аналогично Примеру 1 из 47,3 г (330 ммоль) 1-диметиламино-2метилпентан-3-она, 64,6 г (400 ммоль)1-бромтолуола и 9,72 г (400 ммоль) стружек магния. Эту смесь ввели в колонку 7х50 см с силикагелем и элюировали смесью 7:1 диизопропиловый эфир /метанол. Получили 24,3 г основания, из которого получили 21,5 г гидрохлорида (6) (24% теоретически) с т. пл. 154-155°С при посредстве триметилхлорсилана/воды в 2-бутаноне. Пример 8 (2RS,3RS)-1-диметиламино-3-(3-фторфенил)2-метилпентан-3-ола гидрохлорид (7). 70 г сырой смеси получили в условиях, описанных в Примере 1 из 54,0 г (380 ммоль) 1-диметиламино-2-метилпентан-3-она, 82,5 г (470 ммоль) 1-бром-3-трифторбензола и 9,23 г (470 ммоль) стружек магния. Эту смесь ввели в колонку 7х50 см с силикагелем и элюировали смесью 1:1 этилацетат/метанол. Получили 13,0 г основания, из которого получили 11,2 г гидрохлорида (7) (11,5% теоретически) с т. пл. 145-146°С при посредстве триметилхлорсилана/воды в 2-бутаноне. Пример 9 (2RS,3RS)-3-(3-хлорфенил)-1-диметиламино2-метилпентан-3-ола гидрохлорид (4). 63 г сырой смеси получили в условиях, описанных в Примере 1 из 38,0 г (270 ммоль) 1-диметиламино-2-метилпентан-3-она, 74,7 г (390 ммоль) 1бром-3-хлорбензола и 9,50 г (390 ммоль) стружек магния. Эту смесь ввели в колонку 7х40 см с силикагелем и элюировали смесью 7:1 диизопропиловый эфир/метанол. Получили 12,8 г основания, из которого получили 10,8 г гидрохлорида (4) (14% теоретически) с т. пл. 160-162°С при посредстве триметилхлорсилана/воды в 2-бутаноне/эфире. Пример 6 (2RS,3RS)-1-диметиламино-2-метил-3-(3-трифторметилфенил)-пентан-3-ола гидрохлорид (5). 21,2 г сырой смеси получили в условиях, описанных в Примере 1 из 14,3 г (100 ммоль) 1-диметиламино-2метилпентан-З-она, 29,3 г (130 ммоль) 1-бром-3трифторметилбензола и 3,2 г (130 ммоль) стружек магния. Эту смесь ввели в колонку 6х40 см с силикагелем и элюировали смесью 10:1 диизопропиловый эфир/метанол. Получили 9,1 г основания, из которого получили 10,8 г гидрохлорида (5) (18,5% теоретически) с т. пл. 189-190°С при посредстве триметилхлорсилана/воды в 2-бутаноне. Пример 7 (2RS,3RS)-3-(3-дифторметилфенил)-1-диметиламино-2-метилпентан-3-ола гидрохлорид (8). 7.0 г (34 ммоль) 1-бром-3-дифторметилбензола, полученного из 3-бромбензальдегида и трифторида диэтиламиносеры в дихлорметане, согласно Org. React. 35, 513 (1988), растворили в 110 мл безводного тетрагидрофурана и охладили до -75°С. После добавления 21,12 мл (34 ммоль) 1,6-молярного раствора n-бутиллития в гексане смесь перемешивали в течение часа при -75°С. Затем добавили по каплям 4,8 г (34 ммоль) 1диметиламино-2-метилпентан-3-она, растворенного в 15 мл безводного тетрагидрофурана. Реакционную смесь нагревали до комнатной температуры более 2,5 часов. Доработка осуществлялась добавлением по каплям 65 мл 5% соляной кислоты с охлаждением на ледяной бане , так, чтобы внутренняя температура не достигала 15°С. После разделения фаз органическую фазу экстрагировали 40 мл 5% соляной кислоты. Смешанные водные фазы дважды промыли 50 мл эфира. Чтобы выделить основание, смесь добавили к концентрированному раствору гидроксида натрия и экстрагировали ди (2RS,3RS)-1-диметиламино-2-метил-3-(3-mтолил)-пентан-3-ола гидрохлорид (6). 8 41345 хлорметаном. Таким способом получили 7,8 г сырого продукта и ввели в колонку 7х40 см, содержащую силикагель. Элюирование смесью 1:1 этилацетат/метанол дало 4,89 г основания, иэ которого получили 4,6 г гидрохлорида (8) (44% теоретически) с т. пл. 194-195°С при посредстве триметилхлорсилана/воды в 2-бутаноне. Пример 10 Пример 12 (2RS,3RS)-1-диметиламино-2-метил-3-(4-трифторметилфенил)-пентан-3-ола гидрохлорид (11). 44 г сырой смеси получили в условиях, описанных в Примере 1, из 20 г (140 ммоль) 1-диметиламино-2-метилпентан-3-она, 31,5 г 140 ммоль) (1бром-4-трифторметилбензола, 16,5 г (680 ммоль) стружек магния и 47 мл 1,2-дибромэтана. Эту смесь ввели в колонку 7х50 см с силикагелем и элюировали смесью 5:1 этилацетат/метанол Получили 16,4 г основания, из которого получили 12,3 г гидрохлорида (11) (27% теоретически) с т.пл. 170-171°С при посредстве триметилхлорсилана/воды в 2-бутаноне. Пример 13 Получили 16,4 г основания, из которого получили 12,3 г гидрохлорида (11) (27% теоретически) с т.пл. 170-171°С при посредстве триметилхлорсилана/воды в 2-бутаноне. .(3RS)-1-диметиламино-3-(3-метоксифенил)гексан-3-ола гидрохлорид (12). 18,5 г сырой смеси получили, как описано в Примере 1, из 10 г (70 ммоль) 1-диметиламиногексан-3-она, 18,7 г (100 ммоль) 1-бром-3метоксибензола и 2,3 г (100 ммоль) стружек магния. Эту смесь ввели в колонку 6х50 см с силикагелем и элюировали смесью 1:1 этилацетат/метанол. Получили 6,84 г основания, из которого получили 6,15 г гидрохлорида (12) (32% теоретически) с т. пл. 179-180°С при посредстве триметилхлорсилана/воды в 2-бутаноне. Пример 14 (3RS)-1-диметиламино-3-(3-метоксифенил)гептан-3-ола гидрохлорид (13). 17,3 г сырой смеси получили, как описано в Примере 1, из 10 г (64 ммоль) 1-диметиламиногептан-3-она, 15,9 г (157 ммоль) 1-бром-3метоксибензола и 2,06 г (85 ммоль) стружек магния. Эту смесь ввели в колонку 6х40 см с силикагелем и элюировали этилацетатом. Получили 5,4 г основания, из которого получили 4,1 г гидрохлорида (13) (21% теоретически) с т. пл. 150°С при посредстве триметилхлорсилана/воды в 2-бутаноне. Пример 15 (3RS)-1-диметиламино-3-(3-метоксифенил)4,4-диметилпентан-3-ола гидрохлорид (14). 37 г сырой смеси получили, как описано в Примере 1, из 18,6 г (118 ммоль) 1-диметиламино4,4-диметилпентан-3-она, 28,4 г (152 ммоль) 1бром-3-метоксибензола и 3,7 г (152 ммоль) стружек магния. Эту смесь ввели в колонку 7х40 см с силикагелем и элюировали смесью 5:1 этилацетат/метанол. Получили 2,2 г основания, из которого получили 1,8 г гидрохлорида (14) (5% теоретически) с т. пл. 213°С при посредстве триметилхлорсилана/воды в 2-бутаноне. (2RS,3RS)-1-диметиламино-2-метил-3-(3-метилсульфанилфенил)-пента-н-3-ола гидрохлорид (9). 38 г сырой смеси получили в условиях, описанных в Примере 1 из 17,6 г (123 ммоль) 1-диметиламино-2-метилпентан-3-она, 25,0 г (123 ммоль) 1-бром-3-метилсульфанилбензола и 3,0 г (123 ммоль) стружек магния. Эту смесь ввели в колонку 7х40 см с силикагелем и элюировали смесью 10:1 этилацетат/метанол. Получили 8,35 г основания, из которого получили 7,2 г гидрохлорида (9) (19% теоретически) с т. пл. 159-160°С при посредстве триметилхлорсилана/воды в 2-бутаноне. Пример 11 (2RS,3RS)-3-бензофуран-6-ил-1-диметиламино-2-метил-пентан-3-ола гидрохлорид (10) 3,45 г (18 ммоль) 6-бромбензофурана (полученного в соответствии с ЕР 355 827) и 6 мл 1,2дибромэтана, растворенные в 60 мл безводного эфира, добавляли по каплям более 1,5 ч к 2,12 г (87 ммоль) стружек магния в 30 мл безводного эфира; после добавления смесь нагревали при орошении в течение 30 мин. После этого добавляли по каплям 2,5 г (18 ммоль) 1-диметиламино2-метилпентан-3-она, растворенного в 7,5 мл эфира, в течение более 1,5 ч. при охлаждении на ледяной бане для поддержания внутренней температуры 5-10°С. Реакционную смесь оставили стоять на 12 часов при комнатной температуре, затем снова охладили до 5-10°С и добавили к 35 мл 20% водного раствора хлорида аммония. После разделения фаз водную фазу дважды экстрагировали 50 мл эфира. Объединенные органические фазы высушили над сульфатом натрия. После удаления растворителя путем дистилляции остаток (3,9 г) ввели в колонку 5х16 см с силикагелем. Элюированием смесью 7:1 дииэопропиловый эфир/метанол получили 0,95 г основания, из которого получили 0,82 г гидрохлорида (10) (15,5% теоретически) с т. пл. 162°С при посредстве триметилхлорсилана/воды в этилацетате/2-бутаноне. 9 41345 Пример 16 тилалюминия в толуоле. По окончании дабавления смесь нагревали в течение 8 ч. при орошении и затем охладили до комнатной температуры. Реакционную смесь разбавили 25 мл толуола. По каплям добавили 9,4 мл этанола и затем 9,4 мл воды при охлаждении на ледяной бане. После перемешивания в течение часа с одновременным охлаждением на ледяной бане реакционную смесь освободили от солей алюминия путем фильтрации, а остаток трижды промыли по 50 мл толуола. Объединенные органические фазы высушили и удалили толуол путем дистилляции. 3,95 г гидрохлорида (16) (85% теоретически) с т.пл. 213214°С получили из основания при посредстве водного раствора соляной кислоты в ацетоне. Пример 19 (2RS,3RS)-4-диметиламино-2-(3-метоксифенил)-3-метилбутан-3-ола гидрохлорид (15) 21 г сырой смеси получили, как описано в Примере 1, из 5,3 г (41 ммоль) 4-диметиламино-3метилбутан-3-она, 23,0 г (123 ммоль) 1-бром-3метоксибензола и 3,0 г (123 ммоль) стружек магния. Эту смесь ввели в колонку 4,5х27 см с силикагелем и элюировали смесью 4:1 этилацетат/метанол. Получили 4,0 г основания, из которого получили 3,6 г гидрохлорида (15) (32% теоретически) с т. пл. 124°С при посредстве триметилхлорсилана/воды в 2-бутаноне. Энантиомеры (16): (-)(2S,3S)-3-(3-диметиламино-1-этил-1-гидрокси-2-метилпропил)-фенола гидрохлорид (-16) (+)(2S,3S)-3-(3-диметиламино-1-этил-1-гидрокси-2-метилпропил)-фенола гидрохлорид (+16) Энантиомеры (-16) и (+16) получили в условиях, описанных в Примере 2. (-16): выход: 85% теоретически т. пл.: 208209°С [a]DRT=-34,6° (с=0,98; метанол) (+16): выход: 85% теоретически т. пл.: 206207°С [a]DRT=+34,4° (с=1,06; метанол) Пример 20 Пример 17 Энантиомеры (15): (-)-(2S,3S)-4-диметиламино-2-(3-метоксифенил)-3метилбутан-3-ола гидрохлорид (-15) (+)-(2S,3S)-4диметиламино-2-(3-метоксифенил)-3-метилбутан3-ола гидрохлорид (+15) Основание выделили из гидрохлорида (15), полученного, как описано в Примере 16, раствором дихлорметана/гидроксида натрия. После сушки и удаления дихлорметана дистилляцией изомеры разделили на хиральной колонке HPLC. Гидрохлориды получили из энантиомеров посредством триметилхлорсилана/воды в 2-бутаноне. (-15): выход: 41% теоретически т. пл.: 117118°С [a]DRT=-38,6°(с=1,05; метанол) (+15): выход: 41% теоретически т. пл.: 118119°С [a]DRT= +41,0° (с=1,01; метанол) Пример 18 (1RS,2RS)-3-(3-диметиламино-1-гидрокси-1,2диметилпропилфенола гидрохлорид (17) Соединение (17) получили в условиях, описанных в Примере 18, начиная с метоксисоединения (15), полученного, как описано в Примере 16. Выход: 85% теоретически т. пл.: 232°С. Пример 21 (2RS,3RS)-3-(3-диметиламино-1-этил-1-гидрокси-2-метилпропил)-фенола гидрохлорид (16). Основание выделили из соединения (1), полученного в Примере 1, раствором дихлорметана/гидроксида натрия. После сушки раствора дихлорметан удалили дистилляцией. 4,3 г(17 ммоль) основания растворили в 25 мл безводного толуола и медленно добавили по каплям к 71 мл (85 ммоль) 1,2-молярного раствора гидрида диизобу Энантиомеры (17): (-)(1S,2S)-3-(3-диметиламино-1-гидрокси-1,2диметилпропил)-фенола гидрохлорид (-17) (+)(1R,2R)-3-(3-диметиламино-1-гидрокси-1,2диметилпропил)-фенола гидрохлорид (+17) Энантиомеры (-17) и (+17) получили в условиях, описанных в Примере 2. 10 41345 (-17): выход: 82% теоретически т. пл.: 204205°С [a]DRT=-42,0° (с=0,94; метанол) (+17): выход: 83% теоретически т. пл.: 204205°С [a]DRT=+41,2° (с=1,01; метанол) Пример 22 смесь охладили до 0-5°С и гидролиэовали 50 мл воды. После разделения фаз водную фазу дважды экстрагировали 50 мл дихлорметана. Объединенные органические фазы высушили и освободили от растворителя дистилляцией под вакуумом. Полученную сырую смесь (8,04 г) ввели в колонку 6х50 см с силикагелем и элюировали смесью 1:1 этилацетат/метанол. Получили 3,04 г основания (+20) (40% теоретически) в виде светложелтого вязкого масла. Этап 3. (+)-(1R,2R)-3-(3-диметиламино-1-этил-1-фтор2-метилпропил)-фенола гидрохлорид (+18). 3,0 г (91 ммоль) вещества (+20) растворили в 15 мл безводного метанола и добавили к 0,44 г палладия на активированном угле (10% палладия) в гидрогенизационном аппарате. После перемешивания в течение 3 ч. при комнатной температуре ввели 215 мл водорода. Катализатор удалили путем фильтрации, а метанол удалили дистилляцией. Получили 2,22 г основания, из которого получили 2,0 г гидро хлорида (+18) (79% теоретически) при посредстве триметилхлорсилана/воды в 2-бутаноне. т. пл.:174-176°С [a]DRT=+29,5°(с=1,08;метанол). Пример 23 (+)-(1R,2R)-3-(3-диметиламино-1-этил-1-фтор2-метилпропил)-фенола гидрохлорид (+18). Этап 1. (+)(1R,2R)-3-(3-бензилоксифенил)-1диметиламино-2-метилпентан)-3-ол (+19). Основание выделили из энантиомера (+16), полученного в Примере 19, раствором дихлорметана/гидроксида натрия. После сушки раствора дихлорметан удалили дистилляцией. 5,3 г (22 ммоль) основания растворили в 27 мл безводного диметилформамида и добавили несколькими порциями к 1,2 г 50 % гидрида натрия. После добавления 2,8 мл (24 ммоль) бензоилхлорида смесь нагревали 3 ч. при 70°С. Затем реакционную смесь охладили до комнатной температуры и вылили в водно-ледяную смесь. Трижды экстрагировали по 70 мл эфира. После сушки объединенных органических фаз над сульфатом натрия дистиллировали растворитель, а остаток ввели в колонку 4,5х30 см с силикагелем. После элюирования смесью дииэопропиловый эфир/метанол получили 6,8 г основания (+19) (92% теоретически) в виде светложелтого высоковязкого масла. (-)-(1S,2S)-3-(3-диметиламино-1-этил-1-фтор2-метилпропил)-фенола гидрохлорид (-18) Энантиомер (-18) получили с теоретическим выходом 29% из энантиомера (-16), полученного, как описано в Примере 19, в условиях, описанных в Примере 22. т. пл.:170-172°С [a]DRT=-28,4°(с=1,03;метанол). Пример 24 (+)-(1R,2R)-3-(3-диметиламино-1-этил-2-метил - пропил)-фенола гидрохлорид (+21). Этап 1 Этап 2. (+)-(2R,3R)-[3-(3-бензилоксифенил)-3-фтор-2метилпентил]-диметил-амин (+20). 6,8 г (21 ммоль) соединения (+19), растворенного в 80 мл дихлорметана, добавляли по каплям при -20°С к раствору 3,7 г (23 ммоль) трифторида диметиламиносеры в 30 мл безводного дихлорметана. По окончании добавления смесь перемешивали 30 мин. при этой температуре и затем нагрели до комнатной температуры. После перемешивания еще один час при комнатной температуре (+)-(2R,3R)-[3-(3-хлор-3-(3-метоксифенил)-2метилфенил]-диметиламина гидрохлорид (+22). 10 г (35 ммоль) вещества (+1), полученного, как описано в Примере 2, добавили к 10 мл тионилхлорида при комнатной температуре. Затем через реакционную смесь в течение 2 ч. пропускали азот для удаления избытка тионилхлорида. После добавления 10 мл свежего тионилхлорида 11 41345 реакционную смесь оставили стоять на 12 ч. перед тем, как снова удалили избыток тионилхлорида в течение 2,5 ч. посредством струи азота. После сушки остаток растворили в 10 мл ледяного 2бутанона и смешали при активном перемешивании с 200 мл эфира и затем с 140 мл диизопропилового эфира. Всплывающую фазу растворителя декантировали, а оставшееся масло снова ввели в 10 мл 2-бутанона. После добавления затравочных кристаллов добавили по каплям 300 мл диизопропилового эфира при энергичном перемешивании более 3 ч. для кристаллизации гидрохлорида. Получили 9,8 г соединения (22) (91% теоретически). т.пл.:120°С (разложение) [a]DRT=+24,7° (с=1,01; метанол). Этап 2. орошении в течение 2 ч. После охлаждения до комнатной температуры реакционную смесь концентрировали под вакуумом от водяного насоса. Остаток обработали концентрированным раствором гидрокарбоната натрия до получения щелочной реакции. После двукратного экстрагирования по 50 мл дихлорметана объединенные органические фазы высушили над суль фатом натрия. Затем дистилляцией под вакуумом удалили дихлорметан и остаток (4 г) ввели в 2-бутанон. После добавления триметилхлорсилана/воды выкристаллизовалось 3,8 г гидрохлорида (+21) (98% теоретически). т.пл.:194-196°С [a]DRT=+24,5°(с=1,10; метанол). Пример 25 (-)-(1S,2S)-3-(3-диметиламино-1-этил-2-метилпропил) -фенола гидрохлорид (-21). Энантиомер (-21) получили с теоретическим выходом 45% из соединения (-1), полученного, как описано в Примере 2, в условиях, описанных в Примере 24. т.пл.:168-170°С [a]DRT=-27,5°(с=0,97; метанол). Пример 26 (+)-(2R,3R)-[3-(3-метоксифенил)-2- метилпентил]-диметиламина гидрохлорид (+23). 46 г высушенного хлорида цинка растворили в 580 мл безводного эфира и затем добавили по каплям к 31 г тестообразного борогидрида натрия в 1800 мл эфира. После перемешивания в течение 12 ч. декантацией удалили 500 мл из полученной суспензии борогидрида цинка и добавили по каплям к 9,8 г (32 ммоль) соединения (+22) в 200 мл безводного эфира. Реакционную смесь перемешивали 72 ч. при комнатной температуре и затем добавили по каплям к 40 мл насыщенного раствора хлорида аммония с охлаждением на ледяной бане. После разделения фаз эфирную фазу дважды промыли насыщенным рассолом; после сушки над сульфатом натрия растворитель удалили дистилляцией под вакуумом. Получили 7,3 г амино-боранового комплексного соединения, которое растворили в 100 мл безводного метанола для отделения свободного основания. После добавления 7,5 г трифенилфосфина смесь нагревали в течение 18 ч. при орошении. После удаления растворителя путем дистилляции осадок добавили к 100 мл 5% соляной кислоты и затем фазу соляной кислоты дважды промыли 50 мл эфира. Затем фазу соляной кислоты сделали щелочной путем обработки концентрированным раствором гидроксида натрия при охлаждении на ледяной бане и дважды экстрагировали растворитель 50 мл дихлорметана. После сушки объединенных органических фаз над сульфатом натрия растворитель удалили дистилляцией под вакуумом, а остаток (5,2 г) ввели в 2-бутанон. После добавления триметилхлорсилана/воды выкристаллизовалось 4,3 г гидрохлорида (+23) (50% теоретически). т.пл.:163-164° С [a]DRT=+25,2° (с=0,95; метанол). Этап 3. (+)-(1R,2R)-3-(3-диметиламино-1-этил-2- метил-пропил)-фенола гидрохлорид (+21). 4,3 г (15 ммоль) соединения (+23) из Этапа 2 добавили к 100 мл концентрированной бромистоводородной кислоты. Затем смесь нагревали при (+)-(1R,2R)-уксусной кислоты-3-диметилами но-1-этил-1-93-метокси-фенил)-2-метил-пропилового эфира гидрохлорид (+24). Основание выделили из энантиомера (+1), полученного, как описано в Примере 2, раствором дихлорметана/гидроксида натрия. После сушки раствора дихлорметан удалили дистилляцией. 3,0 г (39 ммоль) ацетилхлорида добавили по каплям, при охлаждении на ледяной бане, к 10 г (35 ммоль) полученного основания, которое было введено в 150 мл безводного дихлорметана. После добавления ацетилхлорида реакционную смесь нагрели до комнатной температуры и после перемешивания в течение 2 ч. смешали со 100 мл насыщенного раствора гидрокарбоната натрия. Органическую фазу отделили от водной фазы и водную фазу дважды экстрагировали 50 мл дихлорметана. Органические фазы объединили и высушили над сульфатом натрия. После удаления растворителя путем дистилляции получили 13,4 г сырой смеси, из которой получили 10,7 г гидрохлорида (+24) (93% теоретически) посредством триметилхлорсилана/воды в 2-бутаноне/этилацетате. т.пл.:153°С [a]DRT=-17,3°(с=1,04; метанол). 12 41345 Пример 27 чески) с т.пл. 174°С при посредстве трихлорсилана/воды в 2-бутаноне. Этап 3. (1RS)-1-(1-диметиламинометил-циклогексил)1-(3-метоксифенил)-пропан-1-олагидрохлорид(25). 3,0 г сырой смеси получили в условиях, описанных в Примере 1, из 2,8 г (10 ммоль) соединения (27) в виде основания, 1,4 г (13 ммоль) бромэтана и 0,32 г 13 ммоль) стружек магния, используя эфир в качестве растворителя. Эту смесь ввели в колонку 3х20 см с силикагелем и элюировали смесью 19:1 диизопропиловый эфир/метанол. Получили 2,1 г основания, из которого получили 1,9 г гидрохлорида (25) (55% теоретически) с т.пл. 230°С при посредстве трихлорсилана/воды в 2бутаноне/этилацетате. Пример 28 (1RS)-1-(1-диметиламинометил-циклогексил) 1-(3-метоксифенил)-пропан-1-ола гидрохлорид (25). Этап 1. (1RS)-1-(1-диметиламинометил-циклогексил)(3-метоксифенил)-метанола гидрохлорид (26). 44 г сырой смеси получили из 25 г (150 ммоль) 1-диметиламинометилциклогексан-карбальдегида, 32,9 г (180 ммоль) 1-бром-3-метоксибензола и 4,3 г (180 ммоль) стружек магния, в условиях, описанных в Примере 1. Эту смесь ввели в колонку 7х40 см с силикагелем и элюировали смесью 4:1 диизопропиловый эфир/метанол. Получили 38 г основания, из которого получили 40 г гидрохлорида (26) (85% теоретически) с т. пл. 235°С при посредстве триметилхлорсилана/воды в 2-бутаноне. Этап 2. (-)-(2R,3S)-{3[3-(р-изопропил-фенил-карбамоил)-окси-фенил]-2-метилпентил-диметиламина гидрохлорид (-28) Основание выделили из энантиомера (+21), полученного, как описано в Примере 24, раствором дихлорметана/гидроксида натрия и после сушки раствора дихлорметан удалили дистилляцией. 2,2 г (10 ммоль) полученного основания растворили в 20 мл безводного толуола и смешали с 1,8 г (11 ммоль) 4-изопропилфенил-изоцианата. После перемешивания в течение 20 ч. при комнатной температуре толуол удалили дистилляцией. Остаток прореагировал с триметилхлорсиланом/водой в n-пропилацетате, что дало 3,2 г гидрохлорида (-28) (76% теоретически). т.пл.:151-152°С [a]DRT=-5,2° (с=1,11; метанол). Фармакологические исследования. Болевой тест на мышах. Анальгезирующую эффективность соединений согласно изобретению исследовали при помощи теста фенилхиноно-возбуждаемой боли, модифицированного согласно I.C.Hendershot, J. Forsaith в J. Pharmacol. Exptl. Ther. 125, 237 (1959), на мышах. Для этой цели использовались самцы мышей NMRI с весом от 25 до 30 г. На каждую дозу вещества, принимаемую каждыми 10 животными, через 30 минут после орального приема соединения согласно изобретению вводилось внутрибрюшинно 0,3 мл/мышь 0/02% водного раствора фенилхинона (фенилбензохинон производства Sigma, Deisenhofen; раствор готовят с добавлением 5% этанола и держат на водяной бане при 45°С). После этого животных помещали каждого в отдельную клетку для наблюдения. Количество вызванных болью движений вытягивания (болевая реакция = выпрямление тела с вытягиванием задних конечностей) подсчитывалось при помощи кнопочного счетчика. Значение ED50 (эффективная доза с 50%-ным ингибированием болевой реакции) было рассчитано с доверительным пределом 95% при помощи регрессионного анализа (программа расчета производства (1RS)-1-(1-диметиламинометил-циклогексил) (3-метоксифенил)-метанона гидрохлорид (27). Основание выделили из соединения (26) раствором дихлорметана /гидроксида натрия и после сушки раствора дихлорметан удалили дистилляцией. 8,3 г (30 ммоль) основания растворили в 30 мл n-гексана и добавили по каплям к суспензии, состоящей из 95 г пиридинийхлорхромата (полученного в соответствии с Syn thesis 1980, 223), абсорбированного на нейтральном оксиде алюминия. После перемешивания в течение 72 ч. при комнатной температуре реакционную смесь смешали с 120 мл дихлорметана, перемешивали в течение 2 ч. и затем профильтровали через 30 г оксида алюминия. Остаток фильтрования три раза промыли декантацией при помощи 50 мл дихлорметана и эфира на каждый раз. Органические фазы объединили с фильтратом и освободили от растворителя дистилляцией. Полученный остаток ввели в 60 мл 2-нормального раствора гидроксида натрия и 4 раза экстрагировали по 20 мг этилацетата. После сушки объединенных органических фаз растворитель удалили дистилляцией. Получили 4,8 г сырой смеси, которую ввели в колонку 6х30 см с силикагелем и элюировали, сначала этилацетатом, затем смесью 9:1 этилацетат/метанол и, наконец, смесью 4:1 этилацетат/метанол. Получили 3,8 г основания, из которого получили 3,1 г гидрохлорида (27) (33% теорети 13 41345 Martens EDV-Service, Eckental) исходя из зависимого от дозы снижения болевой реакции, в сравнении с параллельно исследуемыми мышами, которым был введен только фенилхинон. Все со единения согласно изобретению, которые были испытаны, проявили сильный анальгезирующий эффект. Результаты приведены в следующей таблице. Таблица Ингибирование боли Пример Соединение согласно изобретению 1 2 2 3 4 5 6 7 8 9 10 11 13 15 16 17 18 19 19 20 21 21 22 24 (1) (-1) (+1) (2) (3) (4) (5) (6) (7) (8) (9) (10) (12) (14) (15) (+15) (16) (-16) (+16) (17) (-17) (+17) (+18) (+21) ЕD50 (мг/кг на ед.) (мг/кг на ед.) 5,8 22,3 1,1 13,2 % ингибирования при 25 мг/гк на ед. при 25 мг/гк на ед. -81,3 15,5 8,3 11,3 27,3 12,9 12,8 12,9 19,9 10,5 3,8 16,1 1,0 17,7 1,9 -95,2 -100,0 -87,0 -58,3 -97,2 ________________________________________________________ ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 __________________________________________________________ Підписано до друку ________ 2002 р. Формат 60х84 1/8. Обсяг ______ обл.-вид. арк. Тираж 50 прим. Зам._______ ____________________________________________________________ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22 ___________________________________________________________ 14
ДивитисяДодаткова інформація
Назва патенту англійськоюCompound 1-phenyl-3-dimethylaminopropane , a process for the preparation thereof (variants ), a method for pain relief and analgesic
Автори англійськоюBushman Helmut, Strassburger Wolfgang, Friederichs Elmar
Назва патенту російськоюСоединение 1-фенил-3-диметиламинопропана, способ ее получения (варианты), способ снятия боли и анальгетик
Автори російськоюБушманн Хельмут, Штрассбургер Вольфганг, Фридерихс Элмар
МПК / Мітки
МПК: C07C 217/74, C07C 219/00, C07C 237/40, A61K 31/215, C07C 217/62, A61K 31/27, A61K 31/34, C07C 217/66, C07C 217/72, C07C 215/00, A61P 25/04, C07C 225/00, C07C 271/58, C07D 307/79, C07C 323/36, A61K 31/135, A61K 31/343
Мітки: 1-феніл-3-диметиламінопропану, болю, зняття, анальгетик, спосіб, варіанти, одержання, сполука
Код посилання
<a href="https://ua.patents.su/14-41345-spoluka-1-fenil-3-dimetilaminopropanu-sposib-oderzhannya-varianti-sposib-znyattya-bolyu-i-analgetik.html" target="_blank" rel="follow" title="База патентів України">Сполука 1-феніл-3-диметиламінопропану, спосіб її одержання (варіанти), спосіб зняття болю і анальгетик</a>