Фармацевтична композиція для лікування кардіоваскулярних і цереброваскулярних захворювань
Номер патенту: 85065
Опубліковано: 25.12.2008
Автори: Чен Квінгчуанг, Лі Декун, Хуанг Жіджуан, Луо Чонгніан, Юе Хонгшуі, Вей Фенг
Формула / Реферат
1. Фармацевтична композиція, що містить:
5,0 % - 70,0 % екстракту кореня Salviae Miltiorrhizae;
10,0 % - 85,0 % екстракту кореня Notoginseng;
5,0 % - 70,0 % екстракту кореня Astragali і
1,0 % - 15,0 % борнеолу або олії Lignum Dalbergiae Odoriferae,
де згаданий екстракт кореня Salviae Miltiorrhizae містить
45 % - 70 % салвіанолевої кислоти типу В,
2 % - 10 % салвіанолевої кислоти типу Е,
4 % - 20 % розмаринової кислоти,
1 % - 10 % літоспермової кислоти і
більш ніж 70 % салвіанолевих кислот;
згаданий екстракт кореня Notoginseng містить
2 % - 10 % нотогінзенозиду R1,
2 % - 6 % гінзенозиду Re,
15 % - 40 % гінзенозиду Rg1,
15 % - 40 % гінзенозиду Rb1,
5 % - 12 % гінзенозиду Rd і
більш ніж 70 % сапонінів кореня Notoginseng;
згаданий корінь Astragali містить
5 % - 15 % астрагалозиду І і
більш ніж 70 % сапонінів кореня Astragali.
2. Композиція за пунктом 1, що містить:
15,0 % - 50,0 % екстракту кореня Salviae Miltiorrhizae;
25,0 % - 65,0 % екстракту кореня Notoginseng;
15,0 % - 50,0 % екстракту кореня Astragali і
2,0 % - 12,0 % борнеолу або олії Lignum Dalbergiae Odoriferae.
3. Композиція за пунктом 2, що містить:
20,0 % - 30,0 % екстракту кореня Salviae Miltiorrhizae;
30,0 % - 55,0 % екстракту кореня Notoginseng;
20,0 % - 30,0 % екстракту кореня Astragali і
4,0 % - 10,0 % борнеолу або олії Lignum Dalbergiae Odoriferae.
4. Композиція за пунктом 3, що містить:
23 % екстракту кореня Salviae Miltiorrhizae;
45 % екстракту кореня Notoginseng;
23 % екстракту кореня Astragali і
9% борнеолу або олії Lignum Dalbergiae Odoriferae.
5. Композиція за пунктом 1, де згаданий екстракт кореня Salviae Miltiorrhizae містить більш ніж 80 % салвіанолевих кислот; згаданий екстракт кореня Notoginseng містить більш ніж 80 % сапонінів кореня Notoginseng; і згаданий екстракт кореня Astragali містить більш ніж 80 % сапонінів кореня Astragali.
6. Композиція за пунктом 1, 2, 3 або 4, що знаходиться у формі ін'єкції, таблеток, таблеток з уповільненим вивільненням, пілюль, гранул, порошку для ін'єкції, капсул або мікрогранул.
7. Композиція за пунктом 6, що являє собою ін'єкцію або порошок для ін'єкції.
8. Застосування композиції за будь-яким з пунктів 1-7, для лікування кардіоваскулярних і цереброваскулярних захворювань.
Текст
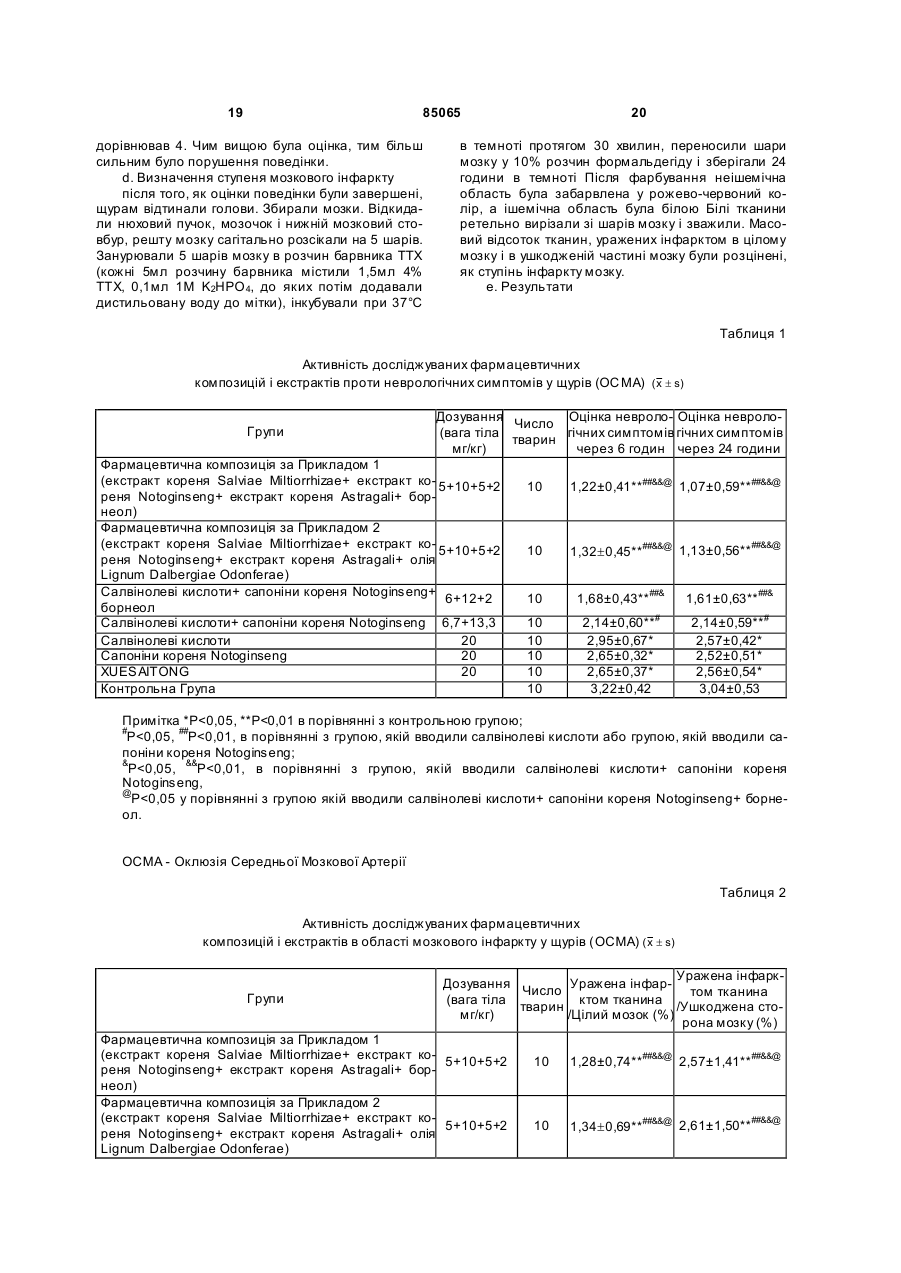
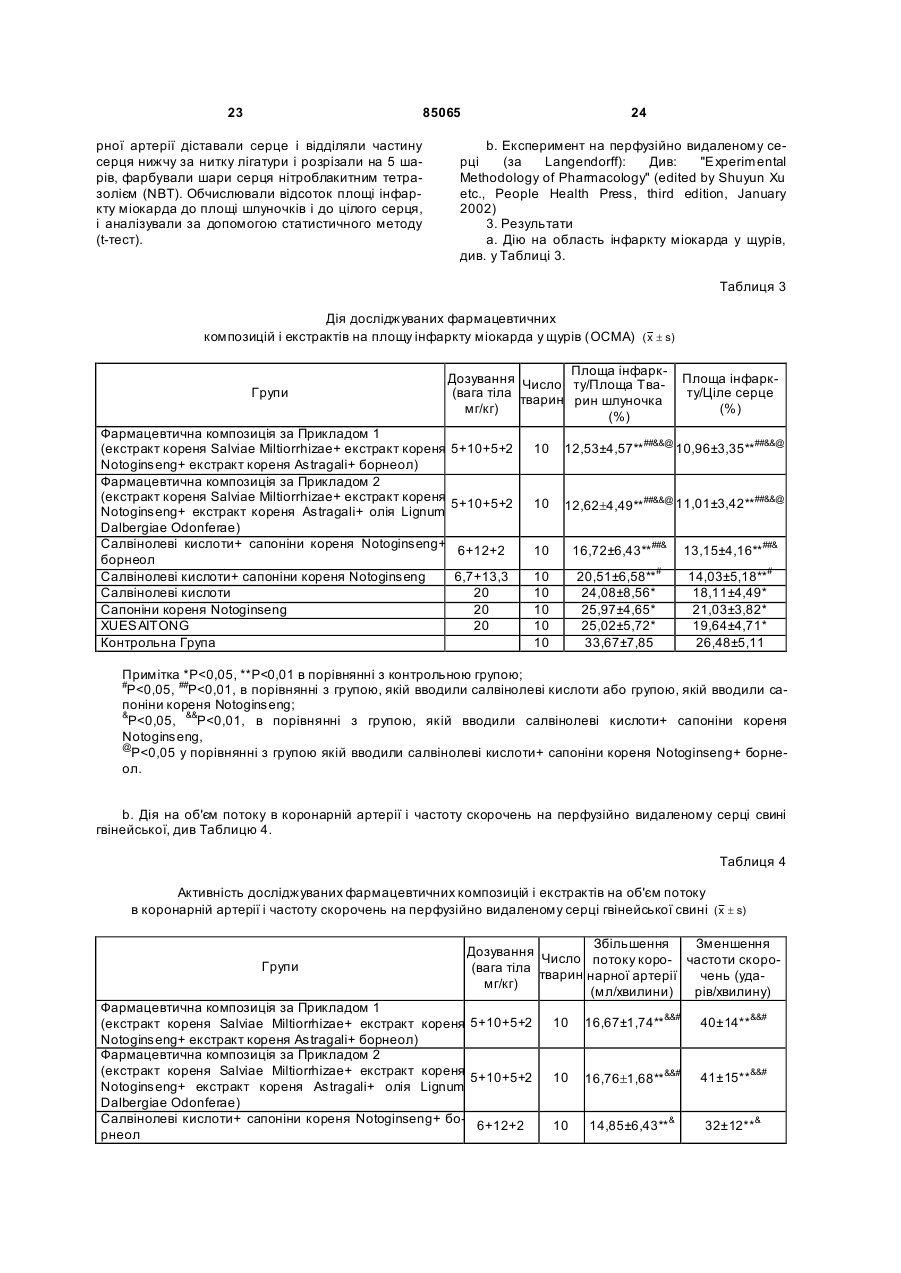
1. Фармацевтична композиція, що містить: 5,0%-70,0% екстракту кореня Salviae Miltiorrhizae; 10,0%-85,0% екстракту кореня Notoginseng; 5,0%-70,0% екстракту кореня Astragali і 1,0%-15,0% борнеолу або олії Lignum Dalbergiae Odoriferae, де згаданий екстракт кореня Salviae Miltiorrhizae містить 45%-70% салвіанолевої кислоти типу В, 2%-10% салвіанолевої кислоти типу Е, 4%-20% розмаринової кислоти, 1%-10% літоспермової кислоти і більш ніж 70 % салвіанолевих кислот; згаданий екстракт кореня Notoginseng містить 2%-10% нотогінзенозиду R1, 2%-6% гінзенозиду Re, 15%-40% гінзенозиду Rg1, 15%-40% гінзенозиду Rb1, 2 (19) 1 3 85065 Винахід стосується лікарської композиції. Зокрема, винахід стосується фармацевтичної композиції для лікування кардіоваскулярних і цереброваскулярних захворювань. Статистичні дані вказують на те, що захворюваність і смертність від кардіоваскулярних і цереброваскулярних захворювань в Китаї постійно зростають протягом останніх п'яти десятиліть Від 1950 до 1960 років кардіоваскулярні і цереброваскулярні захворювання посіли місце п'яте і шосте місця за поширеністю серед всіх захворювань, що викликають смерть Однак починаючи з 1975 року вони піднялися до другого та третього місць відповідно і смерть від кардіоваскулярних і цереброваскулярних захворювань посідає перше місце серед всіх інши х захворювань, які приводять до смерті По суті, смертність від кардіоваскулярних і цереброваскулярних захворювань серед китайців в 2001 році складала 42,6% всіх смертей порівняно до 12,07% в 1975-му У теперішній час ці захворювання викликають близько 2 мільйонів смертей щороку Деякі пацієнти виживають але більшість з тих, що залишилися в живих стали інвалідами і не в змозі піклуватися про себе у повсякденному житті що лягає тягарем на їх родини і суспільство. У західних країнах кардіоваскулярні і цереброваскулярні захворювання також лідирують у списку причин смертності. За оцінками спеціалістів, які ґрунтуються на поточних епідеміологічних даних, до 2020 року, хвороба коронарної артерії і мозковий крововилив все ще будуть першою і другою причинами смерті людей, хоча порядок розташування причин смерті від захворювань значно зміниться. За прогнозами, в наші дні кількість смертей у світі від хвороби коронарної артерії зросте до 11 мільйонів порівняно до 6,3 мільйонів у 1990 році; і кількість смертей від мозкового крововиливу зросте від 4,4 мільйонів до 7,7 мільйонів Протягом найближчих 30 років, смертність, викликана захворюваннями системи кровообігу, зросте до 59,6%. Смертність від хвороби коронарної артерії і інсульту зросте до 74,6% і 75% відповідно. Всі ці дані показують, що кардіоваскулярні і цереброваскулярні захворювання є не тільки головними захворюваннями, які шкодять людському здоров'ю; на сьогодні і в майбутньому вони також залишаються „вбивцями номер 1”, що призводять до смерті або інвалідності. Якщо розглядати терапевтичні засоби для лікування кардіоваскулярних і цереброваскулярних захворювань, то призначення лікарських засобів традиційної китайської патентованої медицини і західної медицини сфокусоване на різні аспекти; традиційні китайські патентовані лікарські засоби мають менше побічних ефектів, і тому завоювали добру частку ринку. Серед доступних традиційних китайських патентованих засобів для лікування кардіоваскулярних і цереброваскулярних захворювань все більшу увагу до себе привертають ті, що містять у якості активних компонентів, активні інгредієнти біологічно ефективних частин лікарських рослин, такі як, наприклад, нотогінзенозид (notoginsenoside), салвіанолеву (salvianoiic) кислоту, пуерарінові ізофлавони (puerarine), і гіпенозиди 4 (gypenosfdes). Оскільки біологічно ефективні частини лікарських рослин, що застосовуються в традиційних китайських патентованих лікарських засобах для лікування кардіоваскулярних і цереброваскулярних захворювань мають відповідну дію та ефект і впливають на різні аспекти, очікується, що вони матимуть широке застосування у комбінованому призначенні. З іншого боку, насьогодні, традиційні китайські патентовані лікарські засоби базуються на одній біологічно ефективній частині лікарської рослини, особливо у формі розчинів для ін'єкцій, як наприклад препарати XUESAITONG, XUESHUANTONG (торгові назви), не задовольняють вимозі комбінованого призначення. До того ж, просте змішування декількох традиційних китайських патентованих лікарських засобів у формі розчинів для ін'єкцій без попереднього схвалення Державною Адміністрацією з Продовольства і Лікарських засобів представляє великий ризик виникнення неочікуваних несприятливих реакцій, таких, як наприклад швидке збільшення кров'яного тиску, лихоманка, і алергія. Тому, дуже важливо забезпечити більш ефективні і зручні композиції біологічно активних частин лікарських рослин для клінічних застосувань. Завданням даного винаходу є забезпечення більш ефективної і зручної композиції з біологічно активних частин лікарських рослин і препарату на їх основі для лікування кардіоваскулярних і цереброваскулярних захворювань, який надає можливість подолати недоліки традиційних китайських патентованих лікарських засобів, які містять лише біологічно активні частини лікарських рослин, і тому не можуть задовольнити клінічну потребу в комбінованому призначенні, і дозволить уникнути потенційних побічних ефектів пов'язаних із простим змішуванням препаратів. Даний винахід може бути здійснений, як це наведено у наступних втіленнях. Фармацевтичні композиції відповідно до даного винаходу що містять: Екстракт кореня Salviae Miltiorrhizae, Екстракт кореня Notoginseng, Екстракт кореня Astragali, і Борнеол або олію Lignum Dalbergiae Odonferae. У переважному втіленні даного винаходу, композиція складається з: 5,0%-70,0% екстракту кореня Salviae Miltiorrhizae, 10,0%-85,0% екстракту кореня Notoginseng, 5,0%-70,0% екстракту кореня Astragali, і 1,0%-15,0% борнеолу або олії Lignum Dalbergiae Odonferae У більш переважному втіленні даного винаходу композиція складається з: 15,0%-50,0% екстракту кореня Salviae Miltiorrhizae, 25,0%-65,0% екстракту кореня Notoginseng, 15,0%-50,0% екстракту кореня Astragali ι 2,0%-12,0% борнеолу або олії Lignum Dalbergiae Odonferae У ще більш переважному втіленні даного винаходу, композиція складається з: 5 85065 20,0%-30,0% екстракту кореня Salviae Miltiorrhizae; 30,0%-55,0% екстракту кореня Notoginseng; 20,0%-30,0% екстракту кореня Astragali; і 4,0%-10,0% борнеолу або олії Lignum Dalbergiae Odoriferae. У найбільш переважному втіленні даного винаходу, композиція містить: 23% екстракту кореня Salviae Miltiorrhizae; 45,0% екстракту кореня Notoginseng; 23% екстракту кореня Astragali, і 9% борнеолу або олії Lignum Dalbergiae Odoriferae. У більш переважному втіленні композиції відповідно до даного винаходу, згаданий екстракт кореня Salviae Miltiorrhizae містить 45%-70% салвіанолевої кислоти типу В, 2%-10% салвіанолевої кислоти типу E, 4%-20% розмаринової (rosmarinic) кислоти, 1%-10% літоспермової (lithospermic) кислоти, і більш ніж 70% салвінолевих (salvinohc) кислот. У більш переважному втіленні композиції відповідно до даного винаходу, згаданий екстракт кореня Notoginseng містить 2%-10% нотогінзенозиду R1, 2%-6% гінзенозиду (ginsenoside) Re, 15%40% гінзенозиду Rg1, 15%-40% гінзенозиду Rb1, 5%-12% гінзенозиду Rd, і більш ніж 70%, переважно, більш ніж 80%, сапонінів кореня Notoginseng. У більш переважному втіленні композиції відповідно до даного винаходу, згаданий екстракт кореня Astragali містить 5%-15% астрагалозиду (astragaloside) I і більш ніж 70% сапонінів кореня Astragali. У найбільш переважному втіленні композиції відповідно до даного винаходу, згаданий екстракт кореня Salviae Miltiorrhizae містить більш ніж 80% салвінолевих кислот; згаданий екстракт кореня Notoginseng містить більш ніж 80% сапонінів кореня Notoginseng, і згаданий екстракт кореня Astragali містить більш ніж 80% сапонінів кореня Astragali. У більш переважному втіленні, композиції відповідно до даного винаходу знаходяться у вигляді ін'єкції, таблеток, таблеток з уповільненим вивільненням, драже, гранул, порошку для ін'єкції, капсул або мікрогранул. У найбільш переважному втіленні, композиції відповідно до даного винаходу знаходяться у вигляді ін'єкції або порошку для ін'єкції. Композиція відповідно до винаходу застосовується для лікування кардіоваскулярних і цереброваскулярних захворювань. Екстракт кореня Salviae Miltiorrhizae, який входить до згаданих вище фармацевтичних композицій може бути приготовлений за допомогою процесів, відомих з рівня техніки, наприклад, процесом, розкритим [у патентних заявках CN1352985A, CN1247855A, CN1242364A, CN1384090A, CN1459448A, і Guo Ying et al., The Journal of Yunnan University of Traditional Chinese Medicine, 2001, 24(4): 6]. Він також може бути отриманий за допомогою процесів, подібних до згаданого вище з відповідними модифікаціями. Досліджуваний екстракт кореня Salviae Miltiorrhizae містить 45%-70% салвіанолевої кисло 6 ти типу В, 2%-10% салвіанолевої кислоти типу E1 4%-20% розмаринової кислоти, 1%-10% літоспермової кислоти, і більш ніж 70%, переважно, більш ніж 80%, салвінолевих кислот Незалежно від процесу виготовлення екстракту кореня Salviae Miltiorrhizae, вираз "екстракт кореня Salviae Miltiorrhizae", що використовується в цьому тексті, означає, що склад екстрактів знаходиться у межах наведених проміжків, і, для цієї мети, невідповідні екстракти можуть бути вдосконалені, наприклад концентрацією, щоб відповідати вимогам до вмісту компонентів. Компоненти і їх вміст можуть бути охарактеризовані і визначені як вказано нижче відповідно: 1. Визначення вмісту салвіанолевої кислоти типу В, салвіанолевої кислоти типу E, розмаринової кислоти, і літоспермової кислоти в екстракті кореня Salviae Miltiorrhizae (ВЕРХ) a. Умови хроматографування Наповнювач: октадецилсиліл-силікагель; Рухома фаза ацетонітрил-вода-фосфорна кислота (23,5:76,5:0,02); Довжина виявлення хвилі: 288нм. Кількість теоретичних тарілок, обчислена за піком салвіанолевої кислоти типу В, - не менше 5000. b. Приготування контрольних розчинів: Контрольний розчин 0,2мг/мл салвіанолевої кислоти типу В готували шляхом змішування контрольного зразка з рухомою фазою. Подібним чином готували контрольний розчин 0,02мг/мл салвіанолевої кислоти типу E, контрольний розчин 0,05мл розмаринової кислоти, і контрольний розчин 0,01мг/мл літоспермової кислоти. с. Приготування пробних розчинів: 35мг екстракту кореня Salviae Miltiorrhizae точно зважували в мірній колбі об'ємом 25мл. До колби додавали рухому фазу, щоб розчинити пробу. Одержаний розчин, далі доводили рухомою фазою до 25мл, одночасно струшуючи 5мл пробного розчину переносили у мірну колбу об'ємом 25мл, і додавали рухому фазу до 25мл, струшуючи одержаний розчин для досягнення однорідності. d. Процедура дослідження 10мкл кожного контрольного розчину та пробних розчинів відповідно досліджували за допомогою рідинної хроматографії. 2. Визначення салвінолевих кислот в описаному вище екстракті кореня Salviae Miltiorrhizae (спектрофотометрія) а. Приготування контрольних розчинів· Розчин 20мкг/мл салвіанолевої кислоти типу В готували шля хом змішування зразка з сумішшю ацетонітрил-вода-фосфорна кислота (23,5:76,5:0,02). b. Приготування пробних розчинів: 25мг екстракту кореня Salviae Miltiorrhizae точно зважували в мірній колбі об'ємом 50мл. До колби додавали суміш ацетонітрил-вода-фосфорна кислота (23,5:76,5:0,02). Одержаний розчин, розводили згаданою сумішшю до 25мл одночасно струшуючи. 2мл пробного розчину точно переносили в мірну колбу об'ємом 50мл. Додавали згадану суміш до 25мл, стр ушуючи одержаний розчин для досягнення однорідності. с. Процедура дослідження 7 85065 Як розчин порівняння брали суміш ацетонітрил-вода-фосфорна кислота (23,5:76,5:0,02), ступінь поглинання контрольних розчинів і пробних розчинів визначали окремо методом спектрофотометрії при довжині хвилі 288нм (China Pharmacopoeia, edition 1995, volume 1, appendix VA). Розрахунки проводили за на наступною формулою: Вміст салвінолевих кислот (%)=f(A-B)+В де, f дорівнює 0,626 і є поправкою, А - вміст салвінолевих кислот, визначених спектрофотометрично відносно салвіанолевої кислоти типу В, В вміст салвіанолевої кислоти типу В визначений за допомогою ВЕРХ 3. ВЕРХ спектр відбитків пальців згаданого екстракту кореня Salviae Miltiorrhizae Умови методу визначення співпадають з умовами для визначенням салвіанолевої кислоти типів В і E, розмаринової кислоти, літоспермової кислоти в згаданому вище п ункті (1), на який робиться посилання Тривалість знімання складала 60 хвилин. Серед всіх загальних піків відбитків пальців, пік салвіанолевої кислоти типу В, загальний пік що представляє собою відносно велику і стабільну площу під піком, був обраний піком порівняння Відносний час затримки і відносна площа під піком обчислювалась відносно часу затримки і піку порівняння В спектрі відбитків пальців згаданого вище екстракту кореня Salviae Miltiorrhizae було 5-7 загальних піків, зазвичай - 6 загальних піків Відносні часи затримки 6 загальних піків складали 0,55-0,65 (пік салвіанолевої кислоти типу E), 0,66-0,70 (пік розмаринової кислоти), 0,71-0,79 (пік літоспермової кислоти), 1 (пік салвіанолевої кислоти типу В), 1,03-1,12, 1,21-1,30 Серед всіх загальних піків, тільки для піка салвіанолевої кислоти типу B, піка порівняння, співвідношення площі під одним піком до повної площі під піками було більшим ніж 20%. Площа під піком салвіанолевої кислоти типу В складала 57%-87% повної площі під піками його відносна площа під піком була прийнята за 1 При відносному часі затримки 0,66-0,70, площа під загальним піком розмаринової кислоти складала 3%18% повної площі під піками і його відносна площа під піком дорівнює 0,03-0,25. Загальна площа під піком не загального піка дорівнює менш ніж 10% повної площі під піками. Екстракт кореня Notoginseng, що входить до складу згаданих вище фармацевтичних композицій може бути приготовлений з використанням процесів, відомих з рівня техніки, наприклад процесу, розкритого [в китайському патенті ZL1095363C, китайській патентній заявці CN1352985A, у Qian Tianxiang et al, Foreign Medical Sciences, Plant Medicine Section, 1997, 12(4), Tang Diguang, The journal of Chinese Traditional Patent Medicine, 1990, 12(8): 5, The Standard of Public Health Ministry of China WS3-B-3590-2001 (z)]. Він також може бути отриманий за допомогою процесів, подібних до згаданого вище з відповідними модифікаціями. Він також є комерційно доступним на ринку наприклад, у формі екстракту, що містить 95% (визначається за допомогою УФ 8 спектроскопії) сапонінів кореня Notoginseng (Rb1 30%, Rg1 20%, R1 15%, визначається ВЕРХ). Досліджуваний екстракт кореня Notoginseng містить 2%-10% нотогінзенозиду R1, 2%-6% гінзенозиду Re, 15%-40% гінзенозиду Rg1, 15%-40% гінзенозиду Rb1, 5%-12% гінзенозиду Rd, і більш ніж 70%, переважно, більш ніж 80%, сапонінів кореня Notoginseng. Незалежно від процесу виготовлення екстракту кореня Notoginseng, вираз "екстракт кореня Notoginseng", що використовується в цьому тексті, означає, що склад екстрактів знаходиться у межах наведених проміжків; і, для цієї мети, невідповідні екстракти можуть бути вдосконалені, наприклад концентрацією, щоб відповідати вимогам до вмісту компонентів. Компоненти і їх вміст можуть бути охарактеризовані і визначені як вказано нижче відповідно: 1. Визначення вмісту гінзенозиду Re, гінзенозиду Rd, нотогінзенозиду R1, гінзенозиду Rg1, і гінзенозиду Rb1 в екстракті кореня Notoginseng (BEPX). а. Умови хроматографування і випробування придатності системи Наповнювач: октадецилсиліл-силікагель; Температура в колонці: 40°C; Швидкість потоку: 0,7мл/хвилину; Де тектувальна довжина хвилі: 203нм; Градієнт рухомої фази як вказано нижче: Час 0 10 30 Вода 70 70 10 Ацетонітрил 30 30 90 b. Приготування контрольних розчинів: 0,2мг/мл контрольного розчину гінзенозиду Re готували змішуванням контрольного зразка з метанолом. Так само приготували контрольний розчин 0,4мг/мл гінзенозиду Rd, контрольний розчин 0,2мг/мл гінзенозиду R1, контрольний розчин 0,4мг/мл нотогінзенозиду Rg1 і контрольний розчин 0,4/мл гінзенозиду Rb1 відповідно. с. Приготування пробних розчинів: 20мг екстракту кореня Notoginseng точно зважували в мірній колбі об'ємом 50мл. До колби додавали рухому фаз у, щоб розчинити пробу. Одержаний розчин, далі доводили рухомою фазою до 50мл, одночасно струшуючи. d. Процедура випробування 10мкл кожного контрольного розчину та пробних розчинів вприскували в ВЕРХ-систему, і аналізували. Таким чином одержували ВЕРХ спектр екстракту кореня Notoginseng відповідно до даного винаходу. (1) Визначення сапонінів кореня Notoginseng в згаданому вище екстракті кореня Notoginseng (спектрофотометрія) (2) ВЕРХ спектр відбитків пальців згаданого екстракту кореня Notoginseng Процедура визначення аналогічна наведеній в описі вище процедурі ВЕРХ (1) для гінзенозиду Re, гінзенозиду Rd, гінзенозиду R1, нотогінзенозиду Rg1 і гінзенозиду Rb1. Тривалість знімання складала 30 хвилин. Серед всіх загальних піків відбитків пальців, пік гінзенозиду Rg1, що представляє собою відно 9 85065 сно велику і стабільну площу під піком, був обраний піком порівняння. Відносний час затримки і відносна площа під піком обчислювалась відносно часу затримки і піку порівняння. В спектрі відбитків пальців згаданого вище екстракту кореня Notoginseng було 9-12 загальних піків, зазвичай 11 загальних піків. Відносні часи затримки 11 складали 0,77-0,85 (пік нотогінзенозиду R1), 0,870,97 (пік гінзенозиду Re), 1 (пік гінзенозиду Rg1, довідковий пік), 2,58-2,67, 0,68-2,76, 2,77-2,81, 2,82-2,91 (пік гінзенозиду Rb1), 2,95-3,03, 3,053,13, 3,15-3,22 (пік гінзенозиду Rd), 3,24-3,91. Серед всіх загальних піків, тільки для піка гінзенозиду Rg1 і піка гінзенозиду Rb1, співвідношення площі під одним піком до повної площі під піками було більшим ніж 20%. Площа під піком гінзенозиду Rg1, тобто, під піком порівняння, складала 20%35% повної площі під піками; його відносна площа під піком була прийнята за 1. Площа під піком гінзенозиду Rb1 складала 30%-50% повної площі під піками; його відносна площа під піком дорівнює 0,85-2,50. Площа під піком нотогінзенозиду R1 складала 2%-8% повної площі під піками; його відносна площа під піком дорівнює 0,06-0,40. Площа під піком гінзенозиду Rd складала 5%-14% повної площі під піками; його відносна площа під піком дорівнює 0,14-0,70. Повна площа не загального піка дорівнює менш ніж 10% повної площі під піками. Екстракт кореня Astragali згаданої вище фармацевтичного композиції може бути приготовлений за допомогою методів, відомих з рівня техніки, наприклад, розкритими [у китайських патентах CN1096269C, Yu Нао et al., West China Journal of Pharmaceutical Sciences , 1993, 8(3):163, Teng Xinglong et al., Heilongjiang Medical Journal, 2002, 15(5): 340, Wang Zhijie et al., Journal of Zhejiang College of Traditional Chinese Medicine, 2001, 25(5): 43]. Також їх можна одержати за допомогою процесів, подібних до згаданих вище з відповідними модифікаціями. Вони також є комерційно доступними на ринку, наприклад, у формі екстракту, що містить 80%-98% (УФ-визначення) екстракту кореня Astragali. Досліджуваний екстракт кореня Astragali містить 5%-15% астрагалозиду І і більше ніж 70%, або, переважно, більше ніж 80% сапонінів кореня Astragali. Незалежно від процесу виготовлення екстракту кореня Astragali, вираз "екстракт кореня Astragali", що використовується в цьому тексті, означає, що склад екстрактів знаходиться у межах наведених проміжків; і, для цієї мети, невідповідні екстракти можуть бути вдосконалені, щоб відповідати вимогам до вмісту компонентів. Борнеол, для застосування у згаданій вище композиції, може бути сполукою природного походження, або синтезованим. Олію Lignum Dalbergiae Odoriferae, яку використовують в згаданій композиції, можна одержати дистиляцією Lignum Dalbergiae Odoriferae. Композиції відповідно до даного винаходу, можуть знаходитись у вигляді різних дозованих форм, шляхом поєднання з одою або більшою кількістю фармацевтично прийнятних допоміжних речовин. Згадана допоміжна речовина може вклю 10 чати наступні сполуки,: крохмаль, декстрин, лактоза, мікрокристалічна целюлоза (avicel), гідроксипропілметилцелюлоза (HPMC), поліетиленгліколь, стеарат магнію, мікрокремнієвий гель, ксиліт, лактитол, глюкоза, гліцин, D-манітол і подібні, але не обмежується ними. Дана фармацевтична композиція, може знаходитись у формі ін'єкцій, таблеток, таблеток з уповільненим вивільненням, драже, гранул, порошку для ін'єкцій, капсул, мікрогранул та подібних. Перевага надається таблеткам, драже, порошку для ін'єкцій, і капсулам. Якщо композиції відповідно до даного винаходу виготовлені у вигляді ін'єкцій або порошку для ін'єкцій, повний вміст салвінолевих кислот, сапонінів кореня Notoginseng і сапонінів кореня Astragali складає переважно понад 80%. Складові композиції відповідно до даного винаходу є легко доступними і це сприяє її комерційному виробництву. Дана композиція за бажанням може бути виготовлена у вигляді різних форм, що забезпечує зручніший і ефективніший сучасний китайський традиційний патентований лікарський засіб з високим рівнем контролю якості для клінічного застосування. Даний винахід порівнює активність композицій відповідно до даного винаходу проти антицеребральну ішемію а саме салвінолеві кислоти плюс сапоніни кореня Notoginseng плюс борнеол або олія Llignum Dalbergiae Odonferae, салвінолеві кислоти плюс сапоніни кореня Notoginseng, салвінолеві кислоти і сапоніни кореня Notoginseng, використовуючи модель локалізованої ішемії головного мозку викликаної місцевим застосуванням гексагідрату хлориду заліза (III) на середню мозкову артерію, шля хом визначення неврологічних симптомів і області/площі мозкового інфаркту. Результати показують що дана композиція має істотну активність при анти-церебральній ішемії. Її терапевтична активність є істотнішою, ніж активність взятих окремо салвінолевих кислот або сапонінів кореня Notoginseng, істотнішою, ніж активність композицій, що складаються з салвінолевих кислот плюс сапоніни кореня Notoginseng, або з салвінолевих кислот плюс сапоніни кореня Notoginseng плюс борнеол або олія Lignum Dalbergiae Odonferae. Результати демонструють, що фармацевтична композиція відповідно до даного винаходу тобто комбінація екстракт кореня Salviae Miltiorrhizae плюс екстракт кореня Notoginseng плюс екстракт кореня Astragali і борнеол або екстракт кореня Salviae Miltiorrhizae плюс екстракт кореня Notoginseng плюс екстракт кореня Astragali і олія Lignum Dalbergiae Odonferae мають істотний синергічний ефект. Фіг.1: ВЕРХ спектр відбитків пальців екстракту кореня Salviae Miltiorrhiaze (0-60 хвилин), Фіг.2: ВЕРХ спектр відбитків пальців екстракту кореня Notoginseng (0-30 хвилин) В описі даного винаходу всі відсотки якщо не зазначено інше є ваговими. Винахід стане краще зрозумілим при посиланні на приклади які слідують нижче. Наступні приклади наведені з ілюстративною метою і не обмежують обсяг винаходу. 11 85065 Приклад 1 Екстракт кореня Salviae Miltiorrhizae: Екстракт кореня Salviae Miltiorrhizae був приготовлений методом розкритим [в китайській патентній заявці CN1459448A]. Отже 5кг кореня Salviae Miltiorrhizae подрібнювали до одержання грубому порошку а потім екстрагували 3 рази деіонізованою водою при 100°C при м'яких умовах кипіння. Для першої екстракції до порошку додавали 27,5л води і кипятили протягом 1 години, для другої та третьої екстракції, додавали 15л води і кип'ятили протягом 0,5 години відповідно Кислотність екстракту доводили до рН2 додаванням 10% HCI а потім відфільтровували Фільтрат виливали на колонку заповнену поліамідною смолою (кількість сухої смоли дорівнює кількості двох третини неочищенного екстракту). Колонку промивали деіонізованою водою кількістю, що дорівнювала п'яти об'ємам колонки, далі промивали п'ятьма об'ємами розчину 0,1% NaHCO3. Елюат зібрали. Після доведення рН розчину до 2 додаванням 10% HCI, елюат завантажували на колонку заповнену макропористою абсорбційною смолою D101. Смолу промивали деіонізованою водою, поки елюат не став нейтральним. Потім колонку промивали 95% етанолом відбираючи забарвлену частину. Зібраний розчин випаровували у вакуумі досуха. Сухий залишок розчиняли у воді і залишали у холодильнику на ніч. Після фільтрування через 0,3мкм змішану целюлозну мікропористу фільтрувальну плівку одержували екстракт, що містить салвінолеві кислоти рН розчину доводили до 6,0 2% розчином NaOH і негайно ліофілізували з одержанням 221г замороженого сухого порошку естрактивного матеріалу кореня Salviae Miltiorrhizae. Вихід неочищенного матеріалу з кореня Salviae miltiorrhizae склав 4,4%. Одержаний у такий спосіб екстракт кореня Salviae Miltiorrhizae містив салвіанолеву кислоту типу А, салвіанолеву кислоту типу В, салвіанолеву кислоту типу C, салвіанолеву кислоту типу D, салвіанолеву кислоти типу E, салвіанолеву кислоту типу G, мілтіонон (miltionone) I, розмаринову кислоту, літоспермову кислоту, 3,4дипдроксифенілмолочну кислоту (danshensu) і так далі. Вміст салвіанолевої кислоти типу В складав 53,73%, салвіанолевої кислоти типу E складав 3,7%, розмаринової кислоти складав 5,2%, літоспермової кислоти дорівнював 1,7%, і вміст салвінолевих кислоти - 83,94%. На ВЕРХ спектрі відбитків пальців екстракту кореня Salviae Mittiorrhizae одержали 6 загальних піків (середнє значення для 10 партій). Середні величини відносних часів затримки для цих 6 загальних піків були наступними 0,60 (пік салвіанолевої кислоти типу E), 0,68 (пік розмаринової кислоти), 0,73 (пік літоспермової кислоти), 1 (пік салвіанолевої кислоти типу В), 1,08, 1,26. Серед всіх загальних піків тільки для піка салвіанолевої кислоти типу В, який був піком посилання, співвідношення площі під одним піком до повної площі під піками було більшим ніж 20%. Площа під піком салвіанолевої кислоти типу В складала 72% (середнє значення) повної площі під піками і його відносна площа під піком була прийнята за 1; Площа під піком розмаринової кислоти 12 складала 10% (середнє значення) повної площі під піками і його відносна площа під піком дорівнювала 0,14 (середнє значення). Повна площа не загального піка дорівнює менш ніж 10% повної площі під піками. ВЕРХ спектр відбитків пальців кореня Salviae Miltiorrhizae показаний на Фіг.1. Екстракт кореня Notoginseng: Комерційно доступні сапоніни кореня Notoginseng були додатково вдосконалені, щоб одержати екстракт кореня Notoginseng бажаної якості. Одержаний екстракт містив гінзенозид Rd, гінзенозид Rb1, гінзенозид Re, гінзенозид Rg1, гінзенозид Rg2, гінзенозид Rg3, гінзенозид Rh1, гінзенозид Rh2, панакситріол (panaxytrioi), нотогінзенозид R1, нотогінзенозид R2, нотогінзенозид R3, 20-глюкогінзенозид Rf. Вміст пнзенозиду Re складав 3,9%, гінзенозиду Rg1 - 34,3%, гінзенозиду Rb1 - 31,0%, гінзенозиду Rd - 8,8%, нотогінзенозиду R1 - 6,8%, і сапонінів кореня Notoginseng - 94%. На ВЕРХ спектрі відбитків пальців екстракту кореня Notoginseng одержали 11 загальних піків. Середні величини відносних часів затримки для цих 11 загальних піків були наступними: 0,82 (пік нотогінзенозиду R1), 0,94 (пік гінзенозиду Re), 1 (пік гінзенозиду Rg1 довідковий пік), 2,63, 2,74, 2,79, 2,85 (пік гінзенозиду Rb1), 2,99, 3,08, 3,18 (пік гінзенозиду Rd), і 3,28. Серед всіх загальних піків, тільки для піка гінзенозиду Rg1 і піка гінзенозиду Rb1, співвідношення площі під одним піком до повної площі під піками було більшим ніж 20%. Площа під піком гінзенозиду Rg1 (піка порівняння) складала 28% (середнє значення) повної площі під піками; і його відносна площа під піком була прийнята за 1. Площа під піком гінзенозиду Rb1 складала 39% (середнє значення) повної площі під піками; і його відносна площа під піком - 1,36 (середнє значення). Площа під піком нотогінзенозиду R1 вважається за 6% (середнє значення) повної площі під піками; і його відносна площа під піком дорівнювала 0,20 (середнє значення). Площа під піком пнзенозиду Rd складала 10% (середнє значення) повної площі під піками; і його відносна площа під піком дорівнювала 0,37 (середнє значення). Повна площа не загального піка дорівнює менш ніж 10% повної площі під піками. ВЕРХ спектр відбитків пальців кореня Salviae Miltiorrhizae показаний на Фіг.2. Екстракт кореня Astragali: Комерційно доступний екстракт кореня Astragali був додатково вдосконалений. Одержаний екстракт містив ацетиластрагалозид, астрагалозид І, астрагалозид II, астрагалозид III, астрагалозид IV, ізоастрагалозид І, ізоастрагалозид II, астрамембраннін (astramembrannin) II, циклоастрагенол (cycloastragenol), соєвий сапонін (soyasaponm) I, лупеод (lupeod), β-сітостерол (βsitosterol), даукостерін (daucostenn). Вміст астрагалозиду складав 9,5% а екстракту кореня Astragali - 88,9%. 75мг екстракту кореня Salviae Miltrorrhizae, 150мг екстракту кореня Notoginseng 75мг екстракту кореня Astragali, одержані як описано вище, і 30мг борнеолу добре перемішували. Потім суміш ліофілізували і одержували композицію відповідно до даного винаходу. 13 85065 Приклад 2 100мг екстракту кореня Salviae Miltrorrhizae, 200мг екстракту кореня Notoginseng, 75мг екстракту кореня Astragali, одержаних як зазначено у Прикладі 1 і 30мг олії Lignum Dalbergiae Odonferae змішували з 400мг поліетиленгліколю-6000 і розплавляли для одержання суміші. Після охолодження суміші одержували композицію відповідно до даного винаходу. Приклад 3 96мг екстракту кореня Salviae Miltrorrhizae, 136мг екстракту кореня Notoginseng, 70мг екстракту кореня Astragali, одержаних як зазначено у Прикладі 1 і 28мг борнеолу добре перемішували. Потім суміш ліофілізували і одержували композицію відповідно до даного винаходу. Приклад 4 70мг екстракту кореня Salviae Miltrorrhizae, 150мг екстракту кореня Notoginseng 90мг екстракту кореня Astragali, одержаних, як зазначено у Прикладі 1, і 20мг борнеолу добре перемішували. Потім суміш ліофілізували і одержували композицію відповідно до даного винаходу. Приклад 5 165мг екстракту кореня Salviae Miltrorrhizae 80мг екстракту кореня Notoginseng 60мг екстракту кореня Astragali, одержаних як зазначено у Прикладі 1 і 25мг борнеолу добре перемішували. Потім суміш ліофілізували і одержували композицію відповідно до даного винаходу. Приклад 6 75мг екстракту кореня Salviae Miltrorrhizae 135мг екстракту кореня Notoginseng, 82мг екстракту кореня Astragali, одержаних як зазначено у Прикладі 1 і 38мг борнеолу добре перемішували. Потім суміш ліофілізували і одержували композицію відповідно до даного винаходу. Приклад 7 230мг екстракту кореня Salviae Miltrorrhizae, 75мг екстракту кореня Notoginseng, 17мг екстракту кореня Astragali, одержаних, як зазначено у Прикладі 1, і 8мг борнеолу добре перемішували. Потім суміш ліофілізували і одержували композицію відповідно до даного винаходу. Приклад 8 17мг екстракту кореня Salviae Miltrorrhizae, 70мг екстракту кореня Notoginseng, 230мг екстракту кореня Astragali, одержаних, як зазначено у Прикладі 1 і 13мг борнеолу добре перемішували. Потім суміш ліофілізували і одержували композицію відповідно до даного винаходу. Приклад 9 55мг екстракту кореня Salviae Miltrorrhizae, 160мг екстракту кореня Notoginseng, 63мг екстракту кореня Astragali, одержаних, як зазначено у Прикладі 1, і 48мг борнеолу добре перемішували. Потім суміш ліофілізували і одержували композицію відповідно до даного винаходу. Приклад 10 96мг екстракту кореня Salviae Miltrorrhizae, 136мг екстракту кореня Notoginseng, 70мг екстракту кореня Astragali, одержаних, як зазначено у Прикладі 1, і 28мг олії Lignum Dalbergiae Odoriferae добре перемішували з 400мг поліетиленгліколю6000, і розплавляли для одержання суміші. Після 14 охолодження суміші, одержували композицію відповідно до даного винаходу. Приклад 11 70мг екстракту кореня Salviae Miltrorrhizae, 150мг екстракту кореня Notoginseng, 90мг екстракту кореня Astragali, одержаних, як зазначено у Прикладі 1, і 20мг олії Lignum Dalbergiae Odoriferae добре перемішували з 400мг поліетиленгліколю6000, і розплавляли для одержання суміші. Після охолодження суміші, одержували композицію відповідно до даного винаходу. Приклад 12 165мг екстракту кореня Salviae Miltrorrhizae, 80мг екстракту кореня Notoginseng, 60мг екстракту кореня Astragali, одержаних, як зазначено у Прикладі 1, і 25мг олії Lignum Dalbergiae Odoriferae добре перемішували з 400мг поліетиленгліколю6000, і розплавляли для одержання суміші. Після охолодження суміші, одержували композицію відповідно до даного винаходу. Приклад 13 75мг екстракту кореня Salviae Miltrorrhizae, 135мг екстракту кореня Notoginseng, 82мг екстракту кореня Astragali, одержаних, як зазначено у Прикладі 1, і 38мг олії Lignum Dalbergiae Odoriferae добре перемішували з 400мг поліетиленгліколю6000, і розплавляли для одержання суміші. Після охолодження суміші, одержували композицію відповідно до даного винаходу. Приклад 14 230мг екстракту кореня Salviae Miltrorrhizae, 75мг екстракту кореня Notoginseng, 17мг екстракту кореня Astragali, одержаних, як зазначено у Прикладі 1, і 8мг олії Lignum Dalbergiae Odoriferae добре перемішували з 400мг поліетиленгліколю6000, і розплавляли для одержання суміші. Після охолодження суміші, одержували композицію відповідно до даного винаходу. Приклад 15 17мг екстракту кореня Salviae Miltrorrhizae, 70мг екстракту кореня Notoginseng, 230мг екстракту кореня Astragali, одержаних, як зазначено у Прикладі 1, і 13мг олії Lignum Dalbergiae Odoriferae добре перемішували з 400мг поліетиленгліколю6000, і розплавляли для одержання суміші. Після охолодження суміші, одержували композицію відповідно до даного винаходу. Приклад 16 55мг екстракту кореня Salviae Miltrorrhizae, 160мг екстракту кореня Notoginseng, 63мг екстракту кореня Astragali, одержаних, як зазначено у Прикладі 1, і 48мг олії Lignum Dalbergiae Odoriferae добре перемішували з 400мг поліетиленгліколю6000, і розплавляли для одержання суміші. Після охолодження суміші, одержували композицію відповідно до даного винаходу. Приклад 17 75г екстракту кореня Salviae Miltrorrhizae, 135г екстракту кореня Notoginseng, 96г екстракту кореня Astragali, одержаних, як зазначено у Прикладі 1, і 25г борнеолу, 90г маннітолу, 15г динатрій ЕДТАту кальцію, і 15мл дистильованої води добре перемішували. Потім суміш ліофілізували і розділяли на 1000 аліквот. 15 85065 Приклад 18 67г екстракту кореня Salviae Miltrorrhizae [див. китайську патентну заявку CN1352985A, Приклад 1], 180г екстракту кореня Notoginseng (Приклад 1 опису винаходу), 67г екстракту кореня Astragali (див. Приклад 1 опису винаходу), і 16г борнеолу добре перемішували з 40г мікрокристалічної целюлози. Для пом'якшення до суміші додавали 3% розчин повідон-етанолу. Суміш пропускали крізь сито №18 для формування гранул і висушували при 60°C протягом 30-45 хвилин. Одержані в такий спосіб гранули , додавали 4г тальку ретельно перемішували. Сформованими гранулами наповнювали капсули. Приклад 19 50г екстракту кореня Salviae Miltrorrhizae (приготовленого методом водного екстрагування з наступним осадженням спиртом, [див. Guo Ying et al, The Journal of Yunnan University of Traditional Chinese Medicine, 2001, 24(4): 6], 210г екстракту кореня Notoginseng [див Qian Tian Xiang et al. Foreign Medical Sciences, Plant Medicine Section, 1997, 12(4)], 50г екстракту кореня Astragali (див. Приклад 1 опису винаходу), і 20г борнеолу розчиняли окремо у невеликій кількості фізіологічного розчину. Додавали відповідну кількість Tween 80. Кожну суміш тонко подрібнювали і знебарвлювали після додавання фізіологічного розчину. Розчин відфільтровували у вакуумі, поки він не ставав чистим і прозорим. Фільтрат збирали у контейнер, що містив фізіологічний розчин. Контейнер запечатували і стерилізували у киплячій воді. Всі три види прозорих розчинів змішували і доводили кислотність до 5. Додавали відповідний об'єм фізіологічного розчину. Процес фільтрування повторювали для одержання чистого і прозорого розчин. Таким чином одержували бажану ін'єкцію. Приклад 20 60г екстракту кореня Salviae Miltrorrhizae [див китайську патентну заявку CN1384090A, Приклад 1], 80г екстракту кореня Notoginseng [Tang Di Guang , The Journal of Chinese Traditional Patent Medicine, 1990, 12(8): 5], 165г екстракту кореня Astragali (див. Приклад 1 опису винаходу), і 25г борнеолу добре перемішували з 40г мікрокристалічної целюлози. Для пом'якшення до суміші додавали 3% розчин повщон-етанолу. Суміш пропускали крізь сито №18 для формування гранул і висушували при 60°С протягом 30-45 хвилин. Одержані в такий спосіб гранули обробляли, додавали 4г тальку ретельно перемішували. Сформовані гранули спресовували у таблетки. Приклад 21 90г екстракту кореня Salviae Miltrorrhizae [див китайську патентну заявку CN1384090A, Приклад 1], 150г екстракту кореня Notoginseng (див Приклад 1 опису винаходу), 82г екстракту кореня Astragali (див Приклад 1 опису винаходу), і 8г борнеолу добре перемішували з 40г мікрокристалічної целюлози. Для пом'якшення до суміші додавали 3% розчин повщон-етанолу. С уміш пропускали крізь сито №18 для формування гранул і висушували при 60°C протягом 30-45 хвилин. Одержані в такий спосіб гранули обробляли, додавали 4г тальку ретельно перемішували. 16 Приклад 22 85г екстракту кореня Salviae Miltrorrhizae [див китайську патентну заявку CN1384090A, Приклад 1], 135г екстракту кореня Notoginseng (див Приклад 1 опису винаходу), 80г екстракту кореня Astragali [Teng Xing Long et al, Неi Long Jiang Medical Journal, 2002, 15(5) 340] і 30г борнеолу добре перемішували з 700г поліетиленгліколю6000, і сплавляли Потім виливали у низькоплавкий рідкий парафін, відбирали пілюлі і видаляли низькоплавкий рідкий парафін. Приклад 23 17г екстракту кореня Salviae Miltrorrhizae [див китайську патентну заявку CN1384090A, Приклад 1], 280г екстракту кореня Notoginseng (див Приклад 1 опису винаходу), 17г екстракту кореня Astragali (Приклад 1 опису винаходу, [Екстракція· Yu Нао et al., West China Journal of Pharmaceutical Sciences, 1993, 8(3): 163]; Очищення [Teng Xing Long et al, Неi Long Jiang Medical Journal, 2002, 15(5): 340)], і 16г борнеолу добре перемішували з 700г поліетиленгліколю-6000, і сплавляли Потім виливали у низькоплавкий рідкий парафін, відбирали пілюлі і видаляли низькоплавкий рідкий парафін. Приклад 24 67г екстракту кореня Salviae Miltrorrhizae [див китайську патентну заявку CN1352985A, Приклад 1], 180г екстракту кореня Notoginseng (див Приклад 1 опису винаходу), 67г екстракту кореня Astragali (див. Приклад 1 опису винаходу), і 16г олії Lignum Dalbergiae Odoriferae добре перемішували з 40г мікрокристалічної целюлози. Для пом'якшення до суміші додавали 3% розчин повідон-етанолу. Суміш пропускали крізь сито №18 для формування гранул і висушували при 60°C протягом 30-45 хвилин. Одержані в такий спосіб гранули обробляли, додавали 4г тальку ретельно перемішували. Сформованими гранулами наповнювали капсули. Приклад 25 60г екстракту [див китайську патентну заявку CN1384090A, Приклад 1] кореня Salviae Miltrorrhizae, 80г екстракту [Tang Di Guang , The journal of Chinese Traditional Patent Medicine, 1990, 12(8): 5] кореня Notoginseng, 165г екстракту (див. Приклад 1 опису винаходу) кореня Astragali, і 25г олії Lignum Dalbergiae Odoriferae добре перемішували з 40г мікрокристалічної целюлози. Для пом'я кшення до суміші додавали 3% розчин повідонетанолу. Суміш пропускали крізь сито №18 для формування гранул і висушували при 60°C протягом 30-45 хвилин. Одержані в такий спосіб гранули обробляли, додавали 4г тальку ретельно перемішували Після обробляли, 4г тальку було додано і змішано цілком. Сформовані гранули спресовували у таблетки. Приклад 26 90г екстракту кореня Safviae Miltrorrhizae [див. китайську патентну заявку CN1384090A, Приклад 1], 150г екстракту кореня Notoginseng (див. Приклад 1 опису винаходу), 82г екстракту кореня Astragali (див. Приклад 1 опису винаходу), і 8г олії Lignum Dalbergiae Odoriferae добре перемішували з 40г мікрокристалічної целюлози. Для пом'якшення до суміші додавали 3% розчин повідон-етанолу. 17 85065 Суміш пропускали крізь сито №18 для формування гранул і висушували при 60°C протягом 30-45 хвилин. Одержані в такий спосіб гранули обробляли, додавали 4г тальку ретельно перемішували. Одержані таким чином гранули обробляли і упаковували. Приклад 27 85г екстракту кореня Salviae Miltrorrhizae [див. китайську патентну заявку CN1384090A, Приклад 1], 135г екстракту кореня Notoginseng (див Приклад 1 опису винаходу), 80г екстракту кореня Astragali [Teng Xing Long et al, Неі Long Jiang Medical Journal, 2002, 15(5): 340] і 30г олії Lignum Dalbergiae Odoriferae добре перемішували з 700г поліетиленгліколю-6000, і сплавляли. Потім виливали у низькоплавкий рідкий парафін, відбирали пілюлі і видаляли низькоплавкий рідкий парафін. Приклад 28 17г екстракту кореня Salviae Miltrorrhizae [див китайську патентну заявку CN1384090A, Приклад 1], 280г екстракту кореня Notoginseng (див. Приклад 1 опису винаходу), 17г екстракту кореня Astragali (приклад 1 з винаходу, Екстракція: [Yu Нао et al., West China Journal of Pharmaceutical Sciences, 1993, 8(3): 163]; Очищення [Teng Xing Long et al., Hei Long Jiang Medical Journal, 2002, 15(5): 340], і 16г олії Lignum Dalbergiae Odoriferae добре перемішували з 700г поліетиленгліколю6000, і сплавляли. Потім виливали у низькоплавкий рідкий парафін, відбирали пілюлі і видаляли низькоплавкий рідкий парафін. Експеримент 1 - Активність досліджуваних фармацевтичних композицій проти локалізованої ішемії головного мозку у щурів 1. Ма теріали a. Тварини: Щури чоловічої статі лінії SpragueDawley (SD), вагою 180-200 грам, Сертифікат Контролю Якості №SCXK (Пекін) 2002-0003, виданий Beijing Weitong Lihua Experimental Animal Technology Co., Limited. b. Засоби, що проходили випробування і хімічні реагенти: Засоби, що проходили випробування: композиція, відповідно до Прикладу 1 і Прикладу 2 опису винаходу; екстракт кореня Salviae Miltiorrhizae відповідно до Прикладу 1; екстракт кореня Notoginseng відповідно до Прикладу 1; екстракт кореня Astragali відповідно до Прикладу 1; олія Lignum Dalbergiae Odoriferae і борнеол. Препарат XUESAITONG (торгова назва) виробництва [Qunming Pharmaceutical Co., Limited, партія №20020922 03] придбали у вільному продажі. Хімічний реагент: 2,3,5-трифенілтетразолію хлорид (TTX), порошок світло-жовтого кольору, продукт вироблений [Beijing Mashi Fine Chemical Co., Limited, партія №011102]. c. Експериментальне Обладнання: Стереоскопічний мікроскоп XTT, продукт Юннаньської фабрики оптичних інструментів; Електронні аналітичні ваги, модель AEG-220, продукт японської корпорації Shimadzu; Настільний набір стоматологічних інструментів 307-6, продукт Шанхайської фабрики стоматологічних медичних інструментів; Air Bath Vibrator HZQ-C, продукт Харбінської фабрики медичних інструментів Dongming. 18 2. Ме тоди і Результати a. Утворення груп і введення досліджуваних засобів: Тварини групувалися випадково, без урахування ваги. Введення всіх випробовуваних препаратів тваринам всіх гр уп відбувалося через під'язикову вену через 30 хвилин після операції. Досліджувані засоби також вводили шляхом внутрішньочеревинної ін'єкції через 2 години і через 23 години після операції. Всі досліджувані засоби розводили фізіологічним розчином до бажаної концентрації. Об'єм ін'єкції складав 0,4мл на кожні 100г маси тіла. b. Моделювання емболії середньої мозкової артерії: Для знеболювання щурам внутрішньочеревинно вводили 10% розчин хлоральгідрату (350мг/кг) і зафіксували їх у положенні на правому боці. Посередині між зовнішнім кутом лівого ока і зовнішню частиною лівого слухово го каналу зробили кривий надріз довжиною 1,5см. Відрізали скроневий м'яз, відкривали доступ до скроневої кістки, і під стереоскопічним мікроскопом, робили у кістці отвір діаметром 2,5мм у положенні на сполученні виличної кістки і лускатої виличної кістки, який знаходився на відстані 1мм від краю суглоба. Очищували від осколків і відкривали доступ до середньої мозкової артерії (розміщений між нюховим пучком і нижньою мозковою веною); Вміщували маленький шматок пластикової плівки, щоб захистити область, що оточує кровоносну судину. Потім над цим сегментом середньої мозковоїартерії вміщували маленький шматок фільтрувального паперу, просоченого 10мкл 50% розчину хлориду заліза (III), через 30 хвилин, фільтровальний папір прибирали, промивали оточуючі тканини фізіологічним розчином, і пошарово зашивали надріз. Щурів повертали до кліток і відтворювали нормальні умови перебування Кімнатну температуру підтримували на рівні 24°C. с. Критерії оцінки неврологічних симптомів Оцінку поведінки проводили через 24 години після операції. Критерії оцінки були наступними: (1). Спостерігали згинання передніх кінцівок в суглоба х після того, як щурів піднімали за хвіст; Характеристикою 0 балів позначали стан, коли обидві кінцівки розпрямлялися вперед симетрично; 1 бал присуджували, якщо кінцівка була зігнута у плечовому суглобі, ліктьовому суглобі та/або у плечовому суглобі на боці, протилежному до оперованого. (2). Розміщували щура на плоскій поверхні, натискали одночасно на обидва плеча у напрямку до протилежних сторін і оцінювали опір. Присуджували 0 балів, якщо опір однаковий і сильний з обох боків; 1 бал, якщо на боці, протилежному до оперованого опір був меншим. (3). Розміщували кінцівки щура на металевій сітці і спостерігали напруженість м'язів. Стану давали оцінку 0 балів, якщо напруження м'язів з обох боків були однаково сильними; 1 бал, якщо напруженість м'я зу кінцівки на боці, протилежному до оперованого опір була меншою. (4). Давали оцінку в 1 бал, якщо щур безперервно обертався у напрямку протилежному до оперованого, коли його піднімали за хвіст. Заснована на наведених вище критеріях оцінки, вищий бал 19 85065 дорівнював 4. Чим вищою була оцінка, тим більш сильним було порушення поведінки. d. Визначення ступеня мозкового інфаркту після того, як оцінки поведінки були завершені, щурам відтинали голови. Збирали мозки. Відкидали нюховий пучок, мозочок і нижній мозковий стовбур, решту мозку сагітально розсікали на 5 шарів. Занурювали 5 шарів мозку в розчин барвника TTX (кожні 5мл розчину барвника містили 1,5мл 4% TTX, 0,1мл 1М K2HPO 4, до яких потім додавали дистильовану воду до мітки), інкубували при 37°С 20 в темноті протягом 30 хвилин, переносили шари мозку у 10% розчин формальдегіду і зберігали 24 години в темноті Після фарбування неішемічна область була забарвлена у рожево-червоний колір, а ішемічна область була білою Білі тканини ретельно вирізали зі шарів мозку і зважили. Масовий відсоток тканин, уражених інфарктом в цілому мозку і в ушкодженій частині мозку були розцінені, як ступінь інфаркту мозку. e. Результати Таблиця 1 Активність досліджуваних фармацевтичних композицій і екстрактів проти неврологічних симптомів у щурів (OC MA) ( х ± s) Групи Дозування Число Оцінка невроло- Оцінка невроло(вага тіла тварин гічних симптомів гічних симптомів мг/кг) через 6 годин через 24 години Фармацевтична композиція за Прикладом 1 (екстракт кореня Salviae Miltiorrhizae+ екстракт ко- 5+10+5+2 реня Notoginseng+ екстракт кореня Astragali+ борнеол) Фармацевтична композиція за Прикладом 2 (екстракт кореня Salviae Miltiorrhizae+ екстракт ко- 5+10+5+2 реня Notoginseng+ екстракт кореня Astragali+ олія Lignum Dalbergiae Odonferae) Салвінолеві кислоти+ сапоніни кореня Notoginseng+ 6+12+2 борнеол Салвінолеві кислоти+ сапоніни кореня Notoginseng 6,7+13,3 Салвінолеві кислоти 20 Сапоніни кореня Notoginseng 20 XUESAITONG 20 Контрольна Група 10 1,22±0,41**##&&@ 1,07±0,59**##&&@ 10 ##&&@ 1,32±0,45**##&&@ 1,13±0,56** 10 1,68±0,43**##& 1,61±0,63**##& 10 10 10 10 10 2,14±0,60**# 2,95±0,67* 2,65±0,32* 2,65±0,37* 3,22±0,42 2,14±0,59**# 2,57±0,42* 2,52±0,51* 2,56±0,54* 3,04±0,53 Примітка *Р
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical composition for treatment of cardiovascular and cerebrovascular diseases
Автори англійськоюWei Feng, Li Dekun, Luo Chongnian, Yue Hongshui, Chen Qingchuang, Huang Zhijuan
Назва патенту російськоюФармацевтическая композиция для лечения кардиоваскулярных и цереброваскулярных заболеваний
Автори російськоюВей Фенг, Ли Декун, Луо Ченгниан, Юе Хонгшуи, Чен Квингчуанг, Хуанг Жиджуан
МПК / Мітки
МПК: A61P 9/00, A61K 36/258, A61K 36/537, A61K 36/481, A61K 31/125
Мітки: фармацевтична, захворювань, кардіоваскулярних, композиція, лікування, цереброваскулярних
Код посилання
<a href="https://ua.patents.su/14-85065-farmacevtichna-kompoziciya-dlya-likuvannya-kardiovaskulyarnikh-i-cerebrovaskulyarnikh-zakhvoryuvan.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція для лікування кардіоваскулярних і цереброваскулярних захворювань</a>
Попередній патент: Статичний тиристорний компенсатор
Наступний патент: Спосіб приготування транс- або цис-діамонійдихлородигідроксоплатини (iv) і її застосування при одержанні фармацевтично активних речовин
Випадковий патент: Спосіб лікування хронічної гнійної рани