Інгібітори дипептидилпептидази iv, фармацевтична композиція на їх основі, композиція для лікування та спосіб лікування захворювань
Формула / Реферат
1. Сполука формули 1 або її фармацевтично прийнятна сіль
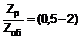 , 1
, 1
де:
X1 вибирають з атома сірки, атома кисню, сульфінільної групи, сульфонільної групи і метиленової групи;
X2 вибирають з O, S і метилену;
X3 є або NR5, або карбонільною, або тіокарбонільною групою;
R1 є або атомом водню, або нітрильною групою;
R2 і R3, незалежно, вибрані з H і C1-C6 алкілу, або разом можуть бути -(CH2)p-;
R4 є R4A, якщо X3 є NR5, і R4B, якщо X3 є карбонільною або тіокарбонільною групою;
R4A вибирають з R6R7NC(=O), R6R7NC(=S); R8(CH2)qC(=O), R8(CH2)qC(=S), R8(CH2)qSO2, R8(CH2)qOC(=O) і R8(CH2)qOC(=S);
R4B є R6R7N;
R5 є H або C1-C6 алкілом;
R6 і R7, незалежно, вибрані з R8(CH2)q, або разом є -(CH2)2-Z1-(CH2)2- або -CHR9-Z2-CH2-CHR10-;
R8 вибирають з H, С1-С4алкілу, бензоконденсованого цикло(С1-С6)алкілу, ацилу, ді(С1-С6)алкілкарбамоїлу, ді(С1-С6)алкіламіно, N-(С1-С6)алкілпіперидилу, необов’язково, заміщеного арилу, необов’язково, заміщеного ![]() -(С1-С6)алкілбензилу, необов’язково, заміщеного ароїлу, необов’язково, заміщеного арилсульфонілу і, необов’язково, заміщеного гетероарилу, де гетероарил означає моноциклічне п’яти- та шестичленне кільце ароматичних груп, які містять один або два гетероатоми, вибрані з азоту, кисню та сірки, бензоконденсовані похідні цих кілець, біциклічні групи, утворені шляхом злиття двох таких моноциклічних гетероароматичних груп;
-(С1-С6)алкілбензилу, необов’язково, заміщеного ароїлу, необов’язково, заміщеного арилсульфонілу і, необов’язково, заміщеного гетероарилу, де гетероарил означає моноциклічне п’яти- та шестичленне кільце ароматичних груп, які містять один або два гетероатоми, вибрані з азоту, кисню та сірки, бензоконденсовані похідні цих кілець, біциклічні групи, утворені шляхом злиття двох таких моноциклічних гетероароматичних груп;
R9 і R10, незалежно, вибрані з H, карбамоїлу, гідроксиметилу і ціанометилу;
Z1 вибирають з ковалентного зв’язку, -(CH2)r-, -O-, -SOt- і -N((CH2)qR8)-;
Z2 є, необов’язково, заміщеним орто-феніленовим замісником;
m є 1 – 3;
n є 0 – 4;
p є 2 – 5;
q є 0 – 3;
r є 1 або 2; і
t є 0 – 2;
необов‘язкові замісник(и), якщо присутні, вибирають з (С1-С6)алкілу, арилу, який може бути в свою чергу заміщений однією або більшою кількістю метильних або трифторметильних груп, гідроксигрупами, (С1-С6)алкілокси, (С1-С6)алкілсульфонільними, ацильними, перфторацильними групами, аміногрупами, (С1-С6)алкіламіногрупами, ді(С1-С6)алкіламіно, аміно(С1-С6)алкіленовими групами, фтором, хлором, бромом, трифторметильними групами, нітро, ціано групами, карбамоїльними групами, карбоксигрупами і (С1-С6)алкілоксикарбонільними і/або, коли присутні два сусідні замісники, два сусідні замісники можуть бути з‘єднані з утворенням кільця, приконденсованого до основного арильного або гетероарильного кільця,
за умови, що, якщо X2 є CH2, X3 є NH і R4 є R8CH2O(CO), тоді R8 не є незаміщеним фенілом або нітрофенілом; і що коли Х1 є СН2, R1 є Н, Х2 є СН2, Х3 є NH і R4 є R8(CH2)qC(=O), тоді R8(CH2)q не є метилом або етилом.
2. Сполука за пунктом 1, в якій R1 є нітрильною групою.
3. Сполука за пунктом 2, в якій стереохімія нітрильної групи відповідає показаній у формулі 2
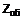 2
2
4. Сполука за пунктом 1 або 2, в якій стереохімічний центр, розташований поруч з первинним аміном, має S-конфігурацію, як показано у формулі 3
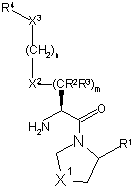 3
3
5. Сполука за пунктом 4, в якій R1 є нітрильною групою і стереохімія нітрильної групи показана у формулі 4
 4
4
6. Сполука за будь-яким з попередніх пунктів, в якій m є 1.
7. Сполука за будь-яким з попередніх пунктів, в якій R2 і R3 є, незалежно, H або метилом.
8. Сполука за будь-яким з попередніх пунктів, в якій m є 1, X2 є -CH2-, і R2 і R3 є обидва H.
9. Сполука за будь-яким з пунктів 1 – 7, в якій m є 1, X2 є -О-, і один з R2 і R3 є метилом і інший є H.
10. Сполука за будь-яким з пунктів 1 – 7, в якій m є 1, X2 є -S-, і R2 і R3 є обидва метилом.
11. Сполука за будь-яким з попередніх пунктів, в якій X3 є NH.
12. Сполука за пунктом 11, в якій m є 1, R2 і R3 є H, і n є 1 або 2.
13. Сполука за пунктом 12, в якій R4 є R8СO або R8HNCO, і R8 є, необов’язково, заміщеним гетероарилом, де необов‘язково заміщений гетероарил є таким, як визначено в пункті 1.
14. Сполука за будь-яким з пунктів 1 – 7, в якій m є 1, X2 є -CH2-, R2 і R3 є обидва H, n є 0, і X3 є CO.
15. Сполука за пунктом 14, в якій R4 є R6NH.
16. Сполука за пунктом 15, в якій R6 є, необов’язково, заміщеним гетероарилом, де необов‘язково заміщений гетероарил є таким, як визначено в пункті 1.
17. Сполука за пунктом 13 або пунктом 16, в якій гетероарильна група є незаміщеною або моно- або дизаміщеною, і замісники вибрані з C1-C6 алкілу, C1-C6 алкілокси, фтору, хлору і трифторметилу.
18. Сполука за пунктом 1, в якій R1 є CN, і X1 є CH2.
19. Сполука за пунктом 1, в якій R1 є H, і X1 є S.
20. Сполука за пунктом 1, в якій X3 є NH, і R4 вибирають з R6R7N(CO), R8(CH2)qCO і R8(CH2)qSO2.
21. Сполука за пунктом 1, вибрана з:
(2S)-1-[Nw-(піразиніл-2-карбоніл)-L-орнітиніл]піролідин-2-карбонітрилу,
(2S)-1-[Nw-(піразиніл-2-карбоніл)-L-лізиніл]піролідин-2-карбонітрилу,
(4R)-3-[Nw-(піразиніл-2-карбоніл)-L-лізиніл]тіазолідин-4-карбонітрилу,
(2S)-1-[Nw-(піридил-3-метил)-L-глутамініл]піролідин-2-карбонітрилу,
1-[Nw-(піразиніл-2-карбоніл)-L-орнітиніл]піролідину,
(2S)-1-[S-(ацетиламінометил)-L-цистеїніл]піролідин-2-карбонітрилу,
3-[Nw-(2-хлорпіридил-3-карбоніл)-L-орнітиніл]тіазолідину,
1-[Nw-(2-хлорпіридил-3-карбоніл)-L-орнітиніл]піролідину,
(2S)-1-[Nw-(2-хлорпіридил-3-карбоніл)-L-орнітиніл]піролідин-2-карбонітрилу,
3-[Nw-(піразиніл-2-карбоніл)-L-орнітиніл]тіазолідину,
3-[Nw-(2-хіноксалоїл)-L-лізиніл]тіазолідину,
(2S)-1-[(2'R)-3'-(ацетиламінометилтіо)-2'-аміно-3'-метилбутаноїл]піролідин-2-карбонітрилу,
(2S)-1-[S-(3-піколікарбамоїлметил)-L-цистеїніл]піролідин-2-карбонітрилу,
3-[Nw-(3-піридилоксикарбоніл)-L-орнітиніл]тіазолідину і
3-[O-(3-хлорбензилкарбамоїл)сериніл]тіазолідину.
22. Сполука згідно з будь-яким з пунктів 1-21, для одержання фармацевтичної композиції для лікування, принаймні, одного з захворювань: діабет типу 2, зменшена толерантність до глюкози, брак гормону росту, синдром полікістозу яєчників, аутоімунне і запальне захворювання.
23. Сполука згідно з будь-яким з пунктів 1-21, для лікування, принаймні, одного з захворювань: діабет типу 2, зменшена толерантність до глюкози, брак гормону росту, синдром полікістозу яєчників, аутоімунне і запальне захворювання.
24. Фармацевтична композиція для застосування у лікуванні людини, яка містить, принаймні, одну сполуку за будь-яким з попередніх пунктів.
25. Композиція для лікування, принаймні, одного з захворювань: діабет типу 2, зменшена толерантність до глюкози, брак гормону росту, синдром полікістозу яєчників, аутоімунні і запальні захворювання, що містить принаймні одну сполуку, вибрану з похідних формули 1, їх таутомерів і стереоізомерів, і фармацевтично прийнятних солей зазначених похідних, таутомерів і ізомерів, згідно з будь-яким з пунктів 1 – 21,
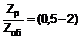 ,
,
де:
X1 вибирають з атома сірки, атома кисню, сульфінільної групи, сульфонільної групи і метиленової групи;
X2 вибирають з O, S і метилену;
X3 є або NR5, або карбонільною, або тіокарбонільною групою;
R1 є або атомом водню, або нітрильною групою;
R2 і R3, незалежно, вибрані з H і C1-C6 алкілу, або разом можуть бути -(CH2)p-;
R4 є R4A, якщо X3 є NR5, і R4B, якщо X3 є карбонільною або тіокарбонільною групою;
R4A вибирають з R6R7NC(=O), R6R7NC(=S); R8(CH2)qC(=O), R8(CH2)qC(=S), R8(CH2)qSO2, R8(CH2)qOC(=O) і R8(CH2)qOC(=S);
R4B є R6R7N;
R5 є H або C1-C6 алкілом;
R6 і R7, незалежно, вибрані з R8(CH2)q, або разом є -(CH2)2-Z1-(CH2)2- або -CHR9-Z2-CH2-CHR10-;
R8 вибирають з H, С1-С4алкілу, бензоконденсованого цикло(С1-С6)алкілу, ацилу, ді(С1-С6)алкілкарбамоїлу, ді(С1-С6)алкіламіно, N-(С1-С6)алкілпіперидилу, необов’язково, заміщеного арилу, необов’язково, заміщеного ![]() -(С1-С6)алкілбензилу, необов’язково, заміщеного ароїлу, необов’язково, заміщеного арилсульфонілу і, необов’язково, заміщеного гетероарилу, де гетероарил означає моноциклічне п’яти- та шестичленне кільце ароматичних груп, які містять один або два гетероатоми, вибрані з азоту, кисню та сірки, бензоконденсовані похідні цих кілець, біциклічні групи, утворені шляхом злиття двох таких моноциклічних гетероароматичних груп;
-(С1-С6)алкілбензилу, необов’язково, заміщеного ароїлу, необов’язково, заміщеного арилсульфонілу і, необов’язково, заміщеного гетероарилу, де гетероарил означає моноциклічне п’яти- та шестичленне кільце ароматичних груп, які містять один або два гетероатоми, вибрані з азоту, кисню та сірки, бензоконденсовані похідні цих кілець, біциклічні групи, утворені шляхом злиття двох таких моноциклічних гетероароматичних груп;
R9 і R10, незалежно, вибрані з H, карбамоїлу, гідроксиметилу і ціанометилу;
Z1 вибирають з ковалентного зв’язку, -(CH2)r-, -O-, -SOt- і -N((CH2)qR8)-;
Z2 є, необов’язково, заміщеним орто-феніленовим замісником;
m є 1 – 3;
n є 0 – 4;
p є 2 – 5;
q є 0 – 3;
r є 1 або 2; і
t є 0 – 2;
необов‘язкові замісник(и), якщо присутні, вибирають з (С1-С6)алкілу, арилу, який може бути в свою чергу заміщений однією або більшою кількістю метильних або трифторметильних груп, гідроксигрупами, (С1-С6)алкілокси, (С1-С6)алкілсульфонільними, ацильними, перфторацильними групами, аміногрупами, (С1-С6)алкіламіногрупами, ді(С1-С6)алкіламіно, аміно(С1-С6)алкіленовими групами, фтором, хлором, бромом, трифторметильними групами, нітро, ціано групами, карбамоїльними групами, карбоксигрупами і (С1-С6)алкілоксикарбонільними і/або, коли присутні два сусідні замісники, два сусідні замісники можуть бути з‘єднані з утворенням кільця, приконденсованого до основного арильного або гетероарильного кільця,
за умови, що, якщо X2 є CH2, X3 є NH і R4 є R8CH2O(CO), тоді R8 не є незаміщеним фенілом або нітрофенілом.
26. Спосіб лікування принаймні одного з захворювань: діабет типу 2, зменшена толерантність до глюкози, брак гормону росту, полікістоз яєчників, аутоімунні і запальні захворювання, який включає призначення пацієнту, якому необхідне таке лікування, терапевтично ефективної кількості принаймні однієї сполуки, яка вибрана з похідних формули 1, їх таутомерів і стереоізомерів, і фармацевтично прийнятних солей зазначених похідних, таутомерів і ізомерів, згідно з будь-яким з пунктів 1 – 21,
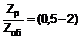 ,
,
де:
X1 вибирають з атома сірки, атома кисню, сульфінільної групи, сульфонільної групи і метиленової групи;
X2 вибирають з O, S і метилену;
X3 є або NR5, або карбонільною, або тіокарбонільною групою;
R1 є або атомом водню, або нітрильною групою;
R2 і R3, незалежно, вибрані з H і C1-C6 алкілу, або разом можуть бути -(CH2)p-;
R4 є R4A, якщо X3 є NR5, і R4B, якщо X3 є карбонільною або тіокарбонільною групою;
R4A вибирають з R6R7NC(=O), R6R7NC(=S); R8(CH2)qC(=O), R8(CH2)qC(=S), R8(CH2)qSO2, R8(CH2)qOC(=O) і R8(CH2)qOC(=S);
R4B є R6R7N;
R5 є H або C1-C6 алкілом;
R6 і R7, незалежно, вибрані з R8(CH2)q, або разом є -(CH2)2-Z1-(CH2)2- або -CHR9-Z2-CH2-CHR10-;
R8 вибирають з H, С1-С4алкілу, бензоконденсованого цикло(С1-С6)алкілу, ацилу, ді(С1-С6)алкілкарбамоїлу, ді(С1-С6)алкіламіно, N-(С1-С6)алкілпіперидилу, необов’язково, заміщеного арилу, необов’язково, заміщеного ![]() -(С1-С6)алкілбензилу, необов’язково, заміщеного ароїлу, необов’язково, заміщеного арилсульфонілу і, необов’язково, заміщеного гетероарилу, де гетероарил означає моноциклічне п’яти- та шестичленне кільце ароматичних груп, які містять один або два гетероатоми, вибрані з азоту, кисню та сірки, бензоконденсовані похідні цих кілець, біциклічні групи, утворені шляхом злиття двох таких моноциклічних гетероароматичних груп;
-(С1-С6)алкілбензилу, необов’язково, заміщеного ароїлу, необов’язково, заміщеного арилсульфонілу і, необов’язково, заміщеного гетероарилу, де гетероарил означає моноциклічне п’яти- та шестичленне кільце ароматичних груп, які містять один або два гетероатоми, вибрані з азоту, кисню та сірки, бензоконденсовані похідні цих кілець, біциклічні групи, утворені шляхом злиття двох таких моноциклічних гетероароматичних груп;
R9 і R10, незалежно, вибрані з H, карбамоїлу, гідроксиметилу і ціанометилу;
Z1 вибирають з ковалентного зв’язку, -(CH2)r-, -O-, -SOt- і -N((CH2)qR8)-;
Z2 є, необов’язково, заміщеним орто-феніленовим замісником;
m є 1 – 3;
n є 0 – 4;
p є 2 – 5;
q є 0 – 3;
r є 1 або 2; і
t є 0 – 2;
необов‘язкові замісник(и), якщо присутні, вибирають з (С1-С6)алкілу, арилу, який може бути в свою чергу заміщений однією або більшою кількістю метильних або трифторметильних груп, гідроксигрупами, (С1-С6)алкілокси, (С1-С6)алкілсульфонільними, ацильними, перфторацильними групами, аміногрупами, (С1-С6)алкіламіногрупами, ді(С1-С6)алкіламіно, аміно(С1-С6)алкіленовими групами, фтором, хлором, бромом, трифторметильними групами, нітро, ціано групами, карбамоїльними групами, карбоксигрупами і (С1-С6)алкілоксикарбонільними і/або, коли присутні два сусідні замісники, два сусідні замісники можуть бути з‘єднані з утворенням кільця, приконденсованого до основного арильного або гетероарильного кільця,
за умови, що, якщо X2 є CH2, X3 є NH і R4 є R8CH2O(CO), тоді R8 не є незаміщеним фенілом або нітрофенілом.
Текст
1. Сполука формули 1 або її фармацевтично прийнятна сіль 2 3 75592 4 4 R6 і R7, незалежно, вибрані з R8(CH2)q, або разом є R -(CH2)2-Z1-(CH2)2- або -CHR9-Z2-CH2-CHR10-; X3 8 R вибирають з H, С1-С4алкілу, бензоконденсованого цикло(С1-С6)алкілу, ацилу, ді(С1(CH2)n С6)алкілкарбамоїлу, ді(С1-С6)алкіламіно, N-(С1С6)алкілпіперидилу, необов‟язково, заміщеного арилу, необов‟язково, заміщеного -(С1X2 (CR2R3)m С6)алкілбензилу, необов‟язково, заміщеного ароїлу, необов‟язково, заміщеного арилсульфонілу і, O необов‟язково, заміщеного гетероарилу, де гетеH2N роарил означає моноциклічне п‟яти- та шестичленне кільце ароматичних груп, які містять один N CN або два гетероатоми, вибрані з азоту, кисню та сірки, бензоконденсовані похідні цих кілець, біцик1 X лічні групи, утворені шляхом злиття двох таких 2 моноциклічних гетероароматичних груп; 4. Сполука за пунктом 1 або 2, в якій стереохімічR9 і R10, незалежно, вибрані з H, карбамоїлу, гідроний центр, розташований поруч з первинним аміксиметилу і ціанометилу; ном, має S-конфігурацію, як показано у формулі 3 Z1 вибирають з ковалентного зв‟язку, -(CH2)r-, -O-, R4 SOt- і -N((CH2)qR8)-; X3 Z2 є, необов‟язково, заміщеним орто-феніленовим замісником; (CH2)n m є 1 – 3; n є 0 – 4; X2 (CR2R3)m p є 2 – 5; q є 0 – 3; O r є 1 або 2; і H2 N t є 0 – 2; N необов„язкові замісник(и), якщо присутні, вибираR1 ють з (С1-С6)алкілу, арилу, який може бути в свою чергу заміщений однією або більшою кількістю 1 X метильних або трифторметильних груп, гідроксиг3 рупами, (С1-С6)алкілокси, (С15. Сполука за пунктом 4, в якій R1 є нітрильною С6)алкілсульфонільними, ацильними, перфторагрупою і стереохімія нітрильної групи показана у цильними групами, аміногрупами, (С1формулі 4 С6)алкіламіногрупами, ді(С1-С6)алкіламіно, аміR4 но(С1-С6)алкіленовими групами, фтором, хлором, X3 бромом, трифторметильними групами, нітро, ціано групами, карбамоїльними групами, карбоксигру(CH2)n пами і (С1-С6)алкілоксикарбонільними і/або, коли присутні два сусідні замісники, два сусідні замісниX2 (CR2R3)m ки можуть бути з„єднані з утворенням кільця, приконденсованого до основного арильного або гетеO роарильного кільця, 2 3 4 H2 N за умови, що, якщо X є CH2, X є NH і R є N R8CH2O(CO), тоді R8 не є незаміщеним фенілом CN або нітрофенілом; і що коли Х1 є СН2, R1 є Н, Х2 є 3 4 8 8 1 СН2, Х є NH і R є R (CH2)qC(=O), тоді R (CH2)q не X 4 є метилом або етилом. 6. Сполука за будь-яким з попередніх пунктів, в 2. Сполука за пунктом 1, в якій R1 є нітрильною якій m є 1. групою. 7. Сполука за будь-яким з попередніх пунктів, в 3. Сполука за пунктом 2, в якій стереохімія нітриякій R2 і R3 є, незалежно, H або метилом. льної групи відповідає показаній у формулі 2 8. Сполука за будь-яким з попередніх пунктів, в якій m є 1, X2 є -CH2-, і R2 і R3 є обидва H. 9. Сполука за будь-яким з пунктів 1 – 7, в якій m є 1, X2 є -О-, і один з R2 і R3 є метилом і інший є H. 10. Сполука за будь-яким з пунктів 1 – 7, в якій m є 1, X2 є -S-, і R2 і R3 є обидва метилом. 11. Сполука за будь-яким з попередніх пунктів, в якій X3 є NH. 12. Сполука за пунктом 11, в якій m є 1, R2 і R3 є H, і n є 1 або 2. 13. Сполука за пунктом 12, в якій R4 є R8СO або R8HNCO, і R8 є, необов‟язково, заміщеним гетеро 5 75592 6 арилом, де необов„язково заміщений гетероарил є рювання, що містить принаймні одну сполуку, вибтаким, як визначено в пункті 1. рану з похідних формули 1, їх таутомерів і стереоі14. Сполука за будь-яким з пунктів 1 – 7, в якій m є зомерів, і фармацевтично прийнятних солей за1, X2 є -CH2-, R2 і R3 є обидва H, n є 0, і X3 є CO. значених похідних, таутомерів і ізомерів, згідно з 15. Сполука за пунктом 14, в якій R4 є R6NH. будь-яким з пунктів 1 – 21, 6 R4 16. Сполука за пунктом 15, в якій R є, неоX3 бов‟язково, заміщеним гетероарилом, де необов„язково заміщений гетероарил є таким, як визначено в пункті 1. (CH2)n 17. Сполука за пунктом 13 або пунктом 16, в якій гетероарильна група є незаміщеною або моноX2 (CR2R3)m або дизаміщеною, і замісники вибрані з C1-C6 алкілу, C1-C6 алкілокси, фтору, хлору і трифторметиO лу. 1 1 H2N 18. Сполука за пунктом 1, в якій R є CN, і X є N R1 CH2. 1 1 19. Сполука за пунктом 1, в якій R є H, і X є S. 1 20. Сполука за пунктом 1, в якій X3 є NH, і R4 вибиX , 6 7 8 8 рають з R R N(CO), R (CH2)qCO і R (CH2)qSO2. де: 21. Сполука за пунктом 1, вибрана з: X1 вибирають з атома сірки, атома кисню, сульфі(2S)-1-[N -(піразиніл-2-карбоніл)-Lнільної групи, сульфонільної групи і метиленової орнітиніл]піролідин-2-карбонітрилу, групи; (2S)-1-[N -(піразиніл-2-карбоніл)-LX2 вибирають з O, S і метилену; лізиніл]піролідин-2-карбонітрилу, X3 є або NR5, або карбонільною, або тіокарбоніль(4R)-3-[N -(піразиніл-2-карбоніл)-Lною групою; лізиніл]тіазолідин-4-карбонітрилу, R1 є або атомом водню, або нітрильною групою; (2S)-1-[N -(піридил-3-метил)-LR2 і R3, незалежно, вибрані з H і C1-C6 алкілу, або глутамініл]піролідин-2-карбонітрилу, разом можуть бути -(CH2)p-; R4 є R4A, якщо X3 є NR5, і R4B, якщо X3 є карбоніль1-[N -(піразиніл-2-карбоніл)-L-орнітиніл]піролідину, ною або тіокарбонільною групою; (2S)-1-[S-(ацетиламінометил)-LR4A вибирають з R6R7NC(=O), R6R7NC(=S); цистеїніл]піролідин-2-карбонітрилу, R8(CH2)qC(=O), R8(CH2)qC(=S), R8(CH2)qSO2, 3-[N -(2-хлорпіридил-3-карбоніл)-L8 8 R (CH2)qOC(=O) і R (CH2)qOC(=S); орнітиніл]тіазолідину, R4B є R6R7N; 1-[N -(2-хлорпіридил-3-карбоніл)-LR5 є H або C1-C6 алкілом; орнітиніл]піролідину, R6 і R7, незалежно, вибрані з R8(CH2)q, або разом є (2S)-1-[N -(2-хлорпіридил-3-карбоніл)-L-(CH2)2-Z1-(CH2)2- або -CHR9-Z2-CH2-CHR10-; орнітиніл]піролідин-2-карбонітрилу, R8 вибирають з H, С1-С4алкілу, бензоконденсова3-[N -(піразиніл-2-карбоніл)-Lного цикло(С1-С6)алкілу, ацилу, ді(С1орнітиніл]тіазолідину, С6)алкілкарбамоїлу, ді(С1-С6)алкіламіно, N-(С13-[N -(2-хіноксалоїл)-L-лізиніл]тіазолідину, С6)алкілпіперидилу, необов‟язково, заміщеного (2S)-1-[(2'R)-3'-(ацетиламінометилтіо)-2'-аміно-3'арилу, необов‟язково, заміщеного -(С1метилбутаноїл]піролідин-2-карбонітрилу, С6)алкілбензилу, необов‟язково, заміщеного арої(2S)-1-[S-(3-піколікарбамоїлметил)-Lлу, необов‟язково, заміщеного арилсульфонілу і, цистеїніл]піролідин-2-карбонітрилу, необов‟язково, заміщеного гетероарилу, де гете3-[N -(3-піридилоксикарбоніл)-Lроарил означає моноциклічне п‟яти- та шестичорнітиніл]тіазолідину і ленне кільце ароматичних груп, які містять один 3-[O-(3-хлорбензилкарбамоїл)сериніл]тіазолідину. або два гетероатоми, вибрані з азоту, кисню та 22. Сполука згідно з будь-яким з пунктів 1-21, для сірки, бензоконденсовані похідні цих кілець, біцикодержання фармацевтичної композиції для лікулічні групи, утворені шляхом злиття двох таких вання, принаймні, одного з захворювань: діабет моноциклічних гетероароматичних груп; типу 2, зменшена толерантність до глюкози, брак R9 і R10, незалежно, вибрані з H, карбамоїлу, гідрогормону росту, синдром полікістозу яєчників, аутоксиметилу і ціанометилу; імунне і запальне захворювання. Z1 вибирають з ковалентного зв‟язку, -(CH2)r-, -O-, 23. Сполука згідно з будь-яким з пунктів 1-21, для SOt- і -N((CH2)qR8)-; лікування, принаймні, одного з захворювань: діаZ2 є, необов‟язково, заміщеним орто-феніленовим бет типу 2, зменшена толерантність до глюкози, замісником; брак гормону росту, синдром полікістозу яєчників, m є 1 – 3; аутоімунне і запальне захворювання. n є 0 – 4; 24. Фармацевтична композиція для застосування у p є 2 – 5; лікуванні людини, яка містить, принаймні, одну q є 0 – 3; сполуку за будь-яким з попередніх пунктів. r є 1 або 2; і 25. Композиція для лікування, принаймні, одного з t є 0 – 2; захворювань: діабет типу 2, зменшена толерантнеобов„язкові замісник(и), якщо присутні, вибираність до глюкози, брак гормону росту, синдром ють з (С1-С6)алкілу, арилу, який може бути в свою полікістозу яєчників, аутоімунні і запальні захвочергу заміщений однією або більшою кількістю 7 75592 8 метильних або трифторметильних груп, гідроксигR4A вибирають з R6R7NC(=O), R6R7NC(=S); рупами, (С1-С6)алкілокси, (С1R8(CH2)qC(=O), R8(CH2)qC(=S), R8(CH2)qSO2, 8 8 С6)алкілсульфонільними, ацильними, перфтораR (CH2)qOC(=O) і R (CH2)qOC(=S); цильними групами, аміногрупами, (С1R4B є R6R7N; С6)алкіламіногрупами, ді(С1-С6)алкіламіно, аміR5 є H або C1-C6 алкілом; 6 7 8 но(С1-С6)алкіленовими групами, фтором, хлором, R і R , незалежно, вибрані з R (CH2)q, або разом є 1 9 2 бромом, трифторметильними групами, нітро, ціано -(CH2)2-Z -(CH2)2- або -CHR -Z -CH2-CHR10-; групами, карбамоїльними групами, карбоксигруR8 вибирають з H, С1-С4алкілу, бензоконденсовапами і (С1-С6)алкілоксикарбонільними і/або, коли ного цикло(С1-С6)алкілу, ацилу, ді(С1присутні два сусідні замісники, два сусідні замісниС6)алкілкарбамоїлу, ді(С1-С6)алкіламіно, N-(С1ки можуть бути з„єднані з утворенням кільця, приС6)алкілпіперидилу, необов‟язково, заміщеного конденсованого до основного арильного або гетеарилу, необов‟язково, заміщеного -(С1роарильного кільця, С6)алкілбензилу, необов‟язково, заміщеного ароїза умови, що, якщо X2 є CH2, X3 є NH і R4 є лу, необов‟язково, заміщеного арилсульфонілу і, R8CH2O(CO), тоді R8 не є незаміщеним фенілом необов‟язково, заміщеного гетероарилу, де гетеабо нітрофенілом. роарил означає моноциклічне п‟яти- та шестич26. Спосіб лікування принаймні одного з захворюленне кільце ароматичних груп, які містять один вань: діабет типу 2, зменшена толерантність до або два гетероатоми, вибрані з азоту, кисню та глюкози, брак гормону росту, полікістоз яєчників, сірки, бензоконденсовані похідні цих кілець, біцикаутоімунні і запальні захворювання, який включає лічні групи, утворені шляхом злиття двох таких призначення пацієнту, якому необхідне таке лікумоноциклічних гетероароматичних груп; вання, терапевтично ефективної кількості принайR9 і R10, незалежно, вибрані з H, карбамоїлу, гідромні однієї сполуки, яка вибрана з похідних формуксиметилу і ціанометилу; 1 ли 1, їх таутомерів і стереоізомерів, і Z вибирають з ковалентного зв‟язку, -(CH2)r-, -O-, фармацевтично прийнятних солей зазначених SOt- і -N((CH2)qR8)-; похідних, таутомерів і ізомерів, згідно з будь-яким Z2 є, необов‟язково, заміщеним орто-феніленовим з пунктів 1 – 21, замісником; R4 m є 1 – 3; X3 n є 0 – 4; p є 2 – 5; (CH2)n q є 0 – 3; r є 1 або 2; і X2 (CR2R3)m t є 0 – 2; необов„язкові замісник(и), якщо присутні, вибираO ють з (С1-С6)алкілу, арилу, який може бути в свою H2N чергу заміщений однією або більшою кількістю 1 N R метильних або трифторметильних груп, гідроксигрупами, (С1-С6)алкілокси, (С11 X , С6)алкілсульфонільними, ацильними, перфтораде: цильними групами, аміногрупами, (С1X1 вибирають з атома сірки, атома кисню, сульфіС6)алкіламіногрупами, ді(С1-С6)алкіламіно, амінільної групи, сульфонільної групи і метиленової но(С1-С6)алкіленовими групами, фтором, хлором, групи; бромом, трифторметильними групами, нітро, ціано X2 вибирають з O, S і метилену; групами, карбамоїльними групами, карбоксигруX3 є або NR5, або карбонільною, або тіокарбонільпами і (С1-С6)алкілоксикарбонільними і/або, коли ною групою; присутні два сусідні замісники, два сусідні замісни1 R є або атомом водню, або нітрильною групою; ки можуть бути з„єднані з утворенням кільця, приR2 і R3, незалежно, вибрані з H і C1-C6 алкілу, або конденсованого до основного арильного або гетеразом можуть бути -(CH2)p-; роарильного кільця, R4 є R4A, якщо X3 є NR5, і R4B, якщо X3 є карбонільза умови, що, якщо X2 є CH2, X3 є NH і R4 є ною або тіокарбонільною групою; R8CH2O(CO), тоді R8 не є незаміщеним фенілом або нітрофенілом. Даний винахід стосується ряду нових сполук, які є інгібіторами ензиму дипетидилпептидаза IV, фармацевтичних композицій, які включають ці інгібітори, а також застосування композицій у лікуванні захворювань у людини. Ензим дипептидилпептидаза IV, для якого вживається тут скорочення ДП-IV (та у деяких місцях ДАП-IV або ДПП-IV), та який відомий за класифікацією як ЕС.3.4.14.5, є серинпротеазою, яка відрізає N-термінальний дипептид від пептидів, які починаються послідовністю Н-Xaa-Pro (в якій Хаа є будь-якою амінокислотою, хоча переважною є ліпофільна, і Pro є проліном). Він також буде прийматись як субстратні пептиди, які починаються послідовністю Н-Хаа-АІа (в якій Ala є аланіном). ДП-IV спочатку виявили як мембран-зв'язаний протеїн. Нещодавно виявили його розчинну форму. 9 75592 10 Спочатку інтерес до ДП-IV фокусувався на її або >C=S; R4A вибирають з R6R7NC(=O), ролі у активації Τ лімфоцитів. ДП-IV ідентична R6R7NC(=S); R8(CH2)qC(=O), R8(CH2)qC(=S), 8 8 8 протеїну Т-клітин CD26. Була висунута думка, що R (CH2)qSO2, R (CH2)qOC(=S) і R (CH2)qOC(=O); інгібітори ДП-IV здатні модулювати здатність до R4B є R6R7N; R5 є Η або нижчим алкілом; R6 і R7 відповіді Т-клітин, і тому можуть бути розроблені в кожний є, незалежно, R8(CH2)q, або разом є 8 якості нових імуномодуляторів. Також було при(CH2)2-Z-(СН2)2-; R вибирають з Н, алкілу, необопущено, що CD26 є необхідним співрецептором в'язково, заміщеного арилу, необов'язково, заміпри ВІЛ, і тому інгібітори ДП-IV можуть бути корисщеного ароїлу, необов'язково, заміщеного арилсуними у лікуванні СНІДу. льфонілу і, необов'язково, заміщеного Увагу приділили ролі ДП-IV поза межами імунгетероарилу; Ζ вибирають з ковалентного зв'язку, ної системи. Було визнано, що ДП-IV виконує про(СН2)r-, -О-, -SOt- і -N((CH2)qR8)-; n є 0-4; p є 2-5; q є відну роль в деградації декількох пептидних гор0-3; r є 1 або 2; і t є 0-2. монів, включаючи гормон, що вивільнює гормон У першому втіленні, даний винахід включає росту (ГВГР), глюкагон-подібний пептид-1 і -2 ряд нових сполук, які є інгібіторами ензиму ДП-ІV і (ГПП-1 і ГПП-2). Через те, що відомо, що ГПП-1 є корисними у лікуванні певних хвороб людини. підсилює дію інсуліну при регулюванні рівню глюСполуки описані загальною формулою 1. кози у крові після прийому їжі, зрозуміло, що інгібітори ДП-IV повинні бути також корисними у лікуванні діабету типу II і зменшеної толерантності до глюкози. Принаймні два інгібітори ДП-IV проходять зараз клінічні дослідження, направленні на вивчення їх можливостей. Деякі групи описали інгібітори ДП-IV. В той час як деякі результати були одержані використовуючи програми випадкового скринінгу, основна частина роботи у цьому напрямку була направлена на дослідження субстратних аналогів. Інгібітори ДПIV, які є субстратними аналогами, описані, наприВ загальній формулі 1, X1 є двовалентною груклад, в US 5,462,928, US 5,543,396, W095/15309 пою, вибраною з атому сірки (-S-), атому кисню ((відповідає US 5,939,560 і ЕР 0731789), О-), сульфінільної групи (-SO-), сульфонільної груW098/19998 (відповідає US 6,011,155), пи (-SO2-) і метиленової групи (-СН2-). X2 є двоваW099/46272 і W099/61431. Найбільш ймовірними лентною групою, вибраною з атому кисню (-О-), інгібіторами є аміноакрилпіролідинборні кислоти, атому сірки (-S-) і метиленової групи (-СН2-). X3 є але вони не є стабільними і схильні до циклізації, в або заміщеною іміногрупою (-NR5-), або карбонітой час як більш стабільні похідні піролідину і тіальною (>С=О) або тіокарбонільною (>C=S) групою. золідину менш подібні до ензиму, і тому у лікуванні R1 є або атомом водню (Н), або нітрильною слід використовувати більші дози. Піролідиннітригрупою (-CN). ли є гарним компромісом через їх високу подібR2 і R3 можуть, кожний незалежно один від одність до ензиму та достатньо довгий час напіврозного, бути атомом водню, або нижчим алкілом, або кладу у розчині у вигляді вільної основи. Але, разом вони можуть бути ланцюгом з 2-5 метилеоднак, залишається необхідність у інгібіторах ДПнових груп (-(СН2)р-, де ρ знаходиться у межах 2-5) IV з покращеними властивостями. з утворенням, разом з атомом вуглецю, до якого Даний винахід стосується ряду інгібіторів ДПвони приєднані, трьох-, чотирьох-, п'яти- або шесIV з підвищеною спорідненістю до ензиму. Сполуки ти- членного кільця. Значення m може бути 1, 2 можуть застосовуватись у лікуванні ряду хвороб або 3. Якщо m більше ніж 1, тоді кожна CR2R3 грулюдини, включно зі зменшеною толерантністю до па може бути однаковою або відмінною. Наприглюкози та діабетом типу II. Відповідно, винахід клад, якщо m є 2, тоді (CR2R3)2 може бути СН2СН2, також стосується застосування сполук для одерСН2С(Ме)2, С(Ме)2СН2 і тому подібне. жання фармацевтичних композицій, власне до Природа R4 залежить від X3 таким чином, що таких композицій, та до застосування таких комподві групи з'єднані амідним (CO-N), тіоамідним (CSзицій у лікуванні людей. Сполуки згідно з даним N) або сульфонамідним (SO2-N) зв'язком. Таким винаходом описані загальною формулою 1. чином, якщо X3 є заміщеною іміногрупою (-NR5-), В загальній формулі 1, X1 вибирають з -S-, -О-, -SO-, -SO2- і -СН2-; X2 вибирають з -О-, -S-, -NH- і СН2-; X3 є або -NR5- або >С=О, або >C=S групою; R1 є або Н, або -CN; R2 і R3, незалежно, вибрані з Η і нижчого алкілу, або разом можуть бути -(СН2)р-; R4 є R4A, якщо X3 є -NR5-, і R4B, якщо X3 є >С=О тоді R4 є R4A, де R4A вибирають з карбамоїльних груп (R6R7NC(=O)), тіокарбамоїльних груп 6 7 (R R NC(=S)); необов'язково, модифікованих ацильних груп (R8(CH2)qC(=O), необов'язково, модифікованих тіоацильних груп (R8(CH2)qC(=S)), сульфонільних груп (R8(CH2)qSO2), необов'язково, модифікованих (алкіл або арилокси)карбонільних 8 груп (R (CH2)qOC(=O)) і, необов'язково, модифікованих (алкіл або арилокси)тіокарбонільних груп (R8(CH2)qOC(=S)). Як він використовується тут, термін "необов'язково, модифікований" вживається для зазначення того, що деякі втілення R8 виходять за об'єми термінів "алкіл", "ацил" і "арил". Об'єм визначення R4A обумовлений об'ємом ви 11 75592 12 значення R8. Альтернативно, якщо X3 є карбоніль(циклопропіл)етил, 3,3-диметилциклобутил і біцикною (>С=О) або тіокарбонільною (>C=S) групою, ло[3.1.0]гексил. тоді R4 є R4B, якщо R4B є заміщеною аміногрупою Термін "гетероарил" включає моноциклічне (R6R7N). п'яти- та шести- членне кільце ароматичних груп, R5 є атомом водню (Н), або нижчим алкілом. які містять один або два гетероатоми, вибрані з 5 Переважно, R є Н. азоту, кисню та сірки. Таким чином, гетероарильні R6 і R7 можуть, кожний незалежно один від одгрупи включають піридил, піридиазиніл, піримідиного, бути R8(CH2)q. Альтернативно, вони можуть ніл, піразиніл, піроліл, тієніл, фурил, імідазоліл, разом бути групою -(CH2)2-Z1-(CH2)2-, або -CHR9піразоліл, тіазоліл, ізотіазоліл, оксазоліл і ізоксаCH2-CR10-. У цьому випадку Ζ1 є ковалентним зв'язоліл. Термін "гетероарил" також включає бензозком, метиленовою або етиліденовою групою (конденсовані похідні цих кілець, такі як хінолініл, (СН2)r-, де r є 1 або 2), атомом кисню (-О-), атомом ізохінолініл, хіноксалініл, хіназолініл, фталазиніл, сірки або окисленої сірки (-SO,- де t є нулем, 1 або цинолініл, індоліл, ізоіндоліл, бензотіазоліл і тому 2), або заміщеною іміногрупою (-N((CH2)qR8)-), так подібне, а також біциклічні групи, утворені шляхом що група NR6R7 є піролідиновим, піперидиновим, злиття двох таких моноциклічних гетероароматичпергідроазепіновим, морфоліновим, необов'язконих груп. во, окисленим тіоморфоліновим, або заміщеним Термін "арил" включає феніл, нафтил і гетепіперазиновим кільцем. Z2 є орто-феніленовим роарил. замісником (-С6Н4-) так що група NR6R7 є тетрагідСполуки загальної формули 1 мають принайроізохіноліном. мні один стереогенний центр, і тому можуть проR8 вибирають з атому водню (Н), нижчого алявляти оптичний ізомеризм. Усі такі ізомери, вклюкілу, бензоконденсованого нижчого циклоалкілу чно з енантіомерами, діастереомерами і (такого як інданільна група), ацильної (нижчий алепімерами, включені у об'єм даного винаходу. Крім кіл-СО) групи, ди(нижчий алкіл)аміногрупи, того, винахід включає такі сполуки як окремі ізоди(нижчий алкіл)карбамоїльної групи, N-(нижчий мери та суміші, включно з рацематами. Деякі споалкіл)піперидинільної групи, необов'язково, замілуки загальної формули 1, включаючи ті, в яких гетроарильна група несе гідрокси або аміно замісщеної -алкілбензильної групи, необов'язково, ник, можуть існувати у вигляді таутомерів. Ці таузаміщеної фенільної, нафтильної або гетероаритомери, або окремо, або у вигляді сумішей, також льної групи, і, необов'язково, заміщеної ароїльної включені до об'єму даного винаходу. (арил-СО), або арилсульфонільної (арил-SО2) груСполуки загальної формули 1 мають принайпи. У вищенаведеному придатними необов'язкомні одну основну функціональну групу. Вони тому вими замісниками є нижчий алкіл, арил, які можуть можуть утворювати адитивні солі з кислотами. Такі бути в свою чергу заміщеними одною або більшою адитивні солі, одержані з фармацевтично прийнякількістю метильних або триформетильних груп, тними кислотами, включені до об'єму даного винагідроксигрупами, нижчими алкілокси, нижчими алходу. Прикладами придатних кислот є оцтова кискілсульфонільними, ацильними, перфторацильнилота, трифтороцтова кислота, лимонна кислота, ми групами, аміногрупами, нижчими алкіламіногфумарова кислота, бензойна кислота, памоїнова рупами, ди(нижчий алкіл)аміно, аміноалкіленовими кислота, метансульфонова кислота, соляна кислогрупами, фтором, хлором, бромом, трифторметита, азотна кислота, сірчана кислота, фосфорна льними групами, нітро, ціано групами, карбамоїлькислота і тому подібні. ними групами, карбокси групами і нижчими алкілоДеякі сполуки загальної формули 1 мають киксикарбонільними групами. Крім того, два сусідні слотну групу, тому можуть утворювати солі з оснозамісники можуть бути приєднані з утворенням вами. Прикладами таких солей є солі натрію, калію кільця, приконденсованого до початкового арильта кальцію, одержані шляхом взаємодії кислоти з ного або гетероарильного кільця. відповідним гідроксидом, оксидом, карбонатом, R9 і R10, незалежно, вибрані з водню, карбрмоабо бікарбонатом металу. Таким же чином, солі їльної, гідроксимеильної і ціанометильної груп. тетраалкіламонію можуть бути одержані шляхом n вибирають з цілих чисел від нуля до 4, і q взаємодії кислоти з гідроксидом тетраалкіламонію. вибирають з 0-3. Первинні, вторинні і третинні аміни, такі як триетиЗокрема, деякі сполуки вилучені з об'єму даноламін, можуть утворювати адитивні солі з кислого винаходу. Якщо X2 є метиленом, X3 є NH і R4 є тою. Окремим прикладом може бути внутрішня (R8(CH2)qO(CO), причому q=1, тоді R8 може не бути адитивна сіль, одержана між кислотною групою та незаміщеним фенілом, або фенілом, заміщеним групою первинного аміну однієї молекули, яка танітрогрупою. Взагалі є переважним, що якщо X2 є кож називається цвітер-іон. Через те, що вони є метиленом, X3 є NH, R4 є R8(CH2)qO(CO), q є 1 і R8 фармацевтично прийнятними, всі ці солі включені є заміщеною фенільною групою, тоді замісник, або до об'єму цього винаходу. замісники, повинні вибиратись з хлору, метокси і У переважному втіленні цього винаходу R1 є трифторметилу. нітрильною групою. У цьому втіленні є переважУ контексті даного опису, термін "нижчий алним, щоб стереохімія нітрильної групи відповідала кіл", або так як він є, або у таких комбінаціях як наведеній у загальній формулі 2. нижчий алококси, вжити для позначення лінійних, розгалужених і циклічних насичених вуглеводневих груп, які містять 1-6 атомів вуглецю. Прикладами груп нижчого алкілу є, але не обмежуються ними, метил, етил, ізопропіл, трет-бутил, неопентил, циклогексил, циклопентилметил, 2 13 75592 14 льною групою, заміщеною одною або двома групами, вибраними з нижчих алкільних груп, нижчих алкілокси груп, фтору, хлору і трифторметильних груп. В іншому переважному втіленні, X3 є СО і R4 є 8 8 R NH. Більш переважно, R є, необов'язково, заміщеною гетероарильною групою. Ще більш переважно, R8 є незаміщеною гетероарильною групою, або гетероарильною групою, заміщеною одною або двома групами, вибраними з нижчих алкільних груп, нижчих алкілокси груп, фтору, хлору і триЗгідно з стандартною термінологією, це S фторметильних груп. конфігурація, якщо X1 є метиленом, і R конфігураВ іншому переважному втіленні X3 є NH, і R4 ція, якщо X1 є сіркою, киснем, сульфінілом або вибирають з R6R7N(CO), R8(CH2)qCO і сульфонілом. 8 R (CH2)qSO2. В іншому переважному втіленні, стереохімія Особливо переважними сполуками винаходу центру, розташованого поруч з первинним аміном, є: відповідає показаній у загальній формулі 3. Це S (2S)-1-[N -(Піразиніл-2-карбоніл)-Lконфігурація, якщо X2 є атомом кисню, або метиорнітиніл]піролідин-2-карбонітрил, леновою або іміногрупою, і R конфігурація, якщо (2S)-1-[N -(Піразиніл-2-карбоніл)-LX2 є атомом сірки. лізиніл]піролідин-2-карбонітрил, (2S)-1-[(2'S)-2'-Аміно-4'-(піразиніл-2"карбоніламіно)бутаноїл]піролідин-2-карбонітрил, (4R)-3-[N -(Піразиніл-2-карбоніл)-Lлізиніл]тіазолідин-4-карбонітрил, (2S)-1-[N -(Піридил-3-метил)-Lглутамініл]піролідин-2-карбонітрил, 1-[N -(Піразиніл-2-карбоніл)-Lорнітиніл]піролідин, (2S)-1-[S-(Ацетиламінометил)-Lцистеїніл]піролідин-2-карбонітрил, 3-[N -(2-Хлорпіридил-3-карбоніл)-LУ цьому втіленні є більш переважним коли R1 орнітиніл]тіазолідин, є нітрильною групою, і ще більш переважним коли 1-[N -Хлорпіридил-3-карбоніл)-Lвін має абсолютну конфігурацію, показану у загаорнітиніл]піролідин, і льній формулі 4. (2S)-1-[N -(2-Хлорпіридил-3-карбоніл)-Lорнітиніл]піролідин-2-карбонітрил, S-[N -(Піразиніл-2-карбоніл)-Lорнітиніл]тіазолідин, 3-[N -(2-хіноксалот)-L-лізиніл]тіазолідин, 3-[N -(2-хіноксалоїл)-L-орнітиніл]тіазолідин, (2S)-1-[N -(2-хіноксалоїл)-Lорнітиніл]піролідин-2-карбонітрил, 3-[N -(6-Метилпіразиніл-2-карбоніл)-Lорнітиніл]тіазолідин, 3-[N -(Ізохінолін-3-карбоніл)-LВ іншому переважному втіленні винаходу m є орнітиніл]тіазолідин, 1. Більш переважно, m є 1, R2 і R3 є, незалежно, 3-[N -(6-Трифторметилнікотиноїл)-Lатомами водню або метильними групами. Якщо X2 орнітиніл]тіазолідин, є метиленовою групою, є більш переважним, коли (2S)-1-[(2'R)-3'-(Ацетиламінометилтіо)-2'-аміноR2 і R3 є обидва воднем. Якщо X2 є атомом кисню, 3'-метилбутаноїл]піролідин-2-карбонітрил, 2 3 є більш переважним, коли один з R і R є воднем і (2S)-1-[S-(3-Піколікарбамоїлметил)-Lінший є метильною групою. Якщо X2 є атомом сірцистеїніл]піролідин-2-карбонітрил, ки, є більш переважним, коли обидва R2 і R3 є ме3-[N -(3-Піридилоксикарбоніл)-Lтильними групами. орнітиніл]тіазолідин, В іншому переважному втіленні, X1 є або S, 3-[О-(3або метиленом. Більш переважно, X1 є S, і R1 є Н, Хлорбензилкарбамоїл)сериніл]тіазолідин, і або X1 є метиленом і R1 є CN. 3-[(2'S)-2'-Аміно-5'-оксо-5'-(1",2",3",4"В іншому переважному втіленні, X3 є NH. тетрагідроізохінолін-2"-іл)пентаноїл]тіазолідин. 3 2 3 Більш переважно, X є NH, m є 1, R і R є обидва У другому втіленні даний винахід включає фаН, X2 є метиленом і n є 1 або 2. рмацевтичну композицію для лікування людини. 4 8 В іншому переважному втіленні, R є R NHCO, Композиція відрізняється тим, що вона включає в або R8CO і R8 є, необов'язково, заміщеною гетеякості активного агента принаймні одну із зазначе8 роарильною групою. Більш переважно, R є незаних вище сполук. Така композиція корисна у лікуміщеною гетероарильною групою, або гетероариванні хвороб людини. Загалом композиція включає 15 75592 16 один або два додаткових компоненти, вибрані з які піддаються лікуванню, є такими, в яких інгібуфармацевтично активних екcципієнтів і фармацеввання ДП-IV або CD26 надає клінічні переваги або тично активних агентів, відмінних від агентів данобезпосередньо, або опосередковано. Безпосередго винаходу. ньою дією є блокування активації Τ лімфоцитів. Композиція може бути представлена у вигляді Опосередкована для полягає в потенціації пептитвердої або рідкої рецептури, залежно від певного дого гормону шляхом запобігання деградації цих шляху введення. Прикладами твердих рецептур є гормонів. Прикладами хвороб є, але не обмежупілюлі, таблетки, капсули та порошки для перораються ними, аутоімунні і протизапальні захворюльного призначення, супозиторії для ректального вання, такі як запалення кишки і ревматоїдний або вагінального призначення, порошки для назаартрит, брак гормону росту, що спричинює малий льного або пульмонарного призначення, та пласзріст, полікістоз яєчників, зменшена толерантність тирі для трансдермального або трансмукозальнодо глюкози і діабет типу 2. Особливо переважним го (такого як букальне) призначення. Прикладами є застосування сполук і композицій для лікування рідких рецептур є розчини та суспензії для внутрізменшеної толерантності до глюкози і діабету типу шньовенних, підшкірних або внутрішньом'язових 2, та, відповідно, спосіб лікування цих захворюін'єкцій, та перорального, назального та пульмовань шляхом призначення ефективної кількості нарного призначення. Особливо переважною фосполуки або композиції як описано вище. рмою є таблетки для перорального призначення. Безпосередньо лікування, включаючи режим Іншою переважною формою, особливо для швиддозування, визначається лікарем, беручи до уваги кої та термінової допомоги, є стерильні розчини загальні відомості про пацієнта та ступінь захводля внутрішньовенних ін'єкцій. рювання. Для таких захворювань як запалення Композиція включає принаймні одну сполуку кишок, які після періодів спокою загострюються, згідно з даним винаходом. Композиція може вклюлікар може вибрати відносно великі дози під час чати більше ніж одну сполуку, але загалом є перегострої фази і нижчі дози для підтримання стану важним, коли вона містить лише одну. Кількість під час періоду спокою. Для хронічних захворюсполуки, яка використовується у композиції, буде вань, таких як діабет типу 2 та зменшена толерантакою, щоб загальна денна доза активного агента тність до глюкози, дози повинні підтримуватись на могла бути призначена 1-4 зручними дозами. Наоднаковому рівні упродовж тривалого періоду. приклад, композиція може бути у формі таблетки, Графік дозування від однієї до чотирьох таблеток яка містить кількість сполуки, яка відповідає загана день, кожна з яких містить між 0,1мг і 1г (і перельній необхідній денній дозі, така таблетка прийважно між 1мг і 250мг) активної сполуки, може бумається один раз на день. Альтернативно, таблетти типовим у такому випадку. ка може містити половину (або одну третю, або Сполуки згідно з даним винаходом можуть буодну четверту) денної дози, тоді вона приймається ти одержані методами, відомими фахівцям у цій двічі (тричі, або чотири рази) на день. На такій галузі. Вибраний шлях буде залежати від особлитаблетці може бути зроблена зарубка для полегвої природи замісників, присутніх на цільових мошення розподілення дози, таким чином, наприлекулах. У наступному загальному описі шлях синклад, таблетка, яка включає повністю денну дозу, тезу описаний для сполук, в яких m є 1. Сполуки, в може бути розламана навпіл і прийматися двома яких m=2 або 3, можуть загалом одержувати анаприйомами. Переважно, таблетка, або інша форма логічними методами. дозування, буде містити між 0,1мг і 1г активної Початковим матеріалом звичайно є похідна сполуки. Більш переважно, вона буде містити між , -діамінокислоти 5, або похідна амінодикарбо1мг і 250мг. нової кислоти 6. Композиція загалом включає один або більшу кількість екcципієнтів, вибраних з тих, які визнані фармацевтично прийнятними. Придатними екcципієнтами є, але не обмежуються ними, наповнювачі, зв'язуючи агенти, розріджувачі, розчинники, консерванти та ароматизатори. Агенти, які змінюють характеристики вивільнення композиції, такі як полімери, які селективно розчиняються у кишечнику ("покриття, що руйнуються в кишковому тракті") також беруться до уваги в контексті даного винаходу як придатні екcципієнти. PG1 і PG2 є "ортогональними" захисними груКомпозиція може включати, окрім сполуки згіпами - групами, які захищають активні аміногрупи, дно з даним винаходом, другий фармацевтично і кожна з яких може бути селективно видалена у активний агент. Наприклад, сполука може включаприсутності іншої. Придатні групи широко описані ти антидіабетичний агент, протизапальний агент, у літературі. PG3 і PG4 є захисними групами карбоабо противірусний агент. Однак, загалом є перексильних груп. Вони вибираються таким чином, що важним, коли композиція включає лише активний кожна є ортогональною відносно одна одної, і заагент. хисних аміногруп. Придатні варіанти PG3 і PG4 У третьому втіленні винахід стосується застотакож добре відомі в літературі. Похідні діамінокисування описаних вище сполук і композицій для слот загальної формули 5 і похідні амінодикарболікування захворювань людини. Це втілення може нових кислот загальної формули 6 або є комерційвідповідно розглядатись як таке, що включає споно доступними, або можуть бути одержані шляхом сіб лікування таких захворювань. Захворювання, методів, описаних у літературі. На практиці, та 17 75592 18 залежно від обраного методу, початковий матеріСхема А ілюструє введення піролідинової (або ал має лише дві або три захисні групи. Або PG3 тіазолідинової, або оксазолідинової) групи на первідсутній для введення залишку піролідину (або шій стадії одержання сполук згідно з даним винатіазоліну, або осказолідину), або відсутній PG1, ходом. або PG4 для трансформації бокового ланцюга. Сполуки 5А і 6А відповідають 5 і 6, які містять PG у вигляді атому водню (тобто без захисної групи). Вільна карбонова кислота може взаємодіяти з похідною піролідину 7 з одержанням аміду 8 або 9. Умови проходження реакції для забезпечення цього перетворення добре відомі в літературі. Придатними реагентами є карбодііміди, фосфорні реагенти і алкілхлорформіати, реакцію звичайно каталізують третинним аміном, таким як триетиламін або диметиламінопіридин. Реакція, проілюстрована на Схемі А, є придатною для всіх комбінацій R1 і X1. Однак, у випадку, коли R1 є нітрильною групою, коли X1 є сульфінільною, або сульфонільною групою, є бажаним модифікувати методику, що показана на Схемах В і С. 3 На Схемі В R1 групу вводили як первинний амід і потім перетворювали у нітрил шляхом взаємодії з дегідратуючим агентом, таким як ангідрид трифтороцтової кислоти. На Схемі С X1 групу вводили як тіоетер і потім перетворювали в сульфоксид (а=1), або сульфон (а=2) шляхом взаємодії з окиснюючим агентом, таким як перйодат натрію. Зміна методики на методику Схеми С неможлива, якщо X2 є атомом сірки. На Схемі D, сполука 5D є похідною діамінокислоти 5, в якій -захисною групою є атом водню. Вільні аміногрупи легко реагують з сульфонілхлоридами, ацилхлоридами і тіоацилхлоридами, звичайно у присутності третинного аміну, з одержанням сульфонамідів 14, амідів 15 і тіоамідів 16, відповідно. Реагенти є або доступними per se, або можуть бути одержаними з відповідних кислот. Реакція схеми D загалом придатна для усіх варіацій групи R8(CH2)q за умови, що деякі замісники розглянутих фенільних та гетероарильних кілець, що є варіантами значення R8, можуть потребувати захист. Такі замісники і відповідний захист загалом буде очевидний фахівцям у цій галузі. 19 Реагенти: і) СОСІ2; іі) CSCI2; iii) R8(CH2)qOH; iv) R R NH; v) R8(CH2)qOCOCI; vi) R8(CH2)qOCSCI; vii) R6R7NCOCI; viii) R6R7NCSCI. Схема Ε ілюструє удосконалення 5D з одержанням карбаматів та сечовин, а також їх тіо аналогів. Якщо R5 не є атомом водню, сполука 5D може бути перетворена у відповідний карбамоїлхлорид 17, або тіокарбамоїлхлорид 18 шляхом реакції з фосгеном, або тіофосгеном. Інші реагенти, відомі у цій галузі, є функціонально еквівалентними цим токсичним реагентам і вони також можуть застосовуватись. Якщо R5 є воднем, одержаною проміжною сполукою є ізоціанат, або ізотіоціанат, але функціонально вони поводяться як еквівалент відповідного хлориду. Проміжні 17 і 18 звичайно не виділяють, але безпосередньо оброблюють спиртами з одержанням карбаматів 19 і тіокарбаматів 20. Шляхом обробки цих проміжних сполук амінами одержують сечовини 21 і тіосечовини 22. Альтернативно, 5D може безпосередньо взаємодіяти з хлорформіатом, або хлортіоформіатом з одержанням карбамату, або тіокарбамату, або, якщо ні R6, ні R7 не є воднем, з хлорформамідом, або хлортіоформамідом з одержанням сечовини, або тіосечовини. Якщо R6 або R7 є атомом водню, хлорформамід або хлортіоформамід буде мати схильність до нестабільності, в цьому випадку використовують ізоціанат (наприклад R6-NCO), або ізотіоціанат (наприклад R6-NCS). Як обговорювалось відносно Схеми D, деяким замісникам у межах втілень R8 може бути необхідний відповідний захист. 6 7 75592 20 Схема F ілюструє трансформацію бокового ланцюга ряду амінодикарбонової кислоти. Захищена кислота 6F може вступати в реакцію з аміном в різних умовах з одержанням аміду 23. Конденсуванню може сприяти дегідратуючий реагент, такий як карбодіімід або фосфорний реагент. Альтернативно, кислота може бути перетворена у більш активну похідну, так як шляхом обробки оксалілхлоридом або тіонілхлоридом з одержанням відповідного хлорангідриду кислоти, який буде безпосередньо взаємодіяти з аміном. Тіоамід 24 можуть одержувати шляхом обробки аміду 23 реагентом Лоуессона. Після трансформації усіх груп, видаляється кінцева захисна група, продукт відділяють та очищують за допомогою стандартних методик. Стандартні методи ілюстровані нижче, але не обмежуються прикладами. Приклади Скорочення Були вжиті наступні скорочення: ДМФ Ν,Ν-Диметилформамід год. Година(и) ВЕРХ Вискоефективна рідкісна хроматографія хв. Хвилина(и) пет. ефір фракція петролейного ефіру, що кипить при 60-80°С (Бензотріазол-1РуВОР ілокси)трипіролідинфосфонію гескафторфосфат РуВrоР Бромтрипіролідинофосфонію гескафторфосфат ТФО Трифтороцтова кислота Приклад 1 (2S)-1-[N -(Піразиніл-2-карбоніл)-Lорнітиніл]піролідин-2-карбонітрилу трифторацетат 21 75592 22 А. N-(2-Нітробензолсульфеніл)-L-пролін діетиловий етер (1000мл). Тверду речовину відфіL-Пролін (25г, 217ммоль) розчиняли в 2М льтровували, промивали діетиловим етером NaOH (110мл, 220ммоль) і діоксані (120мл). Пові(500мл) і перекристалізовували з суміші метально додавали розчин 2нол/діетиловий етер з одержанням білої твердої нітробензолсульфенілхлорду (42г, 222ммоль) в речовини, визначеної як гідрохлорид (2S)діоксані (60мл) одночасно з 2М NaOH (110мл, піролідин-2-карбонітрилу (18,9г, 142,5ммоль, 96%). 220ммоль). Через 2год. при кімнатній температурі F. (2S)-1-[N -(трет-Бутилоксикарбоніл)-N реакційну суміш виливали у воду (500мл) і тверду (піразиніл-2-карбоніл)-L-орнітиніл]-піролідин-2речовину відфільтровували. Рівень рН фільтрату карбонітрил доводили до рН3 2М НСІ і розчин екстрагували N -(трет-Бутилоксикарбоніл)-N -(піразиніл-2етилацетатом (3 500мл). Об'єднані органічні ексткарбоніл)-L-орнітин (2,5г, 7,4ммоль) розчиняли в ракти промивали водою (4 200мл) і розчином солі СН2СІ2 (50мл). Цей розчин охолоджували до 0°С, додавали гідрохлорид (2S)-піролідин-2(1 200мл), сушили (Na2SO4) і випарювали in vacuo карбонітрилу (1,2г, 9,1ммоль) і РуВОР (4,3г, з одержанням оранжевої твердої речовини, визначеної як N-(2-нітробензолсульфеніл)-L-пролін 8,23ммоль), і рівень рН доводили до рН9 триети(58,1г, 217ммоль, 100%). ламіном. Після 18год. відстоювання при від 0°С до В. N-(2-Нітробензолсульфеніл)-L-пролін суккімнатної температури розчинник видаляли in цинімідиловий естер vacuo і залишок переносили в етилацетат (200мл). N-(2-Нітробензолсульфеніл)-L-пролін (57,9г, Цей розчин промивали 0,3М KHSO4 (2 50мл), на216ммоль) розчиняли в СН2СІ2/ДМФ (9:1, 500мл). сич. NaHCO3 (2 50мл), водою (2 50мл) і розчином Додавали N-гідроксисукцинімід (37,3г, 324ммоль) і солі (1 50мл), сушили (Na2SO4) і випарювали in розчинний у воді карбодіімід (51,8г, 260ммоль). vacuo з одержанням жовтого масла. Його очищали Через 18год. при кімнатній температурі розчинник за допомогою флеш хроматографії (елюент: 80% видаляли in vacuo і залишок переносили в етилаетилацетат, 20% пет. ефір) з одержанням безбарцетат (1000мл). Розчин промивали водою вного масла, визначеного як (2S)-1-[N -(трет(4 200мл) і розчином солі (1 200мл), сушили бутилоксикарбоніл)-N -(піразиніл-2-карбоніл)-L(Na2SO4) і випарювали in vacuo з одержанням жоорнітиніл]піролідин-2-карбонітрил (2,98г, втої твердої речовини, визначеної як N-(27,16ммоль, 97%). нітробензолсульфеніл)-L-проліну сукцинімідилоG. (2S)-1-[N -(Піразиніл-2-карбоніл)-Lвий естер (78,9г, 216ммоль, 100%). орнітиніл]піролідин-2-карбонітрилу трифторацетат С. N-(2-Нітробензолсульфеніл)-L-пролінамід (2S)-1-[N -трет-Бутилоксикарбоніл-N N-(2-Нiтробензолсульфенiл)-L-проліну сукци(піразиніл-2-карбоніл)-L-орнітиніл]піролідин-2німідиловий естер (78,5г, 215ммоль) розчиняли в карбонітрил (2,8г, 6,7ммоль) розчиняли в трифтодіоксані (500мл). Додавали аміак (35%, 100мл). роцтовій кислоті (5мл). Через 1год. при кімнатній Після перемішування при кімнатній температурі температурі розчинник видаляли in vacuo. Залипротягом 2год. реакційну суміш виливали у воду шок очищали за допомогою препаративної ВЕРХ (700мл). Осад відфільтровували, промивали во(Vydac C18, 5-50% 0,1% ТФО/ацетонітрил в 0,1% дою (200мл), сушили над Р2О5 і перекристалізовуТФО/вода більше ніж 40хв. при 3мл/хв.). Фракції, вали з етилацетат/пет. ефір з одержанням жовтої які містили продукт, ліофілізували з одержанням твердої речовини, визначеної як N-(2безбарвного масла, визначеного як (2S)-1-[N нітробензолсульфеніл)-L-пролінамід (49,6г, (піразиніл-2-карбоніл)-L-орнітиніл]піролідин-2185ммоль, 86%). карбонітрилу трифторацетат (1,5г, 3,48ммоль, D. (2S)-N-(2-Нітробензолсульфеніл)піролідин52%). 2-карбонітрил [М+Н]+=317,3 N-(2-Нітробензолсульфеніл)-L-пролінамід (49г, Приклад 2 183ммоль) розчиняли в сухому ТГФ (300мл). Роз(2S)-1-[N -(Піразиніл-2-карбоніл)-Lчин охолоджували до 0°С, додавали триетиламін лізиніл]піролідин-2-карбонітрилу трифторацетат (36,7г, 367ммоль) з наступним повільним додаванням ангідриду трифтороцтової кислоти (77г, 367ммоль). Рівень рН доводили до рН9 триетиламіном. Через 30хв. реакційну суміш розводили етилацетатом (500мл), промивали водою (1 200мл) і розчином солі (1 200мл), сушили (Na2SO4) і випарювали in vacuo з одержанням оранжевого масла, яке очищали за допомогою флеш хроматографії (елюент: 80% пет. ефір, 20% А. (N -(трет-Бутилоксикарбоніл)-N -(9етилацетат) з одержанням жовтої твердої речовифторенілметилоксикарбоніл)-L-лізиніл)-Lни, визначеної як (2S)-N-(2пролінамід нітробензолсульфеніл)піролідин-2-карбонітрил N -(трет-Бутилоксикарбоніл)-N -(9(38,9г, 150ммоль, 82%). фторенілметилоксикарбоніл)-L-лізин (5г, Е. (2S)-Піролідин-2-карбонітрилу гідрохлорид 10,7ммоль) розчиняли в СН2СІ2 (100мл). Розчин (2S)-N-(2-Нітробензолсульфеніл)піролідин-2охолоджували до 0°С, додавали L-пролінамід карбонітрил (38,5г, 149ммоль) розчиняли в діети(1,78г, 11,7ммоль) і РуВОР (6,7г, 12,8ммоль), ловому етері (200мл). Повільно додавали 4М рівень рН доводили до рН9 триетиламіном. Після НСІ/діоксан (150мл, 600ммоль). Через 2год. при 18год. відстоювання при від 0°С до кімнатної темкімнатній температурі реакційну суміш виливали у 23 75592 24 ператури розчинник видаляли in vacuo і залишок визначеного як (2S)-1-(N -(третпереносили в етилацетат (200мл). Розчин промибутилоксикарбоніл)-N -(піразиніл-2-карбоніл)-Lвали О3М KHSO4 (2 50мл), насич. NaHCO3 лізиніл)піролідин-2-карбонітрил (124мг, 0,29ммоль, (2 50мл), водою (2 50мл) і розчином солі 93%). (1 50мл), сушили (Na2SO4) і випарювали in vacuo. Е. (2S)-1-[N -(Піразиніл-2-карбоніл)-LЗалишок очищали за допомогою флеш хроматоглізиніл]піролідин-2-карбонітрилу трифторацетат рафії (елюент 2% метанол, 98% хлороформ) з (2S)-1-(N -(трет-Бутилоксикарбоніл)-N одержанням безбарвного масла, визначеного як (піразиніл-2-карбоніл)-L-лізиніл)піролідин-2(N -(трет-бутилоксикарбоніл))-N -(9карбонітрил (110мг, 0,26ммоль) розчиняли в трифторенілметилоксикарбоніл)-L-лізиніл)-Lфтороцтовій кислоті (5мл). Через 1год. при кімнатпролінамід (4,05г, 7,2ммоль, 67%). ній температурі розчинник видаляли in vacuo. Залишок очищали за допомогою препаративної В. (2S)-1-(N -(трет-Бутилоксикарбоніл)-N -(9ВЕРХ (Vydac C18, 5-50% 0,1% ТФО/ацетонітрил в фторенілметилоксикарбоніл)-L-лізиніл)-піролідин0,1% ТФО/вода більше ніж 40хв. при 3мл/хв.). 2-карбонітрил Фракції, які містили продукт, ліофілізували з одер(N -(трет-Бутилоксикарбоніл)-N -(9жанням безбарвного масла, визначеного як (2S)-1фторенілметилоксикарбоніл)-L-лізиніл)-L[N -(піразиніл-2-карбоніл)-L-лізиніл]піролідин-2пролінамід (3,95г, 7,02ммоль) розчиняли в сухому карбонітрилу трифторацетат (66мг). ТГФ (100мл). Розчин охолоджували до 0°С, дода[М+Н]+=331,1 вали триетиламін (1,4г, 14ммоль) з наступним поПриклад 3 вільним додаванням ангідриду трифтороцтової кислоти (2,97г, 14,1ммоль). Рівень рН доводили до (4R)-3-[N -(Піразиніл-2-карбоніл)-LрН9 триетиламіном. Через 30хв. реакційну суміш лізиніл]тіазолідин-4-карбонітрилу трифторацетат розводили етилацетатом (100мл), промивали водою (1 50мл) і розчином солі (1 50мл), сушили (Na2SO4) і випарювали in vacuo з одержанням оранжевого масла. Залишок очищали за допомогою флеш хроматографії (елюент 60% пет. ефір, 40% етилацетат) з одержанням безбарвного масла, визначеного як (2S)-1-(N -(третбутилоксикарбоніл)-N -(9фторенілметилоксикарбоніл)-L-лізиніл)піролідин-2А. (4R)-3-(трет-Бутилоксикарбоніл)тіазолідинкарбонітрил (3,3г, 6,11ммоль, 87%). 4-карбоксамід С. (2S)-1-(N -(трет-Бутилоксикарбоніл)-L(4R)-3-(трет-Бутилоксикарбоніл)тіазолідин-4лізиніл)піролідин-2-карбонітрил карбонову кислоту (12,5г, 54,1ммоль) розчиняли в (2S)-1-(N -(трет-Бутилоксикарбоніл)-N -(9СН2СІ2/ДМФ (9:1, 150мл). До цього розчину при фторенілметилоксикарбоніл)-L-лізиніл)піролідин-20°С додавали гідрат 1-гідроксибензотриазолу карбонітрил (3,1г, 5,7ммоль) розчиняли в ТГФ (14,6г, 108ммоль) і розчинний у воді карбодіімід (80мл). Додавали діетиламін (20мл). Через 2год. (13,0г, 65ммоль). Через 1год. при 0°С додавали при кімнатній температурі розчинник видаляли in аміак (35%, 50мл). Після 18год. відстоювання при vacuo. Залишок очищали за допомогою флеш від 0°С до кімнатної температури розчинник видахроматографії (елюент: 90% хлороформ, 7% меляли in vacuo і залишок переносили в етилацетат танол, 3% триетиламін) з одержанням безбарвно(500мл). Розчин промивали 0,3М KHSO4 го масла, визначеного як (2S)-1-(N -(трет(2 100мл), насич. NaHCO3 (2 100мл), водою бутилоксикарбоніл)-L-лізиніл)піролідин-2(2 100мл) і розчином солі (1 100мл), сушили карбонітрил (1,63г, 5,03ммоль, 89%). (Na2SO4) і випарювали in vacuo з одержанням жоD. (2S)-1-(N -(трет-Бутилоксикарбоніл)-N втого масла. Залишок очищали за допомогою (піразиніл-2-карбоніл)-L-лізиніл)піролідин-2флеш хроматографії (елюент: 2% метанол, 98% карбонітрил хлороформ) з одержанням безбарвного масла, (2S)-1-(N -(трет-Бутилоксикарбоніл)-Lвизначеного як (4R)-3-(третлізиніл)піролідин-2-карбонітрил (100мг, 0,31ммоль) бутилоксикарбоніл)тіазолідин-4-карбоксамід (8,9г, розчиняли в СН2СІ2/ДМФ (9:1, 20мл). До цього ро38,4ммоль, 71%). зчину при 0°С додавали гідрат 1В. (4R)-Тіазолідин-4-карбоксаміду гідрохлорид гідроксибензотриазолу (84мг, 0,62ммоль), розчин(4S)-3-(трет-Бутилоксикарбоніл)тіазолідин-4ний у воді карбодіімід (76мг, 0,38ммоль), 2карбоксамід (8,6г, 37,1ммоль) розчиняли в 4М піразинкарбонову кислоту (43мг, 0,35ммоль) і триНСІ/діоксан (50мл). Через 1год. при кімнатній теметиламін (65мг, 0,65ммоль). Після 18год. відстоюпературі розчинник випарювали in vacuo з одервання при від 0°С до кімнатної температури розжанням білої твердої речовини, визначеної як чинник видаляли in vacuo і залишок переносили в (4R)-тіазолідин-4-карбоксаміду гідрохлорид (6,2г, етилацетат (70мл). Цей розчин промивали 0,3М 36,8ммоль, 99%). KHSO4 (2 20мл), насич. NaHCO3 (2 20мл), водою С. (4R)-3-[N -(трет-Бутилоксикарбоніл)-N -(9(2 20мл) і розчином солі (1 20мл), сушили фторенілметилоксикарбоніл)-L-лізиніл]-тіазолідин(Na2SO4) і випарювали in vacuo з одержанням жо4-карбоксамід втого масла. Залишок очищали за допомогою N -(трет-Бутилоксикарбоніл)-N флеш хроматографії (елюент: 2% метанол, 98% фторенілметилоксикарбоніл)-L-лізин (5г, хлороформ) з одержанням безбарвного масла, 25 75592 26 10,7ммоль) розчиняли в СН2СІ2 (100мл). Цей роз(1 20мл), сушили (Na2SO4) і випарювали in vacuo. чин охолоджували до 0°С, додавали (4R)Залишок очищали за допомогою флеш хроматогтіазолідин-4-карбоксаміду гідрохлорид (1,78г, рафії (елюент: 2% метанол, 98% хлороформ) з 11,7ммоль) і РуВОР (6,7г, 12,8ммоль), і рівень одержанням безбарвного масла, визначеного як рН доводили до рН9 триетиламіном. Після 18год. (4R)-3-[N -(трет-бутилоксикарбоніл)-N -(піразинілвідстоювання при від 0°С до кімнатної температу2-карбоніл)-L-лізиніл]тіазолідин-4-карбонітрил ри розчинник видаляли in vacuo і залишок перено(112мг, 0,25ммоль, 86%). сили в етилацетат (200мл). Розчин промивали G. (4R)-3-[N -(Піразиніл-2-карбоніл)-L0,3М KHSO4 (2 50мл), насич. NaHCO3 (2 50мл), лізиніл]тіазолідин-4-карбонітрилу трифторацетат водою (2 50мл) і розчином солі (1 50мл), сушили (4R)-3-[N -(трет-Бутилоксикарбоніл)-N (Na2SO4) і випарювали in vacuo з одержанням жо(піразиніл-2-карбоніл)-L-лізиніл]тіазолідин-4втого масла. Залишок очищали за допомогою карбонітрил (110мг, 0,26ммоль) розчиняли в трифлеш хроматографії (елюент: 2% метанол, 98% фтороцтовій кислоті (5мл). Через 1год. при кімнатхлороформ) з одержанням безбарвного масла, ній температурі розчинник видаляли in vacuo. Завизначеного як (4R)-3-[N -(третлишок очищали за допомогою препаративної ВЕРХ (Vydac C18, 5-50% 0,1% ТФО/ацетонітрил в бутилоксикарбоніл)-N -(9-фтореніл0,1% ТФО/вода більше ніж 40хв. при 3мл/хв.). метилоксикарбоніл)-L-лізиніл]тіазолідин-4Фракції, які містили продукт, ліофілізували з одеркарбоксамід (2,81г, 4,8ммоль, 44%). жанням безбарвного масла, визначеного як (4R)-3D. (4R)-3-[N -(трет-Бутилоксикарбоніл)-N -(9[N -(піразиніл-2-карбоніл)-L-лізиніл]тіазолідин-4фторенілметилоксикарбоніл)-L-лізиніл]-тіазолідинкарбонітрилу трифторацетат (57мг). 4-карбонітрил [M+H]+=349,1 (4R)-3-[N -(трет-Бутилоксикарбоніл)-N -(9Приклад 4 фторенілметилоксикарбоніл)-1-лізиніл]тіазолідин(2S)-1-[N -(Піридил-3-метил)-L4-карбоксамід (2,7г, 4,7ммоль) розчиняли в сухому глутамініл]піролідин-2-карбонітрилу дигідрохлорид ТГФ (100мл). Розчин охолоджували до 0°С, додавали триетиламін (1,0г, 10ммоль) з наступним повільним додаванням ангідриду трифтороцтової кислоти (2,0г, 9,5ммоль). Рівень рН доводили до рН9 триетиламіном. Через 30хв. реакційну суміш розводили етилацетатом (100мл), промивали водою (1 50мл) і розчином солі (1 50мл), сушили (Na2SO4) і випарювали in vacuo. Залишок очищали за допомогою флеш хроматографії (елюент: 60% А. (2S)-1-[N-(трет-Бутилоксикарбоніл)-О пет. ефір, 40% етилацетат) з одержанням безбарметил-L-глутамініліпіролідин-2-карбонітрил вного масла, визначеного як (4R)-3-[N -(третN-(трет-Бутилоксикарбоніл)-О -метил-Lбутилоксикарбоніл)-N -(9глутамінову кислоту (1,0г, 3,83ммоль) розчиняли в фторенілметилоксикарбоніл)-L-лізиніл]тіазолідинСН2СІ2 /ДМФ (9:1, 20мл). До цього розчину при 0°С 4-карбонітрил (2,14г, 3,81ммоль, 82%). додавали гідрат 1-гідроксибензотриазолу (788мг, Е. (4R)-3-[N -(трет-Бутилоксикарбоніл)-L5,84ммоль), розчинний у воді карбодіімід (877мг, лізиніл]тіазолідин-4-карбонітрил 4,38ммоль), (2S)-піролідин-2-карбонітрилу гідрох(4R)-3-[N -(трет-Бутилоксикарбоніл)-N -(9лорид (609мг, 4,6ммоль) і триетиламін (65мг, фторенілметилоксикарбоніл)-L-лізиніл]тіазолідин0,65ммоль). Після 18год. відстоювання при від 0°С 4-карбонітрил (1,9г, 3,4ммоль) розчиняли в ТГФ до кімнатної температури розчинник видаляли in (40мл). Додавали діетиламін (10мл). Через 2год. vacuo і залишок переносили в етилацетат (70мл), при кімнатній температурі розчинник видаляли in цей розчин промивали 0,3М KHSO4 (2 20мл), наvacuo. Залишок очищали за допомогою флеш сич. NaHCO3 (2 20мл), водою (2 20мл) і розчином хроматографії (елюент: 90% хлороформ, 7% месолі (1 20мл), сушили (Na2SO4) і випарювали in танол, 3% триетиламін) з одержанням безбарвноvacuo. Залишок очищали за допомогою флеш го масла, визначеного як (4R)-3-[N -(третхроматографії (елюент: 50% етилацетат, 50% пет. бутилоксикарбоніл)-L-лізиніл]тіазолідин-4ефір) з одержанням коричневого масла, визначекарбонітрил (863мг, 2,5ммоль, 75%). ного як (2S)-1-[N-(трет-бутилоксикарбоніл)-O F. (4R)-3-[N -(трет-Бутилоксикарбоніл)-N метил-L-глутаміл]піролідин-2-карбонітрил (290мг, (піразиніл-2-карбоніл)-L-лізиніл]тіазолідин-40,86ммоль, 22%). карбонітрил В. (2S)-1-[N-(трет-Бутилоксикарбоніл)-L(4R)-3-[N -(трет-Бутилоксикарбоніл)-Lглутаміл]піролідин-2-карбонітрил лізиніл]тіазолідин-4-карбонітрил (100мг, (2S)-1-[N-(трет-Бутилоксикарбоніл)-O -метил0,29ммоль) розчиняли в СН2СІ2 (20мл). До цього L-глутаміл]піролідин-2-карбонітрил (250мг, розчину при 0°С додавали 2-піразинкарбонову 0,74ммоль) розчиняли в діоксані (5мл). Додавали кислоту (43мг, 0,35ммоль) і РуВОР (170мг, 1М гідроксид літію (1,1мл, 1,1ммоль). Через 1год. 0,33ммоль) і рівень рН доводили до рН9 триетипри кімнатній температурі розчинник видаляли in ламіном. Після 18год. відстоювання при від 0°С до vacuo і залишок переносили в етилацетат (70мл). кімнатної температури розчинник видаляли in Цей розчин промивали 1М KHSO4 (2 20мл), водою vacuo і залишок переносили в етилацетат (70мл). (2 20мл) і розчином солі (1 20мл), сушили Розчин промивали 0,3М KHSO4 (2 20мл), насич. (Na2SO4) і випарювали in vacuo з одержанням безNaHCO3 (2 20мл), водою (2 20мл) і розчином солі 27 75592 28 барвного масла, визначеного як (2S)-1-[N-(трет(1 50мл), сушили (Na2SO4) і випарювали in vacuo. бутилоксикарбоніл)-L-глутаміл]піролідин-2Залишок очищали за допомогою флеш хроматогкарбонітрил (200мг, 0,61ммоль, 83%). рафії (елюент: 90% етилацетат, 10% пет. ефір) з С. (2S)-1-[N -(трет-Бутилоксикарбоніл)-N одержанням безбарвного масла, визначеного як 1(піридил-3-метил)-L-глутамініл]піролідин-2[N -(бензилоксикарбоніл)-N -треткарбонітрил бутилоксикарбоніл)-L-орнітиніл]піролідин (5,15г, (2S)-1-[N-(трет-Бутилоксикарбоніл)-L12,3ммоль, 82%). глутаміл]піролідин-2-карбонітрил (30мг, В. 1-[N -(трет-Бутилоксикарбоніл)-L0,093ммоль) розчиняли в СН2СІ2/ДМФ (9:1, 10мл). орнітиніліпіролідин До цього розчину при 0°С додавали гідрат 11-[N -(Бензилоксикарбоніл)-N -(третгідроксибензотриазолу (21мг, 0,16ммоль), розчинбутилоксикарбоніл)-L-орнітиніл]піролідин (2,15г, ний у воді карбодіімід (21мг, 0,105ммоль), 35,13ммоль) розчиняли в метанолі (80мл). Цей роз(амінометил)піридин (11мг, 0,1ммоль) і триетилачин гідрували над 10% Pd/C (400мг). Через 2год. мін (20мг, 0,2ммоль). Після 18год. відстоювання каталізатор відфільтровували і промивали метапри від 0°С до кімнатної температури розчинник нолом (50мл). Об'єднані фільтрати випарювали in видаляли in vacuo і залишок переносили в етилаvacuo з одержанням майже білої твердої речовицетат (70мл). Розчин промивали 0,3М KHSO4 ни, визначеної як 1-[N -(трет-бутилоксикарбоніл)(2 20мл), насич. NaHCO3 (2 20мл), водою L-орнітиніл]піролідин (1,35г, 4,74ммоль, 94%). (2 20мл) і розчином солі (1 20мл), сушили С. 1-[N -(трет-Бутилоксикарбоніл)-N (Na2SO4) і випарювали in vacuo з одержанням жо(піразиніл-2-карбоніл)-L-орнітиніл]піролідин втого масла. Залишок очищали за допомогою 1-[N -(трет-Бутилоксикарбоніл)-Lфлеш хроматографії (елюент: 5% метанол, 97% орнітиніл]піролідин (100мг, 0,35ммоль) розчиняли хлороформ) з одержанням безбарвного масла, в СН2СІ2 (20мл). До цього розчину при 0°С додавизначеного як (2S)-1-[N -(третвали РуВrоР (195мг, 0,4ммоль), 2бутилоксикарбоніл)-N -(піридил-3-метил)-Lпіразинкарбонову кислоту (50мг, 0,4ммоль) і триеглутамініл]піролідин-2-карбонітрил (16,6мг, тиламін (100мг, 1,0ммоль). Після 18год. відстою0,04ммоль, 44%). вання при від 0°С до кімнатної температури розD. (2S)-1-[N -(Піридил-3-метил)-Lчинник видаляли in vacuo і залишок переносили в глутамініл]піррлідин-2-карбонітрилу дигідрохлорид етилацетат (70мл). Розчин промивали 0,3М KHSO4 (2S)-1-[N -(трет-Бутилоксикарбоніл)-N (2 20мл), насич. Na2CO4 (2 20мл), водою (2 20мл) (піридил-3-метил)-L-глутамініл]піролідин-2і розчином солі (1 20мл), сушили (Na2SO4) і випакарбонітрил (17мг, 0,04ммоль) розчиняли в 4М рювали in vacuo. Залишок очищали за допомогою НСІ/діоксан (5мл). Через 1год. при кімнатній темфлеш хроматографії (елюент: 3% метанол, 97% пературі розчинник видаляли in vacuo з одержанхлороформ) з одержанням липкої білої твердої ням білої твердої речовини, визначеної як (2S)-1речовини, визначеної як 1-[N -(трет[N -(піридил-3-метил)-L-глутамініл]піролідин-2бутилоксикарбоніл)-N -(піразиніл-2-карбоніл)-Lкарбонітрилу дигідрохлорид (17мг, 0,04ммоль, орнітиніл]піролідин (90мг, 0,25ммоль, 66%). 100%). D. 1-[N -(Піразиніл-2-карбоніл)-L+ [М+Н] =316,2 орнітиніл]піролідину трифторацетат Приклад 5 1-[N -(трет-Бутилоксикарбоніл)-N -(піразиніл1-[N -(Піразиніл-2-карбоніл)-L2-карбоніл)-L-орнітиніл]піролідин (90мг, орнітиніл]піролідину трифторацетат 0,23ммоль) розчиняли в 4М НСІ/діоксан (15мл). Через 45хв. при кімнатній температурі розчинник видаляли in vacuo. Залишок очищали за допомогою препаративної ВЕРХ (Vydac C18, 5-50% 0,1% ТФО/ацетонітрил в 0,1% ТФО/вода більше ніж 40хв. при 3мл/хв.). Фракції, які містили продукт, ліофілізували з одержанням безбарвного масла, визначеного як 1-[N -(піразиніл-2-карбоніл)-Lорнітиніл]піролідину трифторацетат (51мг). [М+Н]+=292,1 А. 1-[N -(Бензилоксикарбоніл)-N -(третПриклад 6 бутилоксикарбоніл)-L-орнітиніл]піролідин 3-[N -(Піразиніл-2-карбоніл)-LN -(Бензилоксикарбоніл)-N -треторнітиніл]тіазолідину трифторацетат бутилоксикарбоніл)-L-орнітин (5,49г, 15ммоль) розчиняли в СН2СІ2/ДМФ (9:1, 100мл). До цього розчину при 0°С додавали гідрат 1гідроксибензотриазолу (3,37г, 22ммоль), розчинний у воді карбодіімід (3,46г, 18ммоль), піролідин (1,28г, 18ммоль) і триетиламін (200мг, 20ммоль). Після 18год. відстоювання при від 0°С до кімнатної температури розчинник видаляли in vacuo і залишок переносили в етилацетат (200мл). Розчин промивали 0,3М KHSO4 (2 50мл), насич. NaHCO3 А. 3-[N -(трет-Бутилоксикарбоніл)-N (2 50мл), водою (2 50мл) і розчином солі фторенілметилоксикарбоніл)-L 29 75592 30 орнітиніл]тіазолідин [М+Н]+=310,0 Приклад 7 N -(трет-Бутилоксикарбоніл)-N (2S)-1-[S-(Ацетиламінометил)-Lфторенілметилоксикарбоніл)-L-орнітин (2,73г, цистеїніл]піролідин-2-карбонітрилу трифторацетат 6ммоль) розчиняли в СН2СІ2/ДМФ (9:1, 100мл). До цього розчину при 0°С додавали гідрат 1гідроксибензотриазолу (1,53г, 10ммоль), розчинний у воді карбодіімід (1,34г, 7ммоль), тіазолідин (1,28г, 18ммоль) і триетиламін (80мг, ммоль).Після 18год. відстоювання при від 0°С до кімнатної температури розчинник видаляли in vacuo і залишок переносили в етилацетат (100мл). Розчин промивали 0,3М KHSO4 (2 25мл), насич. NaHCO3 (2 25мл), водою (2 25мл) і розчином солі A. (2S)-1-[S-(Ацетиламінометил)-N-(трет(1 25мл), сушили (Na2SO4) і випарювали in vacuo. бутилоксикарбоніл)-L-цистеїніл]піролідин-2Залишок очищали за допомогою флеш хроматогкарбонітрил рафії (елюент: 75% етилацетат, 25% пет. ефір) з S-(Ацетиламінометил)-N-(третодержанням білої твердої речовини, визначеної як бутилоксикарбоніл)-L-цистеїн (660мг, 2,26ммоль) 3-[N -(трет-бутилоксикарбоніл)-N -(9розчиняли в СН2СІ2 (30мл). До цього розчину при фторенілметилоксикарбоніл)-L0°С додавали (2S)-піролідин-2-карбонітрилу гідроорнітиніл]тіазолідин (2,55г, 4,85ммоль, 81%). хлорид (250мг, 1,89ммоль) і РуВОР (1,3г, В. 3-[N -(трет-Бутилоксикарбоніл)-L2,49ммоль), рівень рН доводили до рН9 триетиорнітиніл]тіазолідин ламіном. Після 18год. відстоювання при від 0°С до 3-[N -(трет-Бутилоксикарбоніл)-N -(9кімнатної температури розчинник видаляли in фторенілметилоксикарбоніл)-Lvacuo і залишок переносили в етилацетат (150мл). орнітиніл]тіазолідин (1,15г, 2,13ммоль) розчиняли Розчин промивали 0,3М KHSO4 (2 30мл), насич. в ацетонітрилі (20мл). Додавали діетиламін (5мл). NaHCO3 (2 30мл), водою (2 30мл) і розчином солі Через 90хв. при кімнатній температурі розчинник (1 30мл), сушили (Na2SO4) і випарювали in vacuo. видаляли in vacuo і залишок очищали за допомоЗалишок очищали за допомогою флеш хроматоггою флеш хроматографії (елюент: 90% хлорорафії (елюент: 75% етилацетат, 25% пет. ефір) з форм, 7% метанол, 3% триетиламін) з одержанодержанням безбарвного масла, визначеного як ням блідо-жовтого масла, визначеного як 3-[N (2S)-1-[S-(ацетиламінометил)-N-(трет(трет-бутилоксикарбоніл)-L-орнітиніл]тіазолідин бутилоксикарбоніл)-L-цистеїніл]-піролідин-2(530мг,1,67ммоль, 78%). карбонітрил (650мг, 1,76ммоль, 78%). С. 3-[N -(трет-Бутилоксикарбоніл)-N В. (2S)-1-[S-(Ацетиламінометил)-L(піразиніл-2-карбоніл)-L-орнітиніл]тіазолідин цистеїніл]піролідин-2-карбонітрилу трифторацетат 3-[N -(трет-Бутилоксикарбоніл)-L(2S)-1-[S-(Ацетиламінометил)-N-(треторнітиніл]тіазолідин (80мг, 0,27ммоль) розчиняли в бутилоксикарбоніл)-L-цистеїніл]піролідин-2СН2СІ2 (20мл). До цього розчину при 0°С додавали карбонітрил (610мг, 1,65ммоль) розчиняли в триРуВrоР (146мг, 0,3ммоль), 2-піразинкарбонову фтороцтовій кислоті (30мл). Через 1год. при кімнакислоту (37мг, 0,3ммоль) і триетиламін (90мг, тній температурі розчинник видаляли in vacuo з 0,9ммоль). Після 18год. відстоювання при від 0°С одержанням безбарвного масла, визначеного як до кімнатної температури розчинник видаляли in (2S)-1-[S-(ацетиламінометил)-Lvacuo і залишок переносили в етилацетат (70мл). цистеїніл]піролідин-2-карбонітрилу трифторацетат Розчин промивали 0,3М KHSO4 (2 20мл), насич. (620мг, 1,61ммоль, 98%). NаНСО3 (2 20мл), водою (2 20мл) і розчином солі [М+Н]+=271,0 (1 20мл), сушили (Na2SO4) і випарювали in vacuo. Приклад 8 Залишок очищали за допомогою флеш хроматог(2S)-1-[(2'R)-3'-Ацетиламінометилтіо)-2'-амінорафії (елюент: 3% метанол, 97% хлороформ) з 3'-метилбутаноїл]піролідин-2-карбонітрилу триодержанням липкої білої твердої речовини, визнафторацетат ченої як 3-[N -(трет-бутилоксикарбоніл)-N (піразиніл-2-карбоніл)-L-орнітиніл]тіазолідин (45мг, 0,11ммоль, 41%). D. 3-[N -(Піразиніл-2-карбоніл)-Lорнітиніл]тіазолідину трифторацетат 3-[N -(трет-Бутилоксикарбоніл)-N -(піразиніл2-карбоніл)-L-орнітиніл]тіазолідин (45мг, 0,11ммоль) розчиняли в 4М НСІ/діоксан (10мл). Через 45хв. при кімнатній температурі розчинник видаляли in vacuo. Залишок очищали за допомоА. (2S)-1-[(2'R)-3'-Ацетиламінометилтіо)-2'гою препаративної ВЕРХ (Vydac C18, 5-50% 0,1% (трет-бутилоксикарбоніламіно)-3'ТФО/ацетонітрил в 0,1% ТФО/вода більше ніж метилбутаноїл]піролідин-2-карбонітрил 40хв. при 3мл/хв.). Фракції, які містили продукт, 3-(Ацетиламінометил)-N-(третліофілізували з одержанням безбарвного масла, бутилоксикарбоніл)пеніциламін (720мг, 2,25ммоль) розчиняли в СН2СІ2 (30мл). До цього розчину при визначеного як 3-[N -(піразиніл-2-карбоніл)-L0°С додавали (2S)-піролідин-2-карбонітрилу гідроорнітиніл]тіазолідину трифторацетат (14мг). 31 75592 32 0,14ммоль, 53%). хлорид (270мг, 2,04ммоль) і РуВОР (1,3г, 2,49ммоль), рівень рН доводили до рН9 триетиС. (2S)-1-(N -(2-Хлорпіридил-3-карбоніл)-Lламіном. Після 18год. відстоювання при від 0°С до орнітиніліпіролідин-2-карбонітрилу трифторацетат кімнатної температури розчинник видаляли in (2S)-1-[N -(трет-Бутилоксикарбоніл)-N -(2vacuo і залишок переносили в етилацетат (150мл). хлорпіридил-3-карбоніл)-L-орнітиніл]піролідин-2Розчин промивали 0,3М KHSO4 (2 30мл), насич. карбонітрил (60мг, 0,14ммоль) розчиняли в трифтороцтовій кислоті (5мл). Через 1год. при кімнатNaHCO3 (2 30мл), водою (2 30мл) і розчином солі ній температурі розчинник видаляли in vacua За(1 30мл), сушили (Na2SO4) і випарювали in vacuo. лишок очищали препаративною ВЕРХ (Vydac C18, Залишок очищали за допомогою флеш хроматог5-50% 0,1% ТФО/ацетонітрил в 0,1% ТФО/вода рафії (елюент: 75% етилацетат, 25% пет. ефір) з більше ніж 40хв. при 3мл/хв.). Фракції, які містили одержанням безбарвного масла, визначеного як продукт, ліофілізували з одержанням білої твердої (2S)-1-[(2'R)-3'-ацетиламінометилтіо)-2'-(третречовини, визначеної як (2S)-1-[N -(2-хлорпіридилбутилоксикарбоніламіно)-3'3-карбоніл)-L-орнітиніл]піролідин-2-карбонітрилу метилбутаноїл]піролідин-2-карбонітрил (742мг, трифторацетат (52мг). 1,86ммоль, 83%). [М+Н]+=350,1 В. (2S)-1-[(2'R)-3'-Ацетиламінометилтіо)-2'Приклад 10 аміно-3'-метилбутаноїл]піролідин-2-карбонітрилу трифторацетат 1-[N -(2-Хлорпіридил-3-карбоніл)-L(2S)-1-[(2'R)-3'-(Ацетиламінометилтіо)-2'-(треторнітиніл]піролідину гідрохлорид бутилоксикарбоніламіно)-3'-метилбутаноїл]піролідин-2-карбонітрил (710мг, 1,78ммоль) розчиняли в трифтороцтовій кислоті (30мл). Через 1год. при кімнатній температурі розчинник видаляли in vacuo з одержанням безбарвного масла, визначеного як (2S)-1-[(2'R)-3'(ацетиламінометилтіо)-2'-аміно-3'-метилбутаноїл]піролідин-2-карбонітрилу трифторацетат (560мг, 1,36ммоль, 76%). А. 1-(N -(трет-Бутилоксикарбоніл)-N -(2[М+Н]+=299,1 хлорпіридил-3-карбоніл)-L-орнітил)-піролідин Приклад 9 1-(N -(трет-Бутилоксикарбоніл)-L(2S)-1-[N -(2-Хлорпіридил-3-карбоніл)-Lорнітил)піролідин (20мг, 0,069ммоль) розчиняли в орнітиніл]піролідин-2-карбонітрилу трифторацетат СН2СІ2 (5мл). До цього розчину додавали 2хлорпіридин-3-карбонілхлорид (14мг, 0,076ммоль) і рівень рН доводили до рН9 триетиламіном. Через 1год. при кімнатній температурі розчинник видаляли in vacuo і залишок переносили в етилацетат (70мл). Розчин промивали 0,3М KHSO4 (2 20мл), насич. NaHCO3 (2 20мл), водою (2 20мл) і розчином солі (1 20мл), сушили (Na2SO4) і випарювали in vacuo. Залишок очищали за допомогою флеш хроматографії (елюент: 10% метанол, 90% дихлоA. (2S)-1-(N -(трет-Бутилоксикарбоніл)-Lрметан) з одержанням безбарвного масла, визнаорнітил)піролідин-2-карбонітрил ченого як 1-(N -(трет-бутилоксикарбоніл)-N -(2(2S)-1-(N -(трет-Бутилоксикарбоніл)-Lхлорпіридил-3-карбоніл)-L-орнітил)піролідин (19мг, орнітил)піролідин-2-карбонітрил одержували ме0,045ммоль, 63%). тодом, описаним для похідної лізину у Прикладі 2. В. 1-[N -(2-Хлорпіридил-3-карбоніл)-LB. (2S)-1-(N -(трет-Бутилоксикарбоніл)-N -(2орнітиніл]піролідину гідрохлорид хлорпіридил-3-карбоніл)-L-орнітил)-піролідин-2карбонітрил 1-[N -(трет-Бутилоксикарбоніл)-N -(2хлорпіридил-3-карбоніл)-L-орнітиніл]піролідин (2S)-1-(N -(трет-Бутилоксикарбоніл)-L(19мг, 0,045ммоль) розчиняли в 4М НСІ/діоксан орнітил)піролідин-2-карбонітрил (80мг, 0,26ммоль) (10мл). Через 45хв. при кімнатній температурі розрозчиняли в СН2СІ2 (20мл). До цього розчину дочинник видаляли in vacuo з одержанням білої тведавали хлорид 2-хлорпіридин-3-карбонілу (55мг, 0,32ммоль) і рівень рН доводили до рН9 триетирдої речовини, визначеної як 1-[N -хлорпіридил-3ламіном. Через 18год. при кімнатній температурі карбоніл)-L-орнітиніл]піролідину гідрохлорид розчинник видаляли in vacuo і залишок переноси(15мг). ли в етилацетат (70мл). Розчин промивали 0,3М [М+Н]+=325,1 Приклад 11 KHSO4 (2 20мл), насич. NaHCO3 (2 20мл), водою 3-[N -(2-Хлорпіридил-3-карбоніл)-L(2 20мл) і розчином солі (1 20мл), сушили орнітиніл]тіазолідину гідрохлорид (Na2SO4) і випарювали in vacuo. Залишок очищали за допомогою флеш хроматографії (елюент: 95% етилацетат, 5% пет. ефір) з одержанням безбарвного масла, визначеного як (2S)-1-(N -(третбутилоксикарбоніл)-N -(2-хлорпіридил-3-карбоніл)L-орнітил)піролідин-2-карбонітрил (60мг, 33 75592 34 89%). В. (2S)-1-[S-(Бензилоксикарбонілметил)-N(трет-бутилоксикарбоніл)-L-цистеїніл]-піролідин-2карбонітрил S-(Бензилоксикарбонілметил)-N-(третбутилоксикарбоніл)-L-цистеїн (5,10г, 13,8ммоль) розчиняли в СН2СІ2 (200мл). Цей розчин охолоджували до 0°С, додавали (2S)-піролідин-2карбонітрилу гідрохлорид (2,1г, 15,8ммоль) і РуА. 3-(N -(трет-Бутилоксикарбоніл)-N -(2ВОР (8,0г, 15,3ммоль), рівень рН доводили до рН9 хлорпіридил-3-карбоніл)-L-орнітил)-тіазолідин триетиламіном. Після 18год. відстоювання при від 3-(N -(трет-Бутилоксикарбоніл)-L0°С до кімнатної температури розчинник видаляли орнітил)тіазолідин (136мг, 0,45ммоль) розчиняли в in vacuo і залишок переносили в етилацетат СН2СІ2 (10мл). До цього розчину додавали 2(150мл). Цей розчин промивали 0,3М KHSO4 хлорпіридин-3-карбонілхлорид (88мг, 0,5ммоль) і (1 50мл), насич. NaHCO3 (1 50мл), водою рівень рН доводили до рН9 триетиламіном. Через 1год. при кімнатній температурі розчинник вида(1 50мл) і розчином солі (1 50мл), сушили ляли in vacuo і залишок переносили в етилацетат (Na2SO4) і випарювали in vacuo з одержанням жовтого масла. Його очищали за допомогою флеш (70мл). Розчин промивали 0,3М KHSO4 (2 20мл), хроматографії (елюент: 40% етилацетат, 60% пет. насич. NaHCO3 (2 20мл), водою (2 20мл) і розчиефір) з одержанням безбарвного масла, визначеном солі (1 20мл), сушили (Na2SO4) і випарювали ного як (2S)-1-[S-(бензилоксикарбонілметил)-Nin vacuo. Залишок очищали за допомогою флеш (трет-бутилоксикарбоніл)-L-цистеїніл]піролідин-2хроматографії (елюент: 1,5% метанол, 98,5% дихкарбонітрил (5,82г, 13,0ммоль, 94%). лорметан) з одержанням безбарвного масла, виС. (2S)-1-[N-(трет-Бутилоксикарбоніл)-Sзначеного як 3-(N -(трет-бутилоксикарбоніл-N (карбоксиметил)-L-цистеїніл]піролідин-2хлорпіридил-3-карбоніл)-L-орнітил)тіазолідин карбонітрил (30мг, 0,068ммоль, 15%). (2S)-1-[S-(Бензилоксикарбонілметил)-N-(третВ. 3-[N -(2-Хлорпіридил-3-карбоніл)-Lбутилоксикарбоніл)-L-цистеїніл]піролідин-2орнітиніл]тіазолідину гідрохлорид карбонітрил (1,31г, 2,9ммоль) розчиняли в ТГФ 3-[N -(трет-Бутилоксикарбоніл)-N -(2(100мл). Додавали водний розчин гідроксиду літію хлорпіридил-3-карбоніл)-L-орнітиніл]тіазолідин (1М, 3,5мл, 3,5ммоль). Через 3 години при кімнат(30мг, 0,068ммоль) розчиняли в 4М НСІ/діоксан ній температурі реакційну суміш розводили етила(10мл). Через 45хв. при кімнатній температурі розцетатом (100мл), промивали 1М лимонною кислочинник видаляли in vacuo з одержанням білої тветою, водою і розчином солі, сушили (Na2SO4) і рдої речовини, визначеної як 1-[N -(2-хлорпіридилвипарювали in vacuo з одержанням безбарвного 3-карбоніл)-L-орнітиніл]тіазолідину гідрохлорид масла. Його очищали за допомогою флеш хрома(25мг). + тографії (елюент: 97% хлороформ, 2% метанол, [М+Н] =342,1 1% оцтова кислота) з одержанням безбарвного Приклад 12 масла, визначеного як (2S)-1-[N-(трет(2S)-1-[S-{3-Піколікарбамоїлметил)-Lбутилоксикарбоніл)-S-(карбоксиметил)-Lцистеїніл]піролідин-2-карбонітрилу трифторацетат цистеїніл]піролідин-2-карбонітрил (860мг, 2,4ммоль, 82%). D. (2S)-1-[N-(трет-Бутилоксикарбоніл)-S-(3піколікарбамоїлметил)-L-цистеїніл]-піролідин-2карбонітрил (2S)-1-[N-(трет-Бутилоксикарбоніл)-S(карбоксиметил)-L-цистеїніл]піролідин-2карбонітрил (150мг, 0,42ммоль) розчиняли в СН2СІ2 (20мл). Цей розчин охолоджували до 0°С, додавали 3-(амінометил)піридин (53мг, 0,5ммоль) і РуВОР (270мг, 0,52ммоль), і рівень рН доводили до рН9 триетиламіном. Після 18год. відстоювання А. S-(Бензилоксикарбонілметил)-N-(третпри від 0°С до кімнатної температури розчинник бутилоксикарбоніл)-L-цистеїн видаляли in vacuo і залишок переносили в етилаN-(трет-Бутилоксикарбоніл)-L-цистеїн (3,5г, цетат (70мл). Цей розчин промивали 0,3М KHSO4 15,8ммоль), бензил 2-бромацетат (3,7г, (1 20мл), насич. NaHCO3 (1 20мл), водою 16,1ммоль) і триетиламін (1,8г, 18,0ммоль) розчи(1 20мл) і розчином солі (1 20мл), сушили няли в ТГФ (100мл). Через 18 годин при кімнатній (Na2SO4) і випарювали in vacuo з одержанням жотемпературі реакційну суміш розводили етилацевтого масла. Його очищали за допомогою флеш татом (100мл), промивали 0,3М KHSO4, насич. хроматографії (елюент: 96% хлороформ, 4% меNaHCO3, водою і розчином солі, сушили (Na2SO4) і танол) з одержанням безбарвного масла, визнавипарювали. Залишок очищали за допомогою ченого як (2S)-1-[N-(трет-бутилоксикарбоніл)-S-(3флеш хроматографії (елюент 95% хлороформ, 4% піколікарбамоїлметил)-L-цистеїніл]піролідин-2метанол, 1% оцтова кислота) з одержанням безкарбонітрил (170мг, 0,38ммоль, 91%). барвного масла, визначеного як SЕ. (2S)-1-[S-(3-Піколікарбамоїлметил)-L(бензилоксикарбонілметил)-N-(третцистеїніл]піролідин-2-карбонітрилу трифторацетат бутилоксикарбоніл)-L-цистеїн (5,2г, 14,1ммоль, 35 75592 36 (2S)-1-[N-(трет-Бутилоксикарбоніл)-S-(3(14мг, 0,182ммоль) при 0°С. Через 90хв. розчинник піколікарбамоїлметил)-L-цистеїніл]піролідин-2видаляли in vacuo і залишок розчиняли в СН2СІ2 карбонітрил (130мг, 0,29ммоль) розчиняли в три(20мл). Додавали 3-[N -(третфтороцтовій кислоті (10мл). Через 1 годину при бутилоксикарбоніл)орнітиніл]тіазолідин (42мг, кімнатній температурі розчинник видаляли in 0,138ммоль) і триетиламін (28мг, 0,28ммоль). Реаvacuo з одержанням білої твердої речовини, викційну суміш перемішували при кімнатній темперазначеної як (2S)-1-[5-(3-піколікарбамоїлметил)-Lтурі протягом 18 годин і розчинник видаляли in цистеїніл]піролідин-2-карбонітрилу трифторацетат vacuo. Залишок очищали за допомогою флеш (116мг, 0,25ммоль, 86%). хроматографії (елюент: 97% хлороформ, 3% ме[М+Н]+=348,2 танол) з одержанням безбарвного масла, визнаПриклад 13 ченого як 3-[N -(трет-бутилоксикарбоніл)-N -(33-[N -(2-Хіноксалоїл)-L-лізиніл]тіазолідину гідпіридилоксикарбоніл)-L-орнітиніл]тіазолідин (16мг, рохлорид 0,038ммоль, 27%). В. 3-[N -(3-Піридилоксикарбоніл)-Lорнітиніл]тіазолідину гідрохлорид 3-[N -(трет-Бутилоксикарбоніл)-N -(3піридилоксикарбоніл)-L-орнітиніл]тіазолідин (16мг, 0,038ммоль) розчиняли в 4М НСІ/діоксан (20мл). Через 1 годину при кімнатній температурі розчинник видаляли in vacuo з одержанням білої твердої речовини, визначеної як 3-[N -(3піридилоксикарбоніл)-L-орнітиніл]тіазолідину гідA. 3-[N -(трет-Бутилоксикарбоніл)-N рохлорид (14мг, 0,038ммоль, 100%). хіноксалоїл)-L-лізиніл]тіазолідин [М+Н]+=325,1 3-[N -(третПриклад 15 Бутилоксикарбоніл)лізиніл]тіазолідин (128мг, 3-[О-(30,4ммоль) розчиняли в СН2СІ2 (10мл). Додавали 2Хлорбензилкарбамоїл)сериніл]тіазолідину гідроххіноксалоїлхлорид (85мг, 0,44ммоль) і карбонат лорид калію (45,8мг, 0,3ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 18 годин і розчинник видаляли in vacuo. Залишок очищали за допомогою флеш хроматографії (елюент: 99,5% хлороформ, 0,5% метанол) з одержанням безбарвного масла, визначеного як 3-[N (трет-бутилоксикарбоніл)-N -(2-хіноксалоїл)-Lлізиніл]тіазолідин (140мг, 0,296ммоль, 74%). B. 3-N -(2-Хіноксалоїл)-L-лізиніл]тіазолідину гідрохлорид А. 3-[N-(трет-Бутилоксикарбоніл)-L3-[N -(трет-Бутилоксикарбоніл)-N -(2сериніл]тіазолідин хіноксалоїл)-L-лізиніл]тіазолідин (140мг, N-(трет-Бутилоксикарбоніл)-L-серин (2,1г, 0,296ммоль) розчиняли в 4М НСІ/діоксан (20мл). 10,2ммоль) розчиняли в СН2СІ2/ДМФ (9:1,50мл). Через 1 годину при кімнатній температурі розчинДодавали тіазолідин (650мг, 11,2ммоль), гідроксиник видаляли in vacuo з одержанням білої твердої бензотриазол (2,8г, 20,7ммоль) і розчинний у воді речовини, визначеної як 3-[N -(2-хіноксалоїл)-Lкарбодіімід (3,9г, 19,5ммоль) при 0°С. Рівень рН лізиніл]тіазолідину гідрохлорид (128мг, доводили до рН8 N-метилморфоліном. Реакційну 0,296ммоль, 100%). суміш перемішували при кімнатній температурі [М+Н]+=374,2 протягом 18 годин, розчинник видаляли in vacuo і Приклад 14 залишок переносили в етилацетат (150мл). Цей 3-[N -(3-Піридилоксикарбоніл)-Lрозчин промивали 0,3М KHSO4 (1 50мл), насич. орнітиніл]тіазолідину гідрохлорид NaHCO3 (1 50мл), водою (1 50мл) і розчином солі (1 50мл), сушили (Na2SO4) і випарювали in vacuo з одержанням білої твердої речовини, визначеної як 3-[N-(трет-бутилоксикарбоніл)-L-сериніл]тіазолідин (2,15г, 7,78ммоль, 76%). В. 3-[N-(трет-Бутилоксикарбоніл)-О-(3хлорбензилкарбамоїл)-L-сериніл]тіазолідин 3-[N-(трет-Бутилоксикарбоніл)-Lсериніл]тіазолідин (110мг, 0,48ммоль) розчиняли в ДМФ (10мл) і додавали 1,1'-карбоніл-діімідазол (71мг, 0,43ммоль. Через 2 години при кімнатній А. 3-[N -(трет-Бутилоксикарбоніл)N -(3температурі додавали 3-хлорбензиламін (62мг, піридилоксикарбоніл)-L-орнітиніл]тіазолідин 0,4ммоль). Через наступні 18 годин додавали 3-Гідроксипіридин (14,9мг, 0,138ммоль) розчиЕtOАс (200мл). Цей розчин промивали 0,3М няли в СН2СІ2 (20мл). Додавали фосген (20% розKHSO4 (1 50мл), насич. NaHCO3 (1 50мл), водою чин в толуолі, 0,335мл, 0,685ммоль) і піридин 37 75592 38 хлорбензилкарбамоїл)-L-сериніл]тіазолідин (4 50мл) і розчином солі (1 50мл), сушили (140мг, 0,32ммоль) розчиняли в 4М НСІ/діоксан (Na2SO4) і випарювали in vacuo з одержанням жо(20мл). Через 1 годину при кімнатній температурі втого масла. Його очищали за допомогою флеш розчинник видаляли in vacuo з одержанням білої хроматографії (елюент: 40% етилацетат, 60% пет. твердої речовини, визначеної як 3-[O-(3ефір) з одержанням безбарвного масла, визначехлорбензилкарбамоїл)-L-сериніл]тіазолідину гідного як 3-[N-(трет-бутилоксикарбоніл)-O-(3рохлорид (115мг, 0,3ммоль, 94%). хлорбензилкарбамоїл)-L-сериніл]тіазолідин [М+Н]+=344,1 (158мг, 0,36ммоль, 90%). Приклади, наведені у наступних Таблицях, буС. 3-[O-(3-Хлорбензилкарбамоїл)-Lли одержані методами, аналогічними вищеописасериніл]тіазолідину гідрохлорид ним. 3-[N-(трет-Бутилоксикарбоніл)-O-(3 39 75592 40 41 75592 42 43 75592 44 45 75592 46 47 75592 48 49 75592 50 51 75592 52 із пероральним шляхом введення. Контрольним пацюками перорально давали розчин глюкози і визначали рівень глюкози у плазмі. У цих пацюків спостерігали значну гіперглікемію. Сполуки згідно з даним винаходом розчиняли в розчині глюкози у різних концентраціях таким чином, що пацюкам давали різні дози сполуки одночасно з викликом глюкози. Гіперглікемічне відхилення зменшувалось у залежності від дози у тварин, які одержали від 0,1 до 100мг/кг інгібітора ДП-IV. Приклад 453 Фармацевтична рецептура Таблетки, які містили 100мг сполуки Прикладу 1 у якості активного агента одержували з наступних компонентів: Сполука Прикладу 1 200,0г Кукурудзяний крохмаль 71,0г Гідроксипропілцелюлоза 18,0г Кабоксиметилцелюлоза кальцію 13,0г Стеарат магнію 3,0г Лактоза 195,0г Разом 500,0г Матеріали змішували і потім запресовували з одержанням 2000 таблеток 250мг, кожна містила 100мг сполуки Прикладу 1. Приклад 451 Вищенаведене показує, що сполуки згідно з Визначення активності даним винаходом є інгібіторами ДП-IV і очікується, Сполуки досліджувались як інгібітори ДП-IV віщо вони будуть корисними у якості терапевтичних дповідно до методів, описаних в W095/15309. Всі агентів для лікування зменшеної толерантності до сполуки, описані у вищенаведених прикладах, буглюкози, діабету типу II, та інших захворювань, при ли інгібіторами ДП-IV, які порівнювали, із значеняких інгібування цього ензиму приведе до покраням К, менше ніж 300нМ. щення стану при існуючій патології, або зменшенПриклад 452 ня симптомів. Визначення активності in vivo Даний винахід визначений у наступній формуАнтидіабетичну дію вибраних сполук демонлі. стрували на товстих пацюках Цукера, застосовуючи стандартний тест на толерантність до глюкози Комп‟ютерна верстка О. Гапоненко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюInhibitors of dipeptidyl peptidase iv, pharmaceutical composition based thereof, composition for treatment and method for treatment of diseases
Назва патенту російськоюИнгибиторы дипептидилпептидазы iv, фармацевтическая композиция на их основе, композиция для лечения и способ лечения заболеваний
Автори російськоюEvans, David, Michael
МПК / Мітки
МПК: C07D 417/12, C07D 207/16, C07D 405/12, C07D 413/12, C07D 277/06, C07D 295/18, C07D 401/12, C07D 417/06, C07D 409/12, C07D 471/04, A61P 5/50, A61K 31/401, A61K 31/425, C07D 403/12
Мітки: спосіб, фармацевтична, основі, лікування, інгібітори, захворювань, дипептидилпептидази, композиція
Код посилання
<a href="https://ua.patents.su/26-75592-ingibitori-dipeptidilpeptidazi-iv-farmacevtichna-kompoziciya-na-kh-osnovi-kompoziciya-dlya-likuvannya-ta-sposib-likuvannya-zakhvoryuvan.html" target="_blank" rel="follow" title="База патентів України">Інгібітори дипептидилпептидази iv, фармацевтична композиція на їх основі, композиція для лікування та спосіб лікування захворювань</a>
Попередній патент: Спосіб лікування розладів акомодації та різних видів рефракції
Наступний патент: Сплав на основі заліза, що містить хром-вольфрамовий карбід, та спосіб його виробництва
Випадковий патент: Вібраційний транспортер












