Кристалічний поліморф базедоксифену ацетату
Номер патенту: 85703
Опубліковано: 25.02.2009
Автори: Демерсон Крістофер, Ієра Сільвіо, Алі Кадум А.
Формула / Реферат
1. Кристалічний поліморф (форма А) базедоксифену ацетату, що має рентгенограму на порошку, яка включає характеристичні піки, у показниках ![]() , при приблизно 12,7° та приблизно 18,5°.
, при приблизно 12,7° та приблизно 18,5°.
2. Поліморф за п. 1, у якому зазначена рентгенограма на порошку додатково включає характеристичні піки, у показниках ![]() , при приблизно 16,0°, приблизно 20,7° та приблизно 22,3°.
, при приблизно 16,0°, приблизно 20,7° та приблизно 22,3°.
3. Поліморф за п. 1, у якому зазначена рентгенограма на порошку включає принаймні 5 характеристичних піків, у показниках ![]() , вибраних з приблизно 9,8°, приблизно 12,7°, приблизно 15,2°, приблизно 16,0°, приблизно 17,1°, приблизно 17,4°, приблизно 18,5°, приблизно 18,8°, приблизно 19,6°, приблизно 20,4°, приблизно 20,7°, приблизно 22,3°, приблизно 23,5°, приблизно 24,9°, приблизно 25,6°, приблизно 26,1°, приблизно 27,4°, приблизно 28,0°, приблизно 28,7°, приблизно 29,6°, приблизно 29,9° та приблизно 30,7°.
, вибраних з приблизно 9,8°, приблизно 12,7°, приблизно 15,2°, приблизно 16,0°, приблизно 17,1°, приблизно 17,4°, приблизно 18,5°, приблизно 18,8°, приблизно 19,6°, приблизно 20,4°, приблизно 20,7°, приблизно 22,3°, приблизно 23,5°, приблизно 24,9°, приблизно 25,6°, приблизно 26,1°, приблизно 27,4°, приблизно 28,0°, приблизно 28,7°, приблизно 29,6°, приблизно 29,9° та приблизно 30,7°.
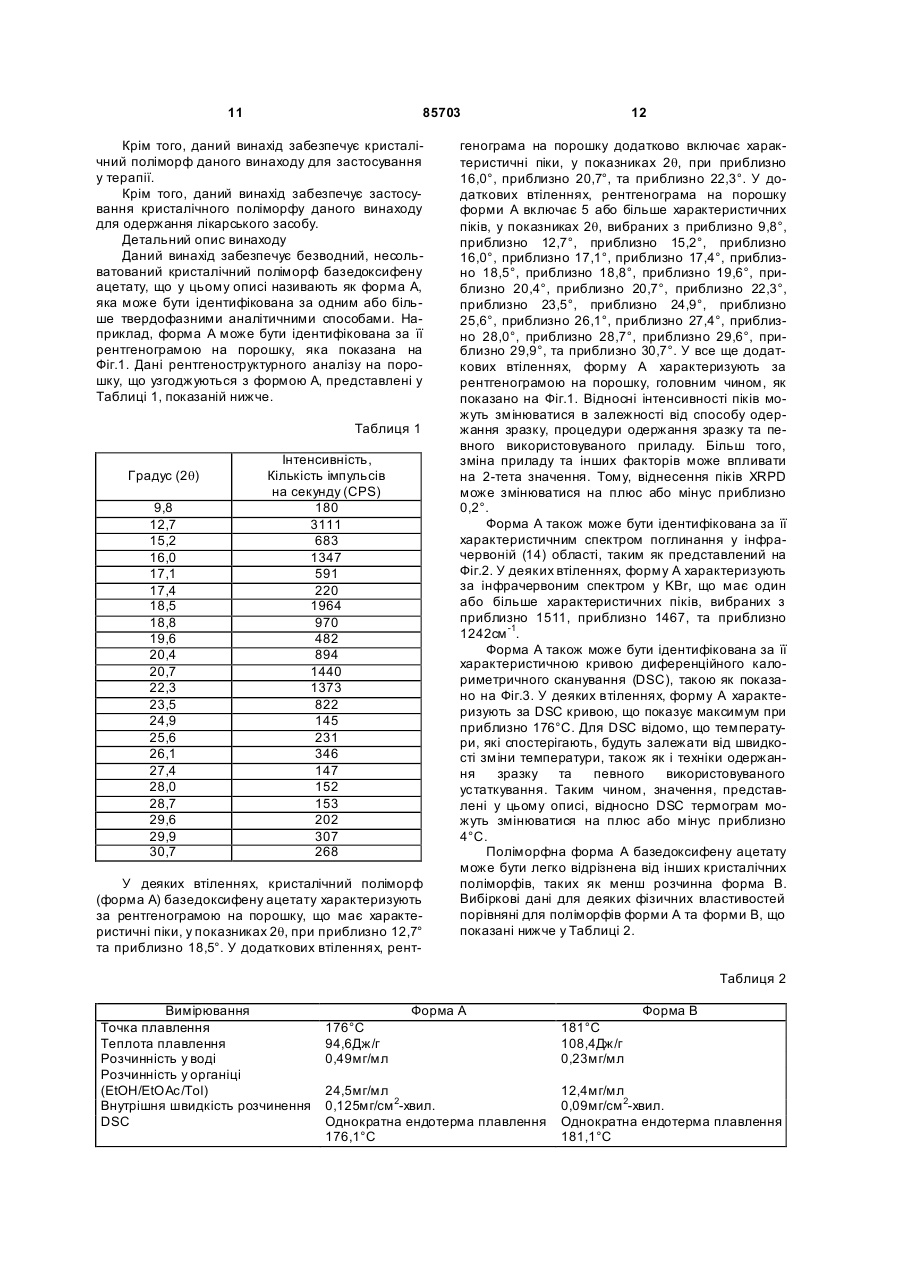
4. Поліморф за п. 1, що має рентгенограму на порошку в основному таку, як показана на Фігурі 1.
5. Поліморф за п. 1, що має інфрачервоний спектр у КВr, що включає один або більше характеристичних піків, вибраних з приблизно 1511, приблизно 1467 та приблизно 1242см-1.
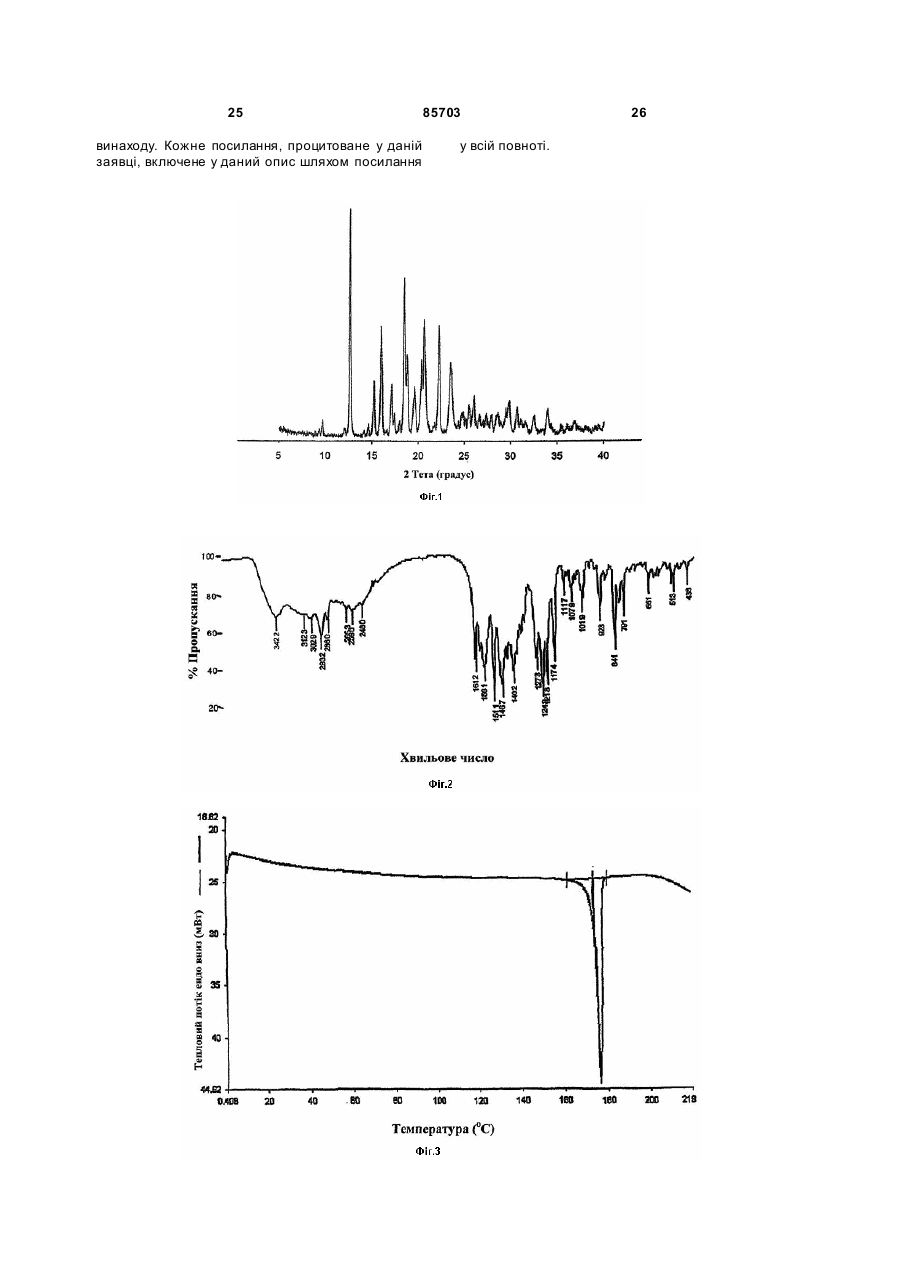
6. Поліморф за п. 1, що має інфрачервоний спектр у КВr в основному такий, як показаний на Фігурі 2.
7. Поліморф за п. 1, що має криву диференційної скануючої калориметрії, яка показує максимум при приблизно 176° С.
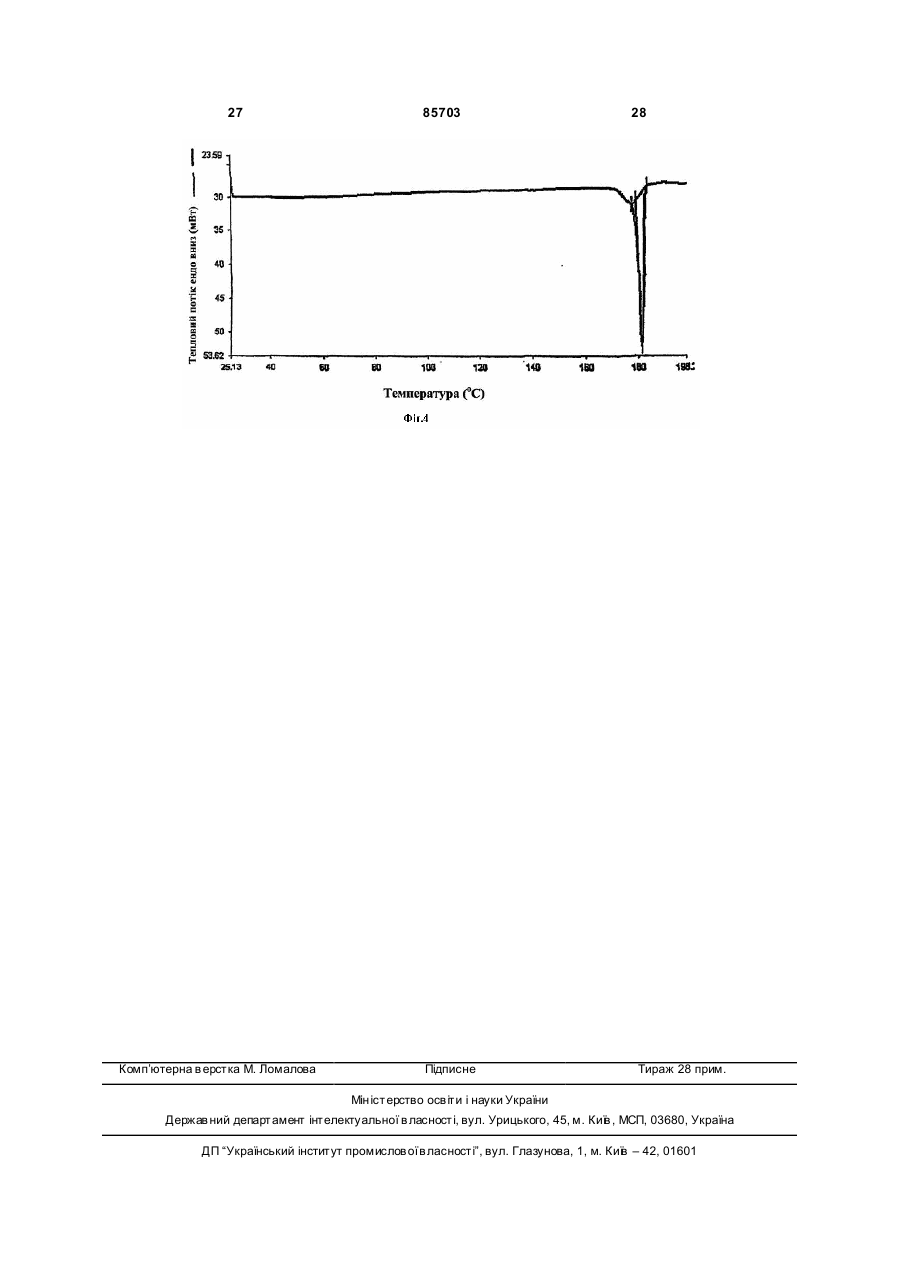
8. Поліморф за п. 1, що має криву диференційної скануючої калориметрії в основному таку, як показана на Фігурі 3.
9. Композиція, що містить поліморф за будь-яким з пп. 1-8 та необов'язково один або більше фармацевтично прийнятних додатків.
10. Композиція за п. 9, у якій принаймні приблизно 50 % за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу.
11. Композиція за п. 9, у якій принаймні приблизно 70 % за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу.
12. Композиція за п. 9, у якій принаймні приблизно 80 % за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу.
13. Композиція за п. 9, у якій принаймні приблизно 90 % за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу.
14. Композиція за п. 9, у якій принаймні приблизно 95 % за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу.
15. Композиція за п. 9, у якій принаймні приблизно 97 % за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу.
16. Композиція за п. 9, у якій принаймні приблизно 98,0 % за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу.
17. Композиція за п. 9, у якій принаймні приблизно 98,1 % за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу.
18. Композиція за п. 9, у якій принаймні приблизно 98,2% за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу.
19. Композиція за п. 9, у якій принаймні приблизно 98,3 % за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу.
20. Композиція за п. 9, у якій принаймні приблизно 98,4 % за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу.
21. Композиція за п. 9, у якій принаймні приблизно 98,5 % за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу.
22. Композиція за п. 9, у якій принаймні приблизно 98,6 % за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу.
23. Композиція за п. 9, у якій принаймні приблизно 98,7 % за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу.
24. Композиція за п. 9, у якій принаймні приблизно 98,8 % за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу.
25. Композиція за п. 9, у якій принаймні приблизно 98,9 % за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу.
26. Композиція за п. 9, у якій принаймні приблизно 99,0 % за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу.
27. Композиція за п. 9, у якій принаймні приблизно 99,1 % за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу.
28. Композиція за п. 9, у якій принаймні приблизно 99,2 % за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу.
29. Композиція за п. 9, у якій принаймні приблизно 99,3 % за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу.
30. Композиція за п. 9, у якій принаймні приблизно 99,4 % за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу.
31. Композиція за п. 9, у якій принаймні приблизно 99,5 % за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу.
32. Композиція за п. 9, у якій принаймні приблизно 99,6 % за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу.
33. Композиція за п. 9, у якій принаймні приблизно 99,7 % за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу.
34. Композиція за п. 9, у якій принаймні приблизно 99,8 % за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу.
35. Композиція за п. 9, у якій принаймні приблизно 99,9 % за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу.
36. Композиція, що містить зазначений поліморф за будь-яким з пп. 1-8 (Форма А) та Форми В.
37. Композиція за п. 36, що містить від приблизно 70 до приблизно 90 % за масою Форми А та від приблизно 10 до приблизно 30 % за масою Форми В.
38. Композиція за п. 36, що містить від приблизно 75 до приблизно 85 % за масою Форми А та від приблизно 15 до приблизно 25 % за масою Форми В.
39. Композиція за п. 36, що містить від приблизно 78 до приблизно 92 % за масою Форми А та від приблизно 18 до приблизно 22 % за масою Форми В.
40. Композиція за п. 36, що містить приблизно 80 % за масою Форми А та приблизно 20 % за масою Форми В.
41. Композиція, що містить базедоксифену ацетат, у якому від приблизно 70 % до приблизно 90 % за масою загального базедоксифену ацетату у зазначеній композиції присутні як Поліморф за п. 1 (Форма А) та від приблизно 10 до приблизно 30 % за масою загального базедоксифену ацетату у зазначеній композиції присутні як Форма В.
42. Композиція, що містить базедоксифену ацетат, у якому від приблизно 75 % до приблизно 85 % за масою загального базедоксифену ацетату у зазначеній композиції присутні як Поліморф за п. 1 (Форма А) та від приблизно 15 до приблизно 25 % за масою загального базедоксифену ацетату у зазначеній композиції присутні як Форма В.
43. Композиція, що містить базедоксифену ацетат, у якому від приблизно 78 % до приблизно 82 % за масою загального базедоксифену ацетату у зазначеній композиції присутні як Поліморф за п. 1 (Форма А) та від приблизно 18 до приблизно 22 % за масою загального базедоксифену ацетату у зазначеній композиції присутні як Форма В.
44. Композиція, що містить базедоксифену ацетат, у якому приблизно 80 % за масою загального базедоксифену ацетату у зазначеній композиції присутні як Поліморф за п. 1 (Форма А) та приблизно 20 % за масою загального базедоксифену ацетату у зазначеній композиції присутні як Форма В.
45. Композиція, що містить поліморф за будь-яким з пп. 1-8 та фармацевтично прийнятний носій.
46. Композиція, що містить в основному базедоксифену ацетат, де принаймні 95 % за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у вигляді поліморфу за будь-яким з пп. 1-8.
47. Композиція, що містить в основному базедоксифену ацетат, де принаймні 97 % за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у вигляді поліморфу за будь-яким з пп. 1-8.
48. Композиція, що містить в основному базедоксифену ацетат, де принаймні 98,0 % за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у вигляді поліморфу за будь-яким з пп. 1-8.
49. Композиція, що містить в основному базедоксифену ацетат, де принаймні 98,1 % за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у вигляді поліморфу за будь-яким з пп. 1-8.
50. Композиція, що містить в основному базедоксифену ацетат, де принаймні 98,2 % за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у вигляді поліморфу за будь-яким з пп. 1-8.
51. Композиція, що містить в основному базедоксифену ацетат, де принаймні 98,3 % за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у вигляді поліморфу за будь-яким з пп. 1-8.
52. Композиція, що містить в основному базедоксифену ацетат, де принаймні 98,4 % за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у вигляді поліморфу за будь-яким з пп. 1-8.
53. Композиція, що містить в основному базедоксифену ацетат, де принаймні 98,5 % за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у вигляді поліморфу за будь-яким з пп. 1-8.
54. Композиція, що містить в основному базедоксифену ацетат, де принаймні 98,6 % за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у вигляді поліморфу за будь-яким з пп. 1-8.
55. Композиція, що містить в основному базедоксифену ацетат, де принаймні 98,7 % за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у вигляді поліморфу за будь-яким з пп. 1-8.
56. Композиція, що містить в основному базедоксифену ацетат, де принаймні 98,8 % за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у вигляді поліморфу за будь-яким з пп. 1-8.
57. Композиція, що містить в основному базедоксифену ацетат, де принаймні 98,9 % за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у вигляді поліморфу за будь-яким з пп. 1-8.
58. Композиція, що містить в основному базедоксифену ацетат, де принаймні 99,0 % за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у вигляді поліморфу за будь-яким з пп. 1-8.
59. Композиція, що містить в основному базедоксифену ацетат, де принаймні 99,1 % за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у вигляді поліморфу за будь-яким з пп. 1-8.
60. Композиція, що містить в основному базедоксифену ацетат, де принаймні 99,2 % за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у вигляді поліморфу за будь-яким з пп. 1-8.
61. Композиція, що містить в основному базедоксифену ацетат, де принаймні 99,3 % за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у вигляді поліморфу за будь-яким з пп. 1-8.
62. Композиція, що містить в основному базедоксифену ацетат, де принаймні 99,4 % за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у вигляді поліморфу за будь-яким з пп. 1-8.
63. Композиція, що містить в основному базедоксифену ацетат, де принаймні 99,5 % за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у вигляді поліморфу за будь-яким з пп. 1-8.
64. Композиція, що містить в основному базедоксифену ацетат, де принаймні 99,6 % за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у вигляді поліморфу за будь-яким з пп. 1-8.
65. Композиція, що містить в основному базедоксифену ацетат, де принаймні 99,7 % за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у вигляді поліморфу за будь-яким з пп. 1-8.
66. Композиція, що містить в основному базедоксифену ацетат, де принаймні 99,8 % за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у вигляді поліморфу за будь-яким з пп. 1-8.
67. Композиція, що містить в основному базедоксифену ацетат, де принаймні 99,9 % за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у вигляді поліморфу за будь-яким з пп. 1-8.
68. Композиція, що містить поліморф за будь-яким з пп. 1-8 та один або більше стероїдних естрогенів.
69. Композиція за п. 68, у якій зазначений стероїдний естрогенний компонент включає кон'юговані естрогени.
70. Спосіб одержання базедоксифену ацетату поліморфної форми А, що включає:
a) введення у реакцію гексаметиленіміно-бензилоксиіндолу з гідрогенуючим агентом у розчиннику та необов'язково у присутності каталізатору гідрогенування впродовж часу та в умовах, прийнятних для утворення реакційної суміші, що містить базедоксифенову вільну основу;
b) обробку реакційної суміші оцтовою кислотою впродовж часу та в умовах, прийнятних для утворення базедоксифену ацетату поліморфної форми А.
71. Спосіб за п. 70, у якому зазначений розчинник являє собою спирт.
72. Спосіб за п. 71, у якому зазначений спирт являє собою етанол.
73. Спосіб за п. 70 або п. 71, у якому зазначений розчинник додатково містить етилацетат.
74. Спосіб за будь-яким з пп. 70-73, у якому зазначений гідрогенуючий агент являє собою Н2.
75. Спосіб за будь-яким з пп. 70-74, у якому зазначений каталізатор гідрогенування являє собою Pd/C.
76. Спосіб за будь-яким з пп. 70-75, у якому зазначену обробку стадії b) виконують у присутності антиоксиданту.
77. Спосіб за п. 76, у якому зазначений антиоксидант являє собою аскорбінову кислоту.
78. Спосіб за будь-яким з пп. 70-77, у якому зазначену обробку стадії b) виконують при температурі приблизно 25°С або нижчій.
79. Спосіб за будь-яким з пп. 70-78, який додатково включає витримування реакційної суміші стадії b) при температурі від приблизно -20 до приблизно 20 °С впродовж принаймні приблизно 2 годин.
80. Спосіб за будь-яким з пп. 70-78, який додатково включає витримування реакційної суміші стадії b) при температурі приблизно 20 °С впродовж принаймні приблизно 2 годин.
81. Спосіб за будь-яким з пп. 70-78, який додатково включає витримування реакційної суміші стадії b) при температурі приблизно 0 °С впродовж принаймні приблизно 2 годин.
82. Спосіб одержання базедоксифену ацетату поліморфної форми А, що включає кристалізування базедоксифену ацетату з розчину, що містить спирт, де зазначений розчин підтримують при температурі нижче приблизно 20 °С.
83. Спосіб за п. 82, де зазначений розчин підтримують при температурі нижче приблизно 10 °С.
84. Спосіб за п. 82 або 83, де зазначений спирт являє собою етанол.
85. Спосіб лікування ссавця, що має хворобу або синдром, пов'язаний з недостатністю естрогену або надлишком естрогену, що включає введення зазначеному ссавцю терапевтично ефективної кількості поліморфу за будь-яким з пп. 1-8.
86. Спосіб лікування ссавця, що має хворобу або розлад, пов'язаний з проліферацією або анормальним розвитком ендометріальних тканин, що включає введення зазначеному ссавцю терапевтично ефективної кількості поліморфу за будь-яким з пп. 1-8.
87. Спосіб зниження холестерину у ссавця, що включає введення зазначеному ссавцю терапевтично ефективної кількості поліморфу за будь-яким з пп. 1-8.
88. Спосіб інгібування втрати кісткової тканини у ссавця, що включає введення зазначеному ссавцю терапевтично ефективної кількості поліморфу за будь-яким з пп. 1-8.
89. Спосіб лікування раку молочної залози у ссавця, що включає введення зазначеному ссавцю терапевтично ефективної кількості поліморфу за будь-яким з пп. 1-8.
90. Спосіб лікування жінки в постменопаузі з одним або більше вазомоторними розладами, що включає введення зазначеній жінці в постменопаузі терапевтично ефективної кількості поліморфу за будь-яким з пп. 1-8.
91. Спосіб за п. 90, у якому вазомоторний розлад являє собою припливи.
92. Кристалічний поліморф форми А базедоксифену ацетату, одержаний відповідно до способу за будь-яким з пп. 70-81.
93. Поліморф за будь-яким з пп. 1-8, одержаний за способом, що включає:
a) введення у реакцію гексаметиленіміно-бензилоксиіндолу з гідрогенуючим агентом у розчиннику та необов'язково у присутності каталізатора гідрогенування впродовж часу та в умовах, прийнятних для утворення реакційної суміші, що містить базедоксифенову вільну основу;
b) обробку реакційної суміші оцтовою кислотою впродовж часу та в умовах, прийнятних для утворення базедоксифену ацетату поліморфної форми А.
94. Поліморф за будь-яким з пп. 1-8, одержаний відповідно до способів, що включають кристалізування базедоксифену ацетату з розчину, що містить спирт, де зазначений розчин підтримують при температурі нижче приблизно 20 °С.
Текст
1. Кристалічний поліморф (форма А) базедоксифену ацетату, що має рентгенограму на порошку, яка включає характеристичні піки, у показниках 2q , при приблизно 12,7° та приблизно 2. Поліморф за п. 1, у якому зазначена рентгеног18,5°. рама на порошку додатково включає характеристичні піки, у показниках 2q , при приблизно 16,0°, приблизно 20,7° та приблизно 3. Поліморф за п. 1, у якому зазначена рентгеног22,3°. рама на порошку включає принаймні 5 характеристичних піків, у показниках 2q , вибраних з приблизно 9,8°, приблизно 12,7°, приблизно 15,2°, приблизно 16,0°, приблизно 17,1°, приблизно 17,4°, приблизно 18,5°, приблизно 18,8°, приблизно 19,6°, приблизно 20,4°, приблизно 20,7°, приблизно 22,3°, приблизно 23,5°, приблизно 24,9°, приблизно 25,6°, приблизно 26,1°, приблизно 2 (19) 1 3 16. Композиція за п. 9, у якій принаймні приблизно 98,0% за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу. 17. Композиція за п. 9, у якій принаймні приблизно 98,1% за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу. 18. Композиція за п. 9, у якій принаймні приблизно 98,2% за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу. 19. Композиція за п. 9, у якій принаймні приблизно 98,3% за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу. 20. Композиція за п. 9, у якій принаймні приблизно 98,4% за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу. 21. Композиція за п. 9, у якій принаймні приблизно 98,5% за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу. 22. Композиція за п. 9, у якій принаймні приблизно 98,6% за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу. 23. Композиція за п. 9, у якій принаймні приблизно 98,7% за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу. 24. Композиція за п. 9, у якій принаймні приблизно 98,8% за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу. 25. Композиція за п. 9, у якій принаймні приблизно 98,9% за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу. 26. Композиція за п. 9, у якій принаймні приблизно 99,0% за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу. 27. Композиція за п. 9, у якій принаймні приблизно 99,1% за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу. 28. Композиція за п. 9, у якій принаймні приблизно 99,2% за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу. 29. Композиція за п. 9, у якій принаймні приблизно 99,3% за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу. 30. Композиція за п. 9, у якій принаймні приблизно 99,4% за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу. 31. Композиція за п. 9, у якій принаймні приблизно 99,5% за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу. 85703 4 32. Композиція за п. 9, у якій принаймні приблизно 99,6% за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу. 33. Композиція за п. 9, у якій принаймні приблизно 99,7% за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу. 34. Композиція за п. 9, у якій принаймні приблизно 99,8% за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу. 35. Композиція за п. 9, у якій принаймні приблизно 99,9% за масою загального базедоксифену ацетату у зазначеній композиції присутні у вигляді зазначеного поліморфу. 36. Композиція, що містить зазначений поліморф за будь-яким з пп. 1-8 (Форма А) та Форми В. 37. Композиція за п. 36, що містить від приблизно 70 до приблизно 90% за масою Форми А та від приблизно 10 до приблизно 30% за масою Форми В. 38. Композиція за п. 36, що містить від приблизно 75 до приблизно 85% за масою Форми А та від приблизно 15 до приблизно 25% за масою Форми В. 39. Композиція за п. 36, що містить від приблизно 78 до приблизно 92% за масою Форми А та від приблизно 18 до приблизно 22% за масою Форми В. 40. Композиція за п. 36, що містить приблизно 80% за масою Форми А та приблизно 20% за масою Форми В. 41. Композиція, що містить базедоксифену ацетат, у якому від приблизно 70% до приблизно 90% за масою загального базедоксифену ацетату у зазначеній композиції присутні як Поліморф за п. 1 (Форма А) та від приблизно 10 до приблизно 30% за масою загального базедоксифену ацетату у зазначеній композиції присутні як Форма В. 42. Композиція, що містить базедоксифену ацетат, у якому від приблизно 75% до приблизно 85% за масою загального базедоксифену ацетату у зазначеній композиції присутні як Поліморф за п. 1 (Форма А) та від приблизно 15 до приблизно 25% за масою загального базедоксифену ацетату у зазначеній композиції присутні як Форма В. 43. Композиція, що містить базедоксифену ацетат, у якому від приблизно 78% до приблизно 82% за масою загального базедоксифену ацетату у зазначеній композиції присутні як Поліморф за п. 1 (Форма А) та від приблизно 18 до приблизно 22% за масою загального базедоксифену ацетату у зазначеній композиції присутні як Форма В. 44. Композиція, що містить базедоксифену ацетат, у якому приблизно 80% за масою загального базедоксифену ацетату у зазначеній композиції присутні як Поліморф за п. 1 (Форма А) та приблизно 20% за масою загального базедоксифену ацетату у зазначеній композиції присутні як Форма В. 45. Композиція, що містить поліморф за будь-яким з пп. 1-8 та фармацевтично прийнятний носій. 46. Композиція, що містить в основному базедоксифену ацетат, де принаймні 95% за масою зазначеного базедоксифену ацетату присутні у за 5 значеній композиції у ви гляді поліморфу за будьяким з пп. 1-8. 47. Композиція, що містить в основному базедоксифену ацетат, де принаймні 97% за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у ви гляді поліморфу за будьяким з пп. 1-8. 48. Композиція, що містить в основному базедоксифену ацетат, де принаймні 98,0% за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у ви гляді поліморфу за будьяким з пп. 1-8. 49. Композиція, що містить в основному базедоксифену ацетат, де принаймні 98,1% за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у ви гляді поліморфу за будьяким з пп. 1-8. 50. Композиція, що містить в основному базедоксифену ацетат, де принаймні 98,2% за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у ви гляді поліморфу за будьяким з пп. 1-8. 51. Композиція, що містить в основному базедоксифену ацетат, де принаймні 98,3% за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у ви гляді поліморфу за будьяким з пп. 1-8. 52. Композиція, що містить в основному базедоксифену ацетат, де принаймні 98,4% за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у ви гляді поліморфу за будьяким з пп. 1-8. 53. Композиція, що містить в основному базедоксифену ацетат, де принаймні 98,5% за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у ви гляді поліморфу за будьяким з пп. 1-8. 54. Композиція, що містить в основному базедоксифену ацетат, де принаймні 98,6% за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у ви гляді поліморфу за будьяким з пп. 1-8. 55. Композиція, що містить в основному базедоксифену ацетат, де принаймні 98,7% за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у ви гляді поліморфу за будьяким з пп. 1-8. 56. Композиція, що містить в основному базедоксифену ацетат, де принаймні 98,8% за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у ви гляді поліморфу за будьяким з пп. 1-8. 57. Композиція, що містить в основному базедоксифену ацетат, де принаймні 98,9% за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у ви гляді поліморфу за будьяким з пп. 1-8. 58. Композиція, що містить в основному базедоксифену ацетат, де принаймні 99,0% за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у ви гляді поліморфу за будьяким з пп. 1-8. 59. Композиція, що містить в основному базедоксифену ацетат, де принаймні 99,1% за масою зазначеного базедоксифену ацетату присутні у за 85703 6 значеній композиції у ви гляді поліморфу за будьяким з пп. 1-8. 60. Композиція, що містить в основному базедоксифену ацетат, де принаймні 99,2% за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у ви гляді поліморфу за будьяким з пп. 1-8. 61. Композиція, що містить в основному базедоксифену ацетат, де принаймні 99,3% за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у ви гляді поліморфу за будьяким з пп. 1-8. 62. Композиція, що містить в основному базедоксифену ацетат, де принаймні 99,4% за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у ви гляді поліморфу за будьяким з пп. 1-8. 63. Композиція, що містить в основному базедоксифену ацетат, де принаймні 99,5% за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у ви гляді поліморфу за будьяким з пп. 1-8. 64. Композиція, що містить в основному базедоксифену ацетат, де принаймні 99,6% за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у ви гляді поліморфу за будьяким з пп. 1-8. 65. Композиція, що містить в основному базедоксифену ацетат, де принаймні 99,7% за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у ви гляді поліморфу за будьяким з пп. 1-8. 66. Композиція, що містить в основному базедоксифену ацетат, де принаймні 99,8% за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у ви гляді поліморфу за будьяким з пп. 1-8. 67. Композиція, що містить в основному базедоксифену ацетат, де принаймні 99,9% за масою зазначеного базедоксифену ацетату присутні у зазначеній композиції у ви гляді поліморфу за будьяким з пп. 1-8. 68. Композиція, що містить поліморф за будь-яким з пп. 1-8 та один або більше стероїдних естрогенів. 69. Композиція за п. 68, у якій зазначений стероїдний естрогенний компонент включає кон'юговані естрогени. 70. Спосіб одержання базедоксифену ацетату поліморфної форми А, що включає: a) введення у реакцію гексаметиленімінобензилоксиіндолу з гідрогенуючим агентом у розчиннику та необов'язково у присутності каталізатору гідрогенування впродовж часу та в умовах, прийнятних для утворення реакційної суміші, що містить базедоксифенову вільну основу; b) обробку реакційної суміші оцтовою кислотою впродовж часу та в умовах, прийнятних для утворення базедоксифену ацетату поліморфної форми А. 71. Спосіб за п. 70, у якому зазначений розчинник являє собою спирт. 72. Спосіб за п. 71, у якому зазначений спирт являє собою етанол. 73. Спосіб за п. 70 або п. 71, у якому зазначений розчинник додатково містить етилацетат. 7 85703 74. Спосіб за будь-яким з пп. 70-73, у якому зазначений гідрогенуючий агент являє собою Н2. 75. Спосіб за будь-яким з пп. 70-74, у якому зазначений каталізатор гідрогенування являє собою Pd/C. 76. Спосіб за будь-яким з пп. 70-75, у якому зазначену обробку стадії b) виконують у присутності антиоксиданту. 77. Спосіб за п. 76, у якому зазначений антиоксидант являє собою аскорбінову кислоту. 78. Спосіб за будь-яким з пп. 70-77, у якому зазначену обробку стадії b) виконують при температурі приблизно 25°С або нижчій. 79. Спосіб за будь-яким з пп. 70-78, який додатково включає витримування реакційної суміші стадії b) при температурі від приблизно -20 до приблизно 20°С впродовж принаймні приблизно 2 годин. 80. Спосіб за будь-яким з пп. 70-78, який додатково включає витримування реакційної суміші стадії b) при температурі приблизно 20°С впродовж принаймні приблизно 2 годин. 81. Спосіб за будь-яким з пп. 70-78, який додатково включає витримування реакційної суміші стадії b) при температурі приблизно 0°С впродовж принаймні приблизно 2 годин. 82. Спосіб одержання базедоксифену ацетату поліморфної форми А, що включає кристалізування базедоксифену ацетату з розчину, що містить спирт, де зазначений розчин підтримують при температурі нижче приблизно 20°С. 83. Спосіб за п. 82, де зазначений розчин підтримують при температурі нижче приблизно 10°С. 84. Спосіб за п. 82 або 83, де зазначений спирт являє собою етанол. 85. Спосіб лікування ссавця, що має хворобу або синдром, пов'язаний з недостатністю естрогену або надлишком естрогену, що включає введення зазначеному ссавцю терапевтично ефективної кількості поліморфу за будь-яким з пп. 1-8. 86. Спосіб лікування ссавця, що має хворобу або розлад, пов'язаний з проліферацією або анормальним розвитком ендометріальних тканин, що 8 включає введення зазначеному ссавцю терапевтично ефективної кількості поліморфу за будьяким з пп. 1-8. 87. Спосіб зниження холестерину у ссавця, що включає введення зазначеному ссавцю терапевтично ефективної кількості поліморфу за будьяким з пп. 1-8. 88. Спосіб інгібування втрати кісткової тканини у ссавця, що включає введення зазначеному ссавцю терапевтично ефективної кількості поліморфу за будь-яким з пп. 1-8. 89. Спосіб лікування раку молочної залози у ссавця, що включає введення зазначеному ссавцю терапевтично ефективної кількості поліморфу за будь-яким з пп. 1-8. 90. Спосіб лікування жінки в постменопаузі з одним або більше вазомоторними розладами, що включає введення зазначеній жінці в постменопаузі терапевтично ефективної кількості поліморфу за будь-яким з пп. 1-8. 91. Спосіб за п. 90, у якому вазомоторний розлад являє собою припливи. 92. Кристалічний поліморф форми А базедоксифену ацетату, одержаний відповідно до способу за будь-яким з пп. 70-81. 93. Поліморф за будь-яким з пп. 1-8, одержаний за способом, що включає: a) введення у реакцію гексаметиленімінобензилоксиіндолу з гідрогенуючим агентом у розчиннику та необов'язково у присутності каталізатора гідрогенування впродовж часу та в умовах, прийнятних для утворення реакційної суміші, що містить базедоксифенову вільну основу; b) обробку реакційної суміші оцтовою кислотою впродовж часу та в умовах, прийнятних для утворення базедоксифену ацетату поліморфної форми А. 94. Поліморф за будь-яким з пп. 1-8, одержаний відповідно до способів, що включають кристалізування базедоксифену ацетату з розчину, що містить спирт, де зазначений розчин підтримують при температурі нижче приблизно 20°С. Даний винахід відноситься до кристалічного поліморфу, позначеного як форма А, модулятору селективного естрогенового рецептору 1-[4-(2азепан-1-іл-етокси)-бензил]-2-(4-гідрокси-феніл)-3метил-1Н-індол-5-олу оцтової кислоти (базедоксифену ацетат). Базедоксифену ацетат (1-[4-(2-азепан-1-ілетокси)-бензил]-2-(4-гідрокси-феніл)-3-метил-1Ніндол-5-ол оцтової кислоти), що має хімічну формулу, показану нижче: відноситься до класу лікарських засобів, що зазвичай називають як модулятори селективного естрогенового рецептору (SERMs). Згідно цієї класифікації, базедоксифен демонструє афінність до естрогенових рецепторів (ER), але показує селек 9 85703 тивні естрогенові ефекти у тканинах. Наприклад, базедоксифену ацетат демонструє низьку стимуляцію або не показує ніякої стимуляції відповіді матки у передклінічних моделях стимуляції матки. Навпаки, базедоксифену ацетат демонструє ефект, подібний до агоністу естрогену, у запобіганні втраті кісткової маси та зниженні холестерину у оваріектомізованій щурячій моделі остеопорозу. У MCF-7 клітинній лінії (клітинна лінія раку молочної залози людини), базедоксифену ацетат веде себе як естрогеновий антагоніст. Ці дані показують, що базедоксифену ацетат є естрогенним до кісткових та серцево-судинних ліпідних параметрів та антиестрогенним до тканин матки та молочних залоз і, таким чином, має потенціал для лікування багатьох різних хворобливих або хворобоподібних станів, у які залучається естрогеновий рецептор. [Патенти США №№5,998,402 та 6,479,535] описують одержання базедоксифену ацетату та характеризують сіль як таку, що має точку плавлення 174-178°С. Синтетичне одержання базедоксифену ацетату також показане у загальній літературі. Дивись, наприклад, [Miller та інші, J. Med. Chem., 2001, 44, 1654-1657], який доповідає про сіль, як про кристалічну тверду речовину, що має точку плавлення 170,5-172,5°С. Більш докладний опис біологічної активності лікарських засобів також показаний у загальній літературі [наприклад, Miller та інші. Drugs of the Future, 2002, 27 (2), 117121]. Відомо, що кристалічна поліморфна форма певного лікарського засобу часто є важливою детермінантою легкості одержання, стабільності, розчинності, стійкості при зберіганні, легкості розробки рецептури та in vivo фармакології лікарського засобу. Поліморфні форми зустрічаються, коли та сама композиція кристалізується з різним розташуванням просторової решітки, що приводить до одержання різних термодинамічних властивостей та стабільностей, специфічних до певної поліморфної форми. У випадках, коли можуть бути одержані дві або більше поліморфних речовини, бажано мати способи одержання обох поліморфів у чистій формі. При вирішенні, який поліморф є кращим, необхідно порівняти численні властивості поліморфів та вибрати кращий поліморф, ґрунтуючись на багатьох змінних фізичних властивостей. Цілком можливо, що одна поліморфна форма може бути кращою у деяких обставинах, коли певні аспекти, такі як легкість одержання, стабільність, тощо, вважають критичними. У інших обставинах, інший поліморф може бути кращим завдяки вищій розчинності та/або кращій фармакокінетиці. Так як послідовно шукають покращені склади лікарських засобів, що показують, наприклад, кращу біодоступність або кращу стабільність, існує постійна необхідність у нових або більш чистих поліморфних формах існуючи х молекул лікарських засобів. Поліморф базедоксифену ацетату, представлений у цьому описі, допомагає задовольнити ці та інші потреби. На Фіг.1 показана рентгенограма на порошку поліморфу базедоксифену ацетату форми А, де 10 кут ди фракції (2q) знаходиться у інтервалі від 5° до 40° з кроком 0,02°. На Фіг.2 показаний 1Ч спектр поліморфу базедоксифену ацетату форми А у KВr таблетці. На Фіг.3 показана крива диференційної скануючої калориметрії (DSC) поліморфу базедоксифену ацетату форми А. На Фіг.4 показана крива DSC поліморфу базедоксифену ацетату форми В як порівняння. Даний винахід забезпечує кристалічний поліморф (форма А) базедоксифену ацетату, о характеризований відповідно до даних рентгеноструктурного аналізу на порошку, даних ІЧ-спектрометрії, та DSC даних, представлених у цьому описі. Крім того, даний винахід забезпечує композиції, що містять поліморфну форму А базедоксифену ацетату. Крім того, даний винахід забезпечує спосіб одержання базедоксифену ацетату поліморфної форми А, що включає: a) введення у реакцію гексаметиленімінобензилоксиіндолу з гідрогенуючим агентом у розчиннику та необов'язково у присутності каталізатору гідрогенування впродовж часу та в умовах, прийнятних для утворення реакційної суміші, що містить базедоксифенову вільну основу; b) обробку реакційної суміші оцтовою кислотою впродовж часу та в умовах, прийнятних для утворення базедоксифену ацетату поліморфної форми А. Крім того, даний винахід забезпечує спосіб лікування ссавця, що має хворобу або синдром, пов'язаний з недостатністю естрогену або надлишком естрогену, що включає застосування до зазначеного ссавця терапевтично ефективної кількості поліморфу форми А базедоксифену ацетату. Крім того, даний винахід забезпечує спосіб лікування ссавця, що має хворобу або розлад, пов'язаний з проліферацією або анормальним розвитком ендометріальних тканин, що включає застосування до зазначеного ссавця терапевтично ефективної кількості поліморфу форми А базедоксифену ацетату. Крім того, даний винахід забезпечує спосіб зниження холестерину у ссавця, що включає застосування до зазначеного ссавця терапевтично ефективної кількості поліморфу форми А базедоксифену ацетату. Крім того, даний винахід забезпечує спосіб інгібування втрати кісткової тканини або раку молочної залози у ссавця, що включає застосування до ссавця терапевтично ефективної кількості поліморфу форми А базедоксифену ацетату. Крім того, даний винахід забезпечує спосіб лікування жінки в постменопаузі з одним або більше вазомоторними розладами, такими як приливи, що включає застосування до жінки в постменопаузі терапевтично ефективної кількості поліморфу форми А базедоксифену ацетату. Крім того, даний винахід забезпечує кристалічний поліморф форми А базедоксифену ацетату, одержаний за будь-яким зі способів, представлених у цьому описі. 11 85703 Крім того, даний винахід забезпечує кристалічний поліморф даного винаходу для застосування у терапії. Крім того, даний винахід забезпечує застосування кристалічного поліморфу даного винаходу для одержання лікарського засобу. Детальний опис винаходу Даний винахід забезпечує безводний, несольватований кристалічний поліморф базедоксифену ацетату, що у цьому описі називають як форма А, яка може бути ідентифікована за одним або більше твердофазними аналітичними способами. Наприклад, форма А може бути ідентифікована за її рентгенограмою на порошку, яка показана на Фіг.1. Дані рентгеноструктурного аналізу на порошку, що узгоджуються з формою А, представлені у Таблиці 1, показаній нижче. Таблиця 1 Градус (2q) 9,8 12,7 15,2 16,0 17,1 17,4 18,5 18,8 19,6 20,4 20,7 22,3 23,5 24,9 25,6 26,1 27,4 28,0 28,7 29,6 29,9 30,7 Інтенсивність, Кількість імпульсів на секунду (CPS) 180 3111 683 1347 591 220 1964 970 482 894 1440 1373 822 145 231 346 147 152 153 202 307 268 У деяких втіленнях, кристалічний поліморф (форма А) базедоксифену ацетату характеризують за рентгенограмою на порошку, що має характеристичні піки, у показниках 2q, при приблизно 12,7° та приблизно 18,5°. У додаткових втіленнях, рент 12 генограма на порошку додатково включає характеристичні піки, у показниках 2q, при приблизно 16,0°, приблизно 20,7°, та приблизно 22,3°. У додаткових втіленнях, рентгенограма на порошку форми А включає 5 або більше характеристичних піків, у показниках 2q, вибраних з приблизно 9,8°, приблизно 12,7°, приблизно 15,2°, приблизно 16,0°, приблизно 17,1°, приблизно 17,4°, приблизно 18,5°, приблизно 18,8°, приблизно 19,6°, приблизно 20,4°, приблизно 20,7°, приблизно 22,3°, приблизно 23,5°, приблизно 24,9°, приблизно 25,6°, приблизно 26,1°, приблизно 27,4°, приблизно 28,0°, приблизно 28,7°, приблизно 29,6°, приблизно 29,9°, та приблизно 30,7°. У все ще додаткових втіленнях, форму А характеризують за рентгенограмою на порошку, головним чином, як показано на Фіг.1. Відносні інтенсивності піків можуть змінюватися в залежності від способу одержання зразку, процедури одержання зразку та певного використовуваного приладу. Більш того, зміна приладу та інших факторів може впливати на 2-тета значення. Тому, віднесення піків XRPD може змінюватися на плюс або мінус приблизно 0,2°. Форма А також може бути ідентифікована за її характеристичним спектром поглинання у інфрачервоній (14) області, таким як представлений на Фіг.2. У деяких втіленнях, форму А характеризують за інфрачервоним спектром у KВr, що має один або більше характеристичних піків, вибраних з приблизно 1511, приблизно 1467, та приблизно 1242см -1. Форма А також може бути ідентифікована за її характеристичною кривою диференційного калориметричного сканування (DSC), такою як показано на Фіг.3. У деяких втіленнях, форму А характеризують за DSC кривою, що показує максимум при приблизно 176°С. Для DSC відомо, що температури, які спостерігають, будуть залежати від швидкості зміни температури, також як і техніки одержання зразку та певного використовуваного устаткування. Таким чином, значення, представлені у цьому описі, відносно DSC термограм можуть змінюватися на плюс або мінус приблизно 4°С. Поліморфна форма А базедоксифену ацетату може бути легко відрізнена від інших кристалічних поліморфів, таких як менш розчинна форма В. Вибіркові дані для деяких фізичних властивостей порівняні для поліморфів форми А та форми В, що показані нижче у Таблиці 2. Таблиця 2 Вимірювання Точка плавлення Теплота плавлення Розчинність у воді Розчинність у органіці (EtOH/EtOAc/Tol) Внутрішня швидкість розчинення DSC Форма А Форма В 176°С 94,6Дж/г 0,49мг/мл 181°С 108,4Дж/г 0,23мг/мл 24,5мг/мл 0,125мг/см 2-хвил. Однократна ендотерма плавлення 176,1°С 12,4мг/мл 0,09мг/см 2-хвил. Однократна ендотерма плавлення 181,1°С 13 85703 14 Продовження таблиці 2 TGA Аналогічно Рентгеноструктурний аналіз на порошку 12,7°, 16,0°, 18,5°, 20,7°, 22,3° (2q) Раманівська / інфрачервона спектроскопія 1511, 1467см -1 Як може бути видно з Таблиці 2, два кристалічних поліморфи мають відмінні фізичні та спектроскопічні характеристики. Як видно, форма А має вищу розчинність у системах водного та органічного розчинників, ніж форма В, що є переважним у певних складах або дозах, де має значення розчинність певної композиції. Наприклад, вища розчинність може сприяти кращій біологічній абсорбції та розподіленню лікарського засобу, також як і полегшити розробку рецептури у рідких носіях. Форма А може бути одержана, наприклад, шляхом зняття захисту з гексаметиленбензилоксиіндолу [дивись, наприклад, Патент США №5,998,402] шляхом гідрогенолізу у розчиннику, що містить спирт (наприклад, етанол) у присутності каталізатору гідрогенування (наприклад, 10% паладію на вугіллі; Pd/C 10%). Гідрогеноліз може бути проведений впродовж будь-якого проміжку часу та зазвичай проводять до того, поки реакція не буде в основному закінчена, що може контролюватися з допомогою HPLC або будь-якої іншої прийнятної технології. Далі каталізатор може бути видалений фільтруванням та антиоксидант (наприклад, аскорбінову кислоту) додають для інгібування можливого окисного розкладу гідрогенованого продукту. Приклади прийнятних масових співвідношень розчиннику до гексаметиленбензилоксиіндолу включають, наприклад, від приблизно 10:1 до приблизно 2:1, від приблизно 8:1 до приблизно 4:1, або від приблизно 6:1 до приблизно 7:1. Оцтова кислота може бути додана до гідрогенованого продукту (базедоксифенової вільної основи), утворюючи ацетатну сіль. Прийнятних кількостей оцтової кислоти зазвичай достатньо для перетворення вільної основи, присутньої у реакційній суміші, до сольової форми. Відповідно, можуть бути додані один або більше еквівалентів оцтової кислоти (по відношенню до кількості гексаметилен-бензилоксиіндолового вихідного матеріалу). У деяких втіленнях, додають від приблизно 1 до приблизно 2 еквівалентів оцтової кислоти. Повна бажана кількість оцтової кислоти може бути додана однією або багатьма частинами. Кристалічний продукт зазвичай осаджують з розчину при додаванні оцтової кислоти та може бути перекристалізований зі спирто-вмісного розчиннику відповідно до загальновідомих способів. Прийнятні спирти, що використовують у розчинниках процедур одержання та перекристалізації, описаних вище, можуть включати, наприклад, метанол, етанол, ізопропанол, їх суміші та подібні. У деяких втіленнях, спирт являє собою етанол, який може бути необов'язково денатурований з допомогою приблизно 1-10% об'єм/об'єм толуолу, приблизно 1-10% об'єм/об'єм гексанів, приблизно 1-10% об'єм/об'єм етилацетату та подібних. У до Аналогічно 13,3°, 20,8°, 21,6°, 25,0° (2q) 1513, 1449, 1406см-1 даткових втіленнях, розчинник реакції та/або розчинник перекристалізації являє собою етанол, що містить 5% (за об'ємом) етилацетату. У додаткових втіленнях, розчинник являє собою етанол. Стадії, що залучаються у одержання форми А, можуть бути виконані при будь-якій прийнятній температурі, наприклад при температурі приблизно 25°С або нижче, приблизно 20°С, або приблизно 15°С. Наприклад, гідрогенування може бути виконане при кімнатній температурі, такій як 25°С. Додавання оцтової кислоти може бути виконане при приблизно 20°С або нижче. Реакційна суміш, що містить базедоксифену ацетат, може бути витримана впродовж будь-якого періоду часу (наприклад, принаймні приблизно 1 години, принаймні приблизно 2 годин, принаймні приблизно 6 годин, або принаймні приблизно 12 годин) при температурі від приблизно -20 до приблизно 20°С. У деяких втіленнях, реакційну суміш тримають впродовж принаймні приблизно 2 годин при 20°С. У деяких втіленнях, реакційну суміш тримають впродовж принаймні приблизно 2 годин при 0°С. Частина форми В у композиції, що містить суміш форми А та форми В, може бути збільшена відповідно до наступних способів. Наприклад, форма В може включати менше ніж приблизно 10%, менше ніж приблизно 20%, менше ніж приблизно 30%, або менше ніж приблизно 40% за масою загального базедоксифену ацетату у вихідній композиції. Частина форми В може бути збільшена шляхом поєднання розчиннику, що містить спирт, з вихідною композицією та підтримання отриманої суміші при температурі приблизно 25°С або більше (наприклад, від приблизно 25 до приблизно 60°С, від приблизно 25 до приблизно 40°С, або від приблизно 25 до приблизно 30°С) впродовж періоду часу, прийнятного для збільшення частини форми В у композиції. Розчинник може бути використаний у кількості, достатній для розчинення в основному всього або менше ніж весь вихідний матеріал базедоксифену ацетату з утворенням гомогенної або гетерогенної сумішей, відповідно. Розчинник може бути забезпечений у масовому співвідношенні загального розчиннику до кількості базедоксифенового вихідного матеріалу, наприклад, приблизно 5:1, приблизно 3:1, приблизно 2:1 або приблизно 1:1. У деяких втіленнях, суміш базедоксифену ацетату та розчиннику нагрівають до температури зрошення, наприклад, впродовж декількох годин (наприклад, від приблизно 1 до приблизно 3 годин), потім повільно охолоджують ступінчастим способом. Наприклад, суміш може бути охолоджена до температури від приблизно 45 до приблизно 55°С (наприклад, приблизно 50°С) впродовж першого періоду часу та потім охолоджена до температури від приблизно 10 до приблизно 30°С (на 15 85703 приклад, приблизно 20°С) впродовж другого періоду часу. Перший, другий та будь-який додатковий періоди часу можуть тривати впродовж декількох годин, наприклад, від приблизно 1 до приблизно 5 годин або від приблизно 1 до приблизно 3 годин. У деяких втіленнях, перший період часу становить приблизно 1 годину та др угий період часу становить приблизно 3 години. Крім того, суміш можуть додатково витримувати при зниженій температурі (наприклад, від приблизно 10 до приблизно 30°С) впродовж додаткового періоду часу, достатнього для осадження продукту. Додатковий період часу може становити, наприклад, від 2 годин до приблизно 24 годин, від приблизно 8 до приблизно 18 годин, або приблизно 13 годин. У деяких втіленнях, форма А може бути одержана шляхом кристалізування базедоксифену ацетату з розчину, що містить спирт, де розчин тримають при температурі, нижче приблизно 20°С, нижче приблизно 10°С, або нижче приблизно 5°С. Спирт може включати метанол, етанол, нпропанол, ізопропанол, їх суміші та подібні. У деяких втіленнях, спирт являє собою етанол. Способи для одержання форми А також можуть включати внесення затравки у розчини, що містять базедоксифену ацетат, з затравковими кристалами форми А, та способи для одержання форми В також можуть включати внесення затравки у розчини, що містять базедоксифену ацетат, з затравковими кристалами форми В. Приклад одержання форми А забезпечений у Прикладі 1. Приклад одержання форми В забезпечений у Прикладі 2. Способи одержання форми А, забезпечені у цьому описі, можуть приводити в основному до чистої форми А (наприклад, композиції містять менше ніж приблизно 10%, менше ніж приблизно 5%, або менше ніж приблизно 3% форми В), також як і сумішей, збагачених формою А (наприклад, більше ніж приблизно 50% форми А по відношенню до форми В). Відповідно, даний винахід додатково забезпечує композиції, що містять форму А. У деяких втіленнях, принаймні приблизно 50%, принаймні приблизно 70%, принаймні приблизно 80%, принаймні приблизно 90%, принаймні приблизно 95%, принаймні приблизно 97%, принаймні приблизно 98,0%, принаймні приблизно 98,1%, принаймні приблизно 98,2%, принаймні приблизно 98,3%, принаймні приблизно 98,4%, принаймні приблизно 98,5%, принаймні приблизно 98,6%, принаймні приблизно 98,7%, принаймні приблизно 98,8%, принаймні приблизно 98,9%, принаймні приблизно 99,0%, принаймні приблизно 99,1%, принаймні приблизно 99,2%, принаймні приблизно 99,3%, принаймні приблизно 99,4%, принаймні приблизно 99,5%, принаймні приблизно 99,6%, принаймні приблизно 99,7%, принаймні приблизно 99,8%, або принаймні приблизно 99,9% за масою загального базедоксифену ацетату у композиції присутні як форма А. У додаткових втіленнях, композиції даного винаходу включають в основному базедоксифену ацетат, де принаймні приблизно 95%, принаймні приблизно 97%, принаймні приблизно 98,0%, принаймні приблизно 98,1%, принаймні приблизно 98,2%, принаймні приблизно 16 98,3%, принаймні приблизно 98,4%, принаймні приблизно 98,5%, принаймні приблизно 98,6%, принаймні приблизно 98,7%, принаймні приблизно 98,8%, принаймні приблизно 98,9%, принаймні приблизно 99,0%, принаймні приблизно 99,1%, принаймні приблизно 99,2%, принаймні приблизно 99,3%, принаймні приблизно 99,4%, принаймні приблизно 99,5%, принаймні приблизно 99,6%, принаймні приблизно 99,7%, принаймні приблизно 99,8%, або принаймні приблизно 99,9% за масою базедоксифену ацетату присутні у композиції як форма А. У деяких втіленнях, базедоксифену ацетат, що залишився, присутній як форма В або як аморфний матеріал. Відповідні кількості поліморфних форм базедоксифену ацетату у композиції можуть бути визначені за будь-яким прийнятним спектроскопічним способом, таким як рентгенівська дифракція на порошку або DSC. Крім того, даний винахід забезпечує композиції, що містять поліморф даного винаходу (Форма А) та Форми В. У деяких втіленнях, композиція включає від приблизно 70 до приблизно 90% за масою Форми А та від приблизно 10 до приблизно 30% за масою Форми В, від приблизно 75 до приблизно 85% за масою Форми А та від приблизно 15 до приблизно 25% за масою Форми В, від 78 до приблизно 92% за масою Форми А та від приблизно 18 до приблизно 22% за масою Форми В, або приблизно 80% за масою Форми А та приблизно 20% за масою Форми В. Крім того, даний винахід забезпечує композиції, що містять базедоксифену ацетат, де від приблизно 70% до приблизно 90% за масою загального базедоксифену ацетату у композиції присутні як поліморф даного винаходу (Форма А) та від приблизно 10 до приблизно 30% за масою загального базедоксифену ацетату у композиції присутні як Форма В, або де від приблизно 75% до приблизно 85% за масою загального базедоксифену ацетату у композиції присутні як поліморф даного винаходу (Форма А) та від приблизно 15 до приблизно 25% за масою загального базедоксифену ацетату у композиції присутні як Форма В, або де від приблизно 78% до приблизно 82% за масою загального базедоксифену ацетату у композиції присутні як поліморф даного винаходу (Форма А) та від приблизно 18 до приблизно 22% за масою загального базедоксифену ацетату у композиції присутні як Форма В, або де приблизно 80% за масою загального базедоксифену ацетату у композиції присутні як поліморф даного винаходу (Форма А) та приблизно 20% за масою загального базедоксифену ацетату у композиції присутні як Форма В. Композиції, що містять Форми А та В, можуть бути одержані за будь-яким прийнятним способом, включають суміш по суті чисти х Форм А та В, одержаних, наприклад, відповідно до будь-якого зі способів, забезпечених у цьому описі. Способи Як описано у [Патенті США №5,998,402], базедоксифен та його солі являють собою селективні агоністи естрогену з афінністю до рецептору естрогену. На відміну від інших типів агоністів естрогену, базедоксифен та його солі є антиестрогенними у матці та можуть антагонізувати трофічні 17 85703 ефекти агоністів естрогену у тканинах матки. Відповідно, поліморфи базедоксифену ацетату та композицій, що містять їх, можуть мати багато застосувань, що відносяться до лікування хворобливих станів або синдромів, пов'язаних з недостатністю естрогену або надлишком естрогену. Поліморф також може бути застосований у способах лікування хвороб або розладів, які витікають з проліферації або анормального розвитку, дій або росту ендометріальних або ендометріальноподібних тканин. Дана поліморфна форма базедоксифену ацетату має здатність поводити себе як агоніст естрогену шляхом зниження холестерину та інгібування втрати кісткової маси. Відповідно, поліморф є корисним для лікування багатьох хвороб, які витікають з естрогенових ефектів та надлишку або недостатності естрогену, включаючи остеопороз, гіпертрофію предміхурової залози, облисіння у чоловіків, атрофію піхви та шкіри, вугри, дисфункціональні маточні кровотечії, ендометріальні поліпи, доброякісну хворобу молочної залози, лейоміоми матки, аденоміоз, рак яєчників, безпліддя, рак молочної залози, ендометріоз, ендометріальний рак, полікистозну хворобу яєчників, серцевосудинну хворобу, контрацепцію, хворобу Альцгеймера, когнітивний спад та інші розлади ЦНС, також як і певні ракові захворювання, включаючи, серед інших, меланому, рак предміхурової залози, раки кишечнику, ракові захворювання ЦНС. Крім того, ці поліморфи можуть бути використані для контрацепції у жінок у передменопаузному періоді, і також як гормоно-замісна терапія у жінок у постменопаузному періоді (наприклад, для лікування вазомоторних порушень, таких як приливи) або у інших станах естрогенової недостатності, де додавання естрогену було б корисним. Також він може бути використаний у хворобливих станах, де аменорея є бажаною, таких як лейкемія, ендометріальні абляції, хронічна хвороба нирок або печінки або коагуляційні хвороби або розлади. Поліморф даного винаходу також може бути використаний у способах інгібування втрати кісткової маси. Втрата кісткової маси часто витікає з дисбалансу в утворенні нових кісткових тканин індивіду та ресорбції більш ранніх тканин, що веде до повної втрати кісткової тканини. Таке виснаження кісток виникає у кола осіб, особливо жінок у постменопаузі, жінок, що перенесли двосторонню оофоректомію, тих, що одержують, або тих, що одержали розширену кортикостероїдну терапію, тих, що відчувають дисгенезію гонад, та тих, що страждають від синдрому Кушинга. На спеціальні потреби для кісток, включаючи зуби та ротові кістки, заміщення також можна впливати, використовуючи ці поліморфи у осіб з ламкістю кісток, дефективними структурами кісток, та тих, яким роблять хірургічні операції, пов'язані з кістками, та/або імплантацію протезу. Крім проблем, описаних вище, поліморф може бути використаний у лікуваннях остеоартриту, гіпокальцинемії, гіперкальцинемії, хвороби Педжета, остеомаляції, остеогалістерезу, мієломної хвороби та інших форм раку, що мають негативні впливи на кісткові тканини. 18 Способи лікування хвороб та синдромів, перераховані у цьому описі, як розуміють, включають застосування до особи, якій необхідне таке лікування, терапевтично ефективної кількості поліморфу даного винаходу або композицій, що містять його. Як використано у цьому описі, термін "лікування" по відношенню до хвороби означає запобігання, інгібування та/або полегшення хвороби. Як використано у цьому описі, термін "особа" або "пацієнт", що використовуються взаємозамінно, відноситься до будь-якої тварини, включаючи ссавців, переважно мишей, щурів, інши х гризунів, кроликів, собак, котів, поросят, велику рогату худобу, овець, коней, або приматів та найбільш переважно людей. Як використано у цьому описі, фраза "терапевтично ефективна кількість" відноситься до кількості активної сполуки або фармацевтичного агенту, що викликає біологічну або медичну відповідь у тканині, системі, тварині, особі або людині, яку очікують отримати дослідник, ветеринар, лікар або інший клініцист, що включає одну або більше з наступних: (1) запобігання хвороби; наприклад, запобігання хвороби, стану або розладу у особи, що може бути схильною до хвороби, стан у або розладу, але у якої ще не виявили або не проявилася патологія або симптоматика цієї хвороби; (2) інгібування хвороби; наприклад, інгібування хвороби, стану або розладу у особи, у якої виявили або проявилася патологія або симптоматика цієї хвороби, стану або розладу (тобто зупинення або уповільнення подальшого розвинення патології та/або симптоматики); та (3) полегшення стану хвороби; наприклад, полегшення хвороби, стану або розладу у особи, у якої виявили або проявилася патологія або симптоматика цієї хвороби, стану або розладу (тобто обернення патології та/або симптоматики). Дозування та склад Даний винахід також включає фармацевтичні композиції, що використовують один або більше даних поліморфів разом з одним або більше фармацевтично прийнятних носіїв, наповнювачів, тощо. Склади базедоксифену ацетату форми В включають терапевтично ефективні кількості, які можуть бути застосовні у добових дозах, що коливаються у інтервалі від 0,1мг до 1000мг, до пацієнта, якому необхідне таке лікування. Приклади інтервалів доз змінюються від 10мг/добу до приблизно 600мг/добу або від 10мг/добу до приблизно 60мг/добу. Дозування може бути або у разовій дозі або у дозах, поділених на дві або більше частин на добу. Такі дози можуть бути застосовані будь-яким способом, який полегшує введення сполуки у кровоток, включаючи пероральне застосування, через імплантати, парентеральне застосування (включаючи внутрішньовенне, внутрішньочеревинне та підшкірне введення), вагінальне застосування, ректальне застосування та трансдермальне застосування. У деяких втіленнях, представлені склади можуть застосовуватися трансдермально, що вклю 19 85703 чає всі способи застосування через поверхню тіла та вн утрішні покриття проходів тіла, включаючи епітеліальні та слизові тканини. Таке застосування може відбуватися у формі лосьйону, крему, колоїдного розчину, піни, пластиря, суспензії або розчину. Пероральні склади, що містять даний поліморф, можуть включати будь-яку звичайно використовуван у пероральну форму, включаючи таблетки, капсули, букальні форми, пастилки, лікарські льодяники та пероральні рідини, суспензії або розчини. Капсули можуть містити суміші кристалічної форми А у бажаному процетному співвідношенні разом з будь-яким(и) іншим(и) поліморфом(ами) базедоксифену ацетату або аморфним базедоксифену ацетатом. Капсули або таблетки бажаної кристалічної форми у бажаному процетному співвідношенні композиції також можуть бути об'єднані з сумішами інших активних сполук або інертними наповнювачами та/або розріджувачами, такими як фармацевтично прийнятні крохмалі (наприклад, кукурудзяний, картопляний або маніоковий крохмаль), цукри, штучні підсолоджувачі, порошкоподібні целюлози, такі як кристалічна та мікрокристалічна целюлози, ароматизатори, желатини, камеді, тощо. Прийнятні таблеткові склади можуть бути одержані з допомогою способів звичайного пресування, вологого гранулювання або сухого гранулювання та використовують фармацевтично прийнятні розріджувачі (наповнювачі), зв'язуючі агенти, любриканти, дезінтегранти, суспендуючі або стабілізуючі агенти, включаючи, але не обмежуючись ними, такі як стеарат магнію, стеаринова кислота, тальк, лаурил-сульфат натрію, мікрокристалічна целюлоза, карбоксиметилцелюлоза кальцію, полівінілпіролідон, желатин, альгінова кислота, аравійська камедь, ксантанова камедь, цитрат натрію, комплексні силікати, карбонат кальцію, гліцин, декстрин, сахароза, сорбітол, гідрофосфат кальцію, сульфат кальцію, лактоза, каолін, манітол, хлорид натрію, тальк, сухі крохмалі та цукрова пудра. Пероральні склади у цьому описі можуть використовува ти стандартні склади з затримкою дії або пролонгованою дією або спансули. Склади супозиторій можуть бути зроблені з традиційних матеріалів, включаючи масло кокао, з або без додавання восків для зміни точки плавлення супозиторії, та гліцерин. Також можуть бути використані водорозчинні основи для супозиторій, такі як поліетиленгліколі різних молекулярних мас. Приклади систем наповнювачів, прийнятних для одержання складів даного поліморфу, включають один або більше наповнювачів, дезінтегрантів та любрикантів. Наповнюючий компонент може являти собою будь-який наповнюючий компонент, відомий у даній галузі техніки, включаючи, але не обмежуючись ними, лактозу, мікрокристалічну целюлозу, сахарозу, манітол, фосфат кальцію, карбонат кальцію, порошкоподібну целюлозу, мальтодекстрин, сорбіт, крохмаль або ксилітол. Дезінтегранти, прийнятні для застосування у даних складах, можуть бути вибрані з дезінтегрантів, відомих у даній галузі техніки, включаючи 20 пред-клейстеризований крохмаль та натрію крохмалю гліколят. Інші прийнятні дезінтегранти включають такі як кроскармелоза натрію, кросповідон, крохмаль, альгінова кислота, альгінат натрію, глини (наприклад, вигум або ксантанова камедь), неподрібнена целюлоза, іонообмінні смоли, або шипучі системи, такі як ті, що використовують харчові кислоти (такі як лимонна кислота, винна кислота, яблучна кислота, фумарова кислота, молочна кислота, адипінова кислота, аскорбінова кислота, аспарагінова кислота, ериторбова (erythorbic) кислота, глутамінова кислота, та бурштинова кислота) та лужний карбонатний компонент (такий як натрію гідрокарбонат, кальцію карбонат, магнію карбонат, калію карбонат, амонію карбонат, то що). Дезінтегрант(и), прийнятні у цьому описі, можуть становити від приблизно 4% до приблизно 40% композиції за масою, переважно від приблизно 15% до приблизно 35%, більш переважно від приблизно 20% до приблизно 35%. Фармацевтичні склади також можуть містити антиоксидант або суміш антиоксидантів, таких як аскорбінова кислота. Інші антиоксиданти, які можуть бути використані, включають аскорбат натрію та аскорбіл-пальмітат, переважно у поєднанні з певною кількістю аскорбінової кислоти. Приклад інтервалу для антиоксиданту(ів) становить від приблизно 0,5% до приблизно 15% за масою, більш переважно від приблизно 0,5% до приблизно 5% за масою. Типовий пероральний склад містить даний поліморф та наступні системи наповнювачів: а) наповнювач та дезінтегрант, що разом становлять від приблизно 5% до приблизно 82% за масою (wght) загального складу, переважно між приблизно 30% та приблизно 80% складу, де від приблизно 4% до приблизно 40% за масою загального складу становлять один або більше фармацевтично прийнятних дезінтегрантів; та b) любрикант, що становить від приблизно 0,2% до приблизно 10% композиції (wght), наприклад, вибраний з групи, що включає стеарат магнію або стеарати інших металів (наприклад стеарат кальцію або стеарат цинку), складні ефіри жирних кислот (наприклад, натрію стеарилфумарат), жирні кислоти (наприклад, стеаринова кислота), жирні спирти, гліцерин бехенат, мінеральне масло, парафіни, гідрогеновані рослинні масла, лейцин, поліетиленгліколі, лаурил-сульфати металів та хлорид натрію. Додаткова система наповнювачів може включати: a) наповнювач та дезінтегрант, що разом становлять від приблизно 5,4% до приблизно 89% за масою або переважно від приблизно 32,5% до приблизно 87% за масою; та b) любрикант, що становить від приблизно 0,22% до приблизно 10,9% за масою. Системи наповнювачів також можуть необов'язково використовувати фармацевтично прийнятні змочуючі агенти, гліданти та антиоксиданти. Такі системи можуть включати: a) наповнювач та дезінтегрант, що разом становлять від приблизно 5% до приблизно 82% за масою (wght) загального складу, переважно між 21 85703 приблизно 30% та приблизно 80% складу, де від приблизно 4% до приблизно 40% за масою загального складу становлять один або більше фармацевтично прийнятних дезінтегрантів; b) необов'язково, змочуючий агент, що становить від приблизно 0,2 до приблизно 5% композиції (wght), наприклад, вибраний з групи, що включає лаурил-сульфат натрію, складні ефіри поліоксиетилен-сорбіту та жирних кислот, поліоксиетилен-алкільні ефіри, складні ефіри сорбіту та жирних кислот, поліетиленгліколі, похідні поліоксиетилен-касторової олії, докусат натрію, четвертинні амонійні сполуки, цукрові складі ефіри жирних кислот та гліцериди жирних кислот; c) любрикант, що становить від приблизно 0,2% до приблизно 10% композиції (wght), наприклад, вибраний з групи, що включає стеарат магнію або стеарати інших металів (наприклад, стеарат кальцію або стеарат цинку), складні ефіри жирних кислот (наприклад, натрію стеарилфумарат), жирні кислоти (наприклад, стеаринова кислота), жирні спирти, гліцерин бехенат, мінеральне масло, парафіни, гідрогеновані рослинні масла, лейцин, поліетиленгліколі, лаурил-сульфати металів та хлорид натрію; та d) необов'язково, глідант, що становить від приблизно 0,1% до приблизно 10% (wght) кінцевої композиції, глідант вибирають з тих, що відомі у даній галузі техніки, включаючи діоксид кремнію, тальк, стеарати металів, силікат кальцію або лаурил-сульфати металів. Додаткові системи наповнювачів, відповідно до даного винаходу, можуть включати, за масою: a) наповнювач та дезінтегрант, що разом становлять від приблизно 54% до приблизно 80% складу, причому дезінтегрантний(і) агент(и) даного опису становлять від приблизно 4% до приблизно 40% за масою загального складу; b) змочуючий агент, що становить від приблизно 0,55% до приблизно 2,5% складу; c) любрикант, що становить від приблизно 0,2% до приблизно 5,5% складу; та d) глідант, що становить від приблизно 0,1% до приблизно 5,0% складу. Системи наповнювачів, описані вище, також можуть необов'язково включати антиоксидантний компонент, наприклад, аскорбінову кислоту, з концентрацією від приблизно 0,5% до приблизно 5,0% за масою. Серед додаткових систем наповнювачів даного винаходу є ті, що включають: a) наповнювач та дезінтегрант, що разом становлять від приблизно 50% до приблизно 87% складу, де дезінтегрант(и) у цьому описі становлять від приблизно 25% до приблизно 35% складу, за масою; b) змочуючий агент, що становить від приблизно 0,55% до приблизно 2,7% складу; c) любрикант, що становить від приблизно 0,2% до приблизно 5,5% складу; d) глідант, що становить від приблизно 0,1% до приблизно 5,5% складу; та є) антиоксидантний компонент, такий як аскорбінова кислота, у кількості від приблизно 0,5% до приблизно 5,5% за масою. 22 Відсоткові співвідношення, показані вище, для наповнювача, дезінтегранта, любриканта та інших компонентів, розраховані у перерахунку на кінцеву фармацевтичну композицію. Відсоток кінцевої композиції, що залишився, включає активний(і) фармакологічний(і) агент(и) та необов'язково фармацевтично прийнятне поверхневе покриття, таке як глазирування або капсула, як представлено у цьому описі. У деяких втіленнях даного винаходу, активний(і) фармакологічний(і) агент(и) становлять від приблизно 0,5% до приблизно 20%, за масою, кінцевої композиції, більш переважно від приблизно 1% до приблизно 5%, та глазирування або капсула становлять до приблизно 8%, за масою, кінцевого складу. Склади, представлені у цьому описі, можуть бути використані у неглазурованій або некапсульованій твердій формі. У деяких втіленнях, фармакологічні композиції необов'язково покривають плівковим покриттям, наприклад, що становить від приблизно 0,3% до приблизно 8% за масою загальної композиції. Плівкові покриття, прийнятні для даних складів, відомі у даній галузі техніки та в основному складаються з полімеру (зазвичай полімеру целюлозного типу), барвника та пластифікатору. Додаткові інгредієнти, такі як змочуючі агенти, цукри, ароматизатори, масла та любриканти, можуть бути включені у склади плівкових покриттів для надання плівковому покриттю певних характеристик. Композиції та склади цього опису також можуть бути об'єднані та можуть оброблятися як тверді речовини, а потім поміщатися у капсульну форму, таку як желатинова капсула. Фармацевтичні композиції базедоксифену ацетату можуть бути рецептовані зі стероїдними естрогенами, таким як кон'юговані естрогени, USP. Кількість базедоксифену ацетату, яке використовують у складі, може бути відрегульована відповідно до певної поліморфної форми або співвідношення поліморфних форм, що використовують, кількості та типу стероїдного естрогену у складі, також як і певного терапевтичного показання, що передбачується. В основному, базедоксифену ацетат визначеного співвідношення фармацевтичної композиції може бути використаний у кількості, достатній для антагонізування ефекту певного естрогену до бажаного рівня. Інтервал доз кон'югованих естрогенів може становити від приблизно 0,3мг до приблизно 2,5мг, від приблизно 0,3мг до приблизно 1,25мг, або від приблизно 0,3мг до приблизно 0,625мг. Приклад інтервалу для кількості базедоксифену ацетату у комбінаційному складі становить від приблизно 10мг до приблизно 40мг. Для стероїдного естроген-местранолу, добова доза може становити від приблизно 1mг до приблизно 150mг, та для етинілестрадіолу може бути використана добова доза від приблизно 1mг до 300mг. У деяких втіленнях, добова доза знаходиться між приблизно 2mг та приблизно 150mг. Для того, щоб винахід, розкритий у цьому описі, був більше, докладно зрозумілим, нижче представлені приклади. Слід розуміти, що ці приклади представлені тільки для ілюстративних цілей, та не слід тлумачити їх як обмеження даного винаходу будь-яким способом. 23 85703 Приклади Приклад 1 Одержання поліморфу базедоксифену ацетату Форми А У 2-галонову посудину для гідрогенування з мішалкою поміщають гексаметиленімінобензилоксиіндол (250г, 0,3841 моль; [дивись Патент США No.5,998,402] для одержання), етанол (денатурований з допомогою 5% за об'ємом етилацетату) (1578г, 2000мл), та паладій на вугіллі 10% (25г). Ці реагенти гідрогенують при 25°С та 50 псі впродовж 20 годин. Проходження реакції контролюють з допомогою HPLC (Колонка: CSC-S ODS 2, 25см; Мобільна фаза: 20% 0,02Μ ΝΗ4Η2ΡΟ4 (2мл TEA/L, pH=3) та 80% MeCN; Потік: 2мл/хвилину; Детектор: 220нм). Реакцію вважають закінченою, коли визначають менше ніж 1% гексаметиленіміно-бензилоксиіндолу (час утримання 18,2 хвилин) або його монодебензильованої похідної (час утримання 5,1 хвилин). Суміш фільтрують через фільтр, який далі промивають етанолом (денатурованим з допомогою 5% за об'ємом етилацетату) (2´198г, 2´250мл). Фільтрат переносять у 5-літрову багатогорлу колбу з мішалкою, завантажену Lаскорбіновою кислотою (2,04г, 0,0116 моль) у атмосфері азоту. Оцтову кислоту (34,6г, 0,5762 моль) додають при 20°С при перемішуванні. Отриману реакційну суміш перемішують впродовж 2 годин (рН становить приблизно 5 та кристалізація починається через приблизно 10 хвилин додавання оцтової кислоти). Потім реакційну суміш охолоджують до 0°С та підтримують при цій температурі впродовж 2 годин. Отриману тверду речовину збирають фільтруванням на лійці Бюхнера та промивають етанолом (денатурованим з допомогою 5% за об'ємом етилацетату) (2´150г, 2´190мл) при 0°С. Твердий продукт додатково очищують шля хом завантаження 3-літрової багато-горлої колби (з мішалкою, термометром та холодильником у атмосфері азоту) відфільтрованою твердою речовиною, етанолом (денатурованим з допомогою 5% за об'ємом етилацетату) (1105г, 1400мл), та Lаскорбіновою кислотою (1,73г, 0,01 моль). Отриману суміш нагрівають до 75°С та охолоджують до 20°С впродовж 2 годин. Отриману суспензію далі охолоджують до 0°С та тримають при цій температурі протягом 2 годин. Отриманий твердий продукт збирають фільтруванням на лійці Бюхнера та промивають етанолом (денатурованим з допомогою 5% за об'ємом етилацетату) (2´79г, 2´100мл) при 0°С. Продукт сушать у вакуумі при 60°С, 5мм 24 Hg протягом 24 годин, що приводить до одержання 151,3г базедоксифену ацетату форми А (74,2% вихід). Приклад 2 Одержання базедоксифену ацетату Форми В з Форми А До перемішуваного розчину 594г етанолу (денатурованого з допомогою 5% ацетону та 3% циклогексану) та 184г етилацетату, додають у атмосфері азоту 400г базедоксифену ацетату форми А (наприклад, дивись Приклад 1). Гетерогенну суміш тримають при 30°С та перемішують протягом ночі у а тмосфері азоту. Завершення кристалічної трансформації визначають за DSC аналізом. Суміш охолоджують до 0°С та перемішують впродовж 2 годин у атмосфері азоту. Продукт відфільтровують, промивають сумішшю денатурованого етанолу та етилацетату, як показано вище, та сушать протягом ночі при 60°С у вакуумі, з одержанням 391г (97,7% вихід) поліморфу базедоксифену ацетату форми В. По суті той же самий результат був одержаний використовуючи абсолютний етанол або етанол, денатурований з допомогою 5% толуолу. Приклад 3 Дифракція рентгенівських променів на порошку (XRPD) XRPD аналізи (дивись, наприклад, Фіг.1) виконують на (Scintag X2) рентгенівському порошковому рефрактометрі, використовуючи СuKa випромінювання. Прилад оснащують тр убкою з напругою та амперним навантаженням, встановленими при 45кВ та 40мА. Дивергенцію та розсіюючі щілини встановлюють при 1° та отримуючу щілину встановлюють при 0,2мм. Використовують тета-два тета безперервне сканування при 3°/хвил. (0,4сек./0,02° крок) від 3 до 40° 2q. Приклад 4 Інфрачервона (14) спектроскопія ІЧ спектри (наприклад, дивись Фіг.2) отримують наступним чином. Зразки готують у вигляді калій-бромних (KВr) дисків (або таблеток). Невелику кількість кожного зразка (приблизно 3мл) подрібнюють у ступці з твердим покриттям до зникнення блиску. Пів граму (0,5г) KВr додають до зразка та суміш постійно розтирають до повного змішування. Потім суміш переносять у прес-форму та пресують у таблетку, використовуючи гідравлічний прес. ІЧ спектр Фіг.2 одержують використовуючи FTIR Спектрофотометр DIGILAB EXCALIBUR Серії FTS-4000, що працює при 4см -1 розділенні та 16 сканах між 400-4000см -1. Приклад 5 Диференційна скануюча калориметрія (DSC) DSC вимірювання (дивись, наприклад, Фіг.3 та 4) проводять як у запечатаній чашці, так і чашці, що вентилюється, при швидкості сканування 10°С/хвилину від 25°С до 200°С у потоці азоту, використовуючи Pyris IDSC від Perkin-Elmer. Різні модифікації даного винаходу, крім описаних у цьому описі, стануть зрозумілими спеціалісту, кваліфікованому у даній галузі техніки, з поданого вище опису. Розуміють, що такі модифікації також підпадають під обсяг прикладеної Формули 25 винаходу. Кожне посилання, процитоване у даній заявці, включене у даний опис шляхом посилання 85703 у всій повноті. 26 27 Комп’ютерна в ерстка М. Ломалова 85703 Підписне 28 Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюCrystalline polymorph of bazedoxifene acetate
Автори англійськоюDemerson Chistopher, Iera Silvio, Ali Kadum A.
Назва патенту російськоюКристаллический полиморф базедоксифена ацетата
Автори російськоюДемерсон Кристофер, Иера Сильвио, Али Кадум А.
МПК / Мітки
МПК: C07D 209/12, A61K 31/55, A61K 31/404, A61P 5/30
Мітки: поліморф, кристалічний, базедоксифену, ацетату
Код посилання
<a href="https://ua.patents.su/14-85703-kristalichnijj-polimorf-bazedoksifenu-acetatu.html" target="_blank" rel="follow" title="База патентів України">Кристалічний поліморф базедоксифену ацетату</a>
Попередній патент: 3-[4-гетероцикліл-1,2,3-триазол-1-іл]-n-арилбензаміди як інгібітори продукування цитокінів, призначені для лікування хронічних запальних захворювань
Наступний патент: Система, що затримується у шлунку
Випадковий патент: Система передпускової теплової підготовки силової установки транспортного засобу