Кон’югат поліетиленгліколь-інтерферону альфа
Номер патенту: 90805
Опубліковано: 25.05.2010
Автори: Иу Вон-Янг, Янг Хік-Ін, Кім Вьонг-Мун, Канг Су-Хьюнг, Джеон Хьюн-Кюю, Лі Сунг-Хі, Чоі Юн-Кюю, Ио Єонг-Ву
Формула / Реферат
1. Кон'югат три-розгалуженого поліетиленгліколь-інтерферону альфа загальної формули (І), в якому поліетиленгліколь має середню молекулярну вагу від 400 до 45000 дальтонів,
Н2СО(СН2СН2O)n-Z-Y-інтерферон a
|
НСО(СН2СН2O)mСН3
|
Н2СО(СН2СН2O)mСН3, (1)
де n є ціле число від 1 до 1000;
m є ціле число від 10 до 1000;
Z є (CH2)s або (CH2)sNHCO(CH2)s як лінкер інтерферону альфа та поліетиленгліколю, де S є ціле число від 1 до 6;
Y є вторинний амін або амідний зв'язок, що є зв'язком функціональної групи NH2 в молекулі інтерферону та функціональної групи похідної поліетиленгліколю.
2. Кон'югат за п. 1, який відрізняється тим, що поліетиленгліколь має середню молекулярну вагу від 30000 до 45000 дальтонів.
3. Кон'югат за п. 1, який відрізняється тим, що поліетиленгліколь має середню молекулярну вагу 43000 дальтонів.
4. Спосіб приготування кон'югата три-розгалуженого поліетиленгліколь-інтерферону альфа загальної формули (1), в якому поліетиленгліколь має середню молекулярну вагу від 400 до 45000 дальтонів, який полягає в утворенні ковалентного зв'язку похідної розгалуженого поліетиленгліколю загальної формули (2) та інтерферону альфа,
Н2СО(СН2СН2O)n-Z-Y-інтерферон a
|
НСО(СН2СН2O)mСН3
|
Н2СО(СН2СН2O)mСН3, (1)
де n є ціле число від 1 до 1000;
m є ціле число від 10 до 1000;
Z є (CH2)s або (CH2)sNHCO(CH2)s як лінкер інтерферону альфа та поліетиленгліколю, де S є ціле число від 1 до 6;
Y є вторинний амін або амідний зв'язок, що є зв'язком функціональної групи NH2 молекули інтерферону та функціональної групи похідної поліетиленгліколю;
Н2СО(СН2СН2O)n-Х
|
НСО(СН2СН2O)mСН3
|
Н2СО(СН2СН2O)mСН3, (2)
де n є ціле число від 1 до 1000;
m є ціле число від 10 до 1000;
Х є функціональна група, представлена загальною формулою (3), яка може хімічно реагувати з білком або пептидом, що містить інтерферон альфа
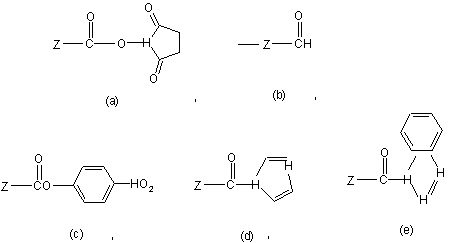 , (3)
, (3)
Z є (CH2)s або (CH2)sNHCO(CH2)s як лінкер інтерферону альфа та поліетиленгліколю, де S є ціле число від 1 до 6.
5. Спосіб за п. 4, який відрізняється тим, що поліетиленгліколь має середню молекулярну вагу від 30000 до 45000 дальтонів.
6. Спосіб за п. 4, який відрізняється тим, що поліетиленгліколь має середню молекулярну вагу 43000 дальтонів.
7. Спосіб за п. 4, який відрізняється тим, що Х є (а) або (b) у загальній формулі (3).
8. Спосіб за п. 4, який відрізняється тим, що молярне співвідношення інтерферону альфа і похідної три-розгалуженого поліетиленгліколю становить від 1:0,5 до 1:50.
9. Спосіб за п. 8, який відрізняється тим, що молярне співвідношення інтерферону альфа і похідної три-розгалуженого поліетиленгліколю у реакції становить від 1:0,5 до 1:3.
10. Фармацевтична композиція для лікування або попереджання захворювань, чутливих до інтерферону альфа, яка містить кон'югат за будь-яким із пп. 1-3 як активний інгредієнт.
11. Композиція за п. 10, яка відрізняється тим, що захворюваннями, чутливими до інтерферону альфа, є лейкоз ворсистих клітин, саркома Капозі, хронічна мієлогенна лейкемія (CML), В-клітинна лімфома, Т-клітинна лімфома, меланома, мієлома та гіпернефрома.
12. Спосіб лікування або попереджання захворювань, чутливих до інтерферону альфа, який полягає у введенні кон'югата за будь-яким із пп. 1-3 як активного інгредієнта.
Текст
1. Кон'югат три-розгалуженого поліетиленгліколь-інтерферону альфа загальної формули (І), в якому поліетиленгліколь має середню молекулярну вагу від 400 до 45000 дальтонів, Н2СО(СН2СН2O)n-Z-Y-інтерферон 2 3 90805 O O C Z 4 O O H CH Z O O O Z (b) , (a) HO2 CO (c) Z , C , O H Z H C H H H (d) , (e) , (3) Z є (CH2)s або (CH2)sNHCO(CH2)s як лінкер інтерферону альфа та поліетиленгліколю, де S є ціле число від 1 до 6. 5. Спосіб за п. 4, який відрізняється тим, що поліетиленгліколь має середню молекулярну вагу від 30000 до 45000 дальтонів. 6. Спосіб за п. 4, який відрізняється тим, що поліетиленгліколь має середню молекулярну вагу 43000 дальтонів. 7. Спосіб за п. 4, який відрізняється тим, що Х є (а) або (b) у загальній формулі (3). 8. Спосіб за п. 4, який відрізняється тим, що молярне співвідношення інтерферону альфа і похідної три-розгалуженого поліетиленгліколю становить від 1:0,5 до 1:50. 9. Спосіб за п. 8, який відрізняється тим, що молярне співвідношення інтерферону альфа і похід ної три-розгалуженого поліетиленгліколю у реакції становить від 1:0,5 до 1:3. 10. Фармацевтична композиція для лікування або попереджання захворювань, чутливих до інтерферону альфа, яка містить кон'югат за будь-яким із пп. 1-3 як активний інгредієнт. 11. Композиція за п. 10, яка відрізняється тим, що захворюваннями, чутливими до інтерферону альфа, є лейкоз ворсистих клітин, саркома Капозі, хронічна мієлогенна лейкемія (CML), В-клітинна лімфома, Т-клітинна лімфома, меланома, мієлома та гіпернефрома. 12. Спосіб лікування або попереджання захворювань, чутливих до інтерферону альфа, який полягає у введенні кон'югата за будь-яким із пп. 1-3 як активного інгредієнта. Галузь техніки Цей винахід стосується кон'югату трирозгалуженого поліетиленгліколь-інтерферону альфа. Попередній рівень техніки Інтерферон був відкритий у 1957р. Ісааком та Лінденманном і був відомий як такий, що має відмінну противірусну дію [Isaacs et al, Virus interference, 147 (1957)]. Інтерферон класифікують на Тип І (IFN- , , ) і Тип II (IFN- ), а клітини, які виробляє інтерферон, є різними, такі як лейкоцити, фібробласти, Т-клітини та ін. Модифікований інтерферон альфа був дозволений і його почали використовувати як терапевтичний агент проти лейкозу ворсистих клітин з 1986р. Отже, інтерферон є першим цитокіном, який виробляють генною рекомбінантною технологією та використовують для лікування раку [Pestka et al, Semin. Oncol., 24 (1997)]. Інтерферон альфа є фармацевтично активним білком, що має антивірусну та протипухлинну дію, і його використовують для лікування більш ніж 14 класів пухлинних та вірусних захворювань у більш ніж 40 країнах світу. Клінічно ефективними сферами лікування інтерфероном альфа є лейкоз ворсистих клітин, саркома Капозі (Kaposi), хронічна міє логенна лейкемія (CML), В-клітинна лімфома, Тклітинна лімфома, меланома, мієлома, гіпернефрома [Nagabhushan T.L. et al, Regulatory practice for biopharmaceutical production, 221-234 (1994)]. Інтерферон є також першим людським білком, що може збільшувати тривалість життя ракового пацієнта, і його вважають придатним до застосування проти різних видів пухлин, таких як рак яєчників, рак грудей, бронхіальний рак, рак сечового міхура, рак шлунка тощо, та гострого лейкозу [Mosbe Talpaz et al, Seminars in Hepatology, 38(3), 22-27 (2001)]. Зокрема, нині для лікування гепатиту В або С використовують інтерферон альфа-2а (IFN альфа2а), інтерферон альфа-2b та інтерферон-con1 (IFN-con1) як його мутеїн. Повідомляли, що в разі хронічного прогресування інфікування вірусом, таким як вірус гепатиту В (HBV) або С (HCV), існує ризик, що інфекція може розвинутись у гепатоцелюлярний рак. Відповідно, інтерферон можна використовувати для попереджання раку. Однак, інтерферон як клінічно корисний білковий лікарський засіб має такі недоліки, як низька стабільність в умовах in vivo, швидке видалення в умовах in vivo, утворення антитіл при повторних введеннях та відповідна реакція гіперчутливості, 5 на зразок ферментів, білків, гормонів, пептидів, утворених методом генної інженерії. Зокрема, часте введення, таке як раз на добу, 3 рази на тиждень і т.д., викликає біль у пацієнтів. Крім того, для пацієнтів, які потребують лікування впродовж тривалого періоду часу, таке введення може загрожувати якості їхнього життя. Для подолання цих проблем як медикамент, що може бути стабільним і підтримувати активність впродовж тривалого періоду часу, був розроблений і зараз застосовується білковий лікарський засіб, який модифікує поліетиленгліколь. Поліетиленгліколь є дуже гідрофільним і може збільшувати розчинність під час зв'язування з терапевтичним білком. Поліетиленгліколь є також ефективним для збільшення молекулярної ваги зв'язаного з ним білка, підтримуючи основні біологічні функції, такі як ферментна активність та рецепторне зв'язування. Таким чином, поліетиленгліколь може знижувати гломерулярну фільтрацію та ефективно захищати білок від розщеплення протеолітичним ферментом. Відповідно, поліетиленгліколь має переваги попереджання розщеплення білка, збільшення стабільності й часу циркуляції білка та зниження імуногенності. Лінійний поліетиленгліколь, який звичайно використовують, має молекулярну вагу приблизно 1000~25000 дальтонів, але він має обмеження у зв'язуванні багатьох лінійних великих молекул з білком або пептидом, при підтриманні їхньої активності, через обмежені біологічно активні ділянки білків та пептидів. Для усунення цих проблем лінійного поліетиленгліколю Wana, H et al намагалися зв'язати похідні розгалуженого моно-метоксиполіетилену (mПЕГ) з білком із використанням трихлортріазину [Wana, Н et al., Ann. N.Y.Acad.Sci. 613:95108(1990)]. Однак, розмір активованих похідних розгалуженого поліетиленгліколю є великим, і тому він індукує стеринну невідповідність на поверхнях білка або пептиду, тим самим знижуючи активність модифікованого білка або пептиду. Також ці похідні звичайно спричиняють низький виробіток очищення внаслідок неповних похідних розгалуженого поліетиленгліколю. У корейському патенті №0396983 намагалися усунути ці проблеми розгалужених високомолекулярних похідних. Зокрема, у патенті намагалися мінімізувати зниження біологічної активності за допомогою захисту білкової структури через мінімізування кількості лінкерів, зв'язаних з біологічно активними ділянками, шляхом подовження лінкерів для з'єднання великої молекули і протеїну, і зниження стеринної невідповідності, індукованої розгалуженими великими молекулами. Однак, триПЕГ-NHS, що є активованими розгалуженими високомолекулярними похідними, які мають довгі лінкери, містять надлишковий лінійний ПЕГ-NHS і ди-ПЕГ-NHS, що має низькомолекулярні кількості як домішки при приготуванні лінкерної структури. Вони конкурують під час участі у реакції зв'язування з інтерфероном і генерують низькомолекулярний кон'югат ПЕГ-інтерферону альфа і кон'югат ди-ПЕГ-інтерферону альфа, які складно очистити. 90805 6 Отже, цей спосіб має недоліки низької чистоти і низького виходу. Таким чином, все ще існує потреба у макромолекулярному кон'югаті поліетиленглікольінтерферону, який може мінімізувати зниження біоактивності інтерферону альфа та має високу чистоту і гарну стабільність. Розкриття винаходу Мета винаходу Мета цього винаходу полягає у забезпеченні кон'югатів три-розгалуженого поліетиленглікольінтерферону альфа, які мають високу виробничу чистоту та виробіток, збільшений період напіввиведення у крові та мінімізоване зниження біоактивності інтерферону порівняно до кон'югатів інтерферону альфа та поліетиленгліколь-інтерферону альфа, відомих у цій галузі; способу їх приготування та фармацевтичної композиції, яка їх містить. Технічне рішення Для досягнення вказаної вище мети цей винахід забезпечує велику молекулу, що зв'язує похідні три-розгалуженого поліетиленгліколю з інтерфероном альфа і має високу чистоту, та фармацевтичну композицію, що містить таку молекулу. Цей винахід докладно пояснено далі. Кон'югат поліетиленгліколь-інтерферону альфа генерується за допомогою реакції зв'язування похідних три-розгалуженого поліетиленгліколю та інтерферону альфа і може бути представлений такою загальною формулою (1): (1) де n є ціле число від 1 до 1000, a m є ціле число від 10 до 1000. У згаданому вище кон'югаті середня молекулярна вага поліетиленгліколю становить від 400 до 45000 дальтонів, краще від 30000 до 45000 дальтонів, ще краще 43000 дальтонів. Якщо молекулярна вага поліетиленгліколю є вищою, фармакокінетика високомолекулярного кон'югату є кращою, але активність знижується. Тому належна молекулярна вага є важливою. Z є (CH2)S або (CH2)SNНСO(CH2)S для відігрівання ролі лінкера інтерферону альфа та поліетиленгліколю, де S є ціле число від 1 до 6. Y є вторинний амін або амідний зв'язок, утворений реакцією зв'язування функціональної групи NH2 молекули інтерферону та функціональної групи похідної поліетиленгліколю. Цей винахід також забезпечує спосіб приготування кон'югату три-розгалуженого поліетиленгліколь-інтерферону альфа, як показано у наведеній далі загальній формулі (1), в якому поліетиленгліколь має середню молекулярну вагу від 400 до 45000 дальтонів, краще від 30000 до 45000 дальтонів, ще краще 43000 дальтонів. Похідні три-розгалуженого поліетиленгліколю за цим винаходом є активованою великою молекулою, яка має таку розгалужену структуру, що поєднує три лінійні біологічно чутливі великі моле 7 кули. Всі з трьох ОН (гідрокси) ділянок у структурі гліцерину полімеризовані частинами молекул етиленгліколю, а кінець однієї ділянки активований як функціональна група. Дві інші ділянки, за винятком активованої ділянки, заміщені монометокси для запобігання додатковим реакціям. При приготуванні згаданих вище розгалужених похідних поліетиленгліколю розмір кожного лінійного поліетиленгліколю можна вільно контролювати, при цьому велика молекула, яка має належну структуру та молекулярну вагу, може бути приготована і зв'язана з інтерфероном альфа. Похідна розгалуженого поліетиленгліколю (ПЕГ), зв'язана з інтерфероном альфа, представлена такою загальною формулою (2): 90805 8 (2) де n є ціле число від 1 до 1000 та m є ціле число від 10 до 1000. Середня молекулярна вага одиниці поліетиленгліколю кон'югату становить від 400 до 45000 дальтонів, краще від 30000 до 45000 дальтонів, ще краще 43000 дальтонів. X є функціональною групою, що може хімічно реагувати з білком або пептидом, що містить інтерферон альфа, як показано нижче у загальній формулі (3). Краще, якщо X є N-гідроксисукцинімід (а) або альдегід (b) у сполуці формули (3), і кожний утворює амідний зв'язок і структурний зв'язок вторинного аміну у реакції зв'язування з інтерфероном альфа при високому виході продукту. (3) Z є (CH2)S або (CH2)SNНСО(CH2)S для відігрівання ролі лінкера інтерферону альфа та поліетиленгліколю, де S є ціле число від 1 до 6. У цьому винаході реакційне молярне співвідношення інтерферону альфа та розгалуженої похідної поліетиленгліколю становить від 1:0,5 до 1:50. Краще, якщо молярне співвідношення інтерферону альфа та розгалуженої похідної поліетиленгліколю становить від 1:0,5 до 1:3. Якщо молярне співвідношення поліетиленгліколю до інтерферону альфа збільшується, виробіток кон'югату монополіетиленгліколь-інтерферону альфа на одиницю часу зменшується. Також цей винахід забезпечує фармацевтичну композицію для лікування або попереджання захворювань, чутливих до інтерферону альфа, яка містить кон'югат поліетиленгліколь-інтерферону альфа за цим винаходом як ефективний інгредієнт. Композиція може складатись з ефективної дози кон'югату поліетиленгліколь-інтерферону альфа за цим винаходом, розріджувача, антисептиків, солюбілізатора, емульгатора, ювантію та/або носія. Фармацевтичні композиції за цим винаходом можуть бути складені у вигляді агента для ін'єкцій, капсули, таблетки, рідких ліків, пілюлі, мазі, очної мазі, очних крапель, трансдермального абсорбувального агента, пасти, припарки, агента для пластиру, аерозолю тощо. Ефективне дозування фармацевтичної композиції за цим винаходом може варіюватись відповідно до віку пацієнта, його стану, ваги тощо, але звичайно один раз на тиждень або один раз на два тижні. Композиція може бути введена один або багато разів на день в межах діапазону денної ефективної дози. Крім того, цей винахід забезпечує спосіб лікування або попереджання захворювань, чутливих до інтерферону альфа, який полягає у введенні кон'югату за цим винаходом як ефективного інгредієнта. Захворюваннями, чутливими до інтерферону альфа, є лейкоз ворсистих клітин, саркома Капозі, хронічна мієлогенна лейкемія (CML), лімфома В-клітин, лімфома Т-клітин, меланома, мієлома, гіпернефрома. Захворюваннями є рак яєчників, рак грудей, бронхіальний рак, рак сечового міхура, рак шлунка тощо та інші види раку, наприклад гострий лейкоз. Цей винахід конкретно пояснено наведеними далі прикладами. Наведені приклади призначені для додаткового ілюстрування цього винаходу, але жодним чином не для обмежування обсягу цього винаходу. Ефекти винаходу Цей винахід стосується біологічно активних нових кон'югатів три-розгалуженого поліетиленгліколь-інтерферону альфа, які мають структуру гліцерину. Отже, цей винахід характеризується тим, що він має високу чистоту та високий виробіток продукту, мінімізує зниження біоактивності та збільшує період напіввиведення у крові шляхом по 9 долання проблем, що лінійний поліетиленгліколь не може зв'язувати багато лінійних великих молекул з білком або пептидом; розгалужені високомолекулярні похідні індукують надлишкову стеринну невідповідність на поверхнях білка або пептиду; і розгалужені високомолекулярні похідні, чиї лінкери подовжені, мають виробіток низького очищення внаслідок низької чистоти тощо. Відповідно, фармацевтична композиція за цим винаходом, що містить кон'югат поліетиленглікольінтерферону альфа, який має антивірусну активність та протипухлинну активність, має такі ефекти, що зниження активності мінімізується, а лікувальний ефект може покращуватись, а незручність для пацієнта може бути мінімізована шляхом зменшення частоти введень завдяки подовженому періоду напіввиведення у тілі порівняно з терапевтичним агентом інтерферону альфа, відомим у цій галузі. Опис креслень Фіг.1 є схематичне креслення, що ілюструє аналітичні результати Прикладу 1 за допомогою гелевої високоефективної рідинної хроматографії (надалі: Г-ВЕРХ). Фіг.2 є схематичне креслення, що ілюструє аналітичні результати Прикладу 2 за допомогою ГВЕРХ. Фіг.3 є схематичне креслення, що ілюструє аналітичні результати Порівняльного прикладу 1 за допомогою Г-ВЕРХ. Фіг.4 є схематичне креслення, що ілюструє аналітичні результати Порівняльного прикладу 2 за допомогою Г-ВЕРХ. Фіг.5 є схематичне креслення, що ілюструє аналітичні результати Порівняльного прикладу 3 за допомогою Г-ВЕРХ. Фіг.6 є схематичне креслення, що ілюструє аналітичні результати Порівняльного прикладу 4 за допомогою Г-ВЕРХ. Фіг.7 є схематичне креслення, що ілюструє аналітичні результати Прикладу 1 за допомогою іонізації лазерною десорбцією із використанням матриці - час-пролітного (MALDI-TOF) масового спектрометру (надалі: MALDI-TOF). Фіг.8 є схематичне креслення, що ілюструє аналітичні результати Прикладу 2 за допомогою MALDI-TOF. Фіг.9 є схематичне креслення, що ілюструє аналітичні результати Порівняльного прикладу 1 за допомогою MALDI-TOF. Фіг.10 є схематичне креслення, що ілюструє аналітичні результати Порівняльного прикладу 2 за допомогою MALDI-TOF. Фіг.11 є схематичне креслення, що ілюструє результати пригнічення цитопатичних ефектів (СРЕ) кон'югатів інтерферону альфа, модифікованих поліетиленгліколем Прикладу 1, та Порівняльні приклади 1 і 3 шляхом використання вірусу везикулярного стоматиту та клітин бичачих нирок Марбін-Дарбі (Marbin-Darby) (MDBK). Фіг.12 є схематичне креслення, що ілюструє порівняльні аналітичні результати фармакокінетики інтерферону альфа та кон'югату поліетиленгліколь-інтерферону альфа Прикладу 1. 90805 10 Фіг.13 є схематичне креслення, що ілюструє результати порівняльних ефектів протипухлинної дії інтерферону альфа та кон'югату поліетиленгліколь-інтерферону альфа Прикладу 1 із використанням клітин Дауді (Daudi). Фіг.14 є схематичне креслення, що ілюструє результати порівняння змін біологічної активності інтерферону альфа та кон'югату інтерферону альфа, модифікованого три-розгалуженим поліетиленгліколем (ПЕГ, мол. вага 43000) - Прикладу 1 відповідно до зміни температури. Фіг.15 є схематичне креслення, що ілюструє аналітичні результати біологічної активності інтерферону альфа та кон'югатів інтерферону альфа, модифікованих поліетиленгліколем Прикладу 1 на протеолітичний фермент і час. Втілення винаходу Приклад 1. Приготування кон'югату трирозгалуженого поліетиленгліколю (мол. вага 43000Да)-інтерферону альфа (І) формули (1) шляхом застосування три-розгалуженого поліетиленгліколь N-гідроксисукциніміду 68мг три-розгалуженого поліетиленгліколь Nгідроксисукциніміду (NOF corporation, Японія), що має молекулярну вагу 43000 дальтонів, додали до 10мг інтерферону альфа (Dong-A Pharm. Co., Ltd.) у 100мМ біцинового буферу, рН8,0. Реакційну суміш збовтували впродовж 2 годин при кімнатній температурі. Реакцію припинили додаванням 0,1М гліцину. Реагент ввели у знесолювальну колонку Ніргер™26/10 (Amersham Pharmacia Biotech), врівноважену 40мМ NaH2PO4 (pH4,0) буферного розчину, і буферний розчин змінили елююванням тим самим буферним розчином. N-гідроксисукцинімід, відокремлений з три-розгалуженого поліетиленгліколь-N-гідрокси сукциніміду за допомогою цієї реакції, видалили. Елюант ввели у катіон-обмінну хроматографію швидкого потоку SP-Sepharose (Amersham Pharmacia Biotech), врівноважену 40мМ NaH2PO4 (pH4,0) буферного розчину, і потім кон'югат поліетиленгліколь-інтерферону альфа відокремили рідинною хроматографією. Кон'югат поліетиленгліколь-інтерферону альфа поділили на фракції із використанням 0~500мМ градієнту концентрації хлориду натрію (NaCI). Форму та розмір поділеного на фракції елюату підтвердили за допомогою ВЕРХ та SDS-PAGE. Кон'югати форм, зв'язаних з ди- або три-трирозгалуженими поліетиленгліколями з інтерфероном альфа, та немодифіковані інтерферони альфа, що залишились після реакції, вилучили для одержання вказаного у заголовку кон'югату, кон'югату поліетиленгліколь інтерферону альфа, зв'язаного з одним три-розгалуженим поліетиленгліколем (мол. вага 43000) з інтерфероном альфа (або який називають кон'югат моно-три-розгалуженого поліетиленгліколь-інтерферону альфа). За допомогою гелевої високоефективної рідинної хроматографії підтвердили, що суміш реагентів складалась з близько 47% кон'югату монополіетиленгліколь інтерферону альфа (моно-ПЕГIFN ), близько 36% немодифікованого інтерферону (IFN ) та інших кон'югатів [di-ПЕГільованого кон'югату інтерферону альфа (ди-ПЕГ-IFN ) та N 11 гідроксисукциніміду (NHS)] {див. Фіг.1; поглинання вимірювали при 280нм; і час утримування для (а) ди-ПЕГ-IFN складав близько 8хв., для (b) моноПЕГ-IFN - близько 9хв., для (с) IFN - близько 13,5хв., і для (d) NHS - близько 15,3хв.}. Відокремлений кон'югат моно-три-розгалуженого поліетиленгліколь інтерферону альфа аналізували із використанням MALDI-TOF, як показано на Фіг.7, і показник становив 65943,2 (m/z) (див. Фіг.7). Приклад 2. Приготування кон'югату трирозгалуженого поліетиленгліколю (мол. вага 43000Да)-інтерферону альфа (II) із використанням альдегіду три-розгалуженого полі етиленгліколю. 68 мг альдегіду три-розгалуженого поліетиленгліколю (NOF corporation, Японія) з молекулярною вагою 43 000 дальтонів додали до 10мг інтерферону альфа (Dong-A Pharm. Co., Ltd.) у 40мМ буферу з ацетату натрію (С2Н3NaO2), рН4,0. Реакційну суміш збовтували впродовж 14 годин при холодній температурі. Реагент ввели у знесолювальну колонку Нірrер™26/10 (Amersham Pharmacia Biotech), врівноважену 40мМ NaH2PO4 (pH 4,0) буферного розчину, і потім буферний розчин змінили елююванням тим самим буферним розчином. Потім елюат ввели у катіон-обмінну хроматографію швидкого потоку SP-Sepharose (Amersham Pharmacia Biotech), врівноважену 40мМ NaH2PO4 (pH4,0) буферного розчину, і кон'югат поліетиленгліколю інтерферону альфа відокремили рідинною хроматографією. Кон'югат поліетиленглікольінтерферону альфа поділили на фракції із використанням 0~500мМ градієнта концентрації хлориду натрію (NaCI). З поділеного на фракції елюата видалили інтерферон альфа, що залишився після реакції, за допомогою ВЕРХ та SDS-PAGE для одержання вказаного у заголовку кон'югату, кон'югату поліетиленгліколю (мол. вага 43000Да)-інтерферону альфа (II) (кон'югату моно-три-розгалуженого поліетиленгліколю інтерферону альфа), в якому лише один три-розгалужений поліетиленгліколь був зв'язаний з N-кінцем інтерферону альфа. За допомогою гелевої високоефективної рідинної хроматографії підтвердили, що суміш складалась з близько 42% кон'югату монополіетиленгліколю інтерферону альфа (моно-ПЕГIFN ) і близько 55% немодифікованого інтерферону (IFN ) {див. Фіг.2; поглинання вимірювали при 280нм, і час утримування (а) моно-ПЕГ-IFN складав близько 9,5хв., (b) IFN - близько 14хв.}. Чистоту та молекулярну вагу відокремленого кон'югату моно-три-розгалуженого поліетиленгліколю інтерферону альфа підтвердили із використанням MALDI-TOF, і величина становила 66141,9 (m/z) (див. Фіг.8). Порівняльний приклад 1. Приготування кон'югату два-розгалуженого поліетиленгліколю (ПЕГ, мол. вага 40000Да)-інтерферону альфа (III) із використанням два-розгалуженого поліетиленгліколю-N-гідроксисукциніміду 63мг два-розгалуженого поліетиленгліколю Nгідроксисукциніміду (NOF corporation, Японія) з молекулярною вагою 40000 дальтонів додали до 10мг інтерферону альфа, приготованого відомим 90805 12 способом [Pestka, Sci. Am. 249, 36 (1983)] у 100мМ біцинового буферу, рН8,0. Реакційну суміш збовтували впродовж 2 годин при кімнатній температурі, і реакцію зупинили додаванням 0,1М гліцину. Реагент ввели у знесолювальну колонку Нірrер™26/10 (Amersham Pharmacia Biotech), врівноважену 40мМ NaH2PO4 (pH4,0) буферного розчину, і буферний розчин змінили елююванням тим самим буферним розчином. N-гідроксисукцинімід, відокремлений з три-розгалуженого поліетиленгліколь-N-гідроксисукциніміду шляхом цієї реакції, видалили. Елюант ввели у катіон-обмінну хроматографію швидкого потоку SP-Sepharose (Amersham Pharmacia Biotech), врівноважену 40мМ NaH2PO4 (pH4,0) буферного розчину, і звідти відокремили кон'югат поліетиленгліколю інтерферону альфа із використанням рідинної хроматографії. Кон'югат поліетиленгліколь-інтерферону альфа поділили на фракції із використанням 0~500мМ градієнта концентрації хлориду натрію (NaCI). Форму та розмір поділеного на фракції елюату підтвердили за допомогою ВЕРХ та SDSPAGE. Звідти видалили інтерферон альфа, що залишився після реакції, та кон'югати інтерферону альфа, з якими зв'язані два (2) або більше дварозгалужені поліетиленгліколі з інтерфероном альфа, для одержання вказаного у заголовку кон'югату, кон'югату інтерферону альфа, з яким був зв'язаний лише один два-розгалужений поліетиленгліколь з інтерфероном альфа. За допомогою гелевої високоефективної рідинної хроматографії підтвердили, що суміш складалась з близько 40% кон'югату монополіетиленгліколю-інтерферону альфа (моно-ПЕГIFN ), близько 50% немодифікованого інтерферону (IFN ), іншого [кон'югат ди-ПЕГільованого інтерферону альфа (ди-ПЕГ-IFN ), та Nгідроксисукцинімід (NHS)] {див. Фіг.3; поглинання вимірювали при 280нм, і час утримування (а) диПЕГ-IFN складав близько 8хв., (b) моно-ПЕГ-IFN - близько 9хв., (с) IFN - близько 13,5хв., і (d) NHS - близько 15хв.}. Молекулярну вагу вимірювали для відокремленого моно-два-розгалуженого поліетиленгліколю інтерферону альфа, кон'югованого із використанням MALDI-TOF, і вона становила 62708,2 (m/z) (див. Фіг.9). Порівняльний приклад 2. Приготування кон'югату два-розгалуженого поліетиленгліколю (ПЕГ, мол. вага 40000Да)-інтерферону альфа (IV) із використанням альдегіду два-розгалуженого поліетиленгліколю 63мг альдегіду два-розгалуженого поліетиленгліколю (NOF corporation, Японія) молекулярною вагою 40000 дальтонів додали до 10мг інтерферону альфа (Dong-A Pharm. Co., Ltd.) у 40мМ буферу ацетату натрію (C2H3NaO2), pH4,0. Реакційну суміш збовтували впродовж 10-14год. при холодній температурі. Реагент ввели у знесолювальну колонку Ніргер™ 26/10 (Amersham Pharmacia Biotech), врівноважену 40мМ NaH2PO4 (pH 4,0) буферного розчину, і потім буферний розчин змінили елююванням тим самим буферним розчином. Потім елюат ввели у катіон-обмінну хроматографію швидкого потоку SP-Sepharose (Amersham 13 Pharmacia Biotech), врівноважену 40мМ NaH2PO4 (pH 4,0) буферного розчину, і кон'югат поліетиленгліколю інтерферону альфа відокремили рідинною хроматографією. Реагент поділили на фракції із використанням 0~500мМ градієнта концентрації хлориду натрію (NaCI). Поділений на фракції елюат підтвердили за допомогою ВЕРХ і SDS-PAGE. Звідти видалили інтерферон альфа, що залишився після реакції, для одержання кон'югату поліетиленглікольінтерферону альфа (II), з яким лише один дварозгалужений поліетиленгліколь був зв'язаний з Nкінцем кон'югату інтерферону альфа. За допомогою гелевої високоефективної рідинної хроматографії підтвердили, що суміш складалась з близько 37% кон'югату монополіетиленгліколю інтерферону альфа (моно-ПЕГIFN ) та близько 60% немодифікованого інтерферону (IFN ) {див. Фіг.4; поглинання вимірювали при 280нм, і час утримування (а) моно-PEG-IFN складав близько 9,5хв., а (b) IFN - близько 14хв.}. Молекулярну вагу відокремленого кон'югату монотри-розгалуженого поліетиленгліколь-інтерферону альфа вимірювали із використанням MALDI-TOF, і вона становила 62718,9 (m/z) (див. Фіг.10). Порівняльний приклад 3. Приготування кон'югату поліетиленгліколь-інтерферону альфа, в якому лізин-структурований два-розгалужений поліетиленгліколь (мол. вага 40000Да), що має функціональну групу складного ефіру Nгідроксисукциніміду (складний ефір NHS), був зв'язаний з інтерфероном альфа. Кон'югат два-розгалуженого поліетиленгліколю (мол. вага 40000Да) інтерферону альфа готували шляхом реагування 50мг інтерферону альфа з два-розгалуженим поліетиленгліколем Nгідроксисукциніміду (Nektar, Америка, середня молекулярна вага = 40000 дальтон) відповідно до способу, описаного у корейському патенті №100254097. За допомогою гелевої високоефективної рідинної хроматографії підтвердили, що суміш складалась з близько 17% кон'югату монополіетиленгліколь-інтерферону альфа (моно-ПЕГIFN ), близько 74% немодифікованого інтерферону (IFN ) та іншого [кон'югату ди-ПЕГільованого інтерферону альфа (ди-ПЕГ-IFN ) та Nгідроксисукциніміду (NHS)] {див. Фіг.5; поглинання вимірювали при 280нм, і час утримування (а) диПЕГ-IFN складав близько 8,5хв., (b) моно-ПЕГIFN - близько 9,5хв., (с) IFN - близько 14хв., і (d) NHS - близько 16,5хв.}. Порівняльний приклад 4. Приготування кон'югату поліетиленгліколь-інтерферону альфа, лізинструктурований три-розгалужений поліетиленгліколь якого (мол. вага 43000Да), що має функціональну групу складного ефіру Nгідроксисукциніміду (складний ефір NHS), був зв'язаний з інтерфероном альфа. Три-ПЕГ-NHS (мол. вага 43000Да) готували способом, описаним у корейському патенті № 10 90805 14 0396983, і потім реагували з 3мг інтерферону альфа для одержання кон'югату трирозгалуженого поліетиленгліколю (мол. вага 43000Да) інтерферону альфа. За допомогою гелевої високоефективної рідинної хроматографії підтвердили, що суміш складалась з близько 32% кон'югату монополіетиленгліколю інтерферону альфа (моно-ПЕГIFN ), близько 52% немодифікованого інтерферону (IFN ) та іншого [кон'югату ди-ПЕГільованого інтерферону альфа (ди-ПЕГ-IFN ) та Nгідроксисукциніміду (NHS)] (див. Фіг.6; поглинання вимірювали при 280нм; і час утримування (а) диПЕГ-IFN складав близько 8,5хв., (b) моно-ПЕГIFNa - близько 9,5хв., (с) IFN - близько 14хв. і (d) NHS - близько 16,5хв.). Тест з визначення характеристик та фармакологічної активності проводили шляхом використання приготованих вище кон'югатів, і результати були такими. Експериментальний приклад 1. Тест реактивності похідної поліетиленгліколю та інтерферону альфа Для випробування реактивності використаних вище похідних поліетиленгліколю та інтерферону альфа кількість кон'югату моно-поліетиленгліколю інтерферону альфа, генерованого реагуванням інтерферону альфа з поліетиленгліколем, та кількість немодифікованого інтерферону альфа визначали з пікових зон (Фіг.1 - 6) за допомогою гелевої високоефективної рідинної хроматографії, як показано у Прикладах 1 і 2 та Порівняльних прикладах 1-4. В результаті можна було одержати реактивність інтерферону альфа відповідно до структури поліетиленгліколю (див. Таблиці 1 і 2). Беручи до уваги кількість, що залишилася, немодифікованого інтерферону альфа та кількість генерованого кон'югату моно-поліетиленгліколю інтерферону альфа, зв'язувальна реактивність три-розгалуженого поліетиленгліколю та інтерферону альфа у Прикладах 1 і 2 була найкращою. Експериментальний приклад 2. Молекулярна вага та виробіток кон'югату поліетиленгліколю інтерферону альфа Кон'югати поліетиленгліколь-інтерферону альфа з високою чистотою, одержані за Прикладами 1 і 2 та Порівняльними прикладами 1 і 2, аналізували за допомогою MALDI-TOF для підтвердження відповідності результатів очікуваній молекулярній вазі (див. Фіг.7, 8, 9 і 10). Відносно кількості немодифікованого інтерферону альфа та виходу генерованого кон'югату монополіетиленгліколь-інтерферону альфа підтвердили, що Приклади 1 і 2 мали відмінний очищений виробіток [див. Таблицю 1 (Порівняння реактивності та виходу похідної поліетиленгліколю із використанням N-гідроксисукциніміду та інтерферону альфа) і Таблицю 2 (Порівняння реактивності та виходу похідної поліетиленгліколю із використанням альдегіду та інтерферону альфа)]. 15 90805 16 Таблиця 1 ПЕГ-IFN Приклад 1 Порівняльний приклад 1 Порівняльний приклад 3 Порівняльний приклад 4 Генерований моно-ПЕГIFN (%) 47 41 17 32 Немодифікований IFN , (%) 36 50 74 52 Виробіток (%) 23 20 11 16 Таблиця 2 ПЕГ-IFN Приклад 2 Порівняльний приклад 2 Генерований моно-PEG-IFN (%) 42 37 Експериментальний приклад 3. Випробування антивірусної активності та активності в умовах in vitro кон'югату поліетиленгліколь-інтерферону альфа Для дослідження дії використаних вище похідних поліетиленгліколю та кон'югатів інтерферону альфа стосовно активності інтерферону альфа антивірусну активність кожного з кон'югатів монополіетиленгліколю інтерферону альфа, генерованих у Прикладі 1 та Порівняльних прикладах 1 і 3, вимірювали оцінюванням ситопатичної дії (СРЕ) із використанням клітин бичачих нирок Марбін-Дарбі (Marbin-Darby) (MDBK). Клітини контрольно заразили вірусом везикулярного стоматиту (VSV) і також вимірювали їхню відносну активність щодо інтерферону альфа (див. Фіг.11). Для вимірювання відносної активності інтерферон альфа розбавили в 105 разів, кон'югат поліетиленгліколь-інтерферону альфа Порівняльного прикладу 1 розбавили в 2 105 разів, кон'югат поліетиленгліколь-інтерферону альфа Прикладу 1 Немодифікований IFN , (%) 55 60 Виробіток (%) 28 24 розбавили в 105 разів і кон'югат поліетиленглікольінтерферону альфа Порівняльного прикладу 3 розбавили в 2 104 разів. Після двократного послідовного розбавлення їх додали до клітин бичачих нирок Марбін-Дарбі та контрольно заразили вірусом везикулярного стоматиту (VSV). Після цього обчислювали величини співвідношення подовженого розбавлення, які демонструють величину ТСID50 (інфікувальна доза культури клітин тканини, 50% інфікувальної дози культури клітин тканини), і кожну величину активності одержували статистичним методом. Результати, показані у наведеній нижче Таблиці 3, показують, що зниження біологічної активності шляхом модифікування поліетиленгліколю було меншим в кон'югаті три-розгалуженого поліетиленгліколь-інтерферону альфа, ніж у кон'югаті два-розгалуженого поліетиленгліколь-інтерферону альфа [див. Таблицю З (Біологічна активність кон'югату поліетиленгліколь-інтерферону альфа)]. Таблиця 3 Тип IFN Приклад 1 Порівняльний приклад 1 Порівняльний приклад 3 Експериментальний приклад 4. Фармакодинамічний тест кон'югату поліетиленглікольінтерферону альфа Фармакодинамічний тест проводили шляхом введення підшкірної ін'єкції інтерферону альфа та кон'югату поліетиленгліколь-інтерферону альфа за Прикладом 1 експериментальним тваринам (пацюкам Sprague Dawley), які мали вагу тіла 240~260г. Після введення їм ін'єкцій у кількості 1 107 IU на кожну збирали зразки крові у пацюків через 0хв., 30хв., 1год., 4год., 10год., 24год., 34год., 2 дні, 3 дні, 4 дні, 5 днів, 6 днів і 7 днів після введення ін'єкції. Антивірусну активність зразків Біологічна активність (%) 100 4,3 3,4 3,6 вимірювали за допомогою оцінювання цитопатичного ефекту (СРЕ) і таким чином одержували величини напіввиведення (Т½) інтерферону альфа та кон'югату поліетиленгліколь-інтерферону альфа (див. Фіг.12). Напіввиведення у крові кон'югату трирозгалуженого поліетиленгліколю інтерферону альфа за Прикладом 1 збільшилось у 9,2 разів порівняно з напіввиведенням інтерферону альфа [див. Таблицю 4 (Фармакодинаміка інтерферону альфа та поліетиленгліколь-інтерферону альфа у пацюків (пацюків Sprague Dawley))]. 17 90805 18 Таблиця 4 Сmaх (IU/мл) Тmaх (год.) MRT (год.) CL/F (мл/год./кг) Vss/F (мл/кг) Т1/2 (год.) AUC (IU*год./мл) *Абревіатури у наведеній вище таблиці мають такі значення: Тmaх час для досягнення максимальної концентрації Сmaх: максимальна концентрація у крові MRT: середній залишковий час у крові CL/F: повний кліренс плазми Vss/F: уявний об'єм розподілу у стійкому стані t1/2: напіввиведення елімінації AUC: зона під кривою часу концентрації. Експериментальний приклад 5. Тест протипухлинної активності кон'югату поліетиленглікольінтерферону альфа Клітини Дауді (Daudi) (ATCC CCL-213) вирощували у середовищі RAPI 1640 (Gibco, Америка) з додаванням 10%-ної фетальної бичачої сироватки та пеніциліну-стрептоміцину 0,5% при 37°С у СО2 інкубаторі впродовж 2 днів. Після завершення культуру клітини один раз промили середовищем, а потім розбавили для одержання щільності 106 клітин/мл. Інтерферон альфа та кон'югат трирозгалуженого поліетиленгліколь-інтерферону альфа за Прикладом 1 розбавили для одержання відповідно 2мг/мл і 19,2мг/мл. Кожний з цих розчинів послідовно розводили в 10 разів для одержання 10 зразків з різними концентраціями. Після цього 100мкл розріджувачів/клітина 96-лункового мікропланшету приготували для всіх лунок, за винятком лунок з контрольними клітинами, і додали 50мкл середовища для підтримання у життєздатному стані із вмістом VSV. Як контроль приготували лунки, які містили клітини та вірус, за винятком зразка. Мікропланшет інкубували у СО2 інкубаторі при 37°С впродовж 5 днів. Через 5 днів у кожну лунку додали 40мкл розчину MTS із вмістом PMS (Promega, Америка), які потім інкубували впродовж 1,5 год. Поглинання вимірювали для них при 490нм для обчислення ЕС50 (50% ефективної концентрації). Результати, наведені на Фіг.13, показують, що кон'югат поліетиленгліколь-інтерферону альфа має протипухлинну активність, подібну до інтерферону альфа (див. Фіг.13). Експериментальний приклад 6. Випробування температурної стабільності кон'югату поліетиленгліколь-інтерферону альфа Інтерферон альфа та кон'югат трирозгалуженого поліетиленгліколь інтерферону альфа за Прикладом 1 додали до 40мМ NаН2РО4 (рН 5,0) буферних розчинів для одержання відповідно 1 мг/мл концентрації розчинів. Після їх інкубування при 0°С, 20°С, 37°С, 50°С, 70°С та 100°С IFN 2413 1 5,4 893,6 4803,8 4,5 1.12Е+04 Приклад 1 47214 48 87,9 2,52 221,4 41,5 3.97Е+06 впродовж 15 хв. та охолодження до кімнатної температури вимірювали їх біологічну активність (див. Фіг.14). Результати на Фіг.14 показують, що кон'югат поліетиленгліколь-інтерферону альфа є фармацевтично більш стабільним, ніж немодифікований інтерферон альфа. Експериментальний приклад 7. Випробування стабільності кон'югату поліетиленгліколь інтерферону альфа проти триптичної гідролізації Інтерферон альфа та кон'югат трирозгалуженого поліетиленгліколь інтерферону альфа за Прикладом 1 готували у концентрації 1мг/мл з буферним розчином і відповідно додали 1мг трипсину (рН 7,0) на мілілітр розчину для індукування протеолізу при кімнатній температурі. Аліквотні частини кожного розчину зібрали через 5хв., 10хв., 20хв., 40хв. та 60хв. після початку реакції та виміряли їх біологічну активність (див. Фіг.15). Результати показують, що кон'югат поліетиленгліколь-інтерферону альфа є більш стабільним проти протеази, ніж немодифікований інтерферон альфа. Промислова придатність Цей винахід стосується біологічно активних нових кон'югатів три-розгалуженого поліетиленгліколь-інтерферону альфа, які мають структуру гліцерину. Зокрема, цей винахід характеризується наявністю високої чистоти та високого виходу, мінімізуванням зниження біоактивності та збільшенням напіввиведення у крові шляхом подолання проблем того, що лінійний поліетиленгліколь не може зв'язувати багато лінійних великих молекул з білком або пептидом; розгалужені високомолекулярні похідні індукують надлишкову стеричну невідповідність на поверхні білка або пептиду; та розгалужені високомолекулярні похідні, чиї лінкери є подовженими, мають виробіток низького очищення внаслідок низької чистоти тощо. Отже, фармацевтична композиція за цим винаходом, яка містить кон'югат поліетиленглікольінтерферону альфа, що має антивірусну активність та протипухлинну активність, має такі ефекти, що зниження активності мінімізується і терапевтична ефективність може бути покращена, а контактність пацієнта може бути поліпшена шляхом зменшення частоти введень завдяки подовженому періоду напіввиведення у тілі порівняно з терапевтичним агентом інтерферону альфа, який відомий у цій галузі. 19 90805 20 21 90805 22 23 90805 24 25 90805 26 27 Комп’ютерна верстка Л. Ціхановська 90805 Підписне 28 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPolyethylene glycol-interferon alpha conjugate
Автори англійськоюJo Yeong-Woo, Yoo Won-Young, Jeon, Hyun-Kyu, Choi, Yun-Kyu, Jang Hye-In, Kim, Byong-Moon, Lee, Sung-Hee, Kang, Soo-Hyung
Назва патенту російськоюКоньюгат полиэтиленгликоль-интерферона альфа
Автори російськоюИо Еонг-Ву, Иу Вон-Янг, Джеон Хьюн-Кюю, Чои Юн-Кюю, Янг Хик-Ин, Ким Вьонг-Мун, Ли Сунг-Хи, Канг Cy-Хьюнг
МПК / Мітки
МПК: A61P 35/00, A61K 47/48, A61K 38/21
Мітки: альфа, кон'югат, поліетиленгліколь-інтерферону
Код посилання
<a href="https://ua.patents.su/14-90805-konyugat-polietilenglikol-interferonu-alfa.html" target="_blank" rel="follow" title="База патентів України">Кон’югат поліетиленгліколь-інтерферону альфа</a>
Попередній патент: Центратор для бурильних свердловин
Наступний патент: Спосіб оцінки ефективності антиоксидантної дії тіотриазоліну у хворих на гострий інфаркт міокарда в поєднанні з хронічним гепатитом
Випадковий патент: Ділататор












