Спосіб лікування або запобігання аневризмі черевної аорти
Формула / Реферат
Спосіб лікування або запобігання аневризмі черевної аорти, згідно з яким фармацевтично та фармакологічно ефективну кількість сполуки {1S-[1α,2α,3β(1S*,2R*)-5β]}-3-(7-{[2-(3,4-дифлуорфеніл)циклопропіл]аміно}-5-(пропілтіо)-3Н-1,2,3-триазоло[4,5-d]піримідин-3-іл)-5-(2-гідроксіетокси)циклопентан-1,2-діолу застосовують до суб'єкта при потребі такого лікування або запобігання.
Текст
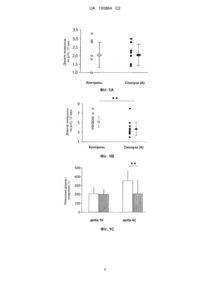
Реферат: Винахід стосується способу лікування або запобігання аневризмі черевної аорти із застосуванням {1S-[1α,2α,3β(1S*,2R*)-5β]}-3-(7-{[2-(3,4-дифлуорфеніл)циклопропіл]аміно}-5(пропілтіо)-3Н-1,2,3-триазоло[4,5-d]піримідин-3-іл)-5-(2-гідроксіетокси)циклопентан-1,2-діолу. UA 100864 C2 (12) UA 100864 C2 UA 100864 C2 5 10 15 20 25 30 35 40 45 50 55 60 Заявлений винахід стосується застосування деяких антагоністів рецепторів Р2Y 12 (також відомих як Р2Т, Р2YАDР або Р2ТАС) у лікуванні або запобіганні аневризми черевної аорти. Аневризма черевної аорти (ААА) є частою формою атеротромбозної хвороби що є дуже пов’язаною з віком та статтю (Веngtssоn Н еt аl. (1996), Аnn N Y Асаd Sсі 800:1-24). Патофізіологія ААА охоплює протеоліз зовнішньоклітинного матриксу (Місhеl JВ (2001), Аrtеrіоsсlеr Тhrоmb Vаsс Віоl 21:1389-1392), зникнення клітин гладеньких м’язів (SМС) (Місhеl JВ (2003), Аrtеrіоsсlеr Тhrоmb Vаsс Віоl 23:2146-2154), інфільтрація запальних клітин, та відсутність колонізації та зцілення клітин (Fоntаіnе V еt аl. (2004), Аm J Раthоl 164:2077-2087). Останнім часом було показано, що динамічна біологія інтрамурального тромба, охоплюючи люмінальний фібриногенез (Тоuаt Z еt аl. (2006), Аm J Раthоl 168:1022-1030) та аблюмінальний фібринолізис (Саrrеll ТW еt аl. (2006), Vаsсulаr 14:9-16; Fоntаіnе V еt аl. (2002), Аm J Раthоl 161:1701-1710), грає значну роль у прогресі ААА. У цьому контексті взаємодія між активованими тромбоцитними агрегатами та поліморфонуклеарним рекрутментом лейкоцитів (РМN) (Sаrdа-Маntеl L еt аl. (2006), Аrtеrіоsсlеr Тhrоmb Vаsс Віоl 26:2153-2159; Тоuаt еt аl., 2006) грає головну роль у відсутності клітинного зцілення (Fоntаіnе V еt аl. (2004), Аm J Раthоl 164:2077-2087). Виявлено, що аденозин 5’-дифосфат (АDР) діє, як ключовий медіатор тромбозу. АDРіндукована агрегація тромбоцитів є опосередкованою підтипом рецепторів Р2Y12 розташованих на мембрані тромбоциту. Рецептор Р2Y12 (також відомий як Р 2Т, Р2YАDР або Р2ТАС) є сполученим з G-білком рецептором, головним чином залученим в опосередковуванні активування/агрегації тромбоцит. Фармакологічні характеристики цього рецептор описані, наприклад, у посиланнях на Нumрhrіеs еt аl. (1994), Вr. J. Рhаrmасоlоgу, 113, 1057-1063, та Fаgurа еt аl. (1998), Вr. J. Рhаrmасоlоgу, 124, 157-164. Показано, що антагоністи цього рецептору пропонують значне поліпшення відносно інших анті-тромбозних агентів (дивись J. Меd. Сhеm. (1999) 42, 213). Міжнародна патентна заявка WО 99/05143 розкриває загалом серію сполук триазоло[4,5d]піримідину, що мають активність як антагоністи Р2Т (також відомого як Р2Y12, Р2YАDР або Р2ТАС). Останнім часом, описано новий клас безпосередніх антагоністів (непроліки) рецептору Р2Т, що пропонує значне поліпшення відносно інших анті-тромбозних агентів Міжнародна патентна заявка WО 00/34283 розкриває нові "безпосередні" Р2Т антагоністи рецептору, охоплюючи сполуки формули (І). Кристалічні та аморфні форми сполук триазоло[4,5d]піримідину розкрито у WО01/92262. Короткий опис фігур Фіг. 1. Запобігання розширення аневризми лікуванням сполукою (А). Вимірювання зовнішнього діаметру аневризми після індукування аневризми на добу 10 (а) та добу 42 (b). Зовнішній діаметр був подібним у контрольних (пустий прямокутник) та лікованих сполукою (А) (чорний прямокутник) щурів через 10 діб (а), але був значно нижчим у групі сполуки (А) через 42 доби лікування (b). (с) Збільшення діаметру аневризми було подібним для двох груп на добу 10, але було значно зменшеним у лікованих сполукою (А) щурів (чорний прямокутник) на добу 42. Справді, жодного збільшення діаметру аневризми не спостерігали між добами 10 та 42 для ** лікованих сполукою (А) щурів. , Р < 0,001. Фіг. 2. Інгібування розвитку інтрамурального тромба лікуванням сполукою (А). (а) фарбування пікро сиріус червоним репрезентактивних аневризм з контролю (ліворуч) та лікованих сполукою (А) щурів (праворуч) на добу 42. Діаметр аорти та площа тромба (Т) були більшими в аневризмах з контролю у порівнянні з лікованими сполукою (А) щурами. Зауважимо, що відкладення колагену (червоне фарбування) у тромбі є спостереженим тільки у групі сполуки (А). (b) Площа тромба/площу стінки збільшена між добами 10 та 42 у обох групах щурів, але була значно зменшеною лікуванням сполукою (А) (чорний прямокутник) на доби 10 та 42. (с) Внутрішньогруповий аналіз показав, що більший діаметр аневризми на добу 42 був 2 2 асоційованим з більшою площею тромба (R = 0,13 та R = 0,40 для контролю (пусті кола) та лікованих сполукою (А) щурів (чорні кола), відповідно, Р < 0,05). (d) Імунопроявлення СD41 (інтегрин αІіb, маркер тромбоцитів) у аневризмі інтрамурального тромба з контролю (ліворуч) та лікованих сполукою (А) щурів (праворуч) на добу 42. L: просвіт аорти. Вимірювання фарбування показує, що лікування протягом 42 діб сполукою (А) значно зменшувало відносний розмір СD41позитивної площі у інтрамуральному тромбі у порівнянні зі спостереженим у контрольній групі. * ** Вихідні збільшення, х200. , Р < 0,05; , Р < 0,01. Фіг. 3. Інгібування запальної інфільтрації лікуванням сполукою (А). (а) Імунопроявлення РМN у аневризмі інтрамурального тромба з контролю (ліворуч) та лікованих сполукою (А) щурів (праворуч) на добу 42. Вимірювання РМN-інфільтрації у інтрамуральному тромбі та стінці на добу 10 (середня панель) та 42 (нижча панель). Через 10 або 42 діб, РМN були здебільшого виявленими у інтрамуральному тромбі контрольних аневризм (пустий прямокутник). Лікування 1 UA 100864 C2 5 10 15 20 25 30 сполукою (А) (чорний прямокутник) інгібувало інфільтрацію РМN у тромб обидва рази. (b) Імунопроявлення макрофагів у аневризмі інтрамурального тромба з контролю (ліворуч) та лікованих сполукою (А) щурів (праворуч) на добу 42. Вимірювання інфільтрації макрофагів в інтрамуральний тромб та стінку на добу 10 (середня панель) та 42 (нижча панель). Макрофаги були виявленими у інтрамуральному тромбі також у стінці контрольних аневризм (пустий прямокутник). Через 42 доби, більше макрофагів було у стінці, ніж у тромбі. Лікування сполукою (А) (чорний прямокутник) інгібувало інфільтрацію макрофагів у тромбі обидва рази. Зменшення вмісту макрофагів у стінці через 10 або 42 діб лікування сполукою (А) не досягали * ** статистичного значення. L: просвіт аорти. Вихідні збільшення, х200. , Р < 0,05; , Р < 0,01. Фіг. 4. Зменшене експресування ММР-9 з лікуванням сполукою (А). (а) імунопроявлення ММР-9 у аневризмі інтрамурального тромба з контролю (ліворуч) та лікованих сполукою (А) щурів (праворуч) на добу 42. Вимірювання проявлення ММР-9 на добу 42 показало, що площа, зайнята проявленням ММР-9 відносно площі стінки була більшою у тромбі, ніж у стінці у контрольних аневризмах (пустий прямокутник). Лікування сполукою (А) сильно зменшувало розмір ММР-9-позитивної площі у тромбі та стінці (чорний прямокутник). L: просвіт аорти. ** *** Вихідні збільшення, х200. , Р < 0,001; , Р < 0,0001. (b) Була позитивна кореляція між розміром ММР-9-позитивної площі у тромбі та сукупної площі тромба на добу 42, коли усі щури були 2 розглянутими (контрольні, пусті кола; ліковані сполукою (А) щури, чорні кола), R = 0,79, Р < 0,0001). Фіг. 5. SМС-колонізація інтрамурального тромба та збереження еластичних ламел у стінці аневризми з лікуванням сполукою (А). (а) Проявлення орсеїном аневризм з контролю (ліворуч) та лікованих сполукою (А) щурів (праворуч) на добу 42. Стрілки свідчать про еластичні ламели. Вимірювання площі еластичних ламел показало благотворну дію сполуки (А) лікування (чорний прямокутник) на доби 10 та 42. (b) Імунопроявлення SМС у аневризмі інтрамурального тромба з контрольних (ліворуч) та лікованих сполукою (А) щурів (праворуч) на добу 42. Стрілка свідчить про SМС у тромбі. Густина SМС у інтрамуральному тромбі та стінці на добу 10 (середня панель) та 42 (нижча панель) збільшена між добами 10 та 42 у обох групах. Лікування сполукою (А) (чорний прямокутник) поліпшувало колонізацію тромба SМС через 42 доби у порівнянні з контролями (пустий прямокутник), тоді як жодної дії сполуки (А) не можна спостерігати у стінці. ** L: просвіт; М: середовища; А: проникнення. Вихідні збільшення, х100. , Р < 0,001. Заявлений винахід стосується застосування сполуки формули (І): H N N N R N N N HO OH S 35 40 45 50 R2 R1 (І) де: R - СН2ОН або О(СН2)2ОН; 1 R - С3-4 алкіл, як варіант, заміщений трьома атомами галогену; 2 R - феніл або 3,4-дифлуорфеніл; або її фармацевтично прийнятне похідне, для лікування або запобігання аневризм черевної аорти. Фармацевтично прийнятні похідні сполуки формули (І) охоплюють солі (наприклад, фармацевтично прийнятні нетоксичні органічні або неорганічні кислотно-адитивні солі, як-то хлоридної, бромідної, нітратної, сульфатної або оцтової кислот), сольвати та сольвати солей. Одним втіленням заявленого винаходу є сполука формули (І) для лікування або запобігання аневризм черевної аорти. Одним втіленням заявленого винаходу є застосування сполуки формули (І) для вироблення медикаменту для лікування або запобігання аневризм черевної аорти. Одним втіленням заявленого винаходу є спосіб лікування або запобігання аневризм черевної аорти, де фармацевтично та фармакологічно ефективну кількість сполуки формули (І) застосовують до суб’єкта при потребі такого лікування або запобігання. Наступним втіленням заявленого винаходу є спосіб лікування або запобігання аневризм черевної аорти, де сполуку формули (І) застосовують до суб’єкта при потребі такого лікування або запобігання. 1 2 В одному втіленні R - н-пропіл, 3,3,3-трифлуорпропіл або н-бутил. В одному втіленні R 2 UA 100864 C2 3,4-дифлуорфеніл. В одному втіленні сполука формули (І) є сполукою (А): F F HN N O HO 5 10 15 20 25 30 35 40 45 N N HO N N S OH (А) Сполука (А) вище має назву {1S-[1α,2α,3β(1S*,2R*),5β]}-3-(7-{[2-(3,4дифлуорфеніл)циклопропіл]аміно}-5-(пропілтіо)-3Н-1,2,3-триазоло[4,5-d]піримідин-3-іл)-5-(2гідроксіетокси)циклопентан-1,2-діол. Придатні композиції для застосування сполукою формули (І) є відомими, та охоплюють відомі з WО00/34283, WО2008/024044 та WО2008/024045. Фармацевтична композиція зазвичай містить інші різноманітні відомі у рівні техніки складові, наприклад консерванти, стабілізатори, регулятори в’язкості, емульгатори або буферувальні агенти. Таким чином фармацевтичні композиції сполуки (І) звичайно містять сукупну кількість сполуки формули (І) у межах від 0,05 до 99 мас%, як-то у межах від 0,10 до 70 мас%, або у межах від 0,10 до 50 мас% на основі маси сукупної композиції. Придатні дози сполуки формули (І) може визначити лікар залежно від суворості стану та пацієнта, а також сполуки, що застосовують. Придатні дози активної сполуки у терапії та/або профілактиці ссавців, особливо людини, охоплюють пацієнтів, що мають середню концентрацію у плазмі до 10 мкмоль/л, наприклад у межах 0,001-10 мкмоль/л протягом курсу лікування доречного стану. У будь-якому випадку лікар або спеціаліст здатні визначити фактичне дозування, що буде найбільш придатним для особи, що ймовірно варіюватиме із станом, а, також віком, масою, статтю та реакцією певної особи. Вищезгадані дози є зразковими. Можуть, безумовно, бути індивідуальні випадки, де вище або нижче дозування є кращим. Для запобігання двозначності термін “лікування” охоплює терапевтичне та/або профілактичне лікування. Біологічне оцінювання Агрегація тромбоцитів Здорові самці щурів Lеwіs (Іffа Сrеdо, Lуоn, Frаnсе) отримували одиничну пероральну дозу сполуки (А) (10 мг/кг маси тіла). Свіжу венозну кров від двох щурів збирали до та на 2, 10, та 24 години після застосування сполуки (А), та центрифугували при 250 g протягом 3 хвилин при температурі довкілля. Збагачену тромбоцитами плазму виготовляли, як раніше описано (Есklу еt аl., 2001). 450-мкл суспензії тромбоцитів перемішували при 1100 об/хвил та активували додаванням 5 мкМ АDР (Сигма, Sаіnt Quеntіn-Fаllаvіеr, Frаnсе) у кінцевому об’ємі 500 мкл. Агрегацію вимірювали при температурі довкілля турбідиметричним способом у подвійноканальному агрегометрі (Сhrоnо-Lоg, Wеst Наvеrtоwn, РА, USА). Ступінь агрегації оцінювали вимірюванням максимуму висоти кривої вище базової. Модель ААА Експериментальні аневризми аорти індукували імплантуванням сегменту деклітинізованої натрій додецилсульфатом аорти морської свинки (ксеногенний матрикс) в аорти щурів (Аllаіrе Е. еt аl. (1994), J Vаsс Surg 19:446-456). Ця модель ААА характеризується імуно-запальним пошкодженням ксеногенного зовнішньоклітинного матриксу (Аllаіrе Е еt аl. (1997), Surgеrу 122:73-81; Аllаіrе Е еt аl. (1996), Тrаnsрlаntаtіоn 62:794-803). Коротше, 46 самців щурів Lеwіs (250 г) та 46 морських свинок (280 г) (Іffа Сrеdо, Lуоn, Frаnсе) утримували як лабораторних тварин. Тварин анестезували інтраперитонеальною ін’єкцією пентобарбіталу (5 мг/100 г мас тіла). Інфраренальні аорти морської свинки (1,5 см) збирали та деклітинізували обробкою натрій додецилсульфатом для отримання трубок суцільного зовнішньоклітинного матриксу, що ортотопічно трансплантували в аорту щура Lеwіs із 10/0 найлоновими переривчастими швами (ксенотрансплантат) (Аllаіrе еt аl., 1997; Аllаіrе еt аl., 1996). Початковий діаметр трансплантату вимірювали на місці, негайно після розжимання, під бінокулярним мікроскопом. Через 24 години, щурів випадково поділяли на дві рівні групи, ліковану сполукою (А) (10 мг/кг маси тіла двічі на добу перорально) або розріджувачем сполуки (А) (1% карбоксиметилцелюлоза/0,1% 3 UA 100864 C2 5 10 15 20 25 30 35 40 45 50 55 60 Тwееn-80 у воді) протягом 10 діб (D10, n = 9 для кожної групи) або 6 тижні (D42, n = 14 для кожної групи). При вбитті, щурів глибоко анестезували, діаметр трансплантату вимірювали знов, та аорту відрізали і фіксували у 4% параформальдегіді. Зразки аорти вмуровували у парафін та нарізали по 5 мкм. Гістологічний та імуногістохімічний аналіз Секції фарбували пікро сиріус червоним для візуалізації колагену та фібрину та орсеїном для візуалізації еластину. Імуногістохімію здійснювали, застосовуючи анті-людини α-актин (розбавлення 1:500, Dаkо, Тrарреs, Frаnсе), анті-СD68 (макрофаги, розбавлення 1:1000, Sеrоtес, Сеrgу Sаіnt-Сhrіstорhе, Frаnсе), анті-щурів поліморфонуклеарні лейкоцити (розбавлення 1:3000, Сеdаrlаnе, Оntаrіо, Саnаdа), анті-СD41 (інтегрин αІІb, тромбоцити, розбавлення 1:50, Sаntа Сruz Віоtесhnоlоgіеs) та анті-ММР-9 (розбавлення 1:50, Саlбіосhеm, Dаrmstаdt, Gеrmаnу), як первинні антитіла та комплект пероксидази Vесtоr АВС для визначення(Vесtоr Lаbs, Вurlіngаmе, СА, USА). Клітини підраховували з растром в окулярі мікроскопу та усереднювали у 4 симетричних полях на тому ж слайді. Розмір площ, представлених тромбом, еластичними волокнами, стінкою ААА та ММР-9 і СD41-позитивні проявлення вимірювали морфометричним аналізом, застосовуючи програму Ніstоlаb (Місrоvіsіоn Іnstrumеnts, Еvlу, Frаnсе). Площі тромба визначали на слайдах з Sіrіus червоним. Площу, зайняту позитивним виявленням, вимірювали способом визначення забарвлення комп’ютерної програми у внутрішньому тромбі та зовнішній стінці. Статистичний аналіз Результати виражені, як середнє ± СВ. Процент збільшення діаметру розраховували, як нижченаведено: (діаметр при збиранні - діаметр при прищепленні) х 100 / діаметр при прищепленні. Порівняння між двома групами робили, застосовуючи непараметричний U-тест Манна-Уітні (Stаtvіеw, vеrsіоn 4,5). Частоту аневризм великого діаметру у відмінних групах 2 аналізували за Χ тестом. Простий регресійний аналіз було застосовувано для тестування для кореляцій між різноманітними параметрами. Р 4 мм) 2 переважав у контрольній групі, у порівнянні з лікованою сполукою (А) групою (Χ = 11,6, Р < 0,001). Утворення інтрамурального тромба Експериментальні аневризми, що розвиваються з ксенотрансплантатів з деклітинізованого зовнішньоклітинного матриксу, характеризуються наявністю інтрамурального тромба, як раніше описано (Тоuаt еt аl., 2006) (Фіг. 2а). У контрольній групі, оцінки площ тромбів/площ стінок представлені 0,22 ± 0,14 на добу 10 та збільшені до 0,78 ± 0,89 на добу 42 (Фіг. 2b). Лікування сполукою (А) значно зменшувало площу тромб/площу стінки, на доби 10 та 42 (0,07 ± 0,05 та 0,35 ± 0,44, відповідно) (Фіг. 2b). Це відносне зменшення площі тромба було асоційоване із значним зменшенням СD41-позитивної площі (інтегрин αІІb, маркер тромбоцитів) у тромбі на 42 добу (0,13 ± 0,16 та 0,68 ± 1,36 для лікованих сполукою (А) щурів та контрольних щурів, відповідно, Р = 0,005) (Фіг. 2с). Була значна кореляція між площею тромба та діаметром 2 аневризми на добу 42, коли усі щури були розглянутими (R = 0,25, Р = 0,0003). Внутрішньогруповий аналіз показав, що лікування сполукою (А) значно зменшувало нахил(с) 2 кореляції у порівнянні з контрольною групою (Сполука (А): с = 0,17, R = 0,40; контроль: с = 0,30, 2 R = 0,13) (Фіг. 2с), забезпечуючи свідоцтво того, що інгібування активування тромбоцитів сполукою (А) обмежуватиме прогрес експериментальної ААА. Запальна інфільтрація 4 UA 100864 C2 5 10 15 20 25 30 35 Розвиток аневризми є асоційованим із запальним процесом, що охоплює поліморфонуклеарні лейкоцити (РМN) та макрофаги. Обидві запальні клітини були наявні у інтрамуральному тромбі та стінці аневризми (Фіг. 3). Однак, РМN були здебільшого виявлені у інтрамуральному тромбі, де вони представляють головний запальний тип клітин. На відміну, макрофаги переважають у стінці. Тоді як густина РМN зменшена між добами 10 та 42, густина макрофагів збільшена (Фіг. 3). Лікування сполукою (А) значно інгібувало інфільтрацію РМN та макрофагів в інтрамуральний тромб на доби 10 та 42 (Фіг. 3). Не було змін інфільтрації макрофагів у стінку аневризми. Експресування ММР-9 в аневризмі та збережених еластичних волокнах у середній оболонці стінки кров’яної судини Експресування ММР-9, виявлене імунопроявленням, визначали у контрольних щурів у тромбі та у стінці аневризми (Фіг. 4а). ММР-9-позитивна площа була більшою у тромбі, ніж у стінці на добу 42. Лікування сполукою (А) помітно зменшувало ММР-9-позитивну площу у тромбі та стінці (Фіг. 4а). На додаток, була значна позитивна кореляція між площею тромба та 2 експресуванням ММР-9 у тромбі на добу 42, коли усі щури були розглянутими (R = 0,79, Р < 0,0001) (Фіг. 4b). Відображуючи зменшене експресування ММР-9, значне збереження еластичних волокон середньої оболонки стінки кров’яної судини спостерігали з лікуванням сполукою (А) в обох точках часу (Фіг. 5а). Хоча відносна площа, зайнята еластичними волокнами залишалася сталою у контрольних щурів між добою 10 та добою 42, площа еластичних волокон сильно збільшена у лікованих сполукою (А) щурів (Фіг. 5а). VSМС-колонізація інтрамурального тромба SМС-колонізований деклітинізований трансплантат та частина інтрамурального тромба розвивалися близько до стінки, як виявлено позитивним проявленням α-актином у стінці та тромбі (Фіг. 5b). Більш того, густина SМС збільшувалася від доби 10 до доби 42, у стінці та тромбі, забезпечуючи свідоцтво тенденції моделі ініціювати спонтанний процес зцілення з часом. Тоді як лікування сполукою (А) протягом 10 діб не модифікувало густину SМС у тромбі у порівнянні з контролями, лікування протягом 42 діб значно поліпшило SМС-колонізацію тромба (Фіг. 5b). Це було асоційовано з відкладенням колагену, як показано проявленням Сиріус червоним (Фіг. 2а). На відміну, лікування сполукою (А) не впливало на SМС-колонізацію стінки через 10 або 42 діб (Фіг. 5b). Висновки Запобігання утворення інтрамурального тромба ААА інгібуванням активування тромбоцитів сполукою (А) обмежувало прогресування експериментальної ААА. Блокуванням активування тромбоцитів та зменшенням утворення інтрамурального тромба, сполука (А) зменшувала рекрутмент лейкоцитів у тромбі та його наступне збагачення протеазою, призводячи до збереження цілісності стінки та ініціювання зцілення, як виявлено посиленням колонізації мезенхімними клітинами. ФОРМУЛА ВИНАХОДУ 40 45 Спосіб лікування або запобігання аневризмі черевної аорти, згідно з яким фармацевтично та фармакологічно ефективну кількість сполуки {1S-[1α,2α,3β(1S*,2R*)-5β]}-3-(7-{[2-(3,4дифлуорфеніл)циклопропіл]аміно}-5-(пропілтіо)-3Н-1,2,3-триазоло[4,5-d]піримідин-3-іл)-5-(2гідроксіетокси)циклопентан-1,2-діолу застосовують до суб'єкта при потребі такого лікування або запобігання. 5 UA 100864 C2 6 UA 100864 C2 7 UA 100864 C2 8 UA 100864 C2 9 UA 100864 C2 10 UA 100864 C2 11 UA 100864 C2 12 UA 100864 C2 Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 13
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for the for the treatment or prevention of abdominal aortic aneurysms
Автори англійськоюMichel, Jean-Baptiste
Назва патенту російськоюСпособ лечения или предотвращения аневризмы брюшной аорты
Автори російськоюМикель Жан-Баптисте
МПК / Мітки
МПК: A61P 9/10, A61K 31/519
Мітки: аорти, запобігання, черевної, спосіб, лікування, аневризми
Код посилання
<a href="https://ua.patents.su/15-100864-sposib-likuvannya-abo-zapobigannya-anevrizmi-cherevno-aorti.html" target="_blank" rel="follow" title="База патентів України">Спосіб лікування або запобігання аневризмі черевної аорти</a>
Попередній патент: Протиударна вставка для прийняття і розподілення потоку розплавленого металу та розливний пристрій
Наступний патент: Твердий дисперсний продукт лікарських засобів на основі n-арилсечовини
Випадковий патент: Спосіб приготування напівфабрикату на основі грибів і пряноароматичних овочів