Протираковий хіміотерапевтичний засіб, що містить похідну сполуки холестанолу та іринотекан
Формула / Реферат
1. Протираковий хіміотерапевтичний засіб, що містить у комбінації похідну сполуки холестанолу, представлену формулою (1):
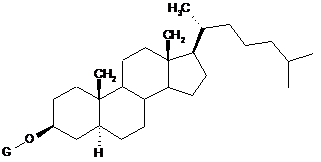 , (1)
, (1)
у якій G представляє GlcNAc-Gal-, GlcNAc-Gal-Glc-, Fuc-Gal-, Gal-Glc-, Gal- або GlcNAc-, або її циклодекстринову сполуку включення, і протираковий засіб, де протираковий засіб являє собою іринотекан.
2. Протираковий хіміотерапевтичний засіб за п. 1, у якому у формулі (1) G являє собою GlcNAc-Gal- або GlcNAc-.
3. Протираковий хіміотерапевтичний засіб за п. 1 або 2, який являє собою багатокомпонентний засіб.
4. Протираковий хіміотерапевтичний засіб за п. 1 або 2, який знаходиться у формі набору, що включає лікарський засіб, який містить у своєму складі похідну сполуки холестанолу і лікарський засіб, що містить протираковий засіб.
5. Протираковий хіміотерапевтичний засіб за п. 4, у якому лікарський засіб, що містить похідну сполуки холестанолу, являє собою ліпосомальну композицію.
6. Застосування в комбінації похідної сполуки холестанолу, представленої формулою (1):
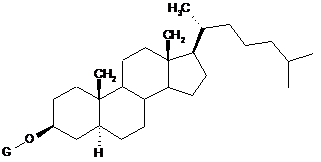 , (1)
, (1)
у якій G являє собою GlcNAc-Gal-, GlcNAc-Gal-Glc-, Fuc-Gal-, Gal-Glc-, Gal- або GlcNAc-, або її циклодекстринової сполуки включення, і протиракового засобу для одержання протиракового хіміотерапевтичного засобу, де протираковий засіб являє собою іринотекан.
7. Спосіб протиракової хіміотерапії, що характеризується тим, що він включає введення в комбінації похідної сполуки холестанолу, представленої формулою (1):
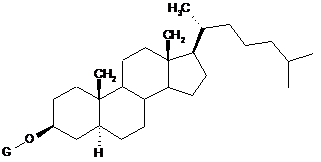 , (1)
, (1)
у якій G представляє GlcNAc-Gal-, GlcNAc-Gal-Glc-, Fuc-Gal-, Gal-Glc-, Gal- або GlcNAc-, або її циклодескстринової сполуки включення, і протиракового засобу пацієнту, який потребує цього, де протираковий засіб являє собою іринотекан.
8. Спосіб протиракової хіміотерапії за п. 7, в якому похідну сполуку холестанолу або її циклодекстринову сполуку включення і протираковий засіб вводять пацієнту, який потребує цього, одночасно або окремо із перервами.
Текст
Реферат: Винахід стосується протиракового хіміотерапевтичного засобу, що містить у комбінації похідну сполуки холестанолу, представлену формулою (1): H3C CH2 CH2 G O H , (1) UA 101884 C2 (12) UA 101884 C2 у якій G представляє GlcNAc-Gal-, GlcNAc-Gal-Glc-, Fuc-Gal-, Gal-Glc-, Gal- або GlcNAc-, або її циклодекстринову сполуку включення, і протираковий засіб, де протираковий засіб являє собою іринотекан. UA 101884 C2 5 10 15 20 25 30 35 40 45 50 Галузь техніки, до якої належить винахід Даний винахід належить до хіміотерапевтичного засобу проти раку (що згадується далі як "протираковий хіміотерапевтичний засіб"), а більш конкретно, до протиракового хіміотерапевтичного засобу, що включає в комбінації похідну сполуку холестанолу та протираковий засіб. Рівень техніки Множина протиракових засобів, що використовуються у хіміотерапії проти раку, яка являє собою один з методів лікування раку, дотепер розробляли і класифікували на основі структури, механізму дії і т. п. Однак ефективність такого протиракового засобу, застосовуваного у вигляді єдиного засобу, є незадовільною. Замість цього, в останні роки проводили мультилікарську терапію із застосуванням великої кількості протиракових засобів переважно з погляду послаблення несприятливих побічних ефектів, і ефективність мультилікарської терапії була визнана. За таких обставин необхідні як розробка нової протиракової комбінованої хіміотерапії, яка має менш несприятливий побічний ефект і вищу ефективність, ніж загальноприйняті способи хіміотерапії, так і розробка нових хіміотерапевтичних засобів для використання в хіміотерапії. Між іншим, раніше було виявлено, що похідна сполука холестанолу, у якої цукровий ланцюг, такий як GlcNAc-Gal-, GlcNAc-Gal-Glc-, Fuc-Gal-, Gal-Glc-, Gal- або GlcNAc-, зв'язаний з холестанолом (сполука, в якій насичений подвійний зв'язок у кільці B холестерину), має чудову протипухлинну активність (патентні документи з 1 по 4). Однак не повідомлялося про факти, коли згадані вище похідні сполуки холестанолу та ще один протираковий засіб застосовують у комбінації. [Патентний документ 1] JP-A-2000-191685 [Патентний документ 2] JP-A-1999-60592 [Патентний документ 3] WO 2005/007172 (публікація) [Патентний документ 4] WO 2007/026869 (публікація) Розкриття винаходу Проблеми, які повинні бути вирішені за допомогою винаходу Таким чином, даний винахід спрямований на надання протиракового хіміотерапевтичного засобу, який має менші побічні ефекти і чудову ефективність. Засоби для вирішення проблем Беручи до уваги вищевикладене, автори даного винаходу провели всебічні дослідження та виявили, що значно посилений протираковий ефект може бути досягнутий за допомогою застосування, в комбінації, похідної сполуки холестанолу, представленої формулою (1), або її циклодекстринової сполуки включення та відомого хіміотерапевтичного засобу (протиракового засобу), і, таким чином, комбіноване застосування даних фармацевтичних засобів у протираковій хіміотерапії є дуже корисним. Відповідно, даний винахід спрямований на наступні пункти з (1) по (14). (1) Протираковий хіміотерапевтичний засіб, що містить, в комбінації, похідну сполуку холестанолу, представлену формулою (1): , (у якій G являє собою GlcNAc-Gal-, GlcNAc-Gal-Glc-, Fuc-Gal-, Gal-Glc-, Gal- або GlcNAc-) або її циклодекстринову сполуку включення і протираковий засіб. (2) Протираковий хіміотерапевтичний засіб згідно з абзацом (1) вище, при цьому у формулі (1) G являє собою GlcNAc-Gal- або GlcNAc-. (3) Протираковий хіміотерапевтичний засіб згідно з абзацом (1) або (2) вище, при цьому протираковим засобом є одна або більше речовин, вибраних з групи, яка складається з таксанового протиракового засобу, протиракового засобу платинового комплексу, сполуки пеметрекседу та фторурацилу. 1 UA 101884 C2 5 10 15 20 25 30 35 40 (4) Протираковий хіміотерапевтичний засіб згідно з абзацом (3) вище, при цьому протираковим засобом є одна або більше речовин, вибраних з групи, яка складається з паклітакселу, доцетакселу, пеметрекседу, 5-FU, цисплатину, оксаліплатину, циклофосфаміду та іринотекану. (5) Протираковий хіміотерапевтичний засіб згідно з абзацом (1) або (2) вище, при цьому протираковим засобом є одна або більше речовин, вибраних з групи, яка складається з таксанового протиракового засобу, сполуки пеметрекседу та фторурацилу. (6) Протираковий хіміотерапевтичний засіб згідно з абзацом (5) вище, при цьому протираковим засобом є одна або більше речовин, вибраних з групи, яка складається з паклітакселу, доцетакселу, пеметрекседу, 5-FU, циклофосфаміду та іринотекану. (7) Протираковий хіміотерапевтичний засіб згідно з будь-яким із абзаців з (1) по (6) вище, який являє собою багатокомпонентний засіб. (8) Протираковий хіміотерапевтичний засіб згідно з будь-яким із абзаців з (1) по (6) вище, який знаходиться у формі набору, що включає лікарський засіб, який містить у своєму складі похідну сполуку холестанолу та лікарський засіб, що містить у своєму складі протираковий засіб. (9) Протираковий хіміотерапевтичний засіб згідно із абзацом (8) вище, при цьому лікарський засіб, що містить у своєму складі похідну сполуку холестанолу, являє собою ліпосомальну композицію. (10) Застосування в комбінації похідної сполуки холестанолу, представленої формулою (1): , (у якій G являє собою GlcNAc-Gal-, GlcNAc-Gal-Glc-, Fuc-Gal-, Gal-Glc-, Gal- або GlcNAc-) або її циклодекстринову сполуку включення та протираковий засіб, для отримання протиракового хіміотерапевтичного засобу. (11) Застосування згідно з абзацом (10) вище, при цьому протираковим засобом є одна або більше речовин, вибраних з групи, яка складається з таксанового протиракового засобу, сполуки пеметрекседу та фторурацилу. (12) Застосування згідно з абзацом (11) вище, при цьому протираковим засобом є одна або більше речовин, вибраних з групи, яка складається з паклітакселу, доцетакселу, пеметрекседу, 5-FU, циклофосфаміду та іринотекану. (13) Протиракова хіміотерапія, яка відрізняється тим, що вона включає введення в комбінації похідної сполуки холестанолу, представленої формулою (1): , (у якій G являє собою GlcNAc-Gal-, GlcNAc-Gal-Glc-, Fuc-Gal-, Gal-Glc-, Gal- або GlcNAc-) або її циклодекстринової сполуки включення та протиракового засобу для пацієнта, який потребує цього. (14) Протиракова хіміотерапія згідно з абзацом (13) вище, при цьому похідну сполуку холестанолу або її циклодекстринову сполуку включення і протираковий засіб вводять пацієнтові, який потребує цього, одночасно або окремо із проміжками. Результати винаходу За допомогою застосування протиракового хіміотерапевтичного засобу і протиракової хіміотерапії згідно з даним винаходом, попередження і лікування раку можна здійснювати безпечно та з більшою ефективністю. 2 UA 101884 C2 5 10 15 20 25 30 35 40 45 50 55 60 Короткий опис креслень Фіг. 1-А являє собою діаграму, що показує інгібуючу дію на клітинну проліферацію протиракового засобу (CDDP або L-OHP), GC-CD і протиракового засобу + GC-CD на клітинах colon26; Фіг. 1-В являє собою діаграму, що показує інгібуючу дію на клітинну проліферацію протиракового засобу (5-FU, PTX, DTX або CPT), GC-CD і протиракового засобу + GC-CD на клітинах colon26; Фіг. 1-С являє собою діаграму, що показує інгібуючу дію на клітинну проліферацію CPA, GCCD і CPA+GC-CD на клітинах colon26; Фіг. 2 являє собою діаграму, що показує інгібуючу дію на клітинну проліферацію CDDP, GCCD і CDDP+GC-CD на клітинах MKN45, клітинах NCIH226 або клітинах colo201; Фіг. 3 являє собою діаграму, що показує інгібуючу дію на клітинну проліферацію CDDP, GGC-CD і CDDP+GGC-CD на клітинах colon26, клітинах MKN45, клітинах NCIH226 або клітинах colo201; Фіг. 4 являє собою діаграму, що показує протипухлинну дію єдиного введення CDDP, GC-CD і CDDP+GC-CD проти перитонеальної дисемінації, викликаної клітинами colon26, інтраперитонеально інокульованим мишам; Фіг. 5 являє собою діаграму, що показує протипухлинну дію множинного уведення CDDP, GC-CD і CDDP+GC-CD проти перитонеальної дисемінації, викликаної клітинами colon26, інтраперитонеально інокульованим мишам; Фіг. 6 являє собою діаграму, яка показує протипухлинну дію єдиного, відстроченого введення CDDP, GC-CD і CDDP+GC-CD проти перитонеальної дисемінації, викликаної клітинами colon26, інтраперитонеально інокульованим мишам, після підтвердження перитонеальної дисемінації на мезотелії мишей; Фіг. 7 являє собою діаграму, яка показує коефіцієнт виживаності мишей, яким інтраперитонеально інокулювали клітини colon26, при єдиному введенні CDDP, GC-CD або CDDP+GC-CD (при єдиному введенні CDDP та подвійному введенні GC-CD, відповідно); Фіг. 8 являє собою діаграму, яка показує результат послаблення або зменшення росту пухлини, у яку клітини colon26 підшкірно інокулювали мишам, при єдиному введенні CDDP, GGC-CD або CDDP+GGC-CD; а Фіг. 9 являє собою діаграму, яка показує результат пригнічення метастазу клітин colon26 у легені, при єдиному введенні CDDP, GC-CD, GGC-CD, CDDP+GC-CD і CDDP+GGC-CD. Докладний опис переважних варіантів здійснення Усі специфічні похідні сполуки холестанолу, які представлені формулою (1) і використовуються в даному винаході, є відомими сполуками. Серед похідних сполук холестанолу, які представлені формулою (1) і в яких G являє собою GlcNAc-Gal-, G переважно являє собою GlcNAc1,3-Gal- або GlcNAc1,4-Gal-. Серед похідних сполук (1) холестанолу, у яких G являє собою GlcNAc-Gal-Glc-, G переважно являє собою GlcNAc1,3-Gal1,4-Glc-. Серед похідних сполук (1) холестанолу, у яких G являє собою Fuc-Gal, G переважно являє собою Fucα1,3Gal-. Серед похідних сполук (1) холестанолу, у яких G являє собою Gal-Glc-, G переважно являє собою Gal1,4Glc-. Серед похідних сполук (1) холестанолу, у яких G являє собою Gal-, G переважно являє собою Gal-. Серед похідних сполук (1) холестанолу, у яких G являє собою GlcNAc-, G переважно являє собою GlcNAc-. З них речовини, у яких G являє собою GlcNAc-Gal- і GlcNAc-, є більш прийнятними, при цьому речовини, у яких G являє собою GlcNAc1,4-Gal- і GlcNAc- є ще більш прийнятними. Згадані вище похідні сполуки холестанолу можуть бути отримані за допомогою способу, наприклад, розкритого у згаданих вище патентних документах 1-4, або аналогічного способу. Похідна сполука холестанолу, представлена формулою (1), легко утворює комплекс включення з циклодекстрином або його похідними сполуками. Таким чином, похідна сполука холестанолу, що використовується в даному винаході, може являти собою її циклодекстринову сполуку включення. При утворенні подібних сполук включення необхідно брати до уваги розмір гостьової молекули, що підлягає включенню, ван-дер-ваальсову взаємодію між гостьовою молекулою і циклодекстрином та водневий зв'язок між гідроксильними групами циклодекстрину і гостьовою молекулою. Внаслідок цього нерозчинні гостьові сполуки не завжди утворюють відповідні сполуки включення. Однак похідна сполука холестанолу даного винаходу може утворювати прийнятні комплекси включення із циклодекстрином. Приклади циклодекстрину, що утворює циклодекстринову сполуку включення даного винаходу, включають такі циклодекстрини, як -циклодекстрин, -циклодекстрин і циклодекстрин; та циклодекстринові похідні сполуки, такі як метил--циклодекстрин, 2гідроксипропіл--циклодекстрин, моноацетил--циклодекстрин і 2-гідроксипропіл- 3 UA 101884 C2 5 10 15 20 25 30 35 40 45 50 55 60 циклодекстрин. З них для одержання поліпшеної розчинності прийнятним є 2-гідроксипропіл-циклодекстрин. Циклодекстринова сполука включення може бути отримана, наприклад, за допомогою наступної методики: одержують водний розчин циклодекстрину або його похідну сполуку, що має відповідну концентрацію (наприклад, від 20 до 40 %), і до водного розчину додають похідну сполуку холестанолу даного винаходу, з наступним струшуванням отриманої у результаті суміші. На концентрацію розчину похідної сполуки холестанолу (1) не накладають ніякого особливого обмеження, за умови, що похідна сполука холестанолу може утворювати сполуку включення із циклодекстрином. У більшості випадків, концентрація становить від приблизно 1 до приблизно 50 мас. %, переважно від приблизно 10 до приблизно 30 мас. %. Отримана в такий спосіб циклодекстринова сполука включення є сильно водорозчинною, і, внаслідок цього, ефективно демонструє дію гостьової молекули in vivo. Ще одна перевага циклодекстриновї сполуки включення полягає у забезпеченні несуперечливих результатів випробувань in vitro. Як альтернатива, похідна сполука холестанолу (1) може бути отримана у вигляді ліпосомальної композиції, за допомогою чого похідна сполука холестанолу може бути більш ефективно доставлена до ділянки експресії дії. Ще одна перевага циклодекстриновї сполуки включення полягає у забезпеченні несуперечливих результатів випробувань in vitro. Переважно, ліпосомальна композиція включає похідну сполуку холестанолу даного винаходу, мембранний компонент і аліфатичний або ароматичний амін. Вміст похідної сполуки холестанолу у ліпосомальній композиції становить переважно від 0,3 до 2,0 моль, більш переважно 0,8 до 1,5 моль відносно 1 моль мембранного компонента. Мембранним компонентом може бути фосфоліпід. Конкретні приклади переважно використовуваних фосфоліпідів включають натуральні і синтетичні фосфоліпіди, такі як фосфатидилхолін, фосфатидилетаноламін, фосфатидилсерин, фосфатидилінозитол і фосфатидна кислота; їх суміші; і модифіковані натуральні фосфоліпіди, такі як водний лецитин. Приклади найбільш прийнятних речовин включають фосфатидилхолін (1дипалмітоїлфосфатидилхолін (DPPC)). Аліфатичний або ароматичний амін використовують головним чином для позитивного зарядження поверхні ліпідної мембрани. Приклади подібних амінів включають аліфатичні аміни, такі як стеариламін і олеїламін; і ароматичні аміни, такі як флуоренілетиламін. Серед них стеариламін використовують особливо переважно. Переважно амін міститься у кількості, що дорівнює від 0,04 до 0,15 моль, більш прийнятно від 0,1 до 0,15 моль, відносно 1 моль мембранного компонента (фосфоліпіду). На додаток до згаданих вище компонентів, за необхідності ліпосома може додатково містити у своєму складі стабілізатор мембранних структур, такий як холестерин, жирна кислота, діацетилфосфат і т. п. Водним розчином, що використовується для диспергування мембранного компонента, переважно є вода, фізіологічний розчин, буфер, водний розчин цукру або їх суміш. Може бути використаний або органічний, або неорганічний буфер за умови, що буфер має буферну дію в умовах концентрації іонів водню людського організму. Приклади подібних буферів включають фосфатний буфер. Ніяке особливе обмеження не накладається на спосіб одержання ліпосомальної композиції, і можуть бути вибрані широко використовувані способи. Приклади способу, який може бути використаний, включають способи, розкриті у JP-A-1982-82310, JP-A-1985-12127, JP-A-198558915, JP-A-1989-117824, JP-A-1989-167218, JP-A-1992-29925 і JP-A-1997-87168; спосіб, розкритий у способах біохімічного аналізу (1988) 33, p.337; або спосіб, розкритий у "Liposome" (опублікованій Nankodo). Ніяке особливе обмеження не накладається на протираковий засіб, який використовують у комбінації з похідною сполукою холестанолу, представленою формулою (1) або її циклодекстриновою сполукою включення, і можуть бути використані відомі протиракові хіміотерапевтичні засоби. Переважно використовують стандартні терапевтичні засоби, які були прийняті відповідно до таргентної терапії раку. Конкретні приклади включають алкілуючі агенти, такі як циклофосфамід, іфосфамід, мелфалан (L-PAM), бусульфан і карбохінон; антагоністи метаболізму, такі як 6-меркаптопурин (6-MP), метотрексат (MTX), 5-фторурацил (5-FU), тегафур, еноцитабін (BHAC) і сполуки пеметрекседу (пеметрексед, MTA) і т. п.); карциностатичні антибіотики, такі як актиноміцин D, даунорубіцин, блеоміцин, пепломіцин, мітоміцин C, акларубіцин і неокарциностатин (NCS); рослинні алкалоїди, такі як вінкристин, віндезин, вінбластин, таксанові протиракові засоби 4 UA 101884 C2 5 10 15 20 25 30 35 40 45 50 55 60 (таксотер (доцетаксел) і таксол (паклітаксел, TXL) і т. п.) та іринотекан (CPT-11); і платинові сполуки, такі як цисплатин (CDDP), карбоплатин і оксаліплатин (L-OHP). Дані протиракові засоби можуть бути використані окремо або в комбінації двох або більше речовин. Як показано у прикладах, описаних далі, коли похідна сполука холестанолу, представлена формулою (1), або її циклодекстринову сполуку включення використовують у комбінації із протираковим засобом, проліферація ракових клітин різних типів сильно пригнічується у порівнянні з випадком введення тільки одного засобу. Внаслідок цього дана комбінована хіміотерапія може радикально підсилювати терапевтичну ефективність і зменшення несприятливих побічних ефектів, а фармацевтичний продукт, що містить у своєму складі дані інгредієнти, являє собою корисний протираковий хіміотерапевтичний засіб. Ніяке особливе обмеження не накладається на рак, який можна ефективно лікувати за допомогою введення протиракового хіміотерапевтичного засобу відповідно до даного винаходу. Приклади раку-мішені включають злоякісні пухлини, такі як рак шлунку, рак товстої кишки, рак підшлункової залози, рак матки, рак яєчників, рак легенів, рак жовчного міхура, рак стравоходу, рак печінки, рак молочної залози, мезотеліома і рак простати. Формою протиракового хіміотерапевтичного засобу даного винаходу може бути багатокомпонентний засіб, в якому згадані вище інгредієнти перемішують у відповідному співвідношенні, кожний в ефективній кількості, для утворення лікарської форми однократного застосування (тип єдиної готової форми), або може бути набір, який складається з відповідної лікарської форми згаданих вище інгредієнтів, кожний з яких утворений незалежно, причому кожний включає ефективну кількість, і який надає можливість введення лікарських форм одночасно або окремо із проміжками (тип подвійної готової форми). Аналогічно загальним фармацевтичним готовим формам, ніяке особливе обмеження не накладається на лікарську форму описаної вище готової форми, і форма може бути будь-якою із твердої форми, такою як таблетка, рідкої форми, такою як ін'єкційний розчин, сухий порошок, що розчиняється перед застосуванням, і т. п. Ніякі особливі обмеження не накладаються на спосіб введення готової форми, і відповідний спосіб може бути визначений залежно від лікарської форми засобів. Наприклад, ін'єкційний розчин може бути введений внутрішньовенно, внутрішньом'язово, підшкірно, черезшкірно або інтраперитонеально, а тверда форма може бути введена перорально або ентерально. Готова форма може бути отримана за допомогою способу, відомого у даній галузі. Також можуть бути використані всі фармацевтично прийнятні носії (ексципієнти або розріджувачі, такі як наповнювач, об'ємоутворювальний агент і зв'язувальна речовина), використовувані в більшості випадків у даній галузі. Наприклад, пероральна тверда форма може бути отримана за допомогою перемішування інгредієнтів лікарського засобу даного винаходу з ексципієнтом і з необов'язковою зв'язувальною речовиною, розпушувачем, мастильною речовиною, барвником, ароматичним засобом, віддушкою і т. п. і формування суміші у таблетки, таблетки з покриттям, гранули, порошок, капсули і т. п. за допомогою способу, відомого у даній галузі. Даними добавками можуть бути добавки, використовувані в більшості випадків у даній галузі. Приклади ексципієнту включають лактозу, сукрозу, натрію хлорид, глюкозу, крохмаль, кальцію карбонат, каолін, мікрокристалічну целюлозу і кремнієву кислоту. Приклади зв'язувальної речовини включають воду, етанол, пропанол, простий сироп, рідку глюкозу, рідкий крохмаль, рідкий желатин, карбоксиметилцелюлозу, гідроксипропілцелюлозу, гідроксипропілкрохмаль, метилцелюлозу, етилцелюлозу, шелак, кальцію фосфат і полівінілпіролідон. Приклади розпушувача включають сухий крохмаль, натрію альгінат, агаровий порошок, натрію гідрокарбонат, кальцію карбонат, натрію лаурилсульфат, моногліцерилстеарат і лактозу. Приклади мастильних речовин включають очищений тальк, стеаратні солі, боракс і поліетиленгліколь. Приклади ароматичного засобу включають сахарозу, апельсинову цедру, лимонну кислоту і винну кислоту. Пероральна рідка готова форма може бути отримана за допомогою перемішування інгредієнтів лікарського засобу даного винаходу з ароматичним засобом, буфером, стабілізатором, віддушкою і т. п. і формування суміші у внутрішній рідкий засіб, сироп, еліксир і т. п. за допомогою способу, відомого у даній галузі. Ароматичним засобом, використовуваним при одержанні, може бути будь-який зі згаданих вище елементів. Приклади буфера включають натрію цитрат. Приклади стабілізатора включають трагант, гуміарабік і желатин. Ін'єкційні розчини можуть бути отримані за допомогою перемішування інгредієнтів лікарського засобу даного винаходу з добавками, такими як регулятор pH, буфер, стабілізатор, засіб, що регулює тонічність, і місцевий анестетичний засіб і т. п. і формування суміші за допомогою способу, відомого в даній галузі, для надання за рахунок цього підшкірної, внутрішньом'язової і внутрішньовенної ін'єкційних рідин. Приклади регулятора pH, і буфера 5 UA 101884 C2 5 10 15 20 25 30 35 40 45 50 55 60 включають натрію цитрат, ЕДТК, тіогліколеву кислоту і тіомолочну кислоту. Приклади місцевого анестетичного засобу включають прокаїну гідрохлорид і лідокаїну гідрохлорид. Приклади засобу, що регулює тонічність, включають натрію хлорид і глюкозу. Супозиторії можуть бути отримані за допомогою перемішування інгредієнтів лікарського засобу даного винаходу з носієм для готової форми, відомим у даній галузі, таким як поліетиленгліколь, ланолін, масло какао і тригліцерид жирної кислоти і з необов'язковою поверхнево-активною речовиною, такою як Tween (зареєстрована торгова марка), і формування суміші в супозиторії за допомогою способу, відомого у даній галузі. Мазі можуть бути отримані за допомогою перемішування інгредієнтів лікарського засобу даного винаходу з необов'язковими добавками, використовуваними в більшості випадків у даній галузі, такими як основа, стабілізатор, зволожувальний компонент та консервант, і формування суміші в мазі за допомогою способу, відомого у даній галузі. Приклади основи включають рідкий парафін, медичний вазелін, прояснений бджолиний віск, октилдодециловий спирт і парафін. Приклади консерванту включають метил-p-гідроксибензоат, етил-p-гідроксибензоат і пропіл-pгідроксибензоат. Катаплазми можуть бути отримані за допомогою нанесення згаданих вище мазей, крему, гелю, пасти і т. п. на використовувану в більшості випадків підкладку за допомогою звичайного способу. Приклади відповідних підкладок включають тканий і нетканий матеріал, виготовлений з бавовни, штапельного волокна або штучного волокна, та плівку і пінопласт, виготовлений з м'якого вінілхлориду, поліетилену, поліуретану і т. п. У більшості випадків, готову форму переважно одержують для того, щоб мати вміст похідної сполуки холестанолу і вміст протиракового засобу, що дорівнює від 0,0001 до 80 мас. % (у вигляді ефективного інгредієнта). Коли протираковий хіміотерапевтичний засіб відповідно до даного винаходу наданий у вигляді набору, набір може бути виконаний з можливістю незалежного пакування відповідної лікарської форми, що включає окремо похідну сполуку холестанолу, представлену формулою (1), або її циклодекстринову сполуку включення і протираковий засіб, кожен з яких було отримано наведеним вище способом, і використання кожної фармацевтичної готової форми, узятої окремо з належної відповідної упаковки перед застосуванням. Як альтернатива, кожна фармацевтична готова форма може зберігатися в упаковці, яка застосовується щоразу при комбінованому введенні. Доза протиракового хіміотерапевтичного засобу даного винаходу варіює залежно від маси тіла, віку, статі, симптомів пацієнта, який потребує цього, способу і частоти введення пацієнту, який цього потребує і т. п. У більшості випадків, наприклад, щоденна доза для дорослого становить приблизно від 0,1 до 30 мг/кг у вигляді похідної сполуки холестанолу (1), переважно від 3 до 10 мг/кг. Доза протиракового засобу може бути в межах діапазону, встановленого щодо засобу, або може бути нижча за цей діапазон. Ніякі особливі обмеження не накладаються на частоту введення, і засіб може бути введений один раз або декілька разів на день. Переважним є єдине введення на день. При використанні набору, кожна готова форма, що включає окремі інгредієнти лікарського засобу, може бути введена одночасно або з перервами. Далі, даний винахід буде описаний більш докладно за допомогою прикладів, які не повинні трактуватися як обмеження винаходу. Приклад Приклад 1 Дія додавання лікарського засобу на пригнічення проліферації ракових клітин. Клітини colon26 (отримані з раку товстої кишки миші) інокулювали на 96-ямковий планшет 4 (110 клітин/50 мкл, 10 %FCS-RPMI середовище/ямка) і інкубували за 37C протягом 16 годин. У кожну ямку додавали добре відомий протираковий засіб (цисплатин (скорочено "CDDP"), оксаліплатин (скорочено "L-OHP"), фторурацил (5-FU), паклітаксел (TXL; скорочено "PTX"), доцетаксел (TXT; скорочено "DTX"), іринотекан (CPT-11; скорочено "CPT") або циклофосфамід (скорочено "CPA")) і/або циклодекстринову сполуку включення (скорочено "GC-CD") похідної сполуки холестанолу, у яких G у формулі (1) означає GlcNAc- (скорочено "GC"), (багаторазове розведення FCS(-)-середовище: підсумкова концентрація: ≤500 мкм, 50 мкл), з наступним інкубуванням за 37C протягом двох днів. GC-CD одержували відповідно до способу, розкритого у прикладі 1(2) патентного документа 4. Конкретно, одержували 40 % водний розчин гідроксипропіл--циклодекстрину, і до розчину додавали GC з подальшим перемішуванням зі струшуванням (80C протягом 30 хвилин) для одержання за рахунок цього GC-CD. Як контроль використовували ямки, у які було додане тільки FCS(-)-середовище. Визначення кількості життєздатних клітин виконували за допомогою набору для підрахунку клітин (продукт Dojin). 6 UA 101884 C2 Швидкість (%) пригнічення клітинної проліферації (CPI) розраховували за допомогою наступного рівняння. Фіг.1 (фіг.1-A, 1-B і 1-C) показує результати. 5 10 15 20 25 30 35 40 45 50 55 Приклад 2 Дія пригнічення проліферації різних ракових клітин Повторювали процедуру прикладу 1 за винятком того, що клітини colon26 замінили на MKN45 (отримані з раку шлунково-кишкового тракту людини), NCIH226 (отримані з раку легенів людини) і Colo201 (отриманих з раку товстої кишки людини). Швидкість CPI (%) визначали аналогічним способом. Фіг. 2 показує результати. У прикладі 2 також використовували циклодекстринову сполуку включення (скорочено "GGC-CD") похідної сполуки холестанолу, у якій G у формулі (1) позначає GlcNAc1,4-Gal(скорочено "GGC"). GGC-CD одержували способом, аналогічним згаданому вище способу одержання GC-CD, за винятком того, що сполуку холестанолу замінили на GGC. Визначали швидкість CPI по відношенню до ракових клітин. Фіг. 3 показує результати. Приклад 3 Дія додавання лікарського засобу на пригнічення проліферації ракових клітин in vivo. У наступних прикладах як досліджуваних тварин використовували мишей Balb/c (вік 6 тижнів, самиці). 4 (1) Клітини colon26 (110 клітин/миша) інтраперитонеально інокулювали мишам (0 день). Наступного дня після інокуляції (1 день) CDDP і/або GC-CD регулювали фізіологічним розчином (ізотонічний розчин Otsuka) до концентрації, що цікавить, і мишам інтраперитонеально вводили CDDP, GC-CD або CDDP+GC-CD (500 мкл) з наступним вирощуванням. На 19 день мишей розтинали і вимірювали масу брижі та великого сальника. Контрольній групі (n=10; 10 мишей/групі) вводили тільки фізіологічний розчин (500 мкл). Фіг. 4 показує результати. 4 (2) Клітини colon26 (110 клітин/миша) інтраперитонеально інокулювали мишам (0 день). На 1 день, 2 день, 3 день, 6 день, 7 день і 8 день CDDP і/або GC-CD регулювали фізіологічним розчином (ізотонічний розчин Otsuka) до концентрації, що цікавить, і мишам інтраперитонеально вводили CDDP, GC-CD або CDDP+GC-CD (500 мкл) з наступним вирощуванням. На 21 день мишей розтинали і вимірювали масу брижі та великого сальника. Контрольній групі (n=10; 10 мишей/групі) вводили тільки фізіологічний розчин (500 мкл). Фіг. 5 показує результати. 4 (3) Клітини colon26 (110 клітин/миша) інтраперитонеально інокулювали мишам (0 день). На 7 день, CDDP та/або GC-CD регулювали фізіологічним розчином (ізотонічний розчин Otsuka) до концентрації, що цікавить, і мишам інтраперитонеально вводили CDDP, GC-CD або CDDP+GC-CD (500 мкл) з наступним вирощуванням. На 18 день мишей розтинали і вимірювали масу брижі та великого сальника. Контрольній групі (n=10; 10 мишей/групі) вводили тільки фізіологічний розчин (500 мкл). Фіг. 6 показує результати. Приклад 4 Протипухлинна дія за допомогою додавання лікарського засобу. Як випробуваних тварин використовували мишей Balb/c (вік 6 тижнів, самки). Клітини 4 colon26 (110 клітин/миша) інтраперитонеально інокулювали мишам (0 день). На 2 день і/або 3 день CDDP та/або GC-CD регулювали фізіологічним розчином (ізотонічний розчин Otsuka) до концентрації, що цікавить, і мишам інтраперитонеально вводили CDDP, GC-CD або CDDP+GCCD (500 мкл) (див. фіг. 7 для графіка введення) з наступним вирощуванням. Тривалість виживання (дні) підраховували до 43 дня. Контрольній групі (n=10; 10 миші/група) вводили тільки фізіологічний розчин (500 мкл). Фіг. 7 показує результати. Приклад 5 Протипухлинна дія за допомогою додавання лікарського засобу. Як випробуваних тварин використовували мишей Balb/c (вік 6 тижнів, самки). Клітини 4 colon26 (510 клітин/миша) підшкірно інокулювали мишам (0 день). Після підтвердження, що розмір пухлини досяг приблизно 4 мм (7-10 день після інокуляції), CDDP і/або GGC-CD регулювали фізіологічним розчином (ізотонічний розчин Otsuka) до концентрації, що цікавить, і мишам через хвостову вену вводили CDDP, GGC-CD або CDDP+GGC-CD (200 мкл) з наступним 7 UA 101884 C2 5 10 вирощуванням. Відслідковували залежну від часу зміну розміру пухлини до 21 дня і визначали відповідний об'єм пухлини. Контрольній групі (n=7; 7 миші/група) вводили тільки фізіологічний розчин (200 мкл). Фіг. 8 показує результати. Приклад 6 Дія пригнічення ракового метастазування за рахунок додавання лікарського засобу. Як досліджуваних тварин використовували мишей Balb/c (вік 6 тижнів, самки). Клітини 4 colon26 (510 клітин/миша) інтраперитонеально інокулювали мишам (0 день). Безпосередньо після інокуляції CDDP і/або GC-CD або GGC-CD регулювали фізіологічним розчином (ізотонічний розчин Otsuka) до концентрації, що цікавить, і мишам через хвостову вену вводили CDDP, GC-CD (або GGC-CD), чи CDDP+GC-CD (або GGC-CD) (200 мкл) з наступним вирощуванням. На 14 день мишей розрізали і підраховували пухлинні вузлики в легенях. Контрольній групі (n=10; 10 миші/група) речовину не вводили. Фіг. 9 показує результати. 15 Як описано вище у даній заявці, за допомогою застосування в комбінації похідної сполуки холестанолу даного винаходу або її циклодекстринової сполуки включення і протиракового засобу, проліферація різних ракових клітин сильно пригнічується, і може бути отриманий синергічний ефект і/або ефект посилення протипухлинної дії відомого протиракового засобу. 20 ФОРМУЛА ВИНАХОДУ 1. Протираковий хіміотерапевтичний засіб, що містить у комбінації похідну сполуки холестанолу, представлену формулою (1): H3C CH2 CH2 G 25 30 35 O H , (1) у якій G представляє GlcNAc-Gal-, GlcNAc-Gal-Glc-, Fuc-Gal-, Gal-Glc-, Gal- або GlcNAc-, або її циклодекстринову сполуку включення, і протираковий засіб, де протираковий засіб являє собою іринотекан. 2. Протираковий хіміотерапевтичний засіб за п. 1, у якому у формулі (1) G являє собою GlcNAcGal- або GlcNAc-. 3. Протираковий хіміотерапевтичний засіб за п. 1 або 2, який являє собою багатокомпонентний засіб. 4. Протираковий хіміотерапевтичний засіб за п. 1 або 2, який знаходиться у формі набору, що включає лікарський засіб, який містить у своєму складі похідну сполуки холестанолу і лікарський засіб, що містить протираковий засіб. 5. Протираковий хіміотерапевтичний засіб за п. 4, у якому лікарський засіб, що містить похідну сполуки холестанолу, являє собою ліпосомальну композицію. 6. Застосування в комбінації похідної сполуки холестанолу, представленої формулою (1): H3C CH2 CH2 G 40 O H , (1) у якій G являє собою GlcNAc-Gal-, GlcNAc-Gal-Glc-, Fuc-Gal-, Gal-Glc-, Gal- або GlcNAc-, або її циклодекстринової сполуки включення, і протиракового засобу для одержання протиракового хіміотерапевтичного засобу, де протираковий засіб являє собою іринотекан. 8 UA 101884 C2 7. Спосіб протиракової хіміотерапії, що характеризується тим, що він включає введення в комбінації похідної сполуки холестанолу, представленої формулою (1): H3C CH2 CH2 G 5 O H , (1) у якій G представляє GlcNAc-Gal-, GlcNAc-Gal-Glc-, Fuc-Gal-, Gal-Glc-, Gal- або GlcNAc-, або її циклодескстринової сполуки включення, і протиракового засобу пацієнту, який потребує цього, де протираковий засіб являє собою іринотекан. 8. Спосіб протиракової хіміотерапії за п. 7, в якому похідну сполуку холестанолу або її циклодекстринову сполуку включення і протираковий засіб вводять пацієнту, який потребує цього, одночасно або окремо із перервами. 9 UA 101884 C2 10 UA 101884 C2 11 UA 101884 C2 12 UA 101884 C2 Комп’ютерна верстка І. Мироненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 13
ДивитисяДодаткова інформація
Назва патенту англійськоюCancer chemotherapeutic agent comprising cholestanol derivative and irinotecan
Автори англійськоюYazawa, Shin, Nishimura, Toyo, Asao, Takayuki
Назва патенту російськоюПротивораковое химиотерапевтическое средство, которое содержит производную соединения холестанола и иринотекан
Автори російськоюЯзава Син, Нисимура Тойо, Асао Такаюки
МПК / Мітки
МПК: A61K 31/7072, A61K 31/4745, A61K 31/282, A61P 35/00, A61K 31/704, A61K 31/337
Мітки: засіб, протираковій, холестанолу, хіміотерапевтичний, іринотекан, містить, сполуки, похідну
Код посилання
<a href="https://ua.patents.su/15-101884-protirakovijj-khimioterapevtichnijj-zasib-shho-mistit-pokhidnu-spoluki-kholestanolu-ta-irinotekan.html" target="_blank" rel="follow" title="База патентів України">Протираковий хіміотерапевтичний засіб, що містить похідну сполуки холестанолу та іринотекан</a>
Попередній патент: Спосіб функціонування пристрою активації і радіомаяка при пошуку постраждалих під завалами
Наступний патент: Електрична машина з постійними магнітами
Випадковий патент: Вологопроникний волокнистий нетканий матеріал












