Фармацевтична композиція у вигляді разової пероральної дози, що містить леводопу, карбідопу і ентакапон або їх солі
Номер патенту: 102111
Опубліковано: 10.06.2013
Автори: Машалкар Манодж, Джаін Гіріш Кумар, Гупта Ятендра Кумар, Талвар Муніш
Формула / Реферат
1. Фармацевтична композиція у вигляді разової пероральної дози, що містить а) леводопу, або її солі, в кількості від приблизно 50 мг до приблизно 300 мг разом з одним або більше полімерами, що регулюють швидкість, в формі пролонгованого вивільнення, b) карбідопу, або її солі, в кількості від приблизно 10 мг до приблизно 100 мг разом з одним або більше полімерами, що регулюють швидкість, в формі пролонгованого вивільнення, і с) ентакапон, або його солі, в кількості від приблизно 100 мг до приблизно 1000 мг разом з одним або більше фармацевтично прийнятними ексципієнтами в формі негайного вивільнення, де фармацевтична композиція необов'язково містить інші фармацевтично прийнятні ексципієнти.
2. Спосіб лікування хвороби Паркінсона у ссавця, що включає в себе введення потребуючому цього ссавцеві разової пероральної дозованої фармацевтичної композиції, що містить а) леводопу, або її солі, в кількості від приблизно 50 мг до приблизно 300 мг разом з одним або більше полімерами, що регулюють швидкість, в формі пролонгованого вивільнення, b) карбідопу, або її солі, в кількості від приблизно 10 мг до приблизно 100 мг разом з одним або більше полімерами, що регулюють швидкість, в формі пролонгованого вивільнення, і с) ентакапон, або його солі, в кількості від приблизно 100 мг до приблизно 1000 мг разом з одним або більше фармацевтично прийнятними ексципієнтами в формі негайного вивільнення, причому фармацевтична композиція необов'язково містить інші фармацевтично прийнятні ексципієнти.
3. Спосіб зменшення явища «виснаження» дози у пацієнтів з хворобою Паркінсона, що включає в себе введення потребуючому цього пацієнту разової пероральної дозованої фармацевтичної композиції, що містить а) леводопу, або її солі, в кількості від приблизно 50 мг до приблизно 300 мг разом з одним або більше полімерами, що регулюють швидкість, в формі пролонгованого вивільнення, b) карбідопу, або її солі, в кількості від приблизно 10 мг до приблизно 100 мг разом з одним або більше полімерами, що регулюють швидкість, в формі пролонгованого вивільнення, і с) ентакапон, або його солі, в кількості від приблизно 100 мг до приблизно 1000 мг разом з одним або більше фармацевтично прийнятними ексципієнтами в формі негайного вивільнення, причому фармацевтична композиція необов'язково містить інші фармацевтично прийнятні ексципієнти.
4. Спосіб отримання разової пероральної дозованої фармацевтичної композиції, що містить а) леводопу, або її солі, в кількості від приблизно 50 мг до приблизно 300 мг разом з одним або більше полімерами, що регулюють швидкість, в формі пролонгованого вивільнення, b) карбідопу, або її солі, в кількості від приблизно 10 мг до приблизно 100 мг разом з одним або більше полімерами, що регулюють швидкість, в формі пролонгованого вивільнення, і с) ентакапон, або його солі, в кількості від приблизно 100 мг до приблизно 1000 мг разом з одним або більше фармацевтично прийнятними ексципієнтами в формі негайного вивільнення, де вказаний спосіб включає в себе: а) нанесення покриття, або змішування леводопи, карбідопи з фармацевтично прийнятними, регулюючими швидкість полімерами, b) ентакапон з одним або більше фармацевтично прийнятними ексципієнтами, с) перемішування суміші зі стадії а) і b) і переведення її у прийнятну дозовану форму.
5. Композиція за п. 1, де дана композиція включає в себе одне або більше з числа таблетки, двошарової таблетки, тришарової таблетки, капсули, порошку, пластинки, таблетки у вигляді капсули, гранул, кульок, гранул в капсулі, міні-таблеток, міні-таблеток в капсулі, кульок в капсулі і саше.
6. Композиція за п. 1, в якій фармацевтично прийнятні, регулюючі швидкість полімери включають в себе один або більше з числа полівінілацетату, ацетату целюлози, ацетату-бутирату целюлози, ацетату-пропіонату целюлози, етилцелюлози, жирної кислоти, ефіру жирної кислоти, алкілового спирту, воску, шелаку, смоли, зеїну (проламіну кукурудзи), повідону, колідону SR, полі(мет)акрилату, мікрокристалічної целюлози або полі(етиленоксиду), солей поліуронової кислоти, простих ефірів целюлози, ксантанової камеді, трагакантової камеді, карайї, гуарової камеді, аравійської камеді, геланової камеді, камеді ріжкового дерева, солей лужних металів альгінової кислоти або пектинової кислоти, альгінату натрію, альгінату калію, альгінату амонію, гідроксипропілцелюлози, гідроксіетилцелюлози, гідроксипропілметилцелюлози, карбоксивінілових полімерів, полімеризованого желатину, шелаку, співполімерів метакрилової кислоти типу С NF, бутирату-фталату целюлози, гідрофталату целюлози, пропіонату-фталату целюлози, фталату полівінілацетату (PVAP), ацетату-фталату целюлози (CAP), ацетату-тримелітату целюлози (CAT), фталату гідроксипропілметилцелюлози, ацетату гідроксипропілметилцелюлози, сукцинату діоксипропілметилцелюлози, карбоксиметилетилцелюлози (СМЕС), ацетату-сукцинату гідроксипропілметилцелюлози (HMPCAS) і полімерів і співполімерів акрилової кислоти типу метилакрилату, етилакрилату, метилметакрилату і/або етилметакрилату зі співполімерами ефірів акрилової і метакрилової кислоти (Eudragit NE, Eudragit RL, Eudragit RS).
7. Фармацевтична композиція за п. 1, в якій одна таблетка вказаної композиції не виявляє суттєвої відмінності в швидкості і/або мірі абсорбції ентакапону в порівнянні з 2-4 таблетками 200 мг ентакапону негайного вивільнення, комерційно доступного у вигляді Comtan®, і відсутня суттєва відмінність в швидкості і/або мірі абсорбції леводопи і карбідопи в порівнянні з однією таблеткою Sinemet®, що вводиться з інтервалом 3-4 години.
8. Спосіб лікування за п. 2, де одна таблетка вказаної композиції не виявляє суттєвої відмінності в швидкості і/або мірі абсорбції ентакапону в порівнянні з 2-4 таблетками 200 мг ентакапону негайного вивільнення, комерційно доступного у вигляді Comtan®, і відсутня суттєва відмінність в швидкості і/або мірі абсорбції леводопи і карбідопи в порівнянні з однією таблеткою Sinemet®, що вводиться з інтервалом 3-4 години.
9. Спосіб зменшення явища «виснаження» дози за п. 3, де одна таблетка вказаної композиції не виявляє суттєвої відмінності в швидкості і/або мірі абсорбції ентакапону в порівнянні з 2-4 таблетками 200 мг ентакапону негайного вивільнення, комерційно доступного у вигляді Comtan®, і відсутня суттєва відмінність в швидкості і/або мірі абсорбції леводопи і карбідопи в порівнянні з однією таблеткою Sinemet®, що вводиться з інтервалом 3-4 години.
Текст
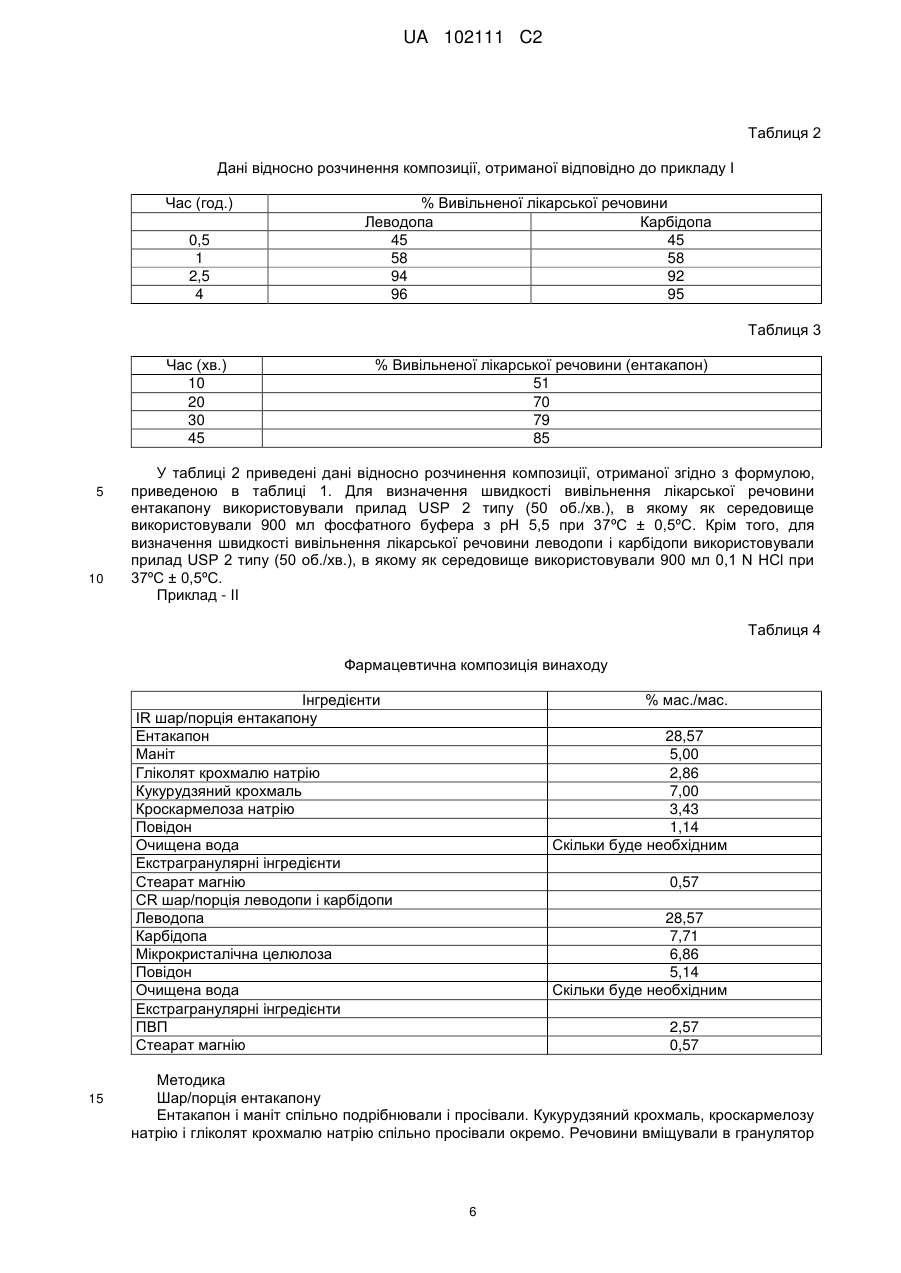
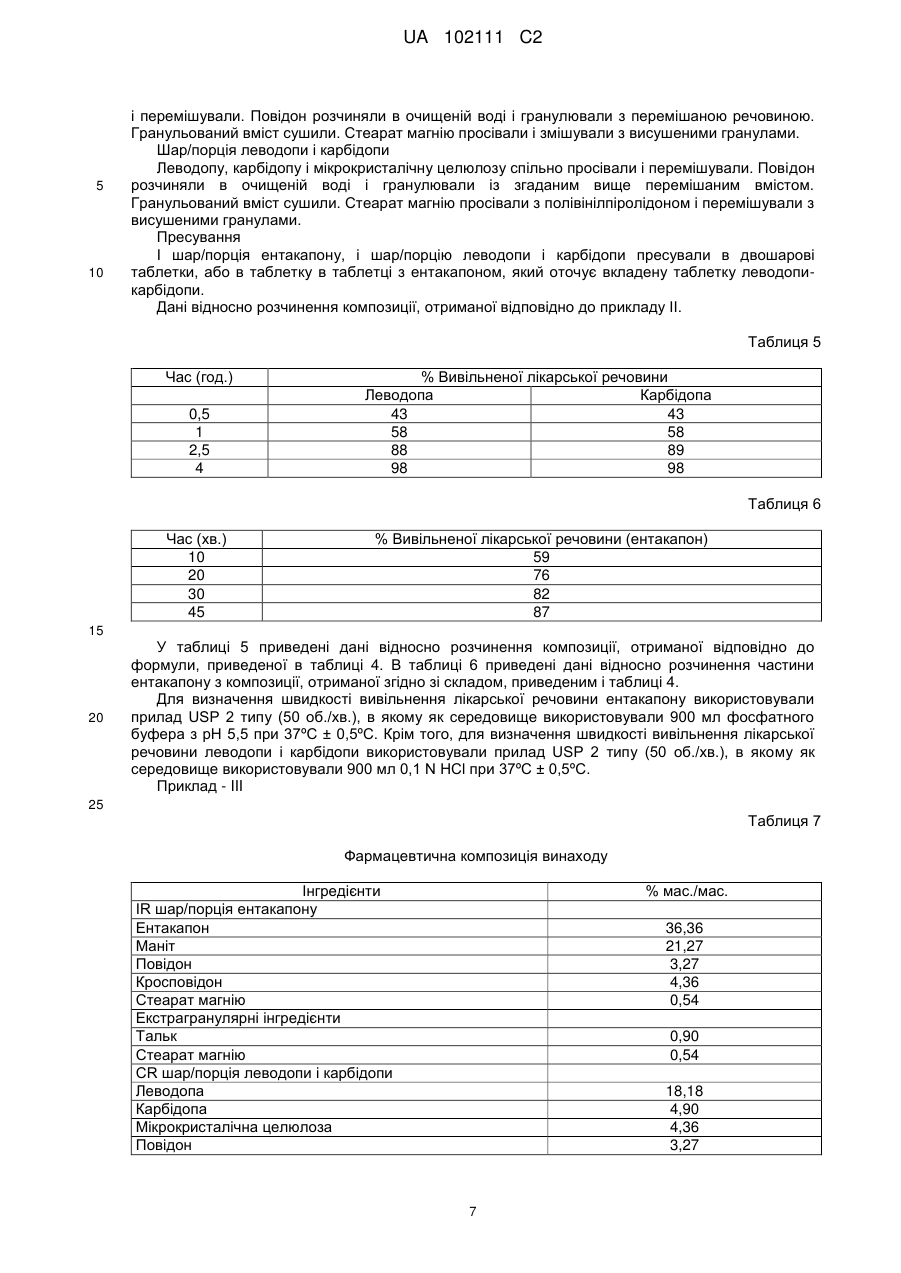
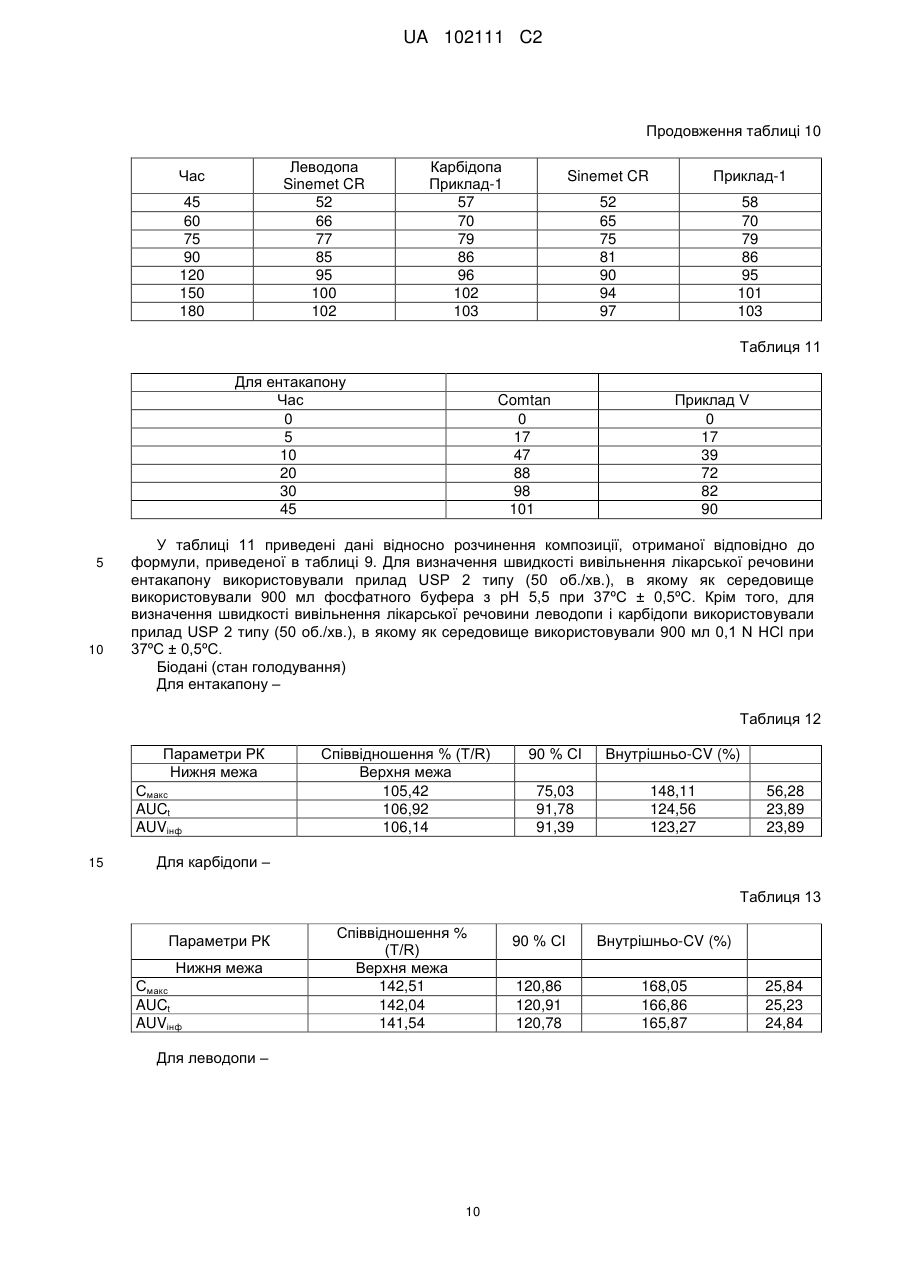
Реферат: Винахід стосується фармацевтична композиції у вигляді разової пероральної дози, що містить а) леводопу, або її солі, в кількості від приблизно 50 мг до приблизно 300 мг разом з одним або більше полімерами, що регулюють швидкість, в формі пролонгованого вивільнення, b) карбідопу, або її солі, в кількості від приблизно 10 мг до приблизно 100 мг разом з одним або більше полімерами, що регулюють швидкість, в формі пролонгованого вивільнення, і с) ентакапон, або його солі, в кількості від приблизно 100 мг до приблизно 1000 мг разом з одним або більше фармацевтично прийнятними ексципієнтами в формі негайного вивільнення, де фармацевтична композиція необов'язково містить інші фармацевтично прийнятні ексципієнти. UA 102111 C2 (12) UA 102111 C2 UA 102111 C2 5 10 15 20 25 30 35 40 Галузь техніки, до якої належить винахід Надана фармацевтична композиція у вигляді разової пероральної дози, що містить а) леводопу, або її солі, в кількості від приблизно 50 мг до приблизно 300 мг в формі пролонгованого вивільнення, b) карбідопу, або її солі, в кількості від приблизно 10 мг до приблизно 100 мг в формі пролонгованого вивільнення, і с) ентакапон, або його солі, в кількості від приблизно 100 мг до приблизно 1000 мг в формі тривалого вивільнення, необов'язково з іншими фармацевтично прийнятними ексципієнтами. Винахід також належить до способу отримання подібних композицій. Рівень техніки Ентакапон, інгібітор катехин-О-метилтрансферази (СОМТ), використовується при лікуванні хвороби Паркінсона як допоміжний засіб до терапевтичного лікування леводопою/карбідопою. Хімічна назва ентакапону - (Е)-2-ціано-3-(3,4-дигідрокси-5-нітрофеніл)-N, N-діетил-2-пропенамід. Його емпірична формула C14H15N3O5, а структурна формула: Карбідопа, інгібітор декарбоксилування ароматичних амінокислот, являє собою кристалічну сполуку білого кольору, малорозчинну у воді. Її хімічна назва - (-)-L-(-гідразино-(-метил--(3,4дигідроксибензол)пропіонова кислота. Її емпірична формула C10H14N2O4, а її структурна формула: Леводопа, ароматична амінокислота, являє собою кристалічну сполуку білого кольору, малорозчинну у воді. Її хімічна назва (-)-L--аміно--(3,4-дигідроксибензол)пропіонова кислота. Її емпірична формула С9Н11NO4, а її структурна формула: У патенті США №№ 6500867 і 6797732 описані пероральні тверді таблетовані композиції, що містять ентакапон, леводопу і карбідопу, або їх фармацевтично прийнятні солі, або гідрати, і фармацевтично прийнятний ексципієнт. У патенті США 7094427 і патенті США 20040166159 описана композиція, яка містить компонент негайного вивільнення і пролонгованого вивільнення. У патенті США 20080051459 описаний спосіб лікування хвороби Паркінсона, що включає в себе введення фармацевтично ефективної кількості композиції, що містить леводопу. У патенті США 20070275060 описана таблетка пролонгованого вивільнення, що включає в себе композицію пролонгованого вивільнення, яка містить леводопу, і композицію негайного або швидкого вивільнення, яка містить карбідопу. У WO07/073702 описана багатошарова таблетка, що забезпечує три різних профілі вивільнення. У патенті США 20060173074 описаний спосіб лікування синдрому неспокійних ніг у ссавця. Ентакапон доступний у вигляді композиції негайного вивільнення під торговою маркою Comtan®. Концентрація у продажу становить 200 мг. Потрійне поєднання леводопи, карбідопи і ентакапону доступне у вигляді композиції негайного вивільнення різної концентрації. Наприклад, Stalevo® 50 (яка містить 12,5 мг карбідопи, 50 мг леводопи і 200 мг ентакапону), Stalevo® 75 (яка містить 18,75 мг карбідопи, 75 мг леводопи і 200 мг ентакапону), Stalevo® 100 (яка містить 25 мг карбідопи, 100 мг леводопи і 1 UA 102111 C2 5 10 15 20 25 30 35 40 45 50 55 60 200 мг ентакапону), Stalevo® 125 (яка містить 31,2575 мг карбідопи, 125 мг леводопи і 200 мг ентакапону), Stalevo® 150 (яка містить 37,5 мг карбідопи, 150 мг леводопи і 200 мг ентакапону) і Stalevo® 200 (яка містить 50 мг карбідопи, 200 мг леводопи і 200 мг ентакапону). Хвороба Паркінсона являє собою повільно прогресуюче захворювання, симптоми якого посилюються з часом. Тому симптоми будуть змінюватися і розвиватися. Характер симптомів може варіюватися для кожної людини. Однак після ряду років деякі люди можуть побачити зміни в тому, як їх лікарський засіб контролює їх симптоми. Ці зміни загальновідомі як рухові флуктуації. Згодом симптоми починають повертатися перед тим, як час приймати наступну дозу ліків леводопи. Дану зміну в симптомах називають "зношуванням". Як тільки "виснаження" стає помітним, проміжок часу для хорошого відгуку на леводопу (відомий як час "увімкнення") зменшується, а час слабкого відгуку на леводопу (відомого як час "вимкнення") може збільшитися. На ранніх стадіях захворювання мозок здатний запасати достатню кількість допаміну. Це дозволяє більш рівномірно вивільняти допамін в мозку. Крім того, це забезпечує більш постійне контролювання симптомів. Однак, по мірі того, як хвороба Паркінсона посилюється, в мозку стає менше клітин, які можуть поглинати леводопу і запасати її у вигляді допаміну для вивільнення при низьких концентраціях. Внаслідок цієї зниженої здатності запасати допамін в мозку, симптоми можуть повертатися після більш коротких періодів часу (наприклад, "виснаження"). Якщо комусь зі зниженою здатністю запасати допамін дають дуже багато леводопи, це може призвести до побічних ефектів (наприклад, дискінезії). Є можливість краще контролювати дані симптоми за рахунок зміни або регулювання лікування. Як тільки виникають дані рухові флуктуації, можуть з'явитися інші небажані побічні ефекти. Вони включають в себе мимовільні рухи, відомі як дискінезія (наприклад, рухи скручування/повороту), або дистонія (наприклад, тривалий м'язовий спазм). У пацієнтів, які отримують лікування від хвороби Паркінсона, часто можуть розвиватися рухові флуктуації, що характеризуються недостатністю кінця лікування, дискінезією і акінезією при піковій дозі, при терапевтичному лікуванні леводопою (виснаження), при якому пацієнти страждають на непередбачувані коливання від рухливості до нерухомості. Більше ніж у 50 % пацієнтів з хворобою Паркінсона після терапевтичного лікування леводопою розвиваються рухові флуктуації у відповідь (явище "виснаження"). Симптоми виснаження включають в себе брадикінезію, дистонію, тремтіння, знижену спритність рук, парестезію, м'язовий біль, ослаблення голосу. Передбачається, що ефект "виснаження" можна звести до мінімуму у пацієнтів за допомогою режиму лікування, який забезпечує властивості менш швидкого розчинення і приведе до більш рівномірного профілю леводопи в плазмі крові. При введенні в поєднанні з леводопою, ентакапон підвищує біодоступність леводопи, сприяючи її проходженню через гематоенцефалічний бар'єр. Тому ентакапон прийнятий як допоміжний засіб при лікуванні леводопою хвороби Паркінсона. Однак дозу доступного в цей час препарату леводопи і ентакапону, тобто Stalevo®, дають вісім разів на день. Часте дозування даних препаратів пов'язане з більш флуктуючими концентраціями ентакапону в плазмі. Крім того, даний режим не сприяє прихильності пацієнта лікуванню. Крім того, спостерігалося, що пацієнту надто незручно одночасно приймати таблетку Sinemet CR і Comtan декілька разів на день, що приводить до непідданості пацієнта лікуванню, особливо у разі пацієнта з хворобою Паркінсона. Крім того, в літературі також передбачають, що якщо три даних інгредієнти - ентакапон, карбідопа і леводопа - знаходяться разом, це приводить до зниження біодоступності ентакапону і леводопи. Тому в комерційно доступному препараті Stalevo значна частина карбідопи міститься окремо від леводопи і карбідопи. Крім того, в літературі також повідомляється про дестабілізацію препарату з потрійною комбінацією в присутності мікрокристалічної целюлози. Отже, є необхідність в сприяючій прихильності пацієнта лікуванню композиції ентакапону і/або потрійної комбінації, що включає в себе леводопу, карбідопу і ентакапон, яка буде розчинятися повільно і забезпечить більш рівномірний профіль в плазмі крові у пацієнтів з режимом лікування ентакапоном, або леводопою/ентакапоном/карбідопою. Суть винаходу У одному з аспектів даного винаходу надана разова пероральна дозована фармацевтична композиція, яка містить а) леводопу, або її солі, в кількості від приблизно 50 мг до приблизно 300 мг в формі пролонгованого вивільнення, b) карбідопу, або її солі, в кількості від приблизно 10 мг до приблизно 100 мг в формі пролонгованого вивільнення, і с) ентакапон, або його солі, в кількості від приблизно 100 мг до приблизно 1000 мг в формі негайного вивільнення, необов'язково з іншими фармацевтично прийнятними ексципієнтами. 2 UA 102111 C2 5 10 15 20 25 30 35 40 45 50 55 У наступному загальному аспекті даного винаходу наданий спосіб лікування хвороби Паркінсона у ссавця, що включає в себе введення потребуючому цього ссавцеві разової пероральної дозованої фармацевтичної композиції, що містить а) леводопу, або її солі, в кількості від приблизно 50 мг до приблизно 300 мг в формі пролонгованого вивільнення, b) карбідопу, або її солі, в кількості від приблизно 10 мг до приблизно 100 мг в формі пролонгованого вивільнення, і с) ентакапон, або його солі, в кількості від приблизно 100 мг до приблизно 1000 мг в формі негайного вивільнення, необов'язково з іншими фармацевтично прийнятними ексципієнтами. У наступному загальному аспекті даного винаходу наданий спосіб зменшення явища "виснаження" у пацієнтів з хворобою Паркінсона, що включає в себе введення потребуючому цього пацієнту разової пероральної дозованої фармацевтичної композиції, що містить а) леводопу, або її солі, в кількості від приблизно 50 мг до приблизно 300 мг в формі пролонгованого вивільнення, b) карбідопу, або її солі, в кількості від приблизно 10 мг до приблизно 100 мг в формі пролонгованого вивільнення, і с) ентакапон, або його солі, в кількості від приблизно 100 мг до приблизно 1000 мг в формі негайного вивільнення, необов'язково з іншими фармацевтично прийнятними ексципієнтами. У наступному загальному аспекті даного винаходу наданий спосіб отримання разової пероральної дозованої фармацевтичної композиції, що містить а) леводопу, або її солі, в кількості від приблизно 50 мг до приблизно 300 мг в формі пролонгованого вивільнення, b) карбідопу, або її солі, в кількості від приблизно 10 мг до приблизно 100 мг в формі пролонгованого вивільнення, і с) ентакапон, або його солі, в кількості від приблизно 100 мг до приблизно 1000 мг в формі негайного вивільнення, де вказаний спосіб включає в себе: а) нанесення покриття, або змішування леводопи, карбідопи з фармацевтично прийнятними, регулюючими швидкість полімерами, b) ентакапон з одним або більше фармацевтично прийнятними ексципієнтами, с) перемішування суміші зі стадії а) і b) і переведення її у прийнятну дозовану форму. Варіанти здійснення даної фармацевтичної композиції можуть включати в себе одну або більше наступних ознак. Наприклад, фармацевтично прийнятні ексципієнти можуть включати в себе один або більше з числа наповнювачів, зв'язувальних речовин, змащувальних речовин, підсолоджувальних агентів, забарвлюючих і смакових агентів, глідантів, дезінтегруючих речовин і так далі. Подробиці одного або більше варіантів здійснення даного винаходу представлені в приведеному нижче описі. Інші ознаки, об'єкти і переваги винаходу будуть ясні з опису і формули винаходу. Докладний опис винаходу Працюючи над композиціями леводопи, ентакапону і карбідопи, автори винаходу помітили, що складання з леводопи або карбідопи препарату в формі пролонгованого вивільнення дає можливість безперервно вивільняти леводопу або карбідопу протягом тривалого періоду часу. Таким чином, композиція пролонгованого вивільнення підтримує тривале вивільнення леводопи і карбідопи, приводячи, таким чином, до нефлуктуючих постійних концентрацій леводопи і карбідопи в плазмі крові. Крім того, це приводить до зменшення явища "виснаження", яке спостерігається у пацієнтів з хворобою Паркінсона в результаті нефлуктуючих концентрацій в плазмі. Крім того, автори винаходу несподівано виявили, що Sinemet CR і Comtan можна об'єднати у вигляді фіксованої комбінації разової пероральної дози, не впливаючи на біодоступність будьякого з активних компонентів в присутності іншого. Навіть мікрокристалічну целюлозу можна також використати в даній комбінації фіксованої дози без надання якого-небудь дестабілізуючого впливу на композицію фіксованої дози. Крім того, дана комбінація фіксованої дози приводить до збільшення прихильності пацієнта лікуванню. Використаний в даному описі термін "пролонговане вивільнення" належить до певного вивільнення лікарського засобу протягом певного періоду часу, який може продовжуватися від 4 год. до 24 год. або більше. Пролонгованого вивільнення в фармацевтичній композиції можна досягти за рахунок одного або більше покриттів, або впровадження в матрицю з використанням гідрофільних або гідрофобних полімерів, або за рахунок сполучення з іонообмінними смолами. Крім того, пролонгованого вивільнення можна досягти також за допомогою технології осмотичного перорального вивільнення. Одна таблетка вказаної композиції не виявляє суттєвої відмінності в швидкості і/або мірі абсорбції ентакапону в порівнянні з 2-4 таблетками 200 мг ентакапону негайного вивільнення, 3 UA 102111 C2 5 10 15 20 25 30 35 40 45 50 55 комерційно доступного у вигляді Comtan®, і леводопи і карбідопи в порівнянні з однією таблеткою Sineret®CR, що вводиться з інтервалом 3-4 години. "Біоеквівалентність" встановлюють по 90 % довірчому інтервалу (CI) в межах від 0,80 до 1,25 як для Смакс, так і для AUC згідно з регулюючими нормативами Управління по санітарному нагляду за якістю харчових продуктів і медикаментів США (USFDA), або по 90 % CI для AUC в межах від 0,80 до 1,25 і 90 % CI для Смакс в межах від 0,70 до 1,43 згідно з регулюючими нормативами європейського ЕМЕА. Використовуваний тут термін "довірчий інтервал" належить до звичайного значення, відомого фахівцю в даній галузі. Довірчий інтервал належить до статистичного інтервалу з певною імовірністю того, що заданий параметр потрапить в даний інтервал. Використовуваний тут термін "коваріація" належить до звичайного значення, відомого фахівцю в даній галузі. Вона являє собою статистичну міру варіації двох випадкових змінних, які спостерігають, або вимірюють в один і той же середній період часу. Ця міра дорівнює продукту відхилень прийнятних значень двох даних змінних від їх прийнятних середніх значень. Фармацевтична композиція пролонгованого вивільнення може включати в себе одне або більше з числа таблетки, двошарової таблетки, тришарової таблетки, таблетки в таблетці, капсули, порошку, пластинки, таблетки у вигляді капсули, гранул, кульок, гранул в капсулі, мінітаблеток, мінітаблеток в капсулі, кульок в капсулі, саше і так далі. Леводопа, карбідопа або ентакапон можуть знаходитися в формі порошку, гранул, пілюль, кульок, мікротаблеток, мінітаблеток і кристалів. Кількість ентакапону в даних фармацевтичних композиціях змінюється від приблизно 100 до приблизно 1000 мг. Кількість леводопи в даних фармацевтичних композиціях змінюється від приблизно 50 до приблизно 300 мг. Кількість карбідопи в даних фармацевтичних композиціях змінюється від приблизно 10 до приблизно 100 мг. Прийнятні регулюючі швидкість гідрофільні або гідрофобні полімери включають в себе один або більше з числа полівінілацетату, ацетату целюлози, ацетату-бутирату целюлози, ацетатупропіонату целюлози, етилцелюлози, жирної кислоти, ефіру жирної кислоти, алкілового спирту, воску, шелаку, смоли, зеїну (проламіну кукурудзи), повідону, колідону SR, полі(мет)акрилату, мікрокристалічної целюлози або полі(етиленоксиду), солей поліуронової кислоти, простого ефіру целюлози, ксантанової камеді, трагакантової камеді, карайї, гуарової камеді, аравійської камеді, геланової камеді, камеді ріжкового дерева, солей лужних металів альгінової кислоти, або пектинової кислоти, альгінату натрію, альгінату калію, альгінату амонію, гідроксипропілцелюлози, гідроксіетилцелюлози, гідроксипропілметилцелюлози, карбоксивінілових полімерів, полімеризованого желатину, шелаку, співполімерів метакрилової кислоти типу С NF, бутирату-фталату целюлози, гідрофталату целюлози, пропіонату-фталату целюлози, фталату полівінілацетату (PVAP), ацетату-фталату целюлози (САР), ацетатутримелітату целюлози (САТ), фталату гідроксипропілметилцелюлози, ацетату гідроксипропілметилцелюлози, сукцинату діоксипропілметилцелюлози, карбоксиметилетилцелюлози (СМЕС), ацетату-сукцинату гідроксипропілметилцелюлози (HMPCAS) і полімерів і співполімерів акрилової кислоти типу метилакрилату, етилакрилату, метилметакрилату і/або етилметакрилату зі співполімерами ефіру акрилової і метакрилової кислоти (Eudragit NE, Eudragit RL, Eudragit RS) і так далі. Полімер можна використовувати в кількості від 0,1-50 % від маси композиції. Фармацевтична композиція пролонгованого вивільнення може включати в себе один або більше фармацевтично прийнятних ексципієнтів. Фармацевтично прийнятні ексципієнти можуть включати в себе розріджувачі, зв'язувальні речовини, дезінтегруючі речовини, поверхневоактивні речовини, змащувальні речовини, гліданти і так далі. Прийнятна зв'язувальна речовина може являти собою одне або більше з числа повідону, крохмалю, стеаринової кислоти, камедей, гідроксипропілметилцелюлози і так далі. Зв'язувальну речовину можна використовувати в кількості від 0,1 % до 40 % від маси композиції. Прийнятний розріджувач може являти собою одне або більше з числа мікрокристалічної целюлози, маніту, фосфату кальцію, сульфату кальцію, каоліну, сухого крохмалю, цукрової пудри і так далі. Розріджувач можна використовувати в кількості від 1 до 50 % від маси композиції. Прийнятний дезінтегруючий агент може являти собою одне або більше з числа крохмалю, кроскармелози натрію, кросповідону, гліколяту крохмалю натрію і так далі. Дезінтегруючий агент можна використовувати в кількості від 2-20 % від маси композиції. Прийнятна змащувальна речовина може являти собою одне або більше з числа стеарату магнію, стеарату цинку, стеарату кальцію, стеаринової кислоти, стеарилфумарату натрію, 4 UA 102111 C2 5 10 15 гідрованої рослинної олії, гліцерилбегенату і так далі. Змащувальну речовину можна використовувати в кількості від 0,1-5 % від маси композиції. Прийнятний глідант може являти собою один або більше з числа колоїдного оксиду кремнію, тальку, кукурудзяного крохмалю і так далі. Глідант можна використовувати в кількості від 0,15 % від маси композиції. Дану фармацевтичну композицію можна отримати, змішуючи ентакапон з фармацевтично прийнятними ексципієнтами для отримання суміші ентакапону. Леводопу і карбідопу можна змішати з одним або більше фармацевтично прийнятними полімерами і ексципієнтами для отримання суміші леводопи-карбідопи. Суміш ентакапону і суміш леводопи-карбідопи можна змішати з фармацевтично прийнятними ексципієнтами і перевести у прийнятну дозовану форму. Далі винахід ілюстрований наступними прикладами, які надані тільки для ілюстрації винаходу і не обмежують рамок винаходу. Деякі модифікації і еквіваленти будуть очевидні фахівцям в даній галузі, і мається на увазі, що вони входять в рамки даного винаходу. Приклади: Композиція порцій приведена в таблицях з 1 по 23. Наступні склади є представницькими для переважних композицій винаходу. Отримання прикладу детально описане далі. Приклад – I Таблиця 1 Фармацевтична композиція винаходу Інгредієнти IR шар/порція ентакапону Ентакапон Маніт Гліколят крохмалю натрію Кукурудзяний крохмаль Кроскармелоза натрію Повідон Очищена вода Екстрагранулярні інгредієнти Стеарат магнію СR шар/порція леводопи і карбідопи Леводопа Карбідопа Мікрокристалічна целюлоза Повідон Очищена вода Екстрагранулярні інгредієнти Полівінілпіролідон Стеарат магнію % мас./мас. 38,41 6,73 3,85 9,42 4,62 1,51 Скільки буде необхідним 0,77 19,22 5,19 4,62 3,46 Скільки буде необхідним 1,73 0,38 20 25 30 35 Методика Шар/порція ентакапону Ентакапон і маніт спільно подрібнювали і просівали. Кукурудзяний крохмаль, кроскармелозу натрію і гліколят крохмалю натрію спільно просівали окремо. Речовини вміщували в гранулятор і перемішували. Повідон розчиняли в очищеній воді і гранулювали з перемішаною речовиною. Гранульований вміст сушили. Стеарат магнію просівали і змішували з висушеними гранулами. Шар/порція леводопи і карбідопи Леводопу, карбідопу і мікрокристалічну целюлозу спільно просівали і перемішували. Повідон розчиняли в очищеній воді і гранулювали із згаданим вище перемішаним вмістом. Гранульований вміст сушили. Стеарат магнію просівали з полівінілпіролідоном і перемішували з висушеними гранулами. Пресування І шар/порцію ентакапону, і шар/порцію леводопи і карбідопи пресували в двошарові таблетки, або в таблетку в таблетці з ентакапоном, який оточує вкладену таблетку леводопикарбідопи. 5 UA 102111 C2 Таблиця 2 Дані відносно розчинення композиції, отриманої відповідно до прикладу I Час (год.) 0,5 1 2,5 4 % Вивільненої лікарської речовини Леводопа Карбідопа 45 45 58 58 94 92 96 95 Таблиця 3 Час (хв.) 10 20 30 45 5 10 % Вивільненої лікарської речовини (ентакапон) 51 70 79 85 У таблиці 2 приведені дані відносно розчинення композиції, отриманої згідно з формулою, приведеною в таблиці 1. Для визначення швидкості вивільнення лікарської речовини ентакапону використовували прилад USP 2 типу (50 об./хв.), в якому як середовище використовували 900 мл фосфатного буфера з рН 5,5 при 37ºC ± 0,5ºC. Крім того, для визначення швидкості вивільнення лікарської речовини леводопи і карбідопи використовували прилад USP 2 типу (50 об./хв.), в якому як середовище використовували 900 мл 0,1 N HCl при 37ºC ± 0,5ºC. Приклад - ІІ Таблиця 4 Фармацевтична композиція винаходу Інгредієнти IR шар/порція ентакапону Ентакапон Маніт Гліколят крохмалю натрію Кукурудзяний крохмаль Кроскармелоза натрію Повідон Очищена вода Екстрагранулярні інгредієнти Стеарат магнію СR шар/порція леводопи і карбідопи Леводопа Карбідопа Мікрокристалічна целюлоза Повідон Очищена вода Екстрагранулярні інгредієнти ПВП Стеарат магнію 15 % мас./мас. 28,57 5,00 2,86 7,00 3,43 1,14 Скільки буде необхідним 0,57 28,57 7,71 6,86 5,14 Скільки буде необхідним 2,57 0,57 Методика Шар/порція ентакапону Ентакапон і маніт спільно подрібнювали і просівали. Кукурудзяний крохмаль, кроскармелозу натрію і гліколят крохмалю натрію спільно просівали окремо. Речовини вміщували в гранулятор 6 UA 102111 C2 5 10 і перемішували. Повідон розчиняли в очищеній воді і гранулювали з перемішаною речовиною. Гранульований вміст сушили. Стеарат магнію просівали і змішували з висушеними гранулами. Шар/порція леводопи і карбідопи Леводопу, карбідопу і мікрокристалічну целюлозу спільно просівали і перемішували. Повідон розчиняли в очищеній воді і гранулювали із згаданим вище перемішаним вмістом. Гранульований вміст сушили. Стеарат магнію просівали з полівінілпіролідоном і перемішували з висушеними гранулами. Пресування І шар/порція ентакапону, і шар/порцію леводопи і карбідопи пресували в двошарові таблетки, або в таблетку в таблетці з ентакапоном, який оточує вкладену таблетку леводопикарбідопи. Дані відносно розчинення композиції, отриманої відповідно до прикладу II. Таблиця 5 Час (год.) 0,5 1 2,5 4 % Вивільненої лікарської речовини Леводопа Карбідопа 43 43 58 58 88 89 98 98 Таблиця 6 Час (хв.) 10 20 30 45 % Вивільненої лікарської речовини (ентакапон) 59 76 82 87 15 20 У таблиці 5 приведені дані відносно розчинення композиції, отриманої відповідно до формули, приведеної в таблиці 4. В таблиці 6 приведені дані відносно розчинення частини ентакапону з композиції, отриманої згідно зі складом, приведеним і таблиці 4. Для визначення швидкості вивільнення лікарської речовини ентакапону використовували прилад USP 2 типу (50 об./хв.), в якому як середовище використовували 900 мл фосфатного буфера з рН 5,5 при 37ºC ± 0,5ºC. Крім того, для визначення швидкості вивільнення лікарської речовини леводопи і карбідопи використовували прилад USP 2 типу (50 об./хв.), в якому як середовище використовували 900 мл 0,1 N HCl при 37ºC ± 0,5ºC. Приклад - III 25 Таблиця 7 Фармацевтична композиція винаходу Інгредієнти IR шар/порція ентакапону Ентакапон Маніт Повідон Кросповідон Стеарат магнію Екстрагранулярні інгредієнти Тальк Стеарат магнію СR шар/порція леводопи і карбідопи Леводопа Карбідопа Мікрокристалічна целюлоза Повідон % мас./мас. 36,36 21,27 3,27 4,36 0,54 0,90 0,54 18,18 4,90 4,36 3,27 7 UA 102111 C2 Продовження таблиці 7 Інгредієнти Очищена вода Екстрагранулярні інгредієнти ПВП Стеарат магнію 5 10 15 % мас./мас. Скільки буде необхідним 0,16 0,03 Методика Шар/порція ентакапону Ентакапон і маніт спільно подрібнювали і просівали. Повідон, кросповідон і маніт спільно просівали окремо. Речовини змішували, отримуючи масу. Стеарат магнію просівали і змішували із згаданою вище масою. Масу пресували і подрібнювали. Стеарат магнію і тальк просівали окремо і змішували з подрібненою речовиною. Шар/порція леводопи і карбідопи Леводопу, карбідопу і мікрокристалічну целюлозу спільно просівали і перемішували. Повідон розчиняли в очищеній воді і гранулювали із згаданим вище перемішаним вмістом. Гранульований вміст сушили. Стеарат магнію просівали з полівінілпіролідоном і перемішували з висушеними гранулами. Пресування І шар/порція ентакапону, і шар/порцію леводопи і карбідопи пресували в двошарові таблетки, або в таблетку в таблетці, з ентакапоном, який оточує вкладену таблетку леводопикарбідопи. Приклад - IV Таблиця 8 Фармацевтична композиція винаходу Інгредієнти IR шар/порція ентакапону Ентакапон Маніт Повідон Кросповідон Стеарат магнію Екстрагранулярні інгредієнти Тальк Стеарат магнію СR шар/порція леводопи і карбідопи Леводопа Карбідопа Мікрокристалічна целюлоза Повідон Очищена вода Екстрагранулярні інгредієнти ПВП Стеарат магнію % мас./мас. 27,39 21,27 2,47 3,29 0,41 0,68 0,41 27,39 7,39 6,58 4,93 Скільки буде необхідним 2,46 0,54 20 25 Методика Шар/порція ентакапону Ентакапон і маніт спільно подрібнювали і просівали. Повідон, кросповідон і маніт спільно просівали окремо. Речовини змішували, отримуючи масу. Стеарат магнію просівали і змішували із згаданою вище масою. Масу пресували і подрібнювали. Стеарат магнію і тальк просівали окремо і змішували з подрібненою речовиною. Шар/порція леводопи і карбідопи Леводопу, карбідопу і мікрокристалічну целюлозу спільно просівали і перемішували. Повідон розчиняли в очищеній воді і гранулювали із згаданим вище змішаним вмістом. Гранульований 8 UA 102111 C2 5 вміст сушили. Стеарат магнію просівали з полівінілпіролідоном і перемішували з висушеними гранулами. Пресування І шар/порція ентакапону, і шар/порцію леводопи і карбідопи пресували в двошарові таблетки, або в таблетку в таблетці, з ентакапоном, який оточує вкладену таблетку леводопикарбідопи. Приклад – V Таблиця 9 Фармацевтична композиція винаходу Інгредієнт Внутрішнє LC-ER ядро таблетки Леводопа Карбідопа Гідроксипропілцелюлоза Маніт Повідон К90 Ізопропіловий спирт Хлористий метилен Стеарат магнію Маса внутрішнього ER ядра таблетки Зовнішні IR гранули ентакапону Ентакапон Маніт 25 Гліколят крохмалю натрію Кроскармелоза натрію Кукурудзяний крохмаль Повідон К30 Вода Гліколят крохмалю натрію Стеарат магнію Маса зовнішніх IR гранул ентакапону Загальна маса таблетки 10 15 20 % мас./мас. 30,77 8,31 4,62 1,54 0,46 0,00 0,00 0,46 30,77 5,38 3,08 3,69 7,54 1,23 0,00 1,54 0,62 Методика Шар/порція ентакапону Леводопу, карбідопу, гідроксипропілцелюлозу і маніт спільно просівали і перемішували. Повідон К90 розчиняли в ізопропіловому спирті і хлористому метилені. Масузі стадії 1 гранулювали з використанням розчину зі стадії 2 і сушили гранули. До отриманих гранул додавали стеарат магнію і пресували змазані гранули, отримуючи ядра таблеток. Зовнішні гранули IR ентакапону Ентакапон і маніт спільно просівали. Гліколят крохмалю натрію, кроскармелозу натрію, кукурудзяний крохмаль спільно просівали. Повідон К30 розчиняли в очищеній воді і використовували для гранулювання маси зі стадії 1. Гранули сушили. Гліколят крохмалю натрію просівали через прийнятне сито і додавали до описаних вище гранул. До описаної вище суміші додавали стеарат магнію. Пресування Таблетку в таблетці, яка складається з внутрішніх ядер таблеток LC ER і зовнішніх гранул IR ентакапону пресували за допомогою прийнятного апарату для пресування. 25 Таблиця 10 Час 0 15 30 Леводопа Sinemet CR 0 20 37 Карбідопа Приклад-1 0 15 40 9 Sinemet CR Приклад-1 0 23 38 0 16 40 UA 102111 C2 Продовження таблиці 10 Леводопа Sinemet CR 52 66 77 85 95 100 102 Час 45 60 75 90 120 150 180 Карбідопа Приклад-1 57 70 79 86 96 102 103 Sinemet CR Приклад-1 52 65 75 81 90 94 97 58 70 79 86 95 101 103 Таблиця 11 Для ентакапону Час 0 5 10 20 30 45 5 10 Comtan 0 17 47 88 98 101 Приклад V 0 17 39 72 82 90 У таблиці 11 приведені дані відносно розчинення композиції, отриманої відповідно до формули, приведеної в таблиці 9. Для визначення швидкості вивільнення лікарської речовини ентакапону використовували прилад USP 2 типу (50 об./хв.), в якому як середовище використовували 900 мл фосфатного буфера з рН 5,5 при 37ºC ± 0,5ºC. Крім того, для визначення швидкості вивільнення лікарської речовини леводопи і карбідопи використовували прилад USP 2 типу (50 об./хв.), в якому як середовище використовували 900 мл 0,1 N HCl при 37ºC ± 0,5ºC. Біодані (стан голодування) Для ентакапону – Таблиця 12 Параметри РК Нижня межа Смакс AUCt AUVінф 15 Співвідношення % (Т/R) Верхня межа 105,42 106,92 106,14 90 % СI Внутрішньо-CV (%) 75,03 91,78 91,39 148,11 124,56 123,27 56,28 23,89 23,89 Для карбідопи – Таблиця 13 Параметри РК Нижня межа Смакс AUCt AUVінф Співвідношення % (Т/R) Верхня межа 142,51 142,04 141,54 Для леводопи – 10 90 % СI Внутрішньо-CV (%) 120,86 120,91 120,78 168,05 166,86 165,87 25,84 25,23 24,84 UA 102111 C2 Таблиця 14 Параметри РК Нижня межа Смакс AUCt AUVінф 5 Співвідношення % (Т/R) Верхня межа 125,57 112,57 112,58 90 % СI Внутрішньо-CV (%) 109,25 97,92 97,88 144,32 129,41 129,49 21,73 21,76 21,84 У таблиці 12 представлений біопрофіль ентакапону IR; в таблиці 13 представлений біопрофіль карбідопи ER; в таблиці 14 представлений біопрофіль леводопи ER, отриманих згідно з прикладом V в умовах голодування в порівнянні з контрольним продуктом Comtan® 200 мг + одна таблетка Sinemet CR (виробник: Merck; леводопа 200 + карбідопа 50 мг ER таблетка). Схема дослідження включає в себе подвійне перехресне дослідження біоеквівалентності на 15 нормальних дорослих суб'єктах в умовах отримання їжі. Приклад – VI 10 Таблиця 15 Фармацевтична композиція винаходу Інгредієнт Внутрішнє LC ER ядро таблетки Леводопа Карбідопа Гідроксипропілцелюлоза Маніт Співполімер метакрилової кислоти Ізопропіловий спирт Хлористий метилен Стеарат магнію Зовнішні гранули IR ентакапону Ентакапон Маніт 25 Гліколят крохмалю натрію Кроскармелоза натрію Кукурудзяний крохмаль Повідон К30 Вода Гліколят крохмалю натрію Стеарат магнію Загальна маса таблетки 15 20 25 % мас./мас. 30,30 8,18 4,55 1,97 1,52 --0,45 30,30 5,30 3,03 3,64 7,42 1,21 -1,52 0,61 Методика Внутрішнє LC-ER ядро таблетки Леводопу, карбідопу, гідроксипропілцелюлозу і маніт спільно просівали і змішували. Співполімер метакрилової кислоти розчиняли в ізопропіловому спирті і хлористому метилен. Масу зі стадії 1 гранулювали з використанням розчину зі стадії 2 і сушили гранули. До отриманих гранул додавали стеарат магнію і перемішували. Масу зі стадії 4 гранулювали з використанням прийнятних штампів, отримуючи ядра таблеток. Зовнішні гранули IR ентакапону Ентакапон і маніт перемішували і подрібнювали. Гліколят крохмалю натрію, кроскармелозу натрію, кукурудзяний крохмаль спільно просівали і перемішували. Повідон К30 розчиняли в очищеній воді. Масу зі стадії 7 гранулювали з використанням розчину зі стадії 8 і гранули сушили. Гліколят крохмалю натрію додавали до маси зі стадії 9 і перемішували. Стеарат магнію додавали до маси зі стадії 10 і перемішували. Пресування 11 UA 102111 C2 Дозовану форму таблетки в таблетці отримували при використанні внутрішніх ядер LC ER таблеток і зовнішніх гранул IR ентакапону за допомогою прийнятного апарату для пресування. ФОРМУЛА ВИНАХОДУ 5 10 15 20 25 30 35 40 45 50 55 60 1. Фармацевтична композиція у вигляді разової пероральної дози, що містить а) леводопу, або її солі, в кількості від приблизно 50 мг до приблизно 300 мг разом з одним або більше полімерами, що регулюють швидкість, в формі пролонгованого вивільнення, b) карбідопу, або її солі, в кількості від приблизно 10 мг до приблизно 100 мг разом з одним або більше полімерами, що регулюють швидкість, в формі пролонгованого вивільнення, і с) ентакапон, або його солі, в кількості від приблизно 100 мг до приблизно 1000 мг разом з одним або більше фармацевтично прийнятними ексципієнтами в формі негайного вивільнення, де фармацевтична композиція необов'язково містить інші фармацевтично прийнятні ексципієнти. 2. Спосіб лікування хвороби Паркінсона у ссавця, що включає в себе введення потребуючому цього ссавцеві разової пероральної дозованої фармацевтичної композиції, що містить а) леводопу, або її солі, в кількості від приблизно 50 мг до приблизно 300 мг разом з одним або більше полімерами, що регулюють швидкість, в формі пролонгованого вивільнення, b) карбідопу, або її солі, в кількості від приблизно 10 мг до приблизно 100 мг разом з одним або більше полімерами, що регулюють швидкість, в формі пролонгованого вивільнення, і с) ентакапон, або його солі, в кількості від приблизно 100 мг до приблизно 1000 мг разом з одним або більше фармацевтично прийнятними ексципієнтами в формі негайного вивільнення, причому фармацевтична композиція необов'язково містить інші фармацевтично прийнятні ексципієнти. 3. Спосіб зменшення явища «виснаження» дози у пацієнтів з хворобою Паркінсона, що включає в себе введення потребуючому цього пацієнту разової пероральної дозованої фармацевтичної композиції, що містить а) леводопу, або її солі, в кількості від приблизно 50 мг до приблизно 300 мг разом з одним або більше полімерами, що регулюють швидкість, в формі пролонгованого вивільнення, b) карбідопу, або її солі, в кількості від приблизно 10 мг до приблизно 100 мг разом з одним або більше полімерами, що регулюють швидкість, в формі пролонгованого вивільнення, і с) ентакапон, або його солі, в кількості від приблизно 100 мг до приблизно 1000 мг разом з одним або більше фармацевтично прийнятними ексципієнтами в формі негайного вивільнення, причому фармацевтична композиція необов'язково містить інші фармацевтично прийнятні ексципієнти. 4. Спосіб отримання разової пероральної дозованої фармацевтичної композиції, що містить а) леводопу, або її солі, в кількості від приблизно 50 мг до приблизно 300 мг разом з одним або більше полімерами, що регулюють швидкість, в формі пролонгованого вивільнення, b) карбідопу, або її солі, в кількості від приблизно 10 мг до приблизно 100 мг разом з одним або більше полімерами, що регулюють швидкість, в формі пролонгованого вивільнення, і с) ентакапон, або його солі, в кількості від приблизно 100 мг до приблизно 1000 мг разом з одним або більше фармацевтично прийнятними ексципієнтами в формі негайного вивільнення, де вказаний спосіб включає в себе: а) нанесення покриття, або змішування леводопи, карбідопи з фармацевтично прийнятними, регулюючими швидкість полімерами, b) ентакапон з одним або більше фармацевтично прийнятними ексципієнтами, с) перемішування суміші зі стадії а) і b) і переведення її у прийнятну дозовану форму. 5. Композиція за п. 1, де дана композиція включає в себе одне або більше з числа таблетки, двошарової таблетки, тришарової таблетки, капсули, порошку, пластинки, таблетки у вигляді капсули, гранул, кульок, гранул в капсулі, міні-таблеток, міні-таблеток в капсулі, кульок в капсулі і саше. 6. Композиція за п. 1, в якій фармацевтично прийнятні, регулюючі швидкість полімери включають в себе один або більше з числа полівінілацетату, ацетату целюлози, ацетатубутирату целюлози, ацетату-пропіонату целюлози, етилцелюлози, жирної кислоти, ефіру жирної кислоти, алкілового спирту, воску, шелаку, смоли, зеїну (проламіну кукурудзи), повідону, колідону SR, полі(мет)акрилату, мікрокристалічної целюлози або полі(етиленоксиду), солей поліуронової кислоти, простих ефірів целюлози, ксантанової камеді, трагакантової камеді, карайї, гуарової камеді, аравійської камеді, геланової камеді, камеді ріжкового дерева, солей лужних металів альгінової кислоти або пектинової кислоти, альгінату натрію, альгінату калію, альгінату амонію, гідроксипропілцелюлози, гідроксіетилцелюлози, гідроксипропілметилцелюлози, карбоксивінілових полімерів, полімеризованого желатину, шелаку, співполімерів метакрилової кислоти типу С NF, бутирату-фталату целюлози, гідрофталату целюлози, пропіонату-фталату целюлози, фталату полівінілацетату (PVAP), 12 UA 102111 C2 5 10 15 20 ацетату-фталату целюлози (CAP), ацетату-тримелітату целюлози (CAT), фталату гідроксипропілметилцелюлози, ацетату гідроксипропілметилцелюлози, сукцинату діоксипропілметилцелюлози, карбоксиметилетилцелюлози (СМЕС), ацетату-сукцинату гідроксипропілметилцелюлози (HMPCAS) і полімерів і співполімерів акрилової кислоти типу метилакрилату, етилакрилату, метилметакрилату і/або етилметакрилату зі співполімерами ефірів акрилової і метакрилової кислоти (Eudragit NE, Eudragit RL, Eudragit RS). 7. Фармацевтична композиція за п. 1, в якій одна таблетка вказаної композиції не виявляє суттєвої відмінності в швидкості і/або мірі абсорбції ентакапону в порівнянні з 2-4 таблетками 200 мг ентакапону негайного вивільнення, комерційно доступного у вигляді Comtan®, і відсутня суттєва відмінність в швидкості і/або мірі абсорбції леводопи і карбідопи в порівнянні з однією таблеткою Sinemet®, що вводиться з інтервалом 3-4 години. 8. Спосіб лікування за п. 2, де одна таблетка вказаної композиції не виявляє суттєвої відмінності в швидкості і/або мірі абсорбції ентакапону в порівнянні з 2-4 таблетками 200 мг ентакапону негайного вивільнення, комерційно доступного у вигляді Comtan®, і відсутня суттєва відмінність в швидкості і/або мірі абсорбції леводопи і карбідопи в порівнянні з однією таблеткою Sinemet®, що вводиться з інтервалом 3-4 години. 9. Спосіб зменшення явища «виснаження» дози за п. 3, де одна таблетка вказаної композиції не виявляє суттєвої відмінності в швидкості і/або мірі абсорбції ентакапону в порівнянні з 2-4 таблетками 200 мг ентакапону негайного вивільнення, комерційно доступного у вигляді Comtan®, і відсутня суттєва відмінність в швидкості і/або мірі абсорбції леводопи і карбідопи в порівнянні з однією таблеткою Sinemet®, що вводиться з інтервалом 3-4 години. Комп’ютерна верстка А. Крижанівський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 13
ДивитисяДодаткова інформація
Назва патенту англійськоюSingle unit oral dose pharmaceutical composition comprising levodopa, carbidopa and entacapone or salts thereof
Автори англійськоюGupta, Yatendra Kumar, Jain, Girish Kumar, Talwar, Munish, Mashalkar, Manoj
Назва патенту російськоюФармацевтическая композиция в виде разовой пероральной дозы, которая содержит леводопу, карбидопу и энтакапон или их соли
Автори російськоюГупта Ятендра Кумар, Джаин Гириш Кумар, Талвар Муниш, Машалкар Манодж
МПК / Мітки
МПК: A61K 31/137, A61P 25/16, A61K 31/198, A61K 9/20
Мітки: фармацевтична, леводопу, солі, композиція, ентакапон, дози, разової, карбідопу, перорально, містить, вигляді
Код посилання
<a href="https://ua.patents.su/15-102111-farmacevtichna-kompoziciya-u-viglyadi-razovo-peroralno-dozi-shho-mistit-levodopu-karbidopu-i-entakapon-abo-kh-soli.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція у вигляді разової пероральної дози, що містить леводопу, карбідопу і ентакапон або їх солі</a>
Попередній патент: Фільтр тонкого очищення
Наступний патент: Натурально підсолоджений соковий продукт з бета-глюканом
Випадковий патент: Збір із рослинної сировини