Прозорий шприц
Номер патенту: 41268
Опубліковано: 17.09.2001
Автори: Абе Масару, Міва Акіра, Йокоте Сатіо, Кікуті Масахіко
Формула / Реферат
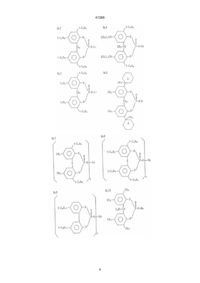
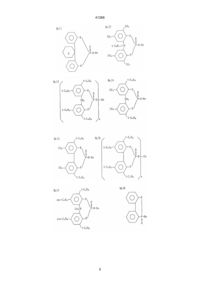
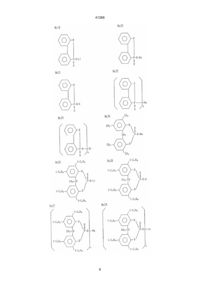
1. Прозрачный шприц, предварительно заполненный раствором лекарства, полученный формованием смолы, отличающийся тем, что смола содержит в качестве базового материала полимер пропилена, и в качестве зародышеобразующего агента эфир фосфорной кислоты общей формулы (1):
где R1, R2, R3 и R4 по отдельности представляют атом водорода или неразветвленный, разветвленный, или циклический алкил, который может быть замещен, R представляет простую связь, атом серы или алкилиденовую группу, Х и У означают по отдельности 0 или 1, М представляет атом металла и n означает валентность металла, причем прозрачный шприц предварительно заполнен лекарством, сохраняющим свою
прозрачность и незагрязненность при продолжительности хранения по меньшей мере 6 месяцев при температуре 40° С.
2. .Прозрачный шприц по п.1, отличающийся тем, что раствор лекарства представлен контрастной средой.
3. Прозрачный шприц по п.1, отличающийся тем, что раствор лекарства представлен раствором, содержащим в качестве основного компонента йогексол.
4. Прозрачный шприц по п.1, отличающийся тем, что полимер пропилена выбирают из группы, состоящей из гомополимеров пропилена, (ii) кристаллических сополимеров с другими мономерами, в основном состоящих из пропилена, и (ііі) смесей кристаллического полипропилена в качестве основного компонента с другими полимерами, причем гомополимеры, сополимеры и смеси характеризуются индексом текучести расплава 0,5-100 г/10 мин при определении согласно ASTM D-1238.
5. Прозрачный шприц по п.1, отличающийся тем, что указанный зародышеобразующий агент представляет собой метилен- бис(2,4-ди-трет-бутилфенол)-фосфат.
6. Прозрачный шприц по п.1, отличающийся тем, что указанный эфир фосфорной кислоты общей формулы (1) является единственным зародышеобразующим агентом.
7. Прозрачный шприц по п.1, отличающийся тем, что указанная смола состоит, в основном, из базового материала и указанного зародышеобразующего агента.
8. Прозрачный шприц по п.1, отличающийся тем, что указанная смола состоит из базового материала и указанного зародышеобразующего агента.
Текст
1. Прозрачный шприц предварительно заполненный раствором лекарства, полученный формованием смолы, отличающийся тем, что смола содержит в качестве базового материала полимер пропилена, и в качестве зародышеобразующего агента эфир фосфорной кислоты общей формулы (1): C2 (54) ПРОЗОРИЙ ШПРИЦ 41268 циенту и т.п., и другой тип инъекций, в которых лекарство содержалось в сосудике в виде порошка или лиофилизованного аморфного порошка, где вновь растворялось с целью возможности переноса лекарства в корпус шприца для использования в виде инъекции. При использовании таких инъекций возникали следующие проблемы: I) продолжительное время, необходимое для переноса лекарства в виде раствора, II) сложность операции, III) возможность ошибки и IV) потенциальная возможность попадания в инъекции стекольного порошка при использовании ампул из стекла. Кроме того, поскольку подобные инъекции при использовании необходимо переносить в корпус шприца возникает проблема V) бактериального загрязнения, смешивания с чужеродным веществом и т.п., если идет речь о стерильном состоянии. Для решения указанных проблем в последнее время изучались стеклянные или пластиковые корпуса шприцов небольшого объема, в которые заранее загружался раствор лекарства. В случае пластиковых корпусов шприцов из смолистых материалов наиболее часто для изготовления корпусов применялись полипропиленовые смолы с добавкой сорбита в качестве зародышей кристаллизации. Однако, при использовании таких смол возникает проблема растворения из компонентов смолы добавок и т.п., если раствор лекарства остается длительное время в корпусе шприца из такой смолы. Помимо корпусов шприцев, заранее заполненных раствором лекарства, аналогичная потенциальная проблема возникает и в случае контейнеров для вливания и контейнеров для хранения медицинских растворов, например, растворов для инъекций, инъектируемых длительное время в организм человека, т.к. поскольку раствор лекарства контактирует со смолой, из которой изготовлен контейнер, длительное время, из смолы в раствор лекарства могут вымываться содержащиеся в смоле добавки. Таким образом, с точки зрения безопасности требовались тщательные исследования используемых материалов (Фармакопия Японии, Методы испытаний пластиковых контейнеров для водных растворов для вливаний, Испытание на растворение и т.д., Руководство для фармацевтов Японии, В-431). Тем не менее, полностью удовлетворительных результатов до сего момента получено не было. С другой стороны, такие корпуса шприцев и контейнеры должны быть прозрачными, чтобы иметь возможность наблюдать невооруженным глазом помутнение раствора лекарства и определять количество введенного лекарства, содержащегося в шприце или контейнере. Соответственно цель настоящего изобретения заключается в создании препарата, представляющего собой корпус шприца или контейнер вместе с раствором лекарства, заключенного в корпус шприца или контейнер, причем корпус шприца или контейнер характеризуется хорошей прозрачностью и отсутствием какого-либо вымывания добавок из смолы, образующей корпус шприца или контейнер, при длительном хранении раствора лекарства. Кроме того, цель изобретения заключается в создании корпуса шприца или контейнера, пригодных для изготовления подобных препаратов. Создателями настоящего изобретения в свете вышеизложенного проведены интенсивные исследования. В результате таких исследований обнаружено, что если раствор лекарства заключить в корпус шприца или контейнер, изготовленных формованием полипропиленовой смолы с добавкой в качестве зародышей кристаллизации эфиров фосфорной кислоты общей формулы (1), раскрытой ниже, можно получить препарат, характеризующейся отсутствием вымывания добавок из смолы и хорошей прозрачностью корпуса шприца или контейнера в течение длительного периода, что и составило объект настоящего изобретения. Соответственно, настоящее изобретение направлено на препарат, представляющий собой прозрачный корпус шприца или контейнер, полученные формованием смолы, состоящей из полимера пропилена в качестве базового материала и эфира фосфорной кислоты в качестве зародыша кристаллизации, эфир фосфорной кислоты отвечает общей формуле (1): (1) где R1, R2, R3 и R4 могут по отдельности представлять атом водорода или нормальный, разветвленный или циклический алкил, который может быть замещен, R представляет простую связь, атом серы или алкилиден, х и у (по отдельности) = О или I, М представляет ион металла и n означает валентность металла, вместе с раствором лекарства, заключенным в корпус шприца или контейнер. Настоящее изобретение, кроме того, направлено на прозрачный корпус шприца или контейнер, пригодные для приготовления вышеуказанного препарата. Препарат настоящего изобретения получают загрузкой заранее раствора лекарства в корпус шприца или контейнер. Желательно раствор лекарства таков, что его можно инъектировать непосредственно в организм человека и отвечает требованиям высокой безопасности. В виде примеров могут быть упомянуты растворы лекарства для внутривенного введения, внутриартериального введения, внутримышечного введения, подкожного введения, прямого введения в органы и т.п. Никаких конкретных ограничений не накладывается на тип раствора лекарства, заранее загружаемого в корпус шприца или контейнер. Однако, в качестве примеров таких растворов могут быть упомянуты растворы лекарств, применимых в лечении или диагностики различных заболеваний или нарушений, раствор Ринджера, физиологически приемлемые жидкие питательные вещества и т.п. Шприц и препарат в виде шприца настоящего изо 2 41268 бретения применимы в случае введения больших количеств раствора лекарства. В качестве примеров диагностических средств в виде вышеописанных растворов лекарств могут быть упомянуты контрастные средства различного типа. Примеры контрастных сред могут включать контрастные среды для радиографии, МРИ и ультразвуковой эхографии. В качестве примеров контрастных сред для радиографии можно указать контрастные среды, содержащие соединения йода. Контрастные среды, содержащие соединения йода, могут включать йогексол и йодиксанол. В качестве примеров контрастных сред для МРИ могут быть указаны (I) ионы парамагнитного металла, такого как: гадолиний (Gd), марганец (Мn) и диспрозий (Dy) и их хелатные соединения, (II) ферромагнитные или ультраферромагнитные вещества, типичными представителями которых являются различные ферриты, (III) нитроксидные радикалы и рибосомные препараты, содержащие вещества (I), (II) или (III). В качестве примеров контрастных сред для ультразвуковой эхографии могут быть упомянуты контрастные среды, содержащие пузырьки или капсулы, в которых включены или содержатся крохотные пузырьки, например, пузырьки альбумина. В виде примера можно указать препарат альбумина ("Алюбмекс") в виде так называемых микропузырьков, включенных в препарат. Кроме того, могут быть упомянуты контрастные среды для ультразвуковой эхографии, каждая из которых вместо альбумина содержит различные белки, углеводы или полимеры. Более того, раствор лекарства не ограничен водными растворами, но включает суспензии, а также растворы и суспензии в масле. Дополнительные примеры типа препарата включают корпуса шприцов и контейнеров для хранения растворов лекарства. Тем не менее, рекомендуются корпуса шприцов. Состав смолы, применяемый для изготовления корпусов шприцов или контейнеров изобретения, характеризуется наличием полимера пропилена в качестве базового материала и вышеприведенного эфира формулы (1) в качестве зародышей кристаллизации. В данном случае полимер пропилена не ограничен гомополимером пропилена, но включает также его кристаллические сополимеры с другими мономерами и смеси кристаллического полипропилена с другими полимерами при условии, что полимер в основном состоит из пропилена. В качестве кристаллических сополимеров, состоящих в основном из пропилена, рекомендуются пропилен-этилен неупорядоченные со полимеры и пропилен-бутен-1 сополимеры. Примеры других полимеров, смешиваемых с кристаллическим полипропиленом, включают этиленбутеновые сополимеры и т.п. Из таких полимеров пропилена с точки зрения прозрачности особенно рекомендуются гомополимер пропилена и этиленпропиленовые неупорядоченные сополимеры, полученные сополимеризацией пропилена с 0,57% масс. (предпочтительно 0,5-5% масс.) этилена. Кроме того, из указанных полимеров пропилена рекомендуются полимеры, характеризующиеся индексом текучести расплава (ИТР) 0,5100 г/10 мин (более предпочтительно 550 г/10 мин), определенного согласно АСТМ D-1238. Зародышами кристаллизации, смешиваемыми с применяемой в настоящем изобретении смолой, являются эфиры фосфорной кислоты общей формулы (1), приведенной выше. В качестве примеров алкилиденовых групп, обозначенных в общей формуле (1) символом Р, можно указать метилиден, этилиден, изопропилиден, бутилиден, гексилиден, октилиден, нинилиден, циклопентилиден, циклогексилиден и циклооктилиден. В качестве примеров алкилов, обозначенных символами R1, R2, R3 и R4, можно указать метил, этил, изопропил, н-пропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-амил, трет-амил, гексил, гептил, н-октил, 2-этилгексил, трет-октил, нонил, децил, ундецил, додецил, тридецил, тетрадецил, пентадецил, гексадецил, гептадецил, октадецил и т.д. Кроме того в качестве примеров циклоалкильных групп могут быть упомянуты циклопентил, циклогептил, циклооктил и т.д. В качестве примеров атома металла, указанного символом М, можно указать литий, натрий, калий, берилий, магний, кальций, стронций, цинк, алюминий, германий, олово, свинец, титан, хром, висмут, молибден, марганец, железо, кобальт, никель, цирконий, сурьму, кадмий и т.д., из которых особенно рекомендуются металлы Iа Группы, такие как литий, натрий и калий и металлы IIа Группы, такие как магний, кальций, стронций и барий. Типичные примеры соединений, применяемых в настоящем изобретении и представленных общей формулой (1), раскрыты, например, в Патентной Публикации Японии № 8980/1988. Эти соединения приведены ниже. Наиболее типичным представителем соединений этого типа является натриевая соль 2,2'-метилен-бис(4,6-ди-трет-бутилфенол)фосфорной кислоты (далее сокращенно "NA-II"), представленная ниже под № 1. 3 41268 4 41268 5 41268 6 41268 Такие эфиры фосфорной кислоты формулы (1) рекомендуется добавлять к смоле в количестве 0,001-5% масс., более предпочтительно 0,01-3% масс. и наиболее предпочтительно 0,050,5% масс. Если эфир применяют в количестве менее 0,001% масс., прозрачность контейнера или аналогичного изделия становится недостаточной, как оказывается недостаточной способность предотвращать вымывание в зaгpyженный в контейнер раствор лекарства. В практике настоящего изобретения в применяемую смолу могут быть добавлены и другие добавки, например: нейтрализующие средства, антиокислители, антистатики, органические перекиси и т.д. В качестве типичных нейтрализующих средств, которые согласно изобретению могут быть добавлены в смолу, можно указать металлические соли стеариновой кислоты, оксиды щелочноземельных металлов, гидроксиды щелочноземельных металлов, основные соли и основные двойные соли. Металлические соли стеариновой кислоты могут включать стеарат кальция (далее сокращенно "СТК"), стеарат магния, стеарат цинка и т.п. Могут быть также использованы металлические соли, полученные заменой стеариновой кислоты в вышеуказанных солях другими жирными кислотами. В качестве примеров рекомендуемых оксидов и гидроксидов щелочноземельных металлов, можно указать оксид магния, оксид кальция и гидроксид кальция. В качестве примеров основных солей можно указать соли, полученные частичной нейтрализацией двуокисью углерода вышеупомянутых оксидов и гидроксидов, таких как основной карбонат магния и основной карбонат кальция. В качестве примеров основных двойных солей могут быть упомянуты гидротальциты, являющиеся водными основными карбонатными минералами магния и алюминия. В качестве особенно рекомендуемых соединений щелочноземельных металлов можно указать оксид магния, гидроксид магния, основной карбонат магния, гидроксид алюминия и гидротальциты. В качестве представителей антиокислителей могут быть упомянуты фенольные антиокислители, фосфитные антиокислители, органические фосфитные антиокислители и т.д. В качестве типичного фенольного антиокислителя можно указать тетракис/метилен-3(3',5'-ди-трет-бутил-4'гидроксифенил)-пропионат/метан (фирменное наименование "Ирганокс 1010", далее сокращенно "ИРН"), 1,3,5-трис(3,5-ди-трет-бутил-4-гидроксибензил)изоцианурат, 1,3,5-трис(3,5-ди-трет-бутил4-гидроксибензил)-2,4,6-триметилбензол и т.п. Кроме того, могут быть указаны антиокислители, раскрытые в открыто-отложенной патентной Публикации Японии № 53344/1986. В качестве особенно рекомендуемого примера органического фосфитного соединения или органического фосфонитного соединения можно указать трис(2,4-ди-трет-бутилфенлл)фосфит (фирменное наименование "Иргафос 168", далее сокращенно "ИР168"). Все вышеупомянутые добавки могут быть использованы в смолистом материале для корпусов шприцов или контейнеров изобретения. Однако, рекомендуется подбирать их из числа веществ, допущенных для употребления в качестве добавок FDА в США. В случае добавления органической перекиси и проведения термообработки можно регулировать индекс текучести расплава (ИТК) конечной смолы. Подобная обработка может улучшить формуемость и технологичность смолы, и как следствие, внешний вид готового формованного изделия. В качестве примеров органических перекисей, применимых при получении смолистого материала для корпусов шприцов и контейнеров изобретения можно указать перекись ди-трет-бутила, третбутил-пероксипивалат, перекись бензоила, перекись лауроила, перекись циклогексанона, третбутилпероксиизопропилкарбонат, трет-бутилпероксибензоат, перекись метилэтилкетона, перекись дикумила, 2,5-диметил-2,5-ди (трет-бутилперокси) гексан, 2,5-диметил-2,5-ди(трет-бутилперокси) гексин-3 и т.п. Эти соединения могут быть использованы как по отдельности, так и в сочетании. Кроме того, смолистые композиции, служащие материалом для изобретения, могут содержать, если необходимо, тяжелые металлы в качестве дезактиваторов, оловоорганические соединения, пластификаторы, эпоксипроизводные, пигменты, наполнители, пенообразующие средства, замедлители горения, технологические добавки и т.п. В то же время смолистые композиции настоящего изобретения желательно получать без применения каких-либо УФ-абсорбентов и смазок. Однако, УФ-абсорбенты и смазки могут быть включены в небольших количествах при условии, что они не влияют на настоящее изобретение. Количество добавляемого стеарата металла предпочтительно охватывается отношением 0,005-1 часть по массе на 100 частей по массе полипропиленовой смолы. Количество добавляемого фенольного антиокислителя предпочтительно охватывается интервалом 0,001-3 части по массе, в частности, 0,005-1 часть по массе на 100 частей по массе полиолефина. Количество добавляемого фосфита или фосфонита предпочтительно охватывается интервалом 0,001-5 частей по массе, в частности, 0,01-3 части по массе на 100 частей по массе полиолефина. Органическую перекись рекомендуют добавлять в количестве, охватываемым интервалом 0,001-0,5 части по массе на 100 частей по массе всей композиции. Корпус шприца или контейнер настоящего изобретения могут быть изготовлены формованием смолы, полученной нижеследующим способом, использованием соответствующих средств формования, например, литьевым формованием. Получение смолы осуществляют, например, использованием в качестве базового материала вышеописанного полимера пропилена, введением в полимер таких добавок, как зародыши кристаллизации, нейтрализующее средство и антиокислитель и смешиванием их в однородной дисперсии, плавлением и таблетированием дисперсии в экструдере. Кроме того, формование рекомендуют проводить повторным плавлением при нагревании полученных гранул с последующим формованием расплава в задуманную форму в температурном 7 41268 стеарат кальция (СТК) и/или "Гидротальцит" (фирменное наименование, ГИ) в качестве нейтрализующих средств), а также "Иргафос 168" (фирменное наименование, ИР168), "Ирганокс 1010" (фирменное наименование, ИРН) и/или "Ультранокс" (фирменное наименование, УН) в качестве антиокислителей, добавляемых по отдельности. В качестве зародышей кристаллизации в количествах, указанных в табл. 1, добавлен "NАІІ" (фирменное название NAII). Кроме того, в качестве органической перекиси добавлен 2,5диметил-2,5-ди(трет-бутилперокси)гексан (25Z). Перечисленные компоненты добавляют к базовому материалу согласно указанному в табл. 1 составу и смешивают их в смесителе Хеншеля в однородную суспензию. Каждую полученную дисперсию плавят и таблетируют в одношнековом экструдере (диаметр барабана 25 мм) при 230°С. Этим способом могут быть приготовлены смолы, содержащие различные количества добавок. Смола № 8 приготовлена вышеприведенным способом за тем исключением, что в качестве базового материала использован гомополимер пропилена с ИТР 20 г /10 мин. Определены физические свойства полученных смол. В испытаниях определены ИТР (индекс текучести расплава, г/10 мин) и помутнение (%) (согласно АSТМ D-1003) использованием в каждом случае формованного образца толщиной в 2 мм. Полученные результаты приведены в табл. 2. Определением физических свойств подтверждено, что помутнение прямопропорционально прозрачности смолы при определении невооруженным глазом в водном растворе или на воздухе. Полученные гранулы по отдельности подвергают повторному плавлению с последующим формованием в целевые корпуса шприцев при температуре литья под давлением 230±10°С. интервале 180-280°С, предпочтительно 230±10°С литьевым формованием. Ниже приводится способ перевода раствора лекарства в препарат использованием контейнера из смолы, приготовленной вышеприведенным методом. После стерилизации контейнера в автоклаве или обработкой окисью этилена на кончик контейнера, полученного вышеприведенным способом, например, корпус шприца надевают определенную резиновую пробку. После этого с помощью разливочной машины контейнер в асептических условиях заполняют стерильным раствором лекарства (к примеру, нормальным объемом контрастной среды). Количество загружаемого раствора может меняться в пределах от 1 до 2000 мл, часто в интервале 50-150 мл. После заполнения корпус шприца (ту его часть, в которую поступает поршень) закрывают, возможно в вакууме, созданием герметизирующей оболочки, охватывающей, включая пробку, поршень, и получением в результате препарата. Хотя вышеприведенный пример относится к случаю, когда раствор лекарства заливают в корпус шприца, тем не менее растворы лекарства могут быть также залиты в контейнеры, отличные от корпусов шприцов, с превращением их в препараты. Примеры Настоящее изобретение далее иллюстрируется следующими примерами. Однако, следует иметь в виду, что настоящее изобретение не ограничено приведенными примерами. Пример 1 (1) Способ получения синтетической смолы В случае смол № 1-7 в качестве базового материала использован пропилен-этиленовый неупорядоченный сополимер, содержащий 4 части по массе этилена и имеющий текучести расплава (ИТР) 20 г /10 мин. В качестве добавок использованы компоненты, указанные в табл. 1, а именно: Таблица 1 Синтетические полипропиленовые смолы, содержащие сочетания различных добавок Добавка Нейтрализующее средство Антиокислитель Зародыши кристаллизации Органическая кислотаа) УФ-абсорбент СТК ГИ ИР168 ИРН УН NC4 NA-II 25Z CH №1 0,04 0,03 0,05 0,05 №2 0,08 0,045 0,045 Количество вносимой добавки (%) №3 №4 №5 №6 №7 0,08 0,08 0,08 0,08 0,07 0,045 0,045 0,045 0,045 0,045 0,045 0,045 0,045 0,1 0,2 0,3 0,1 0,2 0,013 №8 0,08 0,045 0,045 0,3 0,2 0,04 Примечания к табл. 1 Органическая кислота а) - органическая перекись. b) Гомополимер пропилена. 25Z - 2,5-Диметил-2,5-ди(трет-бутилперокси)гексан. СТК - Стеарат кальция (FDА № 178. 2010). ИР168 - Трис(2,4-ди-трет-бутилфенил)фосфит ("Иргафос 168", FDA № 178. 2010). ИРН - Тетракис/метилен-3-(3'-5'-ди-трет-бутил-4-гидрокси-фенил)пропионат/метан ("Ирганокс 1010", FDА № 178. 2010). NC4 - 1,3,2,4-Ди(п-этилбензилиден)сорбит (FDA № 178.3295) NА-II - Натрий-2,2'-метилен-бис(4,6-ди-трет-бутилфенил)-фосфат ("NA-2UY", FDA № 178. 3296). 8 41268 ГИ - Смесь гидроксида алюминия и гидроксида магния ("Гидротальцит", FDA № 184. 1428). УН - Ди (2,4-ди-трет-бутилфенил)пентаэритритдифосфит ("Ультранокс 626", FDА № 178. 2010). СН - Поликонденсат диметилоукцинат-1-(2-гидроксиэтил)-4-гидрокси-2,2,6,6-тетраметилпиперидина ("Санол L, S-622", FDA № 178. 2010). Таблица 2 Физические свойства различных пластиковых смол Испытание ИТР* Помутнение (%) №1 20 85 №2 20 80 №3 20 41 №4 20 35 №5 20 34 №6 19,5 38 №7 15 25 №8 20 49 *ИТР - индекс текучести расплава ( г/10 мин) Корпус шприца или контейнер для хранения растворов лекарств настоящего изобретения должны (а) отличаться отсутствием вымывания добавок в их содержимое, напр.: раствор лекарства или иную медицинскую жидкость и (b) устойчиво сохранять хорошую прозрачность смолы для проверки наличия чужеродного вещества. Пластиковые контейнеры обладают преимуществами малого веса, прочности и легкости упаковки и транспортировки. С другой стороны, пластиковые контейнеры с течением времени подвергаются неблагоприятному воздействию света и тепла, вследствие чего их прозрачность ухудшается. Помутнение вследствие потери прозрачности затрудняет проверку на наличие чужеродного вещества. При этом также возникает потенциальная проблема добавок, таких как антиокислитель, абсорбент ультрафиолета и пластификатор (стабилизатор). На основании этого можно предвидеть, что когда предполагаемым содержимом контейнера является инъекция, различные виды токсичности, например: отравление крови и острая токсичность указанных добавок для живого организма создаст серьезную проблему, поскольку инъекция вводится непосредственно в человеческий организм (Фармакопия Японии B-439). Пластиковые корпуса шприцов (контейнеры), заполненные раствором лекарства, все еще не нашли достаточного практического использования. В связи с этим в настоящее время не созданы критерии для их производства имеющими к этому отношение официальными органами. Однако, некоторую информацию для оценки дают "Методы испытании пластикового контейнера для водных вливаний" (Фармакопия Японии). Соответственно, согласно "Методам испытаний пластикового контейнера для водных вливаний" проводят (1) оценку прозрачности и (2) внешнего вида. Кроме того, требуется (3) тест на долгосрочную стабильность лекарства с определением химических или физических свойств лекарства или его качества при хранении в корпусе шприца или контейнере. Такие исследования приведены ниже в последующих примерах. Однако, растворы лекарств по изобретению не ограничены случаями, упомянутыми в примерах. Пример 2 Тест на вымывание (1) Для проведения испытаний согласно "Методам испытаний пластикового контейнера для водных вливаний", рекомендованный Фармакопией Японии, использованы в качестве образцов раз личные полипропиленовые смолы, приведенные в табл. 3. В качестве образца из подвергаемого испытанию контейнера вырезают его часть, обладающую наименьшей кривизной и одинаковой толщиной. Вырезанные куски подбирают таким образом, что при толщине не более 0,5 мм общая площадь поверхности обоих сторон составляет примерно 1200 см2, а при толщине более 0,5 мм общая площадь поверхности составляет примерно 600 см2. Отобранные в результате нарезанные куски снова обрезают в кусочки длиной 5 см и длиной 0,5 мм, промывают водой и сушат при комнатной температуре. Полученный образец помещают в твердый стеклянный контейнер с внутренним объемом примерно 300 мл. Затем в контейнер аккуратно наливают 200 мл воды и контейнер герметически закрывают пробкой. Образец нагревают 1 час в автоклаве при 121°С и оставляют охлаждаться до комнатной температуры. Полученную в результате жидкость используют в качестве испытуемой жидкости. С другой стороны получают аналогичным путем холостую испытуемую жидкость использованием одной только воды. С испытуемой жидкостью и холостой испытуемой жидкостью проводят следующие анализы. І) Анализ на присутствие иона аммония и т.п. В трубку Несслера помещают 10 мл испытуемой жидкости и добавляют воду до 50 мл. К полученной жидкой смеси добавляют 2 мл водного раствора, приготовленного добавлением к 1 г гидроксида натрия воды до 3 мл и добавлением 1 мл раствора реактива Несслера. Трубку Несслера тщательно встряхивают. Окраску испытуемой жидкости сравнивают сравнительного раствора. В качестве сравнительного раствора используют раствор, приготовленный добавлением к 0,5 мл стандартного раствора аммиака, заменяющего испытуемую жидкость, воды до 10 мл. Сравнительный раствор обрабатывают вышеприведенным способом. Стандартный раствор аммиака получают следующим образом. Аккуратно отвешивают 2,97 г хлорида аммония и растворяют в очищенной воде для анализа аммония с получением точно 1000 мл водного раствора. Отмеряют точно 10 мл приготовленного раствора и разбавляют до 1000 мл водой, очищенной для анализа на аммонии. Полученный раствор содержит ионы аммония (NH4)+ в концентрации 0,01 мг/мл. 9 41268 Данный анализ основан на реакции, в которой ионы аммония обнаруживаются раствором реактива Несслера. Однако, положительную реакцию дают также амины, глюкоза и т.п. Предел допуска составляет 0,05 мкг/мл в пересчете на ион аммония (NH4)+. Как видно из приведенных в табл. 3 результатов испытаний, смола № 7, содержащая в качестве зародышей кристаллизации сорбит, не отвечает оценочному стандарту (анализ на аммоний в испытании на выбывание согласно методам испытаний пластикового контейнера для водных вливаний, рекомендованных Фармакопией Японии). Однако, смолы № 1-6 и № 8 либо не содержащие зародышей кристаллизации, либо содержащие в качестве зародышей кристаллизации соединения фосфора, отвечают стандарту. ІІ) Анализ на присутствие веществ, восстанавливающих перманганат калия В коническую колбу с пробкой помещают 20 мл испытуемой жидкости и затем добавляют 20 мл 0,01 н. раствора перманганата калия и 1 мл разбавленной соляной кислоты. Содержимое колбы кипятят 3 минуты, охлаждают, после чего добавляют 0,1 г раствора йодида калия. Колбу закрывают пробкой, встряхивают, оставляют на 10 минут, после чего к содержимому колбы добавляют 0,01 н. раствор тиосульфата натрия (индикатор - раствор крахмала, 5 капель). С другой стороны, использованием 20 мл холостой испытуемой жидкости воспроизведена та же методика. Считают, что образцы прошли испытание, если разница в израсходованном растворе 0,01 н. перманганата калия составляет 1 мл или меньше, и не прошли испытания, если эта разница более 1 мл. Как видно из табл. 3, смола № 7, содержащая сорбит в качестве зародышей кристаллизации, не проходит испытания. С другой стороны, разница в расходе перманганата калия в случае смол № 1-6 и № 8 составляет 1 мл или меньше, т.е. эти смолы отв. стандарту. ІІІ) Выявление веществ, поглощающих ультрафиолетовые лучи Стандарт допуска при проведении анализа для каждой испытуемой жидкости методом определения поглощения, в котором для контраста используют холостую испытуемую жидкость, составляет 0,08 или ниже в пересчете на поглощение при длинах волн 220 (включительно)- 241 им (исключая) или 0,05 или меньше в пересчете на поглощение при длинах волн 241-350 нм (включая обе волны). Как видно из табл. 3, смолы № 1-6 и № 8 отв. испытанию на выявление веществ, поглощающих ультрафиолетовые лучи. Таблица 3 Тест на вымывание для различных пластиковых смол Вид анализа Смола № Аммоний и т.д. в сравнении со сравнительной жидкостью Ссылоч.величина Не глубокая №1 №2 №3 №4 №5 №6 №7 №8 Не глубокая Не глубокая Не глубокая Не глубокая Не глубокая Не глубокая Глубокая Не глубокая В-ва, восстанавливающне перманганат калия Разница от холостого 1 мл -0,4 +0,03 -0,02 -0,17 -0,33 -0,2 -1,5 -3,0 Пример 3 Тест на вымывание (2) Смолу № 4 (толщина примерно 0,5 мм, площадь поверхности 1200 см2), полученную в примере 1, размельчают, заливают 400 мл дистиллированной воды и нагревают 1 час в автоклаве при 121°С. Полученный в результате экстракт досуха под азотом примерно при 60°С и получают в результате 4,3 мг сухого твердого образца. Для полученного сухого твердого образца получен инфракрасный спектр поглощения (ИК), осуществлена высокоэффективная жидкостная хроматография (ВЭЖХ) и газовая хроматография (ГХ) с целью определения возможности выбывания добавок. Условия проведения ВЭЖХ и ГХ были следующими: Уф-опектр поглощения 220241240 нм 350 нм 0,08 0,05 0,017 0,027 0,038 0,048 0,045 0,027 0,260 0,07 0,015 0,013 0,005 0,007 0,008 0,004 0,082 0,009 Оценка Отв. Отв. Отв. Отв. Отв. Отв. Не отв. Отв. ВЭЖХ - длина волны 284 нм (ИК), колонка Шодекс GРС К-802 х 2. ГХ - детектор ЦИД, Силикон 0V-12%, Хромосорб W(AW - DМСS), меш 8Л - 100, 2 м х 3 мм в диаметре, стеклянная колонка. В результате в ИК-спектре наблюдалось поглощение при 3300-3500 см-1, примерно при 1600 см-1, 1230 см-1 и 1000 см-1. Сделан вывод о принадлежности такого поглощения базовому материалу смолы. Никакого поглощения, связанного с добавками, не наблюдалось. В ВЭЖХ никаких пиков, соответствующих добавкам, не наблюдалось как при Уф детектировании, так и при ИК детектировании. Кроме того, никаких заметных пиках в ГХ не наблюдалось. Поскольку предел обнаружения для добавок ИК168 и ИРН в ВЭЖХ (УФ) составляет 0,1 млн-1 или меньше, подтверждено, что 10 41268 фтальамид/. Омнипак 240 - это препарат, содержащий в качестве активного компонента 240 мг1 /мл йогексола. Лист полипропиленовой смолы (толщина 0,5 мм) состава, соответствующего смоле № 4, нарезают на кусочки размером 5х0,5 см. Жидкую контрастную среду добавляют в количестве 200 мл на 600 см2 площади поверхности. Полученную смесь нагревают 1 час в автоклаве при 121°С. Полученный в результате раствор используют в качестве образца для проведения нижеприведенных исследований. Невооруженным глазом оценивают внешний вид раствора, определяют также его рН согласно определению рН общими методами анализа, рекомендованными Фармакопией Японии. Отношение осмотического давления определяют согласно определению осмотического давления общими методами анализа, рекомендованными Фармакопией Японии. Уф-поглощение определяют в растворе, приготовленным добавлением к 1 мл образца воды до 500 мл с последующим добавлением к 1 мл полученной жидкой смеси воды до 100 мл, согласно определению поглощения общими методами анализа, рекомендованными Фармакопией Японии. Определение йода и йодидов осуществляют следующим образом. Берут образец в объеме, соответствующем 1 г контрастной среды, и к этому количеству добавляют 4 мл воды с последующим добавлением к полученной смеси 1 мл разбавленной соляной кислоты. Полученную смесь оставляют на 10 минут с периодическим встряхиванием, затем добавляют 5 мл хлороформа, образовавшуюся смесь тщательно встряхивают и оставляют отстаиваться. Слой хлороформа остается прозрачным. Затем к приготовленной смеси добавляют 1 мл раствора нитрита натрия (0,02 г/мл) и встряхивают. После отстаивания полученной смеси слой хлороформа отделяют. Использованием в качестве контроля слой хлороформа, обработанный вышеприведенным способом, но только с применением 4 мл воды, определяют поглощение дисперсии при длине волны 510 нм согласно определению поглощения общими методами анализа, рекомендованными Фармакопией Японии. В результате найдено, что поглощение не превышает поглощения сравнительным раствором (табл. 5). Сравнительный раствор получают следующим образом. Аккуратно взвешивают 0,131 г йодида калия и для его растворения добавляют воду точно до 1000 мл. Отмеряют точно 2 мл приготовленного раствора и разбавляют 3 мл воды и 1 мл разбавленной соляной кислоты. Последующая обработка та же, что и выше. Вышеприведенными результатами показано, что смола № 4 не влияет на стабильность контрастной среды. указанные присадки вымываются из смолы самое большее в количестве 0,1 млн-1. Пример 4 Тест на прозрачность для пластиковых смол Полипропиленовые смолы для различных пластиковых смол, указанных втабл. 4, формуют по отдельности в пластинки толщиной 2 мм, которые используют в качестве образцов. Прозрачность пластинок оценивают невооруженным глазом. Известно, что полипропилен является в целом непрозрачным материалом, но его прозрачность может быть улучшена добавлением в него зародышей кристаллизации и/или аналогичных средств. Соответственно пластинка № 7, характеризующаяся наибольшей прозрачностью, получает оценку 100 среди различных пластинок. По такой шкале, чем больше цифровое значение, тем выше прозрачность. Определение прозрачности проведено как на воздухе, так и в дистиллированной воде. Таблица 4 Прозрачность смол Смола № На воздухе №1 №2 №3 №4 №5 №6 №8 14 29 45 71 83 100 38 В дистиллированной воде 14 29 57 78 71 100 42 Из вышеприведенных результатов очевидно, что если к смоле № 2 добавить зародыши кристаллизации NA-II ("NA-IIVY") с получением таких смолистых материалов, как смолы № 3, 4 и 5, прозрачность значительно улучшается, о чем свидетельствуют оценки по меньшей мере 45 (на воздухе) и по меньшей мере 57 (в дистиллированной воде). Таким образом со всей определенностью показано, что применение смол № 3-5, не говоря уж о смоле № 6, для изготовления контейнеров для лекарств, не будет мешать осмотру невооруженным глазом содержимого контейнера. Пример 5 Изучение взаимодействия между лекарством и смолой (1) Действие на стабильность лекарства Взяв за образец лекарства "Омнипак" (фирменное наименование), прежде всего проведены исследования взаимодействия между лекарством и смолой. Омнипак - это контрастная среда, содержащая в качестве активного компонента йогексол - /(±)-N,N'-бис(2,3-дигидроксипропил)-5-/N-(2,3дигидроксипропил)ацетамид/-2,4,6-трийодоизо 11 41268 Таблица 5 Взаимодействие между йодсодержащей контрастной средойа) и смолой № 4 Вид анализа Внешний вид рН Отношение осмотического давл. УФ-поглощение Йод и Йодиды Содержание (%) Образец Холостой Смола № 4 Бесцветный прозрачный раствор Бесцветный прозрачный раствор 7,24 7,25 2,2 2,2 ах: 245-246 нм Йод: не обнаруживается Йодид: 27,4 млн-1 100 ах: 245-246 нм Йод: не обнаруживается Йодид: 27,4 млн-1 100 а) Йодсодержащей контрастной средой является контрастная среда, содержащая в качестве активного компонента йогексол. Пример 6 Взаимодействие между лекарством и смолой (2) Действие на стабильность лекарства В данном испытании в качестве раствора лекарства использована "Трансамин S инъекция" (фирменное название). Трансамин S инъекция представляет собой инъекцию, содержащую транксамовую кислоту /транс-4-аминометилциклогексанкарбоновую кислоту/ (1 г/10 мл, 250 мг/2,5 мл). Лист полипропиленовой смолы (толщина 0,5 мм) для пластиковых шприцов нарезают на кусочки размером 5х0,5 см. Добавляют Трансамин S инъекцию в количестве 200 мл на 600 см2 площади поверхности. Приготовленную смесь нагревают 1 час в автоклаве при 121°С. Полученный в результате раствор используют в качестве образца для проведения нижеприведенных исследований (табл. 6). Внешний вид раствора оценивают невооруженным глазом, его рН определяют согласно определению рН общими методами анализа, рекомендованными Фармакопией Японии. Отношение осмотического давления определяют согласно определению осмотического давления общими методами анализа, рекомендованными Фармакопией Японии. Содержание транксамовой кислоты определяют титрованием формалином нижеприведенным способом. Точно отвешивают 10 мг образца, разбавляют 50 мл воды и 3 мл нейтрализованного формалина. Полученную смесь подвергают потенциометричеокому титрованию 1 н. раствором гидроксила натрия. Аналогичным образом проводят холостой опыт для коррекции значений титрования. В данном титровании 1 мл 1 н раствора гидроксида натрия соответствует 157,21 мг C8H15NO3. Применяемый нейтрализованный формалин получают добавлением 0,1 н раствора гидроксида натрия к формалину (37%) с установлением его рН 7,5. В результате никакой разницы от холостого опыта не наблюдалось во всех проведенных анализах: внешний вид, рН, отношение осмотического давления и содержание лекарства. Соответственно, сделан вывод о том, что смола № 4 не влияет на качество препарата транксамовой кислоты. Таблица 6 Взаимодействие между транксамовой кислотой и смолой №4 Образец Бесцветный прозрачный раствор Бесцветный прозрачный раствор рН 7,61 7,61 Отношение осмотического давления 2,3 2,3 Содержание (%) 100 100 Вид анализа Пример 7 Взаимодействие между лекарством и смолой (2) Долговечность Изучено действие раствора контрастной среды, содержащей 300 мг1 /мл йогексола, на физико-химические свойства полипропиленовой смолы. Лист полипропиленовой смолы (толщина 0,5 мм), состав которой соответствует смоле № 4, нарезают на кусочки размером 5х0,5 см (площадь поверхности 600 см2). Полученный образец погружают в 200 мл дистиллированной воды или рас твора контрастной среды и выдерживают 1 месяц при 60°С. После этого определяют физикохимические свойства образца, указанные в табл. 7. В той же табл. 7 приведены результаты испытаний, проведенных после выдерживания образца 1 месяц при 60°С на воздухе. В результате со всей определенностью доказано, что физико-химические свойства смолы № 4 не меняются даже при длительном контактировании смолы с водой или раствором лекарства, т.е. смола характеризуется прекрасной долговечностью. 12 41268 Таблица 7 Вид испытаний Метод испытаний Предел текучести АSТМ D-12/38 (кг/см2) Удлинение АSТМ D-638 (%) Прочность на изгиб АSТМ D-790 (кг/см2) Модуль упругости при ASTM D-790 (кг/см2) изгибе Ударная вязкость 23°С Согласно J1,S К-6718 по Дюпону -10°С (кг×см/2" Æ) Ударная вязкость 23°С АSТМ D-256 по Изоду -10°С (кг×см/см ) Твердость по РокАSТМ D-785(R) веллу Температура тепловой ASTM D-523(°С) деформации Блеск АSТМ D-523 (%) Помутнение (%) Вначале 339 709 421 Жидкость для погружения Дистиллированная Раствор контрастВоздух вода ной среды 353 349 348 486 489 570 472 468 453 13700 15600 15700 15400 43-43 1,5 3,6 1,8 38-39 1,5 3,7 1,8 38-40 1,5 4 1,8 36-39 1,5 3,7 1,8 102 106 106 106 105 110 107 109 100 38 98 43 97 42 99 43 Пример 8 Долговечность корпуса шприца Препараты настоящего изобретения, как предполагается, имеют вид корпусов шприцов или контейнеров, заполненных раствором лекарства. В случае их поломки в ходе хранения раствор лекарства вытекает. Таким образом, такие корпуса шприцов и контейнеры должны характеризоваться достаточной долговечностью, в связи с этим проведен тест на долговечность для корпусов шприцов (формованное изделие) в жестких условиях. (1) Вид испытаний Проведены испытания на изгиб, сжатие, действие давления, определение ударной прочности с помощью падающего груза и действие света (все испытания проведены согласно методам испытаний пластмасс, рекомендованных JIS). (2) Жесткость условий Условия действия температуры и света характеризуются 70°С в течение 10 дней и 5°С в течение 3 месяцев и 1800000 люкс-ч соответственно. Жесткие условия реализовывались как для находящихся в автоклаве корпусов шприцов, так для находящихся вне автоклава корпусов шприцов. (3) Подготовка образцов Действие как температуры, так и света осуществлялось в состоянии, при котором раствор контрастной среды, содержащий 300 мг1/мл йогексола, загружался в количестве 102 мл. Что касается корпусов шприцов, подвергаемых температурному воздействию, то испытания проводились после выдерживания корпусов, по меньшей мере, 40 часов при 25°С и 50% ОВ после воздействия на них температуры. (4) Результаты испытаний В результате испытаний показано, что корпуса шприцов, изготовленных из смолы № 4, не меняются при их испытании на изгиб, сжатие, действие давления, определении ударной прочности с помощью падающего груза и действие света даже в таких условиях температурного воздействия и действия света, которые считаются значительно более жесткими по сравнению с обычными условиями их хранения, т.е. корпуса шприцов отличаются прекрасной долговечностью (табл. 7). Пример 9 Долгосрочная стабильность препаратов, содержащих контрастную среду Изготовляют препарат в виде шприца, с раствором контрастной среды, содержащей 240 мг1 /мл йогекоола, в количестве 100 мл и препарат выдерживают 6 месяцев при 40°С и 75% ОВ. Анализ свойств, внешнего вида, рН, чистоты, нерастворимых твердых веществ и пирогенов, асептические испытания и определение содержания проведены в начале хранения и спустя 1 месяц, 2 месяца, 3 месяца и 6 месяцев от начала хранения согласно методам анализа, приведенных в пересмотренном руководстве одиннадцатого совещания фармакологов Японии. В результате, как очевидно из табл. 8, препарат изобретения не показал заметных отклонений даже при хранении в течение 6 месяцев в жестких условиях, т.е. препарат отличается стабильностью. Пример 10 Клинические испытания Использованием препарата в виде шприца настоящего изобретения (изготовлен из смолы № 4) с загруженным в него в качестве раствора лекарства контрастной средой проведены клинические испытания с целью выявления эффективности, стабильности и применимости препарата. (Метод испытания) Препараты в виде шприцов, заполненных контрастной средой, содержащей йогексол в количествах 240 мг1 /мл (100 мл) или 300 мг1 /мл (50, 100 мл), по отдельности присоединяют к автоматическому инъектору. Растворы лекарства по отдельности вводят в дозах 40-100 мл с высокой или низкой скоростью в вену тыльной стороны кисти, подъема стопы или локлевой области с помощью автоматического инъектора (производства Немото Киоринто К.К.). (Результаты испытаний) (1) Эффективность По существу во всех 256 случаев испытаний, проведенных в 16 лечебных учреждениях, за исключением нескольких случаев, в которых вопрос эффективности затруднялся неисправностью обо 13 41268 рудования и т.п., удавалось получить изображения, отличающиеся высокой контрастностью и большой диагностической значимости. Таким образом, препараты настоящего изобретения с точки зрения получения изображения идентичны хранящимся в сосудах препаратам. (2) Стабильность Что касается побочных эффектов, то в 7 случаев из 256 отмечалась тошнота, рвота, чихание, прилив крови к лицу, зуд и т.п. Кроме того, только в 1-2% всех случаев наблюдались легкая чувствительность к теплу и боли. Побочные эффекты и токсичность, которые можно было рассматривать, как вызванные фактом хранения лекарства в шприце (например, гарантией того, что были вымыты компоненты смолы или добавки, к смоле, побочные эффекты и токсичность, обусловленные растворенным веществом), не обнаружены вовсе. Соответственно, препараты настоящего изобретения не создали никаких проблем в 97% случаев их применения, т.е. их можно считать идентичными обычным хранящимся в сосудах препаратам. (3) Практичность В 251 случае из 256 результаты подтверждают то, что препараты настоящего изобретения превосходят с точки зрения простоты и санитарии при их использовании обычные хранящиеся в сосудах препараты. Результаты оформлены в виде отзывов практикующих докторов после использования препаратов. Например, согласно результатам 105 собранных отзывов, в 100 из них (95%) признается, что препараты настоящего изобретения отличаются большой простотой (иные отзывы объясняются неопытностью в обращении с оборудованием). В то же время с точки зрения санитарии в 101 отзывах из 105 (96%) признается, что препараты настоящего изобретения улучшены в санитарном отношении. Согласно замечаниям практикующих врачей, большая простота и прекрасная санитария при использовании препаратов выражается в следующем. Препараты в виде шприца настоящего изобретения, как признано, обладают следующими преимуществами. І) Отсутствует потенциальная проблема бактериального загрязнения и смешивания с чужеродными веществами. ІІ) Сберегается труд при трудоемких операциях переноса раствора лекарства и т.п. с сокращением тем самым времени, необходимого для таких операций. В результате время инъекции контрастной среды остается постоянным, что позволяет легко планировать проведение анализа. ІІІ) Ошибка в дозировке, виде лекарства и т.п., случающейся при приготовлении раствора лекарства, можно избежать (концентрация лекарства и препарата подтверждается этикой на препарате в виде шприца), при этом уменьшаются отходы (сосуды). IV) Препараты в виде шприца могут быть установлены на автоматическом инъекторе, и изображение остается устойчивым даже при использовании тонкой иглы. V) Препарат в виде шприца лишен недостатка потери раствора лекарства при его переносе. Из вышеприведенных результатов можно сделать вывод о том, что препараты в виде шприца настоящего изобретения обладают многими прекрасными достоинствами с точки зрения практичности (см. выше) по сравнению с обычными препаратами в сосудах. Таким образом, могут быть подтверждены отличительные признаки препаратов в виде шприца настоящего изобретения. Пример 11 Препарат в виде шприца, заполненного лекарством, получен литьевым формованием части смолы, приготовленной в примере 1, и заполнением готовой формовки масляным препаратом следующего состава. Димеркапрол 100 мг Бензилбензоат 2 мг Арахисовое масло до 1 мл Пример 12 Препарат в виде шприца, заполненного лекарством, получен литьевым формованием части смолы, приготовленной в примере 1, и заполнением готовой формовки жировым препаратом следующего состава. Соевое масло 100 мг Лецитин желтка 10 мг Глицерин 25 мг Вода для инъекций до 1 мл Промышленное применение Согласно настоящему изобретению даются содержащие лекарство препараты, характеризующиеся прекрасной прозрачностью, отсутствием вымывания добавок к смоле в раствор загруженного в них лекарства даже при длительном хранении в них раствора лекарства, т.е. высокой безопасностью. Подобные препараты особенно полезны в виде шприцов, заполненных раствором лекарства. 14 41268 Таблица 8 Вид испытаний Свойства: Вначале 1 месяц 2 месяца 3 месяца 6 месяцев Внешний вид Бесцветный прозрачный раствор Бесцветный прозрачный раствор Бесцветный прозрачный раствор Бесцветный прозрачный раствор Бесцветный прозрачный раствор Осмотическое отношение1) 1,84-1,89 1,78-1,92 1,73-1,87 1,84-1,88 1,77-1,87 Идентичность (1) Йод Образование пурпурных паров Образование пурпурных паров Образование пурпурных паров Образование пурпурных паров Образование пурпурных паров 245-246 245-246 245-246 245-246 7,23-7,38 7,21-7,43 7,15-7,32 7,18-7,3 0,175-0,190 0,175-0,183 0,173-0,181 0,172-0,198 бесцв. 5,4-19,5 бесцв. 7,1-16,9 бесцв. 8,3-13,5 бесцв. 11,9-19,1 Асептичен Отв. Отв. Отв. Отв. Отрицательный 99,0-101,4 99,2-100,9 98,5-101,4 99,1-101,5 (2) УФ-спектр 245-246 поглощения (нм) pH1) 7,34-7,42 Анализ на чистоту: (1) Ароматические первич. 0,181-0,189 амины1) 2) Йод и йодид Йод бесцв. Йодид1) 0,0-7,0 (млн.-1) Анализ на Асептичен асептичность Нераств. чужеОтв. родные в-ва Алализ на пиОтрицательный рогены Содержание (% от номин. 99,0-101,4 кол-ва) Примечание 1) Анализ повторен трижды, и определенные величины указаны по разбросу минимальных величин и максимальных величин в трех определениях. __________________________________________________________ ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 __________________________________________________________ Підписано до друку ________ 2002 р. Формат 60х84 1/8. Обсяг ______ обл.-вид. арк. Тираж 50 прим. Зам._______ ____________________________________________________________ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22 ___________________________________________________________ 15
ДивитисяДодаткова інформація
Назва патенту англійськоюClear syringe
Автори англійськоюMIWA AKIRA, KIKUCHI MASAHIKO, ABE MASARU, YOKOTE SACHIO
Назва патенту російськоюПрозрачный шприц
Автори російськоюМива Акира, Кикути Масахико, Абе Масару, Йокоте Сатио
МПК / Мітки
МПК: A61M 5/00, A61L 31/08
Код посилання
<a href="https://ua.patents.su/15-41268-prozorijj-shpric.html" target="_blank" rel="follow" title="База патентів України">Прозорий шприц</a>
Попередній патент: Глюкокортикостероїди, спосіб їх отримання (варіанти), фармацевтична композиція
Наступний патент: Фланцевий профіль для надягання на стикові краї елементів вентиляційних коробів
Випадковий патент: Високовольтний трансформаторний модуль