Рекомбінантний химерний білок – антагоніст anth1
Номер патенту: 81908
Опубліковано: 25.02.2008
Автори: Пентон Ролл Гізель, Торрес Руіз Йєні, Лопез Саура Педро, Бланко Гарсез Елізабет, Белло Ріверо Іральдо
Формула / Реферат
1. Рекомбінантний химерний білок, до складу якого входять фрагмент цитокіну, який кодує 60 амінокислот N-кінцевої ділянки людського інтерлейкіну-2, представлений у лістингу послідовностей як Послідовність № 5, і позаклітинна ділянка рецептора цитокіну, що кодує позаклітинну N-кінцеву ділянку альфа-ланцюга рецептора людського γ-інтерферону, представлену у лістингу послідовностей як Послідовність № 7, а також сполучний пептид, представлений у лістингу послідовностей як Послідовність № 6.
2. Рекомбінантний химерний білок за п. 1, який кодується послідовністю нуклеотидів, представленою у лістингу послідовностей як Послідовність № 8, і який є продуктом експресії цієї послідовності.
3. Рекомбінантний химерний білок за будь-яким з пп. 1-2, для продукування якого використовується вектор pHu(AnTHl), хазяїном якого є Е.coli.
4. Рекомбінантний химерний білок за будь-яким з пп. 1-3, який відрізняється тим, що пригнічує біологічну активність інтерлейкіну-2, γ-інтерферону або обох цитокінів разом.
5. Рекомбінантний химерний білок за будь-яким з пп. 1-4, який відрізняється тим, що має рістстимулювальну активність Т-клітин, пригнічує рістстимулювальну активність інтерлейкіну-2, пригнічує антипроліферативну активність γ-інтерферону і пригнічує індукцію HLA-II γ-інтерфероном.
6. Рекомбінантний химерний білок за будь-яким з пп. 1-5, який відрізняється тим, що становить складову частину фармацевтичної композиції для лікування захворювань, опосередкованих дією інтерлейкіну-2, γ-інтерферону або спільною дією обох цитокінів.
7. Рекомбінантний химерний білок за будь-яким з пп. 1-6, який відрізняється тим, що становить складову частину фармацевтичної композиції для лікування автоімунних захворювань, запальних захворювань, відторгнення трансплантатів або інфекцій, що викликаються мікроорганізмами.
8. Рекомбінантний химерний білок за будь-яким із попередніх пунктів, який відрізняється тим, що становить складову частину фармацевтичної композиції для лікування розсіяного склерозу, системного червоного вовчака, важкої псевдопаралітичної міастенії, цукрового діабету, ревматоїдного артриту, запальної хвороби кишечнику, сепсису, псоріазу, атеросклерозу або розладів, що викликаються ішемією, реперфузією.
9. Ланцюг нуклеїнової кислоти, який відрізняється тим, що має послідовність, представлену у лістингу послідовностей як Послідовність № 8, і який кодує рекомбінантний химерний білок за пп. 1-8.
10. Ланцюг нуклеїнової кислоти за п. 9, який відрізняється тим, що являє собою складову частину молекули-носія або вектора для експресії рекомбінантного химерного білка за пп. 1-8.
11. Ланцюг нуклеїнової кислоти за п. 9 або п. 10, який відрізняється тим, що являє собою складову частину фармацевтичної композиції для лікування захворювань, опосередкованих дією інтерлейкіну-2, інтерферону або спільною дією обох цитокінів.
12. Ланцюг нуклеїнової кислоти за будь-яким з пп. 9-11, який відрізняється тим, що являє собою складову частину фармацевтичної композиції для лікування автоімунних захворювань, запальних захворювань або інфекцій, що викликаються мікроорганізмами.
Текст
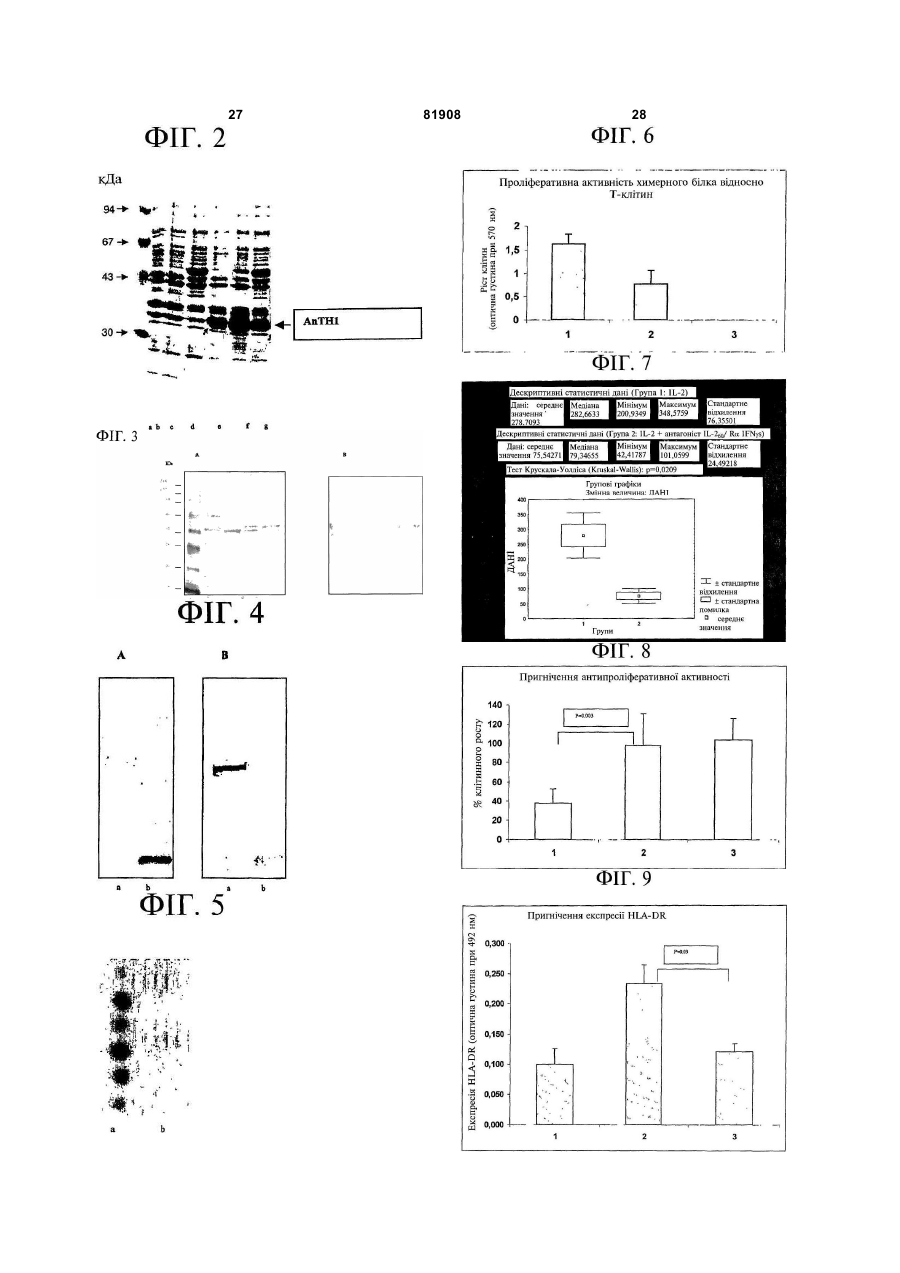
1. Рекомбінантний химерний білок, до складу якого входять фрагмент цитокіну, який кодує 60 амінокислот N-кінцевої ділянки людського інтерлейкіну-2, представлений у лістингу послідовностей як Послідовність № 5, і позаклітинна ділянка рецептора цитокіну, що кодує позаклітинну N-кінцеву ділянку альфа-ланцюга рецептора людського γ-інтерферону, представлену у лістингу послідовностей як Послідовність № 7, а також сполучний пептид, представлений у лістингу послідовностей як Послідовність № 6. 2. Рекомбінантний химерний білок за п. 1, який кодується послідовністю нуклеотидів, представленою у лістингу послідовностей як Послідовність № 8, і який є продуктом експресії цієї послідовності. 3. Рекомбінантний химерний білок за будь-яким з пп. 1-2, для продукування якого використовується вектор pHu(AnTHl), хазяїном якого є Е.coli. 4. Рекомбінантний химерний білок за будь-яким з пп. 1-3, який відрізняється тим, що пригнічує 2 (19) 1 3 81908 4 захворювань, опосередкованих дією інтерлейкінускладову частину фармацевтичної композиції для 2, інтерферону або спільною дією обох цитокінів. лікування автоімунних захворювань, запальних 12. Ланцюг нуклеїнової кислоти за будь-яким з захворювань або інфекцій, що викликаються пп. 9-11, який відрізняється тим, що являє собою мікроорганізмами. Цей винахід має відношення до біологічної науки, біотехнології та медицини, зокрема, до лікарського засобу, що може пригнічувати біологічну активність інтерлейкіну-2 (IL-2) та гамма-інтерферону (IFNg), двох цитокінів, що приймають участь у регулюванні декількох функцій організму, підвищена кількість яких реєструється у патологічному стані. Цим, у свою чергу, запобігається інактивація імунної системи, що ставить під загрозу життя хворих. Продукування цитокінів хелперними Тлімфоцитами (CD4+) та цитотоксичними Тлімфоцитами (CD8+) відбувається за схемами продукування цитокінів, які були позначені як Th1 і Th2. Схема Th1 характеризується продукуванням IL-2, пухлинного некротичного фактора альфа (TNFa) і IFNg, тоді як за схемою Th2 відбувається продукування IL-4, IL-5, IL-6 та інших. Реакція подібного типу відіграє важливу роль у захисті організму, а також є стимулятором різних імунопатологічних реакцій. Існує цілий ряд ситуацій, у яких наслідком запальних та неконтрольованих імунних реакцій є виникнення, розвиток і хронічний перебіг запальних і автоімунних захворювань. Є приклади, що демонструють патологічну роль IL-2 та IFNg у деяких із цих захворювань. Розсіяний склероз являє собою дегенеративне демієлінізуюче автоімунне захворювання. Роль IFNg у цьому автоімунному розладі є дуже чітко визначеною. Так, у клінічних дослідженнях із застосуванням IFNg було показано, що подібна обробка викликає загострення захворювання [Panitch H.S. et al. Exacerbations of multiple sclerosis in patients treated with interferon gamma. Lancet 1, 893-5, 1987]. У хворих, що страждають на цю хворобу, були також зареєстровані високі рівні матричної РНК (мРНК) і білків, що відповідають IL2 та IFNg [Lin J. et al. IL-2, IFN-gamma, and TNFalpha mRNA expression in peripheral blood mononuclear cells in patients with multiple sclerosis. Chung Kuo I Hsueh Kо Hsueh Yuan Hsueh Page 19, 24-8, 1997]. Продукування цих двох цитокінів клітинами хворих дозволяє висунути припущення про їх застосування як маркерів рецидиву розсіяного склерозу [Philippe J. et al. In vitro TNFalpha, IL-2 and IFN-gamma production as markers of relapses in multiple sclerosis. Clin Neurol Neurosurg 98, 286-90, 1996]. Спостерігається також, що IL-2 та IFNg є залученими до активації неспецифічних лімфоцитів, наслідком чого є демієлінізація центральної нервової системи [Martino G. et al. Proinflammatory cytokines regulate antigenindependent T-cell activation by two separate calcium-signaling pathways in multiple sclerosis patients. Ann. Neurol. 43, 340-49, 1998]. Ha пацієнтах, що страждають на цю хворобу і не реагують на лікування IFNb, зараз провадять клінічні випробування із застосуванням антитіла проти IL-2, відомого як даклізумаб (Daclizumab). Червоний вовчак є іншим системним аутоімунним захворюванням, де присутність високих рівнів IL-2 і IFNg асоціюється із загостренням цього захворювання [Viallard J.F. et al. Thl (IL-2, interferon-gamma (IFN-gamma)) and Th2 (IL-10, IL-4) cytokine production by peripheral blood mononuclear cells (PBMC) from patients with systemic lupus erythematosus (SLE). Clin Exp Immunol 115, 189-95, 1999]. З іншого боку, відсутність рецептора IFNg зменшує продукування автоантитіл у тваринних моделях вовчака [Haas С. et al. IFN-gamma receptor deletion prevents autoantibody production and glomerulonephritis in lupus-prone (NZBxNZW)F1 mice. J. Immunol. 160, 3713-18, 1998], а присутність розчинного рецептора IFNg пригнічує виникнення хвороби [Ozmen L. et al. Experimental therapy of systemic lupus erythematosus: the treatment of NZB/W mice with mouse soluble interferon receptor inhibits the onset of glomerulonephritis. Eur. J. Immunol. 25, 612, 1995]. Це було нещодавно перевірено на мишачій моделі вовчака із застосуванням химерного білка, до складу якого входить позаклітинна ділянка IFNg, злита з Fc-фрагментомімуноглобуліну [Lawson B.R. et al. Treatment of murine lupus with cDNA encoding IFN-gammaR/Fc. J. Clin. Invest. 106, 207-15, 2000]. Ефективність молекули цього типу у разі червоного вовчака може, однак, обмежуватись явно вираженою дисфункцією рецептора Fc у пацієнтів, що страждають на червоний вовчак [Frank Μ. Μ. et al. Defective reticuloendothelial system Fc-receptor function in systemic lupus erythematosus. N. Engl. J. Med. 300, 518-23, 1979, Dijstelbloem H.M. et al. Fcgamma receptor polymorphisms in systemic lupus erythematosus: association with disease and in vivo clearance of immune complexes. Arthritis Rheum 43, 2793-800, 2000]. Важка псевдопаралітична міастенія вважається Т-клітинозалежним органоспецифічним автоімунним захворюванням, опосередкованим автоантитілами проти ацетилхолінового рецептора і характеризується м'язовою слабкістю і втомлюваністю. Нещодавно було показано, що IFNg сприяє утворенню автоантитіл проти ацетилхолінового рецептора, у той час як відсутність рецептора IFNy зменшує сприйнятливість тваринних моделей до цього захворювання [Zhang G.X. et al. Mice with IFNgamma receptor deficiency are less susceptible to experimental autoimmune myasthenia gravis. J. Immunol. 162, 3775-81, 1999]. IL-2 та інші цитокіни сприяють, разом з IFNg, розвитку захворювання 5 81908 6 [Zhang G.X. et al. Cytokines and the pathogenesis of www.rileyhospital.org.]. Метою цього дослідження є myasthenia gravis. Muscle Nerve. 20, 543-51, 1997]. запобігання розвитку процесу знищення бетаУ разі діабету типу І (інсулінозалежного) або клітин у дітей з нещодавно встановленим цукрового діабету, бета-клітини підшлункової діагнозом. залози знищуються автоімунним механізмом. Відторгнення трансплантатів є складним Існують in vitro дані відносно того, що IFNy може процесом, у якому важливу роль відіграють бути токсичним для бета-клітин підшлункової клітинно-опосередкований імунітет та циркулюючі залози [Sternesjo J. et al. Effects of prolonged антитіла. У стандартному лікуванні з метою exposure in vitro to interferon gamma and tumor профілактики кризу відторгнення трансплантата necrosis factor-alpha on nitric oxide and insulin застосовуються комбінації лікарських засобів, production of rat pancreatic islets. Autoimmunity 20, наприклад, циклоспорину, рапаміцину, 185-90, 1995, Dunger A. et al. Tumor necrosis factorазатіоприну, стероїдних препаратів тощо. Однак, alpha and interferon-gamma inhibit insulin secretion навіть у разі такого лікування, більш ніж у 50% and cause DNA damage in unweaned-rat islets. хворих, яким були пересаджені нирки, Extent of nitric oxide involvement. Diabetes 45, 183-9, відбувається повільне відторгнення трансплантата 1996, Baldeon M.E. et al. Interferon-gamma впродовж 10 років. Реакція "трансплантат проти independently activates the MHC class I antigen хазяїна" є головною причиною смерті серед processing pathway and diminishes glucose хворих, яким було трансплантовано кістковий responsiveness in pancreatic beta-cell lines. Diabetes мозок. Було показано, що до розвитку цих реакцій, 46, 770-8, 1997]. Однак результати інших які ведуть до відторгнення трансплантатів і ставлять під загрозу життя пацієнтів, що були досліджень показують, що вплив IFNg на клітини піддані трансплантації, свій внесок додають як ILпідшлункової залози, що продукують інсулін, є 2, так і IFNg [Нu H.Z. et ah Kinetics of interferonопосередкованим [Sarventick N. et al. Loss of gamma secretion and its regulatory factors in the pancreatic islet tolerance induced by beta-cell early phase of acute graft-versus-host disease. expression of interferon-gamma. Nature, 346, 844-7, Immunology 988, 379-85, 1999, Nakamura H. et ah 1990]. Його вплив, найімовірніше, активується Serum levels of soluble IL-2 receptor, IL-12, IL-18, через макрофаги для продукування IL-1, TNFa і and IFN-gamma in patients with acute graft-versusоксид азоту, що не мають безпосереднього впливу host disease after allogenic bone marrow на бета-клітини і стимулюють експресію МНС І transplantation. J. Allergy Clin. Immunol. 106, S45-50, (головного комплексу гістосумісності) у бета2000]. клітинах, сприяючи тим самим їх знищенню Ревматоїдний артрит (RA) є хронічним цитотоксичними лімфоцитами [Thomas Η.Ε. et al. системним захворюванням невідомої етіології, що IFN-gamma action on pancreatic beta cells causes характеризується запаленням, гіперплазією class І МИС upregulation but not diabetes. J. Clin. синовіальних оболонок суглобів і руйнуванням Invest, 102, 1249-57, 1998, Thomas HE. et al. Beta уражених суглобів. IL-2, взагалі, вважають cell destruction in the development of autoimmune цитокіном, що викликає запалення і загострює diabetes in the non-obese diabetic (NOD) mouse. стан захворювань типу Th1, наприклад, Diabetes Metab. Res. Rev. 16, 251-61, 2000]. Було автоімунного артриту. Нещодавні дослідження показано також, що відсутність IFNg уповільнює показали, що рівень матричної РНК IL-2 виникнення діабету, хоча і не запобігає йому підвищується на гострій стадії артриту, що [Hultgren В. et al. Genetic absence of gammaвикликається на тваринній моделі колагеном interferon delays but does not prevent diabetes in [Thornton S. et ah Heterogeneous effects of IL-2 on NOD mice. Diabetes 45, 812-7, 1996]. У декількох colagen-induced arthritis. J. Immunol. 165, 1557-63, повідомленнях показано, яким чином інактивація 2000]. З іншого боку, на тваринних моделях було біологічної активності IFNg може застосовуватись зареєстроване загострення хвороби, що для запобігання діабету [Debray-Scahs Μ. et al. пов'язується з підвищенням рівня IFNg [Tellander Prevention of diabetes in NOD mice treated with A.C. et ah Potent adjuvant effect by anti-CD40 in antibody to murine IFN gamma. J. Autoimmun. 4, collagen-induced arthritis. Enhanced disease is 237-48, 1991, Moosmayer D. et al. A bivalent accompanied by increased production of collagen immunoadhesin of the human interferon-gamma type-II reactive IgG2a and IFN-gamma. J. receptor is an effective inhibitor of IFN-gamma Autoimmun. 14, 295-302, 2000]. У тканині activity. I. Interferon Cytokine Res. 15, 1111-5, 1995, синовіальної оболонки суглобів пацієнтів, що Prud'homme G.J. et al. Prevention of autoimmune страждають на ревматоїдний артрит, були значно diabetes by intramuscular gene therapy with a підвищені рівні як IL-2, так і IFNg [Canete J.D. et ah nonviral vector encoding an interferon-gamma Differential Thl/Th2 cytokine patterns in chronic receptor/IgGl fusion protein. Gene Ther. 6, 771-7, arthritis: interferon gamma is highly expressed in 1999]. Було показано також, що IL-2, як synovium of rheumatoid arthritis compared with інактиватор Т-клітин, може докладати свій внесок seronegative spondyloarihropaties. Ann. Rheum. Dis. до цієї реакції по знищенню клітин, що продукують 59, 263-268, 2000]. інсулін. Нещодавно були започатковані клінічні Запальна хвороба кишечнику включає два випробування лікування діабету типу І у розлади шлунково-кишкового тракту: хворобу дітей/підлітків віком від 10 років до 21 року із Крона і неспецифічний виразковий коліт. недавнім діагнозом цього захворювання із Характерною ознакою цих хвороб є хронічне застосуванням антитіла проти IL-2, даклізумабу запалення кишечнику. Хвороба Крона являє собою [Riley Hospital for Children. Project: Prevention of запальний розлад, яким охоплюється внутрішня Diabetes Progression Trial (PDPT). 7 81908 8 поверхня стінки кишечнику і який проникає до його з IL-2, що виділяють вторинні цитокіни, наприклад, найглибших шарів. Це запалення може IL-1, TNFa і IFNb, є причетними до патофізіології віднаходитись у будь-який частині травної системи септичного шоку. (стравохід, шлунок, тонка кишка, товста кишка або Звичайний псоріаз є складним та полігенним задній прохід). Фірма Protein Design Labs шкірним захворюванням, потенційно повідомила про початок клінічних випробувань опосередковане передзапальними цитокінами, що стадії І/ІІ на хворих, що страждають на хворобу продукуються пошкодженими Т-клітинами. Крона (у межах від помірної до тяжкої), із Невідповідна хронічна експресія цих цитокінів застосуванням антитіла проти IFNg (SMARTведе до імунної активації клітин і до пошкодження антитіло проти гамма-інтерферону) [Fremont С.А. тканин. Цей процес характеризується надмірним Protein Design Labs Announces Phase I/II Trial of продукуванням шкірних клітин і утворенням SMART" Anti-Gamma Interferon Antibody in Crohn's кровоносних судин, які, ймовірно, є Disease. Protein Design Labs, Inc. (Nasdaq), January відповідальними за почервоніння і утворення 10, 2001]. Неспецифічний виразковий коліт бляшок, які є частиною цього захворювання. обмежується слизовою оболонкою та підслизовою Встановлено патологічну роль IFNg і IL-2 для основою товстої кишки (товста або пряма кишка). псоріазу. Більшість епідермальних клітин у разі Нещодавно на Щорічному Конгресі Американської звичайного псоріазу продукує IL-2, IFNg і IFNb, які Спілки Гастроентерологів (Annual Congress of the визначаються, як Т-цитотоксичні клітини. У American Association of Gastroenterology) на пацієнтів, що страждають на псоріаз, були мишачій моделі коліту було продемонстровано, виявлені високі рівні IFNg і IL-2, а не IL-4. Це може що зменшення рівнів IFNg у кровотоці є маркером пов'язуватись із дисбалансом популяцій Т-клітин, ремісії [Yawn I. Annual meeting of the American що сприяє тривалій або хронічній імунній активації Gastroenterology Association. May 20-23, 2001. цих клітин [Schaak J.F. et al. T cells involved in Georgia World Congress Center. Atlanta, Georgia.]. psoriasis vulgaris belong to the Thl subset. J. Invest. Септичний шок є результатом дисемінації Dermatol. 102, 145-149, Austin L.M. et al. The мікроорганізмів тяжких інфекційних захворювань із majority of epidermal Τ cells in Psoriasis vulgaris кровотоком. Септичний шок частіше викликається lesions can produce type 1 cytokines, interferonграмнегативними бактеріями, набутими у лікарнях, gamma, interleukin-2, and tumor necrosis factorі є більш поширеним серед хворих з ослабленим alpha, defining Tel (cytotoxic Τ lymphocyte) and TH1 імунітетом та таких, що страждають на хронічні effector populations: a type I differentiation bias is захворювання. У третини хворих септичний шок also measured in circulating blood Τ cells in psoriatic викликають грампозитивні мікроорганізми та patients. J. Invest. Dermatol. 113, 752-759, 1999]. У Candida albicans. У разі септичного шоку, що разі лікування псоріазу із застосуванням викликається як грамнегативними, так і даклізумабу були одержані обнадійливі грампозитивними бактеріями, IFNg і IL-2 сприяють результати [Krueger J.M. et al. Successful in vivo летальності запальних реакцій, у яких вони беруть blockade of CD25 (high-affinity interleukin 2 receptor) участь. IFNg є летальним посередником у on Τ cells by administration of humanized anti-Tac antibody to patients with psoriasis. J. Am. Acad. тваринних моделях септичного шоку [Heremans Η. Dermatol. 43, 448-458, 2000]. Нещодавно et al. Interferon gamma, a mediator of lethal розпочали нове випробування цього лікарського lipopolysaccharide-induced Shwartzman-like shock засобу [Fremont C.A. Protein Design Labs Presents reactions in mice. J. Exp. Med. 171, 1853-69, 1990, Three Humanized Antibodies in Clinical Development Wysocka M. et al. Interleukin-12 is required for for Psoriasis at International Psoriasis Symposium. interferon-gamma production and lethality in June 22, 2000. Protein Design Labs, Inc. (PDL) lipopolysaccharide-induced shock in mice. Eur. J. Nasdaq]. Immunol. 25, 672-676, 1995, Kuschnaroff L.M. et al. Існують інші, менш вивчені захворювання, у Increased mortality and impaired clonal deletion after разі яких застосування антагоніста проти IL-2 та staphylococcal enterotoxin В infection in old mice: relation to cytokines and nitric oxide production. IFNg також може бути корисним; у цьому разі це Scand. J. Immunol. 469-478, 1997]. Як і у разі може бути атеросклероз та ішемія/реперфузія. тваринних моделей інших захворювань, Атеросклероз та посттрансплантаційний відсутність рецептора IFNg у цих тварин робить їх атеросклероз характеризуються розширенням внутрішньої артеріальної оболонки, як результат стійкими до ендотоксинового бактеріальноінфільтрації мононуклеарних лейкоцитів, токсичного шоку [Car B.D. et al. Interferon gamma проліферації клітин гладеньких м'язів судин і receptor deficient mice are resistant to endotoxic накопичення позаклітинного матриксу, а також shock. Exp. Med. 179, 1437-1444, 1994]. Подібним чином, декілька повідомлень показують участь IL-2 присутності IFNg [Ross R. Atherosclerosis-an у розвитку та летальних наслідках септичного inflamatory disease. N. Engl. J. Med. 340, 115-126, шоку [Micusan V.V. et al. Production of human and 1999, Hansson G.K. et al. Immune mechanisms in murine interleukin-2 by toxic shock syndrome toxin-1. atherosclerosis. Arteriosclerosis 9, 567-578, 1989, Innunology 58, 203-208, 1986, Arad G. et al. Libby P. et al. Functions of vascular wall cells related Superantigen antagonist protects against lethal shock to development of transplantation-associated and defines a new domain for T-cell activation. Nat. coronary arteriosclerosis. Transplant. Proc. 21, 3677Med. 6, 378-9, 2000, Stevens D.L. et al. 3684, 1989]. Було показано, що екзогенний IFNg Streptococcal toxic shock syndrome associated with посилює атеросклероз тваринної моделі [Whitman necrotizing fascitis. Annu. Rev. Med. 51, 271-288, S. С. et al. Exogenous interferon-gamma enhances 2000]. Мононуклеарні клітини, культивовані in vitro atherosclerosis in apolypoprotein E-/- mice. Am. J. 9 81908 10 Pathol. 157, 1819-1824, 2000]. З іншого боку, було Chemistry. 267, 9354-9360, 1992, європатент ЕР 0614981 A1]. Потенційне застосування фрагмента показано, що нейтралізація IFNg у сироватці, а імуноглобуліну або його Fc-фрагмента, злитого з також відсутність його гена зменшує ступінь розчинним рецептором IFNg, при червоному розширення внутрішньої оболонки [Gupta S. et al. IFNy potentiates atherosclerosis in ApoE knock-out вовчаку у людей може обмежуватись mice. J. Clin. Invest. 99, 2752-2761, 1997, Nagano H. продемонстрованим порушенням функціонування et al. Interferon γ deficiency prevents coronary рецептора Fc у разі цього автоімунного розладу arteriosclerosis but not myocardial rejection in [Frank Μ. Μ. et al. Defective reticuloendothelial transplanted mouse hearts. J. Clin. Invest. 100, 550system Fc-receptor function in systemic lupus 557, 1997, Raisanen-Sokolowski A. et al. Reduced erythematosus. N. Engl. J. Med. 300, 518-523, 1979]. transplant arteriosclerosis in murine cardiac allografts Інгібітор цього типу є монофункціональним і, як placed in interferon γ knockout recipients. Am. J. наслідок, має менший масштаб дії. Pathol. 152, 359-365, 1998]. Нещодавно було Застосування нейтралізуючих антитіл проти IFNy у мишей зменшує інтенсивність реакції доведено, що IFNg стимулював інтенсивність "трансплантат проти хазяїна" [Mowat A. et al. атеросклерозу за відсутності лейкоцитів [Tellides Antibodies to IFN gamma prevent immunologically G. et al Interferon γ elicits arteriosclerosis in the mediated intestinal damage in murine graft-versusabsence of leukocytes. Nature 403, 207-211, 2000]. host reaction. Immunology 68, 18-23, 1989]. При Ішемія і реперфузія характеризуються вивченні шкірних алотрансплантатів, антитіла перериванням кровотоку на ділянці з подальшим проти IFNg пригнічували відторгнення лише у тому припиненням постачання кисню та поживних речовин; реперфузія характеризується повним або разі, коли трансплантат був несумісним з частковим відновленням кровотоку до тканини, яка антигенами МНС (головний комплекс була ішемічною, що є частим клінічним явищем. гістосумісності) класу II. Це дозволяє припустити, Це може спостерігатись під час гіповолемічного та що IFNg сприяє відторгненню алотрансплантата септичного шоку, інфаркту міокарда, емболії, шляхом індукції антигенів МНС класу II [Rosenberg підвищення тиску у будь-якій анатомічній A. et al. Specific prolongation of MHC class II порожнині, відмороження, трансплантації органу disparate skin allografts by in vivo administration of тощо. Тканинна гіпоксія, у будь-якому разі, anti-IFN gamma monoclonal antibody. J. Immunol. викликає зміну клітинного метаболізму, складні 144, 4648-4650, 1990]. Були одержані також біохімічні та молекулярні модифікації якого стають одноланцюгові антитіла з варіабельною ділянкою все краще зрозумілими. Пошкодження, викликане (scFv) проти людського IFNg, що експресувались реперфузією, викликає у подальшому загибель бактеріями. Була доведена їхня ефективність клітин та порушення функціонування ендотелію щодо нейтралізації біологічної активності унаслідок відновлення кровотворної тканини. мишачого IFNg [Froyen G. et al. Bacterial expression Повідомлялось, що IFNg та IL-2 є посередниками of a single-strand antibody fragment (scFv) that пошкодження, якому піддаються органи унаслідок neutralizes the biological activity of human interferon ішемії та реперфузії [Serrick С. et al. The early g. Mol. Immunol. 30, 805-812, 1993]. У разі release of interleukin-2, tumor necrosis factor-alpha застосування антитіл при лікуванні людей виникає and interferon-gamma after ischemia reperfusion проблема реакцій хазяїна проти імуногенних injury in the lung allograft. Transplantation 58, 1158ділянок цих гетерологічних молекул, а у разі 1162, 1994, March A.R. С. et al. застосування химерних та гуманізованих антитіл Ischemia/Reperfusion-induced IFN-gamma Όρвиникає проблема втрати спорідненості та Regulation: Involvement of IL-12 and IL-18. The специфічності [Merluzzi S. et al. Humanized Journal of Immunology 162, 5506-5510, 1999]. antibodies as potential drugs for therapeutic use. Adv. Декілька авторів наводили опис антагоністів Clin. Path., 4, 77-85, 2000], а також проявів IFNg. Пригнічення противірусної активності токсичності [Clark Μ. et al. Antibodies to IFN gamma людського IFNg його рекомбінантним розчинним prevent immunologically mediated intestinal damage рецептором описується у [ЕР 0393502 А1]. in murine graft-versus-host reaction. Immunology 68, Повідомлялось також про те, що рекомбінантний 18-23, 2000]. розчинний рецептор мишачого IFNg пригнічує Повідомлялось також про інші аналогічні виникнення гломерулонефриту у мишей [Ozmen L. рішення. Пропонувались суміші цитокіну з його et al. Experimental therapy of systemic lupus розчинним рецептором, однак вони мали на меті erythematosus: the treatment of NZB/W mice with підсилення ефекту цитокінів. У цьому випадку mouse soluble interferon-gamma receptor inhibits the цитокін та його рецептор продукуються незалежно onset of glomerulonephritis. Eur. J. Immunol. 25, 6один від одного і пізніше змішуються у одному препараті, як було показано у [WO 94/21282]. 12, 1995]. Були сконструйовані три мишачі IFNg. До Циклоспорин A, FK506 і рапаміцин є їхнього складу входять химерні білки, що сильнодіючими супресорами імунної системи, включають позаклітинну ділянку мишачого зокрема, Т-клітин, і застосовуються для рецептора IFNg і константні ділянки запобігання відторгнення трансплантатів. Перші імуноглобулінових молекул. Ці генно-інженерні два пригнічують трансдукцію сигналу, яка конструкції нейтралізують противірусну активність започатковується рецептором антигену до Т-клітин мишачого IFNg і мають подовжену середню і веде до транскрипції ранніх генів активації. Сюди тривалість життя у крові [Cornelia К. et al. входить транскрипція гена, що кодує IL-2, Construction, purification, and characterization of new необхідний для переходу клітинного циклу від interferon gamma (IFNg) inhibitor protein. J. Вiol. стану покою G0 до перед синтетичного періоду 11 81908 12 G1. Рапаміцин не впливає на ранній синтез future drug therapies for rheumatoid arthritis. цитокінів Т-клітинами, однак він пригнічує реакцію Rheumatology (Oxford) 39 Suppl. 1:36-42, 2000]. цих клітин на IL-2, необхідну для переходу Антитіла, спрямовані проти RaIL-2, застосовують клітинного циклу від періоду G1 до фази синтезу S для запобігання відторгнення ниркових [Waldmann Ί.Α. et al. The IL-2/IL-2 receptor system: a трансплантатів [OlyaeiA.J. et al. Use of basiliximab target for rational immune intervention. Immunology and daclizumab in kidney transplantation. Prog. Today 14, 264-270, 1993]. Рапаміцин забезпечує Transplant. 11, 33-37, 2001]. Обмеження щодо можливість специфічної активації Т-клітин, однак застосування антитіл при довгостроковому запобігає їх клональній експансії шляхом лікуванні описувались вище. втручання до процесу передачі сигналу завдяки Нейтралізація передзапальних цитокінів, бета-ланцюгу рецептора IL-2 (RblL-2) [Woerly G. et наприклад, TNFa [Beutler В. et al. Passive al. Effect of rapamycin on the expression of the IL-2 immunization against cachectin/tumor necrosis factor receptor (CD25). Clin. Exp. Immunol. 103, 322-7, protects mice from lethal effect of endotoxin. Science 1996]. Циклоспорин А значно підвищує 229, 869-871, 1989] або IL-1 [Natanson C. et al. виживаність ниркових алотрансплантатів, у той Selected treatment strategies for septic shock based час як він також зменшує ймовірність виникнення on proposed mechanism of pathogenesis. Ann. автоімунних захворювань. Застосування цих Intern. Med. 120, 771-83, 1994], зменшувала рівень імуносупресорів обмежується з причини їхніх смертності унаслідок сепсису у декількох токсичних ефектів, а саме шлунково-кишкових тваринних моделей. Однак у клінічних ускладнень, гіпертрофії ясен і, особливо, випробуваннях із застосуванням антагоністів IL-1 дозозалежної нефротоксичності та гіпертензії (антагоніст рецептора IL-1) [Fischer C.J. et al. [Hortelano S. et al. Potentiation by nitric oxide of Recombinant human interleukin-1 receptor antagonist cyclosporin A and FK506-syduced apoptosis in renal in the treatment of patients with sepsis syndrome: proximal tubule cells. J. Am. Soc. Nephrol. 11, 2315results from randomized, double-blind, placebo2323, 2000, Tsimaratos M. et al. Kidney function in controlled trial. JAMA 271, 1836-1843, 1994] та cyclosporine-treated paediatric pulmonary transplant TNFa (рекомбінантний химерний білок: розчинний recipients. Transplantation 69, 2055-9, 2000]. рецептор TNF/Fc) [Fischer C.J. et al. Treatment of Моноклональні антитіла, що блокують septic shock with tumor necrosis factor receptor. Fc взаємодію IL-2 з його рецептором, застосовували fusion protein. N. Engl. J. Med. 334, 1697-1702, на тваринних моделях для пригнічення реакції 1996] вони не лише не викликали поліпшень, але "трансплантат проти хазяїна" і відторгнення також підвищили рівень смертності унаслідок алотрансплантатів. Ці антитіла застосовувались деактивації імунної системи. Управління із також на гризунах для пригнічення автоімунних санітарного нагляду за харчовими продуктами і розладів. У клінічних випробуваннях антитіла медикаментами (США) схвалило два антагоністи проти альфа-ланцюга рецептора IL-2 (RaIL-2) TNFa [Lipsky P. E. et al. Infliximab and Methotrexate поліпшували перебіг реакції "трансплантат проти in the Treatment of Rheumatoid Arthritis. N. Engl. J. хазяїна", що не піддавалась лікуванню Med., 343, 1594-1602, 2000], які продемонстрували стероїдними препаратами. Ці зусилля, однак, є сприятливі ефекти при лікуванні ревматоїдного обмеженими з причини антигенності цих антитіл. артриту. Одним з них є антитіло проти субодиниці Було встановлено, що одноланцюгові антитіла рецептора TNFa (інфліксимаб (Infliximab)). варіабельної ділянки пригнічують зв'язування IL-2 Нейтралізація TNFa поза певні межі може із субодиницею g рецептора IL-2 і впливають на викликати деактивацію імунної системи, як було біологічну активність IL-2, що перевірялась на лінії продемонстровано на моделі з пацюками, що мишачих клітин CTLL-2, як описано у [ЕР 0621338 страждають на ревматоїдний артрит [Colagiovanni А2]. Одержання гуманізованих антитіл поліпшило D.B. et al TNF-alpha blockade by a dimeric TNF type терапію такого типу, однак вони все ще не I receptor molecule selectively inhibits adaptive позбавлені вад, які згадувались вище. У терапії immune responses. Immunopharmacol. такого типу перевірялись також моноклональні Immunotoxicol. 22, 627-651, 2000]. У пацієнтів, які антитіла, кон'юговані з токсинами або мічені одержували інфліксимаб, спостерігалась радіоактивними ізотопами [Waldmann T.A. підвищена частота інфекцій, порівняно з Genetically engineered monoclonal antibodies armed контрольними групами, які не одержували цього with radionuclides. Year Immunol. 7, 205-12, 1993]. препарату (групи, що одержували плацебо) Повідомлялось про застосування токсинів, злитих [Schaible T.F. Long term safety of infliximab. Can. J. з антитілами проти IL-2 або з IL-2 для знищення Gastroenterol. 14 Suppl. C.29C-32C, 2000], а також клітин, що експресують рецептор IL-2 і сприяють поява автоантитіл і розвиток вовчака [Markham A. розвитку патогенних станів, наприклад, у [WO et al. Infliximab: a review of its use in the 92/20701] та у [ЕР 0369316 А2]. Застосування цих management of rheumatoid arthritis. Drugs 59, 1341лікарських препаратів навряд чи можна 1359, 2000]. Етанерцепт (Etanercept) являє собою рекомендувати з причини неспецифічної химерний білок, зв'язаний з розчинним токсичності імунотоксинів [Frankel Α. Ε. et al. рецептором TNFa і Fc-фрагментом IgGl Clinical trials of target toxins. Cancer Biology 6, 307[MorelandL.W. et al. Etanercept therapy in 317, 1995], а також їхньої імуногенності [Chen S-Y. rheumatoid arthritis. A randomized, controlled trial. et al. Design of genetic immunotoxin to eliminate toxin Ann. Intern. Med. 130, 478-486, 1999]. Тимчасове immunogenicity. Gene Therapy 2, 116-123, 1995]. припинення лікування викликає у хворого рецидив; Розробляють антитіла проти IL-2 для лікування таким чином, цей лікарський препарат хвороби не ревматоїдного артриту [Simon L.S. et al. New and лікує. Це означає, що хворого слід лікувати 13 81908 14 (GM-CSF) з IL-3. Проблема з пептидами цього типу впродовж тривалих періодів часу. Хоча впродовж полягає у тому, що вони можуть бути жорсткими і короткострокових досліджень суттєвих негативних негнучкими. Як наслідок, білок не може рухатись ефектів не спостерігалось, тривале лікування для набуття точної конформації, яка б надавала може викликати появу антитіл проти цієї молекули йому можливість відповідного здійснення його [Russel Ε. et al. Patients receiving etanercept may біологічної активності. Таким чином, необхідно develop antibodies that interfere with monoclonal також конструювати та віднаходити пептиди, що antibody laboratory assays. Arthritis Rheum 43, 944можуть зв'язувати дві молекули і одночасно 47, 2000]. У декількох випадках лікування хворих надавати кожній з них можливість для набуття етанерцептом повідомлялось про розвиток відповідної конформації з одержанням біологічно летальної гіпопластичної анемії, а також активної молекули. Приймаючи останнє до уваги, панцитопенії та синдромів демієлінізації [Klippel необхідними є безпечніші, більш ефективні і більш J.H. Biologic Therapy for Rheumatoid Arthritis. N. специфічні імуносупресорні та протизапальні Engl. J. Med., 343, 1640-1, 2000]. лікарські засоби. Важливо, таким чином, одержати До цього часу у клінічних умовах не молекулу з більшою функціональною застосовувався жоден антагоніст IFNy IFNg. різнобічністю, яка пригнічує усі патологічні Вивчались антагоністи багатьох цитокінів із метою активності або функції лікарських препаратів застосування їх для запобігання, полегшення або цілеспрямованої дії, однак, одночасно з цим, може ліквідації запальних і автоімунних реакцій, що надавати можливість здіснення важливих функцій пошкоджують тіло унаслідок тимчасової зміни або для організму із забезпеченням можливості хронічності. Багато з них виявились їхнього тривалого застосування без виникнення неефективними. У деяких випадках антагоніст загрози для життя хворих. Антагоніста, який може обмежується молекулою цитокіну і масштаби його одночасно перешкоджати дії двох цитокінів і дії і активності є обмеженими, оскільки дози запобігати пригніченню імунної системи, поки що антагоніста не можуть підвищуватись з приводу не було створено. його токсичності. У антагоністів, що були здатними Сутністю цього винаходу є рекомбінантний до нейтралізації цитокіну, цей ефект був химерний білок, який називають AnTH1, що екстремальним і викликав деактивацію важливих складається з фрагмента (який включає 60 функцій організму (імунної системи). амінокислот) N-кінцевої ділянки людського IL-2, IL-2 взаємодіє зі своїм RaIL-2. Ця субодиниця злитого, через пептид довжиною у 4 амінокислоти, є здатною до інтерналізації IL-2, що було з N-кінцевою позаклітинною ділянкою альфапродемонстровано для Т- та В-лімфоцитів, і, субодиниці рецептора IFNg, до складу якої входить ймовірно, повторно повертається на поверхню 228 амінокислот. Цей білок має (піддається рециклізації), у той час як інші ланцюги рістстимулювальну активність Т-клітин, він цього рецептора розпадаються після інтерналізації пригнічує рістстимулювальну активність Т-клітин, [HemarA. et al. Endocytosis of interleukin 2 receptors індуковану IL-2, він пригнічує індукування системи in human Τ lymphocytes: distinct intracellular HLA-IΙ (антигени головного комплексу localization and fate of the receptor alpha, beta, and гістосумісності людини) IFNg і він пригнічує gamma chains. J. Cell. Biol. 129, 55-64, 1995]. IFNg антипроліферативну активність IFNg. інтерналізується і розпадається, у той час як його Послідовність ДНК, що відповідає першим 60 рецептор піддається рециклізації [Celada A. et al. амінокислотам N-кінцевої ділянки людського IL-2 Internalization and degradation of receptor-bound та сполучному пептиду (Послідовність №5) і interferon-gamma by murine macrophages. послідовність сполучного пептиду і ДНК, що кодує Demonstration of receptor recycling. J. Immunol. 139, 147-153, 1987]. Характеристики інтерналізації IL-2 228 амінокислот позаклітинної ділянки RaIFNg (Послідовність №7), одержали шляхом зворотної його RaIL-2, а також характеристики інтерналізації транскрипції полі(А)-сайту РНК Jurkat- та RajaIFNg його рецептором, вказують на потенційну клітин, відповідно, і ампліфікували зі рециклізацію принаймні позаклітинної ділянки специфічними праймерами засобами полімеразнорецептора IFNg, яка є складовою частиною ланцюгової реакції (PCR) (дивись приклад 1, химерного антагоніста AnTh1. Наслідком цього є Послідовність №1 і Послідовність №2, подовження присутності цієї молекули у кровотоці Послідовність №3, Послідовність №4). і, таким чином, її впливу. Послідовність ДНК, що відповідає сполучному Наслідком об'єднання або кон'югації двох пептиду (Послідовність №6), сконструювали з цією молекул часто є значне зниження або втрата метою і додали до праймерів, що застосовувались біологічної активності споріднених молекул із для ампліфікації ділянки розчинного рецептора причини конформаційних змін, що відбуваються RaIFNg. або просторового взаємовпливу, що виникає як У цьому винаході наводять також опис наслідок утворення нової молекули [Knusli С. et al. вектора, що застосовувався для продукування за Polyethylene glycol (PEG) modification of допомогою Е.соIі рекомбінантного білка АnТН1, granulocyte-macrophage colony stimulating factor який було названо pHu(AnTH1), що був (GM-CSF) enhances neutrophil priming activity but депонований у Бельгійській Координованій not colony stimulating activity. Br. J. Haematol. 82, Колекції Мікроорганізмів (ВССМ) під номером 654-663, 1992]. Застосовувались певні LMBP 4535 6 травня 2002 року. Цей вектор альтернативні варіанти, як, наприклад, у [патенті одержали за допомогою методу рекомбінантних США №5,073,627], у якому наведено опис ДНК [Sambrook et al. Molecular Cloning - A сполучного пептиду, який з'єднує гранулоцитарноlaboratory Manual, 2 ed., Cold Spring Harbor, New макрофагальний колонієстимулювальний фактор 15 81908 16 York, 1989]. Згаданий вектор модифікували і зараз Цей винахід пропонує новий спосіб він включає відповідний маркер, триптофановий запобігання, втручання та/або ліквідування дій промотор і послідовність, що кодує 60 амінокислот двох цитокінів, що мають патогенні функції у людського IL-2, сполучний пептид і 228 різних захворюваннях. Таким чином, ціль цього винаходу розширюється із набуттям більш амінокислот позаклітинної ділянки RaIFNg конкретної форми. Застосування химерного білка, (Послідовність №8). Одержаний вектор кінцевої що може нейтралізувати або впливати на системи конструкції називають рНu(АnТН1), (дивись передачі сигналів двох цитокінів у однакових приклад 2, Фіг.1). патологічних ситуаціях, надає можливість У цьому винаході наводять також опис штаму розширення шляхів впливу і, таким чином, Е.соlі, трансформованого вектором pHu(AnTH1). підвищення ефективності. Наявність певної Вектор pHu(AnTH1) було застосовано для рістстимулювальної активності Т-клітин виключає трансформування штаму Е.соlі W3110P3. Штам небажану інактивацію імунної системи, що надає Е.соlі W3110P3, що містить вектор pHu(AnTH1), можливість більш тривалого застосування культивували і індукували для експресії пацієнтами та для лікування нозологічніх одиниць, рекомбінантного химерного білка АnТН1. Згаданий які потребують цього. Таким чином, цей лікарський штам забезпечує високий ступінь експресії білка препарат є більш безпечним і більш ефективним. (дивись приклад 4). Цей білок може Ціль цього винаходу полягає у створенні гетероекспресуватись іншими клітинами-хазяями бівалентного антагоніста, що може впливати на (клітинами комах, клітинами ссавців і рослинними функції людського IL-2 та IFNg з підсиленням клітинами із застосуванням відповідних векторів). У цьому винаході наводять також опис терапевтичних можливостей молекули і одержання рекомбінантного химерного білка запобіганням негативних реакцій. відповідного ступеня чистоти для визначення його Депонування мікроорганізмів біологічної активності способом, який забезпечує Плазміда pHu(AnTH1) була депонована за одержання препарату біологічно активного білка Будапештським Договором про Захист 80-90% чистоти. Клітинний осад, який одержали Мікроорганізмів до Бельгійської Координованої шляхом культивування штаму після індукції, Колекції Мікроорганізмів (ВССМ) під номером піддавали обробці з метою екстрагування LMBP 4535 6 травня 2002 року. рекомбінантного білка. Подальше послідовне Фіг.1. Генно-інженерна плазміда pHu(AnTH1) промивання осаду здійснювали за допомогою для експресії рекомбінантного химерного білка солюбілізаторів (денатураційних), що AnTH1. забезпечують екстрагування відповідного білка з Фіг.2. Експресія Е.coli химерного білка AnTH1. мінімальною кількістю забруднювальних білків Електрофорез у 12,5% поліакриламідному гелі за Е.coli. Після досягнення за допомогою цих відновних умов, а: стандарт молекулярної маси; b, процедур відповідного ступеня чистоти (80-90%), с, d: негативний контрольний штам через 0год, препарат, що містив білок АnТН1, піддавали 8год і 18год індукування; e, f, g: штам, що містить повторному впорядкуванню. Ця процедура плазміду pHu(AnTH1), за умов індукування через полягає у повільному видаленні денатураційних 0год, 8год, 18год. агентів. Згаданий спосіб ілюструється у прикладі 5. Фіг.3. Присутність рекомбінантного химерного У цьому винаході наводять опис біологічної білка AnTH1 на різних стадіях процесу активності рекомбінантного білка AnTH1. Цей напівочищення. А: Електрофорез у 12,5% білок має рістстимулювальну активність Т-клітин поліакриламідному гелі за відновних умов. На лінії (приклад 7). Він здатен впливати на стимулювання а: стандарт молекулярної маси; b: ферментація; с: проліферації Т-клітин, що індукується людським екстрагування розчином сечовини (8М); d: змішані IL-2 у лінії мишачих клітин CTLL-2 (приклад 8). Він гель-хроматографічні фракції; є: суміш фракцій здатен пригнічувати антипроліферативну після діалізу. В: "Вестерн-блотинг" із застосуванням антисироватки проти AnTH1, активність людського IFNg у лінії клітин Нер-2 розведеної 1:1000 у 1% забуференому фосфатом (приклад 9) і він також пригнічує стимулювання фізіологічному розчині/знежиреному молоці, IFNg експресії HLA-II у лінії клітин COLO 205 виділеної з антитіл проти штаму Е.coli W3110P3. (приклад 10). Людський IL-2, у протилежність до В: На лініях a, b, c, d були застосовані ті самі IFNg, може також впливати на мишачі клітини. зразки і у тому самому порядку, який наведено для Цей рекомбінантний білок може електрофорезу на Фіг.А (стандарт молекулярної застосовуватись для одержання фармацевтичної маси не застосовувався). композиції, придатної для лікування захворювань, Фіг.4. Ідентифікація химерного білка AnTH1 у яких патологічну роль відіграють як IL-2, так і засобами "вестерн-блотингу". Для ідентифікації IFNg. Це можуть бути хвороби автоімунного типу, застосовували антисироватки (А) проти IL-2 та (В) наприклад, розсіяний склероз, системний проти AnTH1. Коефіцієнт розведення у обох червоний вовчак, важка псевдопаралітична випадках становив 1:1000. На лінії а міастенія, інсулінозалежний цукровий діабет, застосовували препарат AnTH1, який було піддано активний хронічний гепатит і блискавичний повторному впорядкуванню після діалізу; на лінії b гепатит; автоімунного/запального типу, наприклад, застосовували IL-2. ревматоїдний артрит і псоріаз, а також Фіг.5. Аналіз зв'язування людського IFNg, відторгнення органів, реакція "трансплантат проти міченого І125, із химерним білком AnTH1 засобами хазяїна" і запальні захворювання, наприклад, "дот-блотингу". Застосували приблизно 1мкл гельсептичний шок, а також атеросклероз. хроматографічних фракцій, елюйованих на 17 81908 18 комплементарної нитки ДНК для перших 60 нітроцелюлозній мембрані. Смуги інкубували з амінокислот людського IL-2, представлені у IFNg, міченим І125 (35мкКі/мкг) за відсутності (лінія Послідовності №1 (праймер 1) і Послідовності №2 а) та у присутності (лінія b) надлишку людського (зворотний праймер 1). Послідовності праймерів, IFNg (у 100 разів більше). що застосовувались для ампліфікації Фіг.6. Рістстимулювальна активність Т-клітин комплементарної нитки ДНК для 228 амінокислот рекомбінантного химерного білка AnTH1. Стовпчик амінокінцевої ділянки людського RaIFNgs, 1: 2,8нг/мл IL-2, стовпчик 2: 1,5мкг/мл AnTH1, представлені у Послідовності №3 (праймер 2) і стовпчик 3: культуральне середовище. Послідовності №4 (зворотний праймер 2). Фіг.7. Пригнічення рекомбінантним химерним Ампліфіковану ДНК, що кодує перші 60 білком AnTH1 рістстимулювальної активності амінокислот людського IL-2 і сполучного пептиду людського IL-2 на лінії мишачих клітин CTLL-2 (Послідовність №5), розщеплювали рестриктазою (результати виражені у міжнародних одиницях Nco I (підкреслена у послідовності праймеру 1, (МОд) IL-2). Послідовність №1). Після цього здійснювали Фіг.8. Результати пригнічення екстрагування фенолом-хлороформом із метою антипроліферативної активності людського IFNg видалення ферменту і буфера. Екстракт рекомбінантним химерним білком AnTH1. осаджували, ресуспендували у відповідному Стовпчик 1: 4МОд/мл IFNg (4нг/мл), стовпчик 2: 4 буфері і зберігали при температурі -70°С. Дивись МОд/мл IFNg+50мкг/мл AnTH1, стовпчик 3: послідовність сполучного пептиду (Послідовність 50мкг/мл AnTH1. №6). Фіг.9. Пригнічення IFNg-індукованої системи Ампліфіковану ДНК, що кодує сполучний HLA II рекомбінантним химерним білком AnTH1. пептид і 231 амінокислоту RaIFNg (Послідовність Стовпчик 1: Вихідний рівень (IFNg=0МОд/мл), №7) додавали до "липкого" кінця за допомогою стовпчик 2: IFNy 500МОд/мл (0,5мкг/мл), стовпчик полімерази Кльонова і очищали, як описувалось 3: IFNg 500МОд/мл+1,5мкг/мл AnTH1. вище. Після цього її розщеплювали рестриктазою Фіг.10. Амінокислотна послідовність ВатН І (підкреслена у послідовності зворотного рекомбінантного химерного білка AnTH1. праймера 2) і очищали, як описувалось вище. Позначені пептиди, визначені засобами масДивись послідовність сполучного пептиду спектрометрії. (Послідовність №6). Приклади Ампліфіковані смуги (Послідовність №5 і Приклад 1 Послідовність №7) змішували у розрахованих Виділення комплементарних ниток ДНК, що пропорціях і у відповідному буфері для кодують перші 60 амінокислот людського IL-2 та забезпечення ампліфікації нової смуги, що містить позаклітинну ділянку a-субодиниці розчинного послідовність ДНК, яка відповідає першим 60 рецептора людського IFNg (RaIFNgs) амінокислотам людського IL-2, зв'язаної з Для виділення людської ДНК, відповідною послідовністю 231 амінокислоти комплементарної кодувальному ланцюга ДНК або позаклітинної ділянки людського RaIFNg і мРНК, Raja- (клітини лінії африканської лімфоми послідовністю, що відповідає сполучному пептиду Бьоркітта, АТСС (Американська колекція типових (Послідовність №6). Нову смугу ампліфікували культур):CCL-86) і Jurkat- (людський гострий Тзасобами полімеразно-ланцюгової реакції. клітинний лейкоз, АТСС:ТІВ-152) клітини Ампліфіковану ДНК (Послідовність №8) культивували у живильному середовищі RPMI очищали, як описувалось вище. Очищену ДНК 1640, доповненому 10% фетальної сироватки розщеплювали рестриктазою Ват НІ і обробляли з великої рогатої худоби у 5л колбі з обережним метою видалення ферменту і буфера, як збовтуванням при температурі 37°С у 5% описувалось. Після цього ДНК знову атмосфері СО2. Екстрагування загальної РНК з розщеплювали рестриктазою Nco І і очищали, як Jurkat- і Raja-клітин здійснювали за методом описувалось. Чомшіски [Chomczyski P. et al. Single-step method Приклад 2 of RNA isolation by acid guanidium thiocyanateГенно-інженерна конструкція для експресії phenol-chloroform extraction. Anal. Biochem. 162, рекомбінантного химерного білка AnTH1 156-9, 1987]. Після цього полі(А)-сайт РНК Вектор експресії містить сильний екстрагували за допомогою комерційної системи триптофановий промотор. Згаданий вектор виділення мРНК (фірма Isolation System Life розщеплювали рестриктазою ВатН І. Після цього Technologies Messagemaker, номер за каталогом здійснювали екстрагування фенолом10551-018). ДНК, комплементарну кодувальному хлороформом із метою видалення ферменту і ланцюгу ДНК або мРНК, що кодує перші 60 буфера. Екстракт осаджували і ресуспендували у амінокислот людського IL-2 і 288 амінокислот відповідному буфері. Після цього його позаклітинної амінокінцевої ділянки людського розщеплювали рестриктазою Nco І. Вектор, RaIFNgs виділяли шляхом зворотної транскрипції і нарешті, відокремлювали на гелі, як описувалось полі(А)-сайт РНК Jurkat- і Raja-клітин, відповідно, вище. Таким чином, вектор містить триптофановий ампліфікували засобами полімеразно-ланцюгової промотор, вільний "липкий" сайт Nco І, вільний реакції. Приблизно 1-2мкг полі(А)-сайту РНК "липкий" сайт ВатН І, термінатор Т4 і ген стійкості піддавали процесингу із застосуванням довільних до ампіциліну. гексамерів. ДНК, що відповідає Послідовності №8, Послідовності олігонуклеотидів (праймерів), лігували до вектора за допомогою лігази фага Т4. що застосовувались для ампліфікації Клітини Е.coli трансформували за допомогою 19 81908 20 згаданої генно-інженерної конструкції. солюбілізують розчином сечовини (приблизно Ідентифікували трансформанти, що містять 150мл, 3мл/хв) на колонці K9/60 (Pharmacia, комплементарний фрагмент ДНК для перших Sweden), заповненій смолою Sephadex G-100, яка амінокислот людського IL-2, а також сполучного була попередньо врівноважена 3 об'ємами 50мМ розчину Трис-НСІ (рН 9) і 4Μ розчину сечовини. пептиду і 231 амінокислоти людського RaIFNgs у Елюювання здійснювали у тому самому буфері. тому самому напрямку, що і триптофановий Фракції, що містили білки, об'єднували і промотор, шляхом здійснення рестрикційного діалізували проти 0,1Μ розчину Трис-НСІ (рН 9). У аналізу за допомогою рестриктаз Nco І і Eco RI. подальшому діаліз продовжували проти Одержану плазміду назвали pHu(AnTH1) (дивись забуференого фосфатом фізіологічного розчину Фіг.1). (PBS) (рН 7,4). (Дивись Фіг.3 і Фіг.4). Приклад 3 Приклад 6 Секвенування Зв'язування гамма-інтерферону з Кінцеву генно-інженерну конструкцію рекомбінантним химерним білком AnTH1 піддавали секвенуванню. Секвенування Один мікролітр (приблизно 1мкг загального здійснювали за протоколом, основу якого білка) рекомбінантного химерного білка AnTH1 становить методика Сангера [Sanger F. et al. DNA після впорядкування наносили на нітроцелюлозні sequencing with chain-terminating inhibitors. Proc. смужки. Смужки інкубували з 10% знежиреного Natl. Acad. Sci. USA 74, 5463-67, 1977]. Було молока впродовж 2год при кімнатній температурі. доведено, що згадана генно-інженерна конструкція Мембрани двічі промивали фізіологічним має під контролем частину генів, що кодують IL-2 розчином, забуференим трис-буфером (TBS) (60 амінокислот, розпочинаючи з амінокінцевої впродовж 5хв. Після промивання смужки групи), і, далі, послідовність нуклеотидів, що кодує інкубували з гамма-інтерфероном, міченим сполучний пептид (Послідовність №6), зв'язану з ділянкою, що кодує 228 амінокислот амінокінця радіоактивним йодом (125I-IFNg, 35мкКі/мкг впродовж 1год при кімнатній температурі) у RaIFNgs. Дивись Послідовність №8. присутності або за відсутності надлишку гаммаПриклад 4 інтерферону, який не був міченим. Після цього Експресія Е.coli рекомбінантного химерного нітроцелюлозні смужки двічі промивали TBS білка AnTH1 впродовж 5хв, потім TBS+0,03% твін 20 впродовж Штамом-хазяїном був штам Escherichia coli 5хв. І, нарешті, смужки експонували на W3110 Р3 (прототроф F—) і плазміда pHu(AnTH1). рентгенівську плівку, зберігали при температурі Для експресії, плазміду вводили до 5мл 70°С впродовж 72год, після чого проявляли. живильного середовища LB (середовище Луріа) з (Дивись Фіг.5). ампіциліном (50мкг/мл) і L-триптофаном Приклад 7 (100мкг/мл) і інкубували при температурі 37°С Рістстимулювальна активність Т-клітин впродовж 6год зі збовтуванням. Цю культуру рекомбінантного химерного білка AnTH1 додавали до 50мл середовища LB і Біологічну активність рекомбінантного встановлювали на струшувач (100об/хв) на 6год химерного білка AnTH1 перевіряли на лінії IL-2при температурі 37°С. Цю культуру додавали до залежних мишачих Т-лімфоцитів. Згадані клітини 500мл живильного середовища М9 (33мМ розчин культивували на живильному середовищі RPMINa2HPO4, 2мМ розчин KН2РО4, 8,5мМ розчин NaCl, 1640, що містило 1мМ розчин пірувату, 2мМ 18мМ розчин NH4CI, 0,1мМ розчин СаСІ2, 1мМ розчин L-глутаміну, 40мМ розчин ГЕПЕС-буфера, розчин MgSO4), збагаченого 0,2% гідролізованого 100Од/мл пеніциліну, 50мкг/мл стрептоміцину, казеїну, 0,4% глюкози, 50мкл/мл ампіциліну, таким 50мкМ розчин 2-меркаптоетанолу і 10% фетальної чином, що початкова оптична густина культури сироватки великої рогатої худоби, доповненої (620нм) дорівнювала 0,3. Після цього впродовж 8МОд/мл людського рекомбінантного інтерлейкіну8год здійснювали інкубування за умов, які були 2 з питомою активністю 1,2´107МОд/мг. Клітини описані вище і, нарешті, клітинний осад збирали шляхом центрифугування (дивись Фіг.2). перед застосуванням тричі промивали, Приклад 5 ресуспендували у повному культуральному Екстрагування, очищення і ренатурація середовищі без IL-2 і інкубували впродовж 1год рекомбінантного химерного білка AnTH1 при температурі 37°С у вологій атмосфері СО2. Клітини гомогенізують за допомогою політрону Після цього клітини промивали, ресуспендували з з концентрацією 0,1г вологої біомаси на мл густиною 4´105клітин/мл і розподіляли на 96буфера ТЕ (10мМ розчин Трис-НСІ, 1мМ розчин лункові планшети (100мкл/лунку), що містили по EDTA (етилендіамінтрифтороцтова кислота, рН 100мкл серійних розведень (1:2) rhIL-2 або зразків 7,2). Цю суспензію піддають ферментативному (рекомбінантного химерного білка AnTH1) у гідролізу за допомогою лізоциму. Осад, який повному живильному середовищі. У цьому одержали на попередній стадії, промивають випробуванні застосовували міжнародний розчинами сечовини різної молярності (від 1Μ до стандарт IL-2010397. Після 36год інкубування при 8М) у 50мМ розчині Трис-буфера (рН 7,2), 1мМ температурі 37°С до кожної лунки додавали 20мкл розчині EDTA. Гомогенізацію здійснюють за (5мг/мл) МТТ (C18H16N5SBr), і планшети інкубували допомогою політрону. Спочатку гомогенізацію впродовж 4год за тих самих умов. На завершення, здійснюють впродовж 1хв, потім процес додавали суміш 10% SDS (додецилсульфат гомогенізації припиняють на 3хв, після чого натрію), 0,1N розчину НСI, 50% ізопропанолу гомогенізацію відновлюють ще на 1хв. Увесь (50мкл/лунку), планшети струшували впродовж процес відбувається при температурі 4°С. Білки 1год при температурі 37°С, і оптичну густину 21 81908 22 1640, збагаченого 10% фетальної сироватки визначали при 570нм за допомогою планшетвеликої рогатої худоби. Клітини інкубували рідера. (Дивись Фіг.6). впродовж 12год при температурі 37°С у термостаті Приклад 8 у 5% атмосфері СО2. Після цього клітини, Пригнічення активності IL-2 щодо культивовані у культуральному середовищі, стимулювання росту Т-клітин рекомбінантним додавали до рекомбінантного химерного білка і химерним білком AnTH1 Біологічну активність IL-2 перевіряли на лінії IFNg у об'ємі 0,1мл, після чого інкубували IL-2-залежних мишачих Т-лімфоцитів. Згадані впродовж 1год при температурі 37°С. Після клітини культивували чином, подібним до інкубування живильне середовище видаляли, і попереднього експерименту. Клітини перед лунки тричі промивали культуральним застосуванням тричі промивали, ресуспендували у середовищем. Після цього до лунок додавали повному культуральному середовищі без IL-2 і 1,2мл аліквоти середовища, і планшети інкубували інкубували впродовж 1год при температурі 37°С у впродовж 48год при температурі 37°С для вологій атмосфері СО2. Після цього клітини індукування антигенів HLA-DR. Лунки промивали промивали, ресуспендували з густиною забуференим фосфатом фізіологічним розчином, і 4x105клітин/мл і розподіляли на 96-лункові клітини фіксували чистим етанолом впродовж 2хв. планшети (100мкл/лунку), що містили по 100мкл Промивання повторювали, і планшети інкубували серійних розведень (1:2) rhIL-2 або зразків (rhILвпродовж 1 год при кімнатній температурі з 2+рекомбінантний химерний білок AnTH1 або мишачим моноклональним антитілом анти-HLAлише рекомбінантний химерний білок AnTH1) у DR, розбавленим забуференим фосфатом повному живильному середовищі. У цьому фізіологічним розчином з 0,5% сироваткового випробуванні застосовували міжнародний альбуміну великої рогатої худоби. Лунки стандарт IL-2010397. Після 36год інкубування при промивали забуференим фосфатом фізіологічним температурі 37°С до кожної лунки додавали 20мкл розчином і інкубували за тих самих умов із (5мг/мл) МТТ (C18H16N5SBr) і планшети інкубували мишачим антитілом анти-IgG, кон'югованим із впродовж 4год за тих самих умов. На завершення, пероксидазою. Промивання повторювали тричі і додавали суміш 10% SDS (додецилсульфат проявляли шляхом додання 100мкл/лунку 0,15% натрію), 0,1N розчину НСI, 50% ізопропанолу Η2O2+5мг/мл о-фенілендіаміну. Реакцію виявляли (50мкл/лунку), після чого планшети струшували за допомогою 50мкл/лунку 2Μ розчину H2SO4 і впродовж 1год при температурі 37°С, і оптичну оптичну густину визначали при 492нм за густину визначали при 570нм за допомогою допомогою планшет-рідера. (Фіг.9). планшет-рідера. Результати були виражені у Приклад 11 одиницях rhIL-2, виходячи з аналізу даних Mac-спектрометричний аналіз стандартної кривої розведення rhIL-2 і серійних Аліквоту (0,5мкг) очищеного білка аналізували розведень зразка. (Дивись Фіг.7). засобами електрофорезу у поліакриламідному гелі Приклад 9 у присутності додецилсульфату натрію і піддавали Пригнічення антипроліферативної активності оборотному забарвленню із застосуванням ZnIFNy рекомбінантним химерним білком AnTH1 імідазолу [Castellanos-Serra L. et al. Detection of Клітини лінії Нер-2 культивували (96-лункові biomolecules in electrophoresis gels with salts of imidazole and zinc II: a decade of research. планшети, 2,5´103клітин/лунку) у живильному Electrophoresis. 2001, 22, 864-7]. Смугу вирізали і середовищі MEM CANE (мінімальне живильне інкубували з розчином (1%) лимонної кислоти середовище із замінними амінокислотами), впродовж 5хв до повного знебарвлення, після чого доповненому 10% фетальної сироватки великої додатково інкубували впродовж 10хв у воді для рогатої худоби. Культури інкубували впродовж видалення надлишку хелатоутворювача. Прозору 24год при температурі 37°С у термостаті з 5% смугу додатково нарізали на маленькі приблизно СО2. Після завершення інкубування живильне 1мм3 кубики, і дегідратували у 90% водному середовище замінювали з доданням зразків, розчині ацетонітрилу з трифтороцтовою кислотою призначених для оцінки, і відповідних контролів. і повністю висушували у вакуумній сушарці. Через 72год інкубування клітини забарвлювали Шматочки гелю повторно гідратували у 20-30мкл 0,5% розчином кристалічного фіолетового 50мМ розчину NH4HCO3, що містив 12,5нг впродовж 2хв, і планшети зчитували за допомогою модифікованого трипсину (чистий для планшет-рідера. (Дивись Фіг.8). секвенування) від фірми Promega (штат Приклад 10 Массачусетс, США). Гідроліз у гелі здійснювали Пригнічення індукування HLAII IFNg шляхом інкубування впродовж ночі при рекомбінантним химерним білком AnTH1 температурі 37°С у термоміксері (фірма Eppendorf, Це випробування на клітинах здійснюють із США). Додатково додавали 20мкл 50мМ розчину застосуванням ELISA (твердофазний NH4HCO3 і додатково інкубували впродовж 45хв. імуноферментний аналіз) за методикою, опис якої Триптичні пептиди екстрагували за допомогою наведено у роботі [Seeling G. et al Development of ZipTips С18 від фірми Millipore (США), які receptor peptide antagonist to human g-interferon and попередньо були активовані і врівноважені за characterization of its ligand-bound conformation рекомендаціями виробника. Для екстрагування using transferred nuclear overhauser effect триптичних пептидів здійснили двадцять циклів spectroscopy. J. Biol. Chem. 270, 9241-9253, 1995]. завантаження. Гідролізат підкислювали Була застосована лінія клітин Colo 205. Клітини мурашиною кислотою, інкубували впродовж 45хв культивували на 96-лункових планшетах при кімнатній температурі, після чого здійснювали (2,5´105клітин/лунку) у 0,1мл середовища RPMI 23 81908 24 зі здійсненням впливу на імунорегуляторні та ще двадцять циклів завантаження. ZipTips запальні механізми. Конструювання химерного екстенсивно промивали 5% розчином мурашиної білка полягає у злитті ліганду (ІL-260) через пептид кислоти; протеолітичні пептиди елюювали 2мкл з 4 амінокислот із позаклітинною ділянкою 60% розчину ацетонітрилу, що містив 1% мурашиної кислоти. рецептора (RalFNg). Подібна комбінація надає Низькоенергетичні мас-спектри визначали за можливість сполучення рекомбінантного допомогою гібридного квадрупольного химерного білка з клітинами, що мають на своїй ортогонального прискорювального тандемного поверхні RaIL-2. Ця субодиниця є присутньою, мас-спектрометра QTOF від фірми Micromass головним чином, у неактивованих Т-клітин та у (Манчестер, Великобританія), спорядженого високоафінного рецептора IL-2 (RabgIL-2) джерелом електророзпилюваного нанопотоку іонів активованих Т-клітин [Smith K.A. The interleukin-2 із застосуванням ефекту Зеемана. Масreceptor. Annu. Rev. Cell. Biol. 5, 397-403, 1989, спектрометр функціонував при температурі Strom T.B. et al. Inerleukin-2 receptor-directed джерела 80°С і з потоком сушильного газу 50л/год. therapies: antibody- or cytokine-based targeting Пептиди розчиняли для одержання приблизної molecules. Annu. Rev. Med. 44, 343-350, 1993]. концентрації 5пмоль/мкл. Вносили 2мкл У разі, коли білок AnTH1 зв'язується з RaIL-2 триптичних пептидів до боросилікатного клітин у стані покою, він може бути нанопотокового наконечника. До згаданого інтерналізованим, у той час як RalFNgs наконечника і до вхідного конуса прикладали залишається у цитоплазмі -за умови виведення напругу у 900В і 35В відповідно. Мас-спектри назовні, і впливає на IFNg, який буде визначали за методом, опис якого наведено у продукуватись при активації клітин. Була описана роботі [Gonzalez L. et al. Differentiating alpha-and взаємодія IFNg цитоплазми із позаклітинною beta-aspartic acids by electrospray ionization and ділянкою мембранного рецептора, наслідком чого low-energy tandem mass spectrometry. Rapid. може бути біологічна активність IFNg [Szente B.E. Commun. Mass. Spectrom. 2000, 14, 2092-210]. et al. Identification of IFN (receptor binding sites for Перший квадруполь застосовували для JAK2 and enhancement of binding by IFNg and its Cвідбирання іона-попередника у межах 4-5Th. Для terminal peptide IFNg (95-133). J. Immunol. 155, одержання фрагментарних іонів у шестигранній 5617-5622, 1995]. Під час хвороби, коли може камері зіткнення застосовували газ зіткнення виникнути необхідність послаблення дії IL-2, що (аргон) під тиском -3´10-2Па. Для зменшення продукується тілом, при доданні білка AnTH1, цей вихідної напруженості іона-попередника більше білок буде зв'язуватись через частину ІL-260 з ніж наполовину, застосовували відповідну енергію альфа-субодиницею високоафінного комплексу зіткнення. Збирання і обробку даних здійснювали (RabgIL-2) активованих клітин, він буде за допомогою системи MassLynx (версія 3.5) від перешкоджати зв'язуванню нативного IL-2, що фірми Micromass. секретується клітинами імунної системи і буде Mac-спектрометричний аналіз з електронперешкоджати його біологічній активності. З стимульованою іонізацією триптичних пептидів, іншого боку, IFNg, який вже був секретований одержаних з білка AnTH1 активованими Т-клітинами, може зв'язуватись частиною RalFNgs химерного білка, що запобігає Послідовності Експериментальне Теоретичне № Z b) Абсолютна помилка c) його зв'язуванню з мембранним рецептором. пептидів а) відношення m/z відношення m/z 11 Таким чином, автоімунна та/або запальна реакція T-Κ33 d) 1 908,81 908,83 3 0,02 40 44 може контролюватись1 на двох різних стадіях, під М-K 2 639,34 639,35 0,01 час активації та у процесі розвитку реакції. 45 F-K50 3 685,33 685,33 1 0,00 Винахід пропонує гетеро-бівалентний 56 H-R66 f) 4 442,87 442,88 3 0,01 химерний білок, який може впливати на біологічну 67 A-K114 5 1781,52 1781,54 3 0,02 активність IL-2 і IFNg. Приймаючи до уваги те, що 101 Q-K114 d), e) 6 807,93 807,95 2 0,02 рекомбінантний химерний білок AnTH1 має також 120 N-R151 f) 7 921,14 921,17 4 0,03 рістстимулювальну активність Т-клітин, можна 166 S-R173 8 506,23 506,23 2 0,00 очікувати менш глибокої інактивації імунної 177 I-K181 9 511,31 511,28 0,03 системи, яка буде 1спонукати до виникнення 190 Q-R220 f) 10 1225,20 1225,23 3 0,03 антагоністичні антицитокіни, що було вже клінічно 221 доведено. V-R227 d) 11 456,74 456,75 2 0,01 228 M-K236 d) 12 535,24 535,25 2 0,01 a) Нумерація послідовностей пептидів відповідає послідовності білка AnTH1, зображеній на Фіг.10. Зарядовий стан окремих пептидів. с) Вказує різницю абсолютної маси між теоретичною і експериментальною молекулярними масами виявлених пептидів. d) Пептиди, секвеновані засобами мас-спектрометричного аналізу з електрон-стимульованою іонізацією. e) Пептид, одержаний шляхом неспецифічного розщеплення трипсину. f) Пептид, що містить вільний цистеїн. b) Переваги запропонованого рішення Цей винахід об'єднує у одній молекулі здатність до втручання до двох сигнальних систем 25 81908 26 27 81908 28 29 81908 30
ДивитисяДодаткова інформація
Назва патенту англійськоюRecombinant chimeric protein - anth1 antagonist
Автори англійськоюBello Rivero Iraldo, Torres Rouis Yeni, Blanco Garsez Elisabeth, Penton Roll Gizel, Lopez Saura Pedro
Назва патенту російськоюРекомбинантный химерный белок - антагонист anth1
Автори російськоюБелло Риверо Иральдо, Торрес Руиз Йени, Бланко Гарсез Элизабет, Пентон Ролл Гизель, Лопез Саура Педро
МПК / Мітки
МПК: C07K 14/55, A61P 29/00, C12N 15/62, C07K 14/715, A61K 38/20
Мітки: антагоніст, білок, рекомбінантний, anth1, химерний
Код посилання
<a href="https://ua.patents.su/15-81908-rekombinantnijj-khimernijj-bilok-antagonist-anth1.html" target="_blank" rel="follow" title="База патентів України">Рекомбінантний химерний білок – антагоніст anth1</a>
Попередній патент: Пристрій для віброізоляції сидіння машиніста і командоапаратів екскаватора
Наступний патент: Пристрій для дистанційного релейно-контактного керування по тролеях
Випадковий патент: Спосіб формування однорядного кишкового шва