Спосіб виготовлення лікарського препарату у формі таблеток на основі міансерину гідрохлориду
Номер патенту: 93232
Опубліковано: 25.01.2011
Автори: ШТЕЙНГАРТ Марк Вольфович, Приходько Роман Миколайович, Дубіна Олег Вячеславович
Формула / Реферат
1. Спосіб виготовлення лікарського препарату у формі таблеток на основі міансерилу гідрохлориду, згідно з яким змішують міансерилу гідрохлорид, кальцію дифосфатдигідрат, крохмаль картопляний, аеросил, додають розчин метилцелюлози, отриману масу зволожують, сушать, гранулюють крізь сито, ще додають решту крохмалю картопляного та аеросилу, а також магнію стеарат, змішують, калібрують крізь сито, пресують таблетки, який відрізняється тим, що змішують 9,68-11,11 мас. % міансерину гідрохлориду, 75,5-77,55 мас. % кальцію дифосфатдигідрату, 60 % від 8,18-8,38 мас.% крохмалю картопляного і 40 % від 1,61-1,85 мас. % аеросилу протягом 10-15 хвилин у швидкісному ротаційному змішувачі зі швидкістю ротора 60-100 об/хв., додаючи 1,80-1,96 мас. % метилцелюлози, попередньо розчиненої у воді і підігрітої до температури 45-55 °С, та зволожуючи масу 15-25 хвилин при швидкості ротора 60-100 обертів/хв., отриману вологу масу висушують до остаточної вологи 2,5-3,0 %, гранулюють крізь сито з діаметром отворів 1-1,5 мм і змішують протягом 15 хвилин з 40 % крохмалю та 60 % аеросилу, що залишились, після додавання 0,97-1,11 мас. % магнію стеарату масу перемішують ще 2-3 хв., перед пресуванням таблетки-ядра отриману масу калібрують крізь сито з діаметром отворів 1 мм, а після пресування наносять на таблетки-ядра плівкове покриття, на основі гідроксипропілметилцелюлози.
2. Лікарський препарат у формі таблеток на основі міансерилу гідрохлориду, одержаний способом за п. 1, що містить міансерину гідрохлорид, кристалічний наповнювач - кальцію дифосфатдигідрат, допоміжні речовини аморфної структури - крохмаль картопляний, метилцелюлозу, аеросил, магнію стеарат, який відрізняється тим, що компоненти взяті у такому співвідношенні, мас. %:
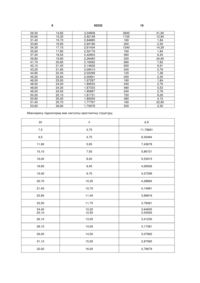
міансерину гідрохлорид 9,68-11,11
кальцію дифосфатдигідрат 75,5-77,55
крохмаль картопляний 8,18-8,38
метилцелюлоза 1,80-1,96
аеросил 1,61-1,85
магнію стеарат 0,97-1,11,
причому плівкове покриття становить 2,2-3,5 % від маси таблетки.
3. Кристалічний склад лікарського препарату за п. 2, який відрізняється тим, що має наступні параметри рентгенівської дифракції при вимірюванні на дифрактометрі ДРОН 3, дисцинтиляційним детектором, мідним антикатодом λ=1,5405 Ǻ, напругою 40 кВ, силою струму 40 мА, при розміщенні θ-θ, діапазоні вимірюваня 5-40о при безперервній реєстрації на папері з уточненням положення шляхом точкової реєстрації з часом вимірювання на етапі 10 с, з приростом перед кожним вимірюванням 0,02о та графітовим монохроматором на відбитому промені:
2Ө
Ө
d,Ǻ
I
I відн.%
7,50
3,75
11,78691
120
1,38
11,60
5,80
7,62843
8680
100,00
15,10
7,55
5,86721
120
1,38
19,00
8,50
4,67000
40
0,98
20,90
10,45
4,25000
2880
33,18
23,40
11,70
3,80152
760
8,76
24,50
12,25
3,63328
80
0,92
26,60
13,30
3,35102
80
0,92
28,20
14,10
3,16442
80
0,92
29,30
14,65
3,04808
3640
41,94
30,60
15,30
2,92148
1120
12,90
31,40
15,70
2,84885
160
1,84
33,80
16,90
2,65186
200
2,30
34,30
17,15
2,61434
1240
14,29
35,60
17,80
2,52179
160
1,84
37,00
18,50
2,42953
560
6,45
39,80
19,90
2,26483
200
24,90
41,70
20,85
2,16592
680
7,83
42,10
21,05
2,14626
600
6,91
43,20
21,60
2,09413
240
2,76
44,80
22,40
2,02299
120
1,38
45,20
22,60
2,00601
200
2,30
46,00
23,00
1,97297
160
1,84
48,00
24,00
1,89533
240
2,76
48,60
24,30
1,87333
480
5,53
49,00
24,50
1,85897
240
2,76
50,20
25,10
1,81731
720
8,29
50,80
25,40
1,80000
360
4,15
51,40
25,70
1,77767
160
22,90
53,60
26,80
1,70978
200
2,30
4. Кристалічний склад за п. 3, який відрізняється тим, що міансерину гідрохлорид має наступні параметри рентгенівської дифракції:
2Ө
Ө
d,Ǻ
7,5
3,75
11,78691
9,5
4,75
9,30464
11,90
5,95
7,43678
15,10
7,55
5,86721
16,00
8,00
5,53915
18,90
9,45
4,69526
19,40
9,70
4,57299
20,70
10,35
4,28864
21,40
10,70
4,14991
22,80
11,40
3,89816
23,50
11,75
3,78361
24,40
12,20
3,64605
25,10
12,55
3,54593
26,10
13,05
3,41230
28,10
14,05
3,17381
29,00
14,50
3,07892
31,10
15,55
2,87565
32,00
16,00
2,79679
32,70
16,35
2,73851
38,80
19,40
2,32086
40,00
20,00
2,25396
45,70
22,85
1,98522
47,80
23,90
1,90279
48,80
24,40
1,86612
50,10
25,05
1,82070
5. Кристалічний склад за п. 3, який відрізняється тим, що міансерину гідрохлорид в таблетках з кальцію дифосфатдигідратом має на 40-80 % в залежності від брегівського кута меншу інтенсивність ніж в субстанції.
6. Кристалічний склад за п. 3, який відрізняється тим, що кальцію дифосфатдигідрат має наступні параметри рентгенівської дифракції :
2Ө
Ө
d,Ǻ
I
I=I/Imax*100
11,60
5,80
7,62843
4200
100,00
13,10
6,55
6,75812
200
4,76
20,90
10,45
4,25026
3120
74,29
23,40
11,70
3,80152
320
7,62
25,60
12,80
3,47960
80
1,90
26,40
13,20
3,37595
1600
38,10
28,50
14,25
3,13179
120
2,86
29,30
14,65
3,04808
3200
76,19
30,50
15,25
2,93083
1360
32,38
31,30
15,65
2,85773
200
4,76
32,50
16,25
2,75490
400
9,52
32,80
16,40
2,73038
360
8,57
34,30
17,15
2,61434
1080
25,71
35,80
17,90
2,50816
120
2,86
37,10
18,55
2,42321
480
11,43
39,10
19,55
2,30374
40
0,95
39,60
19,80
2,27580
120
2,86
40,10
20,05
2,24857
360
8,57
41,20
20,60
2,19104
120
2,86
42,00
21,00
2,15114
520
12,38
43,30
21,65
2,08953
560
13,33
44,60
22,30
2,03159
200
4,76
45,40
22,70
1,99764
80
1,90
47,80
23,90
1,90279
240
5,71
48,50
24,25
1,87695
80
1,90
49,20
24,60
1,85188
360
8,57
50,20
25,10
1,81731
280
6,67
50,80
25,40
1,79724
520
12,38
Текст
1. Спосіб виготовлення лікарського препарату у формі таблеток на основі міансерину гідрохлориду, згідно з яким змішують міансерину гідрохлорид, кальцію дифосфатдигідрат, крохмаль картопляний, аеросил, додають розчин метилцелюлози, отриману масу зволожують, сушать, гранулюють крізь сито, ще додають решту крохмалю картопляного та аеросилу, а також магнію стеарат, змішують, калібрують крізь сито, пресують таблетки, який відрізняється тим, що змішують 9,68-11,11 мас. % міансерину гідрохлориду, 75,5-77,55 мас. % кальцію дифосфатдигідрату, 60 % від 8,18-8,38 мас.% крохмалю картопляного і 40 % від 1,61-1,85 мас. % аеросилу протягом 10-15 хвилин у швидкісному ротаційному змішувачі зі швидкістю ротора 60-100 об/хв., додаючи 1,80-1,96 мас. % метилцелюлози, попередньо розчиненої у воді і підігрітої до температури 45-55 °С, та зволожуючи масу 1525 хвилин при швидкості ротора 60-100 обертів/хв., отриману вологу масу висушують до остаточної вологи 2,5-3,0 %, гранулюють крізь сито з діаметром отворів 1-1,5 мм і змішують протягом 15 хвилин з 40 % крохмалю та 60 % аеросилу, що залишились, після додавання 0,97-1,11 мас. % магнію стеарату масу перемішують ще 2-3 хв., перед пресуванням таблетки-ядра отриману масу калібрують крізь сито з діаметром отворів 1 мм, а після пресування наносять на таблетки-ядра плівкове покриття, на основі гідроксипропілметилцелюлози. 2. Лікарський препарат у формі таблеток на основі міансерину гідрохлориду, одержаний способом за 2 (19) 1 3 33,80 34,30 35,60 37,00 39,80 41,70 42,10 43,20 44,80 45,20 46,00 48,00 48,60 49,00 50,20 50,80 51,40 53,60 16,90 17,15 17,80 18,50 19,90 20,85 21,05 21,60 22,40 22,60 23,00 24,00 24,30 24,50 25,10 25,40 25,70 26,80 2,65186 2,61434 2,52179 2,42953 2,26483 2,16592 2,14626 2,09413 2,02299 2,00601 1,97297 1,89533 1,87333 1,85897 1,81731 1,80000 1,77767 1,70978 93232 200 1240 160 560 200 680 600 240 120 200 160 240 480 240 720 360 160 200 2,30 14,29 1,84 6,45 24,90 7,83 6,91 2,76 1,38 2,30 1,84 2,76 5,53 2,76 8,29 4,15 22,90 2,30 4. Кристалічний склад за п. 3, який відрізняється тим, що міансерину гідрохлорид має наступні параметри рентгенівської дифракції: 2Ө 7,5 9,5 11,90 15,10 16,00 18,90 19,40 20,70 21,40 22,80 23,50 24,40 25,10 26,10 28,10 29,00 31,10 Ө 3,75 4,75 5,95 7,55 8,00 9,45 9,70 10,35 10,70 11,40 11,75 12,20 12,55 13,05 14,05 14,50 15,55 d,Ǻ 11,78691 9,30464 7,43678 5,86721 5,53915 4,69526 4,57299 4,28864 4,14991 3,89816 3,78361 3,64605 3,54593 3,41230 3,17381 3,07892 2,87565 4 32,00 32,70 38,80 40,00 45,70 47,80 48,80 50,10 16,00 16,35 19,40 20,00 22,85 23,90 24,40 25,05 2,79679 2,73851 2,32086 2,25396 1,98522 1,90279 1,86612 1,82070 5. Кристалічний склад за п. 3, який відрізняється тим, що міансерину гідрохлорид в таблетках з кальцію дифосфатдигідратом має на 40-80 % в залежності від брегівського кута меншу інтенсивність ніж в субстанції. 6. Кристалічний склад за п. 3, який відрізняється тим, що кальцію дифосфатдигідрат має наступні параметри рентгенівської дифракції : 2Ө 11,60 13,10 20,90 23,40 25,60 26,40 28,50 29,30 30,50 31,30 32,50 32,80 34,30 35,80 37,10 39,10 39,60 40,10 41,20 42,00 43,30 44,60 45,40 47,80 48,50 49,20 50,20 50,80 Ө 5,80 6,55 10,45 11,70 12,80 13,20 14,25 14,65 15,25 15,65 16,25 16,40 17,15 17,90 18,55 19,55 19,80 20,05 20,60 21,00 21,65 22,30 22,70 23,90 24,25 24,60 25,10 25,40 d,Ǻ 7,62843 6,75812 4,25026 3,80152 3,47960 3,37595 3,13179 3,04808 2,93083 2,85773 2,75490 2,73038 2,61434 2,50816 2,42321 2,30374 2,27580 2,24857 2,19104 2,15114 2,08953 2,03159 1,99764 1,90279 1,87695 1,85188 1,81731 1,79724 I 4200 200 3120 320 80 1600 120 3200 1360 200 400 360 1080 120 480 40 120 360 120 520 560 200 80 240 80 360 280 520 I=I/Imax*100 100,00 4,76 74,29 7,62 1,90 38,10 2,86 76,19 32,38 4,76 9,52 8,57 25,71 2,86 11,43 0,95 2,86 8,57 2,86 12,38 13,33 4,76 1,90 5,71 1,90 8,57 6,67 12,38 Винахід належить до галузі медицини, а саме, до психіатрії, де як антидепресивний препарат використовується міансерину гідрохлорид формули Емпірична формула: Молекулярна маса: Хімічна назва: C18H21ClN2 300,8 (RS)-2-метил-1, 2, 3, 4, 10, 14bгексагідродибензо [с,]пиразинол[1, 2-]азепину гідрохлорид 5 Субстанція розчинна в 2-диметиленхлориді, повільно розчинна у воді та мало розчинна в спирті. Міансерину гідрохлорид являє собою кристалічний порошок білого або майже білого кольору. Мікроскопія порошків різних виробників показує, що кристали можуть мати різну форму. Порошок фірми «HEUMANN PCS», Німеччина: складається із ізодіаметричних пластинок (квадратних, прямокутних). Розмір основної фракції 2-3 мкм, причому є невелика кількість кристалів розміром до 40x50 мкм. Кристали агреговані, агрегати та окремі кристали непрозорі. Порошок фірми «EUTICALS SPA», Італія: складається із основної фракції більшого розміру: 5-10 мкм. В патенті US№ 3,534,041, C07D 241/04,1970, запропоновано спосіб синтезу цієї субстанції під назвою GB-94. Детальні дослідження фармакологічних властивостей були приведені в US №4,128,641, А61КЗ1/495, 1978. Міансерину гідрохлорид - це антидепресивний препарат, який належить до групи піперазино-азепінових сполук і відрізняється від трициклічних антидепресантів (ТЦА). У хімічній структурі міансерину гідрохлориду відсутній боковий ланцюжок, характерний для ТЦА, який, як вважається, відповідає за їх антихолінергічну активність. Міансерину гідрохлорид підвищує центральну норадренергічну нейротрансмісію шляхом ауторецепторної блокади та пригнічення зворотного захоплення норадреналіну. Було також виявлено взаємодію препарату з серотоніновими рецепторами центральної нервової системи (ЦНС). Антидепресивний ефект подібний до ефекту інших сучасних антидепресантів. Більше того, препарат має анксіолітичну (протитривожну) дію, що важливо при лікуванні хворих на депресію у поєднанні з тривожністю. Седативний ефект міансерину гідрохлориду, пов'язаний з впливом міансерину гідрохлориду на альфа-1-адренорецептори і Н-1-гістамінові рецептори, дає можливість застосовувати його для лікування порушень сну в рамках депресії. Міансерину гідрохлорид добре переноситься пацієнтами, в тому числі людьми похилого віку та тими, хто має серцево-судинні захворювання. При застосуванні в терапевтичних дозах Міансерину гідрохлорид практично не має антихолінергічної активності і, відповідно, впливу на серцевосудинну систему. При передозуванні він спричинює значно менше кардіотоксичних ефектів порівняно з ТЦА. Міансерину гідрохлорид не виявляє взаємодії з симпатоміметичними і гіпотензивними препаратами, дія яких пов'язана з впливом на бета-адренорецептори (наприклад, бетанідин) чи альфа-адренорецептори (наприклад, клонідин або метилдопа). Фармакокінетика. Після перорального прийому міансерин швидко всмоктується. Максимальні концентрації міансерину в плазмі досягаються через 3 години після прийому препарату. Його біодоступність становить 20%. З білками плазми міансерин зв'язується приблизно на 95%. Період напіввиве 93232 6 дення становить 21-61 год, тому застосовувати препарат достатньо один раз на добу. Стабільна концентрація міансерину гідро хлориду в плазмі досягається впродовж 6 діб його прийому. Міансерину гідрохлорид метаболізується і виділяється із сечею та фекаліями протягом 7-9 діб. Основними шляхами біотрансформації є деметилювання і окислення, з подальшою кон'югацією метаболітів. Відомо спосіб виготовлення лікарського препарату на основі міансерину гідрохлориду, згідно з яким 10 кг міансерину гідрохлориду, 7,5кг крохмалю картопляного, 1кг аеросилу, 74,6 кг кальцію дифосфатдигідрату змішують протягом 1-3 хв. у швидкісному змішувачу і зволожують 15 кг водного розчину, який містить 1кг метилцелюлози, та додають 2,5 мас.% стабілізатору. Зволожену масу сушать при температурі 40-50° до вмісту вологи 3,2% в апараті киплячого шару, або в сушарці. Суху суміш калібрують крізь сито з діаметром отворів 3,5 або 0,7 мм у залежності від умов сушіння, додають 2,5кг крохмалю, 1кг аеросилу, змішують, а потім додають 0,2кг магнію стеарату. Пресують таблетки по 100 мг, вміст міансерину гідрохлориду в таблетці 10мг [US № 5,441,747, А61К9/16, 1995]. За цим патентом пресують таблетки по 100 мг, вміст міансерину гідрохлориду в таблетці становить 10 мг. Такий же якісний склад мають зареєстровані в Україні таблетки Лерівон фірми ORGANON, які містять 30мг міансерину гідрохлориду і мають середню вагу таблетки 300 мг. За даними патенту [US № 5,441,747, А61К9/16, 1995] при визначені стабільності цих таблеток порівняно з такими ж таблетками, що містять 2,5 % стабілізатора останні мають значно більшу стабільність. Крім того, при пресуванні таблеток за прототипом з вагою 0,3г і вмістом міансерину гідрохлориду 30 мг вони, як показали наші дослідження, мають малу міцність. При виготовленні таблеток з середньою вагою 0,2г і дозою міансерину гідрохлориду 30 мг розчинність in vitro досягається вже за 7-10хвилин, що для препарату такої дії є небажаним. За зазначеним способом одержують лікарський препарат на основі міансерину гідрохлориду що містить, мас.%: міансерину гідрохлорид 10 крохмаль картопляний 10 метилцелюлоза 1 аеросил 2 кальцію дифосфатдигідрат 74,2 магнію стеарат 0.2 стабілізатор 2,5 вода очищена решта [US № 5,441,747, А61К9/16, 1995]. Недоліком цього препарату є недостатня механічна міцність таблетки, завдяки чому при виготовлені їх в циліндричній формі з двояковипуклими поверхнями і рискою спостерігаються механічні пошкодження на краях таблетки та рисках і значна стиранність, недостатня для покриття цих таблеток плівковим покриттям.. Для багатьох лікарських препаратів вважається за необхідне визначення кристалічної структури 7 93232 лікарської субстанції, особливо в тих випадках, коли можливе утворення різних поліморфних структур. Так, в патенті UA №57089, А61Р 25/04, 2003 фірми MERCK визначають кристалічну структуру при застосуванні похідних морфоліну або тіоморфоліну як лікарських речовин при лікуванні деяких психічних розладів. Відомо визначення кристалічної структури періндаприлу [UA 57187, А61К 45/00, 2003]. Фармакопея США для карбамазепіну дозволяє використовувати лише одну з5 відомих поліморфних форм [5 видання, 2005, с.341]. Найближчою до винаходу, що заявляється, є визначена кристалічна структура лікарської речовини в твердих лікарських формах, де вона застосовується разом з іншими кристалічними допоміжними речовинами [UA 28988, C07D 209/42, 2007]. Зазначена кристалічна структура визначена для трет-бутиламінової солі періндоприлу. Міансерину гідрохлорид має асиметричний атом вуглецю, тому може утворювати 2 оптичних ізомери, але в лікарському препараті застосовується їх рацемічна суміш. Міансерину гідрохлорид також входить до складу препарату МіансеринРатіофарм, який використовується за тими ж медичними показниками, але має інший кількісний склад допоміжних речовин. Крім цих препаратів, він виготовляється в формі таблеток як генеричний препарат ще багатьма фірмами в різних країнах. Субстанція виготовляється в різних країнах і є рацемічною сумішшю двох енантіотропних форм, тому особливо необхідно при застосуванні в таблетках визначення кристалічної структури, але сучасний стан рівня техніки в цьому питанні не має таких досліджень. В основу винаходу поставлено задачу створення способу виготовлення лікарського препарату у формі таблеток на основі міансерину гідрохлориду, що давав би можливість одержати міцні таблетки, розчинність яких досягалась би повільно протягом 30 хвилин. Другу задачу, яку поставлено в основу винаходу, - це розроблення шляхом зміни кількості компонентів лікарського препарату на основі міансерину гідрохлориду, таблетки якого були би міцнішими, що, в свою чергу, дало би можливість розширити їх покриття плівкою та фасування, а також були би стабільнішими. Третя задача, яку поставлено в основу винаходу, полягає у визначенні кристалічної структури для обґрунтуванню складу таблеток лікарського 2 7,50 11,60 15,10 19,00 20,90 23,40 24,50 26,60 28,20 3,75 5,80 7,55 8,50 10,45 11,70 12,25 13,30 14,10 d,Å 11,78691 7,62843 5,86721 4,67000 4,25000 3,80152 3,63328 3,35102 3,16442 8 препарату на основі міансерину гідрохлориду, одержаного способом, що заявляється. Поставлену задачу вирішують тим, що у способі виготовлення лікарського препарату у формі таблеток на основі міансерилу гідрохлориду, згідно з яким змішують міансерилу гідрохлорид, кальцію дифосфатдигідрат, крохмаль картопляний, аеросил, додають розчин метилцелюлози, отриману масу зволожують, сушать, грагулюють крізь сито, ще додають решту крохмалю картопляного та аеросилу, а також магнію стеарат, змішують, калібрують крізь сито, пресують таблетки, згідно з винаходом, змішують 9,68 - 11,11 мас.% міансерину гідрохлориду, 75,5 - 77,55 мас. % кальцію дифосфатдигідрату, 60% від 8,18-8,38 мас.% крохмалю картопляного і 40% від 1,61 - 1,85 мас. % аеросилу протягом 10-15 хвилин у швидкісному ротаційному змішувачу зі швидкістю ротора 60-100 об/хв., додаючи 1,80 - 1,96 мас.% метилцелюлози, попередньо розчиненої у воді і підігрітої до температури 45 - 55°С, та зволожуючи масу 15-25 хвилин при швидкості ротора 60-100 обертів/хв., отриману вологу масу висушують до остаточної вологи 2,5-3,0%, гранулюють крізь сито з діаметром отворів 1 - 1,5 мм і змішують протягом 15 хвилин з 40% крохмалю та 60% аеросилу, що залишились, після додавання 0,97 - 1,11 мас.% магнію стеарату масу перемішують ще 2-3 хв., перед пресуванням таблетки-ядра отриману масу калібрують крізь сито з діаметром отворів 1 мм, а після пресування наносять на таблетки-ядра плівкове покриття, на основі гідроксіпропілметицелюлози. Другу поставлену задачу вирішують тим, що в лікарському препараті у формі таблеток на основі міансерилу гідрохлориду, який містить міансерину гідрохлорид, кристалічний наповнювач - кальцію дифосфатдигідрат, допоміжні речовини аморфної структури - крохмаль картопляний, метилцелюлозу, аеросил, магнію стеарат, згідно з винаходом, компоненти взяті у такому співвідношенні, мас.%: міансерину гідрохлорид 9,68-11,11 кальцію дифосфатдигідрат 75,5-77,55 крохмаль картопляний 8,18-8,38 метилцелюлоза 1,80-1,96 аеросил 1,61-1,85 магнію стеарат 0,97-1,11, причому плівкове покриття становить 2,2-3,5% від маси таблетки. Третю поставлену задачу вирішують, згідно з винаходом, визначенням кристалічної структури лікарського препарату у формі таблеток на основі міансерину гідрохлориду І 120 8680 120 40 2880 760 80 80 80 Івідн% 1,38 100,00 1,38 0,98 33,18 8,76 0,92 0,92 0,92 9 29,30 30,60 31,40 33,80 34,30 35,60 37,00 39,80 41,70 42,10 43,20 44,80 45,20 46,00 48,00 48,60 49,00 50,20 50,80 51,40 53,60 93232 14,65 15,30 15,70 16,90 17,15 17,80 18,50 19,90 20,85 21,05 21,60 22,40 22,60 23,00 24,00 24,30 24,50 25,10 25,40 25,70 26,80 3,04808 2,92148 2,84885 2,65186 2,61434 2,52179 2,42953 2,26483 2,16592 2,14626 2,09413 2,02299 2,00601 1,97297 1,89533 1,87333 1,85897 1,81731 1,80000 1,77767 1,70978 10 3640 1120 160 200 1240 160 560 200 680 600 240 120 200 160 240 480 240 720 360 160 200 41,94 12,90 1,84 2,30 14,29 1,84 6,45 24,90 7,83 6,91 2,76 1,38 2,30 1,84 2,76 5,53 2,76 8,29 4,15 22,90 2,30 Міансерину гідрохлорид має наступну кристалічну структуру, 2 d,Å 7,5 3,75 11,78691 9,5 4,75 9,30464 11,90 5,95 7,43678 15,10 7,55 5,86721 16,00 8,00 5,53915 18,90 9,45 4,69526 19,40 9,70 4,57299 20,70 10,35 4,28864 21,40 10,70 4,14991 22,80 11,40 3,89816 23,50 11,75 3,78361 24,40 25,10 12,20 12,55 3,64605 3,54593 26,10 13,05 3,41230 28,10 14,05 3,17381 29,00 14,50 3,07892 31,10 15,55 2,87565 32,00 16,00 2,79679 11 93232 12 32,70 16,35 2,73851 38,80 19,40 2,32086 40,00 20,00 2,25396 45,70 22,85 1,98522 47,80 23,90 1,90279 48,80 24,40 1,86612 50,10 25,05 1,82070 Міансерину гідрохлорид в таблетках з кальцію дифосфатдигідратом має на 40-80% в залежності від брегівського кута меншу інтенсивність ніж в субстанції 2 11,60 13,10 20,90 23,40 25,60 26,40 28,50 29,30 30,50 31,30 32,50 32,80 34,30 35,80 37,10 39,10 39,60 40,10 41,20 42,00 43,30 44,60 45,40 47,80 48,50 49,20 50,20 50,80 5,80 6,55 10,45 11,70 12,80 13,20 14,25 14,65 15,25 15,65 16,25 16,40 17,15 17,90 18,55 19,55 19,80 20,05 20,60 21,00 21,65 22,30 22,70 23,90 24,25 24,60 25,10 25,40 Створення міцнішої стабільної таблетки з тим же профілем розчинення і такою ж кристалічною структурою, як Лерівон, потребує використання як допоміжної речовини кальцію дифосфатдигідрату, як наповнювачу. Зміцнення таблетки досягнуто без зміни профілю розчинності і впливу на кристалічну структуру, тобто без зміни якісного составу, лише за рахунок зміни співвідношень компонентів. Експериментальний пошук таких співвідношень показав, що зменшення загальної кількості крохмалю і у порівнянні з прототипом значне зменшення його кількості в інтрагранулярній фазі дає змогу, використовуючи значно більшу кількість Кальцію дифосфатдигідрат має наступну кристалічну структуру: d,Å 7,62843 6,75812 4,25026 3,80152 3,47960 3,37595 3,13179 3,04808 2,93083 2,85773 2,75490 2,73038 2,61434 2,50816 2,42321 2,30374 2,27580 2,24857 2,19104 2,15114 2,08953 2,03159 1,99764 1,90279 1,87695 1,85188 1,81731 1,79724 І 4200 200 3120 320 80 1600 120 3200 1360 200 400 360 1080 120 480 40 120 360 120 520 560 200 80 240 80 360 280 520 I=I/Imax*100 100,00 4,76 74,29 7,62 1,90 38,10 2,86 76,19 32,38 4,76 9,52 8,57 25,71 2,86 11,43 0,95 2,86 8,57 2,86 12,38 13,33 4,76 1,90 5,71 1,90 8,57 6,67 12,38 полімеру - метилцелюлози, досягнути утворення міцнішого грануляту, чому сприяє більша порівняно с прототипом кількість аеросилу в цій фазі. Досягти такого, крім змін в составі інтрагранулярної фази, допоміг процес „зволоження-сушіння", поєднаний з пониженим тиском у робочій зоні. Щоб збільшений зміст крохмалю в міжгранулярній фазі не міг прискорити вивільнення міансерину гідрохлориду, в цю фазу додають більшу кількість магнію стеарату, що зменшує проникнення вологи в таблетку. При цьому, для забезпечення потрібної кінетики розчинення необхідно лише незначно зменшити кількість крохмалю як розпушувача, не 13 93232 більше ніж на 1,8%. У цьому технічному рішенні змінюється механізм створення грануляту, при якому міансерину гідрохлорид різних виробників у таблетках гарантовано потрібний профіль розчинності. Зменшення кількості крохмалю в суміші з діючою речовиною і збільшення кількості полімеру - метилцелюлози дає можливість отримання більшого шару полімеру на кристалах розчинного міансерину гідрохлориду рівномірного вивільнення при РН=6,8. При цьому, як показала експериментальна перевірка, підвищується стабільність міансерину гідрохлориду і зникає потреба в використанні стабілізаторів. Сучасний рівень техніки не має змоги прогнозувати кількість полімеру на кристалах різних компонентів суміші, які відрізняються розчинністю, розміром і формою, а також сорбційною ємністю. Таблетки, отримані способом, що заявляється, мають стабільність без використання в них стабілізатору. Визначення в структурі показників, які відтворюються в лікарській формі незмінними, дали змогу встановити, з якої кристалічної субстанції виготовлені таблетки, а також можливу зміну структури під час проведення технологічних операцій. Рішення цієї задачі дозволило забезпечити відтворюваність застосованої лікарської субстанції за показниками, які залишаються за межами аналітичних сертифікатів, але впливають на відтворюваність технології. Додатково це дозволяє запобігти можливостям фальсифікації. На Фіг.1-Фіг.3 наведені порівняльні характеристики розчинності таблеток Лерівону і таблеток, виготовлених за способом, що пропонується. Роз 14 чинення проведені в трьох середовищах з РН 1, РН 4,5, РН 6,8. Винахід ілюструється прикладом способу виготовлення лікарського препарату. Приклад Метилцелюлозу в кількості 1,8 мас.% розчинили у 32,6 л води і підігріли до температури 50°С. 11 мас.% міансерину гідрохлориду, 76,2 мас.% кальцію дифосфатдигідрату, 4,9 мас.% крохмалю картопляного і 0,72 мас.% аеросилу змішували протягом 5 хвилин у швидкісному ротаційному змішувачу зі швидкістю ротора 100 об/хв., додали 1,8 мас.% розчину метилцелюлози и зволожували 25 хвилин при швидкості ротора 100 об/хв. Температура стінок змішувача становила 50С, температура розчину 35С. Вакуум у робочій камері 900 мбар. Масу висушували при швидкості ротора 35 об/хв. і вакуумі 50 мбар до остаточної вологи 3,0%. Сушку здійснювали протягом 15 хв. Суху масу калібрувати крізь сито з діаметром отворів 1,5 мм і змішували з 3,3 мас.% крохмалю та 1,08 мас.% аеросилу протягом 15 хвилин, після чого додали 1,0 мас.% магнію стеарату і змішували додатково ще 3 хвилини. Отриману масу калібрували крізь сито з діаметром отворів 1 мм і пресували таблетки - ядра. На таблетки - ядра відомим способом нанесли плівкове покриття на основі гідроксіпропілметицелюлози. Винахід також ілюструється прикладами лікарського препарату, виготовленого за способом, що заявляється. Таблиця 1 Компоненти Міансерину гідрохлорид Кальцію дифосфатдигідрат Крохмаль картопляний Метилцелюлоза Аеросил Магнію стеарат Маса таблеток-ядер Плівкове покриття Приклад 1 Приклад 2 Приклад 3 210 г 225 г 210г 1558,2 г 1530 г 1689 г 168 г (69,9 в масу г, в опуд- 171 (в масу 69.9г, в опуд- 175 (в масу 70,0г, в опудрювання 98,1г) рювання 101,1) рювання 105) 37,8г 40,5 38,5 35,0 г (в масу 21,0 г, в опуд- 36 г (в масу 21,6 г, в опу- 35,7 г (в масу 1,42г, в опудрювання 14 г) дрювання 14,4 г) рювання 14,3 г) 21 г 22,5 г 21 г 0,29 г (7000 таблеток) 0,27 г (7500 таблеток) 0,31г (7000 таблеток) 0,01 г 0,01 г 0,01 г Физико-механічні властивості одержаних таблеток та таблеток прототипу наведені в таблиці. Таблиця 2 Показники Міцність Стиранність ядер Розпад ядер Розпад таблеток Лерівон 40 Н 140 с Приклад 1 120 Н 0,1 % 90 с 160 с Приклад 2 105 Н 0,13 % 60 с 140 с Приклад 3 130 Н 0,12 % 90 с 150 с 15 93232 Було проведено рентгеноструктурне дослідження субстанцій міансерину гідрохлориду, які виготовляються фірмами „EUTICALS SPA", Італія і „HEUMANN PCS", Німеччина в наступних умовах: дифрактометр ДРОН 3, дисцинтиляційний детектор, мідний антикатод λ= 1,5405А, напруга 40кВ, сила струму 40мА, розміщення - , діапазон вимірювань 5-40° при безперервній реєстрації на папері з уточненням положення шляхом точкової реєстрації з часом вимірювання на етапі 10 с, з приростом перед кожним вимірюванням 0,02° та графітовим монохроматором на відбитому промені. В таблицях 3 і 4 наведені дифрактограми порошків цих субстанцій, які були запресовані без допоміжних речовин при тиску 20 кПа Таблиця 3 Міансерину гідрохлорид, „Euticals", Італія 7,50 9,50 11,90 14,10 15,10 15,90 18,90 19,40 20,70 21,40 22,80 23,50 24,40 25,10 26,10 28,00 29,00 29,70 30,40 31,10 32,00 32,70 33,80 34,80 36,20 37,50 38,30 39,30 40,00 41,70 42,60 43,70 45,50 47,50 48,80 50,10 3,75 4,75 5,95 7,05 7,55 7,95 9,45 9,70 10,35 10,70 11,40 11,75 12,20 12,55 13,05 14,00 14,50 14,85 15,20 15,55 16,00 16,35 16,90 17,40 18,10 18,75 19,15 19,65 20,00 20,85 21,30 21,85 22,75 23,75 24,40 25,05 11,79 9,30 7,44 6,28 5,87 5,57 4,70 4,58 4,29 4,15 3,90 3,79 3,65 3,55 3,41 3,19 3,08 3,01 2,94 2,88 2,80 2,74 2,65 2,58 2,48 2,40 2,35 2,29 2,25 2,17 2,12 2,07 1,99 1,91 1,87 1,82 3280,00 1240,00 2920,00 320,00 2240,00 1640,00 2680,00 2560,00 2560,00 2760,00 720,00 2680,00 2200,00 2720,00 960,00 1360,00 600,00 520,00 1240,00 960,00 600,00 360,00 120,00 280,00 240,00 240,00 240,00 280,00 400,00 80,00 160,00 280,00 240,00 320,00 160,00 280,00 100,00 37,80 89,02 9,76 68,29 50,00 81,71 78,05 78,05 84,15 21,95 81,71 67,07 82,93 29,27 41,46 18,29 15,85 37,80 29,27 18,29 10,98 3,66 8,54 7,32 7,32 7,32 8,54 12,20 2,44 4,88 8,54 7,32 9,76 4,88 8,54 16 Таблиця 4 Міансерину гідрохлорид, „Heumann PCS", Німеччина 2 7,5 9,50 11,90 14,10 15,10 16,00 18,90 19,40 20,70 21,40 22,80 23,50 24,40 25,10 26,10 28,10 28,60 29,00 29,70 30,40 31,10 32,00 32,70 34,80 35,50 36,20 37,50 38,30 38,80 39,30 40,00 41,70 42,60 43,70 45,70 46,50 47,80 48,80 50,10 Міансерину гідро хлорид heumann d,Å І Io=I/Imax*100 3,75 11,78691 16800 100,00 4,75 9,30464 2480 14,76 5,95 7,43678 1600 9,52 7,05 6,28099 360 2,14 7,55 5,86721 12240 72,86 8,00 5,53915 1000 5,95 9,45 4,69526 1840 10,95 9,70 4,57299 1840 10,95 10,35 4,28864 1360 8,10 10,70 4,14991 1480 8,81 11,40 3,89816 4560 27,14 11,75 3,78361 5000 29,76 12,20 3,64605 1280 7,62 12,55 3,54593 1720 10,24 13,05 3,41230 640 3,81 14,05 3,17381 920 5,48 14,30 3,11945 480 2,86 14,50 3,07892 1040 6,19 14,85 3,00637 360 2,14 15,20 2,94025 5280 31,43 15,55 2,87565 1800 10,71 16,00 2,79679 360 2,14 16,35 2,73851 280 1,67 17,40 2,57791 200 1,19 17,75 2,52867 160 0,95 18,10 2,48136 280 1,67 13,15 3,38856 450 2,68 19,15 2,35000 1200 7,14 19,40 2,32086 630 3,75 19,65 2,29248 360 2,14 20,00 2,25396 560 3,33 20,85 2,16592 80 0,48 21,30 2,12222 200 1,19 21,85 2,07132 280 1,67 22,85 1,98522 360 2,14 23,25 1,95291 160 0,95 23,90 1,90279 360 2,14 24,40 1,86612 120 0,71 25,05 1,82070 760 4,52 Порошки мають майже однакові міжплощинні відстані в кристалічних структурах, тобто мають одну кристалічну форму, але для деяких міжплощинних відстаней (тобто для деяких брегівських кутів) мають дуже значну різницю в показнику інтенсивності і відносної інтенсивності, ніяк не обумовлену умовами експерименту. Цей специфічний для міансерину гідрохлориду ефект є наслідком того, що міансерину гідрохлорид є сумішшю двох енантіотропів. Таким чином кристалічна структура міансерину гідрохлориду має такі найбільш істотні показники 17 93232 Таблиця 5 2 7,5 9,5 11,90 15,10 16,00 18,90 19,40 20,70 21,40 22,80 23,50 24,40 25,10 26,10 28,10 29,00 31,10 32,00 32,70 38,80 40,00 45,70 47,80 48,80 50,10 3,75 4,75 5,95 7,55 8,00 9,45 9,70 10,35 10.70 11,40 11,75 12,20 12,55 13,05 14,05 14,50 15,55 16,00 16,35 19,40 20,00 22,85 23,90 24,40 25,05 d,Å 11,78691 9,30464 7,43678 5,86721 5,53915 4,69526 4,57299 4,28864 4,14991 3,89816 3,78361 3,64605 3,54593 3,41230 3,17381 3,07892 2,87565 2,79679 2,73851 2,32086 2,25396 1,98522 1,90279 1,86612 1,82070 Визначення структури таблеток може бути вирішено порівняльним аналізом дифрактограм усіх кристалічних компонентів, які входять до складу таблеток з міансерину гідрохлоридом з дифрактограмами цих таблеток. Результати аналізу не можуть бути передбачені ані спеціалістами з фармацевтичної технології, ані спеціалістами з рентгеноструктурного аналізу тому, що склад таблетки утворює єдиний, емпірично складений комплекс кристалічної лікарської субстанції з кристалічними і аморфними допоміжними речовинами, який в сукупності, за умов технологічної переробки, забезпечує вищевказану фармакологічну дію. В цій багатокомпонентній системі можуть виникати нові фазові перевтілення, бо навіть в чистих субстанціях різних виробників, як видно з таблиць 3 та 4, при однаковій кристалічній формі є різниця в інтенсивності відтворення рентгенівського випромінювання на різних брегівських кутах. До цього часу таких дослідів в фармацевтичній технології майже не проводилось, за виключенням патенту UA 28988 (прототип), в якому досліджувались дифрактограми трет-бутиламінової солі періндоприлу. Визначення кристалічної структури таблеток, що знаходяться в ринковому обігу, дозволяють обґрунтувати склад таблеток, який би вирішив не тільки технологічне розв'язання тих недоліків, які мають сучасні таблетовані препарати міансерину гідрохлориду, а також встановити зміни кристалічної структури діючої і допоміжних речовин і відтворюваність структур при виготовлені таблеток. Структурні дослідження особливо важливі для міансерину гідрохлориду, тому що він є сумішшю або може бути одним із енантіомерів, і можливі 18 перевтілення енантіотропних форм. Ці результати не можуть бути прогнозовані апріорі. До складу таблеток Леривон, МіансеринРатіофарм та інших генеричних препаратів входять: міансерину гідрохлорид -10 - 20%, кальцію 60-75%, та аморфні допоміжні речовини - крохмаль, метилцелюлоза, аеросил, магнію стеарат - в сукупності до 100% В патенті USA 5441747 Ρ de Haas et al 15 aug.1995 424/465, A61K09/16, A61K09/20, A61K009/20 доведено, що використання кальцію дифосфатдигідрату стабілізує хлористоводневу сіль міансерину, яка може під час виготовлення та зберігання таблетки під дією вологи змінювати колір. При вирішенні цих завдань необхідно встановити, який з багатьох сортів кальцію дифосфатдигідрату використовується в таблетках В таблицях 6 і 7 показані дифрактограми двох сортів цієї допоміжної речовини, які частіш за все використовуються в промисловому виробництві таблеток. Таблиця 6 кальцію дифосфатдигідрат DI-CAFOS PF С 92-02 2 11,60 13,10 20,90 23,40 25,60 26,40 28,50 29,30 30,50 31,30 32,50 32,80 34.30 35,80 37,10 39,10 39,60 40,10 41,20 42,00 43,30 44,60 45,40 47,80 48,50 49,20 50,20 50,80 5,80 6,55 10,45 11,70 12,80 13,20 14,25 14,65 15,25 15,65 16,25 16,40 17,15 17,90 18,55 19,55 19,80 20,05 20,60 21,00 21,65 22,30 22,70 23,90 24,25 24,60 25,10 25,40 d,Å 7,62843 6,75812 4,25026 3,80152 3,47960 3,37595 3,13179 3,04808 2,93083 2,85773 2,75490 2,73038 2,61434 2,50816 2,42321 2,30374 2,27580 2,24857 2,19104 2,15114 2,08953 2,03159 1,99764 1,90279 1,87695 1,85188 1,81731 1,79724 І 4200 200 3120 320 80 1600 120 3200 1360 200 400 360 1080 120 480 40 120 360 120 520 560 200 80 240 80 360 280 520 I=I/Imax*100 100,00 4,76 74,29 7,62 1,90 38,10 2,86 76,19 32,38 4,76 9,52 8,57 25,71 2,86 11,43 0,95 2,86 8,57 2,86 12,38 13,33 4,76 1,90 5,71 1,90 8,57 6,67 12,38 Таблиця 7 Кальцію діфосфатдигідрат DI-CAFOS С 92-14 2 13,20 17,90 20,30 6,60 8,95 10,15 d,Å I=n*400 I=I/Imax*100 6,70715 280 7,61 4,95525 80 2,17 4,37450 20 0,54 19 20,90 22,20 24,30 25,70 26,60 27,10 28,70 30,30 31,20 32,60 32,90 34,90 35,50 36,10 38,30 39,20 10,45 11,10 12,15 12,85 13,30 13,55 14,35 15,15 15,60 16,30 16,45 17,45 17,75 18,05 19,15 19,60 4,25026 4,00422 3,66273 3,46629 3,35102 3,29032 3,11042 2,94972 2,86666 2,74668 2,72231 2,57075 2,52867 2,48801 2,35000 2,29810 93232 40 60 80 240 3680 280 440 2840 240 1000 1080 40 80 600 60 240 1,09 1,63 2,17 6,52 100,00 7,61 11,96 77,17 6,52 27,17 29,35 1,09 2,17 16,30 1,63 6,52 20 40,20 41,10 41,90 42,80 43,20 43,80 44,70 45,70 46,50 47,50 48,80 49,30 20,10 20,55 20,95 21,40 21,60 21,90 22,35 22,85 23,25 23,75 24,40 24,65 2.24321 2,19614 2,15605 2,11277 2,09413 2,06683 2,02728 1,98522 1,95291 1,91411 1,86612 1,84835 680 440 320 200 160 120 140 200 40 440 160 680 18,48 11,96 8,70 5,43 4,35 3,26 3,80 5,43 1,09 11,96 4,35 18,48 В таблицях 8 та 9 приведені дифрактограми Лерівону та Міансерину-Ратіофарм Таблиця 8 Лерівон 7,5 9,5 11,70 15,10 16,30 18,00 18,80 19,40 20,80 3,75 4,75 5,85 7,55 8,15 9,00 9,40 9,70 10.40 11,7869 9,30464 7,56345 5,86710 5,43330 4,92795 4,71990 4,57530 4,27046 520 380 7700 64 96 60 96 104 3040 6,75 4,93 100,00 0,83 1,25 0,78 1,25 1,35 39,48 23,60 11,80 3,76976 640 8,31 24,20 24,80 25,50 29,40 30,60 31,40 32,40 34,30 37,10 12,10 12,40 12,75 14,70 15,30 15,70 16,20 17,15 18,55 3,67764 3,59000 3,49302 3,03794 2,92148 2,84885 2,76317 2,61434 2,42321 40 40 280 3480 1280 170 40 1440 680 0,52 0,52 3,64 45,19 16,62 2,21 0,52 18,70 8,83 37,80 18,90 2,37993 60 0,78 39,70 19,85 2,27030 800 10,39 41,60 42,20 20,80 21,10 2,17090 2,14141 584 600 7,58 7,79 43,20 21,60 2,09413 240 3,12 45,40 22,70 1,99764 400 5,19 46,10 23,05 1,96892 160 2,08 48,10 48,70 49,20 50,30 50,80 24,05 24,35 13,15 25,15 25,40 1,89162 1,86971 3,38856 1,81393 1,79724 320 500 280 720 216 4,16 6,49 3,64 9,35 2,81 Міансерину гідрохлорид Міансерину гідрохлорид Міансерин+дифосфат Міансерину гідрохлорид Міансерину гідрохлорид Міансерину гідрохлорид Міансерину гідрохлорид Міансерину гідрохлорид Кальцію дифосфатдигідрат Міансерину гідрохлорид + кальцію дифосфатдигідрат Міансерину гідрохлорид Міансерину гідрохлорид Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Міансерин+дифосфат Кальцію дифосфат Кальцію дифосфат Міансерину гідрохлорид + кальцію дифосфатдигідрат Міансерину гідрохлорид + кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Міансерину гідрохлорид + кальцію дифосфатдигідрат Міансерину гідрохлорид + кальцію дифосфатдигідрат Міансерину гідрохлорид + кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат 21 93232 22 Таблиця 9 Міансерину гідрохлорид -ратиофарм 2 7,60 9,50 3,80 4,75 d,Å 11,63204 9,30464 І 152 104 Ιο =I/Imax*100 1,62 1,08 11,70 5,85 7,56345 9400 100 15,10 16,20 18,10 18,80 19,50 20,90 7,50 8,00 9,05 9,40 9,75 10,45 5,90610 5,53915 4,90095 4,72001 4,55213 4,25026 120 112 60 190 150 3320 1,28 1,19 0,64 2,02 1,60 35,32 23,50 11,75 3,78557 800 8,51 24,40 25,10 12,20 12,55 3,64794 3,54777 120 100 1,28 1,06 26,40 13,20 3,37595 80 0,85 28,20 14,10 3,16442 160 1,70 29,50 30,50 31,40 34,30 37,10 39,70 41,60 42,20 14,75 15,25 15,70 17,15 18,55 19,85 20,80 21,10 3,02787 2,93083 2,84885 2,61434 2,42321 2,27030 2,17090 2,14141 3800 1640 300 3160 1200 160 640 720 40,43 17,45 3,19 33,62 12,77 1,70 6,81 7,66 43,30 21,65 2,08953 240 2,55 45,30 22,65 2,00182 120 1,28 48,10 48,50 49,10 50,20 50,80 53,50 24,05 24,25 24,55 25,10 25,40 26,75 1,98162 1,87695 1,85541 1,81731 1,79724 1,71274 280 450 280 840 320 160 2,98 4,79 2,98 8,94 3,40 1,70 З порівняння результатів в таблицях 6-9 можна зробити висновок, що в цих лікарських препаратах застосовується кальцію дифосфатдигідрат DI-CAFOS PF С 92-02. Порівняння даних таблиць 3, 4 з таблицями 8 і 9 показує, що інтенсивність ліній міансерину гідрохлориду в таблетках значно менша, ніж в самій субстанції в перерахунку на кількісний зміст його в таблетках. По даних таблиць 8 і 9 в таблетках самостійно проявляються такі міжплощинні відстані міансерину гідрохлориду: Таблиця 10 2 7,50 9,50 15,10 16,20 d,Å 11,7869 9,30464 5,8671 5,53915 18,80 19,40 24,40 25,10 Міансерину гідрохлорид Міансерину гідрохлорид Міансерину гідрохлорид + кальцію дифосфатдигідрат Міансерину гідрохлорид Міансерину гідрохлорид Міансерину гідрохлорид Міансерину гідрохлорид Міансерину гідрохлорид Кальцію дифосфатдигідрат Міансерину гідрохлорид + кальцію дифосфатдигідрат Міансерину гідрохлорид Міансерину гідрохлорид Міансерину гідрохлорид + кальцію дифосфатдигідрат Міансерину гідрохлорид + кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Міансерин+дифосфат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Міансерину гідрохлорид + кальцію дифосфатдигідрат Міансерину гідрохлорид + кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат 4,72001 4,5753 3,6479 3,5478 Для тих, міжплощинних відстаней міансерину гідрохлориду, які накладаються на структури кальцію дифосфатдигідрату також спостерігається значне зменшення інтенсивності, ніж це можна очікувати теоретично, виходячи з правила адитивності. Для того, щоб визначити вплив кристалічних наповнювачів іншої хімічної структури досліджено в тих же самих умовах таблетки міансерину гідрохлориду, виготовлені за патентом US №4,128,641, А61К31/495, 1978, в якому пропонувався склад таблеток з використанням як допоміжної речовини - молочного цукру - лактози. Ці дані наведені в таблиці 11. 23 93232 24 Таблиця 11 Міансерину гідрохлориду з лактозою, г 2 7,50 9,40 11,90 12,60 14,00 15,10 16,40 17,10 19,10 19,60 20,00 20,80 21,20 22,80 23,80 24,50 25,10 25,70 26,20 27,50 28,10 28,70 30,50 31,10 31,70 33,20 34,80 36,20 36,90 37,70 38,20 39,50 39,90 40,70 41,90 42,50 43,10 44,20 45,20 45,80 47,40 47,90 3,75 4,70 5,95 6,30 7,00 7,55 8,20 8,55 9,55 9,80 10,00 10,40 10,60 11,40 11,90 12,25 12,55 12,85 13,10 13,75 14,05 14,35 15,25 15,55 15,85 16,60 17,40 18,10 18,45 18,85 19,10 19,75 19,95 20,35 20,95 21,25 21,55 22,10 22,60 22,90 23,70 23,95 d,Å 11,78079 9,40340 7,43292 7,02151 6,32235 5,86417 5,40213 5,18254 4,64414 4,52678 4,44000 4,26825 4,18861 3,89816 3,73659 3,63139 3,54593 3,46449 3,39950 3,24168 3,17381 3,10881 2,92931 2,87415 2,82111 2,69700 2,57657 2,48007 2,43462 2,38477 2,35470 2,28015 2,25821 2,21565 2,15493 2,12588 2,09767 2,04798 2,00497 1,98009 1,91692 1,89807 І 1160 2000 760 2920 160 1200 2320 680 7840 9280 25120 2720 4680 1520 1920 480 960 1640 800 680 720 1720 320 720 520 400 960 1200 1280 2480 1520 560 1000 560 240 280 440 200 200 280 360 320 Io=I/Imax*100 4,62 7,96 3,03 11,62 0,64 4,78 9,24 2,71 31,21 36,94 100,00 10,83 18,63 6,05 7,64 1,91 3,82 6,53 3,18 2,71 2,87 6,85 1,27 2,87 2,07 1,59 3,82 4,78 5,10 9,87 6,05 2,23 3,98 2,23 0,96 1,11 1,75 0,80 0,80 1,11 1,43 1,27 Міансерину гідрохлорид Міансерину гідрохлорид Міансерину гідрохлорид +лактоза Тальк Міансерину гідрохлорид+лактоза Міансерину гідрохлорид Міансерину гідрохлорид+лактоза Міансерину гідрохлорид+лактоза Міансерину гідрохлорид+лактоза Міансерину гідрохлорид+лактоза Лактоза Міансерину гідрохлорид+лактоза Міансерину гідрохлорид+лактоза Міансерину гідрохлорид+лактоза Міансерину гідрохлорид+лактоза Міансерину гідрохлорид+лактоза Міансерину гідрохлорид+лактоза Міансерину гідрохлорид+лактоза Міансерину гідрохлорид+лактоза Лактоза Міансерину гідрохлорид+лактоза Міансерину гідрохлорид Міансерину гідрохлорид+лактоза Міансерину гідрохлорид+лактоза Лактоза Лактоза Лактоза Лактоза Лактоза Лактоза Лактоза Лактоза Міансерину гідрохлорид+лактоза Лактоза Міансерину гідрохлорид+лактоза Лактоза Лактоза Лактоза Лактоза Лактоза Лактоза Лактоза 25 93232 26 Лактоза в цьому препараті має наступну структуру Таблиця 12 Кут 2° Кут 0° 8,0 11,8 12,50 16,30 17,0 19,0 19,5 19,9 20,7 21,1 22,8 23,8 25,0 25,50 26,1 27,3 28,2 28,9 30,2 31,0 31,6 33,1 34,5 34,8 35,5 36,1 36,8 37,5 38,1 38,5 39,3 39,9 40,6 41,8 42,3 43,0 44,1 45,7 47,2 47,9 48,8 49,5 50,2 51,8 4,0 5,90 6,25 8,15 8,50 9,5 9,75 9,95 10,35 10,55 11,4 11,90 12,50 12,75 13,05 13,65 14,10 14,45 15,1 15,5 15,80 16,55 17,25 17,40 17,75 18,05 18,40 18,75 19,05 19,25 19,65 19,95 20,3 20,9 21,15 21,5 22,05 22,85 23,60 23,95 24,40 24,75 25,10 25,90 Міжплощинна відстань d,Å 11,05 7,50 7,08 5,43 5,21 4,67 4,55 4,46 4,29 4,21 3,90 3,74 3,56 3,49 3,41 3,27 3,16 3,09 2,96 2,88 2,83 2,71 2,60 2,58 2,53 2,49 2,44 2,40 2,36 2,34 2,29 2,26 2,22 2,16 2,14 2,10 2,05 1,98 1,93 1,90 1,87 1,84 1,82 1,76 Порівняння результатів інтенсивності відтворення рентгенівського випромінювання міансерину гідрохлориду на різних міжплощинних відстанях в таблицях 8, 9 і 11 показує, що в таблетках з кальцієм дифосфатдигідратом спостерігається значне зниження інтенсивності, чого немає в таблетках з лактозою. Лише при запису дифрактограм табле Відносна інтенсивність , % 0,3 1,0 14,2 10,8 2,4 42,2 51,4 100 13,9 24,3 6,8 9,1 3,4 7,8 4,0 5,4 4,0 1,0 1,0 3,7 3,0 2,7 5,7 5,4 3,0 4,7 7,8 14,2 9,1 5,4 3,0 5,1 3,4 1,7 2,7 3,4 2,7 2,0 2,0 3,0 1,0 1,7 3,0 1,7 ток міансерину гідрохлориду в режимі чутливості 2*103 можливе визначення присутності міансерину гідрохлориду в таблетках і їх кількісний склад. Якщо цей склад розраховувати по значеннях адитивності інтенсивності, то він становить не більше 50% істинного вмісту. 27 93232 28 29 Комп’ютерна верстка Л. Купенко 93232 Підписне 30 Тираж 23 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the production of pharmaceutical composition in the form of tablet based on mianserin hydrochloride
Автори англійськоюShteinhart Mark Volfovych, Prykhodko Roman Mykolaiovych, Dubyna Oleh Viacheslavovych
Назва патенту російськоюСпособ изготовления лекарственного препарата b форме таблеток ha ochobe миансерина гидрохлорида
Автори російськоюШтейнгарт Марк Вольфович, Приходько Роман Николаевич, Дубина Олег Вячеславович
МПК / Мітки
МПК: A61P 25/24, A61K 9/20, A61K 31/498, A61K 31/55
Мітки: форми, лікарського, міансерину, гідрохлориду, препарату, спосіб, таблеток, виготовлення, основі
Код посилання
<a href="https://ua.patents.su/15-93232-sposib-vigotovlennya-likarskogo-preparatu-u-formi-tabletok-na-osnovi-mianserinu-gidrokhloridu.html" target="_blank" rel="follow" title="База патентів України">Спосіб виготовлення лікарського препарату у формі таблеток на основі міансерину гідрохлориду</a>
Попередній патент: Складові частини сигарети та сигарета, які містять капсульовані частинки каталізатора, та спосіб виготовлення сигарети
Наступний патент: Регулювальний клапан з профільованим ущільнювальним елементом
Випадковий патент: Пристрій для термічної переробки відходів