Спосіб отримання частинок зі зменшеними електростатичними зарядами
Формула / Реферат
1. Спосіб отримання частинок носія сухої порошкової композиції для інгаляції, яка містить:
і) фракцію спільно тонкоподрібнених частинок, утворену із суміші моногідрату альфа-лактози, масова частка якого складає 98-99 %, та стеарату магнію, масова частка якого складає 1-2 %, причому частинки суміші мають масовий середній діаметр (MMD), менший за 10 мкм, та
іі) фракцію крупнозернистих частинок моногідрату альфа-лактози, які мають масовий діаметр, що дорівнює 212-355 мкм; причому відношення спільно тонкоподрібнених частинок до крупнозернистих частинок складає 10:90 та 15:85 % у масових частках,
який полягає у:
a) спільному тонкому подрібненні частинок моногідрату альфа-лактози та стеарату магнію та
b) змішуванні спільно тонкоподрібнених частинок з крупнозернистими частинками моногідрату альфа-лактози протягом щонайменше чотирьох годин для надання їм кулястої форми, причому перед змішуванням спільно тонкоподрібнені частинки спочатку кондиціонують, піддаючи їх дії води в атмосфері з відносною вологістю 50-70% при температурі 22±2 °С протягом 48 годин.
2. Спосіб отримання препарату у вигляді сухого порошку для інгаляції, який полягає у змішуванні частинок носія згідно з п. 1 з одним або декількома активними інгредієнтами.
3. Спосіб за п. 2, в якому активний інгредієнт вибрано з групи, що складається з агоністу β2-адренорецептора, кортикостероїду, антихолінергетичного засобу, окремо або в їх комбінації.
4. Спосіб за п. 3, в якому активним інгредієнтом є агоніст β2-адренорецептора, вибраний з групи, що складається з сальбутамолу, тербуталіну, фенотеролу, сальметеролу, формотеролу, індакатеролу, вілантеролу та мілветеролу.
5. Спосіб за п. 3, в якому активним інгредієнтом є кортикостероїд, вибраний з групи, що складається з будезоніду, флутиказону пропіонату, флутиказону фуроату, мометазону фуроату, беклометазону дипропіонату та циклезоніду.
6. Спосіб за п. 3, в якому антихолінергетичним засобом, як активним інгредієнтом, є антихолінергічний бронходилататор, вибраний з групи, що складається з іпратропію броміду, тіотропію броміду, окситропію броміду та глікопіронію броміду.
7. Спосіб за п. 3, в якому агоністом β2-адренорецептора є формотерол фумарат дигідрат, кортикостероїдом є беклометазон дипропіонат, та антихолінергетичним засобом є глікопіронію бромід або тіотропію бромід.
Текст
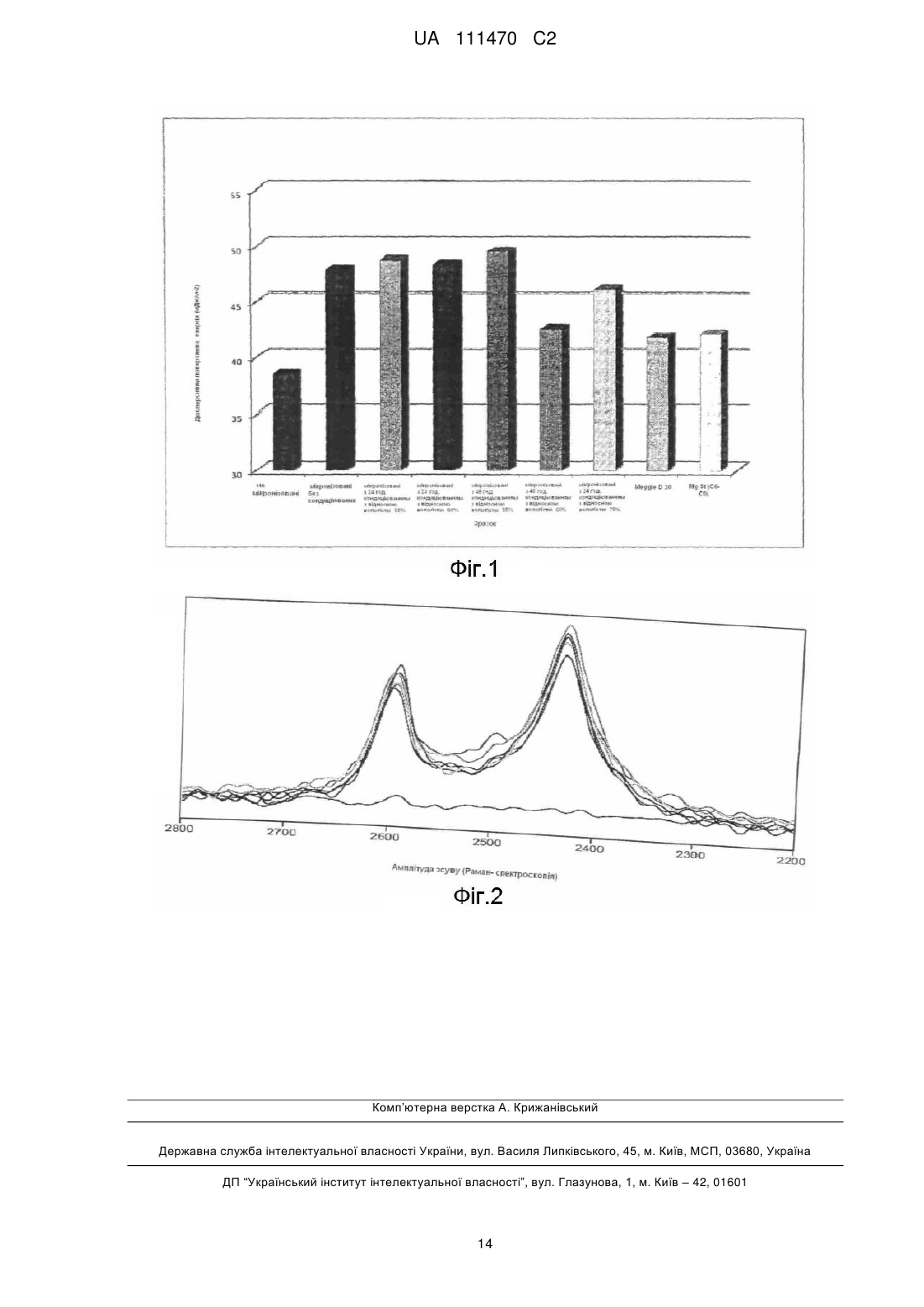
Реферат: Винахід стосується способу отримання частинок носія для препаратів у вигляді сухого порошку для інгаляції, що мають зменшені електростатичні заряди. UA 111470 C2 (12) UA 111470 C2 UA 111470 C2 5 10 15 20 25 30 Винахід стосується способу отримання препаратів у вигляді сухого порошку для інгаляції. Зокрема, винахід стосується способу отримання частинок носія для препаратів у вигляді сухого порошку із зниженими електростатичними зарядами. Для лікування людей, що потерпають від респіраторних захворювань, як-то астма, хронічна обструктивна хвороба легенів (ХОЗЛ) та алергічний риніт, вже багато років застосовують терапію з інгаляторами сухого порошку (DPI). Ліки, призначені для інгаляції у вигляді сухих порошків, треба застосовувати у вигляді тонкоподрібнених частинок, які звичайно отримують подрібненням або за допомогою інших способів, як-то сушіння розпиленням. Призначені для інгаляції препарати у вигляді сухого порошку звичайно отримують шляхом змішування тонкоподрібнених ліків з крупнозернистими частинками носія, що призводить до отримання впорядкованої суміші, в якій тонкоподрібнені активні частинки прилипають до поверхні частинок носія, коли знаходяться в інгаляторі. Носій робить тонкоподрібнений порошок менш здатним зчеплюватися та підвищує його плинність, що, в свою чергу, робить поводження з порошком в процесі виробництва (засипання, заповнювання тощо) більш зручним. Проте відомо, що ці сухі порошки, як правило, стають електростатично зарядженими. Трибоелектризація у фармацевтичних порошках є дуже складним та не зовсім зрозумілим процесом, хоча відомо, що на неї впливають багато факторів. У ході різних операцій при виробництві (подрібнювання, змішування, перенесення та заповнювання), порошки накопичують електростатичні заряди від зіткнень між частинками та від контакту з твердими поверхнями (наприклад, зі стінками контейнера). Процес електростатичної індукції як тертям, так і зіткненням, виявлено в механізмах втрати ліків через сегрегацію, адгезію та утворення агломератів. Крім того, чим більше енергії споживає процес, тим більша схильність матеріалів до накопичування значного рівня електростатичних зарядів. У наступній таблиці наведено деякі типові значення заряду для різних операцій виробництва препаратів у вигляді сухого порошку. Типове утворення зарядів протягом операцій отримання порошку. Посилання: Звід практичних правил контролю небажаної статичної електрики, BS 5958 (British Standards institution, London, 1991) Операція Просіювання Засипання Переміщення реакційної суміші Тонке подрібнення Пневматичне транспортування 35 40 45 Щільність електричного заряду одиниці маси (мкКл/кг) -3 -6 10 -10 -1 -3 10 -10 -2 1-10 2 -1 3 -1 10 -10 10 -10 Підсумковий електростатичний заряд суміші порошку дуже залежить від частоти зіткнень частинок з субстратом та частинок між собою протягом виробництва, що може постійно призводити до накопичування підсумкового заряду у зразку порошку, який може бути позитивним, негативним або тим та іншим. У WO 01/78693 та WO 01/78695 описано препарати у вигляді сухого порошку, що містять фракцію крупнозернистих частинок, фракцію, отриману з дрібних частинок та додаток, як-то стеарат магнію або лейцин, та способи їх отримання. Опублікована заявка США 2004/02022616 розкриває застосування стеарату магнію для поліпшення вологостійкості препаратів у вигляді сухого порошку для інгаляції. Guchardi R. et al Int. J. Pharm. 2008, 348, 10-17 досліджують фізичні властивості сухих порошків для інгаляції в залежності від кількості тонкоподрібнених частинок лактози та присутності стеарату магнію. Зазначені препарати можливо отримати дуже просто, вони хімічно та фізично стійкі та мають добрі інгаляційні властивості. Проте, ці документи не надають жодної інформації стосовно електростатичних зарядів. 1 UA 111470 C2 5 10 15 20 25 30 35 40 45 50 55 60 З іншого боку, зниження електростатичної поляризованості може поліпшити реологічні властивості впродовж операцій процесу виробництва (просіювання, засипання) та під час заповнювання інгалятора. Це, в свою чергу, призвело б до поліпшеної гомогенності активного інгредієнта у препараті, отже, до поліпшеної відтворюваності та точності доставленої дози та дози дрібних частинок. З урахуванням наведених вище міркувань, дуже бажаним буде надання способу отримання порошкових препаратів, наприклад, описаних у WO 01/78693 та WO 01/78695, здатності зменшувати електростатичні заряди, поліпшуючи таким чином робочі характеристики цих препаратів. Винахід стосується способу отримання частинок носія для препарату у вигляді сухого порошку для інгаляцій, що містить: i) фракцію спільно тонкоподрібнених частинок, отриманих з суміші наповнювача та додатку, суміші, що має MMD (масовий середній діаметр), менший, ніж 20 мкм; ii) фракцію крупнозернистих частинок наповнювача, що мають MMD, що дорівнює або вище, ніж 80 мкм, де вказаний спосіб полягає у: a) спільному тонкому подрібненні частинок та наповнювача та частинок та додатку; b) додаванні та змішуванні отриманих спільно тонкоподрібнених частинок з крупнозернистими частинками наповнювача, що відрізняється тим, що ці спільно тонкоподрібнені частинки в операції a) спочатку витримують в умовах відносної вологості у 5075 % при температурі 22±2 °C протягом 24-60 год. У другому аспекті, винахід також стосується способу отримання препарату у вигляді сухого порошку для інгаляції, який полягає у змішуванні частинок носія з одним або декількома активними інгредієнтами. У третьому аспекті, винахід стосується суміші спільно тонкоподрібнених частинок, отриманих з наповнювача та домішки для застосування у препараті у вигляді сухого порошку для інгаляції, де вказана суміш має ефективну щільність електричного заряду у діапазоні -9 × -10 -8 10 - -5 × 10 нКл/г, де вказану суміш можна отримати завдяки способу, що полягає у її кондиціюванні протягом 24-60 год. при кімнатній температурі в умовах відносної вологості у 5075 %. У четвертому аспекті, винахід стосується препарату у вигляді сухого порошку для інгаляції, що містить вищезгадану суміш спільно тонкоподрібнених частинок та один або декілька активних інгредієнтів. У п'ятому аспекті, винахід стосується інгалятора сухого порошку, заповненого вищезгаданим препаратом у вигляді сухого порошку. У шостому аспекті, винахід стосується застосування суміші спільно тонкоподрібнених частинок винаходу для отримання лікарського засобу для профілактики та/або лікування хвороби легенів, як-то астми або хронічної обструктивної хвороби легень (ХОЗЛ). Терміни "активний лікарський засіб", "активний інгредієнт", "активний" та "активний агент", "активна сполука" та "терапевтичний агент" тут застосовано синонімічно. Термін "гігроскопічний" має відношення до активної сполуки, що завжди повністю висихає у контакті з повітрям, що має вміст вологи >0 % відносної вологості, але завжди містить певну кількість абсорбційно зв'язаної води (H. Sucker, P. Fuchs та P. Speiser: Pharmaceutical Technology, Georg Thieme Verlag, Stuttgart, New York, 2nd edition 1991, page 85). Термін "гідрофільний" має відношення до активного інгредієнта, що може легко бути зволоженим водою. Під терміном "кондиціювання" мається на увазі витримування порошку, розміщеного у прийнятному контейнері з комбінацією контрольованих умов температури та відносної вологості. Під "терапевтично ефективною дозою" мається на увазі кількість активного інгредієнта, уведеного одночасно шляхом інгаляції з приведенням в дію інгалятора. Під "приведенням в дію" мається на увазі вивільнення активного інгредієнта з пристрою шляхом однієї активації (наприклад, механічним шляхом або диханням). Під терміном "активний інгредієнт з низкою ефективністю дозування" мається на увазі активний інгредієнт для постачання із застосуванням інгалятора сухого порошку (DPI), де доза, доставлена після кожного приведення в дію інгалятора, дорівнює або є меншою за 12 мкг та переважно дорівнює або є меншою за 6 мкг та більш переважно дорівнює або є меншою за 4 мкг та ще більш переважно є меншою за 2 мкг. Звичайно, розмір частинок вираховують шляхом вимірювання з допомогою лазерної дифракції характеристичного еквівалентного діаметра сфери, відомого, як діаметр за обсягом. Розмір частинок також можна підрахувати вимірюванням мас-діаметра з допомогою 2 UA 111470 C2 5 10 15 20 25 30 35 40 45 50 55 60 відомого прийнятного інструмента, наприклад, гранулометричний аналізатор. Діаметр за обсягом (VD) є пов'язаним з мас-діаметром (MD) через щільність частинок (припускаючи для частинок незалежну від розмірів щільність). Тут розмір частинок наведено на основі мас-діаметра та розподіл часток за розміром наведено на основі масового середнього діаметра (MMD), що відповідає діаметру 50 відсотків частинок за вагою [d(0.5)], та, вибірково, також на основі мас-діаметра у мікрометрах 10 % та 90 % частинок, відповідно, [d(0.1) та d(0.9)]. Термін "тверді гранули" має відношення до сферичних або напівсферичних одиниць, ядро яких складається з крупнозернистих частинок наповнювача. Термін "сферонізація" має відношення до способу надання частинкам, що виникають протягом обробки, сферичної форми. Термін "псевдозрідження" має відношення до властивості DPI-препарату на основі носія бути "псевдозрідженим", тобто легко переноситися у повітряному потоці під час утворення аерозолю. Вказана властивість залежить від опору (когезивності) суміші. Термін "добра плинність" має відношення до препарату, що легко контролюється в процесі виробництва та здатен забезпечити точну та відтворну доставку терапевтично ефективної дози. Характеритики потоку можна оцінити з допомогою різних тестів, як-то кута природного укосу, індекса стислості Карра, співвідношення Хауснера або швидкості потоку крізь отвір. У контексті цієї заявки реологічні властивості тестували шляхом вимірювання швидкості потоку крізь отвір згідно зі способом, описаним у Європейській фармакопеї (European Pharmacopeia). Вираз "добра гомогенність" має відношення до препарату, у якому, при перемішуванні, рівномірність розподілу активного інгредієнта, що наведена у вигляді коефіцієнта мінливості (CV), також відомого, як відносне стандартне відхилення (RSD), є меншою, ніж 2,5 %, переважно дорівнює або є меншою, ніж 1,5 %. Вираз "вдихальна фракція" має відношення до індексу відсотка активних частинок, що можуть глибоко проникнути у легені пацієнта. Вдихальну фракцію, що також має назву фракції дрібних частинок, оцінюють з застосуванням прийнятного in vitro пристрою, як-то багатоступінчастого каскадного імпактора або багатоступінчастого рідкісного імпінджера (MLSI) згідно з процедурами, повідомленими у звичайних фармакопеях та обчислюють по співвідношенню між вдихальною дозою та доставленою дозою. Доставлену дозу обчислюють від сукупного зберігання у пристрої у той час як вдихальну дозу (дозу дрібних частинок) обчислюють від зберігання на Стадіях 3 (S3) до фільтрування (AF), відповідно до частинок з розмірами у 12 год. В якості газу-носія застосували сухий та інертний азот. Після дейтеризування зразки інкубували додатково ще 2 год. в потоці газоподібного азоту для усунення залишкового оксиду дейтерію. У порівнянні з некондиціонованими та не тонкоподрібненими порівняльними зразками було проаналізовано 5 зразків спільно тонкоподрібнених частинок (№1, №2, №3, №4 та №7). На Фіг. 2 показано оптичну щільність смуг валентних коливань зразків спільно тонкоподрібнених частинок, підданих кондиціюванню після дії парів D 2O (строком більш, ніж 12 год. з 25 % відносної вологості). Результати свідчать, що всі завантажені партії містили суттєво незначну кількість аморфного матеріалу у кондиціонованих зразках, порівняно з некондиціонованими. Це наводить на думку про те, що при застосуванні наведеного тут способу кондиціонування відбувається ефективна ре-кристалізація значної кількості аморфного матеріалу, який є наявним у значної кількості аморфного матеріалу, який є наявним у зразку перед початком кондиціонування. Приклад 5 - Отримання носія. Кожен зі зразків спільно тонкоподрібнених частинок Прикладу 1 перемішали з тріщинуватими крупнозернистими частинками моногідрату альфа-лактози, що мали масдіаметр 212-355 мкм; та отримали шляхом просіювання, у співвідношенні масової частки, що дорівнює 90:10 %. Змішування провадили у змішувачі Turbula протягом 4 год. Отримані суміші частинок, які далі позначено як "НОСІЙ", аналізували для визначення розміру частинок шляхом просіювання та із застосуванням показника плинності. Розмір частинок було визначено просіюванням. Реологічні властивості перевірили з допомогою способу, описаного у European Pharmacopeia. Суміші порошків (біля 110 г) завантажили у суху лійку з отвором прийнятного діаметра з можливістю його закривання відповідним засобом. Після видривання отвору у дні лійки записували час, необхідний для того, щоб весь зразок вийшов з неї. Плинність наведено у секундах та у десятих частинах секунд стосовно 100 г зразка. В той час, як кондиціонування не вплинуло на щільність та розмір частинок, у носіях, що містили кондиціоновані спільно тонкоподрібнені частинки, спостерігалося зниження плинності. Для цих зразків, швидкість потоку у отворі діаметром 4 мм становила 136-134 сек./100 г, тоді як швидкість потоку носія, що містив некондиціоновані спільно тонкоподрібнені частинки, дорівнювала близько 142 сек./100 г. Приклад 6 - Отримання препарату у вигляді сухого порошку. У дослідженнях носія, що містить некондиціоновані спільно тонкоподрібнені частинки, застосовували зразки спільно тонкоподрібнених частинок №2 та №8. Частину кожного носія, отриманого, як наведено у Прикладі 5, змішували у міксері Turbula з тонкоподрібненим формотерол фумарат дигідратом (FF) зі швидкістю 32 об/хв. протягом 30 хв. та отриману суміш пропустили крізь сито з розміром отворів 0,3 мм (300 мкм). 11 UA 111470 C2 5 10 15 20 25 Тонкоподрібнений беклометазон дипропіонат (BDP) та частину носія, що залишилася, перемішали з пропущеною крізь сито сумішшю у міксері Turbula при 32 об/хв. протягом 60 хв. для отримання кінцевого продукту. Співвідношення активних інгредієнтів до 10 мг носія дорівнювало 6 мкг FF дигідрату (теоретична доза, що доставляється, дорівнює 4.5 мкг) та 100 мкг BDP. Протягом виробництва не спостерігали жодних агломератів. Порошкові препарати, охарактеризовані стосовно рівномірності розподілення активного інгредієнта та аерозольних властивостей після їх завантаження у мультидозовий порошковий інгалятор описано у WO 2004/012801. Рівномірність розподілення активних інгредієнтів оцінювали шляхом вилучення 20 зразків від різних частин суміші та застосуванням ВЕРХ (високоефективна рідинна хроматографія) хроматографічного аналізу. Оцінювання аерозольних властивостей проводили із застосуванням каскадного імпактора th Андерсона (апарат D), згідно з умовами, повідомленими у European Pharmacopeia 6 Ed 2008, par 2.9.18, pages 293-295. Після аерозолізації 10 доз, каскадний імпактор Андерсона розібрали та кількості ліків, депонованих на різних етапах спочатку відновили промиванням сумішшю розчинника та потім піддали кількісному аналізу з допомогою ВЕРХ-хроматографії (HPLC). Було обчислено такі параметри: i) доставлена доза, що дорівнює кількості ліків, отриманій від пристрою та відновленій в імпакторі; ii) доза дрібних частинок (FPD), яка дорівнює кількості доставленої дози, що була відновлена на етапах S3-AF та має розмір частинок, який дорівнює або є меншим, ніж 5.0 мкм; iii) фракція дрібних частинок (FPF), яка є відсотком дози дрібних частинок; iv) MMAD (мас-медіанний аеродинамічний діаметр). Результати стосовно рівномірності розподілення та аерозольних властивостей (середнє значення ± S.D) наведено відповідно у Таблицях 4 та 5. Таблиця 4 Рівномірність розподілення Рівномірність розподілення % FF (S.D.) CV % % BDP (S.D.) CV % некондиціоновані 97.9 (2.5 %) 2.6 97.9 (2.1 %) 2.1 №2 101.6 (1.8 %) 1.8 101. 5 (1.5 %) 1.5 №8 103.0 (1.1 %) 1.1 101.3 (1.1 %) 1.1 Таблиця 5 Аерозольні властивості Зразок Доставлена доза [мкг] Доза дрібних частинок [мкг] Фракція дрібних частинок [%] MMAD [мкм] Доставлена доза [мкг] Доза дрібних частинок [мкг] Фракція дрібних частинок [%] MMAD [мкм] 30 35 некондиціоновані FF 3.77(±1.1) 2.85(±1.0) 59.36(±8.5) 1.77 BDP 78.81(±13.8) 47.16(±8.5) 59.82(±0.3) 1.38 №2 №8 4.45(±0.3) 2.73(±0.1) 61.49(±0.7) 1.78 4.58(±0.1) 2.90(±0.08) 63.32(±1.3) 1.8 78.54(±2.7) 46.49(±2.8) 59.20(±1.5) 1.4 78.19(±2.1) 48.85(±1.1) 62.49(±0.3) 1.31 З даних, наведених у Таблиці 4, можна зазначити, що препарати, отримані із застосуванням кондиціонованих спільно тонкоподрібнених частинок показують підвищену рівномірність розподілення обох активних інгредієнтів порівняно з тими, що містять некондиціоновані спільно тонкоподрібнені частинки. З даних, наведених у Таблиці 5, можна зазначити, що препарати, отримані з застосуванням кондиціонованих спільно тонкоподрібнених частинок надають більш точну доставлену дозу FF, активного інгредієнта, присутнього у меншій дозі. Крім того, препарати, отримані з застосуванням кондиціонованих спільно тонкоподрібнених частинок виявляють тенденцію до 12 UA 111470 C2 поліпшеної вдихальної фракції для обох активних інгредієнтів. ФОРМУЛА ВИНАХОДУ 5 10 15 20 25 30 1. Спосіб отримання частинок носія сухої порошкової композиції для інгаляції, яка містить: і) фракцію спільно тонкоподрібнених частинок, утворену із суміші моногідрату альфа-лактози, масова частка якого складає 98-99 %, та стеарату магнію, масова частка якого складає 1-2 %, причому частинки суміші мають масовий середній діаметр (MMD), менший за 10 мкм, та іі) фракцію крупнозернистих частинок моногідрату альфа-лактози, які мають масовий діаметр, що дорівнює 212-355 мкм; причому відношення спільно тонкоподрібнених частинок до крупнозернистих частинок складає 10:90 та 15:85 % у масових частках, який полягає у: a) спільному тонкому подрібненні частинок моногідрату альфа-лактози та стеарату магнію та b) змішуванні спільно тонкоподрібнених частинок з крупнозернистими частинками моногідрату альфа-лактози протягом щонайменше чотирьох годин для надання їм кулястої форми, причому перед змішуванням спільно тонкоподрібнені частинки спочатку кондиціонують, піддаючи їх дії води в атмосфері з відносною вологістю 50-70 % при температурі 22±2 °С протягом 48 годин. 2. Спосіб отримання препарату у вигляді сухого порошку для інгаляції, який полягає у змішуванні частинок носія згідно з п. 1 з одним або декількома активними інгредієнтами. 3. Спосіб за п. 2, в якому активний інгредієнт вибрано з групи, що складається з агоністу β 2адренорецептора, кортикостероїду, антихолінергетичного засобу, окремо або в їх комбінації. 4. Спосіб за п. 3, в якому активним інгредієнтом є агоніст β2-адренорецептора, вибраний з групи, що складається з сальбутамолу, тербуталіну, фенотеролу, сальметеролу, формотеролу, індакатеролу, вілантеролу та мілветеролу. 5. Спосіб за п. 3, в якому активним інгредієнтом є кортикостероїд, вибраний з групи, що складається з будезоніду, флутиказону пропіонату, флутиказону фуроату, мометазону фуроату, беклометазону дипропіонату та циклезоніду. 6. Спосіб за п. 3, в якому антихолінергетичним засобом, як активним інгредієнтом, є антихолінергічний бронходилататор, вибраний з групи, що складається з іпратропію броміду, тіотропію броміду, окситропію броміду та глікопіронію броміду. 7. Спосіб за п. 3, в якому агоністом β2-адренорецептора є формотерол фумарат дигідрат, кортикостероїдом є беклометазон дипропіонат, та антихолінергетичним засобом є глікопіронію бромід або тіотропію бромід. 13 UA 111470 C2 Комп’ютерна верстка А. Крижанівський Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 14
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for preparing carrier particles having reduced electrostatic charges
Автори англійськоюCocconi, Daniela, Musa, Rossella
Назва патенту російськоюСпособ получения частиц носителя с уменьшенными электростатическими зарядами
Автори російськоюКоккони Даниела, Муза Росселла
МПК / Мітки
МПК: A61K 9/14
Мітки: отримання, частинок, зарядами, зменшеними, спосіб, електростатичними
Код посилання
<a href="https://ua.patents.su/16-111470-sposib-otrimannya-chastinok-zi-zmenshenimi-elektrostatichnimi-zaryadami.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання частинок зі зменшеними електростатичними зарядами</a>
Попередній патент: Дозувальний насос з регулятором ходу поршня
Наступний патент: Висівна секція для сівалки, сівалка і спосіб сіяння
Випадковий патент: Багатосекційний роторний компресор