Препарат, що містить 2-аміно-2-[2-(4-октилфеніл)етил]пропан-1,3-діол
Формула / Реферат
1. Тверда фармацевтична композиція для перорального введення, що містить:
a) першу сполуку, вибрану з 2-аміно-2-[2-(4-октилфеніл)етил]пропан-1,3-діолу, його фармацевтично прийнятної солі і його фосфатного похідного,
b) наповнювач, і
c) стабілізатор, що містить циклодекстрин або його похідну,
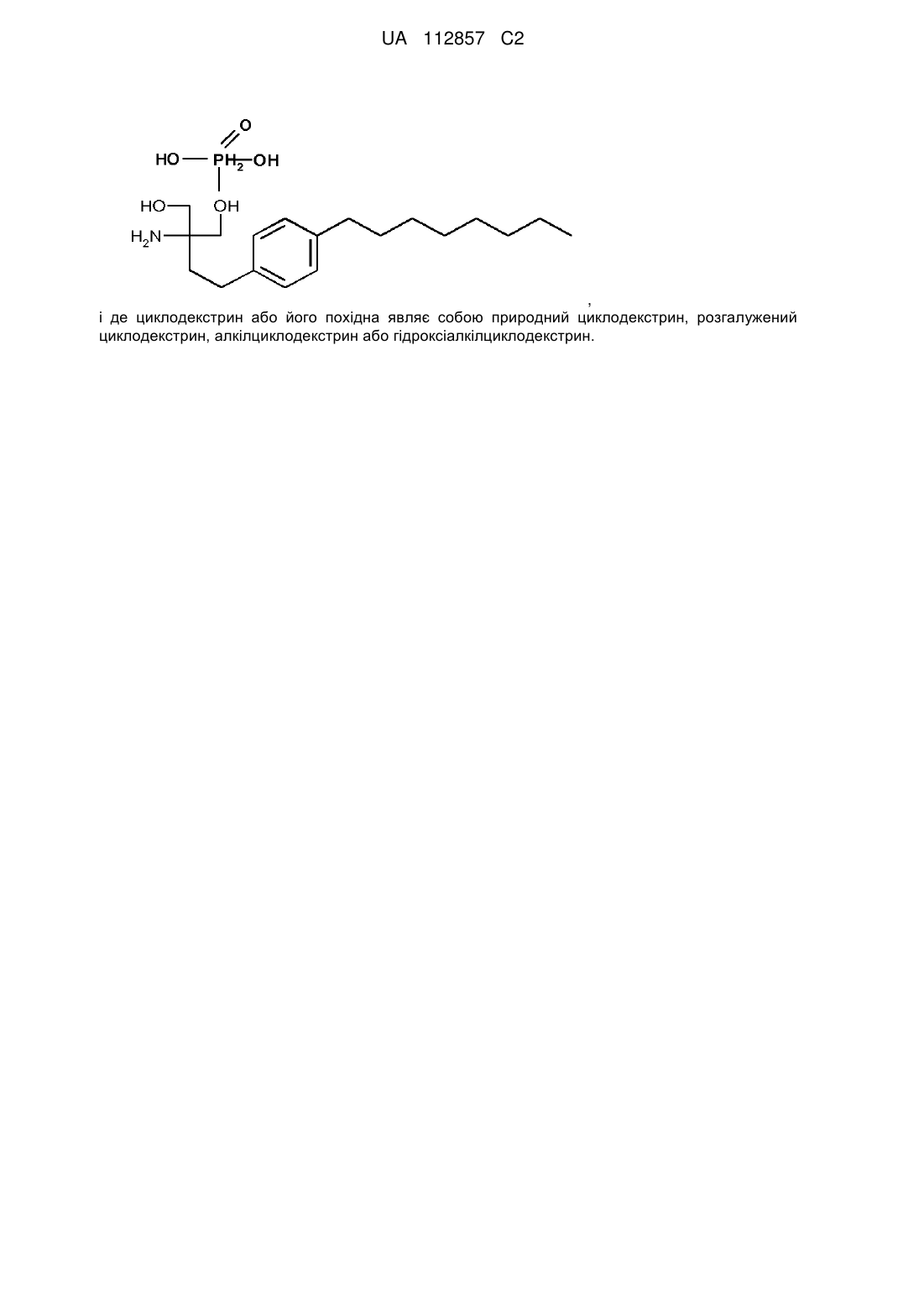
де вказана композиція містить 0,5 мг або менше 2-аміно-2-[2-(4-октилфеніл)етил]пропап-1,3-діолу, де фосфатна похідна має формулу
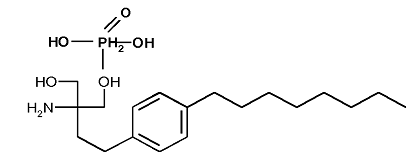 ,
,
і де циклодекстрин або його похідна являє собою природний циклодекстрин, розгалужений циклодекстрин, алкілциклодекстрин або гідроксіалкілциклодекстрин.
2. Композиція за п. 1, де наповнювач містить цукровий спирт.
3. Композиція за п. 2, де наповнювач містить манітол як цукровий спирт.
4. Композиція за будь-яким з пп. 1-3, що додатково містить зв'язувальну речовину.
5. Композиція за п. 4, де зв'язувальна речовина являє собою гідроксипропілцелюлозу.
6. Композиція за будь-яким з пп. 1-5, що додатково містить змащувальну речовину, яка містить стеарат магнію.
7. Композиція за будь-яким з пп. 1-6, де циклодекстрин або його похідна являє собою α-циклодекстрин, β-циклодекстрин, γ-циклодекстрин, гідроксипропілциклодекстрин, сульфбутиловий ефір β-циклодекстрину, додекакис-2,6-О-метил-α-циклодекстрин, тетрадекакис-2,6-О-метил-β-циклодекстрин, гексадекакис-2,6-О-етил-γ-циклодекстрин, тетрадекакис-2,6-О-етил-β-циклодекстрин, α-циклодекстрин, частково етерифікований 2-гідроксипропілом, β-циклодекстрин, частково етерифікований 2-гідроксипропілом, розгалужений α-циклодекстрин або розгалужений β-циклодекстрин, де глюкоза або мальтоза зв'язані за допомогою α-1,6-глюкозидного зв'язку.
8. Композиція за п. 7, де стабілізатор містить гідроксипропіл-бета-циклодекстрин.
9. Композиція за будь-яким з пп. 1-8, де стабілізатор присутній у кількості, в 0,4-3 рази більшій за кількість 2-аміно-2-[2-(4-октилфеніл)етил]пропан-1,3-діолу або його фармацевтично прийнятної солі, у молярному співвідношенні.
10. Композиція за будь-яким з попередніх пунктів, де першою сполукою є 2-аміно-2-[2-(4-октилфеніл)етил]пропан-1,3-діол або його фармацевтично прийнятна сіль.
11. Композиція за будь-яким з попередніх пунктів для застосування у лікуванні аутоімунного захворювання.
12. Композиція за п. 11, де аутоімунне захворювання являє собою розсіяний склероз.
13. Композиція за п. 11, де аутоімунне захворювання являє собою ремітуючо-рецидивний розсіяний склероз (RRMS).
14. Композиція за п. 11, де аутоімунне захворювання являє собою первинно-прогресуючий розсіяний склероз (PPMS).
15. Композиція за будь-яким з попередніх пунктів, де фармацевтична композиція представлена в одиничній дозованій формі, і кожна одинична дозована форма містить від 0,03 до 0,50 мг 2-аміно-2-[2-(4-октилфеніл)етил]пропан-1,3-діолу у вільній формі, у формі фармацевтично прийнятної солі або у формі фосфатної похідної згідно з формулою:
 .
.
Текст
Реферат: Винахід стосується твердої фармацевтичної композиції, придатної для перорального застосування, що містить: a) першу сполуку, вибрану з 2-аміно-2-[2-(4-октилфеніл)етил]пропан-1,3-діолу, його фармацевтично прийнятної солі і його фосфатного похідного, b) наповнювач, і c) стабілізатор, що містить циклодекстрин або його похідну, де вказана композиція містить 0,5 мг або менше 2-аміно-2-[2-(4-октилфеніл)етил]пропап-1,3діолу, де фосфатна похідна має формулу UA 112857 C2 (12) UA 112857 C2 , і де циклодекстрин або його похідна являє собою природний циклодекстрин, розгалужений циклодекстрин, алкілциклодекстрин або гідроксіалкілциклодекстрин. UA 112857 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід відноситься до фармацевтичних композицій, що містять модулятор рецептора S1P, вибраний з 2-аміно-2-[2-(4-октилфеніл)етил]пропан-1, 3-діолу у вільній формі, у формі фармацевтично прийнятної солі (фінголімод, FTY720) і його фосфатного похідного (FTY 720-фосфат), а також до способу їх одержання та застосування фармацевтичних композицій. Гідрохлорид 2-аміно-2-[2-(4-октилфеніл)етил]пропан-1,3-діолу став першим пероральним лікарським засобом, схваленим для скорочення випадків рецидивів і затримки розвитку порушення здоров'я у хворих з формами розсіяного склерозу (MS), що мають рецидиви. Раніше всі лікарські засоби для MS, які представлені на ринку, доставлялися частими ін'єкціями, або внутрішньовенно, або внутрішньом'язово з інтервалом уведення від одного разу на добу до одного разу на тиждень залежно від лікарського засобу. Фінголімод, як вважається, зменшує число лімфоцитів, що циркулюють у кровотоці, зворотно захоплюючи їх частину в лімфатичних вузлах. Отже, число активованих лімфоцитів, що досягають мозку, скорочується, що приводить до зниження запального процесу. Ефективність фінголімоду для лікування розсіяного склерозу була показана на людях (наприклад, як описано в "FTY720 therapy exerts differential effects on T cell subsets in multiple sclerosis", Mehling M, et al., Neurology. 2008 Oct. 14; 71 (16):1261-7; і "Oral fingolimod (FTY720) for relapsing multiple sclerosis", Kappos L, Antel J, Comi G, Montalban X, O'connor P, Polman CH, Haas T, Korn A.A, Karlsson G, Radue E.W; FTY720 D2201 Study Group. N Engl J Med. 2006 Sep. 14; 355(11):1124-40). Фармацевтичні композиції, що містять 2-аміно-2-[2-(4-октилфеніл)етил]пропан-1,3-діол у вільній формі або у формі фармацевтично прийнятної солі (фінголімод) або фосфатного похідного, зокрема, у формі препарату для перорального застосування, відомі в даній галузі, наприклад, описані в EP 1613288A, зміст якого повністю включений в даний опис шляхом посилання. EP 1613288A розкриває таблетку, що містить 1,4 мг гідрохлоридної солі 2-аміно-2[2-(4-октилфеніл)етил]пропан-1,3-діолу, і капсули, що містять 0,56 мг, 1,0 мг або більш гідрохлоридної солі 2-аміно-2-[2-(4-октилфеніл)етил]пропан-1, 3-діолу. Тверді форми гідрохлориду 2-аміно-2-[2-(4-октилфеніл)етил]пропан-1,3-діолу також описані в даній галузі. Наприклад, IPCOM000204549D розкриває кристали гідрохлориду 2-аміно-2-[2-(4октилфеніл)етил]пропан-1,3-діолу, отримані змішуванням приблизно 30 % мас. гідрохлориду 2аміно-2-[2-(4-октилфеніл)етил]пропан-1,3-діолу із приблизно 75 % мас. (- або (-циклодекстрину у воді, потім випаровуванням води з етанолом досуха й сушінням твердої речовини. Відсутні якінебудь вказівки на використання гідрохлориду 2-аміно-2-[2-(4-октилфеніл)етил]пропан-1,3-діолу в низькій кількості, як у даному винаході, при одержанні композиції, що містить низьку кількість гідрохлориду 2-аміно-2-[2-(4-октилфеніл)етил]пропан-1,3-діолу, яка відповідає всім вимогам для фармацевтичних композицій, як тепер досягнуте композиціями даного винаходу. Однак дотепер існує потреба в створенні поліпшеної фармацевтичної композиції для перорального прийому, що містить 2-аміно-2-[2-(4-октилфеніл)етил]пропан-1,3-діол у вільній формі, у фармацевтично прийнятній формі солі або фосфатного похідного. Зокрема, існує потреба в створенні фармацевтичної композиції, яка може бути використана для безпечного застосування й пролонгованої доставки низької кількості сполуки, тобто композиції, яка стабільна, однорідна й показує відповідну однорідність сполуки, що містить 0,5 мг або менше 2аміно-2-[2-(4-октилфеніл)етил]пропан-1,3-діолу. Одержання композиції, яка є стабільної, однорідної, наприклад, яка має відповідну однорідність компонентів, що змішуються, і/або однорідністю лікарського засобу, особливо важливо для композиції з низькою кількістю активної речовини, оскільки в цьому випадку навіть незначна зміна кількості лікарського засобу, наприклад, внаслідок розкладання або неоднорідності, може суттєво вплинути на кількість лікарського засобу, який споживає пацієнт. При обмеженій кількості лікарського засобу в композиції, навіть обмежене його розкладання може привести до того, що пацієнт може одержати кількість лікарського засобу, який занадто мало, щоб забезпечити необхідну терапевтичну дію. Тобто, для пацієнта є дуже важливим одержання відповідної дози лікарського засобу щораз, коли він (або вона) приймає своє лікування з тим, що б мати гарантію тривалої ефективності лікарського засобу. Чим менше вміст лікарського засобу, тем більше число таких вимог необхідно дотримати. Наприклад, може бути показане, що стабільність твердої композиції, що містить фінголімод, залежить від концентрації лікарського засобу, і тому чим менше концентрація сполуки, тим більше воно стає чутливим до деградації. Крім того, при одержанні лікарської форми пероральної композиції, що містить 2-аміно-2-[2(4-октилфеніл)етил]пропан-1,3-діол у вільній формі, у фармацевтично прийнятній формі солі або фосфатного похідного, фахівцеві в даній галузі прийде зіштовхнутися з декількома труднощами, обумовленими природою й властивостями сполуки. Фінголімод нестабільний у 1 UA 112857 C2 5 10 15 20 25 30 35 40 присутності багатьох допоміжних речовин, особливо в умовах підвищених температур або вологості: багато фармацевтично прийнятних допоміжних речовин не сумісні з фінголімодом, тобто при їх додаванні викликають утворення домішок або продуктів розкладання в концентраціях вище припустимого рівня для фармацевтичної композиції, відповідно до вимог регуляторних органів в галузі охорони здоров'я. Фінголімод, зокрема при мікронізації, також статичний по своїй природі й має тенденцію прилипати до металевих поверхонь, приводячи до значної сегрегації лікарського засобу при виробництві лікарських форм. Це може викликати небажані проблеми, при виробництві в більших масштабах композицій, що містять фінголімод, зокрема композицій, що містять низьку дозу лікарського засобу, наприклад, 0,5 мг або менше. У цей час було встановлено, що при використанні стабілізатора, наприклад, циклодекстрину, стає можливо приготувати фармацевтичні композиції для перорального прийому, що містять малу кількість 2-аміно-2-[2-(4-октилфеніл)етил]пропан-1,3-діолу у вільній формі, у фармацевтично прийнятній формі солі або фосфатного похідного, які мають необхідну однорідність сполуки й фізично стабільні навіть у більш тривалі періоди. Зокрема, стало можливо одержати стабільні композиції, що містять менше 0,5 мг 2-аміно-2-[2-(4октилфеніл)етил]пропан-1,3-діолу, наприклад, 0,25 мг або менше. Несподівано, незважаючи на низьку кількість 2-аміно-2-[2-(4-октилфеніл)етил]пропан-1,3діолу, взаємодія фінголімоду з іншими допоміжними речовинами, які необхідні для одержання твердої композиції для перорального приймання, тепер мінімізоване. Крім того, сегрегація, яка відбувалася під час виробничого процесу одержання й приводила до часткового зменшення лікарського засобу, скорочена. У такий спосіб композиції, що містять низьку кількість 2-аміно-2-[2-(4-октилфеніл)етил]пропан-1,3-діолу, наприклад, 0,5 мг або менше, можуть бути отримані у великомасштабному виробничому процесі з обмеженим діапазоном значень вмісту лікарського засобу в різних партіях. Зокрема, застосування стабілізатора, наприклад, циклодекстрину або його похідного, у способі одержання препарату дозволяє змішувати різні інгредієнти (активна речовина й допоміжна речовини), так, щоб одержати суміш із однорідним розміром частинок і, таким чином, забезпечується однорідний розподіл лікарської речовини в отриманій композиції. Згідно з винаходом запропоновані тверді фармацевтичні композиції для перорального приймання, що включають: a) сполуку, обрану з 2-аміно-2-[2-(4-октилфеніл)етил]пропан-1,3-діолу, його фармацевтично прийнятної солі і його фосфатного похідного, b) наповнювач, c) стабілізатор і, необов'язково, d) зв'язувальну і/або змащувальну речовину. Сполуку за винаходом вибирають з 2-аміно-2-[2-(4-октилфеніл)етил]пропан-1,3-діолу у вільній формі, його фармацевтично прийнятної солі і його фосфатного похідного, наприклад, являє собою 2-аміно-2-[2-(4-октилфеніл)етил]пропан-1,3-діол у вільній формі або його фармацевтично прийнятну сіль. Структура 2-аміно-2-[2-(4-октилфеніл)етил]пропан-1,3-діолу (FTY720) показана нижче: . Структура його фосфатного похідного показана нижче: 45 50 . Згідно з винаходом, сполука може являти собою сіль, обрану з аскорбату, оксалату, фосфату, солі мигдальної кислоти, адипату, етансульфонату, нафталін-1, 5-дисульфонату, нафталін-1-сульфонату, нафталін-2-сульфонату, аспартату, наприклад, L-аспартату, бензоату, 4-ацетамідобензоату, (+)камфорату, (+) камфор-10-сульфонату, деканоату, гексаноату, октаноату, цінамату, додецилсульфату, етан-1, 2-дисульфонату, 2-гідроксиетансульфонату, глутарату, лактату, наприклад, Dl-лактату, 1-гідрокси-2-нафтоату, лауреату, саліцилату, гідрохлориду, тартрату, мезилату, цитрату, бензоату, сукцинату, малонату, ацетату, пропіонату і їх сумішей. Сіль, необов'язково, може бути в кристалічній формі. В одному варіанті виконання винаходу сіль являє собою гідрохлорид. 2 UA 112857 C2 5 10 15 20 25 30 35 40 45 50 55 60 Композиція за винаходом може містити від 0,01 до 20 % мас. сполуки за винаходом, наприклад, від 0,1 до 10 %, наприклад, від 0,05 до 10 %, наприклад, від 0,05 до 5 %, наприклад, від 0,05 до 2 %, наприклад, від 0,1 до 5 %, наприклад, від 0,1 до 2 %, наприклад, від 0,1 до 5 %, наприклад, від 0,1 до 2 %, наприклад, від 0,5 до 5 %, наприклад, від 0,5 до 2 %, наприклад, від 0,8 до 1,3 %, наприклад, від 0,9 до 1,2 % мас., від загальної маси композиції, або наприклад, від 0,1 до 0,5 %, наприклад, від 0,15 до 0,5, наприклад, від 0,2 до 0,3 % мас., від загальної маси композиції. Наприклад, композиція за винаходом містить приблизно 1 % мас. модулятора рецептора S1P, від загальної маси композиції, наприклад, 1 % мас. плюс або мінус 0,15 % модулятора рецептора S1P, від загальної маси композиції. Наприклад, приблизно 0,6 % мас., наприклад, приблизно 0,5 % мас., наприклад, приблизно 0,4 % мас., наприклад, приблизно 0,3 % мас., наприклад, приблизно 0,25 % мас., наприклад, приблизно 0,2 % мас., наприклад, приблизно 0,15 % мас., від загальної маси композиції. В іншому прикладі композиція за винаходом містить менше 2 % мас., менше 1,5 % мас., менше 1 % мас. модулятора рецептора S1P, наприклад, менше 0,5 % мас., наприклад, менше 0,4 % мас., наприклад, менше 0,3 % мас., наприклад, менше 0,2 % мас. від загальної маси композиції. Згідно з винаходом, стабілізатор може бути вибраний із циклодекстрину або його похідного, гліцину HСl, бікарбонату натрію і їх сумішей. В одному варіанті виконання винаходу стабілізатор містить циклодекстрин або його похідне, або складається із циклодекстрину або його похідного, наприклад, як визначено тут нижче. Під циклодекстрином і його похідним слід розуміти, наприклад, природний циклодекстрин, розгалужений циклодекстрин, алкіл-циклодекстрин або гідроксиалкіл-циклодекстрин. Наприклад, циклодекстрин або/і його похідне, і може являти собою -циклодекстрин; циклодекстрин, γ-циклодекстрин; гідроксипропіл-циклодекстрин, такий як гідроксипропіл-циклодекстрин або гідроксипропіл-циклоклодекстрин; сульфбутиловий ефір циклодекстрину; додекакис-2, 6-o-метил--циклодекстрин; тетрадекакис-2, 6-o-метил-циклодекстрин; гексадекакис-2,6, о-метил-γ-циклодекстрин; тетрадекакис-2, 6-o-етил-циклодекстрин; -циклодекстрин, частково етерифікований 2-гідроксипропілом; циклодекстрин, частково етерифікований 2-гідроксипропілом; розгалужений -циклодекстрин і розгалужений -циклодекстрин, де глюкоза або мальтоза зв'язані за допомогою -1, 6глюкозидного зв'язку. У конкретному варіанті виконання винаходу циклодекстрин або його похідне являє собою гідроксипропіл--циклодекстрин або гідроксипропіл--циклодекстрин, наприклад, гідроксипропіл--циклодекстрин (також називається тут як ΗΡ- (CD). В іншому варіанті виконання винаходу, циклодекстрин і його похідне не є ні циклодекстрином, ні -циклодекстрином. Композиція за винаходом, наприклад, готовий продукт для перорального прийому або напівфабрикат можуть містити від 0,1 до 30 %, наприклад, від 0,2 до 15 % мас. стабілізатора, наприклад, циклодекстрину або його похідного, наприклад, від 0,4 до 10 %, наприклад, від 0,5 до 10 %, наприклад, від 0,6 до 10 %, наприклад, від 1,5 до 8 % або від 1,5 до 3,5 %, наприклад, від 1,0 до 5 % або від 1,0 до 3 %, наприклад, від 0,1 до 10 %, наприклад, від 0,1 до 8 %, наприклад, від 0,1 до 5 %, наприклад, від 0,1 до 3 %, наприклад, від 0,1 до 1 %, наприклад, від 0,5 до 1 %, по масі стабілізатора, наприклад, циклодекстрину, від загальної маси композиції. Наприклад, композиція за винаходом може містити приблизно 5 %, наприклад, приблизно 4 %, наприклад, приблизно 3 %, наприклад, приблизно 2,5 %, наприклад, приблизно 2 %, наприклад, приблизно 1,5 %, наприклад, приблизно 1 %, наприклад, приблизно 0,5 % мас. стабілізатора, наприклад, циклодекстрину, від загальної маси композиції, наприклад, готового продукту для перорального прийому або напівфабрикату. Згідно з винаходом, стабілізатор, наприклад, циклодекстрин, може бути присутнім у кількості приблизно в 7, наприклад, приблизно в 6, наприклад, приблизно в 5 раз, наприклад, приблизно в 4 рази (у масовому співвідношенні), більшому, ніж кількість модулятора рецептора S1P за винаходом, наприклад, чому кількість 2-аміно-2-[2-(4-октилфеніл)етил]пропан-1,3-діолу або його фармацевтично прийнятної солі, у молярному співвідношенні. Наприклад, кількість стабілізатора, наприклад, циклодекстрину, може бути приблизно в 5 раз більше, наприклад, у чотири рази більше, наприклад, у три рази більше, ніж кількість модулятора рецептора S1P за винаходом, наприклад, ніж кількість 2-аміно-2-[2-(4-октилфеніл)етил]пропан-1,3-діолa у вільній формі або його фармацевтично прийнятної солі, наприклад, гідрохлориду 2-аміно-2-[2-(4октилфеніл)етил]пропан-1,3-діолу, у масовому співвідношенні. Згідно з винаходом, стабілізатор, наприклад, циклодекстрин, може бути присутнім у кількості від приблизно в 0 до 4 раз, наприклад, приблизно у від 0,2 до 3 раз, наприклад, приблизно у від 0,4 до 3 раз, наприклад, приблизно в 0,4 рази, наприклад, приблизно в 1 раз, наприклад, 3 UA 112857 C2 5 10 15 20 25 30 35 40 45 50 55 60 приблизно в 1,5 рази, наприклад, приблизно в 2 рази, наприклад, приблизно в 2,5 рази, наприклад, приблизно в 3 рази, наприклад, приблизно в 3,5 рази (у молярному співвідношенні) більшим, ніж кількість модулятора рецептора S1P за винаходом, наприклад, чому кількість 2аміно-2-[2-(4-октилфеніл)етил]пропан-1,3-діолу або його фармацевтично прийнятної солі, у молярному співвідношенні. Наприклад, кількість стабілізатора, наприклад, циклодекстрину, може бути приблизно в 3 рази або в 2 рази вище, чим кількість модулятора рецептора S1P за винаходом, наприклад, чому кількість 2-аміно-2-[2-(4-октилфеніл)етил]пропан-1,3-діолу або його фармацевтично прийнятної солі, у молярному співвідношенні. В одному варіанті здійснення молярне співвідношення циклодекстрину й 2-аміно-2-[2-(4-октилфеніл)етил]пропан-1,3-діолу у вільній формі або в якості його фармацевтично прийнятної солі, наприклад, гідрохлориду, становить приблизно від 0,6 до 1,2, наприклад, приблизно 0,7, наприклад, приблизно 0,8, наприклад, приблизно 0,9, наприклад, приблизно 1,0, наприклад, приблизно 1,1, наприклад, приблизно 1,2. Відповідно до винаходу, наповнювач може бути вибраний із цукрового спирту, ® мікрокристалічної целюлози (наприклад, Avicel ), метилцелюлози, гідроксипропілцелюлози, гідроксипропілметилцелюлози, крохмалю (наприклад, кукурудзяного крохмалю, прежелатинізованого крохмалю), дикальційфосфату і їх сумішей. У конкретному варіанті виконання винаходу наповнювач вибирається із цукрового спирту, мікрокристалічної целюлози (наприклад, Avicel®) і їх сумішей, наприклад, наповнювач складається з одного або більш цукрових спиртів або суміші одного цукрового спирту з мікрокристалічною целюлозою, наприклад, суміші маніту з мікрокристалічною целюлозою, наприклад, маніту з Avicel®. Відповідно до винаходу, масове співвідношення цукрового спирту (наприклад, маніту або суміші маніту з іншим цукровим спиртом) і мікрокристалічної целюлози може становити приблизно 5:95, наприклад, приблизно 10:90, наприклад, приблизно 15:85, наприклад, приблизно 20:80; наприклад, приблизно 25:75; наприклад, приблизно 30:70; наприклад, приблизно 35:65; наприклад, приблизно 40:60; наприклад, приблизно 45:55; наприклад, приблизно 50:50; наприклад, приблизно 55:45; наприклад, приблизно 60:50; наприклад, приблизно 65:45; наприклад, приблизно 70:00. У конкретному варіанті здійснення масове співвідношення маніт: Avicel становить приблизно 10:90, наприклад, приблизно 15:85, наприклад, приблизно 20:80; наприклад, приблизно 25:75, наприклад, приблизно 30:70, наприклад, приблизно 35:65. В іншому варіанті здійснення наповнювач містить суміш одного або більш цукрових спиртів з іншим наповнювачем, як згадано вище. Наприклад, наповнювач являє собою суміш одного або більш цукрових спиртів із другим компонентом, обраним з метилцелюлози, гідроксипропілцелюлози та гідроксипропілметилцелюлози; наприклад, наповнювач являє собою суміш одного або більш цукрових спиртів з гідроксипропілцелюлозою. В одному конкретному прикладі наповнювач містить суміш маніту і гідроксипропілцелюлози. В іншому варіанті виконання винаходу наповнювач являє собою або містить крохмаль, наприклад, кукурудзяний крохмаль або прежелатинізований крохмаль або їх суміші. Наприклад, масове співвідношення цукрового спирту (наприклад, маніту або суміш маніту з іншим цукровим спиртом) і крохмалю (наприклад, кукурудзяний крохмаль або прежелатинізований крохмаль, або їх суміші) становить приблизно 50:50; наприклад, приблизно 55:45; наприклад, приблизно 60:40; наприклад, приблизно 65:35; наприклад, приблизно 70:30; наприклад, приблизно 75:25; наприклад, приблизно 80:20; наприклад, приблизно 85:15; наприклад, приблизно 90:10. У конкретному варіанті здійснення масове співвідношення маніт:крохмаль, наприклад, маніт:кукурудзяний крохмаль або прежелатинізований крохмаль становить приблизно 55:45; наприклад, приблизно 60:40; наприклад, приблизно 65:35; наприклад, приблизно 70:30; наприклад, приблизно 75:25; наприклад, приблизно 80:20; наприклад, приблизно 85:15. Кількість наповнювача може становити від приблизно 0,1 до приблизно 90 % мас., наприклад, від приблизно 1 до приблизно 30 %, наприклад, від приблизно 10 до приблизно 30 % мас.; наприклад, від приблизно 15 до приблизно 30 % мас.; наприклад, від приблизно 20 до приблизно 30 % мас., наприклад, приблизно 10 %, наприклад, приблизно 15 %, наприклад, приблизно 20 %, наприклад, приблизно 25 %, наприклад, приблизно 30 %, наприклад, приблизно 35 %, наприклад, приблизно 40 %, наприклад, приблизно 45 %, наприклад, приблизно 50 %, наприклад, приблизно 55 %, наприклад, приблизно 60 %, наприклад, приблизно 65 % мас., від загальної маси композиції, наприклад, у кінцевому продукті або його проміжній формі. Відповідно до винаходу дезінтегранти можуть бути обрані із кросповідону, крохмалю (наприклад, кукурудзяного крохмалю, прежелатинізований крохмалю або їх суміші), 4 UA 112857 C2 5 10 15 20 25 30 35 40 45 50 55 60 кроскармелози натрію і їх суміші. В одному прикладі дезінтегрант може містити приблизно від 1 до 6 % мас., наприклад, від 2 до 5 % мас., наприклад, від 3 до 4 % мас. кросповідону. Він може містити приблизно від 4 до 12 % мас., наприклад, приблизно від 5 до 10 % мас., наприклад, приблизно від 6 до 8 % мас. крохмалю (наприклад, кукурудзяного крохмалю, прежелатинізованого крохмалю або їх суміші). Дезінтегрант може містити: В одному варіанті здійснення дезінтегрант може містити суміш кросповідону, прежелатинізованго крохмалю й кроскармелози натрію. Наприклад, він може містити приблизно від 5 до 30 % мас., наприклад, приблизно від 10 до 25 % мас., наприклад, приблизно від 15 до 20 % мас. кроскармелози натрію. Відповідно до винаходу цукровий спирт може бути вибраний з маніту, мальтиту, інозиту, ксиліту, лактиту і їх сумішей. Наприклад, цукровий спирт являє собою по суті негігроскопічний цукровий спирт, наприклад, маніт, наприклад, D-Маніт. Може бути використаний один цукровий спирт або суміш двох або більш цукрових спиртів, наприклад, суміш маніту й ксиліту, наприклад, у співвідношенні 1:1 до 4:1. У конкретному варіанті здійснення цукровий спирт одержують із висушеної розпиленням композиції, наприклад, композиції маніту з високою питомою площею поверхні. Застосування такого типу композиції маніту сприяє рівномірному розподілу модулятора рецептора S1P з манітом у композиції. Більш висока площа поверхні може забезпечуватися цукровим спиртом, наприклад, манітом, приготовленим із частинок з меншим середнім діаметром і/або необроблених частинок. Також було виявлено, що використання висушеного розпиленням цукрового спирту, наприклад, маніту, наприклад, із середнім розміром частинок 300 мкм або менше, поліпшує здатність до пресування і твердість таблеток, отриманих з їх композиції. В одному варіанті виконання винаходу однокрапкова площа поверхні препарату цукрового 2 2 2 спирту, наприклад, маніту становить від 1 до 7 м /г, наприклад, від 2 до 6 м /г або від 3 до 5 м /г. Середній розмір частинок препарату маніту може відповідно становити від 10 до 400 мкм, наприклад, від 10 до 300 мкм, наприклад, від 150 до 250 мкм. Наприклад, середній розмір частинок маніту за винаходом може становити 60 мкм, 120 мкм, 180 мкм, 200 мкм, 300 мкм або 400 мкм. Наприклад, середній розмір частинок маніту може становити 60 мкм або маніт може являти собою Parteck M200. У конкретному варіанті здійснення може бути використана суміш манітів, наприклад, суміш маніту (60 мкм) і маніту (180 мкм) або маніту (60 мкм) і маніту (120 мкм). Наприклад, маніт може являти собою суміш маніту (200 мкм) з іншим манітом, наприклад, з манітом (180 мкм), манітом (60 мкм), манітом (120 мкм) або їх сумішами. Співвідношення маніт (60 мкм): маніт (180 мкм) може варіювати, наприклад, від 1:0 до 2:0, наприклад, від 1:2 до 1:5. Наприклад, може становити приблизно 20 % маніту (60 мкм):70 % маніту (180 мкм); наприклад, приблизно 30 % маніту (60 мкм):60 % маніту (180 мкм); наприклад, приблизно 40 % маніту (60 мкм):50 % маніту (180 мкм). Співвідношення маніту (200 мкм): інший маніт (наприклад, маніт 180 мкм) може варіювати, наприклад, від 1:0 до 2:0. Наприклад, може становити приблизно 20 % маніту (200 мкм): 80 % інших форм маніту; наприклад, приблизно 30 % маніту (200 мкм): 70 % інших форм маніту; наприклад, приблизно 40 % маніту (60 мкм): 60 % інших форм маніту. Насипна щільність маніту може становити від 0,4 до 0,6 г/мл, наприклад, від 0,45 до 0,55 г/мл. Композиція може містити від 20 до 99,99 % мас.; наприклад, від 30 до 99,99 % мас.; наприклад, від 40 до 99,99 % мас.; наприклад, від 50 до 99,99 % мас.; наприклад, 60 до 99,99 % мас.; наприклад, від 70 до 99,99 % мас.; наприклад, від 75 до 99,99 % мас.; наприклад, від 20 до 60 % мас.; наприклад, від 25 до 55 % мас. від 30 до 50 % мас.; наприклад, приблизно 20 % мас.; наприклад, від 85 до 99,9 %, наприклад, від 90 до 99,5 %, наприклад, від 92 до 97 %, наприклад, від 93 до 96 % мас., цукрового спирту, наприклад, маніту, від загальної маси композиції, наприклад, кінцевого продукту, що підходить для перорального прийому або його проміжної форми. Наприклад, вона може містити, наприклад, приблизно 25 % мас.; наприклад, приблизно 30 % мас.; наприклад, приблизно 35 % мас.; наприклад, приблизно 40 % мас.; наприклад, приблизно 45 % мас.; наприклад, приблизно 50 % мас.; наприклад, приблизно 55 % мас.; наприклад, приблизно 60 % мас., наприклад, приблизно 70 % мас., наприклад, приблизно 80 % мас., наприклад, приблизно 90 % мас., наприклад, приблизно 92 % мас., наприклад, приблизно 94 % мас., наприклад, приблизно 95 % мас., наприклад, приблизно 96 % мас., цукрового спирту, наприклад, маніту. Композиція переважно додатково містить змащувальну речовину. Підходящі змащувальні речовини включають стеаринову кислоту, стеарат магнію, стеарат кальцію, стеарат цинку, гліцерил пальмітостеарат, натрію стеарилфумарат, масло каноли, гідрогенізовану рослинну 5 UA 112857 C2 ® 5 10 15 20 25 30 35 40 45 50 55 60 ® олію, таку як гідрогенізована касторова олія (наприклад, Cutina або Lubriwax 101), мінеральне масло, лаурилсульфат натрію, оксид магнію, колоїдний діоксид кремнію, силіконову рідину, поліетиленгліколь, полівініловий спирт, бензоат натрію, тальк, полоксамер або суміш кожного з вищезгаданих. Наприклад змащувальна речовина містить стеарат магнію, гідрогенізовану касторову олію, мінеральне масло, колоїдний діоксид кремнію, поліетиленгліколь або їх суміші, наприклад, стеарат магнію, гідрогенізовану касторову олію, мінеральне масло або їх суміші. У конкретному варіанті здійснення змащувальна речовина складається зі стеарату магнію, гідрогенізованої касторової олії, мінерального масла або їх сумішей, наприклад, складається зі стеарату магнію або суміші стеарату магнію з іншою змащувальною речовиною. Композиція переважно містить від 0,01 до 5 % мас. змащувальної речовини, наприклад, стеарату магнію, наприклад, від 0,5 до 3 % мас., від 1 до 2 % мас., наприклад, приблизно 3 % мас., наприклад, приблизно 2 % мас., приблизно 1 % мас., приблизно 0,5 % мас. приблизно 0,05 % мас., від загальної маси композиції. Композиція може містити одну або більш додаткових допоміжних речовин, таких як зв'язувальна речовина. Зв'язувальна речовина може бути обрана з полівінілпіролідону, метилцелюлози, гідроксипропілцелюлози, гідроксипропілметилцелюлози і їх сумішей. Якщо використовується, то кількість зв'язувальної речовини може становити від 1 до 8 %, наприклад, від 3 до 6 % мас., від загальної маси композиції. Застосування зв'язувальної речовини збільшує міцність гранул препарату, що особливо важливо для тонкої грануляції. Особливо кращими є мікрокристалічна целюлоза й метилцелюлоза, якщо потрібні висока твердість таблетки і/або більш тривалий час розпаду. Гідроксипропілцелюлоза може бути краща, якщо потрібно більш швидка розпаду. Якщо використовується, то в якості додаткової зв'язувальної речовини може бути доданий ксиліт, наприклад, на додаток до мікрокристалічної целюлози, наприклад, у кількості до 30 % мас., наприклад, до 20 % мас.; наприклад, до 10 % мас. цукрового спирту, наприклад, маніту або ксиліту, або їх суміші. Композиція за винаходом відноситься до твердої композиції, що підходить для перорального прийому, або її проміжній формі, наприклад, препарат може бути використаний для одержання твердої композиції, що підходить для перорального приймання, де композиція може бути у формі м'якого гелю, порошку, гранул або пелет, або дозованої лікарської форми, наприклад, таблетки або капсули, наприклад, таблетка, отримана сушінням заморожуванням. Композиції по даному винаходу адаптовані для капсулювання в капсульні оболонки для перорального приймання, зокрема, желатинові тверді оболонки або HPMC (гіпромелоза) капсули. Наприклад, це можуть бути композиції, якими заповнюють тверді желатинові капсули, застосовуючи технологію розподілу рідини. Розчин, що містить сполука за винаходом, може бути розподілений у капсулі, яка попередньо заповнена цукровим спиртом, як визначено вище, наприклад, манітом. Альтернативно, композиції можуть бути спресовані в таблетки. Необов'язково, таблетки можуть бути покриті, наприклад, покриттями з тальку або полісахариду (наприклад, целюлози) або гідроксипропілметилцелюлози. Композиція за винаходом не є ін'єкційною або іншою парентеральною композицією. Якщо фармацевтична композиція представлена в одиничній дозованій лікарській формі, кожна одинична дозована форма може містити від 0,01 мг до 5 мг модулятора рецептора S1P, наприклад, від 0,01 мг до 1 мг, наприклад, від 0,01 мг до 0,7 мг, наприклад, від 0,03 до 0,50 мг, наприклад, від 0,05 мг до 0,50 мг, наприклад, від 0,06 мг до 0,50 мг, наприклад, від 0,10 мг до 0,50 мг, наприклад, від 0,12 до 0,50 мг, наприклад, від 0,13 мг до 0,50 мг, наприклад, від 0,14 мг до 0,50 мг, наприклад, від 0,15 мг до 0,50 мг, наприклад, від 0,16 мг до 0,50 мг, наприклад, від 0,17 мг до 0,50 мг, наприклад, від 0,18 мг до 0,50 мг, наприклад, від 0,19 мг до 0,50 мг, наприклад, від 0,20 мг до 0,50 мг, наприклад, від 0,21 мг до 0,50 мг, наприклад, до 0,22 мг до 0,50 мг, наприклад, до 0,23 мг до 0,50 мг, наприклад, до 0,24 мг до 0,50 мг, наприклад, до 0,25 мг до 0,50 мг, наприклад, до 0,26 мг до 0,50 мг, наприклад, до 0,27 мг до 0,50 мг, наприклад, до 0,28 мг до 0,50 мг, наприклад, до 0,29 мг до 0,50 мг, наприклад, до 0,30 мг до 0,50 мг, наприклад, до 0,32 мг до 0,50 мг, наприклад, до 0,34 мг до 0,50 мг. В іншому варіанті здійснення кожна одинична дозована форма може містити від 0,01 мг до 0,40 мг, наприклад, від 0,02 мг до 0,40 мг, наприклад, від 0,03 мг до 0,40 мг, наприклад, від 0,06 мг до 0,40 мг, наприклад, від 0,10 мг до 0,40 мг, наприклад, від 0,12 мг до 0,40 мг, наприклад, від 0,13 мг до 0,40 мг, наприклад, від 0,14 мг до 0,40 мг, наприклад, від 0,15 мг до 0,40 мг, наприклад, від 0,16 мг до 0,40 мг, наприклад, від 0,17 мг до 0,40 мг, наприклад, від 0,18 мг до 0,40 мг, наприклад, від 0,20 мг до 0,40 мг, наприклад, від 0,22 мг до 0,40 мг, наприклад, від 0,25 мг до 0,40 мг, наприклад, від 0,30 мг до 0,40 мг, наприклад, від 0,35 мг до 0,40 мг. 6 UA 112857 C2 5 10 15 20 25 30 35 40 45 50 55 60 У додатковому варіанті здійснення кожна одинична дозована форма може містити від 0,050 мг до 0,350 мг, наприклад, від 0,050 мг до 0,325 мг, наприклад, від 0,060 мг до 0,350 мг, наприклад, від 0,060 мг до 0,325 мг, наприклад, від 0,125 мг до 0,350 мг, наприклад, від 0,125 мг до 0,325 мг. У конкретному варіанті здійснення кожна одинична дозована форма містить приблизно 0,125 мг, приблизно 0,250 мг або приблизно 0,500 мг. В іншому конкретному варіанті здійснення кожна одинична дозована форма містить приблизно 0,03 мг, приблизно 0,06 мг, приблизно 0,125 мг, приблизно 0,250 мг, приблизно 0,325 мг або приблизно 0,500 мг. Наприклад, якщо композиція представлена в одиничній дозованій лікарській формі, кожна одинична дозована форма композиції за винаходом може містити приблизно 0,50 мг, наприклад, приблизно 0,40 мг, наприклад, приблизно 0,30 мг, наприклад, приблизно 0,25 мг, наприклад, приблизно 0,20 мг, наприклад, приблизно 0,15 мг, наприклад, приблизно 0,14 мг, наприклад, приблизно 0,13 мг, наприклад, приблизно 0,12 мг, наприклад, приблизно 0,11 мг, наприклад, приблизно 0,10 мг, наприклад, приблизно 0,06 мг, наприклад, приблизно 0,05 мг, наприклад, приблизно 0,04 мг, наприклад, приблизно 0,03 мг, наприклад, приблизно 0,02 мг, наприклад, приблизно 0,01 мг, наприклад, приблизно 0,375 мг, наприклад, 0,325 мг, наприклад, 0,175 мг, наприклад, приблизно 0,135 мг, наприклад, приблизно 0,125 мг, наприклад, приблизно 0,115 мг, наприклад, приблизно 0,105 мг. Наприклад, якщо фармацевтична композиція за винаходом представлена в одиничній дозованій формі, наприклад, являє собою капсулу або таблетку, і містить приблизно 0,06 мг, або приблизно 0,125 мг, або приблизно 0,250 мг, або приблизно 0,325 мг або приблизно 0,375 мг модулятора рецептора S1P за винаходом, наприклад, гідрохлориду 2-аміно-2-[2-(4октилфеніл)етил]пропан-1,3-діолу. Композиції за винаходом проявляють гарні показники стабільності, як показано в стандартних тестах на стабільність, наприклад, проявляють стабільність протягом строку придатності до одного, двох або трьох років, і навіть більш довгий строк. Як тут визначене, стабільні фармацевтичні композиції відносяться до фармацевтичних композицій, що не містять домішок, або містять домішки в припустимій кількості, наприклад, при зберіганні при кімнатній температурі, зокрема згідно із правилами й вимогам Регулювальних органів охорони здоров'я. Показники стабільності можуть бути визначені, наприклад, шляхом виміру продуктів розпаду методами ВЕРХ після зберігання протягом певних періодів часу при певних температурах, наприклад, при 20(, 40 (або 60(C і/або в умовах високої вологості. Фармацевтичні композиції даного винаходу можуть бути отримані стандартними способами, наприклад, звичайними методиками змішування, гранулювання, глазурування цукром, розчинення або ліофілізації. Методики, які можуть бути використані, відомі в даній галузі, rd наприклад, описані в L. Lachman et al. The Theory and Practice of Industrial Pharmacy, 3 Ed, 1986, H. Sucker et al, Pharmazeutische Technologie, Thieme, 1991, Hagers Handbuch der th pharmazeutischen Praxis, 4 Ed. (Springer Verlag, 1971) і Remington's Pharmaceutical Sciences, th 13 Ed., (Mack Publ., Co., 1970) або більш пізніх виданнях. В одному аспекті даний винахід відноситься до способу одержання фармацевтичної композиції, де спосіб включає: (a) змішування стабілізатора, наприклад, циклодекстрину, з модулятором рецептора S1P; і, необов'язково, здрібнювання і/або гранулювання отриманої суміші, (b) змішування наповнювача, наприклад, цукрового спирту, наприклад, маніту; необов'язково, здрібнювання і/або гранулювання отриманої суміші; (c) необов'язково, здрібнювання і/або гранулювання отриманої в (b) суміші; і (d) змішування розмеленої і/або гранульованої суміші, отриманої в (b) або (c), зі змащувальною речовиною. На стадії (b) наповнювач, наприклад, цукровий спирт, наприклад, маніт, може бути, необов'язково, розмелений і/або здрібнений перед додаванням до суміші, отриманої на стадії (a). В іншому варіанті виконання винаходу композиція за винаходом може бути отримана способом, що включає: (a) змішування стабілізатора, наприклад, циклодекстрину, з модулятором рецептора S1P; і, необов'язково, здрібнювання і/або гранулювання отриманої суміші, (a1) змішування сполучного (наприклад, гідроксипропілцелюлози) за винаходом із цукровим спиртом, наприклад, манітом; і, необов'язково, здрібнювання і/або гранулювання отриманої суміші; (b) змішування сумішей, отриманих на стадії (a) і (a1); 7 UA 112857 C2 5 10 15 20 25 30 35 40 45 50 55 60 (c) необов'язково, здрібнювання і/або гранулювання отриманої в (b) суміші; і (d) змішування розмеленої і/або гранульованої суміші, отриманої в (b) або (c), зі змащувальною речовиною. При використанні цього способу досягається одержання препарату з хорошими показниками вмісту й однорідності суміші (тобто з по суті рівномірним розподілом модулятора рецептора S1P у композиції), часом розчинення й стабільністю. Модулятор рецептора S1P, наприклад, гідрохлорид 2-аміно-2-[2-(4-октилфеніл)етил]пропан1,3-діолу, може бути, необов'язково, мікронізований і/або попередньо просіяний, наприклад, через сита з розміром меш гнізда 400-500 мкм, перед стадією (a) для видалення грудок. Стадія змішування (a) може відповідно включати змішування модулятора рецептора S1P і наповнювача, наприклад, цукрового спирту, наприклад, маніту в будь-якій підходящій мішалці або змішувачі з, наприклад, 100-400 обертами. Спосіб може бути виконаний шляхом сухого змішування компонентів. У цьому варіанті здійснення стадія здрібнювання (a), (a1), або (c) може відповідно містити в собі пропущення суміші, отриманої в (a) або (a1), через сито із кращим розміром меш гнізда 400-500 мкм. Стадія (a) способу може містити в собі стадію змішування загальної кількості модулятора рецептора S1P спочатку із циклодекстрином з утворенням попередньої суміші. Потім необхідна кількість цукрового спирту додається в цю суміш. Стадія (a), (a1) або (c) може також включати стадію додавання розчину зв'язувальної речовини, наприклад, метилцелюлози і/або ксиліту, наприклад, водного розчину, перед змішуванням. Альтернативно, зв'язувальну речовину додають у суху суміш, а воду на стадії грануляції. Розмелена суміш, отримана в (a) або (a1), необов'язково, може бути перемішана ще раз до змішування зі змащувальною речовиною. Змащувальна речовина, наприклад, стеарат магнію, переважно попередньо просівають, наприклад, через сито 800-900 мкм, перед змішуванням. Альтернативно, може використовуватися метод вологої грануляції. У цьому варіанті здійснення модулятор рецептора S1P переважно солюбілізують у розчиннику зі стабілізатором, наприклад, циклодекстрином і розпорошують на суху суміш обраного наповнювача, наприклад, цукрового спирту, наприклад, маніту. Отримана суміш наповнювач/модулятор рецептора S1P, наприклад, суміш цукровий спирт/модулятор рецептора S1P, наприклад, суміш маніт/модулятор рецептора S1P, потім може бути змішана в сухій формі з іншою зв'язувальною речовиною, такою як, наприклад, гідроксипропілцелюлоза або гідроксипропілметилцелюлоза. Потім додають розчинник, і суміш подрібнюють, наприклад, на автоматичному грануляторі. Потім гранулят сушать і розмелюють. Розчинником може бути вода. Альтернативно, може бути використаний метод нанесення покриття розпиленням. У цьому варіанті здійснення DS, у формі розчину (DS+CD), розпорошують на гранули цукру або гранули маніту, розчинник випаровують, і висушені гранули капсулюють у тверді желатинові або HPMC капсули. Розчинники для одержання розчину DS можуть являти собою воду (водний) або етанол (неводний). Необов'язково, може бути додана додаткова кількість сполучного на стадії (d) до суміші, отриманої в (b). Спосіб може включати наступну стадію одержання таблеток або капсулювання суміші, отриманої в (d), наприклад, у тверду желатинову капсулу на автоматичнім устаткуванні для капсулювання. Капсули можуть бути пофарбовані або маркіровані для того, щоб придати бажаний зовнішній вигляд і зробити їх добре розпізнаваними. Барвники можуть служити для посилення розпізнавання, а також для ідентифікації капсул. Фармацевтично прийнятні барвники, як правило, включають каротиноди, оксиди заліза й хлорофіл. Переважно, капсули за винаходом маркіруються кодом. Відповідно до винаходу забезпечується спосіб одержання твердої композиції для перорального прийому 2-аміно-2-[2-(4-октилфеніл)етил]пропан-1,3-діолу у вільній формі, у фармацевтично прийнятній формі солі або у формі фосфатного похідного, що включає в себе стадії: (i) змішування сполуки, обраного з 2-аміно-2-[2- (4-октилфеніл)етил]пропан-1,3-діолу, його фармацевтично прийнятної солі і його фосфатного похідного, зі стабілізатором, наприклад, циклодекстрином, у розчиннику; (ii) змішування наповнювача, наприклад, цукрового спирту, до суміші, отриманої на стадії (i); (iii) додавання розчинника; (iv) гранулювання, (v) сушіння, здрібнювання, змішування, і (vi) необов'язково, таблетування або капсулювання. Необов'язково, щоби зв'язувальна речовина була змішана, наприклад, у сухій формі, із сумішшю, отриманої на стадії (ii) і/або стадії (iii). У конкретному варіанті здійснення, використовуваний на стадії (ii) наповнювач, наприклад, цукровий спирт, наприклад, маніт, являє собою такою, отриманий сушінням з розпиленням. 8 UA 112857 C2 5 10 15 20 25 30 35 40 45 50 При здійсненні цього способу досягається одержання препарату, що показує хороші показники вмісту й однорідності суміші (тобто по суті рівномірний розподіл лікарського засобу по всій композиції), і стабільність. Фармацевтичні композиції по даному винаходу можуть застосовуватися як окремо, так і в комбінації з іншими активними компонентами, для лікування й профілактики станів, наприклад, як розкрито в US 5604229, WO 97/24112, WO 01/01978, US 6004565, US 6274629 і JP-14316985, повний зміст яких включено в даний опис шляхом вказівки посилання. Зокрема, фармацевтичні композиції можуть застосовуватися для: a) лікування й запобігання відторгнення органа або трансплантата тканини, наприклад, для лікування реципієнтів трансплантатів серця, легені, комбінації серця-легені, печінки, нирки, підшлункової залози, шкіри або роговиці, і запобігання реакції "трансплантат проти хазяїна", яка іноді зустрічається після пересадження кісткового мозку; зокрема, при лікуванні відторгнення гострого або хронічного ало- і ксенотрансплатату, або при трансплантації інсулін-продукуючих клітин, наприклад, кліток панкреатичних острівців; b) лікування й запобігання аутоімунної хвороби або запальних захворювань, наприклад, тривалих хронічних захворювань, наприклад, розсіяного склерозу, артриту (наприклад, ревматичного артриту), запального захворювання кишечнику, гепатиту і т. д.; Розсіяний склероз може ухвалювати кілька форм із новими симптомами, що проявляються або в дискретних атаках (рецидивні форми), або повільно наростаючими протягом довгого часу (прогресуючі форми). Як тут визначене, до розсіяного склерозу без обмеження відносяться ремітуючий-рецидивний розсіяний склероз (RRMS) або первинно-прогресуючий розсіяний склероз (PPMS), наприклад, RRMS. Відповідно до даного винаходу, терміни "лікування" або "лікувати" відносяться або до профілактичних, або превентивним заходам, а також до лікування або зміни стану захворювання, включаючи лікування пацієнтів c ризиком виникнення захворювання або порушення, або з підозрою на ризик виникнення захворювання або порушення, а також пацієнтів, які вже хворі або були діагностовані, як такі, що мають захворювання або порушення. Як тут визначене, лікування розсіяного склерозу без обмеження відноситься до зниження частоти клінічних загострень, затримці прогресування симптомів або порушень, асоційованих з розсіяним склерозом, або затримці настання фізичного порушення здоров'я, викликаного розсіяним склерозом. Симптоми або порушення, асоційовані з розсіяним склерозом, охоплюють неврологічні симптоми, порушення фізичного й когнітивного здоров'я, а також психоневрологічні порушення. Відповідно, у додаткових аспектах даний винахід забезпечує: 1. Композицію, як визначено вище, для застосування для лікування або запобігання захворювання або стану, як визначено вище. 2. Спосіб лікування суб'єкта, що потребує імуномодуляції, який включає введення суб'єктові ефективної кількості композиції, як визначено вище. 3. Спосіб лікування або запобігання захворюванню або стану, як визначено вище, що включає введення суб'єктові композиції, як визначено вище. 4. Застосування фармацевтичної композиції, як визначено вище, для одержання лікарського засобу для запобігання або лікування захворювання або стану, як визначено вище. Винахід далі буде розкритий у наступних конкретних варіантах здійснення. Приклад 1 FTY720 розчиняли у воді для одержання приблизно 20 відсоткового розчину (розчин A). ΗΡ(CD розчиняли у воді для одержання приблизно 15 відсоткового розчину (розчин B). Маніт додавали в гранулятор з малим зусиллям зрушення і розпиляли розчини A і B. У такий спосіб отриману гранульовану масу сушили на лотковій сушарці при 60(C. Висушені гранули потім розмелювали на млині Frewitt із ситами 18 меш. Розмелені гранули змішували зі стеаратом магнію в ємності мішалки. Змащені гранули пресували для одержання таблеток з бажаною дозою 0,04 мг, і потім капсулювали для одержання дози 0,125 мг, що містить: 9 UA 112857 C2 Таблиця 1 Компоненти Кількість (мг) на мінітаблетку 0,040 мг 0,0448 3,755 11,735 0,120 0,040 1 FTY720 Hcl Кількість (мг) на капсулу 125 мг 0,140 0,375 0,125 Маніт USP Гідроксипропіл-бета-циклодекстрин (HP- CD) Магнію стеарат 11 ,0 частини FTY720 еквівалентні 1,119 частинам солі FTY720 Hcl. Приклад 2 Композицію з гідрокси-бета-циклодекстрином за прикладом 1 використовували для одержання порошкової маси для одержання міні-таблеток і капсул. 5 Таблиця 2 Результати дослідження однорідності суміші по загальній кількості продуктів розкладання % FTY720 Обмірюваний Масовий баланс 96,9 0,1 97,1 95,7 0,1 95,9 93,8-99,2 %RS 98,9 0,3 99,2 D: 2,3 93,6 10 Загальне розкладання Діапазон/Середнє 0,2 93,8 У таблиці 2 показані результати однорідності для отриманої суміші з RSD 2,3 %, що показують відсутність проблем сегрегації після фінального змішування. Отриману суміш потім пресують у міні-таблетки й капсулюють. Маса спресованих таблеток становить 4 мг, з дозою, що доставляється, 40 мікрограмів лікарського засобу. 10 UA 112857 C2 Таблиця 3 Стабільність у різних умовах, включаючи умови з навантаженням 50C/75 %RH Умови стабільності/Часовий інтервал Загальне розкладання % FTY720 Обмірюваний Масовий баланс c HP-CD 100,19 Без CD 95,02 c HP-CD 0 50D - сухий/2 тижня 98,97 94,12 0,5 0,7 99,4 94,8 50D-75 % RH/2 тижня 96,04 90,88 1,5 1,2 97,6 92,1 50D-75 % RH/12 тижнів 104,25 100,23 2,5 7,0 106,7 107,2 25D/60 % RH/4 тижня 100,20 93,86 1,2 0,5 101,4 94,3 50D - сухий/4 тижня 99,04 93,99 0,6 1,4 99,6 95,4 50D-75 % RH/4 тижня 95,94 87,23 1,4 2,4 97,4 89,6 0 тиждень Без CD c HP-CD 0,0 100,2 Без CD 95,0 CD=циклодекстрин. 5 Дані нижче показують, що загальна кількість продукту розкладання склала 1,4 % при 50(C/75 % RH протягом 4 тижнів у препараті з ΗΡ- (CD. Капсули, отримані капсулюванням з масою заповнення 14 мг, з дозою 125 мікрограмів кожна. У таблиці 4 показані загальні дані по стабільності в різних умовах, включаючи умови з навантаженням 50(C/75 % RH (відносна вологість). Таблиця 4 Умови стабільності/Час Номер партії % FTY720 обмірюваний Загальне розкладання Масовий баланс c HP-CD Без CD c HP-CD Без CD c HP-CD Без CD 110,4 108,48 0 0 110,0 108,5 50D-75 % RH/2 тиждень 111,07 108,94 110,98 106,09 0,0 0,3 0,2 0,7 111,1 109,2 111,2 106,8 5D/12 тиждень 110,75 109,89 0,4 0,1 111,2 110,0 50D-Cухий/12 тижнів 113,01 110,47 112,46 106,29 0,3 0,4
ДивитисяДодаткова інформація
Назва патенту англійськоюFormulations comprising 2-amino-2-[2 (4-octylphenyl)ethyl]propane-1,3-diol
Автори англійськоюRane, Supriya
Автори російськоюРане Суприя
МПК / Мітки
МПК: A61K 31/724, A61K 9/16, A61K 31/137, A61P 25/28
Мітки: препарат, містить, 2-аміно-2-[2-(4-октилфеніл)етил]пропан-1,3-діол
Код посилання
<a href="https://ua.patents.su/16-112857-preparat-shho-mistit-2-amino-2-2-4-oktilfeniletilpropan-13-diol.html" target="_blank" rel="follow" title="База патентів України">Препарат, що містить 2-аміно-2-[2-(4-октилфеніл)етил]пропан-1,3-діол</a>
Попередній патент: Спосіб приготування олії у формі крему, олія у формі крему, одержана таким способом, тісто, що включає олію, та випечений продукт із його застосуванням
Наступний патент: Синергетична гербіцидна композиція, що містить пеноксулам і гліфосат
Випадковий патент: Спосіб зведення литої смуги