Камсилатна сіль
Формула / Реферат
1. Камсилатна сіль (1r,1'R,4R)-4-метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'Н-диспіро[циклогексан-1,2'-інден-1',2"-імідазол]-4"-аміну:
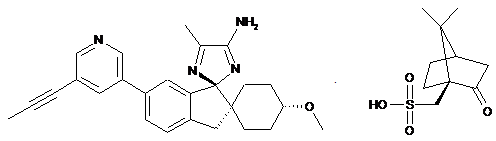 .
.
2. Камсилатна сіль (1r,1'R,4R)-4-метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'Н-диспіро[циклогексан-1,2'-інден-1',2"-імідазол]-4"-аміну:
 ,
,
яка відрізняється тим, що порошкова рентгенограма (XRPD) цієї солі має суттєво дуже високі, високі та середні піки з d-величинами:
Кореговані кути
d-розміщення (Å)
Відносна інтенсивність
5,66
15,60
дуже сильна
7,72
11,44
середня
11,30
7,83
середня
12,35
7,16
сильна
12,83
6,89
середня
15,24
5,81
середня
15,47
5,72
середня
17,17
5,16
середня
18,13
4,89
середня
19,71
4,50
середня
20,77
4,27
середня
21,12
4,20
середня
23,63
3,76
середня
24,50
3,63
середня
26,18
3,40
середня
26,54
3,36
середня
34,30
2,61
середня
36,78
2,44
середня
3. Камсилатна сіль (1r,1'R,4R)-4-метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'Н-диспіро[циклогексан-1,2'-інден-1',2"-імідазол]-4"-аміну:
 ,
,
яка відрізняється тим, що ця сіль суттєво має порошкову рентгенограму (XRPD), яку показано на Фігурі 1.
4. Фармацевтична композиція, яка містить як активну складову терапевтично ефективну кількість солі за п. 1, п. 2 або п. 3 у поєднанні принаймні з одним фармацевтично прийнятним наповнювачем, носієм або розріджувачем.
5. Сіль за п. 1, п. 2 або п. 3 для застосування як медикаменту.
6. Сіль за п. 5 для застосування як медикаменту для лікування або профілактики пов'язаної з Αβ патології.
7. Сіль за п. 6 для застосування як медикаменту для лікування або профілактики пов'язаної з Αβ патології, де цією пов'язаною з Αb патологією є синдром Дауна, b-амілоїдна ангіопатія, церебральна амілоїдна ангіопатія, спадкова церебральна геморагія, розлад, пов'язаний з когнітивною недостатністю, МСІ (м'яка когнітивна недостатність), хвороба Альцгеймера, втрата пам'яті, симптоми дефіциту уваги, пов'язані з хворобою Альцгеймера, нейродегенерація, пов'язана з хворобою Альцгеймера, слабоумство змішаного васкулярного походження, слабоумство дегенеративного походження, пресенільне слабоумство, сенільне слабоумство, слабоумство, пов'язане з хворобою Паркінсона, прогресуючий супрануклеарний параліч або кіркова базальна дегенерація.
8. Сіль за п. 7 для застосування як медикаменту для лікування або профілактики хвороби Альцгеймера.
9. Сіль за п. 1, п. 2 або п. 3 для застосування як медикаменту для лікування або профілактики пов'язаної з Αb патології в комбінації принаймні з одним засобом підсилення розпізнавання, засобом підсилення пам'яті або інгібітором холінестерази.
10. Спосіб лікування або профілактики пов'язаної з Αb патології у пацієнта, що цього потребує, який полягає в призначенні цьому пацієнту терапевтично ефективної кількості солі за п. 1, п. 2 або п. 3.
11. Спосіб за п. 10, в якому пов'язаною з Αb патологією є синдром Дауна, b-амілоїдна ангіопатія, церебральна амілоїдна ангіопатія, спадкова церебральна геморагія, розлад, пов'язаний з когнітивною недостатністю, МСІ (м'яка когнітивна недостатність), хвороба Альцгеймера, втрата пам'яті, симптоми дефіциту уваги, пов'язані з хворобою Альцгеймера, нейродегенерація, пов'язана з хворобою Альцгеймера, слабоумство змішаного васкулярного походження, слабоумство дегенеративного походження, пресенільне слабоумство, сенільне слабоумство, слабоумство, пов'язане з хворобою Паркінсона, прогресуючий супрануклеарний параліч або кіркова базальна дегенерація.
12. Спосіб лікування або профілактики хвороби Альцгеймера у пацієнта, що цього потребує, який полягає в призначенні цьому пацієнту терапевтично ефективної кількості солі за п. 1, п. 2 або п. 3.
13. Спосіб лікування або профілактики пов'язаної з Αb патології у пацієнта, що цього потребує, який полягає в призначенні цьому пацієнту терапевтично ефективної кількості солі за п. 1, п. 2 або п. 3 та принаймні одного засобу підсилення розпізнавання, засобу підсилення пам'яті або інгібітору холінестерази.
Текст
Реферат: Камсилатна сіль (1r,1'R,4R)-4-метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'Ндиспіро[циклогексан-1,2'-інден-1'2'-імідазол]-4"-аміну, фармацевтичні композиції, які містять сіль, та терапевтичні застосування солі для лікування Α-пов'язаних патологій, як-то хвороба Альцгеймера, синдром Дауна, -амілоїдна ангіопатія та стани, як-то слабоумство, охоплюючи слабоумство змішаного васкулярного та дегенеративного походження, пресенільне слабоумство, сенільне слабоумство та слабоумство, пов'язане з хворобою Паркінсона, прогресуючий супрануклеарний параліч або кіркова базальна дегенерація. UA 114196 C2 (12) UA 114196 C2 UA 114196 C2 5 10 15 20 25 30 35 40 45 50 55 Винахід стосується солі камфорсульфокислоти (камсилату) (1r,1'R,4R)-4-метокси-5"-метил6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'H-диспіро[циклогексан-1,2'-інден-1'2'-імідазол]-4"-аміну та фармацевтичних композицій, які містять сіль. Крім того, заявлений винахід стосується терапевтичних способів, які застосовують сіль для лікування та/або попередження наступного: Aβ-пов'язані патології, як-то синдром Дауна, β-амілоїдна ангіопатія, як-то, але без обмеження, церебральна амілоїдна ангіопатія або спадкова церебральна геморагія, розлади, пов'язані з когнітивною недостатністю, як-то, але без обмеження, MCI ("м'яка когнітивна недостатність"), хвороба Альцгеймера, втрата пам'яті, симптоми дефіциту уваги, пов'язані з хворобою Альцгеймера, нейродегенераця, пов'язана з хворобами, як-то хвороба Альцгеймера або слабоумство, охоплюючи слабоумство змішаного васкулярного та дегенеративного походження, пресенільне слабоумство, сенільне слабоумство та слабоумство, пов'язане з хворобою Паркінсона, прогресуючий супрануклеарний параліч або кіркова базальна дегенерація. Первинний невропатологічний випадок, який відрізняє хворобу Альцгеймера (AD), полягає у відкладенні 40-42-осаду амілоїду β-пептиду (Aβ) у паренхімі мозку та церебральних судинах. Головна частина генетичних, біохімічних та in vivo даних підтверджують кардинальну роль Aβ у патологічному каскаді, який зрештою призводить до AD. У пацієнтів зазвичай присутні ранні симптоми (зазвичай - втрата пам'яті) на шостому або сьомому десятиріччях життя. Хвороба прогресує зі зростанням слабоумства та підвищеним відкладенням Aβ. Одночасно, пов'язана з мікроканальцем гіперфосфорилована форма tau-білку акумулюється в нейронах, що призводить до шкідливої дії плетори на нейрональну функцію. Переважна робоча гіпотеза стосовно тимчасової залежності між Aβ та tau-патологіями стверджує, що відкладення Aβ передує tau-агрегації в моделях хвороби в людей та тварин. У межах цього контексту, варто звертати увагу, що точна молекулярна природа Aβ, яка опосередковує цю патологічну функцію, тепер є проблемою інтенсивного дослідження. Найбільш правдоподібним є континуум токсичних різновидів у діапазоні від олігомерів Aβ нижчого порядку до надмолекулярних сукупностей, як-то волокнинки Aβ. Пептид Aβ - інтегральний фрагмент Типу I білку APP (Aβ-амілоїдний білок-попередник), білок повсюдно експресований у тканинах людини. Оскільки розчинні Aβ можна знайти в плазмі та цереброспінальній рідині (CSF) та середовищі з культивованих клітин, APP має піддаватися протеолізу. Існують три головні розщеплення APP, які стосуються патобіології AD, так звані α-, β-, та γ-розщеплення. α-розщеплення, яке відбувається приблизно в середині домену Aβ у APP, виконується металопротеазами ADAM10 від ADAM17 (остання також відома як TACE). βрозщеплення, яке відбувається при N-кінцевому Aβ, генеровано трансмембранною аспартилпротеазою Beta site APP Cleaving Enzyme1 (BACE1). γ-розщеплення, яке генерує C-кінцеві Aβ та подальше вивільнення пептиду, зроблено мульти-субодиницею аспартил-протеази, названої γсекретазою. Розщеплення ADAM10/17, а потім - розщеплення γ-секретази призводить до вивільнення розчинного пептиду p3, N-кінцевого скороченого фрагменту Aβ, який втрачає силу формувати відкладення амілоїду у людей. Цей протеолітичний шлях як зазвичай називають "неамілоідогенний шлях". Послідовне розщеплення з допомогою BACE1 та γ-секретази генерує інтактний пептид Aβ, отже, ця схема називається амілоідогенним шляхом. При наявності цієї інформації можливо передбачати два можливі шляхи зниження продукування Aβ: стимулювання неамілоідогенного шляху, або інгібувати чи модулювати амілоідогенний шлях. Ця заявка зосереджена на останній стратегії, інгібуванні модулюванні амілоідогенного шляху. Амілоідогенні бляшки та судинна амілоїдна ангіопатія також характеризують наступне: мозки пацієнтів з Trisomy 21 (синдромом Дауна), спадкова церебральна геморагія з амілоідозом Dutch-типу (HCHWA-D) та інші нейродегенеративні хвороби. Неврофібрилярні ускладнення також відбуваються при інших нейродегенеративних хворобах, охоплюючи хвороби, які збуджують слабоумство (Varghese, J., et al, Journal of Medicinal Chemistry, 2003, 46, 4625-4630). β-амілоїдні відкладення переважно є сукупністю пептиду Aβ, який в свою чергу є продуктом протеолізу попереднику амілоіду білку (APP). Конкретніше, пептид Aβ є результатом розщеплення APP при C-кінцях одною або більше γ-секретаз, та при N-кінцях ферментом βсекретазою (BACE), також відомою як аспартил-протеаза або Asp2, або Beta site APP Cleaving Enzyme (BACE), як частина β-амілоідогенного шляху. Активність BACE корельовано безпосередньо до генерування пептиду Aβ з APP (Sinha, et al, Nature, 1999, 402, 537-540), та дослідження все більшою мірою вказують, що інгібування BACE стримує продукування пептиду Aβ (Roberds, S. L., et al, Human Molecular Genetics, 2001, 10, 1317-1324). BACE - мембранозв'язаний білок типу 1, який синтезовано як частково активний профермент, та є дуже експресованим у мозкову тканину. Є намір втілювати головну активність 1 UA 114196 C2 5 10 15 20 25 30 β-секретази та вважати обґрунтованою стадію, що лімітує швидкості реакції продукування амілоїд-β-пептиду (Aβ). Отже, лікам, які зменшують або блокують активність BACE, слід зменшувати рівні Aβ та рівні фрагментів Aβ у мозку, або в іншому місці, де осаджені Aβ або їх фрагменти та, отже, сповільнювати створення амілоїдних бляшок та прогресію AD або інших хвороб, охоплюючи відкладення Aβ або його фрагментів. Тому BACE є важливим кандидатом для розширення ліків як для лікування та/або профілактики наступного: Aβ-пов'язані патології, як-то синдром Дауна, β-амілоїдна ангіопатія, як-то, але без обмеження, церебральна амілоїдна ангіопатія або спадкова церебральна геморагія, розлади, пов'язані з когнітивною недостатністю, як-то, але без обмеження, MCI ("м'яка когнітивна недостатність"), хвороба Альцгеймера, втрата пам'яті, симптоми дефіциту уваги, пов'язані з хворобою Альцгеймера, нейродегенерація, пов'язана з хворобами, як-то хвороба Альцгеймера або слабоумство, охоплюючи слабоумство змішаного васкулярного та дегенеративного походження, пресенільне слабоумство, сенільне слабоумство та слабоумство, пов'язане з хворобою Паркінсона, прогресуючий супрануклеарний параліч або кіркова базальна дегенерація. Отже, слід бути корисним інгібувати відкладення Aβ та його частин інгібуванням BACE через інгібітори, як-то передбачені тут сполуки. Терапевтичний потенціал інгібування відкладення Aβ має багато мотивованих груп, щоб виділяти та характеризувати ферменти секретази та ідентифікувати їх можливі інгібітори. Фігура 1 - рентгенівська дифракція на порошку камсилатної солі (1r,1'R,4R)-4-метокси-5"метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'H-диспіро[циклогексан-1,2'-інден-1'2'-імідазол]-4"-аміну. Заявлений винахід стосується камсилатної солі сполуки (1r,1'R,4R)-4-метокси-5"-метил-6'-[5(проп-1-ін-1-іл)піридин-3-іл]-3'H-диспіро[циклогексан-1,2'-інден-1'2'-імідазол]-4"-аміну. Камсилатну сіль (1r,1'R,4R)-4-метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'Hдиспіро[циклогексан-1,2'-інден-1'2'-імідазол]-4"-аміну альтернативно можна зображати як камфорсульфокислотну сіль (1r,1'R,4R)-4-метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]3'H-диспіро[циклогексан-1,2'-інден-1'2'-імідазол]-4"-аміну. Одне втілення заявленого винаходу - камсилатна сіль сполуки (1r,1'R,4R)-4-метокси-5"метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'H-диспіро[циклогексан-1,2'-інден-1'2'-імідазол]-4"-аміну, описане діаграмою рентгенівської дифракції (XRPD), де наведено, по суті, наступні піки з величинами d-розміщення як зображено в таблиці 1: Таблиця 1 Піки, визначені рентгенівською дифракцією на порошку Кореговані кути 5,66 7,72 8,11 11,30 12,35 12,83 14,97 15,95 15,24 15,47 16,24 16,68 17,17 17,33 17,62 17,84 18,13 19,71 20,18 20,77 21,12 21,67 21,88 d- Розміщення (Å) 15,60 11,44 10,89 7,83 7,16 6,89 6,29 5,88 5,81 5,72 5,45 5,31 5,16 5,11 5,93 4,97 4,89 4,50 4,40 4,27 4,20 4,10 4,96 2 Відносна інтенсивність дуже сильні середня дуже слабка середня сильна середня слабка слабка середня середня слабка слабка середня слабка дуже слабка слабка середня середня слабка середня середня дуже слабка дуже слабка UA 114196 C2 Таблиця 1 Піки, визначені рентгенівською дифракцією на порошку Кореговані кути 22,99 22,29 22,73 23,11 23,63 24,50 26,18 26,54 27,72 27,95 28,80 28,93 29,71 30,56 31,14 31,64 31,74 32,11 32,84 33,86 34,30 36,78 37,49 40,23 40,93 41,32 42,43 44,54 46,29 48,32 5 d- Розміщення (Å) 4,92 3,99 3,91 3,84 3,76 3,63 3,40 3,36 3,22 3,19 3,10 3,98 3,90 2,92 2,87 2,83 2,82 2,79 2,72 2,65 2,61 2,44 2,40 2,24 2,20 2,18 2,13 2,93 1,96 1,88 Відносна інтенсивність дуже слабка слабка слабка дуже слабка середня середня середня середня дуже слабка дуже слабка дуже слабка дуже слабка дуже слабка дуже слабка дуже слабка дуже слабка дуже слабка дуже слабка дуже слабка дуже слабка середня середня слабка дуже слабка дуже слабка дуже слабка слабка дуже слабка дуже слабка дуже слабка Ще одне втілення заявленого винаходу - камсилатна сіль сполуки (1r,1'R,4R)-4-метокси-5"метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'H-диспіро[циклогексан-1,2'-інден-1'2'-імідазол]-4"-аміну, описана діаграмою рентгенівської дифракції, де наведено, по суті, наступні дуже сильні, сильні та середні піки з величинами d-розміщення, які зображено в таблиці 2: Таблиця 2 Піки, ідентифіковані рентгенівською дифракцією на порошку Кореговані кути 5,66 7,72 11,30 12,35 12,83 15,24 15,47 17,17 18,13 19,71 20,77 21,12 23,63 24,50 d-Розміщення (Å) 15,60 11,44 7,83 7,16 6,89 5,81 5,72 5,16 4,89 4,50 4,27 4,20 3,76 3,63 3 Відносна інтенсивність дуже сильна середня середня сильна середня середня середня середня середня середня середня середня середня середня UA 114196 C2 Таблиця 2 Піки, ідентифіковані рентгенівською дифракцією на порошку Кореговані кути 26,18 26,54 34,30 36,78 5 10 15 20 25 30 35 40 45 50 d-Розміщення (Å) 3,40 3,36 2,61 2,44 Відносна інтенсивність середня середня середня середня Як тут застосовано, термін камсилатна сіль сполуки (1r,1'R,4R)-4-метокси-5"-метил-6'-[5(проп-1-ін-1-іл)піридин-3-іл]-3'H-диспіро[циклогексан-1,2'-інден-1'2'-імідазол]-4"-аміну також охоплює всі сольвати та їх сумісні кристали. Альтернативні солі сполуки (1r,1'R,4R)-4-метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]3'H-диспіро[циклогексан-1,2'-інден-1'2'-імідазол]-4"-аміну охоплюють сукцинат, хлорид, фосфат, сульфат, фумарат та 1,5 нафталіндисульфонат. Згідно з конкретним аспектом винаходу запропоновано фармацевтичну композицію, яка містить як активну складову терапевтично ефективну кількість камсилатної солі сполуки (1r,1'R,4R)-4-метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'H-диспіро[циклогексан-1,2'інден-1'2'-імідазол]-4"-аміну в поєднанні з фармацевтично прийнятними наповнювачами, носіями або розріджувачами. Згідно із ще одним аспектом винаходу запропоновано камсилатну сіль сполуки (1r,1'R,4R)-4метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'H-диспіро[циклогексан-1,2'-інден-1'2'імідазол]-4"-аміну для застосування як медикаменту. Згідно з іншим аспектом винаходу запропоновано застосування камсилатної солі сполуки (1r,1'R,4R)-4-метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'H-диспіро[циклогексан-1,2'інден-1'2'-імідазол]-4"-аміну як медикамент для лікування або попередження пов'язаної з Aβ патології. Згідно з іншим аспектом винаходу запропоновано застосування камсилатної солі сполуки (1r,1'R,4R)-4-метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'H-диспіро[циклогексан-1,2'інден-1'2'-імідазол]-4"-аміну як медикаменту для лікування або попередження пов'язаної з Aβ патології, де названа пов'язана з Aβ патологія - синдром Дауна, β-амілоїдна ангіопатія, церебральна амілоїдна ангіопатія, спадкова церебральна геморагія, розлад, пов'язаний з когнітивною недостатністю, MCI ("м'яка когнітивна недостатність"), хвороба Альцгеймера, втрата пам'яті, симптоми дефіциту уваги, пов'язані з хворобою Альцгеймера, нейродегенерація, пов'язана з хворобою Альцгеймера, слабоумство змішаного васкулярного походження, слабоумство дегенеративного походження, пресенільне слабоумство, сенільне слабоумство, слабоумство, пов'язане з хворобою Паркінсона, прогресуючий супрануклеарний параліч або кіркова базальна дегенерація. Згідно з іншим аспектом винаходу запропоновано застосування камсилатної солі сполуки (1r,1'R,4R)-4-метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'H-диспіро[циклогексан-1,2'інден-1'2'-імідазол]-4"-аміну, як медикаменту для лікування або попередження хвороби Альцгеймера. Згідно з іншим аспектом винаходу запропоновано застосування камсилатної солі сполуки (1r,1'R,4R)-4-метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'H-диспіро[циклогексан-1,2'інден-1'2'-імідазол]-4"-аміну у виготовленні в медикаменту для лікування або попередження пов'язаної з Aβ патології. Згідно з іншим аспектом винаходу запропоновано застосування камсилатної солі сполуки (1r,1'R,4R)-4-метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'H-диспіро[циклогексан-1,2'інден-1'2'-імідазол]-4"-аміну у виготовленні медикаменту для лікування або попередження пов'язаної з Aβ патології, де названа пов'язана з Aβ патологія - синдром Дауна, β-амілоїдна ангіопатія, церебральна амілоїдна ангіопатія, спадкова церебральна геморагія, розлад, пов'язаний з когнітивною недостатністю, MCI ("м'яка когнітивна недостатність"), хвороба Альцгеймера, втрата пам'яті, симптоми дефіциту уваги, пов'язані з хворобою Альцгеймера, нейродегенерація, пов'язана з хворобою Альцгеймера, слабоумство змішаного васкулярного походження, слабоумство дегенеративного походження, пресенільне слабоумство, сенільне слабоумство, слабоумство, пов'язане з хворобою Паркінсона, прогресуючий супрануклеарний параліч або кіркова базальна дегенерація. Згідно з іншим аспектом винаходу запропоновано застосування камсилатної солі сполуки (1r,1'R,4R)-4-метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'H-диспіро[циклогексан-1,2' 4 UA 114196 C2 5 10 15 20 25 30 35 40 45 50 55 60 інден-1'2'-імідазол]-4"-аміну у виготовленні в медикаменту для лікування або попередження хвороби Альцгеймера. Згідно з іншим аспектом винаходу запропоновано спосіб інгібування активності BACE, який полягає в контактуванні названого BACE із камсилатною сіллю сполуки (1r, 1'R, 4R)-4-метокси5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'H-диспіро[циклогексан-1,2'-інден-1'2'-імідазол]-4"аміну. Згідно з іншим аспектом винаходу запропоновано спосіб лікування або попередження пов'язаної з Aβ патології в пацієнта, який цього потребує, який полягає в застосуванні до названого пацієнта терапевтично ефективної кількості камсилатної солі сполуки (1r,1'R,4R)-4метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'H-диспіро[циклогексан-1,2'-інден-1'2'імідазол]-4"-аміну. Згідно з іншим аспектом винаходу запропоновано спосіб лікування або попередження пов'язаної з Aβ патології в пацієнта, який цього потребує, який полягає в застосуванні до названого пацієнта терапевтично ефективної кількості камсилатної солі сполуки (1r,1'R,4R)-4метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'H-диспіро[циклогексан-1,2'-інден-1'2'імідазол]-4"-аміну, де названа пов'язана з Aβ патологія - синдром Дауна, β-амілоїдна ангіопатія, церебральна амілоїдна ангіопатія, спадкова церебральна геморагія, розлад, пов'язаний з когнітивною недостатністю, MCI ("м'яка когнітивна недостатність"), хвороба Альцгеймера, втрата пам'яті, симптоми дефіциту уваги, пов'язані з хворобою Альцгеймера, нейродегенерація, пов'язана з хворобою Альцгеймера, слабоумство змішаного васкулярного походження, слабоумство дегенеративного походження, пресенільне слабоумство, сенільне слабоумство, слабоумство, пов'язане з хворобою Паркінсона, прогресуючий супрануклеарний параліч або кіркова базальна дегенерація. Згідно з іншим аспектом винаходу запропоновано спосіб лікування або попередження хвороба Альцгеймера в пацієнта, який цього потребує, який полягає в застосуванні до названого пацієнта терапевтично ефективної кількості камсилатної солі сполуки (1r,1'R,4R)-4метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'H-диспіро[циклогексан-1,2'-інден-1'2'імідазол]-4"-аміну. У деяких втіленнях згідно із заявленим винаходом запропоновано спосіб інгібування активності BACE, який полягає в контактуванні BACE із камсилатною сіллю сполуки (1r,1'R,4R)4-метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'H-диспіро[циклогексан-1,2'-інден-1'2'імідазол]-4"-аміну. Вважають, що BACE представляє головну активність β-секретази та стадію, яка лімітує стадію продукування амілоїд-β-білку (Aβ). Отже, інгібуванню BACE через інгібітори, як-то передбачені тут сполуки, слід бути корисним для інгібування відкладень Aβ та його частин. Оскільки відкладення Aβ та його частин пов'язано із хворобами як хвороба Альцгеймера, BACE є головним кандидатом для розробки ліків для лікування та/або профілактики Aβ-пов'язаних патологій, як-то синдром Дауна та β-амілоїдна ангіопатія, як-то, але без обмеження, церебральна амілоїдна ангіопатія, спадкова церебральна геморагія, розлади, пов'язані з когнітивною недостатністю, як-то, але без обмеження, MCI ("м'яка когнітивна недостатність"), хвороба Альцгеймера, втрата пам'яті, симптоми дефіциту уваги, пов'язані з хворобою Альцгеймера, нейродегенерація, пов'язана з хворобами, як-то хвороба Альцгеймера або слабоумство, охоплюючи слабоумство змішаного васкулярного та дегенеративного походження, пресенільне слабоумство, сенільне слабоумство та слабоумство, пов'язане з хворобою Паркінсона, прогресуючий супрануклеарний параліч або кіркова базальна дегенерація. У деяких втіленнях згідно із заявленим винаходом запропоновано спосіб профілактики наступного: Aβ-пов'язані патології, як-то синдром Дауна та β-амілоїдна ангіопатія, як-то, але без обмеження, церебральна амілоїдна ангіопатія, спадкова церебральна геморагія, розлади, пов'язані з когнітивною недостатністю, як-то, але без обмеження, MCI ("м'яка когнітивна недостатність"), хвороба Альцгеймера, втрата пам'яті, симптоми дефіциту уваги, пов'язані з хворобою Альцгеймера, нейродегенерація, пов'язана з хворобами, як-то хвороба Альцгеймера або слабоумство, охоплюючи слабоумство змішаного васкулярного та дегенеративного походження, пресенільне слабоумство, сенільне слабоумство та слабоумство, пов'язане з хворобою Паркінсона, прогресуючий супрануклеарний параліч або кіркова базальна дегенерація, при застосуванні до ссавця (включно людину) терапевтично ефективної кількості камсилатної солі сполуки (1r,1'R,4R)-4-метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'Hдиспіро[циклогексан-1,2'-інден-1'2'-імідазол]-4"-аміну. У деяких втіленнях згідно із заявленим винаходом запропоновано спосіб лікування або попередження наступного: Aβ-пов'язані патології, як-то синдром Дауна та β-амілоїдна ангіопатія, як-то, але без обмеження, церебральна амілоїдна ангіопатія, спадкова церебральна 5 UA 114196 C2 5 10 15 20 25 30 35 40 45 50 55 60 геморагія, розлади, пов'язані з когнітивною недостатністю, як-то, але без обмеження, MCI ("м'яка когнітивна недостатність"), хвороба Альцгеймера, втрата пам'яті, симптоми дефіциту уваги, пов'язані з хворобою Альцгеймера, нейродегенерація, пов'язана з хворобами, як-то хвороба Альцгеймера або слабоумство, охоплюючи слабоумство змішаного васкулярного та дегенеративного походження, пресенільне слабоумство, сенільне слабоумство та слабоумство, пов'язане з хворобою Паркінсона, прогресуючий супрануклеарний параліч або кіркова базальна дегенерація, при застосуванні до ссавця (включно людину) камсилатної солі сполуки (1r,1'R,4R)4-метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'H-диспіро[циклогексан-1,2'-інден-1'2'імідазол]-4"-аміну та когнітивного засобу та/або засобу підсилення пам'яті. У деяких втіленнях згідно із заявленим винаходом запропоновано спосіб лікування або попередження наступного: Aβ-пов'язані патології, як-то синдром Дауна та β-амілоїдна ангіопатія, як-то, але без обмеження, церебральна амілоїдна ангіопатія, спадкова церебральна геморагія, розлади, пов'язані з когнітивною недостатністю, як-то, але без обмеження, MCI ("м'яка когнітивна недостатність"), хвороба Альцгеймера, втрата пам'яті, симптоми дефіциту уваги, пов'язані з хворобою Альцгеймера, нейродегенерація, пов'язана з хворобами, як-то хвороба Альцгеймера або слабоумство, охоплюючи слабоумство змішаного васкулярного та дегенеративного походження, пресенільне слабоумство, сенільне слабоумство та слабоумство, пов'язане з хворобою Паркінсона, прогресуючий супрануклеарний параліч або кіркова базальна дегенерація, застосуванням до ссавця (включно людину) камсилатної солі сполуки (1r,1'R,4R)-4метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'H-диспіро[циклогексан-1,2'-інден-1'2'імідазол]-4"-аміну та інгібітору холінестерази та протизапального засобу. У деяких втіленнях згідно із заявленим винаходом запропоновано спосіб лікування або попередження наступного: пов'язані з Aβ патології, як-то синдром Дауна та β-амілоїдна ангіопатія, як-то, але без обмеження, церебральна амілоїдна ангіопатія, спадкова церебральна геморагія, розлади, пов'язані з когнітивною недостатністю, як-то, але без обмеження, MCI ("м'яка когнітивна недостатність"), хвороба Альцгеймера, втрата пам'яті, симптоми дефіциту уваги, пов'язані з хворобою Альцгеймера, нейродегенерація, пов'язана з хворобами, як-то хвороба Альцгеймера або слабоумство, охоплюючи слабоумство змішаного васкулярного та дегенеративного походження, пресенільне слабоумство, сенільне слабоумство та слабоумство, пов'язане з хворобою Паркінсона, прогресуючий супрануклеарний параліч або кіркова базальна дегенерація або описані тут будь-яка інша хвороба, розлад або стан, застосуванням до ссавця (включно людину) сполуки заявленого винаходу та нетиповий нейролептичний засіб. Нетипові нейролептичні засоби охоплюють, але без обмеження, оланзапін (у продажу "зупрекса"), арипіпразол (у продажу "абіліфай"), рисперидон (у продажу "риспердал"), кветиапін (у продажу "сероквел"), клозапін (у продажу "клозарил"), зипрасидон (у продажу "геодон") та оланзапін/флуоксетин (у продажу "симбіакс"). У деяких втіленнях ссавцю або людині, яких лікували камсилатною сіллю сполуки (1r,1'R,4R)-4-метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'H-диспіро[циклогексан-1,2'інден-1'2'-імідазол]-4"-аміну, ставили діагноз щодо конкретної хвороби або розладу, як-то описані тут. У цих випадках ссавець або людина потребували такого лікування. Діагноз, однак, не потребував його здійснення заздалегідь. Викладені в цій заявці дефініції призначено для прояснення термінів, застосованих у цій заявці. Термін "тут" означає суцільну заявку. Як тут застосовано, "фармацевтично прийнятний" стосується тих сполук, матеріалів, композицій та/або форм дозування, які є в межах обґрунтованої медичної оцінки та є придатними для застосування при контакті із тканинами людей та тварин без надмірної токсичності, подразнення, алергії, інших проблем ускладнення, порівнянними з розсудливим співвідношенням користі/ризику. У визначеному тут лікуванні слабоумства можна залучати тільки терапію, або можна охоплювати додатково до сполуки винаходу звичайну хіміотерапію. Така хіміотерапія може охоплювати одну або більше з наступних категорій засобів: інгібітори ацетилхолінестерази, протизапальні засоби, когнітивні засоби та/або засоби підсилення пам'яті та нетипові нейролептичні засоби. Такого сумісного лікування можна досягати шляхом допоміжної речовини та конкурентного, одночасного, послідовного або роздільного дозування окремих складових лікування. У таких комбінованих продуктах застосовують сполуки цього винаходу. Додаткова хіміотерапія може охоплювати одну або більше з наступних категорій засобів: (i) антидепресанти, (ii) нетипові нейролептичні засоби, (iii) нейролептичні засоби, (iv) анксіолітики, (v) антиконвульсанти, (vi) застосовані тепер засоби лікування хвороби Альцгеймера, (vii) засоби лікування хвороби Паркінсона, (viii) засоби лікування мігрені, (ix) засоби лікування інсульту, (x) 6 UA 114196 C2 5 10 15 20 25 30 35 40 45 50 55 60 засоби лікування нетримання сечі, (xi) засоби лікування невропатичного болю, (xii) засоби лікування ноцицептивного болю, (xiii) засоби лікування безсоння та (xiv) стабілізатори настрою. Відомі засоби лікування для попередніх терапій можна застосовувати в комбінації з описаним тут винаходом. Такі комбіновані продукти застосовують камсилатну сіль сполуки (1r,1'R,4R)-4-метокси-5"метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'H-диспіро[циклогексан-1,2'-інден-1'2'-імідазол]-4"-аміну з описаним тут діапазоном доз та іншою фармацевтично активною сполукою або сполуками в межах затверджених діапазонів доз та/або як визначено спеціалістом у рівні техніки. Сполуки заявленого винаходу можна призначати для застосування перорально, парентерально, защічно, вагінально, ректально, інгаляцією, вдуванням, під'язично, внутрішньом'язово, підшкірно, місцево, інтраназально, інтраперитонеально, внутрішньоторакально, внутрішньовенно, епідурально, інтратекально, внутрішньо у мозковому шлуночку та ін'єкцією в суглоб. Дозування залежить від шляху застосування, ступеню тяжкості хвороби, віку та маси пацієнта та інших факторів, які беруться до уваги лікарем, який лікує, при визначенні індивідуального режиму та рівня дозування як найбільш придатних для конкретного пацієнта. Ефективною кількістю сполуки заявленого винаходу для застосування в лікуванні слабоумства є достатньою кількістю для симптоматичного полегшення в теплокровної тварини, конкретно в людини, симптомів слабоумства, для сповільнення прогресування слабоумства та зменшення ризику погіршення в пацієнтів із симптомами слабоумства. Окрім сполук заявленого винаходу фармацевтична композиція винаходу також може містити або бути співзастосованою (одночасно або послідовно) з одним або більше фармакологічними засобами, важливими для лікування одної або більше розглянутих тут станів хвороби Кількість камсилатної солі сполуки (1r,1'R,4R)-4-метокси-5"-метил-6'-[5-(проп-1-ін-1іл)піридин-3-іл]-3'H-диспіро[циклогексан-1,2'-інден-1'2'-імідазол]-4"-аміну, яку застосовано до пацієнта, якого лікують, слід змінювати, приблизно, від 10 нг/кг маси тіла до 100 мг/кг маси тіла на добу, та краще - від 10 нг/кг до 10 мг/кг на добу. Наприклад, дозування може легко встановлювати спеціаліст у рівні техніки із цього розкриття та знання в рівні техніки. Отже, кваліфікований фахівець може легко визначити в композиціях кількість сполуки та необов'язкових додаткових речовин, наповнювачів та/або носіїв для застосування в способах винаходу. СПОСОБИ ОТРИМАННЯ Камсилатна сіль (1r,1'R,4R)-4-метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'Hдиспіро[циклогексан-1,2'-інден-1'2'-імідазол]-4"-аміну Камсилатну сіль сполуки (1r,1'R,4R)-4-метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]3'H-диспіро[циклогексан-1,2'-інден-1'2'-імідазол]-4"-аміну можна отримувати, виходячи з розчину (1r,1'R,4R)-4-метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'H-диспіро[циклогексан-1,2'інден-1'2'-імідазол]-4"-аміну в придатному розчиннику, наприклад, 2-пропанолі, ацетонітрилі або ацетоні, або сумішах цього з водою, а потім - перемішування отриманого розчину безпосередньо з (1S)-(+)-10-камфорсульфокислотою або розчиненою у придатному розчиннику, наприклад, 2-пропанолі або воді, при температурі між кімнатною температурою та 80 °C. Кристалізацію можна отримувати випаровуванням розчиннику та/або охолодженням розчину безпосередньо із кристалізацією з реакції солі. Для ініціювання кристалізації можна застосовувати кристали для затравки. Затравки можна приготувати із самої партії відбором порції розчину малого об'єму й потім швидким його охолодженням для індукування кристалізації. Потім кристали додають до партії як затравки. Аналіз XRPD: Аналіз рентгенівської дифракції на порошку (XRPD) робили не зразках, отриманих згідно зі стандартними способами, наприклад, описаними в Giacovazzo, C. et al (1995), Fundamentals of Crystallography, Oxford University Press; Jenkins, R. та Snyder, R. L. (1996), Introduction to X-Ray Powder Diffractometry, John Wiley & Sons, New York; Bunn, C. W. (1948), Chemical Crystallography, Clarendon Press, London; °F Klug, H. P. & Alexander, L. E. (1974), X-ray Diffraction Procedures, John Wiley та Sons, New York. Аналіз рентгенівської дифракції робили, застосовуючи дифрактометр PANanlytical X'Pert PRO MPD diffractometer протягом 96 хвилин від 1 до 60° 2θ. Інтервал величин XRPD може змінюватися в діапазоні ±2 на останній розряд десяткового дробу. Відносні інтенсивності отримували з виміряних дифрактограм зі змінними діафрагмами. Визначені відносні інтенсивності стосовно найсильнішого піку надано як дуже сильні, приблизно, 50 %, як сильні між 25 та 50 %, як середні між 10 та 25 %, як слабкі між 5 та 10 % та як дуже слабкі нижче 5 % відносно висоти піку. Спеціалісту в рівні техніки слід розуміти, що ці 7 UA 114196 C2 5 інтенсивності XRPD різних зразків можуть відрізнятися та можуть відрізнятися їх виготовлення із цілого ряду причин, охоплюючи кращу орієнтацію. Спеціалісту в рівні техніки також слід розуміти, що менші зсуви вимірюваного кута та, отже, d-розміщення може виникати з різних причин, охоплюючи зміну поверхневого рівня зразка в дифрактометрі. Приклад 1 6'-Бромоспіро[циклогексан-1,2'-інден]-1',4(3'H)-діон O Br O 10 15 20 25 Калій трет-бутоксид (223 г, 1,99 мол) завантажували до 100 л реакційного апарату, який містить перемішувану суміш 6-бромо-1-інданону (8,38 кг, 39,7 мол) у ТГФ (16,75 л) при 20-30 °C. Тоді до суміші завантажували метилакрилат (2,33 л, 25,8 мол) протягом 15 хвилин, утримуючи температуру між 20-30 °C. Додавали розчин калій трет-бутоксиду (89,1 г, 0,79 мол), розчинений у ТГФ (400 мл), після чого додавали метилакрилат (2,33 л, 25,8 мол) протягом 20 хвилин при 2030 °C. Тоді додавали третю порцію калій трет-бутоксиду (90 г, 0,80 мол), розчиненого в ТГФ (400 мл), а потім - третє додавання метилакрилату (2,33 л, 25,8 мол) протягом 20 хвилин при 20-30 °C. Калій трет-бутоксид (4,86 кг, 43,3 мол), розчинений у ТГФ (21,9 л), завантажували до реакційного апарату протягом 1 години при 20-30 °C. Реакцію нагрівали, приблизно, до 65 °C та відганяли 23 л розчиннику. Температуру реакції знижували до 60 °C, та до суміші додавали 50 % водний калій гідроксид (2,42 л, 31,7 мол), розчинений у воді (51,1 л), протягом 30 хвилин при 55-60 °C, після суміш перемішували 6 годин при 60 °C, охолоджували до 20 °C протягом 2 годин. Після перемішування протягом години при 20 °C твердий матеріал відфільтровували, промивали двічі сумішшю води (8,4 л) та ТГФ (4,2 л), тоді сушили при 50 °C під вакуумом, що 1 дало 6'-бромоспіро[циклогексан-1,2'-інден]-1',4(3'H)-діон (7,78 кг; 26,6 мол). H ЯМР (500 МГц, -1 ДМСО-d6) млн 1,78-1,84 (m, 2 H), 1,95 (td, 2 H), 2,32 - 2,38 (m, 2 H), 2,51-2,59 (m, 2 H), 3,27 (s, 2 H), 7,60 (d, 1 H), 7,81 (m, 1 H), 7,89 (m, 1 H). Приклад 2 (1r,4r)-6'-бромо-4-метоксиспіро[циклогексан-1,2'-інден]-1'(3'H)-он O Br O 30 35 40 45 50 Комплекс боран трет-бутиламін (845 г, 9,7 мол), розчинений у ДХМ (3,8 л), завантажували до кашки 6'-бромоспіро[циклогексан-1,2'-інден]-1',4(3'H)-діону (7,7 кг, 26,3 мол) у ДХМ (42,4 л), приблизно, при 0-5 °C протягом, приблизно, 25 хвилин. Реакцію залишали перемішуватися при 0-5 °C протягом 1 години, після чого аналізом підтверджено, що перетворення було >98 %. Завантажували розчин, отриманий із натрій хлориду (2,77 кг), води (13,3 л) та 37 % хлоридної кислоти (2,61 л, 32 мол). Суміш нагрівали, приблизно, до 15 °C та фази відокремлювали після розшарування. Органічну фазу повертали до реакційного апарату разом із метил метансульфонатом (2,68 л, 31,6 мол) та тетрабутиламоній хлоридом (131 г, 0,47 мол), та суміш енергійно струшували при 20 °C. тоді до енергійно струшуваної реакційної суміші завантажували 50 % натрій гідроксид (12,5 л, 236 мол) протягом, приблизно, 1 години, та реакцію залишали при енергійному струшуванні при 20 °C протягом ночі. Додавали воду (19 л), та водну фазу відкидали після відокремлення. Органічний шар нагрівали, приблизно, до 40 °C та 33 л розчиннику відганяли. Завантажували етанол (21 л) та відокремлення відновлювали при підвищеній температурі (22 л відганяли впритул до 79 °C). Етанол (13,9 л) завантажували, приблизно, при 75 °C. Воду (14,6 л) завантажували протягом 30 хвилин, утримуючи температуру між 72-75 °C., приблизно, 400 мл розчину відбирали до 500 мл поліетиленової ємності, та зразок кристалізовано спонтанно. Порцію охолоджували до 50 °C, зразок кристалізованої кашки додавали назад до розчину. Суміш охолоджували до 40 °C. Суміш охолоджували до 20 °C протягом 4 годин, потім її перемішували протягом ночі. Тверде відфільтровували, промивали сумішшю етанолу (6,6 л) та води (5 л) і сушили при 50 °C під 8 UA 114196 C2 5 вакуумом, що дало (1r,4r)-6'-бромо-4-метоксиспіро[циклогексан-1,2'-інден]-1'(3'H)-он (5,83 кг, 1 -1 18,9 мол) H ЯМР (500 МГц, ДМСО-d6) β млн 1,22-1,32 (m, 2 H), 1,41-1,48 (m, 2 H), 1,56 (td, 2 H), 1,99-2,97 (m, 2 H), 3,91 (s, 2 H), 3,16 - 3,23 (m, 1 H), 3,27 (s, 3 H), 7,56 (d, 1 H), 7,77 (d, 1 H), 7,86 (dd, 1 H). Приклад 3 (1r,4r)-6'-бромо-4-метоксиспіро[циклогексан-1,2'-інден]-1'(3'H)-імін гідрогенхлорид NH + HCl Br O 10 15 20 25 30 35 40 45 50 (1r, 4r)-6'-Бромо-4-метоксиспіро[циклогексан-1,2'-інден]-1'(3'H)-он (5,82 кг; 17,7 мол) завантажували до 100 л реакційного апарату при температурі навколишнього середовища, а потім - титан (IV)етоксид (7,4 л; 35,4 мол) та розчин трет-бутилсульфонаміду (2,94 кг; 23,9 мол) у 2-метилтетрагідрофурані (13,7 л). Суміш перемішували та нагрівали до 82 °C. Після 30 хвилин при 82 °C температуру далі підвищували (до 97 °C) та відганяли 8 л розчиннику. Реакцію охолоджували до 87 °C та додавали 2- метилтетрагідрофуран (8,2 л), надаючи реакції температуру 82 °C. Реакцію залишали при перемішуванні при 82 °C протягом ночі. Температуру реакції підвищували (до 97 °C) та відганяли 8,5 л розчиннику. Реакцію охолоджували до 87 °C та додавали 2- метилтетрагідрофуран (8,2 л), надаючи реакції температуру 82 °C. Через 3,5 години температуру реакції підвищували (до 97 °C) та відганяли 8 л розчиннику. Реакцію охолоджували до 87 °C та додавали 2-метилтетрагідрофуран (8,2 л), надаючи реакції температуру 82 °C. Через 2 години температуру реакції підвищували (до 97 °C) та відганяли 8,2 л розчиннику. Реакцію охолоджували до 87 °C та додавали 2-метилтетрагідрофуран (8,2 л), надаючи реакції температуру 82 °C. Реакцію перемішували протягом ночі при 82 °C. Температуру реакції далі підвищували (до 97 °C) та відганяли 8 л розчиннику. Реакцію охолоджували до 25 °C. Завантажували дихлорметан (16,4 л). До окремого реакційного апарату додавали воду (30 л) та енергійно струшували й додавали натрій сульфат (7,54 кг), та отриманий розчин охолоджували до 10 °C. До водного розчину додавали сульфатну кислоту (2,3 л, 42,4 мол) та температуру регулювали до 20 °C. Відбирали 6 л кислотного водного розчину та далі зберігали. Органічну реакційну суміш завантажували до кислотного водного розчину протягом 5 хвилин із добрим струшуванням. Органічну реакційну посудину промивали дихлорметаном (16,4 л), та дихлорметановий промивний розчин також додавали до кислотного водного. Суміш перемішували протягом 15 хвилин і тоді дозволяли осаджуватися протягом 20 хвилин. Нижню водну фазу відціджували, та додавали 6 л збереженого кислотного промивного, потім - воду (5,5 л). Суміш перемішували протягом 15 хвилин і тоді дозволяли осаджуватися протягом 20 хвилин. Нижчий органічний шар відціджувати до бутилів, та верхній водний шар відкидали. Органічний шар завантажували назад до посудини, а потім - натрій сульфат (2,74 кг), та суміш струшували протягом 30 хвилин. Натрій сульфат відфільтровували та промивали дихлорметаном (5,5 л), та комбіновані органічні фази завантажували до чистої посудини. Цю порцію нагрівали для дистиляції (зібрано 31 л, максимальна температура 57 °C). Порцію охолоджували до 40 °C та додавали дихлорметан (16,4 л). Порцію нагрівали для дистиляції (зібрано 17 л, максимальна температура 54 °C). Порцію охолоджували до 20 °C і додавали дихлорметан (5,5 л) та етанол (2,7 л). До реакції завантажували 2 M гідроген хлорид у діетиловому етері (10,6 л; 21,2 мол) протягом 45 хвилин, утримуючи температуру між 16-23 °C. Отриману кашку перемішували при 20 °C протягом 1 години, після чого тверде відфільтровували та промивали 3 рази 1:1 сумішшю дихлорметану та діетилового етеру (3×5,5 л). Тверде сушили при 50 °C під вакуумом, що дало (1r,4r)-6'-бромо-4-метоксиспіро[циклогексан1 1 1,2'-інден]-1'(3'H)-імін гідрогенхлорид (6,9 кг; 14,3 мол; аналіз - 82 мас % за H ЯМР) H ЯМР -1 (500 МГц, ДМСО-d6) β млн 130 (m, 2 H), 1,70 (d, 2 H), 1,98 (m, 2 H), 2,10 (m, 2 H), 3,17 (s, 2 H), 3,23 (m, 1 H), 3,29 (s, 3 H), 7,61 (d, 1 H), 8,94 (dd, 1 H), 8,75 (d, 1 H), 12,90 (br s, 2H). Приклад 4 (1r,4r)-6'-бромо-4-метокси-5"-метил-3'H-диспіро[циклогексан-1,2'-інден-1'2'-імідазол]-4"(3"H)тіон 9 UA 114196 C2 5 10 15 20 Триметилортоформіат (4,95 л; 45,2 мол) та діізопропілетиламін (3,5 л; 20,9 мол) завантажували до реакційного апарату, який містить (1r,4r)-6'-бромо-4метоксиспіро[циклогексан-1,2'-інден]-1'(3'H)-імін гідрогенхлорид (6,25 кг; 14,9 мол) у ізопропанолі (50,5 л). Реакційну суміш перемішували та нагрівали до 75 °C протягом 1 години, таким чином, отримали чистий розчин. Установлювали температуру 70 °C, та завантажували протягом 1 години 2 M розчин 2-оксопропантіоаміду в ізопропанолі (19,5 кг; 40,6 мол), потім реакцію перемішували протягом ночі при 69 °C. Партію засівали (1r,4r)-6'-бромо-4-метокси-5"-метил-3'Hдиспіро[циклогексан-1,2'-інден-1'2'-імідазол]-4"(3"H)-тіоном (3 г; 7,6 ммол), та температуру знижували до 60 °C, і перемішували протягом 1 години. Суміш концентрували дистиляцією (температура дистиляції, приблизно, 60 °C; відганяли 31 л). Додавали воду (31 л) протягом 1 години, та температуру 60 °C знижували до 25 °C протягом 90 хвилин, потім суміш перемішували протягом 3 годин. Тверде відфільтровували, промивали двічі ізопропанолом (2×5,2 л) та сушили під вакуумом при 40 °C, що дало (1r,4r)-6'-бромо-4-метокси-5"-метил-3'Hдиспіро[циклогексан-1,2'-інден-1'2'-імідазол]-4"(3"H)-тіон (4,87 кг; 10,8 мол; аналіз - 87 мас % за 1 H ЯМР). Приклад 5 (1r,1'R,4R)-6'-бромо-4-метокси-5"-метил-3'H-диспіро[циклогексан-1,2'-інден-1'2'-імідазол]-4"амін D(+)-10-камфорсульфокислоти сіль NH2 N Br N O O HO 25 30 35 40 45 O S O 7 M Аміак у метанолі (32 л; 224 мол) завантажували до реакційного апарату, який містить (1r,4r)-6'-бромо-4-метокси-5"-метил-3'H-диспіро[циклогексан-1,2'-інден-1'2''-імідазол]-4"(3"H)-тіон (5,10 кг; 11,4 мол) та цинк ацетат дигідрат (3,92 кг; 13,8 мол). Реакційний апарат герметизували, та суміш нагрівали до 80 °C і перемішували протягом 24 годин, після чого її охолоджували до 30 °C. завантажували 1-бутанол (51 л), та реакційну суміш концентрували вакуумною відгонкою, приблизно, 50 л. Додавали 1-бутанол (25 л), та суміш концентрували вакуумною відгонкою 27 л. Суміш охолоджували до 30 °C та завантажували 1 M натрій гідроксид (30 л; 30 мол). Двофазову суміш струшували протягом 15 хвилин. Нижчу водну фазу відокремлювали. Завантажували воду (20 л) та суміш струшували протягом 30 хвилин. Нижчу водну фазу відокремлювали. Органічну фазу нагрівали до 70 °C, після завантажували (1S)-(+)-10-камфорсульфокислоту (2,4 кг; 10,3 мол). Суміш перемішували протягом 1 години при 70 °C і тоді знижували до 20 °C протягом 3 годин. Тверде відфільтровували, промивали етанолом (20 л) та сушили у вакуумі при 50 °C, що дало (1r,4r)-6'-бромо-4-метокси-5"-метил-3'H-диспіро[циклогексан-1,2'-інден-1'2'1 імідазол]-4"-амін (+)-10-камфорсульфокислоти сіль (3,12 кг; 5,13 мол; аналіз - 102 мас % за H ЯМР). Приклад 6 (1r,1'R,4R)-4-метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'H-диспіро[циклогексан-1,2'інден-1'2'-імідазол]-4"-амін Na2PdCl4 (1,4 г; 4,76 ммол) та 3-(ди-трет-бутилфосфоніум)пропан сульфонат (2,6 г; 9,69 ммол), розчинений у воді (0,1 л), завантажували до посудини, яка містить (1r,4r)-6'-бромо-4метокси-5"-метил-3'H-диспіро[циклогексан-1,2'-інден-1'2'-імідазол]-4"-амін (+)-10камфорсульфокислоти сіль (1 кг; 1,58 мол), калій карбонат (0,763 кг; 5,52 мол) у суміші 1бутанолу (7,7 л) та води (2,6 л). Суміш ретельно обробляли азотом, потім завантажували 5 10 UA 114196 C2 5 10 15 20 25 30 35 40 45 50 55 60 (проп-1-ініл)піридин-3-іл боронову кислоту (0,29 кг; 1,62 мол), та суміш знов ретельно обробляли азотом. Реакційну суміш нагрівали до 75 °C та перемішували протягом 2 годин, після чого згідно з аналізом показано повне перетворення. Температуру регулювали до 45 °C. Перемішування зупиняли та нижчу водну фазу відокремлювали. Органічний шар промивали 3 рази водою (3×4 л). Температуру реакції регулювали до 22 °C та завантажували очисник Phosphonics SPM32 scavenger (0,195 кг), і суміш струшували протягом ночі. Очисник відфільтровували та промивали 1-бутанолом (1 л). Реакцію концентрували до 3 л відгонкою під зниженим тиском. Завантажували бутилацетат (7,7 л), та суміш знов концентрували до 3 л відгонкою під зниженим тиском. Завантажували бутилацетат (4,8 л), та суміш нагрівали до 60 °C. Суміш перемішували протягом 1 години, потім концентрували, приблизно, до 4 л відгонкою під зниженим тиском. Установлювали температуру до 60 °C та протягом 20 хвилин додавали гептани (3,8 л). Суміш охолоджували до 20 °C протягом 3 годин, тоді залишали перемішуватися протягом ночі. Тверде відфільтровували та промивали двічі сумішшю 1:1 бутилацетату:гептану (2×2 л). Продукт сушили під вакуумом при 50 °C, що дало (1r,1'R,4R)-4метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'H-диспіро[цикло гексан-1,2'-інден-1'2'1 1 імідазол]-4"-амін (0,562 кг; 1,36 мол; аналіз - 100 мас % за H ЯМР). H ЯМР (500 МГц, ДМСО-d6) -1 β млн 0,97 (d, 1 H), 1,12-1,30 (m, 2 H), 1,37-1,51 (m, 3 H), 1,83 (d, 2 H), 2,99 (s, 3 H), 2,17 (s, 2 H), 2,89-3,12 (m, 3 H), 3,20 (s, 3 H), 6,54 (s, 2 H), 6,83 (s, 1 H), 7,40 (d, 1 H), 7,54 (d, 1 H), 7,90(s, 1H). 8,51(d, 1H), 8,67(d, 1H) Приклад 7 Отримання камсилатної солі (1r,1'R,4R)-4-метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3іл]-3'H-диспіро[циклогексан-1,2'-інден-1'2'-імідазол]-4"-аміну (1r,1'R,4R)-4-Метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'H-диспіро[циклогексан1,2'-інден-1'2'-імідазол]-4"-амін, 1,105 кг, розчиняли в 8,10 л 2-пропанолу та 475 мл води при 60 °C. Тоді завантажували 1,9 моль-еквівалент (622 грама) (1S)-(+)-10 камфорсульфокислоти при 60 °C. Кашку струшували до розчинення всієї (1S)-(+)-10 камфорсульфокислоти. Додавали другу порцію 2-пропанолу (6,9 л) при 60 °C і тоді вмісти відганяли до збирання 4,3 л дистиляту. Тоді завантажували 9,1 л гептану при 65 °C. Через одну годину партія ставала непрозорою. Тоді робили додаткову відгонку, приблизно, при 75 °C та збирали 8,2 л дистиляту. Тоді партію охолоджували до 20 °C протягом 2 годин та тримали при цій температурі протягом ночі. Тоді партію фільтрували та промивали сумішшю 1,8 л 2-пропанолу та 2,7 л гептану. Кінцеву 1 речовину сушили при зниженому тиску та 50 °C. Вихід дорівнював 1,44 кг (83,6 мас %). H ЯМР -1 (400 МГц, ДМСО-d6) δ млн 12,12 (1H, s), 9,70 (2H, d, J 40,2), 8,81 (1H, d, J 2,1), 8,55 (1H, d, J 1,7), 8,95 (1H, dd, J 2,1, 1,7), 7,77 (1H, dd, J 7,8, 1,2), 7,50 (2H, m), 3,22 (3H, s), 3,19 (1H, d, J 16,1), 3,10 (1H, d, J 16,1), 3,92 (1H, m), 2,90 (1H, d, J 14,7), 2,60 (1H, m), 2,41 (1H, d, J 14,7), 2,40 (3H, s), 2,22 (1H, m), 2,10 (3H, s), 1,91 (3H, m), 1,81 (1H, m), 1,77 (1H, d, J 18,1), 1,50 (2H, m), 1,25 (6H, m), 0,98 (3H, s), 0,69 (3H, s). БІОЛОГІЧНИЙ АНАЛІЗ Рівні активності камсилатної солі (1r,1'R,4R)-4-метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин3-іл]-3'H-диспіро[циклогексан-1,2'-інден-1'2'-імідазол]-4"-аміну можна досліджувати, застосовуючи наступні способи: Аналіз TR-FRET Застосований в TR-FRET фермент β-секретази отримано як викладено нижче: кДНК для розчинної частини β-секретази людини (AA 1 - AA 460) клонували, застосовуючи вектор експресії ссавця ASP2-Fc10-1-IRES-GFP-neoK. Ген конденсували до Fc-домену IgG1 (мітка спорідненості) та стабільно клонували в клітини HEK 293. Очищене sBACE-Fc зберігали при -80 °C у 50 мМ гліцині, pH 2,5, відрегульованому до pH 7,4 з допомогою 1 M Трис, та який мав чистоту 40 %. Фермент (укорочену форму) розбавляли до 6 мкг/мл (штам 1,3 мг/мл), та субстрат TruPoint BACE1 - до 200 нМ (штам 120 мкM) у реакційному буфері (Naацетат, осколки, тритон x-100, ЕДТА pH 4,5). Фермент та сполуку в диметилсульфоксиді (кінцева концентрація ДМСО - 5 %) змішували та попередньо інкубували протягом 10 хвилин при кімнатній температурі. Тоді додавали субстрат та реакцію інкубували протягом 15 хвилин при кімнатній температурі. Реакцію зупиняли додаванням 0,35 об'єму розчину для зупинки (Naацетат, pH 9). Флуоресценцію продукту визначали на планшет-рідері Victor II plate reader із довжинами хвилі збудження 340-485 нм та довжинами хвилі випромінювання 590-615 нм. Кінцева концентрація ферменту дорівнювала 2,7 мкг/мл; кінцева концентрація субстрату дорівнювала 100 нМ (Km, приблизно, 250 нМ). Контроль диметилсульфоксиду замість сполуки тесту встановлював 100 % рівень активності, та 0 % активності визначали лунками, де відсутній фермент (заміщений реакційним буфером), або насичувальною дозою відомого інгібітору 2-аміно-6-[3-(3 11 UA 114196 C2 5 10 15 20 25 30 метоксифеніл)феніл]-3,6-диметил-5H-піримідин-4-ону. Інгібітор контролю також застосовували в аналізі відгуку дози та він дорівнював, IC50, приблизно, 150 нM. Камсилатна сіль (1r,1'R,4R)-4-метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'Hдиспіро[циклогексан-1,2'-інден-1'2'-імідазол]-4"-аміну мала в цьому аналізі середню величину IC50 - 0,2 нM. Аналіз вивільнення sAPPβ Клітини SH-SY5Y культивовано в DMEM/F-12 з Glutamax, 10 % FCS та 1 % неважливих 6 амінокислот та кріоконсервували й зберігали при -140 °C при концентрації 7,5-9,5×10 клітин на ампулу. Клітини відтавали, та їх засівали при концентрації, приблизно, 10000 клітин/лунку в DMEM/F-12 з Glutamax, 10 % FCS та 1 % неважливих амінокислот до 384-лункового планшету, обробленого культурою тканини, 100 мкл клітинної суспензії/лунку. Тоді клітинні планшети інкубували протягом 7-24 год. при 37 °C, 5 % CO2. Клітинне середовище видаляли, а потім додавали 30 мкл сполуки, розбавленої в DMEM /F-12 з Glutamax, 10 % FCS, 1 % неважливих амінокислот та 1 % PeSt до кінцевої концентрації - 1 % ДМСО. Сполуки інкубували із клітинами протягом 17 год. (протягом ночі) при 37 °C, 5 % CO2. Планшети Meso Scale Discovery (MSD) застосовано для виявлення вивільнення sAPPβ. Планшети MSD sAPPβ блокували в 1 % BSA у Трис-буфері для промивання (40 мкл/лунку) при струшуванні протягом 1 год. при кімнатній температурі та промивали 1 раз у Трис-буфері для промивання (40 мкл/лунку). Переносили 20 мкл середовища до попередньо блокованого та промивали мікропланшети MSD sAPPβ, та клітинні планшети далі застосовували в аналізі ATP для вимірювання цитотоксичності. Планшети MSD інкубували зі струшуванням при кімнатній температурі протягом 2 год. та середовище відкидали. Додавали 10 мкл антитіла (1 нM) на лунку, а потім - інкубування зі струшуванням при кімнатній температурі протягом 2 год., і тоді відкидали. Додавали 40 мкл буферу для зчитування на лунку та планшети зчитували на SECTOR Imager. Аналіз ATP Як показано в аналіз вивільнення sAPPβ, після перенесення 20 мкл середовища з клітинних планшетів для визначення sAPPβ, планшети застосовували для аналізу цитотоксичності, застосовуючи комплект клітинної проліферації/цитотоксичності ViaLightTM від Cambrex BioScience, на якому вимірюють загальну клітинну ATP. Аналіз здійснювали згідно із протоколом обробки. Briefly, Додавали 10 мкл реагенту лізису клітини на лунку. Планшети інкубували при кімнатній температурі протягом 10 хвилин. Через дві хвилини після додавання 25 мкл відтвореного реагенту ViaLightTM плюс ATP вимірювали люмінесценцію. Поріг токсичності сигнал, нижчий 75 % контролю. ФОРМУЛА ВИНАХОДУ 35 1. Камсилатна сіль (1r,1'R,4R)-4-метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'Ндиспіро[циклогексан-1,2'-інден-1',2"-імідазол]-4"-аміну: NH2 N N N O . HO O S O O 40 . 2. Камсилатна сіль (1r,1'R,4R)-4-метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'Ндиспіро[циклогексан-1,2'-інден-1',2"-імідазол]-4"-аміну: NH2 N N N O . O HO S O O , яка відрізняється тим, що порошкова рентгенограма (XRPD) цієї солі має суттєво дуже сильні, сильні та середні піки з d-величинами: 12 UA 114196 C2 Кореговані кути d-розміщення (Å) Відносна інтенсивність 5,66 15,60 дуже сильна 7,72 11,44 середня 11,30 7,83 середня 12,35 7,16 сильна 12,83 6,89 середня 15,24 5,81 середня 15,47 5,72 середня 17,17 5,16 середня 18,13 4,89 середня 19,71 4,50 середня 20,77 4,27 середня 21,12 4,20 середня 23,63 3,76 середня 24,50 3,63 середня 26,18 3,40 середня 26,54 3,36 середня 34,30 2,61 середня 36,78 2,44 середня 3. Камсилатна сіль (1r,1'R,4R)-4-метокси-5"-метил-6'-[5-(проп-1-ін-1-іл)піридин-3-іл]-3'Ндиспіро[циклогексан-1,2'-інден-1',2"-імідазол]-4"-аміну: NH2 N N N O . O HO S O 5 10 15 20 25 30 O , яка відрізняється тим, що ця сіль суттєво має порошкову рентгенограму (XRPD), яку показано на Фігурі 1. 4. Фармацевтична композиція, яка містить як активну складову терапевтично ефективну кількість солі за п. 1, п. 2 або п. 3 у поєднанні принаймні з одним фармацевтично прийнятним наповнювачем, носієм або розріджувачем. 5. Сіль за п. 1, п. 2 або п. 3 для застосування як медикаменту. 6. Сіль за п. 5 для застосування як медикаменту для лікування або профілактики пов'язаної з Αβ патології. 7. Сіль за п. 6 для застосування як медикаменту для лікування або профілактики пов'язаної з Αβ патології, де цією пов'язаною з Α патологією є синдром Дауна, -амілоїдна ангіопатія, церебральна амілоїдна ангіопатія, спадкова церебральна геморагія, розлад, пов'язаний з когнітивною недостатністю, МСІ (м'яка когнітивна недостатність), хвороба Альцгеймера, втрата пам'яті, симптоми дефіциту уваги, пов'язані з хворобою Альцгеймера, нейродегенерація, пов'язана з хворобою Альцгеймера, слабоумство змішаного васкулярного походження, слабоумство дегенеративного походження, пресенільне слабоумство, сенільне слабоумство, слабоумство, пов'язане з хворобою Паркінсона, прогресуючий супрануклеарний параліч або кіркова базальна дегенерація. 8. Сіль за п. 7 для застосування як медикаменту для лікування або профілактики хвороби Альцгеймера. 9. Сіль за п. 1, п. 2 або п. 3 для застосування як медикаменту для лікування або профілактики пов'язаної з Α патології в комбінації принаймні з одним засобом підсилення пізнання, засобом підсилення пам'яті або інгібітором холінестерази. 10. Спосіб лікування або профілактики пов'язаної з Α патології у пацієнта, що цього потребує, який полягає в призначенні цьому пацієнту терапевтично ефективної кількості солі за п. 1, п. 2 або п. 3. 11. Спосіб за п. 10, в якому пов'язаною з Α патологією є синдром Дауна, -амілоїдна ангіопатія, церебральна амілоїдна ангіопатія, спадкова церебральна геморагія, розлад, пов'язаний з когнітивною недостатністю, МСІ (м'яка когнітивна недостатність), хвороба Альцгеймера, втрата пам'яті, симптоми дефіциту уваги, пов'язані з хворобою Альцгеймера, нейродегенерація, пов'язана з хворобою Альцгеймера, слабоумство змішаного васкулярного походження, 13 UA 114196 C2 5 10 слабоумство дегенеративного походження, пресенільне слабоумство, сенільне слабоумство, слабоумство, пов'язане з хворобою Паркінсона, прогресуючий супрануклеарний параліч або кіркова базальна дегенерація. 12. Спосіб лікування або профілактики хвороби Альцгеймера у пацієнта, що цього потребує, який полягає в призначенні цьому пацієнту терапевтично ефективної кількості солі за п. 1, п. 2 або п. 3. 13. Спосіб лікування або профілактики пов'язаної з Α патології у пацієнта, що цього потребує, який полягає в призначенні цьому пацієнту терапевтично ефективної кількості солі за п. 1, п. 2 або п. 3 та принаймні одного засобу підсилення пізнання, засобу підсилення пам'яті або інгібітору холінестерази. Комп’ютерна верстка Т. Вахричева Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП "Український інститут інтелектуальної власності", вул. Глазунова, 1, м. Київ – 42, 01601 14
ДивитисяДодаткова інформація
Назва патенту англійськоюCamsylate salt
Автори англійськоюBohlin, Martin, Hans, Stewart, Craig Robert
Автори російськоюБолин Мартин Ганс, Стюарт Крэйг Роберт
МПК / Мітки
МПК: A61K 31/4439, C07D 401/10
Мітки: камсилатна, сіль
Код посилання
<a href="https://ua.patents.su/16-114196-kamsilatna-sil.html" target="_blank" rel="follow" title="База патентів України">Камсилатна сіль</a>
Попередній патент: Вагон-цистерна для затвердівальних продуктів
Наступний патент: Охолоджуваний кільцевий газозбірник
Випадковий патент: Спосіб інформаційного супроводу товарів та послуг












