Спосіб одержання 4-хлор-3-сульфамоілбензойної кислоти
Номер патенту: 19123
Опубліковано: 25.12.1997
Автори: Дьордь Шімон, Іда Свобода, Ендре Палоші, Дежьо Карбонітш, Ержебет Молнар, Ласло Харшінг, Каталін Мармароші, Шандор Віраг, Віра Гергелі
Формула / Реферат
Способ получения 4-хлор-3-сульфамоил-бензойной кислоты общей формулы 1:
где R1 - водород, С1-С4 - алкил, C1-C4-алкилтиогруппа, фенильная группа, меркаптогруппа,
R2 - водород,
R3 - водород или трифторметил, карбоксигруппа, С2-С5 - алкоксикарбонил или сульфамоил, или их фармацевтически приемлемых солей, отличающийся тем, что 1-аминобензимидазоловое производное общей формулы II
где R1 и R3 имеют указанные значения, вводят в реакцию с производными карбоновой кислоты общей формулы III
где R2 имеют указанное значение,
X - хлор,
R5 и R - водород или совместно образуют группу =СНN(СН3)2 и защитную группу, удаляют в щелочной среде и целевой продукт выделяют в свободном виде или в виде соли.
Текст
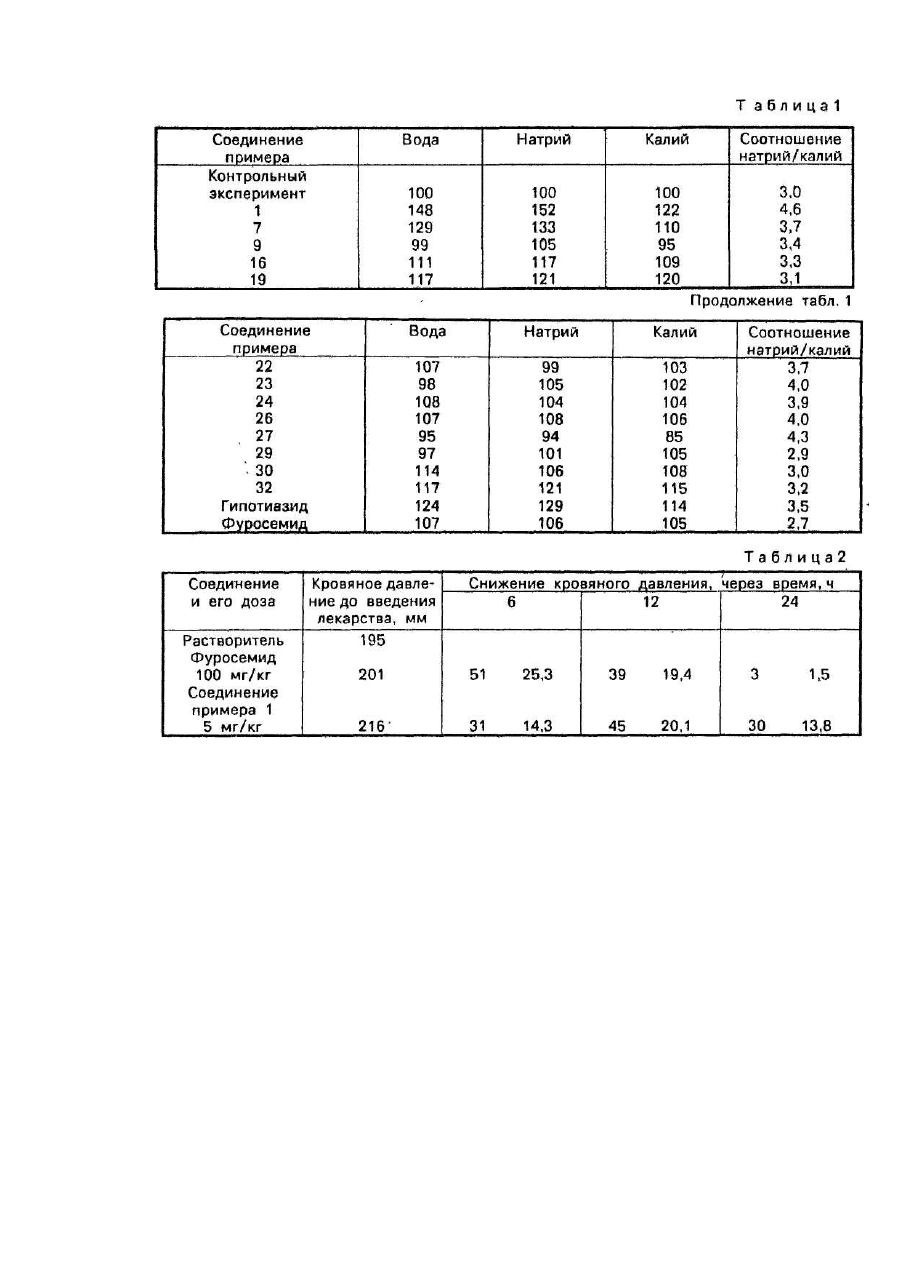
Изобретение относится к бензимидазоловым производным общей формулы где R1 - водород, C1-4 - алкил, C1-4 - алкилтиогруппа, фенильная группа, меркапто-группа; R2 - водород, Из - водород или трифторметил, карбок-сигруппа, С1-5 - алкоксикарбонил или сульфамоил или к их фармацевтически приемлемым солям, которые обладают диуретическим и салидиуретическим действием. Известен способ получения аминов взаимодействием галогенпроизводных с аминами [1]. Цель изобретения - синтез новых бензимидазолов с использованием известного способа получения аминов из аминов и галогенпроизводных, по своим свойствам превосходящих известные диуретики бензимидазольнога типа. Поставленная цель достигается согласно способу получения соединений общей формулы (I), заключающемуся во взаимодействии 1-аминобензимидазолового производного общей формулы где R1 и R3 имеют выше указанные значения, с производным карбоновой кислоты общей формулы где R2 имеет вышеуказанное значение, Х- хлор, R5 и R4 - водород или совместно образуют гр уппу =СНN(СН3)2; защитн ую гр уппу удаляют в щелочной среде и целевой продукт выделяют в свободном виде или в виде соли. Πример 1. 105 мл сероуглерода добавляют в суспензию, которая содержит 100 г 2-амино-5метоксикарбонил-Ы-(4'-хлор-З'-сульфамоилбензоил)- фенил гидразина в 400 мл метанола. Затем по каплям в реакционную смесь при температуре ниже 20°С с перемешиванием и охлаждением холодной водой добавляют гидрат окиси калия, растворенный в 190 мл абсолютированного этанола. После завершения операции добавления смесь кипятят с обратным холодильником с перемешиванием в течение 2 ч, а затем прозрачный коричневый раствор оставляют стоять в течение ночи. На следующий день в раствор добавлять 145 мл уксусной кислоты и перемешивают в течение 1 ч, затем выпаривают до половины объема. Остаток выливают в 1500 мл воды с перемешиванием. Бежевый осадок отфильтровывают с вакуумом, промывают водой и высушивают, Сырой продукт растворяют в кипящей смеси диметилформамида с водой в соотношении 1:1, горячий раствор осветляют активированным углем и профильтровывают в горячем состоянии. После охлаждения кристаллический бежевый осадок отфильтровывают с вакуумом, промывают водой и высушивают при 100°С под пониженным давлением. В результате получают 75 г (68%-ный выход) 1(4'-хлор-3'-сульфамоил-бензоил)-амино-5-метоксикарбонилбензи - мидазол-2-тиона с т.пл, 242-245°С (с разложением). После перекристаллизации из смеси диметилформамида с водой в соотношении 1:2 его температура плавления составляет 252-261°С (с разложением). Вычислено,%: С 43,59; Η 2,97; N 12,71; С 8,04; S44,55. C15H13CIH2 O5S 2 Найдено. %: С 43,80; Η 2,78; N 12,57; СІ 8,62; S 14.60. 48,4 г сложного эфира, полученного по описанному способу, перемешивают совместно с 330 мл 2 н. раствора гидрата окиси натрия при 50°С в течение 4 ч. Прозрачный желтый раствор охлаждают и подкисляют до величины рН 3-4 добавлением 2 н. соляной кислоты. Осадок отфильтровывают с вакуумом, промывают водой и высушивают при 80°С. Полученный сырой продукт перекристаллизовывают из смеси диметилформамида с водой в соотношении 1:1 с осветлением раствора. активированным углем. Таким образом, получают 1-(4'-хлор-3'-сульфамоилбензоил)-амино-5-карбок-сибензимидазол-2-тион, содержащий 1 молекулу диметилформамида, в виде снежно-белых очень мелких кристаллов. Продукт, содержащий диметилформамид, кипятят с 430 мл дистиллированной воды в течение 30 мин. После охлаждения с вакуумом отфильтровывают белые кристаллы, которые промывают водой и высушивают при 80°С под пониженным давлением. В результате в виде снежно-белых кристаллов получают 37,4 г (выход 76,6%) 1-(4'~хлор-3'-сульфамоилбензоил)-амино-5-карбоксибе-нзамидазол-2- тионионогидрата с т.пл. 320322°С. Вычислено, %: С 40,50; Η 2,94; N 12,59; СІ 7,97; S 14,41. C15H11CIS 2-H2O Найдено, %: С 40,22; Η 2,80; Ν 12,20; СІ 7,70; S 14,65. Получение исходного продукта. A) 80 мл гидразингидрата выливают в суспензию 172,5 г метил-4-хлор-З-нитробеи-зоата в 1600 мл абсолютированного спирта с перемешиванием, Затем реакционную смесь подвергают кипячению с обратным холодильником с перемешиванием в течение 45 мин. Исходный материал растворяют, и началось выпадение в осадок продукта. После охлаждения продукт отфильтровывают с вакуумом и подвергают последовательной промывке абсолютированным этанолом и водой до полного освобождения от ионов хлора. Таким образом, в виде желтых кристаллов получают 143,6 г (85%-ный выход) 4-метоксикарбонил-2-нитрофенилгидразина с т.пл. 169-171°С. Вычислено, %: С 45,49; Η 4,29; N 19,89. C8H9N3O1 Найдено, %: С 45,58; Η 4,31; N 20,33. B) 127 г 4-хлор-З-сульфамоилбензоилх-лорида, растворенного в 500 мл диоксана, добавляют в суспензию 105гфенилгидрази-нового производного, полученного по методике А, в 1 л диоксана с перемешиванием. Затем в смесь добавляют 26,5 г безводного карбоната натрия, и эту смесь перемешивают при кипячении с обратным холодильником на бане с горячей водой в течение 5 ч. После охлаждения смесь профильтровывают и фильтрат выпаривают под пониженным давлением с получением в виде остатка смолоподобной массы, которую перемешивают совместно с 1500 мл воды до тех пор, пока она не превратилась в порошок, после чего этот последний отфильтровывают с вакуумом, промывают водой и высушивают при 80°С. Получают в виде желтого порошка 203 г (выход 94,7%) 4-метоксикарбонил-2-нитро-N(4'-хлор-3'-сульфамоилбензоил)-фенилгидразина с т.пл.144-147°С. Вычислено, %: С 42,01; Η 3,05; N 13,07; СІ 8,27; S 7,48. C15H13CIN4 O7S Найдено,%; С 41,71; Η 3,38; Ν 13,06; СІ 8,01; S 7,86. С) 10 г никеля Ренея в качестве катализатора добавляют в раствор, который содержит 60 г нитросоединения, полученного в соответствии с методикой В, в 500 мл метоксиэтанола (этиленгликольмонометиловый эфир), температуру которого поддерживают на уровне 70°С. Затем смесь подвергают гидрогенизации при 70°С под давлением 10 атм в машине для встряхивания. После прекращения поглощения водорода реакционную смесь охлаждают и отфильтровывают катализатор. Фильтрат выпаривают под пониженным давлением и остаточную смолоподобную массу перемешивают в 500 мл воды до ее разрушения и превращения в фильтруемый порошок. Продукт отфильтровывают с вакуумом, промывают водой и высушивают при 80°С. В результате получают 52 г(91%-ный выход) 2-амино-4-метоксикарбонил-N-(4'-хлор-3'~сульфамоилбензои)-фенилгидразина в виде бежевого порошка с т.пл. 214-215°С (с разложением). Вычислено, %: С 45,17; Η 3,79; N 14,05; СІ 8,89; S 8,04. C15H15ClN4O5S Найдено.%: С 45,72; Η 3,17; Ν 13,75; СІ 9,29; S 7,94. Πримeр 2. 42 мл сероуглерода выливают в суспензию 38,5 г 2-амино-4-карбок-си-М-(4'-хлор-3'сульфамоилбензоил)-фенилгидразина в 160 мл метанола, а затем по каплям в указанную смесь при перемешивании добавляют 20,72 г гидрата окиси калия, растворенного в 105 мл абсолютированного этанола. Приготовленный раствор кипятят в течение 1 ч, затем охлаждают и величину рН доводят до 4-5 добавлением 2 н. соляной кислоты. Осадок отфильтровывают с вакуумом, промывают водой и высушивают при 80°С. В результате получают 31,8 г (75%-ный выход) 1-(4'-хлор-3'-сульфамоилбензо-ил)-амино-5карбоксибензимидазол-2-ти-она в виде бежевого порошка с т.пл. 290-295°С (с разложением). После очистки по примеру 1 продукт идентичен продукту по примеру 1. Получение исходного продукта. А) 25,7 г 4-метоксикарбонил-2-нитро-Ы-(4'-хлор-3'-сульфамоилбензоил)-фенил гидразина перемешивают с 120 мл 2 н. раствором гидрата окиси натрия при 50°С в течение 4 ч. После охлаждения величину рН темно-фиолетового раствора доводят до 5 добавлением 2 н. соляной кислоты. Желтый осадок отфильтровывают с вакуумом, промывают водой и высушивают при 80°С, получив в виде желтого порошка 23 г (вы ход 92,5%) 4-карбокси-2-нитро-Ы-(4-хлор-3'-сульфамоилбензоил)- фенилгидразика с т.пл. 273-275°С. Вычислено,%: С 40.53; Η 2,67; N 13,50; СІ 8,50; S 7,70. C14H11CIN4 O7S Найдено,%: С 40,23; Η 2,88; Ν 13,76; СІ 8,54; S 7,66. В) 4 г 10%-ного палладия на угле в качестве катализатора добавляют в суспензию 41,4 г нитросоединения, полученного по методике А примера 2, в 500 мл 96%-ного этанола. Затем реакционную смесь нагревают с перемешиванием до 60-70°С и по каплям 150 мл 30%-ного водного раствора гипофосфата натрия добавляют с такой скоростью, которая позволяет избегать интенсивного пенообразования. После охлаждения смесь профильтровывают и фильтровальный пирог перемешивают с 70 мл 2 и. раствора гидрата окиси натрия. Отфильтровывают катализатор и величину рН фильтрата доводят до5 добавлением 2 н. соляной кислоты. Осадок отфильтровывают с вакуумом, промывают водой и высушивают при 80°С. В результате получают 32 г (83%-ный выход) 2-амино-4-карбокси-Ы-(4'-хлор-3'-сульфа-моилбензоил)фенилгидразина с т.пл. 240-244°С (с разложением). После перекристаллизации из смеси диметилформамида с водой в соотношении 1:2 температура плавления этого продукта составляет 245-246°С (с разложением). Вычислено,0/,: С 43,70; Η 3,40; N 14,56; СІ 9,21; S 8,33. C14N13CIN4 O5S Найдено,%: С43,83; Η 3,40; Ν 14,21; СІ 8,94; S 8,10. Примерз. Смесь, содержащую 8 г 2-амино-4-метоксикарбонил- Ы-(4'-хлор-3'-сульфамоилбензоил)-фенил гидразина и 3,2 г этилксантата калия в 30 мл пиридина кипятят с обратным холодильником в течение 30 мин, после чего пиридин выпаривают под пониженным давлением. После растворения остатка в 40 мл ледяной уксусной кислоты раствор выливают в 160 мл воды. Осадок отфильтровывают с вакуумом, промывают водой и высушивают при 80°С. В результате в виде розового порошка получают 8,2 г (94%-ный выход) 1-(4'-хлор-3'сульфамоилбензоил)-амино-5-метоксикар-бонилбензимидазол-2-тиона с т.пл. 258-261 °С (с разложением) после его предварительной перекристаллизации из смеси ди-метилформамида с водой в соотношении 1:2. . Πример 4. 0,85 мл тиофосгена по каплям добавляют в раствор, который содержит 4 г 2-амино-4метоксикарбонил-N-(4'-[лор-3'-сульфаомилбензоил)-фен илгидразина в 22 мл 1 н. раствора гидрата окиси натрия, с одновременным перемешиванием и охлаждением водой. Смесь перемешивают при комнатной температуре в течение 4 ч, после чего ее кипятят с обратным холодильником в течение 30 мин. После охлаждения величину рН смеси доводят до 7 добавлением нормального раствора бикарбоната натрия, перемешивают в течение 30 мин, затем величину рН доводят до 5 добавлением уксусной кислоты. Осадок отфильтровывают с вакуумом, промывают водой и высушивают при 80°С, получив в виде бежевого порошка 4,35 г (выход - 98,5%) 1-(4'-хлор-3'-сульфамоилбензоил)-амино-5-метоксикарбонилбензимидазол-2-тиона с т.пл. 258-261°С (с разложением) после предварительной перекристаллизации из смеси диметилформамида с водой в соотношении 1:2. Πример 5. 2,54 г 4-хлор-З-сульфамо-илбензоилхлорида добавляют при перемешивании в виде небольших порций в раствор 2,2 г 1-амино-5-метоксикарбонил-бензимидазол-2-тиона в 8 мл диметилформамида и 1,4 триэтиламина. Реакционную смесь оставляют стоять на ночь, затем величину рН доводят до 5 добавлением уксусной кислоты и разбавляют смесь 100 мл воды. Выделившийся смолоподобный продукт разрушается до порошкообразного состояния, который отфильтровывают с вакуумом, промывают водой и высушивают при 80°С. Полученный сырой продукт кипятят с 10 мл ледяной уксусной кислоты в течение 30 мин, а затем выливают в 50 мл воды. Выделившаяся смолоподобная масса при перемешивании разрушается с образованием порошка. Осадок отфильтровывают с вакуумом, промывают водой и высушивают при 80°С. В результате в виде бежевого порошка получают2,4 г(вы ход54,5%) 1-(4'-хлор-3'-суль-фамоилбензоил)-амино-5-метоксикарбо-нилбензимидазол-2тионаст.пл. 258-261°С (с разложением) после предварительной перекристаллизации из смеси диметилформамида с водой в соотношении 1:2. Получениеисходного продукта. А) После кипячения 105,6 г 4-метокси-карбонил-2-нитрофенилгидразина с 1 л ледяной уксусной кислоты в течение 1 ч прозрачный оранжево-красный раствор выпаривают под пониженным давлением. Остаток перемешивают в 1500 мл воды, кристаллический осадок отфильтровывают с вакуумом, промывают водой и высушивают при 80°G. Получают в виде желтых порошкообразных кристаллов 123 г (выход 97%) 4метоксикарбонил-2-нитро-N-ацетилфенил-гидразина с т.пл. 182-185°С, а после перекристаллизации из водного раствора этанола его т.пл. 190-192°С. Вычислено,%: С 43,47; Η 4,38; N 16,59. C10H11N3 O5 Найдено.%: С 47,55; Η 4,73: N 16,58. B) 107,7 г производного бензойной кислоты, полученного по методике А примера 5, кипятят с обратным холодильником в 425 мл 1 н.раствора гидрата окиси натрия в течение 10 мин, а затем раствор фильтруют, получив прозрачный темно-красный раствор, который подкисляют до величины рН 3-5 добавлением уксусной кислоты. Кристаллический осадок отфильтровывают с вакуумом, промывают водой и высушивают при 80°С. Получают 98 г (вы ход 96,4%) 4-карбок-си-2-нитро-Ы-ацетилфенилгидразина в виде желтого твердого кристаллического вещества с т.пл. 262-263°С. После перекристаллизации из 50%-ного водного раствора этанола температуру плавления повышают до272-274°С (с разложением). C) Раствор 116,3 г нитросоединения, полученного по методике В примера 5, в 490 мл нормального раствора бикарбоната натрия фильтруют. Получают прозрачный раствор, который подвергают гидрогенизации в присутствии 10 г 10%-ного палладия на угле в качестве катализатора до прекращения поглощения водорода. После отфильтровывания катализатора фильтрат подкисляют до величины рН 4 добавлением 5 н. соляной кислоты. Кристаллический осадок отфильтровывают с вакуумом, промывают водой и высушивают при 80°С. Получают в виде бежевого твердого кристаллического продукта 80,9 г (выход 79,6%) 2-змино-4-карбокси-N-ацетилфенилгидразина с т.пл. 145-150°С(с разложением). После перекристаллизации из абсолютированного этанола температур у плавления удалось повысить до 156-158°С (с разложением). Вычислено, %: С 51,67; Η 5,30; N 20,09. С9Н11N3О 3 Найдено, %: С 51,31; Η 5,49; N 19,79. D) 62,75 г аминового соединения, полученного по методике С примера 5, растворяют в растворе 36 г гидрата окиси калия в 450 мл абсолютированного этанола, а затем добавляют 20,5 мл сероуглерода и смесь кипятят с обратным холодильником при перемешивании в течение 5 ч. В осадок выпадает желтый твердый кристаллический материал, В смесь добавляют 250 мл горячей воды, полученный раствор осветляют активированным углем, фильтруют и из фильтрата под пониженным давлением отгоняют около 200 мл этанола. К оставшейся части раствора добавляют 65 мл уксусной кислоты, отфильтровывают с вакуумом желтый кристаллический осадок, промывают его водой и высушивают при 80°С. Получают в виде белого кристаллического твердого вещества 46 г (выход 61 %) 1-ацетиламино-5-карбоксибензимидазол-2-тиона с т.пл. 334-338°С после предварительной перекристаллизации из 50%-ного водного раствора этанола. Вычислено,%: С 48,00; Η 3,61; N 16,72; S 12,76. C10H9N3O 3S2 Найдено. %; С 48,70; Η 3,50; N 16,70; S 12,74. Ε) 25,1 г бензимидазолового производного, полученного по методике D примера 5, кипятят со 100 мл 2 н. соляной кислоты при перемешивании в течение 6 ч. После охлаждения кристаллы отфильтровывают с вакуумом, промывают водой и суша т при 80°С. Получают в виде бежевого твердого кристаллического продукта 20,5 г (выход 98%) 1-амино-5-карбоксибензимидазол-2-тиона с т.пл. 301-304°С (с разложением). Вычислено, %: С 45,92; Η 3,37; N 20,08; S 15,30. C8H7NO2S Найдено,%: С 45,40; Η 3.34; N 19,92; S 15.70. F) Суспензию, содержащую 20,5 г карбоновой кислоты, полученной по методике Ε примера 5, в 250 мл метанола насыщают газообразным хлористым водородом, а затем кипятят с обратным холодильником при перемешивании в течение 30 мин, постепенно вводят газообразный хлористый водород. После охлаждения кристаллы отфильтровывают с вакуумом и добавляют во влажном состоянии к 80 мл нормального раствора бикарбоната натрия при интенсивном перемешивании. После перемешивания в течение 30 мин кристаллический осадок отфильтровывают с вакуумом, промывают водой и высушивают при 80°С. Таким образом, в виде кристаллов костяной окраски получают 19,9 г (выход 91 %) 1-ами-но-5метоксикарбонилбензимидазол-2-ти-она с т.пл. 239°С (с разложением) после предварительной перекристаллизации из смеси диметилформамида с водой в соотношении 2:1. Вычислено,%: С 48,42; Η 4,06; N 18,82; S 14,36. C9H9N3O2S Найдено, %: С 48,16; Η 3,94; Ν 18,50; S 14,61. Πримeр 6.12,7 г безводного карбоната натрия, растворенного в 200 мл воды, добавляют в суспензию 44,6 г 1-амино-5-ме-токсикарбонилбензимидазол-2-тиона в 400 мл диоксана, затем по каплям в указанную смесь при перемешивании и охлаждении водой до 15-20°С добавляют раствор, который содержит 68 г 4-хлор-3-(Мдиметилами-нометилиден)-сульфамоилбензоилхлорида в 400 мл диоксана. После завершения добавления реакционную смесь перемешивают при 20°С в течение 2 ч, а затем ее фильтруют с получением прозрачного раствора. Фильтрат разбавляют 2 л воды, кристаллический осадок отфильтровывают с вакуумом, промывают водой и сушат при 80°С. 84,5 г полученного сырого продукта растворяют в горячем виде 1 л воды при интенсивном перемешивании. После охлаждения кристаллический осадок отфильтровывают с вакуумом, промывают водой и сушат при 80°С. Получают в виде белого порошка 74,4'г (выход 75,5%) 1-{4'-хлор-3'-(Nдимєтиламинометииден-сульфамоилбензоил]-амино-4- метоксикарбонилбензими-дазол-2-тиона с т.пл. 238239°С (с разложением), Вычислено, %,: С 45,92; Η 3,85; N 14,10; Cl 7,13; S 12,90. C19H18CIN5 O5S Найдено, %,: С 45,45; Η 3,59; Ν 13,95; СІ 7,10; S 13,16. 86,8 г соединения, полученного по вышеизложенному, перемешивают в 500 мл 2 н. раствора гидрата окиси натрия при 50°С в течение 8 ч, а затем раствор осветляют активированным углем, профильтровывают и величину рН фильтрата добавляют до 6 добавлением 2 н соляной кислоты с одновременным охлаждением и интенсивным перемешиванием. После добавления 100 мл этанола выпавший осадок отфильтровывают с вакуумом, промывают водой и сушат при температуре 80°С с получением 60,8 г .(выход 81,4%) 1-(4'-хлор-3'сульфамоилбен-зоил)-амино-5-карбоксибензимидазол-2-тиона с т.пл. 285-290°С (с разложением). После очистки аналогично методике примера 1 оба вещества оказывают совершенно идентичными. Πример 7. После добавления 3,66 г Ν,Ν- ди-(метоксикарбонил)-метилизомочевины в раствор 2,06 г 2амино-4-мето-ксккарбонил- (4'-хлор~3'-сульфамоилбензоил)-фенилгидразина в 10 мл диметилформамида полученный раствор кипятят в течение 3 ч, а затем выпаривают при пониженном давлении. Остаток растворяют в 10 мл теплой ледяной уксусной кислоты, осветляют активированным углем, фильтруют и фильтрат выливают в 100 мл воды. Выделившиеся кристаллы отфильтровывают с вакуумом, промывают водой и высушивают при 80°С. В результате получают 3,7 г (выход 87%) 1-(4-хлор-З'-сульфамоилбензоиламино-6-метоксикарбонилбензимидазолона с т.пл. 210-216°С (с разложением). 3,7 г бензимидазолового производного, полученного по вышеизложенному, перемешивают в 37 мл 2 н. раствора гидрата окиси натрия при 60°С в течение 5 ч. Затем смесь осветляют активированным углем, профильтровывают и фильтрат подкисляют 2 н. соляной кислотой. Кристаллический осадок отфильтровывают с вакуумом, промывают водой и высушивают при 60°С, Таким образом, в виде бежевого твердого кристаллического продукта получают 2,6 г (выход 72%) 1-(4'-хлор-3'-сульфамоилбензоил)-амино-5карбоксибензимидазолона с температурой плавления после перекристаллизации из 50%-ного водного раствора этанола 339°С. Вычислено,%: С 43,85; Η 2,70; N 13,64; S 7,80. C15H11CIH4 O6S Найдено,%: С 43,57; Η 2,86; N 13,58; S 7,42. Примере.11 г 1-(4'-хлор-3'-сульфамо-илбензоил)-амино-5-метоксикарбонилбе-нзимидазол-2-тиона растворяют в растворе, который приготовляют из 0,58 г металлического натрия и 10 мл метанола. После добавления 1,56 мл йодистого метила раствор кипятят с обратным холодильником в течение 3 ч, затем метанол выпаривают и остаток растирают в воде. Порошкообразные кристаллы отфильтровывают с вакуумом, промывают водой и высушивают при 80°С, В результате получают 10,8 г (выход 95%) 1-(4'-хлор-3'сульфамоилбензоил)-ами-но-5-метоксикарбонил-2-метилтиобензим-идазола с т.пл. 186-188°С (с разложением). Вычислено, %: С 44,88; Η 3,32; N 12,32; СІ 7.79; S 14,10. C17H15CIN4 O5S 2 Найдено,%: С 44,75; Η 3,68; Ν 12,50; СІ 7,60; S 13,91. Пример 9. Юг сложного эфира, полученного по методике примера 8, гидролизуют с использованием 50 мл 2 н. раствора гидрата окиси натрия аналогично примеру 1. Таким образом, получают 9 г (выход 94%) 1-(4'хлор-3'-сульфамоилбензо-ил)-амино-6-карбокси-2-метилтиобензимида-зола, который перекристаллизовывают из 50%-ного водного раствора этанола. В результате получают ве щество с 1,5 молекулы кристаллогидратнойвлагиит.пл.214-222°С (с разложением). Вычислено, %: С 41,06; Η 3,44; N 11.97; ' СІ 7,57; S 13,07. C16H13CIN4S 2-1,5H2O Найдено, %: С 41,00; Η 3,35; Ν 11,71; СІ 7.11; S 13,15. Πример 10. 6,6 г 1-(4'-хлор-3'-сульфа-моилбензоил)-амино-5-метоксикарбонил-бензимидазол-2-тиона растворяют в растворе, приготовленном из 0,35 г металлического натрия и 60 мл метанола. После добавления 2 мл хлористого бензоила реакционную смесь подвергают кипячению с обратным холодильником в течение 16 ч, а затем выпаривают под пониженным давлением. Остаток растирают в воде, твердый продукт отфильтровывают и подвергают после сушки хроматографической обработке в колонке. В качестве сорбента используют силикагель, а в качестве элюента - смесь бензола с ацетоном в соотношении 2:1. Таким образом, в виде белого порошкообразного твердого продукта получают 5,37 г (выход 67,8%) 2-бензилтио-1-(4'-хлор-3'сульфамоилбензоил)-амино-5-метоксикар - бонилбензимидазола с т.пл. 111—118°С (с разложением). Величина этого продукта равна 0,90, ее определяют тонкослойной хроматографией (ТХС) с использованием для проявления системы хлороформ-уксусная кислота - метанол. Вычислено,%: С 52,02; Η 3,61; N 10,55; СІ 6,68; S 12,08. C23H19CIN4 O5S 2 Найдено, %,: С 52,32; Η 4,00; Ν 9,90; СІ 6.00; S 12,00. Πримeр 11. Суспензию, которая содержит 5,3 г 2-бензилтио-1-(4'-хлор-3'-сульфамоилбензоил)-амино-5метоксика-рбонилбензимидазола в 30 мл 2 н. раствора гидрата окиси натрия, перемешивают в течение 4 ч при 50°С. Тем временем растворяется большая часть исходного вещества. После отфильтровывания нерастворимой части фильтрат нейтрализуют добавлением 30 мл 2 н. соляной кислоты. Белый осадок отфильтровывают с вакуумом, промывают водой и высушивают с получением 4,9 г (выход 94,8%) 2бензилтио-1-(4'-хлор-3'-суль-фамоил)-амино-5-карбоксибензимидазола с т.пл. 190-196°С(с разложением). Вычислено, %: С 51,10; Η 3,31; N 10,84; СІ 6,86; S 12,40. C23H19CIN4 O5S 2 Найдено,%: С 49,23; Η 3,77; Ν 11,00; СІ 6,84; S 11,40. Πример 12.3,85 мл 35%-ного раствора перекиси водорода по каплям при 20 С добавляют в суспензию 9 г (4'-хлор-3*-сульфа-моилбензоил)-амино-2-метилтио-5-метокси-карбонилбензимидазола в 20 мл ледяной уксусной кислоты. Затем реакционную смесь перемешивают в горячей воде в течение 90 мин. После охлаждения твердый продукт отфильтровывают с вакуумом, промывают водой и высушивают. Получают в виде белого порошка 6,4 г (выход 65,7%) 1-(4'-хлор-3'-сульфамоилбензоил)-амино-5-метоксикарбонил-2метилсульфонилбе-изимидазола с т.пл. 254-255°С (с разложением) после перекристаллизации из смеси диметилформамида с водой в соотношении 1:1. Вычислено,%: С 41,93; Η 3,10; N 11,50; СІ 7,28; S 13,17. C17H15CIN4 O4S 2 Найдено,%: С 42,01; Η 3,15; Ν 11,34; СІ 7,35; S 13,01. Πример 13. Суспензию, содержащую 5,4 г 1-(4'-хлор-3'-сульфамоилбензоил)-ами-но-5-метоксикарбонил-2метилсульфонил-бензимидазола в 30 мл 2 н.раствора гидрата окиси натрия перемешивают при 50°С в течение 4 ч, В результате получают прозрачный фиолетовый раствор, который осветляют активированным углем, фильтруют и фильтрат подкисляют до величины рН 2 добавлением 2 н. соляной кислоты. Белый осадок отфильтровывают с вакуумом, промывают водой и высушивают. Получают в виде белого порошкообразного твердого продукта 4,43 г (выход 85,7%) 5-карбокси-1-(4'-хлор-3'-сульфамоилбензоил) амино-2-метилсульфонилбензимидазола с т.пл. 222-225°С (с разложением), которая не изменяется после перекристаллизации из смеси диметилформамида с водой в соотношении 3:2. Вычислено,%: С 40,64; Η 2,77; N 11,85; СІ 7,50; S 13,56. C16H23CIN4 O7S 2 Найдено, %: С 40,07; Η 3,01; Ν 12,02; СІ 7,65; S 13,29. Πример 14. 17,25 г 4-хлор-3-(N-диметиламинометилиден)-сульфамоилбензоилхло-рида добавляют в суспензию 11,45 г 1-ами-ио-5-метоксикарбонил-2-метилбензи-мида зола в 25 мл пиридина. Затем реакционную смесь нагревают до 60-70°С с получением желтого раствора. Густую желтую смесь оставляют стоять на ночь, затем добавляют 200 мл воды. Выделившаяся желтая смолоподобная масса разрушается с образованием бежевого порошка после перемешивания в течение нескольких минут. Продукт отфильтровывают с вакуумом, промывают водой и высушивают с получением 23,9 г(выход90%) 1-[4'-хлор-3'(N-диметиламинометилиден)-сульфамоилбензоил]-амино-5-метоксикарбонил-2-метил-бензимидазола с т.пл. 240~245°С (с разложением). После перекристаллизациииз нитрометана температура плавления продукта 260-263°С (с разложением). Вычислено, %: С 50,26; Η 4.22; N 14,65; СІ 7,42; S 6,71. C20H20CIN5 O5S Найдено, %: С 49,85; Η 4,31; Ν 15,12; СІ 7,44; S 6,52. Получение исходных продуктов. A) 235 мл уксусного ангидрида добавляют в суспензию 97,5 г 2-амино-4-карбокси-Nацетилфенилгидразина в 450 мл дихлорметана с одновременным перемешиванием. Эту смесь перемешивают при комнатной температуре в течение 3 ч, затем кристаллы отфильтровывают с вакуумом, промывают дихлорметаном и высушивают при 60°С. Таким образом, получают 101,2г (выход 86,5%) 2ацетиламино-4-кар-бокси-ГЧ-ацетилфенилгидразина с т.пл, 238°С (с разложением). Вычислено, %: С 52,58; Η 5,21; N 16,93. С11Н13N3 O4 Найдено, %: С 52,82; Η 5,12; N 17,20. B) 101,2 г ацетилоеого производного, полученного по примеру 14А, кипятят в 800 мл уксусной кислоты в течение 13 ч, а затем выпаривают под пониженным давлением. После перемешивания остатка в 800 мл воды кристаллический осадок отфильтровывают с вакуумом, промывают водой и высушивают при 80°С. Получают в виде белого порошкообразного твердого продукта 73,1% (выход 78,5%) 1-ацетил амино-5-карбокси-2-метилбензимидазола с т.пл. 293-294°С (с разложением), Вычислено, %: С 56,65; Η 4,75; N 18,02 C11H11N3 O3 Найдено, %: С 56,71; Η 4.62; N 17,89. C) 73,1 г бензимидазолового производного, полученного по методике В примера 14, кипятят в 310 мл 2 н. соляной кислоты в течение 5 ч. Полученный таким образом прозрачный раствор осветляют активированным углем и фильтруют. После охлаждения кристаллический осадок фильтруют с вакуумом, промывают небольшим объемом воды и высушивают при 80°С. В результате в виде снежно-белых блестящих пластинок получают 68,9 г (вы ход 96%) 1-амино-5-карбокси-2-метилбензимидазолхлорида с т.пл. 287-288°С (с разложением). Вычислено, %: С 47,48; Η 4,43; N 18,46; СІ 15.17. С11Н11СІN3 О2 Найдено, %: С 47,85; Η 4,83; Ν 18,15; СІ 15,20. D) 68,1 г гидрохлорида, полученного по методике С примера 14, суспендируют в 1 л метанола. Далее повторяют методику F примера 5, получив 48 г (вы ход 78%) 1-амино-5-метоксикарбонил-2метилбензимидазола с т.пл. 220-222°С. Вычислено, %: С 58,53; Η 5,40; N 20,48. C10H11N3 O2 Найдено, %: С 58,10; Η 5,38; N 20,25. Ε) В суспензию, содержащую 14,5 г 4-хлор-3-(N-диметиламинометилиден)-сульфамоилбензойной кислоты в 50 мл хлористого тионила добавляют 2 капли диметилформамида. Реакционную смесь кипятят с обратным холодильником при перемешивании в течение 2 ч, затем фильтруют, получив прозрачный раствор. Фильтрат выпаривают под пониженным давлением. В результате получают 12,7 г (выход 82%) 4-хлор-3-(Nдиметиламинометилиден)-сульфамоилбензоилхлорида в виде снежно-белого твердого вещества с т.пл. 140°С. После перекристаллизации из бензола температуру плавления повышают до 154-155°С. Вычислено, %: С 38,84; Η 3,26; N 9,06; СІ 22,93; S 10,37. C10H10CI 2N2O 3S Найдено, %: С 38,28; Η 3,07; Ν 8,94; СІ 23,14; S 10,58. Πример 15. Смесь, содержащую 25 г, 2 амино-4-метоксикарбонил-N-4'-хлор-3'-(Nдиметиламинометилиден)-сульфамоилбензоил)-фенилгидразина в 80 мл уксусного ангидрида, выдерживают при комнатной температуре в течение ночи, а затем смешивают с 250 мл воды. Кристаллы фильтруют с вакуумом, промывают водой и сушат. Получают 26 г 2-ацетиламино-4-метоксикар-бонил-N-[4-хлор-31-(Nдиметиламинометилиден)-сульфамоилбен зоил ]-фе нил гидразина с т.пл, 216-220°С (с разложением). 26 г полученного таким образом продукта кипятят в 200 мл ледяной уксусной кислоты в течение 5 ч. Прозрачный желтый раствор выпаривают под пониженным давлением и остаток растирают в воде. Выделившиеся кристаллы фильтруют с вакуумом, промывают водой и высушивают. Таким образом, в виде бежевого порошка получают 24,5 г (вы ход 98% в пересчете на исходное аминосоединение) 1-[4'-хлор-3-(Г\1димети-ламинометилиден)-сульфамоилбензоил]-ами-но-5-метоксикарбонил-2-метилбензимидазоласт.пл.245255°С(с разложением). Температур у плавления перекристаллизацией из нитрометана удается повысить до 260-263°С. Этот продукт оказывается идентичным продукту по примеру 14. Получение исходных материалов. A) 17,75г кристаллического карбоната натрия, растворенного в330мл воды, добавляют в суспензию 70,76 г 4-метоксикарбо-нил-2-нитрофенилгидразина в 670 мл диоксэна, 103,6 г 4-хлор-3-(Νдиметиламинометилиден)-сульфамоилбензоилхлорида, растворенного в 280мл диоксана, по каплям добавили в вышеуказанную смесь с перемешиванием, ι результате чего получают темный прозрачный раствор. Величину рН реакционной смеси периодически регулируют, поддерживая ее на уровне приблизительно 7 периодическим добавлением нормального раствора бикарбоната натрия. После завершения операции добавления смесь перемешивают в течение дополнительного 1 ч, а затем разбавляют 1 л воды. Осадок фильтруют с вакуумом, промывают водой и высушивают при 80°С. Получают 127,8 г (выход 78,8%) 4-метоксикарбонил-2-нитро-N-[4'-хлор-3'-(N-метиламинометилиден)-сульфамоилбензоил]-фенил гидразина с т.пл. 243-247°С. После перекристаллизации из нитрометана температуру плавления повышают до 255-256°С. Вычислено, %: С 44,68; Η 3,75; N 14,47; СІ 7,33; S 6,63. C18H18CIN5 O7S Найдено, %: С 44,70; Η 3,69; Ν 14,70; СІ 7,53; S 6,79. B) 5 г 10%-ного палладия на угле в качестве катализатора добавляют в суспензию 61 г нитросоединения, полученного по методике А примера 15, в 40 мл 96%-ного этанола. Смесь выдерживают при 60-70°С и по каплям при той же температуре добавляют 250 мл 30%-ного водного раствора гипофосфита натрия с такой скоростью, чтобы избежать интенсивного пенообразования. После завершения операции добавления смесь перемешивают в течение дополнительных 30 мин при 60-70°С. После охлаждения смесь фильтруют, твердый продукт смешивают с 250 мл диоксана, фильтруют и фильтрат выпаривают под пониженным давлением. После растирания остатка в 200 мл 50%-ного водного раствора этанола кристаллы фильтруют с вакуумом, промывают 50%-ным этанолом и высушивают при 80°С, Таким образом, в форме кристаллов цвета масла получают 40 г (выход 68%) 2- амино-4-метоксикарбонил-N-[4'-хлор-3'-(N-диметиламинометилиден)сульфамоил-бензоил]-фенилгидразина с т.пл. 219-220°С (с разложением). Вычислено,%; С 47,63; Η 4,44; N 15,43; СІ 7,8. C16H20CIN5 O5S Найдено, %: С 47,80; Η 4,25; N 15,44; СІ 7,41. Πример 16. 23,9 г 1-[4'-хлор-3'-(N-диметиламинометилиден)-сульфамоилбензоил]-амино-5метоксикарбонил-2-метилбензи-мидазола перемешивают в 150 мл 2 н. раствора гидрата окиси натрия при 50°С до прекращения процесса образования аммиака. В этот период времени образовался желтый раствор. После охлаждения раствор подкисляют до рН 1 добавлением 2 н. соляной кислоты. Осадок фильтруют с вакуумом, промывают водой и высушивают. Получают в виде белого порошкообразного продукта Н4'-хлор-3'сульфонилбензоил)-ами-но-5-карбокси-2-метилбензимидазола с т.пл. 293-296°С (с разложением) после перекристаллизации из 50%-ного водного раствора этанола. Вычислено, % ; С 47,00; Η 3,20; N 13,71; О 8,67; S 7,85. C16H13CIN4 O5S Найдено, %: С 45,80; Η 3,71; N 13,93; СІ 8,80; S 7,74. Πример 17. Методику примера 14 повторяют за исключением того, что в данном случае в качестве исходного соединения используют 10,63 г 1-амино-5-метоксикарбо-нилбензимидазола. В результате в виде бледно-желтого порошка получают 21,1 г (выход 82%) 1-[4'-хлор-3'-(N-диметиламиноэтилиден)сульфамоилбензоил]-амино-5-метоксикарбонилбензимидазола с т.пл. 249-252°С(с разложением). Вычислено, %: С 49,19; Η 3,91; N 15,10; S 6,91. C19H18CIN5S Найдено, %: С 49,62; Η 4,36; N 15,30; S 6,68. Получение исходных продуктов. А) 2 ,5 г 10%-ного палладия на угле в качестве катализатора добавляют в раствор 25,3 г 4метоксикарбонил-2-нитро-N-ацетилфенилгидразина в 380 мл метоксиэтанола и смесь подвергают гидрогенизации в аппарате для встряхивания до прекращения процесса поглощения водорода. После отфильтровывания катализатора фильтрат выпаривают под пониженным давлением и остаток смешивают с 100 мл воды. Выделившиеся кристаллы фильтруют с вакуумом, промывают водой и высушивают при 80°С. Таким образом, в виде бежевого кристаллического твердого вещества получают 19,1 г (выход 85,6%) 2амино-4-метоксикарбонил-N-ацетилфенилгидразина ст.пл. 175-178°С. После перекристаллизации из метанола температур у плавления удается повысить до 180-182°С Вычислено, %: С 53,80; Η 5,87; N 18,82. С10H13N3 О3 Найдено, %: С 53,17; Η 5,94; N 18,93. B) Кипятят с обратным холодильником 22,3 г фенилгидразинового производного, полученного по методике А примера 17, в 150 мл безводной муравьиной кислоты в течение 5 ч, прозрачный раствор фиолетового цвета выпаривают под пониженным давлением. В результате приливання 250 мл воды к остаточной смолоподобной массе получают раствор, из которого вскоре начинают выпадать белые кристаллы. После выдержки в течение нескольких часов кристаллы отфильтровывают с вакуумом, промывают водой и высушивают при 80°С. Получают в виде белого кристаллического твердого вещества 17,2 г(выход 76%) 1-аце-тиламино-5-метоксикарбонил-бензимидаз-ола с т.пл. 210~212°С (с разложением). Вычислено, %: С 56,65; Η 4,75; N 18,02. C11H11N3 О3 Найдено, %: С 56,55; Η 4,67; N 18,28. C) 32,5 г бензимидазолового производного, полученного по методике В примера 17, кипятят в 140 мл 2 н. соляной кислоты в течение 5 ч. После осветления раствора активированным углем, фильтрования и охлаждения выпавшие в осадок кристаллы отфильтровывают с вакуумом, промывают небольшим количеством воды и высушивают при 80°С. Таким образом, в виде снежно-белого кристаллического твердого вещества получают 23,2 г (вы ход 78%) 1-амино-5-кар-боксибензимидазолпидрохлорида с т.пл. 325-330°С. Вычислено, %: С 44,98; Η 3,77;.Ν 19,67; СІ 16,60. С8Н8СІN3О2 Найдено, %: С44,49; Η 3,80; N 19,68rCI 16,52. D) 26 г бензимидазолового производного, полученного по методике С примера 17, используют для реакции с 270 мл метанола, содержащего хлористый водород, аналогично методике F примера 5. Для разложения полученного таким образом гидрохлорида используют 220 мл нормального раствора бикарбоната натрия. В результате получают 19,3 г (вы ход 83%) 1-амино-5-метоксикарбо-нилбензимидазола с т.пл. 194195°С. Вычислено, %: С 56,54; Η 4,75; N 21,98. C9H9N3O2 Найдено, %: С 56,95; Η 4,63; N 21,62. Пример18. 28,7 г 2-амино-4-метокси-карбонил-N-[4'-хлор-3'-(N-диметиламинометилиден)сульфамоилбензоил]-фенил гидразина кипятят в 200 мл безводной муравьиной кислоты в течение 6 ч. После выпаривания раствора под пониженным давлением остаток растирают в воде, выделившиеся, кристаллы отфильтровывают с вакуумом, промывают водой и высушивают. Получают в виде желтовато-бежевого порошка 19 г {выход 64%) 1-[4*-хлор-3'-(Nдиметиламиномвтилиден)-сульфамоилбензоил]-амино-5-метокcикарбонилбензимидазола с т.пл, 240-253°С (с разложением), По всем аспектам этот продукт оказался идентичным продукту примера 17. Πример 19. Осуществляют методику примера 16 за исключением того, что в качестве исходных материалов в данном случае используют 6,5 г 1-[4'-хлор-3'-(N-диметиламинометилиден)сульфамоилбензоил]-амино-5-метоксикарбонидбензимидазола и 40 мл 2 н. раствора гидрата окиси натрия. Таким образом, после перекристаллизации из 50%-ного водного раствора этанола получают 5,1 г (выход 92%) 1-(4'-хлор-3'-суль-фамоилбензоил)-амйно-5-карбоксибензимидазола с т.пл. 290-291 °С (с разложением). Вычислена %: С 45,63; Η 2,81; N 14,19; Сі 8,98; S 8,12. C15H10ClN4O5S Найдено, %; С 45,27; Η 2,79; Ν 13,85; СІ 8,93; S7.71. Пример 20. Повторяют методику примера 1 за исключением того, что в данном случае в качестве исходных материалов используют 2,32 г 2-амино-4-циано-N-(4'-хлор-3*-еульфамоилбензоил)-диcульфида, 1,07 г гидрата окиси калия и 4,5 мл абсолютированного этанола. Реакционную смесь подкисляют добавлением 24 мл уксусной кислоты. Таким образом, получают 2,32 г (выход 97%) сырого продукта, который очищают хроматографической обработкой в колонке с силикагедем с использованием в качестве элюента смеси бензола с ацетоном в соотношении 1:1. Таким образом, получают Т^(4'-хлор-3'-сульфамоилбензрил)амино-5-цианобензимидазол-2-тиона ст.пл. 315°С. Вычислено, %: С 44,16; Η 2,47; N 17,17; СІ 8,69; S 15,72. C15H10CIN5 O3S Найдено. %: С 44,40; Η 2,67; Ν 16,94; СІ 8.96; S 15,33. Получение исходных продуктов. А) Повторяют методику В примера 1, используя в качестве исходных материалов 8,1 г 4-циано-2'нитрофенилгидразина, 114 мл диоксина, 46 мл водного раствора, 2,4 г кристаллического карбоната натрия и 11,6 г 4-хлор-З-сульфамоилбензоилхлорида, растворенного в 53 мл диоксана. После выпаривания реакционной смеси остаток тщательно смешивают с водой, выпавший желтый осадок отфильтровывают с вакуумом, промывают водой и высушивают при 80°С. Таким образом, после перекристаллизации из уксусной кислоты получают 3,75 г (выход 65%) 2-4-циан'о-2-нитро-N-(4'-хлор-3'-сульфамоилбензоил)-фенилгидразина с т.шь 292-295°С (с разложением). Вычислено,% : С 40,63; Η 2,92; N 16,92; СІ 8,57; S 7,78. C14H10CIN3 O5S -0,5СН3СООН Найдено, %: С 40.06г Η 2,52; N 16,85; CI 8,23; S 7,65. В) 1 г никеля Ренeя в качестве катализатора добавляют к 8,54 г нитросоединения, полученного по методике А примера 20, растворяют а 500 мл метоксиэтанола, а затем смесь подвергают гидрогенизации под aтмoсферным давлением при комнатной температуре в аппарате для встряхивания до прекращения поглощения водорода. После отфильтровывания катализатора и выпаривания фильтрата под пониженным давлением остаток растирают в воде, выпавшие белые кристаллы oсадка фильтруют с вакуумом, промывают водой и высушивают при 80°С. Таким образом, получают 6,62 г (выход 80%)2-амино-4-циано-(4'-хлор-3! сульфамо-илбензоил)-фенилгидразина с т.пл. 205°С (с разложением), Вычислено, %: С 45,96; Η 3,31; N 19,15; СІ 9,69; S 8,77, C13H12CIN5 O3S Найдено, %: С 46,06; Η 3,28; Ν 19,21; СІ 9,81; S 8,80. Πример 21. Методику примера 1 повторяют с использованием 2,9 г 2-амино-4-бензил-N-[4'-хлор-3'еульфамоилбензоил)-фенилгидразина, 10 мл метанола, 2,8 мл сероуглерода и 1,2 г гидрата окиси калия, растворенного в 4,5 мл абсолютированного этанола, в качестве исходных материалов, Для подкисления реакционной смеси добавляют 24 мл уксусной кислоты. После перекристаллизации сырого продукта в виде влажного фильтровального пирога из 96%-ного этанола получают 1,7 г (вы ход 57%) 5нбензоил-1-[4"-хлар-3'сульфамоилбензсил)-аминабензимидазол-2-тиона с т.пл, 233°С (с разложением). Вычислено, %: С 51,79; Η 3,11; N11,51; СІ 7,28; 3 13.17. C21H15CIN4 O4S Найдено.%: С51,30; Η 3,74; Ν 11,39; СІ 7,40; S 13,50. Получение исходных продуктов. А) 20 мл гидразингидрата добавляют в суспензию 52,33 г 4-хлор-З-нитробензофе-нона в 200 мл абсолютированного этанола при перемешивании. Реакционную смесь перемешивают при комнатной температуре в течение 25 мин, а затем осторожно нагревают до температуры кипения. После завершения бурной реакции смесь кипятят с обратным холодильником в течение дополнительно 1 ч. После охлаждения кристаллы отфильтровывают с вакуумом, тща тельно промывают водой и высушивают при 80°С. Таким образом в виде оранжево-красных кристаллов получают 38,62 г (выход 75%) 4-бензоил-2нитрофемллгидразина с т.пл. 163-1б4°С. Вычислено, %: С 60,89; Η 4,31; N 16,33. C13H11N3 О3 Найдено, %: С 60,60; И 4,15; N 16,40. B) Повторяют методику В примера 1, используя в качестве исходных материалов 28 г 4-бензоил-2нитрофенилгидразина, 272 мл диоксана, 5,8 г безводного карбоната натрия, растворенного в 217 мл диоксана. В результате после перекристаллизации из метанола получают 29,1 г (выход 61%) 4-бензоил-2нитро-N-{4'-хлор-3'-сульфамоил-бензоил)-фенилтидрaзина с т.пл. 148 С. Вычислено, %; С 50,5θ; Η 3,18; Ν 11,80; СІ 7,47; S 6,75. C20C15CIN4 O6S Найдено, %: С 49,59; Η 3,15; Ν 11.46; СІ 7,71; S 6,46. C) Повторяют методику В примера 20, используя в качестве исходных материалов 23,7 г нитрссоединения, полученного по методике В примера 21, и 500 мл метанола. В результате получают Т9-.7 г (выход 88,5%) 2-амино-4-бензоил-М-(4'-хлор-3"-сульфамоил-бензоил)- фенил гидразина с т.пл. 162°С (с разложением). Вычислено, %; С 53,99; Η 3,85; N 12,59; СІ 7,97; S 7,21, C20H17CIN4 O4S Найдено, %; С 53,80; Η 3,94; Ν 12,87; СІ 7,71; 5 7,43. Πример 22. Повторяют методику примера 16 с использованием в качестве исходных материалов 6,2 г 1[4'-хлор-3'-(N-диметиламинометилиден)-сульфамоилбензоил]-аминобензимидазола и 40 мл 2 н. раствора гидрата окиси натрия. В результате после перекристаллизации из 96%-ного этанола получают 6 г (выход 87,6%) 1-(4'-хлор-3'-сульфамоилбензоил)-аминобензимидазола с т.пл. 162°С (с разложением). Вычислено, % : С 47,93; Η 3,16; N 15,97; СІ 10,11; S 9,14. C11H11CIN4 O3S Найдено, %: С 47.50; Η 3,08; Ν 15,70; СІ 9,95; S 8,96. Получение исходного продукта. Повторяют методику примера 14 с использованием в качестве исходных материалов 4 г 1аминобензимидазола, 7 мл пиридина и 9,3 мг 4-хлор-3-(N-диметиламинометилиденсульфамоилбензоилхлорида). В результате после перекристаллизации из нитрометана получают 11,1 г (выход 91 %) 1-[4'-хлор-3'-диметиламинометилиден)-сульфамоилбензоил]-аминобензимидазола с т.пл. 258-261°С. Вычислено, %: С 50,30: Η 3,97; N 17,26; СІ 8,74; S 7,90. C17H16CIH5 O3S Найдено, %: С 50,13; Η 4,01; Ν 17,27; СІ 8,90; S 8,03. Πример 23. Повторяют методику примера 16 с использованием в качестве исходных материалов 5,1 г 1[4'-хлор-3'-(N-диметиламинометилиден)-сульфамоилбензоил]-амино-2-метилбензимидазола и 30 мл 2 н. раствора гидрата окиси натрия. В результате после перекристаллизации из смеси диметилформамида с водой в соотношении 1;1 получаю ι 0,7 г (выход 87%) 1-(4'-хлор-3'-сульфамоилбензоил)-амино-2-метилбензимидазола с т.пл. 300°С (с разложением). Вычислено, %: С 49,38; Η 3,59; N 15,36; СІ 9,72; S 8,79. C15H13CIN4 O3S Найдено, %: С 49,18; Η 3.56; Ν 15,20; СІ 9,72; S 8,98. Повторяют методику примера 14 с использованием 4.1 г 1-амино-2-метилбензимидазола, 15 мл пиридина и 9,3 г 4-хлор-3-[N-Диметиламинометилиден)-сульфамоилбензоилхлорида. В результате после перекристаллизации из 96%-ного водного раствора этанола получают 10,2 г (вы ход 77,6%) 1-[4'-хлор-3'-(Nдиметиламинометилиден)-сульфамоилбензоил]-моно-2-метил-бензимидазолгидрата с т.пл. 166°С (с разложением). После перекристаллизации из аце-тонитрила температура плавления достигла 232-235°С. Вычислено, %: С 49,36; Η 4,60; N 15,99; СІ 8,10; S 7,01. C18H18CIN5 O3S Найдено, %: С 49,25; Η 4,61; Ν 15,72; СІ 8,10; S 7,10. Πример 24. Повторяют методику примера 16 с использованием в качестве исходных материалов 2,4 г 1[4'-хлор-3'- (Ν-диметиламинометилиден)-еульфамоилбензо-ил]-5-сульфамоилбензимидазол-2-тиона и 12 мл 2 н. раствора гидрата окиси натрия. В результате после тщательного кипячения в этаноле получают 1,64 г (выход 76%) 1-(4'-хлор-3'-сульфамоилбензоил)-амино-5-сульфамоилбензимидазол-2-тиона с т.пл. 326°С (с разложением). Вычислено, %: С 36,40; Η 2,62; N. 15,16; СІ 7,68; S 20,82. C11H12ClN5O5S 2 Найдено, %: С 36,31; Η 2.45; Ν 15,66; СІ 7,36; S 20,80. Получение исходных продуктов. A) 20 мл гидразингидрата добавляют в суспензию 47,33 г 4-хлор-З-нитробензол-сульфонамида в 20 мл абсолютированного этанола. Смесь кипятят с перемешиванием в течение 30 мин, а затем охлаждают. Кристаллы фильтруют с вакуумом и тщательно промывают водой. Получают 43,38 г (выход 93,4%) 2-нитро-4сульфамоилфенилгидразина с т.пл. 217-218°С(с разложением). Вычислено, %: С 31,08; Η 3,47; N24,13; S 13,81. C6H8N3O4S Найдено, %: С 31,50; Η 3,48; N 24,34; S 13,57, B) Повторяют методику В примера 1 с использованием 65,7 г нитросоединения, полученного по методике А примера 24, 700 мл диоксана, 15 г безводного карбоната натрия, растворенного в 280 мл воды, и 87,5 г 4хлор-3-(N-диметиламинометилиден)-сульфамоилбензоилхлорида, растворенного в 560 мл диоксана. После выпаривания реакционной смеси под пониженным давлением остаток тщательно смешивают с водой, твердый продукт фильтруют с вакуумом и влажный фильтровальный пирог кипятят в 600 мл метанола. После фильтрования и сушки получают 121,5 г (выход 85%) 2-нитро-4-сульфамоил-N-[4'-хлoр-3'-(Nдиметиламинометилиден)-сульфамоилбензоил]-фенилгидразина с т.пл. 248°С (с разложением). После перекристаллизации из ледяной уксусной кислоты температура плавления продукта 252°С (с разложением). Вычислено, %: С 38,06; Η 3,39; N 16,64; СІ 7,02; S 12,70. C16H17CIN6 O7S 2 Найдено, % : С 38,10; Η 3,42; Ν 16,59; СІ 7,00; S 12,68. C) Повторяют методику В примера 15 с использованием в качестве исходных материалов 5 г нитросоединения, полученного по методике В примера 24, 60 мл абсолютированного этанола, 0,5 г 10%-ного палладия на угле в качестве катализатора и 30 мл 30%-ного водного раствора гипосульфита натрия. Таким образом, получают 4,2 г (выход 88%) 2-амино~4-сульфамоил-N-[4'-хлор-3'-(N-диметиламинометилден)сульфамоилбензоил]-фенилгидразина с т.пл. 152°С (с разложением). D) Повторяют методику примера 3 с использованием в качестве исходных материалов 4,75 г фенилгидрааинового производного, полученного по методике С примера 24, 20 мл пиридина и 1,6 г этилксантаната калия. Таким образом, получают 3,2 г (выход 62%) 1-[4'-хлор-3'~(М-диметиламинометилиден)-сульфамоилбензимидазол}-2-тионa с т.пл.124°С (с разложением). Πример 25. Повторяют методику примера 3 с использованием в качестве исходных материалов 6,3 г 2амино-4-ме-тилсульфонил-N-(4'-хлор-3'-сульфамоил-бензоил)-фенилгидразина, 35 мл пиридина и 2.4 г этилксантаната калия. В результате после перекристаллизации из 50%-ного водного раствора получают 5 г (выход 73%) 1-(4'-хлор-3'-сульфамоилбензоил)-амино-5 -метилсульфонилбензимидазол-2-тиона с т.пл. 298300°Є. Вычислено, %; С 39,08; Η 2,82; N 12,16; СІ 7,69; S 20,87. C15H13CIN4 O5S 3 Найдено, %: С 38,90; Η 2,70; Ν 12,12; СІ 7,98; S 20,60. , Получение исходных продуктов. A) Повторяют методику А примера 24 с использованием 12,5 г4-метилсульфонил-2-нитрохлорбензола, 50 мл абсолютированного этанола и 5,3 мл гидразингидрата. В результате получают 11 г (вы ход 92%)4-метилсульфонил-2-нитрофенилгидразина с т.пл, 188-190°С. Вычислено, %: С 36,36; Η 3,92; N 18,17; S 13,87. C7H9N3O4S Найдено, %: С 36,23; Η 3,36; N 18,17; S 13,97. B) Повторяют методику В примера 1 с использованием в качестве исходных материалов 11 гфенилгидрэзинового производного, полученного по методике А примера 25, 120 мл диоксана 2,5 г безводного карбоната натрия, растворенного в 47 мл воды, и 12 г 4-хлор-З-сульфамоилбензоилхлорида, растворенного в 95 мл диоксана. Таким образом, после перекристаллизации из уксусной кислоты получают 19,5 г (выход 94%) 4-метилсульфонил-2'-нитро-N-(4'-хлор-3 -сульфамоилбензоил)-фенилгидразина с т.пл. 279°С (с разложением). Вычислено, %: С 35,73; Η 3,00; N 12,82; СІ 8,11; S 14,67. C13H13CIN4 O7S 2 Найдено, %: С 35,75; Η 2,90; Ν 12,49; СІ 7,91; S 14,24. C) Методику С примера 1 повторяют с использованием 14,8 г нитросоединения, полученного по методике В примера 25, 250 мл метоксиэтанола и 2 г никеля Ренея в качестве катализатора. В результате после перекристаллизации из этанола получают 14,1 г (выход 99%) 2-амино-4-метилсульфонил-N-[4*-хлор-3'сульфамоилбензоил)-фенилгидразина с т.пл. 200°С (с разложением). Вычислено, %: С 40,14; Η 3,61; N 13,38; СІ 8,46; S 15,31. C14N15CIN4 O5S 2 Найдено, %: С 40,51; Η 3,77; Ν 13,65; СІ 8,83; S 15,43. Πример 26. Методику примера 16 повторяют с использованием в качестве исходных материалов 1-[4'хлор-3'-(N-диметиламинометилиден)-сульфамоилбензоил]-амино-5-трифторметилбензимидазола и 80 мл 2 н. раствора гидрата окиси натрия. После перекристаллизации сырого продукта из смеси бензола с ацетоном в соотношении 1:1 получают 14 г (выход 77,7%) 1-{4"-хлор-3'-суль фамоилбензоил)-амино-5-трифторметилбензимидазола с т.пл.164°С. Вычислено, %: С 43,01; Η 2.41; N 13,38; S СІ 8,47. C15H10CIF 3N4O 3S Найдено, %: С 43,82; Η 2,78; N 13,56; S СІ 8,11. Получение исходных материалов, A) 64 г 2-нитро-4-трифторметилфенил-гидрэзина выдерживают при повышенной температуре в 200 мл 85%-ной муравьиной кислоты на водяной бане в течение 90 мин. После охлаждения желтый раствор выливают в 250 мл воды. Выпавшие в осадок кристаллы отфильтровывают с вакуумом, промывают водой и высушивают при 80°С. В результате получают 70 г (выход 98%) 2-нитро-4-трифторметил-N-формилфенилгидразина с т.пл. 152-153°С. Вычислено, %: С 38,56; Η 2,43; N 16,86. C8H6F3N3O 3 Найдено, %: С 38,38; Η 2,48; N 16,98. B) 6 г 10%-ного палладия на угле в качестве катализатора добавляют в раствор 65,45 г нитросоединения, полученного по методике А примера 26, в 780 мл абсолютированного этанола, а затем смесь подвергают гидрогенизации при комнатной температуре до прекращения процесса поглощения водорода. После отфильтровывания катализатора фильтрат выпаривают. Получают 55,8 г 2-амино-4-трифторметил-1Н1формилфенилгидразина с т.пл. 121-122°С. Вычислено. %: С 43,84; Η 3,68; П 19,18. C8H6F3N3O Найдено. %: С 43,25; Η 3.94; N 19,19. C) После кипячения 44 г фенилгидразинового производного, полученного по методике В примера 26, в 200 мл 85%-ной муравьиной кислоты в течение 5 ч полученный красный раствор выпаривают под пониженным давлением. После растирания остатка в 200 мл воды кристаллический осадок отфильтровывают с вакуумом, промывают водой и высушивают при 80°С. В результате после перекристаллизации на смеси ацетона с водой в соотношении 1:2 получают 40,8 г (вы ход 88,7%) 1-формиламино-5трифторметилбензимидазолэ с т,пл. 209-210°С. Вычислено, %: С 47ν17; Η 2.64; N 18,34. C9H6F3N3O Найдено, %: С 47,69; Η 2,59; N 18,51. D) После кипячения 15,11 г бензимида-золового производного, полученного по методике С примера 26, в 68 мл 2 н. соляной кислоты в течение 5 ч полученному раствору придают щелочную реакцию добавлением 2 н. раствора гидрата окиси натрия. Кристаллический осадок отфильтровывают с вакуумом, промывают водой и высушивают при 80°Сс получением 11,7 г (выход 88%) 1-ами-но-5-трифторметилбензимидазола с т.пл. 140142°С. Вычислено, %: С 47,76; Η 3,00; N 20,89. С9Н6F3N3O 3 Найдено, % : С 47,82; Η 2,94; N 20,64. Ε) Повторяют методику примера 14 с использованием в качестве исходных материалов 8,69 г бензимидазолового производного, полученного по примеру 26, 10 мл пиридина и 13,35 г 4-хлор-3-(Nдиметилами-нометилиден)-сульфамоилбензоилхлорида. Таким образом, после перекристаллизации из метанола получают 20,27 г (выход 100%) 1- [4'-хлор-3'-(1-диметиламинометилиден)-сульфамоилбензоил]амино-5-трифтормети-ленбензимидазола с т.пл. 266-270°С. Вычислено, %: С 45,62; Η 3.19; N 14,78: S 6,77. C18H15CIF 3N5O 3 Найдено, %: С 45,70; Η 3.94; N 14,35; S 6,98. Пример 27. Повторяют методику примера 16 с использованием в качестве исходных материалов 7,4 г 1[4'-хлор-3'-(N-диметиламинометилиден)-сульфамоил6ензоил]-амино-2-метил-5-трифторметилбензим-идазола и 20 мл 2 н. раствора гидрата окиси натрия. В результате после перекристаллизации из смеси бензола с ацетоном в соотношении 1:1 получают 5,3 г (вы ход 80,7%) 1-(4'-хлор-3'-сульфамоилбензоил)-амино-2-метил5-трифторм*етилбензимидазола с т.пл. 193-195°С. Вычислено, %: С 44,40; Η 2,80; N 12.95; СІ 8,19. C10H12CIF 3N4O 3 Найдено, %: С 44,92; Η 2,64; N 13,13; СІ 8,36. Получение исходных продуктов. А) После кипячения 23,3 г 2-амино-4-трифторметил-Ы-ацетилфенилгидразина в 120 мл уксусной кислоты и 20 мл уксусного ангидрида в течение 6 ч полученный оранжево-красный раствор выпаривают под пониженным давлением и остаток растирают в воде. Выделившиеся кристаллы отфильтровывают с вакуумом, промывают водой и высушивают при 80°С. В результате после перекристаллизации из ацетона получают 23,2 г (выход 90%) 1-ацетиламино-2-метил-5-трифторметилбензимидазола с т.пл.214-216°С. Вычислено, %: С 51,36; Η 3,92; N 16,34. C11H10F 3N3O Найдено, %: С 51,43; Η 3,98; N 16,38. B) После кипячения 71,14 г бензимидазолового производного, полученного по методике А примера 27, в 300 мл 2 н. соляной кислоты в течение 5 ч желтый горячий раствор осветляют активированным углем и фильтруют. Фильтрат нейтрализуют до величины рН 6 добавлением 10 н. раствора гидрата окиси натрия. Снежно-белый кристаллический осадок фильтруют с вакуумом, тщательно промывают водой и высушивают при 80°С. В результате получают 53,2 г (выход 89,5%) 1-амино-2-метил-5-трифторме-тилбензимидазола с т.пл. 190-192°С, Вычислено, %: С 50,23; Η 3,75; N 19,23. C9H8F3N3 Найдено, %: С 50,35; Η 3,97; N 19,63. C) Повторяют методику примера 14 с использованием в качестве исходных материалов 18,02 г бензимидазолового производного, полученного по методике В примера 27, 25 мл пиридина и 25,9 г 4-хлор-3(N-диметиламинометилиден)-сульфамо-илбензоилхлорида. В результате получают 34,4 г (выход 84%) 1-[4'хлор-3'-(N-диметиламинометилиден)-сульфамоилбензоил)-амино-2-метил-5-трифторметилбензимидазола с т.пл. 300°С. Пример 28. Повторяют методику примера 16 с использованием в качестве исходных материалов 11,33 г 1-[4'-хлор-3'-(N-диметиламинометилиден)-сульфамоилбензоил]-амино-5-трифторметилбензимид-азол-2тиона и 50 мл 2 н, раствора гидрата окиси натрия. Таким образом, после перекристаллизации из 50%-ного водного раствора этанола получают 7,92 г (выход 77,7%) 1-(4'-хлор-3'-сульфамоилбензоил)-амино-5трифторметилбензимидазол- 2-тиона с т.пл. 282-283°С (с разложением). Вычислено, %: С 39,96; Η 2,24; N 12,43; СІ 7,86. C15H10F 3CIN4O 3S2 Найдено, %: С 39,09; Η 2,12; N 12,20; СІ 7,11. Получение исходных продуктов. А) Методику примера 14 повторяют с использованием в качестве исходных материалов 8,84 г 2-нитро-4трифторметилфе-нилгидразина, 50 мл пиридина и 12,36 г 4-хлор-3-(N-диметиламинометилиден)сульфамоилбензоилхлорида. В результате после перекристаллизации из уксусной кислоты получают 17 г (выход 86%) 2-нитро-4-триф-торметил-N-хлор-3'-N-диметиламинометилидиен)-сульфамоилбензоил]-фенилгидразина с т.пл. 261~262°С {с разложением). Вычислено, %: С 41,34; Η 3,06; N 14,19. С17Н10СlF3NО 3S Найдено, %; С41.23; Η 3,36; N 14,09. В) Повторяют методику В примера 2 с использованием в качестве исходных материалов 17 г нитросоединения, полученного по методике А примера 28, 1,5 г 10%-ного палладия на угле β качестве катализатора, 100 мл 96%-ного этанола и 60 мл 30%-ного водного раствора гипофосфита натрия. Таким образом, после перекристаллизации из 96%-ного этанола получают 11,45 г (выход 72%) 2*-амино-4трифторметил-N-[4'-хлор-3'-(N-Диметиламинометилиден)-сульфомоилбензоил]-фенилгидразина с т.пл. 199200°С (с разложением). Вычислено, %: С 44,01; Η 3,69, N 15,10; СІ 7,64. C17H17CIF 3N5O 3S Найдено, %: С 43,98; Η 3,62; N 14,98; СІ 7,27, С) Повторяют методику примера 3 с использрванием в качестве исходных материалов 10,4 г фениЛгидразинового производного, полученного в соответствии с методикой В примера 28,45 мл пиридина и 3,6 г этилксантата калия. Таким образом, получают 11,33 г(выход 100%) 1-(4'-хлор-3'-(Nдиметиламинометалиден)-сульфамоилбензоил-амино-5-трифторметилбензимидозол-2-тмона, Этот продукт используют без дополнительной очистки. Пример 29. Повторяют методику примера 14 с использованием в качестве исходных материалов 5,55 г Nамино-2-фенил-5-трифторметилбензимидазола, 15 мл пиридина и 6,2 г 4-хлор-3-(Ν-диметиламинометилиден)-сульфамоилбензоилхлорида. В результате получают 9,7 г 1-[4'-хлор-N-{Nдиметиламинометилиден}-судьфамоилбензоил]-амино-2-фенил-5-трифторметилбензи-мидазола, который далее гидролизуют 50 мл 2 н. раствора гидрата окиси натрия аналогично примеру 16. Таким образом, после перекристаллизации из бутанола получают 7 г (вы ход 98%) Ц4'- хлор-3'*еульфамоил-бензшл^амино-Я-фенилб-трифторметилбен-зимидазола с т.пл. 282-284°С (с разложением). Полученное соединение содержит 1 молекулу бутанола. Вычислено, %: С 52,76; Η 4,25; N 9,84. C21H14CIF 3N4O 3S -O4H9OH Найдено, %: С 52,35; Η 4,37; Ν 9,66. Получение исходных продуктов. A) Повторяют методику примера 14 с использованием в качестве исходных материалов 66,5 г 2-амино-4трифторметил-N-ацетилфенилгидразина, 70 мл пиридина и 32,9 мл хлористого бензоила. В результате после перекристаллизации из 96%-ного этанола получают 90 г (выход 93,6%) 2-бензо-иламино-4-трифторметил-Nзцетил фенил гидразина с т.пл. 212-214°С. Вычислено, %; С 55,97; Η 4,18; N 12,46. C16H14N3N3 O2 Найдено, %: С 57,15: Η 4,08; N 12,48. B) После кипячения 52,2 г фенилгидразинового производного, полученного по методике А примера 29, в 270 мл ледяной уксусной кислоты в течение 6 ч полученный раствор выпаривают под пониженным давлением и остаток растирают в воде. Кристаллы отфильтровывают с вакуумом, промывают водой и высушивают при 80°С. В результате после перекристаллизации из 50%-ного водного раствора этанола получают 46,3 г (выход 88,5%) 1-ацетиламино-2-фенил-5-трифторметилбензимидазола с т.пл. 150-154°С. Вычислено. %: С 60,19; Η 3.79; N 13,16. C16H12F 3N3O Найдено, %: С 59,98; Η 3,74; N 13,04. C) Поело кипячения 45 г бензимидазолового производного, полученного по методике В примера 29, в смеси 100 мл 96%-ного этанола с 300 мл 2 н, соляной кислоты в течение 8 ч горячий раствор осветляют активированным углем ϋ фильтруют. После подщелачивания фильтрата до величины рН 10 добавлением раствора гидрата окиси натрия осадок отфильтровывают с вакуумом, промывают водой и высушивают при 80°С. В результате после перекристаллизации из 96%-ного этанола получают 34,1 г (вы ход 87%) 1-амино-2фения-5- трифторметилбензимидазола с т.пл.200-203°С. Вычислено, %: С 60,65; Η 3,64; N 15,18. C14H10F 3N3 Найдено, %: С 60,25; Η 3,24; N 15,58. Пример 30. Повторяют методику примера 14 с использованием в качестве исходных материалов 9,88 г 1амино-2-ме-тилтио-5-трифторметилбензимидазола, 20 мл пиридина и 12,2 г 4-хлор-3-(Nдиметиламинометилиден)-сульфамоилбензоилхло-рида- Таким образом, получают 19,4 г (вы ход 98%)-1-{4'хлор-3'-(N-диметиламинометилидем)-сульфамоилбензоил}-амино-2~метил-тмобензимидазола, который гидролизуют с использованием 100 мл 2 н. раствора гидрата окиси натрия аналогично примеру 16. После перекристаллизации из этилацетата получают 15,45 г (выход 83%) 1-(4'-хлор-3'-сульфамоилбенаоил)-амичо2-метилтио-5-трифторметилбензимидазола с т„пл. 126-128 С (с разложением). Вычислено, %: С 41,34; Η 2,73; N 10,34. C16H12CIF 3N4O 3S2 Найдено, %: С 41,3В; Η 2,78; N 10,61. , Получение исходных продуктов. A) После добавления 69,96 г 2-амино-4-трифторметил-N-ацетилфенилгидразина в раствор 19,07 г гидрата окиси калия в 300 мл абсолютированного этанола в смесь при ее перемешивании по каплям добавляют 20,5 мл сероуглерода. Красный раствор, который образовался, кипятят с обратным холодильником а течение 5 ч. Горячий раствор осветляют активированным углем и фильтруют. После добавления 370 мл воды, а затем 70 мл смеси уксусной кислоты с водой в соотношении 1:2 в фильтрат кристаллический осадок отфильтровывают с вакуумом, промывают водой и высушивают при 80°С. После перекристаллизации из 50%-ного водного раствора этанола получают 55,5 г (выход 67%) 1-ацетиламино-5трифторме-тилбензимидазол-2-тиона с т.пл.294-295°С. Вычислено, %: С 43,63; Η 2,93: N 15,27. C10H8F3N 3OS Найдено, %: С 43,52; Η 2,95; N 15,40. B) 10 мл диметилсульфата добавляют в суспензию, содержащую 27,5 г бензимидазолового производного, полученного по методике А примера 30, в 200 мл нормального раствора гидрата окиси натрия. Вначале суспензию трудно перемешивать, однако это явление продолжается в течение всего нескольких минут. Смесь перемешивают на горячей водяной бане в течение 30 мин, затем ее охлаждают. Осадок фильтруют с вакуумом, промывают водой и высушивают при 80°С. В результате после перекристаллизации из бензола получают 27,2 г (выход 94%) 1-ацетиламино-2-метилтио-5-трифтор-метилбензимидазола с т.пл.175-178°С. Вычислено, %: С 45,67; Η 3,48; N 14,52. C11H10F 3N3OS Найдено, %: С 45,36; Η 3,76; N 14,27. C) 22,2 г бензимидазолового производного, полученного по методике В примера 30, кипятят в 80 мл 2 н. соляной кислоты в течение 6,5 ч, а затем выпаривают досуха под пониженным давлением. Твердый остаток диспергируют в 80 мл нормального раствора карбоната натрия и выдерживают при повышенной температура до прекращения выделения пузырьков. После охлаждения кристаллический осадок отфильтровывают с вакуумом, промывают водой и высушивают при 80°С. Таким образом,· после перекристаллизации из 50%ного водного раствора этанола получают 16,88 г(88,5%) 1-амино-2-метил-5-трифторметилбензимидазола с т.пл. 170-173°С. Вычислено. %: С 43,72; Η 3,26; N 16.99. C9H8F3N3S Найдено, %: С 43,65; Η 3,17; N 16,64. Πример 31. Повторяют методику примера 8 с использованием в качестве исходного материала 11,25 г Н4'-хлор-3'-суль-фамоилбензоил)-амино-5-трифторметилбензи-мидазол-2-тиона. В результате получают 10,8 г (вы ход 93%) 1-(4'-хлор-3'-сульфамоил-бензоил)-амин-2-етилтио-5-трифтор-метилбензимидазола, который во всех аспектах идентичный продукту, полученному в примере 29. Πример 32. После прикапывания 1,46 мл хлористого тионила в раствор, содержащий 8,2 г 1-(4'-хлор-3'сульфамоилбензоил)-амино-2-метил-5-карбоксибензимидазола в 50 мл метанола, с одновременным перемешиванием реакционную смесь кипятят с обратным холодильником в течение 5 ч. Полученный прозрачный раствор выпаривают досуха под пониженным давлением и твердый остаток растирают в нормальном растворе бикарбоната натрия. После декантации раствора над твердым продуктом остаток перекристаллизовывают из смеси диоксана с водой в соотношении 1:1. Таким образом, получают 6,35 г (выход 75%) 1-(4'-хлор-3'-сульфамоилбензоил}-амино-5-меток-сикарбонил-2-метилбензимидазола с т.пл. 251252°С (с разложением). Вычислено, %: С 48,28; Η 3,58; N 13,25; СІ 8,39; S 7,58. C17H15CIN4 O5S Найдено, %: С 47,96: Η 3,38; Ν 12,95; СІ 8,12; S 7,52. Предлагаемым способом получают следующие соединения, 1) 1-(4'-Хлор-3'-сульфамоилбензоил) амино-6-метоксикарбонилбензимидазолтион, т.пл. 252-261 °С (с разложением). Вычислено, %: С 43,59; Η 2,97; N 12,71; СІ 8,04; S 14,55. C16H13CIN2 O5S 2 Найдено, %: С 43,80; Η 2,78; Ν 12.57; СІ 8,62; S 14,60. 2) 1-(4'-Хлор-3'-сульфамоилбензоил)-амино-5-карбоксибензимидазол-2-тион, т.пл. 290-295°С (с разложением). 3) 1-(4'-Хлор-3'-сульфамоилбензоил)-амино-5-Карбоксибензимидазолон, т.пл. 339°С Вычислено, %: С 43,85; Η 2,70; Ν 13,64; S 7,80. C15H11CIN4 O6S Найдено, %: С 43,57; Η 2.86: Ν 13,58; S 7,42. 4) 1-(4'-Хлор-3'-сульфамоилбензоил)-амино-5-метоксикарбонил-2-метилтиобензимидазол, т.пл. 186188°С. Вычислено.%; С 44.S8; Η 3,32; Ν 12,32; СІ 7,79; S 14.10. C17H15CIN4 O5S 2 Найдено, %: С 44,75; Η 3,68; Ν 12,50; СІ 7,60; S 13,91. 5) 1-(4'-Хлор-3'-сульфамоилбензоил)-амино-5-карбокси-2-метилтиобензимидазол, т.пл. 214-222°С (g разложением). Вычислено, %: С 41.06; Η 3,44; Ν 11,97; СІ 7.57,-S 13,07. C16H13CIN4 O5S 2*1,5H2O Найдено, %: С 41,0; Η 3,35; Ν 11,71; СІ 7,11; S 13,15. 6) 2-Бензилтио-1-(4'-хлор-3'-сульфамоилбензоил)-амино-5-метоксикарбонилбензимидазол, т.пл. 111118°С (с разложением). Вычислено, %: С 52,02; Η 3,61; Ν 10,55; СІ 6,68; S 12,08. C23Hl9CIN4O5S 2 Найдено, %: С 52,32; Η 4,00; Ν 9,90; СІ 6,00; S 12,00, 7) 2-Бензйлтио-1-(4'-хлор-3'-сульфамоил)-амино-5-карбокси6ензимидазол. т.пл. 190-196°С (с разложением). Вычислено, %: С 51,10; Η 3,31; Ν 10,84; CI6.86.S 12,40. C23H19CIN4 O5S 2 Найдено, %: С 49,23; Η 3,77; Ν 11,00; СІ 6.84; S 11.40. 8) 1-(4-хлор-3-сульфамоил)-амино-5-метоксикарбонил-2-метилсульфонилбензими-дазол, т.пл. 254-255°С (с разложением). Вычислено, %: С 41,93; Η 3,10; Ν 11,50; СІ 7,28: S 13,17. C17H15CIN4 О4S Найдено, %: С 42,01; Η 3.15; Ν 11.34; СІ 7,35; S 13,01. 9)5-Карбокси-1-(4'-хлор-3'-сульфамоил)-амино-2-метилсульфонилбензимидазол, т.пл. 222-225°С (с разложением). Вычислено, %: С 40,64; Η 2,77; Ν 11,85; СІ 7,50; S 13,56. C16H23CIN4 O7S Найдено,%: С 40,07; Η 3,01; Ν 12,02; СІ 7,65; S 13,29. 10) 1-[4'-хлор-3'-(N-диметиламинометилиден)-сульфамоилбензоил]-амино-5-мето-ксикарбонил-2бензимидазол, т.пл. 260-263°С (с разложением). 11) 1-4'-Хлор-3'-сульфамоилбензоил)-амино-5-цианобензимидазол- 2-тион, т.пл. 315°С. Вычислено, %: С 44,16; Η 2,47; Ν 17,17; СІ 8,69; S 15,72. C15H10CIN5 O3 Найдено, %: С 44,40; Η 2,67; Ν 16.94; СІ 8,96; S 15,33. 12) 5-Бензоил-1-(4'-хлор-3'-сульфамоил-бензоил)-амино-6ензимидазол2-тион, т.пл. 233°С (с разложением). Вычислено, %: С51,79; Η 3,11; Ν 11,51; СІ 7,28; S 13,17. C21H15CIN4 O4S 2 Найдено, %: С 51,30; Η 3,74; Ν 11,39; СІ 7,40; S 13,50. 13) 1-{4'-Хлор-3'сульфамоилбензоил)-амино-5-сульфамоилбензимидазол-2-тион, т.пл. 326°С (с разложением). Вычислено, %: С 36,40: Η 2,62; Ν 15,16; СІ 7,68; S 20.82. C14H12ClN5O5S 2 Найдено, %: С 36,31; Η 2,45; Ν 15,66; СІ 7.36; S 20,80. 14) 1-(4'-хлор-3'-сульфамоилбензоил)-амино-5-метилсульфонилбензимидазол-2-тион, т.пл. 298-300°С. Вычислено,%: С 39.08; Η 2,82: Ν 12,16; СІ 7,69; S 20,87. C15H13CIN4 О5S 3 Найдено, %: С 38,90; Η 2,70; Ν 12,12; СІ 7,98; S 20,60. 15) 1-{4'-Хлор-3-сульфамоилбензоил)-амино-5-трифторметилбензимидазол-2-тион, т.пл. 282-283°С (с разложением). Вычислено, %: С 39,96; Η 2,24; N 12,43; СІ 7,86. C15H10F 3CIN4O 3S2 Найдено, %: С 39,09; Η 2.12; N 12,20; Сі 7,11. 16) 1-(4'-Хлор-3'-сульфамоилбензоил)-амино-2-метилтио-5-трифторметилбензими-дазол. 17) 1-(4'-Хлор-3'-сульфамоилбензоил)-амино-5-метоксикарбонил^-метилбензими-дазола с т.пл. 251252°С (с разложением). Вычислено, %; С 48,28; Η 3,58; N 13,25; СІ 8,39; S 7,58. C17H15CIN4 O5S Найдено, %: С 47.98; Η 3,38; Ν 12.95; СІ 8,12; 5 7,52. Πример 33. А) 44,5 ґ моногидрата 1-(4'-хлор-3'-сульфамоилбензоил)-амино-5-кар-боксибензимидазол-2тиона при перемешивании небольшими порциями добавляют в 200 мл 1 н. раствора гидроокиси натрия. После того, как энергичное вспенивание уменьшилось, смесь нагревают на водяной бане до тех пор, пока не получится прозрачный раствор. Раствор упаривают на водяной бане при пониженном давлении досуха. Получают 44,4 г белоснежной натриевой соли 1-(4'-хлор-3'-сульфамоилбензоил)-амино-5карбоксибензимидазол-2-тиона. Вычислено, %: №5,12. C15H10CIN4 О5SNa Найдено, %: Na5,15. Полученная таким образом натриевая соль растворяется в воде, образуя прозрачный раствор с рН - 7. В) 44,5 г моногидрата' 1-(4'-хлоро-3'-сульфамоилбензоил}-амино-5-карбоксибензи-мидазол-2-тиона при перемешивании небольшими порциями добавляют к 200 мл раствора 6,9 г карбоната калия в дистиллированной воде. После того, как энергичное вспенивание уменьшилось, смесь нагревают на водяной бане до тех пор, пока не получится прозрачный раствор. Раствор упаривают на водяной бане при пониженном давлении досуха. Получают 46,3 г (99,5%) калиевой соли 1-{4'-хлоро-3'-сульфамоилбензоил}амино-5-кар6оксибензимидазол-2-тиона в виде белоснежного порошка. Вычислено, %: К 8,41. C15H10CIN4 O5S 2K Найдено, %: К 8,25. Полученная таким образом калиевая соль растворяется в воде, образуя прозрачный раствор с рН = 7. Следуя примеру А и исходя из подходящего производного карбоновой кислоты, получают следующие натриевые соли. 1~(4'-Хлоро-3'-сульфамоилбензоил)-ами-но-5-метилтиобензимидазола натриевая соль. Вычислено, %: Na 4,97. C16H12CIN4 O5S 2Na Найдено, %:№4,85. 1-(4'-Хлоро-3'-сульфамоилбензоил)-амино-5-карбокси-2-бензилтиобензимидазола натриевая соль. Вычислено, %: Na 4,27. C22H16CIN4 O5S 2 Найдено, %: Na 4,40. 1-(4'-Хлоро-3'-сульфамоилбензоил)-ами-но-5-карбокси-2-метилбензимидазола натриевая соль. Вычислено, %: Na 5,34, C16H12CIN4 O5Na Найдено, %: Na 5,30. 1-(4'-Хлоро-3'-сульфамоилбензоил)-ами-но-5-карбоксибензимидазола натриевая соль. Вычислено, % Na 5,39. C15H10ClN4O5SNa Найдено, %: Na 5,45. Следуя примеру В и исходя из подходящего производного карбоновой кислоты, получают следующие калиевые соли. 1-(4'-Хлоро-3'-сульфамоилбензоил)-ами-но-5-карб0кси-2-метилтиобензимидазола калиевая соль. Вычислено, %: К 8,16. C16H12CIN4 O5S 2K Найдено, %:К8.01. 1-{4''-Хлоро-3'-сульфамоилбензоил)-ами-но~5~карбокси-2-бензилтиобензимидазола калиевая соль. Вычислено, %: К 7,04. C22H16CIN4 O5S 2K Найдено, %: К 7,11. 1-{4'-Хлоро-3'-сульфамоилбензоил)-ами-но-5-карбокси-2-метилбензимидазола калиевая соль. Вычислено, %: К 8,75. C16H12CIN4 O5SK Найдено, %: К 8,60. 1-{4'-Хлоро-3'-сульфамоилбензоил)-ами-но-5-карбоксибензимидазола калиевая соль. Вычислено, %: К 9,03. C15H10CIN4 O5SK Найдено, %: К 8,95. Биологическое действие солей соответствует действию адекватных кислот. Исследование салидиуретического действия на крысах. Классификационные испытания проводят на самках крыс LATI CFY среднего живого веса 240 г. Животных содержат на стандартном корме для крыс и перед началом эксперимента им не дают есть в течение 16 ч, однако их не ограничивают в воде. Для оценки диуретического действия используют метод Липшица, модифицированный Кагавой и Каком. Действие одинарной пероральной дозы предлагаемых соединений на диурез воды, натрия и калия в течение 24 ч в процентах от результатов одновременных измерений у контрольных животных, а также действие на соотношение между натрием и калием в выделяемой моче показано в табл.1. Исследование салидиуретического действия на собаках. Соединение, описанное в примере 1, исследуют на перинеотомизированных самках собак. Предварительно собак наблюдают в течение 2 недель без какого-либо их лечения, а затем их подвергают хирургической обработке. Для адаптации, начиная с четвертой недели после операции, мочевой пузырь животных освобождают с помощью катетера или обрабатывают физиологическим раствором с помощью желудочного зонда. В ходе эксперимента собак держат на стандартной диете, давая им неограниченное количество воды. В экспериментальные дни собакам пищи не дают, они получают только по 20 мл/кг воды. С пищей вводят 7,7 ммоль/кг натрия и 6,02 ммоль/кг калия. В день эксперимента освобождают мочевые пузыри животных и из вены ноги отбирают пробы крови, после чего с помощью желудочного зонда в дозировке 10 мл/кг животным вводят соответственно раствор диуретика или растворителе (контрольная группа). Животных размещают индивидуально по клеткам для исследования метаболизма. Пи истечении соответственно 7 и 24 ч в мочевые пузыри животных вводят катетеры и промыванием клеток для исследования метаболизма собирают мочу, Через 24 ч после введения катетера вновь берут пробы крови. Помимо выделенного объема определяют содержание в моче ионов натрия и калия, а также содержание глюкозы и холестерина в сыворотке. Излучение антигипертонического действия на крысах. Эти исследования проводят на самках крыс Окамотр {SH) С самопроизвольно развившейся гипертонией. По меньшей мере за одну неделю до начала эксперимента животных индивидуально рассаживают по клеткам и cодержат на воде и полусинтетическом корме для крыс, которые им дают без ограничений. Одновременно с этим ежедневно у каждого животного измеряют кровяное давление и обездвиженным животным вводят желудочные зонды. Из эксперимента исключают животных, кровяное давление у которых составляет менее 170 мм рт.ст. Основываясь на результатах ежедневно измеряемого кровяного давления, животных разделяют на экспериментальные группы, у всех особей которых среднее кровяное давление и отклонения приблизительно равны. В начале эксперимента животным дают соответственно по 0,2 мл/100 г раствора, содержащего испытываемое соединение, и по 1 мл/100 г раствора фуросемида. В ходе каждого эксперимента исследуют также животных групп, которым дают соответственно физиологический раствор и растворитель. Перед измерением кровяного давления животных помещают в свето- и звуконепроницаемую камеру, а затем обездвиживают, У корня хвоста закрепляют надуваемую резиновую манжету(в каждом случае на одном и том же месте), которая соединена с манометром. Материал и диаметр манжеты для хвоста стандартизированы Измерение проводят в соответствии с принципом Рива-Роччи. Для измерения систолического кровяного давления используют метод пульсаций. Частоту сердцебиения измеряют с помощью пьезоэлектрического кристалла, помещенного в резиновое кольцо, Измерения кровяного давления у каждого животного начинают через 2 мин после обездвиживания, повторяют по истечении каждых 30 с и обычно за результаты принимают те значения, которые получают повторно по несколько раз. Действие одинарной пероральной дозы соответственно соединения примера 1 или фуросемида на систолическое кровяное давление у крыс SH показано в табл.2.
ДивитисяДодаткова інформація
Назва патенту англійськоюA process for preparation of 4-chloro-3-sulfamoyl-benzoic acid
Автори англійськоюPalosi Endre, Karbonitsh Dezhe, Molnar Erzsebet, Szvoboda Ida, Kharshing Laslo, Shimon Derd, Shandor Virah, GERGELI VERA, Katalin Marmarosi
Назва патенту російськоюСпособ получения 4-хлор-3-сульфамоилбензойной кислоты
Автори російськоюЭндре Палоши, Дежё Карбонитш, Эржебет Молнар, Ида Свобода, Ласло Харшинг, Дьордь Шимон, Шандор Вераг, Вера Гергели, Каталин Мармароши
МПК / Мітки
МПК: C07D 235/22, C07D 235/18
Мітки: кислоти, одержання, 4-хлор-3-сульфамоілбензойної, спосіб
Код посилання
<a href="https://ua.patents.su/16-19123-sposib-oderzhannya-4-khlor-3-sulfamoilbenzojjno-kisloti.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 4-хлор-3-сульфамоілбензойної кислоти</a>
Попередній патент: Спосіб визначення еквівалентної шумової температури входу підсилювача
Наступний патент: Жолоб для випуску чавуну
Випадковий патент: Препарувальний столик для фіксації лабораторних тварин