Поліпептид, спосіб діагностики інсулінозалежного цукрового діабету (iddm), що розвинувся або що розвивається (варіанти), набір для діагностики iddm (варіанти), препарат для запобігання або лікування iddm, фарма
Формула / Реферат
1. Полипептид последовательности
Val-Leu-Gly-Gly-Gly-X1-Ala-Leu-Leu-Arg-X2-Ile-Pro-Ala-Leu-Asp-Ser-Leu-Х3-Pro-Ala-Asn-Glu-Asp,
где
X1 и Х2, каждый, представляют собой остатки Cys или Val, Х3 является остатком Thr или Lys, но Х1 и Х2 оба не могут быть остатками Cys, когда Х3 представляет собой Thr, а также его соли и функциональные производные.
2. Полипептид по п.1, отличающийся тем, что выбран из пептидов, обозначенных как р277 (Val11), где Х1 представляет собой Cys, X2 представляет собой Val, и Х3 представляет собой Thr; р277 (Val6-Val11), где как X1, так и Х2 являются Val, а Х3 представляет собой Thr; р277 (Val11-Lys19), где X1 представляет собой Cys, Х2 представляют собой Val, и Х3 представляет собой Lys; р277 (Val6,11-Lys19), где как Х1, так и X2 представляют собой Val и Х3 представляет собой Lys.
3. Полипептид по любому из пп.1, 2, отличающийся тем, что предназначен для получения композиции для диагностики инсулинзависимого сахарного диабета (IDDM).
4. Способ диагностики развившегося или развивающегося инсулинзависимого сахарного диабета (IDDM) у пациента, включающий исследование крови или мочи указанного пациента на присутствие антител, которые иммунологически реактивны с человеческим hsp60, присутствие которого указывает на высокую вероятность наличия или начальную стадию IDDM, отличающийся тем, что в качестве антигена используют полипептид по любому из пп.1 или 2.
5. Способ по п.4, отличающийся тем, что присутствие антител против hsp60 обнаруживают с помощью радиоиммуноанализа или по методу ELISA (твердофазный иммуноферментный анализ).
6. Набор для диагностики IDDM путем исследования на присутствие антител против hsp60 по любому из способов по пп.4, 5, содержащий: антиген, являющийся пептидом по п.1, и меченое антитело, способное распознавать невариабельную область указанных антител против hsp60, которые определяют.
7. Способ диагностики развившегося или развивающегося IDDM у пациента, включающий исследование крови или мочи указанного пациента на присутствие Т-клеток, которые иммунологически реактивны с человеческим hsр60, присутствие которых указывает на высокую вероятность наличия или начальную стадию IDDM, отличающийся тем, что в качестве антигена используют пептид по любому из пп. 1, 2.
8. Способ по п.7, отличающийся тем, что присутствие Т-клеток, которые иммунореактивны с hsp60, определяют с помощью испытания на Т – клеточную пролиферацию, включающего следующие стадии: получение мононуклеарной клеточной фракции, содержащей Т-клетки из образца крови, взятого у указанного пациента, добавление к указанной мононуклеарной клеточной фракции антигена, выбранного из числа пептидов по п.1, инкубирование указанной клеточной фракции в присутствии указанного антигена в течение подходящего периода времени и при подходящих для культивирования условиях, добавление меченого нуклеотида к инкубированной клеточной культуре в подходящий момент времени перед окончанием указанного периода инкубации для обеспечения включения указанного меченного нуклеотида в ДНК пролиферирующих Т-клеток, и определение количества пролиферирующих Т-клеток с помощью анализа количества меченого нуклеотида, включенного в указанные Т-клетки.
9. Способ по п. 7, отличающийся тем, что присутствие Т-клеток, которые иммунореактивны с hsp60, определяют с помощью испытания на Т – клеточную цитокинную реакцию, включающего следующие стадии: получение мононуклеарной клеточной фракции, содержащей Т-клетки из образца крови, взятого у указанного пациента, добавление к указанной мононуклеарной клеточной фракции антигена, выбранного из числа пептидов по п.1, инкубирование указанной клеточной фракции в присутствии указанного антигена в течение подходящего периода времени и при подходящих для культивирования условиях, и определение наличия цитокина, секретированного отвечающими лимфоцитами в среду, при этом цитокин представляет собой ![]() -интерферон, ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-10,
-интерферон, ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-10, ![]() -ФНО или TGF
-ФНО или TGF![]() .
.
10. Набор для диагностики IDDM путем испытания на присутствие Т-клеток, которые иммунореактивны с hsp60, no способу по п.8, содержащий: антиген, являющийся пептидом по п.1, меченый нуклеотид и подходящую среду для культивирования лимфоцитов.
11. Набор для диагностики IDDM путем испытания на присутствие Т-клеток, которые иммунореактивны с hsp60, по способу по п.9, содержащий; антиген, являющийся пептидом по п.1, подходящую среду для культивирования лимфоцитов и аналитический набор для определения присутствия цитокина, секретированного отвечающими лимфоцитами в среду.
12. Препарат для предупреждения или лечения IDDM содержащий Т – клеточный продукт, выбранный из группы, состоящей из: человеческих Т-клеток, которые проявляют специфичность к последовательности р277 человеческого hsp60, где указанные клетки активированы путем инкубации в присутствии пептида по п.1, указанных человеческих Т-клеток, которые облучены или аттенуированы другим способом, указанных человеческих Т-клеток, которые подвергнуты обработке давлением посредством гидростатического давления, обработке химическим перекрестно – сшивающим агентом и/или обработке цитоскелетным перекрестно – сшивающим агентом, фрагментов или поверхностных белков, образованных из указанных Т-клеток, или пептида, состоящий, по существу, из вариабельной области рецептора человеческих Т-клеток, которые проявляют специфичность к последовательности р277 человеческого hsp60, где указанные клетки активированы путем инкубации в присутствии пептида по п.1, специфического для указанного белка, или его соль, функциональное производное, предшественник или его активную фракцию.
13. Препарат по п.12, отличающийся тем, что указанные человеческие Т-клетки, которые проявляют специфичность к последовательности р277 человеческого hsp60, и которые активированы путем инкубации в присутствии пептида по п.1, являются аутологичными Т-клетками, полученными от больного IDDM, подвергаемого лечению, и указанная специфичность указанных Т-клеток создана путем контакта in vitro с указанным пептидом по п.1.
14. Препарат по любому из пп.12 или 13, отличающийся тем, что указанные Т-клетки обладают созданной in vitro специфичностью к пептиду по п.1.
15. Фармацевтическая композиция для профилактики или лечения IDDM, содержащая пептид по п.1 и фармацевтически приемлемый носитель.
16. Фармацевтическая композиция по п. 15, отличающаяся тем, что указанный пептид является пептидом по п. 2.
17. Пептид по любому из пп.1 или 2, предназначен для использования в качестве активного ингредиента фармацевтической композиции для предупреждения или лечения IDDM.
Текст
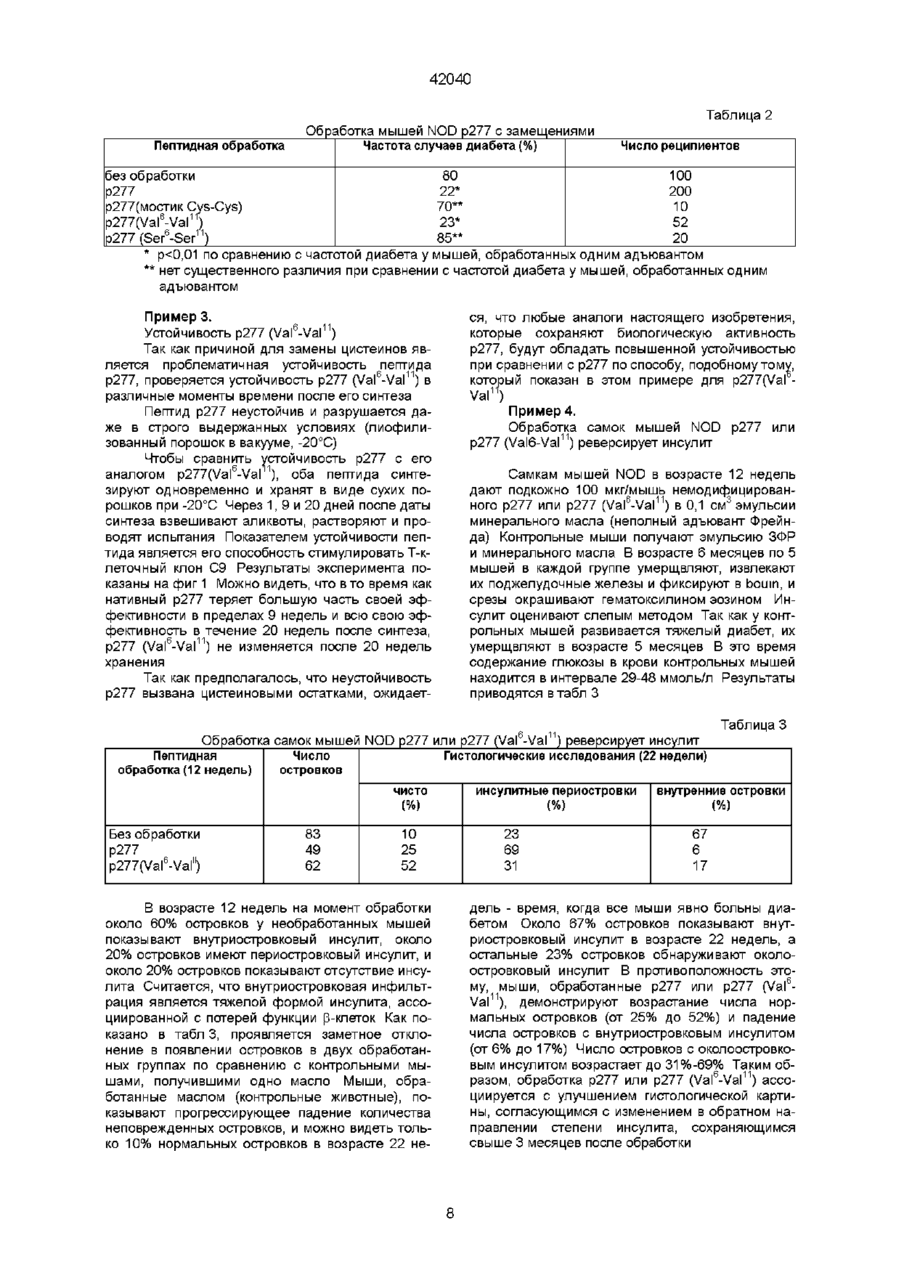
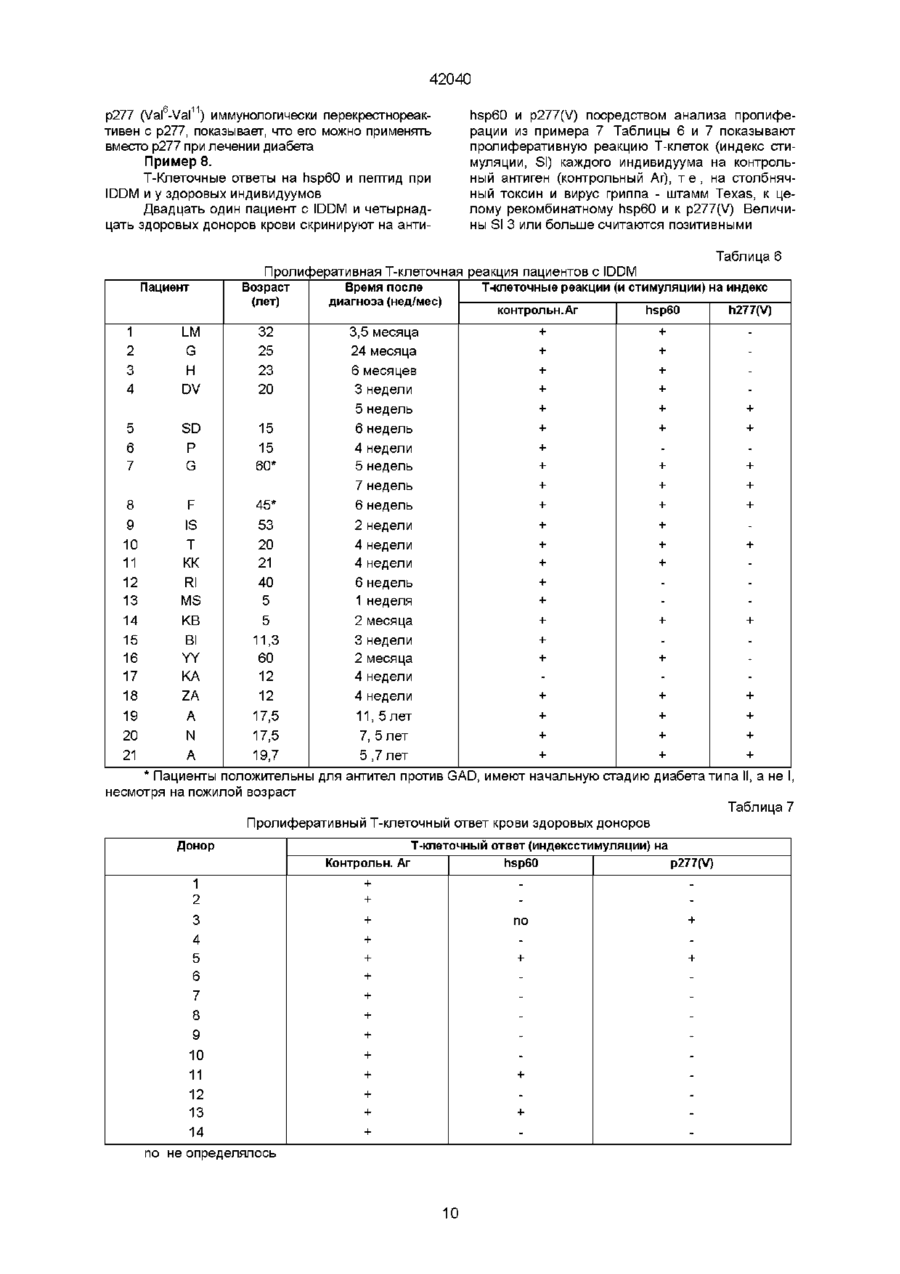
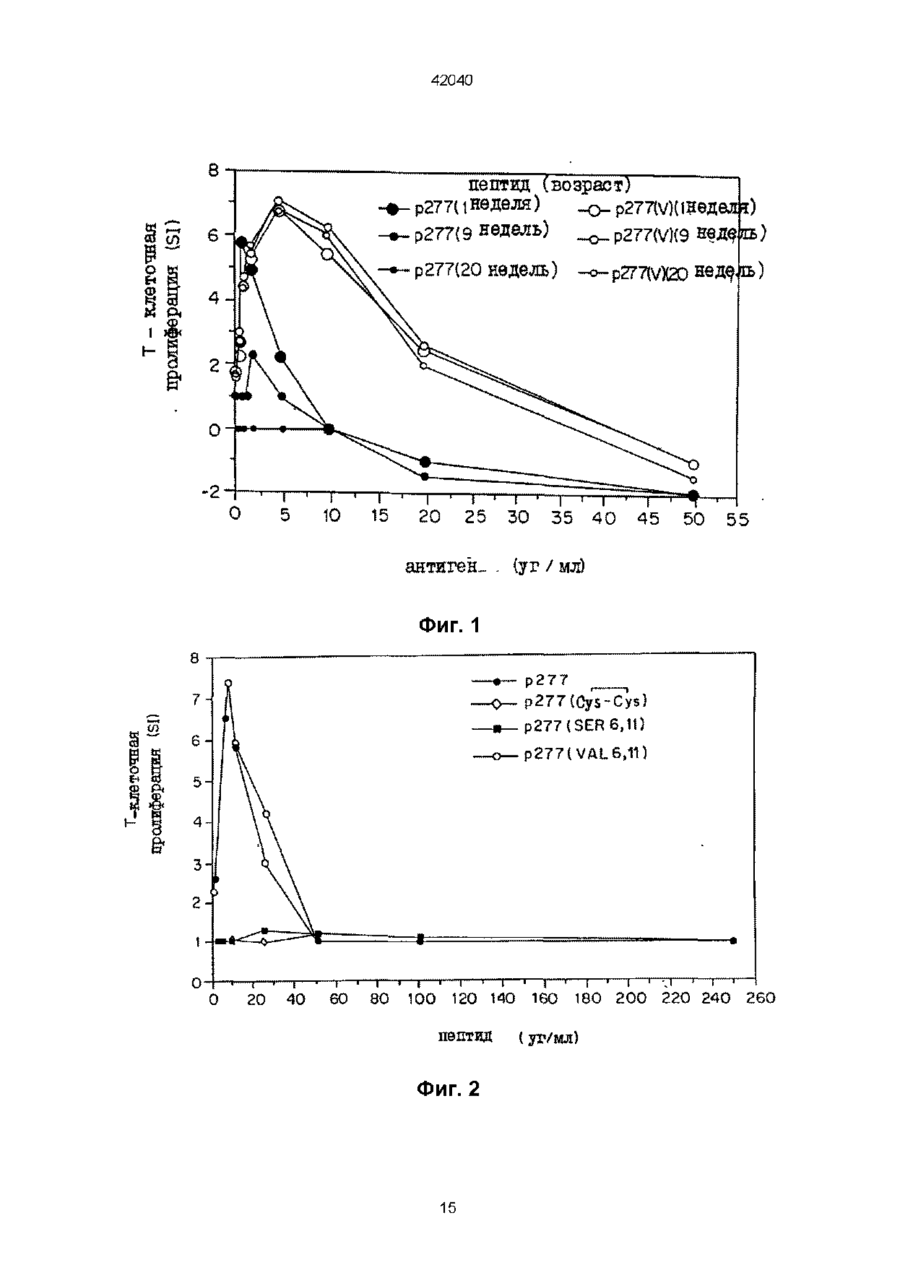
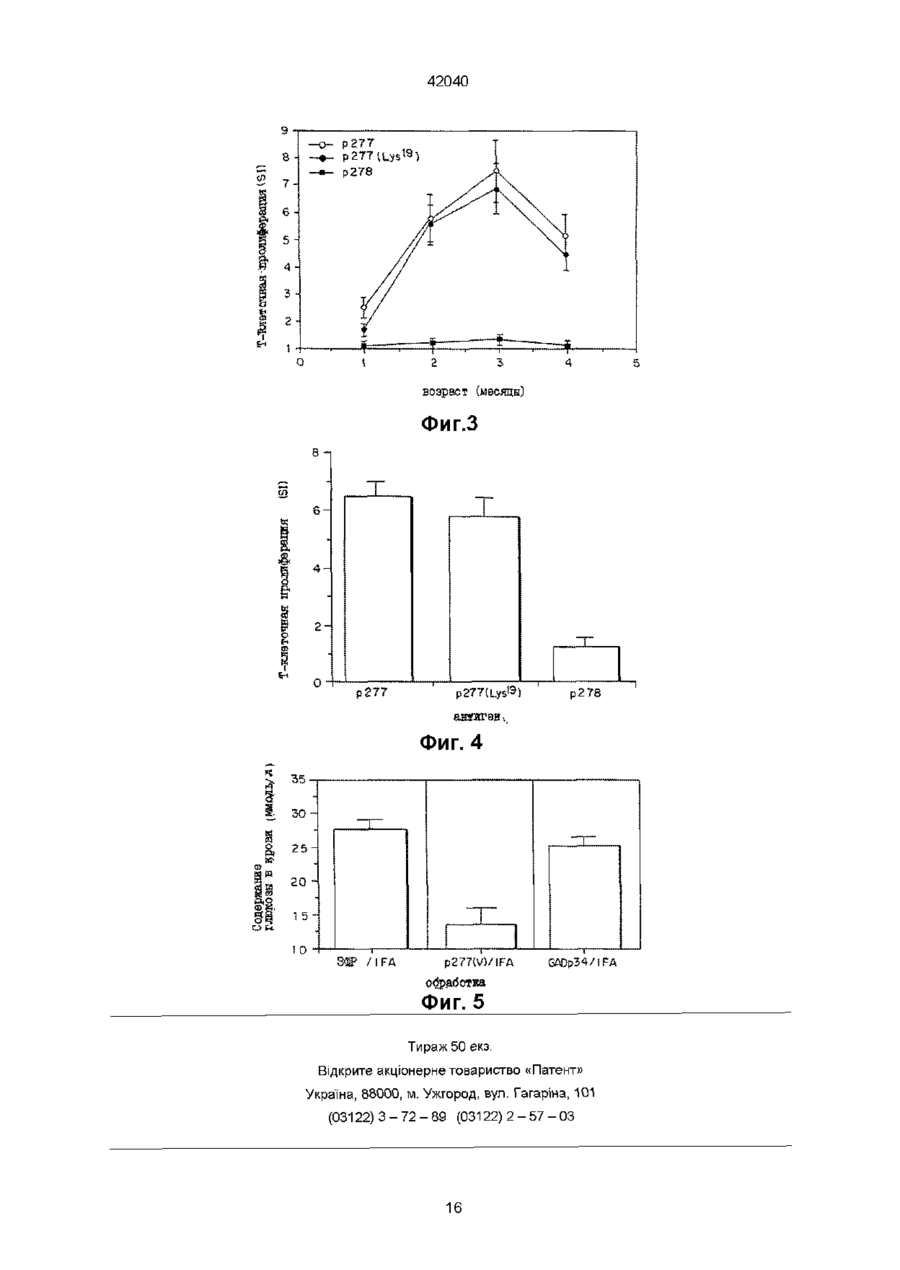
1 Полипептид последовательности Val-Leu-Gly-Gly-Gly-Xi-Ala-Leu-Leu-Arg-X2-lle-ProAla-Leu-Asp-Ser-Leu-X3-Pro-Ala-Asn-Glu-Asp, где Xi и Хг, каждый, представляют собой остатки Cys или Val, Хз является остатком Thr или Lys, но Xi и Хг оба не могут быть остатками Cys, когда Хз представляет собой Thr, а также его соли и функциональные производные 2 Полипептид по п 1 , отличающийся тем, что выбран из пептидов, обозначенных как р277 (Val 1 ), где Xi представляет собой Cys, X2 представляет собой Val, и Хз представляет собой Thr, р277 (Val6-Val11), где как Х-і, так и Хг являются Val, а Хз представляет собой Thr, p277 (Val11-Lys19), где Xi представляет собой Cys, X2 представляют собой Val, и Хз представляет собой Lys, p277 (Val611-Lys19), где как Х-і, так и Хг представляют собой Val и Хз представляет собой Lys 3 Полипептид по любому из п п 1 , 2, отличающийся тем, что предназначен для получения ком Зоя позиции для диагностики инсулинзависимого сахарного диабета (IDDM) 4 Способ диагностики развившегося или развивающегося инсулинзависимого сахарного диабета (IDDM) у пациента, включающий исследование крови или мочи указанного пациента на присутствие антител, которые иммунологически реактивны с человеческим hsp60, присутствие которого указывает на высокую вероятность наличия или начальную стадию IDDM, отличающийся тем, что в качестве антигена используют полипептид по любому из пп 1 или 2 5 Способ по п 4, отличающийся тем, что присутствие антител против hsp60 обнаруживают с помощью радиоиммуноанализа или по методу ELISA (твердофазный иммуноферментный анализ) 6 Набор для диагностики IDDM путем исследования на присутствие антител против hsp60 по любому из способов по пп 4, 5, содержащий антиген, являющийся пептидом поп 1, и меченое антитело, способное распознавать невариабельную область указанных антител против hsp60, которые определяют 7 Способ диагностики развившегося или развивающегося IDDM у пациента, включающий исследование крови или мочи указанного пациента на присутствие Т-клеток, которые иммунологически реактивны с человеческим hsp60, присутствие которых указывает на высокую вероятность наличия или начальную стадию IDDM, отличающийся тем, что в качестве антигена используют пептид по любому из пп 1,2 8 Способ по п 7, отличающийся тем, что присутствие Т-клеток, которые иммунореактивны с hsp60, определяют с помощью испытания на Тклеточную пролиферацию, включающего следующие стадии получение мононуклеарной клеточной фракции, содержащей Т-клетки из образца крови, взятого у указанного пациента, добавление к указанной мононуклеарной клеточной фракции антигена, выбранного из числа пептидов по п 1 , инкубирование указанной клеточной фракции в присутствии указанного антигена в течение подходящего периода времени и при подходящих для культивирования условиях, добавление меченого нуклеотида к инкубированной клеточной культуре в подходящий момент времени перед окончанием о О О 42040 указанного периода инкубации для обеспечения включения указанного меченого нуклеотида в ДНК пролиферирующих Т-клеток, и определение количества пролиферирующих Т-клеток с помощью анализа количества меченого нуклеотида, включенного в указанные Т-клетки 9 Способ по п 7, отличающийся тем, что присутствие Т-клеток, которые иммунореактивны с hsp60, определяют с помощью испытания на Тклеточную цитокинную реакцию, включающего следующие стадии получение мононуклеарной клеточной фракции, содержащей Т-клетки из образца крови, взятого у указанного пациента, добавление к указанной мононуклеарной клеточной фракции антигена, выбранного из числа пептидов по п 1, инкубирование указанной клеточной фракции в присутствии указанного антигена в течение подходящего периода времени и при подходящих для культивирования условиях, и определение наличия цитокина, секретированного отвечающими лимфоцитами в среду, при этом цитокин представляет собой r-интерферон, ИЛ-2, ИЛ-4, ИЛ-6, ИЛИ0, a-0>HOm-mTGFp 10 Набор для диагностики IDDM путем испытания на присутствие Т-клеток, которые иммунореактивны с hsp60, no способу по п 8, содержащий антиген, являющийся пептидом по п 1 , меченый нуклеотид и подходящую среду для культивирования лимфоцитов 11 Набор для диагностики IDDM путем испытания на присутствие Т-клеток, которые иммунореактивны с hsp60, по способу по п 9, содержащий антиген, являющийся пептидом по п 1 , подходящую среду для культивирования лимфоцитов и аналитический набор для определения присутствия цитокина, секретированного отвечающими лимфоцитами в среду 12 Препарат для предупреждения или лечения IDDM, содержащий Т-клеточный продукт, выбранный из группы, состоящей из человеческих Тклеток, которые проявляют специфичность к последовательности р277 человеческого hsp60, где указанные клетки активированы путем инкубации Настоящее изобретение относится к новым пептидам, являющимся вариантами эпитопа человеческого хитшокового белка в 60 кД (hsp 60) и к фармацевтическим композициям, содержащим такие пептиды, и к способам диагностики и лечения инсулинзависимого сахарного диабета (IDDM) с использованием таких пептидов Предпосылки создания изобретения Диабет типа I или IDDM является аутоиммунным заболеванием, вызванным Т-клетками, которые атакуют и разрушают продуцирующие инсулин р-клетки, находящиеся в островках поджелудочной железы (Castano и Eisenbarth, 1990) Аутоиммунный процесс, завершающийся IDDM, начинается и развивается без симптомов Заболевание проявляется клинически только тогда, когда совокупная утрата р-клеток превышает способность оставшихся р-клеток вырабатывать инсулин В самом деле, полагают, что коллапс глюкозного в присутствии пептида по п 1 , указанных человеческих Т-клеток, которые облучены или аттенуированы другим способом, указанных человеческих Т-клеток, которые подвергнуты обработке давлением посредством гидростатического давления, обработке химическим перекрестно- сшивающим агентом и/или обработке цитоскелетным перекрестно-сшивающим агентом, фрагментов или поверхностных белков, образованных из указанных Т-клеток, или пептида, состоящий, по существу, из вариабельной области рецептора человеческих Тклеток, которые проявляют специфичность к последовательности р277 человеческого hsp60, где указанные клетки активированы путем инкубации в присутствии пептида по п 1, специфического для указанного белка, или его соль, функциональное производное, предшественник или его активную фракцию 13 Препарат по п 12, отличающийся тем, что указанные человеческие Т-клетки, которые проявляют специфичность к последовательности р277 человеческого hsp60 и которые активированы путем инкубации в присутствии пептида по п 1, являются аутологичными Т-клетками, полученными от больного IDDM, подвергаемого лечению, и указанная специфичность указанных Т-клеток создана путем контакта in vitro с указанным пептидом по п1 14 Препарат по любому из пп 12 или 13, отличающийся тем, что указанные Т-клетки обладают созданной in vitro специфичностью к пептиду по п 1 15 Фармацевтическая композиция для профилактики или лечения IDDM, содержащая пептид по п 1 и фармацевтически приемлемый носитель 16 Фармацевтическая композиция по п 15, отличающаяся тем, что указанный пептид является пептидом по п 2 17 Пептид по любому из пп 1 или 2, отличающийся тем, что он предназначен для использования в качестве активного ингредиента фармацевтической композиции для предупреждения или лечения IDDM гомеостаза и клинический IDDM имеют место только после того, как иммунной системой инактивированы 80-90% р-клеток Таким образом, пациенты, которых идентифицируют как страдающих от IDDM, непременно находятся в поздней стадии аутоиммунного разрушения их р-клеток Кроме того, диагноз начального, преклинического диабета путем детекции иммунологических маркеров р-клеточного аутоиммунитета можно установить только после начала аутоиммунного процесса Следовательно, терапевтический поиск должен найти безопасный, специфичный и эффективный способ сворачивания аутоиммунного процесса, который уже пошел Авторы настоящего изобретения прежде изучали этот вопрос, исследуя развитие спонтанного диабета у мышей линии NOD, который, как считается,является достоверной моделью человеческого IDDM (Castano и Eisenbarth, 1990) У мы 42040 шей MOD в возрасте примерно 4 недель развивается инсулит, который начинается как околоостровковый инфильтрат и развивается до серьезного внутриост-ровкового воспаления Гипергликемия, которая подтверждает недостаточность инсулина, начинается у самок в нашей колонии в возрасте 14-17 недель В возрасте 35-40 недель почти у всех мышей NOD развивается тяжелый диабет, и большинство погибает при отсутствии лечения инсулином Самцы мышей NOD реже заболевают диабетом по неясным причинам Показано, что диабет у мышей NOD вызывается аутоиммунными Т-клетками (Bendelac etal , 1987) Т-Кпеточная реактивность и аутоантитела к различным антигенам определены у больных IDDM, а также у мышей NOD (Ehas, 1994), и неясно, является ли первичной причиной заболевания иммунитет к любому одному из возможных мишенных антигенов Кроме вопроса о причинах заболевания существует вопрос лечения Показано, что инициация аутоиммунного процесса у мышей NOD может быть предупреждена различными воздействиями на мышей - до появления диабета, такими как ограничение питания, вирусные инфекции или неспецифическая стимуляция иммунной системы (Bowman et al , 1994) Диабет у мышей NOD также предупреждается путем индукции иммунологической толерантности у преддиабетных мышей к антигену тутами новой кислоты-декарбоксилазы (GAD) (Kaufman et al, 1993, Tisch et al , 1993) Авторы настоящего изобретения ранее обнаружили, что диабет у мышей NOD можно предупредить Т-клеточной вакцинацией с использованием Т-клеток, специфических для пептидной последовательности р277 молекулы человеческого hsp60 (Ehas et al , 1991) Этот белок прежде назывался hsp65, но теперь называется hsp60 с учетом более точных сведений о молекулярной массе, независимо от названия, это одинаковые белки Пептид р277, будучи эпитопом человеческого hsp60, вовлеченным в IDDM и соответствующим позициям 437-460 последовательности человеческого hsp60, впервые описан в заявке на патент Израиля № 94241 заявителей настоящей заявки и в работе Ehas и Cohen, 1994, и имеет следующую последовательность Val-Leu-Gly-Gly-Gly-Cys-Ala-Leu-Leu-Arg-CysIle-Pro-Ala-Leu-Asp-Ser-Leu-Thr-Pro-Ala-Asn-GluAsp (послед № 1) Показано, что введение самого пептида р277 в начале инсулита также предотвращает развитие диабета, вероятно, посредством отрицательной негативной модуляции иммунитета против р277, что существенно для NOD-диабета (Ehas et al , 1991, заявка на патент Израиля № 94241) Последние исследования показали, что пептид р277 также можно использовать для реверсии р-клеточного аутоиммунитета, который развился до поздней стадии (Ehas и Cohen, 1994) Согласно последним лабораторным исследованиям авторов настоящего изобретения, форма аутоиммунного диабета может быть индуцирована в мышах линии C57BL/KsJ путем введения очень низкой дозы р-клеточного токсина стрептозотоцина (STZ) (Ehas et al , 1994) В то время как стандартная низкая доза STZ в 40 мг/кг, вводимая ежедневно в течение 5 дней, обычно вызывает клинический диабет в пределах 3 недель, введение 30 мг/кг в течение 5 дней индуцирует клинический диабет только через скрытый период примерно в 3 месяца Эта модель индуцированного диабета отличается появлением в продромный период аутоантител к инсулину, антиидиотипических антител к антиинсулиновым антителам и аутоантител к hsp60 Мыши также проявляют спонтанную Т-клеточную реактивность к hsp60 и к его пептиду р277 (Ehas et al , 1994) Таким образом, оказывается, что доза STZ ниже стандартной низкой дозы инициирует аутоиммунный процесс, не отличающийся от процесса, наблюдаемого при спонтанном диабете, развивающемся у мышей NOD (Ehas etal , 1990) Предметом настоящего изобретения являются варианты пептида р277, причем указанные варианты могут использоваться для диагностики и лечения IDDM Краткое изложение сущности изобретения При исследовании фрагментов и вариантов пептида р277 неожиданно обнаружилось, что пептиды, в которых один треониновый остаток заменяется на лизиновый остаток, и/или один или оба остатка цистеина заменяются на остаток (остатки) валина, так же активны при лечении диабета, как р277 Эти результаты были даже более неожиданными, так как замещение цистеиновых остатков остатками серина дает в результате инактивные пептиды Таким образом, настоящее изобретение относится к пептиду, содержащему последовательность I 6 11 Val-Leu-Gly-Gly-Gly-Xi-Ala-Leu-Leu-ArgO^-lle-Pro19 (I) Ala-Leu-Asp-Ser-Leu-X3-Pro-Ala-Asn-Glu-Asp (послед № 2), где каждый из Xi и Хг является остатком Cys или Val, а Хз является остатком Thr или Lys, но оба Xi и Хг не могут быть остатками Cys, когда ХЗ является Thr-остатком В конкретных вариантах осуществления настоящего изобретения пептид состоит из последовательности І, в которой какХі, так и Хг являются Cys, а Хз представляет собой Lys, и назван здесь р277 (Lys 9) (послед № 3), или Xi представляет собой Val, X2 представляет собой Cys, а Хз является Thr или Lys, и такие пептиды названы здесь р277 (Val6) (послед № 4) и р277 (Val6-Lys19) (послед № 5), соответственно, или Xi представляет собой Cys, X2 представляет собой Val, а Х3 является Thr или Lys, и такие пептиды названы здесь р277 (Val11) (послед № 6) и р277 (Val11Lys19) (послед № 7), соответственно, или как Xi так и Хг представляют собой Val, а Хз является Thr или Lys, и такие пептиды названы здесь p277(Val6-Val11) (послед № 8) и р277 (Val6l11-Lys19) 42040 (послед № 9), соответственно Пептид р277 (Val Val11) называется здесь также р277 (V) Также целью настоящего изобретения являются способы и наборы для ранней диагностики IDDM, использующие пептид последовательности I изобретения В процессе развития IDDM животные экспрессируют молекулы hsp60 или молекулы, которые являются перекрестно-реактивными с ними, которые находят их путь в крови и моче животных Они также экспрессируют антитела и Т-клетки, направленные специфически к таким молекулам Таким образом, присутствие hsp60 (или молекул, которые перекрестнореактивны с ним) или антител или Т-клеток, специфических для него, в крови или в моче служит методом анализа для обнаружения процесса IDDM до завершения разрушения бета-клеток, когда индивидуум обречен на пожизненный диабет Наличие или появление IDDM у пациента можно диагностировать путем анализа крови или мочи указанного пациента на присутствие антител против hsp60 или Т-клеток, которые иммунологически реактивны с человеческим hsp60, с использованием в качестве антигена пептида последовательности I настоящего изобретения В самом деле, любая из описанных ранее процедур, которую можно осуществлять с использованием р277, таких, какие описаны в заявке на международный патент, опубликованной под № WO 90/10499, включенный здесь в качестве ссылки, также может использоваться с заменой р277 на пептид с последовательностью I настоящего изобретения Соответственно, настоящее изобретение относится к способу диагностирования наличия или появления IDDM у пациента, включающему проверку указанного пациента на присутствие антител к hsp60 или Т-клетки, которая иммунореактивна с hsp60, причем положительный результат такой проверки, указывающий на присутствие антител к hsp60 или Т-клетки, которая иммунореактивна с hsp60, или Т-клетки или Т-клетки, которая иммунореактивна с hsp60, указывает на высокую вероятность наличия или появления IDDM При этом способе диагностики IDDM пациента можно проверить на присутствие антител против hsp60, при этом указанный способ исследования может включать радиоиммунноанализ или анализ методом ELISA Пациента также можно проверить на присутствие Т-клетки, которая иммуннореактивна с hsp60 В одном из вариантов осуществления изобретения в таком аспекте метод исследования включает испытание на Т-клеточную пролиферациию, содержащее стадии (I) получения мононуклеарной клеточной фракции, содержащей Т-клетки из образца крови, взятого у указанного пациента, (II) добавления к указанной мононуклеарной клеточной фракции антигена, выбранного из числа пептидов последовательности I настоящего изобретения, (III) инкубации указанной клеточной фракции в присутствии указанного антигена в течение соответствующего периода времени и при подходящих условиях культивирования, (IV) добавления меченого нуклеотида к инкубированной клеточной культуре, полученной в (III), в подходящий момент времени перед окончанием указанного инкубационного периода для обеспечения включения указанного меченого нуклеотида в ДНК пролиферирующих Т-клеток, и (V) определения количества пролиферирующих Т-клеток путем анализа количества меченных нуклеотидов, включенных в указанные Т-клетки На описанной выше стадии (IV) указанный меченый нуклеотид представляет собой, предпочтительно, 3Н-тимидин Определение количества пролиферирующих Т-клеток осуществляют путем вычисления индекса стимуляции Т-клеток стандартными способами В другом варианте осуществления изобретения в этом аспекте метод исследования включает испытание на Т-клеточный цитокиновый ответ, при котором стадии (l)-(lll) такие же, как в описанном выше испытании на Т-клеточную пролиферацию, а на четвертой (IV) стадии определяют, с помощью стандартных способов с коммерчески доступными наборами, присутствие цитокина, такого как интерферон-у, ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-10, а-ФНО или TGFp, секретированного в среду отвечающими лимфоцитами В своем другом аспекте настоящее изобретение относится к способу in vivo, при котором антиген, выбранный из пептидов с последовательностью I, инъецируют пациенту подкожно, и наблюдают появление детектируемой кожной реакции (DTH) Настоящее изобретение также относится к средствам осуществления таких анализов, а также к наборам для осуществления таких анализов Наборы можно получить для осуществления любого из многих анализов, применяемых для выполнения настоящего изобретения Каждый такой набор включает все материалы, необходимые для проведения отдельного анализа или определенного числа анализов Например, набор для определения присутствия антител против hsp60 может содержать иммобилизованный на твердой фазе пептид последовательности I и меченое антитело, способное узнавать невариабельную область антитела против hsp60, которое детектируют, как, например, меченое античеловеческое Fab Набор также может содержать указания по применению набора и емкости для хранения материалов набора Можно использовать любую обычную метку, такую как радиоизотоп, фермент, хромофор или флуорофор Типичным радиоизотопом является иод-125 или сера-35 Типичными ферментами для этих целей являютсяпероксидаза хрена обыкновенного, р-галактозидаза и щелочная фосфотаза Набор для диагностирования наличия IDDM посредством исследований на присутствие антител против hsp60 включает (I) антиген, выбранный из пептидов последовательности I, и (II) меченое антитело, способное узнавать невариабельную область указанных антител против hsp60, которые определяют Набор для диагностирования наличия IDDM посредством исследований на присутствие Т-клетки, которая иммунореактивна с hsp60, включает 42040 (I) антиген, выбранный из пептидов последовательности I, и (II) подходящую среду для культивирования лимфоцитов (Т-клеток), и (III) либо меченый нуклеотид для испытания на Т-клеточную пролиферацию, либо набор для цитокинового анализа, например, на -интерферон, ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-10, а-ФНО или TGFp, для испытания на цитокины Для проверки in vivo набор будет содержать только пептид последовательности І в форме, подходящей для инъекции Настоящее изобретение также относится к способам предупреждения или лечения IDDM Вакцинация антигенным пептидом последовательности I настоящего изобретения может обеспечить специфическую супрессирующии эффект для аутоиммунитета к антигену, и эффективно создает сопротивление аутоиммунному процессу IDDM То же справедливо в отношении вакцинации Т-клетками, специфическими для таких антигенов, в аттенюированной или авирулентной форме, или после обработки для улучшения ее антигенности, или их фрагментами или активными фракциями Если видно, что пациент уже находится в преклинической начальной стадии IDDM, инъекция такого антигена или Т-клеток (или фракции) может вызвать супрессирующее действие на аутоиммунный процесс для этого антигена и, таким образом, остановить аутоиммунный процесс, прежде чем он причинит значительные необратимые повреждения Пептид также можно использовать в качестве терапевтического средства для остановки аутоиммунного процесса даже после того, как он далеко продвинулся, как показали недавно авторы настоящего изобретения в отношении лечения мышей NOD пептидом р277 (Ehas and Cohen, 1994) Соответственно, настоящее изобретение относится к препарату для предупреждения или лечения инсулинзависимого сахарного диабета (IDDM), содержащему Т-клеточный продукт, выбранный из группы, состоящей из (а) человеческих Т-клеток, которые показывают специфичность к последовательности р277 человеческого hsp60, причем указанные клетки активированы путем инкубации в присутствии указанного пептида последовательности I, (б) указанных человеческих Т-клеток по (а), которые облучены или аттенюированы другим способом, (в) указанных человеческих Т-клеток по (а), которые подвергнуты обработке под давлением посредством гидростатического давления, обработке химическим перекрестносшивающим агентом и/или обработке цитоскелетным перекрестносшивающим агентом, (г) фрагментов или поверхностных белков, образованных из Т-клеток (а), (б) или (в), или (д) пептида, состоящего, по существу, из вариабельной области рецептора (а), специфического для указанного белка, или его соль, функциональное производное или активную фракцию В предпочтительном варианте осуществления настоящего изобретения препарат содержит аутологичные человеческие Т-клетки, полученные от пациента с IDDM, которого лечат, и эти Т-клетки активированы путем контакта in vitro с указанным пептидом последовательности I Такие спе цифические и активированные Т-клетки затем вводят тому же пациенту, от которого их первоначально получили Настоящее изобретение также относится к фармацевтической композиции для предупреждения или лечения IDDM, содержащей фармацевтически приемлемый носитель и, в качестве активного элемента, эффективное количество пептида последовательности I, его соли или функционального производного Фармацевтически приемлемый носитель представляет собой, предпочтительно, масляный носитель, такой как эмульсия минерального масла, известная как неполный адъювант Фрейнда (IFA) Однако, IFA, как и полный адъювант Фрейнда (CFA, препарат, содержащий различные количества убитых организмов микобактерии), не допускает применения для человека, поскольку минеральное масло не преобразуется в ходе обмена веществ и не может разлагаться организмом В настоящее время авторами настоящего изобретения обнаружено, что некоторые жировые эмульсии, которые в течение многих лет применяют для парентерального питания пациентовлюдей, также могут действовать как носители для пептидной терапии, использующей пептиды настоящего изобретения Например, две такие эмульсии являются коммерчески доступными жировыми эмульсиями, известными под названиями интралипид (Intrahpid) и липофундин (Lypofundm) "Интралипид" является зарегистрированным торговым названием фирмы Kabi Pharmacia, Швеция, для жировой эмульсии для парентерального питания, описанной в патенте США № 3169094 "Липофундин" является зарегистрированным торговым названием фирмы В Braun Melsungen, Германия Обе эмульсии в качестве жира содержат соевое масло (100 или 200 г в 1000 мл дистиллированной воды, соответственно, 10% или 20%) В качестве эмульгаторов в интралипиде используются фосфолипиды яичного желтка (12 г на л дистиллированной воды), а в липофундине используется лецитин яичного желтка (12 г на л дистиллированной воды) Как в интралипиде, так и в липофундине изотоничность достигается добавлением глицерина (25 г/л) Настоящее изобретение также относится к способу предупреждения или лечения IDDM, который включает введение пациенту, нуждающемуся в таком лечении, фармацевтической композиции, содержащей пептид последовательности I, или препарата, содержащего Т-клетки, которые выращены специфически к указанному пептиду последовательности I настоящего изобретения Краткое описание чертежей Фиг 1 представляет график показывающий устойчивость р277 и р277 (Val6-Val1 ) Заштрихованные кружки относятся к результатам с полученным с р277, а незаштрихованные кружки - к р277 (Val6Val ) Большие кружки показывают результаты, полученные после 1 недели хранения, кружки среднего размера - результаты после 9 недель, и самые маленькие кружки - после 20 недель Фиг 2 показывает, что NOD-T-клетки диабетогенного клона С9 пролиферируют в ответ на пептиды р277 (заштрихованные кружки) и р277 (Val -Val ) (незаштрихованные кружки) 42040 Фиг 3 показывает, что Т-клетки селезенки мышей NOD пролиферируют в присутствии пептида p277(l_ys19) Исследовались селезенки 5 самок мышей NOD в каждой возрастной группе на Т-клеточную пролиферацию в ответ на пептид p277(l_ys19) (заштрихованные кружки), р277 (незаштрихованные кружки) и контрольный пептид р278 (заштрихованные квадраты) Фиг 4 показывает, что Т-клетки диабетогенного клона С9 мышей NOD пролиферируют в ответ на пептид р277 (Lys19) Фиг 5 представляет диаграмму, показывающую эффективность предварительной обработки p277(V) в IFA при предупреждении индуцированного STZ диабета по сравнению с контрольной обработкой или обработкой GADp34 Подробное описание изобретения Всякий раз, когда в описании изобретения употребляется выражение "пептид последовательности I", подразумеваются также его соли и функциональные производные, пока сохраняется биологическая активность пептида в отношении диабета "Соли" пептида I, предполагаемые изобретением, являются физиологически приемлемыми органическими и неорганическими солями "Функциональные производные" пептида I, о которых здесь идет речь, охватывают производные, которые можно получить на основе функциональных групп, которые встречаются в боковых цепях в остатках или в N- или С-концевых группах, способами, известными в технике, и включаются в изобретение, пока они остаются фармацевтически приемлемыми, т е , не разрушают активность пептида настолько, насколько это касается его подобия известной активности р277, не придают токсических свойств композициям, которые их содержат, и не оказывают вредного влияния на их антигенные свойства Такие "функциональные производные" не включают такие изменения, которые эффективно превращают одну аминокислоту в другую С учетом приведенных выше ограничений, эти производные могут, например, включать сложные эфиры алифатических спиртов карбоксильных групп, амиды, полученные при реакции карбоксильных групп с аммиаком или первичными или вторичными аминами, N-ацильные производные свободных аминогрупп аминокислотных остатков, образовавшиеся при реакции с ацильными группами (например, алканоильными или карбоциклическими ароильными группами), или О-ацильные производные свободной гидроксильной группы (например, гидроксильной группы серильного или треонильного остатков), образовавшиеся при реакции с ацильными группами Пептид последовательности I изобретения можно использовать в качестве иммуногена в фармацевтических композициях, в частности, в вакцинах, для снятия симптомов или лечения IDDM, а также в качестве антигена в диагностических композициях для диагностики IDDM Указанные фармацевтические и диагностические композиции, которые можно получить способами, известными в технике, также составляют часть настоящего изобретения Когда пептид настоящего изобретения используется для терапевтического лечения или в виде профилактической вакцины, его, предпочтительно, вводят с биологически активным носителем, который промотирует сдвиг ТН1-ТН2 аутоиммунных Т-клеток Т-Клетки CD4 хелперного типа подразделяются на две группы, в соответствии с цитокинами, которые они секретируют, когда активированы (Mosmann and Coffman, 1989) клетки ТН1 секретируют ИЛ-2 и интерферону, в то время как клетки ТН2 секретируют ИЛ-4 и ИЛ-10 Такой носитель, предпочтительно, представляет собой жировую эмульсию, содержащую 10-20% триглицеридов растительного и/или животного происхождения, 1,2-2,4% фосфолипидов растительного и/или животного происхождения, 2,25-4,5% осморегулятора, 0-0,5% антиоксиданта и стерильную воду до 100% Такой носитель представляет собой, наиболее предпочтительно, интралипид или липофундин Применение таких носителей описано в заявке на патент Израиля (указанной ссылкой заявителя 9523), зарегистрированной в один день с датой регистрации израильской заявки на настоящее изобретение (указанной ссылкой заявителя 9451 А), с тем же Заявителем, что и настоящая заявка, и эта заявка включена в настоящее в качестве ссылки Лечебная композиция по настоящему изобретению может вводиться перорально или парентерально, например, подкожно, внутримышечно, внутривенно, интраназально или интраректально Приведенные здесь примеры доказывают эффективность терапевтического лечения соединениями и композициями настоящего изобретения на научно признанных животных моделях IDDM человека Примеры Материалы и методы (I) Мыши Инбредных самок мышей линии NOD/Lt получают из Центра по разведению животных (Animal Breeding Center) Weizmann Institute of Science, Rehovot, Израиль У этих мышей в возрасте 14-17 недель спонтанно развивается аутоиммунный диабет, который имитирует IDDM у людей (II) Пептиды Пептиды синтезируют обычными методами Fmoc-химии с использованием синтезатора ABIMED (ФРГ), и очищают на колонках для ВЭЖХ с помощью хроматографии с обращенной фазой Последовательности устанавливают с помощью анализа аминокислот Синтезируют следующие пептиды пептид р277, контрольный пептид р278 с последовательностью Asn-Glu-Asp-GlnLys-lle-Gly-lle-Glu-lle-lle-Lys-Arg-Thr-Leu-Lys-lle (послед № 10), соответствующий позициям 458474 молекулы человеческого hsp60, фрагменты р277 аминополовину р277 (р277 N), карбоксиполовину р277 (р277 С) и р277С, объединенный с р278 (р277 С-р278), пептид р277 (Lys ), и пептид р277 с различными аминокислотными замещениями двух цистеиновых остатков в последовательности вида р277 с мостиковыми -SH группами (р277(мостик Cys-Cys)), p277 с замещением обоих цистиновых остатков валином (р277 (Val6-Val11)) или серином (p277(Ser6-Ser11)) 42040 (III) Обработка и контроль Мышам дают эмульсии р277, других пептидов или бычий сывороточный альбумин (БСА, приобретен у Sigma, СентЛуис, Миссури, США) в объемах 0,1 мл, инъекцией подкожно в спину Антигены разводят в ЗФР и эмульгируют в равном объеме минерального масла (неполный адъювант Фрейнда (IFA), Sigma) или 10% интралипида У мышей проверяют содержание глюкозы в крови при 10 А М в неголодающем состоянии, как описано Ehas с сотр , 1991, во время лечения (в возрасте 7, 12, 15 или 17 недель) и, у мышей, которые выжили, в возрасте 40 недель Значительной гипергликемией считается концентрация глюкозы 11,1 мМ/л или выше, поскольку такая концентрация глюкозы в крови превышает три стандартных отклонения от среднего уровня содержания глюкозы в крови, измеренного у 100 здоровых мышей (не показан) Гистологическое исследование островков поджелудочной железы осуществляют на срезах, окрашенных гематоксилином или эозином Срезы оцениваются независимо двумя наблюдателями, которым не известно об идентичности групп Чтобы удостовериться в статистических различиях при различных обработках, используют критерий хи-квадрат (IV) Анализ Т-клеточной пролиферации Суспензии клеток клона С9 и селезеночных клеток, полученных от самок мышей NOD, анализируют на Т-клеточную пролиферацию/ как описано ранее (Ehas et al , 1991) Коротко, 1 х105 клоновых клеток/мл или 1x106 спленоцитов/мл инкубируют при четырехкратном повторении в течение 72 час в 0,2 мл культуральной среды в лунках на микротитровальном планшете в присутствии или при отсутствии 5 мкг/мл различных антигенов Пролиферацию измеряют, включая [3Н]-тимидин в ДНК во время последних 12 часов инкубации Результаты подсчитывают в виде индекса стимуля ции - отношения тестового среднего чим (число импульсов в минуту) в присутствии антигена к среднему фоновому чим при отсутствии антигена Стандартные отклонения между четырьмя повторами всегда составляли менее 10% от среднего чим Фон составляет
ДивитисяДодаткова інформація
Назва патенту англійськоюPolypeptide, method for diagnostics of insulin-dependent diabetes mellitus (iddm), which has been developed or is developing (variants), kit for diagnostics of (variants), preparation for prevention of treatment of iddm, pharmaceutical composition for prophylaxis or treatment of iddm
Автори англійськоюCOHEN IRUN R, ELIAS DANA, FRIDKIN MATITYAHU
Назва патенту російськоюПолипептид, способ диагностики инсулинзависимого сахарного диабета (iddm), который развился или развивается (варианты), набор для диагностики iddm (варианты), препарат для предупреждения или лечения iddm, фармацевтическая композиция для профилактики или лечения iddm
Автори російськоюКохен Айран Р., ЭлИас Дана, Фридкин Матитьяху
МПК / Мітки
МПК: C07K 16/18, A61K 49/00, C07K 14/47, A61K 35/14, A61K 39/00, C12Q 1/02, A61P 3/08, A61P 3/10, G01N 33/53, C07K 14/00, A61K 38/00
Мітки: препарат, цукрового, фарма, інсулінозалежного, лікування, варіанти, розвивається, набір, запобігання, спосіб, діабету, iddm, діагностики, поліпептид, розвинувся
Код посилання
<a href="https://ua.patents.su/16-42040-polipeptid-sposib-diagnostiki-insulinozalezhnogo-cukrovogo-diabetu-iddm-shho-rozvinuvsya-abo-shho-rozvivaehtsya-varianti-nabir-dlya-diagnostiki-iddm-varianti-preparat-dlya-zapobiga.html" target="_blank" rel="follow" title="База патентів України">Поліпептид, спосіб діагностики інсулінозалежного цукрового діабету (iddm), що розвинувся або що розвивається (варіанти), набір для діагностики iddm (варіанти), препарат для запобігання або лікування iddm, фарма</a>
Попередній патент: Матеріал шкіряний
Наступний патент: Труба із сплаву на основі цирконію і спосіб її одержання
Випадковий патент: Матеріал для упакування