Спосіб індукування т-клітинної толерантності до донорської тканини або органа (варіанти), спосіб лікування діабету
Номер патенту: 44892
Опубліковано: 15.03.2002
Автори: Філіпс Ненсі Е., Греніер Дейл Л., Ноуел Рендолф Дж., Паркер Дейвід К., Мордес Джон П., Россіні Альдо А., Еппел Майкл К., Д'юері Файоуна Х.
Формула / Реферат
1. Способ индуцирования Т-клеточной толерантности к донорской ткани или органу у реципиента ткани или органа, включающий введение упомянутому реципиенту
а) аллогенной или ксеногенной клетки, которая экспрессирует по, крайней мере один донорский антиген и которая имеет лиганд на клеточной поверхности, взаимодействующий с рецептором на поверхности реципиентной Т-клетки, который опосредует контакт зависимую хелпер-эффекторную функцию и представляет собой gр39, и б) антагониста рецептора на поверхности Т-клетки, который ингибирует взаимодействие лиганда с рецептором.
2. Способ по п. 1, отличающийся тем, что антагонист представляет собой антитело против gр39.
3. Способ по п. 2, отличающийся тем, что антитело против gр39 представляет собой моноклональное антитело.
4. Способ по п. 2, отличающийся тем, что антитело против gр39 представляет собой антитело против человеческого gр39.
5. Способ по п. 3, отличающийся тем, что моноклональное антитело представляет собой MR1, полученное из гибридомы, зарегистрированной в Американской Коллекции Культур Клеток под № НВ 11048.
6. Способ по п. 3, отличающийся тем, что моноклональное антитело представляет собой химерное моноклональное антитело.
7. Способ по п. 3, отличающийся тем, что моноклональное антитело представляет собой очеловеченное моноклональное антитело.
8. Способ по п. 1, отличающийся тем, что аллогенная или ксеногенная клетка представляет собой лимфоидную клетку.
9. Способ по п. 8, отличающийся тем, что лимфоидная клетка представляет собой В-клетку.
10. Способ по п. 9, отличающийся тем, что В-клетка представляет собой покоящуюся В-клетку.
11. Способ по п. 1, отличающийся тем, что аллогенную или ксеногенную клетку, и антагонист вводят реципиенту перед трансплантацией ткани или органа.
12. Способ по п. 1, отличающийся тем, что ткань или орган включает панкреатические островки.
13. Способ по п. 1, отличающийся тем, что ткань или орган выбирают из группы, в которую входят печень, почка, сердце, легкое, кожа, мышца, нервная ткань, желудок и кишка.
14. Способ индуцирования Т-клеточной толерантности к донорской ткани или органу у реципиента ткани или органа, включающий введение упомянутому реципиенту
а) аллогенмой или ксеногенной клетки, которая экспрессирует по крайней мере один донорский антиген, и
б) антитела против gр39.
15. Способ по п. 14, отличающийся тем, что антитело против gр39 представляет собой моноклональное антитело.
16. Способ по п. 14, отличающийся тем, что антитело против gр39 представляет собой антитело против человеческого gр39.
17. Способ по п. 14, отличающийся тем, что моноклональное антитело представляет собой MR1.
18. Способ по п. 15, отличающийся тем, что моноклональное антитело представляет собой химерное моноклональное антитело.
19. Способ по п. 15, отличающийся тем, что моноклональное антитело представляет собой очеловеченное моноклональное антитело.
20. Способ по п. 14, отличающийся тем, что антагонист gр39 представляет собой растворимую фазу лиганда gр39.
21.Способ по п. 20, отличающийся тем, что растворимая фаза лиганда gр39 представляет собой слитый белок CD40.
22. Способ по п. 14, отличающийся тем, что аллогенная или ксеногенная клетка представляет собой лимфоидную клетку.
23. Способ по п. 22, отличающийся тем, что лимфоидная клетка представляет собой В-клетку.
24. Способ по п. 23, отличающийся тем, что В-клетка представляет собой покоящуюся В-клетку.
25. Способ по п. 14, отличающийся тем, что аллогенную или ксеногенную клетку и антагонист вводят реципиенту перед трансплантацией ткани или органа.
26. Способ по п. 14, отличающийся тем, что ткань или орган включает панкреатические островки.
27. Способ по п. 14, отличающийся тем, что ткань или орган выбирают из группы, в которую входят печень, почка, сердце, легкое, кожа, мышца, нервная ткань, желудок и кишка.
28. Способ лечения диабета, включающий введение субъекту, нуждающемуся в таком лечении,
а) аллогенной или ксеногенной клетки, которая экспрессирует по крайней мере один донорский антиген,
б) антитела против gр39,
в) донорских клеток панкреатических островков.
29. Способ по п. 28, отличающийся тем, что антитело против gр39 представляет собой моноклональное антитело.
30. Способ по п. 28, отличающийся тем, что антитело против gр39 представляет собой антитело против человеческого gр39.
31. Способ по п. 29, отличающийся тем, что моноклональное антитело представляет собой MR1, полученное из гибридомы, зарегистрированной в Американской Коллекции Культур Клеток под № НВ 11048.
32. Способ по п. 29, отличающийся тем, что моноклональное антитело представляет собой химерное моноклональное антитело.
33. Способ по п. 29, отличающийся тем, что моноклональное антитело представляет собой очеловеченное моноклональное антитело.
34. Способ по п. 28, отличающийся тем, что антагонист gp39 представляет собой растворимую фазу лиганда gp39.
35. Способ по п. 34, отличающийся тем, что растворимая фаза лиганда gp39 представляет собой слитый белок CD40.
36. Способ по п. 28, отличающийся тем, что аллогенная или ксеногенная клетка представляет собой лимфоидную клетку.
37. Способ по п. 36, отличающийся тем, что лимфоидная клетка представляет собой В-клетку.
38. Способ по п. 37, отличающийся тем, что В-клетка представляет собой покоящуюся В-клетку.
39. Способ по п. 28, отличающийся тем, что аллогенную или ксеногенную клетку и антагонист вводят реципиенту перед трансплантацией клеток панкреатических островков.
40. Способ индуцирования Т-клеточной толератности к донорской ткани или органу у реципиента ткани или органа, включающий введение упомянутому реципиенту
а) донорской аллогенной клетки,
б) моноклонального антитела против gp39,
при этом донорскую аллогенную клетку и антитело против gp39 вводят
реципиенту перед трансплантацией ткани или органа.
41. Способ по п. 40, отличающийся тем, что моноклональное антитело против gp39 представляет собой антитело против человеческого gp39.
42. Способ по п. 41, отличающийся тем, что моноклональное антитело представляет собой MR1, полученное из гибридомы, зарегистрированной в Американской Коллекции Культур Клеток под № НВ 11048.
43. Способ по п. 42, отличающийся тем, что моноклональное антитело представляет собой химерное моноклональное антитело.
44. Способ по п. 43, отличающийся тем, что моноклональное антитело представляет собой очеловеченное моноклональное антитело.
45. Способ по п. 40, отличающийся тем, что аллогенная или ксеногенная клетка представляет собой лимфоидную клетку.
46. Способ по п. 45, отличающийся тем, что лимфоидная клетка представляет собой В-клетку.
47. Способ по п. 46, отличающийся тем, что В-клетка представляет собой покоящуюся В-клетку.
Текст
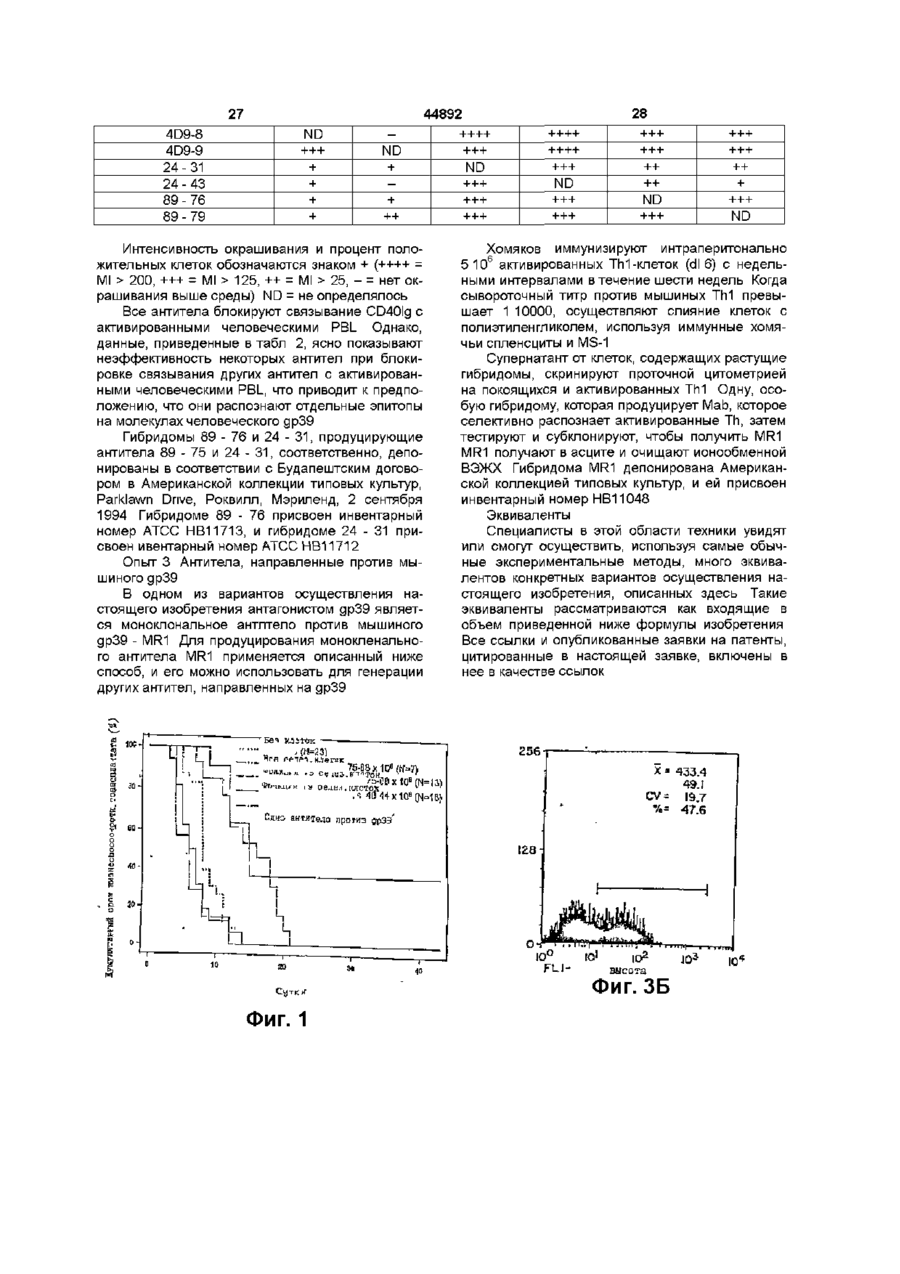
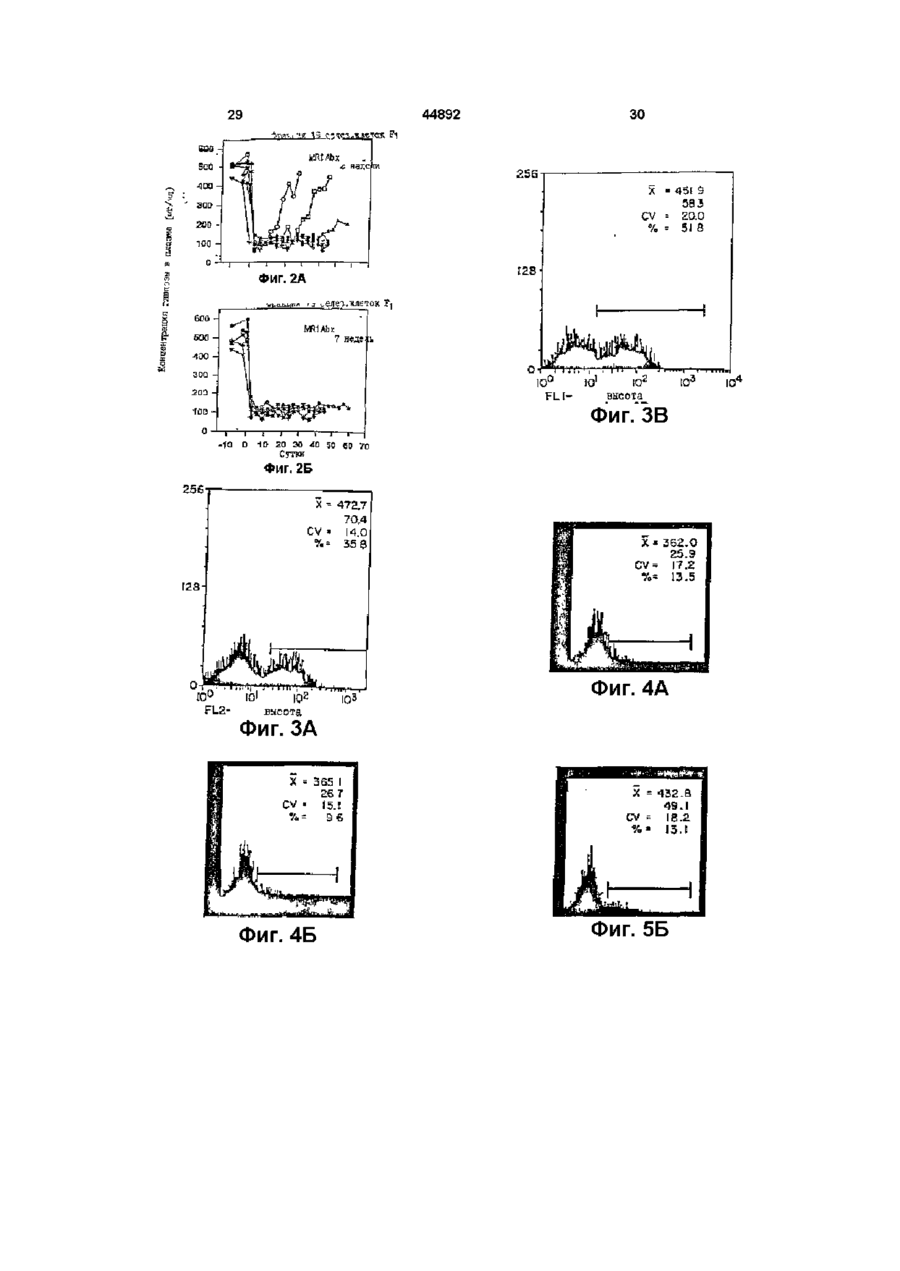
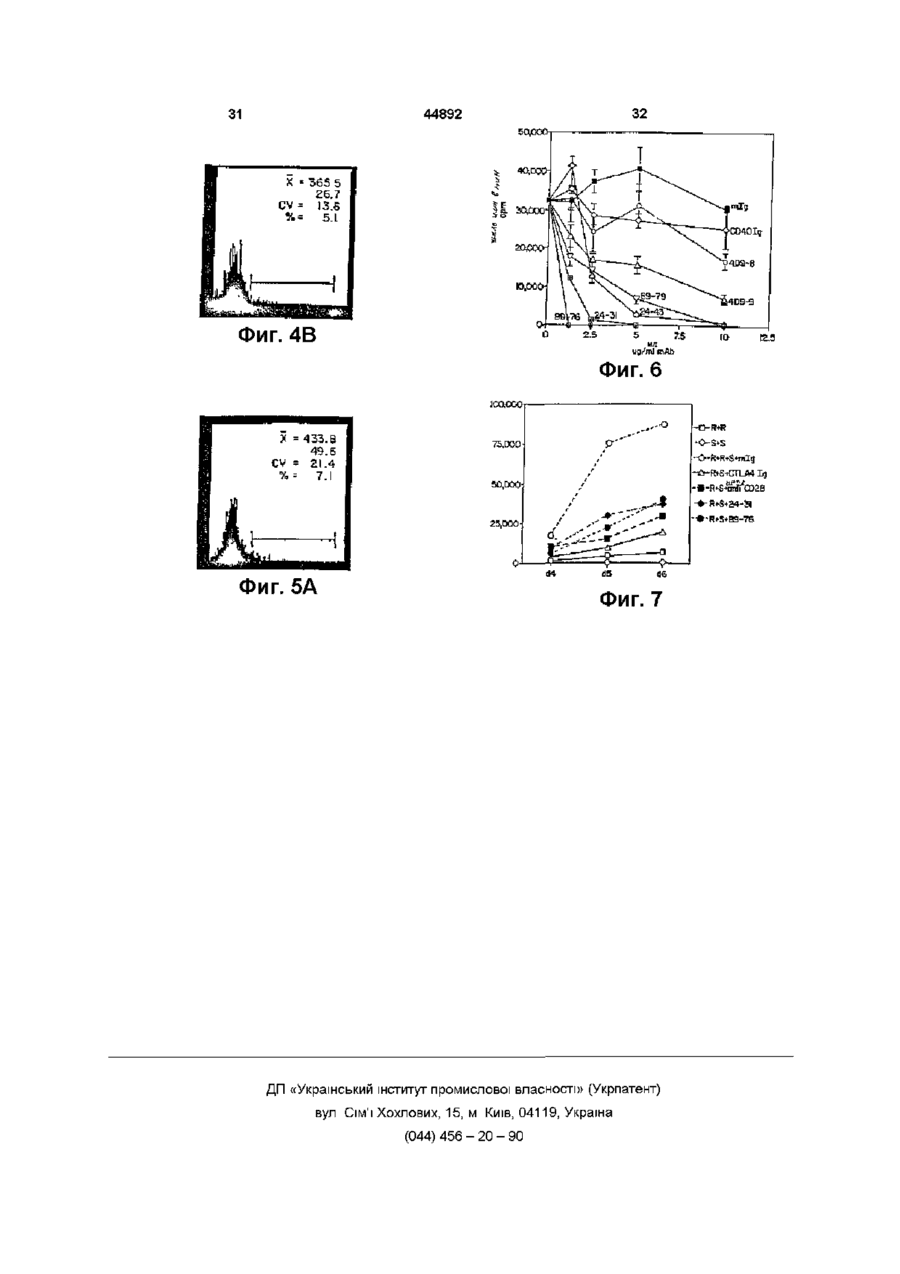
1 Способ индуцирования Т-клеточной толерантности к донорской ткани или органу у реципиента ткани или органа, включающий введение упомянутому реципиенту а) аллогенной или ксеногенной клетки, которая экспрессирует по, крайней мере один донорский антиген и которая имеет лиганд на клеточной поверхности, взаимодействующий с рецептором на поверхности реципиентной Т-клетки, который опосредует контакт зависимую хелпер-эффекторную функцию и представляет собой др39, и б) антагониста рецептора на поверхности Т-клетки, который ингибирует взаимодействие лиганда с рецептором 2 Способ по п 1, отличающийся тем, что антагонист представляет собой антитело против др39 3 Способ по п 2, отличающийся тем, что антитело против др39 представляет собой моноклональное антитело 4 Способ по п 2, отличающиися тем, что антитело против др39 представляет собой антитело против человеческого др39 5 Способ по п 3, отличающийся тем, что моноклональное антитело представляет собой MR1, полученное из гибридомы, зарегистрированной в Американской Коллекции Культур Клеток под № НВ 11048 6 Способ по п 3, отличающийся тем, что моноклональное антитело представляет собой химерное моноклональное антитело 7 Способ по п 3, отличающийся тем, что моно тональное антитело представляет собой очеловеченное моноклональное антитело 8 Способ по п 1, отличающийся тем, что аллогенная или ксеногенная клетка представляет собой лимфоидную клетку 9 Способ по п 8, отличающийся тем, что лимфоидная клетка представляет собой В-клетку 10 Способ по п 9, отличающийся тем, что Вклетка представляет собой покоящуюся В-клетку 11 Способ по п 1, отличающийся тем, что аллогенную или ксеногенную клетку, и антагонист вводят реципиенту перед трансплантацией ткани или органа 12 Способ по п 1, отличающийся тем, что ткань или орган включает панкреатические островки 13 Способ по п 1, отличающийся тем, что ткань или орган выбирают из группы, в которую входят печень, почка, сердце, легкое, кожа, мышца, нервная ткань, желудок и кишка 14 Способ индуцирования Т-клеточной толерантности к донорской ткани или органу у реципиента ткани или органа, включающий введение упомянутому реципиенту а) аллогенмой или ксеногенной клетки, которая экспрессирует по крайней мере один донорский антиген, и б) антитела против др39 15 Способ по п 14, отличающийся тем, что антитело против др39 представляет собой моноклональное антитело 16 Способ по п 14, отличающийся тем, что антитело против др39 представляет собой антитело против человеческого др39 17 Способ по п 14, отличающийся тем, что моноклональное антитело представляет собой MR1 18 Способ по п 15, отличающийся тем, что моноклональное антитело представляет собой химерное моноклональное антитело 19 Способ по п 15, отличающийся тем, что моноклональное антитело представляет собой очеловеченное моноклональное антитело 20 Способ по п 14, отличающийся тем, что антагонист др39 представляет собой растворимую фазу лиганда др39 21 Способ по п 20, отличающийся тем, что растворимая фаза лиганда др39 представляет собой слитый белок CD40 О 00 22 Способ по п 14, отличающийся тем, что аллогенная или ксеногенная клетка представляет собой лимфоидную клетку 23 Способ по п 22, отличающийся тем, что лимфоидная клетка представляет собой В-клетку 24 Способ по п 23, отличающийся тем, что Вклетка представляет собой покоящуюся В-клетку 25 Способ по п 14, отличающийся тем, что аллогенную или ксеногенную клетку и антагонист вводят реципиенту перед трансплантацией ткани или органа 26 Способ по п 14, отличающийся тем, что ткань или орган включает панкреатические островки 27 Способ по п 14, отличающийся тем, что ткань или орган выбирают из группы, в которую входят печень, почка, сердце, легкое, кожа, мышца, нервная ткань, желудок и кишка 28 Способ лечения диабета, включающий введение субъекту, нуждающемуся в таком лечении, а) аллогенной или ксеногенной клетки, которая экспрессирует по крайней мере один донорский антиген, б) антитела против др39, в) донорских клеток панкреатических островков 29 Способ по п 28, отличающийся тем, что антитело против др39 представляет собой моноклональное антитело 30 Способ по п 28, отличающийся тем, что антитело против др39 представляет собой антитело против человеческого др39 31 Способ по п 29, отличающийся тем, что моноклональное антитело представляет собой MR1, полученное из гибридомы, зарегистрированной в Американской Коллекции Культур Клеток под № НВ 11048 32 Способ по п 29, отличающийся тем, что моноклональное антитело представляет собой химерное моноклональное антитело 33 Способ по п 29, отличающийсятем, что моноклональное антитело представляет собой очеловеченное моноклональное антитело 34 Способ по п 28, отличающийся тем, что антагонист др39 представляет собой растворимую фазу лиганда др39 44892 4 35 Способ по п 34, отличающийся тем, что растворимая фаза лиганда др39 представляет собой слитый белок CD40 36 Способ по п 28, отличающийся тем, что аллогенная или ксеногенная клетка представляет собой лимфоидную клетку 37 Способ по п 36, отличающийся тем, что лимфоидная клетка представляет собой В-клетку 38 Способ по п 37, отличающийся тем, что Вклетка представляет собой покоящуюся В-клетку 39 Способ по п 28, отличающийся тем, что аллогенную или ксеногенную клетку и антагонист вводят реципиенту перед трансплантацией клеток панкреатических островков 40 Способ индуцирования Т-клеточной толератности к донорской ткани или органу у реципиента ткани или органа, включающий введение упомянутому реципиенту а) донорской аллогенной клетки, б) моноклонального антитела против др39, при этом донорскую аллогенную клетку и антитело против др39 вводят реципиенту перед трансплантацией ткани или органа 41 Способ по п 40, отличающийся тем, что моноклональное антитело против др39 представляет собой антитело против человеческого др39 42 Способ по п 41, отличающийся тем, что моноклональное антитело представляет собой MR1, полученное из гибридомы, зарегистрированной в Американской Коллекции Культур Клеток под № НВ 11048 43 Способ по п 42, отличающийся тем, что моноклональное антитело представляет собой химерное моноклональное антитело 44 Способ по п 43, отличающийся тем, что моноклональное антитело представляет собой очеловеченное моноклональное антитело 45 Способ по п 40, отличающийся тем, что аллогенная или ксеногенная клетка представляет собой лимфоидную клетку 46 Способ по п 45, отличающийся тем, что лимфоидная клетка представляет собой В-клетку 47 Способ по п 46, отличающийся тем, что Вклетка представляет собой покоящуюся В-клетку Для индуцирования антиген-специфической Тклеточной активации и тональной экспансии к поверхности покоящихся Т-лимфоцитов должны быть доставлены два сигнала, обеспеченных антигенпредставляющими клетками (АПК) (Jenkins, М and Schwartz, R (1987) J Exp Med 165, 302 319, Mueller.DL etal (1990) J Immunol 144,3701 - 3709, Williams, IR and Unnanue, ER (1990) J Immunol 145, 85 - 93) Первый сигнал, который представляет специфичность иммунной реакции, передается через Т-клеточный рецептор (TCR) после распознавания инородного атигенного пептида, представленного в связи с главным комплексом гистосовметимости (ГКГС) Второй сигнал, называемый костимуляцией, индуцирует Тклетки к пролиферации и появлению функцио нальности (Schwartz, R Н (1990) Science 248, 1349 - 1356) Костимуляция не является ни антигенспецифической, ни ограниченной ГКГС, и, полагают, обеспечивается одной или несколькими отдельными -молекулами клеточной поверхности, экспрессированными АПК (Jenkins, M К et al (1988) J Immunol 140, 3324 - 3330, Lmsley, P S et al (1991) J Exp Med 173, 721 - 730, Gimmi, С D , et al (1991) Proc Natl Acad Sci USA 88, 6575 6579, Yong , J W , et al (1992) J Clm Invest 90, 229-237, Koulova, L, etal (1991) J Exp Med 173, 759 - 762, Reiser, H , et al (1992) Proc Natl Acad Sci USA 89, 271 - 275, van-Seventer, G A , et al (1990) J Immunol 144, 4579 - 4586, LaSalle, J M , et al (1991) J Immunol 147, 774 - 780, Dustm, M I , et al (1989) J Exp Med 169, 503, Armitage, R J , et al (1992) Nature 357, 80 - 82, Liu, Y , et al (1992) J Exp Med 175, 437 - 445) Один костимуляторный каскад, включенный в Т-клеточную активацию, включает молекулу CD28 на поверхности Тклеток Эта молекула может получить костимудяторный сигнал, доставленный лигандом на Вклетках или других АПК Лиганды для CD28 включают членов семейства В7 В-лимфоцитных активационных антигенов, таких как В7-1 и/или В7-2 (Freedman, A S , et al (1987) J ImmunoL 137, 3260 3267, Freeman, G J , et al (1989) J Immunol 143, 2714 - 2722, Freeman, G J , et al (1991) J Exp Med 174, 625 - 631, Freeman, G J , et al (1993) Science 262, 909 - 911, Azuma, M , et al (1993) Nature 366, 76 - 79, Freeman, G J , et al (1993) J Exp Med 178,2185-2192) B7-1 и В7-2 также являются лигандами для другой молекулы - CTLA4, присутствующей на поверхностях активированных Т-клеток, хотя роль CTLA4 при костимуляции неясна Доставка к Т-клетке антиген-специфического сигнала костимуляторным сигналом ведет к активности Т-клеток, которая может включать как пролиферацию Т-клеток, так и секрецию цитокинов В противоположность этому, полагают, что доставка к Т-клетке антиген-специфичного сигнала в отсутствии костимуляторного сигнала индуцирует в Т-клетке состояние иммунологической неотвечаемости или анергии, индуцируя, таким образом, антиген-специфическую толерантность в Т-клетке Взаимодействие между Т-клетками и Вклетками играет центральную роль в иммунных реакциях Индукция гуморального иммунитета к тимус-зависимым антигенам требует "помощи", обеспечиваемой Т-клетками-хелперами (далее Тп-клетками) Хотя некоторая помощь, обеспеченная Влимфоцитами, передается растворимыми молекулами, выделяемыми Тп-клетками (например, лимфокинами, такими как IL-4 и IL-5), активация Вклеток также требует контакт-зависимого взаимодействия между В-клетками и Тп-клетками См Hirohata et al , J ImmunoL, 140 3736 - 3744 (1988), Barlett et al , J ImmunoL, 143 1745 - 1754 (1989) Это указывает, что активация В-клеток включает обязательное взаимодействие молекул клеточной поверхности В-клеток и Тп-клеток Следовательно, молекула (молекулы) на Т-клетке опосредуют контакт-зависимые хелпер-эффекторные функции Т-клетки Контакт-зависимое взаимодействие между молекулами на В-клетках и Т-клетках также поддерживает наблюдение, что изолированные плазматические мембраны активированных Тклеток могут обеспечивать хеллерные функции, необходимые для активации В-клеток См Brian, Ргос NatL Acad Sci USA, 85 564 - 568 (1988), Hodgkm et al , J Immunol, 145 2025 - 2034 (1990), Noelleetal , J ImmunoL, 146 1118-1124(1991) Молекула CD40 идентифицирована на поверхностях незрелых и зрелых В-лимфоцитов, и при перекрестном сшивании антителами индуцирует пролиферацию В-клеток См Valle et al , Eur J Immunol , 19 1463 - 1467 (1989), Gordon et al , J Immunol, 1401425 - 1430 (1988), Gruber et al , J Immunol, 142 4144 - 4152 (1989) Молекулы CD40 44892 клонированы и охарактеризованы См Stamenkovic et al , EMBO J , 8 1403 - 1410 (1989) Лиганд для CD40 - gp39 (называемый также CD40лигандом или CD40L) - также клонирован молекулярно и охарактеризован См Armitage et al , Nature, 357 80 - 82 (1992), Lederman et al , J Exp Med, 175 1091 - 1101 (1992), Hollenbaugh et al , EMBO J 11 4313-4319(1992) Белок gp39 экспрессируется на активированных, а не на покоящихся, СD4+-Th-клетках См Spnggs et al , J Exp Med ,176 1543 - 1550 (1992), Lane et al , Eur J Immunol, 22 2573 - 2578 (1992), Roy et al , J Immunol ,151 1-14 (1993) Клетки, трансфицированные геном gp39, и экспрессирующие белок др39 на своей поверхности, могут вызывать Вклеточную пролиферацию и, вместе с другими стимуляторными сигналами, могут индуцировать продуцирование антител См Armitage et al , Nature, 357 80 - 82 (1992), Hollenbaugh et al , EMBO J , 11 4313-4319(1992) Молекулы клеточной поверхности, которые опосредуют контакт-зависимые хелперэффекторные функции Т-клеток, важны для индуцирования иммунных реакций, которые требуют помощи Т-клеток Например, взаимодействие др39 на Т-клетках с CD40 на В-клетках играет центральную роль при активации реакций В-клеток на антиген Настоящее изобретение основывается, по крайней мере частично, на открытии, что молекулы клеточной поверхности, которые опосредуют контакт-зависимые хелпер-эффекторные функции Т-клеток, также играют критическую роль в реакции Т-клеток к аллоантигенам В частности, обнаружено, что при определенных условиях вмешательство во взаимодействии др39 с лигандом на аллогенной клетке, которая представляет аллоантигены Т-клетке, может индуцировать толерантность в Т-клетке Предпочтительно, аллогенная клетка, которая представляет аллоантигены Тклетке, требует взаимодействия между лигандом др39 на Т-клетке, чтобы иметь возможность обеспечить сигналы, необходимые для активации Тклетки Ингибирование взаимодействия лиганда др39 на аллогенной клетке с др39 на Т-клетке предотвращает активацию Т-клеток и индуцирует, скорее, аллоантиген-специфическую толерантность Т-клеток Индуцирована Т-клеточной толерантности к аллоантигенам, как описывается в настоящем изобретении, может использоваться в качестве препаративной схемы для пересадки ткани или органа Соответственно, способы настоящего изобретения в особенности пригодны для индуцировать Т-клеточной толерантности к донорской ткани или органу у реципиента ткани или органа Упомянутые способы включают введение реципиенту трансплантата 1) аллогенных или ксеногенных клеток, которые экспрессируют по крайней мере один донорский антиген, и которые имеют лиганд на клеточной поверхности, который взаимодействует с рецептором на поверхности реципиентной Т-клетки, которая опосредует контакт-зависимые хелпер-эффекторные функции, 2) антагониста молекулы на поверхности реципиентной Т-клетки, которая опосредует контакт-зависимые хелперэффекторные функции Антагонист ингибирует 44892 взаимодействие между молекулой на Т-клетке и ее лигандом на аллогенной или ксеногенной клетке В предпочтительном варианте осуществления изобретения рецептор на поверхности Т-клетки, которая опосредует контакт-зависимые хелперэффекторные функции, представляет собой др39 При таком варианте осуществления изобретения антагонист представляет собой молекулу, которая ингибирует взаимодействие др39 на Т-клетке с лигандом др39 на аллогенной или ксеногенной клетке Особенно предпочтительный антагонист др39 представляет собой антитело против др39 В другом варианте осуществления настоящего изобретения антагонист др39 представляет собой растворимую форму лиганда др39, например, растворимый CD40 Аллогенные или ксеногенные клетки, которые вводятся реципиенту, представляют собой, предпочтительно, лимфоидные клетки, например, В-клетки Альтернативно, аллогенные или ксеногенные клетки представляют собой малые покоящиеся В-клетки Аллогенные или ксеногенные клетки и антагонист обычно вводят реципиенту перед пересадкой реципиенту ткани или органа Например, лимфоидные клетки (например, В-клетки) от донора ткани или органа вводят реципиенту, вместе с антагонистом, до трансплантации реципиенту ткани или органа Способы настоящего изобретения могут применяться, например, для индуцирования Тклеточной толерантности к пересаженным тканям или органам, таким как печень, почка, сердце, легкое, кожа, мышца, нервная ткань, желудок и кишки В одном из вариантов осуществления настоящего изобретения трансплантированная ткань содержит панкреатические островки Соответственно, изобретение относится к способу лечения диабета, включающему введение пациенту, нуждающемуся в таком лечении, 1) аллогенных или ксеногенных клеток, которые экспрессируют донорские антигены, 2) антагониста рецептора на поверхности Т-клеток реципиента, которые опосредуют контакт-зависимые хелпер-эффекторные функции, такого как антагонист др39 (например, антитело против др39), и 3) донорских панкреатических островков Краткое описание рисунков На Фиг 1 приводится графическое изображение срока жизнеспособности аллотрансплантатов панкреатических островков, пересаженных мышам с "химическим" диабетом, которым предварительно ввели одно антитело против др39, или предварительно ввели одни нефракционированные или фракционированные аллогенные клетки селезенки Фиг 2А и Фиг 2Б являются графическими изображениями срока жизнеспособности трансплантатов панкреатических островков, пересаженных мышам с "химическим" диабетом, которые предварительно получали однократную дозу фракционированных аллогенных клеток селезенки вместе с лечением антителом против gp39 (MR1) либо в течение 2 недель (Фиг 2А), либо в течение 7 недель (Фиг 2Б), при этом срок жизнеспособности определяют по снижению концентрации глюкозы в плазме Каждая кривая представляет ре 8 зультаты, полученные для отдельной мыши Незаштрихованные значки относятся к реципиентам, у которых островковые аллотрансплантаты самопроизвольно переставали действовать Заштрихованные значки относятся к мышам, у которых трансплантаты функционировали при окончании эксперимента На Фигурах ЗА, ЗБ и ЗВ изображаются профили проточной цитометрии при окрашивании активированных в течение 6 часов человеческих лимфоцитов периферической крови с одним из CD40g (Фиг ЗА), mAb (монокл антитело) 4D9-8 (Фиг ЗБ) или mAb 4D9-9 (Фиг ЗВ) На Фигурах 4А, 4В и 4В изображаются профили проточной цитометрии при окрашивании активированных в течение 6 часов человеческих лимфоцитов периферической крови, выращенных в присутствии циклопорина А, окрашенных одним из mAb 4D9-8 (Фиг 4А), mAb 4D9-9 (Фиг 4Б) или CD40lg (Фиг 4В) На Фигурах 5А и 5Б изображаются профили проточной цитометрии при окрашивании активированных в течение 6 часов человеческих лимфоцитов периферической крови CD40lg в присутствии немеченного mAb 4D9-8 (Фиг 5А) или немеченного mAb 4D9-9 (Фиг 5Б) На Фиг 6 приводятся графики ингибирования пролиферации человеческих В-клеток растворимым др39 и IL-4, когда клетки выращиваются в присутствии моноклональных антител 4D9-8, 4D99, 24 - 31, 24 - 43, 89 - 76 или 89 - 79 к человеческому др39 На Фиг 7 графически изображается ингибирование реакции алло-специфической смешанной культуры лимфоцитов, когда клетки выращиваются в присутствии моноклональных антител 24 - 31 или 89 - 79 против человеческого др39 Настоящее изобретение относится к способам индуцирова-ния in vivo Т-клеточной толерантности к донорскому трансплантату ткани или органа у реципиента трансплантата Упомянутые способы включают введение реципиенту трансплантат 1) аллогенных или ксеногенных клеток, которые экспрессируют донорские антигены, и которые имеют лиганд на клеточной поверхности, который взаимодействует с рецептором на поверхности реципиентной Т-клетки, которая опосредует контактзависимые хелпер-эффекторные функции, 2) антагониста рецептора на поверхности Т-клетки, который ингибирует взаимодействие лиганда и рецептора Как здесь установлено, термин "реципиент" относится к субъекту, которому должны пересаживаться ткань или орган, пересаживаются ткань или орган или пересажены ткань или орган Как здесь установлено, "алло-генные" клетки получают от различных индивидуумов того же вида, что и реципиент, и они экспрессируют "аллоантигены", которые отличаются от антигенов, экспрессированных клетками реципиента "Ксеногенные" клетки получают от видов, иных, чем реципиент, и они экспрессируют "ксеноантигены", которые отличаются от антигенов, экспрессированных клетками реципиента Как здесь установлено, термин "донорские антигены" относится к антигенам, экспрессированным донорской тканью или донорским органом, которые трансплантируют реципиенту 44892 10 Fab или F(ab')2, химерные антитела или очеловеченные антитела) растворимые формы лиганда др39 (например, растворимый CD40), растворимые формы слитого белка лиганда др39 (например, растворимый CD40lg), или фармацевтические средства, которые разрушают или препятствуют взаимодействию gp39 - CD40 А Антитела Млекопитающее (например, мышь, хомяк или кролик) может быть иммунизировано иммуногенной формой белка др39 или фрагментом белка (например, пептидным фрагментом), которая выявляет образование антител у млекопитающего Клетка, которая экспрессирует др39 на своей поКроме аллогенных и ксеногенных клеток, реверхности, может также использоваться в качестципиенту в качестве части схемы вызывания тове иммуногена Альтернативные иммуногены лерантности вводят антагонист молекулы на Твключают очищенный белок др39 или фрагменты клетках, которая опосредует контакт-зависимые белка Очистку др39 от экспрессирующей др39 хелпер-эффекторные функции Как установлено клетки можно осуществить стандартными метоздесь, молекула или рецептор, который опосредудами очистки Кроме того, в клетке-хозяине может ет контакт-зависимые хелпер-эффекторные функбыть экспрессирована кДНК gp39 (Armitage et al , ции, представляет собой молекулу или рецептор, Nature, 357 80 - 82 (1992), Lederman et al , J Exp который экспрессируются на Тп-клетке и взаимоMed , 175 1091 - 1101 (1992), Hollenbaugh et al , действует с лигандом на эффекторной клетке (наEMBO J , 11 4313 - 4319 (1992)), например, в липимер, на В-клетке), при этом взаимодействие нии бактериальных клеток или клеток млекопимолекулы с ее лигандом является необходимым тающего, и др39 очищают от клеточных культур для генерации реакции эффекторной клетки ( т е , стандартными методами Альтернативно, с исактивации В-клетки) Теперь обнаружено, что, попользованием известных методов (например, Fмимо вовлечения в реакции эффекторных клеток, тос или Т-Ьос химического синтеза) на основе такая молекула или рецептор вовлекается в реакаминокислотной последовательности др39 (опицию Т-клетки к антигену Предпочтительно, молесанной в Armitage et al , Nature, 357 80 - 82 (1992), кула на Т-клетке, которая опосредует контактLederman et al , J Exp Med, 175 1091 - 1101 зависимую хелпер-эффекторную функцию, пред(1992), Hollenbaugh et al , EMBO J , 11 4313 - 4319 ставляет собой др39 Соответственно, в предпоч(1992)) могут быть синтезированы пептиды gp39 тительных вариантах осуществления изобретеМетоды предоставления иммуногенности белку ния, способы изобретения включают введение включают конъюгирование с носителями или друреципиенту трансплантата аллогенных или ксеногие технические приемы, хорошо известные в техгенных клеток и антагониста др39 Активация ренике Например, белок может быть введен в приципиента Т-клеток аллогенными и ксеногенными сутствии адъюванта Развитие иммунизации клетками включает взаимодействие между др39 может быть проконтролировано путем обнаружена реципиентных Т-клетках и др39 на аллогенных ния титров антител в плазме или сыворотке Для или ксеногенных клетках При ингибировании этооценки уровней антител могут использоваться го взаимодействия антагонистом др39 Т-клетки стандартные ELISA или другие методы иммуноареципиента не активируются донорскими антигенализа с иммуногеном в качестве антигена нами, экспрессираванными аллогенными и ксеногенкыми клетками, но скорее в них вызывается После иммунизации могут быть получены антолерантность к донорским антигенам Индукция тисыворотки, и, если желательно, из сывороток толерантности к донорским антигенам у реципиможно выделить политональные антитела Для ента создает возможность, таким образом, для получения моноклональных антител продуцируюуспешной трансплантации донорской ткани или щие антитела клетки (лимфоциты) могут быть сооргана без иммуноопосредованного отторжения браны у иммунизированного животного и слиты с донорского трансплантата миеломными клетками стандартными методами слияния соматических клеток, при этом эти клетки Различные аспекты настоящего изобретения иммортализируются, и образуются клетки гибриподробнее описываются в следующих разделах домы Такие методы хорошо известны в технике I Антагонисты др39 Например, гибридомная техника первоначально В соответствии со способами изобретения, разработанная Kohler и Milstem (Nature (1975) реципиенту вводят антагонист др39, чтобы вос256 495 - 497), а также разработаны другие технипрепятствовать взаимодействию др39 на Тческие приемы, такие как гибридомный метод с клетках реципиента с лигандом др39 на аллогенчеловеческими В-клетками (Kozbar et al , Immunol ных и ксеногенных клетках, таких как В-клетки, Today (1983) 4 72), EBV-гибридомный способ для введенных реципиенту Агонист др39 определяетпродуцирования человеческих моноклональных ся как молекула, которая препятствует этому антител (Cole et al , Monoclonal Antibodies in взаимодействию, Агонист др39 может представCancer Therapy (1985) (Alien R Bliss, Inc , pages 77 лять собой антитело, направленное против др39 - 96), и скрининг библиотек химерных антител (например, моноклональное антитело против (Huse et al , Science (1989) 246 1275) Клетки гибдр39), фрагмент или производное антитела, наридом для получения антител, специфически реправленного против др39 (например, фрагменты Донорские антигены могут быть аллоантигенами или ксеноантигенами, в зависимости от источника трансплантата Аллогенные или ксеногенные клетки, введенные реципиенту как часть схемы вызывания толерантности, экспрессируют донорские антигены, т е , эекспрессируют некоторые или все те же антигены, присутствующие на донорской ткани или органе, которые трансплантируют Аллогенные или ксеногенные клетки получают, предпочтительно, от донора тканевого или органного трансплантата, но их можно получать из одного или нескольких источников, имеющих с донором общие антигенные детерминанты 11 44892 12 активных к белку или пептиду, могут быть скринипубликации РСТ ВОИС92/06193 или ЕР 0 239 400 рованы иммунохимическим способом, и моноклоОчеловеченные антитела могут быть произведенальныетела выделены ны коммерчески, например, Scotgen Limited, 2 Holly Road, Twickencham, Middlesex, ВеликобритаИспользуемый здесь термин "антитело" предния полагается и для обозначения его фрагментов, которые являются специфически реактивными в Другой способ генерирования специфических отношении белка др39 или его пептида или слитантител, или фрагментов антител, реактивных ного белка др39 Антитела могут быть фрагментипротив белка или пептида др39, состоит в скрированы с использованием известных методов, и нирсвании библиотек экспрессии кодирующих имфрагменты скринируют для применения таким же муноголбулиновых генов или их частей, экспресспособом, какой описан выше для целых антител сированных в бактериях, белком или пептидом Например, фрагменты F(ab')2 могут быть генеридр39 Например, полные Fab-фрагменты, YHрованы обработкой антител пепсином Получаюобласти и FY-области могут быть экспрессироващийся в результате фрагмент F(ab')2 может быть ны в бактериях с использованием фаговых бибобработан для восстановления дисульфидных лиотек экспрессии См , например, Ward et al , мостиков с образованием фрагментов Fab' Также Nature, 341 544 - 546 (1989), Huse et al , Science, предполагается, что антитела в настоящем изо246 1275 - 1281 (1989), и McCafferty et al , Nature, бретении включают биспецифические и химерные 348 552 - 554 (1990) Скринирование таких бибмолекулы, имеющие часть анти-др39 лиотек, например пептидом gp39, может идентифицировать фрагменты иммуноглобулина, реагиКогда антитела, продуцированные в субъекрующие с др39 Альтернативно, для тах, не относящихся к человеку, используются для продуцирования антител или их фрагментов молечения людей, они распознаются, с переменным жет быть использована SCID-hu-мышь (доступны успехом, как инородные, и у пациента может быть от Genpharm) вызвана иммунная реакция Один из подходов для снижения до минимума или устранения этой проМетодология продуцирования моноклональблемы, которому следует отдать предпочтение ных антител, направленных против др39, включая при общей иммуносупрессии, состоит в продуцичеловеческий др39 и мышиный др39, и моноклировании производных химерных антител, т е , мональных антител, ПОДХОДЯЩИХ для применения в лекул антител, которые комбинируют вариабельспособах настоящего изобретения, описывается ную область животного, не относящегося к подробнее в примере 2 человеку, и человеческую константную область Моноклональные антитела против человечеМолекулы химерных антител могут включать, наского др39 по настоящему изобретению являются пример, антиген-связывающий домен из антитела предпочтительными для использования при индумыши, крысы или другого вида, и человеческие цировании толерантности антигенспецифических константные области Описано множество подхоТ-клеток Предпочтительными антителами являдов к получению химерных антител, и они могут ются моноклональные антитела ЗЕ4, 2Н5, 2Н8, применяться для получения химерных антител, 4D9-8, 4D9-9, 24 - 31, 24 - 43, 89 - 76 и 89 - 79, содержащих вариабельную область иммуноглоописанные в примере 2 Особенно предпочтибулина, которая распознает др39 См , например, тельными антителами являются моноклональные Morrison et al , Proc Natl Acad Sci U S A 81 6851 антитела 89 - 75 и 24 - 31 Гибридомы 89 - 76 и 24 (1985), Takeda et al , Nature 314 452 (1985), Cabilly - 31, продуцирующие антитела 89 - 75 и 24 - 31, et al , патент США No 4 816 567, Boss et al , патент соответственно, депонированы, по условиям БуСША No 4 816 397, Tanaguchi et al , публикация дапештсткого договора, в Американской коллекевропейского патента ЕР 1 711 496, публикация ции типовых культур, Parklawn Drive, Роквилл, европейского патента 0 173 494, патент СоедиМэриленд, 2 сентября 1994 Гибридоме 89 - 76 ненного королевства GB 1 ЛИ 096В Ожидается, присвоен инвентарный номер АТСС НВ11713, и что такие химерные антитела будут у человека гибридоме 24 - 31 присвоен инвентарный номер менее иммуногенными, чем соответствующие неАТСС НВ11712 Антитела 2 4 - 3 1 и 89 - 76 являхимерные антитела ются изотипом IgGI Для целей лечения людей моноклональные или химерные антитела, специфически реакционноспособные с белком др39 или пептидом, затем могут быть очеловечены посредством продуцирования химер человеческой вариабельной области, в которых части вариабельных областей, особенно, консервативные остовные области антигенсвязывающего домена, имеют человеческое происхождение, и только гипервариабельные участки имеют нечеловеческое происхождение Такие измененные иммуноглобулиновые молекулы могут быть получены любым из нескольких методов, известных в технике (см , например, Teng et al , Proc Natl Acad Sci U S A , 80 7308 - 7312 (1983), Kozbor et al , Immunology Today, 4 7279 (1983), Olsson et al , Meth EnzymoL, 92 3 - 1 6 (1982)), и, предпочтительно, их получают по рекомендациям В другом варианте осуществления изобретения для использования в способах настоящего изобретения mAb против человеческого др39 связывает эпитоп, распознавемый моноклональным антителом, выбранным из группы, состоящей из ЗЕ4, 2Н5, 2Н8, 4D9-8, 4D9-9, 24 - 31, 89 - 76 и 89 79 Предпочтительнее, mAb против человеческого ер39 связывает эпитоп, распознаваемый моноклональным антителом 24 - 31 или моноклональным антителом 89 - 76 Способность mAb связывать эпитоп, указанный любым из вышеупомянутых антител, может быть определена стандартными проверками перекрестной конкуренции Например, антитело, которое связывает те же эпитопы, которые узнаны mAb 2 4 - 3 1 , будет конкурировать со связыванием меченного 2 4 - 3 1 с 13 44892 14 активированными Т-клетками, в то время как анклетке), и таким образом, клетка доставляет к Ттитело, которое связывает другой, не узнанный клетке только антигенный сигнал в отсутствие mAb 24 - 31 эпитоп, не будет конкурировать при костимуляторного сигнала, индуцируя, таким обсвязывании меченного 24 - 31 с активированными разом, толерантность Т-клетками Соответственно, по способам настоящего изобретения реципиенту вводят аллогенные или Б Растворимые лиганды для др39 ксеногенные клетки Аллогенная или ксеногенная Другие антагонисты др39, которые можно ввоклетка способна представить антиген Т-клеткам дить для индуцирования толерантности Т-клеток, реципиента, и представляет собой, например, Ввключают растворимые формы лиганда др39 Одлимфоцит - клетку, "профессионально" представновалентный растворимый лиганд др39, такой как ляющую антиген (например, моноцит, дендритную растворимый CD40, может связываться с др39, клетку, клетку Лагерганса), или другую клетку, коингибируя, таким образом, взаимодействие др39 с торая представляет антиген имунным клеткам CD40 на В-клетках Термин "растворимый" указы(например, кератиноцит, эндотелиальную клетку, вает, что лиганд не ассоциируется постоянно с астроцит, фибробласт, олигодендроцит) Более клеточной мембраной Растворимый лиганд др39 того, предпочтительно, чтобы аллогенная или может быть получен химическим синтезом или, ксеногенная клетка имела пониженную способпредпочтительно, методом рекомбинантных ДНК, ность стимулировать костимуляторный сигнал в например, путем экспрессии только внеклеточного реципиентных Т-клетках Например, аллогенная домена лиганда (при отсутствии трансмембранили ксеногенная клетка может утратить экспресных и цитоплазматических доменов) Предпочтисию, или экспрессировать только на низком уровтельным растворимым лигандом др39 является не, костимуляторных молекул, таких как белков растворимый CD40 Альтернативно, растворимый семейства В7 (например, В7-1 и В7-2) Экспрессия лиганд др39 может находиться в формеслитого костимуляторных молекул на потенциальных албелка Такой слитый белок содержит по крайней логенных или ксеногенных клетках, которые исмере часть лиганда др39, присоединенную ко втопользуются в способах настоящего изобретения, рой молекуле Например, CD40 может быть может быть оценена стандартными методами, зкспрессирован в виде слитого белка с иммуногнапример, проточной цитометрией, с использовалобулином ( т е , слитый белок CD40lg) В одном нием антител, направленных против костимуляиз вариантов осуществления изобретения продуторных молекул цируется слитый белек, содержащий аминокислотные остатки внеклеточного домена части Предпочтительными аллогенными или ксеноCD40, связанные с аминокислотными остатками генными клетками для индуцирования Тпоследовательности, соответствующей шарнирам клеточной толерантности являются лимфоидные СН2 и СНЗ тяжелой цепи иммуноглобулина, т е , клетки, например, лимфоциты периферической Cyl, с образованием слитого белка CD40lg (см , крови или селезеночные клетки Предпочтительнапример, Lmsley et al , (1991) J Exp Med 1783 ными лимфоидными клетками для индуцирования 721 - 730, Capon et al , (1989) Nature 337 525 - 531, Т-клеточной толерантности являются В-клетки Ви Capon, патент США 5 116 964) Слитый белок клетки могут быть выделены в чистом виде из может быть получен путем химического синтеза, смешанной популяции клеток (например, клеток или, предпочтительно, методом рекомбинантных других типов в периферической крови или селеДНК на основе кДНК CD40 (Stamenkovic et al , зенке) стандартными способами разделения клеEMBO J , 8 1403 -1410 (1989)) ток Например, прилипающие клетки можно удалить путем культивирования селезеночных клеток II Клетки для индукции антигенв пластиковых чашках и извлечения популяции специфической толерантности неприлипающих клеток Т-клетки можно удалить Настоящее изобретение основано, по крайней из смешанной популяции клеток путем обработки мере частично, на открытии, что представление антителом против Т-клеток (например, анти-Thyl 1 аллоантигенов Т-клеткам аллогенными клетками в и/или анти-Thyl 2) и комплементом В одном из присутствии антагониста др39 приводит в резульвариантов осуществления изобретения в качестве тате к Т-клеточной толерантности к аллоантигеантиген- представляющих клеток используются нам Клетки, которые способны индуцировать топокоящиеся лимфоидные клетки, предпочтительлерантность по такому механизму, включают но, покоящиеся В-клетки Покоящиеся лимфоидклетки, которые представляют антиген и активиные клетки, такие как покоящиеся В-клетки, можно руют Т-клетки путем взаимодействия с др39 (те , выделить методами, известными в технике, надля доставки соответствующих сигналов к Тпример, основываясь на их малом размере и клетке для активации Т-клеток необходимо взаиплотности Покоящиеся лимфоидные клетки можмодействие между др39 на Т-клетке и лигандом но выделить, например, проточным элютриациондр39 на клетке, представляющей антиген) Ингиным центрифугированием, как описано в примере бирование взаимодействия лиганда на аллоген1 При использовании проточного элютриационноной или ксеногенной клетке с др39 на реципиентго центрифугирования популяция малых, покояных Т-клетках предотвращает Т-клеточную щихся лимфоидных клеток, очищенная от клеток, активацию алло- или ксеноантигенами и, скорее, которые могут активировать Т-клеточные реакции, индуцирует Т-клеточную толерантность к антигеможет быть получена путем собирания фрации нам Препятствовал активации Т-клетки через (фракций) при 14 - 19мл/мин, предпочтительно др39 может предотвратить индукцию костимуляпри 19мл/мин (при 3200об/мин) С другой стороны, торных молекул на аллогенной или ксеногенной малые покоящиеся лимфоциты (например, Вклетке (например, молекул семейства В7 на В 15 44892 16 клетки) могут быть выделены путем центрифугипример 1) Число вводимых клеток, может измерования в прерывистом градиенте плотности, наняться в зависимости от типа используемых клепример, при использовании градиента фиколла ток, типа тканевого или органного трансплантата, или перколла, и после центрифугирования может массы реципиента, общего состояния реципиента быть получен слой, содержащий малые покояи других переменных, известных специалисту щиеся лимфоциты Малые покоящиеся В-клетки Подходящее число клеток для использования в также можно отличить от активированных Вспособе настоящего изобретения может быть опклеток путем проверки, стандартными методами ределено специалистом в этой области техники (например, иммунофлюоресценцией), экспрессии обычными способами (например, как описано в костимуляторных молекул, таких как В7-1 и/или примере 1) Клетки вводят в форме и путем, котоВ7-2, на поверхности активированных В-клеток рые подходят для индукции Т-клеточной толерантности у реципиента Клетки могут быть ввеАллогенкые или ксеногеннке клетки, введендены в физиологически приемлемом растворе, ные реципиенту, функционируют, по крайней мере таком как забуференныи фосфатом физиологичечастично, как представляющие донорские антигеский раствор, или в подобном носителе Предпочны реципиентным Т-клеткам Таким образом, тительно, клетки вводят внутривенно клетки экспрессируют антигены, которые также зкспрессируются донорской тканью или органом Антагонист по изобретению вводят субъекту в Обычно, это может осуществляться посредством биологически совместимой форме, пригодной для использования аллогенных или ксеногенных клефармацевтического введения in vivo для индуциток, полученных от донора тканевого или органнорования Т-клеточной толерантности "Биологичего трансплантата Например, от донора ткани или ски совместимая форма, пригодная для введения органа могут быть выделены периферические in vivo" означает форму антагониста, в которой лимфоидные клетки, В-клетки или селезеночные любые токсические эффекты превешиваются леклетки, и использованы в способах настоящего чебным действием соединения Термин "субъект" изобретения Альтернативно, аллогенные или предполагается для обозначения живых организксеногенные клетки могут быть получены из исмов, в которых может быть вызвана иммунная точника иного, чем донор ткани или органа, если реакция, например, млекопитающих Примерами такие клетки имеют антигенные детерминанты, субъектов являются люди, собаки, кошки, мыши, общие с тканью или органом донора Например, крысы и их трансгенные виды Антагонист др39 могут использоваться аллогенные или ксеногенможет вводиться в любой фармакологической ные клетки, которые экспрессируют (по большей форме, необязательно, с фармацевтически причасти или все) такие же антигены главного комемлемым носителем Введение терапевтически плекса гистосовместимости, что и донорская ткань активного количества антагониста определяется или орган Таким образом, могут использоваться как введение количества, аффективного при дозах аллогенные или ксенгенные клетки из источника, и в течение времени, необходимых для достижекоторый является гаплотипом ГКГС, совместимым ния нужного результата (например, Т-клеточной с донором ткани или органа (Например, ближайтолерантности) Например, терапевтически активший родственник донора трансплантата) ное количество антагониста др39 может изменяться в соответствии с такими факторами, как III Введение клеток и антагонистов др39 стадия заболевания, возраст, пол и масса особи, Т-клеточная толерантность к органному или и способность антагониста вызывать нужную ретканевому трансплантату может быть индуцироакцию у особи Схемы дозировки могут быть скорвана путем введения реципиенту трансплантата ректированы для обеспечения оптимального теантагониста др39 в сочетании с аллогенной или рапевтического ответа Например, могут ксеногенной клеткой, которые экспрессируют довводиться несколько небольших доз ежедневно, норские антигены и взаимодействуют с реципиили доза может быть пропорционально снижена, в ентными Т-клетками через др39 В предпочтисоответствии с потребностями терапевтической тельном варианте осуществления изобретения ситуации Как описано в примере 1, для лечения аллогенную или ксеногенную клетку и антагонист антителом против др39, схема эффективного ледр39 вводят реципиенту совместно или одновречения может включать установление введения менно С другой стороны, антагонист др39 можно антитела перед трансплантацией ткани или оргавводить до введения аллогенных или ксеногенных на (например, за пять - восемь дней до трансклеток, например, когда антагонист представляет плантации), с последующим повторяющимся ввесобой антитело с длительным временем полужиздением антитела (например, каждый второй день) ни В предпочтительном варианте осуществления в течение нескольких недель (например, двух изобретения антагонист и аллогенные или ксеносеми недель) после пересадки генные клетки вводят реципиенту перед трансплантацией реципиенту органа или ткани ( т е , Активное соединение (например, антагонист, реципиент -предварительно получает антагонист такой как антителе) может вводиться обычным и клетки) Например, введение аллогенных и ксеспособом, таким как инъекция (подкожная, внутногеяных клеток и антагониста может быть осущеривенная и т п ), пероральное введение, ингаляствлено за несколько дней (например, за пятьция, трансдермальная аппликация или ректальное восемь дней) перед пересадкой ткани или органа введение В зависимости от способа введения, активное соединение может быть покрыто матеОбнаружено, что введение однократной дозы риалом для защиты соединения от действия фераллогенных клеток (в сочетании с антагонистом) ментов, кислот и других естественных условий, является достаточным для индукции Т-клеточной которые могут инактивировать соединение Предтолерантности к донорской ткани или органу (см 17 44892 18 почтительным способом введения является внутсочетании с одним или несколькими ингредиентаривенная инъекция ми, перечисленными выше, в соответствии с требованиями, с последующей стерилизацией Чтобы ввести антагонист др39 способом фильтрацией Вообще, дисперсии готовят путем иным, чем парентеральное введение, может повведения активного соединения 2 стерильный надобиться нанести на антагонист покрытие из носитель, который содержит основную дисперсиматериала, или ввести этот материал вместе с онную среду и требуемые другие ингредиенты из антагонистом, который предупредит его инактивачисла перечисленных выше В случае стерильных цию Например, антагонист может вводиться осопорошков для приготовления стерильных раствоби в соответствующем носителе или разбавителе, ров для инъекций предпочтительными способами вводиться вместе с ферментными ингибиторами получения являются вакуумная сушка и сушка или в соответствующем носителе, таком как липовымораживанием, которые дают порошок активносомы Фармацевтически приемлемыми разбавиго ингредиента (например, антагониста) плюс лютелями являются физиологический раствор и водбой дополнительный желательный ингредиент из ные буферные растворы Ферментными их раствора, предварительно стерилизованного ингибиторами являются ингибитор панкреатичефильтрацией ского трипсина, диизопропилфосфат (СЕР) и тразилол Липосомы включают эмульсии "вода в масКогда активное соединение соответствующим ле в воде", а также обычные липосомы (Strejan et образом защищено, как описано выше, белок al , (1984) J Neuroimmunol 7 27) можно вводить орально, например, с инертным Активное соединение также может быть введено парентерально или интраперитонеально Также могут быть получены дисперсии в глицерине, жидких полиэтиленгликолях и в их смесях, и в маслах При обычных условиях хранения и применения эти препараты могут содержать консервант для предупреждения развития микроорганизмов Фармацевтические композиции, пригодные для применения в инъекциях, включают стерильные водные растворы (когда все растворено в воде) или дисперсии и стерильные порошки для приготовления стерильных растворов для инъекции или дисперсии для немедленного применения Во всех случаях композиция должна быть стерильной и должна быть жидкой в такой степени, чтобы можно было легко использовать шприц Она должна быть устойчивой в условиях изготовления и хранения, и должна быть предохранена от загрязнения микроорганизмами, такими как бактерии или грибы Носитель должен представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль, и т п ), и их подходящие смеси Подходящая текучесть может поддерживаться, например, с помощью покрытия, такого как лецитин, путем поддержания требуемого размера частиц в случае дисперсии, и с применением поверхностно-активных веществ Предупреждение действия микроорганизмов может быть достигнуто с помощью различных антибактериальных и противогрибковых средств, например, парабенов, хлорбутанола, фенола, аскорбиновой кислоты, тимерооала, и подобных средств Во многих случаях предпочтительно включать в композицию изотонические агенты, например, сахара, многоатомные спирты, такие как маннит, сорбит, хлорид натрия Пролонгированное поглощение инъецируемых композиций может вызываться включением в композиции средства, которое замедляет абсорбцию, например, моностеарата алюминия или желатина Стерильные инъецируемые композиции можно получить путем включения активного соединения (например, антагониста др39) в требуемом количестве в соответствующий растворитель, в разбавителем или усвояемым съедобным носителем Используемый здесь термин "фармацевтически приемлемый носитель" включает любые растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые средства, изотонические агенты и замедлители, и т п Применение таких сред и агентов с фармацевтически активными веществами хорошо известны в технике Применение любых обычных сред или агентов в лекарственных композициях рассматривается во всех случаях, за исключением их несовместимости с активным соединением В композиции также могут включаться дополнительные активные соединения Особенно выгодно составлять парентеральные композиции в виде единиц лекарственной формы для облегчения введения и равномерности дозировки Под единицей лекарственной формы здесь подразумевается физически разделенные единицы, пригодные для лечения особей млекопитающих в качестве стандартных дев, причем каждая единица содержит заранее установленное количество активного соединения, рассчитанное на получение нужного лечебного действия, в сочетании с требуемым фармацевтическим носителем Определение единиц лекарственной формы по изобретению диктуются и напрямую зависят от (а) особых свойств активного соединения и конкретного терапевтического эффекта, которого нужно достичь, и (б) ограничений, присущих технике приготовления составов такого активного соединения для лечения чувствительных особей После или вместе с описанной здесь схемой вызывания толерантности, донорскую ткань или орган пересаживают реципиенту трансплантата обычными способами IV Применение способов изобретения Способы настоящего изобретения могут использоваться в самых разных ситуациях при пересадке ткани и органов Упомянутые способы могут применяться для индуцирования Тклеточной толерантности у реципиента трансплантата ткани или органа, такого как печень, почка, сердце, легкое, кожа, мышца, нервная ткань, желудок и кишки Таким образом, способы настоящего изобретения могут применяться при ле 19 44892 20 чении заболеваний или состояний, которые влекут чаях в течение одной недели за собой пересадку ткани или органа (например, Фракционирование аллогенных селезеночных пересадка печени при лечении гиперхолестериклеток немии, пересадка мышечных клеток при лечении Донорские аллогенные клетки для предваримышечной дистрофии, пересадка нервней ткани тельного введення реципиентам трансплантатов при лечении болезни Юнтингтона или болезни получают от гибридных животных (С57хВАІ_В/с) Паркинсока, и т п ) В предпочтительном варианте (Н-2 /d)F-i, для предотвращения реакции "трансосуществления изобретения трансплантированплантат против хозяина" Чтобы выделить малые ная ткань содержит панкреатические островки лимфоцитные клетки, суспензии селезеночных Соответственно, изобретение касается способа клеток от 8-недельных самок мышей лечения диабета посредством трансплантации (C57xBALB/c)Fi очищают от эритроцитов и затем клеток панкреатических островков Упомянутый фракционируют по размеру посредством элютраспособ включает введение субъекту, нуждающеции, как описано в Tony H P , at al (1985) J Exp муся в таком лечении, 1) аллогенных или ксеноMed 161, 223, и в Gosselm E J , et ai (1988) J генных клеток, которые экспрессируют донорские Immmol 140 1408 Вкратце, малые лимфоциты антигены, 2) антагониста молекулы, экспрессировыделяют посредством проточного эдютриациннованной на Т-клетках реципиента, которая опосрего центрифугирования, используя, например, цендует контакт-зависимую хелпер-эффекторную трифугу модели J-6B (Beckman Instruments, Palo функцию, такого как антагонист др39 (например, Alto CA) Приблизительно 1 - 5 x 108 клеток в 8мл антитела против др39), и 3) донорских клеток панкультурной среды или в уравновешенном долевом креатических островков Предпочтительно, аллорастворе с 1,5% фетальной бычьей сыворотки генные или ксеногенные клетки и антагонист ввообрабатывают дезоксирибонуклеазой, помещают дят реципиенту перед введением ему в элютрационную камеру при исходной скорости панкреатических островков противотока 13,5мл/мин, и вращают при 4°С с постоянной скоростью 3200об/мин Фракция малых Настоящее изобретение такие иллюстрируетклеток с очень незначительной примесью больших ся следующими далее примерами, которые не клеток элюируется, как правило, при 14 следует рассматривать, как ограничивающие Все 19мл/мин, хотя точная скорость потока может зассылки, патенты и опубликованные заявки на пависеть от среды, в которой суопендируются клеттенты, цитируемые в настоящей заявке, включаки В экспериментах, описанных здесь, фракцию ются в нее в качестве ссылок малых клеток собирают при 19мл/мин (при Пример 1 Индукция толерантности к ал3200об/мин) Эта фракция полностью очищена, по лотрансплантатам панкреатических островков данным о вспомогательной клеточной функции посредством введения реципиенту аллогенных устойчивости к излучению (ЗОООрад), при анализа клеток и анти-39 с Т-клеточными линиями специфическими либо В настоящее время установлено, что алдля кроличьего IgG и Н2 (CDC35), либо для аллотрансплантация зависит от общей иммуносулореактивных к H2b(D10 G4) Малые клетки и пресии, которая неспецифически отсекает иммунефракционированные клетки дважды промывают коэффекторные функции Однако, в безвывороточной среде перед инъекцией в хвоиммуносупрессивные фармацевтические препастовую вену реципиентам аллотрансплантатов раты могут вызвать значительные побочные эфПолучают приблизительно 40 - 100x106 нефракфекты Кроме того, такой подход страдает алционированных селезеночных клеток лотрансплантация островков Лангерханса для лечения диабета (см , например, Robertson, R Р, (C57xBALB/c)Fi(H-2b/d) или 40 - 100x106 элютрии(1992) N Engl J Med 227,1861) Терапия с антированных малых селезеночных клеток телами, направленными против Т-клеток, может (C57xBALB/c)Fi (H-2b/d) дать возможность для успешной аллотранспланПредварительная обработка реципиентов тации островков грызунам, но такой подход дает трансплантатов слишком одинаковые результаты при общей имРеципиентам трансплантатов предварительно мунссупрессии (Carpenter, С В (1990) N Engl вводят либо нефракционированные аллогенные Med 322, 1224, Roark, J H , et al (1992) селезеночные клетки (C57xBALB/c)Fi(H-2b/d), либо Transplantation 54, 1093, Kahan, B D (1992) Curr элютриированную "фракцию 19" селезеночных Opm Immunol 4, 553) В этом примере толерантклеток малого диаметра, которые очищены от акность к островковым трансплантатам индуцируеттивности АПК (выделены так, как описано выше), ся у реципиента трансплантата посредством малибо моноклональное антитело против gp39 (MR1, нипулирования презентацией аллоантигена Тсм, пример 2, опыт 2), либо комбинацию аллогенклеткам с целью предотвращения их активации ных клеток и антитела против др39 Клетки фракСрок клеток жизнеспособности аллотрансплантации 19 проверяют при двух различных интервалах Ь тов у мышей C57BL/6 (Н-2 ) с "химическим" диабедоз - при малой дозировке в 40 - 44x106 клеток том проверяют, используя методологию, описанили при высокой дозе - 7 7 - 88x106 клеток Конную ниже трольным животным не вводят ни аллогенные клетки, ни антитело Аллогенные клетки вводят Индукция диабета реципиентам трансплантата посредством инъекСамцов мышей C57BL/6J (Н-2Ь) приводят в ции в хвостовую вену за пять - восемь суток до состояние диабета посредством внутривенного трансплантации островкового трансплантата Анвведения стрептозотоцина (140мг/кг) Постоянный титело MR1 вводят при дозе 250мкг/мышь дважды диабет подтверждается демонстрацией конценв неделю, начиная за 7 дней до трансплантации трации глюкозы в плазме, > 400мг/мл, в трех слу 21 44892 22 островков и продолжая в течение 2 - 7 недель или жизнеспособности островкового трансплантата до неблагоприятного исхода трансплантации (среднее = 20 - 19сут, интервал S-неопредел , N = Первую инъекцию антитела обычно дают в тот же 5) Степень пролонгации статистически подобна день, что и первую инъекцию аллогенных селезестепени, достигнутой с применением более высоночных клеток кой дозы одних селезеночных клеток фракции 19, и существенно выше степени, достигнутой в трех Трансплантация островкового трансплантата других группах (р < 0,05) Аллогенные островки BALB/c(H-2d) выделяют модифицированным способом коллагеназного Ряд экспериментов, описанных выше, показыпереваривания (Gottlieb, Р А , et ai (1990) Diabets вает, что одно введение высоких доз фракции 19 39, 643) Островки при дозе 30 островков на г масселезеночных клеток, очищенных от АПК, или ансы тела имплантируют в субренальную капсулу ти-др39 mAb может увеличить срок жизнеспособреципиентной мыши (C57B1/6J (Н-2Ь)) сразу же ности трансплантатов панкреатических островков после выделения Срок жизнеспособности транспри сравнении с отсутствием такого введения плантата определяют по сохранению концентраОднако, любая обработка только одним препарации глюкозы в плазме на уровне < 200мг/мл том не является эффективной при индуцировании у реципиента длительной толерантности к островРезультаты ковым трансплантатам Обнаружено, что комбиВ первой серии экспериментов реципиентам нированное введение автогенных селезеночных островковых трансплантатов предварительно клеток и анти-др39 является более эффективным, вводили либо одни аллогенные селезеночные чем введение одного каждого реагента Результаклетки, либо одно антитело против др39 Как видта приводятся на фиг 2, при этом каждая кривая но на фиг 1, при отсутствии предварительно ввепредставляет данные для отдельной мыши Неденных селезеночных клеток, все островковые заштрихованные значки относятся к реципиентам, трансплантаты отторгаются в пределах 13 суток у которых трансплантаты разрушается самопропосле пересадки (9 ± 2сут, интервал 5 - 13сут N = извольно Заштрихованные значки относятся к 23) Недостаточный срок жизнеспособности остмышам, у которых островковые трансплантаты ровков также наблюдается у животных, которым функционировали при окончании эксперимента вводили только нефракционированные селезеФиг 2 показывает, что неопределенный срок жизночные клетки, содержащие нормальную активнеспособности достигается у всех животных, поность АПК (6 ± Зсут, интервал 4 - 12сут, N = 7), или 6 лучавших в течение 7 недель анти-др39 mAb и низкие дозы (40 - 44x10 клеток) фракции 19, однократную инъекцию фракции 19 - селезеночочищенных от АПК, селезеночных клеток (7 ± Зсут, ных клеток, очищенных от АПК (N = 6) Изменение интервал 3 - 14сут, N = 16) Напротив, инъекция этой схемы путем снижения длительности введеболее высокой дозы фракции 19, очищенные от ния анти-др39 ослабляет, но не отменяет, благоАПК, малых спленоцитов (75 - 88x106 клеток) проприятнее действие на срок жизнеспособности длевает срок жизнеспособности аллотрансплантрансплантата Неопределенный срок жизнеспотатов (19 ± Юсут, интервал 7 - 40сут, N = 16) Этот собности трансплантата достигается у 6/8 рециэффект продолжительности срока жизнеспособпиентов, когда анти-др39 mAb вводят только в ности трансплантата статистически довольно знатечение 2 недель в сочетании с фракцией 19 сечителен (F356 - 17,2, р 330мг/мл) в пределах 3 ляция отличается от популяции фракции 19 тем, суток что содержит доступную измерению функцию АПК Реципиенты этих клеток (N = 6) быстро отОстровковые аллотрансплантаты и природная торгают свои трансплантаты (среднее = 8,5сут, поджелудочная железа исследовались гистологиинтервал 6 - 1 2 ) Другой группе реципиентов чески у всех животных, либо когда трансплантат трансплантатов вводили только моноклональное разрушался, либо по окончании эксперимента антитело против gp39 - MR1 Фиг 1 показывает, Гистологические срезы островковых аллотрансчто островковые аллотрансплантаты выходят из плантатов в почках реципиентов фракциониростроя в пределах 15 дней у 7/11 мышей, получивванных аллогенных малых лимфоцитов и продолших только gp39 mAb Остальные четыре мыши жительного (7 недель) введения mAb MR1 имели фукционирующие трансплантаты при запоказывает обильные интактные островки, видивершении эксперимента на 43 сутки Результаты мые ниже ренальной капсулы, которые лишены показывают, что введение реципиенту одного анмононуклеарной инфильтрации и содержат хоротитела против gp39 MR1 может продлить срок шо гранулированные инсулин- и глюкагонположительные клетки Напротив, гистологиче 23 44892 24 ские срезы островковых аллотрансплантатов в скринируют на реакционноспособность с клоном почках реципиентов, получавших одно анти-др39 активированных крысиных Т-клеток РОМС8 Клон mAb, показывают характернее интенсивное вос2Н8 выражает перекрестную реактивность с этой паление с мононуклеарными клетками и разрушелинией крысиных Т-клеток ние сопутствующих островковых клеток Во всех Опыт 2 Антитела, направленные против чеподжелудочных железах хозяев морфология остловеческого др39 ровков едина со стрептовотоциновым диабетом Процедуру иммунизации, подобную процедуПример 2 Продуцирование и исследование ре, описанной в примере 1, используют для полуантител против др39 чения дополнительных антител, направленных против человеческого др39 Одну мышь Balb/c Опыт 1 Антитела, направленные прожив чеиммунизируют растворимым gp39-CD8 в CFA, и ловеческого др39 впоследствии, 4 недели спустя, ей вводят, активиДля индукции антиген-специфической Трованные в течение 5 часов, человеческие лимклеточкой толерантности у человека предпочтифоциты периферической крови Впоследствии тельно вводить антитело, направленное против мышь ревакцинируют растворимым gp39-CD8 за 4 человеческого др39 Для продуцирования мышидня перед слиянием спленоцитов с клетками ных моноклинальных антител против человечеслияния NS-1 по стандартным протоколам Скриского др39 используют следующую методологию нинг гибридомных клонов осуществляют с помоМышей BALB/c иммунизируют растворимым слищью проточкой цитометрии при окрашивании, актым белком gp39 gp39-CD8 в полном адъюванте тивированных в течение 6 часов, PBL Отбирают Фрейнда (CFA) Затем, спустя 6 недель, мышам клоны, окрашивающие активированные, но не повводят растворимый gp39-CD8 в неполном адъюкоящиеся, человеческие PBL Для дальнейшего ванте Фрейнда (IFA) Растворимый gp39-CD8 дают анализа отбирают 6 клонов - 4D9-8, 4D9-9, 2 4 - 3 1 , в растворимой форме через 4 недели после вто24 - 43, 89 - 76 и 89 - 79 рой иммунизации Затем, 2 неделями позже, мышей ревакцинируют активированными человечеСпецифичность выбранных антител подтверскими лимфоцитами периферической крови, и ждается несколькими анализами Сначала анализ еще через 2 недели их окончательно ревакциниметодом проточной цитометрии показывает, что руют растворимым gp39-CD8 Спленоциты сливавсе 6 mAb скрашивают активированные, но не лись с партнерными клетками слияния MS-1 на 4 покоящиеся, Т-клетки периферической крови (см , сутки после последней иммунизации по протококак характерный пример, фиг ЗБ и ЗВ, показылам иммунизации вавшие окрашивание активированных Т-клеток Клоны, продуцирующие антитела против человеческого др-39, выделяют на основа процесса многократного скрининга Сначала клоны скринируют методом фиксации на бактериологических чашках, используя gp39-CD8 Затем положительные клоны скринируют против контрольного слитого белка CD8 - CD72 - CD8 Клоны, которые отмечены как положительные при анализе фиксации на бактериологических чашках, удаляются Остающиеся клоны затем скринируют с покоящимися и активированными в течение 5 часов человеческими лимфоцитами периферической крови (FBL) с помощью проточного цитометрического анализа Положительными считается гибридомы, окрашивающие активированные, а не покоящиеся PBL Наконец, остающиеся клоны проверяют на их способность блокировать связывание CD40lg с зафиксированным на бактериологический чашках др39 Приблизительно 300 клонов скринируют сначала против gp39-CD8 и CD72 - CD8 при анализе фиксации на бактериологических чашках Обнаружено, что из этих клонов 30 находят фиксированный на чашках др39, но не CD8 Эти клоны затем скринируют для обнаружения др39 на активированных человеческих FBL Приблизительно 15 клонов находят молекулу на активированных PBL, но не покоящихся клетках Далее специфичность подтверждается путем определения способности клонов блокировать связывание CD40lg при таком анализе Такими клонами стали ЗЕ4, 2Н5, 2Н8 такие клоны являются предпочтительными для применения в описанных здесь способах Клоны, которые положительны на активированных, а не на покоящихся PBL, также 4D9-8 и 4D9-9, соответственно) Экспрессия молекулы, распознаваемой каждым из шести антител, обнаруживается в пределах 4 часов после активации, является максимальной через 6 - 8 часов после активации, и не обнаруживается через 24 часа поле активации Все шесть mAb распознают молекулу, выраженную на активированных CD8+PBL, в основном , фенотипа CD4+, но часть СО8+Т-клеток также экспрессируют молекулу Экспрессия молекулы, распознаваемой этими шестью антителами, ингибируются присутствием в культуральной среде циклоспорина А, как и экспрессия др39 (см , например, фиг 4А и 4Б, показывающих, окрашивание Т-клеток, обработанных циклоспорином, 4D98 и 4D9-9, соответственно) Кинетика и распространение экспрессии молекулы, распознаваемой этими mAb, идентичны этим параметрам др39, который находит слитый белок человеческого CD40lg Кроме того, все шесть моноклинальных антител блокируют окрашивание gp39 CD40lg (см , например, фиг 5А и 5В, на которых показывается ингибирование окрашивания др39 CD40lg в присутствии 4D9-8 и 4D9-9, соответственно) При анализе по методу ELISA все шесть mAb распознают gp39-CD8, растворимую слитую форму молекулы др39 Кроме того, все шесть mAb образуют иммунопреципитат молекулы приблизительно в 35кд из меченых 353-метионином активированных человеческих PBL Иммунопреципитированная молекула идентична молекуле, преципитированной слитым белком CD10lg Функциональную активность шести выбранных моноклональных антител (4D9-8, 4D9-9, 24 31, 24 - 43, 89 - 76 и 89 - 79) проверяют следую 25 44892 26 щим образом Сначала определяют способность CD8 активированными Т-клетками и IL-2 ОчищенmAb ингибировать пролиферацию очищенных ные lgD+ человеческие В-клетки получают позичеловеческих В-клеток, выращенных с IL-4 и растивной селекцией с клеточным сортером с возбутворимым др39 Очищенные человеческие Тждением флюоресценции (FACS), и затем клетки выращивают с др39 и IL-4 в присутствии культивируют с анти-С08 активированными челоили в отсутствии очищенных моноклональных веческими Т-клетками (обработанными митомиантител или CD40lg при дозах от 0 до 12,5мкг/мл цином С) и IL-2 в течение 6 суток в присутствии Пролиферацию В-клеток определяют через 3 дня или в отсутствии очищенных моноклональных после введения в культуру тимидина Результаты антител против др39 при дозировке от 0 до (приводятся на фиг 6) показывают, что все шесть 10мкг/мл На 6 сутки методом ELISA проверяют mAb могут ингибировать пролиферацию В-клеток продуцирование IgM, IgG и IgA Результаты (даявляются mAb 89 - 75 и 24 - 31 ются ниже в табл 1) показывают, что все шесть антител могут ингибировать Т-клеточноЗатем проверяют способность mAb ингибирзависимою В-клеточную дифференцировку, при свать В-клеточную дифференцировку при измереизмерении по продуцированию IgM, IgG и IgA нии по продуцированию Ig, индуцированного антиТаблица 1 Продуцирование иммуноглобулина Production of Immunoglobulm mAb none нет 4D9-8 ug/ml IgM IgG IgA 17,500 6710 4471 0,1 1,0 4813 4394 2130 2558 389 919 1233 448 981 314 596 4132 2130 1232 1069 352 551 1924 460 135 2819 1519 396 1731 1606 266 344 165 23 432 192 1081 344 171 19 3021 156 434 10,0 4D9-9 24-31 24-43 89-76 89-79 1081 3594 2659 374 3863 1287 1120 6227 3193 7021 3783 2180 818 9763 2314 183 0,1 1,0 10,0 0,1 1,0 10,0 0,1 1,0 10,0 0,1 1,0 10,0 0,1 1,0 10,0 Чтобы проверить влияние тАЬ против gp39 на Т-клеточные реакции, моноклональные антитела включает в стандартные реакции смешанной культуры лимфоцитов (СКЛ) Культивируют 300000 человеческих лимфоцитов периферической крови (респондеры = Р) со 100000 облученных аллогенных лимфоцитов периферической крови (стимуляторы = С) в присутствии или в отсутствии mAb против др39 (10мкг/мл) Культуры метят импульсно ЗН-тимидином на 4, 5 и 6 сутки, и через 18 часов собирают клетки, выросшие в культуре Все шесть mAb против человеческого др39 ингибируют аллоспецифические реакции при измерении по СКЛ (см , как характерный пример, фиг 7, показывающий ингибирование аллоспеци фических реакций, когда Р и С инкубируются в присутствии 24 - 31 или 89 - 76, для положительного контроля используют слитый белок CTLA4иммуноглобулин и mAb против CD28) Чтобы определить, распознают ли все шесть моноклональных антител определенные эпитопы на молекуле человеческого др39, осуществляют эксперименты с перекрестным блокированием Сначала активированные человеческие PBL блокируют каждым из шести mAb (25мкг/мл) Клетки промывают и затем окрашивают 10мкг/мл биотинилированного антитела, после чего следует реакция с фитоэритринилированным авидином (РЕAv) Окрашивание клеток PE-Av анализируют FACS Результаты приводятся ниже в табл 2 Таблица 2 Блокирование нет 4D9-8 +++ 4D9-9 +++ Окрашивающее антитело 24-31 24-43 ++++ ++++ 89-76 ++++ 89-79 ++++ 27 4D9-8 4D9-9 24-31 24-43 89-76 89-79 ND +++ + + + + 44892 ++++ +++ ND +++ +++ +++ ND + + ++ Беч К.Ї5-ИЖ L 1 ЦІ !~T—• 25Й ^ СМ=Й31 ч * ' 433.4 4ЭЛ CV = 13.7 %• 47.6 ( ^•^3|Sx wUi3) ФІ. і L\ ! Ц 1 28 +++ +++ ++ ++ ND +++ | антитело протиэ дрзз' І23 -1 . . 1 1 ц г, о 20 . FLIrKVf Фиг. 1 +++ +++ ++ + +++ ND Хомяков иммунизируют интраперитонально 6 5 10 активированных Thi-клеток (dl 6) с недельными интервалами в течение шести недель Когда сывороточный титр против мышиных Th1 превышает 1 10000, осуществляют слияние клеток с полиэтиленгликолем, используя иммунные хомячьи спленсциты и MS-1 Супернатант от клеток, содержащих растущие гибридомы, скринируют проточной цитометрией на покоящихся и активированных Th1 Одну, особую гибридому, которая продуцирует Mab, которое селективно распознает активированные Тп, затем тестируют и субклонируют, чтобы получить MR1 MR1 получают в асците и очищают ионообменной ВЭЖХ Гибридома MR1 депонирована Американской коллекцией типовых культур, и ей присвоен инвентарный номер НВ11048 Эквиваленты Специалисты в этой области техники увидят или смогут осуществить, используя самые обычные экспериментальные методы, много эквивалентов конкретных вариантов осуществления настоящего изобретения, описанных здесь Такие эквиваленты рассматриваются как входящие в объем приведенной ниже формулы изобретения Все ссылки и опубликованные заявки на патенты, цитированные в настоящей заявке, включены в нее в качестве ссылок Интенсивность окрашивания и процент положительных клеток обозначаются знаком + (++++ = Ml > 200, +++ = Ml > 125, ++ = Ml > 25, - = нет окрашивания выше среды) ND = не определялось Все антитела блокируют связывание CD40lg с активированными человеческими PBL Однако, данные, приведенные в табл 2, ясно показывают неэффективность некоторых антител при блокировке связывания других антител с активированными человеческими PBL, что приводит к предположению, что они распознают отдельные эпитопы на молекулах человеческого др39 Гибридомы 89 - 76 и 24 - 31, продуцирующие антитела 89 - 75 и 24 - 31, соответственно, депонированы в соответствии с Будапештским договором в Американской коллекции типовых культур, Parklawn Drive, Роквилл, Мэриленд, 2 сентября 1994 Гибридоме 89 - 76 присвоен инвентарный номер АТСС НВ11713, и гибридоме 24 - 31 присвоен ивентарный номер АТСС НВ11712 Опыт 3 Антитела, направленные против мышиного др39 В одном из вариантов осуществления настоящего изобретения антагонистом др39 является моноклональное антлтело против мышиного др39 - MR1 Для продуцирования монокленального антитела MR1 применяется описанный ниже способ, и его можно использовать для генерации других антител, направленных на др39 'Ї ++++ ++++ +++ ND +++ +++ ВЫсота Фиг. ЗБ 44892 29 30 = 431 9 563 = £0.0 cv = 51 S % :t 1—і гв г ФИГ. 2А еле>• клеток : 600 500 mni щ і 7 недг. 0 30Q 10" 1 203 FLI 10D0 -10 О 10 20 ЗО
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61K 38/17, A61K 39/395
Мітки: донорської, діабету, лікування, індукування, спосіб, тканини, варіанти, т-клітинної, органа, толерантності
Код посилання
<a href="https://ua.patents.su/16-44892-sposib-indukuvannya-t-klitinno-tolerantnosti-do-donorsko-tkanini-abo-organa-varianti-sposib-likuvannya-diabetu.html" target="_blank" rel="follow" title="База патентів України">Спосіб індукування т-клітинної толерантності до донорської тканини або органа (варіанти), спосіб лікування діабету</a>
Попередній патент: Спосіб окиснення ароматичної сполуки з використанням закису азоту
Наступний патент: Спосіб виготовлення щіткового виробу та щітковий виріб, виготовлений за цим способом
Випадковий патент: Спосіб лікування хворих на варикозну хворобу нижніх кінцівок, асоційовану з недиференційованою дисплазією сполучної тканини