4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-алкокси-3-хінолінкарбонітрили для лікування ішемічного ушкодження
Номер патенту: 80472
Опубліковано: 25.09.2007
Автори: Бошеллі Френк Чарльз, Залеска Маргарет Марія, Бошеллі Дайан Харріс, Арндт Кім Тімоті
Формула / Реферат
1. Спосіб забезпечення нейропротективної дії у хворого після виявлення цереброваскулярного ішемічного симптому (події), що включає введення терапевтично ефективної кількості сполуки формули
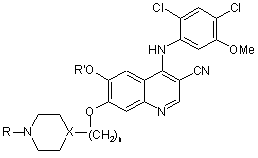 І,
І,
де:
Х являє собою N, СН,
n дорівнює цілому числу від 1 до 3; і
R' і R незалежно являють собою С1-3алкільні групи, і її фармацевтично прийнятної солі; за умови, що коли n дорівнює 1, Х не є N.
2. Спосіб інгібування неврологічних дефіцитних станів у хворого після виявлення цереброваскулярного ішемічного симптому, що включає введення терапевтично ефективної кількості сполуки формули:
 І,
І,
де:
Х являє собою N, СН,
n дорівнює цілому числу від 1 до 3; і
R' і R незалежно являють собою С1-3алкільні групи, і її фармацевтично прийнятної солі; за умови, що коли n дорівнює 1, Х не є N.
3. Спосіб скорочення об'ємів інфаркту у хворого після цереброваскулярної ішемічної події, що включає введення терапевтично ефективної кількості сполуки формули:
 ,
,
де:
X являє собою N, СН,
n дорівнює цілому числу від 1 до 3; і
R' і R незалежно являють собою С1-3алкільні групи, і її фармацевтично прийнятної солі; за умови, що коли n дорівнює 1, Х не є N.
4. Спосіб інгібування постішемічної судинної проникності мозкових кровоносних судин у хворого, що страждає на цереброваскулярний стан, який включає введення терапевтично ефективної кількості сполуки формули:
 I,
I,
де:
Х являє собою N, СН,
n дорівнює цілому числу від 1 до 3; і
R' і R незалежно являють собою С1-3алкільні групи, і її фармацевтично прийнятної солі; за умови, що коли n дорівнює 1, Х не є N.
5. Спосіб за будь-яким з пп. 1-4, де R' являє собою метил.
6. Спосіб за будь-яким з пп. 1-5, де R являє собою метил або етил.
7. Спосіб за будь-яким з пп. 1-6; де Х являє собою N.
8. Спосіб за будь-яким з пп. 1-6, де Х являє собою СН.
9. Спосіб за будь-яким з пп. 1-4, де сполука являє собою:
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7-[3-(4-метил-1-піперазиніл)пропокси]-3-хінолінкарбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-[3-(4-етил-1-піперазиніл)пропокси]-6-метокси-3-хінолінкарбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7-[2-(4-метил-1-піперазиніл)етокси]-3-хінолінкарбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-[2-(4-етил-1-піперазиніл)етокси]-6-метокси-3-хінолінкарбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7-[(1-метилпіперидин-4-іл)метокси]-3-хінолінкарбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7-[2-(1-метилпіперидин-4-іл)етокси]-3-хінолінкарбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7-[3-(1-метилпіперидин-4-іл) пропокси]хінолін-3-карбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-[(1-етилпіперидин-4-іл)метокси]-6-метоксихінолін-3-карбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-етокси-7-[3-(4-метилпіперазин-1-іл)пропокси]хінолін-3-карбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-етокси-7-[(1-метилпіперидин-4-іл)метокси]хінолін-3-карбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-етокси-7-[3-(4-етилпіперазин-1-іл)пропокси]хінолін-3-карбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-етокси-7-[3-(1-метилпіперидин-4-іл)пропокси]хінолін-3-карбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-етокси-7-[2-(4-метил-1-піперазиніл)етокси]хінолін-3-карбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-етокси-7-[2-(1-метилпіперидин-4-іл)етокси]хінолін-3-карбонітрил або
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7-[3-(4-пропіл-1-піперазиніл)пропокси]-3-хінолінкарбонітрил; і їх фармацевтично прийнятні солі.
10. Спосіб за будь-яким з пп. 1-9, в якому сполуку вводять між приблизно 6 і приблизно 24 годинами після ішемічної події.
11. Спосіб за будь-яким з пп. 1-10, в якому терапевтично ефективна кількість складає від приблизно 1 мг/кг до приблизно 30 мг/кг.
12. Спосіб за будь-яким з пп. 1-11, що включає введення сполуки формули І внутрішньовенно.
13. Спосіб за будь-яким з пп. 1-12, в якому пацієнтом є людина.
14. Спосіб за будь-яким з пп. 1-13, в якому ішемічна подія є транзиторною.
15. Спосіб за будь-яким з пп. 1-13, в якому ішемічна подія є гострою.
16. Спосіб за будь-яким з пп. 1-15, в якому ішемічна подія (стан) являє собою інсульт, травму голови, травму спинного мозку, загальну аноксію або гіпоксію.
17. Спосіб за будь-яким з пп. 1-15, в якому ішемічна подія відбувається під час внутрішньочерепного крововиливу, перинатальної асфіксії, зупинки серця або епілептичного статусу.
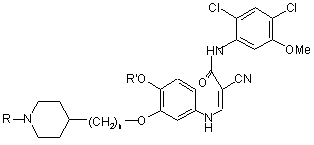
18. Сполука формули:
 I,
I,
де:
n дорівнює цілому числу від 1 до 3; і
R' і R незалежно являють собою С1-3алкільні групи, і її фармацевтично прийнятні солі.
19. Сполука за п. 18, де R' являє собою метил.
20. Сполука за п. 18 або п. 19, де R являє собою метил або етил.
21. Сполука, яка являє собою:
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7-(1-метилпіперидин-4-іл)метокси]-3-хінолінкарбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7-[2-(1-метилпіперидин-4-іл)етокси]-3-хінолінкарбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7-[3-(1-метилпіперидин-4-іл)пропокси]хінолін-3-карбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-[(1-етилпіперидин-4-іл)метокси]-6-метоксихінолін-3-карбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-етокси-7-[(1-метилпіперидин-4-іл)метокси]хінолін-3-карбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-етокси-7-[3-(1-метилпіперидин-4-іл)пропокси]хінолін-3-карбонітрил або
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-етокси-7-[2-(1-метилпіперидин-4-іл)етокси]хінолін-3-карбонітрил;
та їх фармацевтично прийнятні солі.
22. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 18-21 і фармацевтично прийнятний носій або ексципієнт.
23. Фармацевтична композиція, що містить інгібуючу судинну проникність кількість сполуки за будь-яким з пп. 1-9 і фармацевтичний носій або ексципієнт.
24. Композиція за п. 21 у внутрішньовенній дозованій формі.
25. Спосіб отримання сполуки за будь-яким з пп. 18-21, що включає:
(а) взаємодію хіноліну формули
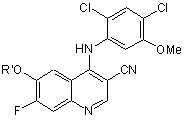 ,
,
де R' має значення, як визначено в п. 18, зі спиртом формули
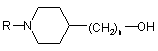 ,
,
де R і n мають значення, як визначено в п. 18,
або (b) взаємодію хіноліну формули
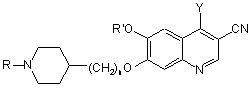 ,
,
де R, R' і n мають значення, як визначено в п. 18, і Y являє собою галоген, з аніліном формули
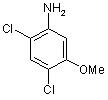 ,
,
або (с) циклизацію сполуки формули
 ,
,
де R, R' і n мають значення, як визначено в п. 18, з отриманням необхідного хіноліну.
26. Застосування сполуки за будь-яким з пп. 1-9 для отримання лікарського препарату для забезпечення нейропротективної дії у хворого після вияву цереброваскулярного ішемічного симптому, інгібування неврологічних розладів у хворого після вияву цереброваскулярного ішемічного симптому (події), скорочення об'ємів інфаркту у хворого після вияву цереброваскулярного ішемічного симптому або інгібування постішемічної судинної проникності мозкових кровоносних судин у хворого, що страждає на цереброваскулярний стан.
Текст
1. Спосіб забезпечення нейропротективної дії у хворого після виявлення цереброваскулярного ішемічного симптому (події), що включає введення терапевтично ефективної кількості сполуки формули 2 3 80472 Cl Cl HN R'O O R N X OM e CN N (C H2)n , де: X являє собою N, СН, n дорівнює цілому числу від 1 до 3; і R' і R незалежно являють собою С 1-3алкільні групи, і її фармацевтично прийнятної солі; за умови, що коли n дорівнює 1, Х не є N. 4. Спосіб інгібування постішемічної судинної проникності мозкових кровоносних судин у хворого, що страждає на цереброваскулярний стан, який включає введення терапевтично ефективної кількості сполуки формули: Cl Cl HN R'O O R N X (C H2)n OM e CN N I, де: Х являє собою N, СН, n дорівнює цілому числу від 1 до 3; і R' і R незалежно являють собою С 1-3алкільні групи, і її фармацевтично прийнятної солі; за умови, що коли n дорівнює 1, Х не є N. 5. Спосіб за будь-яким з пп. 1-4, де R' являє собою метил. 6. Спосіб за будь-яким з пп. 1-5, де R являє собою метил або етил. 7. Спосіб за будь-яким з пп. 1-6; де Х являє собою N. 8. Спосіб за будь-яким з пп. 1-6, де Х являє собою СН. 9. Спосіб за будь-яким з пп. 1-4, де сполука являє собою: 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7[3-(4-метил-1-піперазиніл)пропокси]-3хінолінкарбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-[3-(4-етил1-піперазиніл)пропокси]-6-метокси-3хінолінкарбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7[2-(4-метил-1-піперазиніл)етокси]-3хінолінкарбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-[2-(4-етил1-піперазиніл)етокси]-6-метокси-3хінолінкарбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7[(1-метилпіперидин-4-іл)метокси]-3хінолінкарбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7[2-(1-метилпіперидин-4-іл)етокси]-3хінолінкарбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7[3-(1-метилпіперидин-4-іл) пропокси]хінолін-3карбонітрил; 4 4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-[(1етилпіперидин-4-іл)метокси]-6-метоксихінолін-3карбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-етокси-7[3-(4-метилпіперазин-1-іл)пропокси]хінолін-3карбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-етокси-7[(1-метилпіперидин-4-іл)метокси]хінолін-3карбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-етокси-7[3-(4-етилпіперазин-1-іл)пропокси]хінолін-3карбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-етокси-7[3-(1-метилпіперидин-4-іл)пропокси]хінолін-3карбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-етокси-7[2-(4-метил-1-піперазиніл)етокси]хінолін-3карбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-етокси-7[2-(1-метилпіперидин-4-іл)етокси]хінолін-3карбонітрил або 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7[3-(4-пропіл-1-піперазиніл)пропокси]-3хінолінкарбонітрил; і їх фармацевтично прийнятні солі. 10. Спосіб за будь-яким з пп. 1-9, в якому сполуку вводять між приблизно 6 і приблизно 24 годинами після ішемічної події. 11. Спосіб за будь-яким з пп. 1-10, в якому терапевтично ефективна кількість складає від приблизно 1 мг/кг до приблизно 30 мг/кг. 12. Спосіб за будь-яким з пп. 1-11, що включає введення сполуки формули І вн утрішньовенно. 13. Спосіб за будь-яким з пп. 1-12, в якому пацієнтом є людина. 14. Спосіб за будь-яким з пп. 1-13, в якому ішемічна подія є транзиторною. 15. Спосіб за будь-яким з пп. 1-13, в якому ішемічна подія є гострою. 16. Спосіб за будь-яким з пп. 1-15, в якому ішемічна подія (стан) являє собою інсульт, травму голови, травму спинного мозку, загальну аноксію або гіпоксію. 17. Спосіб за будь-яким з пп. 1-15, в якому ішемічна подія відбувається під час внутрішньочерепного крововиливу, перинатальної асфіксії, зупинки серця або епілептичного статусу. 18. Сполука формули: Cl Cl HN R'O O R N X (CH 2)n OM e CN N I, де: n дорівнює цілому числу від 1 до 3; і R' і R незалежно являють собою С 1-3алкільні групи, і її фармацевтично прийнятні солі. 19. Сполука за п. 18, де R' являє собою метил. 20. Сполука за п. 18 або п. 19, де R являє собою метил або етил. 21. Сполука, яка являє собою: 5 80472 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7(1-метилпіперидин-4-іл)метокси]-3хінолінкарбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7[2-(1-метилпіперидин-4-іл)етокси]-3хінолінкарбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7[3-(1-метилпіперидин-4-іл)пропокси]хінолін-3карбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-[(1етилпіперидин-4-іл)метокси]-6-метоксихінолін-3карбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-етокси-7[(1-метилпіперидин-4-іл)метокси]хінолін-3карбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-етокси-7[3-(1-метилпіперидин-4-іл)пропокси]хінолін-3карбонітрил або 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-етокси-7[2-(1-метилпіперидин-4-іл)етокси]хінолін-3карбонітрил; та їх фармацевтично прийнятні солі. 22. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 18-21 і фармацевтично прийнятний носій або ексципієнт. 23. Фармацевтична композиція, що містить інгібуючу судинну проникність кількість сполуки за будьяким з пп. 1-9 і фармацевтичний носій або ексципієнт. 24. Композиція за п. 21 у внутрішньовенній дозованій формі. 25. Спосіб отримання сполуки за будь-яким з пп. 18-21, що включає: (а) взаємодію хіноліну формули Cl Cl HN R'O F OMe CN N 6 де R' має значення, як визначено в п. 18, зі спиртом формули R N (CH 2) n OH , де R і n мають значення, як визначено в п. 18, або (b) взаємодію хіноліну формули Y R'O R N CN (CH2 )nO N , де R, R' і n мають значення, як визначено в п. 18, і Y являє собою галоген, з аніліном формули NH2 Cl OM e Cl , або (с) циклизацію сполуки формули Cl Cl HN R'O R N (CH2 )n O O OMe CN N H , де R, R' і n мають значення, як визначено в п. 18, з отриманням необхідного хіноліну. 26. Застосування сполуки за будь-яким з пп. 1-9 для отримання лікарського препарату для забезпечення нейропротективної дії у хворого після вияву цереброваскулярного ішемічного симптому, інгібування неврологічних розладів у хворого після вияву цереброваскулярного ішемічного симптому (події), скорочення об'ємів інфаркту у хворого після вияву цереброваскулярного ішемічного симптому або інгібування постішемічної судинної проникності мозкових кровоносних судин у хворого, що страждає на цереброваскулярний стан. , Інсульт є третьою з основних причин смерті та головною причиною інвалідності в США, де кожного року відбувається приблизно 750000 інсультів. Приблизно 80% від цього числа складають ішемічні інсульти, а первинні внутрішньомозкові геморагічні інсульти приблизно 15-20%. До даного часу єдиним схваленим ефективним лікуванням гострого ішемічного мозкового інфаркту є тромболітична терапія за допомогою внутрішньовенного введення t-PA-рекомбінантного тканинного активатора плазміногена. Користь від цього лікування надзвичайно обмежена. Його необхідно проводити в межах тригодинного вікна від появи симптомів, у той час як більшість пацієнтів шукає та/або отримує лікування з істотною затримкою. Крім того, лікування t-PA супроводжується підвищеним ризиком внутрішньомозкового крововиливу - потенційно руйнівного ускладнення. Перед лікуванням необхідно виключити крововилив, а протягом лікування t-PA і після нього треба ретельно управляти кро в'яним тиском і монітору вати його. В даний час в наявності немає нейропротективної терапії для лікування ішемічного інсульту, геморагічного інсульту або мозкової травми. Потреба у нових способах лікування інсульту та інших станів, пов'язаних з судинною проникністю, дуже велика. Відповідно до даного винаходу пропонуються сполуки структурної формули: де: X являє собою N, СН п дорівнює цілому числу від 1 до 3; і 7 80472 R' і R незалежно являють собою С1_3алкільні групи, та їх фармацевтично прийнятні солі, за умови, що якщо n дорівнює 1, X не є N. Приклади С 1_3алкільних гр уп включають метил, етил, н-пропіл та ізопропіл. У деяких переважних варіантах здійснення винаходу R' є метилом. В інших переважних варіантах здійснення винаходу R' являє собою метил або етил. У подальших варіантах здійснення винаходу n дорівнює 2 або 3. X переважно являє собою N в деяких переважних варіантах здійснення винаходу. В інших переважних варіантах здійснення X являє собою СН. Фармацевтично прийнятні солі являють собою солі, які отримані з таких органічних і неорганічних кислот, як оцтова, молочна, карбонова, лимонна, корична, винна, бурштинова, фумарова, малеїнова, малонова, мигдалева, яблучна, щавлева, пропіонова, хлорводнева, бромводнева, фосфорна, азотна, сірчана, гліколева, піровиноградна, метансульфонова, етансульфонова, толуолсульфонова, саліцилова, бензойна та подібні відомі прийнятні кислоти. Конкретні сполуки за винаходом включають: 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6метокси-7-[3-(4-метил-1-піперазиніл)пропокси]-3хінолінкарбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-[3-(4етил-1-піперазиніл)пропокси]-6-метокси-3хінолінкарбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6метокси-7-[2-(4-метил-1-піперазиніл)етокси]-3хінолінкарбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-[2-(4етил-1-піперазиніл)етокси]-6-метокси-3хінолінкарбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6метокси-7-[(1-метилпіперидин-4-іл)метокси]-3хінолінкарбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6метокси-7-[2-(1-метилпіперидин-4-іл)етокси]-3хінолінкарбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6метокси-7-[3-(1-метилпіперидин-4іл)пропокси]хінолін-3-карбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-[(1етилпіперидин-4-іл)метокси]-6-метоксихінолін-3карбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6етокси-7-[3-(4-метилпіперазин-1іл)пропокси]хінолін-3-карбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6етокси-7-[(1-метилпіперидин-4-іл)метокси]хінолін3-карбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6етокси-7-[3-(4-етилпіперазин-1-іл)пропокси]хінолін3-карбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6етокси-7-[3-(1-метилпіперидин-4іл)пропокси]хінолін-3-карбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6етокси-7-[2-(4-метил-1-піперазиніл)етокси]хінолін3-карбонітрил; 8 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6етокси-7-[2-(1-метилпіперидин-4-іл)етокси]хінолін3-карбонітрил і 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6метокси-7-[3-(4-пропіл-1-піперазиніл)пропокси]-3хінолінкарбонітрил; та їх фармацевтично прийнятні солі. Також наданий спосіб отримання сполук формули І, де X являє собою СН, і всі інші групи є такими, як визначено вище, що включає: (а) взаємодію хіноліну формули де R1 визначений вище, зі спиртом формули R-N^-fCH^OH де R та п є такими, як визначено вище, необов'язково в присутності основи, наприклад, гідриду натрію або натрію, або (Ь) взаємодія хіноліну формули де R, R' і n є такими, як визначено вище, і Y являє собою хлор або бром, з аніліном формули необов'язково у прийнятній основі, наприклад, гідриді натрію або гідрохлориді піридину або (с) циклизацію сполуки формули в необхідний хінолін, переважно в безводних умовах, наприклад, з використанням оксихлориду фосфор у в ацетонітрилі, бутиронітрилі, толуолі або ксилолі, зі спиртами або амінними основами як каталізаторами, при прийнятній температурі, наприклад, 80-110°С, як описано [в патенті США 06/496191]. Сполуки за винаходом отримують як проілюстровано нижче. Сполуки за даним винаходом отримували з: (а) комерційно доступних вихідних речовин, (b) відомих вихідних речовин, які можуть бути отримані, як описано в літературних методиках або (с) нових проміжних сполук, наведених на схемах і в експериментальних методиках даного опису. Реакції здійснювали у розчиннику, що відповідає реактивам і речовинам, які використовуються, та є прийнятним для перетворення, що проводиться. Фахівцям в галузі органічного синтезу буде очевидно, що функціональні групи, присутні в молекулі, повинні бути сумісними з передбачуваними 9 80472 10 хімічними перетвореннями. Якщо не обумовлено особливо, то порядок стадій синтезу, вибір захисних гр уп і умов видалення захисту легко стане ясним для фахівців в даній галузі. Крім того, в деяких випадках замісники в початкових речовинах можуть бути несумісними з певними умовами реакції. Обмеження, що відносяться до даних замісників, будуть очевидні фахівцеві в даній галузі. Реакції проводили в інертній атмосфері, де це було доречно. Сполуки формули І отримували відповідно до схеми 1. Сполуки формули І, де R' являє собою метил, X є N і n=3, легко отримати обробкою 7-(3хлорпропокси)-4-[(2,4-дихлор-5метоксифеніл)аміно]-6-метокси-3хінолінкарбонітрилу, 1, N-алкілпіперазином, таким як N-метилпіперазин, N-етилпіперазин або N пропілпіперазин, в присутності йодиду натрію або в чистому вигляді, або в розчиннику, такому як диметиловий ефір етиленгліколю. Отримання цих сполук описане в літературі [Boschelli, D.H. et al., J. Med. Chem., 44, 3965 (2001)]. Аналогічно, сполуки формули І, де R' являє собою Me, X є N і n=2, легко можуть бути отримані обробкою 7-(2-хлоретокси)-4-[(2,4-дихлор-5метоксифеніл)аміно]-6-метокси-3хінолінкарбонітрилу, 2, N-метил або Nетилпіперазином в присутності йодиду натрію або в чистому вигляді, або в розчиннику, такому як диметиловий ефір етиленгліколю. Отримання цих сполук описане в літературі [Ye, F. et. al., 221th National Meeting of the American Chemical Society, San Diego, California (April, 2001)]. Альтернативно сполуки формули І можуть бути отримані через проміжний продукт 7-фтор-3хінолінкарбонітрил. Отримання цього основного проміжного продукту показане на Схемі 2. Аніліни формули 3 можуть бути піддані реакції з діетил(етоксиметилен)малонатом або в чистому вигляді, або в присутності співрозчинника, такого як толуол, за температури від 60 до 120°С. Подальша теплова циклізація, переважно в системі розчинників, такій як суміш дифенілового ефіру та біфенілу, 3:1, за підвищеної температури, такої як 260°С, дає сполуки формули 4. Гідроліз складноефірної групи переважно в основних умовах, таких як гідроксид натрію, в спиртовому розчиннику, такому як етанол, за підвищених температур приводить до сполук формули 5. Перетворення кислотної групи в первинний амід може бути досягнуто обробкою активуючим агентом, таким як 1,1карбонілдіімідазол з подальшим додаванням газо подібного аміаку або, переважно, водного розчину гідроксиду амонію. Сполуки формули 7 отримують дегідратацією первинної аміногрупи сполук формули 6 реактивом, таким як ціанурхлорид, в розчиннику, такому як N,N-диметилформамід. Альтернативно, аніліни формули 3 можуть бути оброблені етил(етоксиметилен)ціаноацетатом, або в чистому вигляді, або в присутності співрозчинника, такого як толуол, за температури від 60 до 120°С. Подальша теплова циклізація, переважно в системі розчинників, такій як суміш дифенілового ефіру та біфенілу, 3:1, за підвищеної температури, такої як 260°С, дає сполуки формули І. Сполуки формули 8 отримують взаємодією сполук 7 з хлоруючим агентом, таким як оксихлорид фосфору. Основні 7-фтор проміжні продукти 9 отримують обробкою сполук формули 8 2,4-дихлор-5метоксіаніліном у присутності гідрохлориду піридину. 11 80472 12 Альтернативний шлях отримання сполук формули 8, де R' являє собою етил, показаний на Схемі 3. При використанні умов схеми 2 4бензилокси-3-фторанілін перетворюють у сполуку формули 10. Видалення бензильної групи тіоані золом і трифтороцтовою кислотою приводить до 6-гідроксипохідного формули 11. Обробка сполук 11 трифенілфосфіном, діетилазодикарбоксилатом і етанолом дає сполуку формули 8, де R' являє собою етил. Як показано на Схемі 4, реакція сполук формули 9 зі спиртом формули 12 в присутності основи, такої як гідрид натрію або натрій, забезпечує сполуки формули І за винаходом. Ця реакція може бути проведена в присутності співрозчинника, такого як диметилформамід або диметилсульфоксид, за оптимальної температури від 120°С до 140°С. 13 80472 14 Сполуки за даним винаходом були оцінені в декількох стандартних фармакологічних випробуваннях, які показали, що сполуки за даним винаходом інгібують Src кіназу та корисні для запобігання судинній проникності. Аналіз кінази Src Інгібітори тирозинкіназної активності Src (частково очищений препарат ферменту, придбаний у Upstate Biotechnologies, Lake Placid, NY) були проаналізовані в форматі твердофазного імуноферментного аналізу (ELISA). Для аналізу використали набір Boehringer Mannheim Tyrosine Kinase Assay (Roche Diagnostics, Basel, Switzerland) з cdc2 пептидом субстрат, що містить Тугі5. Щоб виявити фосфорильований пептид за допомогою кольорової реакції, використали антитіла до фосфотирозину, кон'юговані з пероксидазою хріну (HRP). Умови реакції: аліквоти по п'ять мікролітрів кожної сполуки, свіжоотриманої до часу аналізу, додавали у вигляді розчину в 10мМ HEPES рН 7,5, 10% диметилсульфоксиді (ДМСО) в реакційну ямку. Тридцять п'ять мікролітрів реакційної суміші, що містить Src, буфер і суміш пептид/бичачий сироватковий альбумін, додавали до ямки зі сполукою та інкубували за 30°С протягом 10 хвилин (реакційний буфер: 50 мМ TrisHCl рН 7,5, 10мМ MgCl2, 0,1мМ EGTA, 0,5мМ Na3 Vo4). Реакцію починали шляхом введення 10 мікролітрів АТФ (500 мМ), інкубували за 30°С протягом 1 години та зупиняли додаванням 20 мікролітрів 0,5М EDTA. Реакційну суміш з фосфорильованим пептидом потім переміщували на мікротитрувальний планшет, вкритий стрептавідином, і давали можливість зв'язування протягом 20 хвилин. Незв'язаний пептид і реакційну суміш зливали і пластину шість разів промивали забуференим фосфатом сольовим розчином. Кон'юговані з пероксидазою хріну антитіла до фосфотирозину, що поставляються в комплекті, інкубували з планшетом протягом однієї години, потім зливали. Пластину знов шестиразово промивали забуференим фосфатом сольовим розчином. Додавали субстрат і вимірювали оптичну густину при 405нм. Альтернативно, використовували аналіз, виконаний по суті, як описано вище, крім формату Delfia (Perkin-Elmer), і замість кон'югованих з пероксидазою хріну антитіл до фосфотирозину використовували кон'юговані з європієм антитіла до фосфотирозину, замість бичачого сироваткового альбуміну використовували Pierce Superblock, і після реакції кінази та зв'язування антитіл проводили 6 промивань. Для моніторинга ступеня реакції використовували флюоресценцію європію. Активність визначали як % інгібування, який обчислювали за формулою: (1 Abs/Abs(MaKc))×l00=% інгібування. Якщо використали численні концентрації речовини, що випробовують, можливе визначення ІС5о (концентрації, яка дає 50% інгібування). Як показано в Таблиці 1, сполуки за винаходом інгібують src кіназу in vitro. Незалежний від фіксації Src-трансформований аналіз проліферації фібробластів Фібробласти Rat2, стабільно трансформовані плазмідою, що містить промотор CMV, контролювали v-Src/Hu c-Src ген злиття, в якому замість vSrc каталітичного домена в v-Src гені вставляли каталітичний домен людського c-Src таким чином: Клонування та плазмідні конструкції. Prague С v-Src ген з pSrcHis (Wendler and Boschelli, Oncogene 4: 231-236; 1989), вирізали за допомогою Ncol і BamHI, обробляли ДНКполімеразою Т4 та клонували в ділянці Rl pTRE (Clontech), кінці якого затупляли обробкою ДНКполімеразою Т4. Злиття v-Src::huc-Src створювали шляхом заміни фрагмента Bgl2-Xbal, що кодує Скінець 250 амінокислот v-Src, фрагментом Bgl2Xbal, що містить v-Src::huc-Src фрагмент злиття (див. нижче). Частковий клон людського c-Src ампліфікували з бібліотеки комплементарної ДНК молочної залози (InVitrogen) з використанням пари олігонуклеотидів i клонували в pCRScript (Stratagene). Каталітичний домен людського c-Src в цьому клоні ампліфікували за допомогою цих олігонуклеотидів (злиття vsrc нуклеотиду 734 з людським c-Src нуклеотидом 742 і людського c-Src нуклеотиду 1551 з v-src нук леотидом 1543 в v-Src і людських c-Src відкритих рамок зчитування). Дві v-Src послідовності ампліфікували полімеразною ланцюговою реакцією [ПЛР] (5! Фрагмент v-src з 198 пар основ: 15 80472 1769-1794 з v-src ATG з Xbal і додавали ділянки рестрикції EcoRI (праймер 4)). Праймери 1 і 4 використовували, щоб зробити трифрагментну ампліфікацію ПЛР та злиття v-Src::людського c-Src фрагмента злиття з 5' і 3' фрагментами, ампліфікованими з Prague С v-Src гена і 3' нетрансльованою ділянкою вірусу саркоми Rous. Ця реакція утворює ген злиття, що знаходиться всередині рамки v-Srс::людський ген c-Src (залишок амінокислоти V244 v-Src до С248 людського с-Src з боку N-кінця і А517 людського c-Src до Q515 v-Src). Цей фрагмент гена злиття кодує одну третину С-кінця домену v-Src SH2 і 8Н2-каталітичний домен лінкера, злитий з людським каталітичним доменом сSrc, до якого примикає «хвіст» С-кінця v-Src. Ділянку Bgl2, що зустрічається у природі, поблизу 5'кінця фрагмента злиття та генно-інженерна ділянка Xbal в 3'-кінці фрагмента використовували, щоб вирізати фрагмент для створення гена злиття vSrс::людський c-Src повної довжини, як описано вище. Цілісність конструкту була підтверджена визначенням послідовності ДНК. Аналогічні способи використали, щоб клонувати даний ген в інших плазмідах експресії, таких як pIRES (Clontech), для використання в даних дослідженнях. Ці трансформовані фібробласти Rat2 використовуються для вимірювання залежного від Src припинення росту. Ультранизькі кластерні планшети (Corning Costar, Acton, MA) засівали по 10000 клітин на ямку в 1-й день. Альтернативно, ультранизькі кластерні планшети (Costar 3474) обробляли Sigrnacote (Sigma, St. Louis, MO), обполіскували 70% етанолом, після висихання у витяжній шафі засівали 5000 клітин. На 2-й день додавали сполуку у вигляді послідовних подвійних розведень від 10мкмоль до 0,009мкмоль, і в день 5 додавали реактив MTS (Promega, Madison, WI) (100 мікролітрів суміші MTS/середовища+100 мікролітрів середовища, що вже знаходиться на клітинах) та оптичну щільність вимірювали при 490нм. Результати аналізували, з отриманням ІС 5о для проліферації (мікромолярні одиниці), таким чином: % інгібування=(Аbs490нм зразка-чистий)/(Аbs 490нм без сполуки контролю-чистий)×100%. Як показано в таблиці 1, сполуки за даним винаходу інгібують залежну від src клітинну проліферацію. 16 Внутрішньочеревинне введення сполуки прикладу 1 забезпечує нейропротективну дію на моделі транзиторної осередкової ішемії Сполуку прикладу 1 тестували на щурячій моделі осередкової ішемії. Щурів лінії Wistar піддавали 90-хвилинній оклюзії середньої мозкової артерії (СМА) з використанням внутрішньопросвітного шва, як [описано Longa et at, Stroke 1989, 20:84], з подальшою реперфузією протягом 48 годин. Через 85 хвилин після початку ішемії тварини отримували сполуку прикладу 1 (1,5; 5; 15 або 45мг/кг внутрішньочеревинно). Після реперфузії тварин оцінювали протягом 48 годин на дефіцит неврологічних функцій і втрату/додавання маси. Розмір інфаркту вимірювали після умертвіння через 48 годин після оклюзії СМА. Сполука прикладу 1 у дозах 5 і 45мг/кг значно прискорило видужання від неврологічного дефіциту, викликаного інсультом. Скорочення об'єму мозкової тканини, що зазнала інфаркту, спостерігалися при більшості доз сполуки прикладу 1, але статистична значущість була досягнута тільки при дозі 45мг/кг внутрішньочеревинно. У тварин, яких 17 80472 лікували сполукою прикладу 1, спостерігалося прискорене відновлення маси тіла. Внутрішньовенне введення сполуки прикладу 1 забезпечує нейропротективну дію на моделі скороминучої осередкової ішемії Щурів лінії Wistar піддавали 90-хвилинній оклюзії середньої мозкової артерії (СМА) з використанням внутрішньопросвітного шва, як [описано Longa et al, Stroke 1989, 20:84], з подальшою реперфузією протягом 48 годин. Через тридцять хвилин після оклюзії СМА препарат прикладу 1 для внутрішньовенного введення в суміші 20 мМ 18 цитрат натрію/0,85% розчин хлориду натрію з рН 3 вводили в дозах 3, 10 і 30 мг/кг (внутрішньовенно). Після реперфузії за тваринами спостерігали протягом 48 годин на предмет дефіциту неврологічних функцій і втрати/додавання маси. Об'єм інфаркту мозкової тканини зменшився на 22%, 53% і 42%,відповідно. Втрата маси після інсульту також значно зменшилася. Крім того, як показано в таблиці 2, викликані інсультом неврологічні дефіцити значно зменшилися при всіх трьох дозах. Таким чином, сполуки за даним винаходом забезпечують нейропротективну дію після осередкової ішемії. Таблиця 2 Лікування Розчинник (контроль) 3мг/кг 10мг/кг 30мг/кг Середній бал моторного дефіциту через 24 год Значення Р (з контрольної групи) 4,55±0,16 3,83+0,3* 4,08±0,08 4,08±0,23 не доступно р=0,007 р=0,09 р=0,09 Терапевтичне вікно На моделі скороминучої осередкової ішемії проводили три дослідження, щоб оцінити терапевтичне вікно. Щурів лінії Wistar піддавали 90хвилинній оклюзії СМА, з подальшою реперфузією, як описано вище. Одноразове струминне введення мг/кг сполуки прикладу 1 здійснювали через 30 хвилин, 90 хвилин, З години, 4 години, 5 годин і 6 годин після інсульту. Об'єм тканини, що зазнала інфаркту, вимірювали за допомогою гістологічного фарбування. Одноразова доза 10мг/кг сполуки прикладу 1 статистично зменшувала інфаркт мозкової тканини (як % від лікованих розчинником) при введенні між 30 хвилинами і 4 годинами після ішемічного ушкодження. Статистично значущий захист від неврологічного дефіциту (як процент від лікованих розчинником) був досягнутий при одноразовому введенні дози 10 мг/кг прикладу 1 у терміни до 5 годин після інсульту, і статистично значущий захист від викликаною ішемією втрати маси (як % від лікованих розчинником) була досягнута при одноразовому введенні дози 10 мг/кг прикладу 1 у термін до 5 годин після інсульту. Таким чином, сполуки за даним винаходом виявляють перевершуючий терапевтичний діапазон у порівнянні з доступними в даний час способами лікування. Постішемічна судинна проникність Щурів лінії Wistar піддавали 90-хвилинній оклюзії середньої мозкової артерії (СМА) з використанням внутрішньопросвітного шва, як [описано Longa et al, Stroke 1989, 20:84], з подальшою реперфузією протягом 24 годин. Сполуку прикладу 1 вводили одноразово внутрішньовенно струминно через 30 хвилин після початку ішемії в дозах 3, 10 і 30мг/кг (внутрішньовенно). За дві години до умертвіння тварини отримували в/в ін'єкцію 2% блакитного Еванса у сольовому розчині. Мозок заливали сольовим розчином і смугасте тіло розтинали. Блакитний Еванса екстрагували, його кількість визначали за допомогою спектрофлюорометра, грунтуючись на зовнішніх стандартах. С удинна Середній бал моторноЗначення Р го дефіциту через (з контрольної гру48год. пи) 4,27±0,14 3,25±0,37* 3,67±0,22* 3,67±0,28* не доступно р=0,0001 р=0,016 р=0,016 проникність в ішемізованому смугастому тілі зменшилася, як було засвідчено зниженням на 60% виходу блакитного Еванса за межі судин. Таким чином, сполуки за даним винаходом знижують судинну проникність, пов'язану з ішемічним ушкодженням. Постійна вогнищева ішемія Сполуки прикладу 1 також оцінювали на двох щурячих моделях постійної осередкової ішемії. На моделі надзвичайного тяжкості (оклюзія внутрішньої сонної артерії внаслідок внутрішньопросвітного шва) і з відносно коротким виходом (28 годин) ефект був незначним або був відсутнім. На моделі, що спричиняє широкий інфаркт у чутливій і р уховій корі з кількісною оцінкою неврологічного дефіциту протягом 21 днів після інсульту сполука прикладу 1 забезпечила істотне поліпшення неврологічного виходу після інсульту. Щурів лінії Wistar (n=5 на групу) піддавали впливу моделі осередкового ішемічного інсульту, яка приводить до широкої ішемії в чутливій і руховій корі, по суті, як [описано Chen et al. (Stroke 17:738, 1986)]. Сполуки прикладу 1 або розчинник вводили внутрішньовенно струминно по 10мг/кг через 90 хвилин після індукції інсульту, 4 години потому, а також 24 і 28 годин потому (повна доза 40мг/кг). Тварин обстежували на чутливі рухові дефіцити (постуральний рефлекс, тести на візуальне і тактильне розміщення передньої і задньої кінцівки) у дні 1, 2, 4, 7, 9, 11, 14, 16, 18 і 21 після індукції ішемії. Результати були оцінені за допомогою узагальненої моделі регресії, щоб визначити статистичну значущість відмінностей між нахилами і порівняти кінцевий неврологічний результат після 21-го дня. До 21-го дня у суб'єктів, яких лікували сполукою прикладу 1, з'явилося статистично істотне поліпшення за поведінковою шкалою в порівнянні з контрольною групою. Таким чином, сполуки за даним винаходом забезпечують довгострокове поліпшення неврологічного дефіциту. 19 80472 Судинна проникність через хворобу, ушкодження або іншу травму може статися в різноманітних тканинах і органах, включаючи органи центральної нервової системи, серцево-легеневої системи, шлунково-кишкової системи і ниркової системи. Сполуки за даним винаходом корисні для інгібування судинної проникності, викликаної хворобою, ушкодженням або іншою травмою. Зокрема, судинна проникність може бути інгібована в мозковій і спинній тканині після цереброваскулярних подій. Судинна проникність є головною причиною виходу рідини з судинного русла і/або набряку після цереброваскулярної події (вияву симптомів) і часто приводить до неврологічних розладів та інвалідності. Цереброваскулярні стани, включаючи, але, не обмежуючись ними, скоминучі та гострі ішемічні стани, можна лікувати відповідно до даного винаходу. Гострі стани включають, але не обмежені ними, інсульт, травму голови, травму спинного мозку, загальну аноксію, гіпоксію, включаючи гіпоксію плоду, гіпоглікемію, гіпотонію і також схожі ушкодження, що спостерігаються під час процедур, через ембол, гіперфузії та гіпоксії. Інсульт включає, але не обмежений ними, осередкову та глобальну ішемію, транзиторні церебральні ішемічні атаки та інші мозкові судинні порушення, які супроводжуються ішемією мозку. Даний винахід також буде корисний у діапазоні цереброваскулярних подій, включаючи церебральний крововилив, інфаркт через емболії або тромбозу інтра- або екстракраніальних артерій, перінатальну асфіксію, при зупинці серця та епілептичному статусі, особливо там, де приплив крові до мозку зупиняється на деякий час. Цереброваскулярні події, пов'язані з виходом рідини з судинного русла, також включають інфекції, включаючи, але, не обмежуючись ними, енцефаліт і менінгіт, пов'язаний із запаленням нервової системи, які за допомогою виходу рідини з судинного русла розповсюджують ушкодження на оточуючі тканини. Системне захворювання, таке як діабет, розсіяний склероз, захворювання нирок і атеросклероз, також може привести до збільшення судинної проникності. Сполуки за даним винаходом також прийнятні для зниження судинної проникності, викликаної будь-якою місцевою ішемічною (гіпоксичною) подією в тканині/органі поза центральною нервовою системою, включаючи, але, не обмежуючись ними, ішемію міокарда та ішемічне захворювання кишечнику. Сполуки за даним винаходом забезпечують нейропротективну дію у хворого. Нейропротективна дія, як використано в даному описі, відноситься до захисту нервових клітин проти клітинної смерті або апоптозу. Одним з показників поширеності клітинної смерті або апоптозу слугує об'єм інфаркту; об'єм некротизованої або мертвої тканини мозку. Для оцінки об'єм інфаркту після ішемічної події можуть використовуватися променеві методи дослідження та клінічний статус пацієнта. Сполуки за даним винаходом зменшують об'єм інфаркту у пацієнта в порівнянні з типовим об'ємом інфаркту, відомим з досвіду при схожих ішемічних подіях у відсутності речовин за даним винаходом. Сполуки за даним винаходом запобігають, зменшують або інгібують дегенерацію нервової 20 тканини і/або нейротоксичність, зв'язані з судинною проникністю, які призводять до симптомів, включаючи, але, не обмежуючись ними, погіршення зору, погіршення мови, погіршення пам'яті, погіршення або порушення когнітивних функцій, і погіршення рухови х функцій, включаючи, але, не обмежуючись ним, параліч. Неврологічні дефекти, що виникають внаслідок ушкоджень або захворювань, описаних ви ще, можуть бути пригнічені або їх можна запобігти відповідно до даного винаходу. Таким чином, даний винахід включає способи лікування, запобігання, придушення або полегшення станів, пов'язаних із вказаним вище виходом рідини з судинного русла або проникністю, у ссавця, переважно у людини; включаючі введення фармацевтично ефективної кількості сполуки за даним винаходом і, зокрема, кількості, що пригнічує судинну проникність, ссавцеві, зокрема, пацієнтулюдині, яка потребує цього. Даний винахід також включає фармацевтичні композиції для лікування або регулювання судинної проникності, що містять принаймні одну сполуку формули І, їх суміш і/або їх фармацевтичні солі і, отже, фармацевтично прийнятний носій. Такі композиції готують відповідно до прийнятних фармацевтичних методик, таких як [описано в Remingtons Pharmaceutical Sciences, 17th edition, ed. Alfonoso R. Gennaro, Mack Publishing Company, Easton, PA (1985)]. Фармацевтично прийнятними носіями є сумісні з іншими компонентами композиції та біологічно прийнятні. Для приготування розчинів, суспензій, емульсій, сиропів і еліксирів, включаючи розчини для внутрішньовенного введення, можуть використовуватися рідкі носії. Активний компонент за даним винаходом може бути розчинений або суспендований у фармацевтично прийнятному рідкому носії, такому як вода, органічний розчинник або суміш обох. Рідкий носій може містити інші прийнятні фармацевтичні домішки, такі як солюбілізатори, емульгатори, буфери, консерванти, підсолоджуючі речовини, ароматичні речовини, суспендуючі речовини, загусники, барвники, регулятори в'язкості, стабілізатори, регулятори осмотичного тиску, антиоксиданти та піногасники. Приклади прийнятних рідких носіїв для перорального, внутрішньовенного та парентерального введення включають воду (особливо яка містить домішки, як вказано вище, наприклад, похідні целюлози, переважно розчин натрійкарбоксиметилцелюлози), сольовий розчин, розчин глюкози, розчини глюкози в сольовому розчині та воді, спирти (включаючи одноатомні спирти та багатоатомні спирти, наприклад, гліколі) та їх по хідні. Рідкі носії для парентерального та внутрішньовенного введення використовуються в стерильній формі. рН рідких композицій може бути відрегульований у деяких випадках доданням НС1, гідроксиду натрію та фосфорної кислоти. Переважно, щоб композиції за даним винаходом були рідкими фармацевтичними композиціями, які являють собою стерильні розчини або суспензії в ізоосмотичній фізіологічно сумісній забуференій системі. Рідкі фармацевтичні композиції за даним винаходом можуть вводитися, наприклад, за допомо 21 80472 гою внутрішньом'язової, внутрішньочеревинної, внутрішньовенної або підшкірної ін'єкції. Фармацевтичні композиції за даним винаходом переважно вводяться пацієнту за допомогою внутрішньочеревинної або внутрішньовенної ін'єкції. Найбільш переважно, щоб композиція вводилася внутрішньовенно, наприклад, за допомогою внутрішньовенного струминного введення, внутрішньовенного краплинного введення, повторних повільних струминних введень або інфузії. Форми для перорального введення можуть бути або рідкими, або твердими композиціями. Сполуки за даним винаходом також можна вводити перорально або парентерально, у чистому вигляді або в комбінації зі стандартними фармацевтичними носіями. Прийнятні тверді носії можуть містити одну або більше речовин, які можуть також діяти як ароматичні речовини, змащувачі, солюбілізатори, суспендуючі речовини, наповнювачі, ковзні речовини, речовини, які полегшують пресування, зв'язуючі або розпушуючі таблетку речовини, або інкапсулюючий матеріал. У порошках носій є тонкоподрібненою твердою речовиною, яка знаходиться в суміші з тонкоподрібненим активним компонентом. У таблетках активний компонент у прийнятних пропорціях змішаний з носієм, що має необхідні властивості стиснення, і ущільнений до бажаної форми та розміру. Переважно, щоб порошки та таблетки містили до 99% активного компонента. Прийнятні тверді носії включають, наприклад, фосфат кальцію, стеарат магнію, тальк, цукор, лактозу, декстрин, крохмаль, желатин, целюлозу, метилцелюлозу, натрієву сіль карбоксиметилцелюлози, полівінілпіролідон, легкоплавкий віск і йонообмінні смоли. Переважно, щоб фармацевтична композиція знаходилася в формі одиничних доз, наприклад, у вигляді таблеток, капсул, порошків, розчинів, суспензій, емульсій, гранул, супозиторіїв, ампули або болюсу. В такій формі композиція поділяється на одиничну дозу, що містить відповідну кількість активного компонента; форми одиничних доз можуть бути розфасованими композиціями, наприклад, загорненими в пакетики порошками, ліофілізованим порошком або масою в ампулах або флаконах, або флаконами, ампулами, наповненим шприцями або саше, що містять рідину. Форма одиничних доз може представляти, наприклад, капсулу або таблетку саму по собі або вона може являти собою відповідну кількість будь-яких таких композицій в упакованій формі. Доза, що вводиться пацієнту, буде змінюватися в залежності від того, що вводять, мети введення, такої як профілактика або лікування, а також стану пацієнта, способу введення і т.п. Термін "терапевтично ефективна кількість" означає кількість, достатню, щоб вилікувати або послабити симптоми хвороби або травми. Загалом, одинична доза (або форма дозування) буде містити від приблизно 1мг/кг до приблизно 30мг/кг і більш переважно від приблизно 1мг/кг до приблизно 10мг/кг сполуки за даним винаходом. Очікується, що деякі пацієнти будуть отримувати багаторазові дози. Дозування, яке використовували для лікування конкретного випадку, повинне бути суб'єктивно 22 визначене лікарем-куратором. Залучені змінні включають конкретний стан і величину, вік і характер відповіді пацієнта. Даний винахід надає переваги в порівнянні з раніше відомими способами лікування інсульту та інших станів, пов'язаних з судинною проникністю. Зокрема, хоча після ішемічного ушкодження переважно розпочати лікування пацієнтів як можна швидше, сполуки за даним винаходом можуть ефективно запобігати нейродегенерації та розвитку неврологічних дефектів у деяких пацієнтів, навіть якщо їх вводять приблизно через 18-24 годин після ішемічного ушкодження. Крім того, лікування може продовжуватися, і поліпшення прогнозу у пацієнта може бути результатом безперервного або повторного введення сполуки за даним винаходом протягом приблизно до 72 годин або довше після ішемічного ушкодження. Один варіант здійснення винаходу включає введення сполуки приблизно між 6-24 годинами після ішемічної події. Подальший варіант здійснення включає введення сполуки приблизно між 18-24 годинами після ішемічного події. «Вводити», як використано в даному описі, означає безпосереднє введення сполуки або композиції за даним винаходом, або введення проліків, похідних або аналогів, які створять еквівалентну кількість активної сполуки або речовини в організмі. Даний винахід включає проліки сполук формули І. "Проліки", як використано в даному описі, означає сполуку, яка може in vivo перетворюватися за допомогою метаболізму (наприклад, гідролізу) в сполуку формули І. Різні форми проліків відомі в даній галузі, наприклад, як обумовлено Bundgaard, (ed.), Design of Prodrugs, Elsevier (1985); Widder, et al. (ed.), Methods in Enzymology, vol. 4, Academic Press (1985); Krogsgaard-Larsen, et al., (ed). "Design and Application of Prodrugs", Textbook of Drug Design and Development, Chapter 5, 113-191 (1991), Bundgaard, et al., Journal of Drag Deliver Reviews, 8:1-38(1992), Bundgaard, J. of Pharmaceutical Sciences, 77:285 et seq. (1988); and Higuchi and Stella (eds.) Prodrugs as Novel Drag Delivery Systems, American Chemical Society (1975). Даний винахід буде більш повно описаний у поєднанні з наступними конкретними прикладами, які не повинні розглядатися як такі, що обмежують обсяг даного винаходу. Довідковий приклад 1 Етил 7-фтор-6-метоксі-4-оксо-1,4-дигідро-3хінолінкарбоксилат Суміш 3-фтор-4-метоксіаніліну (3,00г, 21,26ммоль) та діетилетоксиметиленмалонату (4,59 г, 21,26 ммоль) нагрівали при 110°С протягом 1 години, потім охолоджували до кімнатної температури. Потім додавали гексан і тверді частинки збирали фільтруванням. Тверду речовину суспендували в 45мл суміші дифеніловий ефірібіфеніл, 3:1, і суміш кип'ятили зі зворотним холодильником протягом 2 годин, з отриманням коричневого розчину. Реакційну суміш охолоджували до кімнатної температури та додавали гексан. Отриману в результаті тверду речовину збирали фільтруванням, 23 80472 промивали гексаном, з отриманням 2,62 г етил-7фтор-6-метоксі-4-оксо-1,4-дигідро-3хінолінкарбоксилату у вигляді білої твердої речовини; т.пл. >300°С. МС 265,9 (М+Н)+ Аналіз для C13H12FNO 4 Обчислено: С 58,87; Н 4,56; N 5,28. Знайдено: С 58,66; Н 4,16; N 5,14. Довідковий приклад 2 7-Фтор-6-метоксі-4-оксо-1,4-дигідро-3хінолінкарбонова кислота Суміш етил-7-фтор-6-метоксі-4-оксо-1,4дигідро-3-хінолінкарбоксилату (2,2г, 8,30ммоль) і 13,2мл 1н. гідроксиду натрію та 40мл етанолу кип'ятили зі зворотним холодильником протягом 3 годин, потім охолоджували до кімнатної температури. Додавали воду та суміш підкислювали оцтовою кислотою. Отриману в результаті тверду речовину збирали фільтруванням, промивали водою, з отриманням 1,90г 7-фтор-6-метоксі-4-оксо-1,4дигідро-3-хінолінкарбонової кислоти у вигляді білої твердої речовини; т.пл. 265-267°С. МС 238,1 (М+Н)+ Аналіз для C11H8FN4×1,2H2O Обчислено: С 51,04; Н 4,03; N 5,41. Знайдено: С 50,98; Н 3,95; N 5,33. Довідковий приклад 3 7-Фтор-6-метоксі-4-оксо-1,4-дигідро-3хінолінкарбоксамід Суміш 7-фтор-6-метоксі-4-оксо-1,4-дигідро-3хінолінкарбонової кислоти (1,0г, 4,21ммоль) і 1,1'карбонілдіімідазолу (1,51г, 9,28ммоль) в 14мл N,Nдиметилформаміду нагрівали при 65°С протягом 2 годин, потім охолоджували до кімнатної температури та виливали в 200мл водного гідроксиду амонію, що знаходилися на водяній бані з льодом. Розчин перемішували при кімнатній температурі протягом ночі та потім концентрували до невеликого об'єму. Додавали крижану воду, з подальшим підкисленням оцтовою кислотою. Отриману в результаті тверду речовину збирали фільтруванням, промивали водою, з отриманням 821мг 7-фтор-6метоксі-4-оксо-1,4-дигідро-3-хінолінкарбоксаміду у вигляді білої твердої речовини; т.пл. >300°С. МС 23658 (М+Н)+ Аналіз для C11H9FN2О 3×0,2 H 2O Обчислено: С 55,09; Н 3,94; N 11,68. Знайдено: С 55,00; Н 3,63; N 11,49. Довідковий приклад 4 7-Фтор-6-метоксі-4-оксо-1,4-дигідро-3хінолінкарбонітрил Суміш 7-фтор-6-метоксі-4-оксо-1,4-дигідро-3хінолінкарбоксаміду (700мг, 3,0ммоль) та ціанурхлориду (341мг, 1,65ммоль) в 15мл N,Nдиметилформаміду нагрівали при 65°С протягом 6 годин, потім охолоджували до кімнатної температури та додавали додаткові 206 мг ціанурхлориду. Суміш нагрівали при 65°С протягом 4 годин, потім перемішували протягом ночі при кімнатній температурі. Реакційну суміш виливали в крижану воду та нейтралізували насиченим розчином бікарбонату натрію. Тверді частинки збирали фільтруванням, промивали водою та гексаном, з отриманням 610мг неочищеного продукту. Очищення колонковою фле ш-хроматографією при градієнтному 24 елююванні від 3%-го метанолу в дихлорметані до 10%-го метанолу в дихлорметані давало 272мг 7фтор-6-метоксі-4-оксо-1,4-дигідро-3хінолінкарбонітрилу; т.пл. 147-149°С. MC 216,8 (M-H)Аналіз для C11H7FN2O 2×0,1 дихлорметан Обчислено: С 58,80; Н 3,19; N 12,36. Знайдено: С 59,06; Н 2,96; N 11,97. Альтернативний шлях довідковому прикладу 4 7-Фтор-6-метоксі-4-оксо-1,4-дигідро-3хінолінкарбонітрил Суміш 3-фтор-4-метоксіаніліну (15,31г, 108ммоль) та етил(етоксиметилен)ціаноацетату (18,36г, 108ммоль) в толуолі нагрівали при 100110°С протягом 4,5 годин, потім охолоджували до кімнатної температури. Додавали суміш гексану та етилацетату, 1:1, і суміш охолоджували на льодяній бані. Тверді частинки збирали промивкою гексаном, з отриманням першого збору, 26,10г, і другого збору, 1,24м. Частину цього продукту масою 2,0г додавали до 18мл суміші дифеніловий ефір:біфеніл, 3:1, при кип'ятінні зі зворотним холодильником. Суміш кип'ятили зі зворотним холодильником протягом 4 годин, потім охолоджували та виливали в гексан. Тверді частинки збирали фільтруванням і промивали етилацетатом і гексаном, з отриманням 624мг 7-фтор-6-метоксі-4-оксо-1,4,дигідро-3-хінолінкарбонітрилу у вигляді коричневої твердої речовини. Фільтрат концентрували, залишок розчиняли в етилацетаті та додавали гексан. Отриману в результаті тверду речовину збирали фільтруванням, з отриманням 1,07г 7-фтор-6метоксі-4-оксо-1,4-дигідро-3-хінолінкарбонітрилу у вигляді жовтої твердої речовини. Довідковий приклад 5 4-Хлор-7-фтор-6-метокси-3-хінолінкарбонітрил Суміш 7-фтор-6-метоксі-4-оксо-1,4-дигідро-3хінолінкарбонітрилу (1,0г, 4,59ммоль) і 14г оксихлориду фосфору кип'ятили зі зворотним холодильником протягом 30 хвилин, потім концентрували у вакуумі. Залишок розподіляли між водним розчином бікарбонату натрію та етилацетатом. Органічний шар сушили над сульфатом магнію, фільтрували та концентрували на силікагелі. Очищення колонковою флеш-хроматографією при градієнтному елююванні від суміші етилацетаттексан 1:5 до етилацетат:гексан 1:1 давала 631мг 4-хлор-7фтор-6-метокси-3-хінолінкарбонітрилу; т.пл. 160162°С. МС 236,9 (М+Н)+ Аналіз для C11H6ClFN2O Обчислено: С 55,83; Н 2,56; N 11,84. Знайдено: С 55,66; Н 2,84; N 11,91. Довідковий приклад 6 4-[(2,4-Дихлор-5-метоксифеніл)аміно]-7-фтор6-метокси-3-хінолінкарбонітрил Суміш 4-хлор-7-фтор-6-метокси-3хінолінкарбонітрилу (4,12г, 18ммоль), 2,4-дихлор5-метоксіаніліну (4,5 г, 24ммоль) (Theodoridis, G.; Pestic. Set 1990, 30, 259) та гідрохлориду піридину (2,31г, 19,9ммоль) в 45мл 2-етоксіетанолу нагрівали при 120°С протягом 3 годин, потім охолоджували до кімнатної температури. Реакційну суміш додавали до водного розчину бікарбонату натрію і перемішували протягом 20 хвилин. Тверді частин 25 80472 ки збирали фільтруванням, з отриманням 4,89г 4[(2,4-дихлор-5-метоксифеніл)аміно]-7-фтор-6метокси-3-хінолінкарбонітрилу; т.пл. >260°С. Mac-спектроскопія високого розрізнення: обчислено 392,03634; знайдено 392,03556 (М+Н)+; Аналіз для C18H12Cl2FN3O 2×2,0H2O Обчислено: С 50,48; Н 3,77; N 9,81. Знайдено: С 50,41; Н 2,82; N 9,78. Довідковий приклад 7 6-бензилокси-7-фтор-4-оксо-1,4-дигідро-3хінолінкарбонітрил Суміш 4-бензилокси-3-фтораніліну (6,06г, 27,9ммоль) [США 5622967] та етил(етоксиметилен)ціаноацетату (5,08г, 30,0ммоль) нагрівали при 120°С протягом 45 хвилин, потім охолоджували до кімнатної температури. Цю тверду речовину по частинах додавали до суміші дифеніловий ефір:біфенил, 3:1, при 245°С. Суміш нагрівали при 245°С протягом 3 годин, потім охолоджували і тверді частинки збирали фільтруванням, промивали гексаном і діетиловим ефіром, з отриманням 2,60г 6-бензилокси-7-фтор-4оксо-1,4-дигідро-3-хінолінкарбонітрилу; т.пл. >250°С. МС 293,1 (М-Н)Довідковий приклад 8 6-Бензилокси-4-хлор-7-фтор-3хінолінкарбонітрил Суміш 6-бензилокси-7-фтор-4-оксо-1,4дигідро-3-хінолінкарбонітрилу (645мг, 2,19ммоль) і 10мл оксихлориду фосфор у нагрівали при 115°С протягом 1,5 годин, потім концентрували у вакуумі. Залишок обробляли льодяним водним розчином гідроксиду амонію і отриману в результаті тверду речовину збирали фільтруванням. Очищення колонковою флеш-хроматографією при градієнтному елююванні від 1%-го етилацетату в гексані до 6%го етилацетату в гексані давало 284 мг 6бензилокси-4-хлор-7-фтор-3-хінолінкарбонітрилу; т.пл. 159-160°С. МС 313,13 (М+Н)+ Аналіз для C17H10ClFN2O Обчислено: С 65,15; Н 3,06; N 8,82. Знайдено: С 65,29; Н 3,22; N 8,96. Довідковий приклад 9 4-Хлор-7-фтор-6-гідрокси-3-хінолінкарбонітрил Суміш 6-бензилокси-4-хлор-7-фтор-3хінолінкарбонітрилу (733мг, 2,34ммоль) і 1мл тіоанізолу в 12мл трифтороцтової кислоти кип'ятили зі зворотним холодильником протягом 9 годин, потім концентрували у вакуумі. Залишок обробляли крижаною водою і потім підлужнювали до рН 910 додаванням водного гідроксиду амонію. Отриману в результаті тверду речовину збирали фільтруванням і промивали діетиловим ефіром. Фільтрат екстрагували 10%-м метанолом в етилацетаті. Органічний шар сушили над сульфа том натрію, фільтрували та концентрували у вакуумі. Залишок об'єднували з отриманою твердою речовиною, продукт розчиняли в 5%-му метанолі в етилацетаті та абсорбували силікагелем. Очищення колонковою фле ш-хроматографією при градієнтному елююванні від гексану до наростаючих концентрацій етилацетату в гексані і далі до 5%-го метанолу 26 в етилацетаті давало 260мг 4-хлор-7-фтор-6гідрокси-3-хінолінкарбонітрилу; т.пл. >250°С. МС 220,9 (М-Н)Аналіз для C10H4ClFN2O Обчислено: С 53,96; Н 1,81; N 12,58. Знайдено: С 54,23; Н 2,02; N 12,06. Довідковий приклад 10 4-Хлор-6-етокси-7-фтор-3-хінолінкарбонітрил До суміші з температурою 0°С 4-хлор-7-фтор6-гідрокси-3-хінолінкарбонітрилу (185мг, 0,83ммоль), трифенілфосфіну (392мг, 1,49ммоль) та етанолу (153мг, 3,32ммоль) в 15мл тетрагідрофурану додавали діетилазодикарбоксилат (260мг, 1,80ммоль). Реакційну суміш витримували при 0°С протягом 45 хвилин, потім перемішували при кімнатній температурі протягом ночі. Реакційну суміш концентрували у вакуумі та очищували колонковою фле ш-хроматографією при градієнтному елююванні від 1%-го етилацетату в гексані до 5%го етилацетату в гексане, з отриманням 4-хлор-6етокси-7-фтор-3-хінолінкарбонітрилу; т.пл. 165166°С. МС 251,0 (М+Н)+ Аналіз для C12H8C1FN2O Обчислено: С 57,50; Н 3,22; N 11,18. Знайдено: С 57,24; Н 3,41; N 11,09. Довідковий приклад 11 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6етокси-7-фтор-3-хінолінкарбонітрил Дотримуючись методики довідкового прикладу 6, отримана суміш 4-хлор-6-етокси-7-фтор-3хінолінкарбонітрилу (197мг, 0,78ммоль), 2,4дихлор-5-метоксіаніліну (220мг, 1,14ммоль) і гідрохлориду піридину (120мг, 1,04ммоль), після колонкової флеш-хроматографії при градієнтному елююванні від дихлорметану до 1%-го метанолу в дихлорметані давала 183мг 4-[(2,4-дихлор-5метоксифеніл)аміно]-6-етокси-7-фтор-3хінолінкарбонітрилу; т.пл. 184-186°С. МС 406,0 (М+Н) Аналіз для C19H14Cl2FN3O2×0,5H2O Обчислено: С 54,96; Н 3,64; N 10,12. Знайдено: С 54,99; Н 3,59; N 10,05. Приклад 1 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6метокси-7-[3-(4-метил-1-піперазиніл)пропокси]-3хінолінкарбонітрил Суміш 7-[3-хлорпропокси]-4-[(2,4-дихлор-5метоксифеніл)аміно]-6-метокси-3хінолінкарбонітрилу (656мг, 1,40ммоль) та йодиду натрію (210мг, 1,40ммоль) в 4мл Nметилпіперазину нагрівали при 80°С протягом 20год. Реакційну суміш концентрували у вакуумі та розподіляли між етилацетатом і насиченим водним розчином бікарбонату натрію. Органічний шар промивали концентрованим розчином солі, сушили над сульфатом натрію, фільтрували та концентрували у вакуумі. Залишок очищали колонковою хроматографією при елююванні 30%-м метанолом в дихлорметані. Фракції, що містять продукт, збирали та концентрували у вакуумі. До залишка додавали діетиловий ефір та рожеву тверду речовину збирали фільтруванням, з отриманням 560мг (75%) 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6 27 80472 метокси-7-[3-(4-метил-1-піперазиніл)пропокси]-3хінолінкарбонітрилу; т.пл. 116-120°С; МС (ES) m/z 530,2, 532,2 (М+1). Приклад 2 4-[(2,4-Дихлор-5-метоксифеніл)аміно]-7-[3-(4етил-1-піперазиніл)пропокси]6-метокси-3-хінолінкарбонітрил Суміш 7-[3-хлорпропокси]-4-[(2,4-дихлор-5метоксифеніл)аміно]-6-метокси-3хінолінкарбонітрилу (3,50г, 7,50ммоль), йодиду натрію (1,12г, 7,50ммоль) і 4,8мл N-етилпіперазину в 5мл диметилового ефіру етиленгліколю нагрівали при 95°С протягом 20год. Реакційну суміш концентрували у вакуумі та розподіляли між етилацетатом і насиченим водним розчином бікарбонату натрію. Органічний шар промивали насиченим водним розчином бікарбонату натрію, потім концентрованим розчином солі, сушили над сульфатом натрію, фільтрували та концентрували у вакуумі. До залишку додавали діетиловий ефір і білу тверду речовину збирали фільтруванням, з отриманням 1,80г (44%) 4-[(2,4-дихлор-5метоксифеніл)аміно]-7-[3-(4-етил-1піперазиніл)пропокси]-6-метокси-3хінолінкарбонитрилу: т.пл. 102-104°С; МС (ES) m/z 544,3, 546,4 (М+1). Приклад 3 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6метокси-7-[2-(4-метил-1-піперазиніл)етокси]-3хінолінкарбонітрил Отримували згідно зі способом, використаним для отримання сполуки прикладу 1, взаємодією 7[2-хлоретокси]-4-[(2,4-дихлор-5метоксифеніл)аміно]-6-метокси-3хінолінкарбонітрилу та N-метилпіперазину: т.пл. 165-167°С; MC (ES) m/z 516,0, 518,2 (M+l). Приклад 4 4-[(2,4-Дихлор-5-метоксифеніл)аміно]-7-[2-(4етил-1-піперазиніл)стокси]-6-метокси-3 хінолінкарбонітрил Отримували згідно зі способом, використаним для отримання сполуки прикладу 1, взаємодією 7[2-хлоретокси]-4-[(2,4-дихлор-5метоксифеніл)аміно]-6-метокси-3хінолінкарбонітрилу та N-етилпіперазину: т.пл. 101-105°С; MC (ES) m/z 530 54? 532,4 (М+1). Приклад 5 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6метокси-7-[(1-метилпіперидин-4-іл)метокси]-3хінолінкарбонітрил До розчину 4-[(2,4-дихлор-5метоксифеніл)аміно]-7-фтор-6-метокси-3хінолінкарбонітрилу (600мг, 1,53ммоль) та 1метилпіперидин-4-метанолу (395мг, 3,06ммоль) в 10мл N,N-диметилформаміду при 135°С частинами додавали гідрид натрію (362мг, 9,06ммоль). Через 45 хвилин реакційну суміш виливали в насичений розчин бікарбонату натрію. Після перемішування протягом 15 хвилин тверду речовину збирали фільтруванням. Залишок очищували колонковою флеш-хроматографією при градієнтному елююванні від 5%-го метанолу в дихлорметані до 25%-ого метанолу в ди хлорметані. Розтирання з 28 діетиловим ефіром давало 396мг, 4-[(2,4-дихлор5-метоксифеніл)аміно]-6-метокси-7-[(1метилпіперидин-4-іл)метокси]-3хінолінкарбонітрилу; т.пл. 200-202°С. МС 501,3 (М+Н)+ Аналіз для C25H26Cl2N4O 3×0,8H2O Обчислено: С 58,21; Н 5,39; N 10,86. Знайдено: С 58,19; Н 5,23; N 10,67. Приклад 6 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6метокси-7-[2-(1-метилпіперидин-4-іл)етокси]-3хінолінкарбонітрил Суміш гідриду натрію (128мг, 3,2ммоль) і 1метил-4-піперидинетанолу (180мг, 1,25ммоль) [ЕР 0581538] в 5мл N,N-диметилформаміду нагрівали при 110°С протягом 1 години. Потім додавали 4[(2,4-дихлор-5-метоксифеніл)аміно]-7-фтор-6метокси-3-хінолінкарбонітрил (200мг, 0,51ммоль) та реакційну суміш нагрівали при 135°С протягом 5 годин. Протягом подальших 4 годин до реакційної суміші додавали ще 128мг гідриду натрію при 130°С. Реакційну суміш розподіляли між етилацетатом і водою. Органічний шар сушили над сульфатом натрію, фільтрували та концентрували у вакуумі. Залишок очищували препаративною тонкошаровою хроматографією при елююванні 20% метанолом в дихлорметані, з отриманням 105мг 4[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7[2-(1-метилпіперидин-4-іл)етокси]-3хінолінкарбонітрилу; т.пл. 190-191°С. МС 515,19 (М+Н)+ Аналіз для C26H28Cl2N4O 3×1,0H2O Обчислено: С 58,53; Н 5,67; N 10,50. Знайдено: С 58,65; Н 5,57; N 10,34. Сполуки прикладів 7 і 8 отримували аналогічно способу прикладу 5 і відповідного спирту. Приклад 7 4-[(2,4-Дихлор-5-метоксифеніл)аміно]-6метокси-7-[3-(1-метилпіперидин-4іл)пропокси]хінолін-3-карбонітрил Т.пл. 144-145°С; МС 529,2 (ES+) Приклад 8 4-[(2,4-Дихлор-5-метоксифеніл)аміно]-7-[(1етилпіперидин-4-іл)метокси1-6-метоксихінолін-3карбонітрил Т.пл. 192-195°С; МС 515,2 (ES+) Приклад 9 4-[(2,4-Дихлор-5-метоксифеніл)аміно]-6етокси-7-[3-(4-метилпіперазин-1іл)пропокси]хінолін-3-карбонітрил Суміш 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6етокси-7-фтор-3-хінолінкарбонітрилу (200мг, 0,49ммоль), 3-(4-метилпіперазин-1-іл)пропанолу (155мг, 0,98ммоль) [WO 20047212] та гідриду натрію (196мг, 4,6ммоль) в 5мл N,Nдиметилформаміду нагрівали при 125°С протягом 3 годин. Реакційну суміш виливали в насичений розчин бікарбонату натрію та перемішували протягом 1 години. Водний розчин екстрагували 10% метанолом в дихлорметані. Органічний шар промивали концентрованим розчином солі, сушили над сульфатом магнію та концентрували у вакуумі. Залишок очищували препаративною тонкошаровою хроматографією при елююванні 15% метанолом в дихлорметані. Розтирання з гексаном дава 29 80472 ло 116мг 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6етокси-7-[3-(4-метилпіперазин-1іл)пропокси]хінолін-3-карбонітрилу у вигляді світло-коричневої твердої речовини; т.пл. 137-138°С. МС 542,0 (М-Н)Аналіз для C27H31Cl2N5O 3×0,6H2O Обчислено: С 58,40; Н 5Э84; N 12,61. Знайдено: С 58,31; Н 5,71; N 12,43. Приклад 10 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6етокси-7-[(1-метилпіперидин-4-іл)метокси]хінолін3-карбонітрил Суміш 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6етокси-7-фтор-3-хінолінкарбонітрилу (200мг, 0,49ммоль), 1-метилпіперидин-4-метанолу (188мг, 0,98ммоль) [WO 20047212] та гідриду натрію (196мг, 4,6ммоль) в 5мл N,N-диметилформаміду нагрівали при 125°С протягом 3 годин. Реакційну суміш виливали в насичений розчин бікарбонату натрію та перемішували протягом 1 години. Тверду речовину збирали фільтруванням, промивали водою та сушили у вакуумі. Тверду речовину очищували препаративною тонкошаровою хроматографією при елююванні 15% метанолом в дихлорметані. Розтирання з діетиловим ефіром давало 67мг 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6етокси-7-[(1-метилпіперидин-4-іл)метокси]хінолін3-карбонітрилу у вигляді світло-коричневої твердої речовини; т.пл. 182-186°С. МС 513,0 (М-Н)Аналіз для C26H28C12N4O 3×1,4Н2О Обчислено: С 57,76; Н 5,74; N 10,36. Знайдено: С 57,65; Н 5,43; N 10,15. Приклад 11 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6етокси-7-[3-(4-етилпіперазин-1-іл)пропокси]хінолін3-карбонітрил Суміш 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6етокси-7-фтор-3-хінолінкарбонітрилу (200мг, 0,49ммоль) і 3-(4-етил-піперазин-1-іл)пропанолу (241мг, 0,98ммоль) в 5мл N,N-диметилформаміду нагрівали при 125°С протягом 5хв. Додавали гідрид натрію (60%) (98мг, 2,45ммоль) і суміш нагрівали при 125°С протягом 1 години. Потім додавали додаткову кількість гідриду натрію (98мг, 2,45ммоль) і суміш нагрівали при 125С° протягом 2 годин. Реакційну суміш о холоджували до кімнатної температури, виливали в насичений розчин бікарбонату натрію та перемішували протягом 1 години. Водний розчин екстрагували 10% метанолом в дихлорметані. Органічний шар сушили над сульфатом натрію та концентрували у вакуумі. Залишок очищували препаративною тонкошаровою хроматографією при елююванні 12% метанолом у дихлорметані. Розтирання з діетиловим ефіром і гексаном давало 146мг 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6етокси-7-[3-(4-етилпіперазин-1-іл)пропокси]хінолін3-карбонітрилу у вигляді світло-коричневої твердої речовини; т.пл. 127-130°С. МС 558,3 (М+Н)+ Аналіз для C28H33Cl2N5O 3×1,5H2O Обчислено: С 57,44; Н 6,20; N 11,96. Знайдено: С 57,44; Н 6,24; N 11,79. Приклад 12 30 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6етокси-7-[3-(1-метилпіперидин-4іл)пропокси]хінолін-3-карбонітрил Суміш 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6етокси-7-фтор-3-хінолінкарбонітрилу (200мг, 0,49ммоль) і 3-(1-метил-4-піперидиніл)пропанолу (154мг, 0,98ммоль) в 5мл N,N-диметилформаміду нагрівали при 125°С протягом 5хв. Додавали гідрид натрію (60%) (98мг, 2,45ммоль) і суміш нагрівали при 125°С протягом 1 години. Потім додавали додаткову кількість гідриду натрію (98мг, 2,45ммоль) і суміш нагрівали в 125°С протягом 2 годин. Реакційну суміш охолоджували до кімнатної температури, виливали в насичений розчин бікарбонату натрію та перемішували протягом 1 години. Осад збирали, промивали водою та сушили у вакуумі. Залишок очищували препаративною тонкошаровою хроматографією при елююванні 15% метанолом в дихлорметані. Розтирання з діетиловим ефіром давало 146мг 4-[(2,4-дихлор-5метоксифеніл)аміно]-6-етокси-7-[3-(1метилпіперидин-4-іл)пропокси]хінолін-3карбонітрилу у вигляді не зовсім білої твердої речовини; т.пл. 148-151°С. MC 543,2 (М+Н)+ Аналіз для C28H32Cl2N4O 3××1,8H20 Обчислено: С 58,39; Н 6Э23; N 9,73. Знайдено: С 58,40; Н 6,16; N 9,64. Приклад 13 4-[(2,4-Дихлор-5-метоксифеніл)аміно]-6етокси-7-[2-(4-метил-1-піперазиніл)стокси]хінолін3-карбонітрил Суміш 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6етокси-7-фтор-3-хінолінкарбонітрилу (200мг, 0,49ммоль) та 2-(4-метил-1-піперазиніл)етанолу (141мг, 0,98ммоль) в 5мл N,N-диметилформаміду нагрівали до 100°С. Частинами додавали гідрид натрію (60%) (196мг, 4,9ммоль) і суміш нагрівали при 125°С протягом 3 годин. Реакційну суміш о холоджували до кімнатної температури і обробляли 25мл води. Суміш перемішували протягом 2 годин. Осад збирали, промивали водою і сушили у вакуумі. Залишок очищували колонковою флешхроматографією при градієнтному елююванні від 5%-го метанолу в дихлорметані до 15%-ого метанолу в ди хлорметані. Розтирання з діетиловим ефіром давало 123мг 4-[(2,4-дихлор-5метоксифеніл)аміно]-6-етокси-7-[2-(4-метил-1піперазиніл)етокси]хінолін-3-карбонітрилу у вигляді не зовсім білої твердої речовини; т.пл. 141143°С. МС 530,2 (М+Н)+ Аналіз для C26H29CI2N5 O3 Обчислено: С 58,87; Н 5,51; N 13,20. Знайдено: С 58,48; Н 5,45; N 12,95. Приклад 14 4-[(2,4-Дихлор-5-метоксифеніл)аміно]-6етокси-7-[2-(1-метилпіперидин-4-іл)етокси]хінолін3-карбонітрил Суміш 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6етокси-7-фтор-3-хінолінкарбонітрилу (200мг, 0,49ммоль) і 1-метил-4-піперидинетанолу (140мг, 0,98ммоль) в 5 мл N,N-диметилформаміду нагрівали до 100°С. Частинами додавали гідрид натрію (60%) (162мг, 4,05ммоль) і суміш нагрівали при 31 80472 125°С протягом 3 годин. Реакційну суміш охолоджували до кімнатної температури і обробляли 25 мл води. Осад збирали, промивали водою та сушили у вакуумі. Залишок очищували колонковою флешхроматографією при градієнтному елююванні від дихлорметану, потім при градієнті від 5%-го метанолу в дихлорметані до 30%-го метанолу в ди хлорметані. Розтирання з діетиловим ефіром давало 121мг 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6етокси-7-[2-(1-метилпіперидин-4-іл)етокси]-хінолін3-карбонітрилу у вигляді не зовсім білої твердої речовини; т.пл. 174-17б°С. МС 529,1 (М+Н)+ Комп’ютерна в ерстка Н. Лисенко 32 Аналіз для C27H30CI2N4 O3 Обчислено: С 61,25; Н 5,71; N 10,58. Знайдено: С 61,40; Н 5,84; N 10,35. Приклад 15 4-[(2,4-Дихлор-5-метоксифеніл)аміно]-6метокси-7-[3-(4-пропіл-1-піперазиніл)пропокси]-3хінолінкарбонітрил Отримували згідно зі способом, використаним для отримання сполук прикладу 1, взаємодією 7[3-хлоретокси]-4-[(2,4-дихлор-5метоксифеніл)аміно]-6-метокси-3хінолінкарбонітрилу та N-пропілпіперазину: т.пл. 97-101°С; МС (ES) m/z 558,2, 560,2 (М+1). Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською4-[(2,4-dichloro-5-methoxyphenyl)amino]-6-alkoxy-3-quinolincarbonitriles for treating ischemic lesions
Автори англійськоюBoschelli Diane Harris, Boshelli Frank Charles, Ardnt Kim Timothy
Назва патенту російською-[(2,4-дихлор-5-метоксифенил)амино]-6-алкокси-3-хинолинкарбонитрилы для лечения ишемического поражения
Автори російськоюБошелли Дайан Харрис, Бошелли Фрэнк Чарльз, Арндт Ким Тімоти
МПК / Мітки
МПК: A61K 31/496, A61P 9/10, A61K 31/4706, A61K 31/4709
Мітки: ішемічного, 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-алкокси-3-хінолінкарбонітрили, лікування, ушкодження
Код посилання
<a href="https://ua.patents.su/16-80472-4-24-dikhlor-5-metoksifenilamino-6-alkoksi-3-khinolinkarbonitrili-dlya-likuvannya-ishemichnogo-ushkodzhennya.html" target="_blank" rel="follow" title="База патентів України">4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-алкокси-3-хінолінкарбонітрили для лікування ішемічного ушкодження</a>
Попередній патент: Процес підвищення температури газу нагнітання будь-якого ступеня стиснення компресора та установка для його здійснення
Наступний патент: Спосіб визначення ексцентриситету між центром кутомірної шкали і центром обертання поворотного елемента
Випадковий патент: П`єзоелектричний трансформатор












