Мутанти ifnar2, їх одержання та застосування
Формула / Реферат
1. Застосування мутантного поліпептиду (МIFNAR2) рецептора 2 інтерферону типу I (IFNAR2), який включає послідовність, представлену Послідовністю № 1 (SEQ ID No. 1), з мутаціями на амінокислотних залишках гістидині 78 (H78) і аспарагіні 100 (N100), який має більш високу спорідненість до інтерферону-b (IFNb) у порівнянні з поліпептидом дикого типу, або аналога МIFNAR2, з мутаціями на амінокислотних залишках гістидині 78 (H78) і аспарагіні 100 (N100), який має загалом подібну активність і має до 30 видалених, доданих або замінених амінокислотних залишків, або його солі, для виготовлення лікарського засобу для підсилення впливу IFN-b при лікуванні захворювання, вибраного з-посеред аутоімунного захворювання, вірусного захворювання та раку.
2. Застосування за п. 1, де мутації є замінами.
3. Застосування за п. 2, де заміни є неконсервативними.
4. Застосування за будь-яким із пп. 1-3, де залишок гістидину 78 замінений на аланін.
5. Застосування за будь-яким із пп. 1-4, де залишок аспарагіну 100 замінений на аланін, аспарагінову кислоту або гістидин.
6. Застосування за п. 4 або 5, де обидва залишки 78 і 100 замінені на аланін.
7. Застосування за п. 1, де мутантний поліпептид IFNAR2 включає послідовність, представлену Послідовністю № 2 (SEQ ID No. 2), Послідовністю № 3 (SEQ ID No. 3) або Послідовністю № 4 (SEQ ID No. 4).
8. Застосування забудь-яким із пп. 1-7, де спорідненість мутантного поліпептиду IFNAR2 до IFN-b становить приблизно 30 пМ.
9. Застосування за будь-яким із пп. 1-8, де спорідненість мутантного поліпептиду IFNAR2 до IFN-b є у приблизно 25 разів, за варіантом, якому віддається перевага, до 50 разів і, за варіантом, якому віддається більша перевага, до 100 разів більшою за спорідненість IFNAR2 дикого типу.
10. Застосування за будь-яким із пп. 1-9, де мутантний поліпептид IFNAR2 включає позаклітинний домен (МIFNAR2 EC).
11. Застосування за будь-яким із пп. 1-10, де мутант IFNAR є пегільованим.
12. Застосування за будь-яким із пп. 1-11, де лікування додатково включає введення терапевтично ефективної кількості IFN-b.
13. Застосування за будь-яким із пп. 1-12, де лікарський засіб запобігає олігомеризації IFN.
14. Застосування за будь-яким із пп. 1-13, де захворювання вибране з-посеред розсіяного склерозу, ревматоїдного артриту, важкої псевдопаралітичної міастенії, діабету, звичайного вовчака та неспецифічного виразкового коліту, хронічного гранулематозу, гострокінцевої кондиломи, юнацького ларингопапіломатозу, гепатиту А або хронічної інфекції вірусами гепатитів В та С, волосатоклітинного лейкозу, саркоми Капоші, множинної мієломи, хронічного мієлолейкозу, неходжкінської лімфоми або меланоми.
15. Застосування за будь-яким із пп. 1-14 для виготовлення лікарського засобу для підсилення протиракових активностей IFN-b.
16. Застосування за будь-яким із пп. 1-14 для виготовлення лікарського засобу для підсилення імуномодуляторних терапевтичних властивостей IFN-b.
17. Застосування за п. 16 для виготовлення лікарського засобу для підсилення імуномодуляторних терапевтичних властивостей IFN-b при аутоімунних захворюваннях, вибраних з-посеред розсіяного склерозу, ревматоїдного артриту, важкої псевдопаралітичної міастенії, діабету, звичайного вовчака та неспецифічного виразкового коліту.
18. Фармацевтична композиція, яка містить терапевтично ефективну кількість мутантного поліпептиду (МIFNAR2) рецептора 2 інтерферону типу I (IFNAR2), який включає послідовність, представлену Послідовністю № 1 (SEQ ID No. 1), з мутаціями на амінокислотних залишках гістидині 78 і аспарагіні 100, який має більш високу спорідненість до інтерферону-b (IFNb) у порівнянні з поліпептидом дикого типу, або аналога МIFNAR2, з мутаціями на амінокислотних залишках гістидині 78 (H78) і аспарагіні 100 (N100), який має загалом подібну активність і має до 30 видалених, доданих або замінених амінокислотних залишків, для підсилення впливу IFN-b in vivo при лікуванні захворювання, вибраного з-посеред аутоімунного захворювання, вірусного захворювання та раку.
19. Фармацевтична композиція за п. 18, яка відрізняється тим, що терапевтично ефективна кількість МIFNAR2 в щонайменше 30 разів менша, ніж терапевтично ефективна кількість IFNAR2 дикого типу.
20. Фармацевтична композиція за п. 18 або п. 19, яка додатково містить IFN-b.
21. Фармацевтична композиція за будь-яким із пп. 18-20, яка відрізняється тим, що мутант IFNAR2 включає позаклітинний домен.
22. Фармацевтична композиція за будь-яким із пп. 18-21 для підсилення протиракових, імуномодуляторних або противірусних властивостей IFN-b.
23. Фармацевтична композиція за будь-яким із пп. 18-22 для лікування хронічного гранулематозу, гострокінцевої кондиломи, юнацького ларингопапіломатозу, гепатиту А, хронічної інфекції вірусами гепатитів В та С, волосатоклітинного лейкозу, саркоми Капоші, множинної мієломи, хронічного мієлолейкозу, неходжкінської лімфоми, меланоми, розсіяного склерозу, ревматоїдного артриту, важкої псевдопаралітичної міастенії, діабету, неспецифічного виразкового коліту та звичайного вовчака.
Текст
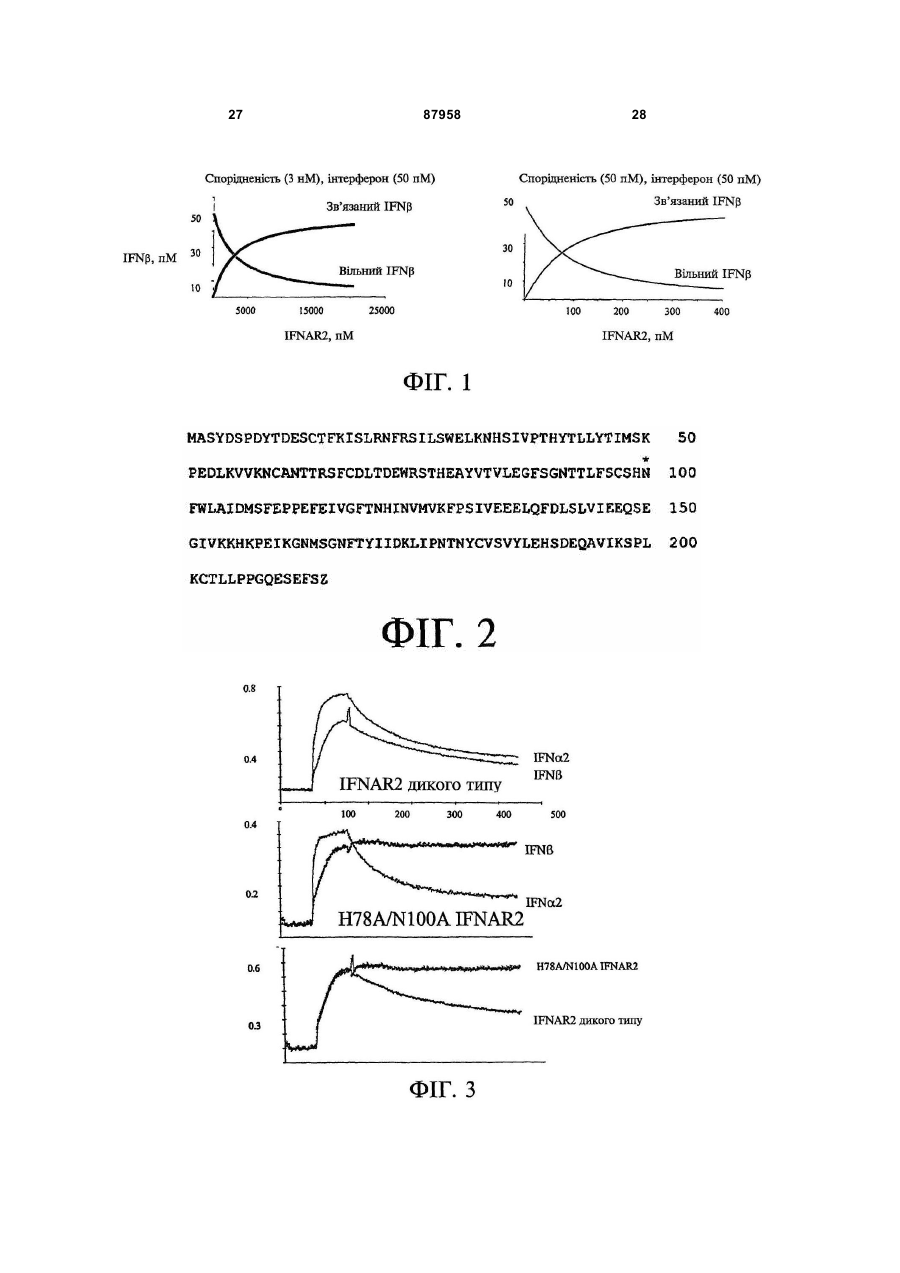
1. Застосування мутантного поліпептиду (МIFNAR2) рецептора 2 інтерферону типу I (IFNAR2), який включає послідовність, представлену Послідовністю № 1 (SEQ ID No. 1), з мутаціями на амінокислотних залишках гістидині 78 (H78) і аспарагіні 100 (N100), який має більш високу спорідненість до інтерферону-b (IFNb) у порівнянні з поліпептидом дикого типу, або аналога МIFNAR2, з мутаціями на амінокислотних залишках гістидині 78 (H78) і аспарагіні 100 (N100), який має загалом подібну активність і має до 30 видалених, доданих 2 (19) 1 3 87958 4 неспецифічного виразкового коліту, хронічного гранулематозу, гострокінцевої кондиломи, юнацького ларингопапіломатозу, гепатиту А або хронічної інфекції вірусами гепатитів В та С, волосатоклітинного лейкозу, саркоми Капоші, множинної мієломи, хронічного мієлолейкозу, неходжкінської лімфоми або меланоми. 15. Застосування за будь-яким із пп. 1-14 для виготовлення лікарського засобу для підсилення протиракових активностей IFN-b. 16. Застосування за будь-яким із пп. 1-14 для виготовлення лікарського засобу для підсилення імуномодуляторних терапевтичних властивостей IFN-b. 17. Застосування за п. 16 для виготовлення лікарського засобу для підсилення імуномодуляторних терапевтичних властивостей IFN-b при аутоімунних захворюваннях, вибраних з-посеред розсіяного склерозу, ревматоїдного артриту, важкої псевдопаралітичної міастенії, діабету, звичайного вовчака та неспецифічного виразкового коліту. 18. Фармацевтична композиція, яка містить терапевтично ефективну кількість мутантного поліпептиду (МIFNAR2) рецептора 2 інтерферону типу I (IFNAR2), який включає послідовність, представлену Послідовністю № 1 (SEQ ID No. 1), з мутаціями на амінокислотних залишках гістидині 78 і аспарагіні 100, який має більш високу спорідненість до інтерферону-b (IFNb) у порівнянні з поліпептидом дикого типу, або аналога МIFNAR2, з мутаціями на амінокислотних залишках гістидині 78 (H78) і аспарагіні 100 (N100), який має загалом подібну активність і має до 30 видалених, доданих або замінених амінокислотних залишків, для підсилення впливу IFN-b in vivo при лікуванні захворювання, вибраного з-посеред аутоімунного захворювання, вірусного захворювання та раку. 19. Фармацевтична композиція за п. 18, яка відрізняється тим, що терапевтично ефективна кількість МIFNAR2 в щонайменше 30 разів менша, ніж терапевтично ефективна кількість IFNAR2 дикого типу. 20. Фармацевтична композиція за п. 18 або п. 19, яка додатково містить IFN-b. 21. Фармацевтична композиція за будь-яким із пп. 18-20, яка відрізняється тим, що мутант IFNAR2 включає позаклітинний домен. 22. Фармацевтична композиція за будь-яким із пп. 18-21 для підсилення протиракових, імуномодуляторних або противірусних властивостей IFN-b. 23. Фармацевтична композиція за будь-яким із пп. 18-22 для лікування хронічного гранулематозу, гострокінцевої кондиломи, юнацького ларингопапіломатозу, гепатиту А, хронічної інфекції вірусами гепатитів В та С, волосатоклітинного лейкозу, саркоми Капоші, множинної мієломи, хронічного мієлолейкозу, неходжкінської лімфоми, меланоми, розсіяного склерозу, ревматоїдного артриту, важкої псевдопаралітичної міастенії, діабету, неспецифічного виразкового коліту та звичайного вовчака. Цей винахід має відношення до мутантних поліпептидів бета-ланцюга рецептора IFN типу І (MIFNAR2) з підвищеною, порівняно з білком дикого типу, спорідненістю до інтереферону-β для продовження ефекту IFNβ in vivo. Передумови створення винаходу Інтерферони поділяються на лейкоцитарні та фібробластні інтерферони типу І або на мітогеніндуковані чи "імунні" інтерферони типу II (Пестка (Pestka) та інші, 1987). Шляхом аналізу ідентичності послідовностей та спільних біологічних активностей було встановлено, що інтерферони типу І включають інтерферон альфа (IFN-α), інтерферон бета (IFN-β) та інтерферон омега (IFN-ω), у той час як інтерферон гамма (IFN-g) є інтерфероном типу II. Гени IFNα, IFNβ та IFNω утворюють кластери на короткому плечі 25 хромосоми 9 (Ленгіл (Lengyl), 1982). Існує щонайменше 25 неалельних генів IFNα, 6 неалельних генів IFNω і один ген IFNβ. Гадають, що усі вони розвинулись з одного спільного предкового гена. У межах видів, гени IFNα мають щонайменше 80% взаємну ідентичність послідовностей. Ген IFNβ має приблизно 50% ідентичність послідовностей з IFNα; ген IFNω є на 70% гомологічним з IFNα (Вайсман (Weissman) та інші, 1986; Дрон (Dron) та інші, 1992). IFNα має діапазон молекулярної маси 1723кДа (165-166 амінокислот), IFNβ приблизно 23кДа (166 амінокислот) і IFNω приблизно 24кДа (172 амінокислоти). Інтерферони типу І є плейотропними цитокінами, що мають таку активність як захист хазяїна проти вірусних та паразитарних інфекцій, протиракові властивості та відіграють роль імуномодуляторів (Барон (Baron) та інші, 1994; Барон (Baron) та інші, 1991). Фізіологічні реакції інтерферону типу І включають антипроліферативний вплив на нормальні та трансформовані клітини, стимулювання цитотоксичної активності лімфоцитів, природних клітин-кілерів та фагоцитів, модулювання диференціації клітин, стимулювання експресії антигенів головного комплексу гістосумісності класу І, пригнічення головного комплексу гістосумісності класу II і модулювання різноманітних поверхневих клітинних рецепторів. За нормальних фізіологічних умов, IFNα та IFNβ (IFNα/β) конститутивно секретуються більшістю людських клітин на низьких рівнях з експресією, яка активується доданням різноманітних індукторів, у тому числі інфекційних агентів (вірусів, бактерій, мікоплазм та найпростіших), дволанцюгової РНК та цитокінів (M-CSF (макрофагальний колонієстимулювальний фактор), IL (інтерлейкін)-1α, IL-2, TNFα (некротичний пухлинний фактор)). Дії інтерферону типу І in vivo можуть контролюватись за допомогою сурогатних маркерів, неоптерину, 2',5'-олігоаденілатсинтетази та мікроглобуліну β2 (Алам (Аlаm) та інші, 1997; Фірлбек (Fierlbeck) та інші, 1996; Салмон (Salmon) та інші, 1996). Інтерферони типу І (IFNα/β/ω) діють через комплекс поверхневих клітинних рецепторів з інду 5 куванням специфічних біологічних ефектів, наприклад, противірусних, протипухлинних та імуномодуляторних. Рецептор IFN типу І (IFNAR) являє собою гетеромультимерний рецепторний комплекс, що складається щонайменше з двох різних поліпептидних ланцюгів (Коламонікі (Colamonici) та інші, 1992; Коламонікі (Colamonici) та інші, 1993; Платаніас (Platanias) та інші, 1993). Гени, що кодують ці ланцюги, знаходяться на хромосомі 21, і їхні білки експресуються на поверхні більшості клітин (Тан (Tan) та інші, 1973). Рецепторні ланцюги початково були позначені як альфа та бета і пізніше одержали назву IFNAR1 для субодиниці альфа та IFNAR2 для субодиниці бета. У більшості клітин молекулярна маса IFNAR1 (альфаланцюг, субодиниця Аза) (Аз (Uze) та інші, 1990) дорівнює 100-130кДа, у той час як молекулярна маса IFNAR2 (бета-ланцюг, βL, IFNα/βR) дорівнює 100кДа. У клітин певних типів (лінії моноцитів та нормальні клітини кісткового мозку) був ідентифікований альтернативний рецепторний комплекс, де субодиниця IFNAR2 (βS) експресується як "скорочений" рецептор із молекулярною масою 51кДа. Субодиниці IFNAR1 та IFNAR2 βS і βL були клоновані (Новік (Novick) та інші, 1994; Доманскі (Domanski) та інші, 1995). Субодиниці IFNAR2 βS та βL мають ідентичні позаклітинні та трансмембранні домени; однак у цитоплазматичному домені спільноідентичними є лише перші 15 амінокислот. Субодиниця IFNAR2 є здатною до самостійного зв'язування IFNα/β, у той час як субодиниця IFNAR1 здатності до зв'язування IFNα/β не має. Коли людською рецепторною субодиницею IFNAR1 самостійно трансфікували лінію мишачих фібробластів L-929, жоден людський інтерферон, за винятком IFNα8/IFNαB, не був здатним до зв'язування з цими клітинами (Аз (Uze) та інші, 1990). L-клітини, трансфіковані людською субодиницею IFNAR2 за відсутності людської субодиниці IFNAR1, зв'язують людський IFNα, причому зв'язування відбувається з Kd приблизно 0,45нМ. У разі трансфікування людськими субодиницями IFNAR2 у присутності людської субодиниці IFNAR1, може демонструватись зв'язування з високою спорідненістю з Kd на рівні 0,026-0,114нМ (Новік (Novick) та інші, 1994; Доманскі (Domanski) та інші, 1995). На більшості клітин, за приблизними оцінками, існує від 500 до 20000 високоафінних та від 2000 до 100000 низькоафінних сайтів зв'язування IFN. Незважаючи на те, що субодиниці комплексу IFNAR1/2 (α/βS або α/βL) зв'язують IFNα з високою спорідненістю, лише пара α/βL, як видається, є функціональним рецептором передачі сигналу. Трансфікування мишачих клітин L-929 субодиницями IFNAR1 та IFNAR2 βL з подальшим інкубуванням з IFNα2 індукує противірусний стан, ініціює фосфорилування внутрішньоклітинних білків і викликає активацію внутрішньоклітинних кіназ (Jak1 і Туk2) та факторів транскрипції (STAT 1, 2 і 3) (Новік (Novick) та інші, 1994; Доманскі (Domanski) та інші, 1995). У відповідному експерименті, трансфекція субодиниці IFNAR2 βS виявилась нездатною до ініціювання подібної реакції. Таким чином, для функціональної активності (противірусна реакція) необхідною є субодиниця IFNAR2 βL, і максималь 87958 6 на індукція відбувається у поєднанні з субодиницею IFNAR1. Окрім зв'язаних із мембраною клітинних поверхневих форм IFNAR, у людській сечі та сироватці ідентифікували розчинний IFNAR (Новік (Novick) та інші, 1994; Новік (Novick) та інші, 1995; Новік (Novick) та інші, 1992; Латфалла (Lutfalla) та інші, 1995). Розчинний IFNAR, виділений із сироватки, має уявну молекулярну масу 55кДа (SDS-PAGE (електрофорез у поліакриламідному гелі у присутності додецилсульфату натрію)), у той час як розчинний IFNAR із сечі має уявну молекулярну масу 40-45кДа (р40). Транскрипти розчинного р40 IFNAR2 є присутніми на рівні мРНК і охоплюють майже увесь позаклітинний домен субодиниці IFNAR2 із двома додатковими амінокислотами на карбоксикінцевій ділянці. Розчинний рецептор IFNAR2 має п'ять потенційних ділянок глікозилування. Було показано, що розчинний р40 IFNAR2 зв'язує IFNα2 і IFNβ та пригнічує in vitro противірусну активність суміші різновидів IFNα ("лейкоцитарний IFN") та окремих інтерферонів типу І (Новік (Novick) та інші, 1995). Було показано, що гібридний білок Ig рекомбінантної субодиниці IFNAR2 пригнічує зв'язування цілого ряду різновидів IFN типу І (IFNαA, IFNαB, IFNαD, IFNβ, IFNα Con1 та IFNω) із клітинами Доді (Daudi) та клітинами лінії COS, подвійно трансфікованими субодиницею α/βS. Були визначені шляхи передачі сигналу IFN типу І (Платаніас (Platanias) та інші, 1996; Ян (Yan) та інші, 1996; Кареші (Qureshi) та інші, 1996; Дункан (Duncan) та інші, 1996; Шарф (Sharf) та інші, 1995; Янг (Yang) та інші, 1996). Гадають, що початкові явища, наслідком яких є передача сигналу, відбуваються завдяки зв'язуванню IFNα/β/ω із субодиницею IFNAR2, з подальшим приєднанням субодиниці IFNAR1 з одержанням комплексу IFNAR1/2 (Платаніас (Platanias) та інші, 1994). Наслідком зв'язування IFNα/β/ω з комплексом IFNAR1/2 є активація двох кіназ Януса (Janus) (Jak1 і Tyk2), які, як гадають, фосфорилують специфічні тирозини на субодиницях IFNAR1 та IFNAR2. Після завершення фосфоритування цих субодиниць, фосфорилуються молекули STAT (STAT 1, 2 і 3), що веде до димеризації транскрипційних комплексів STAT із подальшою ядерною локалізацією транскрипційного комплексу та активацією специфічних IFN-індуцибельних генів. Рандомізоване, подвійне сліпе, плацебоконтрольоване, дворічне багатоцентрове дослідження показало, що природний людський фібробласт ний інтерферон (інтерферон бета), введений підоболонково (IT), ефективно послаблює загострення розсіяного склерозу (MS) у стадії загострення-ремісії. Середній рівень послаблення загострення у 34 пацієнтів із розсіяним склерозом, які одержали інтерферон бета шляхом підоболонкового введення, був значно більшим під час проведення згаданого дослідження, аніж у 35 контрольних пацієнтів, які одержали плацебо (Джейкобз (Jacobs) та інші, 1987). Фармакокінетику та фармакодинаміку інтерферонів типу І визначали на людях (Алам (Alam) та інші, 1997; Фірлбек (Fierlbeck) та інші, 1996; Са 7 лмон (Salmon) та інші, 1996). Виведення IFNβ є доволі швидким із біодоступністю IFNβ нижчою за очікувану для більшості цитокінів. Незважаючи на те, що фармакодинаміку IFNβ визначали на людях, чіткої кореляції між біодоступністю IFNβ та клінічною ефективністю встановлено не було. У нормальних здорових людей-волонтерів наслідком одноразового внутрішньовенного (iv) введення у вигляді болюса (6 МОд) рекомбінантного IFNβ, який одержали на клітинах СНО (яєчник китайського хом'ячка), була швидка фаза розподілу тривалістю 5хв. і кінцевий період напіввиведення тривалістю приблизно 5 год. (Алам (Alam) та інші, 1997). Після підшкірного (sc) або внутрішньом'язового (іm) введення IFNβ, різких змін сироваткових рівнів не спостерігається і системно доступними є лише приблизно 15% дози. Фармакодинамічні показники IFNβ після внутрішньовенного, внутрішньом'язового або підшкірного введення (за результатами визначення змін активності 2',5'олігоаденілатсинтетази (2',5'-AS) у мононуклеарах периферичної крові) були підвищеними впродовж перших 24год. і повільно знижувались до вихідних рівнів впродовж 4 наступних днів. Величина і тривалість біологічного ефекту була однаковою незалежно від шляху введення. Багатодозові фармакодинамічні дослідження IFNβ здійснювали на пацієнтах із меланомою (Фірлбек (Fierlbeck) та інші, 1996). IFNβ вводили підшкірним шляхом, тричі на тиждень у дозі 3 МОд впродовж шести місяців. Активація фармакодинамічних маркерів, 2',5'-олігоаденілатсинтетази, β2мікроглобуліну, неоптерину та природних клітинкілерів, досягала максимального рівня після другої ін'єкції (день 4) і знижувалась через 28 днів. Вона зберігалась на дещо підвищеному рівні впродовж шести місяців. Повідомляли про очищення та повторне впорядкування позаклітинної частини людського IFNAR2 (IFNAR2-EC), експресованої у Escherichia coli та визначення її характеристик відносно її взаємодії з інтерфероном альфа 2 (IFNα2) (Пілер (Piehler) та Шрайбер (Schreiber) 1999A). Було показано, що неглікозилована IFNAR2-EC (молекулярна маса 25кДа) є стабільним, повністю активним білком, який пригнічує противірусну активність IFNα2. Стехіометрія зв'язування IFNα2, за результатами гель-фільтрації, хімічного зшивання та твердофазного виявлення, становить 1:1. Було встановлено, що спорідненість цієї взаємодії становить приблизно 3нМ (Пілер (Piehler) та Шрайбер (Schreiber), 2001). Швидкість утворення комплексу є відносно високою, порівняно з іншими цитокінрецепторними взаємодіями. Сольова залежність кінетики асоціації дозволяє зробити припущення про обмежений, але значний внесок електростатичних сил у швидкість комплексоутворення. Константа дисоціації зростає зі зниженням рН, відповідно до протонування основи із рKа=6,7. Спорідненість IFNβ до IFNAR2 є приблизно у два рази більшою за спорідненість IFNα2 до IFNAR2 (Пілер (Piehler) та Шрайбер (Schreiber), 1999B). Односайтові мутації на ділянці зв'язування IFNAR2 надали можливість картування різниць зв'язування IFNα2 та IFNβ (Пілер (Piehler) та 87958 8 Шрайбер (Schreiber), 1999В). Було, наприклад, встановлено, що мутація Н78А стабілізує комплекс з IFNβ майже у два рази, у той час як комплекс з IFNα2 дестабілізується цією мутацією більше ніж у два рази. Було встановлено, що мутація N100A майже не впливає на швидкість зв'язування IFNα2, у той час як вона зменшує константу швидкості дисоціації для IFNβ майже у чотири рази. У ЕР 1037658 розкривають, що ефект in vivo інтерферону (IFN) типу І може бути продовжений шляхом введення згаданого інтерферону у формі комплексу з IFN-зв'язувальним ланцюгом людського рецептора інтерферону альфа/бета (IFNAR), тобто IFNAR відіграє роль білка-носія IFN. Такий комплекс також поліпшує стабільність інтерферону і підвищує його активність. Згаданий комплекс може бути нековалентним комплексом або таким, у якому IFN та IFNAR зв'язуються ковалентним зв'язком або пептидом. У ЕР 1037658 розкривають також, що збереження IFN у формі такого комплексу збільшує строк придатності IFN і надає можливість збереження за м'якіших умов, аніж було б можливим за інших обставин. Існує потреба у IFNAR2 з поліпшеною спорідненістю до IFNβ, але не до IFNα2, що робить IFNAR2 кращим та специфічним носієм IFNβ. Винахід пропонує мутантний поліпептид IFNAR2 (MIFNAR2), підданий мутації на амінокислотних залишках гістидині 78 та аспарагіні 100, що має підвищену, порівняно з поліпептидом дикого типу, спорідненість до інтерферону-β (IFNβ), або його аналог, функціональну похідну, гібридний білок чи сіль. Мутації являють собою заміни амінокислот, за варіантом, якому віддають перевагу, консервативних амінокислот, за варіантом, якому віддають більшу перевагу, аланіну, аспарагінової кислоти та гістидину. Мутант IFNAR2 має приблизно у 25 разів, за варіантом, якому віддають перевагу, у 50 разів та, за варіантом, якому віддають більшу перевагу, у 100 разів вищу спорідненість, аніж білок дикого типу, і значення, якому віддають перевагу, становить приблизно 30пМ. Конкретніше, винахід пропонує фрагмент мутантного поліпептиду IFNAR2, до складу якого входить позаклітинний домен. Окрім того, винахід пропонує ДНК, що кодує мутантний поліпептид IFNAR2 за цим винаходом, вектор, що містить згадану ДНК, клітини-хазяї, що включають згаданий вектор, та способи одержання поліпептиду-мутанта за цим винаходом шляхом культивування згаданих клітин-хазяїв та виділення продукованого поліпептиду-мутанта. За іншим аспектом, винахід пропонує застосування мутантного поліпептиду IFNAR2 для виготовлення лікарського засобу для модулювання ефектів IFN, за варіантом, якому віддають перевагу, IFNβ, in vivo. Винахід пропонує також фармацевтичну композицію, що містить терапевтично ефективну кількість мутанта IFNAR2 або його фрагмента, що являє собою позаклітинний домен, для введення самостійно або разом з IFN, за варіантом, якому віддають більшу перевагу, з IFNβ, роздільно або у ковалентно зв'язаній формі. Конкретніше, винахід пропонує фармацевтичні композиції для підсилен 9 ня противірусних, протиракових та імуномодуляторних властивостей IFNβ та для лікування автоімунних захворювань, наприклад, розсіяного склерозу, ревматоїдного артриту, важкої псевдопаралітичної міастенії, діабету, неспецифічного виразкового коліту та звичайного вовчака. Окрім того, винахід пропонує способи лікування автоімунних захворювань, вірусних захворювань та раку, що включають введення мутантного поліпептиду IFNAR2 за цим винаходом. На додаток до цього, винахід пропонує застосування мутантного поліпептиду IFNAR2, який, за варіантом, якому віддають перевагу, вводять разом з антагоністом IFN для пригнічення активності IFN у разі захворювання, яке загострюється або викликається IFN. Винахід також пропонує застосування мутантного поліпептиду IFNAR2 за цим винаходом у лікарській формі для запобігання олігомеризації IFN. На Фіг.1 (зліва) зображено моделювання концентрацій зв'язаного та вільного IFNβ із застосуванням постійної концентрації IFN (50пМ) та концентрацій, що підвищуються за допомогою IFNAR2 ЕС (зліва) та мутантного IFNAR2 ЕС (справа) з Kd=3нМ та 50пМ, відповідно, що розраховуються відповідно до закону діючих мас. На Фіг.2 показана амінокислотна послідовність позаклітинного домену білка IFNAR2 (без включення лідерної послідовності) та модифіковані амінокислотні залишки (помічені зірочкою). На Фіг.3 показано зв'язування IFNβ та IFNα2 з мутантом IFNAR2 EC H78A/N100A. Асоціацію та дисоціацію IFNβ та IFNα2 з IFNAR2 EC дикого типу (верхній графік), з мутантом IFNAR2 EC H78A/N100A (середній графік) та зв'язування IFNAR2 дикого типу та мутанта IFNAR2 EC H78A/N100A з IFNβ (нижній графік) визначали за допомогою рефлектометричної інтерференційної спектроскопії (RifS) з IFNAR2, імобілізованим на поверхні (опис наведено у (Пілер (Piehler) та Шрайбер (Schreiber), 2001). Вісь Y=сигнал (нанометри) та вісь Х=час (секунди). На Фіг.4 показана оклюзія IFNβ IFNAR2 дикого типу і мутантами. Постійну кількість IFNβ (10пМ) змішували з різними концентраціями IFNAR2 (R2) дикого типу та мутантами (моносайтові мутанти R2N100A та R2H78A, двосайтові мутанти R2 H78A/N100A, R2 H78A/N100H і R2 H78A/N100D), і залишкову противірусну активність у стані рівноваги визначали на клітинах WISH. У верхній рамці показано графік противірусної активності IFNβ, як функцію його концентрації за відсутності IFNAR2 (вісь Y=індекс виживаності). Цей графік застосовується як стандарт для визначення, яка кількість IFNβ є вільною (активною) при проведенні противірусного аналізу. Винахід має відношення до мутанта беталанцюга рецептора IFN типу І (IFNAR2), який було піддано мутації на амінокислотних залишках Н78 та N100 (дивись послідовність ДНК IFNAR2 дикого типу на Фіг.2, Послідовність №1), що має підвищену спорідненість до IFNβ, але не до IFNα2 (MIFNAR2). Винахід має також відношення до системи-носія лікарського засобу для підвищення активності IFN, що включає позаклітинний домен 87958 10 (EC) MIFNAR2. Винахід має відношення до MIFNAR2, його аналога, функціональної похідної, гібридного білка, фрагмента або його солей. Носії, як правило, вводять для продовження часу внутрішньосудинного утримування білків, що мають молекулярну масу менше 50000 Да (наприклад, інтерферону). Особливо благоприємними є такі носії, які зв'язуються нековалентно і забезпечують можливість постійного вивільнення лікарського засобу. Застосування такого носія є бажаним для того, щоб у будь-який час мати деяку частину вільного лікарського засобу доступною для лікувальної активності (приблизно 20%) і деяку кількість лікувального засобу, зв'язану з носієм та захищену (приблизно 80%). На Фіг.1 (лівий графік) зображено моделювання концентрацій зв'язаного та вільного IFNβ у присутності різних концентрацій IFNAR2 на основі закону діючих мас та з Kd=3нМ (визначено за допомогою рефлектометричної інтерференційної спектроскопії [RifS]). Це моделювання показує, що для одержання 20% вільного IFNβ (10пМ, що дорівнює приблизно 100Од), та 80% зв'язаного, необхідною є дуже висока концентрація білка IFNAR2, наприклад, 12,5нМ (що є еквівалентним 300мкг/кг неглікозилованого IFNAR2). Таким чином, застосування мутанта IFNAR2 з вищою у 50 і більше разів спорідненістю до IFNβ як носія (дивись моделювання, Фіг.1, правий графік) було б вигідним, оскільки для одержання 20% вільного IFNβ (що є еквівалентним 6 мг/кг) необхідним, теоретично, було б лише приблизно 0,24нМ такого мутанта. Одержали мутант IFNAR2 з підвищеною спорідненістю до IFN (MIFNAR2). Для одержання MIFNAR2 EC, IFNAR2 ЕС дикого типу (Фіг.1, Послідовність №1) модифікували на двох амінокислотних залишках, залишку 78, гістидині, та залишку 100, аспарагіні (дивись Фіг.2, Фіг.3 та Фіг.4, Послідовності №2, №3 та №4). Ці мутантні білки IFNAR2 ЕС виявились кращим носієм конкретно для IFNβ, тобто такий носій має підвищену спорідненість до IFNβ, у той час як його спорідненість відносно IFNα2 залишається незмінною. Було встановлено, що спорідненість мутанта до IFNβ була у 26, 40 та більше ніж у 50 разів вищою, аніж відповідні показники для дикого типу (Таблиця 4). Одержані результати показують, що незважаючи на підвищену спорідненість цього мутантного розчинного рецептора (Kd мутанта H78A/N100A IFNAR2 ~30пМ, порівняно з Kd білка дикого типу =3нМ), достатня кількість IFNβ залишається незв'язаною і терапевтично активною, про що свідчить противірусна захисна активність клітин WISH, експериментально інфікованих VSV (вірусом везикулярного стоматиту) (Фіг.4). Результати також показують, що рівні оклюзії IFN (кількість зв'язаного IFN за умов рівноваги), які досягаються за допомогою IFNAR2 EC дикого типу, можуть бути одержані із застосуванням менших концентрацій мутантів IFNAR EC. Найкращі результати одержують із мутантами, модифікованими на обох залишках, зокрема, коли обидві амінокислоти замінюють на аланін, H78A/N100A IFNAR2, наприклад, для одержання 80% зв'язаного IFNβ (8пМ зв'язаного і 2пМ вільного IFNβ), необхідно приблизно у 30 ра 11 зів менше мутанта H78A/N100A IFNAR2, аніж білка IFNAR2 дикого типу. Цей результат показує, що двосайтовий мутант IFNAR2 більш ефективно зв'язує IFNβ і для здійснення ним його активності, як носія IFNβ, необхідним є введення значно менших його кількостей. Переваги застосування MIFNAR2 EC: (І) можна вводити менші кількості (що є технічно можливим) рецептора як носія; (II) завдяки стабілізувальній активності мутанта можна зменшити кількість IFNβ, що вводиться, і, як наслідок, зменшити деякі небажані побічні ефекти лікування за допомогою інтерферону; (III) підвищення активності мутантом є специфічним для IFNβ; і (IV) у разі деяких запальних розладів, при яких може виникнути необхідність зниження концентрацій IFN, цей мутант, за певних умов, можна застосовувати як ефективний антагоніст, конкретно відносно IFNβ, але не IFNα2. MIFNAR2-EC може вводитись самостійно для стабілізації та підсилення активності ендогенного IFNβ, що є особливо корисним для лікування пацієнтів, які мають захворювання або знаходяться у стані, який, природним шляхом, викликає підвищення нативного IFN, завдяки чому IFN вже буде циркулювати у тілі для здійснення свого передбачуваного природного ефекту боротьби проти такого захворювання або стану. MIFNAR2-EC буде впливати конкретно на ендогенний IFNβ, але меншою мірою на IFNα2. За альтернативним варіантом, MIFNAR2-EC може вводитись разом з IFN, за варіантом, якому віддають перевагу, з IFNβ, або може вводитись ковалентно зв'язаним з IFNβ для модулювання активності IFNβ. За варіантом, якому віддають перевагу, MIFNAR2 та IFNβ, які використовують для одержання комплексу, являють собою рекомбінантні молекули. Технологія, необхідна для одержання гібридного білка мутантного EC IFNAR2 та IFN, є подібною до технолога, описаної для одержання комплексу IFNAR/IFN дикого типу, докладний опис якої наведено у WO 9932141, де замість варіанта дикого типу застосовують IFNAR2, підданий мутації на Н78 і N100 (MIFNAR2). Наслідки застосування нековалентно зв'язаного комплексу MIFNAR2/IFNβ за цим винаходом полягають у тому, що необхідними є нижчі концентрації IFNAR2 EC, і цей комплекс може застосовуватись при цілому ряді терапевтичних показань, при яких IFN сам по собі є терапевтично активним. До згаданих показань належать показання, при яких вільні інтерферони продемонстрували деяку терапевтичну активність, наприклад, противірусну, протиракову та імуномодуляторну активність. Очікується, що комплекс мутантного IFNAR2/IFN, унаслідок більшої його ефективності, підвищеної активності та/або поліпшеної фармакокінетики (тобто періоду напіввиведення), буде більш ефективним при лікуванні вірусних, онкологічних та автоімунних розладів. У разі введення in vivo, рецепторний комплекс інтерферону підсилює біодоступність, фармакокінетику та/або фармакодинаміку IFN, з підсилен 87958 12 ням, завдяки цьому, противірусних, протиракових та імуномодуляторних властивостей IFN. До молекул, яким віддається перевага для застосування у комплексах за цим винаходом, належить амінокислотна послідовність нативного IFN-β та MIFNAR2 (Послідовності №2, №3 і №4). Природною послідовністю є послідовність природного людського IFN-β. Такі послідовності є відомими і можуть бути легко знайдені у літературі. Природні алельні варіанти також розглядаються як нативні послідовності. Цей винахід стосується також аналогів вищезгаданого MIFNAR2 EC. Такими аналогами можуть бути аналоги, у білках яких до приблизно 30 амінокислотних залишків, за варіантом, якому віддають перевагу, до 20 амінокислотних залишків і більше, і за варіантом, якому віддають найбільшу перевагу, 10 амінокислотних залишків можуть піддаватись делеції, додаватись або замінюватись на інші, за винятком мутацій на залишках 78 і 100, наслідком яких є зниження спорідненості MIFNAR2 до IFNβ, порівняно зі спорідненістю IFNAR2 дикого типу до IFNβ. Ці аналоги одержують за допомогою відомих методів синтезу та/або сайтспрямованого мутагенезу чи інших відомих придатних для цього способів. Будь-який з таких аналогів, за варіантом, якому віддають перевагу, має послідовність амінокислот, яка достатньою мірою дублює послідовність основного MIFNAR2 для того, щоб мати активність, по суті подібну активності останнього. Таким чином, шляхом стандартного експериментування, яке включає піддання кожного такого аналога випробуванням на зв'язування та біологічну активність, можна визначити, чи має будь-який даний аналог по суті таку саму активність та/або стабільність, що і білок та комплекс за цим винаходом. Аналоги MIFNAR2 EC можуть зв'язувати IFNβ зі спорідненістю, яка у від щонайменше 15 разів до 50-100 разів перевищує спорідненість білка дикого типу, причому спорідненість до IFNα2 значною мірою не змінюється. Відносно IFNβ, аналоги MIFNAR2 EC можуть демонструвати Kd приблизно 30пМ і нижче. Випробування зв'язування для взаємодії MIFNAR2 та IFN можуть включати аналітичну гель-фільтрацію, виявлення оптично гетерогенної фази (наприклад, поверхневий плазмонний резонанс [SPR] або рефлектометрична інтерференційна спектроскопія [RifS], яка нагадує широко розповсюджений метод BIACORE) та флуоресцентну спектроскопію (Пілер (Piehler) та Шрайбер (Schreiber), 1999A; Пілер (Ріеhlеr) та Шрайбер (Schreiber), 2001). Аналоги комплексу, які можуть застосовуватись за цим винаходом, або послідовності нуклеїнових кислот, що їх кодують, включають кінцеву сукупність по суті відповідних послідовностей як замінних пептидів або полінуклеотидів, які можуть одержуватись стандартним шляхом пересічним фахівцем у цій галузі без зайвого експериментування, виходячи з роз'яснень та настанов, наведених у цьому описі. Докладний опис хімії та структури білків дивись у Шульц (Schulz) та інші, Principles of Protein Structure, Springer Verlag, New York (1978); та Крайтон Т.Е. (Creighton Т.Е.), 13 Proteins: Structure and Molecular Properties, W.H. Freeman&Co, San Francisco (1983), які включено до цього опису як посилання. Для представлення замін нуклеотидних послідовностей, наприклад, варіантів кодонів, яким віддається перевага, дивись Озбел (Ausubel) та інші, (1987, 1992), А.1, l-А, 1.24 та Сембрук (Sambrook) та інші, (1987, 1992) 6.3 та 6.4 у Додатках С та D. Замінами аналогів за цим винаходом, яким віддають перевагу, є заміни, відомі як "консервативні". Консервативні заміни амінокислот у послідовності білків за цим винаходом можуть включати синонімічні амінокислоти у межах групи, які мають фізико-хімічні властивості, достатньо подібні для того, щоб у разі заміни між членами цієї групи зберігалась біологічна функція молекули (Грантем (Grantham), 1974). Зрозуміло, що у вищезгаданих послідовностях можуть здійснюватись також інсерції та делеції амінокислот без зміни функції згаданих послідовностей, зокрема, якщо інсерції або делеції залучають лише декілька амінокислот, наприклад, до тридцяти, а за варіантом, якому віддають перевагу, до десяти, і при цьому не видаляються або не замінюються амінокислоти, які є критичними для функціональної конформації, наприклад, залишки цистеїну (Анфінсен (Anfinsen), 1973). Аналоги, які одержують шляхом таких делецій або інсерцій, входять до сфери дії цього винаходу. За варіантом, якому віддають перевагу, до груп синонімічних амінокислот належать групи, визначені у Таблиці І. За варіантом, якому віддають більшу перевагу, групами синонімічних амінокислот є групи, визначені у Таблиці II; і, за варіантом, якому віддають найбільшу перевагу, групами синонімічних амінокислот є групи, визначені у Таблиці III. 87958 14 15 Приклади здійснення амінокислотних замін у білках, які можуть застосовуватись для одержання аналогів MIFNAR2 або MIFNAR2 ЕС для застосування у цьому винаході, включають будь-які відомі стадії способів, наприклад, подані у патентах США №RE 33,653; №4,959,314; №4,588,585 та №4,737,462 на ім'я Марк (Mark) та ін.; №5,116,943 на ім'я Коте (Koths) та ін.; №4,965,195 на ім'я Неймен (Namen) та ін.; та №5,017,691 на ім'я Лі (Lee) та ін., та білки із заміненим лізином, подані у патенті США №4,904,584 (Шоу (Shaw) та інші). Термін "по суті відповідають" означає аналоги з незначними замшами послідовності основного MIFNAR2 або MIFNAR2 EC, які не впливають на їхні основні характеристики, наприклад, їхнє специфічне підсилене зв'язування та спорідненість до ΙFΝβ. Типом замін, які розглядаються як такі, що відповідають терміну "по суті відповідають", є заміни, які можуть бути наслідком традиційних способів мутагенезу ДНК, що кодує комплекс за цим винаходом, що викликають декілька незначних модифікацій з подальшим виявленням необхідної активності способом, який обговорювався вище. За варіантом, якому віддають перевагу, складова частина MIFNAR2 комплексу буде мати корову послідовність, яка є такою самою, що і відповідна складова нативної послідовності або її біологічно активного фрагмента чи її варіанта, яка має амінокислотну послідовність із щонайменше 70% ідентичністю до нативної амінокислотної послідовності і зберігає її біологічну активність. За варіантом, якому віддають більшу перевагу, така послідовність має щонайменше 85% ідентичність, щонайменше 90% ідентичність або, за варіантом, якому віддають найбільшу перевагу, щонайменше 95% ідентичність до нативної послідовності. Щодо складової частини IFN комплексу, коровою послідовністю, яка може застосовуватись, є нативна послідовність або її біологічно активний фрагмент чи її варіант, яка має амінокислотну послідовність із щонайменше 70% ідентичністю, за варіантом, якому віддають більшу перевагу, щонайменше 85% ідентичність або щонайменше 90% ідентичність, та, за варіантом, якому віддають найбільшу перевагу, щонайменше 95% ідентичність. Такі аналоги повинні зберігати біологічну активність нативної послідовності IFN або її фрагмента, або мати антагоністичну активність як буде обговорюватись у цьому описі нижче. Термін "ідентичність послідовності", який застосовують у цьому описі, означає, що послідовності порівнюють таким чином. Послідовності впорядковано розміщують за допомогою програми GAP (програма повного впорядкованого розміщення) (Genetic Computing Group, версія 9) із застосуванням матриці зі значеннями, що надаються за замовчуванням (BLOSUM62) (значення від -4 до +11) зі штрафом за відкритий проміжок -12 (для першого нуля проміжку) і штрафом за подовження проміжку -4 (за кожний додатковий послідовний нуль проміжку). Після впорядкованого розміщення 87958 16 відсоток ідентичності обчислюють шляхом вираження кількості відповідностей у вигляді відсотка кількості амінокислот у заявленій послідовності. Аналоги за цим винаходом можуть також визначатись за такою процедурою. Відносно складової частини MIFNAR2 комплексу або складової частини IFN комплексу, послідовності ДНК IFNAR та IFN є відомими у цій галузі, і їх можна або знайти у літературі, цитованій у попередньому розділі цього опису, або легко визначити пересічним фахівцям у цій галузі. Поліпептиди, закодовані будьякою нуклеїновою кислотою, наприклад, ДНК або РНК, які гібридизуються для доповнення нативної ДНК або РНК за умов високої або помірної жорсткості, доти, доки цей поліпептид зберігає біологічну активність нативної послідовності або, у разі IFN, зберігає біологічну активність MIFNAR2 або MIFNAR2 ЕС або має антагоністичну активність, також розглядаються як такі, що входять до обсягу цього винаходу. Термін "жорсткі умови" означає умови гібридизації та подальшого промивання, які пересічні фахівці у цій галузі традиційно називають "жорсткими". Дивись Озбел (Ausubel), Current Protocols in Molecular Biology, дивись вище, Interscience, N.Y., §6.3 і §6.4 (1987, 1992) та Сембрук та інші (Сембрук Дж.К. (Sambrook J.C.), Фрітш Е.Ф. (Fritsch E.F.), Маніатіс Т. (Maniatis T.) (1989) Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY). Приклади жорстких умов, без обмеження, включають умови промивання при температурі на 12-20°С нижчій за визначену Тm гібриду, який піддається дослідженню, у, наприклад, 2´SSC (стандартний цитратний фізіологічний розчин) та 0,5% SDS (додецилсульфат натрію), 2´SSC та 0,1% SDS впродовж 15хв.; 0,1xSSC та 0,5% SDS при температурі 37°С впродовж 30-60хв. і, після цього, 0,1´SSC та 0,5% SDS при температурі 68°С впродовж 30-60хв. Пересічним фахівцям у цій галузі зрозуміло, що умови жорсткості також залежать від довжини послідовностей ДНК, олігонуклеотидних зондів (наприклад, 10-40 основ) або змішаних олігонуклеотидних зондів. У разі застосування змішаних зондів, перевагу віддають застосуванню тетраметиламонію хлориду (ТМАС) замість SSC. Дивись Озбел (Ausubel), вище. Словосполучення "функціональні похідні", яке застосовують у цьому описі, означає похідні, які можуть бути одержані з функціональних груп, присутніх у вигляді бічних ланцюгів на залишках, або N- чи С-кінцевих груп, засобами, відомими у цій галузі, і які включаються до цього винаходу доти, доки вони залишаються фармацевтично прийнятними, тобто вони не знищують біологічної активності відповідного білка комплексу, як описується, і не надають токсичних властивостей композиціям, які їх містять або комплексу, який одержують з їх використанням. Похідні можуть мати хімічні складові, наприклад, вуглеводні або фосфатні залишки, за умови, що така частина має таку саму біологічну активність і залишається фармацевтично прийнятною. Похідні можуть включати, наприклад, аліфатичні складні ефіри карбоксилу карбоксильних груп, аміди карбоксильних груп, одержані шляхом реак 17 ції з аміаком або з первинними чи вторинними амінами, N-ацильні похідні вільних аміногруп амінокислотних залишків, одержаних з ацильними складовими (наприклад, алканоїльні або карбоциклічні ароїльні групи) або О-ацильні похідні вільної гідроксильної групи (наприклад, похідні залишків серилу або треонілу), одержані з ацильними складовими. Такі похідні можуть також включати, наприклад, бічні ланцюги поліетиленгліколю, які можуть маскувати антигенні сайти і продовжувати перебування комплексу або його частин у загальній воді організму. Термін "гібридний білок" означає поліпептид, до складу якого входить MIFNAR2 або MIFNAR2 EC, його аналог або фрагмент, злитий з іншим білком, який, наприклад, має продовжений час перебування у загальній воді організму. Таким чином, MIFNAR2 або MIFNAR2 EC може зливатись з іншим білком, поліпептидом або т.ін., наприклад, імуноглобуліном або його фрагментом. "Фрагментом" за цими винаходом може, наприклад, бути фрагмент MIFNAR2 або MIFNAR2 EC. Термін "фрагмент" означає будь-який піднабір молекули, тобто коротший пептид, який зберігає бажану біологічну активність. Фрагменти можуть легко одержуватись шляхом видалення амінокислот із будь-якого кінця молекули MIFNAR2 і перевірки одержаного фрагмента на його здатність до зв'язування з IFNβ. Протеази, які можуть застосовуватись для одночасного видалення однієї амінокислоти з N-кінцевої або С-кінцевої ділянки поліпептиду, є відомими, і, таким чином, визначення фрагментів, які зберігають бажану біологічну активність, полягає лише у стандартному експериментуванні. Цей винахід додатково включає як активний фрагмент MIFNΑR2, його аналоги та гібридні білки, будь-який фрагмент або попередники поліпептидного ланцюга білкової молекули самостійно або разом із молекулами чи залишками, приєднаними до неї, наприклад, залишками цукру або фосфорної кислоти чи агрегати білкової молекули або залишків цукру самих по собі, за умови, що згаданий фрагмент має по суті подібну активність. Термін "солі", який застосовують у цьому описі, означає як солі карбоксильних груп, так і солі аміногруп комплексу за цим винаходом або його аналогів, що одержують доданням кислоти. Солі карбоксильної групи можуть одержуватись засобами, відомими у цій галузі, і включають неорганічні солі, наприклад, солі натрію, кальцію, амонію, заліза або цинку тощо, і солі, які одержують з органічними основами, наприклад, солі, які одержують, наприклад, з амінами, наприклад, триетаноламіном, аргініном або лізином, піперидином, прокаїном тощо. Солі, що одержують доданням кислоти, включають, наприклад, солі мінеральних кислот, наприклад, хлористоводневої кислоти або сірчаної кислоти, і солі органічних кислот, наприклад, оцтової кислоти або щавлевої кислоти. Звичайно, будь-яка з таких солей повинна мати біологічну активність, по суті подібну біологічній активності комплексу за цим винаходом або його аналогів. 87958 18 Термін "біологічна активність", який застосовують у цьому описі, витлумачується таким чином. Щодо MIFNAR2, важливою біологічною активністю є його здатність до зв'язування IFNβ з підвищеною спорідненістю. Таким чином, аналоги або варіанти, солі та функціональні похідні повинні вибиратись таким чином, щоб зберігалась ця інтерферонзв'язувальна здатність. Це може перевірятись шляхом стандартних експериментів з аналізом зв'язування. Окрім того, фрагменти MIFNAR2 або його аналоги можуть також застосовуватись доти, доки вони зберігають свою підсилену активність зв'язування інтерферону. Фрагменти можуть легко одержуватись шляхом видалення амінокислот з будь-якого кінця інтерферон-зв'язувального поліпептиду з перевіркою одержаного продукту на інтерферон-зв'язувальні властивості. На додаток до цього, поліпептид, що має таку інтерферон-зв'язувальну активність, яким може бути MIFNAR2, MIFNAR2 EC, аналог, функціональна похідна, фрагмент, може також включати додаткові амінокислотні залишки, що фланкують інтерферон-зв'язувальний поліпептид. Доти, доки одержана молекула зберігає підвищену інтерферон-зв'язувальну здатність корового поліпептиду, шляхом стандартного експериментування можна визначати, чи впливають будь-які фланкуючі залишки на основні та нові характеристики корового пептиду, тобто його інтерферон-зв'язувальні характеристики. Термін "включає по суті", у разі його застосування до визначеної послідовності, означає, що можуть бути присутніми додаткові фланкуючі залишки, які не впливають на основні та нові характеристики визначеної послідовності. Цей термін не означає замін, делецій або додань у межах визначеної послідовності. Незважаючи на те, що у цьому описі та у прикладах застосовують MIFNAR2 або MIFNAR2 EC, слід розуміти, що це є просто приклад, якому віддають перевагу, і що субодиниця IFNAR1, і особливо її позаклітинний домен, може застосовуватись разом із MIFNAR2 або MIFNAR2 EC. Щодо інтерферонової складової частини комплексу за цим винаходом, біологічною активністю, яка повинна зберігатись будь-яким аналогом, функціональною похідною, гібридним білком або фрагментом, є активність інтерферону, на яку покладаються для передбачуваного варіанта застосування. У більшості випадків це буде здатність до зв'язування з нативним клітинним поверхневим рецептором і, таким чином, опосередковування продукування сигналу рецептором. Таким чином, будь-який аналог, похідна або фрагмент повинні зберігати таку рецепторну агоністичну активність для можливості використання у цьому винаході для такого варіанта застосування. З іншого боку, подеколи на рецепторі корисно мати молекулу з антагоністичною активністю для запобігання біологічної активності нативного інтерферону. Такий агоніст може також застосовуватись для тривалого сприятливого ефекту за допомогою комплексу за цим винаходом. Для таких варіантів застосування, у яких необхідно ліквідувати небажаний ефект інтерферону, аналоги, які все ще залишаються зв'язаними рецептором і складовою 19 частиною IFNAR комплексу, однак які не опосередковують сигналу і блокують утворення сигналу нативним інтерфероном на цьому рецепторі (тобто антагоністі інтерферону), можуть також розглядатись, як біологічно активні для цілей цього винаходу і позначатись терміном "інтерферон" у разі застосування відносно комплексів за цим винаходом. За допомогою простих аналізів можна визначити, зберігає такий аналог таку рецепторну агоністичну активність або має рецепторну антагоністичну активність, і міг би, таким чином, бути придатним для одного із варіантів застосування за цим винаходом. Цей винахід також має відношення до послідовностей ДНК, що кодують MIFNAR2 ЕС, наприклад, ДНК, що кодує амінокислотні послідовності в Послідовностях: №2, №3 та №4 або їхніх аналогів та фрагментів, а також до ДНК-векторів, що містять такі послідовності ДНК для експресії в придатних прокаріотних або еукаріотних клітинаххазяях. Можливість одержання великих кількостей гетерологічних білків за допомогою системи експресії рекомбінантних білків призвела до розробки різних терапевтичних засобів, наприклад, t-PA (тканинний активатор плазміногена) та ЕРО (еритропоетин) (Едінгтон (Edington), 1995). Діапазон різних експресійних хазяїв, які можуть продукувати рекомбінантні білки, розпочинається від прокаріот за походженням (наприклад, бактерій) (Олінз (Olins), 1993), і проходить через нижчі еукаріоти (наприклад, дріжджі) (Ратнер (Ratner), 1989) до вищих еукаріотних видів (наприклад, комах та клітин ссавців) (Рувені (Reuveny), 1993; Рефф (Reff), 1993). Усі ці системи покладаються на однаковий принцип - введення послідовності ДНК необхідного білка до клітини вибраного типу (тимчасовим або постійним чином, як інтегрований або епісомний елемент) і використання механізмів транскрипції, трансляції та транспортування хазяїна для надекспресії введеної послідовності ДНК як гетерологічного білка (Кіоун (Keown), 1990). Описують різні методики одержання рекомбінангаих гетеро логічних білків (Озбел (Ausubel) та інші, Current Protocols in Molecular Biology, Greene Publications and Wiley Interscience, New York, NY, 1987-1995; Сембрук (Sambrook) та інші, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, 1989). Окрім експресії нативних генних послідовностей, здатність маніпулювання ДНК на нуклеотидному рівні прискорила розробку нових рекомбінантних послідовностей, які, хоча їх основу і складають природні білки, мають нові активності як результат змін первинної білкової структури (Гразіа (Grazia), 1997). Більше того, вибрані послідовності ДНК можуть фізично з'єднуватись для продукування транскриптів, які перетворюються на нові гібридні білки, де попередньо незалежні білки зараз експресуються як одна поліпептидна одиниця (Ібанес (Ibanez), 1991). Активність таких гібридних білків може бути різною, наприклад, більш ефективною, аніж будь-якого з окремих білків (Куртіс (Curtis), 1991). 87958 20 Для спільного введення MIFNAR2 EC з IFN, людський IFNβ може одержуватись за допомогою способу продукування, у якому застосовують клітини СНО (клітини яєчника китайського хом'ячка), як розкривається у ЕР 220574. Інтерферони типу І можуть експресуватись різноманітними клітинамихазяями, у тому числі клітинами бактерій (Уцумі (Utsumi), 1987), комах (Сміт (Smith), 1983) і людей (Хрістофініс (Christofinis), 1981). Людський MIFNAR2 або його фрагмент може експресуватись із застосуванням клітини-хазяїна СНО. Для секреції MIFNAR2 EC клітинами СНО, послідовність ДНК MIFNAR2 ЕС може лігуватись до послідовності сигнального пептиду соматотропного гормону людини, як описано у заявці на патент WO 0022146. За альтернативним варіантом, розчинні рецептори, наприклад, MIFNAR2 ЕС, можуть успішно експресуватись бактеріальними системами експресії (Терліцез (Terlizzese), 1996). Винахід має також відношення до фармацевтичної композиції, що містить як активний інгредієнт MIFNAR2, MIFNAR2 EC, комплекс MIFNAR2 EC/IFN або аналоги, гібридні білки, функціональні похідні, їхні фрагменти, їхні суміші або їхні солі, і фармацевтично прийнятний носій, розріджувач або наповнювач. Варіант здійснення фармацевтичної композиції за цим винаходом включає фармацевтичну композицію для підсиленої дії IFN при лікуванні вірусних захворювань, у протираковій терапії, у імуномодуляторній терапії, наприклад, при автоімунних захворюваннях та інших варіантах застосування інтерферонів та цитокінів, що до них відносяться. Фармацевтичні композиції за цим винаходом одержують для введення шляхом змішування MIFNAR2, MIFNAR2 EC, комплексу MIFNAR2 EC/IFN або аналогів, гібридних білків, функціональних похідних, їхніх фрагментів, їхніх сумішей або їхніх солей з фізіологічно прийнятними стабілізаторами та/або наповнювачами, і надають їм дозованої лікарської форми, наприклад, шляхом ліофілізації у дозованих ампулах. Спосіб введення може здійснюватись будь-яким прийнятним шляхом введення для подібних агентів, і буде залежати від стану, який підлягає лікуванню, наприклад, внутрішньовенно, внутрішньом'язово і підшкірно, місцевою ін'єкцією або місцевим нанесенням або безперервно шляхом вливання тощо. Кількість активної сполуки, призначеної для введення, буде залежати від шляху введення, хвороби, яка повинна лікуватись, і стану пацієнта. Цей винахід має відношення до способу лікування автоімунних захворювань, наприклад, розсіяного склерозу, ревматоїдного артриту, важкої псевдопаралітичної міастенії, діабету, звичайного вовчака і неспецифічного виразкового коліту, що включає введення терапевтично ефективної кількості MIFNAR2, MIFNAR2 EC, комплексу MIFNAR2 EC/IFN або аналогів, гібридних білків, функціональних похідних, їхніх фрагментів, їхніх сумішей або їхніх солей. Цей винахід має відношення до способу лікування вірусних захворювань, наприклад, гранулематозу, гострокінцевої кондиломи, юнацького ларингопапіломатозу, гепатиту А або хронічної 21 інфекції вірусами гепатитів В і С, що включає введення терапевтично ефективної кількості MIFNAR2, MIFNAR2 EC, комплексу MIFNAR2 EC/IFN або аналогів, гібридних білків, функціональних похідних, їхніх фрагментів, їхніх сумішей або їхніх солей. Цей винахід має відношення до способу лікування раку різних типів, наприклад, волосатоклітинного лейкозу, саркоми Калоші, множинної мієломи, хронічного мієлолейкозу, неходжкінської лімофоми або меланоми, що включає введення терапевтично ефективної кількості MIFNAR2, MIFNAR2 ЕС, комплексу MIFNAR2 EC/IFN або аналогів, гібридних білків, функціональних похідних, їхніх фрагментів, їхніх сумішей або їхніх солей. У вищезгаданих способах MIFNAR2, MIFNAR2 ЕС, комплекс MIFNAR2 EC/IFN або аналоги, гібридні білки, функціональні похідні, їхні фрагменти, їхні суміші або їхні солі можуть вводитись разом із IFN, за варіантом, якому віддають перевагу, з IFN-β. "Терапевтично ефективною кількістю" є така кількість, яка, після введення MIFNAR2, MIFNAR2 ЕС, комплексу MIFNAR2 EC/IFN або аналогів, гібридних білків, функціональних похідних, їхніх фрагментів, їхніх сумішей або їхніх солей, викликає модулювання біологічної активності IFN-β. Доза, одноразова або багаторазова, введена індивіду, може змінюватись у залежності від ряду факторів, у тому числі шляху введення, стану і характеристик пацієнта (стать, вік, маса тіла, стан здоров'я, розміри), поширеності симптомів, одночасного лікування, частоти лікування та бажаного ефекту. Регулювання та маніпулювання встановленими діапазонами доз знаходиться у межах здатностей фахівців у цій галузі, а також способів визначення in vitro та in vivo активності MIFNAR2, MIFNAR2 EC, комплексу MIFNAR2 EC/IFN або аналогів, гібридних білків, функціональних похідних, їхніх фрагментів, їхніх сумішей або їхніх солей. Місцева ін'єкція, наприклад, буде потребувати меншої кількості білка, виходячи з маси тіла, аніж внутрішньовенне вливання. Вільний IFNβ має схильність до олігомеризації. Для пригнічення цієї схильності сучасні лікарські форми IFNβ мають кислий рН, що може викликати деяке місцеве подразнення у разі введення. Оскільки MIFNAR2, MIFNAR2 EC або аналоги, гібридні білки, функціональні похідні, їхні фрагменти, їхні суміші або їхні солі можуть відігравати роль стабілізатора, який перевищує відповідні показники варіанта дикого типу для IFNβ і, тим самим, запобігає олігомеризації, їх застосування у лікарській формі IFNβ може використовуватись для стабілізації IFNβ і ліквідувати, завдяки цьому, необхідність у кислих лікарських формах. Відповідно, частиною цього винаходу також є некислотна фармацевтична композиція, що містить MIFNAR2, MIFNAR2 ЕС або аналоги, гібридні білки, функціональні похідні, їхні фрагменти, їхні суміші або їхні солі, разом з іншими традиційними фармацевтично прийнятними наповнювачами. Цей винахід має також відношення до застосування MIFNAR2, MIFNAR2 EC, комплексу 87958 22 MIFNAR2 EC/IFN або аналогів, гібридних білків, функціональних похідних, їхніх фрагментів, їхніх сумішей або їхніх солей для противірусної, протиракової та імуномодуляторної терапії. Зокрема, мутантний рецептор інтерферону і комплекси мутантного рецептора інтерферону та інтерферону за цим винаходом є придатними для противірусної терапії при таких терапевтичних показаннях, як хронічний гранулематоз, гострокінцева кондилома, юнацький ларингопапіломатоз, гепатит А і хронічна інфекція вірусами гепатитів В і С. Зокрема, мутантний рецептор інтерферону і комплекси мутантного рецептора інтерферону та інтерферону за цим винаходом є придатними для протиракової терапії при таких терапевтичних показаннях, як волосатоклітинний лейкоз, саркома Капоші, множинна мієлома, хронічний мієлолейкоз, неходжкінська лімфома та меланома. Мутантний рецептор інтерферону і комплекси мутантного рецептора інтерферону та інтерферону за цим винаходом є також придатними для імуномодуляторної терапії при автоімунних захворюваннях, наприклад, розсіяному склерозі, ревматоїдному артриті, важкій псевдопаралітичній міастенії, діабеті, звичайному вовчаку і неспецифічному виразковому коліті. "Автоімунним розладом" є захворювання, при якому імунна система особи починає руйнувати власне тіло людини. Імунна система створює антитіла проти своїх власних тканин. Фактично кожна частина тіла є сприйнятливою до автоімунного розладу. Мутантний рецептор інтерферону і комплекси мутантного рецептора інтерферону та інтерферону за цим винаходом є також придатними для лікування нейродегенеративних захворювань, за варіантом, якому віддають перевагу, розсіяного склерозу. Цей винахід має також відношення до фармацевтичної композиції, що містить MIFNAR2, MIFNAR2 EC, комплекс MIFNAR2 EC/IFN або аналоги, гібридні білки, функціональні похідні, їхні фрагменти, їхні суміші або їхні солі, до фармацевтичної композиції, що містить експресійний вектор, зокрема, лентивірусний генотерапевтичний вектор, що експресує MIFNAR2, MIFNAR2 EC, комплекс MIFNAR2 EC/IFN або аналоги, гібридні білки, їхні фрагменти. Термін "лікування", який застосовують у цьому описі, слід розуміти як запобігання, пригнічення, ослаблення, полегшення або обернення напрямку на зворотний будь-яких або усіх симптомів або причини (причин) захворювання. Після завершення опису винаходу, його буде набагато легше зрозуміти шляхом посилання на подальші приклади, наведені для ілюстрації і не призначені для обмеження цього винаходу. Приклади Приклад 1: Експресія і очищення білка IFNAR2-EC (позаклітинний домен) та IFNα експресували у Е.coli, очищали засобами іонообмінної та гель-хроматографії за описом (Пілер (Piehler) та Шрайбер (Schreiber), 1999A). Рівні експресії мутантів IFNAR2-EC були такими самими високими, як і дикого типу. Глікозилований IFNβ 23 дикого типу одержували у СНО (розкрито у ЕР 220574). Концентрації білка визначали за оптичною густиною при 280нМ (Пілер (Piehler) та Шрайбер (Schreiber), 1999А) з 1:280=18070 М-1 для IFNα2, 1:280=30050 М-1 для IFNβ і 1:280=26500 М1 для IFNAR2-EC (відкоректовано до 1:280=21200 М-1 для триптофанових мутантів IFNAR2-EC W102A і W74F). Чистоту білка аналізували засобами SDS-PAGE за невідновних умов. Приклад 2: Одержання мутантів IFNAR EC Сайтспрямований мутагенез здійснювали засобами полімеразно-ланцюгової реакції з матрицею pT72CR2 (Пілер (Piehler) та Шрайбер (Schreiber), 1999) та з 18-21 нуклеотидними праймерами, що містять мутантний кодон із застосуванням високонадійних полімераз pwo (Boehringer Mannheim) та Pfu (Stratagene), як докладно описано (Албек (Albeck), Шрайбер (Schreiber), 1999). Після фосфорилування та літування мутантні плазміди застосовувались для перетворення клітин TG1 Е.соlі. Послідовність повного експресованого гена, що містив мутацію, перевіряли шляхом секвенування ДНК (Озбел (Ausubel) та інші, Current Protocols in Molecular Biology, Greene Publications and Wiley Interscience, New York, NY, 1987-1995; Сембрук (Sambrook) та інші, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, 1989). Одержали мутанти, у яких два амінокислотних залишки, гістидин 78 (Н78) і аспарагін 100 (N100), були замінені: А - обидва на аланін (мутант H78A/N100A), В - на аланін та аспарагінову кислоту, відповідно (H78A/N100D) і С - на аланін та гістидин, відповідно (H78A/N100H). Приклад 3: Термодинамічний і кінетичний аналіз Усі термодинамічні та кінетичні дані були одержані шляхом виявлення гетерогенної фази без мітки. Взаємодію між IFNβ2 та IFNAR2-EC контролювали засобами рефлектометричної інтерференційної спектроскопії (RifS) за протокових умов, як описано (Пілер (Piehler) та Шрайбер (Schreiber), 1999А). Цей метод є подібним до методу Віасоrе і застосовується для точного визначення спорідненості зв'язування між двома білками. IFNAR2-EC (дикого типу або мутантний) імобілїзували за допомогою специфічних імобілізованих антитіл (як описано Пілер (Piehler) та Шрайбер (Schreiber), 2001). Усі визначення з IFNβ, IFNα2 та IFNAR2-EC здійснювали у 50мМ розчині ГЕПЕС-буфера з 500мМ NaCl та 0,01% Тритону Х100 при рН7,4. Взаємодію визначали у 500мМ розчині NaCl із метою виключення неспецифічних взаємодій з поверхнею, які спостерігались з IFNβ у 150мМ розчині NaCl. Кінетику асоціації та дисоціації визначали за стандартними методиками введення і вносили виправлення шляхом проведення контрольних експериментів. Константи швидкості дисоціації визначали при концентрації IFN у межах 1-100нМ з метою насичення поверхні. Повний діапазон дисоціації застосовували для приведення у відповідність до кінетичної моделі 1:1 (Пілер (Piehler) та Шрайбер (Schreiber), 2001). 87958 24 Приклад 4: Аналіз противірусної активності Противірусну активність IFNβ аналізували як пригнічення цитопатичного ефекту вірусу везикулярного стоматиту (VSV) на людських клітинах WISH (Рубинштейн (Rubinstein) та інші, 1981). Приклад 5: Визначення зв'язування IFN з мутантним IFNAR2 Визначали зв'язування IFNβ і IFNα2 з мутантом H78A/N100A (приклад 2) і порівнювали з рецептором EC дикого типу засобами RifS (приклад 3). Було встановлено, що, незважаючи на те, що швидкість асоціації IFNβ із мутантом H78A/N100A була подібною до відповідних показників для дикого типу (Фіг.3), швидкість дисоціації виявилась значно нижчою. Обчислена спорідненість IFNβ до мутанта H78A/N100A становить приблизно 30пМ у зіставленні зі спорідненістю до білка дикого типу, яка становить приблизно 3нМ. Було виявлено, що у протилежність до IFNβ, швидкість як асоціації, так і дисоціації IFNα2 з мутантом H78A/N100A виявились подібними швидкостям, які були одержані з білком дикого типу (Фіг.3). Ці результати показують, що спорідненість мутанта IFNAR2 до IFNβ є у приблизно 100 разів вищою, аніж у дикого типу, і незмінною відносно IFNα2. Приклад 6: Відносна спорідненість інтерферону щодо мутантного IFNAR2 Зв'язування та спорідненість рецептора IFNAR ЕС та мутантного рецептора EC (приклад 2) до IFNβ та IFNα2 визначали за допомогою RifS. IFNAR2 дикого типу або мутант імобілізували на поверхні за допомогою специфічних антитіл (приклад 3). Після визначення спорідненості, значення відносної спорідненості одержали шляхом порівняння Kd мутантного рецептора з Kd рецептора дикого типу (Таблиця 4). Kd зв'язування інтерферону з позаклітинним доменом (EC) IFNAR2 визначали за допомогою RifS і встановили значення приблизно 3нМ (приклад 5). Значення Kd зв'язування IFNβ із мутантом H78A/N100A (EC) становило приблизно 30пМ. Точне визначення Kd для цього мутанта було неможливим, оскільки зв'язування було надто тісним для одержання хороших даних за допомогою RifS. Встановили, що значення Kd IFNα2 з мутантом H78A/N100A було подібним до значення для рецептора дикого типу. Результати у Таблиці 4 показують відносну спорідненість мутантів IFNAR EC порівняно з рецептором IFNAR2 EC дикого типу. Мутанти були такими: піддані мутації на одному амінокислотному залишку, Н78А або N100A, та піддані мутації на двох амінокислотах, H78A/N100A, H78A/N100D та H78A/N100H, де амінокислоту N100 замінено на аланін, аспарагінову кислоту або гістидин, відповідно (приклад 2). Результати показують, що моносайтові мутації IFNAR2 підвищують спорідненість комплексу у 4,67,3 рази, у той час як двосайтова мутація спричинює синергічний ефект з підвищенням спорідненості комплексу у 26 разів та до приблизно 50 разів. Було встановлено, що найкращим мутантом із точки зору спорідненості був двосайтовий мутант із N100, заміненою на аланін, який демонстрував, порівняно з варіантом дикого типу, спорідненість, підвищену більше ніж у 50 разів. 25 87958 Таблиця 4 IFNAR2 Дикий тип Н78А N100A H78A/N100A H78A/N100D H78A/N100H IFNα2 1,0 0,4 2,0 0,7 1,0 0,9 IFNβ ι,ο 4,6 7,3 >50 40,0 26,0 Приклад 7: Оклюзія інтерферону-бета мутантом IFNAR2 Порівнювали здатність IFNAR2 EC дикого типу та мутантів EC відігравати роль носіїв IFNβ. З цією метою контролювали противірусну активність IFNβ (зліва, вільний) у зразках, що включали постійну концентрацію IFNβ (10пМ), змішаних із різними концентраціями рекомбінантних розчинних IFNAR2 EC або мутантів EC IFNAR2 (приклад 6). При проведенні противірусного аналізу суміш (комплекс IFNAR2/IFN) додавали до клітин WISH (людські амніотичні клітини). Після цього згадані амніотичні клітини WISH піддавали експериментальному зараженню вірусом везикулярного стоматиту (VSV), і залишкову (вільну) противірусну активність IFNβ контролювали як ступінь виживаності клітин після 24-год. інкубування (приклад 4). Кількість вільного IFNβ, присутнього у зразках з різною кількістю варіанта дикого типу або концентрацією мутантного IFNAR2 EC (R2) визначали за кривою дози виживаності противірусної активності як функцію концентрації, одержаної за відсутності IFNAR2 (Фіг.4, верхній графік). Були перевірені такі мутанти: IFNAR2 EC, підданий мутації на одному амінокислотному залишку, Н78А або N100A, і підданий мутації на двох амінокислотах H78A/N100A, H78A/N100D і H78A/N100H, де амінокислоту N100 замінюють на аланін, аспарагінову кислоту та гістидин, відповідно (приклад 2). Двосайтовий мутант IFNAR2 H78A/N100A (приклад 2) показав найвищу спорідненість з усіх одержаних мутантів (Kd приблизно 30пМ і нижче, дивись приклади 5 та 6). На Фіг.4 показано, що у присутності 2,5нМ IFNAR2 EC дикого типу з розчинним рецептором зв'язується (піддається оклюзії) приблизно 20% IFNβ, у той час як у присутності лише 0,2нМ двосайтового мутанта EC H78A/N100A зв'язується 50% IFNβ і у разі застосування лише 0,4нМ мутанта EC H78A/N100A зв'язується 80% IFNβ. Біологічний аналіз показав також, що такий самий рівень IFNβ, підданого оклюзії (зв'язування IFNβ за умов рівновага) і залишкової противірусної активності (вільний IFNβ), який одержують з IFNAR2 дикого типу, може бути одержаним із застосуванням у приблизно 30 разів нижчої концентрації мутанта EC H78A/N100A IFNAR2. Результати показують також, що двосайтовий мутант дає кращі результати, зокрема, мутант, у якого обидві амінокислоти були замінені на аланін, H78A/N100A IFNAR2. Ці результати показують, що двосайтовий мутант IFNAR2 більш ефективно зв'язує IFNβ і, таким чином, для здійснення його активності як носія необхідними будуть значно нижчі його кількості. Посилання: 26 Alam et al., Pharmaceutical Research 14: 546549 (1997). Anfinsen, Science 181: 223-230 (1973). Ausubel et al., Current Protocols in Molecular Biology, Greene Publications and Wiley Interscience (New York, 1987-1992). Baron et al., Antiviral Res. 24: 97-110 (1994). Baron, et al., J. Am. Med. Assoc. 266: 1375-1383 (1991). Christofinis, G. J. Journal of General Virology 52: 169-171 (1981). Colamonici et al., J. Immunol. 148: 2126- 2132 (1992). Colamonici et al., J. Biol. Chem. 268: 1089510899 (1993). Curtis B.M., Proc. Natl. Acad. Sci. 88: 5809-5813 (1991). Domanski et al., The Journal of Biological Chemistry 270: 6 (1995). Duncan et al., J. Exp. Med. 184: 2043-2048 (1996). Dron et al., "Interferon α/β gene structure and regulation" in Interferon: principles and Medical Applications, Baron et al., Editors, (University of Texas Medical Branch: Galveston, TX, 1992) pp.3345. Edington S.M., "Biotech Products as Drug Leads" BioTechnology 13: 649 (1995). Fierlbeck et al., Journal of Interferon and Cutokine Research 16: 777 (1996). Grantham, Science 185: X62-X64 (1974). Grazia Cusi, Mo, Immunotechnology 3: 61-69 (1997). Ibanez C.F., EMBO Journal 10: 2105-2110 (1991). Jacobs L, et al. Arch Neurol 1987 Jun.; 44(6): 589-95. Keown WA, Methods in Enzymology 185: 527537 (1990). Lengyl P. Ann. Rev. Biochem. 51: 251-282 (1982). Lutfalla et al., EMBO Journal 14: 5100-5108 (1995). Novick et al., FEBS Lett. 314: 445-448 (1992). Novick et al., Cell 77: 391-400 (1994). Novick et al., J. Leuk. Bio. 57: 712-718 (1995). Piehler and Schreiber J. Моl. Biol. 1999A 289, 57-67. Piehler and Schreiber J. Моl. Biol. 1999B 294, 223-237. Piehler and Schreiber Analytical Biochemistry 289, 173-186. Platanias et al., 1993 J. Immunology 150: 33823388. Platanias et al., 1996 J. Biol. Chem. 271: 236303. Salmon et al., 1996 Journal of Interferon and Cytokine Research 16: 759. Sharf et al., 1995 J. Biol. Chem. 270: 13063-9. Tan et al., 1973. J. Exp. Med. 137: 317-330. Uze et al., 1990 Cell 60: 225-34. Yang et al., 1996 J. Biol. Chem. 271: 8057-61. Yan et al., 1996 Мої. Cell Bio. 16: 2074-82. 27 87958 28 29 87958 30 31 Комп’ютерна верстка Т. Чепелева 87958 Підписне 32 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюIfnar2 mutants, their production and use
Автори англійськоюSchreiber Gideon
Назва патенту російськоюМутанты ifnar2, их получение и применение
Автори російськоюШрайбер Гидеон
МПК / Мітки
МПК: A61P 37/06, C07K 14/715, A61K 38/21, A61K 38/17, C07K 19/00
Мітки: одержання, мутанти, застосування, ifnar2
Код посилання
<a href="https://ua.patents.su/16-87958-mutanti-ifnar2-kh-oderzhannya-ta-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Мутанти ifnar2, їх одержання та застосування</a>