Спосіб отримання ендотеліальних клітин (варіанти)
Номер патенту: 95733
Опубліковано: 25.08.2011
Формула / Реферат
1. Спосіб отримання ендотеліальних клітин з ембріональних стовбурових клітин (ЕСК) людини, що передбачає диференціювання ЕСК людини на підкладці і в середовищі, які забезпечують спрямоване пряме диференціювання ЕСК людини в ендотеліальні клітини, з людським фактором росту ендотелію судин VEGF, і сепарацію отриманих ендотеліальних клітин, який відрізняється тим, що використовують синтетичне середовище для диференціювання на основі суміші DMEM/FI2 з КО замінником сироватки при співвідношенні: рідка DMEM/FI2 - 75-95 %, рідкий КО замінник сироватки - 5-25 %, при цьому синтетичне середовище додатково містить чинники росту SCF, ВМР4, bFGF, TGFbeta в ефективних кількостях, причому TGFbeta додають на 3-6 день диференціювання, а сепарацію проводять на 3-9 день методом імунологічної селекції з використанням маркерів, специфічних для клітин ендотелію, після чого отримані ендотеліальні клітини культивують у зазначеному синтетичному середовищі при щільності посіву не менше 50000 клітин на 1 см2.
2. Спосіб отримання ендотеліальних клітин з ембріональних стовбурових клітин (ЕСК) людини, що передбачає диференціювання ЕСК людини на підкладці і в середовищі, які забезпечують спрямоване пряме диференціювання ЕСК людини в ендотеліальні клітини, з людським фактором росту ендотелію судин VEGF, і сепарацію отриманих ендотеліальних клітин, який відрізняється тим, що використовують середовище для диференціювання на основі суміші DMEM/FI2 з фетальною бичачою сироваткою при співвідношенні: рідка DMEM/FI2 - 75-95 %, рідка фетальна бичача сироватка - 5-25 %, при цьому середовище додатково містить чинники росту SCF і bFGF в ефективних кількостях, а сепарацію проводять на 3-9 день методом імунологічної селекції з використанням маркерів, специфічних для ендотеліальних клітин, після чого отримані ендотеліальні клітини культивують у вказаному середовищі при щільності посіву не менше 50000 клітин на 1 см2.
Текст
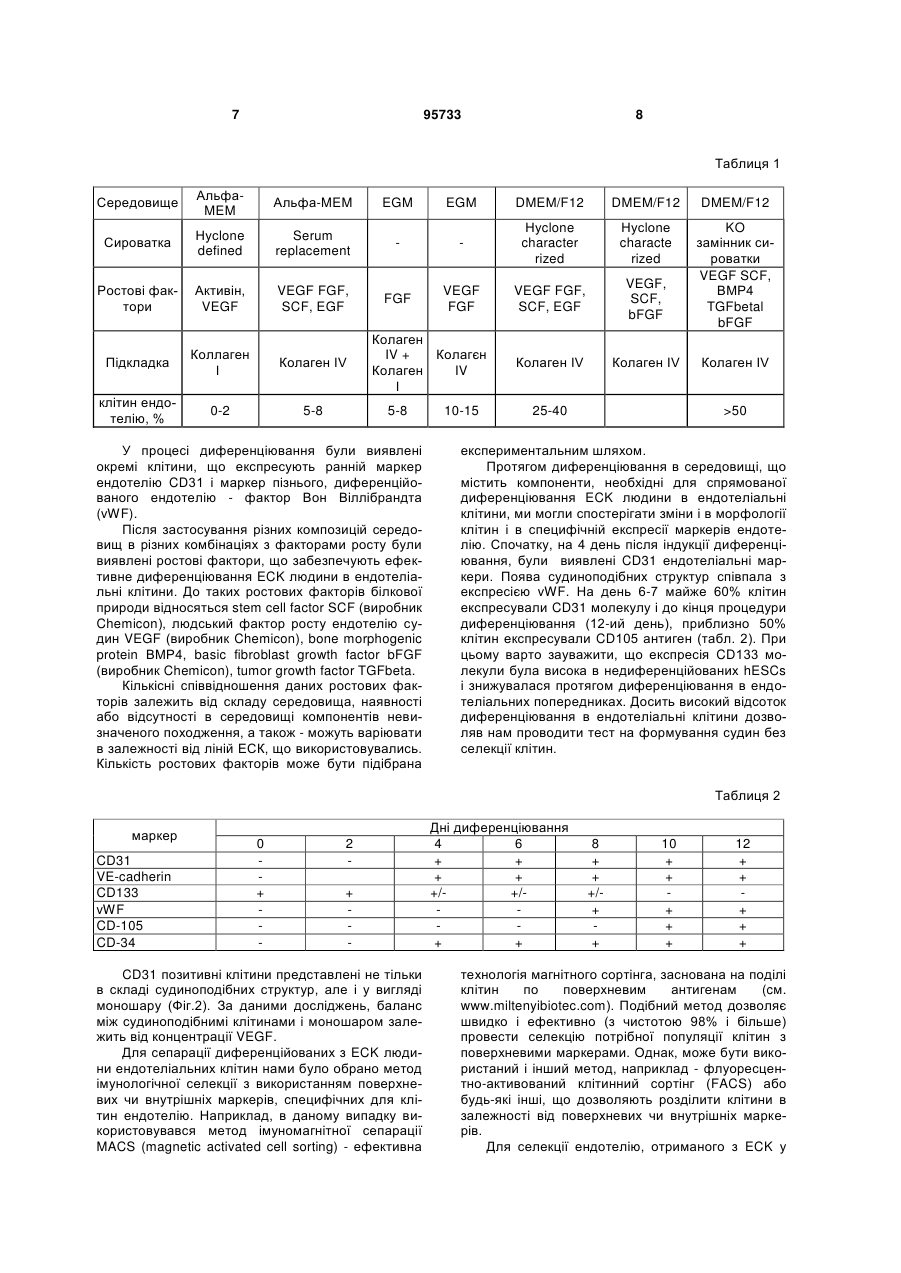
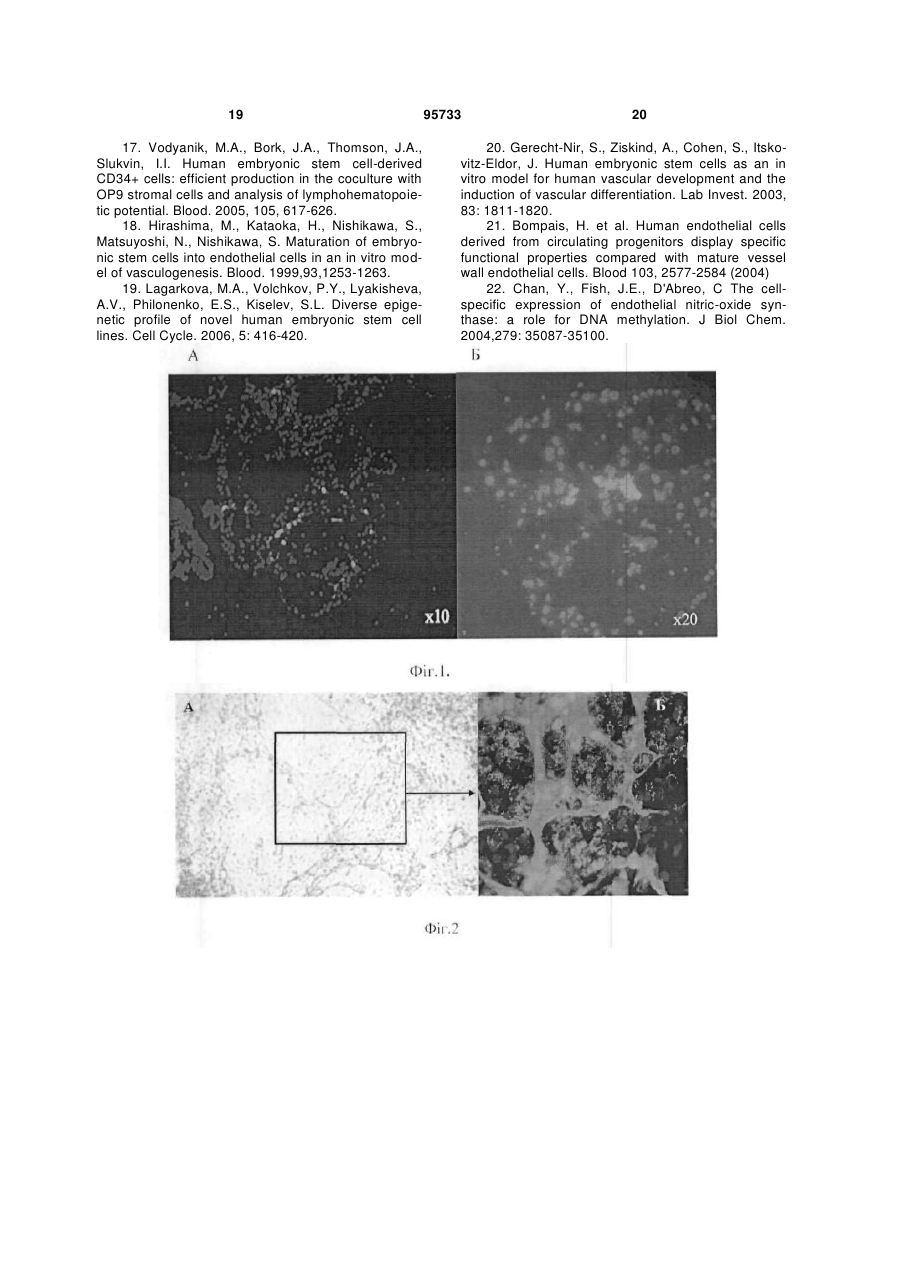
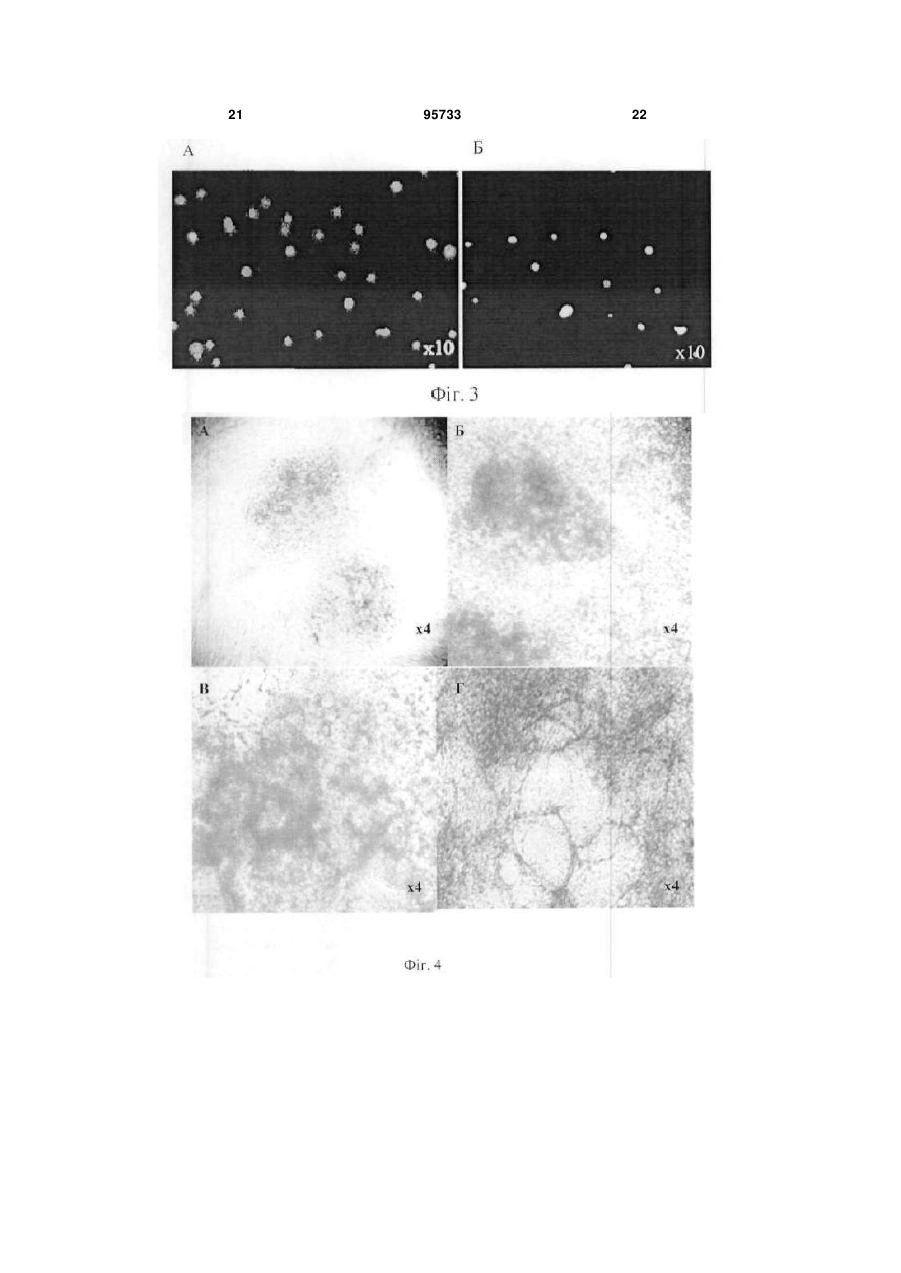
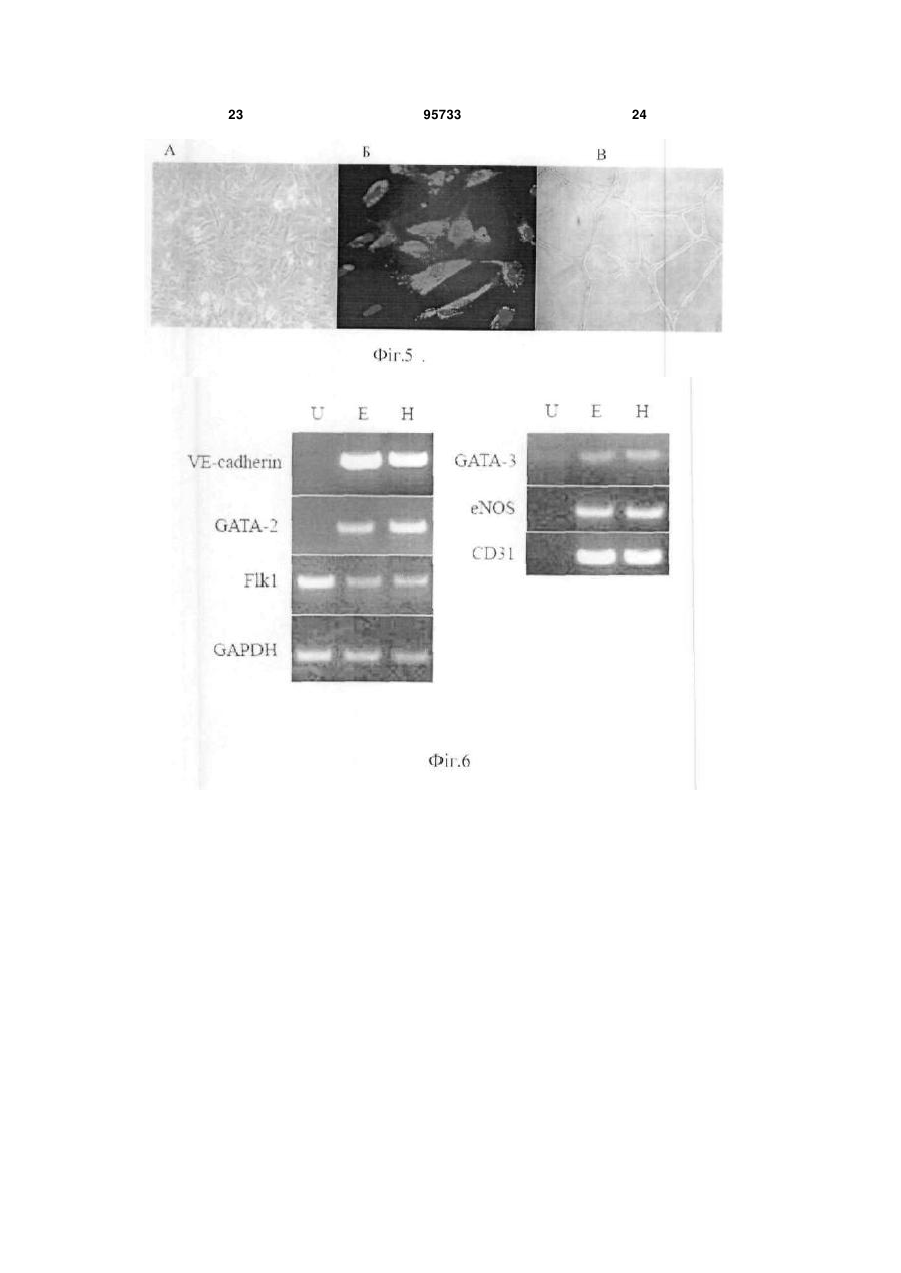
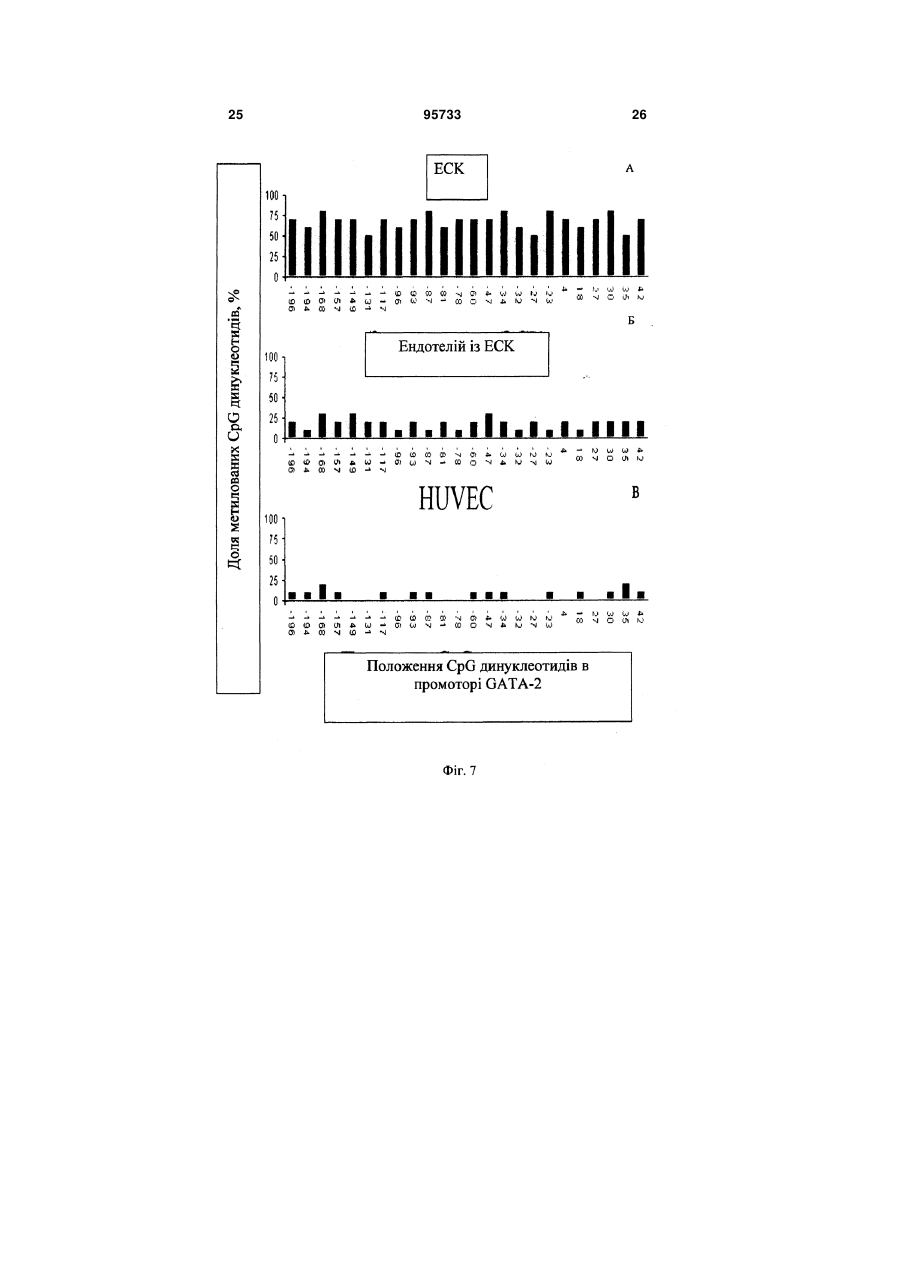
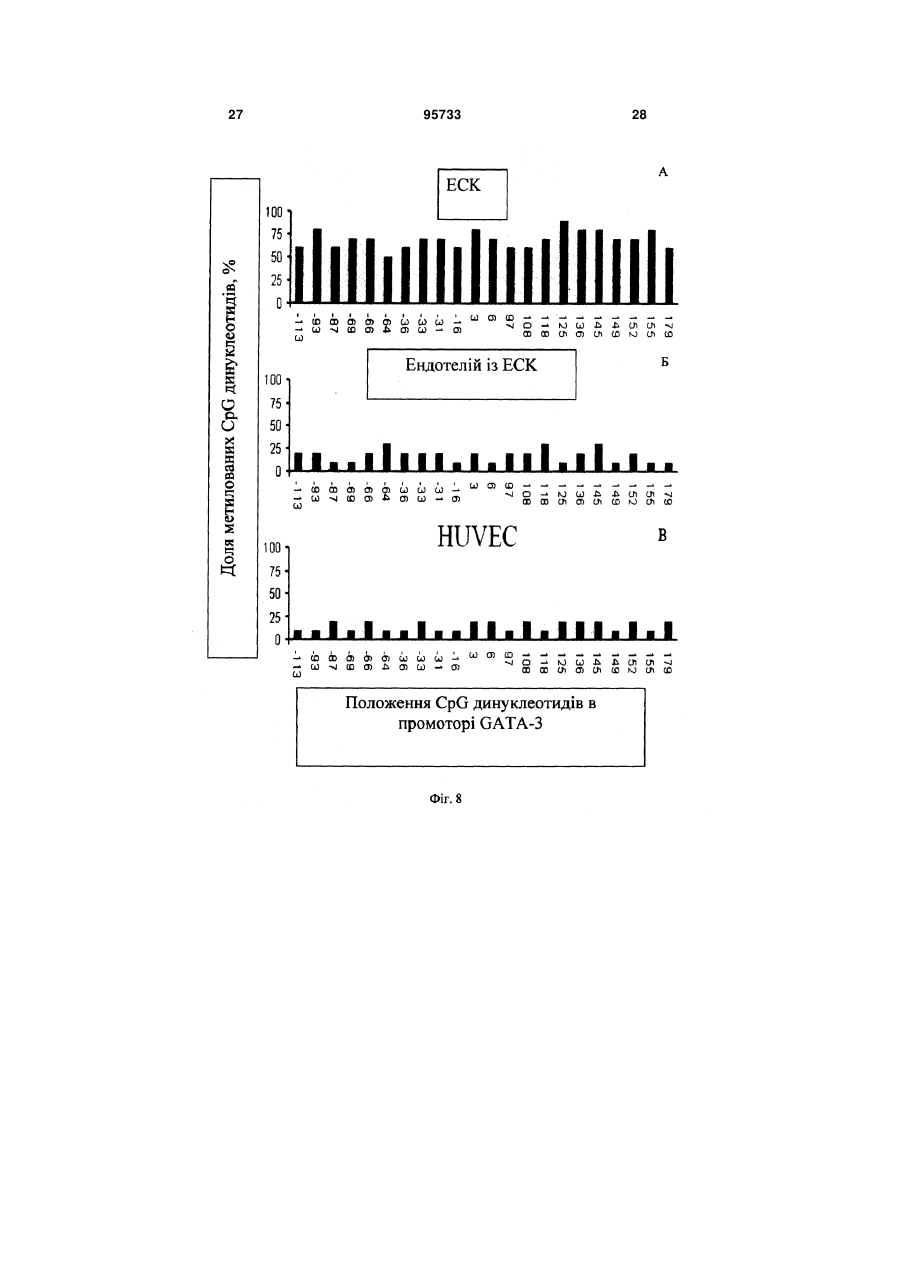
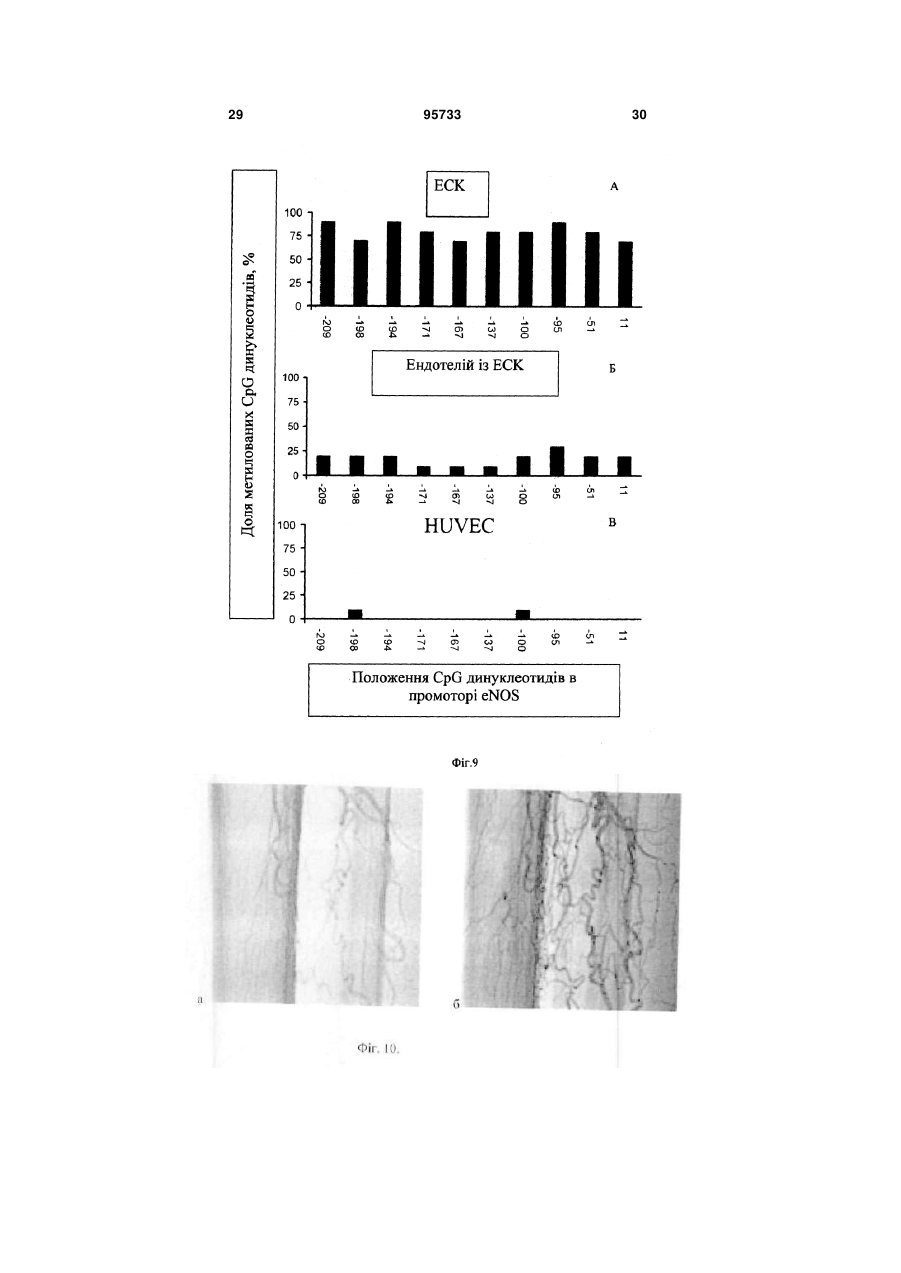
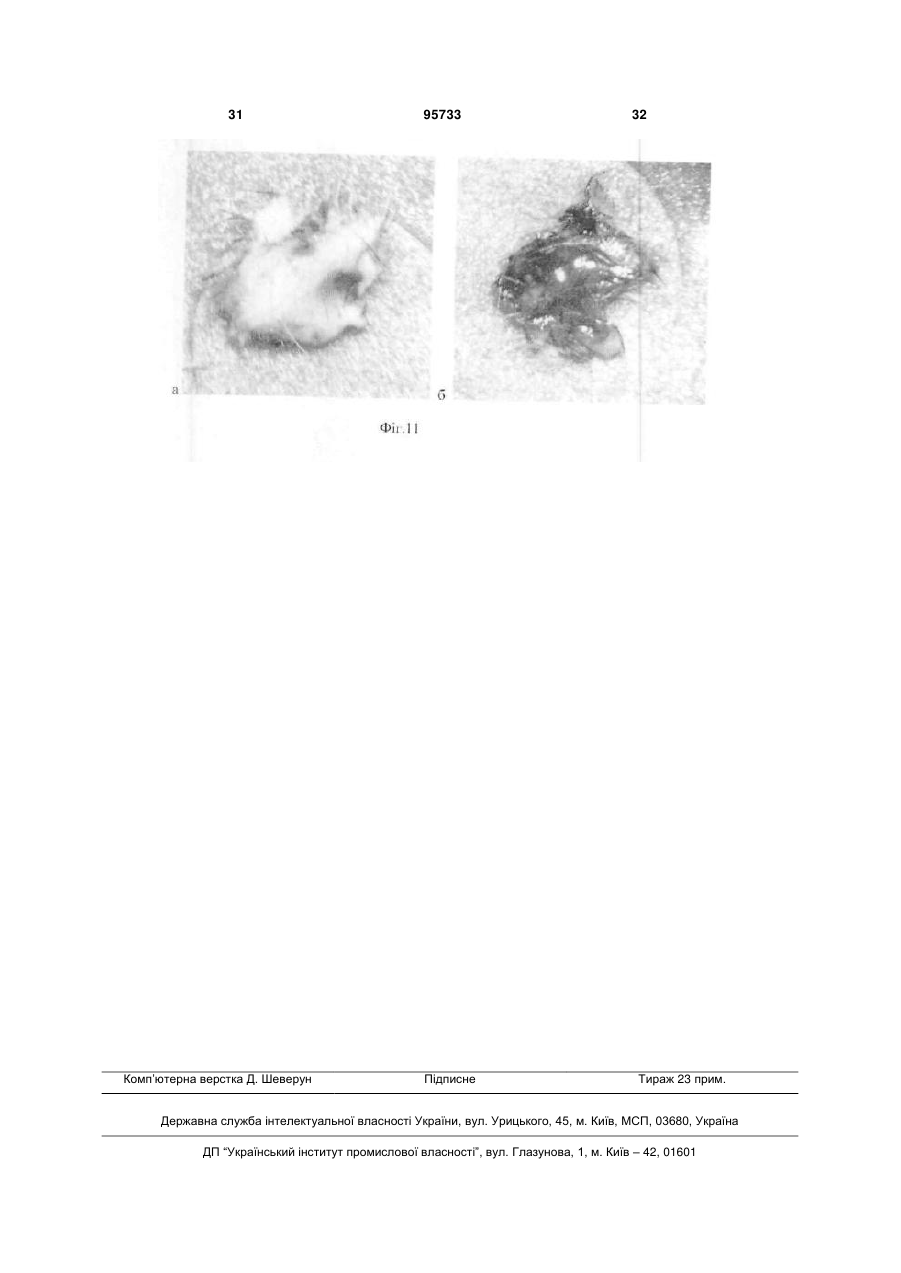
1. Спосіб отримання ендотеліальних клітин з ембріональних стовбурових клітин (ЕСК) людини, що передбачає диференціювання ЕСК людини на підкладці і в середовищі, які забезпечують спрямоване пряме диференціювання ЕСК людини в ендотеліальні клітини, з людським фактором росту ендотелію судин VEGF, і сепарацію отриманих ендотеліальних клітин, який відрізняється тим, що використовують синтетичне середовище для диференціювання на основі суміші DMEM/FI2 з КО замінником сироватки при співвідношенні: рідка DMEM/FI2 - 75-95 %, рідкий КО замінник сироватки C2 2 95733 1 3 hESCs диференціюватися в деякі специфічні типи клітин в даний час інтенсивно вивчається. Загальна мета таких досліджень зазвичай полягає в тому, щоб отримувати спеціалізовані функціональні клітини. Однак подальша можливість застосування цих клітин для лікування людини може бути реалізована тільки за умови забезпечення стійкої клітинної спеціалізації. Таким чином, потрібно розглядати не тільки морфологічні, імунологічні, або функціональні властивості клітини, але також і генетичні та епігенетичні. Диференціація ECK по визначеному шляху супроводжується зміною патерну експресії генів, від генів, характерних для плюрипотентного стану, до тканиноспецифічних генів. Зміна патерну експресії здійснюється за рахунок загасання експресії ключових факторів транскрипції, що беруть участь у підтримці плюрипотентності, і експресією тканиноспецифічних транскрипційних факторів. Паралельно працюють епігенетичні механізми регуляції експресії генів, які репресують гени, необхідні для плюрипотентного стану, і активують тканиноспецифічні. Так як ECK - це in vitro аналог клітин епібласта, що штучно підтримуються в недиференційованому стані, при зміні умов культивування ECK спонтанно диференціюються в різні типи клітин. In vitro спонтанне диференціювання ECK людини спостерігається як при тривалому культивуванні прикріплених колоній, так і в процесі росту ембріоідних тілець (ET) в суспензії. На відміну від ECK миші, не всі лінії ECK людини легко утворюють ембріоідні тільця, і ні одна лінія ECK не утворює ембріоідні тільця з поодиноких клітин. Для ECK людини була показана здатність до диференціювання в багато типів клітин: нейрони і глія, ендотелій, кератиноцити, трофобласти, кардіоміоцити, остеобласти, клітини крові, гепатоцити, інсулін-продукуючі клітини та деякі інші. Похідні ентодерми отримати виявилося найважче. У нещодавно опублікованих повідомленнях про диференціювання ECK людини в інсулінсекретуючі клітини (1) і гепатоцити (2), було показано, що за білковим і генетичним маркерами вони збігаються зі зрілими інсулін-секретуючими клітинами або гепатоцитами. Однак, чинники, що визначають диференціювання в ентодерму, погано охарактеризовані і майже відсутні маркери раннього ентодермального диференціювання. На відміну від ECK миші, які легко диференціюються в кардіоміоцити у відсутності leukemia inhibitory factor LIF, спонтанне диференціювання ECK людини спостерігається у різних ліній ECK у різному відсотку випадків - від ділянок, що спонтанно скорочуються в 70% ET до повної відсутності спонтанного диференціювання (3). Показано, що кардіоміоцити, диференційовані з ECK людини, експресують транскрипційні фактори Nkx 2.5, GATA4, а також - специфічні маркери кардіоміоцитів тропонін 1 і важкий ланцюг альфа-міозину. Нещодавно була опублікована робота з диференціювання кардіоміоцитів у безсироваточному середовищі, минаючи стадію ембріоідних тілець (4). При тривалому культивуванні ECK можуть піддаватися штучній випадковій селекції. Крім того, як виявилося, ЕСК, ідентичні за основними морфологічни 95733 4 ми характеристиками та експресії основних генів, можуть відрізнятися епігенетичним статусом у регуляторних областях деяких генів. Ці фактори можуть призводити до того, що клітинні лінії ECK будуть мати переважні шляхи диференціювання. Тобто, наприклад, ECK будуть легко диференціюватися в нейрони і погано - в кардіоміоцити. Можливо, саме різниця в епігенетичному статусі ECK миші і людини може пояснити настільки різний потенціал диференціювання. При нормальному розвитку ембріона судинна тканина формується з мезодерми. Незабаром після гаструляції мезодерма формується, як окремий шар між екто-і ендодермою. Передбачається, що ендотеліальні і гематопоетичні клітини походять від спільного мезодермального попередника - гемангіобласта (5). Клітини-попередники, які потенційно здатні утворювати гематопоетичні і ендотеліальні клітини, були ідентифіковані на моделі мишачих ECK (6,7,8) і лише пізніше - in vivo, при вивченні гаструляції мишачого ембріона (9). Існує три основних технічних підходи для вивчення диференціювання ECK в клітини ендотелію і гематопоетичні клітини. Перший - диференціювання ECK в ендотеліальні або гематопоетичні клітини через стадію ET (10-15). Другий - спільне культивування ECK зі стромальних клітин (16, 17). Третій - диференціювання ECK в двовимірних умовах (18, 8). Диференціація ECK через утворення ET - це завжди спонтанне, ненаправлене диференціювання. Як вже згадувалося, ET містить клітини, що походять з різних зародкових листків, і тому частка клітин необхідного типу мала. Відсоток клітин ендотелію в ембріоідних тільцях становить близько 2%. Крім того, цей підхід має ще кілька обмежень. Наприклад, важко спостерігати клітини в мікроскоп, проводити аналіз диференціювання одиничних клітин, важко розділяти клітини з агрегатів клітин в ET. Однак, на сьогоднішній день у великій кількості публікацій використовується саме цей підхід. Це обумовлено, зокрема, тим, що спрямоване диференціювання клітин вимагає спеціального підбору умов, a ET - грубий модельний аналог розвитку ембріону, в якому присутні різні клітини, в тому числі і необхідні досліднику. Нами було перевірено, чи є ендотеліальні клітини в ET, що були утворені з ліній ECK людини, що знаходились в нашому розпорядженні. Для аналізу були взяті лінії hESM01 і hESM03. Ці лінії, виділені в лабораторії раніше, проявляли характерну для даного типу клітин морфологію, експресували відповідні маркери і мали нормальний каріотип (19). При переведенні в суспензійну культуру ECK формували ET з характерною морфологією для даного типу структур. При імуногістохімічному аналізі ембріоідних тілець після 10-12 днів культивування були виявлені в невеликій кількості (не більш ніж 1-5%) ендотеліоцитоподібні клітини, що експресують CD31 (Фіг. 1). Диференціація ECK людини в клітини ендотелію у двовимірних умовах (минаючи стадію утворення ET) використовувалася тільки однією групою дослідників (20). Відомий спосіб обраний нами в якості найближчого аналога. Спосіб передбачає диференціювання 5 ECK людини в присутності людського фактору росту ендотелію судин (VEGF) на підкладці з колагену IV. Селекція ендотеліальних клітин здійснювалася за розміром клітин за допомогою фільтрації через фільтр з діаметром пор 40 мкм. 3 робота не ясно, яку частку становили клітини ендотелію після селекції. Однак, вважаючи, що ендотеліальні клітини пов'язані з гематопоетичними клітинами і походять від спільного попередника гемангіобласта, механічний вибір не міг забезпечити бажану чистоту клітин. Швидше за все, даний метод селекції не варто використовувати, якщо необхідно отримати чисту популяцію клітин ендотелію. Короткий опис фігур. Фіг.1 Імуногістохімічний аналіз 10мкм кріозрізу ET 12 днів культивування. A-ET лінії ESM01, забарвлення антитілами до CD31 (червоний); Б-ЕТ лінії ESM03, забарвлення антитілами до CD31 (червоний); ядра пофарбовані DAPI (синій). Вторинні антитіла goat anti-mouse Alexa Fluor 546. Фіг.2 Формування судиноподібних структур і моншару при диференціюванні ECK людини (8 днів). А - світле поле. Б - імуногістохімічне забарвлення антитілами до CD31. Фіг.3 Оцінка життєздатності CD31 позитивних клітин після проведення іммуномагнітної сепарації. А - п'ятий день диференціювання; Б - сьомий день диференціювання. Живі клітини (зелений), мертві (помаранчевий). Фотографія отримана за допомогою флуоресцентного мікроскопа. Фіг.4 Диференціація ECK людини в ендотеліальні клітини в двовимірній системі: А недиференційовані колонії ECK на фідері МЕФ; Б диференційовані похідні, 3 день культивування; В - диференційовані похідні, 5 день культивування; Г - судиноподібні структури, 7 день культивування. Фіг.5 А - CD31 клітини ендотелію, отримані з ECK через 24 години після селекції (Фотографія в світлому полі). Б - імуногістохімічний аналіз ECK після проведення іммуномагнітної сепарації. Експресія CD31 (червоний); ядра пофарбовані DAPI (синій). Вторинні антитіла Alexa Fluor 546. В - Тест на матрігелі (Matrigel Assay), що показує ендотеліальну природу виділених за допомогою іммуномагнітної сепарації клітин. Фіг.6 ЗТ-ПЛР аналіз генів VE-cadherin, GATA-2, Flkl, GAPDH, GATA-3, eNOS, CD31 в недиференційованих ECK лініях ESM03 (U), клітинах ендотелію з ECK лінії ESM03, отриманих за допомогою імуномагнітної сепарації (E ) і в клітинах ендотелію з пуповинної вени (H) людини. Фіг.7 Результати бісульфітного секвенування промоторної області гена GATA-2 з 43 по -187 нуклеотид щодо старту транскрипції. (A) ECK людини, 95733 6 (Б) ендотелій, отриманий з ECK людини, (В) HUVEC. Фіг.8 Результати бісульфітного секвенування промоторної області гена GATА-3 з 228 по -115 нуклеотид щодо старту транскрипції (А) з ECK людини, (Б) ендотелій, отриманий з ECK людини, (В) HUVEC Фіг.9 Результати бісульфітного секвенування промоторної області гена eNOS з 13 по -297 нуклеотид щодо старту транскрипції (А) з ECK людини, (Б) ендотелій отриманий, з ECK людини, (В) HUVEC Фіг. 10 Зміна щільності кровоносних судин через 30 днів після введення клітин ендотелію 10 а до введення, 10 б - через 30 днів після введення. Фіг. 11. (А) матрігель, видалений з експериментальних тварин через 8 днів, що не містить клітини ендотелію, (б) матрігель, видалений з експериментальних тварин через 8 днів, що містить клітини ендотелію. Розкриття винаходу Нами була поставлена задача розробити ефективний та відтворюваний метод диференціювання hESCs в чисту популяцію функціональних ендотеліальних клітин, в якій зміни патерну генної регуляції відповідають зрілим ендотеліальним клітинам. На відміну від диференціювання через стадію ET, пряме диференціювання ECK просте для спостереження за клітинами і маніпуляцій з ними, однак вимагає попередніх досліджень з визначення умов диференціювання. Крім того, контрольоване диференціювання, поперше, повинно приводити переважно до бажаного клітинного фенотипу. По-друге, повинна існувати можливість селекції потрібних популяцій клітин, причому сам процес селекції не повинен істотно впливати на життєздатність клітин та їх диференціювання. Наступним поставленим перед нами завданням є розробка методу сепарації попередників ендотелію та ендотеліальних клітин з диференційованих ECK людини. Відсутність у літературі даних по диференціювання ECK людини в двовимірній системі без формування ET в ендотеліальні клітини вимагала визначення умов і середовищ для диференціювання. Було випробувано понад 15 способів культивування з різними поєднаннями середовищ, сироваток та ростових факторів. Для цього колонії ECK переміщували в чашки Петрі з ростовими середовищами різного складу (табл.1). Табл.1. Порівняння різних середовищ для диференціювання ECK людини в ендотелій. Порівняння проводилося через 8 днів культивування на підставі імуногістохімічного аналізу. 7 95733 8 Таблиця 1 Середовище АльфаMEM Альфа-MEM EGM EGM DMEM/F12 DMEM/F12 DMEM/F12 Сироватка Нусlone defined Serum replacement Нуclone character rized Нусlоnе characte rized Ростові фактори Активін, VEGF VEGF FGF, SCF, EGF FGF VEGF FGF VEGF FGF, SCF, EGF VEGF, SCF, bFGF KO замінник сироватки VEGF SCF, ВМР4 TGFbetal bFGF Підкладка Коллаген І Колаген IV Колаген IV Колаген IV клітин ендотелію, % 0-2 5-8 Колаген IV + Колагєн Колаген IV І 5-8 У процесі диференціювання були виявлені окремі клітини, що експресують ранній маркер ендотелію CD31 і маркер пізнього, диференційованого ендотелію - фактор Вон Віллібрандта (vWF). Після застосування різних композицій середовищ в різних комбінаціях з факторами росту були виявлені ростові фактори, що забезпечують ефективне диференціювання ECK людини в ендотеліальні клітини. До таких ростових факторів білкової природи відносяться stem cell factor SCF (виробник Chemicon), людський фактор росту ендотелію судин VEGF (виробник Chemicon), bone morphogenic protein ВМР4, basic fibroblast growth factor bFGF (виробник Chemicon), tumor growth factor TGFbeta. Кількісні співвідношення даних ростових факторів залежить від складу середовища, наявності або відсутності в середовищі компонентів невизначеного походження, а також - можуть варіювати в залежності від ліній ЕСК, що використовувались. Кількість ростових факторів може бути підібрана 10-15 25-40 Колаген IV >50 експериментальним шляхом. Протягом диференціювання в середовищі, що містить компоненти, необхідні для спрямованої диференціювання ECK людини в ендотеліальні клітини, ми могли спостерігати зміни і в морфології клітин і в специфічній експресії маркерів ендотелію. Спочатку, на 4 день після індукції диференціювання, були виявлені CD31 ендотеліальні маркери. Поява судиноподібних структур співпала з експресією vWF. На день 6-7 майже 60% клітин експресували CD31 молекулу і до кінця процедури диференціювання (12-ий день), приблизно 50% клітин експресували CD105 антиген (табл. 2). При цьому варто зауважити, що експресія CD133 молекули була висока в недиференційованих hESCs і знижувалася протягом диференціювання в ендотеліальних попередниках. Досить високий відсоток диференціювання в ендотеліальні клітини дозволяв нам проводити тест на формування судин без селекції клітин. Таблиця 2 маркер CD31 VE-cadherin CD133 vWF CD-105 CD-34 0 + 2 + CD31 позитивні клітини представлені не тільки в складі судиноподібних структур, але і у вигляді моношару (Фіг.2). За даними досліджень, баланс між судиноподібнимі клітинами і моношаром залежить від концентрації VEGF. Для сепарації диференційованих з ECK людини ендотеліальних клітин нами було обрано метод імунологічної селекції з використанням поверхневих чи внутрішніх маркерів, специфічних для клітин ендотелію. Наприклад, в даному випадку використовувався метод імуномагнітної сепарації MACS (magnetic activated cell sorting) - ефективна Дні диференціювання 4 6 + + + + +/+/+ + 8 + + +/+ + 10 + + + + + 12 + + + + + технологія магнітного сортінга, заснована на поділі клітин по поверхневим антигенам (cм. www.miltenyibiotec.com). Подібний метод дозволяє швидко і ефективно (з чистотою 98% і більше) провести селекцію потрібної популяції клітин з поверхневими маркерами. Однак, може бути використаний і інший метод, наприклад - флуоресцентно-активований клітинний сортінг (FACS) або будь-які інші, що дозволяють розділити клітини в залежності від поверхневих чи внутрішніх маркерів. Для селекції ендотелію, отриманого з ECK у 9 двовимірній системі, ми скористалися маркером CD31, але можуть бути використані й інші маркери ендотелію, такі, як CD34, фактор vWF або інші. Селекцію на CD31 проводили на 5-7 день диференціювання. Помічено, що життєздатність клітин, відібраних на 5 день, була вища, ніж відібраних на день 7 після початку диференціювання (Фіг.3). Цей факт можна пояснити тим, що на 7 день диференціювання клітини ендотелію вже формують структури, які досить важко зруйнувати ферментативною обробкою, а збільшення часу обробки та/або руйнування міжклітинних контактів, що вже сформувалися, веде до істотного зниження життєздатності. Отже, проведення селекції на 5 день диференціювання в наших умовах можна вважати оптимальним. При використанні для селекції інших маркерів, селекцію можна проводити на 3-9 дні диференціювання. Виділені клітини висівали на чашки, покриті колагеном, в середовище для ендотеліального диференціювання. Клітини висівали у високій щільності (не менше 50000 клітин на 1см2 і більше), так як посів у більш низькій щільності негативно впливав на життєздатність клітин. Нами запропоновано 2 варіанти способу отримання ендотеліальних клітин з ECK людини. Сутність першого варіанту способу отримання ендотеліальних клітин з ECK людини полягає в наступному: 1. Проведення диференціювання ECK людини на підкладці і в синтетичному середовищі, які забезпечують спрямоване пряме диференціювання ECK людини в ендотеліальні клітини, з VEGF, SCF, ВМР4, bFGF, TGFbeta. Використання як основи синтетичного середовища суміші рідкої DMEM/FI2 з рідким KO замінником сироватки в кількості (об.%): рідка DMEM/FI2- 75-95%, рідка KO замінник сироватки - 5-25%. Причому TGFbeta вносять в синтетичне середовище на 3-6-ий день диференціювання. 2. Проведення імунологічної селекції з використанням маркерів, специфічних для клітин ендотелію на 3-9 дні диференціювання. 3. Культивування ендотеліальних клітин при щільності посіву не менш 50000 клітин на 1см2. Сутність другого варіанту способу отримання ендотеліальних клітин з ECK людини полягає в наступному: 1 .Проведение диференціювання ECK людини на підкладці і в середовищі, які забезпечують спрямоване пряме диференціювання ECK людини в ендотеліальні клітини, з VEGF, SCF, bFGF. Використання, як основи, середовища суміші рідкої DMEM/FI2 і фетальної бичачої сироватки в кількості (об.%): рідка DMEM/FI2- 75-95%, рідка фетальна бичача сироватка - 5-25%. 2. Проведення імунологічної селекції з використанням маркерів, специфічних для клітин ендотелію на 3-9 дні диференціювання. 3. Культивування ендотеліальних клітин при щільності посіву не менш 50000 клітин на 1см2. У наших способах були випробувані лінії клітин hESM01, hESM03 HESM02, 04, HI, HUES7, 8,9, при цьому отримані результати були близькими, що підтверджує можливість його застосування для 95733 10 диференціювання будь-яких ECK людини. Співвідношення компонентів середовища може оптимізуватися для кожної клітинної лінії окремо для досягнення максимальної ефективності. В якості середовища для культивування клітин можуть бути використані й інші синтетичні середовища повністю відомого і охарактеризованого складу. Заявлені способи дозволяють отримати високий вихід клітин в кінці процедури диференціювання, що мають імунологічні маркери ендотелію, більшість з яких здатна брати участь у формуванні трубчастої мережі. Навіть більше, диференціювання було відтворене з використанням замінника сироватки замість охарактеризованої фетальної бичачої сироватки (FBS), що значно краще від існуючих методів диференціювання. Використання синтетичного середовища, що не містить компонентів тваринного походження, робить метод відтворюваним і незалежним від складу сироватки. Проте, навіть у цьому випадку, приблизно половина клітин була представлена невідомим типом клітин або незначною популяцією недиференційованих клітин. Важливо відзначити, що навіть маленький відсоток недиференційованих клітин або клітин, які диференціювалися в різні типи, може забруднити клітинну культуру. Ці сторонні популяції можуть мати великий вплив на безпеку і функціональну ефективність культури для терапевтичного застосування або подальшого вивчення. Таким чином, селекція специфічної популяції клітин важлива. CD31 визнаний кращим імунологічним маркером ендотеліальних клітин, і в той же самий час його експресія була виявлена дуже рано, на 6 день hESCs диференціювання, що дозволило його використовувати в методі імуномагнітного сортінга. Однак, використання інших маркерів (наприклад, CD34, фактор vWF) та інших методів селекції (наприклад, FACS) теж давало гарні результати. Варіанти здійснення винаходу Можливість здійснення способу підтверджується наступними прикладами його реалізації, які показують лише окремі випадки його виконання. Приклад 1. Культивування ECK людини. Лінії ECK людини культивували в середовищі, що містить 80% KnockOut DMEM, 20% KO замінника сироватки, глутамін 1 мМ, 1% замінні амінокислоти, 50 пеніциліну ОД/мл, 50 мкг/мл стрептоміцину (виробник Invitrogen), 0,1 мМ рмеркаптоетанолу (Sigma), і 4 мкг/мл bFGF (Chemicon) на інгібованих мітоміцином C (10мкг/мл, Sigma) мишачих ембріональних фібробластах (МІФ) при щільності 104 клітин/см2 в культуральних чашках, покритих 0,1%-ним желатином (Merck). Фібробласти готували з 12-денних мишачих ембріонів Fl (C57BL/6JxCBA/Ca). HESC колонії пасерували кожні 5-6 днів культивування обробкою колагенази типом IV (200U/ml, Invitrogen) і механічною диссекцією. Чашки з недиференційованими колоніями hESC, вирощеними протягом 8 днів, обробляли колагеназою IV протягом 10 хвилин, змивали двічі ростовим середовищем, і збирали колонії з фідера механічно, наконечником мікропіпетки вручну. Плюрипотентні лінії клітин, ізольовані і вирощені 11 на фідері, показували типову ECK морфологію клітини, експресували імунологічні маркери, характерні для недиференційованих клітин і підтримували нормальний каріотип. Ми не спостерігали навіть маленький відсоток CD31 позитивних клітин в недиференційованих колоніях. Приклад 2. Диференціація ECK людини в ендотеліальні клітини. Середовище для диференціювання. Для диференціювання використовували синтетичне середовище наступного складу: основа 85% рідкої DMEM/F12 (Нусіопе або аналог іншої фірми), 15% рідкого KO замінник сироватки (Invitrogen або аналог іншої фірми) з додаванням 1 % замінних амінокислот, 2 мМ L-глутаміну, 50 од/мл пеніциліну, 50 мг/мл стрептоміцину, 50 нг/мл SCF, 10нг/мл ВМР4, 50 нг/мл VEGF, активіна ІОнг/мл, 20 нг/мл bFGF, 2нг/мл TGFbeta. TGF beta вносять на 4 день диференціювання. Концентрації і поєднання ростових факторів можуть відрізнятися від зазначених на 50-100% залежно від клітинної лінії та індивідуальних умов культивування. Спосіб приготування середовища. Рідке середовище DMEM/FI2 змішували з рідким замінником сироватки, антибіотиками і глутаміном і для подальшого використання зберігалося при +40 С. Всі інші компоненти (ростові фактори тощо) додавалися в середовище безпосередньо перед додаванням до клітин. Повне середовище не зберігалося. Методика проведення диференціювання. Чашки з недиференційованими колоніями hESC, вирощеними протягом 8 днів (Фіг.4A), обробляли колагеназою IV протягом 10 хвилин, змивали двічі ростовим середовищем, колонії збирали вручну наконечником мікропіпетки, розрізаючи на фрагменти розміром 300-500 клітин. Колонії ECK для проведення диференціювання були переміщені в 35 мм чашки Петрі, покриті колагеном IV (70 ug/ml) в середовищі, зазначеного вище складу (Фіг.4B). На 4день диференціювання в середовище додавали 2нг/мл TGFbeta 1. На наступний після додавання день клітини набували морфологію диференційованих похідних (Фіг. 4В). На 6-10 день культивування колонії містили кластери судиноподібних структур (Фіг. 4Г). Приклад 3. Диференціація ECK людини в ендотеліальні клітини. Відрізняється від прикладу 1 використанням середовища на основі суміші рідких DMEM/F12 (Нусlone) і фетальної бичачої сироватки (Hyclone characterized). Середовище для диференціювання. Для диференціювання використовували середовище наступного складу: основа 85% рідкої DMEM/F12 (Нусіопе або аналог іншої фірми) і 15% фетальної бичачої сироватки (Нусіопе, characterized або аналог іншої фірми), 2 мМ L-глутаміну, 1% замінні амінокислоти, 50 одиниць/мл пеніциліну, 50 мг/мл стрептоміцину, (всі від Invitrogen або аналог іншої фірми), 20 нг/мл SCF (Chemicon або аналог іншої фірми), від 10 до 50 нг/мл VEGF (Chemicon або аналог іншої фірми), 5 нг/мл bFGF (Chemicon або аналог іншої фірми) Ростові фактори можуть варіювати, як зазначено в прикладі 1. 95733 12 Средовище готують, як описано в прикладі 1. Клітини також на 3-6 день набували морфологію диференційованих похідних. На 6-10 день культивування колонії містили кластери судиноподібних структур. Приклад 4. Сепарація ендотеліальних клітин. Для CD31 + клітинної селекції клітини на 5-7 день диференціювання були відокремлені обробкою колагенази IV (Invitrogen або аналог іншої фірми) при 37° C протягом 10 хвилин і змиті двічі забуференим фосфатом фізіологічним розчином (phosphate bufferd saline PBS), який містить 0,5% альбуміну бичачої сироватки (BSA). Отримані клітини інкубували протягом ЗОхвилин з антитілами 6 миші проти CD31 людини в порції 10 мкг на 10 клітин і потім з IgG кози проти миші, пришитими до магнітних кульок (Miltenyi Biotec або аналог іншої фірми) протягом 15 хв при 8С. CD31 позитивні клітини були ізольовані, проходячи через фільтр і колонку MS, прикріплену до магнітного блоку MiniMACS separation unit (Miltenyi Biotech або аналог іншої фірми), щоб отримати збережену магнітом фракцію очищених CD31 + клітин. Після елюції CD31 позитивні клітини були поміщені на покриті колагеном IV плашки з щільністю посіву 50000 клітин на 1см2 і клітини були вирощені в ендотелій - підтримуючому середовищі (Фіг. 5 А). Промислова застосовність Чистоту виділеної популяції визначали по імуноцитохімічному аналізу. Щоб дізнатися, чи є CD31 + клітини, елюйовані з колонки, клітинами ендотелію або їх попередниками, частину клітин піддавали функціональному тесту на приналежність клітин до ендотелію-тесту на матрігелі. Аналіз експресії генів, характерних для ендотелію, проводили методом напівкількісного ЗТ-ПЛР (Зворотньої транскрипції ПЛР). Імуноцитохіміний аналіз. Клітини фіксували 100%-м крижаним метанолом протягом 5 хвилин або 4% парафармальдегідом протягом 10 хвилин при кімнатній температурі. Слайди були промиті в трьох PBS, 0,1% Tween20 і інкубувались з вторинними антитілами: Alexa Fluor 546-conjugated IgG кози проти миші, Alexa Fluor 488-conjugated IgG кози проти миші в розведенні 1:800. Первинні антитіла, що використовувались, були антилюдським CD31, антилюдським vWF, антилюдським CD105, антилюдським CD34, антилюдським CD133, антилюдським Flk-1, антилюдським CD14, антилюдським CD45. Клітини були також пофарбовані 4,6-діамідинів-2фенілондолом (DАРІ). Після цього імуномічені клітини чи фрагменти були досліджені за допомогою флюоресценцентного мікроскопу. Щоб уникати артефактів у виявленні, ми використовували антитіла з різною специфікою для селекції клітин, що використовувались. Чистота популяції клітин була більше ніж 90% (Фіг. 5 Б). Випробування на здатність утворювати судиноподібні структури. Випробування було проведене, як описано в (21). Матрігель додавався в 24 лунки планшета. 4 0,5-2x10 клітин були поміщені в лунки в 0,5 мл ростового середовища і инкубувались при 37С та 5% СO2. Морфологія клітин аналізувалася в фа 13 зовому контрасті на інвертованому світловому мікроскопі. Як видно на Фіг. 5В, клітини формують характерну для ендотелію комірчасту судиноподібну мережу. Зворотньої транскрипції ПЛР (ЗТ-ПЛР). Тотальна PHK була ізольована від недиференційованих hESCs, CD31 селектованих ендотеліальних клітин і HUVECs (ендотеліальні клітини вени людської пуповини) використанням RNeasy Mini Kit (Qiagen). Зворотня реакція транскрипції була виконана, використовуючи PHK (1-2 мкг), випадкові шестинуклеотидні праймери (Promega), RevertAid M-MuLV зворотню транскриптазу і реактиви (Promega) згідно з рекомендаціями виробника. Кодуюча ДНК була розчинена в кінцевому об'ємі 25 мл. Певну кількість кДНК (1-5мл) було піддано ПЛР ампліфікації, використовуючи Taq ДНК полімеразу та реактиви (Fermentas). Всі зразки PHK були здатні призвести до рівної ампліфікації гліцеральдегід-3-фосфатдегідрогенази (GAPDH), як внутрішній стандарт. Послідовності праймерів для ЗТ-ПЛР вказані в Таблиці 3. Продукти ампліфікації були сепаровані в 1,5% агарозному гелі. І Фактори транскрипції грають важливу роль протягом ембріонального розвитку в напрямку диференціювання і підтримки фенотипу. Особливо ендотелій-специфічні фактори транскрипції GATA2 і 3, які майже повністю вимкнені в недиференційованих hESCs, хоча їх експресія в отриманій з hESCs чистій популяції ендотеліальних клітин була порівнянна з їх експресією в HUVECs. Ген eNOSa не експресувався недиференційованими hESCs, але після диференціювання в ендотелій його експресія була виявлена в чистій популяції ендотеліальних клітин на тому ж самому рівні, як в HUVCs. Таким чином, Аналіз експресії генів, характерних для ендотелію, методом напівкількісного ВЩ-ПЛР показав, що рівень експресії цих генів у клітинах ендотелію з ECK порівняний з експресією в HUVEC (Фіг.6) Геномне бісульфітне секвенування. Були виділені геномні ДНК від недиференційованих hESCs, CD31 відібраних hESCs-отриманих ендотеліальних клітин і HUVEC Геномна ДНК була піддана обробці натрієм бісульфіта, використову 95733 14 ючи CpGenome™ Fast DNA Modification Kit, Chemicon. Аліквоти ДНК, модифікованої бісульфітом натрію (25-50нг), були використані для ПЛР при 45 циклах ампліфікації. Праймери для ПЛР у ділянках, що цікавили, були підібрані для натрію бісульфіт модифікованої матриці (Таблиця 4), Кінцеві ПЛР продукти були клоновані за допомогою набору pGEM-T Easy (A1360, Promega), і клони плазміди (10 для кожної ділянки) були секвеновані використанням автоматизованої ABI Prism 377 ДНК Sequencer (Applied Biosystems). Щоб підтвердити, що ендотеліальні клітини диференційовані з hESCs мають правильний прояв епігенетичного статусу, ми порівняли профілі метилювання регулюючих ділянок GATA-2, -3, і генів eNOCa в hESCs, ендотеліальних клітин диференційованих з hESCs і HUVECs. Ми досліджували рівень метилювання кожного CpG в області відповідного селективного промотора гена GATA-2 (з 43 по -187 нуклеотид щодо старту транскрипції, що визначається, як +1) за допомогою бісульфітного секвенування. У недиференційованих hESCs ця область була високо метилована - майже до 80% метилювання (Фіг. 7). Рівні метилювання селективного промотора в HUVEC та ендотеліальних клітинах, диференційованих з hESCs, були низькими і варіювали від 20% в ендотеліальних клітинах, диференційованих з hESCs, до 10%-в HUVECs. CpG розташовані в області від 228-115 нуклеотидів, були високо метиловані в недиференційованих клітинах (до 90%), але в отриманих з hESC клітинах ендотелію і в HUVECs, метилювання означеної області знижувалося до 15-20% (Фіг. 8). Таким чином, незважаючи на гіперметилювання проксимального промотора, ген GATA-3 був слабо експресований в недиференційованих hESCs, хоча гіпометілований промотор значно збільшив його експресію. Згідно з даними Chan (22), в ендотеліальних клітинах найістотніші епігенетичні модифікації відбуваються в області промотора eNOSa, найближчою до сайту початку транскрипції. Ця область гена eNOSa між 13 і-237 нуклеотидами була обрана для аналізу бісульфітного секвенування, який показав, що область була гіперметилована в недиференційованих hESCs приблизно на тому ж самому рівні, як регулюючі області GATA-2 і GATA3 генів - від 70 до 90% у кожному CpG положенні. Після hESCs диференціювання в ендетеліальні походження метилювання цієї області зменшилося до 20% у функціональних ендотеліальних клітинах, відібраних з hESCs і не перевищувало 10% у HUVECs (Фіг.9). Бісульфітное секвенування дозволило виявити, що область селективного промотора GATA-2, 15 гіперметилована в hESCs і гіпометилована в hESCs-отриманих ендотеліальних клітинах. Таким чином, ми показали, що статус метелування GATA-2 селективного промотора впливає на експресію цього фактора транскрипції. Прийняттям до уваги кореляції експресії GATA-2 і його промотора метилювання в hESCsотриманих ендотеліальних клітинах ми могли визнати важливу роль селективного промотора GATA-2 в ендотелій-диференціюванні. Незважаючи на гіперметилювання GATA-3 проксимального промотора, GATA-3 ген був слабо експресуваним в недиференційованих hESCs. Однак, ми не могли виключити, що в недиференційованих hESCs GATА-3 ген запущений альтернативним промотором. Проаналізувавши всі отримані дані, ми можемо заключите, що in vitro зовнішні сигнали викликають складну комбінацію молекулярних механізмів, що закінчуються індукцією певних факторів транскрипції експресії. Навіть більше, вважаючи, що ДНК деметилювання є заключним кроком епігенетичних подій, що ведуть до активації гена, ця індукція постійна і необоротна. Безсумнівно, стовбурові клітини мають великий потенціал, однак цей потенціал повинен управлятися in vitro, інакше небажані наслідки можуть мати місце після неконтрольованого в природних умовах диференціювання. Згідно з нашими даними, GATA-2 і eNOS промотори піддаються гіпометилуванню в ході hESCs диференціювання в ендотелій. Отже, ми можемо заключити, що ендотелій-специфічна експресія eNOSa регулюється через подвійний негативний епігенетичний контроль. У недиференційованих hESCs не тільки промотор eNOSa, але також і промотор його регулюючого чинника транскрипції GATA-2 був блокований метилюванням. Наші дослідження демонструють суттєві відмінності в метилюванні областей промоторів трьох генів від hESCs до з hESCs-отриманим ендотеліальних клітин. Однак, ми спостерігали деякі відмінності між областями промоторів метилювання трьох генів, вивчених в hESCs-отриманих ендотеліальних клітинах і HUVEC В отриманих з hESCs ендотеліальних клітин області промоторів генів, що вивчались, були трохи більше метиловані, ніж відповідні області в HUVEC, хоча це не закінчувалося придушенням транскрипції. Можливо, це відображає, що ендотеліальні клітини, які походять з hESCs, не були ендотеліальними клітинами вени пуповини, а скоріше представляли суміш спеціалізованих підтипів ендотеліальних клітин (наприклад, капілярні, аортальні ендотеліальні клітини, легеневі ендотеліальні клітини), де рівень метилювання є змінним. Отримані ендотеліальні клітини могли бути піддані заморожуванню і зберіганню. При цьому клітини зберігали життєздатність і свої властивості. Кріоконсервацію та відтавання ендотеліальних клітин здійснювали наступним чином. Середовище для заморозки мало наступний склад: 90% фетальна бичача сироватка (інактивована при 56C протягом 45 хвилин) (Invitrogen або 95733 16 аналог іншої фірми), 10% DMSO (ICN Biomedicals, Inc. Або аналог іншої фірми). З культивованих клітин видаляли середовище, промивали двічі PBS, додавали трипсин/ЕДТА 2 2 мл на 100мм чашку або 75 см флакон. Інкубували при 37C 5 хвилин, нейтралізували трипсин/ЕДТА 5 мл культурального середовища і піпетувати, щоб отримати одноклітинну суспензію. Отриману суспензію переносили в 25 мл пробірку і центрифугували 5 хвилин при 12Q0rpm. Осад суспендували в 1мл середовища для заморожування, потім переносили в кріовіалу і відразу поміщали на 24 години на -70C На наступний день кріовіали переносили в рідкий азот для тривалого зберігання. В одній кріовіалі заморожували 1,5-3млн клітин. Кріовіали відтавали на водяній бані при 37C, стерилізували 95% етанолом. Вміст віали переносили в 15 мл пробірку і поступово додавали 9мл культурального середовища. Центрифугували 5 хвилин при 1000rрm, надосадову рідину видаляли, осад суспендували в 1 мл середовища і переносили в культуральну чашку або флакон з середовищем. Клітини рівномірно розподіляли по поверхні і поміщали в інкубатор при 37°С та 5% СO2. Методи, способи, застосування отриманих клітин ендотелію (ендотеліоцити). 1. Отримані описаним вище способом клітини ендотелію можуть бути застосовані для формування судинної мережі (колатералей) de novo за рахунок неоангіогенезу шляхом введення 104, 105, 106 або більшої кількості клітин у вену або артерію ссавців, включаючи людину (Фіг. 10). 2. Отримані клітини можуть бути застосовані для васкуляризації імплантанта шляхом додавання їх до біосумісного матеріалу, такого як желатин, хітозан, колаген, матрігель і інші або їх комбінації, що забезпечують формування тривимірної структури, до якої крім клітин ендотелію можуть входити такі клітини, як фібробласти, кардіоміоцити, гепатоцити, кератиноцити, нейрони, мультипотентні клітини кісткового мозку, гліальні клітини, хондроцити, остеоцити і інші клітинні типи або поєднання типів клітин і імплантування (запровадження) в організм ссавців, включаючи людину. Васкуляризація імплантанта може здійснюватися або за рахунок залучення ендотеліальних клітин організму, або за рахунок васкуляризації імплантованими клітинами, що містяться в тривимірній структурі для забезпечення імпланта (введеної тканинної або клітинної композиції) кровопостачанням (Фіг. 11). 3. Отримані клітини ендотелію можуть бути використані для виготовлення трубчастої структури, покритої ендотеліоцитами, шляхом нанесення їх на двовимірну підкладку з колагену, мтарігелю, хітозану, фібронектину і/або інших біосумісних матеріалів у поєднанні з іншими типами клітин або без них, яка може бути використана в якості трубки при операціях на судинах для відновлення порушеного або недостатнього кровообігу, шляхом заміни частини, фрагменту або повністю судини або її стентування. 4. Стримані стандартизованим методом із стандартної відновлюваної клітинної культури, клітини ендотелію можуть бути використані для 17 тестування токсичності хімічних або біологічних субстанцій, або можуть бути використані для визначення ефективності речовин, здатних стимулювати ріст (проліферацію) клітин ендотелію шляхом визначення проліферації або загибелі клітин ендотелію за допомогою відомих методів. 5. Клітини ендотелію можуть бути використані для діагностичних або терапевтичних цілей для лікування генетичних захворювань або для доставки генів токсинів або самих токсинів в місця активного ангіогенезу (росту судин) для блокування останніх (наприклад, у випадку росту судин у пухлині) з метою припинення кровопостачання органа або тканини та її подальшою загибеллю шляхом їх генетичної модифікації, конструкціями, що містять гени репортери, наприклад, зелений флуоресцентний білок або аналогічні, або генетичними конструкціями, що містять гени токсинів, або генетичними конструкціями, що містять гени для відновлення роботи порушених генів і введення модифікованих клітин ендотелію в організм ссавців, зокрема людини. Ендотеліальні клітини, модифіковані генетичними конструкціями, що кодують фактори росту, можуть бути векторами для стимуляції росту певної тканини, клітин, групи клітин. 6. Поєднання перерахованих вище методів використання. Таким чином, наша двовимірна система диференціювання дозволила нам продукувати ендотеліальні клітини з високою ефективністю, вибирати чисту популяцію функціональних ендотеліальних клітин, які набували той же самий епігенетичний статус ключових факторів транскрипції та гомеостазу підтримки генів, як їх аналоги, що диференціюються в ембріоні in vivo. Отримані ендотеліальні клітини можуть знайти широке застосування в медичній практиці. Відібрані hESC-отримані ендотеліальні клітини експресували ендотелій-специфічні гени, формували судиноподібні структури і морфологічно не відрізнялися від первинних ендотеліальних клітин. CD31 відібрані ендотеліальні клітини, диференційовані з hESCs, були здатні культивуватися in vitro принаймні до 4 пасажів. Використовуючи наш спосіб диференціювання, ми спостерігали CD31 і VE-cadherin експресію на 6 день. Безсумнівно, це могло статися через відмінності між лініями клітин, хоча умови культивування (тобто середовище культивування, фактори росту, обробка) мають великий вплив на властивості диференціювання. Цікаво те, що ми виявили VE cadherin експресію на 6 день hESCs диференціювання, у той час як у природних умовах його експресія спостерігалася лише на 8-му тижні вагітності. Таким чином, маркер диференційованих ендотеліальних клітин VE-cadherin був виявлений дуже рано in vitro. Список літератури. 1. Baharvand, H., Jafary, H., Massumi, M., Ashtiani, S.K. Generation of insulin-secreting cells from human embryonic stem cells. Dev Growth Differ. 2006,48: 323-332. 2. Hay, D.C., Zhao, D., Ross, A., Mandalam, R., Lebkowski, J., Cui, W. Direct Differentiation of Human 95733 18 Embryonic Stem Cells to Hepatocyte-like Cells Exhibiting Functional Activities. Cloning Stem Cells. 2007,9: 51-62 3. Heng, B.C., Haider, H.Kh., Sim, E.K., Cao, T., Ng, S.C. Strategies for directing the differentiation of stem cells into the cardiomyogenic lineage in vitro. Cardiovasc Res. 2004, 62:34-42. 4. Xu, C, He, J.Q., Kamp, T.J., Police, S., Hao, X., O'Sullivan, C, Carpenter, M.K., Lebkowski, J., Gold JD. Human embryonic stem cell-derived cardiomyocytes can be maintained in defined medium without serum. Stem Cells Dev. 2006, 15: 931 -941. 5. Lacaud, G., Keller, G., Kouskoff, V. Tracking mesoderm formation and specification to the hemangioblast in vitro.Trends Cardiovasc Med. 2004,14,314-317. 6. Choi, K., Kennedy, M., Kazarov. A., Papadimitriou, J.C., Keller, G. A common precursor for hematopoietic and endothelial cells. Development. 1998, 125, 725-732. 7. Chung, Y.S., Zhang, W.J., Arentson, E., Kingsley, P.D., Palis, J., Choi, K. Lineage analysis of the hemangioblast as defined by FLKl and SCL expression. Development. 2002, 129,5511-5520. 8. Nishikawa, S.I., Nishikawa, S., Hirashima, M., Matsuyoshi, N., Kodama, H. Progressive lineage analysis by cell sorting and culture identifies FLKl+VE-cadherin+ cells at a diverging point of endothelial and hemopoietic lineages. Development. 1998, 125, 1747-1757. 9. Huber, T.L., Kouskoff, V., Fehling, H.J., Palis, J., Keller, G. Haemangioblast commitment is initiated in the primitive streak of the mouse embryo. Nature. 2004,432, 625-630. 10. Cerdan, C , Rouleau, A., Bhatia, M., VEGFA165 augments erythropoietic development from human embryonic stem cells. Blood. 2004, 103,2504-12. 11. Chadwick, K., Wang, L., Li, L., Menendez, P., Murdoch, B., Rouleau, A., Bhatia, M. Cytokines and BMP-4 promote hematopoietic differentiation of human embryonic stem cells. Blood. 2003, 102, 906-915 12. Levenberg, S., Golub, J.S., Amit, M., Itskovitz-Eldor, J., Langer, R. Endothelial cells derived from human embryonic stem cells. Proc Natl Acad Sci USA. 2002,99: 4391-4396. 13. Ng, E.S., Davis, R.P., Azzola, L., Stanley, E.G., Elefanty, AG. Forced aggregation of defined numbers of human embryonic stem cells into embryoid bodies fosters robust, reproducible hematopoietic differentiation. Blood. 2005,106,1601-1603. 14. Zambidis, E.T., Peault, B., Park, T.S., Bunz, F., Civin, C.I., Hematopoietic differentiation of human embryonic stem cells progresses through sequential hematoendothelial, primitive, and definitive stages resembling human yolk sac development. Blood. 2005, 106, 860-870. 15. Zhan, X., Dravid, G., Ye, Z., Hammond, H., Shamblott, M., Gearhart, J., Cheng, L. Functional antigen-presenting leucocytes derived from human embryonic stem cells in vitro.Lancet. 2004, 364, 163171 16. Kaufman, D.S., Hanson, E.T., Lewis, R.L., Auerbach, R., Thomson, J.A. Hematopoietic colonyforming cells derived from human embryonic stem cells. Proc Natl Acad Sci USA. 2001,98,10716-10721. 19 17. Vodyanik, M.A., Bork, J.A., Thomson, J.A., Slukvin, I.I. Human embryonic stem cell-derived CD34+ cells: efficient production in the coculture with OP9 stromal cells and analysis of lymphohematopoietic potential. Blood. 2005, 105, 617-626. 18. Hirashima, M., Kataoka, H., Nishikawa, S., Matsuyoshi, N., Nishikawa, S. Maturation of embryonic stem cells into endothelial cells in an in vitro model of vasculogenesis. Blood. 1999,93,1253-1263. 19. Lagarkova, M.A., Volchkov, P.Y., Lyakisheva, A.V., Philonenko, E.S., Kiselev, S.L. Diverse epigenetic profile of novel human embryonic stem cell lines. Cell Cycle. 2006, 5: 416-420. 95733 20 20. Gerecht-Nir, S., Ziskind, A., Cohen, S., Itskovitz-Eldor, J. Human embryonic stem cells as an in vitro model for human vascular development and the induction of vascular differentiation. Lab Invest. 2003, 83: 1811-1820. 21. Bompais, H. et al. Human endothelial cells derived from circulating progenitors display specific functional properties compared with mature vessel wall endothelial cells. Blood 103, 2577-2584 (2004) 22. Chan, Y., Fish, J.E., D'Abreo, C The cellspecific expression of endothelial nitric-oxide synthase: a role for DNA methylation. J Biol Chem. 2004,279: 35087-35100. 21 95733 22 23 95733 24 25 95733 26 27 95733 28 29 95733 30 31 Комп’ютерна верстка Д. Шеверун 95733 Підписне 32 Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for producing endothelial cells (variants)
Автори англійськоюKisieliov Sierhiei Lvovich, Laharkova Maria Andrieievna
Назва патенту російськоюСпособ получения эндотелиальных клеток (варианты)
Автори російськоюКиселёв Сергей Львович, Лагарькова Мария Андреевна
МПК / Мітки
МПК: C12N 5/073
Мітки: варіанти, ендотеліальних, клітин, спосіб, отримання
Код посилання
<a href="https://ua.patents.su/16-95733-sposib-otrimannya-endotelialnikh-klitin-varianti.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання ендотеліальних клітин (варіанти)</a>
Попередній патент: Патрон невибухового руйнуючого матеріалу
Випадковий патент: Установка для безперервного піролізу твердих органічних відходів