Портативний інгалятор для розпилення лікарського препарату без використання газу-пропеленту
Номер патенту: 103028
Опубліковано: 10.09.2013
Автори: Вахтель Херберт, Бікманн Дебора, Шпаллек Міхаель
Формула / Реферат
1. Портативний інгалятор (1) для розпилення лікарського препарату (2) без використання газу-пропеленту, який має генератор (5) тиску, що містить камеру (11) тиску, де генератор тиску бажано виконаний у вигляді насоса і/або діє механічно, і який має випускне сопло (12) для випуску розпиленого лікарського препарату (2) у вигляді аерозолю (14) в мундштук (13),
де для розпилення лікарського препарату (2), генератор тиску виконаний з можливістю поміщення лікарського препарату (2) під тиск в камері (11) тиску, який витісняє лікарський препарат (2) з камери (11) тиску через випускне сопло (12),
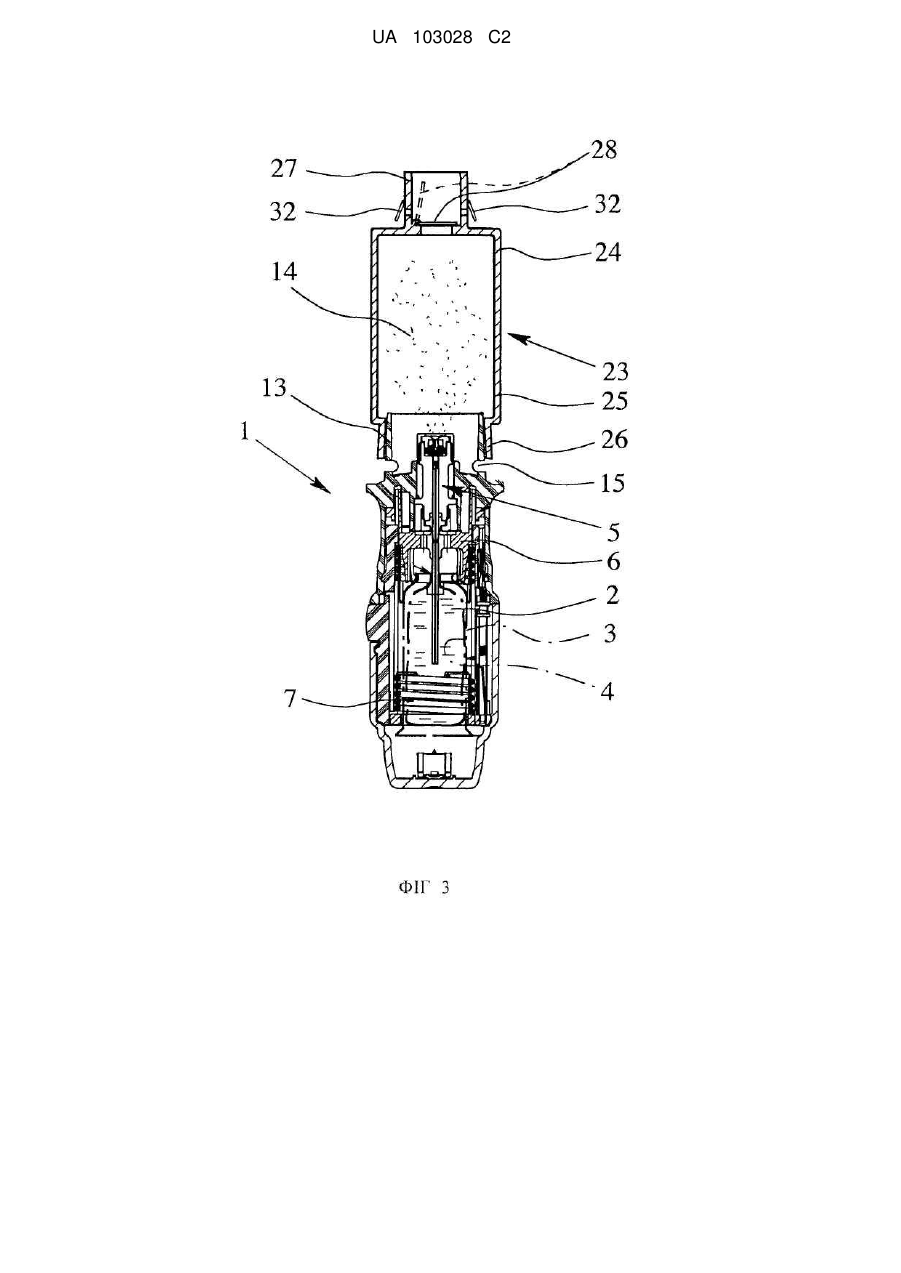
де інгалятор (1) має закріплену на мундштуку (13) приставку (23), яка містить камеру (24) для проміжного розміщення аерозолю (14), де камера (24) розташована або пристосована для розташування нижче за потоком від випускного сопла (12),
який відрізняється тим, що
мундштук (13) має щонайменше один отвір (15) для підведення повітря, який залишається відкритим, коли приставка (23) прикріплена, зокрема, коли вона одягнута.
2. Інгалятор за п. 1, який відрізняється тим, що приставка (23), виконана з можливістю закріплення на мундштуку (13) охоплюючи його і/або може зніматися з інгалятора (1) або мундштука (13).
3. Інгалятор за п. 1 або 2, який відрізняється тим, що приставка (23) або камера (24) мають принаймні в цілому циліндричну, подовжену або конічну будову.
4. Інгалятор за одним з попередніх пунктів, який відрізняється тим, що камера (24) має об'єм більше ніж принаймні 0,1 л, бажано більше ніж 0,2 л, більш бажано приблизно від 0,2 до 0,6 л.
5. Інгалятор за одним з попередніх пунктів, який відрізняється тим, що мундштук (13) має два отвори (15) для підведення повітря, які розташовані нижче випускного сопла (12), відносно їх положення уздовж поздовжньої осі інгалятора (1), тоді як основна частина камери (24) для проміжного розміщення аерозолю (14) простирається вище випускного сопла (12).
6. Інгалятор за одним з попередніх пунктів, який відрізняється тим, що приставка (23) містить зокрема на випускному кінці клапан (28) для запобігання проходження повітря назад в камеру (24) і/або мундштук (13) і/або для всмоктування аерозолю, і/або щонайменше один клапан (32) для випуску повітря, що видихається.
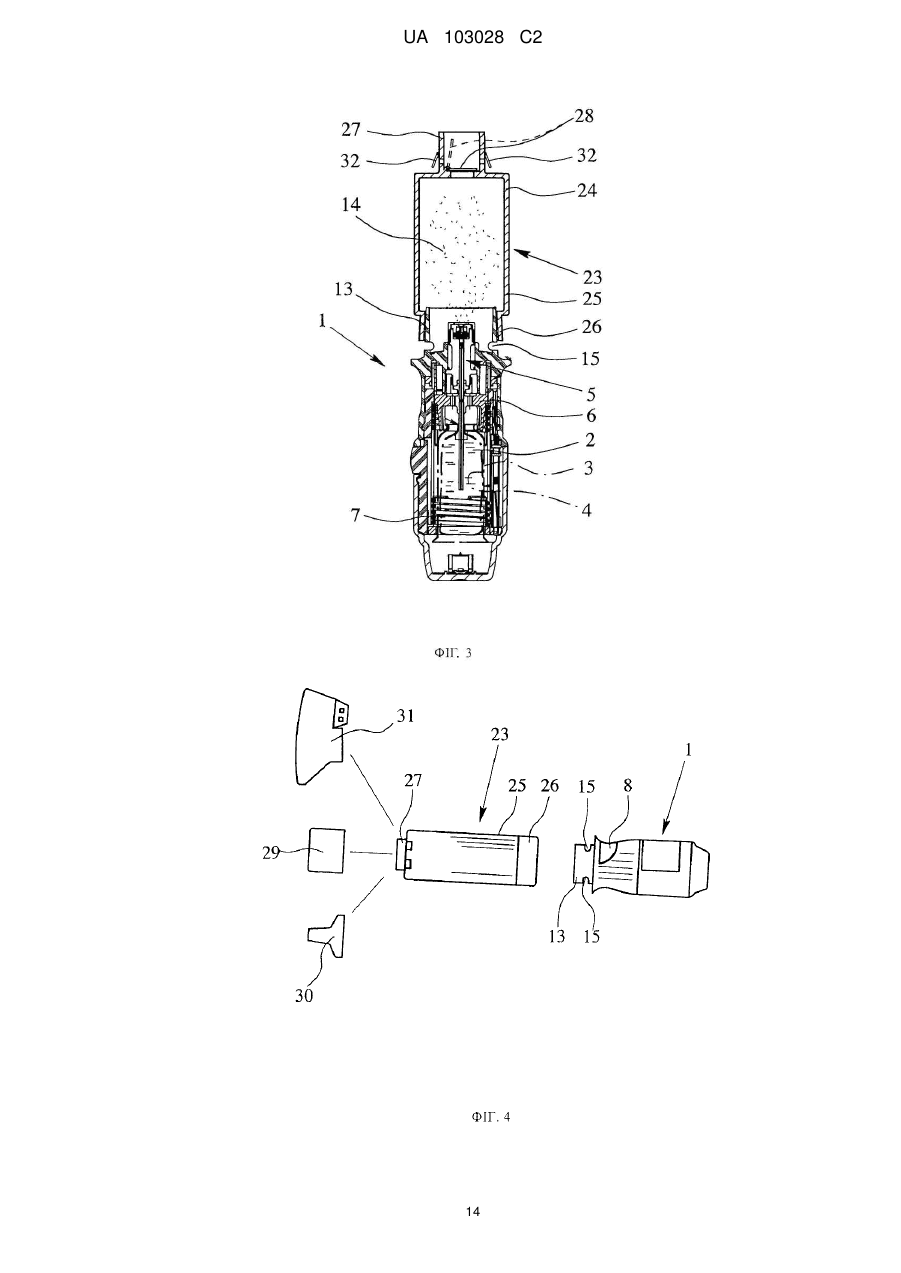
7. Інгалятор за одним з попередніх пунктів, який відрізняється тим, що приставка (23) обладнана або пристосована для установки на неї на вибір додаткового мундштуку (29), трубки (30) і/або дихальної маски (31).
8. Інгалятор за одним з попередніх пунктів, який відрізняється тим, що конструкція інгалятора (1) забезпечує розпилення визначених кількостей лікарського препарату (2) і те, що лікарський препарат (2) досягає тиску 10-60 МПа в генераторі тиску (5) або в камері (11) тиску під час випускання лікарського препарату (2).
9. Інгалятор за одним з попередніх пунктів, який відрізняється тим, що виконаний з можливістю створення тиску або розпилення здійснюється зусиллям пружини.
Текст
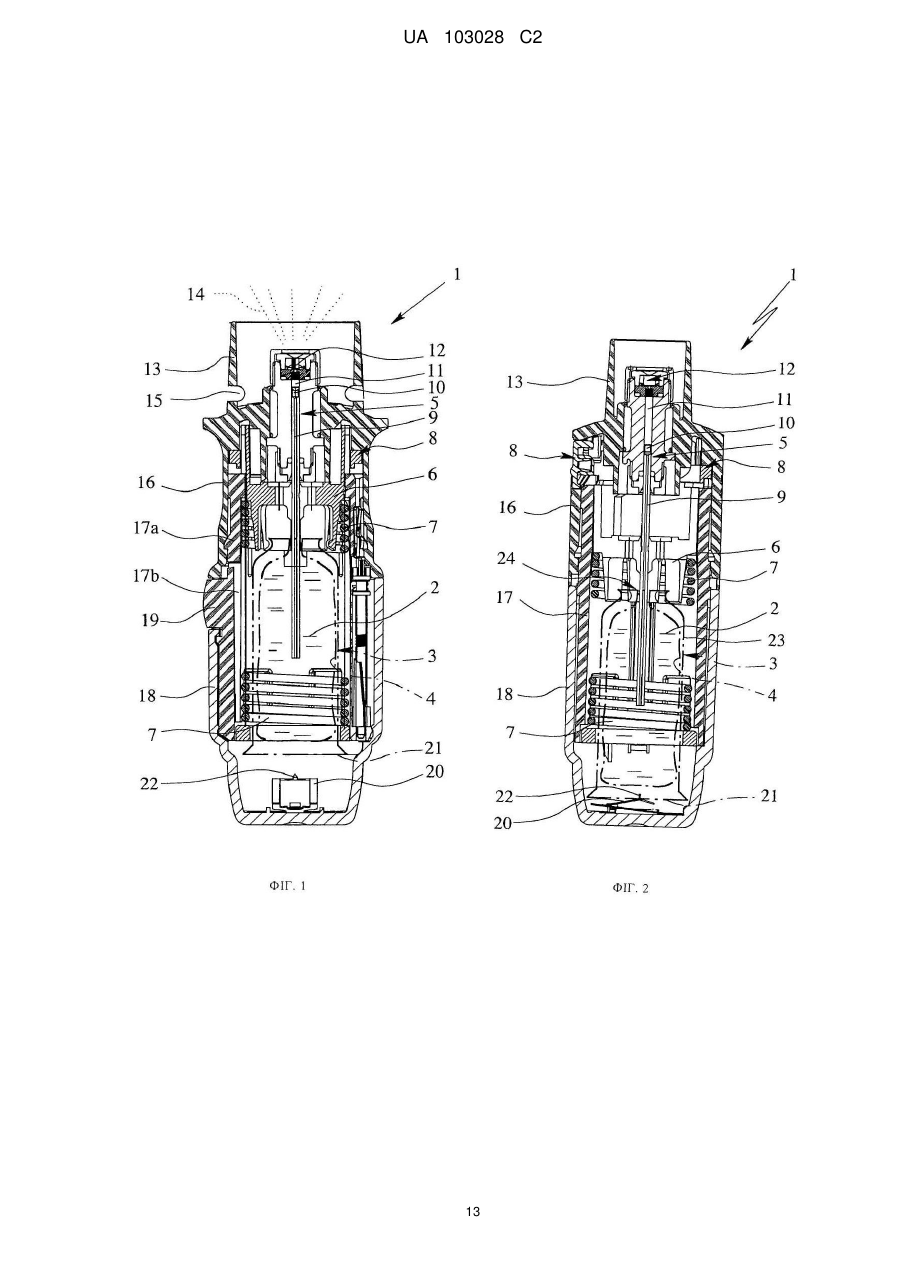
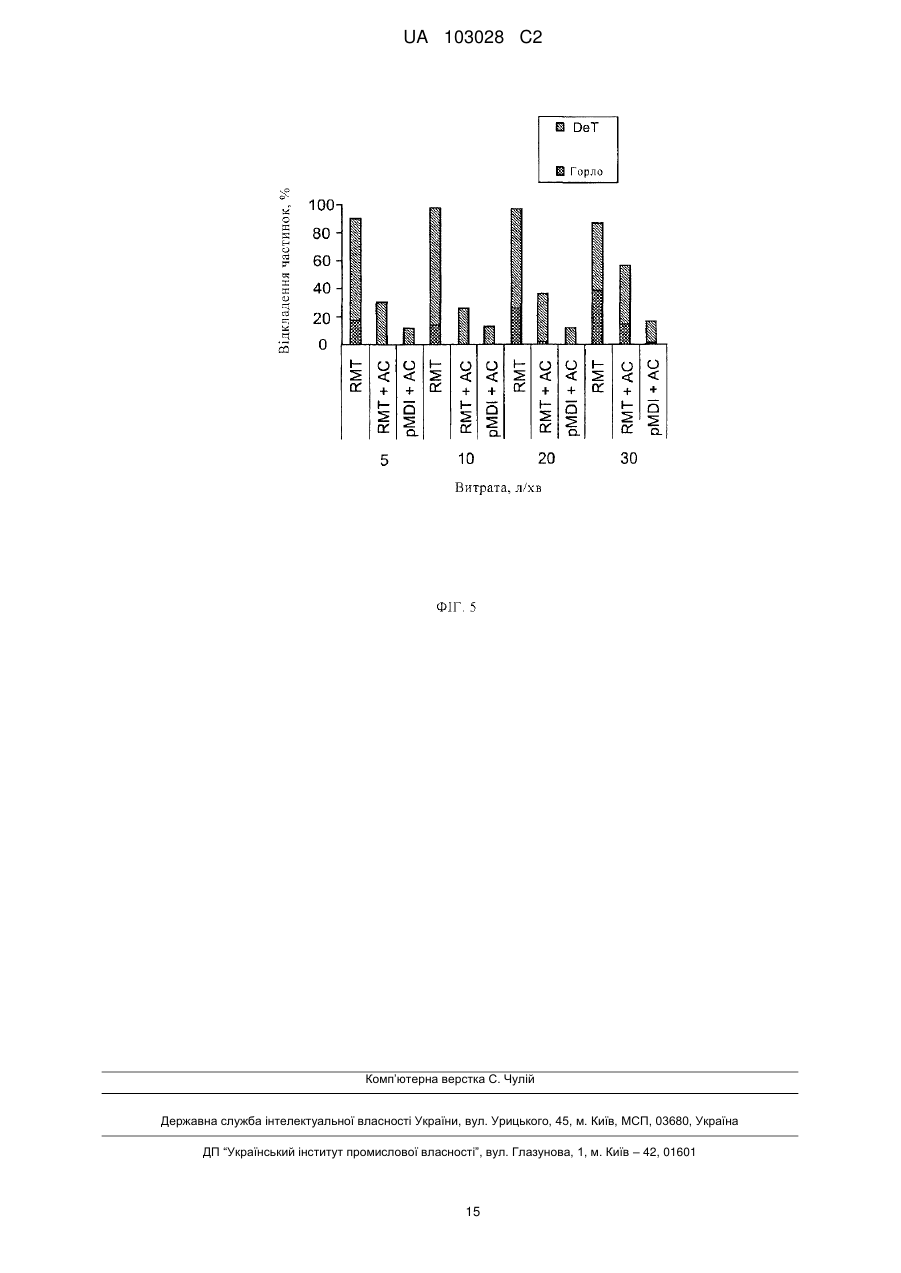
Реферат: Портативний інгалятор (1) для розпилення лікарського препарату (2) без використання газупропеленту має генератор (5) тиску, що містить камеру (11) тиску, де генератор тиску бажано виконаний у вигляді насоса і/або діє механічно, і який має випускне сопло (12) для випуску розпиленого лікарського препарату (2) у вигляді аерозолю (14) в мундштук (13). Для розпилення лікарського препарату (2), генератор тиску виконаний з можливістю поміщення лікарського препарату (2) під тиск в камері (11) тиску, який витісняє лікарський препарат (2) з камери (11) тиску через випускне сопло (12). Інгалятор (1) має закріплену на мундштуку (13) приставку (23), яка містить камеру (24) для проміжного розміщення аерозолю (14), де камера (24) розташована або пристосована для розташування нижче за потоком від випускного сопла (12). Мундштук (13) має щонайменше один отвір (15) для підведення повітря, який залишається відкритим, коли приставка (23) прикріплена, зокрема, коли вона одягнута. UA 103028 C2 (12) UA 103028 C2 UA 103028 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід належить до інгалятора відповідно до преамбули п. 1 формули винаходу, і застосування приставки, яка включає камеру для проміжного зберігання (розміщення) розпиленого лікарського препарату. Даний винахід належить, зокрема, до так званого інгалятора м'яких аерозолів (SMI – від англ. soft mist inhaler), тобто, інгалятора, що створює розпилений туман, який відносно повільно поширюється (аерозоль). Для цілей даного винаходу, до інгаляторів цього типу можна віднести інгалятори, у яких швидкість випуску аерозолю не перевищує 2 м/с, бажано менше 1,5 м/с, а в найбільш бажаному варіанті, менше 1 м/с (у кожному випадку вимірювання виконується на відстані 10 см від дозуючого сопла/насадки). Прототипом даного винаходу є інгалятор, загальний опис якого наведено у WO 91/14468 A1, а докладний – у WO 97/12687 A1 (фіг. 6а, 6b). Відомий інгалятор включає в якості ємності для лікарського препарату, який підлягає розпиленню, вставний жорсткий контейнер, що має внутрішній мішок, який містить лікарський препарат, і засоби створення тиску, що включають приводну пружину для транспортування і розпилення лікарського препарату. Розпилення здійснюється без використання газу-пропеленту, зусиллям приводної пружини. У змісті даного винаходу такий інгалятор являє собою інгалятор м'яких аерозолів (SMI). Загальною проблемою інгаляторів і, зокрема, інгаляторів типу SMI є необхідність координування моменту розпилення лікарського препарату і вдиху. У користувача це може викликати утруднення. Зокрема, було встановлено, що особливо складно це виходить у дітей. Дослідження показали, що вдихання аерозолю користувачами, зокрема дітьми, часто виявляється неоптимальним. У WO 2004/091704 A1 розкривається приставка для проміжного зберігання розпиленого лікарського препарату в камері. Приставка використовується в так званому дозуючому інгаляторі (MDI – від англ. metered dose inhaler). Інгалятор типу MDI включає контейнер під тиском, у якому перебувають підлягаючий розпиленню лікарський препарат і газ-пропелент. Коли інгалятор приводиться в дію, лікарський препарат виштовхується за допомогою газупропеленту при порівняно високому тиску і, відповідно, високою швидкістю та більшою масовою витратою. В результаті, викид препарату відбувається дуже швидко, триваючи менше 0,4 с, зазвичай приблизно від 0,15 до 0,36 с. Мала тривалість викиду препарату є несприятливим фактором для інгаляції, оскільки процес вдиху при інгаляції зазвичай триває значно довше. Відносно високі швидкості, з якими інгалятор типу MDI видає аерозоль, що становлять зазвичай більше 2 м/с, а часто навіть більше 8 м/с, також несприятливі для його проходження в легені, оскільки частки (крапельки) аерозолю в основному осідають у горлі користувача через високу швидкість при прямій інгаляції. З інгаляторами типу MDI використовується відома приставка, яка слугує для вповільнення аерозолю, зокрема, за рахунок збільшення довжини шляху потоку. Тому приставки такого типу також відомі як спейсери ( від англ. spacer). Крім того, приставки служать для проміжного розміщення вироблюваного аерозолю для того, щоб користувач мав досить часу для його інгаляції. Завданням даного винаходу є створення інгалятора, у найбільш бажаному варіанті, інгалятора типу SMI, і використання приставки (насадки) з камерою для проміжного розміщення розпиленого лікарського засобу (препарату), для спрощення інгаляції навіть аерозолів, які видаються з малою швидкістю, і (або) для запобігання або щонайменше зведення до мінімуму проблем координування вдиху з роботою інгалятора. Поставлене завдання здійснюється в інгаляторі за п. 1 формули даного винаходу, або при його використанні за п. 12. Бажані варіанти здійснення розкриті в залежних пунктах формули. В основі даного винаходу лежить ідея об'єднання портативного розпилювача для розпилення лікарського препарату без використання газу-пропеленту, або інгалятора типу SMI, із приставкою, що включає камеру для проміжного розміщення виробленого аерозолю, при цьому камера встановлюється нижче по потоці від випускного сопла (насадки, що розпилює) інгалятора. Було встановлено, що завдяки використанню приставки, навіть із інгалятором, що виробляє аерозоль, який слід вдихати протягом порівняно тривалого часу, бажано більше 1 секунди, і (або) на порівняно малій швидкості, бажано менше 2 м/с, а краще менше 1,5 м/с (вимірюється на відстані 10 см від випускного сопла), можливо досягти суттєво поліпшену інгаляцїю активної речовини, особливо в маленьких дітей і інших осіб з недоліками координації рухів. При цьому значно спрощується координація активації інгалятора, тобто, вироблення аерозолю, і вдиху. Аерозоль виробляється в інгаляторі і впорскується в камеру приставки. Після цього користувач може вдихнути аерозоль, зробивши як можна більш глибокий вдих без якої-небудь необхідності координації або синхронізації. 1 UA 103028 C2 5 10 15 20 25 30 35 40 45 50 55 60 Запропоноване рішення забезпечує досягнення більш визначених результатів інгаляції активної речовини, з одержанням, в остаточному підсумку, більш високого вмісту і (або) менших флуктуацій активної речовини, обложеної в легенях. Це дозволяє поліпшити терапію дітей і (або) розширити коло показань або використання інших лікарських препаратів. Таким чином, у результаті розширюється область застосування інгалятора, що не використовує газ-пропелент, або інгалятора типу SMI. У бажаному варіанті, приставка має клапан для того, щоб не дати можливість користувачеві зробити видих в інгалятор або камеру, тобто, запобігти проходженню повітря від випускної сторони приставки назад у камеру. Інші переваги, ознаки, властивості і особливості даного винаходу будуть очевидні з формули винаходу і наведеного нижче опису бажаного варіанта здійснення відповідно до креслень, де: на фіг. 1 схематично представлений перетин інгалятора в незведеному стані; на фіг. 2 схематично представлений переріз інгалятора, поверненого на 90º щодо зображення на фіг. 1, у зведеному стані; на фіг. 3 схематично представлений переріз інгалятора, що відповідає фіг. 1, із прикріпленою приставкою; на фіг. 4 схематично показані в розібраному стані розпилювач і приставка з різними аксесуарами; і на фіг. 5 схематично представлені результати випробувань. На кресленнях, ті самі цифрові позначення використовуються для однакових або аналогічних компонентів, коли, зокрема, досягаються відповідна або порівнянна властивості і переваги, хоча супутній опис не повторюється. На фіг. 1 і 2 пропонований портативний інгалятор 1 для розпилення лікарського препарату 2 без використання газу-пропеленту схематично представлений у незведеному стані (фіг. 1) і у зведеному стані (фіг. 2). На фіг. 1 і 2 інгалятор 1 показано з контейнером 3, у якому знаходиться лікарський препарат 2. Під час розпилення лікарського препарату 2, який у бажаному варіанті являє собою рідину, формується придатний для вдихання аерозоль 14 (фіг. 1), який може вдихатися користувачем або пацієнтом (не показаний). Як правило, інгаляція проводиться щонайменше раз на день, зокрема, кілька раз на день, бажано з певними інтервалами часу, зокрема, залежно від захворювання пацієнта. Інгалятор 1 включає контейнер 3 для лікарського препарату 2, який, у бажаному варіанті вставляється в інгалятор і може бути зроблений замінним. При цьому контейнер 3 утворює резервуар для лікарського препарату 2, що підлягає розпиленню. У бажаному варіанті, контейнер 3 містить достатню кількість лікарського препарату 2 або активної речовини для декількох доз лікарського препарату 2, тобто, забезпечує приведення декількох розпилень або застосувань. Типовий контейнер 3, розкритий у WO 96/06011 A1, вміщує приблизно від 2 до 10 мл. Краща конструкція контейнера 3 додатково представлена у WO 00/49988 А2. У бажаному варіанті, контейнер 3 має форму циліндра або картриджа і може після розкриття вставлятися в інгалятор 1 знизу або, при необхідності, може замінятися. У бажаному варіанті, контейнер має жорстку конструкцію, причому лікарський препарат 2 міститься в контейнері 3 у мішку, що зминається, 4. В інгаляторі також є транспортуючий пристрій, зокрема, генератор 5 тиску для транспортування і розпилення лікарського препарату 2, зокрема, певними дозованими кількостями в кожному випадку, при необхідності регульованими. Інгалятор 1 або генератор 5 тиску включають, зокрема, затискач 6 для контейнера 3 і пов'язану з ним приводну пружину 7, показану тільки частково, яка в бажаному варіанті має пов'язаний з нею блокуючий елемент 8, що розблоковується вручну, транспортуючий елемент, який у бажаному варіанті представляє собою транспортуючу трубку 9 у формі капілярної трубки, у якій може бути встановлений клапан, зокрема, запірний клапан 10, камеру 11 тиску і (або) випускне сопло 12, зокрема, в області мундштука 13. Контейнер 3 фіксується в інгаляторі 1 за допомогою затискача 6, зокрема, фіксацією або защіпуванням так, щоб транспортуюча трубка 9 проходила всередину контейнера 3. Конструкція затискача 6 може забезпечувати заміну контейнера 3. Коли приводна пружина 7 напружена вздовж осі, затискач 6 з контейнером 3 і транспортуючою трубкою 9 зрушуються вниз на кресленнях, і лікарський препарат 2, більш точно, наступна доза, висмоктується з контейнера 3 крізь зворотний клапан 10 у камеру 11 тиску генератора 5 тиску. Коли після приведення в дію блокувального елемента 8, із приводної пружини 7 потім 2 UA 103028 C2 5 10 15 20 25 30 35 40 45 50 55 60 знімається напруга, лікарський препарат 2 у камері 11 тиску попадає під дію тиску, створюваного транспортуючою трубкою 9, яка рухається вгору. Зворотний клапан 10 тепер закритий і транспортуюча трубка 9 діє як пневмоциліндр. Цим тиском лікарський препарат 2 виштовхується крізь випускне сопло 12, у результаті чого він, як показано на фіг. 1, розпиляється в придатний для вдихання аерозоль 14, як показано на фіг. 1 і 3. Користувач або пацієнт (не показаний) може вдихати аерозоль 14, при цьому подача повітря в мундштук 13 може, у бажаному варіанті, виконуватися через щонайменше один отвір 15 для підведення повітря. Під час розпилення контейнер 3 зрушується приводною пружиною 7 назад у своє вихідне положення. Контейнер 3 виконує, таким чином, рух вгору при створенні напруги й під час процесу розпилення. Інгалятор 1 включає, зокрема, першу частину (верхня частина) 16 корпусу внутрішню частину, яка повертається щодо неї, 17 (фіг. 2), що має верхню частину 17а і нижню частину 17b (фіг. 1), у той час як керована вручну або частина, що повертається (нижня частина) 18 корпусу прикріплена з можливістю зняття, зокрема, посадкою на внутрішню частину 17, бажано, за допомогою запобіжного фіксатора або тримача 19. Зокрема, конструкція запобіжного фіксатора або тримача 19 така, що неможливо випадково відкрити інгалятор 1 або зняти другу частину 18 корпусу. Зокрема, для того, щоб зняти другу частину 18 корпусу, на тримач 19 слід натиснути, долаючи силу пружини. Для того щоб вставити і (або) замінити контейнер 3, друга частина 18 корпусу може бути відділена від інгалятора 1. У бажаному варіанті, друга частина 18 корпусу утворює чашевидну нижню частину корпусу і (або) охоплює навколо або з усіх боків нижню вільну крайову частину контейнера 3. Другу частину 18 корпусу можна повертати щодо першої частини 16 корпусу, і разом з нею внутрішню частину 17. В результаті, у приводній пружині створюється напруга в осьовому напрямку за допомогою механізму (докладно не показаний), що впливає на затискач 6. При створенні напруги, контейнер 3 зрушується уздовж осі вниз або своєю кінцевою частиною (дальньою) у другу частину 18 корпусу, або до його торцевої стінки, доти, поки контейнер 3 не займе кінцеве положення, показане на фіг. 2. У цьому положенні приводна пружина 7 або інгалятор затиснуті і заблоковані. У бажаному варіанті, інгалятор 1 включає засоби для примусового обміну повітрям контейнера 3. При першому взводі, контейнер 3, у бажаному варіанті, проколюється або розкривається біля основи. Зокрема пружина, що вертикально переміщається, 20, яка знаходиться в частині 18 корпусу, наближається до основи 21 контейнера і упирається в нього, і елемент, що проколює, 22 пружини при першому контакті проколює контейнер 3 або, зокрема, газонепроникну нижню заглушку, наявну в основі для обміну повітрям. Таким чином, пристрій примусового обміну повітрям у цьому випадку формується елементом, що проколює, 22, який закріплюється на пружині 20 або формується нею. Можливі, однак, і інші конструктивні рішення. Слід зауважити, що під час проколювання для створення умов для обміну повітрям, розкривається тільки зовнішня оболонка контейнера 3. Мішок 4 для лікарського препарату 2 залишається неушкодженим. Коли лікарський препарат 2 виводиться через транспортуючу трубку 9, еластичний мішок 4 стискається. Для вирівнювання тиску, оточуюче повітря може пройти в контейнер 3 крізь отвір для обміну повітрям або проколотий отвір. Для використання інгалятора 1, спочатку повинен бути вставлений контейнер 3. У бажаному варіанті, для цього видаляють або знімають другу частину 18 корпусу. Потім контейнер 3 вставляється або всувається уздовж осі у внутрішню частину 17. Одночасно контейнер 3 відкривається на верхньому кінці або прикріплюється верхнім кінцем. Це виконується транспортуючим елементом, тобто транспортуючою трубкою 9, яка проколює закупорку контейнера 3, наявну, у бажаному варіанті, на кінці або зверху, і після цього вводиться всередину мішка 4 крізь мембрану, наявну на верхньому кінці контейнера 3. При цьому між контейнером 3, або точніше, між мішком 4 у контейнері 3, і генератором 5 тиску або камерою тиску 11 через транспортуючу трубку 9 формується прохід для текучого середовища. Потім надівається друга частина 18 корпусу. Після цього інгалятор 1 може бути зведений у перший раз. При цьому елементом, що проколює, 22 проколюється в основі контейнер 3, тобто, примусово з'єднується з навколишньою атмосферою, як це було описано раніше. Перед першим застосуванням, після того, як контейнер 3 був вставлений і приєднаний для проходу текучого середовища, інгалятор 1 бажано кілька разів звести і пустити в хід. Цією так званою відкачкою видавлюється все повітря з лікарського препарату 2, що знаходиться в транспортуючій трубці 9 і генераторі 5 тиску, аж до випускного сопла 12. Тепер інгалятор 1 3 UA 103028 C2 5 10 15 20 25 30 35 40 45 50 55 60 готовий для інгаляції. Кількість лікарського препарату 2, яка видається за один акт розпилення, у бажаному варіанті становить приблизно від 10 до 50 мкл, конкретніше, приблизно від 10 до 20 мкл, і найбільше бажано приблизно 15 мкл. У бажаному варіанті, приводна пружина встановлюється у зведений стан для досягнення великого зусилля пружини. У запропонованому інгаляторі 1 створення тиску в лікарському препараті 2 і його транспортування в процесі розпилення здійснюється, у бажаному варіанті, тільки зусиллям пружини і, зокрема, тільки зусиллям приводної пружини 7. У бажаному варіанті, конструкція інгалятора 1 забезпечує в генераторі 5 тиску або камері 11 тиску одержання тиску лікарського препарату 2 під час видачі, що становить від 5 до 60 Мпа, зокрема, приблизно від 10 до 50 Мпа. Бажано, щоб під час видачі або розпилення лікарського препарату 2 тиск, що становить приблизно від 5 до 60 Мпа, зокрема, приблизно від 10 до 30 Мпа, досягався на випускному соплі 12 або на його отворах. При цьому лікарський препарат 2 перетвориться в аерозоль 14, крапельки якого мають аеродинамічний діаметр до 20 мкм, бажано приблизно від 3 до 10 мкм. У бажаному варіанті, ефективність розпилення досягається або додатково підсилюється затримуванням струменів, які випускаються з випускного сопла 12. У бажаному варіанті, конструкція інгалятора 1 забезпечує видачу аерозолю 14 з малою швидкістю, зокрема, зі швидкістю менше 2 м/с, найбільш бажано, зі швидкістю приблизно 1,6 м/с або менше (у кожному випадку вимірюється на відстані 10 см від випускного сопла 12). Таким чином, бажаним видом інгалятора 1 є інгалятор м'яких аерозолів (SMI). Одержання малої швидкості видачі може досягатися або полегшуватися шляхом затримування струменів лікарського препарату 2, що випускаються випускним соплом 12, і (або) належним вибором зусилля пружини. У найбільш бажаному варіанті, конструкція інгалятора 1 забезпечує тривалість вироблення аерозолю більше 0,7 с, бажано щонайменше приблизно 1 с, і зокрема, щонайменше 1,5 с. Таким чином, час, затрачуваний на розпилення дози або на активацію інгалятора 1, перевищує 0,7 с, бажано щонайменше приблизно 1 с, і найбільш бажано понад 1,5 с. Інгалятор 1 включає приставку 23 з камерою 24 для проміжного розміщення аерозолю 14, вироблюваного інгалятором 1, як це показано на схематичному виді перерізу на фіг. 3. Камера 24 розташована або пристосована для розташування нижче за потоком від випускного сопла 12. Камера 24 слугує для прийому і проміжного розміщення аерозолю 14, вироблюваного інгалятором 1. У бажаному варіанті, приставка 23 або її камера 24 мають щонайменше циліндричну, витягнуту або конічну конструкцію. У бажаному варіанті, поперечний переріз камери 24 більше, ніж у мундштука 13 інгалятора 1, і (або) вона розширюється щонайменше до свого випускного кінця або відкритого кінця приставки 23. Завдяки цьому аерозоль потрапляє на стінки камери 24 на мінімальній площі. Таким чином можливо звести до мінімуму відкладення або осадження розпиленого лікарського препарату 2 на стінці камери. У бажаному варіанті, об'єм камери 24 перевищує 0,1 л, зокрема, більше 0,2 л, найбільш бажано приблизно від 0,2 до 0,6 л. Зокрема, приставка 23 або розмір камери 24 адаптовано до інгалятора 1 так, що вироблюваний при активації інгалятора 1 аерозоль може щонайменше по суті повністю поміститися в камері 24 без відкладення або осадження аерозолю 14 або розпиленого лікарського препарату 2 на внутрішній стінці камери. У бажаному варіанті, показана приставка 23 включає кожух 25, конструкція якого відрізняється витягнутою і (або) циліндричною формою. У бажаному варіанті, конструкція приставки 23 або її кожуха щонайменше відрізняється жорсткістю. Однак, в принципі, приставка 23, камера 24 або кожух 25 можуть мати еластичну, надувну і (або) телескопічну конструкцію для того, щоб зменшити займаний об'єм при розміщенні і (або) транспортуванні. У бажаному варіанті, приставка 23 або кожух 25 мають сполучний елемент 26 для приєднання до інгалятора 1, зокрема, до його мундштука 13. У бажаному варіанті, приставка 23 або сполучний елемент 26 можуть бути закріплені на мундштуці 13, наприклад, охоплюючи його, і (або) можуть потім зніматися з інгалятора 1 або мундштука 13. Однак приставка 23, при необхідності, може бути приєднана або, можливо, мати можливість приєднання до інгалятора 1 постійним, незнімним чином. У представленому варіанті здійснення, у мундштуці 13 бажано мати щонайменше один отвір 15 для підведення повітря. Зокрема, бажано, щоб щонайменше один отвір 15 для підведення повітря залишався відкритим, коли надіта приставка 23, зокрема прикріплена, як показано на фіг. 3. Це може бути досягнуто використанням відповідної конічної конструкції мундштука 13 і 4 UA 103028 C2 5 10 15 20 25 30 35 40 45 50 55 60 сполученої з нею конструкцією сполучного елемента 26, фіксатора (не показаний) і (або) інших елементів конструкції. У бажаному варіанті, приставка 23 не може обертатися щодо інгалятора 1. У варіанті здійснення, це досягається завдяки некруговій формі мундштука 13 інгалятора 1, який, у бажаному випадку, має овальний зовнішній контур, з яким сполучається сполучний елемент 26. Можливі також і інші конструктивні рішення. У бажаному варіанті, приставка 23 або кожух 25 включають випускний елемент 27 для випуску аерозолю 14. Випускний елемент 27 бажано встановлювати на кінці камери 24 або кожуха 25, протилежному сполучному елементові 26. Особливо бажано, щоб сполучний елемент 26 і випускний елемент 27 утворювали єдину деталь із кожухом 25. Можливі, однак, і інші конструктивні рішення. У бажаному варіанті, камера 24 або кожух 25 мають щонайменше частково або повністю прозору конструкцію. Цим, зокрема, полегшується їхнє очищення. У бажаному варіанті, приставка 23 на своєму випускному кінці має клапан 28, що запобігає протікання потоку повітря назад у камеру 24. При цьому можливо запобігти проходженню повітря в камеру 24, коли користувач робить видих, яким аерозоль 14 був би виштовхнутий, наприклад, крізь прикріплений мундштук 13 і отвору 15 для підведення повітря. У бажаному варіанті клапан 28 є запірним клапаном. Особливо бажано, щоб клапан 28 був вбудований у сполучний елемент 27. Також бажано, щоб клапан 28 міг бути відділений від приставки 23 або кожуха 25, наприклад, для очищення. У якості альтернативи або додатково до клапана 28, пропонований інгалятор 1 також може включати вентильний пристрій (не показано), наприклад, між сполучним елементом 26 і мундштуком 13, що пропускає повітря в камеру 24, але перешкоджає його витіканню назовні. У цьому випадку можна зовсім обійтися без отворів 15 для підведення повітря і (або) вони можуть бути закриті або заглушені приставкою 23. У бажаному варіанті, приставка 23 включає, у якості альтернативи або додатково, щонайменше один клапан 32 для випуску видихуваного повітря, як це схематично показано на фіг. 3. Зокрема, на фіг. 3 показано два такі клапани 32 у відкритому стані. Стулки клапанів підняті від відповідних випускних отворів. У бажаному варіанті, щонайменше один клапан 32 знаходиться на випускному кінці і, зокрема, розміщений на випускному елементі 27. Можливі, однак, і інші конструктивні рішення. Коли користувач (не показаний) робить вдих, клапан 28 відкривається, як показано пунктирними лініями на фіг. 3. Клапани 32 закриті. Аерозоль 14 висмоктується з камери 24 і випускається крізь випускний елемент 27. Коли користувач робить видих, клапан 28 закривається або закритий. Клапани 32 відкриті і дають можливість виходити видихуваному повітрю, не дозволяючи цьому повітрю проходити в камеру 24, або впливати на аерозоль 14. У бажаному варіанті, приставка 23 або її випускний елемент 27 можуть бути обладнані на випускному кінці додатковим мундштуком (ротовою насадкою) 29, трубкою 30 і (або) дихальною маскою 31, як це показано в якості прикладу на фіг. 4. Зокрема, різні крайові пристрої, наприклад, додатковий мундштук 29, трубку 30 і (або) дихальну маску 31 можна на вибір прикріплювати до приставки 23 або її випускного елементу 27, у найбільш бажаному варіанті, щільно надягаючи на них. Випробування показали, що запропоноване використання приставки 23 з інгалятором 1, тобто, запропоноване проміжне розміщення вироблюваного інгалятором 1 аерозолю 14 у порівняно великій камері 24, може суттєво сприяти підвищенню частки активної речовини, яка потрапляє в легені при інгаляції, навіть при наявності труднощів з координацією. На фіг. 5 показана частка активної речовини, яка потрапила в легені в цілому (Det), і частка активної речовини, яка осіла в горлі, у функції загального розміру дози для різних інгаляторів. По вертикальній осі показано фактично доставлену кількість відповідної дози у відсотках, у той час як Det показує відсоток частки, яка потрапила в легені при інгаляції, а "горло" показує частину, що осіла в горлі. Осадження активної речовини визначалося на основі заявленого складу з використанням моделі горла Фінлея (Finlay). Вдихуваний об'єм у всіх випадках був прийнятий рівним 0,5 л. Випробування проводилися з різними апаратами або комбінаціями апаратів, і при різних витратах, величина яких відкладена по горизонтальній осі. RMT показує результати для інгалятора 1 без приставки 23. RMT+AC показує результати для комбінації інгалятора 1 із приставкою 23. pmdi+AC показує результати комбінації звичайного інгалятора типу MDI (дозуючий інгалятор) із приставкою 23. Кожна із цифр 5, 10, 20 і 30 показує витрату в л/хв. Діаграма на фіг. 5 показує, що використання приставки 23 приводить до скорочення 5 UA 103028 C2 5 10 15 20 25 30 35 40 45 50 55 60 осідання в горлі. Це сприятливо впливає на лікувальний ефект, оскільки активна речовина, що осіла в горлі, зазвичай не бере участь у терапії, а замість цього приводить до (системних) побічних ефектів. Використання приставки 23 дає позитивний результат, тому що із приставкою невеликі відкладення в горлі можна виявити тільки при витраті, що перевищує 20 л/хв. При всіх витратах, відкладення в горлі при використанні пропонованої комбінації інгалятора 1 (SMI) із приставкою 23 виходять менше відкладень при використанні тільки одного такого інгалятора 1. Показник Det може бути пов'язаний з можливим терапевтичним ефектом. Запропонована комбінація інгалятора 1 (SMI) із приставкою завжди має показник Det вище звичайних інгаляторів типу MDI із приставкою. Втрати в показнику Det при використанні приставки 23 у порівнянні із запропонованим інгалятором 1 без приставки 23 помітні, але повинні оцінюватися як суттєво більш низькі в порівнянні із втратами у звичайних інгаляторах типу MDI. Тому при використанні пропонованого рішення можна припустити більш високу ефективність або більш високу частку активної речовини, що дійшла до легень. У завершення розкриття даного винаходу, і беручи до уваги бажаний варіант здійснення інгалятора 1, слід зробити зауваження відносно повного розкриття як WO 91/14468A1, так і WO 97/126 87 A1. На відміну від окремо встановлюваних апаратів і їм подібних, запропонований інгалятор у бажаному варіанті призначений для використання як портативний, і зокрема, є мобільним, переносним пристроєм. Завдяки циліндричній формі і малому розміру інгалятора, що становить менше 9-15 см довжини і 2-4 см ширини, пацієнт може носити інгалятор постійно. Розпилювач розпиляє певний об'єм лікарського препарату 2 крізь малі форсунки, використовуючи високий тиск, для формування придатного для вдихання аерозолю 14. Запропонований інгалятор 1 використовує, зокрема, чисто механічний привід. Однак теоретично, в інгаляторі 1 може використовуватися будь-який інший принцип роботи. Зокрема, вирази "транспортуючий пристрій" і "генератор тиску" повинні розумітися в самому широкому значенні. Наприклад, тиск, необхідний для випуску і розпилення, може додатково створюватися газом-пропелентом, насосом і будь-яким іншим підходящим способом. Запропонований інгалятор 1 призначений, зокрема, для короткочасного розпилення лікарського препарату 2, наприклад, для одного або двох вдихів. Він, однак, може бути призначений або використаний для більш тривалого або безперервного розпилення. Деякі бажані інгредієнти, сполуки і (або) рецепти бажаного для застосування лікарського препарату 2 перераховані нижче. У запропонованому у винаході обладнанні можуть використовуватися розглянуті нижче сполуки, які можна застосовувати індивідуально або в комбінації між собою. Представлені нижче сполуки являють собою фармакологічно активні діючі речовини (ДР), які обираються (наприклад) із групи, що включає бетаміметики, антихолінергічні засоби, кортикостероїди, інгібітори фосфодіестерази 4 (ФДЕ4), антагоністи LTD4, інгібітори EGFR, агоністи допаміну, антагоністи рецептора гістаміну Н1, антагоністи фактора активації тромбоцитів (PAF) та інгібітори PI 3-кінази. Запропонований у винаході пристрій можна також використовувати для інгаляції комбінацій із двох або трьох таких ДР. Як приклад подібних комбінацій ДР можна назвати наступні: - комбінація з бетаміметика і антихолінергічного засобу, кортикостероїда, інгібітора ФДЕ4, інгібітора EGFR або антагоніста LTD4, - комбінація з антихолінергічного засобу і кортикостероїда, інгібітора ФДЕ4, інгібітора EGFR або антагоніста LTD4, - комбінація з кортикостероїда та інгібітора ФДЕ4, інгібітора EGFR або антагоніста LTD4, - комбінація з інгібітора ФДЕ4 та інгібітора EGFR або антагоніста LTD4, - комбінація з інгібітора EGFR і антагоніста LTD4. У якості бетаміметиків бажано при цьому використовувати сполуки, обрані із групи, що включає албутерол, арформотерол, бамбутерол, бітолтерол, броксатерол, карбутерол, кленбутерол, фенотерол, формотерол, гексопреналін, ібутерол, ізоетарін, ізопреналін, левосалбутамол, мабутерол, мелуадрин, метапротеренол, орципреналін, пірбутерол, прокатерол, репротерол, римітерол, ритодрин, салмефамол, салметерол, сотеренол, сульфонтерол, тербуталін, тіарамід, толобутерол, зінтерол, CHF-1035, HOKU-81, KUL-1248, 3(4-{6-[2-гідрокси-2-(4-гідрокси-3гідроксиметилфеніл)етиламіно]гексилокси}бутил)бензилсульфонамід, 5-[2-(5,6-діетіліндан-2іламіно)-1-гідроксиетил]-8-гідрокси-1H-хінолін-2-он, 4-гідрокси-7-[2-{[2-{[3-(2фенілетокси)пропіл]сульфоніл}етил]аміно}етил]-2(3H)-бензотіазолон, 1-(2-фтор-4гідроксифеніл)-2-[4-(1-бензімідазоліл)-2-метил-2-бутиламіно]етанол, 1-[3-(4 6 UA 103028 C2 5 10 15 20 25 30 35 40 45 50 метоксибензиламіно)-4-гідроксифеніл]-2-[4-(1-бензімідазоліл)-2-метил-2-бутиламіно]етанол, 1[2H-5-гідрокси-3-оксо-4H-1,4-бензоксазин-8-іл]-2-[3-(4-N,N-диметиламінофеніл)-2-метил-2пропіламіно]етанол, 1-[2H-5-гідрокси-3-оксо-4H-1,4-бензоксазин-8-іл]-2-[3-(4-метоксифеніл)-2метил-2-пропіламіно]етанол, 1-[2H-5-гідрокси-3-оксо-4H-1,4-бензоксазин-8-іл]-2-[3-(4-нбутилоксифеніл)-2-метил-2-пропіламіно]етанол, 1-[2H-5-гідрокси-3-оксо-4H-1,4-бензоксазин-8іл]-2-{4-[3-(4-метоксифеніл)-1,2,4-тріазол-3-іл]-2-метил-2-бутиламіно}етанол, 5-гідрокси-8-(1гідрокси-2-ізопропіламінобутил)-2H-1,4-бензоксазин-3-(4H)-он, 1-(4-аміно-3-хлор-5трифторметилфеніл)-2-трет-бутиламіно)етанол, 6-гідрокси-8-{1-гідрокси-2-[2-(4-метоксифеніл)1,1-диметилетиламіно]етил}-4H-бензо[1,4]оксазин-3-он, 6-гідрокси-8-{1-гідрокси-2-[2-(етил-4феноксиацетат)-1,1-диметилетиламіно]етил}-4H-бензо[1,4]оксазин-3-он, 6-гідрокси-8-{1гідрокси-2-[2-(4-феноксиоцтова кислота)-1,1-диметилетиламіно]етил}-4H-бензо[1,4]оксазин-3он, 8-{2-[1,1-диметил-2-(2,4,6-триметилфеніл)етиламіно]-1-гідроксиетил}-6-гідрокси-4Hбензо[1,4]оксазин-3-он, 6-гідрокси-8-{1-гідрокси-2-[2-(4-гідроксифеніл)-1,1диметилетиламіно]етил}-4H-бензо[1,4]оксазин-3-он, 6-гідрокси-8-{1-гідрокси-2-[2-(4ізопропілфеніл)-1,1-диметилетиламіно]етил}-4H-бензо[1,4]оксазин-3-он, 8-{2-[2-(4-етилфеніл)1,1-диметилетиламіно]-1-гідроксиетил}-6-гідрокси-4H-бензо[1,4]оксазин-3-он, 8-{2-[2-(4етоксифеніл)-1,1-диметилетиламіно]-1-гідроксиетил}-6-гідрокси-4H-бензо[1,4]оксазин-3-он, 4-(4{2-[2-гідрокси-2-(6-гідрокси-3-оксо-3,4-дигідро-2H-бензо[1,4]оксазин-8-іл)етиламіно]-2метилпропіл}фенокси)масляну кислоту, 8-{2-[2-(3,4-дифторфеніл)-1,1-диметилетиламіно]-1гідроксиетил}-6-гідрокси-4H-бензо[1,4]оксазин-3-он, 1-(4-етоксикарбоніламіно-3-ціано-5фторфеніл)-2-(трет-бутиламіно)етанол, 2-гідрокси-5-(1-гідрокси-2-{2-[4-(2-гідрокси-2фенілетиламіно)феніл]етиламіно}етил)бензальдегід, N-[2-гідрокси-5-(1-гідрокси-2-{2-[4-(2гідрокси-2-фенілетиламіно)феніл]етиламіно}етил)феніл]формамід, 8-гідрокси-5-(1-гідрокси-2-{2[4-(6-метоксидифеніл-3-іламіно)феніл]етиламіно}етил)-1H-хінолін-2-он, 8-гідрокси-5-[1-гідрокси2-(6-фенетиламіногексиламіно)етил]-1H-хінолін-2-он, 5-[2-(2-{4-[4-(2-аміно-2метилпропокси)феніламіно]феніл}етиламіно)-1-гідроксиетил]-8-гідрокси-1H-хінолін-2-он, [3-(4-{6[2-гідрокси-2-(4-гідрокси-3-гідроксиметилфеніл)етиламіно]гексилокси}бутил)-5метилфеніл]сечовину, 4-(2-{6-[2-(2,6-дихлорбензилокси)етокси]гексиламіно}-1-гідроксиетил)-2гідроксиметилфенол, 3-(4-{6-[2-гідрокси-2-(4-гідрокси-3гідроксиметилфеніл)етиламіно]гексилокси}бутил)бензилсульфонамід, 3-(3-{7-[2-гідрокси-2-(4гідрокси-3-гідроксиметилфеніл)етиламіно]гептилокси}пропіл)бензилсульфонамід, 4-(2-{6-[4-(3циклопентансульфонілфеніл)бутокси]гексиламіно}-1-гідроксиетил)-2-гідроксиметилфенол, Nадамантан-2-іл-2-(3-{2-[2-гідрокси-2-(4-гідрокси-3гідроксиметилфеніл)етиламіно]пропіл}феніл)ацетамід, необов'язково у вигляді їх рацематів, енантіомерів, діастереомерів і необов'язково у вигляді їх фармакологічно прийнятних кислотноадитивних солей, сольватів або гідратів. До бажаних згідно з винаходом кислотно-адитивних солей бетаміметиків належать солі, обрані із групи, що включає гідрохлорид, гідробромід, гідроіодид, гідросульфат, гідрофосфат, гідрометансульфонат, гідронітрат, гідромалеат, гідроацетат, гідроцитрат, гідрофумарат, гідротартрат, гідрооксалат, гідросукцинат, гідробензоат і гідропаратолуолсульфонат. У якості антихолінергічних засобів бажано використовувати сполуки, обрані із групи, що включає солі тіотропію, бажано його бромід, солі окситропію, бажано його бромід, солі флутропію, бажано його бромід, солі іпратропію, бажано його бромід, солі глікопіронію, бажано його бромід, солі троспію, бажано його хлорид, і толтеродин. У вказаних вище солях фармакологічно активними компонентами є катіони. У якості ж аніонів вказані вище солі в бажаному варіанті можуть містити хлорид, бромід, йодид, сульфат, фосфат, метансульфонат, нітрат, малеат, ацетат, цитрат, фумарат, тартрат, оксалат, сукцинат, бензоат або паратолуолсульфонат, серед яких в якості протиіонів бажані хлорид, бромід, йодид, сульфат, метансульфонат і паратолуолсульфонат. Із числа всіх вказаних солей особливо бажані хлориди, броміди, йодиди і метансульфонати. До бажаних антихолінергічних засобів належать також такі, обрані із солей формули AC-1 + N O O X AC-1, O HO S S у якій X означає однозарядний аніон, бажано аніон, обраний із групи, що включає фторид, 7 UA 103028 C2 5 хлорид, бромід, йодид, сульфат, фосфат, метансульфонат, нітрат, малеат, ацетат, цитрат, фумарат, тартрат, оксалат, сукцинат, бензоат і паратолуолсульфонат, більш бажано означає однозарядний аніон, обраний із групи, що включає фторид, хлорид, бромід, метансульфонат і паратолуолсульфонат, особливо бажано позначає бромід, необов'язково у вигляді їх рацематів, енантіомерів або гідратів. Особливе значення мають лікарські комбінації, що містять енантіомери формули Ac-1-en + N O O AC-1-en, O HO X S S у якій X може мати вказані вище значення. Бажані далі антихолінергічні засоби, обрані із солей формули AC-2 OH + N 10 R X AC-2, у якій R означає метил або етил, а X може мати вказані вище значення. В іншому варіанті сполука формули AC-2 може бути також представлена у вигляді вільної основи формули Ac-2base OH N 15 20 25 30 35 AC-2-base. Як приклад інших антихолінергічних засобів можна назвати метобромід тропенолового ефіру 2, 2-дифенілпропіонової кислоти, метобромід скопінового ефіру 2, 2-дифенілпропіонової кислоти, метобромід скопінового ефіру фтор-2, 2-дифенілоцтової кислоти, метобромід тропенолового ефіру фтор-2, 2-дифенілоцтової кислоти, метобромід тропенолового ефіру 3,3',4,4'-тетрафторбензилової кислоти, метобромід скопінового ефіру 3,3',4,4'тетрафторбензилової кислоти, метобромід тропенолового ефіру 4,4'-дифторбензилової кислоти, метобромід скопінового ефіру 4,4'-дифторбензилової кислоти, метобромід тропенолового ефіру 3,3'-дифторбензилової кислоти, метобромід скопінового ефіру 3,3'дифторбензилової кислоти, метобромід тропенолового ефіру 9-карбонової кислоти, метобромід тропенолового ефіру 9-карбонової кислоти, метобромід скопінового ефіру 9-карбонової кислоти, метобромід скопінового ефіру 9-карбонової кислоти, метобромід тропенолового ефіру 9карбонової кислоти, метобромід скопінового ефіру 9-карбонової кислоти, метобромід циклопропілтропінового ефіру бензилової кислоти, метобромід циклопропілтропінового ефіру 2, 2-дифенілпропіонової кислоти, метобромід циклопропілтропінового ефіру 9-карбонової кислоти, метобромід циклопропілтропінового ефіру 9-карбонової кислоти, метобромід циклопропілтропінового ефіру 9-карбонової кислоти, метобромід циклопропілтропінового ефіру 9-карбонової кислоти, метобромід циклопропілтропінового ефіру метилового ефіру 4,4'дифторбензилової кислоти, метобромід тропенолового ефіру 9-карбонової кислоти, метобромід скопінового ефіру 9-карбонової кислоти, метобромід тропенолового ефіру 9-карбонової кислоти, метобромід скопінового ефіру 9-карбонової кислоти, метобромід тропенолового ефіру 9карбонової кислоти, метобромід тропенолового ефір кислотий метобромід скопинового ефіру 9карбонової кислоти. Вказані вище сполуки згідно з винаходом можна також використовувати у вигляді солей, які являють собою не метоброміди, а солі мето-X, де X може мати вказані вище для X- значення. В якості кортикостероїдів бажано використовувати сполуки, обрані із групи, що включає 8 UA 103028 C2 5 10 15 20 25 30 35 40 45 50 55 60 беклометазон, бетаметазон, будесонід, бутиксокорт, циклесонід, дефлазакорт, дексаметазон, етипреднол, флунісолід, флутиказон, лотепреднол, мометазон, преднізолон, преднізон, рофлепонід, триамцинолон, RPR-106541, NS-126, ST-26, (S)-фторметиловий ефір 6,9-дифтор17-[(2-фуранілкарбоніл)окси]-11-гідрокси-16-метил-3-оксоандроста-1,4-діен-17-карботіонової кислоти, (S)-(2-оксотетрагідрофуран-3S-иловий) ефір 6,9-дифтор-11-гідрокси-16-метил-3-оксо17-пропіонілоксиандроста-1,4-діен-17-карботіонової кислоти і ціанометиловий ефір 6α,9αдифтор-11β-гідрокси-16α-метил-3-оксо-17α-(2,2,3,3тетраметилциклопропілкарбоніл)оксиандроста-1,4-діен-17β-карбонової кислоти, необов'язково у вигляді їх рацематів, енантіомерів або діастереомерів і необов'язково у вигляді їх солей і похідних, їхніх сольватів і/або гідратів. При будь-якому згадуванні в даному описі стероїдів маються на увазі також їх можливо існуючі солі або похідні, гідрати або сольвати. Як приклад можливих солей і похідних стероїдів можна назвати солі з лужними металами, такі, наприклад, як натрієві або калієві солі, сульфобензоати, фосфати, ізонікотинати, ацетати, дихлорацетати, пропіонати, дигідрофосфати, пальмітати, півалати або ж фуроати. У якості інгібіторів ФДЕ4 бажано використовувати сполуки, обрані із групи, що включає енпрофілін, теофілін, рофлуміласт, аріфло (циломіласт), тофіміласт, пумафентрин, ліриміласт, арофілин, атізорам, D-4418, Bay-198004, BY343, CP-325,366, D-4396 (Sch-351591), AWD-12-281 (GW-842470), NCS-613, CDP-840, D-4418, PD-168787, T-440, T-2585, V-11294A, Cl-1018, CDC801, CDC-3052, D-22888, YM-58997, Z-15370, N-(3,5-дихлор-1-оксопіридин-4-іл)-4дифторметокси-3-циклопропілметоксибензамід, (–)п-[(4aR*,10bS*)-9-етокси-1,2,3,4,4a,10bгексагідро-8-метокси-2-метилбензо[s][1,6]нафтиридин-6-іл]-N,N-диізопропілбензамід, (R)-(+)-1(4-бромбензил)-4-[(3-циклопентилокси)-4-метоксифеніл]-2-піролідон, 3-(циклопентилокси-4метоксифеніл)-1-(4-N'-[N-2-ціано-S-метилізотіоуреідо]бензил)-2-піролідон, цис-[4-ціано-4-(3циклопентилокси-4-метоксифеніл)циклогексан-1-карбонову кислоту], 2-карбометокси-4-ціано-4(3-циклопропілметокси-4-дифторметоксифеніл)циклогексан-1-он, цис-[4-ціано-4-(3циклопропілметокси-4-дифторметоксифеніл)циклогексан-1-ол], (R)-(+)-етил[4-(3циклопентилокси-4-метоксифеніл)піролідин-2-іліден]ацетат, (S)-(–)-етил[4-(3-циклопентилокси4-метоксифеніл)піролідин-2-іліден]ацетат, 9-циклопентил-5,6-дигідро-7-етил-3-(2-тієніл)-9Hпіразоло[3,4-c]-1,2,4-триазоло[4,3-a]піридин і 9-циклопентил-5,6-дигідро-7-етил-3-(трет-бутил)9H-піразоло[3,4-c]-1,2,4-триазоло[4,3-a]піридин, необов'язково у вигляді їх рацематів, енантіомерів, діастереомерів і необов'язково у вигляді їх фармакологично прийнятних кислотноадитивних солей, сольватів або гідратів. До бажаних згідно з винаходом кислотно-адитивних солей інгібіторів ФДЕ4 належать солі, обрані із групи, що включає гідрохлорид, гідробромід, гідройодид, гідросульфат, гідрофосфат, гідрометансульфонат, гідронітрат, гідромалеат, гідроацетат, гідроцитрат, гідрофумарат, гідротартрат, гідрооксалат, гідросукцинат, гідробензоат і гідропаратолуолсульфонат. У якості антагоністів LTD4 бажано використовувати сполуки, обрані із групи, що включає монтелукаст, пранлукаст, зафирлукаст, MCC-847 (ZD-3523), MN-001, MEN-91507 (LM-1507), VUF-5078, VUF-K-8707, L-733321, 1-(((R)-(3-(2-(6,7-дифтор-2-хінолінил)етеніл)феніл)-3-(2-(2гідрокси-2-пропіл)феніл)тіо)метилциклопропаноцтову кислоту, 1-(((1(R)-3-(3-(2-(2,3дихлортиено[3,2-b]піридин-5-іл)-(E)-етеніл)феніл)-3-(2-(1-гідрокси-1метилетил)феніл)пропіл)тіо)метил)циклопропаноцтову кислоту і [2-[[2-(4-трет-бутил-2-тіазоліл)5-бензофураніл]оксиметил]феніл]оцтову кислоту, необов'язково у вигляді їх рацематів, енантіомерів, діастереомерів і необов'язково у вигляді їх фармакологічно прийнятних кислотноадитивних солей, сольватів або гідратів. До бажаних згідно з винаходом кислотно-адитивних солей антагоністів LTD4 належать солі, обрані із групи, що включає гідрохлорид, гідробромід, гідройодид, гідросульфат, гідрофосфат, гідрометансульфонат, гідронітрат, гідромалеат, гідроацетат, гідроцитрат, гідрофумарат, гідротартрат, гідрооксалат, гідросукцинат, гідробензоат і гідропаратолуолсульфонат. Під солями або похідними, які в деяких випадках здатні утворювати антагоністи LTD4, маються на увазі, наприклад, солі з лужними металами, такі, наприклад, як натрієві або калієві солі, солі з лужноземельними металами, сульфобензоати, фосфати, ізонікотинати, ацетати, пропіонати, дигідрофосфати, пальмітати, півалати або ж фуроати. В якості інгібіторів EGFR бажано використовувати сполуки, обрані з групи, що включає цетуксимаб, трастузумаб, ABX-EGF, Mab ICR-62, 4-[(3-хлор-4-фторфеніл)аміно]-6-{[4(морфолін-4-іл)-1-оксо-2-бутен-1-іл]аміно}-7-циклопропілметоксихіназолін, 4-[(3-хлор-4фторфеніл)аміно]-6-{[4-(N,N-диетиламіно)-1-оксо-2-бутен-1-іл]аміно}-7циклопропілметоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-{[4-(N,N-диметиламіно)-1-оксо-2бутен-1-іл]аміно}-7-циклопропілметоксихіназолін, 4-[(R)-(1-фенілетил)аміно]-6-{[4-(морфолін-4іл)-1-оксо-2-бутен-1-іл]аміно}-7-циклопентилоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-{[4 9 UA 103028 C2 5 10 15 20 25 30 35 40 45 50 55 60 ((R)-6-метил-2-оксоморфолін-4-іл)-1-оксо-2-бутен-1-іл]аміно}-7-циклопропілметоксихіназолін, 4[(3-хлор-4-фторфеніл)аміно]-6-{[4-((R)-6-метил-2-оксоморфолін-4-іл)-1-оксо-2-бутен-1-іл]аміно}7-[(S)-(тетрагідрофуран-3-іл)окси]хіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-{[4-((R)-2метоксиметил-6-оксоморфолін-4-іл)-1-оксо-2-бутен-1-іл]аміно}-7-циклопропілметоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-[2-((S)-6-метил-2-оксоморфолін-4-іл)етокси]-7-метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-({4-[N-(2-метоксиетил)-N-метиламіно]-1-оксо-2-бутен-1іл}аміно)-7-циклопропілметоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-{[4-(N,Nдиметиламіно)-1-оксо-2-бутен-1-іл]аміно}-7-циклопентилоксихіназолін, 4-[(R)-(1фенілетил)аміно]-6-{[4-(N,N-біс-(2-метоксиетил)аміно)-1-оксо-2-бутен-1-іл]аміно}-7циклопропілметоксихіназолін, 4-[(R)-(1-фенілетил)аміно]-6-({4-[N-(2-метоксиетил)-N-етиламіно]1-оксо-2-бутен-1-іл}аміно)-7-циклопропілметоксихіназолін, 4-[(R)-(1-фенілетил)аміно]-6-({4-[N-(2метоксиетил)-N-метиламіно]-1-оксо-2-бутен-1-іл}аміно)-7-циклопропілметоксихіназолін, 4-[(R)(1-фенілетил)аміно]-6-({4-[N-(тетрагідропіран-4-іл)-N-метиламіно]-1-оксо-2-бутен-1-іл}аміно)-7циклопропілметоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-{[4-(N,N-диметиламіно)-1-оксо-2бутен-1-іл]аміно}-7-((R)-тетрагідрофуран-3-ілокси)хіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-{[4(N,N-диметиламіно)-1-оксо-2-бутен-1-іл]аміно}-7-((S)-тетрагідрофуран-3-ілокси)хіназолін, 4-[(3хлор-4-фторфеніл)аміно]-6-({4-[N-(2-метоксиетил)-N-метиламіно]-1-оксо-2-бутен-1-іл}аміно)-7циклопентилоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-{[4-(N-циклопропіл-N-метиламіно)-1оксо-2-бутен-1-іл]аміно}-7-циклопентилоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-{[4-(N,Nдиметиламіно)-1-оксо-2-бутен-1-іл]аміно}-7-[(R)-(тетрагідрофуран-2-іл)метокси]хіназолін, 4-[(3хлор-4-фторфеніл)аміно]-6-{[4-(N,N-диметиламіно)-1-оксо-2-бутен-1-іл]аміно}-7-[(S)(тетрагідрофуран-2-іл)метокси]хіназолін, 4-[(3-етинілфеніл)аміно]-6,7-біс-(2метоксиетокси)хіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-7-[3-(морфолін-4-іл)пропілокси]-6[(вінілкарбоніл)аміно]хіназолін, 4-[(R)-(1-фенілетил)аміно]-6-(4-гідроксифеніл)-7H-піроло[2,3d]піримідин, 3-ціано-4-[(3-хлор-4-фторфеніл)аміно]-6-{[4-(N,N-диметиламіно)-1-оксо-2-бутен-1іл]аміно}-7-етоксихінолін, 4-{[3-хлор-4-(3-фторбензилокси)феніл]аміно}-6-(5-{[(2метансульфонілетил)аміно]метил}фуран-2-іл)хіназолін, 4-[(R)-(1-фенілетил)аміно]-6-{[4-((R)-6метил-2-оксоморфолін-4-іл)-1-оксо-2-бутен-1-іл]аміно}-7-метоксихіназолін, 4-[(3-хлор-4фторфеніл)аміно]-6-{[4-(морфолін-4-іл)-1-оксо-2-бутен-1-іл]аміно}-7-[(тетрагідрофуран-2іл)метокси]хіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-({4-[N,N-біс-(2-метоксиетил)аміно]-1-оксо2-бутен-1-іл}аміно)-7-[(тетрагідрофуран-2-іл)метокси]хіназолін, 4-[(3-етинілфеніл)аміно]-6-{[4(5,5-диметил-2-оксоморфолін-4-іл)-1-оксо-2-бутен-1-іл]аміно}хіназолін, 4-[(3-хлор-4фторфеніл)аміно]-6-[2-(2,2-диметил-6-оксоморфолін-4-іл)етокси]-7-метоксихіназолін, 4-[(3-хлор4-фторфеніл)аміно]-6-[2-(2,2-диметил-6-оксоморфолін-4-іл)етокси]-7-[(R)-(тетрагідрофуран-2іл)метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-7-[2-(2,2-диметил-6-оксоморфолін-4іл)етокси]-6-[(S)-(тетрагідрофуран-2-іл)метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-{2-[4(2-оксоморфолін-4-іл)піперидин-1-іл]етокси}-7-метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]6-[1-(трет-бутилоксикарбоніл)піперидин-4-ілокси]-7-метоксихіназолін, 4-[(3-хлор-4фторфеніл)аміно]-6-(транс-4-аміноциклогексан-1-ілокси)-7-метоксихіназолін, 4-[(3-хлор-4фторфеніл)аміно]-6-(транс-4-метансульфоніламіноциклогексан-1-ілокси)-7-метоксихіназолін, 4[(3-хлор-4-фторфеніл)аміно]-6-(тетрагідропіран-3-ілокси)-7-метоксихіназолін, 4-[(3-хлор-4фторфеніл)аміно]-6-(1-метилпіперидин-4-ілокси)-7-метоксихіназолін, 4-[(3-хлор-4фторфеніл)аміно]-6-{1-[(морфолін-4-іл)карбоніл]піперидин-4-ілокси}-7-метоксихіназолін, 4-[(3хлор-4-фторфеніл)аміно]-6-{1-[(метоксиметил)карбоніл]піперидин-4-ілокси}-7-метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-(піперидин-3-ілокси)-7-метоксихіназолін, 4-[(3-хлор-4фторфеніл)аміно]-6-[1-(2-ацетиламіноетил)піперидин-4-ілокси]-7-метоксихіназолін, 4-[(3-хлор-4фторфеніл)аміно]-6-(тетрагідропіран-4-ілокси)-7-етоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]6-((S)-тетрагідрофуран-3-ілокси)-7-гідроксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6(тетрагідропіран-4-ілокси)-7-(2-метоксиетокси)хіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-{транс4-[(диметиламіно)сульфоніламіно]циклогексан-1-ілокси}-7-метоксихіназолін, 4-[(3-хлор-4фторфеніл)аміно]-6-{транс-4-[(морфолін-4-іл)карбоніламіно]циклогексан-1-ілокси}-7метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-{транс-4-[(морфолін-4іл)сульфоніламіно]циклогексан-1-ілокси}-7-метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6(тетрагідропіран-4-ілокси)-7-(2-ацетиламіноетокси)хіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6(тетрагідропіран-4-ілокси)-7-(2-метансульфоніламіноетокси)хіназолін, 4-[(3-хлор-4фторфеніл)аміно]-6-{1-[(піперидин-1-іл)карбоніл]піперидин-4-ілокси}-7-метоксихіназолін, 4-[(3хлор-4-фторфеніл)аміно]-6-(1-амінокарбонілметилпіперидин-4-ілокси)-7-метоксихіназолін, 4-[(3хлор-4-фторфеніл)аміно]-6-(цис-4-{N-[(тетрагідропіран-4-іл)карбоніл]-Nметиламіно}циклогексан-1-ілокси)-7-метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-(цис-4{N-[(морфолін-4-іл)карбоніл]-N-метиламіно}циклогексан-1-ілокси)-7-метоксихіназолін, 4-[(3-хлор 10 UA 103028 C2 5 10 15 20 25 30 35 40 45 50 55 60 4-фторфеніл)аміно]-6-(цис-4-{N-[(морфолін-4-іл)сульфоніл]-N-метиламіно}циклогексан-1-ілокси)7-метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-(транс-4-етансульфоніламіноциклогексан1-ілокси)-7-метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-(1-метансульфонілпіперидин-4ілокси)-7-етоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-(1-метансульфонілпіперидин-4ілокси)-7-(2-метоксиетокси)хіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-[1-(2метоксиацетил)піперидин-4-ілокси]-7-(2-метоксиетокси)хіназолін, 4-[(3-хлор-4-фторфеніл)аміно]6-(цис-4-ацетиламіноциклогексан-1-ілокси)-7-метоксихіназолін, 4-[(3-етинілфеніл)аміно]-6-[1(трет-бутилоксикарбоніл)піперидин-4-ілокси]-7-метоксихіназолін, 4-[(3-етинілфеніл)аміно]-6(тетрагідропіран-4-ілокси]-7-метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-(цис-4-{N[(піперидин-1-іл)карбоніл]-N-метиламіно}циклогексан-1-ілокси)-7-метоксихіназолін, 4-[(3-хлор-4фторфеніл)аміно]-6-(цис-4-{N-[(4-метилпіперазин-1-іл)карбоніл]-N-метиламіно}циклогексан-1ілокси)-7-метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-{цис-4-[(морфолін-4іл)карбоніламіно]циклогексан-1-ілокси}-7-метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[2-(2-оксопіролідин-1-іл)етил]піперидин-4-ілокси}-7-метоксихіназолін, 4-[(3-хлор-4фторфеніл)аміно]-6-{1-[(морфолін-4-іл)карбоніл]піперидин-4-ілокси}-7-(2метоксиетокси)хіназолін, 4-[(3-етинілфеніл)аміно]-6-(1-ацетилпіперидин-4-ілокси)-7метоксихіназолін, 4-[(3-етинілфеніл)аміно]-6-(1-метилпіперидин-4-ілокси)-7-метоксихіназолін, 4[(3-етинілфеніл)аміно]-6-(1-метансульфонілпіперидин-4-ілокси)-7-метоксихіназолін, 4-[(3-хлор-4фторфеніл)аміно]-6-(1-метилпіперидин-4-ілокси)-7-(2-метоксиетокси)хіназолін, 4-[(3-хлор-4фторфеніл)аміно]-6-(1-ізопропілоксикарбонілпіперидин-4-ілокси)-7-метоксихіназолін, 4-[(3-хлор4-фторфеніл)аміно]-6-(цис-4-метиламіноциклогексан-1-ілокси)-7-метоксихіназолін, 4-[(3-хлор-4фторфеніл)аміно]-6-{цис-4-[N-(2-метоксиацетил)-N-метиламіно]циклогексан-1-ілокси}-7метоксихіназолін, 4-[(3-етинілфеніл)аміно]-6-(піперидин-4-ілокси)-7-метоксихіназолін, 4-[(3етинілфеніл)аміно]-6-[1-(2-метоксиацетил)піперидин-4-ілокси]-7-метоксихіназолін, 4-[(3етинілфеніл)аміно]-6-{1-[(морфолін-4-іл)карбоніл]піперидин-4-ілокси}-7-метоксихіназолін, 4-[(3хлор-4-фторфеніл)аміно]-6-{1-[(цис-2,6-диметилморфолін-4-іл)карбоніл]піперидин-4-ілокси}-7метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(2-метилморфолін-4іл)карбоніл]піперидин-4-ілокси}-7-метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(S,S)-(2оксо-5-азабіцикло[2.2.1]гепт-5-іл)карбоніл]піперидин-4-ілокси}-7-метоксихіназолін, 4-[(3-хлор-4фторфеніл)аміно]-6-{1-[(N-метил-N-2-метоксиетиламіно)карбоніл]піперидин-4-ілокси}-7метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-(1-етилпіперидин-4-ілокси)-7метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(2-метоксиетил)карбоніл]піперидин-4ілокси}-7-метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(3метоксипропіламіно)карбоніл]піперидин-4-ілокси}-7-метоксихіназолін, 4-[(3-хлор-4фторфеніл)аміно]-6-[цис-4-(N-метансульфоніл-N-метиламіно)циклогексан-1-ілокси]-7метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-[цис-4-(N-ацетил-N-метиламіно)циклогексан1-ілокси]-7-метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-(транс-4-метиламіноциклогексан1-ілокси)-7-метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-[транс-4-(N-метансульфоніл-Nметиламіно)циклогексан-1-ілокси]-7-метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-(транс-4диметиламіноциклогексан-1-ілокси)-7-метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-(транс4-{N-[(морфолін-4-іл)карбоніл]-N-метиламіно}циклогексан-1-ілокси)-7-метоксихіназолін, 4-[(3хлор-4-фторфеніл)аміно]-6-[2-(2,2-диметил-6-оксоморфолін-4-іл)етокси]-7-[(S)(тетрагідрофуран-2-іл)метокси]хіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6-(1метансульфонілпіперидин-4-ілокси)-7-метоксихіназолін і 4-[(3-хлор-4-фторфеніл)аміно]-6-(1ціанопіперидин-4-ілокси)-7-метоксихіназолін, необов'язково у вигляді їх рацематів, енантіомерів, діастереомерів і необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей, сольватів або гідратів. До бажаних згідно з винаходом кислотно-адитивних солей інгібіторів EGFR належать солі, обрані із групи, що включає гідрохлорид, гідробромід, гідройодид, гідросульфат, гідрофосфат, гідрометансульфонат, гідронітрат, гідромалеат, гідроацетат, гідроцитрат, гідрофумарат, гідротартрат, гідрооксалат, гідросукцинат, гідробензоат і гідропаратолуолсульфонат. В якості агоністів допаміну бажано використовувати сполуки, обрані із групи, що включає бромокриптин, каберголін, альфа-дигідроергокриптин, лізурид, перголід, праміпексол, роксиндол, ропінірол, таліпексол, тергурид і віозан, необов'язково у вигляді їх рацематів, енантіомерів, діастереомерів і необов'язково у вигляді їх фармакологічно прийнятних кислотноадитивних солей, сольватів або гідратів. До бажаних згідно з винаходом кислотно-адитивних солей агоністів допаміну належать солі, обрані із групи, що включає гідрохлорид, гідробромід, гідройодид, гідросульфат, гідрофосфат, гідрометансульфонат, гідронітрат, гідромалеат, гідроацетат, гідроцитрат, гідрофумарат, гідротартрат, гідрооксалат, гідросукцинат, гідробензоат і гідропаратолуолсульфонат. 11 UA 103028 C2 5 10 15 У якості антагоністів рецептора гістамину H1 бажано використовувати сполуки, обрані із групи, що включає епінастин, цетиризин, азеластин, фексофенадин, левокабастин, лоратадин, мізоластин, кетотифен, емедастин, диметинден, клемастин, баміпін, цексхлорфенірамін, фенірамин, доксиламін, хлорфеноксамін, дименгідринат, дифенгідрамін, прометазин, ебастін, деслоратидин і меклозин, необов'язково у вигляді їх рацематів, енантіомерів, діастереомерів і необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей, сольватів або гідратів. До бажаних згідно з винаходом кислотно-адитивних солей антагоністів рецептора гістаміну H1 належать солі, обрані із групи, що включає гідрохлорид, гідробромід, гідройодид, гідросульфат, гідрофосфат, гідрометансульфонат, гідронітрат, гідромалеат, гідроацетат, гідроцитрат, гідрофумарат, гідротартрат, гідрооксалат, гідросукцинат, гідробензоат і гідропаратолуолсульфонат. Крім того, макромолекули, що інгалюються, описані в EP 1003478 або CA 2297174. Також можуть використовуватися сполуки з групи похідних алкалоїдів ріжків, триптанів, інгібіторів CGRP-пептиду та інгібіторів фосфодіестерази 5, необов'язково у вигляді їх рацематів, енантіомерів або діастереомерів і необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей, їх сольватів і/або гідратів. Як приклад похідних алкалоїдів ріжків можна назвати дигідроерготамін і ерготамін. ФОРМУЛА ВИНАХОДУ 20 25 30 35 40 45 50 55 1. Портативний інгалятор (1) для розпилення лікарського препарату (2) без використання газупропеленту, який має генератор (5) тиску, що містить камеру (11) тиску, де генератор тиску бажано виконаний у вигляді насоса і/або діє механічно, і який має випускне сопло (12) для випуску розпиленого лікарського препарату (2) у вигляді аерозолю (14) в мундштук (13), де для розпилення лікарського препарату (2), генератор тиску виконаний з можливістю поміщення лікарського препарату (2) під тиск в камері (11) тиску, який витісняє лікарський препарат (2) з камери (11) тиску через випускне сопло (12), де інгалятор (1) має закріплену на мундштуку (13) приставку (23), яка містить камеру (24) для проміжного розміщення аерозолю (14), де камера (24) розташована або пристосована для розташування нижче за потоком від випускного сопла (12), який відрізняється тим, що мундштук (13) має щонайменше один отвір (15) для підведення повітря, який залишається відкритим, коли приставка (23) прикріплена, зокрема, коли вона одягнута. 2. Інгалятор за п. 1, який відрізняється тим, що приставка (23), виконана з можливістю закріплення на мундштуку (13) охоплюючи його і/або може зніматися з інгалятора (1) або мундштука (13). 3. Інгалятор за п. 1 або 2, який відрізняється тим, що приставка (23) або камера (24) мають принаймні в цілому циліндричну, подовжену або конічну будову. 4. Інгалятор за одним з попередніх пунктів, який відрізняється тим, що камера (24) має об'єм більше ніж принаймні 0,1 л, бажано більше ніж 0,2 л, більш бажано приблизно від 0,2 до 0,6 л. 5. Інгалятор за одним з попередніх пунктів, який відрізняється тим, що мундштук (13) має два отвори (15) для підведення повітря, які розташовані нижче випускного сопла (12), відносно їх положення уздовж поздовжньої осі інгалятора (1), тоді як основна частина камери (24) для проміжного розміщення аерозолю (14) простирається вище випускного сопла (12). 6. Інгалятор за одним з попередніх пунктів, який відрізняється тим, що приставка (23) містить зокрема на випускному кінці клапан (28) для запобігання проходження повітря назад в камеру (24) і/або мундштук (13) і/або для всмоктування аерозолю, і/або щонайменше один клапан (32) для випуску повітря, що видихається. 7. Інгалятор за одним з попередніх пунктів, який відрізняється тим, що приставка (23) обладнана або пристосована для установки на неї на вибір додаткового мундштуку (29), трубки (30) і/або дихальної маски (31). 8. Інгалятор за одним з попередніх пунктів, який відрізняється тим, що конструкція інгалятора (1) забезпечує розпилення визначених кількостей лікарського препарату (2) і те, що лікарський препарат (2) досягає тиску 10-60 МПа в генераторі тиску (5) або в камері (11) тиску під час випускання лікарського препарату (2). 9. Інгалятор за одним з попередніх пунктів, який відрізняється тим, що виконаний з можливістю створення тиску або розпилення здійснюється зусиллям пружини. 12 UA 103028 C2 13 UA 103028 C2 14 UA 103028 C2 Комп’ютерна верстка С. Чулій Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 15
ДивитисяДодаткова інформація
Назва патенту англійськоюInhaler
Автори англійськоюSpallek, Michael, Wachtel, Herbert, Bickmann, Deborah
Автори російськоюВахтель Херберт
МПК / Мітки
МПК: B05B 11/00, A61M 11/06, A61M 15/00
Мітки: розпилення, лікарського, інгалятор, портативний, препарату, використання, газу-пропеленту
Код посилання
<a href="https://ua.patents.su/17-103028-portativnijj-ingalyator-dlya-rozpilennya-likarskogo-preparatu-bez-vikoristannya-gazu-propelentu.html" target="_blank" rel="follow" title="База патентів України">Портативний інгалятор для розпилення лікарського препарату без використання газу-пропеленту</a>
Попередній патент: Гідролого-гідрохімічний зонд для визначення профілю концентрації розчиненого сірководню (варіанти)
Наступний патент: Газовий пальник для печей
Випадковий патент: Спосіб одержання тріпептидів