Фармацевтична композиція 4-{[9-хлор-7-(2-фтор-6-метоксифеніл)-5н-піримідо[5,4-d][2]бензазепін-2-іл]аміно}-2-метоксибензойної кислоти для лікування раку й інших захворювань і порушень стану здоров’я
Номер патенту: 110463
Опубліковано: 12.01.2016
Автори: Раманан Віджаялакшмі, Тобіас Арін Софі, Вервейс Даунтел Спехт, Скверчінскі Реймонд Д.
Формула / Реферат
1. Рідка фармацевтична композиція, що містить натрієву сіль сполуки формули (IІ)
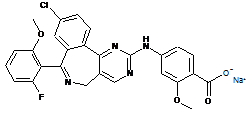 (ІІ)
(ІІ)
або її кристалічну форму, яка відрізняється тим, що фармацевтична композиція містить від 0,10 до 2 % (мас./мас.) сполуки формули (ІІ) або її кристалічної форми; від 0,20 до 3 % (мас./мас.) натрію бікарбонату; і суміш розчинників пропіленгліколю, очищеної води, ПЕГ400 і необов'язково гліцерину; де розчинник містить менше ніж 50 % очищеної води, і композиція містить щонайменше 15 % (мас./мас.) пропіленгліколю і щонайменше 15 % (мас./мас.) ПЕГ400.
2. Фармацевтична композиція за п. 1, яка відрізняється тим, що сполука формули (II) присутня у кількості від 0,40 % (мас./мас.) до 0,50 % (мас./мас.).
3. Фармацевтична композиція за п. 1, яка відрізняється тим, що розчинник присутній у кількості 97, 98 або 99 % (мас./мас.).
4. Фармацевтична композиція за п. 1, яка відрізняється тим, що розчинник присутній у кількості 68, 69 або 70 % (мас./мас.).
5. Фармацевтична композиція за п. 1, яка відрізняється тим, що розчинник являє собою суміш пропіленгліколю, гліцерину, ПЕГ400 і очищеної води.
6. Фармацевтична композиція за п. 1, яка відрізняється тим, що розчинник є сумішшю ПЕГ400, пропіленгліколю та очищеної води.
7. Фармацевтична композиція за п. 1, яка відрізняється тим, що натрію бікарбонат присутній у кількості 0,42 % (мас./мас.).
8. Фармацевтична композиція за п. 1, яка додатково включає консервант, присутній в кількості не більше 1 % (мас./мас.), яка відрізняється тим, що консервант вибирають з групи, яка складається з метилпарабену, пропілпарабену і їх сумішей.
9. Фармацевтична композиція за п. 8, яка відрізняється тим, що консервант присутній в кількості 0,2 % (мас./мас.).
10. Фармацевтична композиція за п. 1, яка додатково включає поверхнево-активну речовину, присутню в кількості не більше 1 % (мас./мас.), яка відрізняється тим, що поверхнево-активною речовиною є натрію лаурилсульфат.
11. Фармацевтична композиція за п. 10, яка відрізняється тим, що поверхнево-активна речовина присутня в кількості 0,5 % (мас./мас.).
12. Фармацевтична композиція за п. 1, яка додатково включає речовину, що виправляє смак лікарського засобу, яка відрізняється тим, що речовина, яка виправляє смак лікарського засобу, вибрана із групи, що складається з сорбіту, мальтиту, сахарози, ацесульфаму калію і їх сумішей.
13. Фармацевтична композиція за п. 12, яка відрізняється тим, що речовиною, яка виправляє смак лікарського засобу, є сорбіт.
14. Спосіб лікування раку, що включає введення терапевтично ефективної кількості фармацевтичної композиції за п. 1.
15. Спосіб за п. 14, який відрізняється тим, що рак вибраний з групи, що включає рак ободової і прямої кишки, рак яєчників, рак молочної залози, рак шлунка, рак передміхурової залози, рак підшлункової залози, нейробластому і гострий лімфобластний лейкоз.
16. Фармацевтична композиція за п. 12, яка відрізняється тим, що речовиною, яка виправляє смак лікарського засобу, є ацесульфам калію.
17. Фармацевтична композиція за п. 1, яка відрізняється тим, що фармацевтична композиція містить від 0,40 % (мас./мас.) до приблизно 0,50 % (мас./мас.) сполуки формули (II) або її кристалічної форми; і 0,42 % (мас./мас.) натрію бікрабонату.
18. Фармацевтична композиція за п. 17, яка додатково включає речовину, яка виправляє смак лікарського засобу.
19. Фармацевтична композиція за п. 1, яка відрізняється тим, що фармацевтична композиція містить від 0,40 (мас./мас.) до приблизно 0,50 % (мас./мас.) сполуки формули (II) або її кристалічної форми; 0,42 % (мас./мас.) натрію бікрабонату; ацесульфам калію; ароматизатор; і в якій розчинник присутній у кількості 97, 98 або 99 % (мас./мас.) і являє собою суміш пропіленгліколю, гліцерину, ПЕГ400 і очищеної води.
20. Фармацевтична композиція за п. 1, яка відрізняється тим, що фармацевтична композиція містить від 0,40 (мас./мас.) до приблизно 0,50 % (мас./мас.) сполуки формули (II) або її кристалічної форми; 0,42 % (мас./мас.) натрію бікрабонату; сорбіт; і в якій розчинник присутній у кількості 68, 69 або 70 % (мас./мас.) і являє собою суміш пропіленгліколю, ПЕГ400 і очищеної води.
Текст
Реферат: Цей винахід пропонує нові фармацевтичні композиції сполуки формули (І): Cl O H N N N F OH N O O (І) або її фармацевтично прийнятної солі, застосовні для масового виробництва оральної лікарської форми; спосіб виробництва зазначеної оральної лікарської форми; і використання UA 110463 C2 (12) UA 110463 C2 фармацевтичної композиції для лікування пацієнтів, що страждають від захворювань, розладів або станів, у розвиток яких залучена виживаність, проліферація й міграція клітин, включаючи хронічні запальні проліферативні захворювання, проліферативні захворювання очей, доброякісні проліферативні захворювання й рак. UA 110463 C2 5 Домагання на пріоритет Це опис винаходу заявляє перевагу пріоритету попередньої заявки США № 61/230,212, поданої 31 липня 2009 року, що повністю включена в цей опис винаходу за допомогою посилання. Рівень техніки Даний винахід стосується фармацевтичних композицій 4-{[9-хлор-7-(2-фтор-6метоксіфеніл)-5H-піримідо[5,4-d][2] бензазепін-2-іл]аміно}- 2-метоксібензойної кислоти формули (I) або її фармацевтично прийнятних солей: Cl O H N N F 10 15 O H N N N 30 35 40 45 O N F 25 O (I) Сполука формули (I) ефективно використовується в інгібуванні активності кінази Aurora A in vitro і in vivo і, особливо – у лікуванні різних захворювань, викликаних порушенням контролю проліферації клітин. Прикладом фармацевтично прийнятної солі формули (I) служить 4-{[9 хлор-7-(2-фтор- 6метоксіфеніл)-5H-Піримідо[5,4-d][2] бензазепін-2-іл]аміно}- 2-метоксібензоат натрію формули (II) або його кристалічна форма: Cl O 20 OH N N O Na+ O (II) За даними Американського товариства по боротьбі з раком, приблизно у 1,48 мільйона американців був уперше діагностовано рак в 2009 році, і приблизно 562 тисячі чоловік померли від цієї хвороби. Хоча досягнення в медицині дозволили підвищити виживаність хворих раком, однаково залишається потреба в розробці нових і більш ефективних способів лікування. Рак характеризується неконтрольованим відтворенням клітин. Мітоз – це стадія життєвого циклу клітини, протягом якої ряд складних подій забезпечує вірний поділ хромосом між двома дочірніми клітинами. Деякі з існуючих засобів для лікування раку, включаючи таксани й алкалоїди барвінку, діють шляхом придушення механізму мітозу. Розвиток мітозу в істотному ступені регулюється протеолізом і способами фосфорилювання, що протікають зі значною участю кіназ мітозу. Сімейство протеїнкіназ Aurora (наприклад, Aurora A, Aurora B, Aurora C) регулює хід мітозу шляхом модуляції поділу центросом, динаміки веретена, контрольної крапки складання веретена, вирівнювання хромосом і цитокінезу (Dutertre et al., Oncogene, 21: 6175 (2002)); Berdnik et al., Curr. Biol., 12: 640 (2002)). Підвищена експресія й/або збільшення числа копій протеїнкіназ Aurora пов'язане з онкогенезом декількох типів пухлин, включаючи пухлини товстої кишки й молочної залози (Warner et al., Mol. Cancer Ther., 2: 589 (2003); Bischoff et al., EMBO, 17: 3062 (1998); Sen et al., Cancer Res., 94: 1320 (2002)). Крім того, інгібування протеїнкіназ Aurora у пухлинних клітинах приводить до мітотичного блоку й апоптозу, що дозволяє розглядати такі кінази як важливі цільові речовини для терапії раку (Ditchfield, J. Cell Biol., 161: 267 (2003); Harrington et al., Nature Med., 1 (2004)). З огляду на центральну роль мітозу в розвитку, практично, всіх злоякісних пухлин, інгібітори кіназ Aurora можуть знайти застосування в лікуванні широкого спектра пухлин у людей. Сполуки, що інгібують ферменти протеїнкінази Aurora, описані в Патенті США № 7572784, US 2008/0045501, US 2008/0167292 і заявці США № 61/306047, зареєстрованої 19 лютого 2010 року, які повністю включені в цей опис винаходу за допомогою посилання. У цих заявках представлені також способи виготовлення таких сполук, фармацевтичних композицій, що містять такі сполуки, і способи профілактики й терапії захворювань, розладів або станів, пов'язаних з надлишковою експресією й/або збільшенням числа копій протеїнкіназ Aurora, включаючи, серед іншого, порушення контролю проліферації клітин, такі як рак. 1 UA 110463 C2 5 10 15 20 25 30 35 40 45 50 55 60 4-{[9-хлор-7-(2-фтор-6-метоксіфеніл)-5H-піримідо[5,4-d][2] бензазепін-2-іл]аміно}2метоксібензоат натрію формули (II) описаний у заявках WO 08/063525 і US 2008/0167292, повністю включених у цей опис винаходу за допомогою посилання. Існує потреба в розробці стійких фармацевтичних препаратів сполуки формули (I) або її фармацевтично прийнятної солі, які було б зручно вводити пацієнтам, зокрема в педіатричній практиці. Сутність винаходу Одним із предметів цього винаходу є фармацевтичні композиції, що містять сполуку формули (I) або її фармацевтично прийнятну сіль, що підходять для масового виробництва оральної фармацевтичної форми дозування. Іншим предметом цього винаходу є фармацевтична композиція, що містить сполуку формули (I) або її фармацевтично прийнятну сіль, що підходить для масового виробництва рідкої оральної лікарської форми. Іншим предметом цього винаходу є фармацевтична композиція, що містить сполуку формули (I) або її фармацевтично прийнятну сіль, принаймні один розчинник, принаймні один буфер й, додатково, одну або більше фармацевтично прийнятних допоміжних речовин, незалежно обраних із групи, що включає консерванти й поверхнево-активні речовини. Іншим предметом цього винаходу є спосіб масового виробництва оральної фармацевтичної форми дозування сполуки (I) або її фармацевтично прийнятної солі. Іншим предметом цього винаходу є способи використання фармацевтичної композиції сполуки (I) або її фармацевтично прийнятної солі в лікуванні пацієнтів, що страждають від хвороб, розладів або станів, пов'язаних з порушеннями проліферації клітин, включаючи хронічні запальні проліферативні захворювання, наприклад, псоріаз і ревматоїдний артрит; проліферативні захворювання очей, наприклад, діабетична ретинопатія; доброякісні проліферативні порушення, наприклад, гемангіома; і рак. У патентній і/або науковій літературі, згаданої в цьому описі винаходу, представлена інформація, доступна фахівцям у цій галузі. Якщо не приводиться спеціальне визначення, всі технічні й наукові терміни, використовувані в цьому описі винаходу, мають звичайні значення, відомі фахівцям в галузі техніки, якої стосується цей винахід. Хоча для практичного втілення або випробувань цього винаходу можуть використовуватися способи й матеріали, аналогічні або еквівалентні зазначеним у цьому описі винаходу, тут описуються переважні способи й матеріали. Видані патенти, заявки й література, що цитується в цьому описі винаходу, включені в цей опис винаходу за допомогою посилання в такому ж ступені, як якби кожний такий патент, заявка або література окремо були зазначені як включені в цей опис винаходу за допомогою посилання. У випадку яких-небудь невідповідностей або протиріч, дані цього опису винаходу, включаючи визначення, мають вирішальну силу. Крім того, матеріали, способи й приклади є лише ілюстративними, і не повинні обмежувати обсяг цього винаходу. Визначення: Термін «приблизно», використовуваний у цьому описі винаходу, означає «приблизно», «біля», «неточно» або «грубо говорячи». Якщо термін «приблизно» використовується в сполученні із числовим діапазоном, він означає, що такий діапазон розширюється за нижню й верхню межу, позначену чисельними значеннями. Як правило, термін «приблизно» використовується в цьому описі винаходу для позначення того, що відповідне чисельне значення дорівнює певному зазначеному значенню ± 10 %. Використовуваний у цьому описі винаходу термін «містить у собі» означає «включає, але не обмежується цим» («включає, серед іншого»). Використовуваний у цьому описі винаходу термін «об'єкт» або «пацієнт» означає, переважно, птаха або ссавця, такого як людина, але може також означати тварину, що потребує ветеринарного лікування, наприклад, свійську тварину (наприклад, собаки, коти й т.п.), сільськогосподарську тварину (наприклад, велику рогату худобу, вівців, домашніх птахів, свиней, коней тощо) і лабораторних тварин (наприклад, пацюка, миші, морських свинок тощо). Термін «фармацевтично прийнятна допоміжна речовина» використовується в цьому описі винаходу для згадування матеріалу, сумісного з об'єктом, якому він вводиться, переважно, зі ссавцем, більш переважно – з людиною, і підходящого для доставки активної речовини в цільове місце, зберігаючи при цьому дію такої активної речовини. Токсичність або небажані ефекти, якщо такі проявляються, зв'язані з допоміжною речовиною, розмірні обґрунтованому відношенню ризику до користі для цільового використання активного інгредієнта. Класи фармацевтично прийнятних допоміжних речовин включають, серед іншого, поверхнево-активні речовини, зв'язувальні речовини, розпушувачі, мастильні речовини, регулятори сипкості, наповнювачі, буфери, розчинники, консерванти й речовини, що виправляють смак лікарських 2 UA 110463 C2 5 10 15 20 25 30 35 40 45 50 55 60 засобів. Огляд педіатричних оральних препаратів представлено, наприклад, в: Strickley RG et al., J. Pharm. Sci., 97(5): 1731-1774 (2007). Термін «речовини, що виправляють смак лікарських засобів» використовується в цьому описі винаходу для позначення засобу, що поліпшує смакові якості фармацевтичної композиції, маскуючи небажаний смак або запах. Речовини, що виправляють смак лікарських засобів, включають, серед іншого, підсолоджувачі, смакові добавки, засоби, що маскують гіркий смак, засоби, що підвищують в'язкість, фарбники й допоміжні ароматизатори (наприклад, аромат ментолу або північноамериканської сливи). Приклади підсолоджувачів, включають, серед іншого, природні й синтетичні підсолоджувачі, такі як сахароза, декстроза, фруктоза, кукурудзяний сироп з високим вмістом фруктози, мальтол, інвертований цукор, сорбіт, сахарин, мальтит, ксиліт, сахарин натрію, сукралоза, аспартам, ацесульфам калію й цикламати. Смакові речовини включають будь-які природні або синтетичні сполуки, відомі фахівцям у даній галузі, які надають певний смак і аромат, включаючи, серед іншого, смак винограду, вишні, ягоди, лимону і інших фруктів, м'яти, ванілі, шоколаду, надувної жувальної гумки й кориці. Див., наприклад, Посібник з інгредієнтів, що надають смак і аромат: Fenaroli’s Handbook of Flavor th Ingredients, 5 Edition, edited by George A. Burdock, Ph.D., CRC Press. Використовувана у цьому описі винаходу загальна вага одиниці лікарської форми визначається підсумовуванням ваг всіх компонентів такої лікарської форми Загальна вага одиниці лікарської форми використовується як основа для розрахунку процентного (за вагоюі) вмісту кожного з компонентів, що входять до складу такої лікарської форми. Використовуване в цьому описі винаходу словосполучення «% (в/в)» означає вагове відношення даного компонента до загальної ваги у відсотках. Використовуваний в цьому описі винаходу вираз «лікуючий» або «лікування» означає профілактику, часткове ослаблення або вилікування захворювання, розлади або стани. Сполуки й композиції, що є предметом цього винаходу, використовуються в терапевтичних засобах, що мають відношення до лікування захворювань і розладів, що протікають за участю кіназ Aurora. Використовуваний в цьому описі винаходу вираз «захворювання або розлади, що протікають за участю кіназ Aurora» означає будь-який розлад, захворювання або стан, викликаний або що характеризується підвищеною експресією або активністю кіназ Aurora, або що потребує активності кіназ Aurora. Термін «захворювання або розлади, що протікає за участю кіназ Aurora» означає також будь-який розлад, захворювання або стан, для лікування якого корисним є придушення активності кіназ Aurora. Захворювання або розлади, що протікають за участю кіназ Aurora, включають проліферативні захворювання. Не вичерпні приклади проліферативних захворювань включають хронічні запальні проліферативні захворювання, наприклад, псоріаз і ревматоїдний артрит; проліферативні очні захворювання, наприклад, діабетична ретинопатія; доброякісні проліферативні захворювання, наприклад, гемангіома; і рак. Використовуваний у цьому описі винаходу термін «кіназа Aurora» означає будь-яку кіназу із сімейства родинних серин-треонін протеїнкіназ, що беруть участь у процесі мітозу. Різноманітні клітинні білки, що відіграють певну роль у розподілі клітин, є субстратами для фосфорилювання за участю ферментів кінази Aurora, включаючи, серед іншого, гістон Н3, р 53, білок А центромеру (CENP-A), міозин II, регуляторний легкий ланцюг, протеїнфосфатазу-1, що направляє (протеїнкіназу) білок ТРХ-2, внутрішній білок центромеру INCENP, сурвівін, топоізомеразу II альфа, виментин, ядерний білок MBD-3 (утримуючий область зв'язування метил- CpG), білок MgcRacGAP (що активує ГТФ-азу Rac чоловічих статевих клітин), десмін, білки Ajuba, XIEg5 (шпорцевой жаби), Ndc10p (у дріжджах, що брунькуються) і D-TACC (трансформуючий кислотний двохспіральний білок дрозофіл). Кінази Aurora також самі є субстратами для аутофосфорилювання, наприклад, у положенні Thr288. Якщо інше не зазначено в контексті, термін «кіназа Aurora» означає будь-який білок кінази Aurora від будьякого виду, включаючи, не обмежуючись, кінази Aurora A, Aurora , і Aurora C, переважно, кінази Aurora A або B. Переважно, кіназа Aurora означає кіназу Aurora людини. Термін «інгібітор кінази Aurora» використовується для позначення сполуки, що має структуру, описану в цьому описі винаходу, та що може взаємодіяти з кіназою Aurora і придушувати її ферментативну активність. Придушення ферментативної активності кінази Aurora означає зниження здатності кінази Aurora до фосфорилювання, що є субстратом пептиду, або білка. У різних варіантах втілення цього винаходу, таке зниження активності кінази Aurora становить принаймні приблизно 50 %, принаймні приблизно 75 %, принаймні приблизно 90 %, принаймні приблизно 95 % або принаймні приблизно 99 %. У різних варіантах здійснення цього винаходу, концентрація інгібітору кінази Aurora, необхідна для зниження ферментативної активності кінази Aurora, становить менш приблизно 1 мкм, менш приблизно 500 нм, менш приблизно 100 нм або менш приблизно 50 нм. 3 UA 110463 C2 5 10 15 20 25 30 35 40 45 50 55 Використовуваний в цьому описі винаходу вираз «терапевтично ефективна кількість» означає таку кількість сполуки, композиції, медикаменту або іншого активного інгредієнта, що викликає бажаний терапевтичний ефект. Докладний опис винаходу В одному з варіантів здійснення цього винаходу, фармацевтична композиція, що є предметом цього винаходу, містить сполуку формули (I) або її фармацевтично прийнятну сіль, принаймні один розчинник, принаймні один буфер й, додатково, одне або більше фармацевтично прийнятних допоміжних речовин, незалежно обраних із групи, що включає консерванти й поверхнево-активні речовини. В іншому варіанті здійснення цього винаходу, фармацевтична композиція, що є предметом цього винаходу, містить також засіб, що виправляє смак лікарського засобу. Ще в іншому варіанті здійснення цього винаходу, фармацевтична композиція, що містить сполуку формули (I) або її фармацевтично прийнятну сіль, придатна для масового виробництва рідкої оральної лікарської форми. Приклади рідких оральних лікарських форм включають, не обмежуючись зазначеним, розчини, суспензії й колоїдні розчини. В одному з варіантів здійснення цього винаходу, фармацевтична композиція, що є предметом цього винаходу, містить, приблизно від 0,05 % (в/в) до приблизно 5 % (в/в) сполуки формули (I) або її фармацевтично прийнятної солі, приблизно від 50 % (в/в) до приблизно 99,2 % (в/в) розчинника, приблизно від 0,01 % (в/в) до приблизно 30 % (в/в) буфера, не більш ніж приблизно 5 % (в/в) консерванту й не більш ніж приблизно 5 % (в/в) поверхнево-активної речовини. В іншому варіанті здійснення цього винаходу, фармацевтична композиція містить приблизно від 0,05 % (в/в) до приблизно 5 % (в/в) сполуки формули (I) або її фармацевтично прийнятної солі, приблизно від 50 % (в/в) до приблизно 99 % (в/в) розчинника, приблизно від 0,01 % (в/в) до приблизно 30 % (в/в) буфера, не більш ніж 60 % (в/в) речовини, що виправляє смак лікарського засобу, не більш ніж приблизно 5 % (в/в) консерванту й не більш ніж приблизно 5 % (в/в) поверхнево-активної речовини. Ще в одному з варіантів здійснення цього винаходу, фармацевтична композиція містить приблизно від 0,10 % (в/в) до приблизно 2 % (в/в) сполуки формули (I) або її фармацевтично прийнятної солі, приблизно від 65 % (в/в) до приблизно 99 % (в/в) розчинника, приблизно від 0,20 % (в/в) до приблизно 3 % (в/в) буфера й приблизно від 15 % (в/в) до приблизно 50 % (в/в) речовини, що виправляє смак лікарського засобу. В іншому варіанті здійснення цього винаходу, фармацевтична композиція містить приблизно 0,44 % (в/в) сполуки формули (I) або її фармацевтично прийнятної солі, приблизно 99,14 % (в/в) розчинника й приблизно від 0,42 % (в/в) буфера. В іншому варіанті здійснення цього винаходу, фармацевтична композиція містить приблизно 0,47 % (в/в) сполуки формули (II) або її кристалічної форми, приблизно 77,36 % (в/в) розчинника, приблизно 21,75 % (в/в) речовини, що виправляє смак лікарського засобу, і приблизно 0,42 % (в/в) буфера. В іншому варіанті здійснення цього винаходу, фармацевтична композиція містить приблизно 0,47 % (в/в) сполуки формули (II) або її кристалічної форми, приблизно 98,41 % (в/в) розчинника, приблизно 0,7 % (в/в) речовини, що виправляє смак лікарського засобу, і приблизно 0,42 % (в/в) буфера. В іншому варіанті здійснення цього винаходу, фармацевтична композиція містить приблизно 0,47 % (в/в) сполуки формули (II) або її кристалічної форми, приблизно 78,11 % (в/в) розчинника, приблизно 21 % (в/в) речовини, що виправляє смак лікарського засобу, і приблизно 0,42 % (в/в) буфера. В одному з варіантів здійснення цього винаходу, фармацевтична композиція, що є предметом цього винаходу, являє собою рідку лікарську форму. В іншому варіанті здійснення цього винаходу, лікарська форма призначена для введення доз у педіатричній практиці. В іншому варіанті здійснення цього винаходу, лікарська форма призначена для введення доз дорослим. У деяких варіантах здійснення цього винаходу, фармацевтична композиція, що є предметом цього винаходу, містить сіль сполуки формули (I), переважно, натрієву сіль формули (II) або її кристалічну форму. Використовуючи аналітичні методи, описані в Прикладі 9, можна виміряти кількість сполуки формули (I) або її фармацевтично прийнятної солі у випробуваному зразку в порівнянні зі стандартом порівняння сполуки формули (II) або її кристалічною формою. Виходячи з молекулярного відношення 1:1 при перетворенні сполуки формули (I) у сполуку формули (II), перерахування молекулярної ваги дає кількість сполуки формули (I), що присутньої у випробуваному зразку. 4 UA 110463 C2 5 10 15 20 25 30 35 40 45 50 55 60 У деяких варіантах здійснення цього винаходу, кількість сполуки формули (I) або її фармацевтично прийнятної солі, що присутньої у фармацевтичній композиції, виражається як еквівалентна кількість сполуки формули (II), виходячи з відношення молекулярних ваг сполуки формули (I) і сполуки формули (II). Наприклад, у деяких варіантах здійснення цього винаходу, фармацевтична композиція містить 0,47 % (в/в)сполуки формули (II), що еквівалентно 0,44 % (в/в) сполуки формули (I), з огляду на співвідношення між значеннями молекулярної ваги цих сполук. У деяких варіантах здійснення цього винаходу фармацевтична композиція містить сполуку формули (I) або сполуку формули (II), є присутньою у кількості від приблизно 0,05 % (в/в) до приблизно 5 % (в/в). У деяких інших варіантах здійснення цього винаходу, сполука формули (I) або сполука формули (II) є присутньою у кількості від приблизно 0,10 % (в/в) до приблизно 2 % (в/в). Ще в деяких інших варіантах здійснення цього винаходу, сполука формули (I) або сполука формули (II) є присутньою у кількості приблизно 0,10 % (в/в), або приблизно 0,20 % (в/в), або приблизно 0,30 % (в/в), або приблизно 0,40 % (в/в), або приблизно 0,50 % (в/в), або приблизно 1,0 % (в/в), або приблизно 1,5 % (в/в), або приблизно 2,0 % (в/в), або приблизно 2,5 % (в/в), або приблизно 3,0 % (в/в), або приблизно 3,5 % (в/в), або приблизно 4,0 % (в/в), або приблизно 4,5 % (в/в), або приблизно 5,0 % (в/в). Ще в деяких інших варіантах здійснення цього винаходу, сполука формули (I) або сполука формули (II) є присутньою у кількості приблизно 0,10 % (в/в), або приблизно 0,15 % (в/в), або приблизно 0,20 % (в/в), або приблизно 0,25 % (в/в), або приблизно 0,30 % (в/в), або приблизно 0,35 % (в/в), або приблизно 0,40 % (в/в), або приблизно 0,45 % (в/в), або приблизно 0,50 % (в/в), або приблизно 0,55 % (в/в), або приблизно 0,60 % (в/в), або приблизно 0,65 % (в/в), або приблизно 0,70 % (в/в), або приблизно 0,75 % (в/в), або приблизно 0,80 % (в/в), або приблизно 0,85 % (в/в), або приблизно 0,90 % (в/в), або приблизно 0,95 % (в/в), або приблизно 1,0 % (в/в), або приблизно 1,05 % (в/в), або приблизно 1,10 % (в/в), або приблизно 1,15 % (в/в), або приблизно 1,20 % (в/в), або приблизно 1,25 % (в/в), або приблизно 1,30 % (в/в), або приблизно 1,35 % (в/в), або приблизно 1,40 % (в/в), або приблизно 1,45 % (в/в), або приблизно 1,50 % (в/в), або приблизно 1,55 % (в/в), або приблизно 1,60 % (в/в), або приблизно 1,65 % (в/в), або приблизно 1,70 % (в/в), або приблизно 1,75 % (в/в), або приблизно 1,80 % (в/в), або приблизно 1,85 % (в/в), або приблизно 1,90 % (в/в), або приблизно 1,95 % (в/в), або приблизно 2,0 % (в/в). Ще в деяких інших варіантах здійснення цього винаходу, сполука формули (I) або сполука формули (II) є присутньою у кількості приблизно від 0,40 % (в/в) до приблизно 0,50% (в/в). Ще в деяких інших варіантах здійснення цього винаходу, сполука формули (I) або сполука формули (II) є присутньою у кількості приблизно 0,21 % (в/в), або приблизно 0,22 % (в/в), або приблизно 0,23 % (в/в), або приблизно 0,24 % (в/в), або приблизно 0,25 % (в/в), або приблизно 0,26 % (в/в), або приблизно 0,27 % (в/в), або приблизно 0,28 % (в/в), або приблизно 0,29 % (в/в), або приблизно 0,30 % (в/в), або приблизно 0,31 % (в/в), або приблизно 0,32 % (в/в), або приблизно 0,33 % (в/в), або приблизно 0,34 % (в/в), або приблизно 0,35 % (в/в), або приблизно 0,36 % (в/в), або приблизно 0,37 % (в/в), або приблизно 0,38 % (в/в), або приблизно 0,39 % (в/в), або приблизно 0,40 % (в/в), або приблизно 0,41 % (в/в), або приблизно 0,42 % (в/в), або приблизно 0,43 % (в/в), або приблизно 0,44 % (в/в), або приблизно 0,45 % (в/в), або приблизно 0,46 % (в/в), або приблизно 0,47 % (в/в), або приблизно 0,48 % (в/в), або приблизно 0,49 % (в/в). У деяких варіантах здійснення цього винаходу, фармацевтична композиція містить розчинник, що є присутнім у кількості приблизно від 50 % (в/в) до приблизно 99,2 % (в/в). У деяких інших варіантах здійснення цього винаходу, фармацевтична композиція містить розчинник, що є присутнім у кількості приблизно від 65 % (в/в) до приблизно 99 % (в/в). У деяких інших варіантах здійснення цього винаходу, фармацевтична композиція містить розчинник, що є присутнім у кількості приблизно від 75 % (в/в) до приблизно 99 % (в/в). Ще в інших варіантах здійснення цього винаходу, фармацевтична композиція містить розчинник, що є присутнім у кількості приблизно 65 % (в/в), або приблизно 66 % (в/в), або приблизно 67 % (в/в), або приблизно 68 % (в/в), або приблизно 69 % (в/в), або приблизно 70 % (в/в), або приблизно 71 % (в/в), або приблизно 72 % (в/в), або приблизно 73 % (в/в), або приблизно 74 % (в/в), або приблизно 75 % (в/в), або приблизно 76 % (в/в), або приблизно 77 % (в/в), або приблизно 78 % (в/в), або приблизно 79 % (в/в), або приблизно 80 % (в/в), або приблизно 81 % (в/в), або приблизно 82 % (в/в), або приблизно 83 % (в/в), або приблизно 84 % (в/в), або приблизно 85 % (в/в), або приблизно 86 % (в/в), або приблизно 87 % (в/в), або приблизно 88 % (в/в), або приблизно 89 % (в/в), або приблизно90 % (в/в), або приблизно 91 % (в/в), або приблизно 92 % (в/в), або приблизно 93 % (в/в), або приблизно 94 % (в/в), або приблизно 95 % (в/в), або приблизно 96 % (в/в), або приблизно 97 % (в/в), або приблизно 98 % (в/в), або приблизно 99 % (в/в). Ще в інших варіантах здійснення цього винаходу, фармацевтична композиція містить 5 UA 110463 C2 5 10 15 20 25 30 35 40 45 50 55 60 розчинник, що є присутнім у кількості приблизно 99,11 % (в/в), або приблизно 99,12 % (в/в), або приблизно 99,13 % (в/в), або приблизно 99,14 % (в/в), або приблизно 99,15 % (в/в), або приблизно 99,16 % (в/в), або приблизно 99,17 % (в/в), або приблизно 99,18 % (в/в), або приблизно 99,19 % (в/в), або приблизно 99,2 % (в/в). Ще в інших варіантах здійснення цього винаходу, фармацевтична композиція містить розчинник, що є присутнім у кількості приблизно 77,65 % (в/в), або приблизно 77,66 % (в/в), або приблизно 77,67 % (в/в), або приблизно 77,68 % (в/в), або приблизно 77,69 % (в/в), або приблизно 77,70 % (в/в), або приблизно 77,71 % (в/в), або приблизно 77,72 % (в/в), або приблизно 77,73 % (в/в), або приблизно 77,74 % (в/в), або приблизно 77,75 % (в/в). Підходящі розчинники включають, не обмежуючись зазначеним, пропіленгліколь, гліцерин, поліетиленгліколь (ПЕГ400), поліетиленгліколь (ПЕГ3350), етанол, циклодекстрини (наприклад, гідроксипропіл-бета-циклодекстрин (ГПБЦД)), рослинні масла, касторове масло, тригліцериди ланцюга середньої довжини, очищену воду й суміші зазначених розчинників. В одному з варіантів здійснення цього винаходу, розчинником є суміш ПЕГ400, пропіленгліколя й очищеної води. У деяких варіантах здійснення цього винаходу, фармацевтична композиція містить буфер, що є присутнім у кількості не більш ніж приблизно 30 % (в/в). У деяких інших варіантах здійснення цього винаходу, фармацевтична композиція містить буфер, що є присутнім у кількості приблизно від 0,20 % (в/в) до приблизно 3 % (в/в). Ще в інших варіантах здійснення цього винаходу, фармацевтична композиція містить буфер, що є присутнім у кількості приблизно 1,0 % (в/в), або приблизно 1,5 % (в/в), або приблизно 2,0 % (в/в), або приблизно 2,5 % (в/в), або приблизно 3,0 % (в/в), або приблизно 3,5 % (в/в), або приблизно 4,0 % (в/в), або приблизно 4,5 % (в/в), або приблизно 5,0 % (в/в), або приблизно 5,5 % (в/в), або приблизно 6,0 % (в/в), або приблизно 6,5 % (в/в), або приблизно 7,0 % (в/в), або приблизно 7,5 % (в/в), або приблизно 8,0 % (в/в), або приблизно 8,5 % (в/в), або приблизно 9,0 % (в/в), або приблизно 9,5 % (в/в), або приблизно 10,0 % (в/в). Ще в інших варіантах здійснення цього винаходу, фармацевтична композиція містить буфер, що є присутнім у кількості приблизно 15 % (в/в), або приблизно 20 % (в/в), або приблизно 25 % (в/в), або приблизно 30 % (в/в). Ще в інших варіантах здійснення цього винаходу, фармацевтична композиція містить буфер, що є присутнім у кількості приблизно 0,01 % (в/в), або приблизно 0,05 % (в/в), або приблизно 0,10 % (в/в), або приблизно 0,15 % (в/в), або приблизно 0,20 % (в/в), або приблизно 0,25 % (в/в), або приблизно 0,30 % (в/в), або приблизно 0,35 % (в/в), або приблизно 0,40 % (в/в), або приблизно 0,45 % (в/в), або приблизно 0,50 % (в/в), або приблизно 0,55 % (в/в), або приблизно 0,60 % (в/в), або приблизно 0,65 % (в/в), або приблизно 0,70 % (в/в), або приблизно 0,75 % (в/в), або приблизно 0,80 % (в/в), або приблизно 0,85 % (в/в), або приблизно 0,90 % (в/в), або приблизно 0,95 % (в/в). Ще в інших варіантах здійснення цього винаходу, фармацевтична композиція містить буфер, що є присутнім у кількості приблизно 0,41 % (в/в), або приблизно 0,42 % (в/в), або приблизно 0,43 % (в/в), або приблизно 0,44 % (в/в). Підходящі буфери включають, серед іншого, натрію бікарбонат, дінатрію фосфат, дікалію фосфат, калію бікарбонат, натрію карбонат, калію карбонат і суміші зазначених солей. В одному з варіантів здійснення цього винаходу, буфером є натрію бікарбонат. У деяких варіантах здійснення цього винаходу, фармацевтична композиція може містити консервант, що може бути присутнім у кількості не більш ніж приблизно 5 % (в/в). У деяких інших варіантах здійснення цього винаходу, консервант присутній у кількості не більш ніж приблизно 2 % (в/в). У деяких інших варіантах здійснення цього винаходу, консервант є присутнім у кількості не більш ніж приблизно 1 % (в/в). У деяких інших варіантах здійснення цього винаходу, консервант є присутнім у кількості приблизно 0,5 % (в/в), або приблизно 1,0 % (в/в), або приблизно 1,5 % (в/в), або приблизно 2,0 % (в/в), або приблизно 2,5 % (в/в), або приблизно 3,0 % (в/в), або приблизно 3,5 % (в/в), або приблизно 4,0 % (в/в), або приблизно 4,5 % (в/в), або приблизно 5,0 % (в/в). Ще в інших варіантах здійснення цього винаходу, фармацевтична композиція містить консервант, що є присутнім у кількості приблизно 0,01 % (в/в), або приблизно 0,05 % (в/в), або приблизно 0,10 % (в/в), або приблизно 0,15 % (в/в), або приблизно 0,20 % (в/в), або приблизно 0,25 % (в/в), або приблизно 0,30 % (в/в), або приблизно 0,35 % (в/в), або приблизно 0,40 % (в/в), або приблизно 0,45 % (в/в), або приблизно 0,50 % (в/в), або приблизно 0,55 % (в/в), або приблизно 0,60 % (в/в), або приблизно 0,65 % (в/в), або приблизно 0,70 % (в/в), або приблизно 0,75 % (в/в), або приблизно 0,80 % (в/в), або приблизно 0,85 % (в/в), або приблизно 0,90 % (в/в), або приблизно 0,95 % (в/в). Підходящі консерванти включають, не обмежуючись зазначеним, парабени, такі як метилпарабен, етилпарабен, пропілпарабен, бутилпарабен, ізобутилпарабен, ізопропілпарабен, бензилпарабен, і їхні натрієві солі, бутилоксіанізол, бутилгідроксітолуол, 6 UA 110463 C2 5 10 15 20 25 30 35 40 45 50 55 60 ЕДТА, похідні, що виробляють формальдегід, натрію бензоат, калію сорбат і суміші зазначених речовин. В одному з варіантів здійснення цього винаходу, консервантом служить суміш метилпарабену й пропілпарабену. У деяких варіантах здійснення цього винаходу, фармацевтична композиція додатково містить поверхнево-активну речовину, що може бути присутньою у кількості, що не перевищує приблизно 5 % (в/в). У деяких варіантах здійснення цього винаходу, поверхнево-активна речовина є присутньою в кількості, що не перевищує приблизно 2 % (в/в). У деяких інших варіантах здійснення цього винаходу, поверхнево-активна речовина присутнє в кількості, що не перевищує приблизно 1 % (в/в). У деяких інших варіантах здійснення цього винаходу, поверхнево-активна речовина присутня в кількості приблизно 0,5 % (в/в), або приблизно 1,0 % (в/в), або приблизно 1,5 % (в/в), або приблизно 2,0 % (в/в), або приблизно 2,5 % (в/в), або приблизно 3,0 % (в/в), або приблизно 3,5 % (в/в), або приблизно 4,0 % (в/в), або приблизно 4,5 % (в/в), або приблизно 5,0 % (в/в). Ще в інших варіантах здійснення цього винаходу, фармацевтична композиція містить поверхнево-активну речовину, що є присутньою у кількості приблизно 0,01 % (в/в), або приблизно 0,05 % (в/в), або приблизно 0,10 % (в/в), або приблизно 0,15 % (в/в), або приблизно 0,20 % (в/в), або приблизно 0,25 % (в/в), або приблизно 0,30 % (в/в), або приблизно 0,35 % (в/в), або приблизно 0,40 % (в/в), або приблизно 0,45 % (в/в), або приблизно 0,50 % (в/в), або приблизно 0,55 % (в/в), або приблизно 0,60 % (в/в), або приблизно 0,65 % (в/в), або приблизно 0,70 % (в/в), або приблизно 0,75 % (в/в), або приблизно 0,80 % (в/в), або приблизно 0,85 % (в/в), або приблизно 0,90 % (в/в), або приблизно 0,95 % (в/в). Підходящі поверхнево-активні речовини включають, не обмежуючись зазначеним, натрію лаурилсульфат, натрію додецилсульфат, полісорбати (наприклад, твін 20 і твін 80), полоксамери (наприклад, полоксамер 331 і полоксамер 407), гліцерилмоноолеат і суміші зазначених речовин. В одному з варіантів здійснення цього винаходу, поверхнево-активною речовиною є натрію лаурилсульфат. У деяких варіантах здійснення цього винаходу, фармацевтична композиція додатково містить речовину, що виправляє смак лікарських засобів, що може бути присутньою у кількості, що не перевищує приблизно 60 % (в/в). У деяких інших варіантах здійснення цього винаходу, речовина, що виправляє смак лікарських засобів, є присутньою у кількості приблизно від 15 % (в/в) до приблизно 50 % (в/в). У деяких інших варіантах здійснення цього винаходу, речовина, що виправляє смак лікарських засобів, є присутньою у кількості приблизно 0,05 % (в/в), або приблизно 0,10 % (в/в), або приблизно 0,15 % (в/в), або приблизно 0,20 % (в/в), або приблизно 0,25 % (в/в), або приблизно 0,50 % (в/в), або приблизно 0,60 % (в/в), або приблизно 0,70 % (в/в), або приблизно 0,80 % (в/в), або приблизно 0,90 % (в/в), або приблизно 1 % (в/в), або приблизно 2 % (в/в), або приблизно 3 % (в/в), або приблизно 4 % (в/в), або приблизно 5 % (в/в), або приблизно 10 % (в/в), або приблизно 15 % (в/в), або приблизно 20 % (в/в), або приблизно 25 % (в/в), або приблизно 30 % (в/в), або приблизно 35 % (в/в), або приблизно 40 % (в/в), або приблизно 45 % (в/в), або приблизно 50 % (в/в), або приблизно 55 % (в/в), або приблизно 60 % (в/в). Ще в інших варіантах здійснення цього винаходу, фармацевтична композиція містить речовину, що виправляє смак лікарських засобів, що є присутньою у кількості приблизно 21 % (в/в), або приблизно 22 % (в/в), або приблизно 23 % (в/в), або приблизно 24 % (в/в), або приблизно 25 % (в/в), або приблизно 26 % (в/в), або приблизно 27 % (в/в), або приблизно 28 % (в/в), або приблизно 29 % (в/в), або приблизно 30 % (в/в), або приблизно 31 % (в/в), або приблизно 32 % (в/в), або приблизно 33 % (в/в), або приблизно 34 % (в/в), або приблизно 35 % (в/в), або приблизно 36 % (в/в), або приблизно 37 % (в/в), або приблизно 38 % (в/в), або приблизно 39 % (в/в). У деяких варіантах здійснення цього винаходу, речовина, що виправляє смак лікарських засобів, підсолоджувач. Підходящі підсолоджувачі, включають, серед іншого, сахарозу, декстрозу, фруктозу, кукурудзяний сироп з високим вмістом фруктози, мальтол, інвертований цукор, сорбіт, сахарин, мальтит, ксиліт,сахарин натрію, сукралозу, аспартам, ацесульфам калію, цикламати й суміші зазначених речовин. Підсолоджувачі, можуть вводитися до складу препарату у вигляді розчинів у воді, наприклад, 70 % розчину сорбіту у воді, або сиропів, наприклад, сиропу Луказин®. В одному з варіантів здійснення цього винаходу, підсолоджувачем є сорбіт. В іншому варіанті здійснення цього винаходу, підсолоджувачем є ацесульфам калію. Ще в іншому варіанті здійснення цього винаходу, підсолоджувачем є суміш сорбіту й ацесульфама калію. У деяких варіантах здійснення цього винаходу, речовина, що виправляє смак лікарських засобів, містить смакову речовину. Підходящі смакові речовини включають, не обмежуючись зазначеним, штучні ароматизатори/смакові системи, такі як системи зі смаком полуниці, апельсина, суміші ягід або надувна жувальна гумка (Ungerer & Co., Лінкольн Парк, Нью-Джерсі). 7 UA 110463 C2 5 10 15 20 25 30 35 40 45 50 55 60 У деяких варіантах здійснення цього винаходу, фармацевтична композиція, що є предметом цього винаходу, містить антивспінювач. Підходящі антивспінювачі включають, серед іншого, симетикон, диметикон і їхні суміші. В одному з варіантів здійснення цього винаходу, фармацевтична композиція, що є предметом цього винаходу, містить сполуку формули (I), пропіленгліколь, натрію бікарбонат і очищена вода. В іншому варіанті здійснення цього винаходу, фармацевтична композиція, що є предметом цього винаходу, містить сполуку формули (I), пропіленгліколь, ПЕГ 400, натрію бікарбонат і очищена вода. Ще в іншому варіанті здійснення цього винаходу, фармацевтична композиція, що є предметом цього винаходу, містить сполуку формули (I), пропіленгліколь, натрію бікарбонат, натрію лаурилсульфат і очищену воду. Ще в іншому варіанті здійснення цього винаходу, фармацевтична композиція, що є предметом цього винаходу, містить сполуку формули (I), пропіленгліколь, натрію бікарбонат, натрію лаурилсульфат, метилпарабен, пропілпарабен і очищену воду. Ще в іншому варіанті здійснення цього винаходу, фармацевтична композиція, що є предметом цього винаходу, містить сполуку формули (I), пропіленгліколь, натрію бікарбонат, гліцерин, метилпарабен, пропілпарабен і очищену воду. Ще в іншому варіанті здійснення цього винаходу, фармацевтична композиція, що є предметом цього винаходу, містить сполуку формули (I), пропіленгліколь, ПЕГ 400, натрію бікарбонат, гліцерин і очищену воду. Ще в іншому варіанті здійснення цього винаходу, фармацевтична композиція, що є предметом цього винаходу, містить сполуку формули (I), пропіленгліколь, натрію бікарбонат, речовину, що виправляє смак лікарського засобу, і очищену воду. В іншому варіанті здійснення цього винаходу, фармацевтична композиція, що є предметом цього винаходу, містить сполуку формули (I), пропіленгліколь, ПЕГ 400, натрію бікарбонат, речовину, що виправляє смак лікарського засобу, і очищену воду. Ще в іншому варіанті здійснення цього винаходу, фармацевтична композиція, що є предметом цього винаходу, містить сполуку формули (I), пропіленгліколь, натрію бікарбонат, натрію лаурилсульфат, речовину, що виправляє смак лікарського засобу, і очищену воду. Ще в іншому варіанті здійснення цього винаходу, фармацевтична композиція, що є предметом цього винаходу, містить сполуку формули (I), пропіленгліколь, натрію бікарбонат, натрію лаурилсульфат, метилпарабен, пропілпарабен, речовину, що виправляє смак лікарського засобу, і очищену воду. Ще в іншому варіанті здійснення цього винаходу, фармацевтична композиція, що є предметом цього винаходу, містить сполуку формули (I), пропіленгліколь, натрію бікарбонат, гліцерин, метилпарабен, пропілпарабен, речовину, що виправляє смак лікарського засобу, і очищену воду. Ще в іншому варіанті здійснення цього винаходу, фармацевтична композиція, що є предметом цього винаходу, містить сполуку формули (I), пропіленгліколь, ПЕГ 400, натрію бікарбонат, гліцерин, речовину, що виправляє смак лікарського засобу, і очищену воду. Один з варіантів здійснення цього винаходу стосується разової дози фармацевтичної композиції, що містить приблизно від 0,05 мг/мл до приблизно 25 мг/мл сполуки формули (I) або її фармацевтично прийнятної солі. В іншому варіанті здійснення цього винаходу, разова доза фармацевтичної композиції містить приблизно від 0,1 мг/мл до приблизно 3 мг/мл сполуки формули (I) або її фармацевтично прийнятної солі. У деяких варіантах здійснення цього винаходу пропонується спосіб широкомасштабного виробництва оральної рідкої фармацевтичної форми дозування сполуки формули (I) або її фармацевтично прийнятної солі, що включає етапи: (а-1) розчинення сполуки формули (I) або її фармацевтично прийнятної солі в суміші, що містить принаймні один розчинник, принаймні один буфер, і, додатково, одну або більше речовин, що виправляють смак лікарського засобу; (а-2) фільтрації розчину, отриманого на етапі (а-1), крізь фільтр підходящого розміру; (а-3) розливу відфільтрованого на етапі (а-2) розчину у підходящі посудини. У деяких варіантах здійснення цього винаходу, пропонується спосіб широкомасштабного виробництва оральної рідкої фармацевтичної форми дозування сполуки формули (I) або її фармацевтично прийнятної солі, що включає етапи: (а-1) розчинення сполуки формули (I) або її фармацевтично прийнятної солі в суміші, що містить принаймні один розчинник, принаймні одну речовину, що виправляє смак лікарського засобу, і принаймні один буфер; 8 UA 110463 C2 5 10 15 20 25 30 35 40 45 50 55 60 (а-2) фільтрації розчину, отриманого на етапі (а-1), крізь фільтр підходящого розміру; (а-3) розливу відфільтрованого на етапі (а-2) розчини у підходящі посудини. У деяких інших варіантах здійснення цього винаходу, пропонується спосіб широкомасштабного виробництва оральної рідкої фармацевтичної форми дозування сполуки формули (I) або її фармацевтично прийнятної солі, що включає етапи: (а-1) розчинення сполуки формули (I) або її фармацевтично прийнятної солі в суміші, що містить пропіленгліколь, очищену воду, ПЕГ400, сорбіт, ацесульфам калію й натрію бікарбонат; (а-2) фільтрації розчину, отриманого на етапі (а-1), крізь фільтр підходящого розміру; і (а-3) розливу відфільтрованого на етапі (а-2) розчину, у підходящі посудини. У деяких варіантах здійснення цього винаходу, сполука формули (I) на етапі (а-1) являє собою фармацевтично прийнятну сіль сполуки формули (I). Якщо в готуванні композицій, що є предметом цього винаходу, використовуються фармацевтично прийнятні солі сполуки формули (I), такі солі, переважно, є солями приєднання основи. Підходящі солі приєднання основи включають, не обмежуючись зазначеним, солі амонію, солі лужних металів, такі як солі натрію й калію, солі лужноземельних металів, такі як солі кальцію й магнію, солі органічних основ, такі як солі діциклогексиламіну, N-метил-D-глюкаміну, трет-бутиламіну, етилендіаміну, етаноламіну й холіну, і солі амінокислот, таких як аргінін, лізин і т.д. У деяких інших варіантах здійснення цього винаходу, активним інгредієнтом на етапі (а-1) є сполука формули (I) або її натрієва або калієва сіль. У деяких варіантах здійснення цього винаходу, активним інгредієнтом на етапі (а-1) є натрієва сіль формули (II) або її кристалічна форма. У деяких варіантах здійснення цього винаходу, активним інгредієнтом на етапі (а-1) є кристалічна форма сполуки формули (I). У деяких інших варіантах здійснення цього винаходу, активним інгредієнтом на етапі (а-1) є кристалічна форма фармацевтично прийнятної солі сполуки формули (I). Деякі приклади фармацевтично прийнятних солей сполуки формули (I) і їхніх кристалічних форм наведені в Патенті США № 7572784, US Publication No. 2008/0167292 і Заявці США № 61/306047, поданої 19 лютого 2010 року, які повністю включені в цей опис винаходу за допомогою посилання. У деяких варіантах здійснення цього винаходу, активним інгредієнтом на етапі (а-1) є поліморфна модифікація натрієвої солі формули (II), наприклад, форма 1 або форма 2, описані в WO 08/063525 і US 2008/0167292, які повністю включені в цей опис винаходу за допомогою посилання. Для реалізації описаних вище етапів способу використовується традиційна апаратура або встаткування. Етап розчинення (а-1), описаний вище, може здійснюватися в будь-якому традиційному апарату або встаткуванні. Приклади такого встаткування включають, не ® обмежуючись зазначеним, поверхневопривідні мішалки, такі як мішалки IKA , і портативні мішалки з нержавіючої сталі LIGHTNIN Stainless Steel Enhanced classic Line (ECL). Етап фільтрування (а-2) може здійснюватися в будь-якому традиційному апараті або встаткуванні. Приклади такого встаткування включають, не обмежуючись зазначеним, поліпропіленові фільтри з діаметром пор 10 мкм й нейлонові фільтри. Етап розливу (а-3) може здійснюватися в будь-якому традиційному апарату або встаткуванні. Фахівці в цій галузі зможуть підібрати посудину, що підходить для зберігання бажаної кількості фармацевтичної композиції й забезпечення стабільних умов зберігання. Приклади підходящих посудин включають, не обмежуючись зазначеним, посудини з темного боросилікатного скла, тип I, відповідно до Фармакопеї США, посудини з вапняно-натрієвого скла, тип III, відповідно до Фармакопеї США, і пластикові посудини з поліетилентерефталату (ПЕТ). Зазначені посудини можуть бути постачені кришками підходящого розміру, які можуть бути, додатково, безпечними для дітей. Приклади підходящих кришок включають, не обмежуючись зазначеним, пропіленові кришки 20-400 або 24-400. У деяких варіантах здійснення цього винаходу, зазначені вище кришки мають прокладки, наприклад, пористі ® поліетиленові прокладки F-217 або прокладки із плівки TRI-Foil WP F-217 (Tri-Seal Holdings Inc., Blauvelt, NY). Фахівцям зрозуміло, що розмір кришки може змінюватися залежно від розміру посудини. У деяких варіантах здійснення цього винаходу, фармацевтична композиція, що є предметом цього винаходу, може вводитися за допомогою пристрою подачі дози, включаючи, серед іншого, ложки, крапельниці, мірні ковпачки, циліндричні мірні черпачки, градуйовані піпетки й оральні шприци, які, додатково, можуть бути заздалегідь заповнені фармацевтичними композиціями, що є предметом цього винаходу. Фармацевтичні композиції, отримані у відповідності зі способом, що є предметом цього винаходу, можуть вводитися в будь-якій кількості, ефективній в лікуванні конкретного 9 UA 110463 C2 5 10 15 20 25 30 35 40 45 50 55 60 захворювання. Точна необхідна кількість є різною для різних пацієнтів, і залежить від виду, віку й загального стану пацієнта, ваги інфекції, конкретного засобу і його способу введення й т.п. Фармацевтичні композиції, переважно, уводяться до складу оральных лікарських форм для простоти введення й однорідності дозування. Вираз «одинична лікарська форма», використовувана в цьому описі винаходу, означає фізично окрему одиницю засобу, що підходить для лікування пацієнта. Треба, однак, розуміти, що загальна денна доза фармацевтичних композицій, що є предметом цього винаходу, буде визначатися лікарем за результатами ретельної медичної оцінки. Конкретний рівень ефективних доз для конкретного пацієнта або організму залежить від різноманітних факторів, включаючи захворювання, що підлягає лікуванню, і важкість такого захворювання; активність конкретної використовуваної сполуки; конкретну використовувану сполуку; вік, вагу тіла, загальний стан здоров'я, стать й характер харчування пацієнта; час введення, шлях введення, швидкість виведення конкретної використовуваної сполуки; тривалість лікування; ліки, використовувані в комбінації або одночасно з конкретною використовуваною сполукою, і подібні фактори, добре відомі медикам. Термін «пацієнт», використовуваний у цьому описі винаходу, означає тварину, переважно, ссавця, ще більш переважно - людину. У певних варіантах здійснення цього винаходу, сполуки, що є предметом цього винаходу, можуть уводитися орально в загальній дозі на рівні приблизно від 1,0 мг/кг до приблизно 7,0 мг/кг, переважно, приблизно від 1,4 мг/кг до приблизно 6,2 мг/кг ваги тіла пацієнта в день, що вводиться у вигляді однієї або декількох доз протягом дня для одержання бажаного терапевтичного ефекту. Фізичну й хімічну стійкість оральної лікарської форми можна випробувати традиційним способом, наприклад, по зовнішньому вигляду або з використанням кількісного аналізу сполуки формули (I) або її фармацевтично прийнятної солі, і визначення продуктів розкладання після зберігання при різних температурах при різних значеннях тривалості зберігання. Фармакологічна композиція має фармакологічні властивості, що роблять її придатною для лікування пацієнтів, що страждають захворюваннями, розладами або станами, обумовленими активністю кіназ Aurora, зокрема кіназ Aurora А и В. Придушення активності кіназ Aurora, зокрема, кіназ Aurora А и В, може використовуватися в лікуванні ряду захворювань, обумовлених виживаністю клітин, їхньою проліферацією й міграцією, включаючи хронічні запальні проліферативні захворювання, наприклад, псоріаз і ревматоїдний артрит; проліферативні захворювання очей, наприклад, діабетичну ретинопатію, доброякісні проліферативні захворювання, наприклад, гемангіоми; і рак. Інший предмет цього винаходу стосується способу лікування рака, що полягає у введенні терапевтично ефективної кількості фармацевтичної композиції, що є предметом цього винаходу, пацієнтові, що потребує такого лікування. У деяких варіантах здійснення цього винаходу, рак є солідною пухлиною. Не вичерпний список прикладів солідних пухлин, які можна лікувати способами, що є предметом цього винаходу, включає рак підшлункової залози; рак сечового міхура; рак ободової і прямої кишки; рак молочної залози, включаючи метастатичний рак молочної залози; рак передміхурової залози, включаючи залежний від андрогену й незалежний від андрогену рак передміхурової залози; рак нирок, включаючи, наприклад, метастатичну нирково-клітинну карциному; гепатоцелюлярний рак; рак легенів, включаючи, наприклад, недрібноклітинний рак легенів, бронхоальвеолярну карциному й аденокарциному легенів; рак яєчника, включаючи, наприклад, епітеліальний або первинний очеревинний рак, що прогресує; рак шийки матки; рак шлунку; рак стравоходу; рак голови й шиї, включаючи, наприклад, пласкоклітинну карциному в області голови й шиї; меланому; нейроендокринний рак, включаючи метастатичні нейроендокринні пухлини; пухлини мозку, включаючи, наприклад, гліому, анапластичну олігодендрогліому, мультиформну гліобластому в дорослих і анапластичну астроцитому у дорослих; рак костей і саркому м'яких тканин. У деяких інших варіантах здійснення цього винаходу, рак є гематологічним злоякісним захворюванням. Не вичерпний список прикладів гематологічних злоякісних захворювань включає гостру мієлоїдну лейкемію; хронічну гранулоцитну лейкемію, включаючи прогресуючу хронічну гранулоцитну лейкемію й бластный криз хронічної гранулоцитної лейкемії; гострий лімфобластний лейкоз; хронічний лімфолейкоз; хворобу Ходжкіна; не-ходжкінскую лімфому, включаючи фолікулярну лімфому та лімфому із клітин мантійной зони; В-клітинну лімфому; Тклітинну лімфому множинну мієлому мікроглобулінемію Вальнедстрема; мієлодиспластичні синдроми, включаючи рефрактерну анемію, рефрактерну анемію з кільцеподібними сидеробластами, рефрактерную анемію з надлишком бластів (РАИБ) і рефрактерну анемію з надлишком бластів на стадії трансформації ( РАИБ-Т); і мієлопроліферативні синдроми. Ще в інших варіантах здійснення цього винаходу, рак вибирається із групи, що містить рак прямої і ободової кишки, рак яєчників, рак молочної залози, рак шлунку, рак передміхурової 10 UA 110463 C2 5 10 15 20 25 30 35 40 45 залози й рак підшлункової залози. Ще в інших варіантах здійснення цього винаходу, рак вибирається із групи, що містить нейробластому або гострий лімфобластний лейкоз. У певних варіантах здійснення цього винаходу, раком є нейробластома у дітей або гострий лімфобластний лейкоз дітей. Фармацевтична композиція може використовуватися в складі монотерапії для лікування захворювання, розладу або симптому, і може використовуватися в комбінованій терапії, при якій використання сполуки або композиції (терапевтичного засобу), що є предметом цього винаходу, комбінується з використанням одного або декількох терапевтичних засобів для лікування розладів, симптомів і захворювань такого ж і/або іншого типу. Комбінована терапія включає одночасне або послідовне введення терапевтичних засобів. Як варіант, терапевтичні засоби можуть бути об'єднані в одній композиції, що вводиться пацієнтові. В одному з варіантів здійснення цього винаходу, фармацевтична композиція, що є предметом цього винаходу, використовується в комбінації з іншими терапевтичними засобами, такими як інгібітори кіназ, особливо, серин/треонін протеїнкіназ. У деяких варіантах здійснення цього винаходу, фармацевтична композиція, що є предметом цього винаходу, уводиться в сполученні з терапевтичним засобом, обраним із групи, що містить цитотоксичні засоби, засоби для радіотерапії й засоби для імунотерапії. Само собою зрозуміло, що можуть створюватися й інші комбінації, залишаючись при цьому в рамках цього винаходу. Для більш повного розуміння цього винаходу представлені наступні приклади, що показують як виготовити або випробувати конкретні композиції. Такі прикладі не слід розглядати як обмежуючі обсяг цього винаходу будь-яким чином. Пприклади Форму 1 або форму 2 поліморфного 4-{[9-хлор-7-(2-фтор-6-метоксіфеніл)-5H-піримідо[5,4d][2] бензазепін-2-іл]аміно}- 2-метоксібензоата натрію формули (II) можна приготувати за допомогою способів синтезу, описаних в WO 08/063525 і US 08/0167292, які повністю включені в цей опис винаходу за допомогою посилання. Хоча в прикладах, представлених у цьому описі винаходу, використовувалася форма 2 4-{[9-хлор-7-(2-фтор- 6-метоксіфеніл)-5H-піримідо[5,4d][2]бензазепін-2-іл]аміно}-2-метоксібензоата натрію формули (II), варто розуміти, що форма 1 поліморфної солі формули (II) або будь-яка інша форма поліморфної солі формули (II) може використовуватися для одержання фармацевтичної композиції, що є предметом цього винаходу. Додаткові приклади різних форм поліморфної солі формули (II) наведені в Заявці США № 61/306047, поданої 19 лютого 2010 року, повністю включеної в цей опис винаходу за допомогою посилання. Приклад 1: Партія обсягом 25,0 кг була виготовлена в такий спосіб. Форму 2 4-{[9- хлор-7-(2фтор-6-метоксіфеніл)-5H-піримідо[5,4-d][2]бензазепін-2-іл]аміно}-2-метоксібензоата натрію формули (II) (0,116 кг) просівали й солюбілізували поліетиленгліколем 400 (7,5 кг) і пропіленгліколем (7,5 кг) з одержанням суміші № 1, використовуючи мішалку фірми IKA, модель RW-20, із пропелером суднового типу. Натрію бікарбонат (0,105 кг), 70 % розчин сорбіту у воді (7,5 кг) і очищену воду (2,285 кг) змішували окремо з одержанням суміші № 2, використовуючи мішалку фірми IKA, модель RW-20, із пропелером суднового типу. На останньому етапі змішування, суміші № 1 і № 2 змішували одна з одною із одержанням гомогенного розчину, використовуючи мішалку фірми IKA, модель RW-20, із пропелером суднового типу. Цей розчин потім фільтрували крізь поліпропіленовий фільтр із діаметром пор 10 мкм і зберігали в скляних банках ємністю 4 л із прокладкою з поліетилентерефталата (ПЕТ) для зберігання нефасованої продукції. Нефасований розчин потім розливали в посудини з темного боросилікатного скла типу I, відповідно до Фармакопеї США, ємністю 20 мл з білими пропіленовими (20-400) кришками із прокладками з пористого поліетилену F217. Склад партії представлений у Таблиці 1. Таблиця 1 Фармацевтична композиція Матеріал Сполука формули (II) Поліетиленгліколь 400 Сорбіт (уводиться у вигляді 70 % розчину у воді) Пропіленгліколь Натрію бікарбонат Очищена вода Функція Лікарська речовина Розчинник Речовина, що виправляє смак лікарського засобу Розчинник Буфер Розчинник 11 Склад (%, в/в) 0,47 30,0 30,0 30,0 0,42 9,11 UA 110463 C2 Приклад 2: Фармацевтична композиція, представлена нижче в Таблиці 2, була отримана з використанням процедур, у цілому, аналогічних описаним у Прикладі 1. Таблиця 2 Фармацевтична композиція Матеріал Сполука формули (II) Поліетиленгліколь Натрію бікарбонат Натрію лаурилсульфат Метилпарабен Пропілпарабен Очищена вода Функція Лікарська речовина Розчинник Буфер Поверхнево-активна речовина Консервант Консервант Розчинник Склад (%, в/в) 0,47 50,0 0,42 0,50 0,18 0,02 48,41 5 Приклад 3: Фармацевтична композиція, представлена нижче в Таблиці 3, була отримана з використанням процедур, у цілому, аналогічних описаним у Прикладі 1. Таблиця 3 Фармацевтична композиція Матеріал Сполука формули (II) Гліцерин Пропіленгліколь Натрію бікарбонат Сорбіт (уводиться у вигляді 70% розчину у воді) Метилпарабен Пропілпарабен Очищена вода 10 Функція Лікарська речовина Розчинник Розчинник Буфер Речовина, що виправляє смак лікарського засобу Консервант Консервант Розчинник Склад (%, в/в) 0,47 30,0 30,0 0,42 30,0 0,18 0,02 8,91 Приклад 4: Фармацевтична композиція, представлена нижче в Таблиці 4, була отримана з використанням процедур, у цілому, аналогічних описаним у Прикладі 1. Таблиця 4 Фармацевтична композиція Матеріал Сполука формули (II) Пропіленгліколь Натрію лаурилсульфат Натрію бікарбонат Мальтит Метилпарабен Пропілпарабен Очищена вода 15 Функція Лікарська речовина Розчинник Поверхнево-активна речовина Буфер Речовина, що виправляє смак лікарського засобу Консервант Консервант Розчинник Склад (%, в/в) 0,47 50,0 0,50 0,42 30,0 0,18 0,02 18,41 Приклад 5: Фармацевтична композиція, представлена нижче в Таблиці 5, була отримана з використанням процедур, у цілому, аналогічних описаним у Прикладі 1. 12 UA 110463 C2 Таблиця 5 Фармацевтична композиція Матеріал Сполука формули (II) Пропіленгліколь Натрію лаурилсульфат Натрію бікарбонат Ксиліт Метилпарабен Пропілпарабен Очищена вода Функція Лікарська речовина Розчинник Поверхнево-активна речовина Буфер Речовина, що виправляє смак лікарського засобу Консервант Консервант Розчинник Склад (%, в/в) 0,47 50,0 0,50 0,42 30,0 0,18 0,02 18,41 Приклад 6: Фармацевтична композиція, представлена нижче в Таблиці 6, була отримана з використанням процедур, у цілому, аналогічних описаним у Прикладі 1. 5 Таблиця 6 Фармацевтична композиція Матеріал Сполука формули (II) Пропіленгліколь Гліцерин Натрію бікарбонат Поліетиленгліколь 400 Ацесульфам калію Очищена вода Функція Лікарська речовина Розчинник Розчинник Буфер Розчинник Речовина, що виправляє смак лікарського засобу Розчинник Склад (%, в/в) 0,47 15,0 30,0 0,42 15,0 0,70 38,41 Приклад 7: Фармацевтична композиція, представлена нижче в Таблиці 7, була отримана з використанням процедур, у цілому, аналогічних описаним у Прикладі 1. Таблиця 7 Фармацевтична композиція Матеріал Сполука формули (II) Пропіленгліколь Гліцерин Натрію бікарбонат Поліетиленгліколь 400 Сорбіт Очищена вода Функція Лікарська речовина Розчинник Розчинник Буфер Розчинник Речовина, що виправляє смак лікарського засобу Розчинник Склад (%, в/в) 0,47 15,0 30,0 0,42 15,0 20,0 19,11 10 Приклад 8: Фармацевтична композиція, представлена нижче в Таблиці 8, була отримана з використанням процедур, у цілому, аналогічних описаним у Прикладі 1. 13 UA 110463 C2 Таблиця 8 Фармацевтична композиція Матеріал Сполука формули (II) Пропіленгліколь Гліцерин Натрію бікарбонат Поліетиленгліколь 400 Сорбіт Функція Лікарська речовина Розчинник Розчинник Буфер Розчинник Речовина, що виправляє смак лікарського засобу Речовина, що виправляє смак лікарського засобу Речовина, що виправляє смак лікарського засобу Розчинник Ацесульфам калію Штучний аромат/смак надувної жувальної гумки Очищена вода 5 10 15 20 25 Склад (%, в/в) 0,47 15,0 30,0 0,42 15,0 21,0 0,40 0,35 17,36 Приклад 9: Способи аналізу. Звернено-Фазова ВЕРХ із використанням колонки З18 при кімнатній температурі й детектуванням в УФ області при 312 нм. Рухлива фаза: Градієнтна програма починається з 75 % рухливої фази А (0,1 % розчин трифтороцтової кислоти у воді) і 25 % рухливої фази В (0,1 % розчин трифтороцтової кислоти в ацетонітрилі) і закінчується на 15 % рухливої фази А через 42 хвилини. Випробуваний зразок виготовляють розчиненням порції фармацевтичної композиції в розріджувачі, що представляє собою суміш ацетонітрилу й води в співвідношенні (об'ємному) 50:50. Наявність сполуки формули (I) у випробуваному зразку підтверджується шляхом порівняння часу втримання зразка згодом утримання стандарту порівняння. Використовуваним стандартом порівняння служить відома кількість сполуки формули (II) відомого ступеня чистоти. Стандарт порівняння виготовляють розчиненням сполуки формули (II) у суміші ацетонітрилу й води в співвідношенні (об'ємному) 50:50. Кількість сполуки формули (I) у зразку розраховують по площі піку при порівнянні у ваговому співвідношенні, включаючи перерахування значень молекулярної ваги, із площею піку стандарту порівняння. Перерахування значень молекулярної ваги враховує відношення молекулярної ваги сполуки формули (I) до молекулярної ваги сполуки формули (II). Як варіант, використовуваним стандартом порівняння може бути відома кількість сполуки формули (I) відомого ступеня чистоти, що може бути приготовлене в таких же умовах, як і стандарт порівняння сполуки формули (II). Межа кількісного визначення таким способом становить 0,05 %, а розрахункова межа детектування - 0,02 %. Хоча в цьому описі винаходу наведений ряд варіантів здійснення цього винаходу, очевидно, що ряд наведених прикладів можна змінити для демонстрації інших варіантів здійснення цього винаходу, у яких використовуються сполуки й способи, що є предметом цього винаходу. Тому обсяг цього винаходу повинен визначатися формулою винаходу, що додається, а не конкретними варіантами здійснення цього винаходу, представленими у вигляді прикладів. ФОРМУЛА ВИНАХОДУ 30 1. Рідка фармацевтична композиція, що містить натрієву сіль сполуки формули (IІ) Cl O H N N N F 35 ONa+ N O O (ІІ) або її кристалічну форму, яка відрізняється тим, що фармацевтична композиція містить від 0,10 до 2 % (мас./мас.) сполуки формули (ІІ) або її кристалічної форми; від 0,20 до 3 % (мас./мас.) натрію бікарбонату; і суміш розчинників пропіленгліколю, очищеної води, ПЕГ400 і 14 UA 110463 C2 5 10 15 20 25 30 35 40 45 50 необов'язково гліцерину; де розчинник містить менше ніж 50 % очищеної води, і композиція містить щонайменше 15 % (мас./мас.) пропіленгліколю і щонайменше 15 % (мас./мас.) ПЕГ400. 2. Фармацевтична композиція за п. 1, яка відрізняється тим, що сполука формули (II) присутня у кількості від 0,40 % (мас./мас.) до 0,50 % (мас./мас.). 3. Фармацевтична композиція за п. 1, яка відрізняється тим, що розчинник присутній у кількості 97, 98 або 99 % (мас./мас.). 4. Фармацевтична композиція за п. 1, яка відрізняється тим, що розчинник присутній у кількості 68, 69 або 70 % (мас./мас.). 5. Фармацевтична композиція за п. 1, яка відрізняється тим, що розчинник являє собою суміш пропіленгліколю, гліцерину, ПЕГ400 і очищеної води. 6. Фармацевтична композиція за п. 1, яка відрізняється тим, що розчинник є сумішшю ПЕГ400, пропіленгліколю та очищеної води. 7. Фармацевтична композиція за п. 1, яка відрізняється тим, що натрію бікарбонат присутній у кількості 0,42 % (мас./мас.). 8. Фармацевтична композиція за п. 1, яка додатково включає консервант, присутній в кількості не більше 1 % (мас./мас.), яка відрізняється тим, що консервант вибирають з групи, яка складається з метилпарабену, пропілпарабену і їх сумішей. 9. Фармацевтична композиція за п. 8, яка відрізняється тим, що консервант присутній в кількості 0,2 % (мас./мас.). 10. Фармацевтична композиція за п. 1, яка додатково включає поверхнево-активну речовину, присутню в кількості не більше 1 % (мас./мас.), яка відрізняється тим, що поверхневоактивною речовиною є натрію лаурилсульфат. 11. Фармацевтична композиція за п. 10, яка відрізняється тим, що поверхнево-активна речовина присутня в кількості 0,5 % (мас./мас.). 12. Фармацевтична композиція за п. 1, яка додатково включає речовину, що виправляє смак лікарського засобу, яка відрізняється тим, що речовина, яка виправляє смак лікарського засобу, вибрана із групи, що складається з сорбіту, мальтиту, сахарози, ацесульфаму калію і їх сумішей. 13. Фармацевтична композиція за п. 12, яка відрізняється тим, що речовиною, яка виправляє смак лікарського засобу, є сорбіт. 14. Спосіб лікування раку, що включає введення терапевтично ефективної кількості фармацевтичної композиції за п. 1. 15. Спосіб за п. 14, який відрізняється тим, що рак вибраний з групи, що включає рак ободової і прямої кишки, рак яєчників, рак молочної залози, рак шлунка, рак передміхурової залози, рак підшлункової залози, нейробластому і гострий лімфобластний лейкоз. 16. Фармацевтична композиція за п. 12, яка відрізняється тим, що речовиною, яка виправляє смак лікарського засобу, є ацесульфам калію. 17. Фармацевтична композиція за п. 1, яка відрізняється тим, що фармацевтична композиція містить від 0,40 % (мас./мас.) до приблизно 0,50 % (мас./мас.) сполуки формули (II) або її кристалічної форми; і 0,42 % (мас./мас.) натрію бікрабонату. 18. Фармацевтична композиція за п. 17, яка додатково включає речовину, яка виправляє смак лікарського засобу. 19. Фармацевтична композиція за п. 1, яка відрізняється тим, що фармацевтична композиція містить від 0,40 (мас./мас.) до приблизно 0,50 % (мас./мас.) сполуки формули (II) або її кристалічної форми; 0,42 % (мас./мас.) натрію бікрабонату; ацесульфам калію; ароматизатор; і в якій розчинник присутній у кількості 97, 98 або 99 % (мас./мас.) і являє собою суміш пропіленгліколю, гліцерину, ПЕГ400 і очищеної води. 20. Фармацевтична композиція за п. 1, яка відрізняється тим, що фармацевтична композиція містить від 0,40 (мас./мас.) до приблизно 0,50 % (мас./мас.) сполуки формули (II) або її кристалічної форми; 0,42 % (мас./мас.) натрію бікрабонату; сорбіт; і в якій розчинник присутній у кількості 68, 69 або 70 % (мас./мас.) і являє собою суміш пропіленгліколю, ПЕГ400 і очищеної води. Комп’ютерна верстка Д. Шеверун Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 15
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical compositions for the treatment of cancer and other diseases or disorders
Автори англійськоюRamanan, Vijayalakshmi, Tobias, Irene Sophie, Verwijs, Dauntel Specht, Skwierczynski, Raymond D.
Автори російськоюРаманан Виджаялакшми, Тобиас Арин Софи, Вервейс Даунтел Спехт, Скверчински Реймонд Д.
МПК / Мітки
МПК: A61K 31/55, A61K 47/32, A61P 35/00, A61K 47/10, A61K 9/08
Мітки: лікування, інших, кислоти, стану, композиція, раку, 4-{[9-хлор-7-(2-фтор-6-метоксифеніл)-5н-піримідо[5,4-d][2]бензазепін-2-іл]аміно}-2-метоксибензойної, порушень, здоров'я, фармацевтична, захворювань
Код посилання
<a href="https://ua.patents.su/17-110463-farmacevtichna-kompoziciya-4-9-khlor-7-2-ftor-6-metoksifenil-5n-pirimido54-d2benzazepin-2-ilamino-2-metoksibenzojjno-kisloti-dlya-likuvannya-raku-jj-inshikh-zakhvoryuvan-i-porushen.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція 4-{[9-хлор-7-(2-фтор-6-метоксифеніл)-5н-піримідо[5,4-d][2]бензазепін-2-іл]аміно}-2-метоксибензойної кислоти для лікування раку й інших захворювань і порушень стану здоров’я</a>
Попередній патент: Спосіб і пристрій для відстеження вмісту
Наступний патент: Установка для випробувань будівельних матеріалів на міцність при малих граничних навантаженнях
Випадковий патент: Газорозподільний механізм двигуна внутрішнього згоряння












