Спосіб визначення гомоцистеїну в пробі та аналітичний набір для його здійснення
Текст
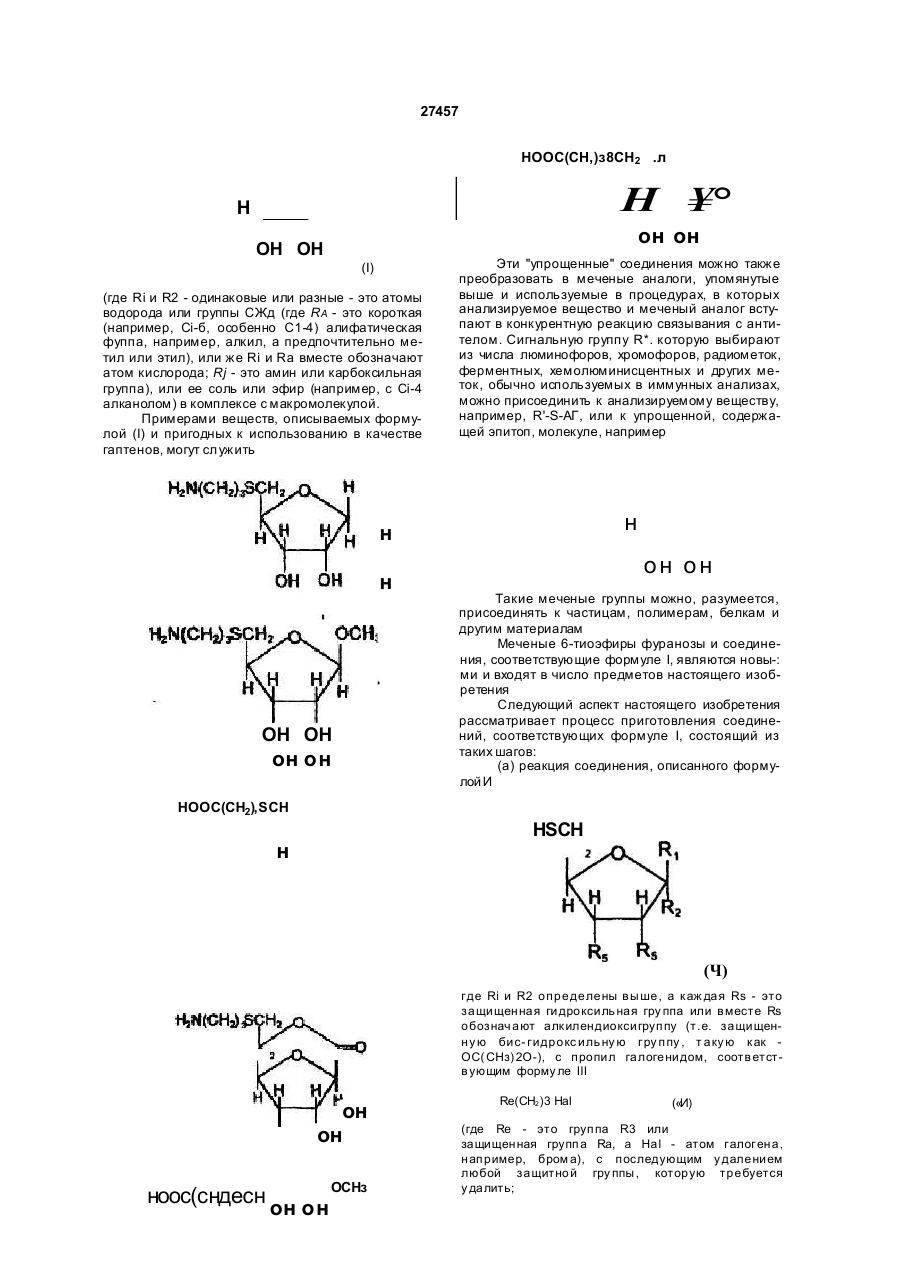
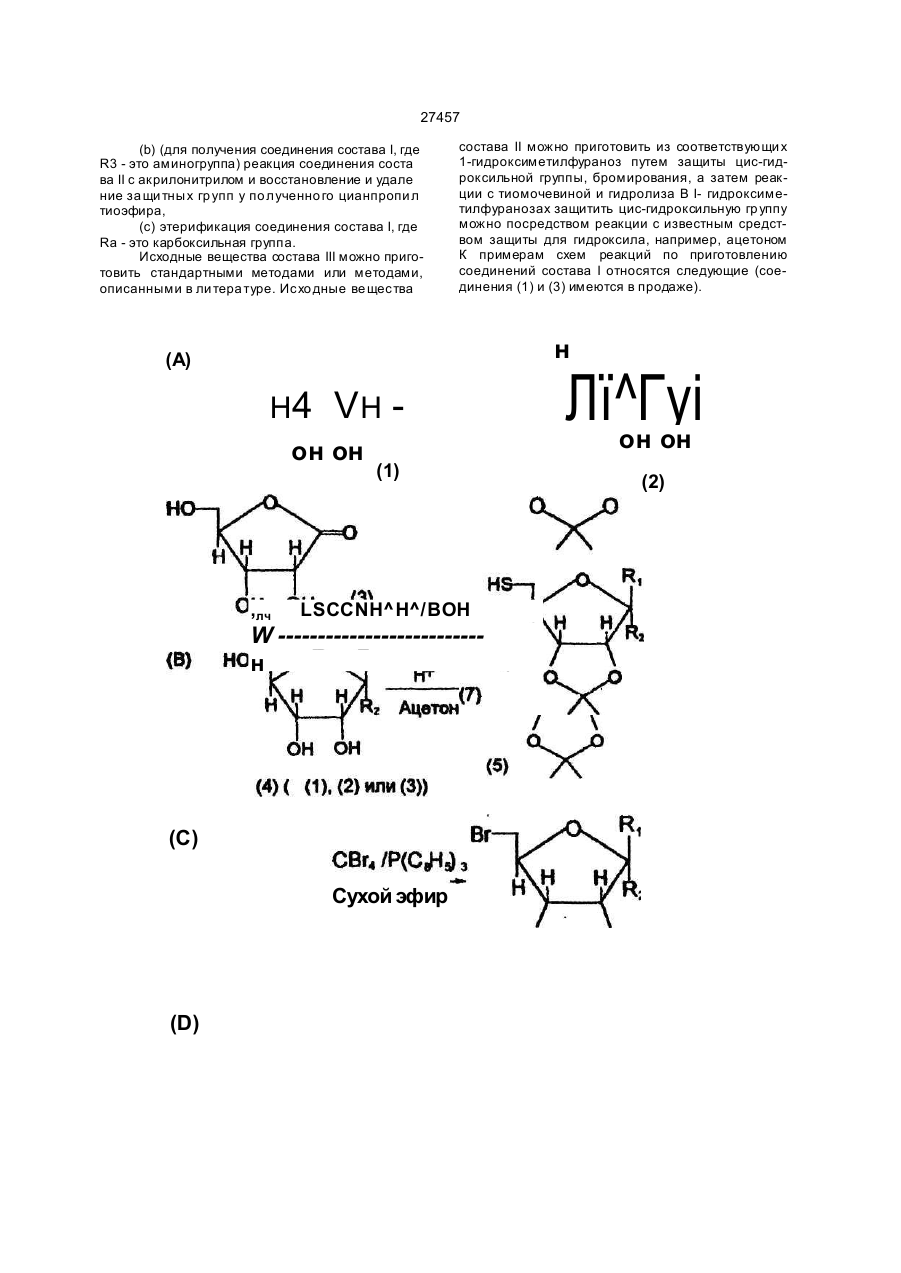
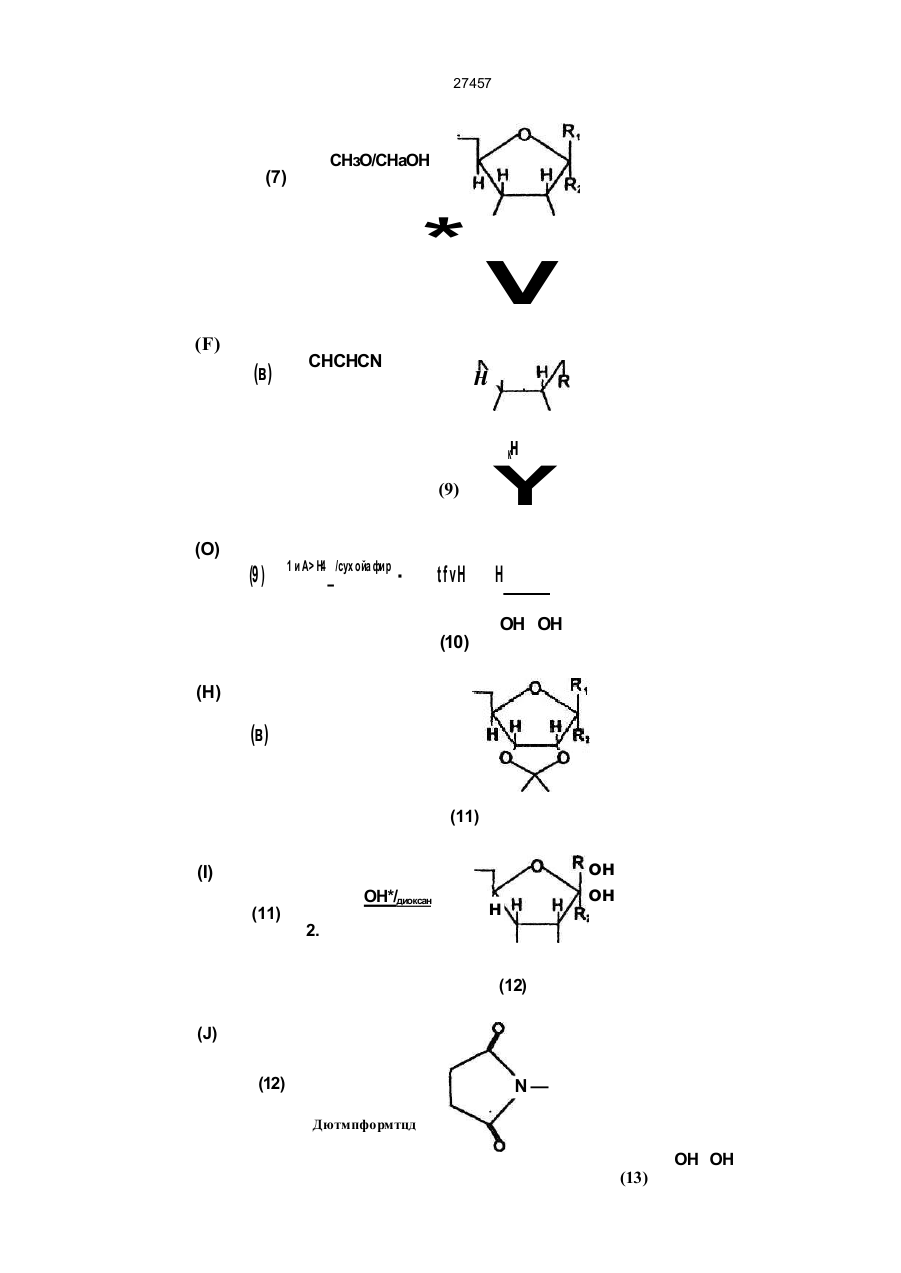
1 Способ определения гомоцистеина в пробе, включающий контактиро вание пробы с фермен том S-аденозилгемоцистеингидролаэой (SAH-аза) в присутствии субстра та, о тлично го о т гомоцис теина, и оценку аналита, отличающийся тем, что в качестве аналита используют немеченный аналит, выбранный из аденозина, аналога аденозина и S-а денозилгомоцистеина (SAH ), и оцени вают аналит ме тодами, о тли чными о т хрома тогра фических. 2. Способ по п. 1, отличающийся тем, что пробу после завер шения фермента ти вной реакции с SAH-азой контактир уют с ан тите лом к аналиту в присутствии гаптена для анти тела , о тлично го от указанного немеченного аналита, при этом оценку анали та о существля ют п о ко ли честву гап тен а, связанного или несвязанного с антителом. 3. Способ по п. 2, отличающийся тем, что гаптен представляет собой полигаптен. 4. Способ по п. 2, отличающийся тем, что гаптен представляет собой меченую молекулу, имеющую эпитопную структурную единицу, аналогичную эпитопной структурной единице немеченного ана лита. 5. Способ по любом у из п унк то в 2-4, отличаю щийся тем, что антитело представляет собой моноклональное антитело. 6. Способ по любом у из п унк то в 2-5, отличаю щийся тем, что ан тите ло связано с носи телемматрицей. 7. Способ по п. 1, отличающийся тем, что пробу после за вер шения фермен та тивно й реакции с участием SAH-азы контактируют со вторым фер ментом, который превращает указанный аналит, при этом оценк у указанно го аналита о суще ств ляют по количеству субстрата второго фермента, отличного от указанного аналита или образовавшегося продукта превращения аналита. 8. Способ по л. 1 или 7 , отл ичающийся тем, что аналит представляет собой аденозин. 9. Способ по п 7, отличающийся тем, что аденозинпревращающий фермент представляет собой аденозинкиназу. 10. Способ по п. 7, отл ичающийся тем, что аде нозин подвергают ферментативном у превра ще нию в присутствии аденозинкинаэы и АТФ не ме нее 1 мин., затем добавляют люциферин и люциферазу и регистрируют генерируемый свет. 11. Способ по п. 7, о тли чающийся тем , что а денозинлревращающий фермент представляет со бой аденозиндезаминазу. 12. Способ по п. 7, отл ичающийся тем, что аде нозин оценивают в присутствии аденозиндезаминазы, нуклеозидфосфорилазы, ксантиноксидазы и лероксидазы по по. лощению УФ 13. Способ по любому из п унк тов 1-7, отличаю щийся тем, что аналит представляет собой S-аденозилгомоцистеин. 14 Способ по п. 1, отличающийся тем, что оценку осуществляют в присутствии меченого 6тиоэфира фуранозы или SAH, меченого хромофором или флуорофором. 15. Способ по п. 1, отличающийся тем, что пробу после завер шения ферментати вной реакции с участием SAH-азы контактируют с меченым флуо рофором SAH или меченым флуорофором 6тиоэфиром фуранозы, затем добавляют моноклональное антитело к SAH, при этом связанное или несвязанное с антителом меченое флуорофором соединение оценивают по поляризации флуорес ценции. 16. Способ по п. 1, отличающийся тем, что пробу после завер шения ферментати вной реакции с участием SAH -азы контактир уют с меченым SAH или меченым 6-тиоэфиром фуранозы, за тем до бавляют моноклонал«-';ое антитело к SAH, связан ное с матрицей -носи телем , ма трицу-носи тель с антителами промывают, связанное с антителами меченое соединение оценивают фотометрически. 17. Способ по п. 16, отличающийся тем, что мет ку связанного с антителами меченого соединения подвергают ферментативной реакции для генери рования хромофора и оценивают его фотометри чески. СМ О о " Ю N . СМ 27457 18. Способ по п 3, отличающийся тем, что оцен ку осуществляют по осаждению или агглютинации конъюгатов антитело-полигэптен. 19. Способ по п. 2, о тличающийся тем, что в ка честве гаптена используют соединение формулы (I) или его соль, или сложный эфир n,(CHjbSCH2 он он (I) где Ri и Яг одинаковые и обозначают атомы водорода или OR4 группы, или вместе атом кислорода, или разные и обозначают атом водорода и OR4, R4 обозначает Сі-в-алифатическую группу, a Rs амино- или карбоксигруппу. 20. Способ по л. 4, о тличающийся тем, что в ка честве гап тена использ уют меченый 6-тиоэфир фуранозы, при этом меченая часть представляет собой хромофор или флуорофор, или радиоактив ный атом, тиоэфирная часть представляет собой триметилентиогруппу. 21. Способ по л. 20, отличающийся тем, что в ка честве меченого тиоэф'ира используют соедине ние формулы (I) по п. 19. 22. Способ по п. 8, отли чающийся тем, что SAHазу используют в инактивированной форме, при этом активиро вание проводят восстанавливаю щим агентом. 23. Способ по п. 1, отличающийся тем, что проба представляет собой пробу крови, плазмы или мо чи, предварительно обработанную восстанавли вающим агентом. 24. Способ по п. 1, отличающийся тем, что оцен ку аналита осуществляют фотометрически. 25. С пособ по п . 2 4 , о тли чающи йся тем , что оценку осуществляют спектрофотометрически или колориметрически. 26. С пособ по п . 2 4 , о тли чающи йся тем , что оценку осуществляют турбидиметрически или пофелометрически. 27. С пособ по п . 2 4 , о тли чающи йся тем , что оценку осуществляют по поляризации флуорес ценции. 28. Аналитический набор для определения гомоцистеина в пробе по п. 1, включающий SAH-азу и субстрат, отличающийся тем, что дополнительно Настоящее изобретение относится к анали- * зу клинических проб на гомоцистеин. Гомоцистеин - это промежуточная аминокислота, которая образуется, когда метионин перерабатывается в цистеин. Обычно гомоцистеин, образующийся в организме, быстро преобразуется одним из двух способов: (1) конденсируется с серином, образуя цистатион, или (2) превращается в метионин, - и его содержание (и содержание его окисленной формы гомоцистина) в живом ор содержит агент, образующий сигнал, а в качестве субстрата - аденозин или аналог аденозина, или S - аденозилгомоцис-гин. 29. Набор по п . 2 8, о тлича ющий ся тем , что до полнительно содержит средства для оценки сигна ла. 30. Набор по п. 28, отличающийся тем, что в ка честве агента, образующего сигнал, содержит ме ченый SAH и необязательно связанное с матри цей-носителем антитело к SAH. 31. Набор по п. 29 и 30, отличающийся тем, что в качестве средства для оценки сигнала содержит средство для фотометрической оценки меченого SAH или его производного. 32. Набор по п. 28, отличающийся тем, что в ка честве субстрата содержит аденозин. 33. Набор по п . 3 2, о тлича ющий ся тем , что до полнительно содержит связанное с матрицей ан титело к SAH и полигаптен для антитела к SAH. 34. Набор по любому из пункто в 29-32, о тличаю щи й ся тем , что сре дство для о ценки си гн ала представляет средство для фотометрического оп ределения агглютинации или преципитации комп лексов антитело-полигаптен. 35. Набор по п, 29, отличающийся тем, что в ка честве субстрата содержит аденозин, в качестве агента, образующего сигнал, аденозинпревращающий фермент, о тличный от SAH-азы, а средство для оценки сигнала представляет собой средство для генерирования фотометрически определяемо го ответа. 36. Набор по п . 3 5, о тлича ющий ся тем , что до полнительно содержит ко-субстра т к аденозинпревращающему ферменту. 37. Набор по п. 35, отли чающийся тем, что фер мент представляет собой аденозинкиназу, а сред ство для генери рования о тве та со держит АТФ, люциферин и люциферазу. 38. Набор по п. 35, отличающийся тем, что фер мент представляет собой аденозиндезаминазу, а средство для генерирования ответа содержит нуклеозидфосфорилазу, ксантиноксидазу и пероксидазу. 39. Набор по п . 2 8, о тлича ющий ся тем , что со держит неактивную SAH-азу, а в качестве актива тора - восстанавливающий агент. 40. Набор по п . 3 9, о тлича ющий ся тем , что со держит дитиотреитол в кислой среде. Приоритет по пп. 1, 7, 8, 11, 12, 13, 23, 24, 25, 27, 2 8 ,29 -2 2 .01 .92 . Приоритет по пп. 30, 31 - 10.02.92. Приоритет по остальным пунктам - 22.01.93. ганизме при нормальных условиях пренебрежимо мало. Однако в некоторых случаях содержание гомоцистеина в биологических пробах может иметь клиническое значение, так как гомоцистеин играет важную роль в сложной совокупности процессов, из которых складывается обмен аминокислоты сульфгидрила, и его накопление может свидетельствовать о различных нарушениях в ходе этих процессов, в том числе о некоторых врожденных 27457 дефектах обмена. Так, например, гомоцистинурия (ненормально высокое содержание гомоцистеина в моче) известна как расстройство аминокислотного обмена, возникающее в результате недостатка ферментов цистатион р синтетазы или метиптетрагидрофолиевой кислоты метилтрансферазы (которая катализирует метилирование гомоцистеина и превращение его в метионин). Обмен аминокислоты сульфгидрила тесно связан с обменом фолиевой кислоты и витамина Ві2 (кобаламина), которые действуют как субстраты или ко-факторы в различных преобразованиях, происходящих в рамках обмена сульфгидрила. Поэтому предложено считать накопление гомоцистеина свидетельством дисфункции кобаламина или фолат-зависимых ферментов или же других расстройств или заболеваний, связанных с обменом кобаламина или фолиевой кислоты. Более того, поскольку превращение гомоцистеина в метионин основано на реакции, в которой в качестве донора метила выступает S-метил тетрагидрофолат, на обмен гомоцистеина могут оказать влияние антифолатные препараты, например, метотрексат, используемые для борьбы с другими расстройствами, такими как рак. Поэтому предложено использовать контроль над содержанием гомоцистеина при лечении злокачественных заболеваний антифолатными препаратами. В последнее время повышение уровня гомоцистеина в крови стали соотносить с развитием атеросклероза (см. Clarke и др., New Eng. J. Med. 324: 1149-1155 (1991)), и даже умеренная гомоцистеинемия рассматривается теперь как фактор риска сердечно-сосудистых забрлеваний. Поэтому измерение уровней гомоцистеина в крови, или в плазме крови, или в жидкой части лимфы также важно для диагностики и лечения сосудистых заболеваний. Хотя иммунологических способов непосредственного определения гомоцистеина не су-' ществуе т, поскольку нет возможности обнаружить антитела к гомоцистеину, предложен ряд других способов обнаружения гомоцистеина в клинических пробах. Эти способы предусматривают выделение путем хроматографии и, как правило, основаны на одном из трех следующи х принципов: (1) классический хроматографический ана лиз аминокислот, (2) реакция гомоцистеина, содержащегося в пробе, с ферментом 5-аденозил-1_-гомоцистеин гидролазой в присутствии меченого радиоакти в ностью или другим способом S-аденозин ко-субстрата, с последующим выделением и количествен ным анализом продук та (S-а денознл-Ьгомоцистеин, S-АГ). Обычно производится выделение пу тем хроматогра фии (жидкостной высокого разре шения, ЖХВР, или тонкослойной, ТСХ) и измере ни е радиоак ти вно сти (см . Re fsum и др ., Clin . Chem. 31: 624-628 (1985); Kredich и др. Anal. Biochem 116:503-510 (1981); Chui, Am. J. Clin. Path . 90(4): 446-449 (1988); Totani и др., Biochem. Soc. 14(6): 1172-9 (1988) и Schimi zu и др., Biote chnol. Appl. Biochem 8:153-159 (1986)), • (3) реакция гомоцистеина, содержащегося в пробе, с люминофором, с последующим выделе нием путем ЖХВР и флуорометрией (см. Refsum и др., Clin. Chem. 35(9): 1921-1927 (1989)). Эти способы отнимают много времени, очень трудоемки и все основаны на непосредственном количественном анализе В частности, хроматографическое выделение, которое является составной частью всех известных способов, требует сложного специализированного оборудования. Использование такого оборудования не принято в повседневной практике клинических лабораторий, и, следовательно, автоматизировать эти процессы в средней клинической лаборатории нельзя. Поэтому существует необходимость в способе анализа на гомоцистеин - простом, точном, не требующем много времени, легко приспособляемом к условиям клинических лабораторий и, самое главное, не требующем дорогостоящего и длительного хроматографического выделения. Настоящее изобретение посвящено разработке такого способа. Итак, один из аспектов настоящего изобретения охватывает способ обнаружения гомоцистеина в пробе; способ, который заключае тся в том, что пробу подвергают реакции с ферментом, преобразующим гомоцистеин, например, с S-аденозил гомоцистеин (S-АГ) гидролазой, и хотя бы одним субстратом к упомянутому ферменту, о тличным от гомоцистеина, и без хроматографического выделения (реагентов или продуктов реакции) оценивают (предпочтительно фотометрически) немеченое анализируемое вещество, которое выбирают из ко-субстрата к гомоцистеину и продуктов ферментной переработки гомоцистеина упомянутым ферментом. После реакции пробы с ферментом, преобразующим гомоцистеин, и субстратом пробу, прежде чем подвергнуть последующим стадиям анализа, желательно выдержать хотя бы 30 секунд, а лучше - хотя бы 5 минут. В предпочти тельны х случая х в каче стве фермен та, прео браз ующе го гомоцистеин , используе тся S-АГ гидролаза , но могут бы ть использованы и др угие фермен ты. В качестве таковы х упомянем бетаин-гомоцистеин метил трансфераз у и др угие фермен ты , участвующие в преобразования х гомоцистеина (например, описанные у Graham, Trends Cardio vasc Med. 1:244-249 (1991 )). Ко-субстрат к гомоцистеину, оцениваемый по способу, предложенному настоящим изобретением, - это соединение, которое реагирует с гомоцистеином s присутствии катализатора - фермента, преобразующего гомоцистеин, например S-АГ гидролазы. Термин "оценка" в настоящем документе обозначает и количественное и качественное определение в смысле получения абсолютного значения количества или концентрации анализируе'мого вещества, например, ко-субстрата к гомоцис* теину, содержащемуся в пробе, а также в смысле получения коэффициента, соотношения, процентной доли, визуальной или другой величины, указывающей на уровень анализируемого вещества в пробе. Оценка может быть непосредственной и косвенной, а зарегистрированное химическое соединение - это не обязательно само анализируемое вещество, это может быть, например, его производное или продукт дальнейших преобразований, как будет пс^азано ниже. 27457 Способ анализа, предложенный настоящим изобретением, предусматривает использование ферментного либо иммунологического методов оценки анализируемого вещества. Предпочтительный ферментный метод предусматривает реакцию анализируемого вещества с другим ферментом, для которого оно служит субстратом Оценке подлежит либо ко-субстрат, либо прямой или косвенный продукт реакции преобразования анализируемого вещества этим другим ферментом. Предпочтительный иммунологический метод включает процедуру, предусматривающую конкурентное связывание с антителом анализируемого вещества и другого гаптена (например, полйгаптена или меченого аналога анализируемого вещества), и оценку связанного или несвязанного гаптена. В предпочтительных случаях в качестве фермента, преобразующего гомоцистеин, настоящим изобретением предписана S-аденозил-гомоцистеин гидропаза (S-АГ гидролаза), которая катализирует реакцию с гомоцистеином: аденозин + гомоцистеин 5 S-аденозил-гомоцистеин (S-АГ) с постоянной равноверия К = 106 М"1. Реакция проходит в том или другом направлении в зависимости от условий среды, концентрации реагирующих веществ и т.д. В приведенной выше схеме аденозин выступает в качестве ко-субстрата гомоцистеина. Для анализа, предложенного настоящим изобрете- . нием,'могут быть использованы и другие ко-субстраты, например, аналоги аденозина или родственные соединения. Способ анализа, предложенный настоящим изобретением, имеет особое достоинство: гомоцистеин является ингибитором S-АГ гидролазы и подавляет реакцию гидролиза, в результате которой образуется гомоцистеин и аденозин, сдвигая равновесие реакции в сторону синтеза S-АГ. Таким образом, количество гомоцистеина в пробе косвенно влияет на образование и расход ко-субстрата к гомоцистеину, например, аденозина, при участии S-АГ гидролазы, т.е., на его окончательную концентрацию в реагирующей смеси. В рамках настоящего изобретения окончательная концентрация или изменение концентрации ко-субстрата к гомоцистеину, например, аденозина, в реагирующей смеси может использоваться как показатель исходной концентрации гомоцистеина в пробе. Таким образом, если анализируемое вещество - косубстрат, то способ анализа, предложенный настоящим изобретением, отличается от существующих тем, что гомоцистеин оценивают не непосредственно, а косвенно - путем определения концентрации его ко-субстрата в реакции его ферментного преобразования. Это дает возможность использовать методы оценки, принятые в обычных клинических лабораториях и непригодные для осуществления уже известных способов анализа на гомоцистеин, например, фотометрические, т.е. применять способ, пред-' ложенный настоящим изобретением, в рутинной клинической практике. В предпочтительных случаях используется v способ, основанный на реакции с S-АГ гидрола- ' зой, проходящей в любом направлении. При этом если проба реагирует с S-АГ гидролазой и аденозином, расходуе тся количество аденозина, соот ветствующее количеству израсходованного гомоцистеина, и количество гомоцистеина в пробе можно определить по изменению концентрации аденозина. вместо самого аденозина. можно использовать его аналоги или вещества, из которых получается аденозин В других предпочтительных случаях можно использовать обратное направление реакции. Пробу подвергают реакции с S-АГ (обычно в избытке) и SАГ гидролазой. Гомоцистеин и аденозин образуются в результате гидролиза S-АГ. Гомоцистеин, содержащийся в пробе изначально, будет тормозить эту реакцию, т.е. тормозить образование аденозина, ко- • личество которого контролируется. В качестве субстрато в- к S-АГ гидролазе можно использовать S-АГ, аденозин, а также их аналоги и предшественники. В сложной совокупности процессов обмена аминокислоты сульфгидрила и реакциях трансметилирования задействовано множество ферментов. Эти процессы и реакции были предметом исследований, в процессе которых изучались регуляторные функции ферментов. Роль одного такого фермента, S-АГ гидролазы «описана в обзоре у Ueland, Pha rmacological Re views 34: 223-253 (1982). Trewyn и др., в J. Biochem. Biophys. Met. 4: 299-307 (1981) описывают изучение регуляторнои роли S-АГ гидролазы и предлагают анализ ферментной активности S-АГ гидролазы. Garras и др. в Anal ytical Biochem. 199: 112-118 (1991) описывают другие пути преобразований гомоцистеина и, в частности, предлагают опыт по преобразованию гомоцистеина в присутствии метионин синтазы. .Как уже сказано, Graham (выше) описывает дальнейшие ферментные преобразования гомоцистеина. Ко-субстраты и продукты этих реакций можно использовать в качестве анализируемых веществ по способу, предложенному*настоящим изобретением, особенно, если применяются иммунологические методы оценки. Пробы для анализа по способу настоящего изобретения можно отбирать из любой биологической жидкости или тканевого экстракта и подвергать предварительной обработке. Как правило используется плазма крови, жидкая часть лимфы или моча. В плазме крови, в жидкой части лимфы или в моче значительная доля гомоцистеина может связываться дисульфидными связями с циркулирующими белками, например, альбумином; кроме того, гомоцистеин может присутствовать в них в виде други х дисульфидных производных (обычно в виде конъюгата гомоцистеин-цистеин). Для того, чтобы оценить общее содержание гомоцистеина в пробе, может потребоваться обработка пробы восстановителем для разъединения дисульфидных связей и высвобождения гомоцистеина. Дисульфиды легко и специфично восстанавливаются тиолами (например, дитиотреитолом ДТТ, дитиоэритритолом ДТЭ, 2-меркапто-этанолом, цистеин - тиогликолатом, тиогликолевой кислотой, глутатионом и подобными соединениями). Непосредственное химическое восстановление можно осуществить с помощью борогидридов (например, натриевого борогидрида) или амальгам (например, натриевой амальгамы) или более специализированных реактивов, например, фосфи 27457 нов или фосфоротиоатов. Восстановление дисульфидов обзорно описано у Jocelyn, Methods of Enzymology 143: 243-256 (1987), где перечислено множество приемлемых восстановителей. Аденозин и другие ко-субстраты гомоцистеина могут оцениваться известными способами. Обычно предпочтительными являются способы, основанные на фотометрическом (например, колориметрическом, спектрофотометрическом и флуорометрическом) анализе, и иммунологические методы, поскольку их легко приспособить к условиям клинических лабораторий. Особо предпочтительными являются способы, основанные на ферментных реакциях или реакциях с моно- или поликлональными антителами, - простые, быстрые и сравнительно недорогие. Так, например, оценка анализируемого вещества может производиться путем контроля реакции с ферментами, которые превращают его, прямо или косвенно, в вещества, которые можно зарегистрировать фотометрически, например, спектрофотометрически. К приемлемым ферментам, которые, конечно, не должны реагировать с другими субстратами к ферменту, преобразующему гомоцистеин, в частности, с гомоцистеином, относятся аденозин деаминаза (превращает аденозин в инозин) и аденозин кинаэа (превращает аденозин и АТФ в АДФ и фосфорилированный аденозин). Такие ферменты можно комбинировать с ферментами, которые преобразуют полученные продукты в другие поддающиеся регистрации продукты. Примерами иммунологических методов могут служить методы, предусматривающие реакцию анализируемого вещества с анти телами, специфичными для него, которые либо поддаются непосредственной оценке, либо могут быть пре_ бразованы в поддающиеся регистрации продукты, например,' посредством сэндвич-анализа. Один очень привлекательный иммунологический метод предусматривает использование меченного люминофором аналога анализируемого вещества, предпочтительно ко-субстрата, например, меченного флуоресцеином аденозина. Этот последний и немеченое анализируемое вещество подвергают реакции с антителом к анализируемому веществу. Если полученный продукт подвергнуть флуоресцентной поляризации с использованием поляризованного возбуждающего излучения, то показатель концентрации немеченого анализируемого вещества можно вывести из степени деполяризации флуоресцентного излучения. Антитела к аденозину имеются на рынке (например, в фирме Paessel & Lorei GmbH, Франкфурт, Германия и Serotech Ltd., Оксфорд, Великобритания), а технология опыта с поляриза цией флуоре сценции (FPIA) хорошо о тработана (см., например, US-A4420568 и US-A-4593089 и др угие п убликации Abbott Laboratories, в которых идет речь о разработанной там технологии TDx). Итак, к схемам анализа, пригодным для использования в рамках настоящего изобретения, относятся антитело (1) аденозин -------------------------------поляризация + аденозин, меченный флуоресцеином флуоресценции (2) аденозин ----------------------------------- ► аденозин диаминаза инозин + О2 (3) аденозин -► инозин аденозин деаминаза фосфорилаза -►, гипоксантин пурин нуклеозид Н2О2 ксантин ксантин оксидаза 2 О2 ксантин оксидаза мочевая кислота (4) аденозин + АТФ аденозин киназа аденозин-5'-Р + АДФ вместе с конкурентной хемолюминесцентнои реакцией с участием АТФ, например оксилюциферин + РР( + АМФ + СОг + люци4>ераза . свет АТФ + люциферин + О лощать ультрафиолетовое излучение и поэтому их или с меченным люминофором аденозином, можно контролировать спектрофотометрически, пукоторый конкурирует за АТТФ/аденозин киназу, тем кинетических измерений. Однако, регистрация причем оценка здесь проводится путем измерения мочевой кислоты и инозина с помощью ультрафиополяризации флуоресценции. летового излучения имеет определенные ограничеЧто касается схем (2) и (3), то инозин и мочения, так как чувствительность этого способа невысовая кислота имеют четко выраженное свойство пог 27457 ка и для него требуется источник ультрафиолетовых лучей и посуда, прозрачная для нчх Поэтому удобнее будет прибегнуть к колориметрической регистрации или к использованию электронных датчиков, что обычно и делают в клинических лабораториях, отдавая предпочтение колориметрии. В этой связи реакция, описанная схемой (2) особенно удобна, так как аммиак, образующийся в ходе реакции с аденозин деаминазой легко регистрируется посредством из вестных колориметрических способов Так, например, аммиак можно подвергнуть реакциям, дающим окрашенные продукты, которые можно зарегистрировать спектрофотометрически. Один из таких способов, описанный в Methods of Enzymatic Analysis (Bergmeyer) Vol |. 1040-1056 (1970) основан на реакции аммиака с фенолом в присутствии гипохлорита в щелочных условиях, при которых образуется краситель индофенол1 [База] NH3 + ОСІ Na2[Fe(CN)5NO] Натрия нитроцианид можно использовать в качестве катализатора. Возможны модификации этого способа с использованием, например, производных фенола Окрашенный конечный продукт образуется в количестве, прямо пропорциональном концентрации аммиака, -а, следовательно, концентрации аденозинав пробе В схеме (3) реакция с ксантин оксидазой поддается' контролю посредством флуорогенов или хромогенов, например, индикаторов окисление-восстановление, с помощью оценки окислительно-восстановительного потенциала, или путем измерения расхода Ог, точнее образование Н2О2, например, при помощи электронных датчиков. Для этой цели можно использовать различные индикаторы окисления-восстановления, а в литературе описано множество способов определения Ог и Н2О2 в растворах. В клинических анализах Н2О2 определяют очень часто. К приемлемым индикаторам относятся метиленовый синий, 2,6- дихлорфенол, индофенол и различные индикаторы окисления-восстановления, перечисленные в таблице 1 катало га № 53 Kodak Laboratory & Research Products. Можно использовать и другие Для облегчения окислительно-восстановительных реакций к реагентам можно добавлять ферменты с пероксидазной активностью, например, хренную пероксидазу. Если н ужен хромоген, выпадающий в осадок, можно использовать МТТ те тразол в сочетании с ксантин оксидазой или др угими подобными ферментами При использовании выпадающе го в осадок флуоро гена или хромогена получается неподвижное значение цве та или свечения, т е , виз уальный показатель концентрации гомоцистеина. Схема (4) описывает хемолюминисцентную реакцию с участием АТФ, используемую для оценки концентрации аденозина. Анализы, основанные на хемолюминисценции, обладают большим потенциалом благодаря низким порогам чувствительности и сравнительной простоте используемого оборудования. Хемолюминисцентные реакции можно использовать для регистрации таких веществ как АТФ или Н2О2. Одна из наиболее эффективных и известных реакций этого типа реакция свечения светляков: люцифераза АТФ + люциферин Люциферин светляков - это соединение на основе бензотриазола, но известны люциферины из других биологических источников, имеющие другое строение. В аналитических целях АТФ, люциферин и люциферазу можно оценивать непосредственно по этой реакции. Другая хемолюминисцентная реакция, которую можно использовать (при ней образуется Н2О2, как и в схеме (3)), - это реакция люминола (люминол - это 5-амин*2,3-дигидро-фталазин-1,4-дион) с катализатором водородной пероксидазой. при которой излучается свет с длиной волны 425 нм. Перекись водорода (по схеме (3), например) также можно оценить по неферментным хемолюминисцентным реакциям пероксиоксалата и эфиров акридина, последние в водных растворах при нейтральном рН. Использование в реакции по схеме (4) меченного люминофором аденозина и оценка по поляризации флуоресценции целесообразны благодаря относительно широкой специфичности аденозин киназы по отношению к субстратам. Эту широкую специфичность, кроме того, можно использо оксилюциферин + РР, + АМФ + СОг + свет вать для компенсации эндогенного аденозина (или других нуклеозидных субсгратов аденозин киназы) путем добавления аденозин киназы в пробу в ходе подготовки ее к анализу, в сочетании с восстановителем, например, ДТТ. Такая подготовка проб к анализу весьма желательна, поскольку во многи х воплощения х настоя щего изобре тения анализируемое вещество (например, аденозин) уже присутствуе т в пробах в различны х количества х и является потенциальным источником ошибки. Фоновое содержание анализируемого ве щества можно компенсировать, проводя анализ части пробы без использования фермента, преобразующего гомоцистеин (например, S-АГ гидролазы); однако, эта процедура отнимает много времени и делает анализ более тр удоемким. Вы ход заключается в предвари тельной обработке пробы средством, ко торое бы уни чтожало или преобразовывало эндогенное анализируемое вещество, например, таким ферментом как аденозин киназа или аденозин деаминаза, которые уничтожают фоновый аденозин. 27457 Как сказано выше, чтобы неоправданно не увеличивалась продолжительность анализа, такая обработка пробы может осуществляться одновременно с обработкой ее восстановителем, высвобождающим гомоцистеин. Для оценки анализируемого вещества, кроме колориметрии, можно использовать и другие методы фотометрии. К числу особенно удобных относятся методы агглютинации частиц и иммунопреципитации. Если используются поликлональные антитела, то можно производить непосредственную агглютинацию частиц или иммунопреципитацию, хо тя если в качестве фермента, антитело (возможно, связанное с частицей) гаптен (предпочтительно полигаптен) Если в качестве фермента, преобразующего гомоцистеин, используется S-АГ гидролаза, то лучше хранить S-АГ гидролазу в присутствии восстановителя или обрабатывать ее восстановителем перед анализом. Выяснилось, что если хранить S-АГ гидролазу иначе, она инактивируется, а использование восстановителя предупреждает инактивацию или же активирует фермент перед анализом. Можно использовать различные восстановители (например, ДТТ, цистеин, меркаптоэтанол, дитиоэритритол, натрия борогидрид и т.д.), однако ДТТ лучше подходит для этой цели, например, в концентрации около 5 мМ. Сам ДТТ следует хранить при низком рН, поэтому в набор для анализа можно включить ДТТ с низким рН (например, около 3), но с низкой буферной способностью и отдельный раствор S-АГ гидролазы, частично или полностью инактивированной, с нейтральным рН и желательно в буфере. Когда эти растворы соединяют, фермент реактивируется при нейтральном рН. Если нужно, растворы можно соединять в присутствии анализируемой пробы или же добавлять пробу вскоре после соединения, чтобы одновременно происходило высвобождение гомоцистеина. Можно использовать и другие восстановители, упомянутые выше, для стабилизации/активации S-АГ гидролазы и для восстановления пробы до высвобождения гомоцистеина. Другой аспект настоящего изобретения заключается именно в использовании восстановителей для реактивации инактивированных форм SАГ гидролазы. Кроме того, следующий аспект настоящего изобретения охватывает набор реактивов, в первом отделении которого находится инактивированная S-АГ гидролаза, а во втором - восстановитель, например, ДТТ в кислой среде (например, рН 3). Используя этот набор, S-АГ гидролазу смешивают с восстановителем, таким образом реактивируя ее, непосредственно перед анализом. Для повышения устойчивости S-АГ гидролазы при хранении и во время анализа можно использовать и другие доба вки. К ним относятся NAD*, глутатион, многоатомные спирты и сахара (инозит, сорбит, ксилит, эритрит, глицерин, этиленгликоль, сахароза, лактит и т.д.), растворимые полимеры, например, некоторые декстраны, й белки (например, носители). преобразующего гомоцистеин, используется S-АГ гидролаза, это обычно нежелательно Однако, можно применить ингибированные преципитации или агглютинации частиц. Оно основано на использовании комбинаций антитело/гаптен, при конъюгации которых происходи т преципитация или укрупнение частиц, регистрируемые турбидиметрическим или нефелометрическим способом. Если образование комплекса антитело/гаптен тормозится анализируемым веществом, например SАГ, то содержание S-АГ можно оценить по ослаблению преципитации/укрупнения. Реакцию можно изобразить так: ------------------------ ► образование комплекса (преципитация или укрупнение частиц) Анти тела, используемые в рамках настоящего изобретения, могут быть поликлональными, но лучше - моноклона л ьными. Если нужных антител нет в продаже, их можно изготовить стандартными методами. Антитела можно выращивать в организмах животных или гибридомах, моноклональных или поликлональных, например, как описано у James Gooding в "Monoclonal antibodies, principle and practice", Academic Press, London, 1983, глава З. Моноклоны следует сортировать, чтобы отделять клоны, которые отличают нужный гаптен от других субстратов к ферментам, например, аденозин от S-АГ. Поликлональные антитела, реагирующие только с анализируемым веществом (например, S-АГ), следует очищать для удаления перекрестно реагирующих антител, то есть тех, которые реагируют с др угими субстратами, кроме анализируемого, т.е. и с аденозином, и с S-АГ. Это можно сделать с помощью аффинной хроматографии, т.е. там, где анализируется S-АГ, используется иммобилизованный аденозин. При производстве антител в качестве гагггена используется либо само анализируемое вещество, либо другая молекула, включающая часть анализируемого вещества, которая считается наиболее удобной площадкой для связывания, т.е. часть, удаленную от участков, задействованных в цЪерментной реакции. Гаптен удобно связать с макромолекулой, такой как BSA (бычий сывороточный альбумин) или гемоцианин. Для S-АГ удобный эпитоп расположен предпочтительно в окрестности тиоэфирного мостика, поэтому в то время как сама S-АГ NH, НООССН(1ОДСН£ Н£СН ОН ОН используется в комплексе с макромолекулой, желательно использовать "упрощенную" молекулу, такую, как описана формулой (1) 27457 НООС(СН,)з8СН2 .л Н ¥° H он он OH OH (I) (где Ri и R2 - одинаковые или разные - это атомы водорода или группы СЖд (где RA - это короткая (например, Сі-б, особенно С1-4) алифатическая фуппа, например, алкил, а предпочтительно метил или этил), или же Ri и Ra вместе обозначают атом кислорода; Rj - это амин или карбоксильная группа), или ее соль или эфир (например, с Ci-4 алканолом) в комплексе с макромолекулой. Примерами веществ, описываемых формулой (I) и пригодных к использованию в качестве гаптенов, могут служить Эти "упрощенные" соединения можно также преобразовать в меченые аналоги, упомянутые выше и используемые в процедурах, в которых анализируемое вещество и меченый аналог вступают в конкурентную реакцию связывания с антителом. Сигнальную группу R*. которую выбирают из числа люминофоров, хромофоров, радиометок, ферментных, хемолюминисцентных и других меток, обычно используемых в иммунных анализах, можно присоединить к анализируемому веществу, например, R'-S-АГ, или к упрощенной, содержащей эпитоп, молекуле, например н н н ОН ОН он он он он Такие меченые группы можно, разумеется, присоединять к частицам, полимерам, белкам и другим материалам Меченые 6-тиоэфиры фуранозы и соединения, соответствующие формуле I, являются новы-: ми и входят в число предметов настоящего изобретения Следующий аспект настоящего изобретения рассматривает процесс приготовления соединений, соответствующих формуле I, состоящий из таких шагов: (а) реакция соединения, описанного формулой И HOOC(CH2),SCH HSCH н (Ч) где Ri и R2 определены в ыше, а к аж дая Rs - это защищенная гидроксиль ная гру ппа или в месте Rs обознач ают алк илендиоксигруппу (т.е. защищенну ю бис- гидрокс иль ну ю гру ппу , т аку ю к ак ОС( СНз) 2О-), с пропил галогенидом, соотв етств ующим форму ле III он он ноос(сндесн он он ОСНз Re(CH2)3 Hal («И) (где Re - это группа R3 или защищенная групп а Ra, a Hal - атом галогена, например, бром а), с последующим у далением любой защитной гру ппы , которую требуется у далить; 27457 (b) (для получения соединения состава I, где R3 - это аминогруппа) реакция соединения соста ва II с акрилонитрилом и восстановление и удале ние за щи тны х гр упп у по лученного цианпропи л тиоэфира, (c) этерификация соединения состава I, где Ra - это карбоксильная группа. Исходные вещества состава III можно приготовить стандартными методами или методами, описанными в ли тера туре. Исхо дные ве щества состава II можно приготовить из соответствующи х 1-гидроксиметилфураноз путем защиты цис-гидроксильной группы, бромирования, а затем реакции с тиомочевиной и гидролиза В I- гидроксиметилфуранозах защитить цис-гидроксильную гр уппу можно посредством реакции с известным средством защиты для гидроксила, например, ацетоном К примерам схем реакций по приготовлению соединений состава I относятся следующие (соединения (1) и (3) имеются в продаже). н (A) H4_V H он он ,лч (1) LSCCNH^H^/BOH W -------------------------н (С) Сухой эфир (D) Лї^Гуі он он (2) 27457 СНзО/СНаОН (7) * (F) (в) CHCHCN V н н к (9) (O) (9 ) 1 и А> Н4 /сухойафир _ Y tfvH H (10) OH OH (H) (в) (11) он он (I) (11) ОН*/диоксан н 2. (12) (J) (12) N— Дютмпформтцд (13) ОН ОН 10 27457 В другом случае в набор ВУОДЯТ яденозин, S-аденозил-гомоцистеин гидролаза, фермент, преобразующий аденозин, возможно, ко-субстра г "к упомянутому ферменту, преобразующему аденозин, и средства выработки фотометрически регистрируемого ответного сигнала от упомянутого ко-субстрата или от продукта ферментного преобразования аденозина упомянутым аденозинпреобразующим ферментом. Например, в качестве фермента, преобразующего аденозин, можно взять аденозин киназу, а в качестве средств выработки ответа - АТФ, люциферин и люциферазу. Можно также использовать аденозин деаминазу, а в качестве средств выработки ответа - нуклеозид фосфорилазу, ксантиноксидазу и пероксидазу. В другом воплощении настоящего изобретения в набор входят: аденозин; S-аденозил-гомоцистеин; антитело к S-аденозил-гомоцистеину, возможно, связанное с матричной частицей; полигаптен к упомянутом у анти телу, и , возможно, средства для фотометрической оценки агглютинации или преципитации комплексов антитело полигап тен В этом воп ло щен ии по ли гап тен может' быть приготовлен из полимера-основы, к которой присоединяют 6-тиоэфиры фуранозы, т е. относительно подвижные остатки состава Поглощение ультрафиолетового излучения, поглощение видимого света, флуоресценция веществ, присутствующих в реагирующей смеси, выпавших в осадок или выделившихся иным путем, измеряется в конечной точке реакции (когда сигнал стабилен) или в один или несколько заданных моментов времени; кроме того, можно провести кинетические измерения, при которых делают несколько замеров в разные моменты времени. Для проведения анализа по способу, предложенному настоящим изобретением, необходимые реагенты следует добавлять в реагирующую смесь один за другим или ввести все одновременно Однако, в ряде предпочтительных воплощений одна или несколько реакций проводятся за некоторое время до последующи х. Например, когда проба реагирует с аденозином и S-АГ гидролазой, реакции образования S-АГ из гомоцистеина и аденозина дают пройти и только после этого приступают к оценке аденозина. В клиническом химическом анализе повсеместно принято использование стандартных калибровочных кривых. Таким образом, при анализе по способу настоящего изобретения для построения стандартной кривой сигнал/ответ можно использовать не 'к линические пробы, а образцы с известным содержанием гомоцистеина, а затем по готовой кривой способом интерполяции вывести содержание гомоцистеина в неисследованных пробах. При этом точный количественный анализ молекул, испускающих сигнал, или точная оценка окислительно- восстановительного потенциала становятся необязательными. Способ анализа, предложенный настоящим изобретением, может быть использован для диагностики и контроля патологических**! потенциально патологических состояний, вызванных содержанием гомоцистеина в биологических жидкостях и тканях или отражающихся на нем. К этим состояниям относится атеросклероз, заболевания крови, авитаминозы и/или врожденные нарушения обмена веществ Это т способ анализа можно также использовать для оценки эффекта фармацевтических препаратов, например, антифолатных средств. Еще один аспект настоящего изобретения рассматривает приспособление для анализа, например, в виде набора реактивов, в который входит: фермент, преобразующий гомоцистеин; субстрат к этому ферменту, отличный от гомоцистеина; средство подачи сигнала: и, возможно, средство оценки сигнала. В одном из предпочтительных случаев в набор реактивов входят: фермент, преобразующий цистеин, например, S-аденозил-гомоцистеин гидролаза; один или несколько субстратов к упомянутому ферменту, отличных от гомоцистеина; средства приготовления поддающегося регистрации производного от анапизируемого вещества, которое выбирают из числа ко-субстрата к гомоцистеину и продуктов ферментного преобразования гомоцистеина; и, возможно, средства спектрометрической или колориметрической оценки упомянутого поддающегося регистрации производного, с помощью которых получают показатель содержимого гомоцистеина в пробе. он он -
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for determination of homocystein in test and analytic set for its implementation
Автори англійськоюSandrehagen Erlin
Назва патенту російськоюСпособ определения гомоцистеина в пробе и аналитический набор для его осуществления
Автори російськоюСандрехаген Эрлин
МПК / Мітки
МПК: G01N 33/543, G01N 33/68, G01N 33/53, C12Q 1/48, C12Q 1/34, C07H 15/14, C12Q 1/66, G01N 33/573, C07H 19/16, C07H 15/26
Мітки: здійснення, гомоцистеїну, аналітичний, набір, визначення, проби, спосіб
Код посилання
<a href="https://ua.patents.su/17-27457-sposib-viznachennya-gomocistenu-v-probi-ta-analitichnijj-nabir-dlya-jjogo-zdijjsnennya.html" target="_blank" rel="follow" title="База патентів України">Спосіб визначення гомоцистеїну в пробі та аналітичний набір для його здійснення</a>
Попередній патент: Велосипед
Наступний патент: Фрита грунтової емалі для нанесення електростатичним методом
Випадковий патент: Спосіб термохімічної обробки порожнистих скловиробів