Антитіло, яке застосовується в імунологічному аналізі зразка для визначення неонікотиноїдного інсектициду, білковий кон’югат для одержання антитіла, спосіб визначення концентрації неонікотиноїдного інсектициду
Номер патенту: 76708
Опубліковано: 15.09.2006
Автори: Вілсон Тімоті Едвард, Сіммонс Дана Філіп, Браді Джеймс Френсіс
Формула / Реферат
1. Антитіло, яке застосовується в імунологічному аналізі зразка для визначення кількості неонікотиноїдного інсектициду, де згадане антитіло є поліклональним антитілом, одержаним імунізацією тварини неонікотиноїдним гаптеном, кон'югованим з імуногенним білком-переносником, і специфічно зв'язується з неонікотиноїдним інсектицидом, який вибраний із групи, яка складається з нітенпіраму, ацетаміприду, тіаклоприду і сполук формули (І) та (III):
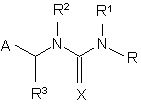 (I),
(I),
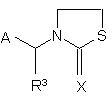 (III),
(III),
де
А означає 2-хлоропірид-5-ил або 2-хлоротіазол-5-іл;
R і R3 незалежно один від одного означають водень або (С1-С4)алкіл;
R1 і R2 незалежно один від одного означають водень або (С1-С4)алкіл, або
R1 і R2 разом з атомами азоту, до яких вони приєднані, утворюють імідазолідинове або оксадіазинове кільце; і
Х означає -N-NO2 або -N-CN.
2. Антитіло за п. 1, де згадане антитіло є селективним по відношенню до сполуки, вибраної з групи, яка складається з імідаклоприду, нітенпіраму, ацетаміприду, тіаметоксаму, тіаклоприду і клотіадину.
3. Сполука формули
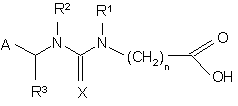 (IA),
(IA),
де
А означає 2-хлоропірид-5-ил або 2-хлоротіазол-5-іл;
R3 означає водень або (С1-С4)алкіл;
R1 і R2 незалежно один від одного означають водень або (С1-С4)алкіл, або
R1 і R2 разом з атомами азоту, до яких вони приєднані, утворюють імідазолідинове або оксадіазинове кільце;
n означає ціле число 1-4; і
Х означає -N-NO2 або -N-CN.
4. Сполука за п. 3 формули
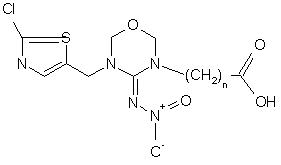 .
.
5. Сполука за п. 4 формули
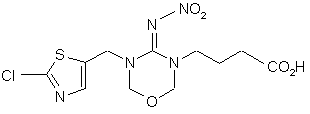 .
.
6. Сполука за п. 3 формули
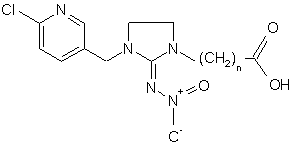 .
.
7. Сполука за п. 6 формули
 .
.
8. Білковий кон'югат формули
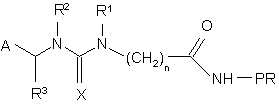 (II),
(II),
де
А означає 2-хлоропірид-5-ил або 2-хлоротіазол-5-іл;
R3 означає водень або (С1-С4)алкіл;
R1 і R2 незалежно один від одного означають водень або (С1-С4)алкіл, або
R1 і R2 разом з атомами азоту, до яких вони приєднані, утворюють імідазолідинове або оксадіазинове кільце;
n означає ціле число 1-4;
Х означає -N-NO2 або -N-CN; і
PR означає залишок білка молекули-переносника, вибраний із групи, яка складається з очищеного білкового похідного (PPD, туберкуліну) з вірусу Diptheria, бичачого сироваткового альбуміну, катіонованого бичачого сироваткового альбуміну, людського сироваткового альбуміну, овальбуміну і гемоціаніну з молюска Megathura crenulata;
або залишок ферменту, вибраний із групи, яка складається з лужної фосфатази, пероксидази хрону і ![]() -галактозидази.
-галактозидази.
9. Білковий кон'югат за п. 8 формули
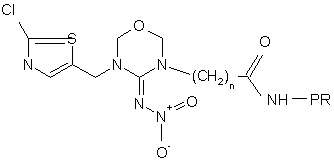 .
.
10. Білковий кон'югат за п. 8 формули
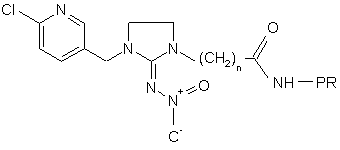 .
.
11. Спосіб визначення концентрації неонікотиноїдного інсектициду в зразку, який включає етапи:
(а) забезпечення твердої фази з іммобілізованим антитілом, селективним до згаданого неонікотиноїдного інсектициду за пунктом 1 або 2;
(б) контакт згаданого зразка з іммобілізованим антитілом у присутності відомої кількості кон'югата гаптену, яким є неонікотиноїдний інсектицид, з ферментом за будь-яким з пунктів 8-10;
(в) промивання твердої фази етапу (б) для видалення будь-якого незв'язаного кон'югата гаптену з ферментом або зразка;
(г) взаємодія хромогенного субстрату, специфічного до згаданого кон'югата гаптену з ферментом, із промитою твердою фазою етапу (в) для того, щоб генерувати хромоген; і
(д) вимірювання кількості хромогену, утвореного на етапі (г), щоб визначити кількість зв’язаного антитіла з кон’югатом гаптену з ферментом і звідси - кількість неонікотиноїдного інсектициду в згаданому зразку.
12. Спосіб за п. 11, де згаданий зразок одержують екстракцією рослинного відтворюваного матеріалу у відповідний розчинник.
13. Спосіб за п. 12, де згаданим рослинним відтворюваним матеріалом є насіння.
14. Спосіб за п. 13, де згадане насіння вибирають із групи, яка складається з рапсу, сорго, пшениці, бавовни, польової кукурудзи або цукрової кукурудзи.
15. Спосіб за п. 11, де згаданим антитілом є поліклональне антитіло, одержане імунізацією тварини з неонікотиноїдним інсектицидом, кон'югованим з імуногенним білком-переносником.
16. Спосіб за п. 15, де згаданим білком-переносником є молекула-переносник, вибрана з групи, яка складається з очищеного похідного білка (PPD, туберкуліну) з вірусу Diptheria, бичачого сироваткового альбуміну, катіонованого бичачого сироваткового альбуміну, людського сироваткового альбуміну, овальбуміну і гемоціаніну з молюска Megathura crenulata.
17. Набір для визначення кількості неонікотиноїдного інсектициду при імунологічному аналізі зразка, де набір включає в сполученні в одному або декількох контейнерах:
(а) тверду фазу з іммобілізованим антитілом, селективним у відношенні згаданого неонікотиноїдного інсектициду за пунктом 1 або 2;
(б) ферментний кон'югат, який містить фермент, кон'югований з неонікотиноїдним гаптеном за будь-яким з пунктів 8-10.
18. Набір за п. 17, де антитілом є поліклональне антитіло, одержане імунізацією тварини з неонікотиноїдним інсектицидом, кон'югованим з імуногенним білком-переносником.
19. Набір за п. 18, де ферментом є пероксидаза хрону.
20. Набір за п. 17, де антитіло специфічно зв'язується з неонікотиноїдним інсектицидом, вибраним із групи, яка складається з імідаклоприду, нітенпіраму, ацетаміприду, тіаметоксаму, тіаклоприду і клотіадину.
Текст
1. Антитіло, яке застосовується в імунологічному аналізі зразка для визначення кількості неонікотиноїдного інсектициду, де згадане антитіло є поліклональним антитілом, одержаним імунізацією тварини неонікотиноїдним гаптеном, кон'югованим з імуногенним білком-переносником, і специфічно зв'язується з неонікотиноїдним інсектицидом, який вибраний із групи, яка складається з нітенпіраму, ацетаміприду, тіаклоприду і сполук формули (І) та (III): R2 R1 C2 2 (13) 1 3 Cl N N (CH2) + N O N N OH N NO2 Cl CO2H . N (CH2) + N O N . O n OH . NO2 N CO2H . 8. Білковий кон'югат формули R2 R1 O N N A (II), (CH2) n NH PR R3 X де А означає 2-хлоропірид-5-ил або 2-хлоротіазол-5іл; R3 означає водень або (С1-С4)алкіл; R1 і R2 незалежно один від одного означають водень або (С1-С4)алкіл, або R1 і R2 разом з атомами азоту, до яких вони приєднані, утворюють імідазолідинове або оксадіазинове кільце; n означає ціле число 1-4; Х означає -N-NO2 або -N-CN; і PR означає залишок білка молекули-переносника, вибраний із групи, яка складається з очищеного білкового похідного (PPD, туберкуліну) з вірусу Diptheria, бичачого сироваткового альбуміну, катіонованого бичачого сироваткового альбуміну, людського сироваткового альбуміну, овальбуміну і гемоціаніну з молюска Megathura crenulata; або залишок ферменту, вибраний із групи, яка складається з лужної фосфатази, пероксидази хрону і -галактозидази. 9. Білковий кон'югат за п.8 формули (CH2) + N O 7. Сполука за п.6 формули Cl PR N N O N NH N N N N N O O N n 10. Білковий кон'югат за п. 8 формули N N (CH2) O + O . 6. Сполука за п.3 формули Cl O N N N N n O 5. Сполука за п.4 формули Cl O S O N S 4 Cl O S N 76708 O n NH PR . 11. Спосіб визначення концентрації неонікотиноїдного інсектициду в зразку, який включає етапи: (а) забезпечення твердої фази з іммобілізованим антитілом, селективним до згаданого неонікотиноїдного інсектициду за пунктом 1 або 2; (б) контакт згаданого зразка з іммобілізованим антитілом у присутності відомої кількості кон'югата гаптену, яким є неонікотиноїдний інсектицид, з ферментом за будь-яким з пунктів 8-10; (в) промивання твердої фази етапу (б) для видалення будь-якого незв'язаного кон'югата гаптену з ферментом або зразка; (г) взаємодія хромогенного субстрату, специфічного до згаданого кон'югата гаптену з ферментом, із промитою твердою фазою етапу (в) для того, щоб генерувати хромоген; і (д) вимірювання кількості хромогену, утвореного на етапі (г), щоб визначити кількість зв’язаного антитіла з кон’югатом гаптену з ферментом і звідси - кількість неонікотиноїдного інсектициду в згаданому зразку. 12. Спосіб за п.11, де згаданий зразок одержують екстракцією рослинного відтворюваного матеріалу у відповідний розчинник. 13. Спосіб за п.12, де згаданим рослинним відтворюваним матеріалом є насіння. 14. Спосіб за п.13, де згадане насіння вибирають із групи, яка складається з рапсу, сорго, пшениці, бавовни, польової кукурудзи або цукрової кукурудзи. 15. Спосіб за п.11, де згаданим антитілом є поліклональне антитіло, одержане імунізацією тварини з неонікотиноїдним інсектицидом, кон'югованим з імуногенним білком-переносником. 16. Спосіб за п.15, де згаданим білкомпереносником є молекула-переносник, вибрана з групи, яка складається з очищеного похідного білка (PPD, туберкуліну) з вірусу Diptheria, бичачого сироваткового альбуміну, катіонованого бичачого сироваткового альбуміну, людського сироваткового альбуміну, овальбуміну і гемоціаніну з молюска Megathura crenulata. 17. Набір для визначення кількості неонікотиноїдного інсектициду при імунологічному аналізі зразка, де набір включає в сполученні в одному або декількох контейнерах: 5 76708 6 (а) тверду фазу з іммобілізованим антитілом, селективним у відношенні згаданого неонікотиноїдного інсектициду за пунктом 1 або 2; (б) ферментний кон'югат, який містить фермент, кон'югований з неонікотиноїдним гаптеном за будь-яким з пунктів 8-10. 18. Набір за п.17, де антитілом є поліклональне антитіло, одержане імунізацією тварини з неоніко тиноїдним інсектицидом, кон'югованим з імуногенним білком-переносником. 19. Набір за п.18, де ферментом є пероксидаза хрону. 20. Набір за п.17, де антитіло специфічно зв'язується з неонікотиноїдним інсектицидом, вибраним із групи, яка складається з імідаклоприду, нітенпіраму, ацетаміприду, тіаметоксаму, тіаклоприду і клотіадину. Даний винахід стосується імунологічних аналізів пестицидів та антитіл і реагентів для проведення таких аналізів. Крім того, винахід стосується способів здійснення таких аналізів і наборів, які містять реагенти для застосування на практиці таких способів. Винахід має специфічне застосування для визначення та кількісної оцінкинеонікотиноїдних інсектицидів у зразку. Інсектициди Застосування інсектицидів для контролю комах-шкідників у сільськогосподарських культурах є універсальною практикою. Дана практика досягла високого ступеня комерційного успіху, оскільки було показано, що такий контроль може підвищити врожайність. Однак ефективне застосування інсектицидів вимагає правильної організації з погляду стійкості комах і торкається впливу на навколишнє середовище і працівника. Одним з рішень, які застосовуються для вирішення цієї проблеми, було забезпечення нових, більш активних інсектицидів, щоб зменшити необхідність у більш старих, високотоксичних інсектицидах та знизити навантаження на навколишнє середовище. Одним новим класом інсектицидів, які одержали значне визнання на ринку, є, так звані, «неонікотиноїдні» інсектициди. Сполуки даного класу включають, наприклад, імідаклоприд, ацетаміприд і тіаметоксам, які описані в [патентах US №4742060 і №5304566 і в ЕР580553А2], відповідно. Пряма обробка рослинних відтворюваних матеріалів (таких, як насіння) інсектицидами є цільовим застосуванням, яке спрямовано на необхідність зниження впливу на навколишнє середовище і працівника і накопиченої стійкості комах при нанесенні окремо або в сполученні з нанесенням інсектицидів на листя і борозну. Однак необхідно звернути увагу, що апарат для покриття насіння калібрований належним чином для того, щоб інсектицид рівномірно наносився на насінний матеріал з метою уникнути, окрім інших, проблеми ефективності дії інсектицидів і фітотоксичності насіння. Можна використовувати аналітичні вимірювання, щоб визначити, чи працює належним чином устаткування для покриття насіння, якщо воно калібровано правильно, і чи може оброблена маса насіння бути випущена для поставки. Однак традиційні способи визначення залишків інсектицидів на насіннях надзвичайно тривалі і вимагають великих витрат, оскільки вони вимагають високоспеціалізованих та дорогих аналітичних методик, таких, як газо-рідинна або високоефективна рідинна хроматографія (ВЕРХ). Обидві хроматографічні методики вимагають дорогого устаткування, яке дорого обслуговувати і на якому повинні працювати фахівці високої кваліфікації. Виробничі об'єкти для обробки насіння та виробники сільськогосподарської продукції звичайно не мають такого устаткування або кадрового складу, тому насіння повинно відправлятися в зовнішні аналітичні лабораторії. Якщо зразки аналізуються такими лабораторіями на основі швидкої оборотності, виробничий об'єкт, який обробляє насіння, може одержувати аналітичні дані приблизно через двадцять чотири години після відправлення. Сповільнені аналізи приводять до більш тривалих перерв у роботі. Ці перерви приводять до незайнятого машинного часу в об'єктах, які піддають обробці. Затримки у відправленні обробленого насіння також неминучі. У цій галузі існує нагальна потреба удосконалити існуючі методики вимірювання, щоб зробити їх менш дорогими, більш ефективними та більш легко здійснюваними. Необхідні способи також повинні бути застосовні за межами лабораторії, у польових умовах, так щоб вони могли швидко і вірогідно забезпечити персонал, який обробляє рослину або насіння, інформацією про наявність та концентрації даного інсектициду в зразку насіння. У цьому відношенні важливо, щоб способи дозволяли диференціювати пестицидний матеріал від інших продуктів, роблячи можливим кількісне визначення потрібного активного інгредієнта, який присутній у насінні. Однак усе ще залишається багато серйозних обмежень, які властиві класичним аналітичним методам. Деякі з цих обмежень можна було б подолати шляхом використання методики імунологічного аналізу. Імунологічні аналізи та визначення пестицидів Створені спочатку для використання в медицині і ветеринарії, імунологічні аналізи почали знаходити все більше застосування в сільськогосподарській галузі. Наприклад, доступні імунологічні аналізи для визначення і кількісної оцінки хвороб сільськогосподарських культур, афлатоксинів та деяких антибіотиків. Незважаючи на те, що імунологічні аналізи для визначення пестицидів описані в науковій літературі (дивись нижче), вони стали доступні на комерційній основі лише протягом останнього десятиліття. Імунологічні аналізи ґрунтуються на високоспецифічних антитілах і відносно простих аналітичних приладах для визначення і/або кількісної оцін 7 ки великої розмаїтості матеріалів-мішеней. Антитіло, а не прилад або умови роботи, забезпечує аналітичну специфічність. Отже, імунологічні аналізи можуть проводитися на відносно неочищених зразках. Більш того, імунологічні способи були оптимізовані для застосування у віддаленому, не лабораторному оточенні, що допускає їх використання в полі так само, як і в спеціалізованій лабораторії. Відомі імунологічні способи для визначення деяких гербіцидів, включаючи 2,4дихлорфеноксіоцтову кислоту [Fleeker J., J. Assoc. Off. Anal. Chem. 70:874-878 (1986)], хлорсульфурон [Kelley Μ. і ін., J. Agric. Food Chem. 33:962-965 (1985)], галоацетаміди [Winzenburger P.A. і ін., European Patent Publication EP 340198, 1989] і багато пестицидів, включаючи дифлубензурон [Wie S.I. і ін., J. Agric. Food Chem. 30:949-957 (1982)], металаксил [Newsome W.H., J. Agric. Food Chem. 33:528-530 (1985)] і паратіон [Ercetgovich CD. і ін., J. Agric. Food Chem. 29:559-563 (1981)]. Описаний також спосіб для імунологічного визначення атразину [патент US №4530786]. Відомі також імунологічні аналізи для ціаназину, диклофоп-метилу, пентахлорфенолу, 2,4,5-Т і тербутрину. В усіх згаданих вище імунологічних способах використовували поліклональні антисироватки, які одержували від тварин-хазяїнів (звичайно від кроликів), імунізованих відповідним антигеном (імуногеном). Зовсім недавно розкриті моноклональні антитіла (mAbs), специфічні до атразину, його похідних та продуктів розпаду, і використання таких mAbs в імунологічних аналізах [Sclhaeppi і ін., European Patent Publication EP 365818(1990)]. Через свою низьку молекулярну масу інсектициди не є імуногенними і не викликають утворення специфічних антитіл у тварини-хазяїна. Отже, створення імунологічного аналізу інсектицидів вимагає багатьох стадій, починаючи зі створення гаптенів, похідних інсектициду, які підтримують структурну специфічність молекули інсектициду й у той же час допускають кон'югацію з білком«переносником», який має більш високу молекулярну масу. Крім того, для скрінингу антитіл при здійсненні способу їх продукції можуть бути також одержані додаткові гаптени, які за хімічною структурою відрізняються від гаптену, який використовується для імунізації тварин. Нарешті, як тільки препарат антитіла одержаний (чи поліклонального, чи моноклонального), повинен бути створений досить чутливий імунологічний аналіз. Основні концепції, які використовуються в сучасних імунологічних аналізах, описані в численних посиланнях [дивись, наприклад, Voller А. і ін. (ред.), Immunoassays For The 80's, University Park, 1981; Voller Α., "The Enzyme Linked Immunosorbent Assay (ELISA)", Diagnostic Horizons 2:1-7, 1978, Microbiological Associates Quarterly Publication, Walkersville, Md; Voller А. і ін., J. Clin. Pathol. 31:507-520 (1978); Butler J.E., Meth. Enzymol. 73:482-523(1981); Maggio E. (ред.), Enzyme Immunoassay, CRC Press, Boca Raton, Fla., 1980]. При кожному підході істотним є побудова калібрувальних кривих з використанням відомих кількостей потрібної аналізованої речовини. 76708 8 Спосіб із застосуванням «міченого антитіла» у звичайному застосуванні означає твердофазний імуноферментний аналіз (ELISA). У даному випадку білковий кон'югат пестициду (що називається антигеном «з покриттям» або «скринінговим» антигеном) одержують, використовуючи білок, який не є структурно споріднений до білка-переносника, що застосовують в пестицидному імуногені, проти якого вироблялися антипестицидні антитіла. Кон'югат антигену з покриттям іммобілізують на твердофазній основі, такій, як лунка мікропланшета, що приводить до фіксованого на твердій фазі кількості пестициду на реакцію. Поряд з досліджуваним зразком додають відому кількість антитіла. Іммобілізований пестицид конкурує з вільним пестицидом у дослідному зразку за обмежену кількість ділянок зв'язування антитіл. Взаємодія між антитілом і речовиною, яку визначають при аналізі, в рідкій фазі пригнічує зв'язування антитіла з іммобілізованим на твердій фазі пестицидом. Антитіло, зв'язане з твердою фазою, визначають за допомогою другого антитіла, специфічного до незмінної ділянки важкого ланцюга антипестицидного антитіла. Багато пов'язаних з ферментом других антитіл комерційно доступні для такого застосування. Після відмивання незв'язаного другого антитіла іммобілізоване друге антитіло звичайно визначають додаванням хромогенного субстрату ферменту, що приводить до забарвленого продукту реакції, який утворений в прямій пропорції до кількості другого зв'язаного антитіла. Таким чином, кількість продукту реакції обернено пропорційно кількості аналізованої речовини в досліджуваному зразку. Модифікація способу «міченого антитіла» виключає застосування антигену з покриттям. При імуноферментному аналізі (ЕІА) антипестицидне антитіло іммобілізують на твердій фазі. Пестицидний гаптен ковалентно зв'язують з ферментом, і ферментний кон'югат, який утворюється, інкубують зі зразками в мікрокомірках або пробірках культивування, покритих антипестицидним антитілом. Пестицид у зразку конкурує з кон'югатом пестицидного гаптену і ферменту за зв'язування з іммобілізованим антитілом. Тверду фазу промивають для видалення незв'язаних матеріалів і кон'югат антитіло-зв'язаний фермент визначають додаванням хромогенного субстрату. Дивись, наприклад, [Bushway R.J., L.P.Perkins, S.A.Savage, S.L.Lekousi, B.S.Ferguson. 1988. Determination of atrazine residues in water and soil by enzyme immunoassay. Bull. Environ. Contam. Toxicol. 40:647-654; Fleeker J.R., L.W.Cook. 1991. Reliability of commercial enzyme immunoassay in detection of atrazine in water. P.78-85 у Μ.Vanderlann, L.H.Stanker, B.E.Watkins, D.W.Roberts (ред.), Immunoassays for Trace Chemical Analysis. ACS Symposium Series 451. Washington, D.C.: American Chemical Society]. У сільськогосподарській галузі існує необхідність у способі аналізу насіння, обробленого активними інгредієнтами, такими, як інсектицид, який можна проводити в полі або всередині виробничого приміщення для обробки насіння. 9 Даний винахід забезпечує неонікотиноїдні гаптени та імуногени для вироблення антинеонікотиноїдних антитіл, а також способи, реагенти та набори для визначення наявності одного або декількох неонікотиноїдних інсектицидів у зразку за допомогою імунологічного аналізу. Даний винахід має особливе застосування для визначення концентрації неонікотиноїдних інсектицидів, нанесених на рослинні відтворювані матеріали, такі, як насіння. Спосіб імунологічного аналізу за винаходом дозволяє персоналу виробничих приміщень для обробки насіння, де неонікотиноїдні інсектициди наносять на насіння, кількісно вимірювати нанесений активний інгредієнт. Спосіб включає швидку екстракцію активних інгредієнтів з насіння і швидке вимірювання екстракційнного розчину, яке ґрунтується на імунологічному аналізі. Дані вимірювання можна використовувати, щоб визначити, чи працює належним чином устаткування для покриття насінин, якщо воно калібровано правильно, і чи може оброблена маса насіння бути випущена для постачання. Створюваний аналіз повинний бути простим у здійсненні, що вимагає лише звичайного лабораторного устаткування і реагентів. Тому персонал, позбавлений досвіду проведення імунологічних аналізів, зможе успішно проводити дослідження після декількох практичних експериментів. Було знайдено, що антигенні неонікотиноїдні кон'югати (імуногени) можуть бути одержані кон'югацією неонікотиноїдного пестицидного гаптену з молекулою-переносником, такою, як очищене білкове похідне (PPD, туберкулін) з вірусу Diptheria, бичачий сироватковий альбумін, людський сироватковий альбумін, овальбумін, або кон'югацією гемоціаніну з молюска Keyhole Limpet (Megathura crenulata) з неонікотиноїдним гаптеном. Можуть бути одержані кон'югати перетворених у похідні матеріалів, таких, як похідне бичачого сироваткового альбуміну, катіонований бичачий сироватковий альбумін тощо. Дивись [A. Muckerheide, R. Apple, A. Pesce, J.G. Michael (1987) J.Immunol. 138:833-837]. Дані імуногени потім можуть бути ін'єковані тваринам-хазяям, які виробляють антитіла до неонікотиноїдного гаптену, які можна зібрати. Потім ці антитіла можуть бути утилізовані в різноманітних методиках імунологічного аналізу для визначення відповідних неонікотиноїдних інсектицидів з використанням різних відомих маркерів, щоб позначити або інсектицид, або антитіло. У деяких варіантах втілення імунологічних аналізів іммобілізують або похідне неонікотиноїдного інсектициду, або антитіло. Як поліклональні, так і моноклональні антитіла можуть застосовуватися в практиці за даним винаходом. Антитіла можуть виявитися селективно зв'язаними з потрібними неонікотиноїдними інсектицидами навіть у присутності інших активних пестицидних інгредієнтів, включаючи інші неонікотиноїдні інсектициди, введені в суміш для покриття насіння. Способи визначення, які можуть застосовуватися на практиці за даним винаходом для вимірювання неонікотиноїдних інсектицидів у зразку, включають біодатчики і ферментні, флуоресцентні, хемілюмінесцентні і радіометричні системи. Для 76708 10 таких аналізів можна використовувати гетерогенний або гомогенний режими і можна застосовувати планшети з мікрокомірками, пробірки для культивування і латексні кульки або частинки як тверді фази. Імунологічні аналізи за даним винаходом застосовують для визначення концентрації неонікотиноїдних інсектицидів, таких, як імідаклоприд, нітенпірам, ацетаміприд, тіаметоксам, тіаклоприд і клотіадин, у зразку, а також у рослинному відтворюваному матеріалі. Даний винахід забезпечує імунологічні аналізи для дослідження зразка на присутність неонікотиноїдних інсектицидів. У таких імунологічних аналізах реакція неонікотиоїдного (антигену)/антитіла може бути визначена різноманітними способами, які використовують різні маркери для введення мітки або в антиген, або в антитіло, щоб уможливити визначення продукту реакції. Більш того, у багатьох випадках іммобілізація або антигену, або антитіла буде сприяти визначенню. Аналізи антигену/антитіла можна розділити на дві категорій: гетерогенну і гомогенну. Гетерогенні аналізи перед визначенням продукту реакції потребують відділення компонента зі зв'язаною міткою від компонента з вільною міткою. При гомогенному аналізі такий етап відділення не потрібно. Крім того, аналізи можуть бути (1) конкурентними, наприклад, якщо антиген конкурує за мічене антитіло з антигеном, іммобілізованим на твердій фазі, або якщо антиген конкурує з міченим антигеном за антитіло, іммобілізоване на твердій фазі, або (2) неконкурентними, якщо існує пряма взаємозалежність між міткою і антитілом або антигеном. Способи імунологічного аналізу, які можуть застосовуватися на практиці за даним винаходом для визначення неонікотиноїдних інсектицидів у зразку, включають ферментний, флуоресцентний, хемілюмінесцентний і біосенсорний імунологічний аналіз, а також радіоімунологічний аналіз. У твердофазному ферментному імунологічному аналізі (ELISA) за даним винаходом гаптени, які відповідають неонікотиноїдним інсектицидам, що представляють інтерес, можна мітити безпосередньо з ферментом або непрямим способом з використанням мічених за ферментом антитіл, які при відповідних умовах каталізують реакцію із субстратом. Ферментну активність звичайно визначають за допомогою утворення забарвленого продукту реакції, тобто, забарвленої кінцевої точки, що може бути легко виявлена візуально або виміряна спектроскопічними або відбивальними способами. У методиках флуоресцентного імунологічного аналізу для застосування за даним винаходом гаптени, що відповідають неонікотиноїдним інсектицидам, що представляють інтерес, можна мітити безпосередньо з флуорохромами або непрямим способом з використанням мічених за флуорохромом антитіл. Флуорохроми представляють собою барвники, які поглинають випромінювання (наприклад, ультрафіолетове світло), при цьому збуджуються і випромінюють світло (наприклад, видиме світло). 11 В одному варіанті втілення за даним винаходом спосіб визначення концентрації неонікотиноїдного інсектициду в зразку складається з етапів: (а) забезпечення твердої фази з іммобілізованим антитілом, селективним до згаданого неонікотиноїдного інсектициду; (б) контакт згаданого зразка з іммобілізованим антитілом у присутності відомої кількості кон'югата неонікотиноїдний інсектицидний гаптен-фермент; (в) промивання твердої фази етапу (б) для видалення будь-якого незв'язаного гаптенферментного кон'югата або зразка; (г) взаємодія хромогенного субстрату, специфічного до згаданого гаптен-ферментного кон'югату, із промитою твердою фазою етапу (в) для того, щоб генерувати хромоген; і (д) вимірювання кількості хромогену, одержаного на етапі (г), для визначення кількості кон'югата антитіло-зв'язаний гаптен-фермент і, отже, кількості неонікотиноїдного інсектициду в згаданому зразку. В одному варіанті втілення винаходу імунологічний аналіз забезпечується у вигляді набору, який включає покриті антитілом пробірки, кон'югат неонікотиноїдний гаптен-фермент, субстрат ферменту і розчин для припинення утворення колориметричного сигналу. Незважаючи на те, що в описі винаходу часто згадується застосування поліклональних антитіл, фахівці в цій галузі зрозуміють, що моноклональні антитіла могли бути використані як альтернатива до застосування поліклональних антитіл. Термін «антитіла», який використовується у контексті, за походженням стосується поліклональних або моноклональних антитіл. Моноклональні антитіла до неонікотиноїдних інсектицидів для застосування в практиці за даним винаходом одержують, використовуючи методики імунізації та культивування гібридом, добре відомі фахівцям. Відповідні лінії клітин гібридоми одержують злиттям клітини, яка продукує антитіло, і мієломної клітини, одержаної з мишиних видів. Клітинами, які продукують антитіла, переважно є клітини селезінки. Може бути використана будьяка відповідна мієломна клітинна лінія, однак бажано застосовувати добре охарактеризовані лінії клітин, деякі з яких звичайно застосовуються. Подібним чином поліклональні антитіла до неонікотиноїдних інсектицидів для застосування в практиці за даним винаходом також одержують, використовуючи методики, добре відоміфахівцям. Даний винахід забезпечує також препарат поліклонального антитіла до IgG (імуноглобуліну G), який зв'язує принаймні один неонікотиноїдний інсектицид, препарат антитіла одержують способом, який складається з етапів: (а) введення хазяїну попередньо визначеної кількості композиції, що включає неонікотиноїдний інсектицид або імунологічний еквівалент, з'єднаний з біологічно прийнятним білком-переносником, (б) збирання сироватки хазяїна і (в) очищення антитіла до IgG від сироватки. Імунологічний еквівалент антигену має здатність при введенні хазяїну викликати вироблення антитіл до антигену. 76708 12 Як відзначено вище, імунологічний аналіз за даним винаходом має особливе застосування для визначення кількості неонікотиноїдного інсектициду, який нанесений на рослинний відтворюваний матеріал. Мається на увазі, що термін «рослинний відтворюваний матеріал» означає всі генеративні частини рослини, такі, як насіння, які можна використовувати для розмноження останньої, і вегетативний рослинний матеріал, такий, як обрізки і бульби (наприклад, картоплі). Можна згадати, наприклад, насіння (у строгому розумінні слова), корені, плоди, бульби, цибулини, кореневища і частини рослин. Можна також згадати пророслі рослини і молоді рослини, що повинні бути пересаджені після проростання або після появи над ґрунтом. Ці молоді рослини можна захистити перед пересадженням за допомогою повної або часткової обробки шляхом занурення. В одному варіанті втілення неонікотиноїдний інсектицид, який визначається аналізом за даним винаходом, представлений формулою (I) де А означає 2-хлорпірид-5-ил або 2хлортіазол-5-іл; R і R3 незалежно один від одного означають водень або (С1-С4)алкіл; R1 і R2 незалежно один від одного означають водень або (С1-С4)алкіл, або R1 і R2 разом з атомами азоту, до яких вони приєднані, утворюють імідазолідинове або оксадіазинове кільце; і X означає -N-NO2 або -N-CN. В іншому варіанті втілення неонікотиноїдний інсектицид, який визначається аналізом за даним винаходом, представлений формулою (II) де A, R3 і X мають наведені вище значення для формули (І). У переважному варіанті втілення імунологічний аналіз за даним винаходом використовує поліклональні антитіла для неонікотиноїдного інсектициду. Ці антитіла можуть бути одержані із сироватки імунізованої тварини. Імунізація може бути здійснена шляхом ін'єкції імуногену (антигенний кон'югат гаптен-PPD) видам тварин, які продукують антитіла, звичайно ссавцю і переважно кролику або вівці. Як правило, початкова ін'єкція супроводжується серією послідовних бустерних ін'єкцій, щоб викликати максимальне утворення антитіл. Оптимально режим введення складається з багаторазових доз, які вводяться білим кроликам породи New Zealand. Кількість імуногену, яка вводиться ін'єкцією, змінюється, але повинна бути адекватною до вироблення кількості антитіл, що визначається. Одержання антитіл може бути підт 13 76708 верджено аналізом сироватки, одержаної в дослідних пробах, із застосуванням ЕІА, ELISA або непрямого флуоресцентного імунологічного аналізу. Ті ж самі мітки, які використовують у відомих імунометричних аналізах, можуть застосовуватися для мічення гаптену за даним винаходом. Серед них можна згадати репортерні молекули (RM), які включають ферменти, такі, як лужна фосфатаза, пероксидаза хрону і -галактозидаза. Крім того, можуть бути використані флуоресцентні, люмінесцентні або радіоактивні мітки, такі, як флуоресцеїн, родамін, люмінол, акридій і радіоактивні ізотопи І25 І і т.д., або колоїдні частинки, такі, як золото і селен і т.д. Нарешті, флуорофори лантанідів, які утворюють хелати, таких, як європій і тербій, можна використовувати для генерування дозволених за часом флуоресцентних сигналів. Найбільш розповсюдженими ферментними маркерами є пероксидаза хрону (HRP) і лужна фосфатаза. В одному варіанті втілення для визначення кількості неонікотиноїду в зразку використовують спектрофотометр. Однак способи за даним винаходом можуть бути адаптовані фахівцями в цій галузі до інших типів хромогенних детекторів. Подібним чином продукт реакції, що визначається, не обмежений наявністю хромофора, а може містити інші мітки, як описано вище. Було знайдено, що гаптени наступних формул (ІА), (IB) і (IIА) застосовні для утворення антигенних неонікотиноїдних кон'югатів (імуногенів) і аналізованих кон'югатів. Гаптен (ІА) 14 R1 і R2 разом з атомами азоту, до яких вони приєднані, утворюють імідазолідинове або оксадіазинове кільце; n означає ціле число 1-5 (переважно ціле число 3-5); і X означає О, -Ν-ΝΟ2 або -NCN. Гаптен (IB) (IB) де A, R1, R2, R3 і X мають значення, як у формулі (ІА); і Ε означає одинарний ковалентний зв'язок або залишок зв'язувальної групи формули -(СН2)m-, у якій m означає ціле число 1-3. Приклад 1: гаптен (llΙΑ) (IIIA) де A, R3, X і n мають значення, як у формулі (ІА). Гаптен (llІВ) (IIB) (IA) де А означає 2-хлорпірид-5-ил або 2-хлортіазол5-іл; R3 означає водень або (С1-С4)алкіл; R1 і R2 незалежно один від одного означають водень або (С1-С4)алкіл, або де A, R3 і X мають значення, як у формулі (ІА), і Ε має значення, як у формулі (IB). Гаптени формул (llΙΑ) і (lllВ) можуть бути одержані за аналогією з наступними методиками: Потрібний гаптен (lllА) або (lllВ) одержують, використовуючи відповідне похідне 2аміноетантіолу, вибране із сполук формул (IIID) або 15 76708 16 (IIIE) го середовища. Крім того, компоненти білкового кон'югата мають тенденцію бути відносно нерозчинними в неводних розчинниках. Було знайдено, що гаптенові кон'югати наступної формули застосовні в практиці за винаходом: де R має значення, наведене вище, для формули (І). Було знайдено, що наступні гаптени особливо корисні в практиці за даним винаходом: (II) де n у кожному випадку означає ціле число 15; переважно n означає ціле число 3-5. Антигенні неонікотиноїдні кон'югати (імуногени) і аналізовані кон'югати можуть бути одержані з'єднанням неонікотиноїдного пестицидного гаптену з переносником або репортерною молекулою залежно від обставини, використовуючи методики, відомі фахівцям у цій галузі. Два основних підходи можуть бути вибрані. Перший використовує лінкери, які стають частиною кон'югата. Дані лінкери є гомобіфункціональними або гетеробіфункціональними і включають ті, які здатні утворювати, наприклад, дисульфідні зв'язки з тіольними групами залишків цистеїну в білкових субстратах або утворювати амідні зв'язки між N-кінцевою аміногрупою або аміногрупами в бокових ланцюгах або в залишках лізину, і активовані ацильні залишки, такі, як сукцинімідні складні ефіри. Загалом, даний підхід включає наявність у лінкера функціональних груп з високою реакційною здатністю і є досить легким у відношенні субстратів для кон'югації. Однак у багатьох випадках вигідно використовувати функціональні групи, які можуть бути менш реакційноздатними, такі, як ті, які здатні утворити гідразони. Другий підхід, особливо зручний при кон'югації двох білкових частин, використовує дегідратуючий агент, такий, як карбодіімід, щоб вплинути на утворення, наприклад, пептидних зв'язків при взаємодії карбоксильної групи одного компонента кон'югата з вільною аміногрупою іншого. У цьому випадку реагент не стає частиною кон'югата. Ця реакція не є особливо зручною, оскільки карбоксильна група не активована; карбодіімід утворює активну проміжну сполуку і зрушує рівновагу шляхом видалення елементів води для утворення пептидного зв'язку. Обидва підходи до кон'югації, як правило, здійснюють у водних розчинниках, оскільки білковий матеріал, який утворює кон'югат, легко денатурує. Білки, розраховані на те, щоб бути стійкими у водному навколишньому середовищі, як відомо, денатурують навіть у таких розчинниках, як етанол, що, здавалося б, є досить подібним до водно де A, R , R2, R3, n і X мають значення, наведені вище для формули (ІА), і PR означає залишок білка: (1) молекули-переносника, такої, як очищене похідне білка (PPD, туберкулін) з вірусу Diptheria, бичачий сироватковий альбумін, людський сироватковий альбумін, овальбумін або гемоціанін з молюска Keyhole Limpet у випадку імуногена, або (2) репортерної молекули (RM), такої, як лужна фосфатаза, пероксидаза хрону і -галактозидаза. Крім того, гаптенові кон'югати наступної формули також є прийнятними: (IIA) де A, R1, R2, R3, Ε і X мають значення, наведені вище для формули (IB). Було показано, що наступні кон'югати особливо корисні в практиці за даним винаходом: де n у кожному випадку означає ціле число 15; переважно n означає ціле число 3-5. Немічене поліклональне антитіло, яке застосовується в способі за даним винаходом для зв'язування антигенного неонікотиноїдного кон'югата або кон'югата гаптен-RM у тестованому зразку, може бути іммобілізоване на будь-якій з основ, які звичайно застосовують у імунометричних аналізах. Серед тих. які можуть застосовуватися, фільтрувальний папір, латексні або полістирольні кульки і поліетиленовий, полістирольний, поліпропіленовий або інший придатний планшет з мікрокомірками або пробірка. Ця основа може бути зроблена з будь-якого полімеру природного або синтетичного походження або з аморфного матеріалу, такого, як скло. Вигідно використовувати мембрани з нітроцелюлози або нейлону для реакційних смуг і полівінільні, поліпропіленові, полісти 17 76708 18 рольні або інші пластмаси для кульок або мікропланшетів. Можуть також використовуватися гелі або частинки, в основі яких агароза, акриламід або латекс. Крім того, будь-які з імунохроматографічних пристроїв, смуг для тестування і пристроїв з горизонтальним розтіканням, відомі фахівцям, можуть бути адаптовані до способу за даним винаходом. Серед відповідних пристроїв з горизонтальним розтіканням можна згадати, наприклад, тип такого пристрою, розкритий у [патенті US №4366241]. Методики для прив'язування антитіл до таких матеріалів добре відомі фахівцям. Відповідним джерелом одержання антитіл, зв'язаних з основою, є, наприклад, [Beacon Analytical Systems, Inc. (Portland, Maine)]. Щоб приготувати зразок насіння для використання в аналізі, вибірку з обробленої неонікотиноїдом серії (наприклад, 5-100г насіння рапсу; 10200г насінин сорго, пшениці, бавовни, польової кукурудзи або цукрової кукурудзи) диспергують у відповідному розчиннику, такому, як ацетон, ацетонітрил, етанол, ізопропанол, метанол або суміші цих розчинників з різним процентним вмістом води. Прийнятні суміші води і розчинників включають, наприклад, 1-50% метанолу/води і 1-20% ацетонітрилу/води. Дисперговане насіння змішують за допомогою обертання і потім поміщають у баню, яка опромінюється ультразвуком, приблизно на двадцять хвилин з наступним додатковим обертанням. Вмісту дають відстоюватися. Визначену частину рідкого екстракту видаляють і додають відому кількість розчину, наприклад, 1% ацетонітрил/вода. Екстракт розбавляють додатково, щоб довести концентрацію екстрагованого неонікотиноїду до діапазону калібрувальної кривої. Було знайдено, що розведення від 1000- до 60000-кратного є зручними. Імунологічний аналіз займає приблизно тридцять п'ять хвилин для свого виконання. Екстракція і приготування екстракту для аналізу займають приблизно тридцять хвилин. Отже, зразок насіння може бути екстрагований і аналізований приблизно за одну годину і п'ять хвилин. В одному варіанті втілення винаходу до двох зразків насіння (разом з вибірками - до п'яти проб на зразок насіння) можуть аналізуватися одночасно. Концентрації неонікотиноїдних інсектицидів від приблизно десяти тисяч частин на мільйон до однієї другої частини на мільярд можуть бути визначені в імунологічних аналізах за даним винаходом. Однак спосіб придатний для будь-якої кількості присутнього неонікотиноїдного інсектициду за умови, що неонікотиноїдний інсектицид у зразку або в екстракті зразка випадає в осад або може бути відповідним чином розведений, щоб випасти в осад у межах калібрувальної кривої. Одержання антигену, вироблення поліклональних антитіл і імунологічний аналіз ілюструються більш докладно наступними прикладами, які не обмежують винахід. Приклади Приклад 1 - синтетична методика для тіаметоксамового гаптену 1.1 2-Метил-1-нітрозосечовина Розчиняли сульфат О-метилізосечовини (38,5г) у суміші азотної кислоти (120мл)/сірчаної кислоти (280мл) при 0°С і перемішували протягом 2год при 0°С. Обережно виливали суміш на колотий лід при перемішуванні і потім . видаляли колотий лід фільтруванням. Розчиняли голчасті кристали в етилацетаті і підлуговували розчин 19 додаванням карбонату калію. Сушили розчин над сульфатом магнію і фільтрували. Концентрували фільтрат, одержуючи білу порошкоподібну речовину (5г). 1.2 Готували розчин з 3г гідрохлориду метилового ефіру 4-аміномасляної кислоти (1.1а) і 15мл води. Доводили рН до 11, додаючи по краплях 2н. NaOH при охолодженні розчину в бані з льодом. Реакційну колбу обладнували електродом для вимірювання рН і термометром, одержаний прозорий основний розчин швидко перемішували в міру додавання невеликими порціями 2-метил-1нітрозосечовини (2,38г), щоб підтримувати температуру розчину нижче 2°С. Коли додавання завершувалося, реакційну суміш перемішували протягом 1,5год при 0°С; відзначити, що значення рН стабілізувалося при 9,6. Додавали ТГФ (1мл) і перемішували протягом додаткових 2год. Реакційну суміш розбавляли водою і виливали в етилацетат. Після відділення органічної фази її сушили над сульфатом магнію, розчин фільтрували. Концентрація фільтрату дала прозоре масло. Флешхроматографія неочищеного масла на силікагелі при елююванні сумішшю дихлорметан/ацетонітрил (3:1) привела до 750мг необхідного продукту у вигляді білої твердої речовини. 1.3 Об'єднували продукт із досліду 1.2 (1,44г) з параформальдегідом (422мг), метансульфоновою кислотою (0,023мл) і мурашиною кислотою (10мл) і нагрівали при 55°С впродовж 15год. Реакційну суміш концентрували у вакуумі. Одержане коричневе масло суспендували в толуолі і за допомогою азеотропу упарювали розчин досуха. Масло, що утворюється, розчиняли в суміші ТГФ/діоксан/ацетонітрил (1:1:1) і обробляли його надлишком діазометану. Даний розчин перемішували протягом 30хв і реакційну суміш обробляли оцтовою кислотою. Концентрували реакційну суміш до утворення масла. Знову розчиняли масло в етилацетаті, промивали розведеним розчином бікарбонату натрію, сушили над сульфатом магнію і знову концентрували до утворення масла. Очищали це масло флеш-хроматографією у суміші дихлорметан/ацетонітрил (3:1), одержуючи 658мг необхідного складного ефіру оксадіазинаміномасляної кислоти (1.3) у вигляді прозорого масла. 1.4 Розчиняли продукт із досліду 1.3 (1,1г) в ацетонітрилі (50мл) і додавали 3г карбонату калію. Додавали (хлорметил)хлортіазол однією порцією і реакційну суміш нагрівали при 55°С впродовж 20год. Охолоджували реакційну суміш до кімнатної температури і фільтрували для видалення твердих речовин. Одержаний коричневий фільтрат концентрували до утворення масла. Очищали масло флеш-хроматографією у суміші дихлорметан/ацетонітрил (3:1), одержуючи 894мг необхідної сполуки у вигляді жовтого/коричневого масла. 1.5 Розчиняли сполуку 1.4 (372мг) у 8мл концентрованої соляної кислоти і 1мл води і перемішували протягом 6год при кімнатній температурі. Розбавляли реакційну суміш водою й обережно підлуго 76708 20 вували, додаючи 1н. NaOH доти, поки значення рН не досягло 4,5. Екстрагували етилацетатом, органічну фракцію сушили над сульфатом магнію. Концентрували висушену органічну фракцію до утворення масла, яке очищали флешхроматографією у суміші дихлорметан/ацетонітрил (1:1), одержуючи потрібний продукт 1.5 (100мг). Приклади 2-5-тіаметоксамові гаптени Використовували синтетичні методики прикладу 1 для одержання наступних тіаметоксамових гаптенів, показаних у таблиці 1, шляхом заміни проміжної сполуки 1.1а відповідним аналогом формули NH2(CH2)nCO2R (1.1b), де n означає ціле число 1-5 і R означає Η або (С1-С4)алкіл. Приклади 9 - тіаметоксамові гаптени Використовували синтетичні методики прикладу 1 для одержання наступних гаптенів тіаметоксаму, показаних у таблиці 2, шляхом заміни проміжної сполуки 1.1а відповідним аналогом формули 1.1с де Ε означає ковалентний одинарний зв'язок або лінкер -(СН2)m-, в якому т означає ціле число 1-3; R означає Η або (С1-С4)алкіл. 21 76708 22 Приклад 10 - синтетична методика для дезнітроімінотіаметоксамового гаптену Методика Об'єднували гаптен тіаметоксаммасляної кислоти (100мг, 0,275ммоля) і анізол (6,5мл) у круглодонній колбі на 10мл, обладнаній магнітною мішалкою і зворотним холодильником. Колбу поміщали в масляну баню і нагрівали при 165°С впродовж 2год. Анізол видаляли при зниженому тиску при 50°С впродовж 5год. Одержаний маслянистий продукт мав чистоту 93% за аналізом методом ВЕРХ. Спектроскопічні дані для характеристики ВЕРХ: сорбент Keystone Scientific Aquasil С-18, 5мкм (колонка 25 0,46см); ацетонітрил-20мМ фосфорна кислота (40:60); 1,0мл/хв; t 40°С; УФдетектор при 240нм (ширина смуги 100нм); час пробігу 13хв; час утримування 4,6хв. ТШХ: (діольний гель) дихлорметан/ацетонітрил (2:1), Rf=0,25. 1 Н-ЯМР (CD3CN, 300МГц), :7,43 (т, 1Н), 4,78 (с, 4H), 4,75 (с, 4Н), 4,48 (д, 2Н), 3,29 (т, 2Н), 2,27 (т, 2Н), 1,73 (кв, 2Н). Мас-спектр [електронна іонізація (ЕІ)/пристрій прямого введення (DEP)]: m/z 319 (M+) Елементний аналіз: обчислено, %: С 41,32; Η 4,41; Ν 13,14; знайдено, %: С 40,13; Η 4,43; Ν 12,99. Приклади 11-18 - дезнітроімінотіаметоксамові гаптени Використовували синтетичні методики прикладу 10 для одержання наступних дезнітроімінотіаметоксамових гаптенів, наведених у таблиці 3. заміняючи сполуку, одержану в прикладі 1, відповідним аналогом із прикладів 2-9. Приклади 19-27 - імідаклопридні гаптени Використовували синтетичні методики прикладу 1 для одержання наступних гаптенів імідаклоприду, представлених у таблиці 4, використовуючи нітрогуанідильне похідне, одержане в досліді 1.2, або його аналог, одержаний заміною проміжної сполуки 1.1а на відповідний аналог формули 1.1b або 1.1с, як показано в прикладах 2-9. 23 Приклади 28-36 - гаптени дезнітроіміноімідаклоприду Використовували синтетичні методики прикладу 10 для одержання наступних гаптенів дезнітроіміноімідаклоприду, наведених у таблиці 5, заміняючи сполуку, одержану в прикладі 1, відповідним аналогом із прикладів 19-27. 76708 24 Приклади 37-45 - гаптени клотіадину Використовували синтетичні методики прикладу 1 для одержання наступних гаптенів клотіадину, наведених у таблиці 6, з використанням нітрогуанідильного похідного, одержаного в досліді 1.2, або його аналога, одержаного заміною проміжної сполуки 1.1а відповідним аналогом формули 1.1b або 1.1с, як показано в прикладах 2-9. 25 76708 26 Приклади 55-63 - гаптени тіаклоприду Використовували синтетичні методики, описані для гаптенів формул (lllА) і (lllВ), для одержання наступних гаптенів клотіадину, наведених у таблиці 8. Приклади 46-54 - гаптени дезнітроіміноклотіадину Використовували синтетичні методики прикладу 10 для одержання наступних дезнітроіміноклотіадинових гаптенів, наведених у таблиці 7, заміняючи сполуку, одержану в прикладі 1, відповідним аналогом із прикладів 37-45. Приклад 64 - одержання тіаметоксамового імуногену 64.1 Готували розчин очищеного білкового похідного (туберкуліну, PPD) у 0,01 ЗФР, рН 7,4 до концентрації 1мг/мл. Доводили рН 0,5мл аліквотної проби даного розчину до 4,5-5,0 з 0,1Μ соляною кислотою. 64.2 Розчиняли гаптен тіаметоксаму з прикладу 1 (1мг) у 250мкл 0,1Μ розчину 2-(Nморфоліно)етансульфонової кислоти, рН 4,5. Об'єднували розчини гаптену і PPD. 27 64.3 Розчиняли 1мг гідрохлориду 1(диметиламінопропіл)-3-етилкарбодііміду (EDC) у 100мкл дистильованої деіонізованої води. Негайно додавали розчин EDC до розчину гаптен-PPD з досліду 3.2. Змішували розчин гаптен-PPD-EDC шляхом обертання протягом 2год при кімнатній температурі. Переносили реакційну суміш у діалізний мішок з відокремленням молекулярної маси 1000-2000Да. Піддавали діалізу екстенсивно проти 2л ЗФР при 4°С при трьох змінах/день протягом сорока восьми годин. Приклад 65 - одержання імідаклопридного імуногену Використовували методики прикладу 64 для одержання імідаклопридного імуногену з застосуванням гаптену з прикладу 21. Приклад 66 - одержання клотіадинового імуногену Використовували методики прикладу 64 для одержання клотіадинового імуногену з застосуванням гаптену з прикладу 39. Приклад 67 - одержання тіаклопридного імуногену Використовували методики прикладу 64 для одержання клотіадинового імуногену з застосуванням гаптену з прикладу 57. Приклад 68 - схема імунізації і збирання антитіл Для початкової імунізації розчиняли імуноген із прикладу 64 у повному ад'юванті Фрейнда. Робили щеплення білим кроликам-самкам породи New Zealand, вводячи приблизно 25мкг імуногену в кожну ділянку. Подібним чином імунізували овець за винятком того, що в кожну ділянку вводили приблизно 38мкг імуногена. При наступних імунізаціях розчиняли імуноген у неповному ад'юванті Фрейнда. Тварини відпочивали протягом чотирьох тижнів між імунізаціями і кров в них брали через десять днів після імунізації. Застосовували активаторні ін'єкції і відбирали кров у тварин протягом дев'яти місяців, наприкінці яких вони були знекровлені. Поліклональні антитіла збирали, використовуючи методики, відомі фахівцям у цій галузі. Приклад 69 - одержання кон'югатів гаптенфермент 69.1 Гаптен тіаметоксаму з прикладу 1 (3,1мг), Nгідроксисукцинімід (NHS) (4,0мг) і EDC (4,6мг) об'єднували в невеликому флаконі. Дані матеріали сушили під слабким струменем азоту протягом 15хв при кімнатній температурі. 69.2 Додавали сухий диметилформамід (2,0мл) і суміш опромінювали ультразвуком протягом 1хв. Одержаний розчин інкубували протягом ночі при кімнатній температурі. 69.3 У невеликому флаконі розчиняли пероксидазу хрону (8,5мг) у карбонатному буфері (2,0мл, 0,05М, рН 9,6). Флакон поміщали в баню з льодом. 69.4 Усі 100мкл розчину гаптен-NHS-EDS з досліду 6.2 повільно додавали протягом 1год і суміш інку 76708 28 бували при перемішуванні протягом 2год. Реакційну суміш пропускали через колонку із сефадексом G-25M, врівноважену із ЗФР (0,01М, рН 7,2). Ферментний кон'югат збирали в перших 3,0 мл елюату і додавали рівний об'єм гліцерину; зберігали при 20°С. Приклад 70 - імунологічний аналіз насіння рапсу, обробленого тіаметоксамом Частина екстракту насіння розбавляли сумішшю 1% метанол/вода доти, поки очікувана концентрація тіаметоксаму не була доведена до діапазону калібрувальної кривої, 0,5-120част./млрд. Пробірки з нанесеними антитілами мітили і поміщали в штатив таким чином, щоб перша й остання пробірки були стандартами, а інші стандарти і зразки змішували. Кожну пробірку закріплювали в штативі так, щоб його можна було перевернути без втрати пробірок. В усі відповідні пробірки додавали аліквоту стандарту або зразка (0,5мл). Розчин ферментного кон'югата (0,5мл) додавали в усі пробірки. Штатив обережно струшували, щоб змішати вміст усіх пробірок. Пробірки інкубували протягом 20хв при кімнатній температурі. Штатив перевертали, щоб декантувати вміст усіх пробірок. В усі пробірки додавали дистильовану воду до переповнення, використовуючи промивну склянку з дозувальним ковпачком, і промивну воду декантували. Пробірки промивали додатково тричі. Після останнього промивання штатив перевертали йобережно постукували пробірками по чистому паперовому рушнику, щоб видалити надлишок промивання. Додавали субстрат ферменту (0,5мл) в усі пробірки, які інкубували протягом 10хв при кімнатній температурі. У процесі інкубації штатив обережно струшували кожні 2,5хв. Кислий розчин, який зупиняє реакцію (1Μ соляна кислота, 0,5мл), додавали в усі пробірки, щоб припинити генерацію сигналу. Як показано в таблиці 10, поглинання продукту реакції вимірювали при 450нм. Поглинання стандартів використовували для побудови калібрувальної кривої, функція регресії у вигляді Υ=mLn(X)+В. Поглинання кожного зразка підставляли у функцію, щоб визначити концентрацію неонікотиноїдного пестициду в розведеному зразку. Одержану концентрацію множили на фактор розведення, щоб розрахувати кількість неонікотиноїдного пестициду у вихідному зразку. Таблиця 10 Типова стандартна крива імунологічного аналізу тіаметоксаму Концентрація1 тіаме- Поглинання при 450нм (анатоксаму літична відповідь) 120 0,3145 20 0,6636 3 1,0283 0,5 1,3618 1 Одиниця вимірювання част/млрд Функцію, яка описує відповідь тіаметоксамових стандартів, виробляли за допомогою регресійного аналізу. Цей набір даних давав стандартну криву 29 76708 за рівнянням Υ=-.191Ln(X)+1,23, r=-.999, де Υ означає аналітичну відповідь і X означає концентрацію тіаметоксамових стандартів. Приклад 71 - тест перехресної реактивності насіння сільськогосподарських культур, оброблених тіаметоксамом. 71.1 Екстракція насіння Зразки обробленого насіння піддавали вибірці шляхом довільного додавання в широкогорлу посудину на 8 унцій 50г насіння бавовни, польової кукурудзи, сорго, цукрової кукурудзи і пшениці або рапсу. Насіння рапсу піддавали вибірці 4 рази, використовували насіння з п'ятикратною вибіркою і насіння інших видів. Додавали розчинник (150мл) і щільно закривали кришку. Насіння бавовни екстрагували сумішшю 5% ацетонітрил/вода, тоді як для іншого насіння використовували суміш розчинників 20% метанол/вода. Посудину енергійно струшували вручну протягом 30сек і поміщали у водну баню, яка опромінюється ультразвуком, при кімнатній температурі на 20хв. Зразки струшували другий раз, як раніше описано. Вмісту посудини давали відстоятися протягом приблизно 5хв і відбирали аліквоту (0,10мл) для аналізу. Аліквоту розводили в суміші 1% метанол/вода для доведення концентрації осаду до діапазону стандартної кривої. 71.2 Імунологічний аналіз Покриті антитілом полістирольні пробірки для культивування мітили і поміщали в штатив для пробірок таким чином, що перша й остання пробірки служили стандартами, а стандарти і зразки, що залишилися, змішували. Зразок і стандартний розчин (по 0,50мл) додавали у відповідні пробірки. Додавали такий же об'єм розчину ферментного кон'югата. Штатив обережно струшували, щоб перемішати розчини, і інкубували протягом 20хв при кімнатній температурі. Вміст усіх пробірок видаляли, перевертаючи штатив над лотком з нержавіючої сталі. Кожну пробірку промивали, наповнюючи до країв дистильованою водою. Штатив перевертали над мийкою, щоб злити промивну воду. Промивання повторювали чотири рази. Потім штатив перевертали і легко постукували по паперовому рушнику, щоб видалити більшу частину води, що 30 залишається. (Деяка кількість рідини, що залишається в пробірках, не впливала на результати аналізу). Розчин субстрату ферменту (0,50мл) додавали в пробірки, які інкубували протягом десяти хвилин при кімнатній температурі. Штатив обережно струшували з інтервалами в 2,5хв, щоб забезпечити збереження достатнього постачання ферменту субстратом. Генерацію синього сигналу припиняли додаванням кислого розчину, який зупиняє реакцію, (0,50мл). Поглинання розчину в кожній пробірці вимірювали спектрофотометрично при 450нм. Концентрацію аналізованої речовини у зразках визначали за функцією регресії у вигляді у=min(x)+b. 71.3 Визначення перехресної реакційної здатності Оцінювали перехресну реакційну здатність або специфічність імунологічного аналізу, щоб визначити, чи будуть інші досліджувані речовини, знайдені в насіннєвих покриттях, заважати вимірюванню тіаметоксаму. Досліджувані речовини розчиняли в суміші 1% метанол/вода до концентрації, яка змінюється від 1000 до 0,01нг/мол. Аліквоти кожної концентрації аналізували, як описано вище. Реакційну здатність кожної досліджуваної речовини вище даного діапазону визначали, як описано раніше Brady J.F., Turne J., Skinner D.H. "Application of a triasulfuron enzyme immunoassay to the analysis of incurred residues in soil and water samples", J. Agric. Food. Chem. 1995, 43:2542-2547. 71.4 Результати Знайдено, що серед досліджуваних аналізованих речовин лише тіаметоксам має значну реакційну здатність в імунологічному аналізі (Таблиця 9 нижче). Отже, даний імунологічний аналіз специфічний до тіаметоксаму. Вибірки оброблених серій насіння аналізували за допомогою імунологічного аналізу і ВЕРХ. Результати даних аналізів наведені в Таблиці 11. Таблиця 11 ілюструє кореляцію середніх результатів імунологічного аналізу, який використовує поліклональне антитіло, і аналізу методом ВЕРХ сорока зразків насіння для тіаметоксаму. Найкраща відповідність лінії регресії вказує на те, що подібні результати були одержані кожним способом. Таблиця 9 Перехресна реакційна здатність в імунологічному аналізі тіаметоксаму Досліджувана речовина Tіаметоксам Клотіадин Lмідаклоприд Хлорпірифос Дифеноконазол Флудіоксоніл Пентахлорнітробензол Металаксил Мефеноксам (R-Металаксил) Флуксофеним Карбоксин Реакційна здатність відносно тіаметоксаму, відсоток1 100
ДивитисяДодаткова інформація
Назва патенту англійськоюAntibody used in immunological analysis of sample for determining neonicotinoid insecticide, protein conjugate for obtaining antibody, method for determination of neonicotinoid insecticide concentration in sample and set for determination of amount of neonicotinoid insecticide
Назва патенту російськоюАнтитело, которое применяется в иммунологическом анализе образца для определения неоникотиноидного инсектицида, белковый конъюгат для получения антитела, способ определения концентрации неоникотиноидного инсектицида в образце и набор для определения количества неоникотиноидного инсектицида
МПК / Мітки
МПК: G01N 33/543, C07D 401/06, C07K 16/44, C07K 14/76, G01N 33/15, C07D 277/28, C07D 417/06, C07K 14/435, C12N 9/08, C12N 9/16, G01N 21/78, C12N 9/38, C07D 213/61, C07D 277/32, G01N 33/53
Мітки: визначення, білковий, зразка, застосовується, яке, аналізі, спосіб, кон'югат, одержання, імунологічному, неонікотиноїдного, концентрації, антитіла, антитіло, інсектициду
Код посилання
<a href="https://ua.patents.su/17-76708-antitilo-yake-zastosovuehtsya-v-imunologichnomu-analizi-zrazka-dlya-viznachennya-neonikotinodnogo-insekticidu-bilkovijj-konyugat-dlya-oderzhannya-antitila-sposib-viznachennya-konce.html" target="_blank" rel="follow" title="База патентів України">Антитіло, яке застосовується в імунологічному аналізі зразка для визначення неонікотиноїдного інсектициду, білковий кон’югат для одержання антитіла, спосіб визначення концентрації неонікотиноїдного інсектициду</a>
Наступний патент: Композиція для одержання люмінесцентного концентрату
Випадковий патент: Форсунка для зрошування стояка коксової печі












