b-кристалічна форма піноцембрину, її отримання та її застосування для виготовлення фармацевтичних композицій
Номер патенту: 102871
Опубліковано: 27.08.2013
Автори: Ван Ке, Ян Чжихун, Тун Юаньфен, У Сун, Чан Ін, Гао Мей, Ду Ганьхуа, Люй Ян
Формула / Реферат
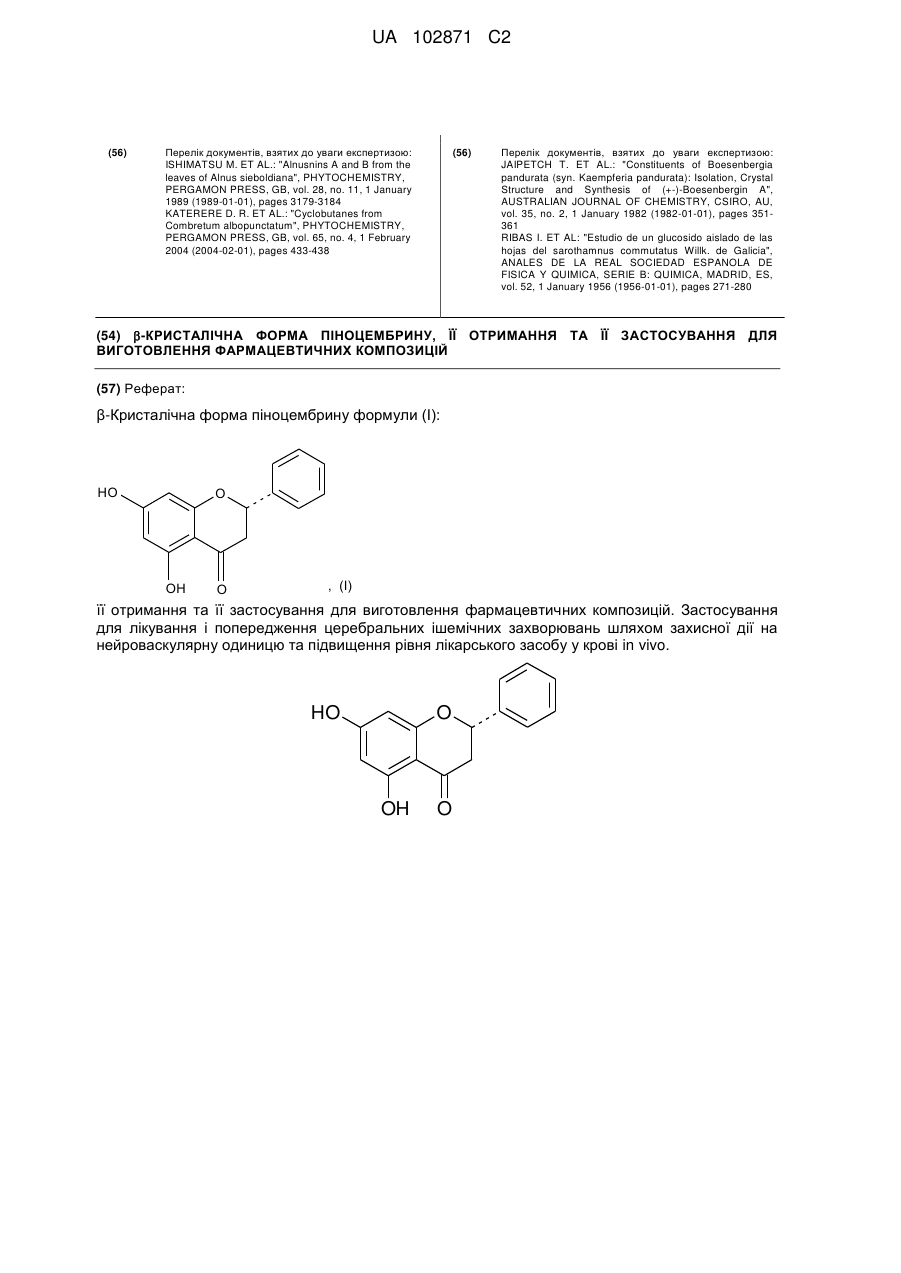
1. β-Кристалічна форма піноцембрину формули (І):
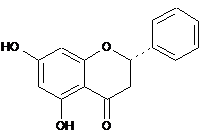 , (І)
, (І)
яка відрізняється тим, що при аналізі рентгенівською порошковою (полікристалічною) дифракцією (CuKα опромінення) локації дифракційного піка: значення 2-тета (°) або d значення (Å), та відносна інтенсивність дифракційного піка: значення висоти піка (Висота %) або значення площі піка (Площа %), мають наступні характеристики:
Пік
2-тета
d(Å)
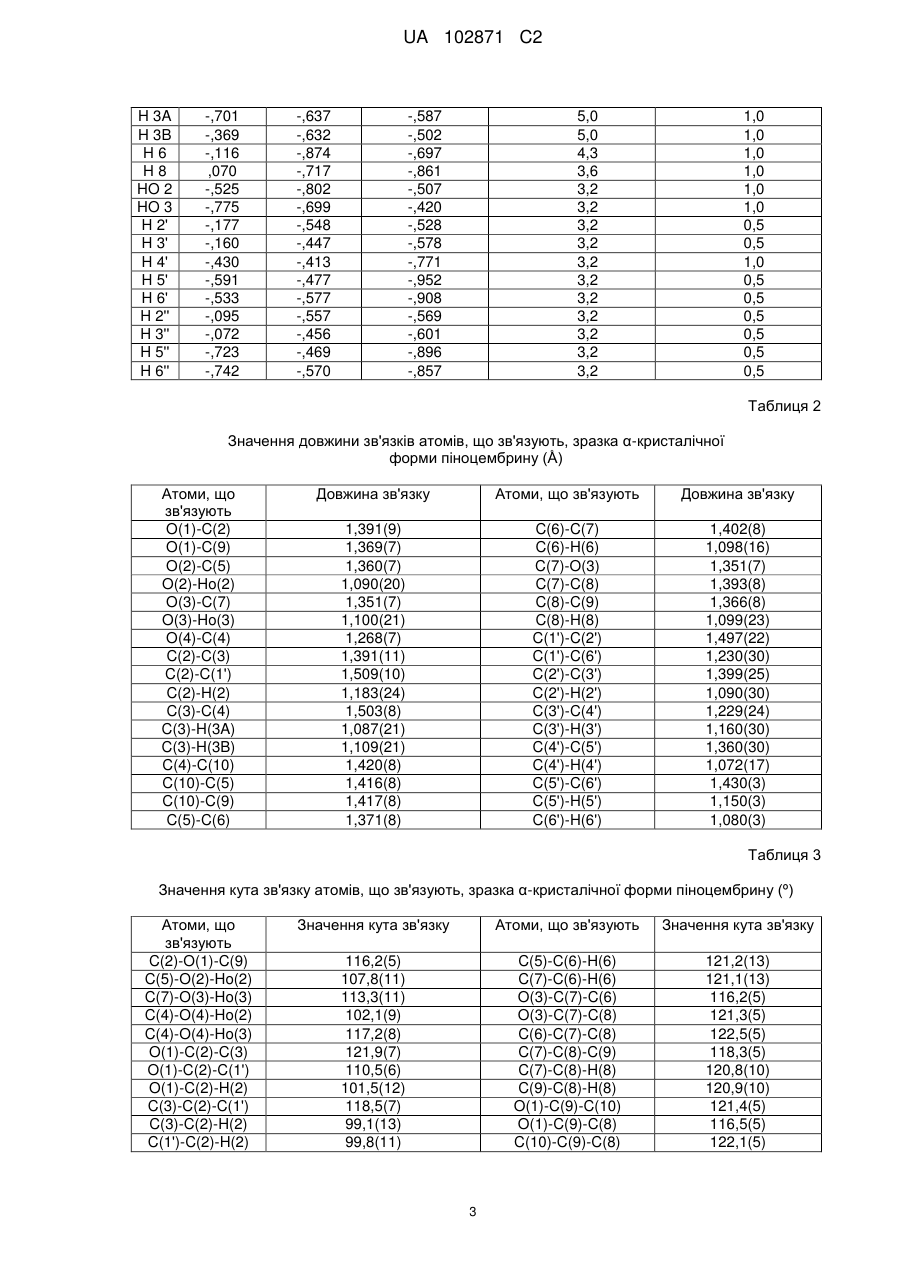
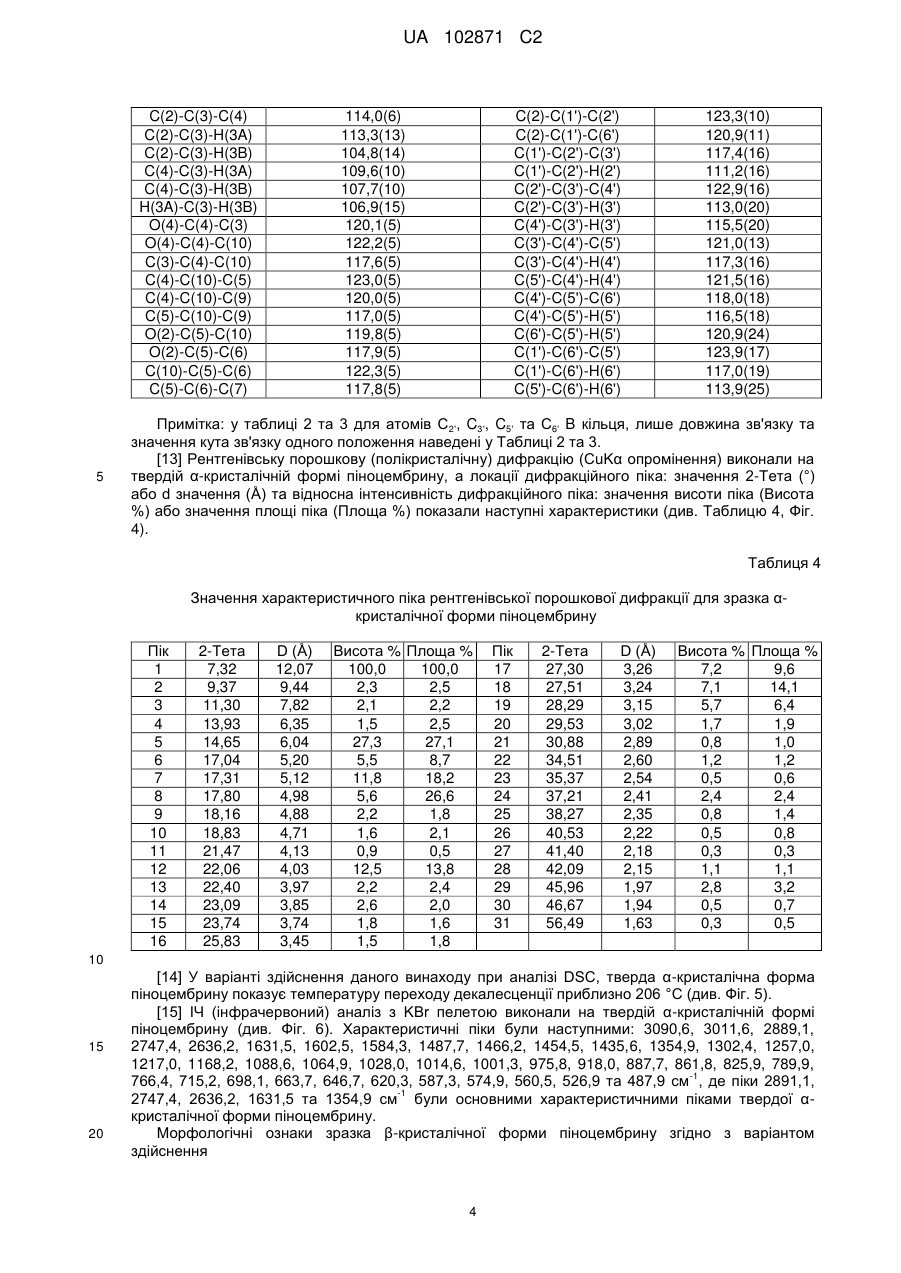
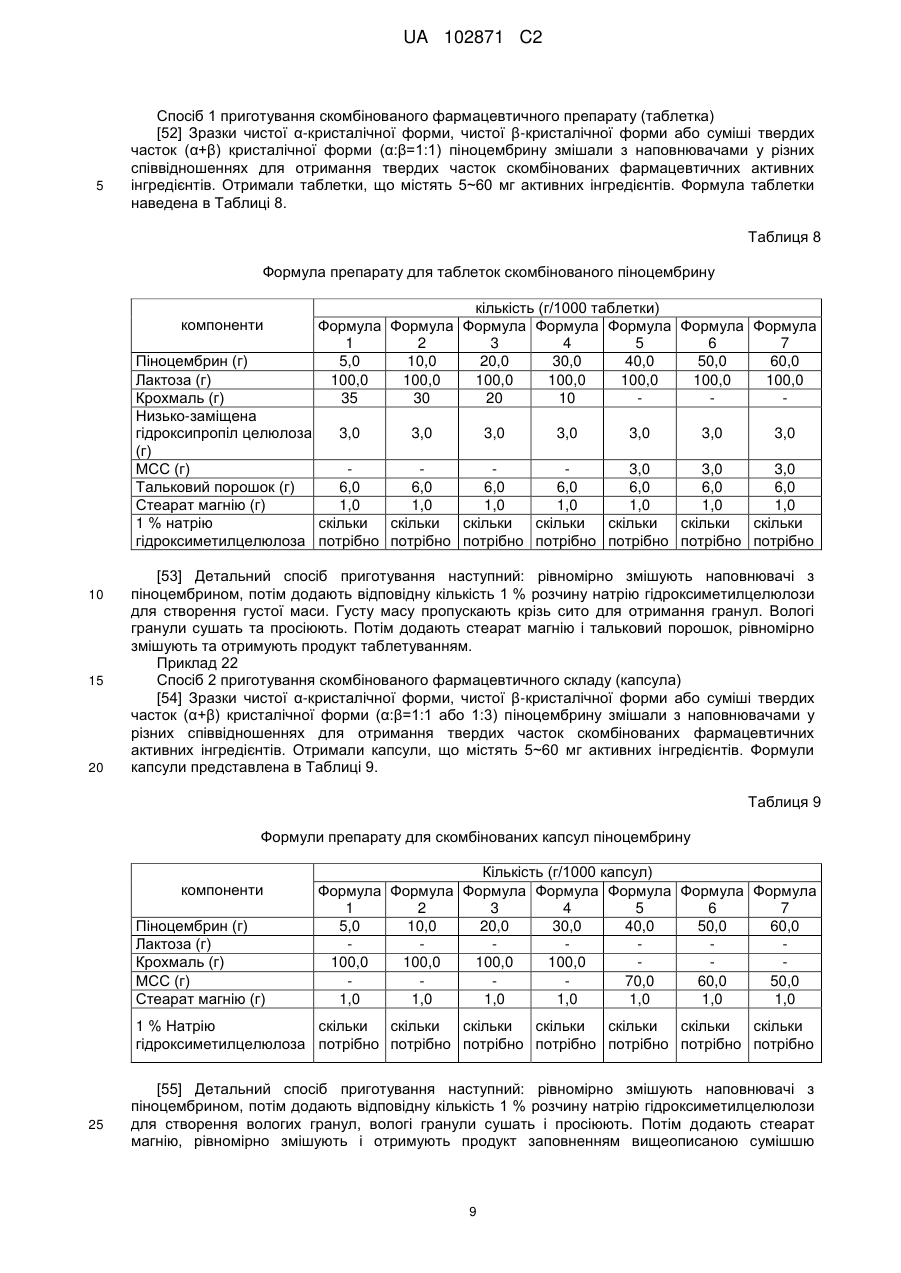
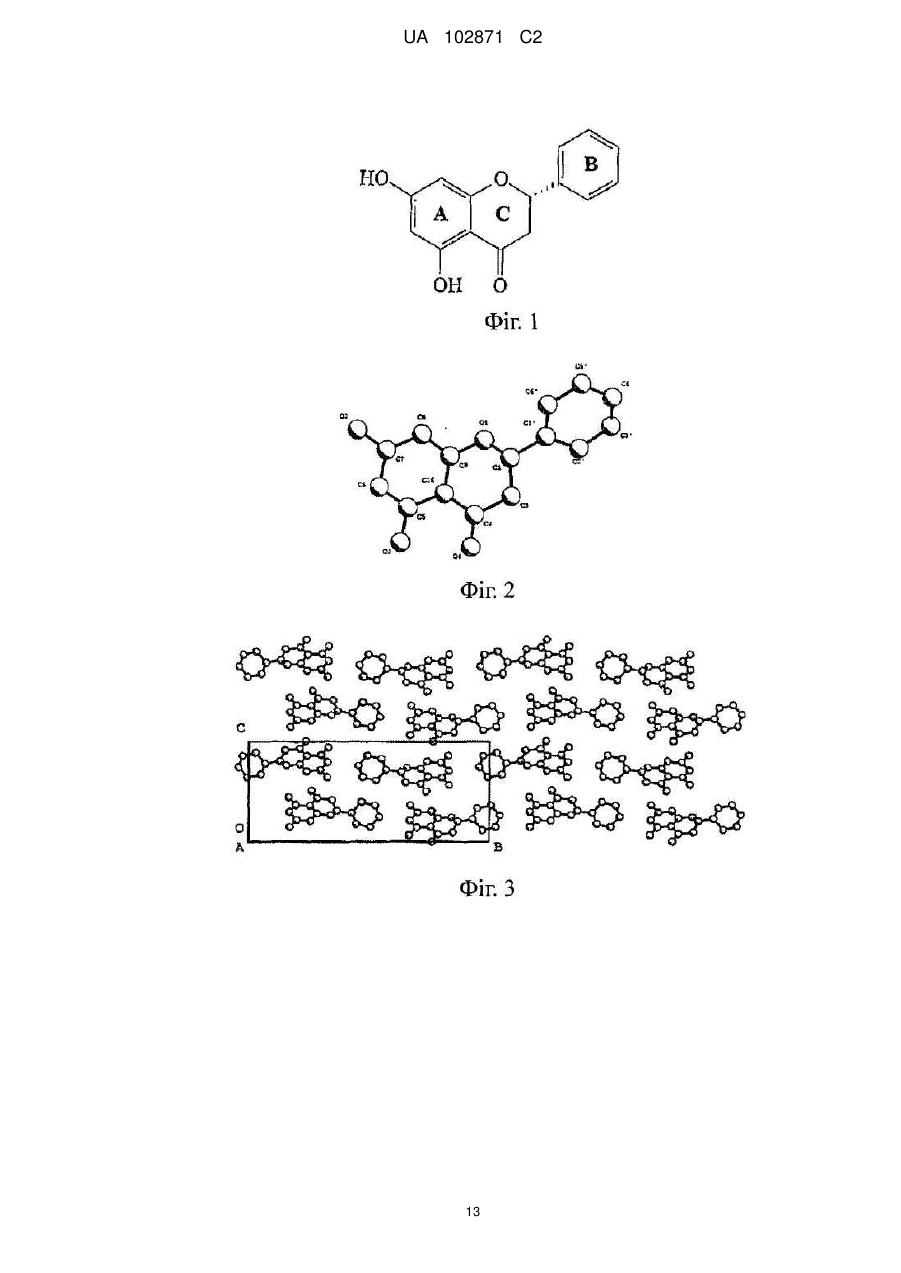
Висота
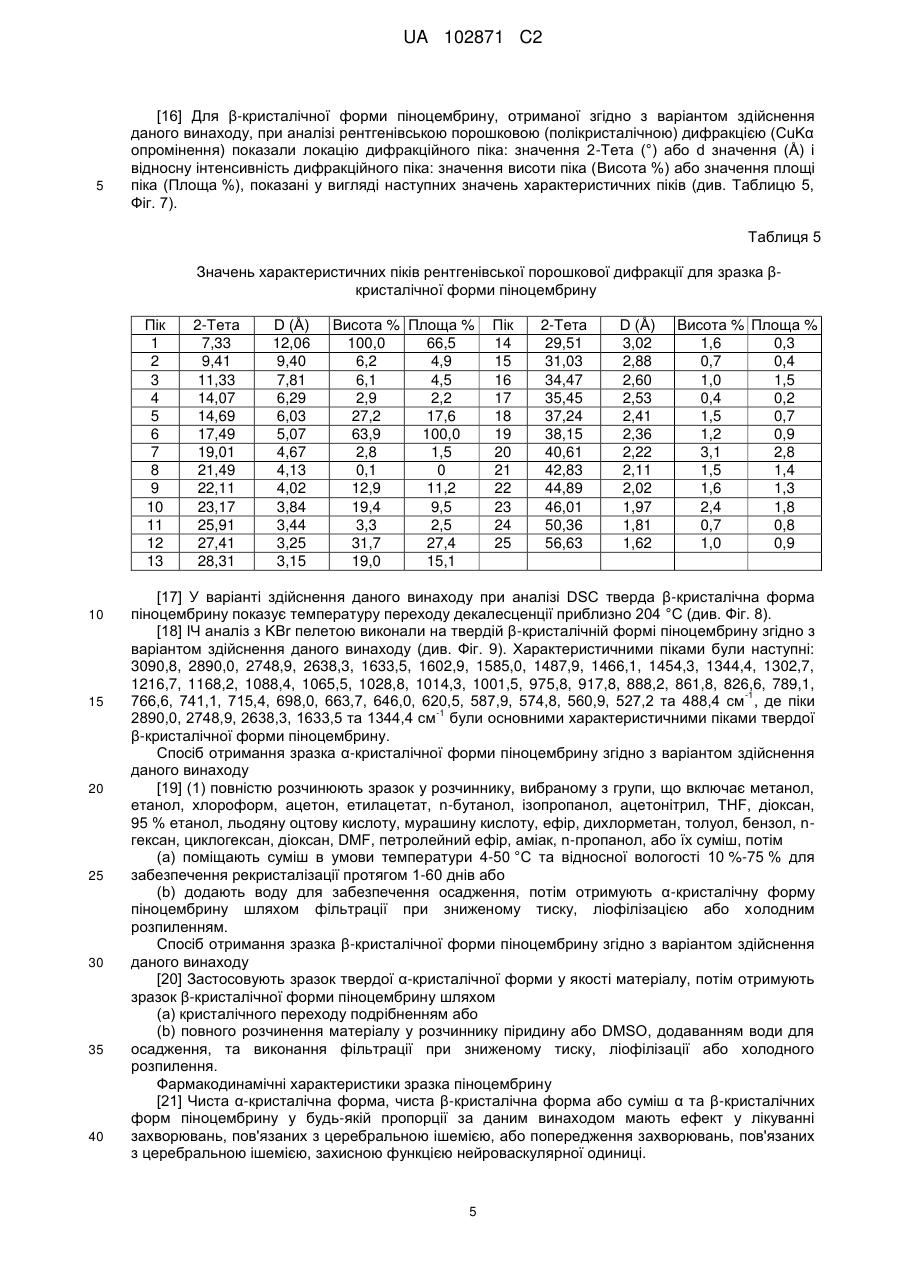
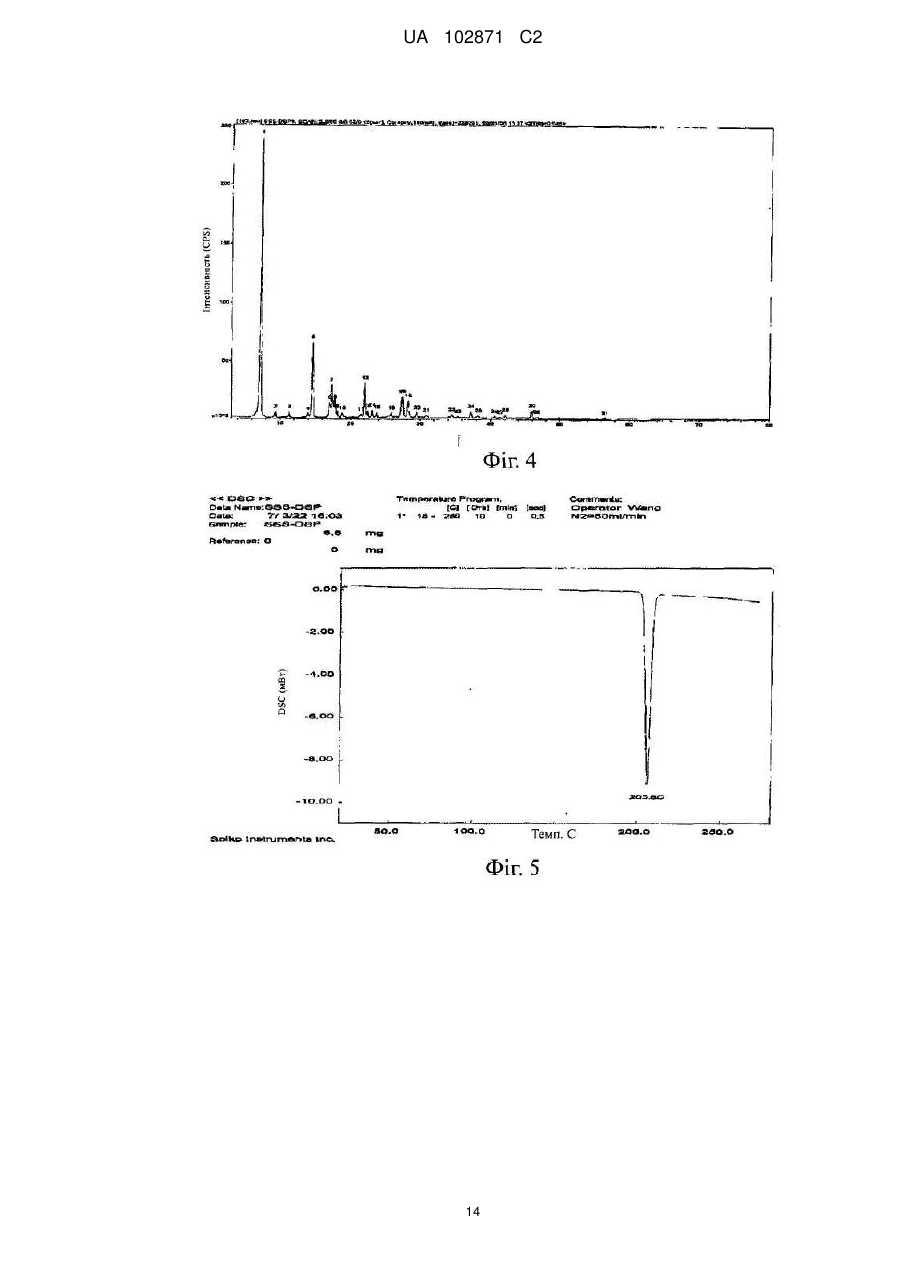
%
Площа
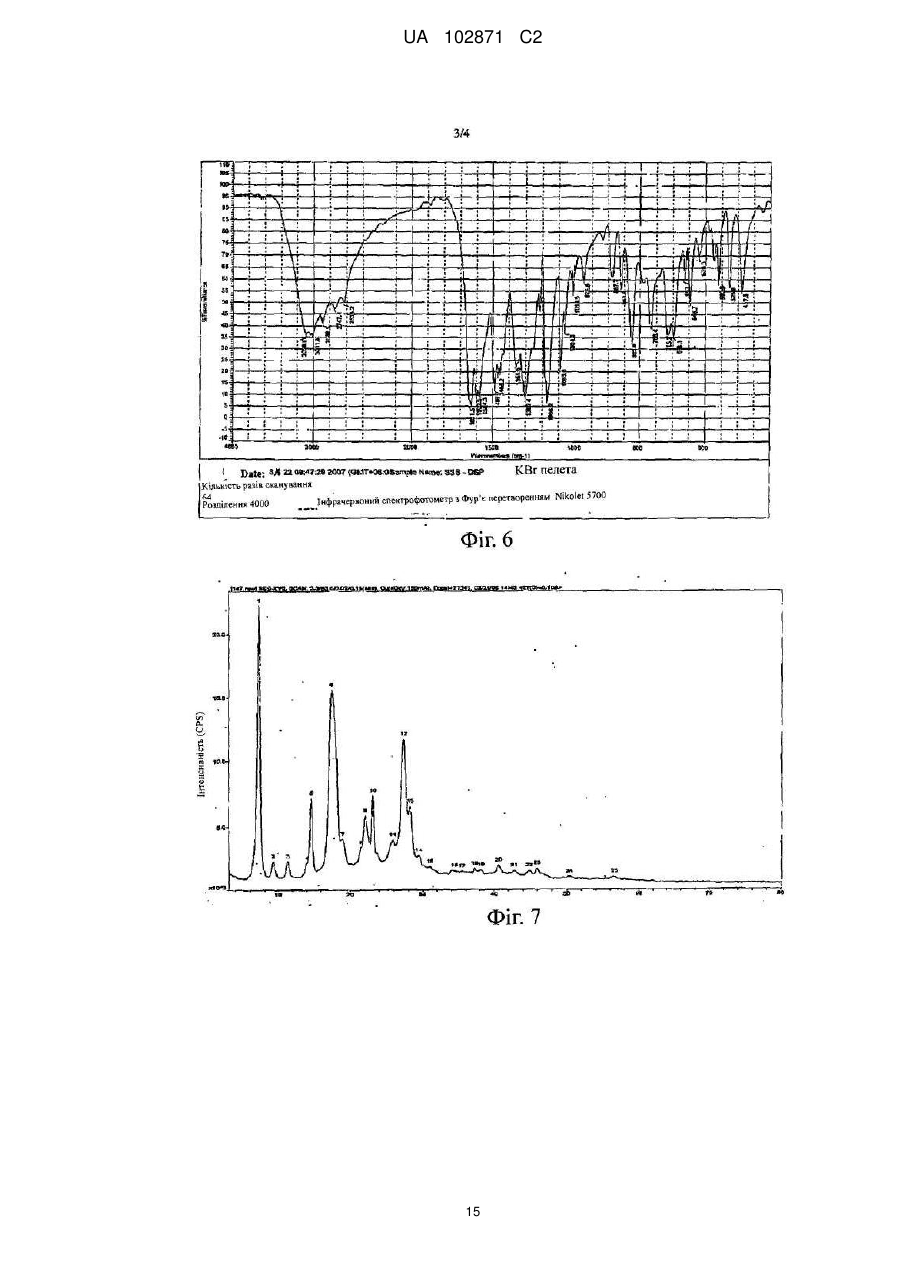
%
Пік
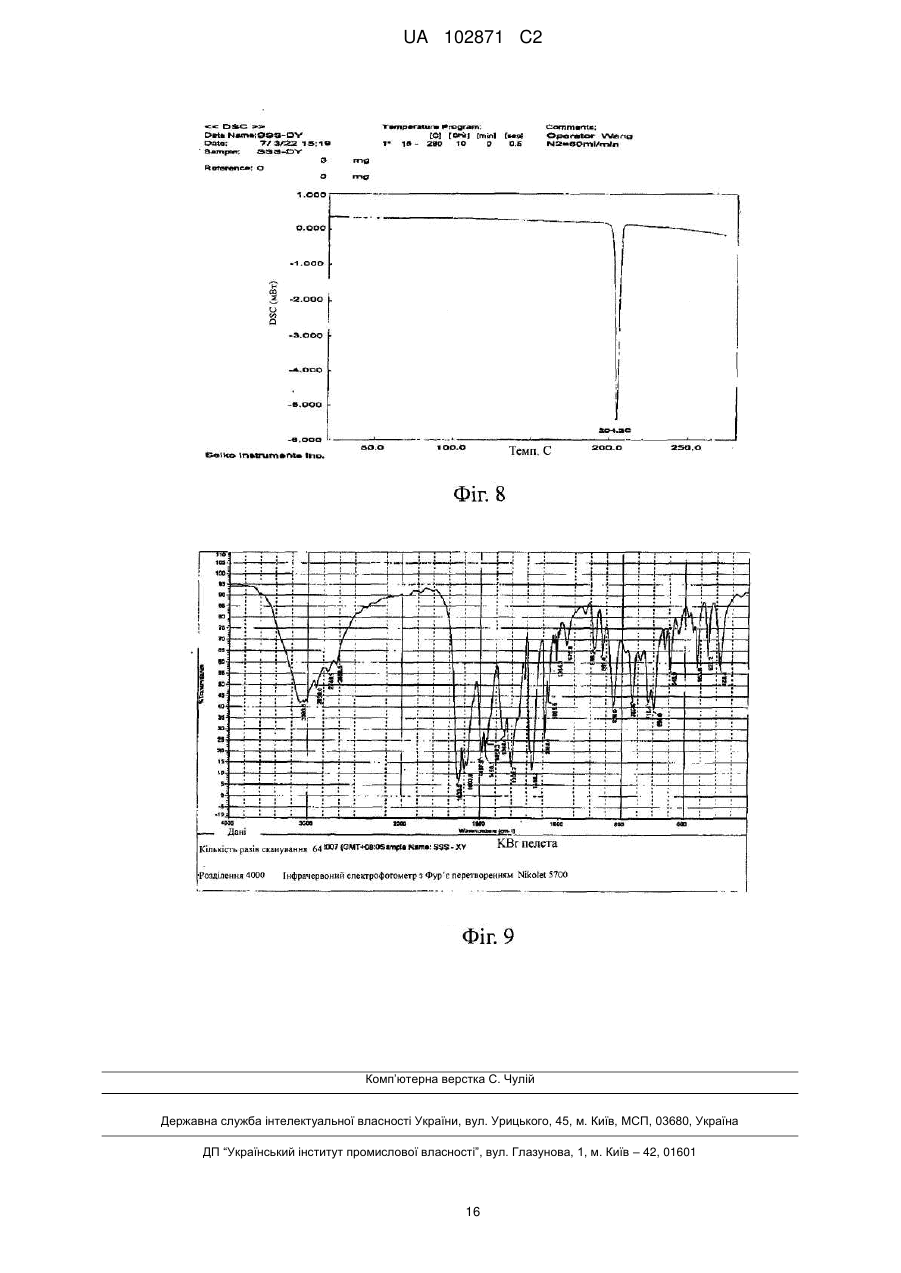
2-тета
d(Å)
Висота
%
Площа %
1
7,33
12,06
100,0
66,5
14
29,51
3,02
1,6
0,3
2
9,41
9,40
6,2
4,9
15
31,03
2,88
0,7
0,4
3
11,33
7,81
6,1
4,5
16
34,47
2,60
1,0
1,5
4
14,07
6,29
2,9
2,2
17
35,45
2,53
0,4
0,2
5
14,69
6,03
27,2
17,6
18
37,24
2,41
1,5
0,7
6
17,49
5,07
63,9
100,0
19
38,15
2,36
1,2
0,9
7
19,01
4,67
2,8
1,5
20
40,61
2,22
3,1
2,8
8
21,49
4,13
0,1
0
21
42,83
2,11
1,5
1,4
9
22,11
4,02
12,9
11,2
22
44,89
2,02
1,6
1,3
10
23,17
3,84
19,4
9,5
23
46,01
1,97
2,4
1,8
11
25,91
3,44
3,3
2,5
24
50,36
1,81
0,7
0,8
12
27,41
3,25
31,7
27,4
25
56,63
1,62
1,0
0,9
13
28,31
3,15
19,0
15,1
2. β-Кристалічна форма піноцембрину за п, 1, яка відрізняється тим, що температура переходу декалесценції сліду DSC становить приблизно 204 °C.
3. β-Кристалічна форма піноцембрину за п. 1, яка відрізняється тим, що її спектр поглинання в інфрачервоній області має наступні піки: 3090,8, 2890,0, 2748,9, 2638,3, 1633,5, 1602,9, 1585,0, 1487,9, 1466,1, 1454,3, 1344,4, 1302,7, 1216,7, 1168,2, 1088,4, 1065,5, 1028,8, 1014,3, 1001,5, 975,8, 917,8, 888,2, 861,8, 826,6, 789,1, 766,6, 741,1, 715,4, 698,0, 663,7, 646,0, 620,5, 587,9, 574,8, 560,9, 527,2 та 488,4 см-1, де піки 2890,0, 2748,9, 2638,3, 1633,5 та 1344,4 см-1 є основними характеристичними піками β-кристалічної форми піноцембрину.
4. Змішана кристалічна форма піноцембрину, що включає α-кристалічну форму та β-кристалічну форму піноцембрину у будь-якій пропорції.
5. Кристалічна форма піноцембрину за будь-яким одним з попередніх пунктів, яка відрізняється тим, що вказана кристалічна форма вільна від кристалізаційної води або іншого кристалічного розчинника.
6. Активний фармацевтичний інгредієнт, що містить кристалічну форму піноцембрину за пп. 1 або 4 як основний компонент, причому вказаний активний фармацевтичний інгредієнт застосовується для виготовлення лікарського препарату для лікування захворювань, пов'язаних з церебральною ішемією, або лікарського препарату для попередження захворювань, пов'язаних з церебральною ішемією, захисною функцією нейроваскулярної одиниці.
7. Активний фармацевтичний інгредієнт за п. 6, щоденна доза якого знаходиться в діапазоні від 5 до 250 мг твердої кристалічної форми піноцембрину.
8. Фармацевтична композиція, що містить терапевтично ефективну кількість кристалічної форми піноцембрину за будь-яким одним з пп. 1 та 4 у комбінації з одним або більше фармацевтично прийнятними носіями.
9. Фармацевтична композиція, що містить активний фармацевтичний інгредієнт за пп. 6 або 7 як основний компонент, яка відрізняється тим, що фармацевтична композиція має форму таблетки, капсули, пігулки, ін'єкції, препарату уповільненого вивільнення або препарату контрольованого вивільнення.
10. Застосування кристалічної форми піноцембрину за пп. 1 або 4 або активного фармацевтичного інгредієнта за п. 6, або фармацевтичної композиції за п. 8 при виготовленні лікарського препарату для лікування захворювань, пов'язаних з церебральною ішемією, або лікарського препарату для попередження захворювань, пов'язаних з церебральною ішемією, захисною функцією нейроваскулярної одиниці.
11. Спосіб отримання β-кристалічної форми піноцембрину, в якому здійснюють етапи, на яких:
застосовують α-кристалічну форму піноцембрину як початковий матеріал, з якого отримують β-кристалічну форму піноцембрину шляхом кристалічного переходу подрібненням.
12. Спосіб отримання β-кристалічної форми піноцембрину, в якому здійснюють етапи, на яких:
застосовують зразок піноцембрину як початковий матеріал, з якого отримують β-кристалічну форму піноцембрину шляхом повного розчинення матеріалу у розчиннику піридині або DMSO, потім додають воду для забезпечення осадження та виконують фільтрацію при зниженому тиску, ліофілізацією або холодним розпиленням.
Текст
Реферат: β-Кристалічна форма піноцембрину формули (І): HO O OH O , (I) її отримання та її застосування для виготовлення фармацевтичних композицій. Застосування для лікування і попередження церебральних ішемічних захворювань шляхом захисної дії на нейроваскулярну одиницю та підвищення рівня лікарського засобу у крові in vivo. O HO OH O UA 102871 C2 5 Область винаходу [01] Даний винахід стосується двох кристалічних форм сполуки піноцембрину та активних фармацевтичних інгредієнтів, фармацевтичних композицій та лікарських форм, що містять дві кристалічні форми піноцембрину, їх застосування для виготовлення фармацевтичних композицій, лікування захворювань та способу отримання двох кристалічних форм піноцембрину. Передумови винаходу [02] Піноцембрин (хімічна назва: 5,7-дигідрокси-2-феніл-4-хроманон) є флавоновою сполукою, широко розповсюдженою у природі. Її хімічна структура показана нижче: O HO 10 15 20 25 30 35 40 45 50 OH O , що існує у формі l-ізомеру, d-ізомеру, або суміші, збагаченої l-ізомером або d-ізомером, та рацемату. [03] Попередні фармакологічні експерименти показали, що піноцембрин має сильні бактеріостазні, противірусні та протигрибкові активності. Наприклад, мед, традиційна китайська корисна для здоров'я їжа, багатий на піноцембрин. Оскільки часте споживання медового цукру не лише безпечно для зубів, але також може знезаражувати ротову порожнину, наприклад, заспокоювати ротову виразку та прискорювати загоєння поранень. Китайський патент CN1695608A під назвою "Застосування піноцембрину для виготовлення фармацевтичних композицій для попередження та лікування захворювань, пов'язаних з пошкодженням нервової [1] клітини" розкрив застосування піноцембрину для виготовлення фармацевтичних композицій для попередження або лікування захворювань, пов'язаних з церебральною ішемією, ускладненням церебральної ішемії, пошкодженням нервової клітини та зміною функції. Опис даного винаходу [04] У даному винаході виявили, що піноцембрин мав дві різні кристалічні форми α та β, і розробили їх препарати. У даному винаході також виявили, що була значна різниця між двома кристалічними формами при засвоюванні організмом, де швидкість засвоєння β-кристалічної форми була більша, ніж α-кристалічної форми, наприклад, швидкість засвоєння β-кристалічної форми може бути в 2 рази або більше, ніж α-кристалічної форми. Їх біологічні активності у медикаментозній терапії відрізняються через різниці концентрацій лікарського засобу в крові. [05] Один варіант здійснення даного винаходу забезпечує α-кристалічну форму, βкристалічну форму або суміш α-кристалічної форми та β-кристалічної форми у різних співвідношеннях відносно піноцембрину. Переважно, ці кристалічні форми або їх суміш не містять кристалізаційну воду або інші органічні розчинники. [06] Один варіант здійснення даного винаходу забезпечує спосіб отримання α-кристалічної форми, β-кристалічної форми або суміші α-кристалічної форми і β-кристалічної форми піноцембрину у різних співвідношеннях. [07] Один варіант здійснення даного винаходу забезпечує фармацевтичну композицію, що містить чисту α-кристалічну форму, чисту β-кристалічну форму або суміш α-кристалічної форми і β-кристалічної форми піноцембрину у різних співвідношеннях. Фармацевтична композиція може також містити один або більше фармацевтично прийнятних носіїв. Не існує обмеження на фармацевтично прийнятні носії за умовою, що вони придатні для складу та не будуть суттєво впливати на ефект кристалічної форми піноцембрину даного винаходу. [08] Один варіант здійснення даного винаходу стосується лікарських форм, що містять тверді кристалічні форми піноцембрину. Не існує обмеження на специфічні лікарські форми. Наприклад, це можуть бути таблетки, капсули, пігулки, ін'єкції, препарати уповільненого вивільнення, препарати контрольованого вивільнення та подібне. [09] Один варіант здійснення даного винаходу забезпечує застосування твердих кристалічних форм піноцембрину, включаючи α-кристалічну форму, β-кристалічну форму або суміш α-кристалічної форми та β-кристалічної форми у різних співвідношеннях, що обумовлюється різницею засвоєння лікарського засобу при лікування. [10] Один варіант здійснення даного винаходу стосується застосування α-кристалічної форми, β-кристалічної форми або суміші α-кристалічної форми та β-кристалічної форми піноцембрину у різних співвідношеннях при виготовленні лікарського препарату для лікування захворювання, пов'язаного з церебральною ішемією, або лікарського препарату для 1 UA 102871 C2 5 10 15 20 попередження захворювання, пов'язаного з церебральною ішемією, шляхом захисту функції нейроваскулярної одиниці. [11] Один варіант здійснення даного винаходу забезпечує застосування піноцембрину для захисту функції нейроваскулярної одиниці при лікуванні захворювань, пов'язаних з церебральною ішемією, та для покращення концентрації у крові в організмі через ефект кристалічної форми. Морфологічні ознаки зразка α-кристалічної форми піноцембрину згідно з варіантом здійснення: [12] Для зразка α-кристалічної форми піноцембрину, отриманого згідно з варіантом здійснення даного винаходу, при аналізі рентгенівською монокристалічною дифракцією показана симетрія моноклінної кристалічної системи, просторова група була P2 1/c, та параметричні значення кристалічної комірки були наступними: a=5,189Å, b=24,149Å, c=10,472Å, α=90°, β=102,31° та γ=90°. Фіг. 1 є ілюстрацією, що показує відносну конфігурацію молекули, Фіг. 2 є ілюстрацією, що показує проекцію стерео-структури молекули, Фіг. 3 є ілюстрацією, що показує укладання елементарної комірки молекули вздовж a осі. Таблиця 1 показує атомні координатні параметри та еквівалентні температурні фактори. Таблиця 2 показує значення довжини зв'язку атомів, що зв'язують. Таблиця 3 показує значення кута зв'язку атомів, що зв'язують. Оскільки деякі атоми вуглецю B кільця приймають стан хаотичної орієнтації, чотири атоми C2', C3', C5' та C6' займають два положення, з коефіцієнтом заповнення 0,5, відповідно. O HO A B C OH O Формула 1 відносна молекулярна конфігурація α-кристалічної форми піноцембрину Таблиця 1 Атомні координатні параметри (відносна координата) зразка α кристалічної форми піноцембрину O1 O2 O3 O4 C2 C3 C4 C10 C5 C6 C7 C8 C9 C 1' C 2' C 3' C 4' C 5' C 6' C 2'' C 3'' C 5'' C 6'' H2 x -,2023(8) -,4261(9) -,8660(9) -,6128(8) -,4094(24) -,5019(13) -,4859(12) -,3269(12) -,2968(12) -,1407(13) -,0117(12) -,0336(12) -,1894(12) -,4049(18) -,316 (5) -,326 (5) -,3988(18) -,456 (5) -,435 (6) -,194 (4) -,178 (4) -,630 (4) -,640 (4) -,591 y -,6574(2) -,8310(2) -,6732(2) -,7370(2) -,6318(3) -,6513(3) -,7131(3) -,7427(2) -,8009(2) -,8289(2) -,7979(2) -,7405(2) -,7138(2) -,5701(3) -,5292(7) -,4730(7) -,4566(3) -,4929(8) -,5510(7) -,5453(7) -,4859(7) -,4859(7) -,5432(6) -,644 температурні фактори 3,4(2) 4,3(2) 4,2(2) 3,6(2) 3,5(8) 3,6(3) 3,0(3) 2,8(3) 3,1(3) 3,3(3) 3,1(3) 2,8(3) 2,9(3) 6,7(5) 7,4(2) 7,4(1) 7,5(1) 7,9(2) 7,8(2) 7,1(1) 7,3(2) 7,4(1) 8,8(1) 7,6 z -,7376 (4) -,5601 (4) -,3557 (4) -,4969 (4) -,6954(12) -,5885 (6) -,5720 (6) -,6435 (6) -,6366 (6) -,7054 (6) -,7862 (6) -,7966 (6) -,7262 (6) -,7176 (9) -,6099(19) -,6436(21) -,7567(10) -,8580(22) -,8288(23) -,6870(25) -,700 (3) -,7856(22) -,7752(22) -,779 2 заповнення 1,0 1,0 1,0 1,0 1,0 1,0 1,0 1,0 1,0 1,0 1,0 1,0 1,0 1,0 0,5 0,5 1,0 0,5 0,5 0,5 0,5 0,5 0,5 1,0 UA 102871 C2 H 3A H 3B H6 H8 HO 2 HO 3 H 2' H 3' H 4' H 5' H 6' H 2'' H 3'' H 5'' H 6'' -,701 -,369 -,116 ,070 -,525 -,775 -,177 -,160 -,430 -,591 -,533 -,095 -,072 -,723 -,742 -,637 -,632 -,874 -,717 -,802 -,699 -,548 -,447 -,413 -,477 -,577 -,557 -,456 -,469 -,570 -,587 -,502 -,697 -,861 -,507 -,420 -,528 -,578 -,771 -,952 -,908 -,569 -,601 -,896 -,857 5,0 5,0 4,3 3,6 3,2 3,2 3,2 3,2 3,2 3,2 3,2 3,2 3,2 3,2 3,2 1,0 1,0 1,0 1,0 1,0 1,0 0,5 0,5 1,0 0,5 0,5 0,5 0,5 0,5 0,5 Таблиця 2 Значення довжини зв'язків атомів, що зв'язують, зразка α-кристалічної форми піноцембрину (Å) Атоми, що зв'язують O(1)-C(2) O(1)-C(9) O(2)-C(5) O(2)-Ho(2) O(3)-C(7) O(3)-Ho(3) O(4)-C(4) C(2)-C(3) C(2)-C(1') C(2)-H(2) C(3)-C(4) C(3)-H(3A) C(3)-H(3B) C(4)-C(10) C(10)-C(5) C(10)-C(9) C(5)-C(6) Довжина зв'язку Атоми, що зв'язують Довжина зв'язку 1,391(9) 1,369(7) 1,360(7) 1,090(20) 1,351(7) 1,100(21) 1,268(7) 1,391(11) 1,509(10) 1,183(24) 1,503(8) 1,087(21) 1,109(21) 1,420(8) 1,416(8) 1,417(8) 1,371(8) C(6)-C(7) C(6)-H(6) C(7)-O(3) C(7)-C(8) C(8)-C(9) C(8)-H(8) C(1')-C(2') C(1')-C(6') C(2')-C(3') C(2')-H(2') C(3')-C(4') C(3')-H(3') C(4')-C(5') C(4')-H(4') C(5')-C(6') C(5')-H(5') C(6')-H(6') 1,402(8) 1,098(16) 1,351(7) 1,393(8) 1,366(8) 1,099(23) 1,497(22) 1,230(30) 1,399(25) 1,090(30) 1,229(24) 1,160(30) 1,360(30) 1,072(17) 1,430(3) 1,150(3) 1,080(3) Таблиця 3 Значення кута зв'язку атомів, що зв'язують, зразка α-кристалічної форми піноцембрину (º) Атоми, що зв'язують C(2)-O(1)-C(9) C(5)-O(2)-Ho(2) C(7)-O(3)-Ho(3) C(4)-O(4)-Ho(2) C(4)-O(4)-Ho(3) O(1)-C(2)-C(3) O(1)-C(2)-C(1') O(1)-C(2)-H(2) C(3)-C(2)-C(1') C(3)-C(2)-H(2) C(1')-C(2)-H(2) Значення кута зв'язку Атоми, що зв'язують Значення кута зв'язку 116,2(5) 107,8(11) 113,3(11) 102,1(9) 117,2(8) 121,9(7) 110,5(6) 101,5(12) 118,5(7) 99,1(13) 99,8(11) C(5)-C(6)-H(6) C(7)-C(6)-H(6) O(3)-C(7)-C(6) O(3)-C(7)-C(8) C(6)-C(7)-C(8) C(7)-C(8)-C(9) C(7)-C(8)-H(8) C(9)-C(8)-H(8) O(1)-C(9)-C(10) O(1)-C(9)-C(8) C(10)-C(9)-C(8) 121,2(13) 121,1(13) 116,2(5) 121,3(5) 122,5(5) 118,3(5) 120,8(10) 120,9(10) 121,4(5) 116,5(5) 122,1(5) 3 UA 102871 C2 C(2)-C(3)-C(4) C(2)-C(3)-H(3A) C(2)-C(3)-H(3B) C(4)-C(3)-H(3A) C(4)-C(3)-H(3B) H(3A)-C(3)-H(3B) O(4)-C(4)-C(3) O(4)-C(4)-C(10) C(3)-C(4)-C(10) C(4)-C(10)-C(5) C(4)-C(10)-C(9) C(5)-C(10)-C(9) O(2)-C(5)-C(10) O(2)-C(5)-C(6) C(10)-C(5)-C(6) C(5)-C(6)-C(7) 5 114,0(6) 113,3(13) 104,8(14) 109,6(10) 107,7(10) 106,9(15) 120,1(5) 122,2(5) 117,6(5) 123,0(5) 120,0(5) 117,0(5) 119,8(5) 117,9(5) 122,3(5) 117,8(5) C(2)-C(1')-C(2') C(2)-C(1')-C(6') C(1')-C(2')-C(3') C(1')-C(2')-H(2') C(2')-C(3')-C(4') C(2')-C(3')-H(3') C(4')-C(3')-H(3') C(3')-C(4')-C(5') C(3')-C(4')-H(4') C(5')-C(4')-H(4') C(4')-C(5')-C(6') C(4')-C(5')-H(5') C(6')-C(5')-H(5') C(1')-C(6')-C(5') C(1')-C(6')-H(6') C(5')-C(6')-H(6') 123,3(10) 120,9(11) 117,4(16) 111,2(16) 122,9(16) 113,0(20) 115,5(20) 121,0(13) 117,3(16) 121,5(16) 118,0(18) 116,5(18) 120,9(24) 123,9(17) 117,0(19) 113,9(25) Примітка: у таблиці 2 та 3 для атомів C 2', C3', C5' та C6' B кільця, лише довжина зв'язку та значення кута зв'язку одного положення наведені у Таблиці 2 та 3. [13] Рентгенівську порошкову (полікристалічну) дифракцію (CuKα опромінення) виконали на твердій α-кристалічній формі піноцембрину, а локації дифракційного піка: значення 2-Тета (°) або d значення (Å) та відносна інтенсивність дифракційного піка: значення висоти піка (Висота %) або значення площі піка (Площа %) показали наступні характеристики (див. Таблицю 4, Фіг. 4). Таблиця 4 Значення характеристичного піка рентгенівської порошкової дифракції для зразка αкристалічної форми піноцембрину Пік 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 2-Тета 7,32 9,37 11,30 13,93 14,65 17,04 17,31 17,80 18,16 18,83 21,47 22,06 22,40 23,09 23,74 25,83 D (Å) 12,07 9,44 7,82 6,35 6,04 5,20 5,12 4,98 4,88 4,71 4,13 4,03 3,97 3,85 3,74 3,45 Висота % Площа % 100,0 100,0 2,3 2,5 2,1 2,2 1,5 2,5 27,3 27,1 5,5 8,7 11,8 18,2 5,6 26,6 2,2 1,8 1,6 2,1 0,9 0,5 12,5 13,8 2,2 2,4 2,6 2,0 1,8 1,6 1,5 1,8 Пік 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 2-Тета 27,30 27,51 28,29 29,53 30,88 34,51 35,37 37,21 38,27 40,53 41,40 42,09 45,96 46,67 56,49 D (Å) 3,26 3,24 3,15 3,02 2,89 2,60 2,54 2,41 2,35 2,22 2,18 2,15 1,97 1,94 1,63 Висота % Площа % 7,2 9,6 7,1 14,1 5,7 6,4 1,7 1,9 0,8 1,0 1,2 1,2 0,5 0,6 2,4 2,4 0,8 1,4 0,5 0,8 0,3 0,3 1,1 1,1 2,8 3,2 0,5 0,7 0,3 0,5 10 15 20 [14] У варіанті здійснення даного винаходу при аналізі DSC, тверда α-кристалічна форма піноцембрину показує температуру переходу декалесценції приблизно 206 °C (див. Фіг. 5). [15] ІЧ (інфрачервоний) аналіз з KBr пелетою виконали на твердій α-кристалічній формі піноцембрину (див. Фіг. 6). Характеристичні піки були наступними: 3090,6, 3011,6, 2889,1, 2747,4, 2636,2, 1631,5, 1602,5, 1584,3, 1487,7, 1466,2, 1454,5, 1435,6, 1354,9, 1302,4, 1257,0, 1217,0, 1168,2, 1088,6, 1064,9, 1028,0, 1014,6, 1001,3, 975,8, 918,0, 887,7, 861,8, 825,9, 789,9, -1 766,4, 715,2, 698,1, 663,7, 646,7, 620,3, 587,3, 574,9, 560,5, 526,9 та 487,9 см , де піки 2891,1, -1 2747,4, 2636,2, 1631,5 та 1354,9 см були основними характеристичними піками твердої αкристалічної форми піноцембрину. Морфологічні ознаки зразка β-кристалічної форми піноцембрину згідно з варіантом здійснення 4 UA 102871 C2 5 [16] Для β-кристалічної форми піноцембрину, отриманої згідно з варіантом здійснення даного винаходу, при аналізі рентгенівською порошковою (полікристалічною) дифракцією (CuKα опромінення) показали локацію дифракційного піка: значення 2-Тета (°) або d значення (Å) і відносну інтенсивність дифракційного піка: значення висоти піка (Висота %) або значення площі піка (Площа %), показані у вигляді наступних значень характеристичних піків (див. Таблицю 5, Фіг. 7). Таблиця 5 Значень характеристичних піків рентгенівської порошкової дифракції для зразка βкристалічної форми піноцембрину Пік 1 2 3 4 5 6 7 8 9 10 11 12 13 10 15 20 25 30 35 40 2-Тета 7,33 9,41 11,33 14,07 14,69 17,49 19,01 21,49 22,11 23,17 25,91 27,41 28,31 D (Å) 12,06 9,40 7,81 6,29 6,03 5,07 4,67 4,13 4,02 3,84 3,44 3,25 3,15 Висота % Площа % 100,0 66,5 6,2 4,9 6,1 4,5 2,9 2,2 27,2 17,6 63,9 100,0 2,8 1,5 0,1 0 12,9 11,2 19,4 9,5 3,3 2,5 31,7 27,4 19,0 15,1 Пік 14 15 16 17 18 19 20 21 22 23 24 25 2-Тета 29,51 31,03 34,47 35,45 37,24 38,15 40,61 42,83 44,89 46,01 50,36 56,63 D (Å) 3,02 2,88 2,60 2,53 2,41 2,36 2,22 2,11 2,02 1,97 1,81 1,62 Висота % Площа % 1,6 0,3 0,7 0,4 1,0 1,5 0,4 0,2 1,5 0,7 1,2 0,9 3,1 2,8 1,5 1,4 1,6 1,3 2,4 1,8 0,7 0,8 1,0 0,9 [17] У варіанті здійснення даного винаходу при аналізі DSC тверда β-кристалічна форма піноцембрину показує температуру переходу декалесценції приблизно 204 °C (див. Фіг. 8). [18] ІЧ аналіз з KBr пелетою виконали на твердій β-кристалічній формі піноцембрину згідно з варіантом здійснення даного винаходу (див. Фіг. 9). Характеристичними піками були наступні: 3090,8, 2890,0, 2748,9, 2638,3, 1633,5, 1602,9, 1585,0, 1487,9, 1466,1, 1454,3, 1344,4, 1302,7, 1216,7, 1168,2, 1088,4, 1065,5, 1028,8, 1014,3, 1001,5, 975,8, 917,8, 888,2, 861,8, 826,6, 789,1, -1 766,6, 741,1, 715,4, 698,0, 663,7, 646,0, 620,5, 587,9, 574,8, 560,9, 527,2 та 488,4 см , де піки -1 2890,0, 2748,9, 2638,3, 1633,5 та 1344,4 см були основними характеристичними піками твердої β-кристалічної форми піноцембрину. Спосіб отримання зразка α-кристалічної форми піноцембрину згідно з варіантом здійснення даного винаходу [19] (1) повністю розчинюють зразок у розчиннику, вибраному з групи, що включає метанол, етанол, хлороформ, ацетон, етилацетат, n-бутанол, ізопропанол, ацетонітрил, THF, діоксан, 95 % етанол, льодяну оцтову кислоту, мурашину кислоту, ефір, дихлорметан, толуол, бензол, nгексан, циклогексан, діоксан, DMF, петролейний ефір, аміак, n-пропанол, або їх суміш, потім (a) поміщають суміш в умови температури 4-50 °C та відносної вологості 10 %-75 % для забезпечення рекристалізації протягом 1-60 днів або (b) додають воду для забезпечення осадження, потім отримують α-кристалічну форму піноцембрину шляхом фільтрації при зниженому тиску, ліофілізацією або холодним розпиленням. Спосіб отримання зразка β-кристалічної форми піноцембрину згідно з варіантом здійснення даного винаходу [20] Застосовують зразок твердої α-кристалічної форми у якості матеріалу, потім отримують зразок β-кристалічної форми піноцембрину шляхом (a) кристалічного переходу подрібненням або (b) повного розчинення матеріалу у розчиннику піридину або DMSO, додаванням води для осадження, та виконання фільтрації при зниженому тиску, ліофілізації або холодного розпилення. Фармакодинамічні характеристики зразка піноцембрину [21] Чиста α-кристалічна форма, чиста β-кристалічна форма або суміш α та β-кристалічних форм піноцембрину у будь-якій пропорції за даним винаходом мають ефект у лікуванні захворювань, пов'язаних з церебральною ішемією, або попередження захворювань, пов'язаних з церебральною ішемією, захисною функцією нейроваскулярної одиниці. 5 UA 102871 C2 5 10 15 20 25 30 35 40 45 50 55 60 [22] Існує різниця в біологічній доступності між чистою α-кристалічною формою та чистою βкристалічною формою за даним винаходом. Для перорального введення біологічна доступність β-кристалічної форми більш ніж в 2 рази вища, ніж α-кристалічної форми. Для суміші двох кристалічних форм у будь-якій пропорції їх біологічна активність може змінюватись в залежності від різних вмістів β-кристалічної форми. Характеристики дозування та препарату [23] Для фармацевтичної композиції або препарату, що містить чисту α-кристалічну форму, чисту β-кристалічну форму або їх суміш у будь-якій пропорції піноцембрину згідно з варіантом здійснення даного винаходу, щоденна доза складає 5~250 мг на основі твердих кристалічних форм піноцембрину. Препарати включають таблетки, капсули, пігулки, ін'єкції, препарати уповільненого вивільнення, препарати контрольованого вивільнення та подібне. Короткий опис графічних матеріалів [24] Фіг. 1 є ілюстрацією, що показує відносну конфігурацію молекули. [25] Фіг. 2 є ілюстрацією, що показує проекцію стерео-структури молекули. [26] Фіг. 3 є ілюстрацією, що показує укладання елементу молекули (вздовж a осі). [27] Фіг. 4 є порошковою дифракційною рентгенограмою для зразка α-кристалічної форми піноцембрину. [28] Фіг. 5 є слідом DSC (диференціальна скануюча калориметрія) для зразка α-кристалічної форми піноцембрину. [29] Фіг. 6 є спектром поглинання в інфрачервоній області для зразка α-кристалічної форми піноцембрину. [30] Фіг. 7 порошковою дифракційною рентгенограмою для зразка β-кристалічної форми піноцембрину. [31] Фіг. 8 є слідом DSC для зразка β-кристалічної форми піноцембрину. [32] Фіг. 9 є спектром поглинання в інфрачервоній області для зразка β-кристалічної форми піноцембрину. Детальний опис винаходу [33] Наступні ілюстративні приклади представлені з метою кращого опису даного винаходу, проте, потрібно відмітити, що даний винахід не обмежений даними прикладами. Інструменти та умови дослідження для наступних прикладів 1. Рентгенографічний аналіз монокристалів Інструмент: площовий детектор MAC DIP-2030K. Умова дослідження: напруга трубки: 50 кВ, потік трубки: 80 мA, ω сканування, MoK α, 2θ≤50,0°, діапазон сканування: 0-180°, кут повороту: 6°, крок: 6°, швидкість сканування: 1,8°/хвилина. 2. Аналіз рентгенівської порошкової дифракції Інструмент: порошковий рентгенівський дифрактометр Rigaku D/max 2550. Умови дослідження: напруга: 40 кВ, струм: 150 мA, швидкість сканування: 8°/хвилина. 3. DSC аналіз Тип інструменту: диференційний скануючий калориметр Seiko Іnstruments Inc. Умови дослідження: газ для продувки: N2, швидкість нагрівання: 10 °C/хвилина. Температурний діапазон: 25-250 °C. 4. ІЧ спектр поглинання Інструмент Nicolet FT-IR спектрометр: IMPACT 400. Умови дослідження: пелета KBr. 5. Аналіз HPCL (високоефективна рідинна хроматографія) Інструмент: високоефективна рідинна хроматографія SHIMADZU LC-10Avp, діодний матричний детектор SPD-M10Avp, система хроматографічних даних CLASS-VP; колонка: Alltch C18 (5μ, 150×4,6 мм); умови дослідження: температура колонки: кімнатна температура; довжина хвилі: 290 нм; рухома фаза: метанол/фосфатний сольовий розчин pH 3,0 (64/36); швидкість потоку: 1,0 мл/хвилина; об'єм ін'єкції: 20 мкл; концентрація ін'єкції: 500,0 мкг/мл. Приготування 1: Синтез зразка піноцембрину [34] До 1000 мл реакційного котла для гідрогенізації додали 5 г (19,7 ммоль) 5,7дигідроксифлавону, 650 мл безводного етанолу та 1,5 г 10 % паладію на вуглеці. Під тиском водню 0,13 МПа реакцію виконували протягом 4 годин при 40 °C. Коли реакція закінчилась, паладій на вуглеці відфільтрували. Фільтрат концентрували, потім відокремили та очистили колонковою хроматографією (елюювали метанолом:оцтовим ефіром:петролейним ефіром = 2:10:100 (об'єм:об'єм:об'єм)) під вакуумом. Розчинник випарили насухо та отримали 3,9 г білого [2] аморфного твердого порошку (чистота: 98,6 %, визначена HPLC) з виходом 52 % . Приготування зразка α-кристалічної форми піноцембрину 6 UA 102871 C2 5 10 15 20 25 Приклад 1: Спосіб 1 приготування зразка α-кристалічної форми піноцембрину [35] 5 г зразка піноцембрину додали до 20 мл 95 % етанолу та нагрівали до повного розчинення, потім охолодили до кімнатної температури та дозволили простояти 24 години. Білу тверду речовину осадили, відфільтрували та висушили. Отримали 4,5 г білої кристалічної речовини (чистота: 98,8 %, визначена HPLC) з виходом 90 %. [36] Отриману кристалічну речовину аналізували рентгеноструктурним аналізом. Він показав моноклінну симетрію, просторова група була P2 1/c, та параметричні значення кристалічної лунки дорівнювали a=5,189Å, b=24,149Å, c=10,472Å, α= 90°, β=102,31° та γ= 90°. [37] Рентгенівську порошкову (полікристалічну) дифракцію (CuKα опромінення) виконали на отриманій кристалічній речовині Значення характеристичних піків локації дифракційних піків: значення 2-Тета (°) або d значення (Å) і відносна інтенсивність дифракційного піка: значення висоти піка (Висота %) або значення площі піка (Площа %) показані у Таблиці 4, а отриманий слід показаний на Фіг. 4. [38] DSC аналіз виконали на отриманій кристалічній речовині, та температура переходу декалесценції складала 206 °C. [39] ІК аналіз з KBr пелетою виконували на отриманій кристалічній речовині, та характеристичні піки були наступними: 3090,6, 3011,6, 2889,1, 2747,4, 2636,2, 1631,5, 1602,5, 1584,3, 1487,7, 1466,2, 1454,5, 1435,6, 1354,9, 1302,4, 1257,0, 1217,0, 1168,2, 1088,6, 1064,9, 1028,0, 1014,6, 1001,3, 975,8, 918,0, 887,7, 861,8, 825,9, 789,9, 766,4, 715,2, 698,1, 663,7, 646,7, -1 620,3, 587,3, 574,9, 560,5, 526,9 та 487,9 см . [40] Вищевказані спектральні дані показали, що кристалічна форма, отримана у даному прикладі, була α-кристалічною формою. Приклади 2-10: Способи 2-10 для приготування зразка α-кристалічної форми піноцембрину [41] Звертаючись до способу приготування за Прикладом 1, застосовуючи етилацетат, хлороформ, ацетон, ацетонітрил, THF, ефір, бензол, циклогексан або DMF як розчинник, отримали білу кристалічну речовину піноцембрину. Результати експериментів показані у таблиці 6. Рентгенівську порошкову дифракцію, DSC та ІК аналіз виконали на отриманій кристалічній речовині, та результати показали, що кристалічною формою була α-кристалічна форма піноцембрину. 30 Таблиця 6 Результати приготування зразків α-кристалічної форми піноцембрину приклад 2 3 4 5 6 7 8 9 10 35 40 45 розчинник реакції етилацетат хлороформ ацетон ацетонітрил THF ефір бензол циклогексан DMF вага продукту (г) 4,40 4,30 4,30 4,20 4,25 4,35 4,20 4,20 4,20 HPLC чистота (%) 99,0 98,7 99,1 98,9 98,8 98,6 98,9 98,6 98,7 Відновлення (%) 88 86 86 84 85 87 84 84 84 Приклад 11: Спосіб 11 приготування зразка α-кристалічної форма піноцембрину [42] 5 г зразка піноцембрину повністю розчинили у 100 мл суміші 95 % етанолу та ацетону (95 % етанол:ацетон=1:1) при кімнатній температурі, потім додали 100 мл води при перемішуванні, та появився білий осад. Осад відфільтрували при зниженому тиску та висушили для отримання 4,00 г білої кристалічної речовини (чистота: 98,7 %) при відновленні 80,0 %. Рентгенівську порошкову дифракцію, DSC та ІК аналіз виконали на отриманій кристалічній формі, та результати показали, що отриманою кристалічною формою була α-кристалічна форма піноцембрину. Приклади 12-16 Способи 12-16 для приготування зразка α-кристалічної форми піноцембрину [43] Звертаючись до способу приготування за Прикладом 1, застосовуючи суміш ізопропанолу та THF (ізопропанол:THF=2:1), суміш ацетонітрилу та DMF (ацетонітрил:DMF=4:1), суміш метанолу та ацетону (метанол:ацетон=3:2), суміш етанолу та ацетонітрилу (етанол:ацетонітрил=1:1) та суміш етанолу, ацетону та льодяної оцтової кислоти (етанол:ацетон:льодяна оцтова кислота=2:1:0,1) як розчинники, отримали білу кристалічну 7 UA 102871 C2 речовину піноцембрину. Результати експериментів показані у Таблиці 7. Рентгенівську порошкову дифракцію, DSC та ІК аналіз виконали на отриманій кристалічній речовині, та результати показали, що отриманою кристалічною формою була α-кристалічна форма піноцембрину. 5 Таблиця 7 Результати зразків α-кристалічної форми піноцембрину приклад розчинник реакції вага продукту (г) 12 13 14 15 2:1 ізопропанол-THF 4:1 ацетонітрил-DMF 3:2 метанол-ацетон 1:1 етанол-ацетонітрил 2:1:0,1 етанол-ацетон-льодяна оцтова кислота 4,00 3,80 3,90 4,05 HPLC чистота (%) 98,8 98,7 98,9 99,0 4,10 98,9 16 10 15 20 25 30 35 40 45 Відновлення (%) 80 76 78 81 82 Приготування зразка β-кристалічної форми піноцембрину Приклад 17: Спосіб 1 приготування зразка β-кристалічної форми піноцембрину [44] 10 г зразка α-кристалічної форми піноцембрину помістили у ступку, рівномірно перетирали у одному напрямку протягом 1 години при кімнатній температурі та отримали білу кристалічну речовину, яка відрізнялася від α-кристалічної форми. [45] Рентгенівську порошкову (полікристалічну) дифракцію (CuKα опромінення) виконали на отриманій кристалічній речовині. Значення характеристичних піків локації дифракційного піка: значення 2-Тета (°) або d значення (Å) і відносна інтенсивність дифракційного піка: значення висоти піка (Висота %) або значення площі піка (Площа %) показані в Таблиці 5, та отриманий слід показаний на Фіг. 7. [46] DSC аналіз виконали на отриманій кристалічній речовині, та температура переходу декалесценції складала 204 °C, як показано на сліді DSC. [47] ІК аналіз з KBr пелетою виконали на отриманій кристалічній речовині, та характеристичними піками були наступні: 3090,8, 2890,0, 2748,9, 2638,3, 1633,5, 1602,9, 1585,0, 1487,9, 1466,1, 1454,3, 1344,4, 1302,7, 1216,7, 1168,2, 1088,4, 1065,5, 1028,8, 1014,3, 1001,5, 975,8, 917,8, 888,2, 861,8, 826,6, 789,1, 766,6, 741,1, 715,4, 698,0, 663,7, 646,0, 620,5, 587,9, -1 574,8, 560,9, 527,2 та 488,4 см . [48] Вищеописані спектральні дані показали, що отриманою кристалічною формою у даному прикладі була β-кристалічна форма. Приклад 18: Спосіб 2 приготування β-кристалічної форми піноцембрину [49] При кімнатній температура 5 г зразка піноцембрину розчинили у 75 мл DMSO, до якого потім додали 150 мл води при перемішуванні, та появився білий осад. Осад відфільтрували та висушили для отримання 4,2 г білої кристалічної речовини (чистота: 98,8 %, визначена за допомогою HPLC) при відновленні 84,0 %. Рентгенівську порошкову дифракцію, DSC та ІК аналіз виконали на отриманій кристалічній речовині, та результати показали, що отриманою кристалічною формою була β-кристалічна форма піноцембрину. Приклад 19: Спосіб 3 приготування зразка β-кристалічної форми піноцембрину [50] За виключенням того, що як розчинник використовували піридин, застосовували то самий спосіб приготування, що і у Прикладі 18, та отримали 8,8 г білої кристалічної речовини (чистота: 98,6 %, визначена за допомогою HPLC) при відновленні 88,0 %. Рентгенівську порошкову дифракцію, DSC та ІК аналіз виконали на отриманій кристалічній речовині, та результати показали, що отриманою кристалічною формою була β-кристалічна форма піноцембрину. Приклад 20 Спосіб приготування зразка суміші піноцембрину α-кристалічної форми та β-кристалічної форми у співвідношенні 1:1 [51] 10 г зразка піноцембрину α та β-кристалічної форми, відповідно, зважили та помістили у посудину, яку можна герметично закрити. Посудину герметично закрили та збовтали для рівномірного змішування твердих часток. Отримали зразок суміші α та β-кристалічної форми у співвідношенні 1:1. Склад Приклад 21 8 UA 102871 C2 5 Спосіб 1 приготування скомбінованого фармацевтичного препарату (таблетка) [52] Зразки чистої α-кристалічної форми, чистої β-кристалічної форми або суміші твердих часток (α+β) кристалічної форми (α:β=1:1) піноцембрину змішали з наповнювачами у різних співвідношеннях для отримання твердих часток скомбінованих фармацевтичних активних інгредієнтів. Отримали таблетки, що містять 5~60 мг активних інгредієнтів. Формула таблетки наведена в Таблиці 8. Таблиця 8 Формула препарату для таблеток скомбінованого піноцембрину компоненти кількість (г/1000 таблетки) Формула Формула Формула Формула Формула Формула Формула 1 2 3 4 5 6 7 5,0 10,0 20,0 30,0 40,0 50,0 60,0 100,0 100,0 100,0 100,0 100,0 100,0 100,0 35 30 20 10 Піноцембрин (г) Лактоза (г) Крохмаль (г) Низько-заміщена гідроксипропіл целюлоза 3,0 3,0 3,0 3,0 3,0 3,0 3,0 (г) MCC (г) 3,0 3,0 3,0 Тальковий порошок (г) 6,0 6,0 6,0 6,0 6,0 6,0 6,0 Стеарат магнію (г) 1,0 1,0 1,0 1,0 1,0 1,0 1,0 1 % натрію скільки скільки скільки скільки скільки скільки скільки гідроксиметилцелюлоза потрібно потрібно потрібно потрібно потрібно потрібно потрібно 10 15 20 [53] Детальний спосіб приготування наступний: рівномірно змішують наповнювачі з піноцембрином, потім додають відповідну кількість 1 % розчину натрію гідроксиметилцелюлози для створення густої маси. Густу масу пропускають крізь сито для отримання гранул. Вологі гранули сушать та просіюють. Потім додають стеарат магнію і тальковий порошок, рівномірно змішують та отримують продукт таблетуванням. Приклад 22 Спосіб 2 приготування скомбінованого фармацевтичного складу (капсула) [54] Зразки чистої α-кристалічної форми, чистої β-кристалічної форми або суміші твердих часток (α+β) кристалічної форми (α:β=1:1 або 1:3) піноцембрину змішали з наповнювачами у різних співвідношеннях для отримання твердих часток скомбінованих фармацевтичних активних інгредієнтів. Отримали капсули, що містять 5~60 мг активних інгредієнтів. Формули капсули представлена в Таблиці 9. Таблиця 9 Формули препарату для скомбінованих капсул піноцембрину компоненти Піноцембрин (г) Лактоза (г) Крохмаль (г) MCC (г) Стеарат магнію (г) Кількість (г/1000 капсул) Формула Формула Формула Формула Формула Формула Формула 1 2 3 4 5 6 7 5,0 10,0 20,0 30,0 40,0 50,0 60,0 100,0 100,0 100,0 100,0 70,0 60,0 50,0 1,0 1,0 1,0 1,0 1,0 1,0 1,0 1 % Натрію скільки скільки скільки скільки скільки скільки скільки гідроксиметилцелюлоза потрібно потрібно потрібно потрібно потрібно потрібно потрібно 25 [55] Детальний спосіб приготування наступний: рівномірно змішують наповнювачі з піноцембрином, потім додають відповідну кількість 1 % розчину натрію гідроксиметилцелюлози для створення вологих гранул, вологі гранули сушать і просіюють. Потім додають стеарат магнію, рівномірно змішують і отримують продукт заповненням вищеописаною сумішшю 9 UA 102871 C2 5 10 порожніх капсул. Альтернативно, без грануляції продукт отримують безпосереднім заповненням наповнювачами та піноцембрином порожніх капсул, після чого їх рівномірно змішують та просіюють. Приклад 23 Спосіб 3 приготування скомбінованого фармацевтичного складу (ін'єкційний розчин для та ліофілізований порошок для ін'єкції) [56] Чисту α-кристалічну форму, чисту β-кристалічну форму або суміш твердих часток (α+β) кристалічної форми (α:β=1:1) піноцембрину змішують з наповнювачами у різних співвідношеннях для отримання твердих часток скомбінованих фармацевтичних активних інгредієнтів. Потім отримують ін'єкції, що містять 5~60 мг активних інгредієнтів на ампулу. Формули ін'єкцій представлені у Таблиці 10. Таблиця 10 Формули препарату для скомбінованих ін'єкцій піноцембрину Компоненти Піноцембрин (г) Гідроксипропіл-β-циклодекстрин (г) Дистильована вода (мл) Етанол (мл) Хлорид натрію (г) Декстроза (г) 15 20 25 30 35 40 45 Формула 1 1 40 400 20 Формула 2 1 40 100 20 Формула 3 1 20 10000 20 90 Формула 4 1 20 10000 20 500 Формула 1: Приготування ін'єкційного розчину піноцембрину (1) До 400 мл дистильованої води додали 40 г гідроксипропіл-β-циклодекстрину та розчинили з перемішуванням. (2) До 20 мл етанол додали 1 г піноцембрину та розчинили, потім отриманий розчин додали до розчину гідроксипропіл-β-циклодекстрину, згаданого вище. (3) Змішаний розчин перемішували магнітним способом протягом 20 хвилин при 40~50 °C. Коли розчин став чистим і прозорим, додали 0,5 г активованого вуглецю для ін'єкції. Потім суміш нагрівали до 80 °C з перемішуванням та тримали при цій температурі протягом 15 хвилин, потім вуглець відфільтрували. Фільтрат розфасували в ампулу по 4 мл в кожну. Ін'єкційний розчин піноцембрину отримали після стерилізації при 121 °C протягом 15 хвилин. Формула 2: Приготування ліофілізованого порошку піноцембрину для ін'єкції (1) В стерильній кімнаті зважили 40 г гідроксипропіл-β-циклодекстрину та розчинили у воді для утворення 150 мл розчину. Додали 0,1 г активованого вуглецю та суміш нагрівали до повільного кипіння протягом 15 хвилин, а потім вуглець відфільтрували. (2) 1 г піноцембрину розчинили у 20 мл безводного етанолу, потім отриманий розчин додали до розчину гідроксипропіл-β-циклодекстрину, згаданого вище. (3) Суміш перемішували магнітним способом протягом 20 хвилин при 40~50 °C. Коли розчин став чистим і прозорим, отримали складний розчин включення піноцембрину у гідроксипропіл-βциклодекстрині. (4) Воду додавали до складного розчину включення до 200 мл. Суміш відфільтрували через 0,22 мкм мембранний фільтр. Фільтрат розфасували у флакон 10 мл (2 мл/флакон) та помістили у ліофілізатор для ліофілізації. Після того, як пробки флакону герметично закрили, отримали стерильний порошок для ін'єкції. Формула 3: Приготування інфузії піноцембрину хлориду натрію (1) До 200 мл дистильованої води додали 20 г гідроксипропіл-β-циклодекстрину та розчинили при перемішуванні. Додали 0,5 г активованого вуглецю для інфузії. Суміш нагрівали до 80 °C з перемішуванням та тримали при цій температурі протягом 15 хвилин, потім вуглець відфільтрували. (2) Зважили 1 г піноцембрину та розчинили у 20 мл безводного етанолу, потім отриманий розчин вилили у розчин гідроксипропіл-β-циклодекстрину, згаданий вище. (3) Суміш перемішували магнітним способом протягом 20 хвилин при 40~50 °C. Коли розчин став чистим і прозорим, отримали складний розчин включення піноцембрину у гідроксипропіл-βциклодекстрині. (4) До комплексу включення розчину додали воду до 800 мл. Після додавання 90 г хлориду натрію для ін'єкції розчин відрегулювали до pH 8~9 та розбавили до 10000 мл водою. Потім додали 10 г активованого вуглецю для ін'єкції та перемішували протягом 20 хвилин. 10 UA 102871 C2 5 10 15 20 25 (5) Після видалення вуглецю розчин розфасували по 100 мл на пляшку. Після стерилізації при 121 °C протягом 30 хвилин отримали продукт. Формула 4: Приготування інфузії декстрози піноцембрину (1) 20 г гідроксипропіл-β-циклодекстрину додали до 200 мл дистильованої води та розчинили з перемішуванням. Додали 0,5 г активованого вуглецю для інфузії. Суміш нагрівали до 80 °C при перемішуванні та тримали при цій температурі протягом 15 хвилин, потім вуглець відфільтрували. (2) 1 г піноцембрину розчинили у 20 мл безводного етанолу, потім отриманий розчин вилили у розчин гідроксипропіл-β-циклодекстрину, згаданий вище. (3) Суміш перемішували магнітним способом протягом 20 хвилин при 40~50 °C. Коли розчин став чистим і прозорим, отримали складний розчин включення піноцембрину у гідроксипропіл-βциклодекстрині. (4) Воду додавали до складного розчину включення до 800 мл. Після додавання 500 г глюкози для ін'єкції розчин відрегулювали до pH 8~9 і розбавили до 10000 мл водою. Потім додали 10 г активованого вуглецю для ін'єкції та перемішували протягом 20 хвилин. (5) Після видалення вуглецю розчин розфасували по 100 мл на пляшку. Після стерилізації при 121 °C протягом 30 хвилин отримали продукт. Приклад 24 In vivo абсорбція та характеристики концентрації в крові для твердого активного інгредієнту піноцембрину α та β-кристалічних форм [57] 18 щурів SD, по половині самок і самців, з вагою тіла 230~250 г, рандомізували на 3 групи, з 6 щурами на кожну групу, де половина з них - самки. Після 10 годин голоду, але з вільним прийомом води, щурам ввели порошок твердого активного інгредієнту піноцембрину α, β або 1:1 (α+β) змішаних кристалічних форм, при дозі 50 мг/кг у шлунок. Потім брали зразки артеріальної крові взяли у різний час та визначали вміст піноцембрину. Результат показав, що для піноцембрину різних кристалічних форм при тому самому дозуванні пероральним введенням, концентрації крові та час досягнення пікової концентрації відрізнялись, де концентрація у крові α-кристалічної форми була безумовно нижче, ніж β-кристалічної форми. Таблиця 11 Концентрації у крові у різний час для щурів, яким ввели перорально зразки піноцембрину різних кристалічних форм (визначено HPLC, значення площі піка) Час кристалічні форми β-кристалічна форма 1:1 (α+β)-кристалічні форми Α-кристалічна форма 10 хвилин 13,2 8,5 3,8 20 хвилин 48,6 15,6 9,7 30 хвилин 14,6 7,9 4,4 40 хвилин 14,2 7,1 3,5 Примітка: концентрації в крові, приведені в таблиці, були середнім значенням для щурів в кожній групі. 30 Посилання 1. Chinese patent: publication number CN1695608A. 2. Cheng Yonghao, etc. synthesis of 5,7-dihydricflavanone, chemical reagents, 2006, 28(7): 437. ФОРМУЛА ВИНАХОДУ 35 1. β-Кристалічна форма піноцембрину формули (І): O HO OH O , (І) 11 UA 102871 C2 яка відрізняється тим, що при аналізі рентгенівською порошковою (полікристалічною) дифракцією (CuKα опромінення) локації дифракційного піка: значення 2-тета (°) або d значення (Å), та відносна інтенсивність дифракційного піка: значення висоти піка (Висота %) або значення площі піка (Площа %), мають наступні характеристики: 5 Пік 1 2 3 4 5 6 7 8 9 10 11 12 13 10 15 20 25 30 35 40 45 2-тета 7,33 9,41 11,33 14,07 14,69 17,49 19,01 21,49 22,11 23,17 25,91 27,41 28,31 d(Å) 12,06 9,40 7,81 6,29 6,03 5,07 4,67 4,13 4,02 3,84 3,44 3,25 3,15 Висота % Площа % 100,0 66,5 6,2 4,9 6,1 4,5 2,9 2,2 27,2 17,6 63,9 100,0 2,8 1,5 0,1 0 12,9 11,2 19,4 9,5 3,3 2,5 31,7 27,4 19,0 15,1 Пік 14 15 16 17 18 19 20 21 22 23 24 25 2-тета 29,51 31,03 34,47 35,45 37,24 38,15 40,61 42,83 44,89 46,01 50,36 56,63 d(Å) 3,02 2,88 2,60 2,53 2,41 2,36 2,22 2,11 2,02 1,97 1,81 1,62 Висота % Площа % 1,6 0,3 0,7 0,4 1,0 1,5 0,4 0,2 1,5 0,7 1,2 0,9 3,1 2,8 1,5 1,4 1,6 1,3 2,4 1,8 0,7 0,8 1,0 0,9 2. β-Кристалічна форма піноцембрину за п. 1, яка відрізняється тим, що температура переходу декалесценції сліду DSC становить приблизно 204 °C. 3. β-Кристалічна форма піноцембрину за п. 1, яка відрізняється тим, що її спектр поглинання в інфрачервоній області має наступні піки: 3090,8, 2890,0, 2748,9, 2638,3, 1633,5, 1602,9, 1585,0, 1487,9, 1466,1, 1454,3, 1344,4, 1302,7, 1216,7, 1168,2, 1088,4, 1065,5, 1028,8, 1014,3, 1001,5, 975,8, 917,8, 888,2, 861,8, 826,6, 789,1, 766,6, 741,1, 715,4, 698,0, 663,7, 646,0, 620,5, 587,9, -1 -1 574,8, 560,9, 527,2 та 488,4 см , де піки 2890,0, 2748,9, 2638,3, 1633,5 та 1344,4 см є основними характеристичними піками β-кристалічної форми піноцембрину. 4. Змішана кристалічна форма піноцембрину, що включає α-кристалічну форму та β-кристалічну форму піноцембрину у будь-якій пропорції. 5. Кристалічна форма піноцембрину за будь-яким одним з попередніх пунктів, яка відрізняється тим, що вказана кристалічна форма вільна від кристалізаційної води або іншого кристалічного розчинника. 6. Активний фармацевтичний інгредієнт, що містить кристалічну форму піноцембрину за п. 1 або 4 як основний компонент, причому вказаний активний фармацевтичний інгредієнт застосовується для виготовлення лікарського препарату для лікування захворювань, пов'язаних з церебральною ішемією, або лікарського препарату для попередження захворювань, пов'язаних з церебральною ішемією, захисною функцією нейроваскулярної одиниці. 7. Активний фармацевтичний інгредієнт за п. 6, щоденна доза якого знаходиться в діапазоні від 5 до 250 мг твердої кристалічної форми піноцембрину. 8. Фармацевтична композиція, що містить терапевтично ефективну кількість кристалічної форми піноцембрину за будь-яким одним з пп. 1 або 4 у комбінації з одним або більше фармацевтично прийнятними носіями. 9. Фармацевтична композиція, що містить активний фармацевтичний інгредієнт за п. 6 або 7 як основний компонент, яка відрізняється тим, що фармацевтична композиція має форму таблетки, капсули, пігулки, ін'єкції, препарату уповільненого вивільнення або препарату контрольованого вивільнення. 10. Застосування кристалічної форми піноцембрину за п. 1 або 4 або активного фармацевтичного інгредієнта за п. 6, або фармацевтичної композиції за п. 8 при виготовленні лікарського препарату для лікування захворювань, пов'язаних з церебральною ішемією, або лікарського препарату для попередження захворювань, пов'язаних з церебральною ішемією, захисною функцією нейроваскулярної одиниці. 11. Спосіб отримання β-кристалічної форми піноцембрину, в якому здійснюють етапи, на яких: застосовують α-кристалічну форму піноцембрину як початковий матеріал, з якого отримують βкристалічну форму піноцембрину шляхом кристалічного переходу подрібненням. 12. Спосіб отримання β-кристалічної форми піноцембрину, в якому здійснюють етапи, на яких: застосовують зразок піноцембрину як початковий матеріал, з якого отримують β-кристалічну форму піноцембрину шляхом повного розчинення матеріалу у розчиннику піридині або DMSO, потім додають воду для забезпечення осадження та виконують фільтрацію при зниженому тиску, ліофілізацією або холодним розпиленням. 12 UA 102871 C2 13 UA 102871 C2 14 UA 102871 C2 15 UA 102871 C2 Комп’ютерна верстка С. Чулій Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 16
ДивитисяДодаткова інформація
Назва патенту англійськоюTwo types of crystalline of pinocembrin: a and b, their preparation and their use for manufacture pharmaceutical compositions
Автори англійськоюDu, Guanhua, Lv, Yang, Wu, Song, Wang, Ke, Chang, Ying, Yang, Zhihong, Tong, Yuanfeng, Gao, Mei
Назва патенту російськоюb-кристаллическая форма пиноцембрина, ее получение и ее применение для изготовления фармацевтических композиций
Автори російськоюДу Ганьхуа, Люй Ян, У Сун, Ван Ке, Чан Ин, Ян Чжихун, Тун Юаньфен, Гао Мей
МПК / Мітки
МПК: A61P 9/10, C07D 311/32, C07D 311/22, A61K 31/353
Мітки: b-кристалічна, фармацевтичних, застосування, виготовлення, форма, композицій, отримання, піноцембрину
Код посилання
<a href="https://ua.patents.su/18-102871-b-kristalichna-forma-pinocembrinu-otrimannya-ta-zastosuvannya-dlya-vigotovlennya-farmacevtichnikh-kompozicijj.html" target="_blank" rel="follow" title="База патентів України">b-кристалічна форма піноцембрину, її отримання та її застосування для виготовлення фармацевтичних композицій</a>
Попередній патент: Пристрій для розливу напоїв і спосіб контролю пристрою для розливу напоїв
Наступний патент: Алюмосилікатна бетонна суміш
Випадковий патент: Блок керування гідравлічний