Кристалічна форма (s)-2 етокси-3-[4-(2-{4-метансульфонілоксифеніл}етокси] феніл) пропанової кислоти, спосіб її виготовлення та застосування в медицині (варіанти)
Формула / Реферат
1. Кристалічна форма сполуки (S)-2-етокси-3-[4-(2-{4-метансульфонілоксифеніл}етокси)феніл] пропанової кислоти, представлена формулою І
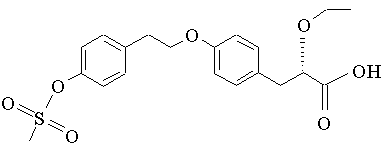 (І),
(І),
яка характеризується тим, що має дифракційну картину рентгенівського випромінювання на порошку, що має характерні піки високої відносної інтенсивності при 6,2, 4,47 та 4,15 Å.
2. Кристалічна форма за п. 1, яка відрізняється тим, що по суті не містить розчинник.
3. Кристалічна форма за п. 2, яка відрізняється тим, що має температуру плавлення 82-92°С.
4. Кристалічна форма за п. 1, яка відрізняється тим, що дифракційна картина рентгенівського випромінювання на порошку має додаткові щодо перших піків характерні піки нижчої відносної інтенсивності при 4,69, 3,64, 3,60 та 3,45 Å.
5. Кристалічна форма сполуки формули І за будь-яким з пп. 1-4, яка відрізняється тим, що застосовується як медикамент.
6. Фармацевтична композиція, яка відрізняється тим, що містить кристалічну форму сполуки формули І за будь-яким з пп. 1-4 та фармацевтично прийнятний ад'ювант, розріджувач чи носій.
7. Застосування кристалічної форми сполуки формули І за будь-яким з пп. 1-4 при виготовленні медикаменту для лікування чи профілактики станів, пов'язаних зі зниженою чутливістю хворих до інсуліну.
8. Застосування речовини за будь-яким з пп. 1-4 при виготовленні медикаменту для лікування метаболічних порушень.
9. Застосування кристалічної форми сполуки формули І за будь-яким з пп. 1-4 при виготовленні медикаменту для лікування або профілактики дисліпідемії, цукрового діабету другого типу, гіперглікемії, гіперінсулінемії, артеріальної гіпертензії та/або абдомінального ожиріння.
10. Спосіб виготовлення кристалічної форми сполуки формули І за п. 1 з некристалічної форми, який включає розчинення некристалічної сполуки у відповідній системі розчинника, після чого некристалічну сполуку кристалізують у системі розчинника через перенасичення, випарювання розчинника та/або додавання антирозчинника.
Текст
1. Кристалічна форма сполуки (S)-2-етокси-3[4-(2-{4-метансульфонілоксифеніл}етокси)феніл] пропанової кислоти, представлена формулою І C2 2 UA 1 Винахід стосується кристалічної форми сполуки (S)-2-етокси-3-[4-(2-{4метансульфонілоксифеніл}етокси)феніл] пропанової кислоти, представленої формулою І O O O OH O S O O (І) 3 75582 4 або її фармацевтично прийнятної солі та сосмертності, особливо ті, хто переніс інфаркт міольвату. Винахід також стосується способів лікукарду чи інсульт. Атеросклероз, пов'язаний з цуквання одного чи більше станів хвороби обміну реровим діабетом 2-го типу, виявляється причиною човин, зокрема таких, що пов'язані із синдромом майже 80% смертей. інсулінорезистентності, застосування кристалічної Щодо клінічної медицини, тут також усвідомформи сполуки або її фармацевтично прийнятної люють потребу підвищити сприйнятливість інсулісолі чи сольвату у виробництві медикаментів тену страждаючими на синдром інсулінорезистентрапевтичного призначення при одній чи більше ності та, відповідно, ліквідувати дисліпідемію, яку хворобах обміну речовин. вважають причиною прискореного розвитку атероВинахід також стосується фармацевтичних склерозу. Проте, сьогодні таке захворювання не є композицій, які містять кристалічну форму сполуки чітко визначеним. або її фармацевтично прийнятну сіль чи сольват, Цей винахід стосується твердої кристалічної як активний інгредієнт, а також способів виготовформи сполуки за формулою І. Значні переваги лення кристалічної форми сполуки, або її фармаможуть виникнути при виділенні кристалічної форцевтично прийнятної солі чи сольвату. ми сполуки формули І, наприклад, при одержанні При утворенні лікарських композицій важливо, сполуки таких рівнів чистоти та однорідності, яких щоб лікарська речовина мала таку форму, яка б вимагають стандарти і таких, що полегшують вигодозволяла легке користування та оброблення. Це товлення композиції. важливо не тільки з огляду на досягнення життєСполуку формули І виділено як тверду кристаздатного в промислових умовах способу виготовлічну речовину. Певна кристалічна форма, яку лення, але і з огляду на подальше виготовлення виділено, існує у формі, яка по суті не містить розфармацевтичних композицій, що містять активну чиннику (далі "безводна форма"). З іншого боку, сполуку. сполуку можливо отримати у сольватованій формі, Хімічна стійкість, стійкість твердого стану та наприклад, гідратованій. час зберігання активних інгредієнтів є також важВинахід представлено кристалічною формою ливими факторами. Лікарська речовина та компосполуки І або її сольватом. Варіантом винаходу є зиції, що її містять, повинні ν мати здатність до кристалічна форма фармацевтично прийнятної ефективного зберігання протягом значного часу, солі сполуки І або її сольват. не виявляючи при цьому суттєвої зміни у фізичних Термін "сольватований" охоплює також "гідрата хімічних властивостях активного компоненту тований". Під терміном "кристалічна форма" слід (хімічний склад, густина, гігроскопічність та розрозуміти кожну імовірну кристалічну форму сполучинність). ки формули І, бажано у безводній формі. Крім того, важливо одержати препарат у найКристалічну форму сполуки формули І можна більш хімічно чистій формі. визначити її точкою плавлення, дифракцією рентЗ огляду на це, значні проблеми можуть ствогенівського випромінювання на порошку та дифрарити аморфні матеріали. Наприклад, на відміну від кцією рентгенівського випромінювання монокрискристалічного матеріалу, складати рецептуру та талу. працювати з ними звичайно важче через ненадійТочка плавлення кристалічної форми сполуки ну розчинність, нестійкість та хімічні домішки. формули І, як правило, залежить від рівня чистоти Фахівці зрозуміють, що ця проблема вирішитьі може бути визначена відомими традиційними ся, коли можна буде легко одержати стійку крисспособами, наприклад, диференційною скануючою талічну форму. калориметрією (ДСК). Звичайно, безводна форма Таким чином, бажано, щоб комерційно життємає точку плавлення від 82°С до 92°С, наприклад, здатні та фармацевтично прийнятні лікарські комблизько 85°С-89°С. позиції, по можливості, мали суттєво кристалічну, За дифракцією рентгенівського випромінюванстійку лікарську форму. ня на порошку, безводна форма має характерні Слід зазначити, що не завжди можна досягти піки високої інтенсивності при 6,2, 4,47 та 4,15 Ǻ. цієї мети. Дійсно, не можна лише за молекулярною Додаткові щодо перших специфічні піки нижчої структурою передбачити кристалічну поведінку відносної інтенсивності мають значення 4,69, 3,64, структури сполуки, оскільки це можливо тільки 3,60 та 3,45 Ǻ. емпірично. Кристалічна форма сполуки формули І може Сполуку згідно з винаходом призначено для бути одержана з некристалічної форми сполуки терапевтичного застосування при синдромі інсуліформули І кристалізацією з відповідного розчиннинорезистентності, пов'язаному із сукупністю проку (включно з органічними розчинниками, їх водявів, включно з резистентністю до інсуліну, що ними розчинами та сумішами) такого як толуол та супроводжується гіперінсулінемією, можливим етилацетат, або суміш таких розчинників, як суміш цукровим діабетом 2-го типу, артеріальною гіперетанол/вода, ізопропанол/вода чи толуол/ізооктан. тензію, центральним (вісцеральним) ожирінням, Для ініціювання кристалізації може бути необхідне дисліпідемією у вигляді порушених рівнів ліпопровведення кристалічної речовини сполуки формули теїну, які типово характеризуються підвищеною І. Кристалізувати сполуку з відповідної системи ЛДНГ (ліпопротеїни з дуже низькою густиною) та розчиннику можна перенасичуванням, наприклад, зменшеною ЛВГ (ліпопротеїни з високою густиохолодженням, випарюванням розчиннику та/або ною), а також зниженим фібринолізом. додаванням антирозчиннику, тобто розчиннику, в Як показав нещодавній епідеміологічний досякому сполука речовини І розчиняється погано, лід, особи резистентні до інсуліну зазнають підвинаприклад, гептан та ізооктан). Температура та щеного ризику серцево-судинних захворювань та час кристалізації залежать від концентрації сполу 5 75582 6 ки формули І у розчині, від системи розчиннику, Винахід також стосується застосування крисяку застосовують та способу кристалізації. талічної сполуки згідно з винаходом, яку описано Кристалічну форму сполуки формули І може вище, для виготовлення медикаменту, призначебути виділено відомими способами, наприклад, ного для: декантуванням, фільтруванням та центрифугуван(і) лікування дисліпідемії; ням. Кристалічну форму можна висушити. (іі) лікування цукрового діабету 2-го типу; Таку саму чи іншу систему розчинників можна (iiі) лікування гіперглікемії; застосувати під час перекристалізації з метою (iv) лікування гіперінсулінемії; зниження вмісту домішок, наприклад, аморфного (ν) лікування гіперліпідемії; матеріалу, хімічних домішок, або, з метою перет(vi) лікування артеріальної гіпертензії; та/або ворення кристалічної форми на сольватова(vii) лікування абдомінального ожиріння. ну/гідратовану або безводну форму. Винахід також стосується способу одержання Кристалізацію бажано проводити безпосередефекту, як описано вище, або лікування хвороби ньо з реакційного розчину. Кристалізацію також чи розладу, що полягає в уведенні теплокровній можна проводити з подальшого розчину. тварині, переважно людині, яка потребує такого Винахід також стосується способу одержання лікування, ефективної кількості кристалічної форкристалічної форми сполуки формули І, який полями сполуки формули І, яку описано вище. гає в кристалізації сполуки формули І. Величина дози кристалічної форми сполуки Термін "безводна форма" не виключає присуформули І для терапевтичних чи профілактичних тності деякої кількості розчиннику, включно з воцілей безумовно буде змінюватися залежно від дою, у кристалічній решітці. Розчинник, включно з типу та складності медичного стану, віку та статі водою, може бути за межами кристалічної решітки. тварини чи пацієнта, які потребують лікування, а Винахід стосується також кристалічної форми також способу уведення, відповідно до відомих сполуки формули І, яку описано вище, для застоправил медицини. сування у медичній терапії. Відповідні щоденні дози сполук, згідно з винаЩе одним об'єктом винаходу є фармацевтичходом, при терапевтичному лікуванні людей стана композиція, яка містить кристалічну форму споновлять приблизно від 0,001-50мг/кг маси тіла, луки формули І, яку описано вище, у поєднанні з найкраще 0,01-10мг/кг маси тіла. фармацевтично прийнятним розріджувачем чи Кристалічну форму сполуки формули І можна носієм. Кристалічну форму сполуки формули І, яку призначати як єдиний засіб лікування або спільно описано вище, при виготовленні фармацевтичної з такими іншими фармакологічно активними агенкомпозиції використовують, поєднуючи кристалічтами, як протидіабетичний, протигіпертензивний, ну форму сполуки формули І та фармацевтично діуретик чи протигіперліпідемічний. прийнятного розріджувача чи носія. Кристалічні форми, одержані згідно з ПриклаКомпозиція може мати форму для пероральдами, наведеними нижче, виявляли суттєво однаного уведення, наприклад, таблетки, капсули, розкові дифракційну картину рентгенівського випромічину у воді чи в олії, суспензії чи емульсії; місцевонювання на порошку та/або термограму го призначення, наприклад, крем, мазь, гель, диференційної скануючої калориметрії. Порівнююводний чи олійний розчин чи суспензія; назального чи відповідні дифракційні картини/термограми уведення, наприклад, лікарський порошок для (враховуючи допущення на експериментальну вдихання через ніс, назальний спрей або краплі; помилку) стало очевидним, що було утворено таку вагінального чи ректального уведення, наприклад, саму кристалічну форму. Початкова температура супозиторій; для інгаляційного уведення, напридиференційної скануючої калориметрії може варіклад, у вигляді тонкодисперсного порошку, сухого юватися в межах ±5°С (наприклад ±2°С), а дистапорошку, мікрокристалічної форми чи рідкого аенційні значення дифракційного рентгенівського розолю; сублінгвального чи букального уведення, випромінювання на порошку можуть змінюватися в наприклад, таблетка чи капсула; або парентерамежах ±5 меншого десяткового розряду. льного уведення (включно з внутрішньовенним, Скорочення підшкірним, внутрішньом'язовим, внутрішньосуEtOAc= етилацетат динним чи інфузією), наприклад, стерильний воHPLC= високоефетивна рідинна хроматодяний або олійний розчин, або суспензія. графія Взагалі, композицію можна одержати традиі-РrOАс= ізопропілацетат ційним способом, застосовуючи традиційні ексциNMP= N-метил-2-піролідинон пієнти. THF= тетрагідрофуран Кількість кристалічної форми сполуки формуСинтез (S)-2-етокси-3-[4-(2-{4ли І, яку описано вище, для поєднання з одним чи метансульфонілоксифеніл) етокси) фенілі пропакількома ексципієнтами, щоб одержати одноразонової кислоти ву дозовану форму, обов'язково буде змінюватися 1) Етилу (S)-2-етокси-3-(4-гідроксифеніл) прозалежно від хворого та способу введення. паноат Наприклад, композиція призначена для пероа) Одержання етилу 2-етоксіетаноату рального введення людині, як правило, буде місРозчин 2-хлорооцтової кислоти (50г, тити від 0,001мг до 50мг активної речовини у по529ммоль, 1,0екв.) у чистому етанолі (110мл, єднанні з відповідною і стандартною кількістю 2,2об.(об. далі означає еквівалент об'єму) уводили ексципієнтів, масова частка яких може змінюватиу етанольний розчин етоксиду натрію (494мл, 90г, ся від 10% до 99,9999% від загальної маси ком1,32ммоль, 2,5об.). Протягом уведення темперапозиції. туру підтримували при 15-25°С. Після того, як уве 7 75582 8 дення було завершено, температуру підвищували 3-(4-метоксифеніл) пропенової кислоти та охолодо 50°С. Реакційну суміш охолодили до 15°С після джували до 0°С. Після кристалізації матеріал фідосягнення >95% конверсії. Потім додавали НСІ (г) льтрували. Вологу речовину використовували без до досягнення рН суміші 95%, суспензію охолодили до 15°С та розчиЗагальний вихід сполуки становив приблизно ном етоксиду натрію (приблизно 5-20% від спочат42% теоретичного для операцій б) та в) разом. ку уведеної кількості) нейтралізували до рН 5-7. Хімічна чистота становила 99,7%. Після нейтралізації суспензію охолодилили до 5°С г) Одержання 2-етокси-3-(4та додали етилацетат (150мл, 3об.). Утворений метоскифеніл)пропанової кислоти. протягом реакції хлорид натрію відфільтрували та Паладій на вугіллі (5%, 60% зволожений вопромили етилацетатом. Після цього розчин випадою) (13,2г, 0,26г Pd, 2,44ммоль Pd, 0,0054екв.) рили. Максимальна масова частка етанолу склала додавали до розчину 2-етокси-3-(420%. Загальний вихід сполуки складав 58% від метоскифеніл)пропенової кислоти (100г, теоретичного (втрати під час випарювання). Хіміч450ммоль, 1,0екв.) у етанолі (800мл, 8об.) у азотна чистота становила >99%. ному середовищі. Потім у посудину вводили воб) Одержання етилу 2-етокси-3-(4день для досягнення загального тиску 400кПа (4 метоксифеніл)пропеноату. бара). Гідрування виконували, поки не досягали 4-метоксибензальдегід (100г, 734ммоль, повної конверсії. Каталізатор відфільтровували, а 1,0екв.) та етил 2-екстоксіетаноат (116г, етанол випарювали у вакуумі. Додавали толуол 881ммоль, 1,2екв.) розчиняли у тетрагідрофурані (500мл, 5об.), а потім випарювали. Залишок роз(600мл, 6об.) в атмосфері азоту. Розчин охолодичиняли у толуолі (500мл, 5об.) та випарювали до ли до -20°С. До одержаного розчину повільно дооб'єму 260мл. Розчин підігрівали до 50°С та додадавали розчин трет-бутоксиду калію (98,8г, ммоль вали ізооктан (800мл, 8об.). Розчин охолоджували 1,2екв.) у тетрагідрофурані (704мл, 7,1об., стосовдо 35°С, після чого вводили затравку 2-етокси-3но трет-бутоксиду калію), підтримуючи температу(4-метоскифеніл) пропанової кислоти. Температуру нижче -10°С. Після того, як додавання було ру підтримували при 35°С протягом 30 хвилин. завершено, реакційну суміш перемішували протяРозріджену суспензію охолоджували із швидкістю гом однієї години при температурі від -15°С до 10°С на годину до температури +5°С, яку підтри10°С. Підтримуючи температуру 95%, утворену під час реакції сіль відфільтрували NaOH (гранули) (45,5г, 1,14ммоль, 4,5екв.) та та промили метиленхлоридом (600мл). Спочатку октантіол (129г, 154мл, 884ммоль, 3,5екв.) додаорганічний шар промили насиченим розчином гідвали до розчину (S)-2-етокси-3-(4-метоксифеніл) рокарбонату натрію (700мл) при температурі 20°С, пропанової кислоти (приблизно 56,6г, 253ммоль, а після цього водою (700мл). Метиленхлорид ви1,0екв.) у N-метилпіролідоні (680мл, 12об.) у атмопарили та замістили ацетонітрилом. На наступносфері азоту. Реакційну суміш підігрівали до 120°С му етапі використовували розчин ацетонітрилу. та підтримували при температурі 115°С-125°С до 3) Етил (S)-2-етокси-3-[4-(2-{4завершення реакції, яку визначали високоефектиметансульфонілоксифевною рідинною хроматографією. ніл}етокси)феніл]пропаноат Реакційну суміш охолоджували до 60°С, а таЕтил (S)-2-етокси-3-[4кож водою. За допомоги концентрованого НСІ рН гідроксифеніл)пропаноат (325г, 1,34ммоль, доводили до 2-3. Температуру підтримували при 1,0екв.) розчинили у ацетонітрилі (2600мл). Коли 60°С -70°С. Було утворено два шари, причому утворився гомогенний розчин, додали карбонат верхній містив переважно октантіол та відповідний калію (560г, 4,05ммоль, 3,0екв.) та сульфат магнію метиловий етер (утворений у реакції). Шари розді(100г, (0,2г/г K2СО3)). Ацетонітриловий розчин 2-(4ляли, а шар, який містить воду та Nметансульфонілоксифеніл)етилметансульфонату метилпіролідон концентрували до 3-4 об'ємів у (загальний об'єм приблизно 2050мл (0,3г/мл, вакуумі при внутрішній температурі 80°С-100°С. 2,21ммоль, 1,65екв.)) влили у реакційну посудину і Залишок екстрагували сумішшю Н2О:ЕtOАс. реакцію суміші вели із зворотним холодильником Потім розчин етилацетату три рази промивали при температурі 82°С протягом 24 годин, інтенси15% розчином NaCI. вно перемішуючи і підтримуючи об'єм постійним Етилацетат випарювали, а залишок застосододаванням порцій ацетонітрилу. Коли конверсія вували безпосередньо на подальшому етапі або, досягла >95%, реакційну суміш охолодили до кімйого також можна викристалізовувати з толуолу, натної температури. Солі, що залишились, відфіщоб одержати білу тверду речовину. льтрували та промили ацетонітрилом (800мл). Після кристалізації, вихід становив 52%, 90%, Фільтрат випарили досуха. Залишок використовузастосовуючи лише випарювання. Хімічна чистота вали на наступному етапі. становила 99,8%. Енантіомерний надлишок стано4) (S)-2-етокси-3-[4-(2-{4вив (виключаючи помилки) 97,8%. метансульфонілоксифеніл}етокси)феніл] пропаноє) Одержання етил-(S)-2-етокси-3-(4ва кислота гідроксифеніл) пропаноату. До масла етил (S)-2-етокси-3-[4-(2-{4(S)-2-етокси-3-(4-гідроксифеніл) пропанову киметансульфонілоксифеніл}етокси)феніл] пропанослоту (874г, 4,16ммоль, 1,0екв.) розчиняли у етиату (723г, (71,2% дослід), 1,18ммоль, 1,0екв.) долацетаті (1250мл). У цей розчин додавали етанол дали тетрагідрофуран (3900мл). Коли утворився (3000мл) та НСІ (37%, водний) (40мл, 0,48ммоль, гомогенний розчин, додали воду (900мл). Суміш 0,12екв.). Розчин підігрівали до кипіння (приблизно охолодили до +10°С. Через одну годину додали 72°С), а воду/ЕtOАс/ЕtOН (2000мл) відганяли. Дорозчин гідроксиду літію (390мл, 4М, 1,32екв.). Далі давали іншу порцію ЕtOН (2000мл) та ще 2000мл температуру підвищували до +30°С, реакцію вели відганяли. Дану процедуру повторювали ще раз. при такій температурі протягом 2-3 годин. Коли На цьому етапі досягали приблизно 95% конверсії. конверсія досягла >99%, реакцію припиняли. ДоДалі, додавали ЕtOН (99,5%, 1000мл) та випарюдавали етилацетат (500мл), а суміш охолодили до вали. Все це повторювали доки не відбувалась кімнатної температури. Розчин перемішували проконверсія >97,5%. Потім розчин концентрували до тягом приблизно 30 хвилин та випарювали тетраоб'єму 1700-2000мл у вакуумі та охолоджували до гідрофуран. Коли приблизно 80%-90% тетрагідро20°С. фурану випарилось, додали воду (1900мл). Повільно (30-40 хвилин) при інтенсивному пеВипарювання продовжували, поки у суміші зовсім ремішуванні до розчину NаНСО3 (мас. частка 7%, не залишалось тетрагідрофурану. Далі лужний 3500мл) додавали розчин етилацетату, що містить водний розчин промивали розчином етилацетату етил (S)-2-етокси-3-(4-гідроксифеніл) пропаноат. (1000мл, 2 1250мл та 950мл). рН водного розчину Через декілька хвилин відбувалась кристалізація. (S)-2-етокси-3-[4-(2-{4Слідом задодаванням суспензію охолоджували до метансульфонілоксифеніл}етокси)феніл] пропано0°С-5°С та перемішували щонайменше протягом вої кислоти довели до 2,0-2,5 за допомоги НСІ години, підтримуючи таку саму температуру. Крис(водний) (550мл, 3,0М). Додали етилацетат тали відфільтровували та висушували у вакуумі. (2500мл) та розділили фази. Етилацетатний роз 11 75582 12 чин (S)-2-етокси-3-[4-(2-{4собами, наприклад такими, що описані [у Giacoметансульфонілоксифеніл}етокси)феніл] пропаноvazzo, С. et al. (1995), Fundamentals of Crystalloвої кислоти промили водою (700мл), а після роздіgraphy, Oxford University Press; Jenkins, R. Та лення випарили досуха. Масло, що залишилась, Snyder, R.L. (1996), Introduction to X-Ray Powder використовували у подальшій кристалізації. Diffractometry, John Wiley and Sons, New York; Кристалізація (S)-2-етокси-3-[4-(2-{4Bunn, C.W. (1948), Chemical Crystallography, ClaметансульФонілоксифеніл}етокси)фенілі пропаноrendon Press, London; або Klug, H.P. та Alexander, вої кислоти L.E. (1974), X-Ray Diffraction Procedures, John Wiley Сирий матеріал з трьох порцій (S)-2-етокси-3and Sons, New York]. [4-(2-{4-метансульфонілоксифеніл}етокси)феніл] Дифракгограми рентгенівського випромінюпропанової кислоти (1871г загальної ваги, 1262г вання на порошку типового зразка безводної криссполуки, 3,09ммоль, 1,0екв.), що містить етилацеталічної форми сполуки формули І зображені на тат (500мл) розчинили у толуолі (5000мл) при теФіг.1. мпературі 50°С. Після того, як одержали прозорий Кристали безводної форми аналізували дифрозчин, його випарювали, щоб зменшити кількість ракцією рентгенівського випромінювання на пороприсутнього етилацетату. Об'єм до випарювання шку, одержані результати наведені у вигляді Табстановив 6750мл. Додали ще одну порцію толуолу лиці 1 (де ВІ - відносна інтенсивність), а також (2500), після додавання об'єм становив 7750мл, показані на Фіг.1. Дифрактограму одержували вивипарювання продовжили. Далі до розчину додали мірюванням зі змінними щілинами та без внутріштретю порцію толуолу (2500мл), об'єм до доданього стандарту. Інтенсивність базується на інтенвання становив 6300мл, після додавання об'єм сивності, яку спостерігали при вимірюванні змінних становив 8800мл. Випарювання продовжували, щілини без віднімання фонового випромінювання. доки не утворився непрозорий розчин об'ємом Відносна інтенсивність є менш надійною, тому, 8200мл. Ізооктан (1000мл) додали до розчину, замість чисельних значень застосовують наступні який був підігрітий до 40°С. Кристалізацію розповизначення: чинали введенням затравки при 40°С. Суміш інте% Відносної Інтенсивності Визначення нсивно перемішували, доки не утворилась суспен25-100 де (дуже сильна) зія. Інтенсивність змішування підвищили. 10-25 с (сильна) Суспензію залишали на ніч для кристалізації. Далі, 3-10 сер (середня) суспензію фільтрували та промивали толуо1-3 сл (слабка) лом:ізооктаном 5:1 (1800мл). Після цього, кристаДеякі додаткові слабкі або дуже слабкі піки, ли сушили під понижениим тиском при темпевиявлені дифрактограмою, на Таблиці 1 не було ратурі 40°С. представлено. Перекристалізація (S)-2-етокси-3-[4-(2-{4метансульфонілоксифеніл}етокси) фенілі пропаТаблиця 1 нової кислоти (S)-2-етокси-3-[4-(2-{4Дані дифракційного метансульфонілоксифеніл}етокси)феніл] пропанорентгенівського випромінювання на ву кислоту (1040г (96,4% дослід), 2,45ммоль, порошку для безводної форми кристалічної 1,0екв.) розчинили у толуолі (7000мл) при темпеформи сполуки формули І, показаної на Фіг.1 ратурі 60°С. Після того, як одержали прозорий розчин, до нього додали ізооктан (1720мл). Розчин dddВІ ВІ ВІ фільтрували крізь силікагель 60. Розчин охолодипараметр/Ǻ параметр/Ǻ параметр/Ǻ ли від 50°С до 45°С, при цій температурі відбува12,3 сл 3,64 с 2,74 сл лась кристалізація. Суспензію охолодили до 20°С. 9,4 сер 3,60 с 2,72 сер Тверду речовину фільтрували та промивали толу7,2 сер 3,56 сер 2,67 сл олом:ізооктаном 5:1 (1500мл). Після чого кристали 6,9 сер 3,45 с 2,60 сл сушили під зниженим тиском при температурі 6,2 дс 3,43 сер 2,45 сл 40°С. 5,3 сер 3,35 сл 2,35 сл Визначення точки плавлення 5,2 сл 3,29 сл 2,31 сл Диференційну скануючу калориметрію (ДСК) 4,90 сл 3,26 сер 2,20 сл проводили на приладі Mettler DSC820, згідно з 4,69 с 3,17 сл 2,18 сл традиційними способами, наприклад такими, що 4,47 дс 3,12 сер 2,11 сл описано у Hohne, G.W. et al. (1996), Differential 4,42 сер 3,10 сл 2,08 сл Scanning Calorimetry, Springer, Berlin. ДСК безвод4,22 сер 3,03 сл 2,02 сл ної форми дала ендотерму з екстрапольованим 4,15 дс 2,95 сл 1,99 сл початком плавлення при температурі приблизно 4,08 сл 2,85 сл 1,93 сл 87°С (приблизно 102Дж/г). 3,95 сл 2,80 сер Визначення дифракційної картини рентгенів3,79 сл 2,78 сл ського випромінювання на порошку Дифрактограми рентгенівського випромінюЗрозуміло, що d-параметр дифракційних карвання на порошку визначали застосовуючи ренттин рентгенівського випромінювання на порошку гендифрактометр Siemens D5000 або/та Philips будуть дещо змінюватися залежно від того чи інX'Pert MPD. Визначення дифракційної картини шого приладу, отже не слід сприймати наведені рентгенівського випромінювання на порошку викозначення як безумовні. Розумно буде припустити, нували на зразках, одержаних традиційними спо 13 75582 14 що кристалічна форма сполуки формули І, яку тут ми рентгенівського випромінювання на окремому описано, має такі d-значення, що знаходяться в кристалі безводної форми. Вона виявилася ортомежах ±5 молодшого десяткового розряду, особромбічною з Р212121 симетрією, Z=4, та мала наливо в межах ±2 молодшого десяткового розряду. ступні показники: а=5,762 Ǻ, b=14,426 Ǻ, с=24,785 Визначення дифракційної картини рентгенівǺ, = = =90° та V=2060,2 Ǻ3. ського випромінювання на окремому кристалі Елементарну комірку визначали згідно з дани Комп’ютерна верстка Т. Чепелева Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюCrystalline form of (s)-2 ethoxy-3-[4-(2-{4-methanesulfonyloxyphenyl}ethoxy] phenyl) propanoic acid, process for preparation thereof and use in medicine (variants)
Назва патенту російськоюКристаллическая форма (s)-2 этокси-3-[4-(2-{4-метансульфонилоксифенил}этокси] фенил) пропановой кислоты, способ ее изготовления и применения в медицине (варианты)
Автори російськоюINGHARD TORD
МПК / Мітки
МПК: A61K 31/192, A61P 3/00, C07C 309/00, A61P 5/48
Мітки: застосування, медицині, виготовлення, етокси-3-[4-(2-{4-метансульфонілоксифеніл}етокси, варіанти, форма, кристалічна, пропанової, спосіб, кислоти, феніл, s)-2
Код посилання
<a href="https://ua.patents.su/7-75582-kristalichna-forma-s-2-etoksi-3-4-2-4-metansulfoniloksifeniletoksi-fenil-propanovo-kisloti-sposib-vigotovlennya-ta-zastosuvannya-v-medicini-varianti.html" target="_blank" rel="follow" title="База патентів України">Кристалічна форма (s)-2 етокси-3-[4-(2-{4-метансульфонілоксифеніл}етокси] феніл) пропанової кислоти, спосіб її виготовлення та застосування в медицині (варіанти)</a>
Попередній патент: Спосіб обробки макухи або шроту капустяних культур для знешкодження антипоживних речовин
Наступний патент: Застосування поліплатилену як радіосенсибілізуючого засобу
Випадковий патент: Пристрій для електромагнітної обробки рідини











