Таблетки для комбінованої терапії
Номер патенту: 103224
Опубліковано: 25.09.2013
Автори: Оліяй Реза, Меннінг Марк М., Козіара Джоанна М.
Формула / Реферат
1. Таблетка, що містить перший шар і другий шар, при цьому
a) перший шар містить:
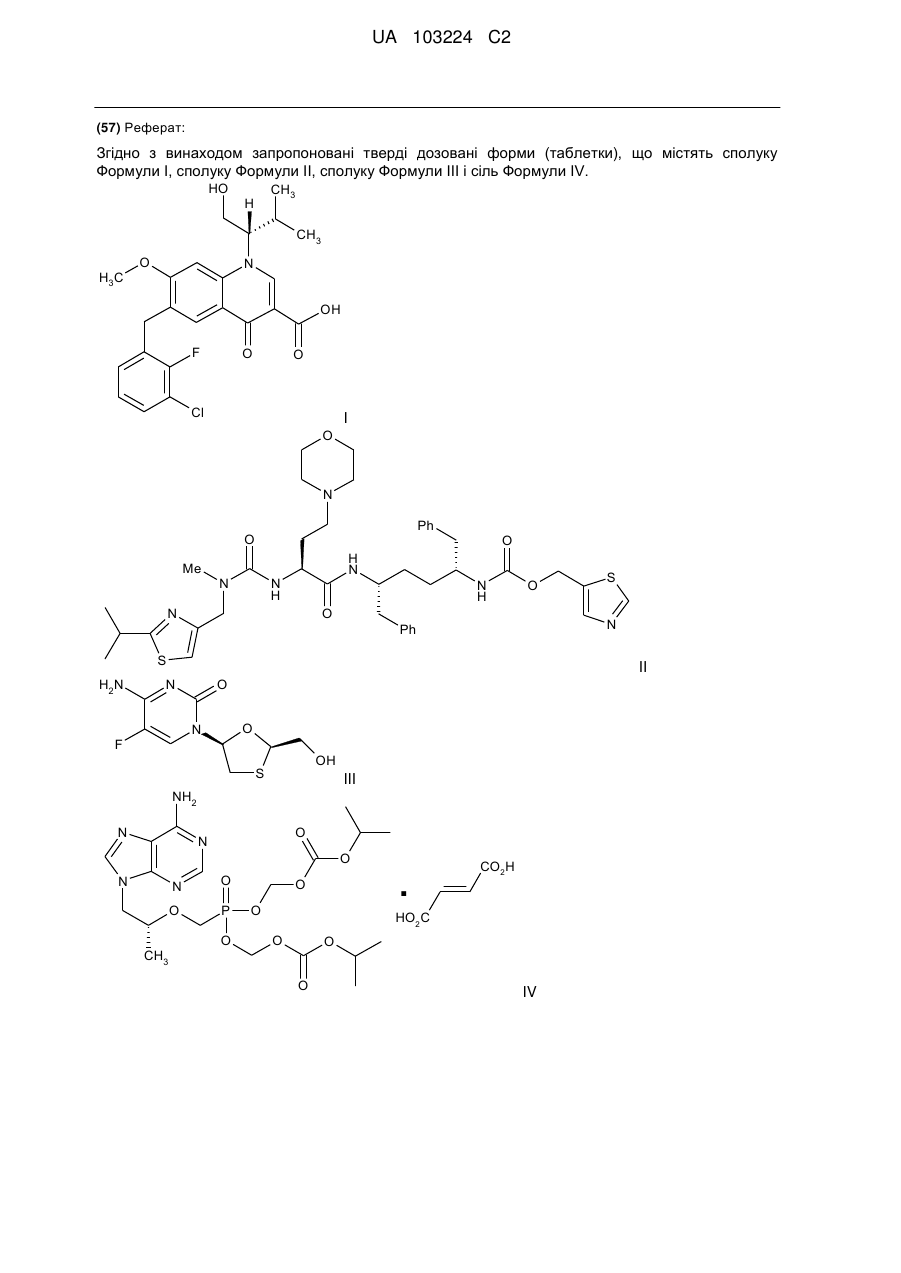
сполуку Формули І:
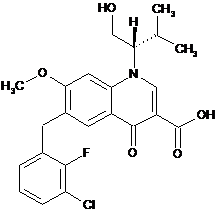 I
I
і
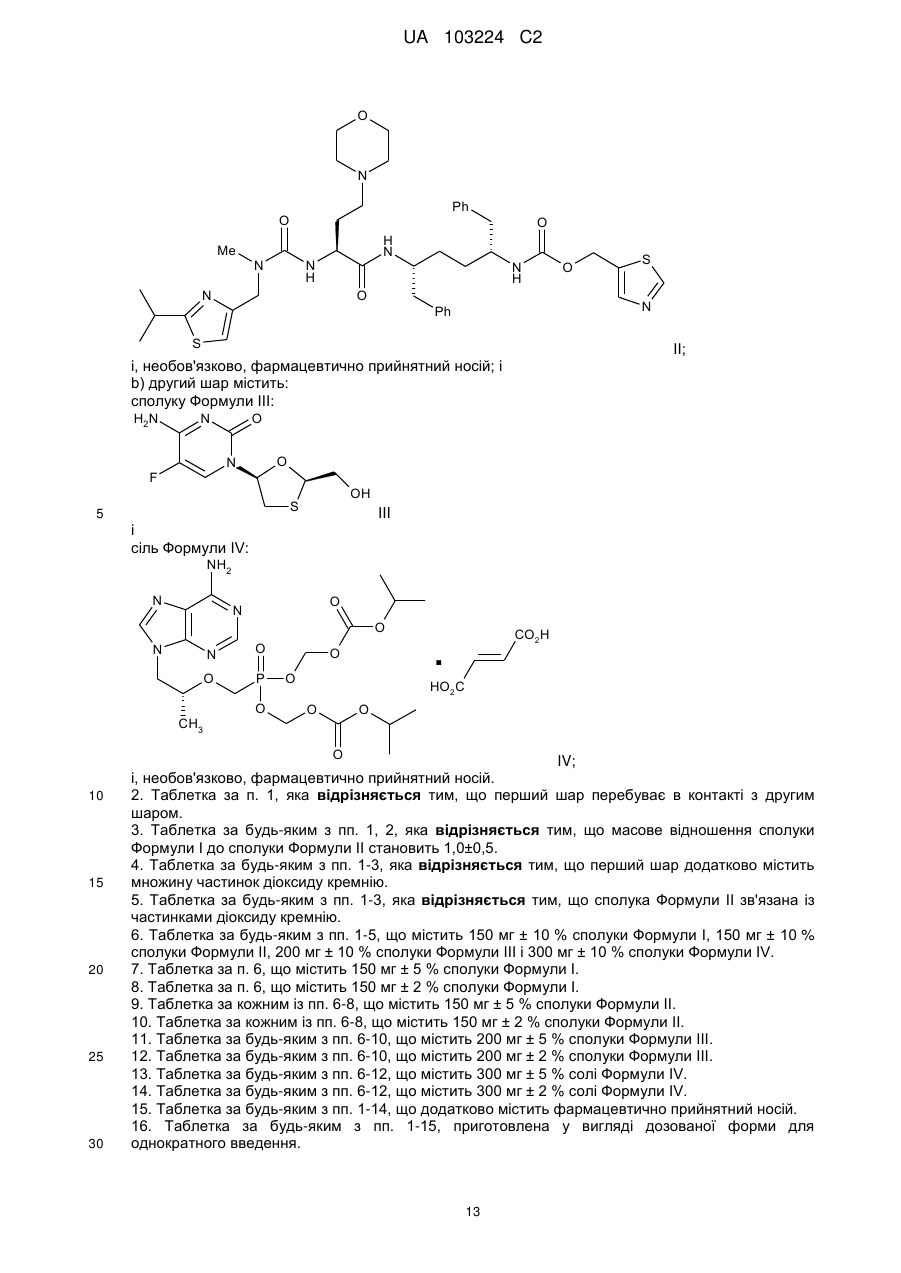
сполуку Формули II:
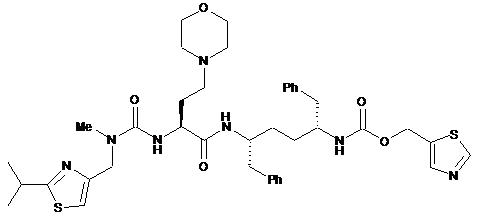 ІІ;
ІІ;
і, необов'язково, фармацевтично прийнятний носій; і
b) другий шар містить:
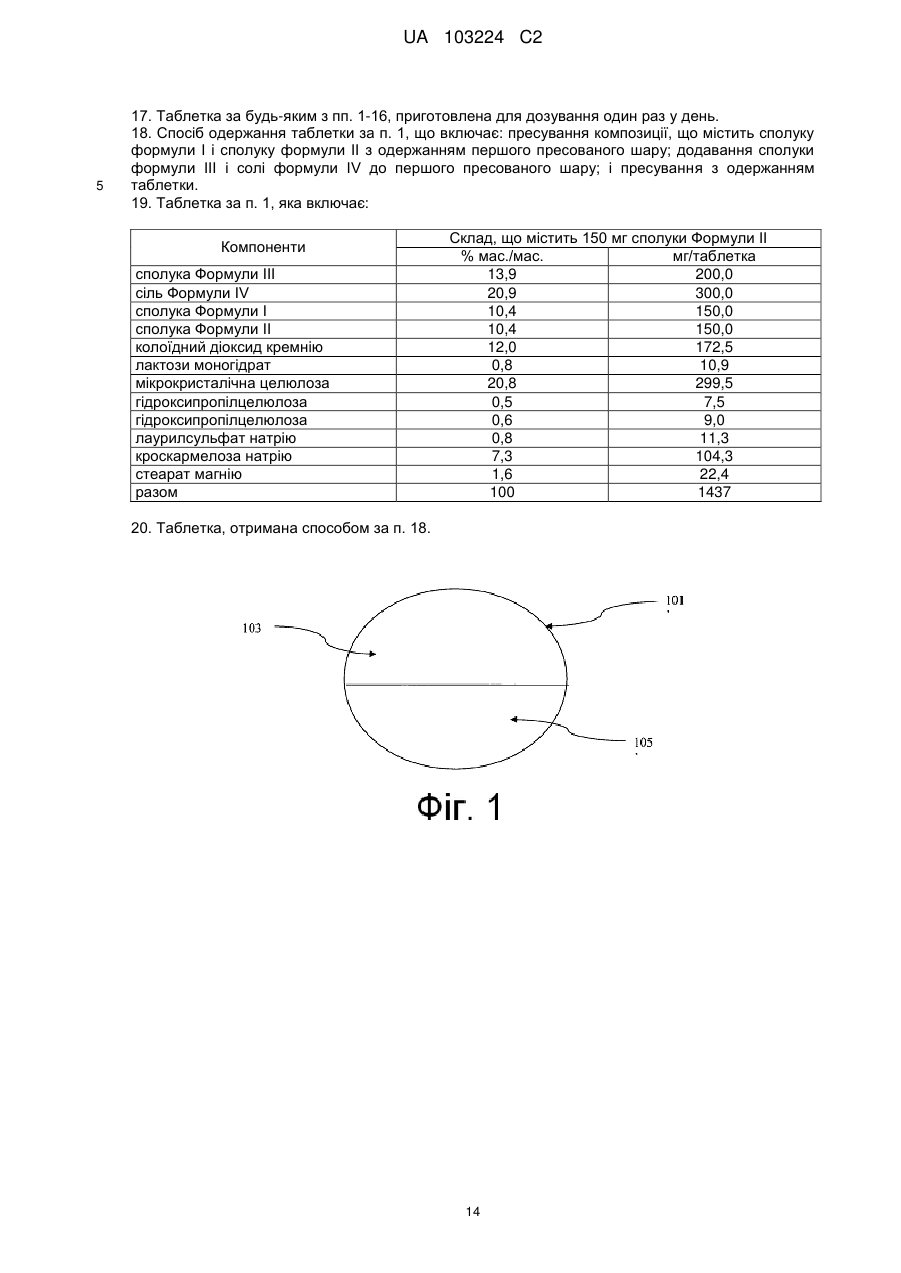
сполуку Формули III:
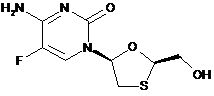 III
III
і
сіль Формули IV:
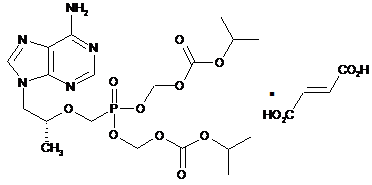 IV;
IV;
і, необов'язково, фармацевтично прийнятний носій.
2. Таблетка за п. 1, яка відрізняється тим, що перший шар перебуває в контакті з другим шаром.
3. Таблетка за будь-яким з пп. 1, 2, яка відрізняється тим, що масове відношення сполуки Формули І до сполуки Формули II становить 1,0±0,5.
4. Таблетка за будь-яким з пп. 1-3, яка відрізняється тим, що перший шар додатково містить множину частинок діоксиду кремнію.
5. Таблетка за будь-яким з пп. 1-3, яка відрізняється тим, що сполука Формули II зв'язана із частинками діоксиду кремнію.
6. Таблетка за будь-яким з пп. 1-5, що містить 150 мг ± 10 % сполуки Формули І, 150 мг ± 10 % сполуки Формули II, 200 мг ± 10 % сполуки Формули III і 300 мг ± 10 % сполуки Формули IV.
7. Таблетка за п. 6, що містить 150 мг ± 5 % сполуки Формули І.
8. Таблетка за п. 6, що містить 150 мг ± 2 % сполуки Формули І.
9. Таблетка за кожним із пп. 6-8, що містить 150 мг ± 5 % сполуки Формули II.
10. Таблетка за кожним із пп. 6-8, що містить 150 мг ± 2 % сполуки Формули II.
11. Таблетка за будь-яким з пп. 6-10, що містить 200 мг ± 5 % сполуки Формули III.
12. Таблетка за будь-яким з пп. 6-10, що містить 200 мг ± 2 % сполуки Формули III.
13. Таблетка за будь-яким з пп. 6-12, що містить 300 мг ± 5 % солі Формули IV.
14. Таблетка за будь-яким з пп. 6-12, що містить 300 мг ± 2 % солі Формули IV.
15. Таблетка за будь-яким з пп. 1-14, що додатково містить фармацевтично прийнятний носій.
16. Таблетка за будь-яким з пп. 1-15, приготовлена у вигляді дозованої форми для однократного введення.
17. Таблетка за будь-яким з пп. 1-16, приготовлена для дозування один раз у день.
18. Спосіб одержання таблетки за п. 1, що включає: пресування композиції, що містить сполуку формули І і сполуку формули II з одержанням першого пресованого шару; додавання сполуки формули III і солі формули IV до першого пресованого шару; і пресування з одержанням таблетки.
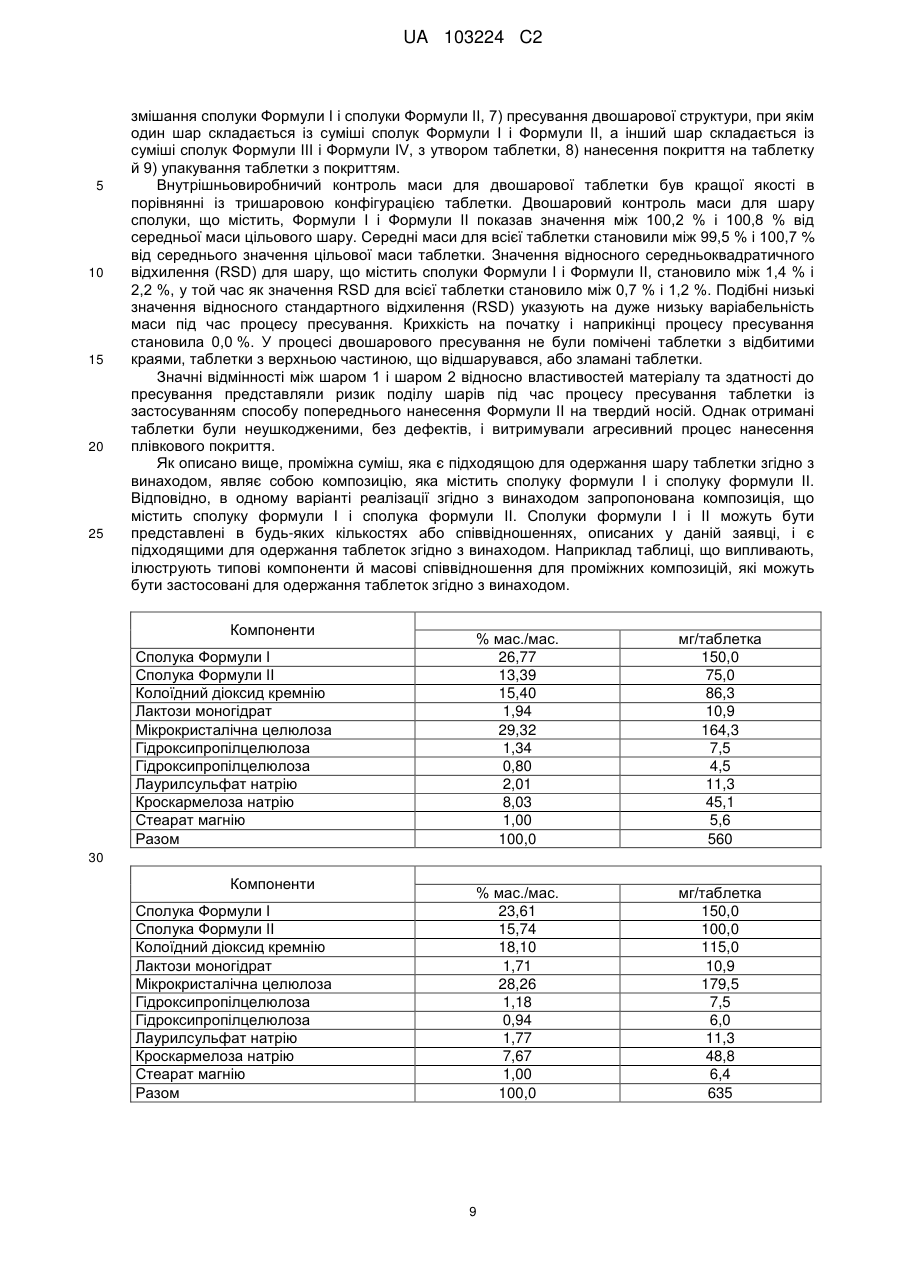
19. Таблетка за п. 1, яка включає:
Компоненти
Склад, що містить 150 мг сполуки Формули II
% мас./мас.
мг/таблетка
сполука Формули III
13,9
200,0
сіль Формули IV
20,9
300,0
сполука Формули І
10,4
150,0
сполука Формули II
10,4
150,0
колоїдний діоксид кремнію
12,0
172,5
лактози моногідрат
0,8
10,9
мікрокристалічна целюлоза
20,8
299,5
гідроксипропілцелюлоза
0,5
7,5
гідроксипропілцелюлоза
0,6
9,0
лаурилсульфат натрію
0,8
11,3
кроскармелоза натрію
7,3
104,3
стеарат магнію
1,6
22,4
разом
100
1437
20. Таблетка, отримана способом за п. 18.
Текст
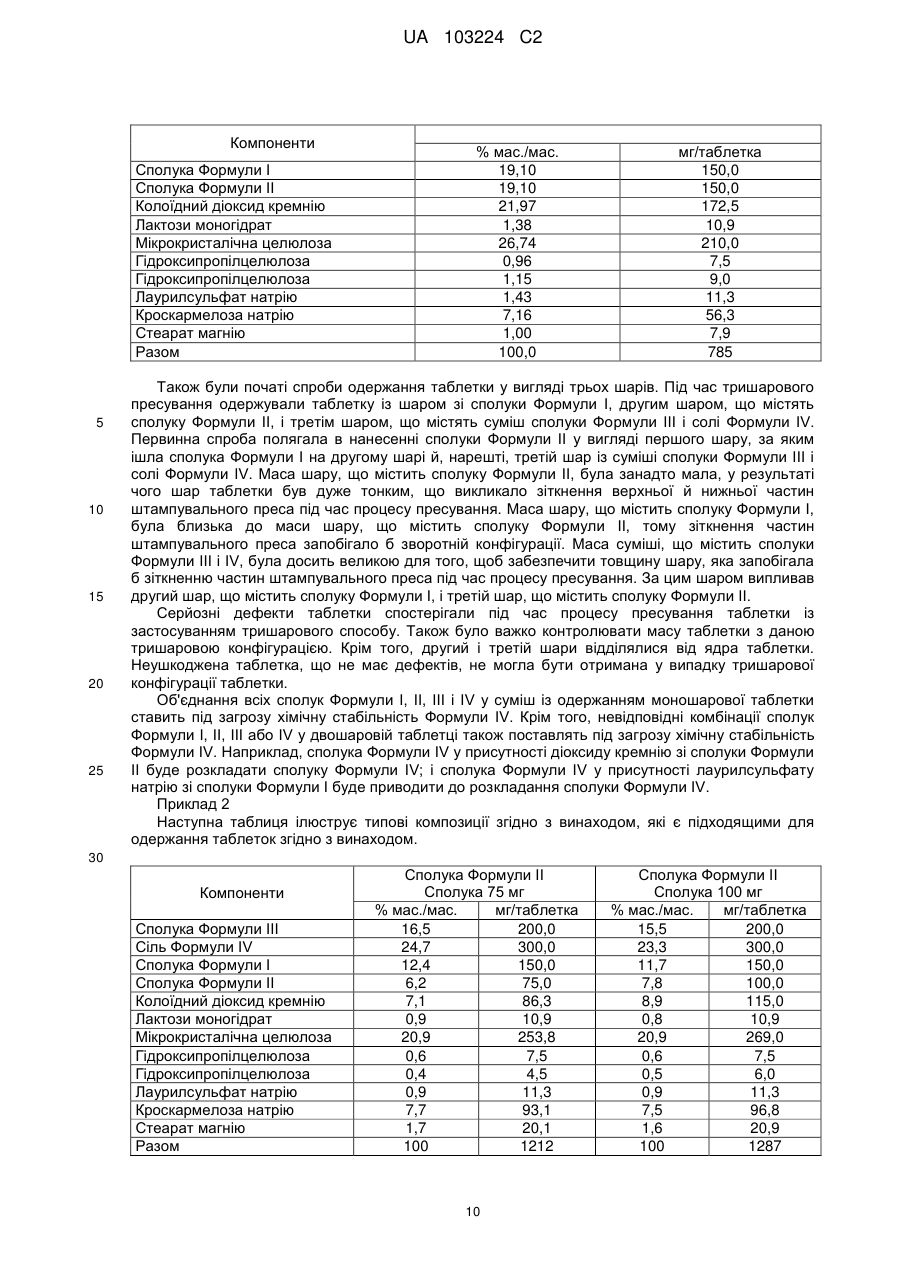
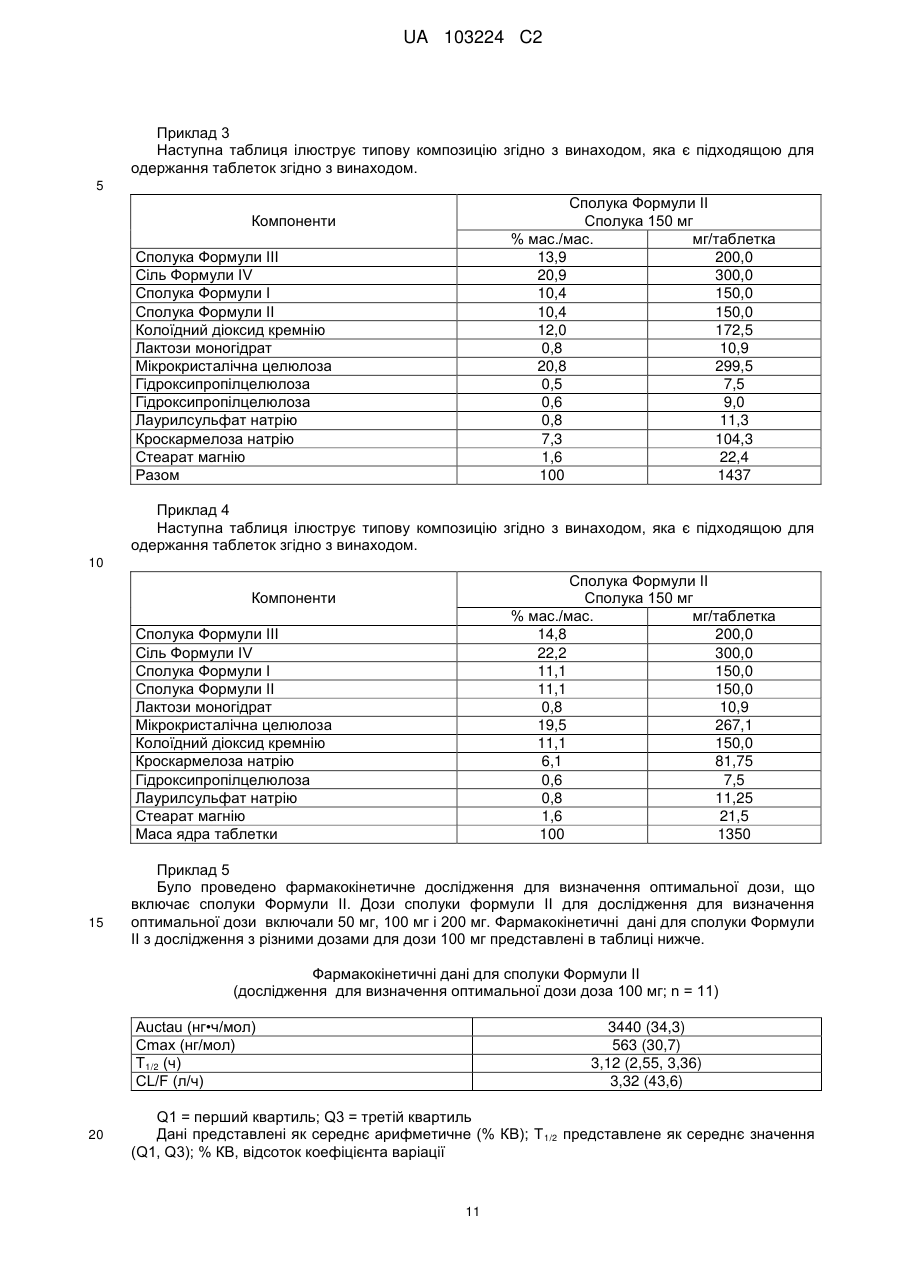
Реферат: Згідно з винаходом запропоновані тверді дозовані форми (таблетки), що містять сполуку Формули І, сполуку Формули II, сполуку Формули III і сіль Формули IV. HO CH3 H CH3 H3 C O N OH F O O Cl I O N Ph O Me O N H N N H N H N O O N Ph S H2N II N O O N F OH S III NH2 N O N O N CH3 O O N S P O O O . CO2H HO2C O O O IV UA 103224 C2 5 Пріоритет винаходу Дана заявка заявляє пріоритет на підставі попередньої заявки на патент США номер 61/150655, поданої 6 лютого 2009 року; і попередньої заявки на патент США номер 61/150652, поданої 6 лютого 2009 року. Повний зміст кожної із зазначених заявок включений в дану заявку шляхом посилання. Рівень техніки У патенті США № 7176220 запропоновані сполуки, які, як повідомляється, підходять для застосування як інгібітори інтегрази. Одне з конкретних сполук являє собою сполуку Формули I (тобто елвітегравір). 10 15 У публікації міжнародної заявки WO 2005/113508 запропоновані деякі конкретні кристалічні форми сполуки Формули I. Зазначені конкретні кристалічні форми, як повідомляється, мають кращу фізичну й хімічну стабільність у порівнянні з іншими фізичними формами даної сполуки. У публікації міжнародної заявки на патент WO 2008/010921 описані сполуки, які поліпшують фармакокінетику лікарського засобу, що вводиться спільно, за рахунок інгібування цитохром-р 450-залежної монооксигенази. Один з таких інгібіторів являє собою сполуку Формули II. 20 25 В WO 2008/010921 також описані фармацевтичні композиції, що містять сполуки, і запропоновані композиції, які включають щонайменше один додатковий терапевтичний агент. На сторінках 170 і 174 WO 2008/010921 також описані комбінації запропонованих сполук (наприклад, сполуки Формули II). У список різних агентів включені сполука Формули I (тобто елвітегравір), сполука Формули III ( тобто емтрицитабін) і сіль Формули IV ( тобто тенофовір дизопроксил фумарат). Відомості, що відносяться до сполук, що містять зазначені сполуки, також можна знайти на сторінках 159-168. 30 1 UA 103224 C2 5 10 15 20 У публікації міжнародної заявки WO 2008/103949 також запропоновані сполуки, які, як повідомляється, підходять для модифікації фармакокінетики лікарського засобу, що вводиться спільно, за допомогою інгібування цитохром-р 450-залежної монооксигенази. На сторінці 199 WO 2008/103949 описана конкретна комбінація сполук Формули I, Формули II, Формули III і Формули IV. Сполуки обговорюються на сторінках 181-190. Незважаючи на ці відомості, у цей час існує потреба в поліпшених твердих дозованих формах (наприклад, таблетках) для доставки композицій, що містять декілька агентів. Також існує потреба в поліпшених твердих дозованих формах сполуки, що містять, Формул I, II, III і IV, які мають підвищену або прийнятною хімічною стабільністю, фізичною стабільністю, характеристиками вивільнення або рівномірністю дозування. Також існує потреба в поліпшених способах одержання твердих дозованих форм композицій, що містять сполуки формул I, II, III і IV. Короткий опис винаходу Згідно із даним винаходом запропоновані тверді дозовані форми (наприклад, таблетки), що містять сполуки Формули I, Формули II, Формули III і сіль Формули IV і способи одержання даних твердих дозованих форм. Заявник виявив, що таблетки, отримані двошаровим способом, мають кращі властивості в порівнянні з таблетками альтернативної структури. Цей виявлений факт є досягненням у розробці комбінованої терапії для лікування вірусних інфекцій, таких як ВІЛ. Відповідно, в одному з варіантів реалізації винаходу запропонований таблетка, що містить перший шар і другий шар, причому а) перший шар містить: сполуку Формули I: ;і 25 сполуку формули II: ; 30 і, необов'язково, фармацевтично прийнятний носій; і b) другий шар містить: сполуку Формули III: ;і 2 UA 103224 C2 сіль формули IV: ; 5 10 15 20 25 і, необов'язково, фармацевтично прийнятний носій. В одному з варіантів реалізації винаходу запропонована фармацевтична композиція, яка містить 150 мг ± 10 % сполуки Формули I; 150 мг ± 10 % сполуки Формули II; 200 мг ± 10 % сполуки Формули III; і 300 мг ± 10 % сполуки Формули IV. В одному з варіантів реалізації винаходу запропонована фармацевтична композиція, яка містить 150 мг ± 5 % сполуки Формули I; 150 мг ± 5 % сполуки Формули II; 200 мг ± 5 % сполуки Формули III; і 300 мг ± 5 % сполуки Формули IV. В одному з варіантів реалізації винаходу запропонована фармацевтична композиція, яка містить 150 мг ± 2 % сполуки Формули I; 150 мг ± 2 % сполуки Формули II; 200 мг ± 2 % сполуки Формули III; і 300 мг ± 2 % сполуки Формули IV. В одному з варіантів реалізації винаходу запропонована фармацевтична композиція, яка складається з 150 мг ± 5 % сполуки Формули I; 150 мг ± 5 % сполуки Формули II; 200 мг ± 5 % сполуки Формули III; і 300 мг ± 5 % сполуки Формули IV у якості фармацевтично активних інгредієнтів і одного або більше фармацевтично прийнятних носіїв. В одному з варіантів реалізації винаходу запропонована фармацевтична композиція, яка складається з 150 мг ± 2 % сполуки Формули I; 150 мг ± 2 % сполуки Формули II; 200 мг ± 2 % сполуки Формули III; і 300 мг ± 2 % сполуки Формули IV у якості фармацевтично активних інгредієнтів і одного або більше фармацевтично прийнятних носіїв. В одному з варіантів реалізації винаходу запропонована таблетка, яка містить наступну сполуку: Компоненти Сполука Формули III Сіль Формули IV Сполука Формули I Сполука Формули II Колоїдний діоксид кремнію Лактози моногідрат Мікрокристалічна целюлоза Гідроксипропілцелюлоза Гідроксипропілцелюлоза Лаурилсульфат натрію Кроскармелоза натрію Стеарат магнію Разом 30 Сполука Формули II Сполука 150 мг % мас./мас. мг/таблетка 13,9 200,0 20,9 300,0 10,4 150,0 10,4 150,0 12,0 172,5 0,8 10,9 20,8 299,5 0,5 7,5 0,6 9,0 0,8 11,3 7,3 104,3 1,6 22,4 100 1437 Згідно з винаходом також запропоновані способи одержання таблеток згідно з винаходом, які описані в даній заявці, а також проміжні композиції й виробу, які підходять для одержання композицій згідно з винаходом. Відповідно, в одному варіанті реалізації винаходу запропонований спосіб одержання таблетки згідно з винаходом, що включає: пресування композиції, яка містить сполуку формули I і сполуку формули II, з одержанням першого пресованого шару; додавання сполуки формули III і солі формули IV до першого пресованого шару; і пресування з одержанням таблетки згідно з винаходом. В одному з варіантів реалізації 3 UA 103224 C2 5 10 15 20 25 30 35 40 45 50 55 60 винаходу композицію, яка містить сполуку формули I і сполуку формули II, пресують із одержанням м'якого шару; суміш, що містить сполуку формули III і сіль формули IV, додають до м'якого шару з одержанням кінцевої комбінації; і кінцеву комбінацію пресують із одержанням таблетки згідно з винаходом. В одному варіанті реалізації способи згідно з винаходом можуть додатково включати нанесення покриття на таблетку. Згідно з винаходом також запропоновані способи, проілюстровані на Фігурах 2 і 3 і в Прикладах у даній заявці, які підходять для одержання проміжних композицій і таблеток згідно з винаходом. Короткий опис креслень Фіг. 1. Ілюструє таблетку згідно з винаходом. Фіг. 2. Ілюструє одержання композицій згідно з винаходом. Фіг. 3. Ілюструє одержання композицій згідно з винаходом. Докладний опис Конкретні значення, наведені нижче для діапазонів і термінів, є лише ілюстративними; вони не виключають інші значення. Кількості сполук і масові співвідношення сполук Таблетки згідно з винаходом містять сполуки Формули I, Формули II, Формули III і сіль Формули IV. Маси й співвідношення, описані в даній заявці, відносяться до описаної комбінованої терапії. Слід розуміти, що кількості різних сполук можуть варіюватися, не виходячи за рамки винаходу. В одному варіанті реалізації кількість сполуки Формули I у таблетці згідно з винаходом становить 150 мг ± 10 %. В іншому варіанті реалізації кількість сполуки Формули I у таблетці згідно з винаходом становить 150 мг ± 5 %. В іншому варіанті реалізації кількість сполуки Формули I у таблетці згідно з винаходом становить 150 мг ± 2 %. В одному варіанті реалізації кількість сполуки Формули II у таблетці згідно з винаходом становить 150 мг ± 10 %. В іншому варіанті реалізації кількість сполуки Формули II у таблетці згідно з винаходом становить 150 мг ± 5 %. В іншому варіанті реалізації кількість сполуки Формули II у таблетці згідно з винаходом становить 150 мг ± 2 %. В одному варіанті реалізації кількість сполуки Формули III у таблетці згідно з винаходом становить 200 мг ± 10 %. В іншому варіанті реалізації кількість сполуки Формули III у таблетці згідно з винаходом становить 200 мг ± 5 %. В іншому варіанті реалізації кількість сполуки Формули III у таблетці згідно з винаходом становить 200 мг ± 2 %. В одному варіанті реалізації кількість солі Формули IV у таблетці згідно з винаходом становить 300 мг ± 10 %. В іншому варіанті реалізації кількість солі Формули IV у таблетці згідно з винаходом становить 300 мг ± 5 %. В іншому варіанті реалізації кількість солі Формули IV у таблетці згідно з винаходом становить 300 мг ± 2 %. Також слід розуміти, що різні масові відносини сполук друг щодо друга в описаній комбінованій терапії можуть варіюватися, не виходячи за рамки винаходу. В одному з варіантів реалізації масове відношення сполуки Формули I до сполуки Формули II у таблетці згідно з винаходом становить 1 ± 0,8. В іншому варіанті реалізації масове відношення сполуки Формули I до сполуки Формули II у таблетці згідно з винаходом становить 1 ± 0,5. В іншому варіанті реалізації масове відношення сполуки Формули I до сполуки Формули II у таблетці згідно з винаходом становить 1 ± 0,3. В іншому варіанті реалізації масове відношення сполуки Формули I до сполуки Формули II у таблетці згідно з винаходом становить 1 ± 0,1. Фармацевтичні сполуки Фармацевтичні композиції згідно з винаходом можуть бути приготовлені із застосуванням звичайних носіїв. Незважаючи на те, що можливе введення активних інгредієнтів композиції окремо, можливо, буде кращим представити їх у вигляді фармацевтичних сполук. Як описано в даній заявці, фармацевтичні сполуки згідно з винаходом можуть містити сполуки Формул I, II, III і IV разом з одним або більш прийнятними носіями. Носій (носії) повинен бути “прийнятним”, тобто бути сумісним з іншими інгредієнтами сполуки й фізіологічно нешкідливим для реципієнта. Відповідно, в одному варіанті реалізації згідно із заявкою запропоновані фармацевтичні композиції, що містять сполуки Формул I, II, III і IV і фармацевтично прийнятний носій. У даній заявці термін носій включає допоміжні речовини, речовини, що сприяють ковзанню, наповнювачі, зв'язувальні речовини, що змазують речовини, розріджувачі, консерванти, поверхнево-активні агенти, диспергуючі агенти й т.п. Термін носій також включає агенти, такі як підсолоджувачі, ароматизатори, барвники й консерванти. Крім того, дані терміни включають значення, як зазначені в даній заявці, так і значення відповідно до звичайної практики. Таблетки, як правило, будуть містити допоміжні речовини, речовини, що сприяють ковзанню, наповнювачі, що зв'язують речовини й т.п. Усі сполуки можуть необов'язково містити допоміжні речовини, такі як зазначені в Handbook of Pharmaceutical Excipients (Apha Publications, Washington, DC), повний зміст якого включено в дану заявку за допомогою посилання. 4 UA 103224 C2 5 10 15 20 25 30 35 40 45 50 55 60 Допоміжні речовини включають аскорбінову кислоту й інші антиоксиданти, хелатуючі агенти, такі як ЕДТА, вуглеводи, такі як декстрин, гідроксиалкілцелюлозу, гідроксиалкілметилцелюлозу, стеаринову кислоту і т.п. рН сполук перебуває в діапазоні від приблизно 3 до приблизно 11, але звичайно приблизно від 7 до 10. Фармацевтичні сполуки включають сполуки, які підходять для способів уведення, обговорюваних у даній заявці. Фармацевтичні сполуки можуть бути для зручності представлені у вигляді дозованої форми для однократного введення й можуть бути отримані за допомогою кожного зі способів, добре відомих в галузі фармації. Методики й сполуки, у загальному випадку, можна знайти в Remington's Pharmaceutical Sciences (Mack Publishing Co., Easton, PA), повний зміст якої включено в дану заявку за допомогою посилання. Такі способи включають стадію зв'язування активного інгредієнта(ів) з носієм, який становить один або більш допоміжних інгредієнтів. У загальному випадку, сполуки можуть бути отримані за допомогою рівномірного й ретельного забезпечення зв'язування активного інгредієнта(ів) з рідкими носіями або високодисперсними твердими носіями, або й з тими, і з іншими, і потім, якщо необхідно, додання форми продукту (наприклад, у вигляді дозованої форми для однократного введення). Конкретний носій, який можна застосовувати в комбінації зі сполукою Формули II, являє собою частинки діоксиду кремнію. Як правило, частинки діоксиду кремнію містять гранулярний гідрофільний високодисперсний діоксид кремнію з середнім діаметром частинок від 10 до 120 мк, питомою поверхнею, визначеною за методом Брунауера – Емета – Теллера (БЕТ), від 40 до 2 400 м /г (відповідно до DIN 66 131 c застосуванням азоту). Частинки діоксиду кремнію також, як правило, мають об'єм пор приблизно від 0,5 до 2,5 мол/г, причому менше ніж приблизно 5 % від загального об'єму пор має діаметр пор менше ніж приблизно 5 нм, а інші являють собою мезопори та макропори. Крім того, частинки діоксиду кремнію, як правило, мають рH у діапазоні від приблизно 3,6 до приблизно 8,5 і насипну щільність від приблизно 220 до приблизно 700 г/л. Конкретний матеріал (частинка) з діоксиду кремнію, що особливо підходить у композиціях згідно з винаходом, являє собою AEROPERL® 300 (високодисперсний діоксид кремнію), який доступний від Evonik Degussa AG, Дюссельдорф, Німеччина. Однак інші матеріали, що мають фізичні та хімічні властивості, подібні властивостям матеріалів з діоксиду кремнію, описаних у даній заявці, наприклад, силікат кальцію (такий як Zeopharm) або алюмосилікат магнію (такий як Neusilin) також підходять для застосування. Частинки діоксиду кремнію, що мають середній діаметр від 10 до приблизно 120 мікронів, є підходящими. Частинки діоксиду кремнію, що мають середній діаметр 20-40 мікронів, також є підходящими. Частинки діоксиду кремнію, що мають 2 питому поверхню, визначену за методом БЕТ приблизно від 40 до 400 м /г, є підходящими. 2 Частинки діоксиду кремнію, що мають питому поверхню за методом БЕТ щонайменше 150 м /г 2 2 2 або щонайменше 200 м /г, або щонайменше 250 м /г, або щонайменше 275 м /г, також є підходящими. В одному варіанті реалізації сполука Формули II зв'язана ( тобто має покриття в порах і на поверхні) із частинками діоксиду кремнію перед сполученням з іншими компонентами композицій згідно з винаходом. В одному варіанті реалізації винаходу масовий відсоток сполуки Формули II стосовно частинок діоксиду кремнію становить 20 % ± 15 %. В одному варіанті реалізації винаходу масовий відсоток сполуки Формули II стосовно частинок діоксиду кремнію становить 50 % ± 10 %. В одному варіанті реалізації винаходу масовий відсоток сполуки Формули II стосовно частинок діоксиду кремнію становить 45 % ± 15 %. В одному варіанті реалізації винаходу масовий відсоток сполуки Формули II стосовно частинок діоксиду кремнію становить 100 % ± 20 %. В одному варіанті реалізації винаходу масовий відсоток сполуки Формули II стосовно частинок діоксиду кремнію становить 85 % ± 15 %. Нанесення Сполука Формули II може бути нанесене на частинки діоксиду кремнію із застосуванням будь-якого придатного способу. Наприклад, сполука Формули II може бути нанесена на частинки діоксиду кремнію за допомогою: а) напилення розчину сполуки (наприклад, розчину сполуки в спиртовому розчиннику, такому як етанол) на частинки діоксиду кремнію; b) об'єднання сполуки Формули II, придатного розчинника (наприклад, летучого розчинника, такого як дихлорметан) і частинок діоксиду кремнію; випаровування розчинника й виділення отриманого твердого матеріалу; або с) об'єднання сполуки Формули I і придатного летучого розчинника (наприклад, галогенованого вуглеводню, такого як дихлорметан) і частинок діоксиду кремнію; додавання антирозчинника (наприклад, високонеполярного розчинника, такого як гексан або гептан) і виділення одержаного у результаті твердого матеріалу (як проілюстровано в Прикладі 4). Сполука Формули II може бути об'єднана з підходящим розчинником і множиною частинок 5 UA 103224 C2 5 10 15 20 25 30 35 40 45 50 55 60 діоксиду кремнію з одержанням суміші. Необов'язково, сполука Формули II може бути об'єднана з підходящим розчинником з одночасним перемішуванням. Як правило, масовий відсоток сполуки Формули II стосовно частинок діоксиду кремнію перед сполученням становить приблизно 50 % ± 10 %. В одному варіанті реалізації винаходу масовий відсоток сполуки Формули II стосовно частинок діоксиду кремнію перед сполученням становить приблизно 20 % ± 10 %. В іншому варіанті реалізації винаходу масовий відсоток сполуки Формули II стосовно частинок діоксиду кремнію перед сполученням становить приблизно 30 % ± 10 %. Може бути застосований будь-який розчинник, у якім розчинна сполука Формули II. Як правило, розчинник містить летучий органічний розчинник, такий як, наприклад, (С 1-С6) спирт (наприклад, етанол). Сполука Формули II може також бути нанесена на матеріал з діоксиду кремнію шляхом розчинення сполуки в придатному розчиннику з одержанням розчину, що містить сполуку Формули II; додавання частинок діоксиду кремнію до розчину з одержанням суміші; необов'язкового збовтування або перемішування суміші; додавання антирозчинника до суміші; і виділення твердої суміші, яка містить сполуку Формули II на частинках діоксиду кремнію. Підходящі розчинники включають органічні розчинники, такі як кетони (наприклад, ацетон), спирти (наприклад, етанол) і галогенированние вуглеводні (наприклад, дихлорметан). Підходящі антирозчинники включають високонеполярні розчинники (наприклад, гексан або гептан). Кінцева тверда суміш може бути виділена за допомогою будь-якого придатного способу виділення (наприклад, фільтруванням). Одне або більш фармацевтично прийнятних допоміжних речовин може бути об'єднане із сумішшю з одержанням другої суміші. Дані фармацевтично прийнятні допоміжні речовини можуть включати наповнювачі, зв'язувальні речовини й дезінтегратори. Для полегшення переробки суміші в наступному процесі водного гранулювання може бути переважно вибирати наповнювачі й дезінтегратори, сумісні з даним водним процесом. Наприклад, мікрокристалічна целюлоза (наповнювач) і кроскармелоза натрію (дезінтегратор) є особливо сумісними з наступним процесом водного гранулювання. Гідроксипропілцелюлоза (зв'язувальна речовина) також є особливо сумісною з наступним процесом гранулювання. В одному варіанті реалізації винаходу масовий відсоток мікрокристалічної целюлози стосовно загальної маси другої суміші становить приблизно 50 % ± 20 %. В одному варіанті реалізації винаходу масовий відсоток гідроксипропілцелюлози стосовно загальної маси другої суміші становить 2 % ± 1 %. В одному варіанті реалізації винаходу масовий відсоток кроскармелози натрію становить 5 % ± 2 %. Після додавання фармацевтично прийнятних допоміжних речовин друга суміш може бути перемішана, наприклад, за допомогою механічної мішалки, такий як гранулятор з високою швидкістю зрушення (Niro-Fielder, модель PMA-25). Вода може бути додана до другої суміші з одержанням вологого гранульованого матеріалу, який згодом може бути підданий деагломерації, наприклад, за допомогою сита номер 20. Сушіння, наприклад, за допомогою сушарки із псевдозрідженим шаром (Fluid Air, модель 20), приводить до одержання висушеного матеріалу, який містить тверді частинки. В одному варіанті реалізації висушений матеріал має вологість менш приблизно 10,0 %, певну по втраті маси при сушінні (LOD). В іншому варіанті реалізації висушений матеріал має вологість менш приблизно 5,0 %, як визначено по втраті маси при сушінні (LOD). В іншому варіанті реалізації висушений матеріал має вологість менш приблизно 1,0 %, певну по втраті маси при сушінні (LOD). Розмір даних частинок може бути зменшений, наприклад, за допомогою сита номер 40 або придатного млина (Quadro Comil, модель 197/S) з одержанням третьої суміші. Придатна фармацевтично прийнятна змащувальна речовина/речовина, що сприяє ковзанню (наприклад, стеарат магнію, стеаринова кислота, стеарат кальцію, стеарат цинку або пептизований крохмаль) може бути об'єднане із третьою сумішшю з одержанням четвертої суміші. В одному варіанті реалізації масовий відсоток стеарату магнію стосовно загальної маси четвертої суміші становить 1 % ± 0,5 %. В одному варіанті реалізації згідно з винаходом запропонована композиція, отримана за допомогою способів, описаних у даній заявці. Згідно з винаходом також запропонований продукт, отриманий за допомогою кожної зі стадій способу, описаного в даній заявці. Сполуки, що підходять для перорального введення, можуть бути представлені у вигляді окремих одиниць, таких як таблетки, кожна з яких містить заздалегідь певне кількість активних складових; у вигляді порошку або гранул. Таблетка може бути отримана шляхом пресування або лиття у форму, можливо із застосуванням одного або більш допоміжних речовин. Спресовані таблетки можуть бути отримані за допомогою пресування в придатному обладнанні активного інгредієнта у вільнотекучій формі, такій як порошок або гранули, необов'язково змішаних зі зв'язувальною 6 UA 103224 C2 5 10 15 20 25 30 35 речовиною, речовиною що змазує, інертним розріджувачем, консервантом, поверхневоактивним агентом або диспергуючим агентом. Литі таблетки можуть бути отримані шляхом лиття у форму в придатному обладнанні суміші перетвореного в порошок активного інгредієнта, зволоженого інертним рідким розріджувачем. На таблетки може бути необов'язково нанесене покриття або насічка, при цьому таблетки можуть бути приготовлені із забезпеченням уповільненого або контрольованого вивільнення активного інгредієнта. Таблетки згідно з винаходом можуть містити один або більш агентів, включаючи підсолоджувачі, ароматизатори, барвники й консерванти з метою забезпечення приємного смаку препарату. Прийнятними є таблетки, що містять активні інгредієнти в суміші з нетоксичними фармацевтично прийнятними допоміжними речовинами, що підходять для виробництва таблеток. Дані допоміжні речовини можуть являти собою, наприклад, інертні розріджувачі, такі як карбонат кальцію або натрію, лактоза, моногідрат лактози, кроскармелоза натрію, повідон, фосфат кальцію або натрію; гранулюючі і дезінтегруючі агенти, такі як кукурудзяний крохмаль або альгінова кислота; зв'язувальні речовини, такі як целюлоза, мікрокристалічна целюлоза, крохмаль, желатин або гуміарабік; і змащувальні агенти, такі як стеарат магнію, стеаринова кислота або тальк. Таблетки можуть бути без покриття або можуть бути постачені покриттям за допомогою відомих способів, включаючи мікрокапсулювання для уповільнення розпаду й адсорбції в шлунково-кишковому тракті і, таким чином, забезпечення тривалої дії протягом більш тривалого періоду часу. Наприклад, може застосовувати речовину, що забезпечує уповільнену дія, таку як гліцерил моностеарат або гліцерил дистеарат, окремо або разом з воском. У публікації міжнародної заявки на патент WO 2005/113508 запропоновані деякі конкретні кристалічні форми сполуки Формули I. Повний зміст публікації міжнародної заявки на патент WO 2005/113508 включене в дану заявку за допомогою посилання (зокрема, див. сторінки 12-62 у ній). Конкретні кристалічні форми в WO 2005/113508 визначені як Кристалічна Форма II і Кристалічна Форма III. Кристалічна форма II характеризується порошковою рентгенограмою, що має характеристичні дифракційні піки при кутах 2θ(°) 6,56, 13,20, 19,86, 20,84, 21,22 і 25,22, визначені за допомогою порошкового рентгенівського дифрактометра. Кристалічна форма III характеризується порошковою рентгенограмою, що має характеристичні дифракційні піки при кутах 2θ(°) 8,54, 14,02, 15,68, 17,06, 17,24, 24,16 і 25,74, обмірювані за допомогою порошкового рентгенівського дифрактометра. В одному з варіантів реалізації композиції згідно з винаходом включають сполука формули I, яке перебуває в Кристалічній Формі II або Кристалічній Формі III. Одержання сполуки Формули II і попереднє нанесення на діоксид кремнію Сполука Формули II або його сіль може бути отримане по реакції комбінації кислої солі формули X, де М являє собою протиіон, з аміном формули IX з утвором відповідного аміду Формули II, як описано в публікації міжнародної заявки на патент WO 2008/103949 (наприклад, див. сторінку 254). 7 UA 103224 C2 5 10 15 20 25 30 35 Дана реакція, що приводить до утворення аміду, може бути проведена при стандартних умовах. Наприклад, вона може бути проведена в підходящому органічному розчиннику (наприклад, тетрагідрофурані або дихлорметані) у присутності придатного агента для комбінації (наприклад, Edc•hcl і Hobt). Інші підходящі реагенти для проведення комбінації аміду й умови відомі в даній галузі техніки. Реакція може, як правило, бути проведена при температурі від приблизно -30 °С до приблизно 20 °С. Кінцевий реакційний розчин, що містить сполуку Формули II у дихлорметані (ДХМ), можна безпосередньо застосовувати в способах, показаних на Фігурі 2, з одержанням типових композицій згідно з винаходом, або розчин сполуки в дихлорметані може бути об'єднаний з етанолом, і отримана суміш може бути піддана перегонці з метою видалення дихлорметану, при цьому залишиться розчин сполуки Формули II в етанолі. Цей розчин в етанолі може бути об'єднаний із частинками діоксиду кремнію та випаруваний (як показано в лівому стовпчику на Фігурі 2) c одержанням композиції, що містить сполука Формули II, нанесене на частинки діоксиду кремнію. Як варіант, розчин сполуки в дихлорметані може бути об'єднаний із частинками діоксиду кремнію, може бути доданий антирозчинник, і отримана суміш може бути відфільтрована й висушена (як показано в правому стовпчику на Фігурі 2) c одержанням композиції, що містить нанесену сполуку Формули II. На Фігурі 1 показаний поперечний розріз таблетки (101) згідно з винаходом. Таблетка включає перший шар (103), який містить сполуку Формули I і сполуку Формули II. Таблетка також включає другий шар (105), який містить сполуку Формули III і сіль Формули IV. Фігура 2 ілюструє процеси, які можна застосовувати для одержання таблетки, що містить сполуку формули II. Фігура 3 ілюструє процес для одержання двошарової таблетки згідно з винаходом. Даний процес додатково описаний більш детально в Прикладі 1. Винахід буде проілюстрований за допомогою наступних необмежуючих Прикладів. ПРИКЛАДИ Приклад1: Приготування таблетки. Виробничий процес для комбінованої таблетки із установленою дозою, що містить сполуки Формул I, II, III і IV, включає наступні стадії: 1) гранулювання й сушіння в псевдозрідженому шарі сполуки Формули I, 2) гранулювання з високою швидкістю зрушення й сушіння в псевдозрідженому шарі сполуки Формули II або сполуки Формули II, нанесеного на частинки діоксиду кремнію, 3) сухе гранулювання сполуки формули III і сухе гранулювання солі Формули IV, 4) здрібнювання сухого гранульованого сполуки Формули III і здрібнювання сухої гранульованої солі Формули IV, 5) перемішування сполуки Формули III і солі Формули IV, 6) 8 UA 103224 C2 5 10 15 20 25 змішання сполуки Формули I і сполуки Формули II, 7) пресування двошарової структури, при якім один шар складається із суміші сполук Формули I і Формули II, а інший шар складається із суміші сполук Формули III і Формули IV, з утвором таблетки, 8) нанесення покриття на таблетку й 9) упакування таблетки з покриттям. Внутрішньовиробничий контроль маси для двошарової таблетки був кращої якості в порівнянні із тришаровою конфігурацією таблетки. Двошаровий контроль маси для шару сполуки, що містить, Формули I і Формули II показав значення між 100,2 % і 100,8 % від середньої маси цільового шару. Середні маси для всієї таблетки становили між 99,5 % і 100,7 % від середнього значення цільової маси таблетки. Значення відносного середньоквадратичного відхилення (RSD) для шару, що містить сполуки Формули I і Формули II, становило між 1,4 % і 2,2 %, у той час як значення RSD для всієї таблетки становило між 0,7 % і 1,2 %. Подібні низькі значення відносного стандартного відхилення (RSD) указують на дуже низьку варіабельність маси під час процесу пресування. Крихкість на початку і наприкінці процесу пресування становила 0,0 %. У процесі двошарового пресування не були помічені таблетки з відбитими краями, таблетки з верхньою частиною, що відшарувався, або зламані таблетки. Значні відмінності між шаром 1 і шаром 2 відносно властивостей матеріалу та здатності до пресування представляли ризик поділу шарів під час процесу пресування таблетки із застосуванням способу попереднього нанесення Формули II на твердий носій. Однак отримані таблетки були неушкодженими, без дефектів, і витримували агресивний процес нанесення плівкового покриття. Як описано вище, проміжна суміш, яка є підходящою для одержання шару таблетки згідно з винаходом, являє собою композицію, яка містить сполуку формули I і сполуку формули II. Відповідно, в одному варіанті реалізації згідно з винаходом запропонована композиція, що містить сполуку формули I і сполука формули II. Сполуки формули I і II можуть бути представлені в будь-яких кількостях або співвідношеннях, описаних у даній заявці, і є підходящими для одержання таблеток згідно з винаходом. Наприклад таблиці, що випливають, ілюструють типові компоненти й масові співвідношення для проміжних композицій, які можуть бути застосовані для одержання таблеток згідно з винаходом. Компоненти Сполука Формули I Сполука Формули II Колоїдний діоксид кремнію Лактози моногідрат Мікрокристалічна целюлоза Гідроксипропілцелюлоза Гідроксипропілцелюлоза Лаурилсульфат натрію Кроскармелоза натрію Стеарат магнію Разом % мас./мас. 26,77 13,39 15,40 1,94 29,32 1,34 0,80 2,01 8,03 1,00 100,0 мг/таблетка 150,0 75,0 86,3 10,9 164,3 7,5 4,5 11,3 45,1 5,6 560 % мас./мас. 23,61 15,74 18,10 1,71 28,26 1,18 0,94 1,77 7,67 1,00 100,0 мг/таблетка 150,0 100,0 115,0 10,9 179,5 7,5 6,0 11,3 48,8 6,4 635 30 Компоненти Сполука Формули I Сполука Формули II Колоїдний діоксид кремнію Лактози моногідрат Мікрокристалічна целюлоза Гідроксипропілцелюлоза Гідроксипропілцелюлоза Лаурилсульфат натрію Кроскармелоза натрію Стеарат магнію Разом 9 UA 103224 C2 Компоненти Сполука Формули I Сполука Формули II Колоїдний діоксид кремнію Лактози моногідрат Мікрокристалічна целюлоза Гідроксипропілцелюлоза Гідроксипропілцелюлоза Лаурилсульфат натрію Кроскармелоза натрію Стеарат магнію Разом 5 10 15 20 25 % мас./мас. 19,10 19,10 21,97 1,38 26,74 0,96 1,15 1,43 7,16 1,00 100,0 мг/таблетка 150,0 150,0 172,5 10,9 210,0 7,5 9,0 11,3 56,3 7,9 785 Також були початі спроби одержання таблетки у вигляді трьох шарів. Під час тришарового пресування одержували таблетку із шаром зі сполуки Формули I, другим шаром, що містять сполуку Формули II, і третім шаром, що містять суміш сполуки Формули III і солі Формули IV. Первинна спроба полягала в нанесенні сполуки Формули II у вигляді першого шару, за яким ішла сполука Формули I на другому шарі й, нарешті, третій шар із суміші сполуки Формули III і солі Формули IV. Маса шару, що містить сполуку Формули II, була занадто мала, у результаті чого шар таблетки був дуже тонким, що викликало зіткнення верхньої й нижньої частин штампувального преса під час процесу пресування. Маса шару, що містить сполуку Формули I, була близька до маси шару, що містить сполуку Формули II, тому зіткнення частин штампувального преса запобігало б зворотній конфігурації. Маса суміші, що містить сполуки Формули III і IV, була досить великою для того, щоб забезпечити товщину шару, яка запобігала б зіткненню частин штампувального преса під час процесу пресування. За цим шаром випливав другий шар, що містить сполуку Формули I, і третій шар, що містить сполуку Формули II. Серйозні дефекти таблетки спостерігали під час процесу пресування таблетки із застосуванням тришарового способу. Також було важко контролювати масу таблетки з даною тришаровою конфігурацією. Крім того, другий і третій шари відділялися від ядра таблетки. Неушкоджена таблетка, що не має дефектів, не могла бути отримана у випадку тришарової конфігурації таблетки. Об'єднання всіх сполук Формули I, II, III і IV у суміш із одержанням моношарової таблетки ставить під загрозу хімічну стабільність Формули IV. Крім того, невідповідні комбінації сполук Формули I, II, III або IV у двошаровій таблетці також поставлять під загрозу хімічну стабільність Формули IV. Наприклад, сполука Формули IV у присутності діоксиду кремнію зі сполуки Формули II буде розкладати сполуку Формули IV; і сполука Формули IV у присутності лаурилсульфату натрію зі сполуки Формули I буде приводити до розкладання сполуки Формули IV. Приклад 2 Наступна таблиця ілюструє типові композиції згідно з винаходом, які є підходящими для одержання таблеток згідно з винаходом. 30 Компоненти Сполука Формули III Сіль Формули IV Сполука Формули I Сполука Формули II Колоїдний діоксид кремнію Лактози моногідрат Мікрокристалічна целюлоза Гідроксипропілцелюлоза Гідроксипропілцелюлоза Лаурилсульфат натрію Кроскармелоза натрію Стеарат магнію Разом Сполука Формули II Сполука 75 мг % мас./мас. мг/таблетка 16,5 200,0 24,7 300,0 12,4 150,0 6,2 75,0 7,1 86,3 0,9 10,9 20,9 253,8 0,6 7,5 0,4 4,5 0,9 11,3 7,7 93,1 1,7 20,1 100 1212 10 Сполука Формули II Сполука 100 мг % мас./мас. мг/таблетка 15,5 200,0 23,3 300,0 11,7 150,0 7,8 100,0 8,9 115,0 0,8 10,9 20,9 269,0 0,6 7,5 0,5 6,0 0,9 11,3 7,5 96,8 1,6 20,9 100 1287 UA 103224 C2 Приклад 3 Наступна таблиця ілюструє типову композицію згідно з винаходом, яка є підходящою для одержання таблеток згідно з винаходом. 5 Сполука Формули II Сполука 150 мг % мас./мас. мг/таблетка 13,9 200,0 20,9 300,0 10,4 150,0 10,4 150,0 12,0 172,5 0,8 10,9 20,8 299,5 0,5 7,5 0,6 9,0 0,8 11,3 7,3 104,3 1,6 22,4 100 1437 Компоненти Сполука Формули III Сіль Формули IV Сполука Формули I Сполука Формули II Колоїдний діоксид кремнію Лактози моногідрат Мікрокристалічна целюлоза Гідроксипропілцелюлоза Гідроксипропілцелюлоза Лаурилсульфат натрію Кроскармелоза натрію Стеарат магнію Разом Приклад 4 Наступна таблиця ілюструє типову композицію згідно з винаходом, яка є підходящою для одержання таблеток згідно з винаходом. 10 Сполука Формули II Сполука 150 мг % мас./мас. мг/таблетка 14,8 200,0 22,2 300,0 11,1 150,0 11,1 150,0 0,8 10,9 19,5 267,1 11,1 150,0 6,1 81,75 0,6 7,5 0,8 11,25 1,6 21,5 100 1350 Компоненти Сполука Формули III Сіль Формули IV Сполука Формули I Сполука Формули II Лактози моногідрат Мікрокристалічна целюлоза Колоїдний діоксид кремнію Кроскармелоза натрію Гідроксипропілцелюлоза Лаурилсульфат натрію Стеарат магнію Маса ядра таблетки 15 Приклад 5 Було проведено фармакокінетичне дослідження для визначення оптимальної дози, що включає сполуки Формули II. Дози сполуки формули II для дослідження для визначення оптимальної дози включали 50 мг, 100 мг і 200 мг. Фармакокінетичні дані для сполуки Формули II з дослідження з різними дозами для дози 100 мг представлені в таблиці нижче. Фармакокінетичні дані для сполуки Формули II (дослідження для визначення оптимальної дози доза 100 мг; n = 11) Auctau (нг•ч/мол) Cmax (нг/мол) T1/2 (ч) CL/F (л/ч) 20 3440 (34,3) 563 (30,7) 3,12 (2,55, 3,36) 3,32 (43,6) Q1 = перший квартиль; Q3 = третій квартиль Дані представлені як середнє арифметичне (% КВ); T 1/2 представлене як середнє значення (Q1, Q3); % КВ, відсоток коефіцієнта варіації 11 UA 103224 C2 5 Також було проведено фармакокінетичне дослідження, що включало дві комбінації з фіксованими дозами сполук Формули I/Формули II/ Формули III/Формули IV. Дози для комбінацій фіксованих доз сполук Формули I/Формули II/Формули III/Формули IV становили 150 мг/100 мг/200 мг/300 мг (Доза А) і 150 мг/150 мг/200 мг/300 мг (Доза В) відповідно. Фармакокінетичні дані для сполуки Формули II з дослідження, що включає дві комбінації фіксованих доз (Доза А и Доза В), представлені в наступній таблиці. Фармакокінетичні дані для сполуки Формули II (дослідження комбінацій фіксованих доз) Середнє (КВ %) PK Auctau (нг•ч/мол) Cmax (нг/мол) Ctau (нг/мол) 10 15 20 Доза А (n = 43) 5150 (31,7) 855 (27,6) 10,8 (83,6) Загальний вплив, визначений за значенням площі під кривій (AUC), було в 1,5- 2 рази вище для сполуки Формули II у ході дослідження комбінацій фіксованих доз (Доза А) у порівнянні із впливом, певним за значенням площі під кривій (AUC) у дослідженні зі змінною для дози 100 мг сполуки Формули II. Завдяки даному збільшеному впливу з боку сполуки Формули II потрібно або менша кількість сполуки Формули I при забезпеченні еквівалентного антивірусного ефекту, або таке ж кількість сполуки Формули I буде забезпечувати підвищений антивірусний ефект при введенні сполуки Формули I разом зі сполукою формули II. Дане несподіване збільшення впливу з боку сполуки Формули II також припускає, що для ефективного впливу сполуки Формули II потрібне менша кількість сполуки формули II. Зміст усіх публікацій, патентів і патентних документів включене в даній опис за допомогою посилання, як якби вони були індивідуально включені за допомогою посилання. Винахід був описаний з посиланням на різні конкретні й кращі варіанти реалізації й способи. Однак слід розуміти, що може бути зроблене багато змін і модифікацій без виходу за рамки даного винаходу. ФОРМУЛА ВИНАХОДУ 25 1. Таблетка, що містить перший шар і другий шар, при цьому a) перший шар містить: сполуку Формули І: HO H CH3 CH3 H3 C O N OH F Cl 30 Доза В (n = 42) 10400 (35,1) 1570 (29,7) 23,3 (103) O O I і сполуку Формули II: 12 UA 103224 C2 O N Ph O Me O N H N N H N H N O O S N Ph S ІІ; і, необов'язково, фармацевтично прийнятний носій; і b) другий шар містить: сполуку Формули III: H2N N O O N F OH S 5 III і сіль Формули IV: NH2 N O N O N CH3 O O N P O O O . CO2H HO2C O O O 10 15 20 25 30 IV; і, необов'язково, фармацевтично прийнятний носій. 2. Таблетка за п. 1, яка відрізняється тим, що перший шар перебуває в контакті з другим шаром. 3. Таблетка за будь-яким з пп. 1, 2, яка відрізняється тим, що масове відношення сполуки Формули І до сполуки Формули II становить 1,0±0,5. 4. Таблетка за будь-яким з пп. 1-3, яка відрізняється тим, що перший шар додатково містить множину частинок діоксиду кремнію. 5. Таблетка за будь-яким з пп. 1-3, яка відрізняється тим, що сполука Формули II зв'язана із частинками діоксиду кремнію. 6. Таблетка за будь-яким з пп. 1-5, що містить 150 мг ± 10 % сполуки Формули І, 150 мг ± 10 % сполуки Формули II, 200 мг ± 10 % сполуки Формули III і 300 мг ± 10 % сполуки Формули IV. 7. Таблетка за п. 6, що містить 150 мг ± 5 % сполуки Формули І. 8. Таблетка за п. 6, що містить 150 мг ± 2 % сполуки Формули І. 9. Таблетка за кожним із пп. 6-8, що містить 150 мг ± 5 % сполуки Формули II. 10. Таблетка за кожним із пп. 6-8, що містить 150 мг ± 2 % сполуки Формули II. 11. Таблетка за будь-яким з пп. 6-10, що містить 200 мг ± 5 % сполуки Формули III. 12. Таблетка за будь-яким з пп. 6-10, що містить 200 мг ± 2 % сполуки Формули III. 13. Таблетка за будь-яким з пп. 6-12, що містить 300 мг ± 5 % солі Формули IV. 14. Таблетка за будь-яким з пп. 6-12, що містить 300 мг ± 2 % солі Формули IV. 15. Таблетка за будь-яким з пп. 1-14, що додатково містить фармацевтично прийнятний носій. 16. Таблетка за будь-яким з пп. 1-15, приготовлена у вигляді дозованої форми для однократного введення. 13 UA 103224 C2 5 17. Таблетка за будь-яким з пп. 1-16, приготовлена для дозування один раз у день. 18. Спосіб одержання таблетки за п. 1, що включає: пресування композиції, що містить сполуку формули І і сполуку формули II з одержанням першого пресованого шару; додавання сполуки формули III і солі формули IV до першого пресованого шару; і пресування з одержанням таблетки. 19. Таблетка за п. 1, яка включає: Компоненти сполука Формули III сіль Формули IV сполука Формули І сполука Формули II колоїдний діоксид кремнію лактози моногідрат мікрокристалічна целюлоза гідроксипропілцелюлоза гідроксипропілцелюлоза лаурилсульфат натрію кроскармелоза натрію стеарат магнію разом Склад, що містить 150 мг сполуки Формули II % мас./мас. мг/таблетка 13,9 200,0 20,9 300,0 10,4 150,0 10,4 150,0 12,0 172,5 0,8 10,9 20,8 299,5 0,5 7,5 0,6 9,0 0,8 11,3 7,3 104,3 1,6 22,4 100 1437 20. Таблетка, отримана способом за п. 18. 14 UA 103224 C2 15 UA 103224 C2 Комп’ютерна верстка В. Мацело Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 16
ДивитисяДодаткова інформація
Назва патенту англійськоюTablets for combination therapy
Автори англійськоюOliyai, Reza, Menning, Mark, M., Koziara, Joanna, M.
Автори російськоюОлияй Реза
МПК / Мітки
МПК: A61K 31/5377, A61P 31/18, A61K 31/47, A61K 9/20, A61K 31/675, A61K 31/506
Мітки: таблетки, терапії, комбінованої
Код посилання
<a href="https://ua.patents.su/18-103224-tabletki-dlya-kombinovano-terapi.html" target="_blank" rel="follow" title="База патентів України">Таблетки для комбінованої терапії</a>
Попередній патент: Фільтр
Наступний патент: Пристрій для охолодження електродугової печі
Випадковий патент: Згладжуючий реактор