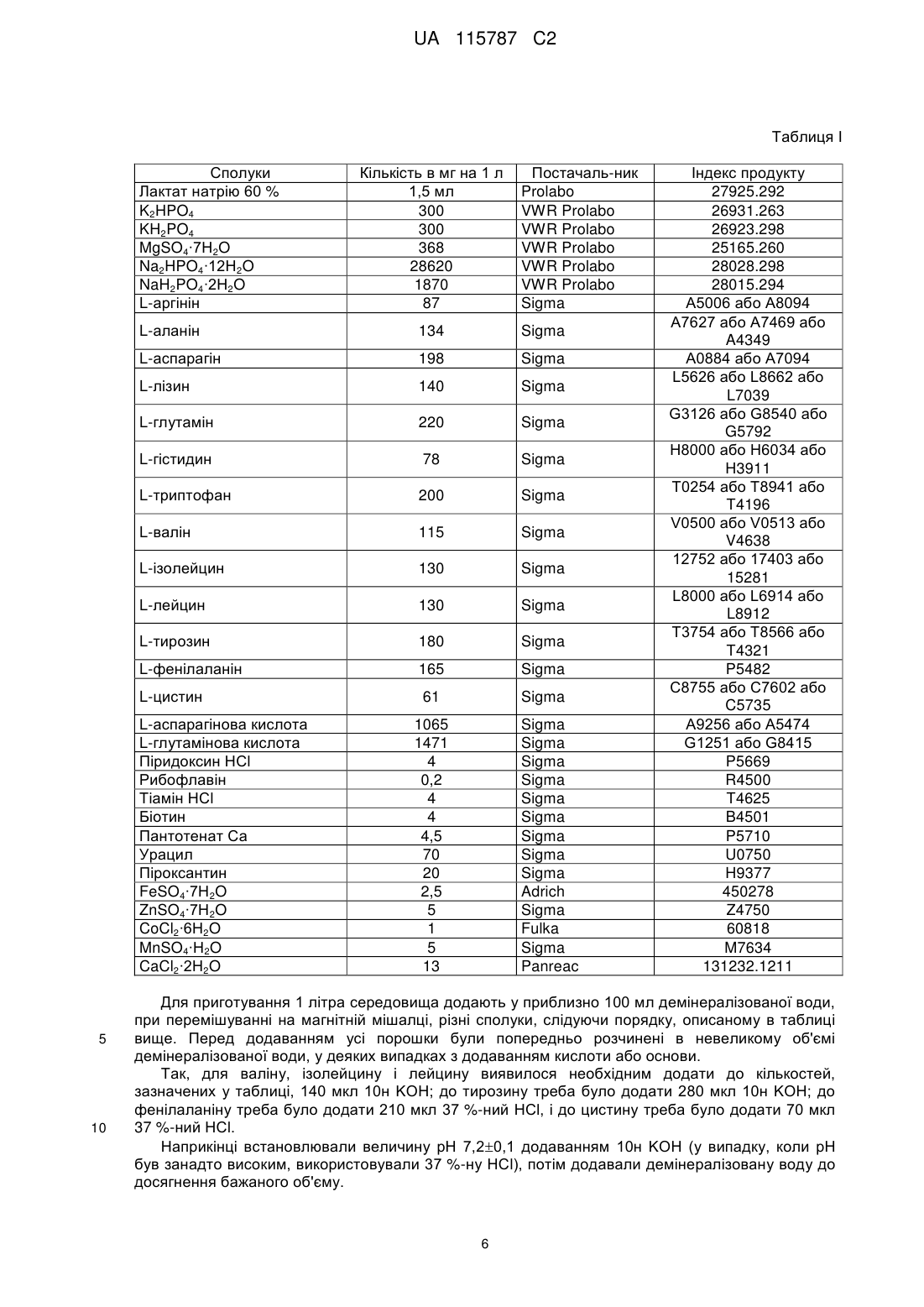
Спосіб одержання антигенів haemophilus influenzae типу b
Номер патенту: 115787
Опубліковано: 26.12.2017
Автори: Ліндлі Ніколас, Барбірато Фабьєн, Лубьєр Паскаль, Ле Ір Жером
Формула / Реферат
1. Спосіб одержання в промисловому масштабі капсулярного полісахариду Haemophilus influenzae типу b (PRP), призначеного для вакцинації, відповідно до якого культивують штам Haemophilus influenzae типу b (Hib) у культуральному середовищі, збирають супернатант культури, який обробляють для екстрагування капсулярного полісахариду, причому зазначене культуральне середовище містить щонайменше:
одне джерело вуглецю,
протопорфірин,
солі,
амінокислоти,
NAD або NADH,
вітаміни,
засоби регулювання рН,
який відрізняється тим, що зазначене культуральне середовище є середовищем із заданим хімічним складом і містить щонайменше цинк.
2. Спосіб за попереднім пунктом, який відрізняється тим, що зазначені засоби регулювання рН складаються з буферних солей.
3. Спосіб за одним із попередніх пунктів, який відрізняється тим, що зазначених джерел вуглецю може бути декілька, і вони можуть бути вибрані з: глюкози, фруктози, галактози, гліцерину, ксилози, рибози, фукози, сіалової кислоти, лактату.
4. Спосіб за одним із попередніх пунктів, який відрізняється тим, що зазначений протопорфірин являє собою синтетичний протопорфірин IX.
5. Спосіб за одним із попередніх пунктів, який відрізняється тим, що зазначені солі вибрані із солей калію, магнію, натрію, кальцію, заліза, цинку, кобальту і марганцю.
6. Спосіб за попереднім пунктом, який відрізняєтьсятим, що зазначені солі вибрані з K2НРО4, KН2РО4, MgSO4×7H2O, Na2HPO4×12H2O, NaH2PO4×2H2O, СаСl2×2Н2О, FeSO4×7H2O, ZnSO4×7H2O, CoCl2×6H2O, MnSO4×H2O.
7. Спосіб за одним із попередніх пунктів, який відрізняється тим, що зазначені амінокислоти вибрані з:
аргініну,
аланіну,
щонайменше одного з: аспарагіну, глутаміну, аспарагінової кислоти, глутамінової кислоти,
лізину,
гістидину,
триптофану,
валіну,
ізолейцину,
лейцину,
тирозину,
фенілаланіну,
цистину або еквівалента.
8. Спосіб за попереднім пунктом, який відрізняється тим, що зазначене культуральне середовище містить щонайменше аргінін, аланін, гістидин, триптофан, тирозин, фенілаланін, цистин, аспарагінову кислоту і глутамінову кислоту.
9. Спосіб за одним із попередніх пунктів, який відрізняється тим, що цистин замінено глутатіоном або цистеїном.
10. Спосіб за одним із попередніх пунктів, який відрізняється тим, що зазначені вітаміни вибрані з: тіаміну, пантотенату, урацилу, піроксантину, біотину, рибофлавіну і піридоксину.
11. Спосіб за одним із попередніх пунктів, який відрізняється тим, що аргінін і урацил замінені цитруліном.
12. Спосіб за одним із попередніх пунктів, який відрізняється тим, що він додатково включає стадію кон'югування отриманого капсулярного полісахариду з білком-носієм.
13. Спосіб за попереднім пунктом, який відрізняється тим, що білок-носій являє собою правцевий анатоксин.
14. Застосування капсулярного полісахариду, отриманого за будь-яким попереднім пунктом, для одержання вакцинної композиції.
15. Спосіб одержання вакцинної композиції, відповідно до якого:
a) готують у промисловому масштабі антиген до Haemophilus influenzae типу b (Hib), що складається з капсулярного полісахариду (PRP), шляхом культивування штаму Hib у середовищі із заданим хімічним складом, природа і кількість кожного компонента якого є повністю визначеними і яке містить щонайменше:
джерело вуглецю,
протопорфірин,
солі,
амінокислоти,
NAD або NADH,
вітаміни,
цинк,
а також засоби регулювання рН,
b) збирають супернатант культури, який обробляють для екстрагування очищеного капсулярного полісахариду,
c) кон'югують капсулярний полісахарид, отриманий на стадії b), з білком-носієм,
d) комбінують кон'югат, отриманий на стадії с), із щонайменше одним або декількома антигенами, призначеними для вакцинації проти однієї або декількох наступних інфекцій: дифтерії, правця, поліомієліту, гепатиту В, вітряної віспи, свинки, краснухи, інфекцій, викликаних Neisseria meningitidis або Streptococcus pneumoniae, інфекцій, викликаних ротавірусом, для одержання вакцинної комбінації, що дозволяє одночасну імунізацію від декількох хвороб.
16. Спосіб одержання вакцинної композиції за п. 15, який відрізняється тим, що кон'югат, отриманий на стадії с), комбінують з антигенами дифтерії, правця, гепатиту В.
17. Спосіб одержання вакцинної композиції за п. 15, який відрізняється тим, що кон'югат, отриманий на стадії с), комбінують з дифтерійним анатоксином, правцевим анатоксином, безклітинними антигенами Bordetella pertussis у числі 2 (анатоксин і ниткоподібний гемаглютинін).
18. Спосіб одержання вакцинної композиції за п. 15, який відрізняється тим, що кон'югат, отриманий на стадії с), комбінують із дифтерійним анатоксином, правцевим анатоксином, безклітинними антигенами Bordetella pertussis у числі 3 (анатоксин, пертактин і ниткоподібний гемаглютинін).
19. Спосіб одержання вакцинної композиції за п. 15, який відрізняється тим, що кон'югат, отриманий на стадії с), комбінують з дифтерійним анатоксином, правцевим анатоксином, безклітинними антигенами Bordetella pertussis у числі 5 (анатоксин, пертактин, аглютиногени і ниткоподібний гемаглютинін).
20. Спосіб одержання вакцинної композиції за п. 15, який відрізняється тим, що кон'югат, отриманий на стадії с), комбінують з дифтерійним анатоксином, правцевим анатоксином, безклітинними антигенами Bordetella pertussis у числі 2, 3 або 5, а також з інактивованими вірусами поліомієліту типу 1, 2 і 3.
21. Спосіб одержання вакцинної композиції за п. 15, який відрізняється тим, що кон'югат, отриманий на стадії с), комбінують з дифтерійним анатоксином, правцевим анатоксином, гепатитом В, безклітинними антигенами Bordetella pertussis у числі 2, 3 або 5, а також з інактивованими вірусами поліомієліту типу 1, 2 і 3.
22. Спосіб одержання вакцинної композиції за п. 15, який відрізняється тим, що кон'югат, отриманий на стадії с), комбінують з цілою бактерією Bordetella pertussis.
Текст
Реферат: Винахід стосується способу одержання в промисловому масштабі капсулярного полісахариду Haemophilus influenzae типу b (PRP), призначеного для вакцинальних цілей, відповідно до якого культивують штам Haemophilus influenzae типу b (Hib) у культуральному середовищі, збирають супернатант культури, який обробляють для екстрагування капсулярного полісахариду, UA 115787 C2 (12) UA 115787 C2 причому зазначене культуральне середовище містить щонайменше: одне джерело вуглецю, протопорфірин, солі, амінокислоти, NAD або NADH, вітаміни, засоби регулювання рН, та де зазначене культуральне середовище являє собою середовище з визначеним хімічним складом. UA 115787 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується способу одержання в промисловому масштабі капсулярних полісахаридів Haemophilus influenzae типу b (Hib), відповідно до якого штам Hib культивують в особливому культуральному середовищі, яке має визначений хімічний склад і не містить якихнебудь складних джерел азоту або вуглецю. У рівні техніки, зокрема, із заявки W02009007641 відомі поліпшені середовища для культивування Haemophilus influenzae типу b, що не містять компонентів із тваринних джерел, як це рекомендується, коли культура Haemophilus influenzae типу b має на меті одержання капсулярного полісахариду, що буде потім уводитися як антиген до складу вакцини. У середовищах, описаних у цьому документі рівня техніки, джерело азоту, що звичайно складається з тваринних пептонів, замінене рослинними пептонами. Такі середовища становлять великий прогрес для безпеки фармацевтичних продуктів у тому, що стосується, зокрема, усунення ризику перенесення таких захворювань, як бичачий губчатий енцефаліт; таким чином, вони дозволяють відповідати рекомендаціям органів охорони здоров'я. Однак склад пептонів може варіювати залежно від партій, які постачаються, що може викликати зміни кількостей утворених бактерій, а також зміну виходу по бажаних антигенах, що виробники вакцин намагалися обмежити або скорегувати, модифікуючи деякі параметри при здійсненні способу. Однак у межах промислового одержання фармацевтичного продукту бажано мати у своєму розпорядженні надійні способи, які вимагають якнайменше модифікацій при кожному застосуванні, і результати якого на кожній стадії відтворюються від партії до партії. Такі способи повинні також дозволяти одержувати виходи, сумісні з промисловою рентабельністю, причому критерієм є, у випадку одержання антигенів з бактерій, не тільки одержати якомога більшу кількість бактерій, а також одержати краще співвідношення між титром антигенів і кількістю отриманих бактерій; таким чином, бажано, щоб бактерії культивувалися в умовах, що орієнтують їхній метаболізм на одержання капсулярного полісахариду. З цією метою об'єктом даного винаходу є спосіб одержання в промисловому масштабі капсулярного полісахариду Haemophilus influenzae типу b (PRP), призначеного для вакцинальних цілей, відповідно до якого культивують штам Haemophilus influenzae типу b (Hib) у культуральному середовищі, збирають супернатант культури, який обробляють для екстрагування капсулярного полісахариду, причому зазначене культуральне середовище містить щонайменше: - одне джерело вуглецю, - протопорфірин, - солі, - амінокислоти, - NAD або NADH, - вітаміни, - засоби регулювання pН, який відрізняється тим, що зазначене культуральне середовище має визначений хімічний склад. Завдяки винаходу можна одночасно мати надійний промисловий спосіб і підвищити утворення капсулярного полісахариду без необхідності відповідно збільшувати біомасу, що дозволяє зменшити кількість одержуваних ліпополісахаридів (LPS) відносно кількості одержуваного PRP. Крім того, відсутність білків у складі культурального середовища знижує необхідну потребу в протиспінювальних засобах і спрощує стадію очищення, що дозволяє, виходячи із супернатанту культури, одержати антиген, утворений з капсулярного полісахариду. Відповідно до винаходу культуральне середовище містить засоби регулювання pН. Ці засоби регулювання pН можуть являти собою буферні солі і/або бути засобами вимірювання pН у комбінації із засобами додавання до середовища кислоти або основи. Завдяки регулюванню pН можна оптимізувати продуктивність. Відповідно до одного варіанта здійснення спосіб за винаходом додатково включає кон'югування отриманого PRP з білком-носієм, таким, як правцевий білок. Об'єктом винаходу є також спосіб одержання вакцинної композиції, відповідно до якого: - готують у промисловому масштабі антиген до Haemophilus influenzae типу b (Hib), що складається з капсулярного полісахариду (PRP), шляхом культивування штаму Hib у середовищі із заданим хімічним складом, природа і кількість кожного компонента в якому повністю визначені, і яке містить щонайменше: - одне джерело вуглецю, 1 UA 115787 C2 5 10 15 20 25 30 35 40 45 - протопорфірин, - солі, - амінокислоти, - NAD або NADH, - вітаміни, - а також засоби регулювання pН, - збирають супернатант культури, який обробляють для екстрагування очищеного капсулярного полісахариду, - кон'югують капсулярний полісахарид з білком-носієм. Відповідно до одного варіанта здійснення отриманий кон'югат додатково комбінують із щонайменше одним або декількома антигенами, призначеними для вакцинації від однієї або декількох наступних інфекцій: дифтерії, правця, поліомієліту, гепатиту B, вітряної віспи, свинки, краснухи, інфекцій, викликаних Neisseria meningitidis або Streplococcus pneumoniae, інфекцій, викликаних ротавірусом, щоб одержати вакцинальну композицію, яка дозволяє одночасну імунізацію від декількох хвороб. Відповідно до винаходу культуральне середовище є хімічно визначеним, тобто відома хімічна структура, а також кількість кожного компонента. Таке середовище не містить складного джерела азоту або вуглецю, такого, як пептони, казеїни, сироватки або інше, і, отже, при бажанні можна гарантувати, що воно не містить яких-небудь елементів, які прямо походять від тварин. Винахід стосується способу одержання в промисловому масштабі капсулярного полісахариду Haemophilus influenzae типу b. Такий спосіб дозволяє одержати виходи по біомасі і капсулярних полісахаридах або PRP, сумісні з промисловими вимогами. Такий спосіб дозволяє, зокрема, одержати, виходячи зі штаму Haemophilus influenzae типу b, що містить у своєму генетичному коді щонайменше 2 копії локусу cap, який кодує функції, що дозволяють синтез капсул, без особливого регулювання середовища (наприклад, регулятори pН або pO2), причому через 12 годин культивування біомаса відповідає оптичній густині D.O. при 694 нм щонайменше 2,4, і кількість зв'язаного PRP становить щонайменше 240 мг/л культурального середовища. Визначення кількості отриманого PRP здійснювалося методом аніонообмінної хроматографії високого розрізнення в сполученні з амперометричним детектором (HPAEC-PAD) (Dionex) або методом, що дає еквівалентні результати. Переважно, спосіб відповідно до винаходу дозволяє одержати кількість PRP щонайменше 270 мг/л середовища, і ще більш переважна кількість — щонайменше 300 мг/л. З можливих джерел вуглецю можна назвати будь-які джерела, метаболізовані штамом Haemophilus influenzae типу b, зокрема: глюкозу, фруктозу, галактозу, гліцерин, ксилозу, рибозу, фукозу, сіалову кислоту, лактат. Можна також використовувати 2 або більше різних джерел, зокрема, лактат і глюкозу. Відповідно до винаходу, кількість глюкози, що присутня у вихідному середовищі, становить від 5 до 25 г/л, зокрема, від 10 до 20 г/л і, зокрема, від 12 до 16 г/л. Кількість лактату, що є присутнім у вихідному середовищі, може становити від 0 до 15 г/л, зокрема, від 0,5 до 10 г/л. Відповідно до одного варіанта здійснення винаходу протопорфірин у середовищі являє собою синтетичний протопорфірин, наприклад, що постачається компанією Sigma Aldrich під індексом 258385 (Protoporphyrin disodium salt - динатрієва сіль протопорфірину). Таким чином, можна використовувати середовище, для якого можна гарантувати, що воно повністю позбавлене речовин тваринного походження. Альтернативно, використовують синтетичний протопорфірин IX наступної формули: , де R означає H або протиіон, переважно протиіон лужного металу, зокрема, натрію. Такий протопорфірин IX і спосіб його одержання описані в патентній заявці FR2914302. 2 UA 115787 C2 5 10 15 20 25 30 35 40 45 50 55 Відповідно до винаходу кількість протопорфірину, що є присутнім у вихідному середовищі, переважно становить від 0,1 до 10 мг/л, зокрема, від 0,25 до 2 мг/л. Культуральне середовище відповідно до винаходу містить солі, які вносять мінерали, необхідні для росту клітин, дозволяють забезпечити осмотичний тиск, сприятливий для бактерії, і які додатково роблять буферну дію на pН. + + Переважно використовувати суміш одновалентних катіонів, таких, як Na і/або K , ++ ++ ++ ++ ++ ++ 2двовалентних катіонів, як Ca , Mg , Co , Zn , Mn , Fe , фосфатних аніонів у вигляді HPO4 , 22H2PO4 і/або PO4 , аніонів SO4 , і Cl , у вигляді сольових розчинів, причому молярність кожного з -4 них звичайно може варіюватися в діапазоні концентрацій від 10 мМ до 1000 мМ. Солі, що є присутніми у культуральному середовищі, вибрані, зокрема, з K2HPO4, KH2PO4, MgSO4∙7H2O, Na2HPO4∙12H2O, NaH2PO4∙2H2O, CaCl2∙2H2O, FeSO4∙7H2O, ZnSO4∙7H2O, CoCl2∙6H2O, MnSO4∙H2O. Концентрації солей вибирають так, щоб мати осмолярність в інтервалі від 200 до 700 мосм/л, зокрема, від 300 до 400 мосм/л, зокрема, 350 мосм/л, і pН від 6,5 до 7,5. Для цього культуральне середовище відповідно до винаходу може містити, зокрема: - MgSO4 7H2O у концентрації від 150 до 1500 мг/л, - CaCl2∙2H2O у концентрації від 6,5 до 52 мг/л, - FeSO4∙7H2O у концентрації від 1,25 до 10 мг/л, - ZnSO4∙7H2O у концентрації від 2,5 до 80 мг/л, - CoCl2∙6H2O від 0,5 до 2 мг/л, - MnSO4∙H2O від 2,5 до 10 мг/л, - натрій, зокрема, у формі 60 %-ного лактату натрію, у кількості від 0 до 4 мл/л, - K2HPO4 і KH2PO4 у концентрації, що становить для кожного від 100 до 1200 мг/л, коли буферний ефект забезпечується парою Na2HPO4∙12H2O/Na2PO4∙2H2O. - Na2HPO4∙12H2O у концентрації від 15 до 120 г/л, - Na2PO4∙2H2O у концентрації в 10-30 разів меншій концентрації Na2HPO4∙12H2O. Альтернативно, буферний ефект можна забезпечити парою K2HPO4/KH2PO4; у цьому випадку, концентрація K2HPO4 становить від 15 до 120 г/л, і концентрація KH2PO4 у 10-30 разів нижче концентрації K2HPO4; концентрація Na2HPO4∙12H2O і Na2PO4∙2H2O може тоді становити від 100 до 1200 мг/л. Можна відзначити, що присутність цинку серед названих солей була особливо вигідною для одержання біомаси і PRP, зокрема, у концентрації від 2,5 до 80 мг/л або, зокрема, від 5 до 20 мг/л. Дуже хороші результати були отримані при концентрації 20 мг/л. У випадку, коли pН культурального середовища регулюють у фазі культивування, шляхом додавання, зокрема сильно концентрованої основи, такої, як NaOH або KOH, можна знизити кількість солей, що є присутніми у середовищі, зокрема, кількість буферних пар Na2HPO4/Na2PO4 або K2HPO4/KH2PO4, за умови, однак, збереження осмолярності на прийнятному рівні, тобто в інтервалі від 200 до 700 мосм/л, шляхом можливого додавання NaCl. Відповідно до винаходу культуральне середовище містить також NAD або джерело NAD, або будь-який інший еквівалентний коензим. NAD (або (β-нікотинамід аденіндинуклеотиду), який називається також коензимом I або фактором V, є незамінним фактором росту для культури Haemophilus influenzae типу b. Він переважно присутній у концентрації від 0,5 до 50 мг/л, зокрема, від 2 до 10 мг/л, зокрема, у концентрації 5 мг/л культурального середовища. Він може бути внесений у середовище у своїй відновленій формі NADH. Замість NAD культуральне середовище відповідно до винаходу може містити попередники NAD, які бактерії будуть здатні утилізувати, такі, як NADP/NADPH (β-нікотинамід фосфату аденіндинуклеотиду) або NMN ((βнікотинамід аденінмононуклеотиду), або NR (нікотинамід рибозиду), βацетилпіридинаденіндинуклеотид (APAD), або β-ацетилпіридинмононуклеотид (APMN). Відповідно до винаходу культуральне середовище містить амінокислоти, що переважно вибрані з аргініну, аланіну, лізину, гістидину, триптофану, валіну, ізолейцину, лейцину, тирозину, фенілаланіну, цистину (або еквівалента), аспарагіну, глутаміну, аспарагінової кислоти, глутамінової кислоти. Рецептура культурального середовища відповідно до винаходу включає тільки аргінін, аланін, гістидин, триптофан, тирозин, фенілаланін, цистин, аспарагінову кислоту і глутамінову кислоту. Альтернативно, у культуральному середовищі присутні усі вищезгадані амінокислоти. Відповідно до одного приватного варіанта винаходу цистин замінений глутатіоном або цистеїном. Відповідно до одного переважного варіанта здійснення у способі відповідно до винаходу застосовується культуральне середовище, що не містить наступних амінокислот: L-метіоніну, L 3 UA 115787 C2 5 10 15 20 25 30 35 40 45 50 55 гліцину, L-проліну, L-серину і L-треоніну. Дійсно, присутність цих амінокислот приводила до збільшення біомаси, але не до відповідного збільшенню вироблення PRP. Амінокислоти постачаються компанією Sigma у вигляді дуже чистих порошків. Особливо переважно, ці амінокислоти мають синтетичне походження або отримані способами, що гарантують, що вони не містять яких-небудь елементів, які прямо надходять від тварини, щоб унеможливити будь-який ризик зараження інфекціями, які передаються, зокрема, ESB (бичачий губчатий енцефаліт). Кількість кожної амінокислоти вибирають так, щоб оптимізувати ріст клітин і утворення PRP. Кількість аспарагінової кислоти, аспарагіну і глутаміну вибирають так, щоб викликати дефіцит у клітинній культурі, що дозволяє орієнтувати метаболізм клітини на одержання капсулярного полісахариду, і кількості інших амінокислот вибирають так, щоб не було нестачі у фазі культивування. Відповідно до винаходу культуральне середовище містить, крім того, вітаміни, які вибрані з тіаміну, пантотенату, урацилу, піроксантину, біотину, рибофлавіну і піридоксину. У контексті винаходу термін вітаміни охоплює також урацил і піроксантин, що являють собою азотовмісні основи. Особливо переважно, що вітаміни, які присутні у культуральному середовищі відповідно до винаходу, мають нетваринне походження, зокрема, є синтетичними, що дозволяє унеможливити будь-який ризик зараження інфекціями, які передаються, зокрема, ESB (бичачий губчатий енцефаліт). Використовують, зокрема, вітаміни, що постачаються компанією Sigma, ступінь чистоти яких точно відомий, що дозволяє мати дуже точне дозування при приготуванні культурального середовища. Кількості вітамінів, що присутні у середовищі, вибирають так, щоб оптимізувати одержання біомаси і PRP. Відповідно до одного приватного варіанта винаходу культуральне середовище містить цитрулін, що може замінити аргінін і урацил. У цьому випадку, кількість цитруліну, що міститься в культуральному середовищі, переважно становить від 150 до 500 мг/л. Завдяки культуральному середовищу відповідно до винаходу вдалося одержати полірибосил-рибітол-фосфат у більшій кількості, ніж при використанні середовищ відповідно до рівня техніки, не витрачаючи при цьому більше вуглеводу і не утворюючи більше забруднюючих речовин, зокрема, LPS. Відповідно до одного варіанта здійснення винаходу культивований штам Haemophilus influenzae типу b є капсулярним штамом, що містить у своєму генетичному коді щонайменше 2 копії локусу cap. Цей локус cap розміром від 17 до 18 кб поєднує гени, експресія яких пов'язана із синтезом і винесенням капсули. Експресія капсули надає білий колір бактерії, коли її культивують на особливому агарі, тому колонії бактерій, що мають локус cap, називаються білими колоніями, тоді як бактерії, що не виносять капсулярний полісахарид на поверхню капсули, називаються сірими колоніями. Експресія капсули потенційно піддана генетичній нестабільності, що може викликати появу мутантів, позбавлених капсули, що, як наслідок, приводить до зниження утворення PRP. Дослідження дозволили продемонструвати, що середовище з визначеним хімічним складом, використовуване в способі за винаходом, дозволяє забезпечити хорошу генетичну стабільність використовуваного штаму протягом приблизно двадцяти реплікацій клітин. Відповідно до винаходу культивування бактерії Haemophilus influenzae типу b можна здійснити за кілька послідовних стадій для поступового збільшення біомаси. У цьому випадку роблять посів бактерій, які походять з ліофілізату або замороженого продукту, в об'єм середовища, що звичайно не перевищує 1 літр. По закінченні ночі культивування або коли оптична густина середовища стане достатньою, цю першу культуру переводять у друге культуральне середовище, ідентичне першому, але об'єм якого може бути до 10-20 разів більше. Кількість бактерій, що засіваються в друге середовище, підбирають так, щоб початкова оптична густина (D.O.) другого культурального середовища при 694 нм становила від 0,2 до 0,4, щоб полегшити швидкий ріст популяції бактерій. Це друге культивування звичайно роблять у ферментері, але можна використовувати й інші типи резервуарів (колби, ролерні колби і т. п.). Коли культивування здійснюють у ферментері, звичайно протягом усього періоду культивування використовують температуру 37C1C, постійне перемішування, тиск 0,1 бар, pO2 30 % і витрату повітря 0,25 об'єму газу на об'єм середовища на хвилину. У компетенції фахівця — вибрати інші параметри для цього типу культивування. До кінця фази експонентного розмноження бактерій можна ще більше збільшити біомасу, переводячи її в інший ферментер більшої ємності, застосовуючи той же порядок дій, і 4 UA 115787 C2 5 10 15 20 25 30 35 40 45 50 55 т. д. Об'єми отриманої культури можуть досягати і навіть перевищувати 1000 літрів. Культивування звичайно здійснюють у періодичному режимі. Нарешті, з останньої культури після інактивації бактерій відбирають супернатант. Інактивацію класично реалізовують за допомогою розчину формаліну в кінцевій концентрації 0,35 %-0,37 % (об./об.). Супернатант класично відокремлюють від бактерій за допомогою стадії центрифугування. PRP, що міститься в отриманому супернатанті, потім екстрагують і очищають класичними способами, добре відомими фахівцю в даній галузі. Зібраний і очищений PRP потім переважно кон'югують з білком-носієм, таким, як правцевий білок, щоб зробити його T-залежним і дозволити, зокрема, провести імунізацію маленьких дітей. Отриманий у такий спосіб антиген PRP-T можна потім використовувати самостійно в моновакцині або комбінувати з іншими антигенами, щоб можна було провести одночасну вакцинацію від декількох хвороб. Особливо переважно даний винахід пропонує спосіб одержання вакцинної композиції, відповідно до якого отриманий кон'югат комбінують із щонайменше одним або декільком антигенами, що звичайно є присутніми у дитячих щепленнях, зокрема, антигенами проти дифтерії, правця, поліомієліту, гепатиту B, інфекцій, викликаних Neisseria meningitidis або Streplococcus pneumoniae, вітряної віспи, свинки, краснухи, інфекцій, викликаних ротавірусом, і т. д. Відповідно до одного варіанта здійснення кон'югат PRP-T знаходиться у вигляді порошку, і інші антигени знаходяться в рідкій формі, причому всі антигени змішують безпосередньо перед уведенням; відповідно до одного альтернативного варіанта здійснення, вакцинна композиція є повністю рідкою. Таким чином, пропонований винаходом спосіб одержання дозволяє виготовити чотиривалентну вакцинну композицію, яка містить, поряд з кон'югатом PRP-T, антигени проти дифтерії, правця, гепатиту B. Альтернативно, можна виготовити чотиривалентну вакцинну композицію, що містить, крім кон'югата PRP-T, дифтерійний анатоксин, правцевий анатоксин, безклітинні антигени Bordetella pertussis у числі 2 (анатоксин і ниткоподібний гемаглютинін), або 3 (2 попередні+пертактин), або 5 (3 попередні+аглютиногени). Спосіб дозволяє також виготовити п'ятивалентну вакцинну композицію, яка містить, поряд з кон'югатом PRP-T, дифтерійний анатоксин, правцевий анатоксин, безклітинні антигени Bordetella pertussis у числі 2, 3 або 5, а також інактивовані віруси поліомієліту типу 1, 2 і 3. Зазначений спосіб дозволяє також виготовити шестивалентну вакцинну композицію, яка містить, крім кон'югата PRP-T, дифтерійний анатоксин, правцевий анатоксин, безклітинні антигени до Bordetella pertussis у числі 2, 3 або 5, гепатиту B, а також інактивовані віруси поліомієліту типу 1, 2 і 3. Така шестивалентна композиція може бути, зокрема, рідкою і містити на дозу 0,5 мл: - дифтерійний анатоксин у кількості 20 МО, - правцевий анатоксин у кількості 40 МО, - поверхневий антиген гепатиту B із розрахунку 10 мкг, - анатоксин Pertussis з розрахунку 25 мкг, - ниткоподібний гемаглютинін Pertussis з розрахунку 25 мкг, - PRP-T з розрахунку 12 мкг PRP, - інактивовані віруси поліомієліту типу 1, 2 і 3 у кількості відповідно 40, 8 і 32 D-антигенних одиниць, 3+ - гідроксид алюмінію з розрахунку 0,6 мг Al . Альтернативно, спосіб дозволяє одержати вакцинні композиції, у яких антигени коклюшу утворені з цільних бактерій Bordetella pertussis. Завдяки пропонованому винаходом способу культивування можна підвищити утворення полірибозил-рибітол-фосфату без збільшення кількості біомаси, що дозволяє зменшити кількість забруднювачів LPS; ця перевага способу за винаходом особливо важливо для промисловості вакцин, де ці продукти вводять як антигени у вакцинні композиції і де кількість LPS повинна бути зведена до мінімуму. Маючи спосіб, що дозволяє обійтися без збільшення кількості отриманого LPS при більшій кількості PRP, можна спростити наступний процес очищення. Приклад 1: Приготування культурального середовища відповідно до винаходу Культуральне середовище відповідно до винаходу готували, виходячи з базового середовища, у яке безпосередньо перед приготуванням додавали збагачувальні розчини. Склад базового середовища наведений нижче в таблиці I. 5 UA 115787 C2 Таблиця I Сполуки Лактат натрію 60 % K2HPO4 KH2PO4 MgSO4∙7H2O Na2HPO4∙12H2O NaH2PO4∙2H2O L-аргінін Кількість в мг на 1 л 1,5 мл 300 300 368 28620 1870 87 Постачаль-ник Prolabo VWR Prolabo VWR Prolabo VWR Prolabo VWR Prolabo VWR Prolabo Sigma L-аланін 134 Sigma L-аспарагін 198 Sigma L-лізин 140 Sigma L-глутамін 220 Sigma L-гістидин 78 Sigma L-триптофан 200 Sigma L-валін 115 Sigma L-ізолейцин 130 Sigma L-лейцин 130 Sigma L-тирозин 180 Sigma L-фенілаланін 165 Sigma L-цистин 61 Sigma L-аспарагінова кислота L-глутамінова кислота Піридоксин HCl Рибофлавін Тіамін HCl Біотин Пантотенат Ca Урацил Піроксантин FeSO4∙7H2O ZnSO4∙7H2O CoCl2∙6H2O MnSO4∙H2O CaCl2∙2H2O 5 10 1065 1471 4 0,2 4 4 4,5 70 20 2,5 5 1 5 13 Sigma Sigma Sigma Sigma Sigma Sigma Sigma Sigma Sigma Adrich Sigma Fulka Sigma Panreac Індекс продукту 27925.292 26931.263 26923.298 25165.260 28028.298 28015.294 A5006 або A8094 A7627 або A7469 або A4349 A0884 або A7094 L5626 або L8662 або L7039 G3126 або G8540 або G5792 H8000 або H6034 або H3911 T0254 або T8941 або T4196 V0500 або V0513 або V4638 12752 або 17403 або 15281 L8000 або L6914 або L8912 T3754 або T8566 або T4321 P5482 C8755 або C7602 або C5735 A9256 або A5474 G1251 або G8415 P5669 R4500 T4625 B4501 P5710 U0750 H9377 450278 Z4750 60818 M7634 131232.1211 Для приготування 1 літра середовища додають у приблизно 100 мл демінералізованої води, при перемішуванні на магнітній мішалці, різні сполуки, слідуючи порядку, описаному в таблиці вище. Перед додаванням усі порошки були попередньо розчинені в невеликому об'ємі демінералізованої води, у деяких випадках з додаванням кислоти або основи. Так, для валіну, ізолейцину і лейцину виявилося необхідним додати до кількостей, зазначених у таблиці, 140 мкл 10н KOH; до тирозину треба було додати 280 мкл 10н KOH; до фенілаланіну треба було додати 210 мкл 37 %-ний HCl, і до цистину треба було додати 70 мкл 37 %-ний HCl. Наприкінці встановлювали величину pН 7,20,1 додаванням 10н KOH (у випадку, коли pН був занадто високим, використовували 37 %-ну HCl), потім додавали демінералізовану воду до досягнення бажаного об'єму. 6 UA 115787 C2 5 10 15 Потім середовище стерилізували шляхом фільтрування через фільтр із порогом відсікання 0,22 мкм. У результаті середовище можна було зберігати 72 години при 5C. Перед інокуляцією середовища додавали: - 27,3 мл глюкози концентрацією 512,8 г/л, отриманої з безводної глюкози D(+), що постачається компанією VWR під індексом 24379.294, - 5 мл розчину NAD 1 г/л, постачається компанією Sigma за назвою β-нікотинамід гідрату аденіндинуклеотиду (індекс 43410), - 4 мл маточного розчину, що містить протопорфірин у концентрації 0,25 г/л і гідроксид амонію в концентрації 5 мл/л; причому протопорфірин постачається компанією Sigma Aldrich за назвою динатрієва сіль протопорфірину IX (індекс 258385), і гідроксид амонію постачається компанією VWR за назвою аміачний розчин 28 % (індекс 21190.292), з одержанням 1 літра середовища, яке готове для інокуляції й містить, поряд з компонентами, описаними вище в таблиці I, додаткові елементи в концентраціях, зазначених нижче в таблиці II. Таблиця II Сполуки Протопорфірин Гідроксид амонію Безводна глюкоза NAD 20 Концентрація перед інокуляцією середовища 1 мг/л 17,7 мкг/л 14 г/л 5 мг/л Приклад 2: Приготування культурального середовища відповідно до рівня техніки Культуральне середовище відповідно до рівня техніки готували, додаючи в базове середовище особливі збагачувальні розчини. Склад базового середовища зазначений нижче в таблиці III. Таблиця III Сполуки Пептон гороху Лактат натрію 60 % Na2HPO4∙12H2O NaH2PO4∙H2O Цистин (L) HCl (10н) Триптофан (L) (NH4)2SO4 MgSO4∙7H2O CaCl2∙2H2O 25 30 35 Концентрація в базовому середовищі 7,42 г/л 1,5 мл/л 31,14 г/л 2,03 г/л 0,07 г/л 0,07 мл/л 0,02 г/л 1 г/л 0,4 г/л 0,02 г/л Для одержання цього базового середовища до 100 мл демінералізованої води, підтримуваної при перемішуванні на магнітній мішалці, додавали кожний з елементів, слідуючи порядку, у якому вони зазначені в таблиці. До цього кожний з елементів, що постачаються у вигляді порошку, був розчинений у невеликому об'ємі демінералізованої води. Пептон гороху отриманий від компанії Kerry, він продається під індексом Hy-pea 7404. (NH4)2SO4 постачається компанією VWR під індексом 21333.296. Інші компоненти придбані в тих же постачальників, вони постачаються під тими ж індексами, як описано в прикладі 1 для одержання середовища відповідно до винаходу. Кінцевий pН встановлювали на значення 7,20,1 додаванням 10н KOH (у випадку, коли pН був занадто високим, використовували 37 %-ну HCl). Потім додавали демінералізовану воду, з одержанням бажаного об'єму, після чого стерилізували в автоклаві, слідуючи циклу 30 хвилин при 120C. Після стерилізації середовище можна було зберігати 15 днів при 4C. До цього базового середовища додавали збагачувальні розчини A, B, C і D. Розчин A являє собою розчин, що містить безводну глюкозу в концентрації 512,8 г/л, постачається компанією VWR за назвою глюкоза D(+) безводна (індекс 24379.294). 7 UA 115787 C2 5 10 15 20 Розчин B є маточним розчином, що містить NAD у концентрації 1 г/л, постачається компанією Sigma за назвою β-нікотинамід гідрату аденіндинуклеотиду (індекс 43410). Розчин C є маточним розчином, що містить NAD у концентрації 0,25 г/л і гідроксид амонію в концентрації 5 мл/л; причому протопорфірин постачається компанією Sigma Aldrich за назвою протопорфірин IX динатрієва сіль (індекс 258385), і гідроксид амонію — компанією VWR за назвою аміачний розчин 28 % (індекс 21190.292), Розчин D являє собою концентрований розчин, що містить ультрафільтрат автолітичного екстракту дріжджів (Ufel) концентрації 125 г/л; він постачається компанією Biospringer за назвою ультрафільтрат автолітичного екстракту дріжджів (Ufel) (індекс Springer 0701). Кожний з цих розчинів стерилізували фільтруванням на фільтрі з порогом відсікання 0,22 мкм. До 1 літра базового середовища додавали: - 35,1 мл розчину A, - 5 мл розчину B, - 4 мл розчини C, - 40 мл розчину D. Додавання кожного розчину в базове середовище здійснювали під витяжкою в ламінарному потоці, що привело до культурального середовища, що містить перед інокуляцією, крім елементів, зазначених вище в таблиці III, додаткові елементи в концентраціях, зазначених нижче в таблиці IV. Таблиця IV Сполуки Ультрафільтрат автолітичного екстракту дріжджів (Ufel) Протопорфірин Гідроксид амонію Безводна глюкоза NAD 25 30 35 40 45 50 Концентрація перед інокуляцією середовища 4,9 г/л 1 мг/л 17,7 мкг/л 18 г/л 5 мг/л Приклад 3: Порівняння утворення PRP у середовищі відповідно до винаходу, описаному в прикладі 1, і в середовищі відповідно до рівня техніки, описаному в прикладі 2 Ці порівняльні експерименти проводили відповідно до протоколу культивування в 2 стадії: стадію попереднього культивування проводили в скляній колбі Ерленмейєра об'ємом 1 літр без перегородок, при 36C і перемішуванні на 130 об./хв. (обертів на хвилину) протягом 8 годин, після закінчення яких штам знаходився наприкінці лінійної фази росту; цю передкультуру ініціювали шляхом інокуляції 280 мл культурального середовища інокулятом бактерії Haemophilus influenzae типу b, що містить щонайменше 2 копії локусу cap, у концентрації 0,5 % (об./об.); потім перенесення 90 мл передкультури дозволило зробити посів у ферментер Biostat B об'ємом більше 2 літрів, що містить 1,8 літра культурального середовища. Цей ферментер підтримували при 37C, перемішуванні на 400 об./хв. з аерацією 0,45 л/хв. (літрів на хвилину) протягом 12 годин. Після 12 годин культивування вимірювали оптичну густина (D.O.) на 694 нм, що дозволило визначити біомасу. Дійсно, у попередніх дослідах вдалося визначити, що одна одиниця оптичної густини, вимірюваної при 694 нм, відповідає 0,64 г біомаси (у сухій масі на літр). Повну кількість PRP у супернатанті культури визначали аніонообмінною хроматографією високого розрізнення в сполученні з імпульсним амперометричним детектором (HPAEC-PAD), за методом, дуже близьким до описаного в публікації Sturgess et al. (Vaccine 17 (1999) 11691178). Супернатант культури фільтрували, проводячи через фільтр із порогом відсікання 0,22 мкм, потім 500 мкл супернатанту піддавали ультрафільтрації, використовуючи колонки Amicon ultra з порогом відсікання 10 Кда (ультратонкий фільтр, позиція UFC5010BK), і потім піддавали стадії основного гідролізу шляхом додавання NaOH. Гідроліз протікав при температурі навколишнього середовища протягом мінімум 4 годин. Вірогідність дозування контролювали, використовуючи внутрішній еталон глюкозамін 1 фосфат (GlcN1P), що є присутнім у розчині для гідролізу, і шляхом регулярного проходження внутрішнього контролю, що має відому концентрацію PRP. Порівняно зі вказівками Sturgess et al, рухома фаза складалася з NaOH 35 мМ і CH 3COONa 114 мМ, і стадію регенерації здійснювали протягом 10 хвилин з NaOH 100 мМ і CH3COONa 400 мМ. 8 UA 115787 C2 Отримані результати наведені в таблиці V нижче. Таблиця V Середовище за винаходом (4 досліди) 2,520,14 1,740,09 5 10 15 20 2,6 34922 169 1993 D.O. при 694 нм Біомаса в г сухої маси на літр культурального середовища Концентрація PRP у мг/літр культурального середовища Питома продуктивність у мг PRP/г біомаси Середовище відповідно до рівня техніки (1 дослід) 3,9 66 Ці результати показують вигоду способу відповідно до винаходу для утворення PRP: дійсно, відзначимо, що хоча при однаковому об'ємі культурального середовища отримана біомаса була більша, ніж з культуральним середовищем відповідно до рівня техніки, але кількість PRP, навпаки, була менша. Приклад 4: Порівняння кількості PRP і LPS, що є присутніми у супернатанті культури відповідно до способу за винаходом й у супернатанті культури відповідно до способу рівня техніки Культивування Haemophilus influenzae типу b здійснювали для порівняння на середовищі відповідно до винаходу і на середовищі відповідно до рівня техніки, за способом, описаним в прикладі 3, але з тією відмінністю, що базове середовище в способі за рівнем техніки містило 10 г/л продукту кислотного гідролізу казеїну, що постачається компанією Solabia (індекс A1434), замість пептону гороху, що був присутнім у середовищі відповідно до прикладу 3. Час попереднього культивування, як і в прикладі 3, становив 8 годин, і час культивування — 12 годин. Кількісне визначення як PRP, так і LPS здійснювали за методом HPAEC-PAD; але кількісне визначення LPS проводили шляхом кількісної оцінки особливого моносахариду, гептози, виходячи зі спектра еталонів очищеного LPS, обробленого згідно з тим же протоколом, причому внутрішнім контролем для цього кількісного аналізу була рамноза. Отримані результати зазначені в таблиці VI нижче. Таблиця VI Середовище за винаходом (4 досліди) 2,50,1 1,70,1 51 34922 7415 D.O. при 694 нм Біомаса, у г сухої маси на літр середовища Концентрація LPS у мг/літр середовища Концентрація PRP у мг/літр середовища Відношення PRP/LPS 25 30 35 Середовище відповідно до рівня техніки (3 досліди) 3,90,3 2,50,2 4,61 175 386 Отримані результати показують вигоду способу відповідно до винаходу, що дозволяє знизити кількість отриманого LPS порівняно з кількістю PRP. Це є великою перевагою способу за винаходом, тому що це багато в чому спрощує операції очищення при збереженні належного рівня безпеки. Приклад 5: Дослід, що дозволяє оцінити важливість цинку Вивчали важливість присутності цинку в культуральному середовищі. Для цього порівнювали три середовища: - середовище, описане в прикладі 1, позначене MS, - середовище, що має склад, ідентичний складу з прикладу 1, але без ZnSO 4, позначене MS Zn-, - середовище, описане в прикладі 1, але з концентрацією ZnSO 4 у 4 рази вищою, тобто 20 мг/л, позначене MS Zn++. Зазначені середовища потім стерилізували шляхом фільтрації через фільтр із порогом відсікання 0,22 мкм. 9 UA 115787 C2 5 10 Спочатку здійснювали одностадійний спосіб попереднього культивування в 1-літровій колбі Ерленмейєра без перегородок, протягом 16 годин при 36C і перемішуванні на 130 об./хв., засіюючи 280 мл середовища, описаного в прикладі 4, замороженими бактеріями Haemophilus influenzae типу b, що мають у своєму генетичному коді щонайменше 2 копії локусу cap. Потім 9,5 мл передкультури промивали в кожному з тестованих культуральних середовищ перед засіванням культури, що проводилося щоразу у 500-мллітровій колбі Ерленмейєра з полікарбонату, з перегородкою, що містить 170 мл тестованого культурального середовища; культивування проводили протягом 12 годин при 37C і перемішуванні на 150 об./хв. Для кожного середовища визначали біомасу, концентрацію PRP, а також кількість LPS наприкінці культивування, тим же способом, як описано в прикладах 3 і 4, і розраховували відношення PRP/біомаса, а також LPS/біомаса і PRP/LPS. Отримані результати наведені в таблиці VII нижче. Таблиця VII Біомаса, у г сухої маси на літр культурального середовища Концентрація PRP у мг/л культурального середовища Питома продуктивність, у мг PRP/г біомаси Концентрація LPS у мг/л культурального середовища Відношення LPS/біомаса в мг/г біомаси Відношення PRP/LPS у мг/мг 15 20 25 MS 1,98 319 160 11,5 6,1 30 MS Zn1,23 203 165 8,8 7,2 23 MS Zn++ 2,22 372 167 12,1 5,5 31 Ці результати показали, що присутність цинку в культуральному середовищі дозволяє значно підвищити утворення біомаси, а також утворення PRP, однак без пропорційного збільшення кількості LPS. Приклад 6: Дослід у ферментері на 5 літрів Проводили культивування Haemophilua injluenzae типу b у культуральному середовищі, описаному відповідно до винаходу в прикладі 1, використовуючи тільки продукти, що, відповідно до гарантій постачальників, не містять тваринних джерел, і використовуючи синтетичний протопорфірин, як описано в патентній заявці FR2914302 і постачається компанією SOLVIAS AG за назвою: протопорфірин IX динатрієва сіль (індекс SOL20402). Потім проводили досліди способом, описаним у прикладі 3, за винятком того, що використовували ферментери об'ємом 5 літрів, підтримувані при 37C, перемішуванні 550 об./хв. і аерацію 0,5 л/хв. Об'єм інокуляту становив у такому випадку 280 мл, тобто весь об'єм передкультури з колби Ерленмейєра. Визначення концентрації PRP і LPS робили, слідуючи протоколам, описаним у прикладах 3 і 4. Отримані результати наведені нижче в таблиці VIII. 30 Таблиця VIII Середовище без тваринних джерел, відповідно до винаходу 3,58 2,29 567 247 D.O. при 694 нм Біомаса, у г сухої маси на літр середовища Концентрація PRP у мг/л середовища Питома продуктивність, у мг PRP/г біомаси 35 40 Ці результати підтверджують попередні результати і демонструють вигоду від способу відповідно до винаходу для одержання великих кількостей PPR. Приклад 7: Порівняння утворення біомаси і PRP на середовищі відповідно до винаходу, описаному в прикладі 1, і на хімічно визначених середовищах, описаних у рівні техніки Проводили культивування Haemophilus influenzae типу b у культуральному середовищі відповідно до винаходу, описаному в прикладі 1, а також у 8 середовищах, описаних у публікаціях у зв'язку з культурою Haemophilus influenzae, і представлених як такі, що мають визначений хімічний склад. Ці 8 середовищ готували, слідуючи рекомендаціям авторів. Мова йде про середовища в хронологічному порядку: Talmadge, Herriott: Biochemical and Biophysical Research Communications, (March 1960), Vol.2 o N 3, p 203-206), 10 UA 115787 C2 5 Butler: J. gen. Microbiol. (1962), 27, 51-60, Wolin: J. Bacteriol. Vol.85, (1963) Notes, p 253-254, o Herriott et al.: Journal of Bacteriology, (Feb. 1970), Vol. 101, N 2, 513-516, Klein, Luginbuhl: Journal of General Microbiology (1979), 113, 409-411, o Coleman et al.: Journal of Clinical Microbiology, (Sept 2003), Vol.41, N 9 p. 4408-4410. Інформація відносно продуктів, використаних для одержання цих 8 середовищ, наводиться в таблиці IX нижче. Таблиця IX Продукти Уридин Інозин Аденозин Гуанін Гуанозин Вітамін B12 Цитрулін Холінхлорид Тимідин Інозитол Путресцину дигідрохлорид Нікотинамід Гематин свинячий Гемін Олеат натрію Ацетат натрію Фолієва кислота Полівініловий спирт Триетаноламін Гліцилгліцин буфер Tween 40 Tween 80 Буфер Tris Етилендіаміну тетраацетат HEPES Глутатіон Аденін Пралін Треонін Гліцин Метіонін Серин Гліцерин K2SO4 KCl MgCl2∙6H2O NaCl NaHCO3 NH4Cl Постачаль-ник Sigma Sigma Sigma Sigma Sigma Sigma Sigma Fulka Sigma Sigma Sigma Sigma Sigma Fulka Sigma Fulka Sigma Sigma Sigma libios Sigma Sigma VWR VWR Sigma Sigma Sigma Sigma Sigma Sigma Sigma Sigma VWR VWR VWR Panreac VWR VWR VWR RPMI 1640 з L-глутаміном і 25 мМ HEPES Invitrogen Піруват натрію MEM 100 мМ Invitrogen 11 Індекс продукту U3003 14125 A4036 G6779 LG6264 V2876 C7629 26978 T9250 15125 P5780 N0636 H3281 51280 O7501 71185 F7876 341584 90278 B-GLYGLY250 P1504 P1754 33621,260 20302.180 H3375 G6013 A8626 P0380 T8625 G7126 M9625 S4500 24387.292 26994.293 26764.298 131396.1211 27810.295 27778.260 21236.291 Старий індекс, наведений у публікації Coleman (2003) індекс 61870036 => новий індекс 52400025 Старий індекс, наведений у публікації Coleman (2003) індекс 11360070 => новий індекс 11360039 UA 115787 C2 5 10 15 Потім середовища стерилізували шляхом фільтрування через фільтр із порогом відсікання 0,22 мкм. Спочатку здійснювали одностадійний спосіб попереднього культивування в 1-літровій колбі Ерленмейєра без перегородок, протягом 16 годин при 36C з перемішуванням на 130 об./хв., засіюючи 280 мл середовища, описаного в прикладі 4, замороженими бактеріями Haemophilus influenzae типу b, що мають у своєму генетичному коді щонайменше 2 копії локусу cap. Потім 9,5 мл передкультури промивали в кожному з тестованих культуральних середовищ перед засіванням для культивування, що проводиться щоразу у 500-мллітровій колбі Ерленмейєра з полікарбонату, з перегородкою, що містить 170 мл випробуваного культурального середовища; культивування проводили протягом 12 годин при 37C і перемішуванні на 150 об./хв. Кожен дослід проводили щонайменше 3 рази. Для кожного середовища щогодини вимірювали D.O. при 694 нм і визначали концентрацію PRP наприкінці культивування, тим же способом, як описано в прикладі 3. Результати з D.O. відтворені на фіг. 1. Результати визначення PRP наведені в таблиці X нижче. Таблиця X Через 12 год. Середовище за винаходом Talmadge Butler Wolin Herriot Mic-cit Herriot Mie Klein MMA (cit) Klein MME Coleman 20 25 30 35 40 45 D.O. при 694 нм 2,860,12 0,280,10 0,040,00 0,040,00 1,260,15 0,980,13 0,380,01 0,200,03 1,430,04 PRP (мг/л) 32015 201 20 60 1387 1015 402 271 20410 Приклад 8: Одержання PRP у промисловому масштабі (1000 літрів) Готували культуральне середовище відповідно до винаходу, що має склад як у прикладі 1, за винятком цинку, концентрація якого становить 20 мг/л замість 5 мг/л. Дійсно, приклад 5 показав, що ця концентрація дозволяла одержати більше PRP без збільшення кількості LPS. Середовище для попереднього культивування і культивування було однаковим, за винятком pН (початковий pН 7,20,1, потім довільний pН для передкультур і встановлення pН на значення 6,70,1 для продуктової культури). Середовище готували як у прикладі 1. Після змішання сполук, попередньо розчинених у невеликому об'ємі очищеної води, у деяких випадках з додаванням кислоти або основи (порівн. приклад 1), і перед додаванням очищеної води до 100 % pН встановлювали на значення 7,20,1 для передкультур і на 6,70,1 для остаточної культури (10н гідроксидом калію або натрію або 37 %-ної HCl). Потім середовище стерилізували шляхом фільтрування через фільтр із порогом відсікання 0,22 мкм. Отримане так середовище можна зберігати 72 години при 5C. Перед інокуляцією середовища додавали: глюкозу 512,8 г/л, отриману з безводної глюкози D(+), що постачається компанією VWR під індексом 24379.294, розчин NAD 1 г/л, постачається компанією Sigma за назвою β-нікотинамід гідрату аденіндинуклеотиду (індекс 43410), маточний розчин, що містить протопорфірин у концентрації 0,25 г/л і гідроксид амонію в концентрації 5 мл/л; причому протопорфірин постачається компанією Sigma Aldrich за назвою протопорфірин IX динатрієва сіль (індекс 258385), і гідроксид амонію компанією VWR за назвою аміачний розчин 28 % (індекс 21190.292), з одержанням середовища, яке готове до інокуляції й містить, крім елементів, описаних у таблиці I із прикладу 1, додаткові елементи в концентраціях, зазначених у таблиці II із прикладу 1 (за винятком глюкози з кінцевою концентрацією 14,87 г/л замість 14 г/л). Спосіб у масштабі 1000 літрів містив 3 серії передкультур: перші передкультури одержували в колбі Ерленмейєра на 1 літр без перегородок, що містить 290 мл повного культурального середовища, при 37C, перемішуванні на 130 об./хв. 12 UA 115787 C2 5 10 15 20 25 (обертів на хвилину), протягом 17-18 годин. Ці передкультури ініціювали шляхом інокуляції культурального середовища інокулятом бактерії Haemophilus influenzae типу b, що містить щонайменше 2 копії локусу cap, зі ступенем інокуляції, що відповідає цільовому початкової оптичної густини D.O. при 694 нм 0,014; другу серію передкультур одержували у ферментері на 6,8 літрів. Два ферментери, що містять 5,2 літра повного культурального середовища, засіювали кожен 260 мл передкультури із серії 1. Ці ферментери підтримували протягом 4 годин при 371C, при початковому pН 7,20,2, парціальному тиску кисню pO2, утримуваному на значенні 30 % відповідно до каскадної схеми, що включає посилення перемішування (від 500 до 800 об./хв.), потім підвищення аерації (від 0,5 до 2,5 л/хв.) і потім збільшення витрати чистого O2 від 0 до 6 л/хв.; третю серію передкультур одержували у ферментері на 120 літрів, що містить 57 літрів повного середовища, яке засіювали 5,8 літрами передкультури із серії 2. Цей ферментер підтримували протягом 3 годин 10 хв. при 371C, при початковому pН 7,20,2, pO2 утримували на значенні 30 % відповідно до каскадної схеми, що включає посилення перемішування (від 300 до 425 об./хв.), потім підвищення аерації (від 6 до 28 л/хв.) і потім збільшення витрати чистого O2 від 0 до 50 л/хв. Промислове культивування реалізували у ферментері на 1000 літрів, що містить 778 літрів повного середовища, яке засіювали 39 літрами передкультури із серії 3. Цей ферментер підтримували при 321C, зі встановленням pН на значення 6,70,2 (2,5н розчином гідроксиду натрію), pO2 утримували на 70 % відповідно до каскадної схеми, що включає посилення перемішування (від 100 до 230 об./хв.), потім підвищення аерації (від 70 до 150 л/хв.) і потім збільшення витрати чистого O2 від 0 до 500 л/хв. Крім того, при необхідності додавали протиспінювач (Biospumex 4 %-ний) залежно від рівня піни. Після 12 годин культивування вимірювали D.O. при 694 нм, що дозволило визначити біомасу (відповідно до відповідності однієї одиниці D.O. 0,64 г сухої біомаси). Визначення концентрації PRP і LPS проводили, слідуючи протоколам, описаним у прикладах 3 і 4. Отримані результати наведені в таблиці XI нижче. Таблиця XI D.O. при 694 нм Біомаса, у г сухої маси на літр культурального середовища Концентрація PRP у мг/л культурального середовища Питома продуктивність, у мг PRP на г біомаси Концентрація LPS у мг/л культурального середовища Відношення LPS/біомаса, у мг/г біомаси Відношення PRP/LPS у мг/мг 30 Середовище відповідно до винаходу (1 дослід) 3,45 2,21 865 392 35,6 16,1 24,3 Ці результати показали перевагу способу відповідно до винаходу для утворення PRP і для відношення PRP/LPS, причому результати продемонстровані в промисловому масштабі. ФОРМУЛА ВИНАХОДУ 35 40 45 1. Спосіб одержання в промисловому масштабі капсулярного полісахариду Haemophilus influenzae типу b (PRP), призначеного для вакцинації, відповідно до якого культивують штам Haemophilus influenzae типу b (Hib) у культуральному середовищі, збирають супернатант культури, який обробляють для екстрагування капсулярного полісахариду, причому зазначене культуральне середовище містить щонайменше: одне джерело вуглецю, протопорфірин, солі, амінокислоти, NAD або NADH, вітаміни, засоби регулювання рН, 13 UA 115787 C2 5 10 15 20 25 30 35 40 45 50 55 який відрізняється тим, що зазначене культуральне середовище є середовищем із заданим хімічним складом і містить щонайменше цинк. 2. Спосіб за попереднім пунктом, який відрізняється тим, що зазначені засоби регулювання рН складаються з буферних солей. 3. Спосіб за одним із попередніх пунктів, який відрізняється тим, що зазначених джерел вуглецю може бути декілька, і вони можуть бути вибрані з: глюкози, фруктози, галактози, гліцерину, ксилози, рибози, фукози, сіалової кислоти, лактату. 4. Спосіб за одним із попередніх пунктів, який відрізняється тим, що зазначений протопорфірин являє собою синтетичний протопорфірин IX. 5. Спосіб за одним із попередніх пунктів, який відрізняється тим, що зазначені солі вибрані із солей калію, магнію, натрію, кальцію, заліза, цинку, кобальту і марганцю. 6. Спосіб за попереднім пунктом, який відрізняється тим, що зазначені солі вибрані з K2НРО4, KН2РО4, MgSO47H2O, Na2HPO412H2O, NaH2PO42H2O, СаСl22Н2О, FeSO47H2O, ZnSO47H2O, CoCl26H2O, MnSO4H2O. 7. Спосіб за одним із попередніх пунктів, який відрізняється тим, що зазначені амінокислоти вибрані з: аргініну, аланіну, щонайменше одного з: аспарагіну, глутаміну, аспарагінової кислоти, глутамінової кислоти, лізину, гістидину, триптофану, валіну, ізолейцину, лейцину, тирозину, фенілаланіну, цистину або еквівалента. 8. Спосіб за попереднім пунктом, який відрізняється тим, що зазначене культуральне середовище містить щонайменше аргінін, аланін, гістидин, триптофан, тирозин, фенілаланін, цистин, аспарагінову кислоту і глутамінову кислоту. 9. Спосіб за одним із попередніх пунктів, який відрізняється тим, що цистин замінено глутатіоном або цистеїном. 10. Спосіб за одним із попередніх пунктів, який відрізняється тим, що зазначені вітаміни вибрані з: тіаміну, пантотенату, урацилу, піроксантину, біотину, рибофлавіну і піридоксину. 11. Спосіб за одним із попередніх пунктів, який відрізняється тим, що аргінін і урацил замінені цитруліном. 12. Спосіб за одним із попередніх пунктів, який відрізняється тим, що він додатково включає стадію кон'югування отриманого капсулярного полісахариду з білком-носієм. 13. Спосіб за попереднім пунктом, який відрізняється тим, що білок-носій являє собою правцевий анатоксин. 14. Застосування капсулярного полісахариду, отриманого за будь-яким попереднім пунктом, для одержання вакцинної композиції. 15. Спосіб одержання вакцинної композиції, відповідно до якого: a) готують у промисловому масштабі антиген до Haemophilus influenzae типу b (Hib), що складається з капсулярного полісахариду (PRP), шляхом культивування штаму Hib у середовищі із заданим хімічним складом, природа і кількість кожного компонента якого є повністю визначеними і яке містить щонайменше: джерело вуглецю, протопорфірин, солі, амінокислоти, NAD або NADH, вітаміни, цинк, а також засоби регулювання рН, b) збирають супернатант культури, який обробляють для екстрагування очищеного капсулярного полісахариду, c) кон'югують капсулярний полісахарид, отриманий на стадії b), з білком-носієм, 14 UA 115787 C2 5 10 15 20 25 d) комбінують кон'югат, отриманий на стадії с), із щонайменше одним або декількома антигенами, призначеними для вакцинації проти однієї або декількох наступних інфекцій: дифтерії, правця, поліомієліту, гепатиту В, вітряної віспи, свинки, краснухи, інфекцій, викликаних Neisseria meningitidis або Streptococcus pneumoniae, інфекцій, викликаних ротавірусом, для одержання вакцинної комбінації, що дозволяє одночасну імунізацію від декількох хвороб. 16. Спосіб одержання вакцинної композиції за п. 15, який відрізняється тим, що кон'югат, отриманий на стадії с), комбінують з антигенами дифтерії, правця, гепатиту В. 17. Спосіб одержання вакцинної композиції за п. 15, який відрізняється тим, що кон'югат, отриманий на стадії с), комбінують з дифтерійним анатоксином, правцевим анатоксином, безклітинними антигенами Bordetella pertussis у числі 2 (анатоксин і ниткоподібний гемаглютинін). 18. Спосіб одержання вакцинної композиції за п. 15, який відрізняється тим, що кон'югат, отриманий на стадії с), комбінують із дифтерійним анатоксином, правцевим анатоксином, безклітинними антигенами Bordetella pertussis у числі 3 (анатоксин, пертактин і ниткоподібний гемаглютинін). 19. Спосіб одержання вакцинної композиції за п. 15, який відрізняється тим, що кон'югат, отриманий на стадії с), комбінують з дифтерійним анатоксином, правцевим анатоксином, безклітинними антигенами Bordetella pertussis у числі 5 (анатоксин, пертактин, аглютиногени і ниткоподібний гемаглютинін). 20. Спосіб одержання вакцинної композиції за п. 15, який відрізняється тим, що кон'югат, отриманий на стадії с), комбінують з дифтерійним анатоксином, правцевим анатоксином, безклітинними антигенами Bordetella pertussis у числі 2, 3 або 5, а також з інактивованими вірусами поліомієліту типу 1, 2 і 3. 21. Спосіб одержання вакцинної композиції за п. 15, який відрізняється тим, що кон'югат, отриманий на стадії с), комбінують з дифтерійним анатоксином, правцевим анатоксином, гепатитом В, безклітинними антигенами Bordetella pertussis у числі 2, 3 або 5, а також з інактивованими вірусами поліомієліту типу 1, 2 і 3. 22. Спосіб одержання вакцинної композиції за п. 15, який відрізняється тим, що кон'югат, отриманий на стадії с), комбінують з цілою бактерією Bordetella pertussis. 15 UA 115787 C2 Комп’ютерна верстка М. Мацело Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 16
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for producing haemophilus influenzae type b antigens
Автори англійськоюLe Hir, Jerome, Loubiere, Pascal, Barbirato, Fabien, Lindley, Nicholas
Автори російськоюЛэ Ир Жэром, Лубьер Паскаль, Барбирато Фабьен, Линдли Николас
МПК / Мітки
МПК: C12R 1/92, A61K 47/26, C12P 19/04, A61K 39/102, C12N 1/20
Мітки: антигенів, haemophilus, одержання, influenzae, типу, спосіб
Код посилання
<a href="https://ua.patents.su/18-115787-sposib-oderzhannya-antigeniv-haemophilus-influenzae-tipu-b.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання антигенів haemophilus influenzae типу b</a>
Попередній патент: Фармацевтична комбінація, що містить інгібітор b-raf, інгібітор egfr та, необов’язково, інгібітор рі3k-a
Наступний патент: Гербіцидні композиції, які містять 4-аміно-3-хлор-5-фтор-6-(4-хлор-2-фтор-3-метоксифеніл)піридин-2-карбонову кислоту
Випадковий патент: Спосіб усунення шлункових ускладнень при видаленні назоінтестинального зонда