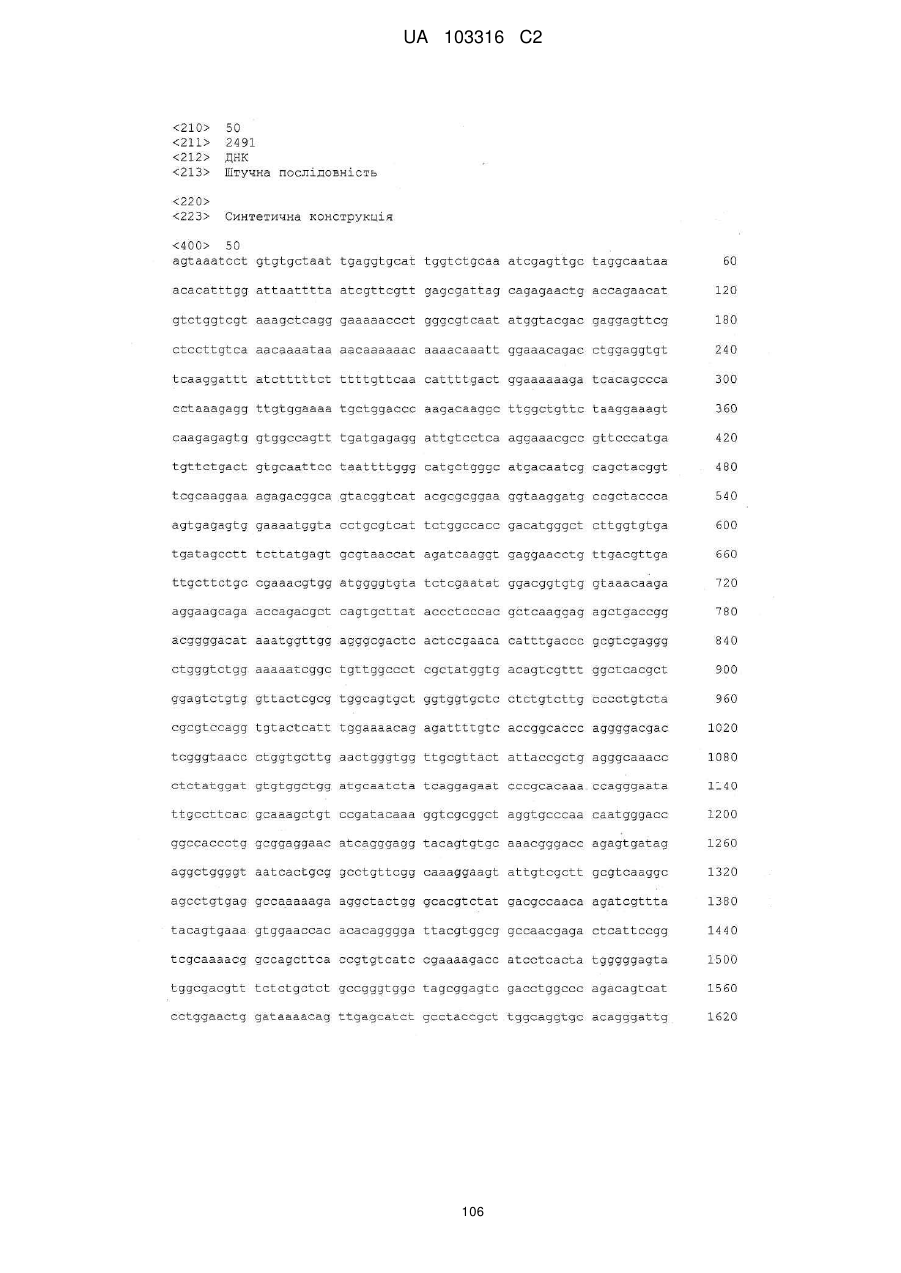
Вакцини на базі флавівірусів з дефектною реплікацією і вектори для одержання вакцин
Номер патенту: 103316
Опубліковано: 10.10.2013
Автори: Джіел-Молоні Меріенн, Румянцев Александер А., Клеантоус Харольд, Пугачев Константін В.
Формула / Реферат
1. Псевдоінфекційний флавівірус, що містить геном флавівірусу, який включає (і) одну або більше делецій або мутацій в послідовностях нуклеотидів, що кодують один або більше білків, вибраних з групи, яка складається з капсидного (С), передмембранного (рrМ) і оболонкового (Е) білка, неструктурного білка 1 (NS1), неструктурного білка 3 (NS3) і неструктурного білка 5 (NS5), і (іі) послідовність, що кодує один або більше гетерогенних патогенів, ракових або пов'язаних з алергією імуногенів.
2. Псевдоінфекційний флавівірус з дефектною реплікацією за п. 1, який відрізняється тим, що вказана одна або більше делецій або мутацій розташовані у межах капсидних (С) послідовностей геному флавівірусу.
3. Псевдоінфекційний флавівірус з дефектною реплікацією за п. 1, який відрізняється тим, що вказані одна або більше делецій або мутацій розташовані у межах передмембранної (рrМ) та/або оболонкової (Е) послідовностей геному флавівірусу.
4. Псевдоінфекційний флавівірус з дефектною реплікацією за п. 1, який відрізняється тим, що вказані одна або більше делецій або мутацій розташовані у межах капсидної (С), передмембранної (рrМ) і оболонкової (Е) послідовностей геному флавівірусу.
5. Псевдоінфекційний флавівірус з дефектною реплікацією за п. 1, який відрізняється тим, що вказані одна або більше делецій або мутацій розташовані у межах неструктурних 1 (NS1) послідовностей білка геному флавівірусу.
6. Псевдоінфекційний флавівірус з дефектною реплікацією за будь-яким з пп. 1-5, який відрізняється тим, що вказаний гетерогенний імуноген походить з патогену, вибраного з групи, що складається з вірусу сказу, Borrelia burgdorferi, кліща, вірусу грипу, вірусу імунодефіциту людини, вірусу імунодефіциту мавпи, вірусу папіломи людини, респіраторного синцитіального вірусу, збудника малярії і Mycobacterium tuberculosis.
7. Псевдоінфекційний флавівірус з дефектною реплікацією за п. 6, який відрізняється тим, що вказаний гетерогенний імуноген містить імуноген G-протеїну вірусу сказу або його імуногенний фрагмент.
8. Псевдоінфекційний флавівірус з дефектною реплікацією за п. 6, який відрізняється тим, що вказаний гетерогенний імуноген містить імуноген Borrelia burgdorferi OspA або його імуногенний фрагмент.
9. Псевдоінфекційний флавівірус з дефектною реплікацією за п. 6, який відрізняється тим, що вказаний гетерогенний імуноген містить білок слини кліща, вибраний з групи, що складається з 64TRP, Isac і Salp20, або його імуногенний фрагмент.
10. Псевдоінфекційний флавівірус з дефектною реплікацією за п. 6, який відрізняється тим, що вказаний гетерогенний імуноген містить вірус грипу М2, гемаглютинін (НА) або епітоп нейрамінідази (NA), або імуногенний фрагмент будь-якого з них.
11. Псевдоінфекційний флавівірус з дефектною реплікацією за п. 6, який відрізняється тим, що вказаний гетерогенний імуноген містить оптимізований за кодонами білок ВІЛ gag, tat/nef або gp120, або його імуногенний фрагмент.
12. Псевдоінфекційний флавівірус з дефектною реплікацією за п. 6, який відрізняється тим, що вказаний гетерогенний імуноген містить HPV16 або HPV18 капсидний білок L1 або L2, або його імуногенний фрагмент.
13. Псевдоінфекційний флавівірус з дефектною реплікацією за п. 6, який відрізняється тим, що вказаний гетерогенний імуноген містить F або G глікопротеїн респіраторного синцитіального вірусу.
14. Псевдоінфекційний флавівірус з дефектною реплікацією за будь-яким з пп. 1-13, який відрізняється тим, що вказаний геном флавівірусу містить послідовності, що кодують передмембранний (рrМ) та/або оболонковий (Е) білок.
15. Псевдоінфекційний флавівірус з дефектною реплікацією за будь-яким з пп. 1-14, який відрізняється тим, що геном флавівірусу вибраний з послідовностей вірусу жовтої лихоманки, вірусу Західного Нілу, вірусу кліщового енцефаліту, вірусу Лангат, вірусу японського енцефаліту, вірусу Денге, вірусу енцефаліту Сент-Луїса та їх химер.
16. Псевдоінфекційний флавівірус з дефектною реплікацією за п. 15, який відрізняється тим, що вказана химера містить передмембранну (рrМ) і оболонкову (Е) послідовності першого флавівірусу та капсидну (С) і неструктурну послідовності другого, іншого флавівірусу.
17. Псевдоінфекційний флавівірус з дефектною реплікацією за п. 16, який відрізняється тим, що вказаний перший флавівірус являє собою вірус кліщового енцефаліту або вірус Лангат.
18. Псевдоінфекційний флавівірус з дефектною реплікацією за пп. 16 або 17, який відрізняється тим, що вказаний другий, інший флавівірус являє собою вірус жовтої лихоманки або вірус Західного Нілу, або вірус Лангат.
19. Псевдоінфекційний флавівірус з дефектною реплікацією за будь-яким з пп. 1-18, який відрізняється тим, що вказаний геном упакований у частинку, що містить передмембранну (рrМ) і оболонкову (Е) послідовності флавівірусу, який аналогічний або відмінний від вірусу геному.
20. Псевдоінфекційний флавівірус з дефектною реплікацією за будь-яким з пп. 1-19, який відрізняється тим, що послідовності, які кодують вказаний гетерогенний імуноген, вставлені в місці одного або більше білків, або в комбінації з однією або більше делецій або мутацій одного або більше білків.
21. Псевдоінфекційний флавівірус з дефектною реплікацією за будь-яким з пп. 1-20, який відрізняється тим, що послідовності, які кодують вказаний гетерогенний імуноген, вставлені в геном флавівірусу в межах послідовностей, які кодують оболонковий (Е) білок, в межах послідовностей, які кодують неструктурний білок 1 (NS1), в межах послідовностей, які кодують передмембранний (рrМ) білок, між генами поміж послідовностями, які кодують оболонковий (Е) білок і неструктурний білок 1 (NS1), між генами поміж неструктурним білком 2В (NS2B) і неструктурним білком 3 (NS3), або як біцистронна вставка на 3' нетрансльованій ділянці геному флавівірусу.
22. Композиція, яка містить перший псевдоінфекційний флавівірус з дефектною реплікацією за будь-яким з пп. 1-21, і другий, інший псевдоінфекційний флавівірус з дефектною реплікацією, що містить геном, який включає одну або більше делецій або мутацій в послідовностях нуклеотидів, що кодують один або більше білків, вибраних з групи, яка складається з капсидного (С), передмембранного (рrМ) і оболонкового (Е) білка, неструктурного білка 1 (NS1), неструктурного білка 3 (NS3) і неструктурного білка 5 (NS5), де один або більше білків, кодовані послідовностями, в яких одна або більше делецій або мутацій знаходяться в другому, іншому псевдоінфекційному флавівірусі з дефектною реплікацією, відрізняються від одного або більше білків, кодованих послідовностями, в яких одна або більше делецій або мутацій знаходяться у першому псевдоінфекційному флавівірусі з дефектною реплікацією.
23. Спосіб індукування імунної реакції на імуноген у суб'єкта, який включає введення суб'єкту одного або більше псевдоінфекційних флавівірусів з дефектною реплікацією за пп. 1-21.
24. Спосіб за п. 23, який відрізняється тим, що суб'єкт знаходиться у зоні ризику, але не інфікований вказаним патогеном, або у нього відсутнє захворювання або стан, пов'язаний з вказаним раковим імуногеном або імуногеном, пов'язаним з алергією.
25. Спосіб за п. 23, який відрізняється тим, що суб'єкт інфікований вказаним патогеном, або у нього присутнє захворювання або стан, пов'язаний з вказаним раковим імуногеном або імуногеном, пов'язаним з алергією.
26. Спосіб за будь-яким з пп. 23-25, який відрізняється тим, що імуноген походить з патогену, вибраного з групи, що складається з вірусу сказу, Borrelia burgdorferi, кліща, вірусу грипу, вірусу імунодефіциту людини, вірусу імунодефіциту мавпи, вірусу папіломи людини, респіраторного синцитіального вірусу, збудника малярії і Mycobacterium tuberculosis.
27. Спосіб за будь-яким з пп. 23-26, який відрізняється тим, що спосіб призначений для індукування імунної реакції проти білка, кодованого геномом флавівірусу, на додаток до джерела імуногену.
28. Спосіб за п. 27, який відрізняється тим, що суб'єкт знаходиться у зоні ризику, але не інфікований флавівірусом, що відповідає геному псевдоінфекційного флавівірусу, який містить послідовності, що кодують передмембранний та/або оболонковий білок флавівірусу.
29. Спосіб за п. 27, який відрізняється тим, що суб'єкт інфікований флавівірусом, що відповідає геному псевдоінфекційного флавівірусу, який містить послідовності, що кодують передмембранний та/або оболонковий білок флавівірусу.
30. Спосіб індукування імунної реакції на імуноген у суб'єкта, який включає введення суб'єкту композиції за п. 22.
31. Спосіб за п. 30, який відрізняється тим, що суб'єкт знаходиться у зоні ризику, але не інфікований вказаним патогеном, або у нього відсутнє захворювання або стан, пов'язаний з вказаним раковим імуногеном або імуногеном, пов'язаним з алергією.
32. Спосіб за п. 30, який відрізняється тим, що суб'єкт інфікований вказаним патогеном, або у нього присутнє захворювання або стан, пов'язаний з вказаним раковим імуногеном або імуногеном, пов'язаним з алергією.
33. Спосіб за будь-яким з пп. 30-32, який відрізняється тим, що імуноген походить з патогену, вибраного з групи, що складається з вірусу сказу, Borrelia burgdorferi, кліща, вірусу грипу, вірусу імунодефіциту людини, вірусу імунодефіциту мавпи, вірусу папіломи людини, респіраторного синцитіального вірусу, збудника малярії і Mycobacterium tuberculosis.
34. Спосіб за будь-яким з пп. 30-33, який відрізняється тим, що спосіб призначений для індукування імунної реакції проти білка, кодованого геномом флавівірусу, на додаток до джерела імуногену.
35. Спосіб за п. 34, який відрізняється тим, що суб'єкт знаходиться у зоні ризику, але не інфікований флавівірусом, що відповідає геному псевдоінфекційного флавівірусу, який містить послідовності, що кодують передмембранний та/або оболонковий білок флавівірусу.
36. Спосіб за п. 34, який відрізняється тим, що суб'єкт інфікований флавівірусом, що відповідає геному псевдоінфекційного флавівірусу, який містить послідовності, що кодують передмембранний та/або оболонковий білок флавівірусу.
Текст
Реферат: UA 103316 C2 (12) UA 103316 C2 Винахід належить до вакцини на базі флавівірусів з дефектною реплікацією і векторів для одержання зазначеної вакцини, а також до відповідної композиції і способу індукування імунної реакції. UA 103316 C2 5 10 15 20 25 30 35 40 45 50 55 60 ГАЛУЗЬ ТЕХНІКИ В даному винаході пропонуються вакцини на базі флавівірусів з дефектною реплікацією і вектори для одержання вакцин, а також відповідні композиції і способи. РІВЕНЬ ТЕХНІКИ Флавівірус розповсюджується у всьому світі і представляє глобальну проблему для охорони здоров'я. Флавівіруси також мають велике значення як ветеринарні патогени. Флавівірусні патогени включають вірус жовтої лихоманки (YF), типи 1-4 вірусу Денге (DEN1-4), вірус японського енцефаліту (JE), вірус Західного Ніла (WN), вірус кліщового енцефаліту (TBE) та інші віруси серокомплексу TBE, наприклад, віруси хвороби Кьясанурського лісу (KFD) і Омської геморагічної лихоманки (OHF). На теперішній час доступні вакцини проти YF [жива, атенуйована вакцина (LAV), штам 17D], JE [інактивовані вакцини (INV) і LAV] і TBE (INV). На даний момент не існує ліцензійних вакцин для людини проти DEN і WN. Застосовують ветеринарні вакцини, у тому числі, наприклад, вакцини проти WN для коней (INV, рекомбінантні і живі химерні вакцини), JE (INV і LAV) з метою запобігання енцефаліту у коней і мертвонародження у свиней в Азії, проти флавівірусу шотландського енцефаліту (INV), з метою запобігання неврологічного захворювання у овець у Великобританії, і проти TBE (INV), що застосовують для тварин на фермах в Чеській республіці (INV) (Monath and Heinz, Flaviviruses, in Fields et al. Eds., Fields Virology, 3rd Edition, Philadelphia, New York, Lippincott-Raven Publishers, 1996, pp. 961-1034). Кліщовий енцефаліт (TBE) являє собою провідне вірусне захворювання у людини, спричинене кліщем. Він є ендемічним в деяких частинах Європи і Північної Азії, спричиняючи більше 10 000 випадків госпіталізації щорічно, з показником смертельних результатів 0,5-1,5 % в Європі і 6-40 % у Сибіру і на Далекому Сході. Істотна частина пацієнтів страждає від тривалих нейропсихіатричних наслідків. Доведено, що для запобігання захворюванню ефективними є інактивовані вакцини, продуковані в культурах клітин ембріону курчати. Наприклад, 86 % охоплення вакцинацією населення Австрії (країни з найвищим рівнем серед Європейських країн) привело до зменшення випадків госпіталізації приблизно на 90 % (Heinz and Kunz, Arch. Virol. Suppl. 18:201-205, 2004). Інактивовані вакцини є дорогими, і для первинної імунізації необхідно зробити три щеплення. Для підтримки імунітету необхідна періодична активна імунізація (кожні 2-5 роки). Таким чином, існує необхідність в менш дорогій вакцина проти TBE, яка була б ефективною після однієї-двох доз і забезпечувала б тривалий, наприклад, на все життя, імунітет (подібно до імунітету, який забезпечується за допомогою імунізації проти YF 17D), і, дійсно, вона ідентифікована ВОЗ як основний пріоритет. Спроби розробки кандидатів LAV TBE в минулих декількох десятиліттях за допомогою емпіричної або раціональної атенуації батьківського вірусу TBE per se або химеризації вірусів TBE або Лангат (LGT, природно атенуйований флавівірус, який близько споріднений [серологічно] TBE) з вірусом Денге 4 зіткнулися з труднощами через проблеми, пов'язані із залишковою вірулентністю кандидатів та/або низькою імуногенністю/надмірною атенуацією (Wright et al., Vaccine 26:882-890, 2008; Maximova et al., J. Virol. 82:5255-5268, 2008; Rumyantsev et al., Vaccine 24:133-143, 2006; Kofler et al., Arch. Virol. Suppl. 18:191-200, 2004; і посилання в даному описі). Флавівіруси являють собою оболонкові плюс ниткові РНК-віруси невеликого розміру, що передаються перш за все векторами членистоногих (москітами або кліщами) природним хазяям, якими в основному є хребетні тварини, наприклад, різні види ссавців, у тому числі людина, і птахи. Геномна молекула РНК флавівірусу складається приблизно з 11 000 нуклеотидів (nt) і включає довгий каркас відкритої рамки зчитування (ORF), суміжний з 5’ і 3’ нетрансльованими кінцевими ділянками (UTR) довжиною приблизно 120 і 500 нуклеотидів, відповідно. ORF кодує прекурсор поліпротеїну, який розщеплюється під час трансляції і після неї для генерації індивідуальних вірусних білків. Білки кодуються в наступному порядку: CprM/M-E-NS1-NS2A/2B-NS3-NS4A/4B-NS5, де C (ядерний/капсидний), prM/M (передмембранний/мембранний) і E (оболонковий) являють собою структурні білки, тобто, компоненти вірусних частинок, а білки NS являють собою неструктурні білки, які залучені до внутрішньоклітинної реплікації вірусу. Реплікація флавівірусу відбувається в цитоплазмі. При інфікуванні клітин і трансляції геномного РНК обробка поліпротеїну розпочинається з транслокації частини prM поліпротеїну влюмен ендоплазматичного ретикулуму (ER) інфікованих клітин з наступною транслокацією частин E і NS1, спрямованою гідрофобними сигналами для білків prM, E і NS1. Амінні кінці білків prM, E і NS1 генеруються розщепленням клітинною сигналазою, яка розташована на люмінальному боці мембрани ER, і в результаті одержані індивідуальні білки залишаються закріпленими в мембрані на карбокси-кінці. Більшість з решти реакцій розщеплення на неструктурній ділянці здійснюється за допомогою серинпротеази NS2B/NS3 вірусу. Вірусна протеаза також відповідальна за генерацію C-кінця зрілого протеїну C, знайденого у віріонах нащадків. Нещодавно синтезовані геномні молекули 1 UA 103316 C2 5 10 15 20 25 30 35 40 45 50 55 60 РНК і протеїн C утворюють щільний сферичний нуклеокапсид, який оточується клітинною мембраною, до якої вбудовані білки E і prM. Зрілий протеїн M продукується розщепленням prM незадовго перед вивільненням вірусу клітинним фурином або подібною протеазою. Основний оболонковий білок - протеїн E - являє собою головну мішень для нейтралізуючих антитіл, основний корелят імунітету проти інфекції флавівірусом. Специфічна по відношенню до вірусу цитотоксична реакція T-лімфоцитів (CTL) є іншою ключовою властивістю імунітету. Множинні епітопи CD8+ і CD4+CTL охарактеризовані в різних структурних і неструктурних білках флавівірусу. Крім того, природні імунні реакції сприяють як кліренсу вірусу, так і регуляції розвитку адаптивних імунних реакцій та імунологічної пам'яті. Крім інактивованих (INV) і живих, атенуйованих (LAV) вакцин проти флавівірусів, що обговорювалися вище, розробляються інші платформи для вакцин. Один з прикладів базується на химерних флавівірусах, що включають капсидні і неструктурні послідовності вірусу жовтої лихоманки і prM-E білки інших флавівірусів, до яких знайдений імунітет. Дана технологія застосовується з метою розробки кандидатів вакцин проти вірусів Денге (DEN), японського енцефаліту (JE), Західного Нілу (WN), енцефаліту Сент-Луїса (SLE) (див., наприклад, патент США № 6,962,708 і 6,696,281). Химерний флавівірус, що базується на вірусі жовтої лихоманки, продемонстрував багатообіцяючі результати у клінічних випробуваннях. Інша платформа для вакцин проти флавівірусів базується на застосуванні технології псевдоінфекційного вірусу (PIV) (Mason et al., Virology 351:432-443, 2006; Shustov et al., J. Virol. 21:11737-11748, 2007; Widman et al., Adv. Virus. Res. 72:77-126, 2008; Suzuki et al., J. Virol. 82:6942-6951, 2008; Suzuki et al., J. Virol. 83:1870-1880, 2009; Ishikawa et al., Vaccine 26:27722781, 2008; Widman et al., Vaccine 26:2762-2771, 2008). PIV являють собою віруси з дефектною реплікацією, атенуйовані за допомогою делеції(й). На відміну від живих вакцин проти флавівірусу, вони здійснюють один круг реплікації in vivo (або, необов'язково, обмежену кількість кругів, для конструкції з двох компонентів; див. нижче), що може забезпечувати переваги з точки зору безпечності. PIV також не індукують віремії і не спричиняють системної інфекції. Крім того, на відміну від інактивованих вакцин, PIV повністю імітують вірусну інфекцію, що може приводити до підвищення ефективності завдяки індукуванню стійких реакцій B- і Tклітин, більшої тривалості імунітету і зменшення доз. Подібно до суцільних вірусів, вакцини PIV націлені на клітини, що презентують антиген, наприклад, дендритні клітини, стимулюють Tollподібні рецептори (TLR) та індукують збалансований імунітет Th1/Th2. Крім того, продемонстровано, що титри конструкцій PIV виростають до високих значень у клітинах субстрату, з незначним або відсутнім цитопатичним ефектом (ЦПЕ), стоворюючи, таким чином, можливість виробництва з високим виходом продукту, і необов'язково з використанням множинних врожаїв та/або розведення інфікованих клітин субстрату. Принципи технології PIV проілюстровані на фіг. 1 і 2. Існують дві варіації даної технології. У першій варіації псевдоінфекційний вірус з одним компонентом (s-PIV) конструюється з великою делецією в капсидному білку (C), що робить неможливим для мутантного вірусу утворення інфекційних вірусних частинок у здорових клітинах (фіг. 1). Делеція не видаляє перші ~20 кодонів протеїну C, які містять послідовність циклізації РНК, і подібну кількість кодонів в кінці C, які кодують ділянку розщеплення вірусною протеазою і сигнальний пептид для prM. S-PIV може репродукуватися, наприклад, в ході виробництва в культурах клітини субстрату (хелпер), в яких протеїн C постачається у трансфіковані, наприклад, в стабільно трансфіковані клітини, що продукують протеїн C (або у касету хелпера більшого розміру, що включає протеїн C), або в клітини, що містять реплікон альфавірусу [наприклад, реплікон вірусу Венесуельського кінського енцефаліту (VEE)], що експресує протеїн C або інший внутрішньоклітинний вектор експресії, що експресує протеїн C. Після щеплення in vivo, наприклад, після імунізації, PIV здійснює один круг реплікації в інфікованих клітинах за відсутності транс-комплементації делеції без розповсюдження до оточуючих клітин. Інфіковані клітини продукують порожні вірусоподібні частинки (ВПЧ), які є продуктом генів prM-E в PIV, що в результаті приводить до індукування реакції у формі нейтралізуючих антитіл. Реакція T-клітин повинна також бути індукована через презентацію MHCI вірусних епітопів. Даний підхід застосований до вірусу YF 17D і вірусів WN і химерних вірусів WN/JE і WN/DEN2 (Mason et al., Virology 351:432-443, 2006; Suzuki et al., J. Virol. 83:1870-1880, 2009; Ishikawa et al., Vaccine 26:2772-2781, 2008; Widman et al., Vaccine 26:2762-2771, 2008; WO 2007/098267; WO 2008/137163). У другій варіації конструюється PIV (d-PIV) з двома компонентами (фіг. 2). Клітини субстрату трансфікують двома дефектними вірусними РНК, одна з делецією в гені C, а у другій відсутні гени оболонкового білка prM-E. Два дефектні геноми доповнюють один одного, що в результаті приводить до акумуляції двох типів PIV у середовищі для культивування клітин (Shustov et al., J. Virol. 21:11737-11748, 2007; Suzuki et al., J. Virol. 82:6942-6951, 2008). Необов'язково, два PIV 2 UA 103316 C2 5 10 15 20 25 30 35 40 45 50 55 60 можна продукувати окремо у відповідних лініях клітин-хелперів, а потім змішувати у рецептурі з двома компонентами. Така композиція може бути переважною завдяки корекції відносних концентрацій двох компонентів, що підвищує імуногенність та ефективність. Даний тип вакцини PIV повинен бути здатним до обмеженого розповсюдження in vivo через інфікування поміж деякими клітинами в ділянці щеплення обома компонентами. Але очікується, що таке розповсюдження буде самообмеженим, оскільки в тканинах існує більше клітин, ніж вірусних частинок, що спочатку продукуються супутньо інфікованими клітинами. Крім того, відносно високе множинне інфікування необхідно для ефективного супутнього інфікування, а за межами ділянки щеплення не очікується, що клітини будуть ефективно супутньо інфікованими (наприклад, при дренуванні лімфовузлів). Клітини, інфіковані тільки ΔC PIV, продукують високо імуногенні ВПЧ. Інфіковані супутньо клітини продукують два типи упакованих дефектних вірусних частинок, які також стимулюють нейтралізуючі антитіла. Очікується, що обмежена інфекція дасть у результаті більш виражену реакцію у формі нейтралізуючих антитіл і реакцію T-клітин у порівнянні з реакцією s-PIV. Для зменшення шансів рекомбінації у процесі виробництва або in vivo, у тому числі з циркулюючими флавівірусами, можна модифікувати послідовності вірусів як s-PIV, так і d-PIV, використовуючи, наприклад, аналогічні заміщення кодонів, з метою зменшення гомології послідовностей нуклеотидів і мутації комплементарної циклізації 5’ та 3’ елементів. КОРОТКИЙ ОПИС ВИНАХОДУ У даному винаході пропонуються флавівіруси з дефектною реплікацією або дефектний псевдоінфекційний флавівірус, у тому числі геном флавівірусу, який включає (i) одну або більше делецій або мутацій в послідовностях нуклеотидів, що кодують один або більше білків, вибраних з групи, яка складається з капсидного (C), передмембранного (prM) і оболонкового (E) білку, неструктурного білку 1 (NS1), неструктурного білку 3 (NS3) і неструктурного білку 5 (NS5), і (ii) послідовності, що кодують один або більше гетерогенних патогенів, ракових або пов'язаних з алергією імуногенів Наприклад, делеція/мутація може бути розташована у межах капсидних (C) послідовностей; передмембранної (prM) та/або оболонкової (E) послідовностей; капсидної (C), передмембранної (prM) і оболонкової (E) послідовностей; або послідовностей неструктурного білка 1 (NS1). Гетерогенний імуноген може походити, наприклад, з патогену, вибраного з групи, що складається з вірусу сказу (наприклад, епітоп протеїну G вірусу сказу), Borrelia burgdorferi (наприклад, імуноген OspA або його імуногенний фрагмент), кліща (наприклад, білок слини кліща, вибраний з групи, що складається з 64TRP, Isac, і Salp20 або його імуногенний фрагмент), вірусу грипу (наприклад, вірус грипу M2, гемаглютинін [HA], або епітоп нейрамінідази [NA], або імуногенний фрагмент будь-якого з них), вірусу імунодефіциту людини (наприклад, оптимізований за кодонами білок ВІЛ gag, tat/nef або gp120, або його імуногенний фрагмент), вірусу імунодефіциту мавпи, вірусу папіломи людини (наприклад, HPV16 або HPV18 капсидний білок L1 або L2, або його імуногенний фрагмент), респіраторного синцитіального вірусу (наприклад, F або G глікопротеїн респіраторного синцитіального вірусу), збудника малярії і Mycobacterium tuberculosis (також див. нижче). Псевдоінфекційні флавівіруси з дефектною реплікацією можуть містити послідовності, що кодують передмембранний (prM) та/або оболонковий (E) білок. В подальшому геноми псевдоінфекційного флавівірусу з дефектною реплікацією можуть бути вибрані з послідовностей вірусу жовтої лихоманки, вірусу Західного Ніла, вірусу кліщового енцефаліту, вірусу Лангат, вірусу японського енцефаліту, вірусу Денге, вірусу енцефаліту Сент-Луїса, їх атенуйованих штамів та їх химер (також див. нижче). У різних прикладах химери містять передмембранну (prM) і (E) послідовності першого флавівірусу (наприклад, вірус кліщового енцефаліту або вірус Лангат) та капсидну (C) і неструктурну послідовності другого, іншого флавівірусу (наприклад, вірус жовтої лихоманки, Західного Ніла або вірус Лангат). Геноми псевдоінфекційного флавівірусу з дефектною реплікацією можуть бути упаковані у частинки, що містять передмембранну (prM) і оболонкову (E) послідовності флавівірусу, який аналогічний або відмінний від вірусу геному. В подальшому послідовності, які кодують гетерогенні імуногени, можуть бути вставлені в сайти одного або більше білків, або в комбінації з однією або більше делецій або мутацій в одному або більше білків. Послідовності, які кодують гетерогенні імуногени, можуть бути вставлені в геноми флавівірусу в межах послідовностей, які кодують оболонковий (E) білок, в межах послідовностей, які кодують неструктурний білок 1 (NS1), в межах послідовностей, які кодують передмембранний (prM) білок, між генами поміж послідовностями, які кодують оболонковий (E) білок і неструктурний білок 1 (NS1), між генами поміж неструктурним білком 2B (NS2B) і неструктурним білком 3 (NS3), або як біцистронна вставка на 3’ нетрансльованій ділянці генома 3 UA 103316 C2 5 10 15 20 25 30 35 40 45 50 55 60 флавівірусу. У даний винахід також включені композиції, у тому числі перший псевдоінфекційний флавівірус з дефектною реплікацією, як описано вище, і другий (або наступний), інший псевдоінфекційний флавівірус з дефектною реплікацією, у тому числі геном, який включає одну або більше делецій або мутацій в послідовностях нуклеотидів, що кодують один або більше білків, вибраних з групи, яка складається з капсидного (C), передмембранного (prM) і оболонкового (E) білку, неструктурного білку 1 (NS1), неструктурного білку 3 (NS3) і неструктурного білку 5 (NS5). У вказаних композиціях один або більше білків, кодовані послідовностями, в яких одна або більше делецій або мутацій знаходяться в другому, іншому псевдоінфекційному флавівірусі з дефектною реплікацією, відрізняються від одного або більше білків, кодованих послідовностями, в яких одна або більше делецій або мутацій знаходяться у першому псевдоінфекційному флавівірусі з дефектною реплікацією. Крім того, до даного винаходу включені способи індукування імунної реакції на імуноген у суб'єкта, що включають введення суб'єкту одного або більше псевдоінфекційних флавівірусів з дефектною реплікацією та/або композиції, як описано в даному описі. У різних прикладах суб'єкт знаходиться у зоні ризику, але не інфікований вказаним патогеном, або у нього відсутнє захворювання або стан, пов'язаний з раковим імуногеном або імуногеном, пов'язаним з алергією. В інших прикладах суб'єкт інфікований вказаним патогеном, або у нього присутнє захворювання або стан, пов'язаний з раковим імуногеном або імуногеном, пов'язаним з алергією. Таким чином, до даного винаходу включені профілактичні і терапевтичні способи. В даних способах імуноген може походити з, наприклад, патогену, вибраного з групи, що складається з вірусу сказу, Borrelia burgdorferi, кліща, вірусу грипу, вірусу імунодефіциту людини, вірусу імунодефіциту мавпи, вірусу папіломи людини, респіраторного синцитіального вірусу, збудника малярії і Mycobacterium tuberculosis (також див. нижче). В подальшому дані способи можуть бути призначені для індукування імунної реакції проти білка, кодованого геномом флавівірусу, на додаток до джерела імуногену. У різних прикладах суб'єкт знаходиться у зоні ризику, але не інфікований флавівірусом, що відповідає геному псевдоінфекційного флавівірусу, який містить послідовності, що кодують передмембранний та/або оболонковий білок флавівірусу. В інших прикладах суб'єкт інфікований флавівірусом, що відповідає геному псевдоінфекційного флавівірусу, який містить послідовності, що кодують передмембранний та/або оболонковий білок флавівірусу. До даного винаходу також включені живі, атенуйовані химерні флавівіруси, що містять вірус жовтої лихоманки, в якому послідовності, що кодують передмембранний і оболонковий білки, замінені послідовностями, що кодують передмембранний і оболонковий білки вірусу кліщового енцефаліту або вірусу Лангат, а сигнальна послідовність між капсидним і передмембранним білками химерного флавівірусу включає гібрид вірусу жовтої лихоманки і вірусу кліщового енцефаліту або сигнальних послідовностей капсидного/передмембранного білку вірусу Лангат, або його варіанту. У різних прикладах сигнальна послідовність капсидного/передмембранного білку химерного флавівірусу містить послідовності вірусу жовтої лихоманки на амінному кінці ділянки, а послідовності вірусу кліщового енцефаліту або вірусу Лангат на карбокси-кінці ділянки (див. нижче). Крім того, у даний винахід включені живі, атенуйовані химерні флавівіруси, що містять вірус Західного Ніла, в якому послідовності, що кодують передмембранний і оболонковий білки, замінені послідовностями, що кодують передмембранний і оболонковий білки вірусу кліщового енцефаліту або вірусу Лангат, а сигнальна послідовність між капсидним і передмембранним білками химерного флавівірусу включає капсидну/передмембранну сигнальну послідовність вірусу кліщового енцефаліту або вірусу Лангат, або їх варіант. У даний винахід також включені фармацевтичні композиції, у тому числі композиція, що містить один або більше псевдоінфекційних флавівірусів або живих, атенуйованих флавівірусів, як описано в даному описі, і фармацевтично прийнятний носій або розчинник. Крім того, композиції можуть містити ад'ювант. Також до даного винаходу включений псевдоінфекційний флавівірус з дефектною реплікацією, що містить геном флавівірусу, який включає одну або більше делецій або мутацій в послідовностях нуклеотидів, що кодують неструктурний білок 1 (NS1), неструктурний білок 3 (NS3) або неструктурний білок 5 (NS5). Крім того, у даний винахід включені молекули нуклеїнової кислоти, що відповідають геному псевдоінфекційного флавівірусу, або геному живого, атенуйованого флавівірусу, як описано в даному описі, і комплементарні до них. В даному винаході також пропонуються способи виготовлення псевдоінфекційного флавівірусу з дефектною реплікацією, як описано в даному описі, включаючи введення однієї 4 UA 103316 C2 5 10 15 20 25 30 35 40 45 50 55 60 або більше молекул нуклеїнової кислоти, як описано вище, в клітину, яка експресує білок(ки), що відповідає послідовностям, видаленим з генома флавівірусу псевдоінфекційного флавівірусу з дефектною реплікацією. У даних способах білок може експресуватися в клітині з геному другого (або наступного), іншого псевдоінфекційного флавівірусу з дефектною реплікацією. В інших прикладах білок експресується з реплікону (наприклад, реплікон альфавірусу такий, як вірус венесуельського енцефаліту коней; див. нижче). У даний винахід також включені композиції, які містять два або більше псевдоінфекційних флавівірусів з дефектною реплікацією, де два з псевдоінфекційних флавівірусів з дефектною реплікацією вибрані з груп, що складаються з: (a) псевдоінфекційного флавівірусу з дефектною реплікацією, що містить геном, який включає послідовності вірусу японського енцефаліту, і псевдоінфекційного флавівірусу з дефектною реплікацією, що містить геном, який включає послідовності вірусу Денге; (б) псевдоінфекційного флавівірусу з дефектною реплікацією, що містить геном, який включає послідовності вірусу жовтої лихоманки, і псевдоінфекційного флавівірусу з дефектною реплікацією, що містить геном, який включає послідовності вірусу Денге; і (в) псевдоінфекційного флавівірусу з дефектною реплікацією, що містить геном, який включає послідовності кліщового енцефаліту або вірусу Лангат, і вставлену послідовність, що кодує імуноген Borrelia burgdorferi, та псевдоінфекційного флавівірусу з дефектною реплікацією, який містить геном, що включає послідовності кліщового енцефаліту або вірусу Лангат, і вставлену послідовність, що кодує імуноген білка слини кліща, або псевдоінфекційного флавівірусу з дефектною реплікацією, що містить геном, який включає послідовності кліщового енцефаліту або вірусу Лангат, і вставлені послідовності, що кодують імуноген Borrelia burgdorferi та імуноген білка слини кліща. Фармацевтичні композиції, у тому числі живі, атенуйовані химерні флавівіруси, що описані в даному описі, також включені до даного винаходу. Крім того, до даного винаходу включені способи індукування імунної реакції у суб'єкта на вірус кліщового енцефаліту або вірус Лангат, що включають введення суб'єкту подібної фармацевтичної композиції. У різних прикладах суб'єкт не інфікований, але знаходиться у зоні ризику розвитку інфекції вірусом кліщового енцефаліту або вірусом Лангат. В інших прикладах суб'єкт інфікований вірусом кліщового енцефаліту або вірусом Лангат. Також у даний винахід включені псевдоінфекційні флавівіруси з дефектною реплікацією, що містять геном флавівірусу, який включає одну або більше делецій або мутацій у послідовностях нуклеотидів, що кодують один або більше білків, вибраних з групи, що складається з капсидного (C), передмембранного (prM), оболонкового (E), неструктурного білку 1 (NS1), неструктурного білку 3 (NS3) і неструктурного білку 5 (NS5), в яких геном флавівірусу містить послідовності вірусу жовтої лихоманки, в яких послідовності, що кодують передмембранний і оболонковий білки, замінені послідовностями, що кодують передмембранний і оболонковий білки вірусу кліщового енцефаліту або вірусу Лангат, і послідовності, що кодують сигнальну послідовність між капсидними і передмембранними білками генома флавівірусу, включають гібрид послідовностей, що кодують вірус жовтої лихоманки і вірус кліщового енцефаліту або капсидні/передмембранні сигнальні послідовності вірусу Лангат, або його варіант. У різних прикладах послідовності, що кодують капсидну/передмембранну сигнальну послідовність генома флавівірусу, включають послідовності вірусу жовтої лихоманки на 5’ ділянці і послідовності вірусу кліщового енцефаліту або вірусу Лангат на 3’ ділянці. Крім того, у даний винахід включені псевдоінфекційні флавівіруси з дефектною реплікацією, що містить геном флавівірусу, який включає одну або більше делецій або мутацій в послідовностях нуклеотидів, що кодують один або більше білків, вибраних з групи, що складається з капсидного (C), передмембранного (prM), оболонкового (E), неструктурного білку 1 (NS1), неструктурного білку 3 (NS3) і неструктурного білку 5 (NS5), в яких геном флавівірусу містить послідовності вірусу Західного Ніла, в яких послідовності, що кодують передмембранний і оболонковий білки замінені послідовностями, що кодують передмембранний і оболонковий білки вірусу кліщового енцефаліту або вірусу Лангат, а послідовності, що кодують сигнальну послідовність між капсидними і передмембранними білками генома флавівірусу, включають послідовності, що кодують вірус кліщового енцефаліту або капсидну/передмембранну сигнальну послідовність вірусу Лангат, або його варіант. Крім того, у даний винахід включені псевдоінфекційні флавівіруси з дефектною реплікацією, що містить геном флавівірусу, який включає одну або більше делецій або мутацій в послідовностях нуклеотидів, що кодують один або більше білків, вибраних з групи, що складається з капсидного (C), передмембранного (prM), оболонкового (E), неструктурного білку 1 (NS1), неструктурного білку 3 (NS3) і неструктурного білку 5 (NS5), в яких капсидні (C) і неструктурні (NS) білки у вказаному геномі флавівірусу походять з вірусу Лангат, а 5 UA 103316 C2 5 10 15 20 25 30 35 40 45 50 55 60 передмембранні (prM) і оболонкові (E) білки походять з вірусу кліщового енцефаліту. Терміном "псевдоінфекційний флавівірус з дефектною реплікацією" або "PIV" позначається флавівірус, для якого забезпечується дефектна реплікація через делецію або мутацію в геномі флавівірусу. Делеція або мутація може являти собою, наприклад, делецію великої послідовності, наприклад більшості капсидного білка, як описано в даному описі (при цьому послідовність циклізації залишається; див. нижче). В інших прикладах послідовності, що кодують різні білки (наприклад, prM, E, NS1, NS3, та/або NS5; див. нижче) або комбінації білків (наприклад, prM-E або C-prM-E), видалені. Даний тип делеції може бути переважним, якщо PIV слід застосовувати як вектор для доставки гетерогенного імуногену, оскільки делеція може дозволити вставку послідовностей, розмір яких може відповідати, наприклад, як мінімум розміру видаленої послідовності. В інших прикладах мутація може бути, наприклад, точковою мутацією, за умови, що це приводить до дефіциту реплікації, як обговорено вище. Через делецію або мутацію геном не кодує всіх білків, необхідних для продукування суцільної частинки флавівірусу. Пропущені послідовності можуть постачатися трансфікованими за допомогою доповнюючої лінії клітин, яка створена для експресування відсутньої послідовності (наприклад, застосуванням реплікону; s-PIV; див. нижче), або за допомогою супутньої експресії двох геномів з дефектною реплікацією в тій же клітині, де два геноми з дефектною реплікацією, якщо їх розглядають разом, кодують всі білки, необхідні для продукування (система d-PIV; див. нижче). При введенні в клітини, які не експресують доповнюючих білків, геноми повторюють і, в деяких випадках, генерують "вірусоподібні частинки", які вивільняються з клітин і можуть залишити клітини і бути імуногенним, але не можуть інфікувати інші клітини і призводити до генерації інших частинок. Наприклад, у випадку PIV, включаючи делецію в послідовності кодування капсидного білка, після інфікування клітин, які не експресують капсид, ВПЧ, у тому числі prM-E, вивільняються з клітин. Через відсутність капсидного білка ВПЧ бракує капсиду і геному нуклеїнової кислоти. У випадку підходу d-PIV продукування подальших PIV можливе у клітинах, які інфіковані двома PIV, що доповнюють один одного з точки зору продукування всіх необхідних білків (див. нижче). У даному винаході пропонуються декілька переваг. Наприклад, вектори PIV і PIV за даним винаходом високою мірою атенуйовані і є високо ефективними після введення однієї-двох доз, забезпечуючи тривалий імунітет. Крім того, на відміну від інактивованих вакцин, PIV повністю імітують вірусну інфекцію, що може приводити до підвищення ефективності завдяки індукуванню стабільних реакцій B- і T-клітин, більшої тривалості імунітету і зменшення доз. Подібно до суцільних вірусів, вакцини PIV націлені на клітини, що презентують антиген, наприклад, дендритні клітини, стимулюють Toll-подібні рецептори (TLR) та індукують збалансований імунітет Th1/Th2. Також продемонстровано, що титри конструкцій PIV зростають до високих значень у клітинах субстрату, при незначному або відсутньому цитопатичному ефекті (ЦПЕ), стоворюючи, можливість виробництва з високим виходом продукту, і необов'язково з використанням множинних врожаїв та/або розведення інфікованих клітин субстрату. В подальшому вектори PIV за даним винаходом пропонують можливість розробки вакцин проти нефлавівірусних патогенів, проти яких на теперішній час не існує придатних вакцин. Інші особливості та переваги даного винаходу стануть очевидними з подальшого детального опису, фігур і формули винаходу. КОРОТКИЙ ОПИС ФІГУР Фіг. 1 являє собою схематичну ілюстрацію технології PIV (s-PIV) з одним компонентом. Фіг. 2 являє собою схематичну ілюстрацію технології PIV (d-PIV) з двома компонентами. Фіг. 3 являє собою схематичну ілюстрацію загального експериментального дизайну для перевірки імуногенності та ефективності PIV у мишей. Фіг. 4 являє собою графік, де порівнюється гуморальна імунна реакція, індукована PIV-WN (RV-WN), з реакцією YF/WN LAV (CV-WN) у мишей. Фіг. 5 являє собою серію графіків, що демонструють результати провокування хом'яків, імунізованих PIV-YF (RV-YF), YF17D, PIV-WN (RV-WN), і YF/WN LAV (CVWN) за допомогою Asibi, адаптованого для хом'яків (вакцини PIV-YF і YF17D) і необробленого типу WN-NY99 (вакцини PIV-WN і YF/WN LAV). Фіг. 6 являє собою таблицю, що демонструє титри вірусу YF/TBE і YF/LGT і морфологію колоній, одержаних з вказаними химерними флавівірусами. Фіг. 7 являє собою таблицю, що демонструє титри WN/TBE PIV і приклади імунофлуоресценції клітин, що містять вказані PIV. Фіг. 8 являє собою набір графіків, що демонструють кінетику реплікації YF/TBE LAV і PIVWN/TBE в лініях клітин Vero і BHK (CV-Hypr=YF/Hypr LAV; CV-LGT=YF/LGT LAV; RV 6 UA 103316 C2 5 10 15 20 25 30 35 40 45 50 55 60 WN/TBEV=PIV-WN/TBEV). Фіг. 9 являє собою серію графіків, що демонструють виживання мишей, щеплених IC з конструкціями PIV-TBE і YF/TBE LAV у випробуванні на нейровірулентність (ICR миші віком 3,5 тижнів; RV-WN/Hypr=PIV-WN/TBE(Hypr); CV-Hypr=YF/TBE(Hypr) LAV; CV-LGT=YF/LGT LAV). Фіг. 10 являє собою графік, що демонструє виживання мишей, щеплених IP з конструкціями PIV-WN/TBE(Hypr) (RV-WN/Hypr), YF/TBE(Hypr) LAV (CV-Hypr), і YF/LGT LAV (CV-LGT) та YF17D у випробуванні на нейроінвазивність (ICR миші віком 3,5 тижнів). Фіг. 11 являє собою серію графіків, що ілюструють захворюваність у мишей, вимірювану за динамікою зниження маси тіла після провокування вірусом TBE, для груп, імунізованих кандидатами s-PIV-TBE (верхній лівий графік), химерними вірусами YF/TBE і YF/LGT (верхній правий графік) і контролем (YF 17D, мертва вакцина TBE людини та імітація; нижній графік). Фіг. 12 являє собою схематичне представлення конструктів PIV, що експресують протеїн G вірусу сказу, а також ілюстрацію упакування конструктів для створення псевдоінфекційного вірусу та імунізації. Фіг. 13 являє собою схематичне представлення дизайнів вставки, що в результаті дає життєздатні/експресуючі конструкції (на прикладі протеїну G сказу). Фіг. 14 являє собою серію зображень, що демонструють результати імунофлуоресцентного аналізу і графіки, що демонструють криві росту клітин, трансфікованих вказаними конструкціями PIV-WN (∆C-сказ G, ∆PrM-E-сказ G та ∆C-PrM-E-сказ G). Фіг. 15 являє собою серію зображень, що демонструють результати імунофлуоресцентного аналізу RabG, експресованого на мембранах клітин Vero плазми, трансфікованих вказаними конструкціями PIV (∆C-сказ G, ∆PrM-E-сказ G та ∆C-PrM-E-сказ G). Фіг. 16 являє собою схематичну ілюстрацію конструкції G PIV-WN-сказу і серії зображень, що демонструють, як даний конструкт розповсюджується в клітинах-хелперах, але не в звичайних клітинах. Фіг. 17 являє собою серію графіків, що демонструють стабільність гена протеїну G сказу у векторах PIV-WN. Фіг. 18 являє собою набір зображень, що демонструють порівняння розповсюдження варіанту PIV-WN-протеїну G сказу з одним компонентом проти варіанту PIV-WN-протеїну G сказу з двома компонентами в клітинах Vero. Фіг. 19 являє собою набір зображень імунофлуоресценції, що демонструють експресію повнорозмірного білка RSV F (штам A2) за допомогою компоненту ΔprM-E d-PIV-WN в клітинаххелперах після трансфекції. ДЕТАЛЬНИЙ ОПИС ВИНАХОДУ У даному винаході пропонуються вектори псевдоінфекційного вірусу з дефектною реплікацією (PIV), у тому числі послідовності флавівірусу, які можна застосовувати в способах індукування імунітету проти гетерогенного патогену, ракових або пов'язаних з алергією імуногенів, вставлених у вектори, а також, необов'язково, самі вектори безпосередньо. У даний винахід також включені композиції, у тому числі комбінації векторів PIV та/або PIV, як описано в даному описі, і способи застосування таких композицій з метою індукування імунних реакцій проти вставлених послідовностей імуногену та/або послідовностей самих PIV безпосередньо. Крім того, у даний винахід включено конкретні PIV і живі, атенуйовані химерні флавівіруси, у тому числі послідовності вірусу кліщового енцефаліту і споріднені вектори, композиції, і способи застосування. Вектори PIV, PIV, живі атенуйовані химерні флавівіруси, композиції, а також способи за даним винаходом описані нижче. Вектори PIV і PIV Вектори PIV і PIV за даним винаходом можуть базуватися на PIV з одним або двома компонентами, що описано вище (також див. WO 2007/098267 і WO 2008/137163). Таким чином, наприклад, у випадку PIV з одним компонентом, вектори PIV і PIV можуть включати геном, у тому числі делецію великого розміру в капсидному білку, що кодує послідовності, і їх можна продукувати за допомогою доповнюючої лінії клітин, яка продукує капсидний білок у трансфікований (один компонент; фіг. 1 і фіг. 12). Відповідно до даного підходу більшість кодуючої капсид ділянки видалена, таким чином перешкоджаючи геному PIV продукувати інфекційного нащадка в здорових лініях клітин (тобто, лінії клітин, що не експресують капсидні послідовності) і у вакцинованих суб'єктів. Капсидна делеція звичайно не руйнує послідовностей РНК, які є необхідними для циклізації генома (тобто, послідовність, що кодує амінокислоти в положеннях 1-26), та/або послідовності prM, необхідної для дозрівання prM до M. У конкретних прикладах видалені послідовності відповідають послідовностям, що кодують амінокислоти 26100, 26-93, 31-100 або 31-93 протеїну C. Вектори PIV з одним компонентом і PIV можуть бути розмножені в лініях клітин, які 7 UA 103316 C2 5 10 15 20 25 30 35 40 45 50 55 60 експресують касету C або C-prM-E, де їх реплікація досягає високих рівнів. Приклади ліній клітин, що можуть бути використані для експресії векторів PIV з одним компонентом і PIV, включають BHK-21 (наприклад, ATCC CCL-10), Vero (наприклад, ATCC CCL-81), C7/10 та інші клітини хребетних тварин або москітів. Касета C або C-prM-E може експресуватися в таких клітинах за допомогою використання реплікону, який походить з вектору вірусу, наприклад реплікон альфавірусу (наприклад, реплікон, що базується на вірусі Венесуельського кінського енцефаліту (VEEV), вірусі Синдбіс, вірусі лісу Семлики (SFV), вірусі східного кінського енцефаліту (EEEV), вірусі західного кінського енцефаліту (WEEV), або вірусі Рос-Рівер). З метою зменшення можливості продуктивної рекомбінації між векторами PIV/PIV і доповнення послідовностей послідовності в репліконах (що кодують C, prM, та/або E) можуть включати мутації нуклеотидів. Наприклад, послідовності, що кодують доповнюючий протеїн C, можуть містити неприродну послідовність циклізації. Мутації можуть відбуватися через оптимізацію кодону, яка може бути додатковою перевагою при виході PIV. Крім того, у випадку доповнюючих клітин, що експресують послідовності протеїну C (а не касети C-prM-E), може бути переважним включення послідовності закріплення в карбокси-кінець протеїну C, у тому числі, наприклад, приблизно 20 амінокислот prM (див., наприклад, WO 2007/098267). Вектори PIV і PIV за даним винаходом можуть також базуватися на технології геному з двома компонентами, описаній вище. В даній технології використовують дві часткові конструкції генома, в експресії кожної не вистачає як мінімум одного білка, необхідного для продуктивної реплікації (капсидного або prM але, якщо вони присутні в одній і тій же клітині, то в результаті відбувається продукування всіх компонентів, необхідних для створення PIV. Таким чином, в одному з прикладів технології генома з двома компонентами, перший компонент включає делецію великого розміру протеїну C, як описане вище в посиланні на PIV з одним компонентом, а другий компонент включає делецію prM і E (фіг. 2 і фіг. 12). В іншому прикладі перший компонент включає делецію C, prM і E, а другий компонент включає делецію NS1 (фіг. 12). Обидва компоненти можуть містити елементи cis-діючого промотора, необхідного для реплікації РНК і повного комплекту неструктурних білків, які утворюють реплікативний ферментний комплекс. Таким чином, обидва дефектні геноми можуть містити 5’ нетрансльовану ділянку і як мінімум приблизно 60 нуклеотидів (Елемент 1) наступної, природної кодуючої білок послідовності, яка містить фрагмент амінного кінця капсидного білка. Вказана послідовність може бути завершена послідовністю розщеплення протеази, наприклад, убіхітиновою або послідовністю специфічної 2A протеази вірусу ящуру (FAMDV), що може зливатися з послідовністю, яка кодує капсидний або оболонковий (prM-E) білок. Крім того, штучні, оптимізовані за кодонами послідовності можна застосовувати з метою виключення можливості рекомбінації між двома дефектними вірусними геномами, що могло би призвести до утворення вірусів, здатних до реплікації (див., наприклад, WO 2008/137163). Застосування підходу генома з двома компонентами не потребує розробки ліній клітин, що експресують доповнюючі геноми, наприклад клітини, трансформовані репліконами, як обговорено вище в посиланні на підхід PIV з одним компонентом. Приклади ліній клітин, які можна використовувати в підході генома з двома компонентами, включають Vero (наприклад, ATCC CCL-81), BHK-21 (наприклад, ATCC CCL-10), C7/10 та інші клітини хребетних тварин або москітів. Додаткові приклади підходів d-PIV, які можна використовувати у даному винаході, базуються на застосуванні доповнюючих геномів, у тому числі делецій в послідовностях NS3 або NS5. Наприклад, в білках NS1, NS3 або NS5 можна застосовувати делецію до декілька сотень амінокислот у каркасі відкритої рамки зчитування, видаляючи суцільну вибрану послідовність білка, або тільки одну амінокислоту, що веде до інактивації ферментної активності білка (наприклад, активності РНК полімерази NS5, активності гелікази NS3 і т. п.). Альтернативно, зміни точкової амінокислоти (як мінімум одна мутація амінокислоти, або необов'язково більша кількість мутацій) можна ввести в будь-який білок NS, що веде до інактивації ферментної активності. Крім того, декілька делецій ΔNS можна комбінувати в одній молекулі хелпера. Такий же гетерогенний ген, тобто, експресований першим компонентом d-PIV, можна експресувати на місці або у комбінації з делецією(ями) NS в другому компоненті, збільшуючи кількість експресованого імуногену. Слід зазначити, що можливість вставки хелпера зростає пропорційно до розміру делеції(й) NS. Альтернативно, інший чужорідний імуноген(и) можна вставити на місці делеції(й) хелпера з метою продукування полівалентної вакцини. Крім того, додаткові підходи, які можна застосовувати при виготовленні векторів PIV і PIV для застосування у даному винаході, описані, наприклад, у WO 99/28487, WO 03/046189, WO 2004/108936, US 2004/0265338, US 2007/0249032, а також у патенті США № 7,332,322. Вектори PIV і PIV за даним винаходом можуть містити послідовності одного типу флавівірусу (наприклад, вірусів кліщового енцефаліту (TBE, наприклад, штам Hypr), вірусу 8 UA 103316 C2 5 10 15 20 25 30 35 40 45 50 55 60 Лангат (LGT), жовтої лихоманки (наприклад, YF17D), Західного Ніла, японського енцефаліту, Денге (серотип 1-4), енцефаліту Сент-Луїса, Кунджин, енцефаліту Росіо, Ільєус, центральноєвропейського енцефаліту, Сибірського енцефаліту, тайгового весінньо-літнього енцефаліту, хвороби Кьясанурського лісу, Омської геморагічної лихоманки, шотландського енцефаліту овець, вірусів Повасан, Негіши, Абсеттаров, Гансалова і Apoї) або можуть містити послідовності двох або більше різних флавівірусів. Послідовності деяких штамів вказаних вірусів легко доступні із звичайно баз даних послідовностей; послідовності інших штамів можна легко одержати за способами, добре відомими в даній галузі. У випадку векторів PIV і PIV, що містять послідовності більше ніж одного флавівірусу, послідовності можуть походити з химерного флавівірусу, як описано вище (також див., наприклад, патент США № 6,962,708; патент США № 6,696,281; і патент США № 6,184,024).У конкретних прикладах химери містять передмембранні та оболонкові послідовності одного флавівірусу (наприклад, флавівірус, імунітет до якого може бути бажаним), і капсидні та неструктурні послідовності другого, іншого флавівірусу. В одному з конкретних прикладів другий флавівірус являє собою вірус жовтої лихоманки, наприклад вакцина на базі штаму YF17D. Інші приклади включають химери YF/TBE, YF/LGT, WN/TBE, і WN/LGT, описані нижче. Інший приклад являє собою химеру LGT/TBE, створену на основі вірусу LGT, який містить білки prM-E вірусу TBE. Вакцина PIV, що базується на даній генетичній основі, була б переважної, оскільки LGT дуже ефективно реплікується in vitro і є високою мірою атенуйованою та імуногенною для людини. Таким чином, очікується, що химерна вакцина LGT/TBE PIV забезпечує здорову специфічну імунну реакцію у людини проти TBE, особливо завдяки включенню prM-E генів TBE. Вектори за даним винаходом можуть базуватися на конструкціях PIV або живих, атенуйованих химерних флавівірусах, як описано в даному описі (зокрема, YF/TBE, YF/LGT, WN/TBE, і WN/LGT; див. нижче). Застосування конструкцій PIV як векторів забезпечує конкретні переваги за певних обставин, оскільки дані конструкції за необхідністю містять делеції великого розміру, які роблять конструкції більш придатними до акомодації вставок, що як мінімум відповідають розміру видалених послідовностей, без втрати ефективності реплікації. Таким чином, вектори PIV взагалі можуть містити вставки невеликого розміру (наприклад, в інтервалі 6-10, 11-20, 21-100, 101-500, або більше залишків амінокислот, об'єднаних з делецією ∆C або іншими делеціями), а також відносно великі вставки або вставки проміжного розміру (наприклад, в інтервалі 501-1000, 1001-1700, 1701-3000 або 3001-4000 або більше залишків). На відміну від цього, в конкретних прикладах може бути переважним експресувати відносно короткі послідовності в живих атенуйованих вірусах, особливо, якщо вставки здійснені за відсутності відповідної делеції. Нижче надана додаткова інформація, що стосується сайтів вставки, які можна застосовувати у даному винаході. Крім того, як обговорюється нижче, експресія нефлавівірусних імуногенів в PIV і химерних флавівірусів за даним винаходом може приводити до утворення подвійних вакцин, які індукують захисний імунітет як проти вірусного патогена з вектором флавівірусу, так і цільового гетерогенного імуногену [наприклад, такого патогену, як бактеріальний, вірусний, паразитарний або грибковий патоген], раку або пов'язаного з алергією імуногену). Як обговорювалося вище, вектори PIV і PIV за даним винаходом можуть містити послідовності химерних флавівірусів, наприклад, химерні флавівіруси, в тому числі послідовності передмембранного і оболонкового білка першого флавівірусу (наприклад, флавівірус, до якого знайдений імунітет), капсидні і неструктурні послідовності другого, іншого флавівірусу, наприклад вірусу жовтої лихоманки (наприклад, YF17D; див. вище, а також патент США № 6,962,708; патент США № 6,696,281; і патент США № 6,184,024). Крім того, химерні флавівіруси за даним винаходом, що використовуються як джерело для конструювання PIV або як вектори вакцин/вакцини per se, можуть необов'язково містити одну або більше специфічних атенуйованих мутацій (наприклад, мутації протеїну E, мутації протеїну prM, делеції в протеїні C та/або делеції на 3’ нетрансльованій ділянці), наприклад, будь-яку з описаних у WO 2006/116182. Наприклад, делеції в протеїні C або на 3’ нетрансльованій ділянці можна безпосередньо застосовувати до химер YF/TBE або YF/LGT. Подібні делеції можна розробити і ввести в інших химерних кандидатах LAV, наприклад, у випадку геномів, що базуються на LGT/TBE, WN/TBE, і WN/LGT. Щодо мутацій протеїну E можна розробити та застосовувати атенуйовані мутації, подібні до описаних для химери YF/WN в WO 2006/116182, наприклад, базуючись на знанні кристалічної структури протеїну E (Rey et al., Nature 375(6529):291-298, 1995). Крім того, додаткові приклади атенуйованих мутацій протеїну E, описаних для вірусу TBE і інших флавівірусів, наведені у табл. 9. Їх можна ввести аналогічним чином в химерні кандидати вакцини. У даний винахід також включені нові, конкретні химерні флавівіруси, які можна 9 UA 103316 C2 5 10 15 20 25 30 35 40 45 50 55 60 застосовувати як основу для конструювання векторів PIV і PIV як вектори живого атенуйованого химерного флавівірусу, а також як вакцини проти джерел(а) передмембранного і оболонкового компонентів химер. Вказані химери містять вірус кліщового енцефаліту (TBE) або споріднені послідовності prM-E. Таким чином, химери можуть містити послідовності prM-E, наприклад, із штаму Hypr вірусу TBE або вірусу Лангат (LGT). Капсидні і неструктурні білки химер можуть включати послідовності вірусу жовтої лихоманки (наприклад, YF17D) або вірусу Західного Ніла (наприклад, NY99). Головною особливістю вказаних зразкових химер YF/TBE, YF/LGT, WN/TBE і WN/LGT є сигнальна послідовність між капсидними і prM білками. Як показано в Прикладах нижче нами виявлено, що, у випадку химер PIV, що базуються на YF, переважним є використання сигнальної послідовності, що містить послідовності вірусу жовтої лихоманки і TBE (див. нижче). В одному з прикладів сигнальна послідовність містить послідовності вірусу жовтої лихоманки на амінному кінці ділянки (наприклад, SHDVLTVQFLIL; SEQ ID NO: 1) і послідовності TBE на карбокси-кінці ділянки (наприклад, GMLGMTIA SEQ ID NO: 2), що в результаті дає послідовність SHDVLTVQFLILGMLGMTIA (SEQ ID NO: 3). Нами також виявлено, що, у випадку химер PIV, які базуються на WN, переважним є використання сигнальної послідовності, що містить послідовності TBE (наприклад, GGTDWMSWLLVIGMLGMTIA; SEQ ID NO: 4). Таким чином, у даний винахід включені химери YF/TBE, YF/LGT, WN/TBE, і WN/LGT, як PIV, так і LAV, які містять вказані вище сигнальні послідовності, або їх варіанти, що містять, наприклад, 1-8, 2-7, 36, або 4-5 замін амінокислот, делецій або вставок, які істотною мірою не перешкоджають обробці сигнальної послідовності. У різних прикладах заміни являють собою "консервативні заміни, " які характеризуються заміною одного залишку амінокислоти на інший, біологічно подібний залишок. Приклади консервативних замін включають заміну одного гідрофобного залишку, наприклад ізолейцину, валіну, лейцину або метіоніну, на інший, або заміну одного полярного залишку на інший, наприклад між аргініном і лізином, між глютаміновою і аспарагіновою кислотами або між глутаміном і аспарагіном, тощо. Додаткова інформація, що стосується вказаних химер, наведена у Прикладах нижче. Сайти вставки Послідовності, що кодують імуногени, можна вставити на одному або більше різних сайтів в межах векторів за даним винаходом. Відносно короткі пептиди можуть бути доставлені на поверхню PIV або LAV глікопротеїнів (наприклад, білки prM, E та/або NS1) та/або в контексті інших білків (для індукування в основному реакції B-клітин і T-клітин, відповідно). Інші вставки, у тому числі більші частини чужорідних білків, а також суцільні білки, можна експресувати поміж генами, на N- і C-кінцях поліпротеїну, або біцистронно (наприклад, в межах ORF під IRES або на 3’ нетрансльованій ділянці під IRES; див., наприклад, WO 02/102828, WO 2008/036146, WO 2008/094674, WO 2008/100464, WO 2008/115314, і щодо детальної інформації див. нижче). У конструкціях PIV існує додатковий варіант вставки чужорідної послідовності амінокислоти безпосередньо замість введеної делеції(й). Вставки можна здійснити, наприклад, в ΔC, ΔprM-E, ΔC-prM-E, ΔNS1, ΔNS3 та ΔNS5. Таким чином, в одному з прикладів у випадку s-PIV і компоненту ΔC d-PIV, кодуючі імуноген послідовності можна вставити на місце вилучених капсидних послідовностей. Необовязково кодуючі імуноген послідовності можна також вставити на місце вилучених послідовностей prM-E у компоненті ΔprM-E d-PIV. В іншому прикладі послідовності вставлені на місце або комбіновані з вилученими послідовностями у конструкціях ΔC-prM-E. Приклади подібних вставок розглядаються у розділі прикладів нижче. У випадку створення вставок у делеції PIV, вставки можна зробити з декількома (наприклад, 1, 2, 3, 4 або 5) додатковими, специфічними для вектора залишками на N- та/або C-кінцях чужорідного імуногену, якщо послідовність просто є злитою в каркасі (наприклад, ~20 перших амінокислот і декілька останніх залишків протеїну C, якщо послідовність заміщує делецію ΔC), або без них, якщо біля чужорідного імуногену знаходиться відповідний елемент, добре відомий фахівцям у даній галузі (наприклад, сайти розщеплення вірусними протеазами; сайти розщеплення клітинними протеазами, наприклад сигналаза, фурин та інш.; аутопротеаза; кінцевий кодон; та/або елементи IRES). Якщо білок експресується поза межами безперервного вірусного каркасу відкритої рамки зчитування (ORF), наприклад, якщо векторні і невекторні послідовності відокремлені внутрішнім сайтом входу в рибосоми (IRES), то можна досягти експресії продукту в цитоплазмі або можна спрямовувати продукт на секреторний шлях, використовуючи за бажанням відповідні сигнальні/фіксаторні сегменти. Якщо білок експресується в межах вектора ORF, то важливо розглядати розщеплення чужорідного білка з виникаючої послідовності поліпротеїнів, підтримуючи правильну топологію чужорідного білка і всіх вірусних білків (з метою гарантування життєздатності вектора), споріднених з мембраною ER, наприклад, транслокація виділених 10 UA 103316 C2 5 10 1520 25 30 35 40 45 50 55 60 білків в люмен ER, або утримання цитоплазматичних білків або пов'язаних з мембраною білків в цитоплазмі/в сполученні з мембраною ER. Детальніше, у вищеописаних підходах до виготовлення вставок можна задіяти, наприклад, відповідним чином одержані з вектору, одержані із вставки, або не зв'язані сигнальні і фіксаторні послідовності, що включені в N- і C-кінці вставок глікопротеїну. Можна застосовувати стандартні аутопротеази, наприклад аутопротеазу FMDV 2A (~20 амінокислот) або убіхітин (ген ~500 нуклеотидів), або бічні сайти розщеплення вірусною протеазою NS2B/NS3 з метою спрямування розщеплення продукту, що експресується, із зростаючого ланцюга поліпептиду для вивільнення чужорідного білка з вектора поліпротеїну і забезпечення життєздатності конструкції. Необов'язково, зростання ланцюга поліпротеїну можна завершити, використовуючи кодон термінації, наприклад, слідуючи за чужорідною вставкою гена, а синтез білків, що залишаються в конструкціях, можна ініціювати повторно шляхом інкорпорування елементу IRES, наприклад, IRES вірусу енцефаломіокардіту (EMCV), що звичайно використовують у сфері векторів вірусу РНК. Життєздатні рекомбінантні варіанти можуть бути відновлені з клітинхелперів (або звичайних клітин для версій d-PIV). Необов'язково, послідовності PIV хребетних можна реорганізувати, наприклад, якщо останнє приводить до більш ефективної експресії чужорідного гена. Наприклад, реорганізація гена застосована до вірусу TBE, в якому гени prM-E були переміщені на 3’ кінець генома під контролем IRES (Orlinger et al., J. Virol. 80:12197-12208, 2006). Транслокацію prM-E або будь-яких інших генів можна застосовувати до кандидатів вакцини на базі PIV флавівірусу і векторів експресії за даним винаходом. Додаткові деталі, що стосуються різноманітних сайтів вставки, які можна застосовувати у даному винаході, наведені далі (також див. WO 02/102828, WO 2008/036146, WO 2008/094674, WO 2008/100464, WO 2008/115314, як відзначено вище). Пептидні послідовності можна вставити в межах оболонкового білка, який є головною мішенню нейтралізуючих антитіл. Послідовності можна вставити в оболонку, наприклад, в положеннях, відповідних положенням амінокислоти 59, 207, 231, 277, 287, 340, та/або 436 оболонкового білка вірусу японського енцефаліту (див., наприклад, WO 2008/115314 і WO 02/102828). Для ідентифікації відповідних локусів в різноманітних флавівірусах послідовності вирівнюють з послідовністю вірусу японського енцефаліту. Оскільки може не бути точного підбору, слід розуміти, що у не-JE вірусах сайт вставки може варіювати, наприклад, 1, 2, 3, 4, або 5 амінокислот в будь-якому напрямку. Крім того, за умови, що ідентифікація таких сайтів є припустимою в JE, вони також можуть варіювати в JE, наприклад, 1, 2, 3, 4, або 5 амінокислот в будь-якому напрямку. Додаткові припустимі сайти можна ідентифікувати, застосовуючи відповідні способи, наприклад, транспозоний мутагенез (див., наприклад, WO 02/102828 і WO 2008/036146). Вставки можна зробити на вказаних амінокислотах шляхом вставки тільки C-кінця до вказаних амінокислот (тобто, між амінокислотами 51-52, 207-208, 231-232, 277-278, 287-288, 340-341 і 436-437), або у місці коротких делецій (наприклад, делеції довжиною 1, 2, 3, 4, 5, 6, 7 або 8 амінокислот), розпочинаючи з вказаних амінокислот (або в межах їх 1-5 положень в будь-якому напрямку). Крім оболонкового білка вставки можна зробити в інші білки вірусу, у тому числі, наприклад, у мембранний/передмембранний білок і NS1 (див., наприклад, WO 2008/036146). Наприклад, вставки можна зробити в послідовність, передуючу капсидному/передмембранному сайту розщеплення (наприклад, в положеннях -4,-2, або -1) або в межах перших 50 амінокислот передмембранного білка (наприклад, у положенні 26) та/або між амінокислотами 236 і 237 білка NS1 (або на ділянках, що оточують вказані послідовності, як описано вище). В інших прикладах вставки можна зробити поміж генами. Наприклад, вставку можна зробити між білками E і NS1 та/або між білками NS2B і NS3 (див., наприклад, WO 2008/100464). В одному прикладі вставки поміж генами вставлена послідовність може бути злита з C-кінцем протеїну E вектору, після Cкінцевої сигнальної/фіксаторної послідовності білка E, і вставка може включати C-кінцеву фіксаторну/сигнальну послідовність, яка злита з послідовностями NS1 вектора. В іншому прикладі вставки поміж генами вставлені послідовності з бічними сайтами розщеплення протеазою (наприклад, сайти розщеплення YF 17D) можна вставити в унікальний рестрикційний сайт, введений в місці з'єднання NS2B/NS3 (WO 2008/100464). В інших прикладах послідовність можна вставити у контексті внутрішньої ділянки входу в рибосому (IRES, наприклад, IRES, що походить з вірусу енцефаломіокардіту; EMCV), як відзначено вище, наприклад, вставлена на 3’ нетрансльованій ділянці (WO 2008/094674). В одному з прикладів подібного вектора, з використанням, наприклад послідовностей вірусу жовтої лихоманки, можна вставляти IRES-імуногенну касету в множинний сайт клонування, що виявляється за допомогою генної інженерії на 3’ нетрансльованій ділянці вектора, наприклад, у делеції (наприклад, делеції 136 нуклеотиду у випадку прикладу, що базується на вірусі жовтої лихоманки) після кодону зупинки поліпротеїну (WO 2008/094674). 11 UA 103316 C2 5 10 15 20 25 30 Деталі, що стосуються вставки протеїну G вірусу сказу і повнорозмірного протеїну F респіраторного синцитіального вірусу (RSV) у вектори s-PIV і d-PIV за даним винаходом, наведені у Прикладі 3 нижче. Інформація, наведена в Прикладі 3, може бути застосована в контексті інших векторів та імуногенів, описаних в даному описі. Імуногени PIV (s-PIV і d-PIV), які базуються на послідовностях флавівірусу і живих, атенуйованих химерних флавівірусів (наприклад, YF/TBE, YF/LGT, WN/TBE, і WN/LGT), як описано вище, можна застосовувати у даному винаході для доставки чужорідного (наприклад, нефлавівірусного) патогену (наприклад, вірусні, бактеріальні, грибкові і паразитарні патогени), ракових і пов'язаних з алергією імуногенів. Як обговорюється нижче, у конкретних прикладах може бути переважним компонувати декілька патогенів, що займають однакову екологічну нішу, в конкретній географічній регіон. Конкретні, необмежуючі приклади таких імуногенів наведені нижче. Крім вірусу TBE, відомо, що кліщі переносять інше основне захворювання, хворобу Лайма. Таким чином, у першому прикладі PIV за даним винаходом, наприклад PIV, що включають послідовності TBE/LGT, а також химерні флавівіруси, в тому числі послідовності TBE (наприклад, YF/TBE, YF/LGT, WN/TBE, LGT/TBE і WN/LGT; у всіх випадках, де вказаний "TBE", включений варіант використання штаму Hypr), можна застосовувати як вектори для доставки захисних імуногенів для агента, що спричиняє хворобу Лайма (кліщову спірохету Borrelia burgdorferi). Дана комбінація, спрямована на обидва інфекційних агенти (TBE і B. burgdorferi), є переважною, оскільки TBE і хвороба Лайма обидва являють собою захворювання кліщового походження. Підходи PIV можна застосовувати до химер (наприклад, YF/TBE, YF/LGT, WN/TBE або WN/LGT) за даним винаходом, а також до нехимерних вірусів TBE і LGT. Прикладом імуногену з B. burgdorferi, який використовують за даним винаходом, є OspA (Gipson et al., Vaccine 21:3875-3884, 2003). Необов'язково, для збільшення безпечності та/або імуногенності, може бути здійснена мутація OspA з метою зменшення шансів аутоімунних реакцій та/або видалення відповідних сайтів для уникнення небажаної пост-трансляційної модифікації у клітинах хребетних тварин, наприклад N-зв'язане глікозилювання, що може впливати на імуногенність продукту експресії. Мутації, що зменшують аутоімунітет, можуть включати, наприклад, мутації, описані Willett et al., Proc. Natl. Acad. Sci. U.S.A. 101:1303-1308, 2004. В одному з прикладів FTK-OspA, передбачуваний перехресно-реактивний епітоп T-клітини, Bb OspA165-173 (YVLEGTLTA; SEQ ID NO: 5) змінений для того, щоб бути подібним до послідовності відповідного пептиду Borrelia afzelli (FTLEGKVAN; SEQ ID NO: 6). У FTK-OspA відповідна послідовність являє собою FTLEGKLTA (SEQ ID NO: 7). 35 Послідовність OspA являє собою: 40 45 За даним винаходом можна використовувати повнорозмірну послідовність та/або імуногенні фрагменти повнорозмірної послідовності. Приклади фрагментів можуть включати один або більше доменів 1 (амінокислоти 34-41), 2 (амінокислоти 65-75), 3 (амінокислоти 190-220), і 4 (амінокислоти 250-270) (Jiang et al., Clin. Diag. Lab. Immun. 1(4):406-412, 1994). Наприклад, таким чином, можна доставити пептид, що містить будь-яку одну (або більше) з наступних послідовностей (які включають варіації послідовності, що можна включити до послідовності, наведеної вище, в будь-якій комбінації): Крім імуногенів B. Burgdorferi можна експресувати білки слини кліща, наприклад 64TRP, Isac 12 UA 103316 C2 5 10 15 20 25 30 35 40 і Salp20, наприклад, для генерації кандидата трьохвалентної вакцини (TBE + хвороба Лайма + кліщі). Альтернативно, білки слини кліща можна експресувати замість імуногенів B. Burgdorferi у векторах, що містять послідовність TBE. Крім того, існують численні інші кандидати-білки слини кліща, які можна використовувати для розробки вакцини кліщового вектора за даним винаходом (Francischetti et al., Insect Biochem. Mol. Biol. 35:1142-1161, 2005). Один або більше вказаних імуногенів можна експресувати в s-PIV-TBE. Однак, можна також вибрати d-PIV-TBE через його достатньо велику місткість для вставки. Крім PIV-TBE, інші вакцини PIV можна використовувати як вектори, наприклад, для захисту проти хвороби Лайма та іншого захворювання, спричиненого флавівірусом, наприклад вірусом Західного Ніла. Експресію вказаних імуногенів можна оцінити в культурі клітини, а імуногенність/захист, що досліджуються, на доступних моделях тварин (наприклад, як описано у Gipson et al., Vaccine 21:3875-3884, 2003; Labuda et al., Pathog. 2(e27):0251-0259, 2006). Імуногени інших патогенів можна експресувати аналогічно імуногенам проти хвороби Лайма і кліща з метою виготовлення кандидатів полівалентних вакцин. Приклади імуногенів слини кліща, які можна використовувати за даним винаходом, включають наступні: Додаткова інформація, що стосується TBE-споріднених PIV і LAV, наведена у Прикладі 2 нижче. Крім того, у даному винаході пропонуються PIV і LAV-векторні вакцини проти інших нефлавівірусних патогенів, у тому числі вакцини з подвійною дією, які індукують захисний імунітет як проти флавівірусу (як визначено оболонковими білками вектора), так і нефлавівірусних патогенів (як визначено імунологічним детермінантом(ами), що експресується). Вони подібні до вакцин з прикладу вакцин PIV-TBE - хвороба Лайма - кліщового вектора, описаних вище. Як згадано вище, такі вакцини з подвійною дією можуть бути створені проти широкого спектру патогенів шляхом експресії імуногенів, наприклад, з вірусних, бактеріальних, грибкових і паразитарних патогенів, а також імуногенів, пов'язаних з раком і алергією. Як конкретні необмежуючі приклади, в даному описі описано дизайн і біологічні властивості кандидатів вакцини проти сказу з вектором PIV і респіраторного синцітіального вірусу (RSV), сконструйованих шляхом експресії протеїну G вірусу сказу або повнорозмірного протеїну F RSV на місці або в комбінації з різними делеціями у PIV з одним і двома компонентами (див. Приклад 3, нижче). Як продемонстровано в Прикладах, наведених нижче, конструкції s-PIV можна переважно використовувати з метою постійної доставки відносно коротких чужорідних імуногенів (подібних до протеїну OspA збудника хвороби Лайма і білків слини кліща), оскільки вставки об'єднані з відносно короткою делецією ΔC. Вектори PIV з двома компонентами можна переважно використовувати для стабільної експресії відносно великих імуногенів, наприклад протеїну G сказу і протеїну F RSV, оскільки вставки у подібні вектори комбінують, наприклад, з делецією ΔprM-E, ΔC-prM-E, та/або ΔNS1 великого розміру. Деякі з компонентів d-PIV можна виготовляти і використовувати як вакцини самостійно, наприклад, описану нижче конструкцію PIV-RSV F, що містить делецію ΔC-prM-E. В даному випадку вакцина індукує імунну реакцію (наприклад, нейтралізуючі антитіла) в основному проти білка, що експресується, але не проти вірусного патогена вектора флавівірусу. В інших прикладах за даним винаходом подвійний імунітет 13 UA 103316 C2 5 10 15 одержують шляхом набуття імунітету, індукованого компонентами як вектора, так і вставки. Крім того, через велику місткість для вставки векторів PIV і варіанту використання геномів з двома компонентами, вектори PIV можна спрямовувати на декілька нефлавівірусних патогенів одночасно, наприклад, шляхом експресії чужорідних імуногенів двох різних нефлавівірусних патогенів у двох компонентах d-PIV. Крім протеїну F RSV, можна експресувати протеїн G сказу, захисні імуногени хвороби Лайма і білки слини кліща як приклади чужорідних імуногенів, описаних вище, та інші чужорідні імуногени, спрямовуючи вакцини проти відповідних захворювань, у тому числі, наприклад, імуногенів вірусу грипу типу А і B. В даних прикладах можна використовувати декілька коротких епітопів та/або суцільні гени білків вірусних частинок, наприклад, гени M2, HA і NA грипу А та/або гени NB або BM2 грипу B. Також можна використовувати коротші фрагменти M2, NB і BM2, наприклад, відповідні M2e, позаклітинний фрагмент M2. Крім того, можна використовувати фрагменти гена HA, у тому числі епітопи, ідентифіковані як HA0 (довжиною 23 амінокислоти, відповідні сайту розщеплення в HA). Конкретні приклади пов'язаних з грипом послідовностей, які можна застосовувати у даному винаході, включають і 20 25 30 35 40 45 50 Додаткові послідовності M2e, які можна використовувати за даним винаходом, включають послідовності з позаклітинного домену протеїну BM2 грипу B (послідовність MLEPFQ (SEQ ID NO: 25), наприклад, LEPFQILSISGC (SEQ ID NO: 26)), і пептиду M2e пташиного грипу H5N1 (MSLLTEVETLTRNGWGCRCSDSSD (SEQ ID NO: 27)). Інші приклади імуногенів патогену, які можуть бути доставлені у вектори за даним винаходом, включають оптимізовані за кодонами гени SIV або ВІЛ gag (55 кДа), gp120, gp160, SIV mac239-rev/tat/nef або аналоги з ВІЛ та інші імуногени ВІЛ; імуногени з вірусів HPV, наприклад HPV16, HPV18 і т.п., наприклад, капсидний білок L1, який сам по собі збирається у HPV-подібні частинки, капсидний білок L2 або його імунодомінатні частини (наприклад, амінокислоти 1-200, 1-88 або 17-36), протеїни E6 і E7, які залучені до перетворення та імморталізації ссавцевих клітин, злитих разом і відповідно мутованих (злиття двох генів створює злитий білок, такий як E6E7Rb-, тобто він на 10 порядків менше здатний до перетворення фібробластів і мутацій компоненту E7 в 2-х залишках, що в результаті дає мутант злитого білка, нездатний до індукування перетворення (Boursnell et al., Vaccine 14:1485-1494, 1996). Інші імуногени включають захисні імуногени HCV, CMV, HSV2, віруси, збудник малярії, Mycobacterium tuberculosis, що спричиняє туберкульоз, C. difficile та інші нозосоміальні інфекції, відомі в даній галузі, а також грибкові патогени, імуногени раку і білки, пов'язані з алергією, які можна використовувати як мішені для вакцин. Вставки чужорідного імуногену за даним винаходом можна модифікувати різноманітними шляхами. Наприклад, застосовують оптимізацію за кодонами для збільшення рівня експресії і виключення довгих повторів у послідовностях нуклеотидів з метою підвищення стабільності вставки в геномі РНК векторів PIV. Імуногенність можна підвищити за допомогою химеризації білків за допомогою імуностимулюючих фрагментів, добре відомих в даній галузі, наприклад, агоністів TLR, стимулюючі цитокіни, компоненти комплементу, білки теплового шоку та інші (наприклад, розглянуті в "Immunopotentiators in Modern Vaccines, ” Schijns and O'Hagan Eds., 2006, Elsevier Academic Press: Amsterdam, Boston). Щодо конструкції подвійних вакцин проти сказу та інших захворювань, спричинених флавівірусом, можуть представляти інтерес також інші комбінації, наприклад TBE + сказ, YF + сказ і т. п., як для медичного, так і для ветеринарного застосування у відповідних географічних регіонах, і, отже, їх можна генерувати аналогічним чином. Можливі дизайни конструкцій експресії не обмежені описаними в даному описі конструкціями. Наприклад, можна модифікувати делеції та вставки, можна реорганізувати генетичні елементи, або інші генетичні елементи (наприклад нефлавівірусні, несказові сигнали для секреції, детермінантів внутрішньоклітинної доставки, включення або злиття імуностимулюючих фрагментів, наприклад 14 UA 103316 C2 5 10 15 20 25 30 35 40 45 50 55 60 цитокінів, агоністи TLR, наприклад флагелін, компоненти полимеризації, наприклад, лейциновий зіпер, і пептиди, які збільшують період знаходження білка в кровотоку) можна використовувати для полегшення презентації антигену і підвищення імуногенності. Крім того, таке конструювання можна застосовувати до кандидатів вакцини s-PIV і d-PIV, що базуються на геномах вектора інших флавівірусів і експресують імуногени інших патогенів, наприклад, включаючи, але не обмежуючись ними, патогени, описані в даному описі. Інші приклади векторів PIV і LAV за даним винаходом включають комбіновані вакцини, наприклад, вірус DEN + вірус чикунгунья (CHIKV) і YF+CHIKV. CHIKV, альфавірус, ендемічний для Африки, південно-східної Азії, індійського субконтиненту, а також для Островів і островів Тихого океану і займає екологічні/географічні ніші разом з YF і DEN1-4. Вказані комбінації спричиняють серйозне захворювання, що перш за все супроводжується сильним болем (артрит, інші симптоми, подібні до DEN) і спричиняє довготривалі наслідки у більшості пацієнтів (Simon et al., Med. Clin. North Am. 92:1323-1343, 2008; Seneviratne et al., J. Travel Med. 14:320-325, 2007). Інші приклади векторів PIV і LAV за даним винаходом включають YF+Ebola або DEN+Ebola, які супутньо циркулюють в Африці. Імуногени для вищезгаданих нефлавівірусних патогенів, послідовності яких добре відомі у даній галузі, можуть містити глікопротеїн B або злитий білок pp65/IE1 CMV (Reap et al., Vaccine 25(42):7441-7449, 2007; і посилання в даному описі), декілька білків TB (розглядається у Skeiky et al., Nat. Rev. Microbiol. 4(6):469-476, 2006), антигени, збудника малярії, наприклад RTS, S (доеритроцитний білок спорозоїту, CSP) та інші (наприклад, розглядаються у Li et al., Vaccine 25(14):2567-2574, 2007), оболонкові білки E1 і E2 CHIKV (або касети C-E2-E1, E2-E1), структурні білки C-E1-E2 HCV, що утворюють VLP (Ezelle et al., J. Virol. 76(23):12325-12334, 2002) або інші білки для індукування реакцій T-клітин, глікопротеїн GP вірусу Ебола (Yang et al., Virology 377(2):255-264, 2008). Крім імуногенів, описаних вище, вектори, описані в даному описі, можуть включати один або більше імуноген(ів), що походять з або спрямовують імунну реакцію проти одного або більше вірусів (наприклад, вірусний антиген(и) мішені), у тому числі, наприклад, вірусу з двохланцюговою ДНК (наприклад, аденовірус, вірус герпесу, вірус Епштейна-Барр, вірус простого герпесу типу 1, вірус простого герпесу типу 2, вірус простого герпесу типу 8 людини, цитомегаловірус людини, вірус вітряної віспи, поксивірус); вірус з одноланцюговою ДНК (наприклад, парвовірус, вірус папіломи (наприклад, E1, E2, E3, E4, E5, E6, E7, E8, BPV1, BPV2, BPV3, BPV4, BPV5 і BPV6 (у Papillomavirus and Human Cancer, під редакцією H. Pfister (CRC Press, Inc. 1990)); Lancaster et al., Cancer Metast. Rev. pp. 6653-6664, 1987; Pfister et al., Adv. Cancer Res. 48:113-147, 1987)); віруси з двохланцюговою РНК (наприклад, реовірус); віруси з (+) одноланцюговою РНК (наприклад, пікорнавірус, вірус Коксаки, вірус гепатиту А, вірус поліомієліту, тогавірус, вірус краснухи, флавівірус, вірус гепатиту C, вірус жовтої лихоманки, вірус Денге, вірус Західного Ніла); віруси з (-) одноланцюговою РНК (наприклад, ортоміксовірус, вірус грипу, рабдовірус, параміксовірус, вірус кору, вірус епідемічного паротиту, вірус парагрипу, вірус сказу); віруси з одноланцюговою РНК-зворотною транскриптазою (наприклад, ретровірус, вірус імунодефіциту людини (ВІЛ)); і віруси з двохланцюговою ДНК-зворотною транскриптазою (наприклад, гепаднавірус, вірус гепатиту B). Імуногени можуть також походити з інших вірусів, не згаданих вище, але доступних фахівцям у даній галузі. Стосовно ВІЛ, імуногени можна вибрати з будь-якого штаму ВІЛ. Як добро відомо фахівцям у даній галузі, на теперішній час штами ВІЛ класифікують на дискретні генетичні підтипи. Відомо, що ВІЛ-1 підрозділяється як мінімум на десять підтипів (А, B, C, D, E, F, G, H, J і K). Відомо, що ВІЛ-2 включає як мінімум п'ять підтипів (А, B, C, D і E). Підтип B пов'язаний з ВІЛ, епідемічним у гомосексуальних чоловіків і споживачів внутрішньовенних наркотиків у всьому світі. Більшість імуногенів ВІЛ-1, лабораторні штами, реактиви і епітопні карти належать до підтипу B. В Африці південніше Сахари, Індії і Китаї, у регіонах з високою зустрічальністю нових випадків інфікування ВІЛ, підтип ВІЛ-1 B складає тільки невелику долю випадків інфекції, а ВІЛ-1 підтипу C, виявляється найбільш поширеним підтипом. Таким чином, в конкретних варіантах, ймовірно, буде бажаним вибирати імуногени з підтипів B та/або C ВІЛ-1. Можливо, бажаним буде включити імуногени з множинних підтипів ВІЛ (наприклад, ВІЛ-1 підтипи B і C, ВІЛ-2 підтипи А і B, або комбінації підтипів ВІЛ-1 і ВІЛ-2) в одну імунологічну композицію. Придатні імуногени ВІЛ включають ENV, GAG, POL, NEF, а також, наприклад, їх варіанти, похідні і злиті білки. Імуногени можуть також походити з або спрямовувати імунну реакцію проти одного або більше видів бактерій (наприклад, бактеріальні антиген(и) мішені), у тому числі, наприклад, види Bacillus (наприклад, Bacillus anthracis), види Bordetella (наприклад, Bordetella pertussis), види Borrelia (наприклад, Borrelia burgdorferi), види Brucella (наприклад, Brucella abortus, Brucella 15 UA 103316 C2 5 10 15 20 25 30 35 40 45 50 55 60 canis, Brucella melitensis, Brucella suis), види Campylobacter (наприклад, Campylobacter jejuni), види Chlamydia (наприклад, Chlamydia pneumoniae, Chlamydia psittaci, Chlamydia trachomatis), види Clostridium (наприклад, Clostridium botulinum, Clostridium difficile, Clostridium perfringens, Clostridium tetani), види Corynebacterium (наприклад, Corynebacterium diptheriae), види Enterococcus (наприклад, Enterococcus faecalis, enterococcus faecum), види Escherichia (наприклад, Escherichia coli), види Francisella (наприклад, Francisella tularensis), види Haemophilus (наприклад, Haemophilus influenza), види Helicobacter (наприклад, Helicobacter pylori), види Legionella (наприклад, Legionella pneumophila), види Leptospira (наприклад, Leptospira interrogans), види Listeria (наприклад, Listeria monocytogenes), види Mycobacterium (наприклад, Mycobacterium leprae, Mycobacterium tuberculosis), види Mycoplasma (наприклад, Mycoplasma pneumoniae), види Neisseria (наприклад, Neisseria gonorrhea, Neisseria meningitidis), види Pseudomonas (наприклад, Pseudomonas aeruginosa), види Rickettsia (наприклад, Rickettsia rickettsii), види Salmonella (наприклад, Salmonella typhi, Salmonella typhinurium), види Shigella (наприклад, Shigella sonnei), види Staphylococcus (наприклад, Staphylococcus aureus, Staphylococcus epidermidis, Staphylococcus saprophyticus, коагулаза-негативний стафілокок (наприклад, патент США № 7,473,762)), види Streptococcus (наприклад, Streptococcus agalactiae, Streptococcus pneumoniae, Streptococcus pyrogenes), види Treponema (наприклад, Treponema pallidum), види Vibrio (наприклад, Vibrio cholerae) і види Yersinia (Yersinia pestis). Імуногени можуть також походити з або спрямовувати імунну реакцію проти інших видів бактерій, не згаданих вище, але доступних фахівцям у даній галузі. Імуногени можуть також походити з або спрямовувати імунну реакцію проти одного або більше паразитарних організмів (наприклад, антиген(и) мішені паразитів), наприклад, у тому числі види Ancylostoma (наприклад, A. duodenale), види Anisakis, Ascaris lumbricoides, Balantidium coli, види Cestoda, види Cimicidae, Clonorchis sinensis, Dicrocoelium dendriticum, Dicrocoelium hospes, Diphyllobothrium latum, види Dracunculus, види Echinococcus (наприклад, E. granulosus, E. multilocularis), Entamoeba histolytica, Enterobius vermicularis, види Fasciola (наприклад, F. hepatica, F. magna, F. gigantica, F. jacksoni), Fasciolopsis buski, види Giardia (Giardia lamblia), види Gnathostoma, види Hymenolepis (наприклад, H. nana, H. diminuta), види Leishmania, Loa loa, види Metorchis (M. conjunctus, M. albidus), Necator americanus, види Oestroidea (наприклад, ґедзь), види Onchocercidae, види Opisthorchis (наприклад, O. viverrini, O. felineus, O. guayaquilensis та O. noverca), види Plasmodium (наприклад, P. falciparum), Protofasciola robusta, Parafasciolopsis fasciomorphae, Paragonimus westermani, види Schistosoma (наприклад, S. mansoni, S. japonicum, S. mekongi, S. haematobium), Spirometra erinaceieuropaei, Strongyloides stercoralis, види Taenia (наприклад, T. saginata, T. solium), види Toxocara (наприклад, T. canis, T. cati), види Toxoplasma (наприклад, T. gondii), Trichobilharzia regenti, Trichinella spiralis, Trichuris trichiura, види Trombiculidae, види Trypanosoma, види Tunga penetrans та/або Wuchereria bancrofti. Імуногени можуть також походити з або спрямовувати імунну реакцію проти інших паразитарних організмів, не згаданих вище, але доступних фахівцям у даній галузі. Імуногени можуть також походити з або спрямовувати імунну реакцію проти антигенів мішені пухлини (наприклад, антигени мішені пухлини). Під терміном "антиген мішені пухлини" (AМ) можна розуміти як пов'язані з пухлиною антигени (ППА), так і специфічні для пухлини антигени (СПА), де ракова клітина являє собою джерело антигену. AМ може являти собою антиген, що експресується на поверхні клітини пухлини у кількостях більших, ніж спостерігаються для звичайних клітин, або антиген, який експресується на звичайних клітинах протягом ембріонального розвитку. СПА звичайно являє собою антиген, який є унікальним для клітин пухлини і не експресується на звичайних клітинах. Звичайно AМ класифікують за 5 категоріями у відповідності до характеру їх експресії, функції або генетичного походження: антигени раку яєчка (CT) (тобто, MAGE, NY-ESO-1); антигени диференціації меланоцитів (наприклад, Melan A/MART-1, тирозиназа, gp100); мутаційні антигени (наприклад, MUM-1, p53, CDK-4); аутоантигени, що надмірно експресуються (наприклад, HER-2/neu, p53); і вірусні антигени (наприклад, HPV, EBV). Придатні AМ включають, наприклад, gp100 (Cox et al., Science 264:716719, 1994), MART-1/Melan A (Kawakami et al., J. Exp. Med., 180:347-352, 1994), gp75 (TRP-1) (Wang et al., J. Exp. Med., 186:1131-1140, 1996), тирозиназу (Wolfel et al., Eur. J. Immunol., 24:759-764, 1994), NY-ESO-1 (WO 98/14464; WO 99/18206), протеогликан (Hellstrom et al., J. Immunol., 130:1467-1472, 1983), родинні антигени MAGE (наприклад, MAGE-1, 2, 3, 4, 6 та; 12; Van der Bruggen et al., Science 254:1643-1647, 1991; патент США № 6,235,525) родинні антигени BAGE (Boel et al., Immunity 2:167-175, 1995), родинні антигени GAGE (наприклад, GAGE-1,2; Van den Eynde et al., J. Exp. Med. 182:689-698, 1995; патент США № 6,013,765) родинні антигени RAGE (наприклад, RAGE-1; Gaugler et al., Immunogenetics 44:323-330, 1996; патент США 16 UA 103316 C2 5 10 15 20 25 30 35 40 45 50 55 60 №5,939,526) N-ацетилглюкозамінилтрансферазу-V (Guilloux et al., J. Exp. Med. 183:1173-1183, 1996), p15 (Robbins et al., J. lmmunol. 154:5944-5950, 1995), ß-катенін (Robbins et al., J. Exp. Med., 183:1185-1192, 1996), MUM-1 (Coulie et al., Proc. Natl. Acad. Sci. U.S.A. 92:7976-7980, 1995), циклін-залежну кіназу-4 (CDK4) (Wolfel et al., Science 269:1281-1284, 1995), p21-ras (Fossum et al., Int. J. Cancer 56:40-45, 1994), BCR-abl (Bocchia et al., Blood 85:2680-2684, 1995), p53 (Theobald et al., Proc. Natl. Acad. Sci. U.S.A. 92:11993-11997, 1995), p185 HER2/neu (erb-B1; Fisk et al., J. Exp. Med., 181:2109-2117, 1995), рецептор епідермального фактора росту (РЕФР) (Harris et al., Breast Cancer Res. Treat, 29:1-2, 1994), карциномоембріональні антигени (КЕА) (Kwong et al., J. Natl. Cancer Inst., 85:982-990, 1995) патенти США № 5,756,103; 5,274,087; 5,571,710; 6,071,716; 5,698,530; 6,045,802; EP 263933; EP 346710; і EP 784483; пов'язані з карциномою мутантні муцини (наприклад, генні продукти MUC-1; Jerome et al., J. Immunol., 151:1654-1662, 1993); EBNA генні продукти EBV (наприклад, EBNA-1; Rickinson et al., Cancer Surveys 13:53-80, 1992); протеїни E7 і E6 вірусу папіломи людини (Ressing et al., J. Immunol. 154:5934-5943, 1995); простата-специфічний антиген (PSA; Xue et al., The Prostate 30:73-78, 1997); простата-специфічний мембранний антиген (PSMA; Israeli et al., Cancer Res. 54:18071811, 1994); ідіотипичні епітопи або антигени, наприклад, ідіотипи імуноглобуліну або ідіотипи рецептору T-клітини (Chen et al., J. Immunol. 153:4775-4787, 1994); KSA (патент США № 5,348,887), кінезин 2 Dietz, et al., Biochem. Biophys. Res. Commun. 275(3):731-738, 2000), HIP-55, анти-апоптотичний TGFβ-1 (Toomey et al., Br. J. Biomed. Sci. 58(3):177-183, 2001), пухлинний протеїн D52 (Bryne et al., Genomics 35:523-532, 1996), H1FT, NY-BR-1 (WO 01/47959), NY-BR-62, NY-BR-75, NY-BR-85, NY-BR-87 та NY-BR-96 (Scanlan, M. Serologic and Bioinformatic Approaches to the Identification of Human Tumor Antigens, у Cancer Vaccines 2000, Cancer Research Institute, New York, NY), та/або антигени раку підшлункової залози (наприклад, послідовність ІД №: 1-288 патенту США № 7,473,531). Імуногени можуть також походити з або спрямовувати імунну реакцію проти AМ, не згаданих вище, але доступних фахівцям у даній галузі. Крім конкретних послідовностей імуногену, наведених вище, у даному винаході також розглядається застосування аналогів вказаних послідовностей. Такі аналоги включають послідовності, які, наприклад, є ідентичними як мінімум на 80 %, 90 %, 95 %, або 99 % стандартним послідовностям або їх фрагментам. Вказані аналоги також включають фрагменти стандартних послідовностей, які містять, наприклад, один або більше імуногенних епітопів даних послідовностей. Крім того, вказані аналоги включають вкорочення або подовження даних послідовностей (наприклад, вставку додаткових/повторюваних імунодомінантних епітопів або епітопів-хелперів) за допомогою, наприклад, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11-20, тощо амінокислот на одному або обох кінцях. При вкороченні можуть бути видалені незначні з імунологічної точки зору або перешкоджаючі послідовності, наприклад, у межах відомих структурних/імунологічних доменів, або між доменами; або можна вилучити суцільні небажані домени; подібні модифікації можуть знаходитися у межах 21-30, 31-50, 51-100, 101-400, тощо амінокислот. Модифікації також відбуваються, наприклад, у межах 20-400, 30-100 і 50-100 амінокислот. Коктейлі До даного винаходу також включені композиції, у тому числі суміші двох або більше PIV та/або векторів PIV, як описано в даному описі. Як обговорено вище, використання подібних сумішей або коктейлів може бути особливо переважним, якщо бажано індукувати імунітет до більш, ніж одного імуногену та/або патогена. Це може бути корисним, наприклад, при вакцинації проти різних флавівірусів, що можуть бути ендемічними для регіону, де проживає людина, якій вводять вакцину. Це також може бути корисним у контексті введення множинних імуногенів проти однакової мішені. Необмежуючі приклади коктейлів PIV, що входять до даного винаходу, включають PIVJE+PIV-DEN, і PIV-YF+PIV-DEN. В обох вказаних прикладах PIV для одного або обох компонентів можуть являти собою PIV з одним або двома компонентами, як описано вище. Крім того, у випадку PIV-DEN, PIV може включати послідовності тільки одного серотипу Денге, вибраного з групи, що складається з серотипів Денге 1-4, або коктейль може включати PIV, що експресує послідовності з двох, трьох або всіх чотирьох серотипів. Також вакцини білка TBE/Borrelia burgdorferi/ слини кліща (наприклад, 64TRP, Isac, Salp20), описані в даному описі, можуть базуватися на включенні різних імуногенів в межах одного PIV або живого атенуйованого флавівірусу, або можуть базуватися на сумішах PIV (або LAV), кожна з яких включає один або більше імуногенів. Рецептуру коктейлів за даним винаходом можна створити таким чином або можна змішати компоненти безпосередньо перед введенням. Застосування, рецептура і введення До даного винаходу включені вектори PIV, PIV, вектори LAV і LAV, а також відповідні композиції молекул нуклеїнових кислот, фармацевтичні композиції або композиції вакцин і 17 UA 103316 C2 5 10 15 20 25 30 35 40 45 50 55 60 способи їх застосування та одержання. Вектори PIV, PIV, вектори LAV і LAV за даним винаходом можна застосовувати, наприклад, у способах вакцинації з метою індукування імунної реакції проти TBE або іншого флавівірусу, та/або іншого імуногену, що експресується, як описано в даному описі. Вказані способи можуть бути профілактичними, якщо їх проводять на суб'єктах (наприклад, суб'єкти - людина або інші ссавці), які не інфіковані, але знаходяться у зоні ризику розвитку інфекції або захворювання, спричиненого TBE або іншим флавівірусом та/або патогеном, з якого одержаний інший імуноген, що експресується. Способи можуть також бути терапевтичними, у випадку, якщо їх проводять на суб'єктах, вже інфікованих одним або більше відповідних патогенів. Крім того, віруси і вектори можна використовувати індивідуально або в комбінації один з одним або іншими вакцинами. Суб'єкти, яких лікують у відповідності до способів за даним винаходом, включають людину, а також ссавців-тварин (наприклад, таких сільськогосподарських тварин, як велика рогата худоба, свині, коні, вівці та кози, і домашніх тварин, наприклад собак і котів). Композицію векторів PIV, PIV, векторів LAV і LAV за даним винаходом можна одержати, застосовуючи способів, які є стандартними в даній галузі. Численні фармацевтично прийнятні розчини для застосування при одержанні вакцини добре відомі, і фахівці, які працюють в даній галузі, можуть легко пристосувати їх для використання в даному винаході (див., наприклад, th Remington's Pharmaceutical Sciences (18 edition), ed. A. Gennaro, 1990, Mack Publishing Co., Easton, PA). В двох конкретних прикладах вектори PIV, PIV, вектори LAV і LAV поєднують в композиції з сіллю мінімального основного середовища Ігла (MEME), що містить 7,5 % лактози і 2,5 % альбуміну сироватки людини, або MEME, що містить 10 % сорбіту. Однак, вектори PIV, PIV, вектори LAV і LAV можна просто розбавити у фізіологічно прийнятному розчині, наприклад стерильному фізіологічному розчині солі або стерильному буферному сольовому розчині. Вектори PIV, PIV, вектори LAV і LAV за даним винаходом можна вводити, застосовуючи способи, які добре відомі в даній галузі, і фахівці, які працюють в даній галузі, можуть легко визначити відповідні кількості вірусів і векторів, необхідні для введення. Те, що необхідно визначити як відповідну кількість вірусу для введення, можна визначити, розглядаючи такі фактори, як, наприклад, розміри і загальний стан здоров'я суб'єкта, якому слід вводити вірус. Наприклад, у випадку живих, атенуйованих вірусів за даним винаходом віруси можуть бути 2 8 введені в композицію у вигляді стерильного водного розчину, що містить від 10 до 10 , 3 7 наприклад, 10 -10 інфекційних одиниць (наприклад, одиниці, що утворюють бляшки або інфекційні дози культури тканини) в об'ємі дози 0,1-1,0 мл. PIV можна вводити в подібних дозах і в подібних об'ємах; однак, титри PIV звичайно вимірюють, наприклад, в колонієутворюючих одиницях, визначених шляхом імунозабарвлення колоній, оскільки дані дефектні конструкції не 2 8 схильні до утворення вірусоподібних бляшок. Дози можуть варіюватися у межах 10 і 10 КУО і бути введені в об'ємах 0,1-1,0 мл. Всі віруси і вектори за даним винаходом можна вводити, наприклад, внутрішньошкірно, підшкірно, внутрішньом'язово, внутрішньочеревинно або перорально. У конкретних прикладах введення в дендритні клітини відбувається внутрішньошкірно або крізьшкірно, із застосуванням, наприклад, пристрою для шкірних мікроін'єкцій або мікроголки. Крім того, вакцини за даним винаходом можна вводити у вигляді однієї дози або, необов'язково, можна застосувати введення початкової дози з наступною повторною імунізацією, яку проводять, наприклад, через 2-6 місяці, і прийнятність якої визначають фахівці в даній галузі. Необов'язково, вакцини PIV можна вводити шляхом імунізації ДНК або РНК, застосовуючи способи, відомі фахівцям в даній галузі (Chang et al., Nat. Biotechnol. 26:571-577, 2008; Kofler et al., Proc. Natl. Acad. Sci. U.S.A. 101:1951-1956, 2004). Необов'язково, можна застосовувати ад'юванти, відомі фахівцям в даній галузі, при введенні вірусів і векторів за даним винаходом. Ад'юванти, які можна застосовувати для підсилення імуногенності вірусів, включають, наприклад, ліпосомальні композиції, такі синтетичні ад'юванти, як (наприклад, QS21) мураміл дипептид, монофосфорилліпід А, поліфосфазин, олігонуклеотиди CpG або інші молекули, дія яких, ймовірно, здійснюється шляхом активізації молекул Toll-подібного рецептора (TLR) на поверхні клітин або на ядерних мембранах усередині клітин. Хоча вказані ад'юванти звичайно використовують для підсилення імунних реакцій на інактивовані вакцини, їх також можна застосовувати з живими вакцинами або вакцинами з дефектною реплікацією. Як агоністи TLR, так і антагоністи можуть бути придатними у випадку живих вакцин або вакцин з дефектною реплікацією. Для експресії агоністів TLR можна створювати вакцини-кандидати. У випадку вірусу, введеного крізь слизову оболонку, наприклад, перорально, можна використовувати як ад'юванти слизові ад'юванти, наприклад термічно нестійкий токсин E. coli (LT) або мутантні похідні LT. Крім того, можна вставляти гени, що кодують цитокіни, які володіють ад'ювантною активністю, у вакцини-кандидати. Таким чином, 18 UA 103316 C2 5 10 15 20 25 30 35 40 45 50 55 60 гени, що кодують бажані цитокіни, наприклад, GM-CSF, IL-2, IL-12, IL-13, IL-5 і т. п., можна вставляти разом з чужорідними генами імуногену для продукування вакцини, що приводить до підсилення імунних реакцій, або модулювання імунітету, спрямованого більш конкретно на клітинні, гуморальні або слизові реакції (наприклад, розглянутий у "Immunopotentiators in Modern Vaccines", Schijns and O'Hagan Eds., 2006, Elsevier Academic Press: Amsterdam, Boston, etc.). Необов'язково, можна застосовувати над місцем ін'єкції бляшку, що містить шар відповідного ад'юванту, одержаного з токсину. Токсин забезпечує місцеве запалення, що залучає лімфоцити, приводячи до більш здорової імунної реакції. Приклади Більше детально даний винахід розглядається в Прикладах нижче. У Прикладах описані експерименти, в яких досліджуються PIV, що базуються на вірусах WN, JE і YF (див., наприклад, WO 2007/098267 і WO 2008/137163). По-перше, нами продемонстровано, що конструкції є істотною мірою більш атенуйованими на чутливій моделі нейровірулентності новонароджені миші(нульова смертність при всіх перевірених дозах) в порівнянні з доступними засобами контролю LAV (YF 17D, YF/JE LAV, і YF/WN LAV). Нами вперше продемонстровано, що конструкції d-PIV були авірулентними на даній моделі, і, таким чином, що PIV з двома компонентами не зазнають безконтрольного (необмеженого) розповсюдження in vivo і не можуть спричиняти клінічних симптомів. По-друге, нами здійснено порівняння імуногенності та ефективності PIV і LAV і продемонстровано, що вакцини PIV можуть індукувати імунну реакцію, порівнянну з LAV і бути однаково ефективними (наприклад, як спостерігається для пари вакцин PIV-WN і YF/WN LAV). В одній з досліджуваних пар YF 17D LAV був істотною мірою більш імуногенним, ніж PIV-YF. Таким чином, продукування VLP може варіюватися поміж різними, подібним чином сконструйованими конструкціями PIV. Конкретно, ми припускаємо, що PIV-YF не генерує великої кількості YF VLP у порівнянні з PIV-WN (WN VLP), і що підвищене продукування VLP може бути забезпечене шляхом генетичних модифікацій на з'єднанні C/prM в субоптимальних конструкціях PIV. Конкретно, з'єднання C/prM являє собою важливий сайт в поліпротеїні флавівірусу, що координує утворення вірусного оболонки і синтез вірусних білків (Yamshchikov and Compans, Virology 192:38-51, 1993; Amberg and Rice, J. Virol. 73:8083-8094, 1999; Stocks and Lobigs, J. Virol. 72:2141-2149, 1998). Запропоновано, що секрецію VLP в інфікованих PIV клітинах (на відміну від продукування вірусних частинок в суцільних вірусах) можна збільшити за допомогою роз'єднання сайтів розщеплення вірусною протеазою і сигналазою на ділянці з'єднання, або шляхом застосування потужного гетерогенного сигнального пептиду (tPA і т. п.) замість сигналу для prM, або мутагенезу сигналу для prM. Ефективність розщеплення сигналазою на з'єднанні C/prM флавівірусу є низькою (Stocks and Lobigs, J. Virol. 72:2141-2149, 1998), наприклад, як передбачено он-лайн програмою SignalP 3.0. Очікується, що більш висока ефективність розщеплення може бути забезпечена шляхом аналізу конкретних замін амінокислот біля сайту розщеплення за допомогою SignalP 3.0 (наприклад, як описано в заявці WO 2008/100464), з наступною інкорпорацією вибраної мутації(й) в геноми PIV, одержанням нащадка PIV і вимірюванням секреції VLP. Нефлавівірусні сигнали вставляють за допомогою стандартних способів, відомих у даній галузі. Роз'єднання розщеплення вірусною протеазою і сигналазою можна досягнути, видаляючи вірусний сайт розщеплення за допомогою будь-якої неконсервативної мутації (наприклад, RRS в YF17D C до RRA або GRS або RSS і т.п.), або делеції повного сайту або деяких з його 3 залишків. При необхідності, можна досягнути утворення вільного N-кінця сигналу чужорідного білка, застосовуючи такі елементи, як аутопротеаза або кодон термінації з наступним IRES. Альтернативно, природний кодон ініціювання AUG C можна видалити (у конструкціях, де послідовність протеїну C не потрібна, наприклад, ∆C PIV), і AUG розмістити перед чужорідним геном. Оптимізацію сигналу вектора можна здійснювати сліпим мутагенезом, наприклад, вставкою синтетичної рандомізованої послідовності, з наступною ідентифікацією життєздатних варіантів PIV із підвищеною секрецією VLP. Нами також виявлено, що конструкції PIV є істотною мірою більш імуногенними у хом'яків при їх внутрішньочеревинному введенні в порівнянні з підшкірним введенням. Зроблено висновок, що це відбувається, ймовірно, через кращу спрямованість антигену, що презентує клітини в лімфоїдних тканинах, яких багато в черевинній порожнині, але небагато в підшкірних тканинах. Базуючись на даних спостереженнях, нами зроблено висновок, що ефективне націлювання PIV на дендритні клітини, яких багато в шкірі, можна забезпечити за допомогою проведення щеплення через шкіру, наприклад, через шкірні мікроін'єкції або внутрішньошкірну ін'єкцію із застосуванням мікроголок (Dean et al., Hum Vaccin. 1:106-111, 2005). Крім того, нами проведено експерименти з метою продемонструвати придатність для введення сумішей або коктейлів, різних PIV, наприклад PIV, що описані в даному описі 19 UA 103316 C2 5 10 15 20 25 30 35 40 45 50 55 60 (наприклад, JE+DEN і YF+DEN). Для введення коктейлів важливо перевірити відсутність будьякої інтерференції між супутньо введеними компонентами, а також збалансованість індукованої імунної реакції. Для імунізації гризунів застосовували декілька сумішей PIV, і порівнювали імунні реакції з конструкціями PIV, які вводили індивідуально. Не спостерігалося інтерференції в суміші, і, таким чином, вакцини-коктейлі PIV є придатними. Вказані композиції можуть бути особливо важливими в географічних регіонах, де одночасно циркулюють різні флавівіруси. Їх також можна застосовувати для одночасного введення декількох вакцин, які базуються на PIV, проти нефлавівірусних патогенів. Крім того, продемонстровано, що реакція у формі нейтралізуючих антитіл не індукується проти пакувальної оболонки як мінімум після введення двох доз PIV (і, таким чином, антитіла виявлені проти VLP, що виділяються з інфікованих клітин). Це було продемонстровано при використанні хелпера (ΔprM-E) компоненту d-PIV (див. фіг. 2), упакованого індивідуально, або шляхом вимірювання вмісту нейтралізуючих антитіл до гетерогенних пакувальних оболонок (наприклад, до оболонки WN, яку використовують для пакування PIV-JE в клітини-хелпери, перетворюючи WN-специфічні білки C-prM-E на трансфіковані). Останні спостереження підтверджують послідовне застосування різноманітних вакцин PIV, що виробляються в лінії пакувальних клітин універсального хелпера, і послідовне застосування різних рекомбінантних вакцин з вектором PIV у одного і того ж індивідуума, як обговорено вище. Крім того, нами підтверджені попередні спостереження, що конструкції PIV можуть стабільно репродукувати високі виходи in vitro, і що після тривалого пасажу в клітинах субстрату рекомбінації, яка відновляла б суцільний вірус, не відбувається (Mason et al., Virology 351:432-443, 2006; Shustov et al., J. Virol. 21:11737-11748, 2007). Вказані та інші аспекти за даним винаходом описані далі в Прикладах. Приклад 1. Дослідження з розробки платформи псевдоінфекційного вірусу Атенуація на моделі нейровірулентності (НВ) новонародженої миші Матеріали, використані в описаних нижче дослідженнях, наведені в табл. 1 і посиланнях, процитованих в даному описі. Вони включають s-PIV-WN (що базується на послідовності NY99 штаму вірусу wt WN), s-PIV-JE, s-PIV-WN/JE (що базуються на основі вірусу wt WN і генах prM-E з штаму вірусу Накайама wt JE), s-PIV-YF/WN (основа YF 17D і гени prM-E з вірусу WN) і s-PIVYF (що базується на послідовностях YF 17D). Додаткові матеріали включають d-PIV-YF (YF dPIV, вирощений у здорових клітинах BHK (Shustov et al., J. Virol. 21:11737-11748, 2007) і d-PIVWN з двома компонентами (вирощений у здорових клітинах Vero; Suzuki et al., J. Virol. 82:69426951, 2008)). Атенуацію вказаних прототипів PIV порівнювали з LAV YF 17D, химерним вірусом YF/JE і химерним вірусом YF/WN у випробуванні на НВ (підшкірне щеплення) новонародженої миші, використовуючи мишей ICR з високою чутливістю віком 5 днів, інокульованих підшкірно (химерні віруси включають капсидні і неструктурні послідовності вірусу жовтої лихоманки, а також послідовності JE або WN prM-E). Жодна з тварин, які одержали конструкції PIV, не демонстрували клінічних ознак або гинули, тоді як у тварин, щеплених LAV, спостерігали смертельні випадки (табл. 2). Вірус YF 17D нейровірулентний для мишей будь-якого віку, тоді як химерні вакцини не є нейровірулентними для дорослих мишей, але можуть спричиняти дозозалежну смертність у більш чутливих новонароджених мишей (Guirakhoo et al., Virology 257:363-372, 1999; Arroyo et al., J. Virol. 78:12497-12507, 2004). Відповідно, 90-100 % новонароджених мишей, які одержали низькі дози 1 БУО YF 17D загинули. YF/JE і YF/WN LAV спричиняли часткову смертність при набагато вищих дозах (> 2 log 10 БУО і 3 log10 БУО, відповідно), з більшою середньою тривалістю життя (СТЖ) у загиблих тварин. Таким чином, конструкції PIV є повністю авірулентними на даній чутливій моделі (нейровірулентність як мінімум в 20 000-200 000 рази менша, ніж вірулентність зареєстрованої вакцини YF 17D). YF d-PIV і WN d-PIV не спричиняли смертності або клінічних симптомів. Отже, варіанти PIV з двома компонентами, які можна розповсюдити теоретично в межах тканини мозку з клітин, супутньо інфікованих обома їх компонентами, не спричиняли захворювання. Більш того, нами була зроблена спроба знайти d-PIV у мозку додаткових тварин за даним експериментом, яких умертвили на 6 день після щеплення, шляхом титрування. d-PIV не було виявлено (тканини мозку з 10 і 11 мишей, які одержали 4 log10 КУО YF d-PIV і WN d-PIV, відповідно, гомогенізували і використали для титрування). Таким чином, d-PIV не спричиняли поширення інфекційних характеристик суцільного вірусу. Показано, що YF/JE LAV реплікуються в мозку дорослих мишей ICR, щеплених підшкірно з піковим титром ~ 6 log 10 БУО/г на 6-й день, хоча без клінічних симптомів (Guirakhoo et al., Virology 257:363-372, 1999). Очевидно, що супутнє інфікування клітин компонентами d-PIV є менш ефективним способом, ніж інфікування суцільним вірусом. Дані демонструють, що імунні реакції новонароджених (і адаптивні реакції у дорослих тварин) 20 UA 103316 C2 5 10 15 20 25 30 35 40 45 50 55 60 швидко беруть під контроль реплікацію d-PIV in vivo. Імуногенність/ ефективність на мишах і хом'яках Імуногенність/ефективність прототипів PIV, описаних вище, порівнювали з химерними дублікатами LAV і YF 17D у мишей і сірійських хом'яків. Загальний дизайн експерименту проілюстрований на фіг. 3 (миші, внутрішньочеревинна імунізація). Експерименти на хом'яках виконували аналогічно (плюс-мінус декілька днів, підшкірне або внутрішньочеревинне щеплення в дозах, вказаних нижче). Миші ICR віком 3,5 тижнів (для груп s-PIV-WN і -YF, YF/WN LAV, і YF 17D) або миші C57/BL6 (для груп s-PIV-JE і YF/JE LAV) були внутрішньочеревинно імунізовані ранжованими дозами конструкцій PIV (4-6 log10 КУО/дозу) або контролю химерних LAV і YF 17D LAV (4 log10 БУО). На 21-й день вибрані групи PIV-WN, -JE і -YF повторно імунізували 5 log10 КУО відповідних конструкцій (табл. 3). Реакції у формі нейтралізуючих антитіл визначали в зразках сироватки тварин за допомогою стандартних PRNT 50 (реакції нейтралізації зменшення бляшок) проти вірусів YF/WN або /JE LAV, або YF 17D. PIV-WN індукували дуже сильні WN-специфічні реакції у формі нейтралізуючих антитіл у всіх групах, з повторною імунізацією або без неї, що підтверджено титрами PRNT 50, визначеними в пулах зразків сироватки імунізованих тварин в 20-й і 34-й дні, які порівнювали з титрами в групі контролю YF/WN LAV. Відповідно, тварини, імунізовані як PIV-WN, так і YF/WN LAV, були захищені від смертельного провокування на 35-й день вірусом wt WN (внутрішньочеревинне введення, 270 LD50), але імунізовані імітацією тварини не були захищені (табл. 3). Якщо рівні нейтралізуючих антитіл WN вимірювали в зразках сироватки індивідуальних мишей, то спостерігали істотну однорідність імунних реакцій (фіг. 4). Таким чином, вакцини PIV одного круга можуть бути настільки ж імуногенними та ефективними, як і відповідні вакцини LAV. Імуногенність PIV-JE також була вираженою (чорні миші), а імуногенність PIV-YF була істотно нижчою в порівнянні з контролем YF 17D (миші ICR). Спостерігали дозозалежний захист імунізованих PIV-YF тварин (але не імунізованих імітацією тварин), після проведення смертельного підшкірного провокування штамом wt YF вірусу Asibi (500 LD50) (табл. 3), подібний захист підтверджує інформацію про те, що титри нейтралізуючих антитіл низькі 1:10 і захищають проти флавівірусних інфекцій. Вірус контролю YF 17D був високо імуногенним (наприклад, титр PRNT 50 1:1280 на 32-й день), і тому він здатний інфікувати клітини та ефективно реплікуватися in vivo, а його оболонка являє собою потужний імуноген. Таким чином, малоймовірно, що низька імуногенність PIV-YF є наслідком його нездатності інфікувати клітини або ефективно реплікуватися в інфікованих клітинах in vivo. Вважаємо, що низька імуногенність PIV-YF (наприклад, в порівнянні з PIV-WN), ймовірніше за все, є наслідком низьких рівнів продукування YF-специфічних VLP в інфікованих PIV-YF клітинах (тоді як секреція VLP є високою в інфікованих PIV-WN клітинах). Як обговорено вище, нами запропонована можливість істотного підвищення імуногенності PIV-YF, наприклад, шляхом відповідних модифікацій на з'єднанні C/prM, наприклад, шляхом роз'єднання розщеплення двома протеазами, які зустрічаються на даному з'єднанні (розщеплення вірусною протеазою і сигналазою), та/або застосовуючи потужний гетерогенний сигнал [наприклад, сигнал протеїну G вірусу сказу або сигнал активатора плазміногену (tPA) еукаріотних тканин (Malin et al., Microbes and Infection, 2:1677-1685, 2000) і т.п.] замість сигналу YF для prM. Подібний експеримент проводили на сірійських хом'яках віком ~ 4,5 тижнів з метою порівняння імуногенності конструкцій PIV з контролем LAV на даній моделі. Тварини були підшкірно імунізовані ранжируваними дозами досліджуваних речовин (табл. 4). PIV-WN був високо імуногенним, наприклад, WN-специфічні титри PRNT50 на 38-й день (перед провокуванням) становили 1:320, 1:640 і 1:1280 в групах, які одержали 5, 6, і 6 (основну) +5 (повторну) дози log10 КУОКУО, відповідно. Вказані дані були дещо нижчими в порівнянні з контролем YF/WN LAV 4 log10 БУО (≥1:2560). PIV-JE і – YF індукували специфічні реакції у формі нейтралізуючих антитіл, які виявляються, хоча з нижчими титрами в порівнянні і контролем YF/JE LAV і YF 17D. Всі тварини, імунізовані PIV-WN і YF/WN, були надійно захищені від смертельного провокування вірусом wt WN, про що свідчила відсутність смертності і захворюваності (наприклад, зниження маси тіла після провокування), а також відсутність або істотне зменшення спричиненої вірусом WN віремії після провокування. Імунізовані імітацією тварини не були захищені (табл. 4). PIV-JE і - WN захистили тварин від відповідного провокування дозозалежним чином. Захисна ефективність за даним експериментом додатково проілюстрована на фіг. 5. Наприклад, спостерігали виражену віремію, спричинену вірусом YF (штам Asibi, адаптований для хом'яків) після провокування у тварин, імунізованих імітацією, з піком на 3-й день при титрі > 8 log10 БУО/мл (верхній лівий графік); у всіх тварин спостерігалося зниження маси тіла, і 1 з 4 тварин загинула (верхній правий графік). На відміну від цього, віремія була істотно зменшена або відсутня у хом'яків, імунізованих PIV-YF (дві дози; незважаючи на 21 UA 103316 C2 5 10 15 20 25 30 35 40 45 50 55 60 відносно низькі титри нейтралізуючих антитіл) або YF 17D; у жодної з дослідних тварин не спостерігалося зниження маси тіла. Аналогічно, тварини, імунізовані PIV-WN або YF/WN LAV, були істотною мірою або повністю захищені від віремії, спричиненої вірусом WN після провокування, і зниження маси тіла/смертності, на відміну від контролю імітації (порівняння в нижніх графіках). Таким чином, висока імуногенність/ ефективність PIV продемонстрована на другій моделі тварин. В іншому експерименті на хом'яках тварин імунізували внутрішньочеревинно конструкціями PIV в двох дозах. В табл. 5 порівнюються нейтралізуючі імунні реакції (специфічні для кожної вакцини), визначені у пулах сироватки хом'яків у вищеописаному експерименті (підшкірне щеплення), з реакціями після внутрішньочеревинної імунізації для PIV-WN, - YF/WN, -WN/JE, і YF після першої дози (дні 20-21) і другої дози (дні 34-38). Деякий ефект імунізації спостерігали після введення як 1-ої, так і 2-ої дози. Наприклад, для PIV-WN після введення 1-ої дози, підшкірна імунізація приводила до WN-специфічного титру PRNT 50-1:40, тоді як внутрішньочеревинне щеплення приводило до набагато більш високого титру - 1:320 (а після введення 2-ої дози титри були подібними). Більш виражений ефект спостерігали для інших конструкцій, після введення як 1-ої, так і 2-ої дози. Цікаво, що PIV-YF/WN є надзвичайно імуногенним після внутрішньочеревинного введення (титр 1:320 після внутрішньочеревинного введення 1-ої дози проти 1:20 при підшкірному введенні, і 1:1,280 після введення 2-ої дози проти 1:160 при підшкірному введенні). Аналогічно, імуногенність PIV-JE істотно збільшувалася (наприклад, JE-специфічний титр 1:640 після внутрішньочеревинного введення двох доз). Таким чином, краще націлювання лімфоїдних клітин, специфічних антиген-презентуючих клітин (які в більшій кількості наявні в черевній порожнині на протилежність підшкірним тканинам), є важливим для розгляду застосування вакцин PIV. У людей ефективне націлювання дендритних клітин шкіри шляхом збільшення вираженості імунної реакції, може бути забезпечене шляхом внутрішньошкірної доставки, яку ми пропонуємо як спосіб введення для імунізації PIV у людини. У вищеописаних експериментах, нами також було визначено, чи була індукована реакція у формі нейтралізуючих антитіл проти пакувальних оболонок (на протилежність реакції на VLP, що кодуються конструкціями PIV і виділяються інфікованими клітинами). Не виявлені WNспецифічні нейтралізуючі антитіла за допомогою PRNT50 у тварин, імунізованих 5 log10 КУО другого компоненту WN d-PIV, що містить делецію ΔC-prM-E, і, таким чином, не кодує VLP, але упакований в оболонку WN в клітинах-хелперах BHK-CprME(WN), і не виявлено YF-специфічної нейтралізуючої активності у зразках сироватки тварин, імунізованих 4 log10 КУО другого компоненту YF d-PIV, упакованого в оболонку YF. Не індукувалася YF-специфічна реакція нейтралізації двома дозами PIV-YF/WN, упакованого в оболонку YF, і аналогічно, не індукувалася WN-специфічна реакція двома дозами PIV-JE, упакованого в оболонку WN. Відсутність реакції нейтралізації проти пакувальних оболонок дозволяє здійснювати виробництво вакцин за даним винаходом з різними PIV в одній (універсальній) виробничій лінії клітин-хелперів, або імунізацію однієї людини різними рекомбінантними вакцинами, що базуються на одому і тому ж векторі. Коктейлі PIV Оскільки PIV піддаються одному (необов'язково декільком, але обмеженій кількості) кругу реплікації in vivo, ми вважаємо, що можна вводити суміші різних вакцин PIV без інтерференції між індивідуальними конструкціями в суміші (коктейлі). Для з'ясування того, чи можна застосовувати в рецептурах коктейлів вакцини PIV, порівнювали імунні реакції у мишей і хом'яків на декілька конструкцій PIV, введених у вигляді сумішей, з реакціями на такі ж конструкції, введені окремо. Подібні результати були одержані на обох тваринних моделях. Результати експериментів на мишах показані в табл. 6. Подібні титри нейтралізуючих анти-JE антитіл спостерігали в пулах сироватки тварин, яким вводили одну або дві дози суміші PIVJE+PIV-WN або тільки PIV-JE (1:20 проти 1:80 і 1:640 проти 1:160, для однієї і двох доз, відповідно). Аналогічно, WN-специфічні титри проти суміші PIV-JE+PIV-WN і тільки PIV-WN були подібними (1:320 проти 1:640 і 1:5120 проти 1:5120 для однієї і двох доз, відповідно). Не індукувалася, або індукувалася незначна перехресно-специфічна реакція, викликана PIV-JE або -WN. Результат був також підтверджений шляхом вимірювання титрів PRNT50 в сироватці індивідуальних тварин. Таким чином, очевидно, що вакцини PIV можна ефективно вводити у вигляді коктейлів, індукуючи імунітет проти двох або більше флавівірусних патогенів. Крім того, як обговорено вище, можна одержувати різноманітні коктейлі нефлавівірусних вакцин PIV, або будь-яких флавівірусних і нефлавівірусних вакцин PIV. Дослідження in vitro Різноманітні прототипи PIV піддавалися серійному пасажу до 10 разів у клітинах-хелперах BHK з метою одержання s-PIV, або в здорових клітинах Vero з метою одержання d-PIV. Зібрані 22 UA 103316 C2 5 10 15 20 25 30 35 40 45 50 55 60 після кожного пасажу зразки титрували в клітинах Vero шляхом імунозабарвлення. Рівні конструкцій зростали до високих титрів, і не спостерігалося рекомбінації, що відновлювала б суцільний вірус. Наприклад, рівні PIV-WN послідовно зростали до титрів 7-8 log10 КУО/мл в клітинах-хелперах BHK-CprME(WN) (містять VEE реплікон, що експресує білки C-prM-E вірусу WN), а рівні WN d-PIV зростали до титрів, що перевищують 8 log10 КУО/мл в клітинах Vero, без рекомбінації. Приклад 2. PIV-TBE Кандидати вакцини PIV-TBE можна комплектувати, повністю базуючись на послідовностях з вірусу wt TBE або близько спорідненого серологічно вірусу Лангат (LGT) (природно атенуйований вірус, наприклад, штам wt TP-21 або його емпірично атенуйований варіант, штам E5), або базуючись на химерних послідовностях, що містять основу (капсидні і неструктурні послідовності) з YF 17D або інших флавівірусів, наприклад, вірусу WN, і генах оболонкового білка prM-E з TBE, LGT, або інших серологічно споріднених флавівірусів з серокомплексом TBE. Кандидати YF/TBE LAV конструюють, базуючись на основі з YF 17D і генах prM-E з TBE або споріднених вірусів (наприклад, штам E5 LGT), подібно до інших химерних вакцин LAV. Конструкцію прототипів вакцини PIV-TBE і YF/TBE LAV виконували шляхом клонування відповідних генетичних елементів в плазміди для PIV-WN (Mason et al., Virology 351:432-443, 2006; Suzuki et al., J. Virol. 82:6942-6951, 2008), або плазміди для химерних LAV (наприклад, pBSA-AR1, версія з однією плазмідою інфекційного клону YF/JE LAV; WO 2008/036146), відповідно, застосовуючи стандартні способи, відомі в галузі зворотної генетики. Послідовності prM-E штаму Hypr вірусу TBE (код доступу GenBank U39292) і штаму E5 LGT (код доступу GenBank AF253420) були першими оптимізовані за кодонами за допомогою комп'ютера для підтвердження переважного використання кодону в геномі людини і для виключення повторів нуклеотидних послідовностей довше 8 нуклеотидів з метою забезпечення високої генетичної стабільності вставок (якщо вважається необхідним, можна здійснювати подальше скорочення повторів послідовності нуклеотидів). Гени хімічно синтезують і клонують в плазміди для PIV-WN і YF/JE LAV на місці відповідних генів prM-E. Одержані в результаті плазміди транскрибують in vitro, а відповідні клітини (Vero для химерних вірусів і клітини-хелпери BHK для PIV) трансфікують за допомогою транскриптів РНК для генерації зразків вірусу/PIV. Конструкції YF/TBE LAV У конструкціях YF/TBE, що містять гени або TBE Hypr (плазміди p42, p45 і p59), або LGT E5 (плазмід P43) prM-E, першими досліджували два різні типи з'єднання C/prM (див. фіг. 6; тільки з'єднання C/prM показані у Додатку послідовностей 1, а завершені послідовності 5’-кінця, що охоплюють 5’ нетрансльований C-prM-E-початок ділянки NS1, показані у Додатку послідовностей 2). Химера YF17D/Hypr, що походить з p42, містила гібридний сигнальний пептид YF17D/Hypr для білка prM, тоді як химера YF17D/Hypr, що походить з p45, містила гібридний сигнальний пептид YF17D/WN для prM (Додаток послідовностей 1). Перший химерний вірус продукував дуже високі титри в P0 (безпосередньо після трансфекції) і P1 (наступний пасаж в клітинах Vero), до 7,9 log10 БУО/мл, які були в 0,5 log10 раз вище у порівнянні з останнім вірусом; крім того, він утворював істотною мірою більші бляшки в клітинах Vero (фіг. 6). Таким чином, використання TBE-специфічних залишків у сигнальному пептиді для prM забезпечило істотну перевагу росту над сигналом, що містить WN-специфічні залишки. Химера YF17D/LGT, що походить з p43, містила такий же сигнал prM, що і вірус, який походить з p42; вона також продукувала дуже високі титри в пасажах P0 і P1 (до 8,1 log10 БУО/мл) і утворювала великі бляшки. Похідне вірусу, що походить з p42, також продуковано з плазміди p59, яка містить мутацію враженої атенуації, що охарактеризована раніше в контексті вірусу вакцини YF/WN LAV, конкретно, делецію 3-a.a. у YF17D-специфічному протеїні C (PSR, залишки 40-42 на початку α-спіралі I; WO 2006/116182). Як очікувалося, вірус p59 розмножувався до низьких титрів (5,6 і 6,5 log10 БУО/мл в P0 і P1, відповідно) і утворював невеликі бляшки (визначені в окремому експерименті титруванням, і тому не показані на фіг. 6) в порівнянні з батьківською химерою, що походить з p42. Дані початкові спостереження властивостей росту прототипів YF/TBE LAV і кореляції реплікації in vitro з морфологією бляшок підтверджені в експериментах з кривою росту (фіг. 8). Конструкції PIV-TBE Конструювали варіанти PIV-WN/TBE, а упаковані зразки PIV походили з плазмід p39 і p40 (фіг. 7; Додаток послідовностей 1 для послідовностей з'єднання C/prM і Додаток послідовностей для повного 5’ нетрансльованого C-prM-E-початку послідовностей NS1). Вони містили завершені сигнали Hypr або WN prM, відповідно. Обидва PIV були успішно відновлені і репродуковані у клітини-хелпери BHK-CprME(WN) або BHK-C(WN) (Mason et al., Virology 351:432-443, 2006; Widman et al., Vaccine 26:2762-2771, 2008). Титри зразків P0 і P1 варіанту p39 23 UA 103316 C2 5 10 15 20 25 30 35 40 45 50 55 60 складали 0,2-1,0 * log10, що вище за титри варіанту p40. Крім того, клітини Vero, інфіковані варіантом p39, були забарвлені більш інтенсивно в аналізі імунофлуоресценції з використанням поліклонального TBE-специфічного антитіла в порівнянні з p40, що є ознакою більш ефективної реплікації (фіг. 7). Вища швидкість реплікації кандидата p39 в порівнянні з кандидатом p40 підтверджена в експерименті кривої росту (фіг. 8). В останньому експерименті виявлено, що обидва кандидати краще розмножуються у клітинах-хелперах BHK-C(WN) в порівнянні з BHKCprME(WN), причому титр варіанту p39 досягає ~ 7 log10 БУО/мл на 5-й день (слід відзначити, що пікові титри не були досягнути). Відмінною рисою нашого підходу є відкриття впливу сигналу prM на швидкість реплікації як PIV, так і химерних кандидатів вакцини LAV, і детальне порівняння різних сигналів для генерації імуногенної конструкції (див. вище) з найбільш ефективною реплікацією. Як обговорено вище, у даний винахід також включено застосування інших сигналів флавівірусу, у тому числі з відповідними мутаціями, роз'єднання розщеплень вірусною протеазою і сигналазою на з'єднанні C/prM, наприклад, шляхом мутації або делеції сайту розщеплення протеазою на C-кінці C, що передує сигналу prM, застосування потужних нефлавівірусних сигналів (наприклад, сигнал tPA і т. п.) на місці сигналу prM, а також оптимізація послідовностей в убутному порядку від сайту розщеплення сигналазою. У даний винахід також включені інші варіанти PIV-TBE, що повністю базуються на вірусах wt TBE (штам Hypr) і LGT (дикий штам типу TP21 або атенуйований штам E5), а також химерні послідовності основи/prM-E YF 17D (TBE або LGT). Можна конструювати клітини-хелпери, що забезпечують C, C-prM-E і т. п. білки (наприклад, TBE-специфічний) для транс-комплементації, за допомогою стабільного трансфікування ДНК або шляхом застосування відповідного вектора, наприклад, реплікону такого альфавірусу, як той, що базується на штамі TC-83 VEE, з селекцією клітин, що містять реплікон, за допомогою антибіотика. Клітини Vero і BHK21 можна використовувати за даним винаходом на практиці. Останні являють собою схвалений субстрат виробництва вакцин для людини; також можна застосовувати будь-яку іншу лінію клітини, прийнятну для виробництва вакцин для медицини та/або ветеринарії. Крім того, до конструкцій s-PIV можна також комплектувати конструкції d-PIV. Для додаткового підтвердження безпечності для вакцин і оточення можна використовувати відповідні модифікації, у тому числі застосування дегенеративних кодонів і додаткових мутацій в 5’ і 3’ CS елементах з метою мінімізації шансів рекомбінації, яка теоретично могла б призводити до появи життєздатного вірусу. Як і конструкцію, всі кандидати вакцин можна оцінити in vitro щодо придатності для виробництва/стабільності та in vivo щодо атенуації та імуногенності/ефективності на доступних доклінічних тваринних моделях, наприклад, таких, які використовують при розробці і контролю якості вакцин TBE і YF. Нейровірулентність і нейроінвазійність у мишей при введені конструкцій PIV-TBE і YF/TBE LAV Молодих дорослих мишей ICR (віком ~ 3,5 тижнів) інокулювали ранжируваними дозами кандидатів PIV-TBE і YF/TBE LAV підшкірно з метою вимірювання нейровірулентності або внутрішньочеревинно з метою виміру нейроінвазійності (і пізніше імуногенності/ефективності). Тварини, які одержали 5 log10 КУО варіантів PIV-Hypr (p39 і p40) як підшкірно, так і внутрішньочеревинно вижили і не продемонстрували ознак хвороби, подібно до тварин, щепленим імітацією (табл. 7), таким чином, вакцини PIV-TBE можна вважати повністю авірулентними. К мишей, яким ввели підшкірно контроль YF 17D (1-3 log10 БУО), спостерігалася дозозалежна смертність, тоді як всі тварини, щеплені внутрішньочеревинно (5 log10 БУО), вижили, що відповідало відсутності нейроінвазійності вірусу YF 17D. Всі тварини, які одержали ранжирувані підшкірні дози (2-4 log10 БУО) прототипів p42, p45, p43, і p59 YF/TBE LAV, загинули (вмираючих тварин піддавали гуманній евтаназії). Як виявлено, дані варіанти були меншою мірою атенуйовані, ніж YF 17D, наприклад, як це підтвержено повною смертністю і меншим значенням СТЖ при дозі 2 log10 БУО, найнижчій дозі, яку перевіряли для кандидатів YF/TBE LAV. Анейровірулентний фенотип PIV-TBE, вірулентний фенотип YF/TBE LAV і фенотип з проміжною вірулентністю YF 17D також проілюстровані на фіг. 9, демонструючи криві виживання мишей після підшкірної інокуляції. Слід зазначити, що p43 (гени LGT prM-E) і p59 (варіант делеції dC2 YF/Hypr LAV) були менш нейровірулентні, ніж p42 і p45 конструкції YF/Hypr LAV, що виявлено за більшими значеннями СТЖ для відповідних доз (табл. 7). Крім того, кандидати p43 і p59 були анейроінвазійними, тоді як p42 і p45 спричинили часткову смертність після внутрішньочеревинного щеплення (5 log10 БУО /дозу) (табл. 7;фіг. 10). Однак, слід зазначити, що всі конструкції YF/TBE LAV істотною мірою атенуйовані в порівнянні з вірусами wt TBE, наприклад, в порівнянні з вірусом wt TBE Hypr, якому властива однорідна висока вірулентність у мишей як при підшкірному введенні дуже низьких доз (LD 50 ~ 0,1 БУО), так і при внутрішньочеревинному введенні (LD50 ≤ 10 БУО) (Wallner et al., J. Gen. Virol. 77:1035-1042, 24 UA 103316 C2 5 10 15 20 25 30 35 40 45 50 55 60 1996; Mandl et al., J. Virol. 72:2132-2140, 1998; Mandl et al., J. Gen. Virol. 78:1049-1057, 1997). Імуногенність/ ефективність конструкцій PIV-TBE і YF/TBE LAV у мишей Вимірювали реакції у формі TBE-специфічних нейтралізуючих антитіл у мишей, імунізованих внутрішньочеревинно однією або двома дозами варіантів PIV-TBE або YF/TBE LAV, описаних вище, або контролем (1:30 дози для людини) - інактивованою формаліном вакциною TBE для людини. Тварин провокували внутрішньочеревинним введенням високої дози (500 БУО) вірусу wt Hypr TBE; після провокування проводили моніторинг захворюваності (наприклад, зниження маси тіла) і смертності. Імуногенність/ ефективність конструкцій PIV-TBE і YF/TBE LAV у мишей TBE-специфічні реакції у формі нейтралізуючих антитіл у мишей, імунізованих внутрішньочеревинно однією або двома дозами варіантів PIV-TBE або YF/TBE LAV, описаних вище (з експерименту в табл. 7), або контролем (1:20 дози для людини; одна або дві дози) інактивованою формаліном вакциною TBE, або YF 17D і контролем у формі імітації, вимірювали в день 20 за допомогою PRNT 50 проти вірусу wt TBE Hypr (табл. 8; другу дозу, вказаних досліджуваних доз вводили на 14-й день). [Титри визначали в індивідуальних зразках сироватки або пулах сироватки двох тварин у більшості випадків, або пулах сироватки 4 тварин для негативного контролю YF17D і імітації]. Титри в індивідуальних досліджуваних зразках, а також GMT (середнє геометричне значення титрів) для кожної групи наведені в табл. 8. Титри в досліджуваних зразках були подібними в межах кожної групи, наприклад, в групах, імунізованих PIV, вказуючи на високу однорідність імунної реакції у тварин. Як і очікувалося, не знайдено TBE-специфічних нейтралізуючих антитіл у групах негативного контролю (YF 17D і імітація; GMT 7 log 10 КУО/мл. Важливо, що приблизно ідентичні титри знайдені за допомогою імунозабарвлення як RabG-Mab, так і WNантитіла, що було першою ознакою генетичної стабільності вставки. У PIV-інфікованих клітинах Vero, які були фіксовані, але не проникні, виражене забарвлення мембрани спостерігали при імунозабарвленні RabG-Mab, демонструючи те, що продукт ефективно доставлений на поверхню клітини (фіг. 15). Останнє відомо як головна передумова для високої імуногенності G, що експресується. Індивідуальні упаковані PIV можна поширити після інфікування клітинхелперів BHK, але їх не можна поширити в здорових клітинах, як проілюстровано для WN(ΔC)сказу G PIV на фіг. 16. Той факт, що не спостерігається розповсюдження в природних клітинах BHK, демонструє, що рекомбінантні геноми РНК не можна неспецифічно упакувати в пухирці мембрани, що містять протеїн G, якщо вони продуковані інфікованими клітинами PIV. Ідентичний результат був одержаний з протеїном G іншого рабдовірусу, вірусу везикулярного стоматиту (VSV), на протилежність даним попередніх спостережень щодо неспецифічного пакувального реплікону вірусу лісу Семлики (SFV), що експресує протеїн G VSV (Rolls et al., Cell 79:497-506, 1994). Останній являє собою характерну рису бажаної безпечності. [Альтернативно, неспецифічне пакування могло б призвести до обмеженого розповсюдження PIV in vivo, потенційно підсилюючи імунну реакцію проти сказу. Останнє також може бути переважною характерною рисою, яка демонструє, що подібний PIV є безпечним]. Стабільність вставки G сказу в трьох PIV продемонстрована серійними пасажами в клітинах-хелперах BHK-CprME(WN) при високому або низькому рівні інфікування (0,1 або 0,001 КУО/клітину). У кожному пасажі супернатанти клітин збирали і титрували у здорових клітинах (наприклад, клітинах Vero), застосовуючи імунозабарвлення поліклональним антитілом анти-WN для визначення загального титру PIV, або моноклональним антитілом проти сказу G для визначення титру частинок, що містять ген G (проілюстрований для рівня інфікування 0,1 на фіг. 17; подібні результати одержані при рівні інфікування 0,001). WN(ΔC)-G сказу PIV був стабільним для 5 пасажів, а титр PIV, що містить вставку, починав зменшуватися на пасажі 6, що є ознакою нестабільності вставки. Цього можна було очікувати, оскільки у даній конструкції вставку гену G великого розміру (~ 1500 нуклеотидів) комбінували із вставкою делеції ΔC невеличкого розміру (~ 200 нуклеотидів), істотно збільшуючи загальний розмір геному рекомбінантної РНК. На відміну від цього, у PIV WN(ΔprME)-G сказу та WN(ΔCprME)-G сказу, вставку комбінували з набагато більшою делецією (~ 2000 нуклеотидів). Таким чином, вказані конструкції стабільно зберігали вставку для всіх досліджуваних 10 пасажів (фіг. 17). Крім того, на фіг. 17 можна побачити, що в деяких пасажах досягнуті титри 8 log 10 КУО/мл або вище для всіх трьох PIV, таким чином, додатково демонструючи, що PIV можна легко репродукувати до високих виходів. Після індивідуального щеплення in vivo, очікується, що s-PIV WN(ΔC)-G сказу буде індукувати потужні імунні реакції у формі нейтралізуючих антитіл як проти сказу, так і проти вірусів WN, а також у формі реакцій T-клітин. PIV WN(ΔprME)-G сказу і WN(ΔCprME)-G сказу будуть індукувати гуморальну імунну реакцію тільки проти сказу, оскільки вони не кодують генів WN prM-E. Конструкцію s-PIV WN(ΔC)-G сказу можна також інокулювати супутньо з конструкцією 26 UA 103316 C2 5 10 15 20 25 30 35 40 45 50 55 WN(ΔprME)-G сказу в композиції d-PIV (див. фіг. 12), збільшуючи дозу протеїну G, що експресується, з посиленим імунітетом проти обох патогенів за рахунок обмеженого поширення. Як приклад поширення, результати титрування в клітинах Vero зразка s-PIV, WN(ΔprME)-G сказу і зразка d-PIV, WN(ΔprME)-G сказу + WN(ΔC) PIV (останній не кодував протеїн G сказу), показані на фіг. 18. Інфікування природних клітин Vero s-PIV дало тільки індивідуальні клітини, забарвлені RabG-Mab (або невеличкі кластери, сформовані внаслідок поділу клітин). На відміну від цього, великі осередки спостерігали після інфікування зразком d-PIV (фіг. 18, правий графік), що являли собою продукти супутнього інфікування двома типами PIV. Конструкцію WN(ΔCprME)-G сказу можна також застосовувати у композиції d-PIV, якщо вона супутньо інокульована геномом хелперу, перетворюючи C-prM-E на трансфікований (див. фіг. 12). Наприклад, це може бути геном вірусу WN, що містить делецію одного з білків NS, наприклад, NS1, NS3 або NS5, що, як відомо, є транс-комплементними (Khromykh et al., J. Virol. 73:10272-10280, 1999; Khromykh et al., J. Virol. 74:3253-3263, 2000). Нами сконструйовано геном WN-ДNS1 (послідовність наведена у Додатку послідовностей 4) і отримано доказ супутнього інфікування конструкціями WN(ΔprME)-G сказу або WN(ΔCprME)-G сказу та їх поширення in vitro за допомогою імунозабарвлення. У випадку даних d-PIV протеїн G сказу можна також вставляти і експресувати в геном хелперу, наприклад, геном WN-ΔNS1, з метою збільшення кількості протеїну G сказу, що експресується, у результаті чого підсилюється імунна реакція проти сказу. Як і у випадку будь-яких версій dPIV, один імуноген може походити з одного патогену (наприклад, сказу G), а інший з другого патогену, що у результаті дає три антигенні ознаки вакцини. Як обговорено вище, в інших прикладах делеції ∆NS1 можна замінювати або застосовувати в комбінації з делеціями/мутаціями ∆NS3 та/або ∆NS5. Експресія протеїну F RSV в WN s-PIV і d-PIV Респіраторний синцитіальний вірус (RSV), член сімейства Paramyxoviridae, є провідною причиною тяжкого захворювання дихальних шляхів у дітей молодшего віку у всьому світі (Collins and Crowe, Respiratory Syncytial Virus and Metapneumovirus, In: Knipe et al. Eds., Fields Virology, th 5 ed., Philadelphia: Wolters Kluwer/Lippincott Williams and Wilkins, 2007:1601-1646). Злитий протеїн F вірусу являє собою основний вірусний антиген для розробки безпечної та ефективної вакцини. З метою уникнення загострення інфекції RSV після вакцинації, що раніше спостерігали при введені інактивованої формаліном вакцини-кандидата, необхідна збалансована реакція Th1/Th2 на F, чого можна досягти за допомогою кращої стимуляції TLR, передумовою для чого є індукування антитіл з високою спорідненістю (Delgado et al., Nat. Med. 15:34-41, 2009), яке повинно забезпечуватися шляхом доставки F у здоровому векторі, що базується на вірусі. Раніше нами була продемонстрована здатність химерних векторів LAV, що базуються на вірусі жовтої лихоманки, індукувати потужну, збалансовану реакцію Th1/Th2 in vivo проти антигену грипу (WO 2008/036146). У даному винаході химерні вектори LAV і PIV, що базуються на вірусі жовтої лихоманки, використовують для доставки F RSV з метою індукування оптимального імунного профілю реакції. Для даної мети можна також застосовувати інші вектори LAV і PIV, описані в даному описі. Повнорозмірний протеїн F RSV штаму A2 вірусу (код доступу GenBank P03420) оптимізований за кодонами, як описано вище, синтезований і клонований у плазміди для одержання PIV-WN s-PIV і d-PIV із застосуванням схем вставки, показаних на фіг. 12 і 13 для протеїну G сказу, за допомогою стандартних способів молекулярної біології. Точні послідовності вставок і оточуючих генетичних елементів наведені у Додатку послідовностей 5. Транскрипти РНК одержаних in vitro конструкцій WN(ΔC)-RSV F, WN(ΔprME)-RSV F і WN(ΔCprME)-RSV F PIV використовували для інфікування клітин-хелперів BHK-CprME(WN). Вперше ефективна реплікація та експресія протеїну F RSV продемонстрована за допомогою імунозабарвлення клітин, інфікованих анти-RSV F Mab, як проілюстровано для конструкції WN(ΔprME)- RSV F на фіг. 19. Присутність упакованих PIV в супернатантах з інфікованих клітин (титр висотою 7 log10 КУО/мл) визначали шляхом титрування в клітинах Vero за допомогою імунозабарвлення. Крім того, можна застосовувати подібні конструкції, які містять модифікований повнорозмірний ген протеїну F. Конкретно, заміщують природний сигнальний пептид N-кінця F у модифікованому протеїні F пептидом з протеїну G вірусу сказу. Модифікація призначена для з'ясування того, чи може застосування гетерогенного сигналу збільшити швидкість синтезу протеїну F та/або реплікації PIV. 27 UA 103316 C2 Конструкт PIV-WN PIVYF/WN PIVWN/JE PIV-YF Генетичний склад Вірус wt NY99 WN Оболонка (VLP): wt WN NY99 Основа: YF 17D Оболонка (VLP): wt JE Nakayama (Накаяма) Основа: wt WN NY99 YF 17D Упакований в оболонку WN; BHK-CprME(WN) або клітини-хелпери BHKC(WN) (Mason et al., Virology 2006, 351:432-43; Widman et al., Vaccine 2008, 26:2762-71) оболонку YF 17D; клітини-хелпери BHK-CprME(YF) (Widman et al., Adv Virus Res. 2008, 72:77-126) оболонку JE або WN; клітини-хелпери BHK-C(WN) або BHKCprME(WN) (Ishikawa et al., Vaccine 2008, 26:2772-8) оболонку YF 17D; клітини-хелпери BHK-CprME(YF) або BHKC(YF) (Mason et al., Virology 2006, 351:432-43) Таблиця 1 Конструкти прототипу PIV, використані в дослідженнях з розробки платформи Конструкція PIV-YF PIV-WN PIV-WN/JE PIV-YF/WN WN d-PIV YF d-PIV YF17D YF/JE YF/WN Дози (log10) 1-4 2-5 1-4 1-4 1-4 1-4 2 1 0 -1 4 3 2 1 3 0-2 Смертність (%) 0/10 (0 %) 0/10 (0 %) 0/11 (0 %) 0/10-11 (0 %) 0/10-11 (0 %) 0/10 (0 %) 10/10 (100 %) 10/10 (100 %) 9/10 (90 %) 3/10 (30 %) 9/11 (82 %) 7/10 (70 %) 3/11 (27 %) 0/11 (0 %) 2/11 (18 %) 0/10-11 (0 %) 1 СТЖ (дні) н/п н/п н/п н/п н/п н/п 7,6 9,3 9,9 9,6 9,7 12,3 12 н/п 12,5 н/п 2 Одноразова доза, внутрішньошкірне щеплення, миші ICR віком 5 днів, ранжирувані по log введеної дози. 2 СТЖ - середня тривалість життя мишей, які загинули; н/п - непридатний. 28
ДивитисяДодаткова інформація
Назва патенту англійськоюReplication-defective flavivirus vaccines and vaccine vectors
Автори російськоюPugachev, Konstantin, V., Rumyantsev, Alexander, A., Giel-Moloney, Maryann, Kleanthous, Harold
МПК / Мітки
МПК: A61K 39/12
Мітки: вакцини, базі, флавівірусів, вектори, реплікацією, вакцин, одержання, дефектною
Код посилання
<a href="https://ua.patents.su/182-103316-vakcini-na-bazi-flavivirusiv-z-defektnoyu-replikaciehyu-i-vektori-dlya-oderzhannya-vakcin.html" target="_blank" rel="follow" title="База патентів України">Вакцини на базі флавівірусів з дефектною реплікацією і вектори для одержання вакцин</a>
Попередній патент: Картридж із проколюваною випускною стінкою для приготування рідини
Наступний патент: Спосіб автоматизованої цифрової багатопрограмної мультисигнальної комутації з почерговою буферизацією сигналів
Випадковий патент: Круглопиляльний багатопилковий верстат