Високоафінні антитіла людини до рецептора il-4 людини
Номер патенту: 98943
Опубліковано: 10.07.2012
Автори: Стівенс Шон, Рафік Ашик, Ферхерст Жанетта Л., Хуан Таммі Т., Лейдіч Раймонд В., Пападопулос Ніколас Дж., Аренс Діана М., Мартін Джоел Х., Торрес Марсела, Побурскі Кевін Дж., Мікулка Уоррен Р., Ши Ерганг, Віндзор Джоан А.
Формула / Реферат
1. Антитіло або його антигензв'язувальний фрагмент, які специфічно зв'язують hIL-4R (SEQ ID NO:1) з KD, що становить приблизно 200 пМ або менше, яку вимірюють, використовуючи поверхневий плазмонний резонанс, що містять області CDR з послідовностей HCVR і LCVR, де послідовності HCVR/LCVR вибрані з 579/59 і 581/59.
2. Антитіло або антигензв'язувальний фрагмент за п. 1, які виявляють KD у відношенні hIL-4R (SEQ ID NO:1), що становить менше ніж 150 пМ.
3. Антитіло або антигензв'язувальний фрагмент за п. 1, які виявляють KD у відношенні hIL-4R (SEQ ID NO:1), що становить менше ніж 50 пМ.
4. Ізольована молекула нуклеїнової кислоти, що кодує антитіло або антигензв'язувальний фрагмент за будь-яким з попередніх пунктів.
5. Вектор, що містить послідовність нуклеїнової кислоти за п. 4.
6. Система хазяїн-вектор для одержання антитіла або антигензв'язувального фрагмента антитіла, які специфічно зв'язують рецептор IL-4, що містить вектор за п. 5 у відповідній клітині-хазяїні.
7. Система хазяїн-вектор за п. 6, в якій клітина-хазяїн є прокаріотичною або еукаріотичною клітиною, вибраною з Е. соlі або клітини СНО.
8. Спосіб одержання анти-IL-4R-антитіла або його антигензв'язувального фрагмента, що включає вирощування клітин системи хазяїн-вектор за п. 6 або 7 в умовах, що забезпечують продукцію антитіла або його фрагмента, і виділення експресованого таким чином антитіла або фрагмента.
9. Застосування антитіла або антигензв'язувального фрагмента антитіла за будь-яким з пп. 1-3 у виробництві лікарського засобу для застосування з метою послаблення або інгібування опосередкованого IL-4 захворювання або порушення у людини.
10. Антитіло або антигензв'язувальний фрагмент за будь-яким з пп. 1-3 для застосування в способі лікування захворювання або порушення у людини, у якому захворювання або порушення поліпшується, послаблюється або інгібується за допомогою видалення, інгібування або зниження активності інтерлейкіну-4 людини (hIL-4).
11. Застосування за п. 9, в якому захворювання або порушення вибране з артриту, герпетиформних захворювань, хронічної ідіопатичної кропивниці, склеродерми, гіпертрофічного рубцювання, хвороби Уіппла, доброякісної гіперплазії простати, легеневих порушень, запальних порушень, алергічних реакцій, хвороби Кавасакі, серпоподібно-клітинного захворювання, синдрому Черджа-Строса, дифузного токсичного зоба, прееклампсії, синдрому Шегрена, аутоімунного лімфопроліферативного синдрому, аутоімунної гемолітичної анемії, стравоходу Барретта, аутоімунного увеїту, туберкульозу, атопічного дерматиту, виразкового коліту, фіброзу і неврозу.
12. Застосування за п. 11, в якому вказане легеневе порушення являє собою астму, вказане запальне порушення являє собою запальне захворювання кишечнику або вказаний артрит являє собою септичний артрит.
13. Антитіло або антигензв'язувальний фрагмент за п. 10, де захворювання або порушення вибране з артриту, герпетиформних захворювань, хронічної ідіопатичної кропивниці, склеродерми, гіпертрофічного рубцювання, хвороби Уіппла, доброякісної гіперплазії простати, легеневих порушень, запальних порушень, алергічних реакцій, хвороби Кавасакі, серпоподібно-клітинного захворювання, синдрому Черджа-Строса, дифузного токсичного зоба, прееклампсії, синдрому Шегрена, аутоімунного лімфопроліферативного синдрому, аутоімунної гемолітичної анемії, стравоходу Барретта, аутоімунного увеїту, туберкульозу, атопічного дерматиту, виразкового коліту, фіброзу і нефрозу.
14. Антитіло або антигензв'язувальний фрагмент за п. 13, де вказане легеневе порушення являє собою астму, вказане запальне порушення являє собою запальне захворювання кишечнику або вказаний артрит являє собою септичний артрит.
15. Композиція, що містить антитіло або антигензв'язувальний фрагмент за будь-яким з пп. 1-3 і прийнятний носій.
Текст
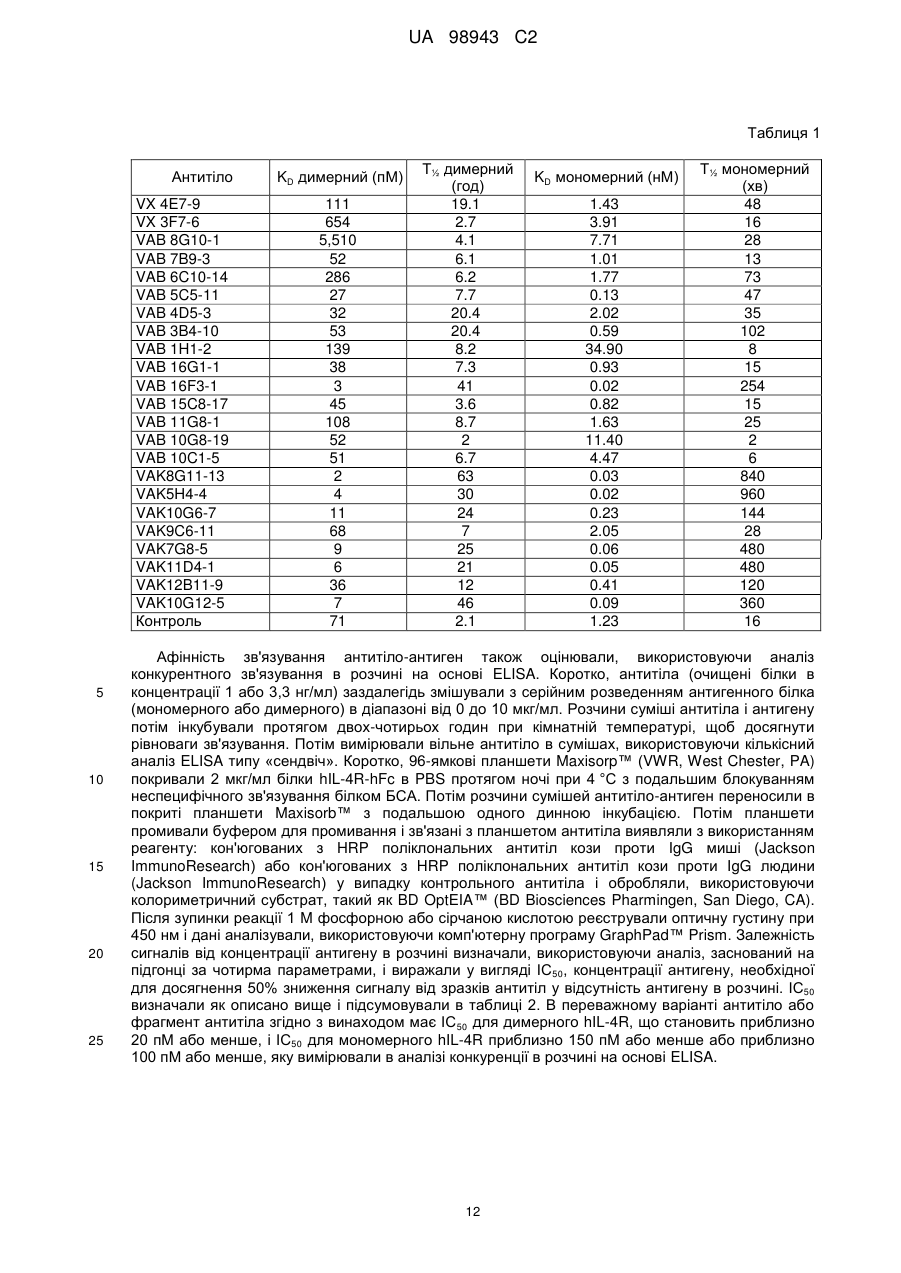
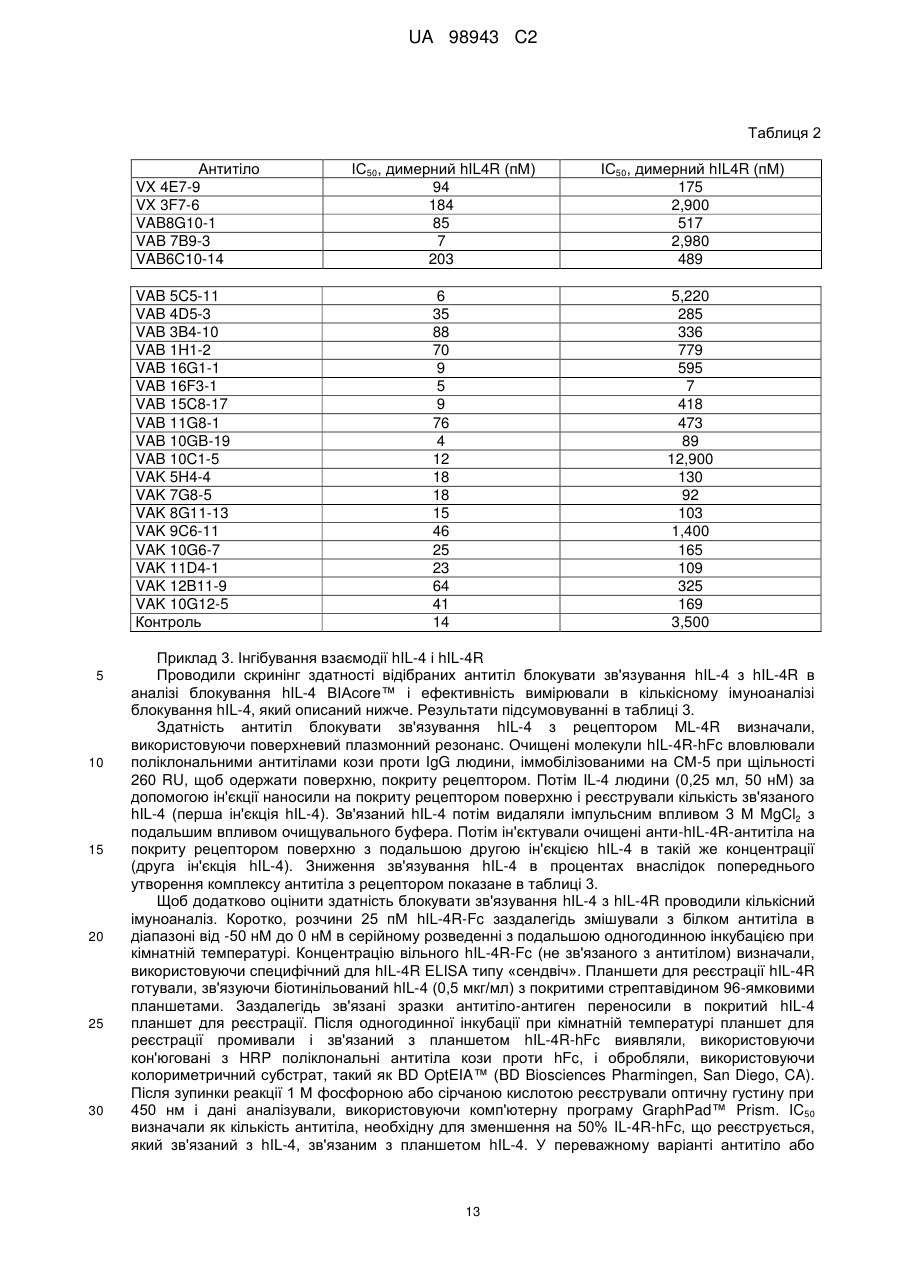
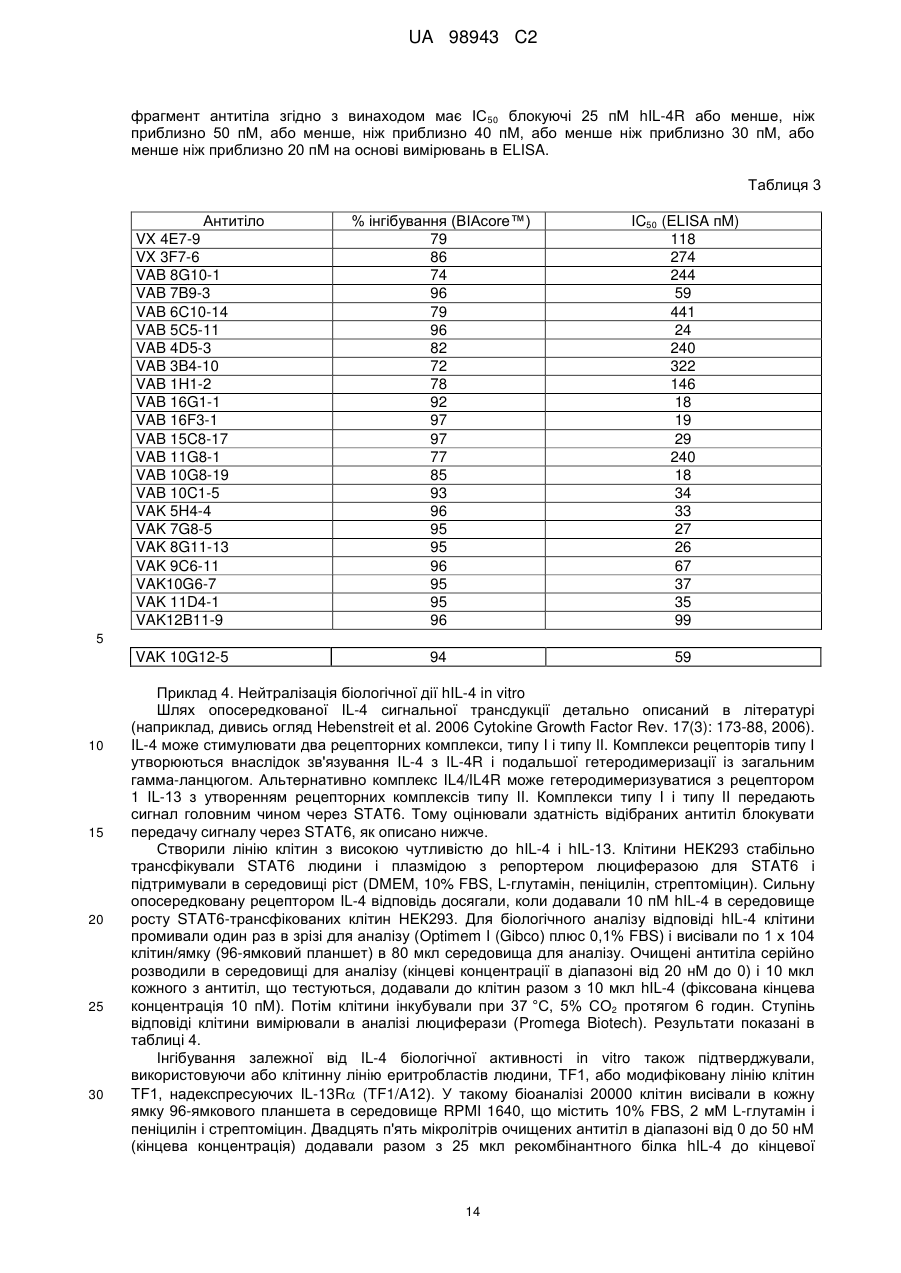
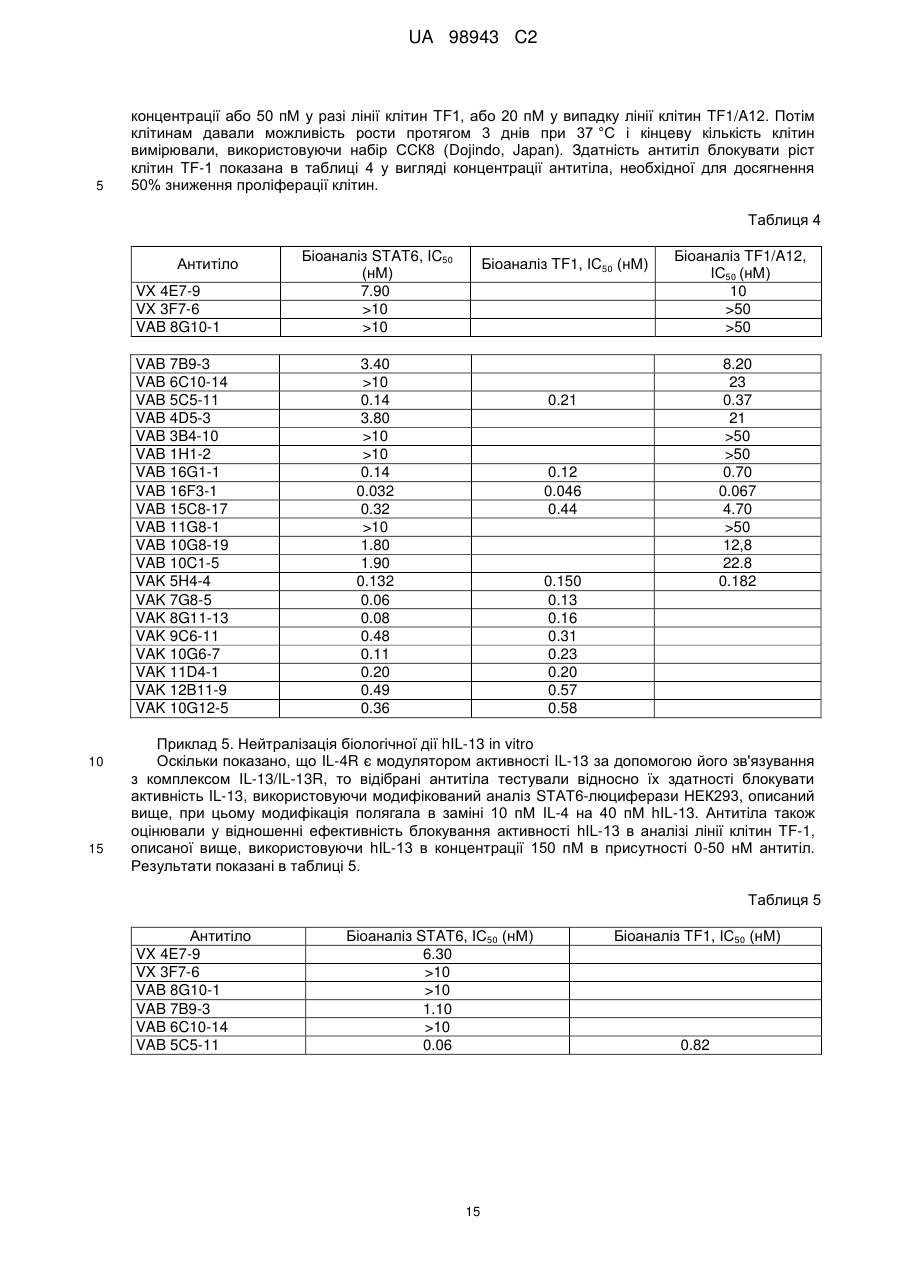
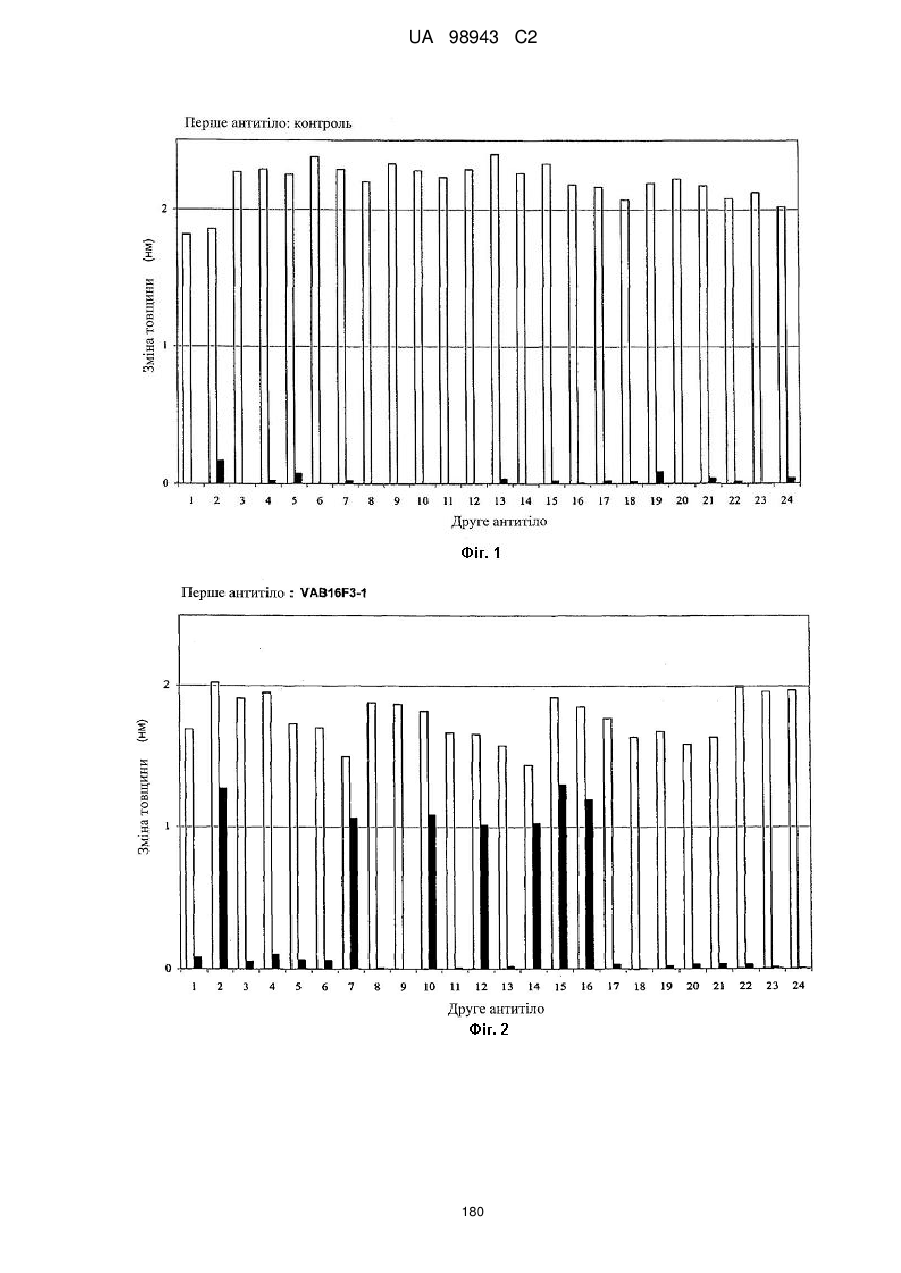
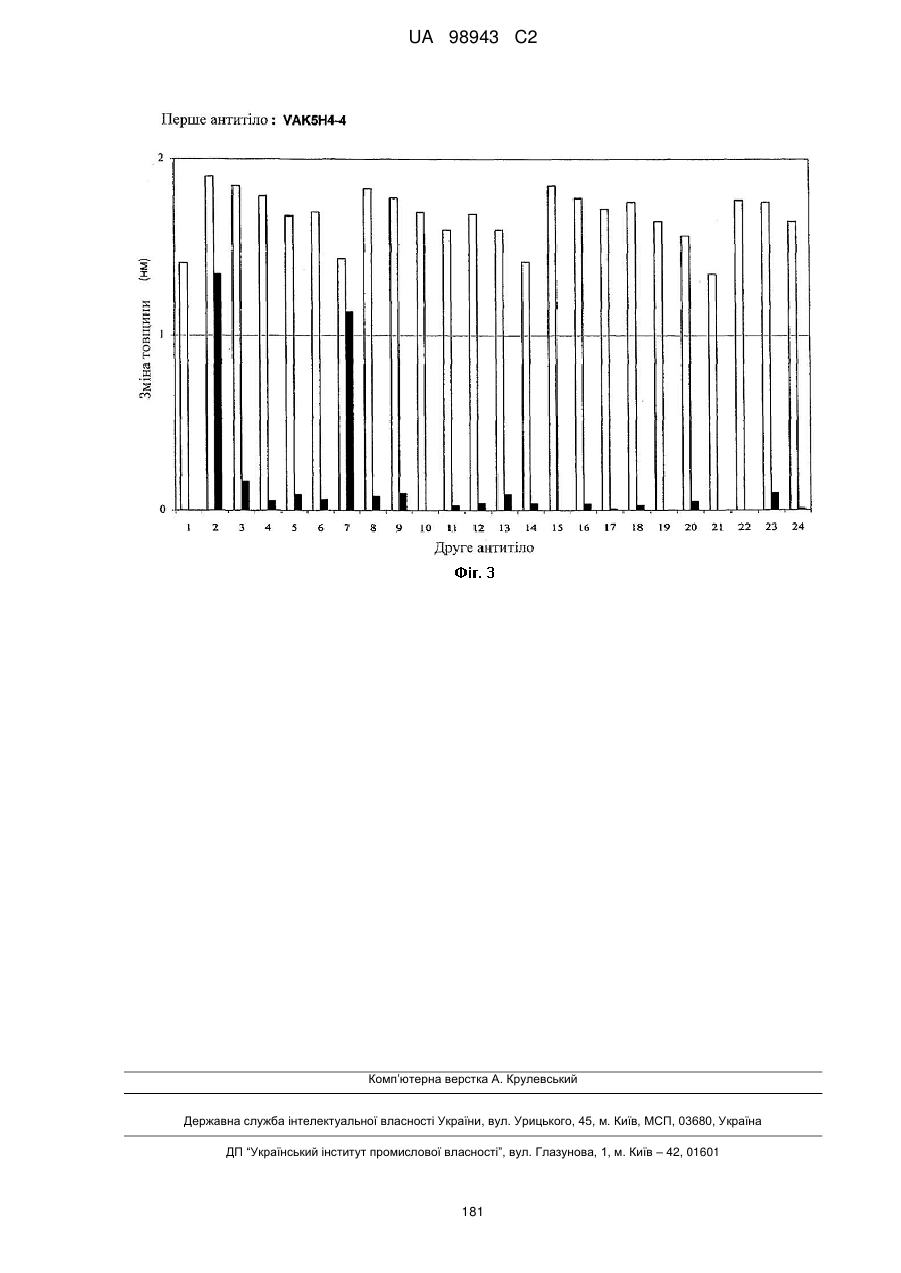
Реферат Винахід належить до високоафінного антитіла або фрагмент антитіла, який зв'язується з рецептором інтелейкіну-4 людини альфа (hIL-4Rα) з константою афінності (KD) менше, ніж приблизно 200 пМ, яке застосовують для послаблення або інгібування опосередкованого IL-4 захворювання або порушення у людини. Також винахід належить до ізольованої молекули нуклеїнової кислоти, вектора, клітини-хазяїна, способу одержання антитіла до рецептора IL-4 та композиції, що містить антитіло до людського IL-4Rα. UA 98943 C2 5 10 15 20 25 30 35 40 45 50 Інтерлейкін-4 (IL-4, також відомий як фактор, що стимулює В-клітини, або BSF-1) спочатку був охарактеризований відносно його здатності стимулювати проліферацію В-клітин у відповідь на низькі концентрації антитіл, направлених до поверхневого імуноглобуліну. Показано, що IL-4 має широкий спектр біологічної активності, включаючи стимуляцію росту Т-клітин, опасистих клітин, гранулоцитів, мегакаріоцитів і еритроцитів. IL-4 індукує експресію молекул головного комплексу гістосумісності класу II в В-клітинах, що покояться, і посилює секрецію ізотипів IgE і IgGl стимульованими В-клітинами. Біологічні активності IL-4 опосередковані специфічними рецепторами IL-4 на клітинній поверхні. Рецептор IL-4 альфа людини (hIL-4R) (SEQ ID NO: 1) описаний, наприклад, в патентах США No. 5599905, 5767065 і 5840869. Антитіла до WL-4R описані в патенті США No. 5717072. Біологічні активності IL-4 опосередковані специфічними рецепторами IL-4 на клітинній поверхні. Рецептор IL-4 альфа людини (hIL-4R) (SEQ ID NO: 1) описаний, наприклад, в патентах США No. 5599905, 5767065 і 5840869. Антитіла до hIL-4R описані в патентах США No. 5717072 і 7186809. Способи одержання антитіл, придатних як терапевтичні засоби для людини, включають створення химерних антитіл і гуманізованих антитіл (дивись, наприклад, US 6949245). Дивись, наприклад, WO 94/02602 (Abgenix) і US 6596541 (Regeneron Pharmaceuticals) (обидві публікації включені в даний опис у вигляді посилання), що описують способи одержання трансгенних мишей, здатних продукувати антитіла людини. Способи застосування антитіл до hIL-4R описані в патентах США No. 5714146, 5985280 і 6716587. У першому аспекті винахід стосується антитіл людини, переважно рекомбінантних антитіл людини, які специфічно зв'язують рецептор інтерлейкіну-4 людини (hIL-4R). Антитіла людини характеризуються зв'язуванням з hIL-4R з високою афінністю і здатністю нейтралізувати активність hIL-4. У конкретних варіантах антитіла людини здатні блокувати зв'язування комплексу hIL-13/hIL-13R1 з hIL-4R і таким чином інгібувати передачу сигналу за допомогою hIL13. Антитіла можуть бути повнорозмірними (наприклад, антитіло IgG1 або IgG4) або можуть містити тільки антигензв'язувальну частину (наприклад, фрагмент Fab, F(ab')2 або scFv), і можуть бути модифіковані, щоб вплинути на функціональність, наприклад, виключити залишкові ефекторні функції (Reddy et al. (2000) J. Immunol. 164: 1925-1933). В одному варіанті винахід стосується антитіла або його антигензв'язувального фрагмента, який специфічно зв'язує hIL-4R (SEQ ID NO: 1) з KD, що становить приблизно 200 пМ або менше, яку вимірюють з використанням поверхневого плазмонного резонансу. У більш конкретному варіанті антитіло або антигензв'язувальна частина мають KD менше, ніж приблизно 150 пМ, або менше ніж приблизно 50 пМ, або менше, ніж приблизно 20 пМ. У різних варіантах антитіло або антигензв'язувальний фрагмент блокує активність hIL-4 з ІС50 приблизно 200 пМ або менше, як виміряно в біоаналізі люциферази STAT6. У більш конкретних варіантах антитіло або антигензв'язувальний фрагмент мають ІС50 приблизно 150 пМ або менше або приблизно 100 пМ або менше або навіть приблизно 50 пМ або менше, як виміряно в біоаналізі люциферази. У різних варіантах антитіло або антигензв'язувальний фрагмент блокує активність hIL-13 з ІС50, що становить приблизно 100 пМ або менше, як виміряно в біоаналізі люциферази STAT6. У більш конкретних варіантах антитіло або антигензв'язувальний фрагмент мають ІС50 приблизно 75 пМ або менше або приблизно 50 пМ або менше, або навіть приблизно 20 пМ або менше. У другому аспекті антитіло згідно з винаходом містить варіабельну область важкого ланцюга (HCVR), вибрану з групи, яка складається з послідовностей або по суті схожої послідовності. У третьому аспекті антитіло згідно з винаходом містить варіабельну область і легкого ланцюга (LCVR), вибрану з групи, що складається з послідовностей 1 UA 98943 C2 або по суті схожої послідовності. В одному варіанті антитіло або фрагмент антитіла згідно з винаходом містить HCVR і LCVR (HCVR/LCVR), вибрані з групи, що складається з послідовностей 5 10 У переважному варіанті антитіло або фрагмент антитіла містять HCVR/LCVR, вибрані з послідовностейSEQ ID NO: 51/59, 259/267, 275/283, 291/299, 579/59 або 581/59. У четвертому аспекті винахід стосується молекул нуклеїнових кислот, що кодують HCVR, при цьому молекула нуклеїнової кислоти являє собою нуклеотидну послідовність, вибрану з групи, що складається з послідовностей 15 або по суті ідентичної послідовності, що має з ними щонайменше 95% гомологію. У п'ятому аспекті винахід стосується молекул нуклеїнових кислот, що кодують LCVR, при цьому молекула нуклеїнової кислоти являє собою послідовність, вибрану з групи, що складається з послідовностей або по суті ідентичної послідовності, що має з ними щонайменше 95% гомологію. В одному варіанті антитіло згідно з винаходом містить HCVR і LCVR, що кодуються парою нуклеотидних послідовностей, вибраною з групи, що складається з послідовностей 2 UA 98943 C2 5 10 15 20 25 30 35 40 45 У переважному варіанті антитіло або фрагмент антитіла містять HCVR/LCVR, що кодуються нуклеотидними послідовностями, вибраними з послідовностей SEQ ID NO: 50/58, 258/266, 274/282, 290/298, 578/58 або 580/58. У шостому аспекті відмітною ознакою винаходу є антитіло або антигензв'язувальний фрагмент антитіла, які специфічно зв'язують hIL-4R, що містить три визначальні компліментарність області важкого ланцюга і три визначальні компліментарність області легкого ланцюга (CDR), де 1 2 3 4 5 6 7 CDR1 важкого ланцюга містить амінокислотну послідовність формули X -Х -Х -Х -Х -Х -Х 8 1 2 3 4 5 6 Х (SEQ ID NO: 582), де X = Gly; X = Туr або Phe; X = Thr або I; X = Phe; X = Asn або Arg; X = 7 8 Ser; X = Tyr і X = Gly; 1 2 3 4 5 6 7 CDR2 важкого ланцюга містить амінокислотну послідовність формули X -Х -Х -Х -Х -Х -Х 8 1 2 3 4 5 Х (SEQ ID NO: 583), де X = Не, X = Ser або Arg, X = Thr або Туr, X = Tyr або Asp, X = Asn 6 7 8 або Gly, X = Gly або Ser, X = Lys або Asn, і X = Thr; 1 2 3 4 5 6 7 CDR3 важкого ланцюга містить амінокислотну послідовність формули X -Х -Х -Х -Х -Х -Х 8 9 10 11 12 13 14 15 16 17 18 19 20 21 1 2 Х -Х -Х -Х -Х -Х -Х -Х -Х -Х -Х -Х -Х -Х (SEQ ID NO: 584), де X = Ala або Val, X = Arg 3 4 5 6 7 8 або Lys, X = Asp або Glu, X = Gly або Glu, X = Ala або Arg, X = Arg або Ser, X = He або Gly, X 9 10 11 12 13 = Val або Ser, X = Val або Trp, X = Ala або Phe, X = Gly або Asp, X = Thr або Pro, X = Thr 14 15 16 17 або відсутній, X = Pro або відсутній, X = Туr або відсутній, X = Туr або відсутній, X = Туr 18 19 20 21 або відсутній, X = Gly або відсутній, X = Met або відсутній, X = Asp або відсутній і X = Val або відсутній; 1 2 3 4 5 6 CDR1 легкого ланцюга містить амінокислотну послідовність формули X -X -Х -Х -Х -Х (SEQ 1 2 3 4 5 6 ID NO: 585), де X = Gin, X = Asp або Ala, X = Не, X = Ser або Asn, X = Asn або Не і X = Trp або Phe; 1 2 3 CDR2 легкого ланцюга містить амінокислотну послідовність формули X -X -X (SEQ ID NO: 1 2 3 586), де X = Ala або Val, X = Ala або Thr, і X = Ser; і 1 2 3 4 5 6 7 CDR3 легкого ланцюга містить амінокислотну послідовність формули X -X -Х -Х -Х -Х -Х 8 9 1 2 3 4 5 6 Х -Х (SEQ ID NO: 587), де X = Gln, X = Gln, X = Ala або Tyr, X = Asn, X = Ser, X = Phe або 7 8 9 His, X = Pro, X = He або Trp, і X = Thr. У сьомому аспекті винахід стосується антитіла або антингезв'язувального фрагменту, що містить CDR3 важкого ланцюга і CDR3 легкого ланцюга, де домен CDR3 важкого ланцюга вибраний з групи, що складається з послідовностей SEQ ID NO: 9, 25, 41, 57, 73, 89, 105, 121, 137, 153, 169, 185, 201, 217, 233, 249, 265, 281, 297, 313, 329, 345, 361 і 377; і домен CDR3 легкого ланцюга вибраний з групи, що складається з SEQ ID NO: 17, 33, 49, 65, 81, 97, 113, 129, 145, 161, 177, 193, 209, 225, 241, 257, 273, 289, 305, 321, 337, 353, 369 і 385. У переважному варіанті області CDR3 важкого ланцюга і легкому ланцюга вибрані з пар послідовностей SEQ ID NO: 57 і 65; 265 і 273; 281 і 289; і 297 і 305. У наступному варіанті відмітною ознакою винаходу є антитіло людини або фрагмент антитіла, що містить домен CDR1 важкого ланцюга, вибраний з групи, що складається з послідовностей SEQ ID NO: 5, 21, 37, 53, 69, 85, 101, 117, 133, 149, 165, 181, 197, 213, 229, 245, 261, 277, 293, 309, 325, 341, 357 і 373, або по суті схожої з ними послідовності; домен CDR2 важкого ланцюга, вибраний з групи, що складається з послідовностей SEQ ID NO: 7, 23, 39, 55, 71, 87, 103, 119, 135, 151, 167, 183, 199, 215, 231, 247, 263, 279, 295, 311, 327, 343, 359 і 375, або по суті схожої з ними послідовності; домен CDR3 важкого ланцюга, вибраний з групи, що складається з послідовностей SEQ ID NO: 9, 25, 41, 57, 73, 89, 105, 121, 137, 153, 169, 185, 201, 217, 233, 249, 265, 281, 297, 313, 329, 345, 361 і 377, або по суті схожої з ними послідовності; домен CDR1 легкого ланцюга, вибраний з групи, що складається з послідовностей SEQ ID NO: 3 UA 98943 C2 5 10 15 20 25 30 35 40 45 50 55 60 13, 29, 45, 61, 77, 93, 109, 125, 141, 157, 173, 189, 205, 221, 237, 253, 269, 285, 301, 317, 333, 349, 365 і 381 або по суті схожої з ними послідовності; домен CDR2 легкого ланцюга, вибраний з групи, що складається з послідовностей SEQ ID NO: 15, 31, 47, 63, 79, 95, 111, 127, 143, 159, 175, 191, 207, 223, 239, 255, 271, 287, 303, 319, 335, 351, 367 і 383, або по суті схожої з ними послідовності; і домен CDR3 легкого ланцюга, вибраний з групи, що складається з послідовностей SEQ ID NO: 17, 33, 49, 65, 81, 97, 113, 129, 145, 161, 177, 193, 209, 225, 241, 257, 273, 289, 305, 321, 337, 353, 369 і 385 або по суті схожих з ними послідовностей. У переважному варіанті антитіло або антигензв'язувальний фрагмент містять області CDR важкого ланцюга SEQ ID NO: 53, 55, 57 і області CDR легкого ланцюга SEQ ID NO: 61, 63, 65; області CDR важкого ланцюга SEQ ID NO: 261, 263, 265 і області CDR легкого ланцюга SEQ ID NO: 269, 271, 273; області CDR важкого ланцюга SEQ ID NO: 277, 279, 281 і області CDR легкого ланцюга SEQ ID NO: 285, 287, 289; і області CDR важкого ланцюга SEQ ID NO: 293, 295, 297 і області CDR легкого ланцюга SEQ ID NO: 301, 303, 305. У восьмому аспекті винахід стосується антитіла або антигензв'язувального фрагменту, що містить три CDR з HCVR і три CDR з LCVR, при цьому HCVR/LCVR вибрані з групи, що складається з 51/59, 579/59, 581/59, 259/267, 275/283 і 291/299. В одному варіанті відмітною ознакою винаходу є антитіло людини або фрагмент антитіла, що містить CDR3 важкого ланцюга і легкого ланцюга, де CDR3 важкого ланцюга кодується нуклеотидною послідовністю, вибраною з групи, що складається з послідовностей SEQ ID NO: 8, 24, 40, 56, 72, 88, 104, 120, 136, 152, 168, 184, 200, 216, 232, 248, 264, 280, 296, 312, 328, 344, 360 і 376; і CDR3 легкого ланцюга кодується нуклеотидною послідовністю, вибраною з групи, що складається з послідовностей SEQ ID NO: 16, 32, 48, 64, 80, 96, 112, 128, 144, 160, 176, 192, 208, 224, 240, 256, 272, 288, 304, 320, 336, 352, 368 і 384. У наступному варіанті відмітною ознакою винаходу є антитіло людини або фрагмент антитіла, що містить домен CDR1 важкого ланцюга кодований нуклеотидною послідовністю, вибраною з групи, що складається з послідовностей SEQ ID NO: 4, 20, 36, 52, 68, 84, 100, 116, 132, 148, 164, 180, 196, 212, 228, 244, 260, 276, 292, 308, 324, 340, 356 і 372 або по суті ідентичної послідовності, що має з ними щонайменше 95% гомологію; домен CDR2 важкого ланцюга кодований нуклеотидною послідовністю, вибраною з групи, що складається з послідовностей SEQ ID NO: 6, 22, 38, 54, 70, 86, 102, 118, 134, 150, 166, 182, 198, 214, 230, 246, 262, 278, 294, 310, 326, 342, 358 і 374 або по суті ідентичної послідовності, що має з ними щонайменше 95% гомологію; домен CDR3 важкого ланцюга кодований нуклеотидною послідовністю, вибраною з групи, що складається з послідовностей SEQ ID NO: 8, 24, 40, 56, 72, 88, 104, 120, 136, 152, 168, 184, 200, 216, 232, 248, 264, 280, 296, 312, 328, 344, 360 і 376 або по суті схожої послідовності, що має з ними щонайменше 95% гомологію; домен CDR1 легкого ланцюга кодований нуклеотидною послідовністю, вибраною з групи, що складається з послідовностей SEQ ID NO: 12, 28, 44, 60, 76, 92, 108, 124, 140, 156, 172, 188, 204, 220, 236, 252, 268, 284, 300, 316, 332, 348, 364 і 380 або по суті схожої послідовності, що має з ними щонайменше 95% гомологію; домен CDR2 легкого ланцюга кодований нуклеотидною послідовністю, вибраною з групи, що складається з послідовностей SEQ ID NO: 14, 30, 46, 62, 78, 94, 110, 126, 142, 158, 174, 190, 206, 222, 238, 254, 270, 286, 302, 318, 334, 350, 366 і 382 або по суті схожої послідовності, що має з ними щонайменше 95% гомологію; і домен CDR3 легкого ланцюга кодований нуклеотидною послідовністю, вибраною з групи, що складається з послідовностей SEQ ID NO: 16, 32, 48, 64, 80, 96, 112, 128, 144, 160, 176, 192, 208, 224, 240, 256, 272, 288, 304, 320, 336, 352, 368 і 384, або по суті схожої послідовності, що має з ними щонайменше 95% гомологію. У переважному варіанті антитіло або антигензв'язувальний фрагмент містить області CDR важкого ланцюга, що кодуються нуклеотидними послідовностями SEQ ID NO: 52, 54, 56, і області CDR легкого ланцюга, що кодуються нуклеотидними послідовностями SEQ ID NO: 60, 62, 64; області CDR важкого ланцюга, що кодуються нуклеотидними послідовностями SEQ ID NO: 260, 262, 264, і області CDR легкого ланцюга, що кодуються нуклеотидними послідовностями SEQ ID NO: 268, 270, 272; області CDR важкого ланцюга, що кодуються нуклеотидними послідовностями SEQ ID NO: 276, 278, 280, і області CDR легкого ланцюга, що кодуються нуклеотидними послідовностями SEQ ID NO: 284, 286, 288; і області CDR важкого ланцюга, що кодуються нуклеотидними послідовностями SEQ ID NO: 292, 294, 296, і області CDR легкого ланцюга, що кодуються нуклеотидними послідовностями SEQ ID NO: 300, 302, 304. Винахід охоплює анти-hIL-4R-антитіла, що мають модифіковану картину глікозилування. У деяких застосуваннях може бути корисна модифікація для видалення небажаних сайтів глікозилування, або антитіло, в якому відсутній залишок фукози, присутній на олігосахаридному ланцюгу, наприклад, щоб збільшити функцію антитіло залежної клітинної цитотоксичності 4 UA 98943 C2 5 10 15 20 25 30 35 40 45 50 55 60 (ADCC) (дивись Shield et al. (2002) JBC 277: 26733). В інших застосуваннях може бути здійснена модифікація галактозилування, щоб модифікувати комплемент-залежну цитотоксичність (CDC). У дев'ятому аспекті винахід стосується рекомбінантних експресуючих векторів, що несуть молекули нуклеїнових кислот згідно з винаходом, і до клітин-хазяїнів, в які введені такі вектори, а також до способів одержання антитіл або антигензв'язувальних фрагментів згідно з винаходом, клітин-хазяїнів, що одержуються за допомогою культивування згідно з винаходом. Клітиною-хазяїном може бути прокаріотична або еукаріотична клітина, переважно клітиноюхазяїном є клітина Е. coli або клітина ссавця, така як клітина СНО. У десятому аспекті відмітною ознакою винаходу є композиція, що містить рекомбінантне антитіло людини, яке специфічно зв'язує hIL-4R, і прийнятний носій. В одинадцятому аспекті відмітною ознакою винаходу є способи інгібування активності hIL-4 з використанням антитіла або його антигензв'язувальної частини згідно з винаходом. У конкретних варіантах антитіла згідно з винаходом також блокують зв'язування комплексу hIL13/hIL-13R1 з hIL-4R. В одному варіанті спосіб включає контактування hIL-4R з антитілом згідно з винаходом або його антигензв'язувальною частиною, так що інгібується активність hIL-4 або hIL-4/hIL-13. В іншому варіанті спосіб включає введення антитіла згідно з винаходом або його антигензв'язувальної частини людині, що страждає порушенням, яке послаблюється при інгібуванні активності hIL-4 або hIL-4/hIL-13. Порушенням, яке можна лікувати, є будь-яке захворювання або стан, який поліпшується, послаблюється, інгібується або запобігається за допомогою видалення, інгібування або зменшення активності hIL-4 або hIL-4/hIL-13. Крім того, в обсяг винаходу входить застосування антитіла або антигензв'язувального фрагмента антитіла згідно з будь-ким з пунктів формули винаходу 1-9 у виробництві лікарського засобу для застосування з метою послаблення або інгібування IL-4-опосередкованого захворювання або порушення у людини. Опосередковане IL-4 порушення або споріднені порушення, які можна лікувати антитілами або фрагментами антитіл згідно з винаходом включають, наприклад, артрит (включаючи септичний артрит), герпетиформні захворювання, хронічну ідіопатичну кропивницю, склеродерму, гіпертрофічне рубцювання, хворобу Уїппла, доброякісну гіперплазію простати, легеневі порушення, такі як астма в легкій, помірній або важкій формі, запальні порушення, таке як запальне захворювання кишечнику, алергічні реакції, хвороба Кавасакі, серпоподібноклітинну хворобу, синдром Черджа-Строса, дифузний токсичний зоб, прееклампсію, синдром Шегрена, аутоімунний лімфопроліферативний синдром, аутоімунну гемолітичну анемію, стравохід Барретта, аутоімунний увеїт, туберкульоз і нефроз. Інші об'єкти і переваги будуть очевидні при розгляді наступного далі докладного опису. Фіг. 1 (А-С). Оцінка профілю зв'язування антитіл, одержана в аналізі послідовного зв'язування на основі OCTET™. Фіг. 1(А) являє собою гістограму, на якій показані результати, одержані в тому випадку, коли першим антитілом, на яке діють зв'язаним антигеном, є контрольне антитіло. Фіг. 1(В): першим антитілом, на яке діють зв'язаним антигеном, є VAB16F3-1. Фіг. 1(С): першим антитілом, на яке діють зв'язаним антигеном, є VAK5H4-4. Друге антитіло: 1 = контроль; 2 = VX4E7-9; 3 = VX3F7-6; 4 = VAB16G-1; 5 = VAB16F3-1; 6 = VAB15C817; 7 - VAB11G8-1; 8 = VAB10C1-5; 9 = VAB10G8-19; 10 = VAB8G10-1; 11 = VAB7B9-3; 12 = VAB6C10-14; 13 = VAB5C5-11; 14 = VAB3B4-10; 15 = VAB4D5-3; 16 = VAB1H1-2; 17 = VAK5H4-4; 18 = VAK7G8-5; 19 = VAK8G11-13; 20 = VAK9C6-11; 21 = VAK10G6-7; 22 = VAK11D4-1; 23 = VAK12B11-9; і 24 = VAK10G12-5. Незаштриховані стовпчики показують рівень зв'язування першого антитіла, заштриховані стовпчики показують додаткове зв'язування другим антитілом. Перед описом способів, потрібно вказати, що даний винахід не обмежений конкретними способами і описаними умовами експериментів, оскільки такі способи і умови можуть варіювати. Також потрібно розуміти, що термінологія, яка використовується в даному описі, використовується тільки з метою опису конкретних варіантів і не призначена для обмеження, оскільки обсяг даного винаходу буде обмежений тільки прикладеною формулою винаходу. Якщо не обумовлено особливо, всі технічні і наукові терміни, що використовуються в даному описі, мають таке ж значення, яке зазвичай розуміє фахівець в тій галузі, до якої належить даний винахід. Хоча при практичному здійсненні або перевірці даного винаходу можна використовувати будь-які способи і матеріали, схожі або еквівалентні способам і матеріалам, описаним в даний публікації, нижче описані переважні способи і матеріали. Визначення Термін «IL4R людини» (hIL-4R) в значенні, що використовується в даному описі, стосується рецептору цитокіну людини, який специфічно зв'язує інтерлейкін-4 (IL-4), IL-4R (SEQ ID NO: 1). Термін «інтерлейкін-13 людини» (hIL-13) стосується цитокіну, який специфічно зв'язує рецептор IL-13, і термін «комплекс hIL-13/hIL-13R1» стосується комплексу, утвореного при зв'язуванні hIL 5 UA 98943 C2 5 10 15 20 25 30 35 40 45 50 55 60 13 з комплексом hIL-13R1, і такий комплекс зв'язує рецептор hIL-4, ініціюючи біологічну активність. Розуміється, що термін «антитіло» в значенні, що використовується в даному описі, стосується молекул імуноглобуліну, що містять чотири поліпептидні ланцюга, два важких (Н) ланцюга і два легких (L) ланцюга, з'єднані дисульфідними зв'язками. Кожний важкий ланцюг містить варіабельну область важкого ланцюга (що скорочено називається в даному описі HCVR або VH) і константну область важкого ланцюга. Константна область важкого ланцюга містить три домени, СН1, СН2 і СН3. Кожний легкий ланцюг містить варіабельну область легкого ланцюга (що скорочено називається в даному описі LCVR або VL) і константну область легкого ланцюга. Константна область легкого ланцюга містить один домен (CL1). Області VH і VL можуть бути додатково поділені на області гіперваріабельності, звані областями, що визначають компліментарність (CDR), між якими знаходяться більш консервативні області, звані каркасними областями (FR). Кожна VH і VL складається з трьох CDR і чотирьох FR, які розподілені від аміно-кінця до карбоксильного кінця в наступному порядку: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Термін «антигензв'язувальна частина» антитіла (або просто «частина антитіла» або «фрагмент антитіла») в значенні, що використовується в даному описі стосується одного або декількох фрагментів антитіла, які зберігають здатність специфічно зв'язуватися з антигеном (наприклад, hIL-4R). Було показано, що антигензв'язувальна функція антитіла може здійснюватися фрагментами повнорозмірного антитіла. Приклади зв'язуючих фрагментів, що охоплюються терміном «антигензв'язувальна частина» антитіла, включають (і) Fab-фрагмент, моновалентний фрагмент, що складається з доменів VL, VH, CL1 і СН 1; (іі) F(аb')2фрагмент, бівалентний фрагмент, що містить два F(ab)'-фрагменти, зв'язаний дисульфідним зв'язком в шарнірній області; (ііі) Fd-фрагмент, що складається з доменів VH і СН1; (iv) Fvфрагмент, що складається з доменів VL і VH одного плеча антитіла, (v) dAb-фрагмент (Ward et al. (1989) Nature 241: 544-546), який складається з домену VH; і (vi) ізольовану область, що визначає компліментарність (CDR). Крім того, хоча два домени Fv-фрагмента, VL і VH, кодуються окремими генами, вони можуть бути пов'язані з використанням способів рекомбінації синтетичним лінкером, який дозволяє одержувати з них один безперервний ланцюг, в якому області VL і VH складають пару з утворенням моновалентних молекул (відомих як одноланцюжковий Fv (scFv); дивись, наприклад, Bird et al. (1988) Science 242: 423-426; і Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85: 5879-5883. Також розуміється, що такі одноланцюжкові антитіла охоплені терміном «антигензв'язувальна частина» антитіла. Інші форми одноланцюжкових антитіл, такі як димерні антитіла, також підпадають під такий термін (дивись, наприклад, Holliger et al. (1993) Proc. Natl. Acad Sci. USA 90: 6444-6448). «Нейтралізуюче» або «блокуюче» антитіло в значенні, що використовується в даному описі, стосується антитіла, зв'язування якого з hIL-4R призводить до інгібування біологічної активності hIL-4 і/або hIL-13. Таке інгібування біологічної активності hIL-4 і/або IL-13 можна оцінити вимірюванням одного або декількох індикаторів біологічної активності hIL-4 і/або hIL-13, відомих в даній галузі, таких як індукована hIL-4- і/або IL-13 активація клітин і зв'язування hIL-4 з hIL-4R (дивись приклади нижче). «CDR» або область, що визначає компліментарність, являє собою область гіперваріабельності, з розсіяними всередині її областями, які є більш консервативними, званими «каркасними областями» (FR). В інших варіантах анти-hIL-4R-антитіла або фрагменти згідно з винаходом FR можуть бути ідентичними послідовностям зародкової лінії людини або можуть бути природними або штучно модифікованими. Термін «поверхневий плазмонний резонанс» в значенні, що використовується в даному описі, стосується оптичного явища, яке дозволяє провести аналіз взаємодій в режимі реального часу за допомогою реєстрації змін в концентраціях білків на біосенсорній матриці, наприклад, використовуючи систему BIAcore™ (Pharmacia Biosensor AB). Термін «епітоп» означає антигенну детермінанту, яка взаємодіє зі специфічною антигензв'язувальною ділянкою у варіабельній області молекули антитіла, відомою як паратоп. Один антиген може мати більше одного епітопа. Епітопи можуть бути або корформаційними, або лінійними. Конформаційний епітоп утворюється просторово близькі амінокислоти з різних ділянок лінійного поліпептидного ланцюга. Лінійний епітоп утворюється сусідніми амінокислотними залишками в поліпептидному ланцюгу. У деяких випадках епітоп може містити залишки сахаридів, групи фосфорилу або сульфонільні групи антигену. Термін «значна ідентичність» або «по суті ідентичний» в тому випадку, коли він стосується нуклеїнової кислоти або її фрагмента, вказує, що при оптимальному вирівнюванні з відповідними інсерціями або делеціями нуклеотидів з іншою нуклеїновою кислотою (або 6 UA 98943 C2 5 10 15 20 25 30 35 40 45 50 55 60 комплементарною їй ниткою), має місце ідентичність нуклеотидних послідовностей, що становить щонайменше близько 95% і більш переважно щонайменше приблизно 96%, 97%, 98% або 99% нуклеотидних основ, яку вимірюють, використовуючи будь-який добре відомий алгоритм визначення ідентичності послідовностей, наприклад FASTA, BLAST або Gap, які обговорюються нижче. По відношенню до поліпептидів термін «значна схожість» або «по суті схожий» означає, що дві пептидних послідовності при оптимальному вирівнюванні, наприклад, за допомогою програм GAP або BESTFIT і з використанням вагових оцінок за пропуск за умовчанням, мають щонайменше 95% ідентичність послідовностей, ще більш переважно щонайменше 98% або 99% ідентичність послідовностей. Переважно положення залишків, які не є ідентичними, відрізняються внаслідок консервативних амінокислотних замін. «Консервативна амінокислотна заміна» являє собою заміну, при якій залишок амінокислоти замінюють іншим амінокислотним залишком, що має бічний ланцюг (R-групу) зі схожими хімічними властивостями (наприклад, заряд або гідрофобність). Загалом, консервативна амінокислотна заміна не буде істотно змінювати функціональні властивості білка. У тих випадках, коли дві або більше амінокислотних послідовностей відрізняються одна від одної консервативними замінами, ідентичність послідовностей в процентах або ступінь схожості можна підвисити, коректуючи консервативну природу заміни. Способи здійснення такого коректування добре відомі фахівцям в даній галузі. Дивись, наприклад, Pearson (1994) Methods Mol. Biol. 24: 307-331. Приклади груп амінокислот, які мають бічні ланцюги зі схожими хімічними властивостями, включають (1) аліфатичні бічні ланцюги: гліцин, аланін, валін, лейцин і ізолейцин; (2) аліфатичні-гідроксильні бічні ланцюги: серин і треонін; (3) бічні ланцюги, що містять амід: аспарагін і глутамін; (4) ароматичні бічні ланцюги: фенілаланін, тирозин і триптофан; (5) основні бічні ланцюги: лізин, аргінін і гістидин; (6) кислі бічні ланцюги: аспартат і глутамат, і (7) бічні ланцюги, що містять сірку: цистеїн і метіонін. Переважні групи консервативних замін амінокислот: валін-лейцин-ізолейцин, фенілаланін-тирозин, лізин-аргінін, аланін-валін, глутамат-аспартат і аспарагін-глутамін. Альтернативно консервативною заміною є будь-яка зміна, що має позитивне значення при оцінці з використанням матриці логарифмічної функції правдоподібності РАМ250, описаної в Gonnet et al. (1992) Science 256: 1443-45. «Помірно консервативною» заміною є будь-яка зміна, що має не негативне значення при оцінці з використанням матриці логарифмічної функції правдоподібності РАМ250. Схожість послідовностей у випадку поліпептидів, яку також називають ідентичністю послідовностей, зазвичай вимірюють, використовуючи комп'ютерну програму аналізу послідовностей. Комп'ютерна програма аналізу білків зіставляє схожі послідовності, використовуючи параметри схожості з урахуванням різних замін, делецій і інших модифікацій, включаючи консервативні амінокислотні заміни. Наприклад, комп'ютерна програма GCG містить такі програми, як Gap і Bestfit, які можуть бути використані з параметрами за умовчанням, щоб визначити гомологію послідовностей або ідентичність послідовностей між близько спорідненими поліпептидами, такими як гомологічні поліпептиди різних видів організмів, або між білком дикого типу і його мутантним варіантом. Дивись, наприклад, GCG Version 6.1. Поліпептидні послідовності також можна порівняти, використовуючи FASTA з параметрами за умовчанням або рекомендованими параметрами, програма в GCG Version 6.1. FASTA (наприклад, FASTA2 і FASTA3) забезпечує вирівнювання і дає процент ідентичності послідовностей в областях найкращого вирівнювання між запитуваною та досліджуваною послідовностями (Pearson (2000) вище). Іншим переважним алгоритмом при порівнянні послідовності згідно з винаходом з базою даних, що містить велику кількість послідовностей з різних організмів, є комп'ютерна програма BLAST, особливо BLASTP або TBLASTN з використанням параметрів за умовчанням. Дивись, наприклад, Altschul et al. (1990) J. Mol. Biol. 215: 403-410 і Altschul et al. (1997) Nucleic Acids Res. 25: 3389-402. Одержання антитіл людини Способи одержання антитіл людини включають, наприклад, Veloclmmune™ (Regeneron Pharmaceuticals), методику XenoMouse™ (Green et al. (1994) Nature Genetics 7: 13-21; Abgenix), спосіб «мінілокууа» і фаговий дисплей (дивись, наприклад, US 5545807, US 6787637). Методика Veloclmmune™ (US 6596541) включає спосіб одержання високоспецифічного повністю людського антитіла до вибраного антигену. Гризунів можна імунізувати будь-яким способом, відомим в даній галузі (дивись, наприклад, Harlow and Lane (1988) вище; Malik and Lillehoj (1994) Antibody techniques, Academic Press, CA). У переважному варіанті антиген hIL-4R вводять безпосередньо мишам, які мають локуси ДНК, що кодують і варіабельну область важкого ланцюга, і варіабельну область легкого ланцюга каппа Ig людини (Veloclmmune™, Regeneron Pharmaceuticals, Inc.; US 6596541), з ад'ювантом, 7 UA 98943 C2 5 10 15 20 25 30 35 40 45 50 55 60 щоб стимулювати імунну відповідь, наприклад, повним або неповним ад'ювантом Фрейнда, системою ад'ювантів MPL+TDM (Sigma) або RIBI (мураміл-дипептиди) (дивись O'Hagan (2000) Vaccine Adjuvant, Human Press, NJ). Ад'ювант може запобігати швидкого розсіяння поліпептиду в результаті секвестрації антигену в локальному депо і може містити фактори, які можуть стимулювати імунну відповідь хазяїна. Методика Veloclmmune™ полягає в створенні трансгенної миші, що має геном, що містить варіабельні області важкого і легкого ланцюга людини, функціонально зв'язаними з ендогенними локусами константних областей миші, так що миша продукує антитіло, що містить варіабельну область людини і константну область миші, у відповідь на антигенну стимуляцію. ДНК, що кодує варіабельні області важкого і легкого ланцюгів антитіла, виділяють і функціонально зв'язують з ДНК, що кодує константні області важкого і легкого ланцюга людини. Потім ДНК експресують в клітині, здатній експресувати повністю людське антитіло. У конкретному варіанті клітина являє собою клітину СНО. Антитіла можуть бути терапевтично застосовні в блокуванні взаємодії ліганд-рецептор або інгібуванні взаємодії компонентів рецептора, а не для того, щоб викликати загибель клітин внаслідок фіксації комплементу (комплемент залежна цитотоксичність) (CDC) і участі залежної від антитіл опосередкованої клітинами цитотоксичності (ADCC). Константна область антитіла є важливою для забезпечення здатності антитіла фіксувати комплемент і опосередковувати залежну від клітин цитотоксичність. Таким чином, ізотип антитіла може бути вибраний на основі того, чи потрібно опосередковування цитотоксичності антитілом. Імуноглобуліни людини можуть існувати в двох формах, які пов'язані з гетерогенністю шарніра. В одній формі молекула імуноглобуліну містить стабільну структуру з чотирьох ланцюгів з молекулярною масою приблизно 150-160 кД, в якій димери містяться разом міжланцюжковим дисульфідним зв'язком між важкими ланцюгами. У другій формі димери не зв'язані за допомогою міжланцюжкових дисульфідних зв'язків, і молекула з молекулярною масою приблизно 75-80 кД утворена ковалентно зв'язаними легким і важким ланцюгами (напівантитіло). Такі форми дуже важко відділити навіть після афінного очищення. Частота появи другої форми в різних інтактних ізотипах IgG є наслідком, але не обмежена, структурними відмінностями, пов'язаними з шарнірною областю ізотипу антитіла. Дійсно одинична амінокислотна заміна в шарнірній області шарніра IgG4 людини може істотно зменшувати появу другої форми (Angal et al. (1993) Molecular Immunology 30: 105) до рівнів, що зазвичай спостерігаються з використанням шарніра IgG1 людини. Даний винахід охоплює антитіла, що мають одну або декілька мутацій в шарнірній області, в області СН2 або СН3, які можуть бути бажані, наприклад, при одержанні, щоб підвищити вихід необхідної форми антитіла. Антитіла згідно з винаходом переважно одержують із застосуванням методики Veloclmmune. Трансгенну мишу, у якої ендогенні варіабельні області важкого і легкого ланцюга імуноглобуліну замінені відповідними варіабельними областями людини, стимулюють представляючим інтерес антигеном і лімфатичні клітини (такі як В-клітини) витягують з організму мишей, які експресують антитіла. Лімфатичні клітини можуть бути злиті з лінією клітин мієломи, щоб одержати іморталізовані лінії клітин гібридоми, і такі лінії клітин гібридоми піддають скринінгу і селекції, щоб ідентифікувати лінії клітин гібридоми, які продукують антитіла, специфічні по відношенню до представляючого інтерес антигену. ДНК, що кодує варіабельні області важкого ланцюга і легкого ланцюга, може бути виділена і зв'язана з необхідними ізотипічними константними областями важкого ланцюга і легкого ланцюга. Такий білок антитіла може бути продукований в клітині, такій як клітина СНО. Альтернативно ДНК, що кодує антигенні-специфічні химерні антитіла або варіабельні області легкого і важкого ланцюгів, може бути виділена безпосередньо з антиген-специфічних лімфоцитів. В одному варіанті трансгенна миша містить до 18 функціональних генів варіабельних областей важкого ланцюга людини і 12 функціональних генів варіабельних областей легкого ланцюга каппа людини. В іншому варіанті трансгенна миша містить до 39 генів варіабельних областей важкого ланцюга людини і 30 генів варіабельних областей легкого ланцюга каппа людини. У ще одному варіанті трансгенна миша містить до 80 генів варіабельних областей важкого ланцюга людини і 40 генів варіабельної області легкого ланцюга каппа людини. Загалом, антитіла згідно з даним винаходом мають дуже високі афінності, звичайно мають -9 -12 KDS приблизно від 10 до 10 М, які вимірюють за допомогою зв'язування з антигеном, або іммобілізованим на твердій фазі, або в розчині. Спочатку виділяють високоафінні химерні антитіла, що мають варіабельну область людини і константну область миші. Як описано нижче, антитіла характеризують і піддають селекції відносно необхідних властивостей, включаючи афінність зв'язування з ML-4R, здатність блокувати зв'язування hIL-4 з hIL-4R і/або вибірковість по відношенню до білка людини. Константні області миші замінюють необхідними константними областями людини, щоб 8 UA 98943 C2 5 10 15 20 25 30 35 40 45 50 55 створити повністю людські антитіла згідно з винаходом, наприклад дикого типу або модифікованих IgG4 або IgG1 (наприклад, SEQ ID NO: 588, 589, 590). У той час як вибирана константна область може варіювати залежно від конкретного застосування, такі властивості, як високоафінне зв'язування антигену і специфічність по відношенню до мішені властиві варіабельній області. Картування епітопів і споріднені методики Для здійснення скринінгу антитіл, які зв'язуються з конкретним епітопом, можна здійснити звичайний аналіз перехресного блокування, такий як аналіз, описаний в Antibodies: A Laboratory Manual 1988 Cold Spring Harbor Laboratory, Harlow and Lane, eds. Інші способи включають аналіз мутантів, що одержуються при аналіновому скануванні, пептидні блоти (Reineke (2004) Methods Mol. Biol, 248: 443-63) або аналіз розщеплення пептидів. Крім того, можна використовувати такі способи, як вирізання епітопу, видалення епітопу і хімічну модифікацію антигенів (Tomer (2000) Protein Science, 9: 487-496). Аналіз профілю, заснований на модифікації (МАР), також відомий як аналіз профілю на основі структури антигену (ASAP), являє собою спосіб, який дозволяє класифікувати великі кількості моноклональних антитіл (мАт), направлених проти одного і того ж антигену на основі схожості профілю зв'язування кожного антитіла з хімічно або ферментативно модифікованими поверхнями антигенна (публікація заявки на видачу патенту США No. 2004/0101920). Кожна категорія може відображати унікальний епітоп або явно відмінний, або частково такий, що перекривається з епітопом, представленим в іншій категорії. Така методика дозволяє швидко відфільтровувати генетично ідентичні антитіла, так що характеристика може бути сфокусована на генетично різних антитілах. У випадку застосування при скринінгу гібридом МАР може полегшувати ідентифікацію рідких клонів гібридоми з необхідними властивостями. МАР можна застосовувати для сортування hIL-4R-антитіл згідно з винаходом на групи антитіл, що зв'язують різні епітопи. Агентами, застосовними для зміни структури іммобілізованого антигену, є ферменти, такі як, наприклад, протеолітичні ферменти, і хімічні агенти. Білок антигену може бути іммобілізований або на поверхнях біосенсорних чипів, або на кульках з полістиролу. Останні можуть зазнавати аналізу, такого як мультиплексний аналіз для реєстрації Luminex™ (Luminex Corp., TX). Внаслідок того, що Luminex™ здатний здійснювати мультиплексний аналіз до 100 різних типів кульок, Luminex забезпечує майже необмежені поверхні антигенів з різними модифікаціями, що призводить до підвищеної розділювальної здатності в аналізі профілю епітопів антитіл за допомогою біосенсорного аналізу. Терапевтичне введення і препарати Введення терапевтичних засобів згідно з винаходом можна здійснювати разом з відповідними носіями, ексципієнтами і іншими агентами, які включають в препарати, щоб забезпечити поліпшене перенесення, доставку, переносимість і тому подібне. Множину придатних препаратів можна знайти в довідниках, відомих всім фахівцям в галузі фармацевтичної хімії: Remington: The Science and Practice of Pharmacy (2003, 20th ed, Lippincott Williams and Wilkins). До таких препаратів належать, наприклад, порошки, пасти, мазі, желе, віск, масла, ліпіди, що містить ліпіди (катіонні або аніонні) везикули (такі як LIPOFECTIN™), ДНК-кон'югати, безводні пасти, що всмоктуються, емульсії типу «масло у воді» і «вода в маслі», карбовакс (поліетиленгліколі різної молекулярної маси), напівтверді гелі і напівтверді суміші, що містять карбовакс. Будь-яка з вказаних вище сумішей може бути придатною для лікування і терапії згідно з даним винаходом, за умови, що активний інгредієнт в препараті не інактивується іншими компонентами препарату, і препарат є фізіологічно сумісним і переносимым у випадку шляху введення, що використовується. Дивись також Powell et al. «Compendium of excipients for parenteral formulations» PDA (1998) J. Pharm. Sci. Technol. 52: 238-311 і цитовані у вказаній роботі публікації для одержання додаткової інформації, пов'язаної з ексципієнтами і носіями, добре відомими фахівцям в галузі фармацевтичної хімії. Терапевтичні молекули згідно з винаходом можна вводити пацієнту таким способом, який підходить для даного показання, наприклад, парентерально, місцево або шляхом інгаляції. У випадку ін'єкції антагоніст можна вводити, наприклад, внутрішньосуглобовим, внутрішньовенним, внутрішньом'язовим шляхом, у вогнище ураження, внутрішньочеревинним або підшкірним шляхами, за допомогою болюсної ін'єкції або безперервної інфузії. Передбачається і локальне введення в місце захворювання або пошкодження, як наприклад, трансдермальна доставка і уповільнене вивільнення з імплантатів. Доставка шляхом інгаляції включає, наприклад, назальну або пероральну інгаляцію, застосування розпилювача, інгаляцію антагоніста в аерозольній формі і тому подібне. Іншими альтернативними варіантами є очні 9 UA 98943 C2 5 10 15 20 25 30 35 40 45 50 55 60 краплі; пероральні препарати, включаючи пілюлі, сиропи, коржики або жувальні гумки; і місцеві препарати, такі як примочки, гелі, спреї і мазі. Конкретні дози і частота введення можуть варіювати залежно від таких факторів як шлях введення, природа і тяжкість захворювання, що піддається лікуванню, від того, чи є стан гострим або хронічним, і маси і загального стану здоров'я пацієнта. Відповідні дози можна визначити способами, відомими в даній галузі техніки, наприклад в клінічних випробуваннях, які можуть включати в себе дослідження з використанням зростаючих доз. Терапевтичні молекули згідно з винаходом можна вводити однократно або багато разів. У конкретних варіантах антитіло або фрагмент антитіла вводять протягом періоду часу, що становить щонайменше місяць або більше, наприклад один, два або три місяці або навіть необмежено. Для лікування хронічних станів зазвичай найбільш ефективне довготривале лікування. Однак для лікування гострих станів може вистачати введення протягом більш коротких періодів, наприклад від одного до шести тижнів. Загалом, терапевтичний засіб вводять аж до виявлення у пацієнта істотної з медичної точки зору міри поліпшення в порівнянні з початковим рівнем за вибраним показником або показниками. Рівень IL-4 можна контролювати під час і/або після лікування терапевтичною молекулою згідно з винаходом. Способи вимірювання рівнів IL-4 в сироватці відомі в даній галузі, наприклад з використанням ELISA і т.д. Терапевтичне застосування і комбінована терапія Антитіла і фрагменти антитіл згідно з винаходом застосовні для лікування захворювань і порушень, стан при яких можна поліпшувати, які можна інгібувати або послаблювати за допомогою зниження активності IL-4. Такі порушення включають порушення, що характеризуються аномальною або надмірною експресією IL-4 або аномальною відповіддю хазяїна на продукцію IL-4. Пов'язані з IL-4 порушення, які можна лікувати антитілами або фрагментами антитіл, включають, наприклад, артрит (включаючи септичний артрит), герпетиформні захворювання, хронічну ідіопатичну кропивницю, склеродерму, гіпертрофічне рубцювання, хвороба Уіппла, доброякісну гіперплазію простати, легеневі порушення, такі як астма (в легкій, помірній або важкій формі), запальні порушення, такі як запальне захворювання кишечнику, алергічні реакції, хвороба Кавасакі, серпоподібно-клітинну хворобу, синдром Черджа-Строса, дифузний токсичний зоб, прееклампсію, синдром Шегрена, аутоімунний лімфопроліферативний синдром, аутоімунну гемолітичну анемію, стравохід Барретта, аутоімунний увеїт, туберкульоз, атопічний дерматит, виразковий коліт, фіброз і нефроз (див. U.S. 7186809). Винахід стосується комбінованої терапії, при якій анти-IL-4R-антитіло або фрагмент антитіла вводять в комбінації з другим терапевтичним засобом. Спільне введення і комбінована терапія не обмежені одночасним введенням, а включають схеми лікування, при яких анти-ІL-4Rантитіло або фрагмент антитіла вводять щонайменше один раз в ході лікування, яке включає в себе введення пацієнту щонайменше одного іншого терапевтичного засобу. Другим терапевтичним засобом може бути інший антагоніст IL-4, такий як інше антитіло/фрагмент антитіла або розчинний рецептор цитокіну, антагоніст IgE, лікарський засіб проти астми (кортикостероїди, нестероїдні засоби, бета-агоністи, антагоністи лейкотрієну, ксантину, флутиказон, сальметерол, альбутерол), які можуть бути доставлені шляхом інгаляції або іншими придатними способами. У конкретному варіанті анти-ІL-4R-антитіло або фрагмент антитіла згідно з винаходом можуть бути введені з антагоністом IL-1, таким як рилонацепт, або антагоністом IL-13. Другий засіб може містити один або декілька антагоністів рецептора лейкотрієну для лікування таких порушень, як алергічні запальні захворювання, наприклад астма і алергії. Приклади антагоністів рецептора лейкотрієну включають без обмеження монтелукаст, пранлукаст і зафірлукаст. Другий засіб може містити інгібітор цитокіну, такий як один або декілька TNF (етанерцепт, ENBREL™), антагоніст IL-9, IL-5 або IL-17. Приклади. Наступні приклади пропонуються для того, щоб надати фахівцям в даній галузі повне розкриття і опис того, як одержувати і застосовувати композиції і способи згідно з винаходом, і приклади не призначені для обмеження обсягу, який автори винаходу розглядають як свій винахід. Зроблені спроби забезпечити точність відносно використовуваних кількісних показників (наприклад, кількості, температури і т.д.), але потрібно враховувати деякі погрішності і відхилення. Якщо не обумовлено особливо, частини являють собою частини по масі, молекулярна маса є середньою молекулярною масою, температура вказана в градусах за Цельсієм, і тиск є атмосферним або близьким до атмосферного. Приклад, 1. Одержання антитіл людини до рецептору IL-4 людини. Мишей, що мають локуси ДНК, які кодують і варіабельну область важкого ланцюга і варіабельну область легкого ланцюга каппа Ig людини (Veloclmmune™, Regeneron 10 UA 98943 C2 5 10 15 20 25 30 35 Pharmaceuticals, Inc.; патент США No. 6596541) імунізували IL-4R людини (hIL-4R, SEQ ID NO: 1). hIL-4R вводили прямою ін'єкцією очищеного антигену в ад'юванті або опосередковано, введенням послідовності ДНК hIL-4R в ДНК-плазміді, яка містить ген hIL-4R і експресує hIL-4R, використовуючи апарат експресії білків клітин хазяїна, даючи антигенний поліпептид in vivo. Щоб одержати оптимальну імунну відповідь проводили подальші бустер-імунізації тварин кожні 3-4 тижні і забори крові проводили через 10 після кожної бустер-імунізації для оцінки розвитку відповіді проти антигену. Коли у мишей досягалася максимальна імунна відповідь, експресуючі антитіла В-клітини збирали і зливали з клітинами мієломи мишей з утворенням гібридом. Необхідні з функціональної точки зори моноклональні антитіла збирали за допомогою скринінгу кондиційованого середовища гібридом або трансфікованих клітин відносно специфічності, афінності зв'язування антигену і ефективності блокування зв'язування hIL-4 з hIL-4R (описано нижче). Відібрані антитіла, які мали необхідну афінність зв'язування антигену, ефективність і/або здатність блокування зв'язування hIL-4 з hIL-4R, включали (HCVR/LCVR): Приклад 2. Визначення афінності зв'язування антигену. Афінність зв'язування (KD) вибраних антитіл по відношенню до hIL-4R визначали за допомогою аналізу, в якому використовують біосенсори на основі поверхневого плазмонного резонансу в реальному часі (ВІАcore™ 2000). Коротко, антитіло може бути іммобілізоване на поверхні з поліклональних антитіл проти IgG GAM миші, створеної за допомогою прямого хімічного зв'язування IgG GAM з чипом ВІАcore™ з утворенням іммобілізованих на поверхні антитіл. Різні концентрації (в діапазоні від 12,5 нМ до 0,625 нМ) мономерного hIL-4R (R&D Systems) або димерного hIL-4R-hFc наносили за допомогою ін'єкції на поверхню з іммобілізованими антитілами. Зв'язування антигену з антитілом і дисоціацію зв'язаного комплексу спостерігали в режимі реального часу. Рівноважні константи дисоціації (KD) і константи швидкості дисоціації встановлювали, здійснюючи кінетичний аналіз з використанням комп'ютерної програми для оцінки даних ВІА. Комп'ютерну програму для оцінки даних ВІА також використовували для розрахунку часу напівжиття дисоціюючого комплексу антиген/антитіло (Т1/2). Результати показані в таблиці 1. Контроль: повністю людське анти-ІL-4T-антитіло (патент США No. 7186809; SEQ ID NO: 10 і 12). Результати кінетичних аналізів виявили, що відібрані антитіла містили високоафінні антитіла, які здатні зв'язуватися з димерним рецептором з KD менше 1 нМ. Також тестували афінність зв'язування анти-hIL-4R-антитіл з IL-4R або миші, або мавпи (Масаса fascicularis). Відібрані антитіла (1) перехресно не реагували з IL-4R миші; і (2) або не могли зв'язувати IL-4R мавпи, або зв'язували IL-4R мавпи з дуже низькою афінністю. 11 UA 98943 C2 Таблиця 1 Антитіло VX 4E7-9 VX 3F7-6 VAB 8G10-1 VAB 7B9-3 VAB 6C10-14 VAB 5C5-11 VAB 4D5-3 VAB 3B4-10 VAB 1H1-2 VAB 16G1-1 VAB 16F3-1 VAB 15C8-17 VAB 11G8-1 VAB 10G8-19 VAB 10C1-5 VAK8G11-13 VAK5H4-4 VAK10G6-7 VAK9C6-11 VAK7G8-5 VAK11D4-1 VAK12B11-9 VAK10G12-5 Контроль 5 10 15 20 25 KD димерний (пМ) 111 654 5,510 52 286 27 32 53 139 38 3 45 108 52 51 2 4 11 68 9 6 36 7 71 Т½ димерний (год) 19.1 2.7 4.1 6.1 6.2 7.7 20.4 20.4 8.2 7.3 41 3.6 8.7 2 6.7 63 30 24 7 25 21 12 46 2.1 KD мономерний (нМ) 1.43 3.91 7.71 1.01 1.77 0.13 2.02 0.59 34.90 0.93 0.02 0.82 1.63 11.40 4.47 0.03 0.02 0.23 2.05 0.06 0.05 0.41 0.09 1.23 Т½ мономерний (хв) 48 16 28 13 73 47 35 102 8 15 254 15 25 2 6 840 960 144 28 480 480 120 360 16 Афінність зв'язування антитіло-антиген також оцінювали, використовуючи аналіз конкурентного зв'язування в розчині на основі ELISA. Коротко, антитіла (очищені білки в концентрації 1 або 3,3 нг/мл) заздалегідь змішували з серійним розведенням антигенного білка (мономерного або димерного) в діапазоні від 0 до 10 мкг/мл. Розчини суміші антитіла і антигену потім інкубували протягом двох-чотирьох годин при кімнатній температурі, щоб досягнути рівноваги зв'язування. Потім вимірювали вільне антитіло в сумішах, використовуючи кількісний аналіз ELISA типу «сендвіч». Коротко, 96-ямкові планшети Maxisorp™ (VWR, West Chester, PA) покривали 2 мкг/мл білки hIL-4R-hFc в PBS протягом ночі при 4 °C з подальшим блокуванням неспецифічного зв'язування білком БСА. Потім розчини сумішей антитіло-антиген переносили в покриті планшети Maxisorb™ з подальшою одного динною інкубацією. Потім планшети промивали буфером для промивання і зв'язані з планшетом антитіла виявляли з використанням реагенту: кон'югованих з HRP поліклональних антитіл кози проти IgG миші (Jackson ImmunoResearch) або кон'югованих з HRP поліклональних антитіл кози проти IgG людини (Jackson ImmunoResearch) у випадку контрольного антитіла і обробляли, використовуючи колориметричний субстрат, такий як BD OptEIA™ (BD Biosciences Pharmingen, San Diego, CA). Після зупинки реакції 1 M фосфорною або сірчаною кислотою реєстрували оптичну густину при 450 нм і дані аналізували, використовуючи комп'ютерну програму GraphPad™ Prism. Залежність сигналів від концентрації антигену в розчині визначали, використовуючи аналіз, заснований на підгонці за чотирма параметрами, і виражали у вигляді ІС50, концентрації антигену, необхідної для досягнення 50% зниження сигналу від зразків антитіл у відсутність антигену в розчині. ІС50 визначали як описано вище і підсумовували в таблиці 2. В переважному варіанті антитіло або фрагмент антитіла згідно з винаходом має ІС 50 для димерного hIL-4R, що становить приблизно 20 пМ або менше, і ІС50 для мономерного hIL-4R приблизно 150 пМ або менше або приблизно 100 пМ або менше, яку вимірювали в аналізі конкуренції в розчині на основі ELISA. 12 UA 98943 C2 Таблиця 2 Антитіло VX 4E7-9 VX 3F7-6 VAB8G10-1 VAB 7B9-3 VAB6C10-14 VAB 5C5-11 VAB 4D5-3 VAB 3B4-10 VAB 1H1-2 VAB 16G1-1 VAB 16F3-1 VAB 15C8-17 VAB 11G8-1 VAB 10GB-19 VAB 10C1-5 VAK 5H4-4 VAK 7G8-5 VAK 8G11-13 VAK 9C6-11 VAK 10G6-7 VAK 11D4-1 VAK 12B11-9 VAK 10G12-5 Контроль 5 10 15 20 25 30 ІС50, димерний hIL4R (пМ) 94 184 85 7 203 ІС50, димерний hIL4R (пМ) 175 2,900 517 2,980 489 6 35 88 70 9 5 9 76 4 12 18 18 15 46 25 23 64 41 14 5,220 285 336 779 595 7 418 473 89 12,900 130 92 103 1,400 165 109 325 169 3,500 Приклад 3. Інгібування взаємодії hIL-4 і hIL-4R Проводили скринінг здатності відібраних антитіл блокувати зв'язування hIL-4 з hIL-4R в аналізі блокування hIL-4 BIAcore™ і ефективність вимірювали в кількісному імуноаналізі блокування hIL-4, який описаний нижче. Результати підсумовуванні в таблиці 3. Здатність антитіл блокувати зв'язування hIL-4 з рецептором ML-4R визначали, використовуючи поверхневий плазмонний резонанс. Очищені молекули hIL-4R-hFc вловлювали поліклональними антитілами кози проти IgG людини, іммобілізованими на СМ-5 при щільності 260 RU, щоб одержати поверхню, покриту рецептором. Потім IL-4 людини (0,25 мл, 50 нМ) за допомогою ін'єкції наносили на покриту рецептором поверхню і реєстрували кількість зв'язаного hIL-4 (перша ін'єкція hIL-4). Зв'язаний hIL-4 потім видаляли імпульсним впливом 3 М MgCl2 з подальшим впливом очищувального буфера. Потім ін'єктували очищені анти-hІL-4R-антитіла на покриту рецептором поверхню з подальшою другою ін'єкцією hIL-4 в такій же концентрації (друга ін'єкція hIL-4). Зниження зв'язування hIL-4 в процентах внаслідок попереднього утворення комплексу антитіла з рецептором показане в таблиці 3. Щоб додатково оцінити здатність блокувати зв'язування hIL-4 з hIL-4R проводили кількісний імуноаналіз. Коротко, розчини 25 пМ hIL-4R-Fc заздалегідь змішували з білком антитіла в діапазоні від -50 нМ до 0 нМ в серійному розведенні з подальшою одногодинною інкубацією при кімнатній температурі. Концентрацію вільного hIL-4R-Fc (не зв'язаного з антитілом) визначали, використовуючи специфічний для hIL-4R ELISA типу «сендвіч». Планшети для реєстрації hIL-4R готували, зв'язуючи біотинільований hIL-4 (0,5 мкг/мл) з покритими стрептавідином 96-ямковими планшетами. Заздалегідь зв'язані зразки антитіло-антиген переносили в покритий hIL-4 планшет для реєстрації. Після одногодинної інкубації при кімнатній температурі планшет для реєстрації промивали і зв'язаний з планшетом hIL-4R-hFc виявляли, використовуючи кон'юговані з HRP поліклональні антитіла кози проти hFc, і обробляли, використовуючи колориметричний субстрат, такий як BD OptEIA™ (BD Biosciences Pharmingen, San Diego, CA). Після зупинки реакції 1 М фосфорною або сірчаною кислотою реєстрували оптичну густину при 450 нм і дані аналізували, використовуючи комп'ютерну програму GraphPad™ Prism. IC50 визначали як кількість антитіла, необхідну для зменшення на 50% IL-4R-hFc, що реєструється, який зв'язаний з hIL-4, зв'язаним з планшетом hIL-4. У переважному варіанті антитіло або 13 UA 98943 C2 фрагмент антитіла згідно з винаходом має ІС 50 блокуючі 25 пМ hIL-4R або менше, ніж приблизно 50 пМ, або менше, ніж приблизно 40 пМ, або менше ніж приблизно 30 пМ, або менше ніж приблизно 20 пМ на основі вимірювань в ELISA. Таблиця 3 Антитіло VX 4E7-9 VX 3F7-6 VAB 8G10-1 VAB 7B9-3 VAB 6C10-14 VAB 5C5-11 VAB 4D5-3 VAB 3B4-10 VAB 1H1-2 VAB 16G1-1 VAB 16F3-1 VAB 15C8-17 VAB 11G8-1 VAB 10G8-19 VAB 10C1-5 VAK 5H4-4 VAK 7G8-5 VAK 8G11-13 VAK 9C6-11 VAK10G6-7 VAK 11D4-1 VAK12B11-9 % інгібування (BIAcore™) 79 86 74 96 79 96 82 72 78 92 97 97 77 85 93 96 95 95 96 95 95 96 IC50 (ELISA пM) 118 274 244 59 441 24 240 322 146 18 19 29 240 18 34 33 27 26 67 37 35 99 94 59 5 VAK 10G12-5 10 15 20 25 30 Приклад 4. Нейтралізація біологічної дії hIL-4 in vitro Шлях опосередкованої IL-4 сигнальної трансдукції детально описаний в літературі (наприклад, дивись огляд Hebenstreit et al. 2006 Cytokine Growth Factor Rev. 17(3): 173-88, 2006). IL-4 може стимулювати два рецепторних комплекси, типу I і типу II. Комплекси рецепторів типу І утворюються внаслідок зв'язування IL-4 з IL-4R і подальшої гетеродимеризації із загальним гамма-ланцюгом. Альтернативно комплекс IL4/IL4R може гетеродимеризуватися з рецептором 1 IL-13 з утворенням рецепторних комплексів типу II. Комплекси типу I і типу II передають сигнал головним чином через STAT6. Тому оцінювали здатність відібраних антитіл блокувати передачу сигналу через STAT6, як описано нижче. Створили лінію клітин з високою чутливістю до hIL-4 і hIL-13. Клітини НЕК293 стабільно трансфікували STAT6 людини і плазмідою з репортером люциферазою для STAT6 і підтримували в середовищі ріст (DMEM, 10% FBS, L-глутамін, пеніцилін, стрептоміцин). Сильну опосередковану рецептором IL-4 відповідь досягали, коли додавали 10 пМ hIL-4 в середовище росту STAT6-трансфікованих клітин НЕК293. Для біологічного аналізу відповіді hIL-4 клітини промивали один раз в зрізі для аналізу (Optimem I (Gibco) плюс 0,1% FBS) і висівали по 1 х 104 клітин/ямку (96-ямковий планшет) в 80 мкл середовища для аналізу. Очищені антитіла серійно розводили в середовищі для аналізу (кінцеві концентрації в діапазоні від 20 нМ до 0) і 10 мкл кожного з антитіл, що тестуються, додавали до клітин разом з 10 мкл hIL-4 (фіксована кінцева концентрація 10 пМ). Потім клітини інкубували при 37 °C, 5% СО2 протягом 6 годин. Ступінь відповіді клітини вимірювали в аналізі люциферази (Promega Biotech). Результати показані в таблиці 4. Інгібування залежної від IL-4 біологічної активності in vitro також підтверджували, використовуючи або клітинну лінію еритробластів людини, TF1, або модифіковану лінію клітин TF1, надекспресуючих IL-13R (TF1/A12). У такому біоаналізі 20000 клітин висівали в кожну ямку 96-ямкового планшета в середовище RPMI 1640, що містить 10% FBS, 2 мМ L-глутамін і пеніцилін і стрептоміцин. Двадцять п'ять мікролітрів очищених антитіл в діапазоні від 0 до 50 нМ (кінцева концентрація) додавали разом з 25 мкл рекомбінантного білка hIL-4 до кінцевої 14 UA 98943 C2 5 концентрації або 50 пМ у разі лінії клітин TF1, або 20 пМ у випадку лінії клітин TF1/A12. Потім клітинам давали можливість рости протягом 3 днів при 37 °C і кінцеву кількість клітин вимірювали, використовуючи набір ССК8 (Dojindo, Japan). Здатність антитіл блокувати ріст клітин TF-1 показана в таблиці 4 у вигляді концентрації антитіла, необхідної для досягнення 50% зниження проліферації клітин. Таблиця 4 VX 4E7-9 VX 3F7-6 VAB 8G10-1 Біоаналіз STAT6, IC50 (нМ) 7.90 >10 >10 VAB 7B9-3 VAB 6C10-14 VAB 5C5-11 VAB 4D5-3 VAB 3B4-10 VAB 1H1-2 VAB 16G1-1 VAB 16F3-1 VAB 15C8-17 VAB 11G8-1 VAB 10G8-19 VAB 10C1-5 VAK 5H4-4 VAK 7G8-5 VAK 8G11-13 VAK 9C6-11 VAK 10G6-7 VAK 11D4-1 VAK 12B11-9 VAK 10G12-5 3.40 >10 0.14 3.80 >10 >10 0.14 0.032 0.32 >10 1.80 1.90 0.132 0.06 0.08 0.48 0.11 0.20 0.49 0.36 Антитіло 10 15 Біоаналіз TF1, ІС50 (нМ) Біоаналіз TF1/A12, ІС50 (нМ) 10 >50 >50 8.20 23 0.37 21 >50 >50 0.70 0.067 4.70 >50 12,8 22.8 0.182 0.21 0.12 0.046 0.44 0.150 0.13 0.16 0.31 0.23 0.20 0.57 0.58 Приклад 5. Нейтралізація біологічної дії hIL-13 in vitro Оскільки показано, що IL-4R є модулятором активності IL-13 за допомогою його зв'язування з комплексом IL-13/IL-13R, то відібрані антитіла тестували відносно їх здатності блокувати активність IL-13, використовуючи модифікований аналіз SТАТ6-люциферази НЕК293, описаний вище, при цьому модифікація полягала в заміні 10 пМ IL-4 на 40 пМ hIL-13. Антитіла також оцінювали у відношенні ефективність блокування активності hIL-13 в аналізі лінії клітин TF-1, описаної вище, використовуючи hIL-13 в концентрації 150 пМ в присутності 0-50 нМ антитіл. Результати показані в таблиці 5. Таблиця 5 Антитіло VX 4E7-9 VX 3F7-6 VAB 8G10-1 VAB 7B9-3 VAB 6C10-14 VAB 5C5-11 Біоаналіз STAT6, ІС50 (нМ) 6.30 >10 >10 1.10 >10 0.06 15 Біоаналіз TF1, ІС50 (нМ) 0.82 UA 98943 C2 VAB 4D5-3 VAB 3B4-10 VAB 1H1-2 VAB 16G1-1 VAB 16F3-1 VAB 15C8-17 VAB 11G8-1 VAB 10G8-19 VAB 10C1-5 VAK 5H4-4 VAK 7G8-5 VAK 8G11-13 VAK 9C6-11 VAK 10G6-7 VAK 11D4-1 VAK 12B11-9 VAK 10G12-5 5 10 15 20 25 30 35 3.30 8.30 >10 0.09 0.018 0.20 8.80 0.97 1.00 0.084 0.04 0.06 0.30 0.07 0.14 0.37 0.26 0.44 0.079 2.60 0.240 0.36 0.42 1.00 0.46 0.44 1.60 1.90 Приклад 6. Оцінка профілю зв'язування антитіла Профіль зв'язування антитіла можна встановити, визначаючи вплив, який антитіло (зв'язане зі своїм антигеном) може надавати на здатність панелі різних антитіл згодом зв'язувати той самий антиген. Наприклад, антиген може бути іммобілізований на підкладці з утворенням покритої антигеном поверхні, покрита антигеном поверхня може бути насичена антитілом і потім покрита антигеном і насичена антитілом поверхня може бути піддана впливу панелі інших антитіл. Міра зв'язування панелі інших антитіл з покритою антигеном і насиченою антитілом поверхнею дає профіль зв'язування антитіла. Засновані на OCTET™ аналізи послідовного зв'язування використовували для одержання профілю зв'язування антитіл. Коротко, групу з 24 біосенсорів FA, що містять стрептавідин, з високою ефективністю зв'язування (ForteBio, Inc., Menlo Park, CA) спочатку інкубували з антигеном, біотин-hIL-4R-hFc, в концентрації 2 мкг/мл протягом 10 хв при 30 °C, щоб досягнути насичення, і кількість зв'язаного антигену вимірювали у вигляді зміни товщини (нм) біологічного шару за рахунок зв'язаного білка, яку безпосередньо вимірювали за зсувом довжини хвилі. Зв'язані з біотин-hIL-4R-hFc біосенсори потім інкубували з першим антитілом (контрольне антитіло) в концентрації 50 мкг/мл протягом 15 хв при 30 °C, щоб досягнути насичення, і кількість зв'язаного контрольного антитіла вимірювали у вигляді зміни товщини (нм) біологічного шару. Кожний біосенсор, зв'язаний з контрольним антитілом, потім інкубували з однією з панелей з 24 різних анти-hIL-4R-антитіл (друге антитіло) в концентрації 50 мкг/мл протягом 15 хв при 30 °C, і кількість зв'язаного другого антитіла вимірювали у вигляді зміни товщини біологічного шару. Такий же аналіз повторювали, використовуючи як перше антитіло анти-hIL-4R-антитіло або VAB16F3-1, або VAK5H4-4. Результати показані на фіг. 1А-З. Відібрані анти-hIL-4R-антитіла також оцінювали з використанням Вестерн-блота (дані не показані). Коротко, мономер hIL-4R (200 нг на доріжку) і His-мічений мономер mfIL-4R (200 нг на доріжку) піддавали електрофорезу в SDS-ПААГ-гелях, використовуючи як відновний, так і невідновний буфер для зразків. Кожний з чотирьох окремих гелів переносили на PVDFмембрану і кожну мембрану піддавали впливу одного з чотирьох перших антитіл: анти-His-мAb (Qiagen), VAB 16F3-1, VAK 5H4-4 або контрольного анти-hIL-4R-антитіла, використовуючи як друге антитіло або кон'юговане з HRP антитіло кози проти mIgG, або антитіло проти hIgG (Pierce). Всі три анти-hIL-4R-антитіла впізнавали невідновлену форму hIL-4R. Тільки VAB 16F3-1 і VAK 5H4-4 виявляли відновлену форму hIL-4R. Жодне з анти-hIL-4R-антитіл не виявляло IL-4R мавпи. СПИСОК ПОСЛІДОВНОСТЕЙ Regeneron Pharmaceuticals, Inc. ВИСОКОАФІННІ АНТИТІЛА ЛЮДИНИ ДО РЕЦЕПТОРУ IL-4 ЛЮДИНИ 40 6030A-WO То be assigned 2007-10-02 16 UA 98943 C2 60/848, 694 2006-10-02 5 60/957, 738 2007-08-24 590 10 FastSEQ for Windows Version 4.0 15 1 207 БІЛОК homo sapiens 1 20 2 351 ДНК Штучна послідовність 25 Синтетична 2 30 17 UA 98943 C2 3 117 БІЛОК Штучна послідовність 5 Синтетична 3 10 15 4 24 ДНК Штучна послідовність Синтетична 20 4 25 30 5 8 БІЛОК Штучна послідовність Синтетична 5 35 6 24 ДНК Штучна послідовність 40 Синтетична 6 45 18 UA 98943 C2 7 8 БІЛОК Штучна послідовність 5 Синтетична 7 10 15 8 30 ДНК Штучна послідовність Синтетична 20 25 8 9 10 БІЛОК Штучна послідовність Синтетична 30 9 35 40 10 321 ДНК Штучна послідовність Синтетична 10 45 11 107 БІЛОК Штучна послідовність 50 Синтетична 19 UA 98943 C2 11 5 10 12 18 ДНК Штучна послідовність Синтетична 12 15 13 6 БІЛОК Штучна послідовність 20 Синтетична 13 25 30 14 9 ДНК Штучна послідовність Синтетична 35 40 14 15 3 БІЛОК Штучна послідовність Синтетична 45 15 20 UA 98943 C2 5 16 27 ДНК Штучна послідовність Синтетична 10 16 15 20 17 9 БІЛОК Штучна послідовність Синтетична 17 25 18 384 ДНК Штучна послідовність 30 Синтетична 18 35 19 128 БІЛОК Штучна послідовність 40 Синтетична 19 45 21 UA 98943 C2 5 20 24 ДНК Штучна послідовність Синтетична 10 20 15 20 21 8 ВІЛОК Штучна послідовність Синтетична 21 25 22 24 ДНК Штучна послідовність 30 Синтетична 22 35 23 8 БІЛОК Штучна послідовність 40 Синтетична 23 45 50 24 63 ДНК Штучна послідовність 22 UA 98943 C2 Синтетична 24 5 25 21 БІЛОК Штучна послідовність 10 Синтетична 25 15 20 26 321 ДНК Штучна послідовність Синтетична 25 30 26 27 107 БІЛОК Штучна послідовність Синтетична 35 27 23 UA 98943 C2 28 18 ДНК Штучна послідовність 5 Синтетична 28 10 15 29 6 БІЛОК Штучна послідовність Синтетична 20 25 29 30 9 ДНК Штучна послідовність Синтетична 30 30 35 40 31 3 БІЛОК Штучна послідовність Синтетична 31 45 32 27 ДНК Штучна послідовність 50 Синтетична 32 55 33 9 БІЛОК 24 UA 98943 C2 Штучна послідовність Синтетична 5 33 10 15 34 366 ДНК Штучна послідовність Синтетична 34 20 35 122 БІЛОК Штучна послідовність 25 Синтетична 35 30 35 36 24 ДНК Штучна послідовність Синтетична 25 UA 98943 C2 36 5 10 37 8 БІЛОК Штучна послідовність Синтетична 37 15 38 24 ДНК Штучна послідовність 20 Синтетична 38 25 39 8 БІЛОК Штучна послідовність 30 Синтетична 39 35 40 40 45 ДНК Штучна послідовність Синтетична 45 50 40 41 15 БІЛОК Штучна послідовність Синтетична 55 41 26 UA 98943 C2 42 321 ДНК Штучна послідовність 5 Синтетична 42 10 15 43 107 БІЛОК Штучна послідовність Синтетична 20 25 30 43 44 18 ДНК Штучна послідовність Синтетична 44 35 45 6 БІЛОК Штучна послідовність 40 Синтетична 45 27 UA 98943 C2 5 46 9 ДНК Штучна послідовність Синтетична 10 46 15 20 47 3 БІЛОК Штучна послідовність Синтетична 47 25 48 27 ДНК Штучна послідовність 30 Синтетична 48 35 49 9 БІЛОК Штучна послідовність 40 Синтетична 49 45 50 50 384 ДНК Штучна послідовність Синтетична 55 50 28
ДивитисяДодаткова інформація
Назва патенту англійськоюHigh affinity human antibodies to human il-4 receptor
Автори англійськоюStevens, Sean, Huang, Tammy, T., Martin Joel H., Fairhurst, Jeanette, L., Rafique, Ashique, Torres, Marcela, Pobursky, Kevin, J., Leidich, Raymond, W., Windsor, Joan, A., Mikulka, Warren, R., Ahrens, Diana, M., Shi, Ergang, Papadopoulos, Nicholas, J.
Назва патенту російськоюВисокоаффинные антитела человека к рецептору il-4 человека
Автори російськоюСтивенс Шон, Хуан Тамми Т., Мартин Джоэл Х., Ферхерст Жанетта Л., Рафик Ашик, Торрес Марсела, Побурски Кевин Дж., Лейдич Раймонд В., Виндзор Джоан А., Микулка Уоррен Р., Аренс Диана М., Ши Эрганг, Пападопулос Николас Дж.
МПК / Мітки
МПК: C12P 21/08, A61K 39/395, C07K 16/28, A61P 37/00, C12N 15/63, C12N 15/13
Мітки: людини, рецептора, високоафінні, антитіла
Код посилання
<a href="https://ua.patents.su/183-98943-visokoafinni-antitila-lyudini-do-receptora-il-4-lyudini.html" target="_blank" rel="follow" title="База патентів України">Високоафінні антитіла людини до рецептора il-4 людини</a>
Попередній патент: Композиція разового фасування покритого оболонкою мийного засобу і спосіб її виготовлення
Наступний патент: Аміди діазабіциклоалканів, селективні відносно ацетилхолінового підтипу нікотинових рецепторів
Випадковий патент: Ручний пристрій для контактного нанесення рідких гербіцидів на бур'яни