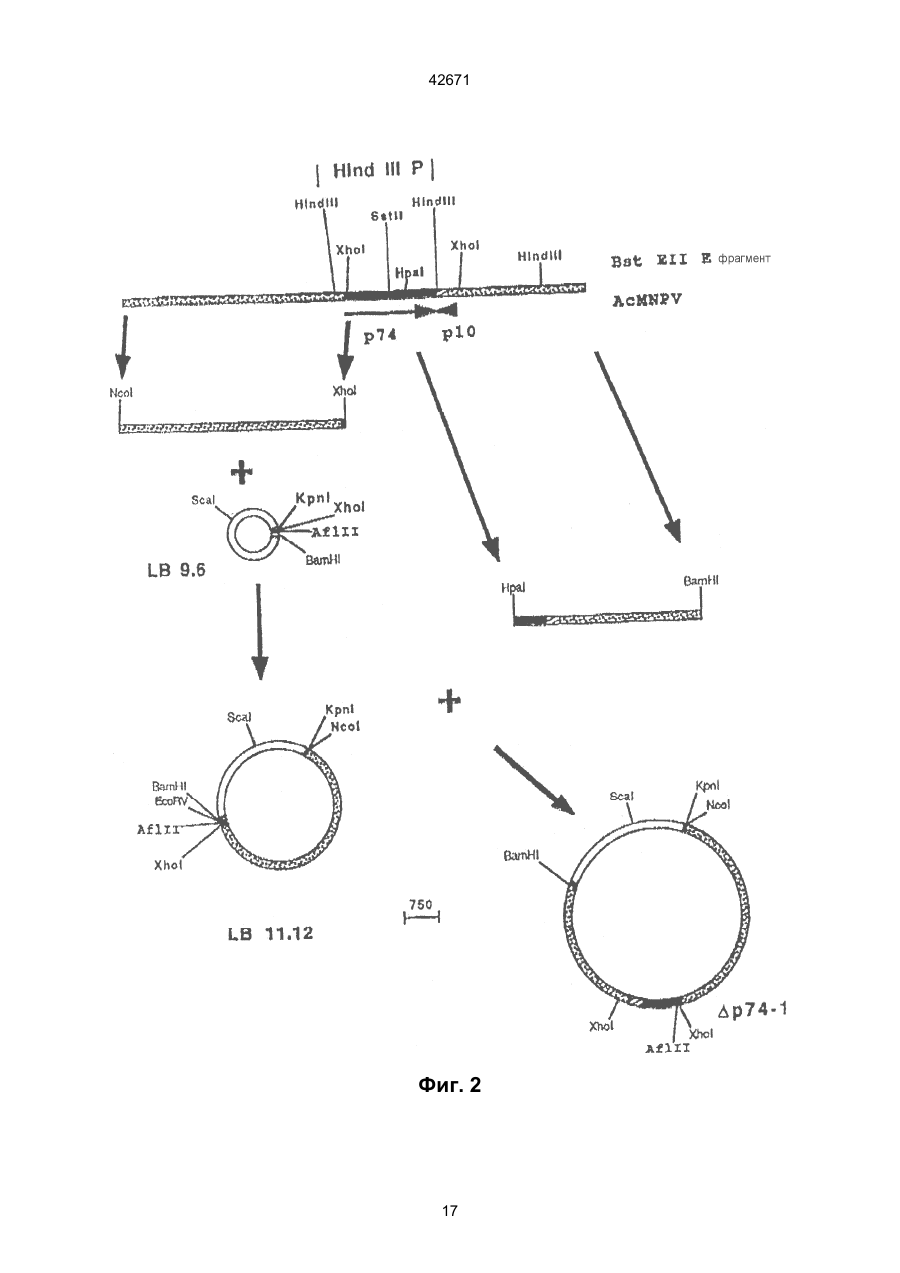
Вірус комах зі зниженою здатністю трансмісії від хазяїна до хазяїна в навколишньому середовищі, спосіб його одержання
Формула / Реферат
1. Вирус насекомых с пониженной способностью трансмиссии от хозяина к хозяину в окружающей среде, содержащий ген р74 или его гомологи, который превращен в неинфекционный для насекомых путем изменения локуса гена р74, кодирующего протеин с молекулярным весом 74 кДа вируса, инфекционность которого восстанавливается посредством комплементации функционально активным геном р74 или протеином, который кодируется соответствующим вирусом дикого типа, тем самым клетка насекомого, которая несет указанный измененный вирус насекомого, дополнительно трансфектируется фрагментом ДНК, который обеспечивает утраченный продукт или функцию измененного локуса гена р74 из функциональной активности вируса дикого типа.
2. Вирус по п. 1, отличающийся тем, что представляет собой Eubaculovirinae вирус, выбранный из группы, состоящей из вирусов ядерного полиэдроза и вирусов гранулоза.
3. Вирус по п. 1, отличающийся тем, что изменение генетического элемента выбирают из группы, состоящей из нарушения функции гена и подавления функции вируса.
4. Вирус по п. 1, отличающийся тем, что инфекционность вируса восстанавливают путем получения вируса в:
(а) клетках насекомых, трансфектированных фрагментом ДНК, который обеспечивает продукт или функцию, которая утрачена или дефектна в измененном вирусе;
б) клеточных линиях, которые содержат фрагмент ДНК, который обеспечивает продукт или функцию, которая утрачена или дефектна в измененном вирусе;
или
(в) трансгенных насекомых, которые содержат фрагмент ДНК, который обеспечивает продукт или функцию, которая утрачена или дефектна в измененном вирусе.
5. Вирус по п. 4, отличающийся тем, что для контроля экспрессии фрагмента ДНК используют гетерологичный промотор.
6. Вирус по п. 1, отличающийся тем, что дополнительно содержит встроенный в вирусный геном гетерологичный ген, кодирующий вещество, контролирующее или модифицирующее насекомое.
7. Вирус по п. 6, отличающийся тем, что вещество, контролирующее или модифицирующее насекомое, выбирают из группы, состоящей из токсинов, нейропептидов и гормонов, ферментов.
8. Вирус по п. 6, отличающийся тем, что гетерологичный ген встроен
(а) непосредственно в локус гена р74 вируса; или
(б) примыкает к локусу гена р74 вируса, так, что сегрегация гетерологичного гена и измененного гена р74 встречается в менее, чем 10% вирусного потомства.
9. Способ получения вируса насекомых с пониженной способностью трансмиссии от хозяина к хозяину в окружающей среде, содержащего ген р74 или его гомологи, отличающийся тем, что включает стадии:
(1) превращения вируса в неинфекционный для насекомых посредством изменения локуса гена р74 вируса; и
(2) восстановления инфекционности вируса посредством комплементации продуктом или функцией, которая утрачена или дефектна в измененном вирусе, посредством трансфекции клетки насекомого, несущей измененный вирус, ДНК фрагментом, обеспечивающим продукт или функцию, которая утрачена или дефектна
из локуса гена р74 дикого типа.
10. Способ по п. 9, отличающийся тем, что изменение генетического элемента вируса выбирают из группы, состоящей из нарушения функции гена и подавления функции вируса.
11. Способ по п. 9, отличающийся тем, что инфекционность вируса восстанавливают путем получения вируса в:
(а) клетках насекомых, трансфектированных фрагментом ДНК, который обеспечивает продукт или функцию, которая утрачена или дефектна в измененном вирусе;
(б) клеточных линиях, которые содержат фрагмент ДНК который обеспечивает продукт или функцию, которая утрачена или дефектна в измененном вирусе;
(в) трансгенных насекомых, которые содержат фрагмент ДНК, который обеспечивает продукт или функцию, которая утрачена или дефектна в измененном вирусе.
12. Способ по п. 9, отличающийся тем, что дополнительно включает использование гетерологичного промотора.
13. Способ по п. 9, отличающийся тем, что дополнительно включает использование встроенного в вирусный геном гетерологичного гена, кодирующего вещество, контролирующее или модифицирующее насекомое.
Текст
1. Вирус насекомых с пониженной способностью трансмиссии от хозяина к хозяину в окружающей среде, содержащий ген р74 или его гомологи, который превращен в неинфекционный для насекомых путем изменения локуса гена р74, кодирующего протеин с молекулярным весом 74 кДа вируса, инфекционность которого восстанавливается посредством комплементации функционально активным геном р74 или протеином, который кодируется соответствующим вирусом дикого типа, тем самым клетка насекомого, которая несет указанный измененный вирус насекомого, дополнительно трансфектируется фрагментом ДНК, который обеспечивает утраченный продукт или функцию измененного локуса гена р74 из функциональной активности вируса дикого типа. 2. Вирус по п. 1, отличающийся тем, что представляет собой Eubaculovirinae вирус, выбранный из группы, состоящей из вирусов ядерного полиэдроза и вирусов гранулоза. 3. Вирус по п. 1, отличающийся тем, что изменение генетического элемента выбирают из группы, состоящей из нарушения функции гена и подавления функции вируса. 4. Вирус по п. 1, отличающийся тем, что инфекционность вируса восстанавливают путем получения вируса в: (а) клетках насекомых, трансфектированных фрагментом ДНК, который обеспечивает продукт или функцию, которая утрачена или дефектна в измененном вирусе; б) клеточных линиях, которые содержат фрагмент ДНК, который обеспечивает продукт или функцию, которая утрачена или дефектна в измененном вирусе; или C2 (54) ВІРУС КОМАХ ЗІ ЗНИЖЕНОЮ ЗДАТНІСТЮ ТРАНСМІСІЇ ВІД ХАЗЯЇНА ДО ХАЗЯЇНА В НАВКОЛИШНЬОМУ СЕРЕДОВИЩІ, СПОСІБ ЙОГО ОДЕРЖАННЯ 42671 или функцию, которая утрачена или дефектна в измененном вирусе; (б) клеточных линиях, которые содержат фрагмент ДНК, который обеспечивает продукт или функцию, которая утрачена или дефектна в измененном вирусе; (в) трансгенных насекомых, которые содержат фрагмент ДНК, который обеспечивает продукт или функцию, которая утрачена или дефектна в измененном вирусе. 12. Способ по п. 9, отличающийся тем, что дополнительно включает использование гетерологичного промотора. 13. Способ по п. 9, отличающийся тем, что дополнительно включает использование встроенного в вирусный геном гетерологичного гена, кодирующего вещество, контролирующее или модифицирующее насекомое. Настоящее изобретение относится к неинфицирующим вирусам насекомых, обладающим измененным генетическим элементом, функция которого восстановлена за счет генетической комплементации, в результате чего снова получают инфицирующую насекомых форму вируса. Настоящее изобретение относится далее к включению гетерологического гена в вирусннй геном, таким образом, чтобы контролирующее или модифицирующее вещество насекомого также вырабатывалось вирусом для повышения биоинсектицидного действия и генетической стабильности нужного признака. В описании использованы следующие сокращения: А. саl. – Autographa californica AcMNPV - ядерный полиэдрозный вирус Autographa californica bp - пары оснований ECV - внеклеточная форма вируса GV - вирус гранулоза кД – килодальтон МОІ - множественность инфекции NPV - вирус ядерного полиэдроза OB - тело окклюзии OV - окклюдированный вирус PCR - реакция цепи полимеразы PDV - вирус, полученный из полиэдрона р.i. - пост-инфекция РІВ - тело инклюзии полиэдрона (также известное как ОВ) 5'UTR - иРНК или генная последовательность, соответствующая участку, простирающемуся от стартового сайта транскрипции гена до последнего основания той пары оснований, которая предшествует кодону, инициирующему синтез протеина 3'UTR - иРНК или генная последовательность, соответствующая участку, простирающемуся от первого основания или пары оснований, которая простирается после кодона терминации синтеза протеина до последнего основания, кодирующего ген по 3' концу иРНК (+)-нить - ДНК нить гена и ее фланкирующая последовательность, которая имеет тот же смысл, что РНК, которая получена из этого гена (-)-нить - нить ДНК гена и ее фланкирующая последовательность которая комплементарна (+) нити. Настоящее изобретение применимо ко всем вирусам насекомых, включая ДНК и РНК вирусы. ДНК вирусы включают entomopox вирус (ЕРV) и Baculoviridae вирусы, такие как вирусы ядерного полиэдроза (NРV) и вирусы гранулоза (GV), и т.п. РНК вирусы включают тогавирусы, флавивирусы, пикорнавирусы, вирусы цитоплазмического полиэдроза (СРV) и т.д. Подсемейство двунитевых ДНК вирусов Eubaculoviridae включают два рода, NPV и GV которые особенно подходят для биологического контроля, так как они продуцируют тела окклюзии (OBs ) в своем жизненном цикле. Более 400 бакуловирусов были идентифицированы как присутствующие у беспозвоночных. Вирус ядерного полиэдроза Autographa californica (AcMNPV) является прототипом вируса семейства Baculoviridae и имеет широкий круг хозяев. AcMNPV вирус был вначале выделен из Autographa californica (A.cal), lepidopteran noctuid (которая является взрослой стадией ночной моли), обычно известной как пяденица люцерновая. Этот вирус инфицирует 12 семейств и более 30 видов отряда насекомых Lepidopteran [1]. Неизвестно продуктивное инфицирование какого-либо вида вне этого отряда. Использование бакуловирусов в качестве биоинсектицидов представляется многообещающим. Одним из основных препятствий к их широкому применению в сельском хозяйстве является временной промежуток между начальным инфицированием насекомого и его гибелью. Этот промежуток может быть от нескольких дней до нескольких недель. Во время этого промежутка насекомое продолжает питаться и продолжает повреждать растение. Ряд исследователей пытались преодолеть этот недостаток, включая гетерологический ген в вирусный геном, так чтобы экспрессировать контролирующее или модифицирующее насекомое вещество, например, токсин [2, 3, 4], нейропоптид и гормон [5, 6] или энзим [7]. Хотя генная инженерия и предоставляет возможности для преодоления технических препятствий к коммерциализации вирусов в качество биоинсентицидов, она также дает основания для понимания того, что может быть и второе потенциальное препятствие к их широкому распространению. В частности, возможна спекуляция на том факте, что вынесение этих вирусов, полученных с помощью генной инженерии, в окружающую среду может привести к непредвиденным последствиям в экосистеме, поскольку эти вирусы реплицируют и распространяются [8, 9]. К настоящему времени все рекомбинантные вирусы насекомых, получаемые для биоконтроля за насекомыми, попадут в область такой спекуляции, так как все способны к передаче от насекомого к насекомому. Так существует необходимость получения рекомбинантных специфических для насекомого вирусов, которые 2 42671 обладают пониженной способностью к передаче от насекомого к насекомому (от хозяина к хозяину) после того, как их выпустят в окружающую среду. Жизненный цикл бакуловирусов, на примере AcMNPV включает две стадии. Каждая стадия жизненного цикла представлена специфической формой вируса; внеклеточные вирусные частицы (ECV), которые не окклюдированы, и окклюдированные вирусные частицы (OV) [10, 11]. Внеклеточные и окклюдированные вирусные формы имеют один и тот жe геном, но демонстрируют различные биологические характеристики. Вызревание каждой из двух форм вирусов управляется различными наборами вирусных генов, некоторые из которых уникальны для каждой из форм. У встречающихся в природе насекомых инфекционные формы, множественные вирионы, существуют включенными в паракристаллическую протеиновую матрицу, известную как тело окклюзии (ОВ), которое так же известно как тело инклюзии полиэдрона (РІВ). Протеиновые вирусные окклюзии известны как полиэдра (полиэдрон является термином в единственной числе). Полиэдриновый протеин с молекулярным весом 29 kb является основным кодируемым вирусом структурным протеином вирусной окклюзии [10, 12]. (Аналогично, GVs продуцирует OBs, которые состоят, главным образом, из гранулина, а не полиэдрина.) Вирусные окклюзии являются важной частью природного жизненного цикла бакуловирусов, обеспечивая средство для горизонтальной (от насекомого к насекомому) передачи среди подверженных инфекции видов насекомых. В окружающей среде подверженное инфекции насекомое (обычно в стадии личинки) переварит вирусные окклюзии из зараженного источника, например, из растения. Кристаллическая окклюзия диссоциирует в кишечнике рассматриваемого насекомого, с высвобождением инфекционных вирусных частиц. Эти вирусы, полученные из полиэдрона (РDV) проникают и реплицируют в клетках тканей средней кишки [10]. Считают, что частицы вирусов проникают в клетки за счет эндоцитоза или слияния, а вирусная ДНК утрачивает оболочку у ядерных пор или в ядрах. Репликация вирусной ДНК обнаруживается в течение шести часов. Через 10-12 часов постинфецирования (р.i.) вторичная инфекция распространяется на другие ткани насекомых за счет активного проникновения в клетку (бадинга) внеклеточного вируса (ЕСV) с поверхности клетки. ЕСV форма вируса ответственна за распространение вирусов от клетки к клетке внутри отдельного инфицированного насекомого, а также за счет передачи инфекции в клеточной культуре. Позднее в цикле инфицирования (12 часов после инфицирования), протеин полиэдрина можно детектировать в инфицированных клетках. Не проходит 18-24 часов после инфицирования, как протеин полиэдрина собирается в ядрах инфицированных клеток, а вирусные частицы оказываются заключенными в протеиновые окклюзи. Вирусные окклюзии накапливаются в значительном количестве за 4-5 дней в виде продукта клеточного лизиса. Такая полиэдра не играет активной рели в распространении инфекции в личинке. ЕСV в гемо лимфе размножается и распространяется, что приводит к гибели личинки [10, 11, 12]. Когда инфицированная личинке гибнет, миллионы полиэдр остаются в разлагающейся ткани, хотя ЕСV разлагаются. Когда другие личинки контактируют с полиэдрой, например, за счет переваривания загрязненных растений или других пищевых материалов, цикл повторяется [10]. Итак, окклюдированные формы вируса ответственны за начальное заражение насекомого через кишечник, а также за стабильность вируса в окружающей среде. Существенно, что РDV не являются инфицирующими, если их вводить с помощью инъекций, но в высокой степени инфекционны при оральном введении. Не-окклюдированная форма вируса (т.е. ECV) ответственна за вторичную и от клетки к клетке инфекцию. ECV отличаются высокой инфекционной способностью для клеток в клеточной культуре или для внутренних клеток насекомого путем инфицирования, но практически неинфокционны при оральном введении. Использование рекомбинантных бакуловирусов, экспрессирующих чужие протеины, которые токсичны для насекомых, облегчается за счет того факта, что эти вирусы не являются патогенами для позвоночных или растений. Кроме того, бакуловирусы обычно отличаются узким кругом хозяев. Множество штаммов ограничены одним или несколькими видами насекомых. Наиболее широко изученным бакуловирусом является АсМNРV. АсМNРV как известно, инфицирует 12 семейств, и более 30 видов отряда насекомых Лепидоптера [1]. Неизвестна продуктивность инфицирования для каких-либо видов вне этого отряда. Как общественность, так и различные регулирующие органы обсуждали потенциальные последствия высвобождения штамма АсМNРV содержащего чужую ДНК последовательность [8, 9]. Это относится к возможности того, чтобы сконструированный вирус мог распространяться в нецелевые насекомые отряда Лепидоптеры. Другим подлежащим рассмотрению фактором является известная стабильность в окружающей среде этих вирусов. Так, существует необходимость в создании рекомбинантных специфических к насекомому вирусов, с пониженной способностью к передаче от насекомого к насекомому (от хозяина к хозяину). Такие вирусы должны быть способны инфицировать насекомое, но должны обладать существенно пониженной способностью к передаче от насекомого к насекомому за счет чего ограничивается длительное существование вируса в окружающей среде. Настоящее изобретение направлено на конструирование и рост штаммов рекомбинантных вирусов насекомых, которые обладают пониженной способностью передаваться от насекомого к насекомому, то есть обладают пониженной способностью к передаче путем от хозяина к хозяина в окружающую среду. Наиболее подходящи для конструирования таких штаммов вирусы семейства Baculoviridae, так как имеют две жизненные стадии, описанные ранее. Такие штаммы вирусов получают за счет изменения вначале генетического элемента таким образом, чтобы сделать вирус неинфекционным 3 42671 для насекомых. Для целей настоящего изобретения, генетический элемент не ограничен генами, кодирующими трансактивные вещества, такие, как РНК или молекулы протеина, но также включает цис-активные элементы или регуляторные последовательности. Такие как усилители транскрипции, промоторы, другие агенты, контролирующие транскрипцию, трансляцию и репликацию генома, а также вирусную ДНК (или РНК) упаковочную последовательность. Такое изменение принимает форму делеции, сдвига рамки, включения, перегруппировки, точечной мутации или другие типы нарушения генной функции. Другие формы изменения включают методы, которые оказывают влияние на функции вируса, например, супрессия транскрипции или трансляции, применение антисмысловой РНК, включение дополнительного генетического элемента, и включение дополнительного регуляторного элемента, например, дрожжевую активирующую в обратном направлении последовательность, которая требует наличия GAL 4 протеина для активности (UASGAL). Задача восстановления инфицирующей способности рекомбинантного вируса, при существенном снижении передачи от хозяина к хозяину, достигают за счет комплементации с продуктом или функцией, которая утрачена или является дефектной в измененном вирусе. В объем нестоящего изобретения включены различные способы получения форм инфицирующих насекомых рекомбинантных вирусов насекомых за счет генетической комплементации, а именно: получение клеточной культуры тканей насекомого, трансфицированного фрагментом ДНК, который обеспечивает продукт или функцию, которые утрачены или являются дефектными в измененном вирусе; (2) получение клеточной линии насекомого, которая была стабильно трансформирована фрагментом ДНК, который обеспечивает продукт или функцию, которые утрачены или являются дефектными в измененных вирусах; и (3) получение в трансгенного насекомого, которое содержит фрагмент ДНК, который обеспечивает продукт или функцию, которые утрачены или являются дефектными в измененном вирусе. В зависимости от продукта или функции, которые нужно получить, может оказаться необходимым или желательным использовать гетерологический вирусный или клеточный промотер для контроля за экспрессией ДНК фрагмента. В этом может возникнуть необходимость из соображений времени и величины дозы. Таким образом клетки насекомых в способах (1) и (2) и в способе трансгенных насекомых (3) действуют как "хелперы" для восстановления инфицирующей способности вируса, таким образом, что частицы вируса (вирионы), полученные таким образом, вызывают инфекцию, будучи переварены насекомыми в природных условиях. Вирионы, полученные в инфицированной личинке, можно детектировать, так как они не комплементированы, и поэтому инфекция не может легко распространяться на других насекомых. Поэтому в отсутствии ко-инфицирующего вируса дикого типа, жизненный цикл рекомбинантного вируса заканчивается после этой единственной инфекции. В предпочтительном варианте нестоящего изобретения ген, кодирующий контролирующее или модифицирующее насекомое вещество, включают в вирусный геном. Этот ген включен в измененный вирус в любом месте внутри вирусного генома. Такие вещества включают токсины, нейропептиды и гормоны, и энзимы. Таким образом экспрессированное вещество повышает биоинсектицидное действие. В частности, ген включают рядом или непосредственно в сайт альтерации генетического элемента, ответственного за снижение способности передачи от хозяина к хозяину. Включение гетерологического гена рядом с или в сайт альтерации генетического элемента предотвращает, или в значительной степени сводит к минимуму, генетическую рекомбинацию, которая могла бы создать форму вируса, обладающую как фенотипом дикого типа, так и контролирующим или модифицирующим насекомое геном для передачи от хозяина к хозяину. На фиг. 1 изображена линейная карта известного бакуловирусного генa АсМNРV генома [13]. На фиг. 2 изображены подробности конструирования плазмиды Dр74-I, которая содержит делецию в р74 гене АсМNРV. На фиг. 3 изображены подробности делеции в р74 гене (Dр74) AcMNPV штамма А4000. На фиг. 4 изображена рестрикционная карта участка вектора экспрессии pMEV серии, на которой изображены промотер, полилинкер и 3'UTR. Создание вируса насекомого с пониженным распространением от одного насекомого к другому приводит к повышенной скорости потери инфекционного вируса из окружающей среды по сравнению со скоростью, достижимой в природном процессе, биологического или абиологичоского разложения. Следовательно, искусственно созданный вирус не обоснуется сам в окружающей среде. Настоящее изобретение применимо ко всем вирусам насекомых, включая ДНК и РНК вирусы. ДНК вирусы включают вирусы двунитевой ДНК в оболочке, такие как (сначала семейств, затем вид) Entomopoxvirinae (поксовирус coleoptera), Eubaculovirinae (Autographa californica MNPV; Hiliоcoverpa zea SNPV), Nudibaculovirinae (Heliоcoverpa zea NOB), Ichnovirus (Campoletis sonorensis virus), и Bracovirus (Cotesia melanoscela virus), а также вирусы двунитевых ДНК без оболочки, такие как Irictoviridae (Chilo iridecent virus) и вирусы однонитевых ДНК без оболочки, такие кaк Parvoviridae (Galleria densovirus). Вирусы РНК включают такие вирусы двунитевых РНК в оболочке, как Togaviridae (Sindbis virus), Bunyaviridae (Beet leafcurl virus) и Flaviviridae (Wesselbron virus), а также вирусы двунитевых РНК без оболочки, как Reoviridae (Corriparta virus) и Burnaviridae (Drosophila X virus), а также вирусы однонитевых РНК без оболочки, такие как Tetraviridae (Nudaurelia beta virus) и Nodaviridae (Black Beetle virus). Подсемейство вирусов двунитевых ДНК Eubaculovirinae включает два рода, вирусы ядерного полиэдроза (NPVs) и вирусы гранулоза (GVs), которые особенно подходят для биологического контроля, так как они продуцируют тела окклюзии в своем жизненном цикле. Примеры NPVs включа 4 42671 ют: Lymantria dispar NPV (gypsy moth NPV), Autographa californica MNPV, Anagrapha falcifera NPV (celery looper NPV), Spodoptera litturalis NPV, Spodoptera frugiperda NPV, Heliothis armigela NPV, Mamestra brassicae NPV, Choristoneura fumiferana NPV, Trichoplusia ni NPV, Helioptera zea NPV, Rachiplusia ou NPV и др. Примеры GVs включают Cydia pomonella GV (coddling moth GV), Pieris brassicae GV, Trichoplusia ni GV, Artogeia rapae GV, Plodia interpunctella GV (Indian meal moth), etc. Примеры entomopox вирусов включают Melolontha melonotha EPV, Amsacta morei EPV, Locusta migratoria EPV, Melanoplus sanguinipes EPV, Schistocerca gregaria EPV, Aedes aegypti EPV, Chironomus luridus EPV и др. Контроль за насекомыми, особенно отрядов Лепидоптера, Ортоптера, Диптера, Изоптера, Гименоптера, Гомоптера, Гемиптера и Колеоптера, а также защита сельскохозяйственных культур, деревьев, кустарников, садов и декоративных растений от нападения таких насекомых достигается при использовании данного изобретения. Хотя изобретение далее будет проиллюстрировано на примере Autographa californica NPV (AcMNPV), следует учитывать, что эти концепции применимы для всех перечисленных выше вирусов насекомых. Кроме того ожидается, что настоящее изобретение окажется чрезвычайно подходящим для усовершенствования новых вирусов насекомых, которые до сих пор не идентифицированы и не классифицированы в литературе. Инфицирование AcMNPV вначале приводит к продуцированию бадинговой формы вируса, известного как ЕСV. ЕСV ответственен за распространение вируса от клетки к клетке внутри отдельного инфицированного насекомого, а также во время роста в клеточной культуре. В случае NPV позднее в цикле инфицирования клетки начинают продуцировать PDV форму, которая представляет собой кристаллическое тело окклюзии (OВ), что также обозначается как тело инклюзии полиэдрона (РІВ). (Аналогично GV продуцируют ОВ, которые состоят, преимущественно, из гранул, а не полиэдрина). Эта PDV форма вируса отвечает за нaчальное инфицирование насекомого через кишечник, а также за стабильность вируса в окружающей среде. Изменение функции, заключающееся в продуцировании интактных инфекционных ОВ, которые не влияют не бадинговую форму вируса, представляется наиболее подходящим. Такие мутации были обнаружены в АсМNPV [14]. Ряд экспериментов по мутагенезу идентифицировал генные локусы, в которых продуцируется вирус бадинговой формы, но в которых не продуцируется интактная инфекционная полиэдра. Одним из наиболее интересных и потенциально перспективных локусов, которые были идентифицированы, является р74 ген, содержащий фрагмент Hind III "Р" генома AcMNPV [15]. р74 является протеином, продуцируемым позднее в бакуловирусной инфекции и с относительно низкими уровнями [15]. Гомологи для р74 гена были идентифицированы в других NPVs, включая Choristoneura fumiferana NPV [16] и Orgyia pseudotsugata NPV [17]. Гомо лог для р74 должен присутствовать во всех членах рода вирусов ядерного полиэдроза. Сходство между жизненными циклами NPV и родственного рода вирусов гранулоза делает весьма вероятным, что эти GV кодируют ген, свойства которого аналогичны свойствам р74. Крупные делеции, которые удаляют этот р74 ген, и около р10 гена приводят к получению вирусов, которые продуцируют полиэдру, которая не является инфекционной при поглощении ее личинками. Так как делеция одного только гена р10 приводит к продуцировению орально инфекционной полиэдры, считают, что делеция гена р74 и ответственна за этот фенотип [15]. Как будет описано делее в примере 1, автор создал вектор переноса (обозначаемый как Dр741), который после рекомбинации с геномом дикого типа приводит к делеции только в гене р74 (Dр74) (фиг. 3). Образцы Е. соli штамма НB101, несущие этот вектор переноса Dр74-1, были депонированы автором 21 мая 1992 г. в Американской коллекции типовых культур, 12301 Parklawn Drive, Rockville, Maryland 20852, США, которым был присвоен АТСС номер 68988. Автор также депонировал 21 мая 1992 г. образцы АсМNPV штамм, обозначенный А400 (где ген р74 был нарушен за счет делеции) в Американской коллекции типовых культур, ему был присвоен номер VR2373. Автор подтвердил, как указано далее в примере 2, что именно делеция ДHК сегмента кодирующего р74 ген приводит к получению РІВ, которые уже нe являются инфекционными при поглощении их личинками. Баддинговые вирусы продолжают продуцироваться, и являются инфекционными, если их вводить с помощью инъекции в гемоцель насекомого. Простая делеция ДНК сегмента не является единственным типом изменений, которые используют для нарушения функций целевого генетического элемента вируса. Для целей рассматриваемого изобретения генетический элемент не ограничивается генами, которые кодируют трансактивные вещества, такие как РНК или молекулы протеина, но также включают цис-активные элементы или регуляторные последовательности, такие как ускорители транскрипции, промоторы и другие сегменты, контролирующие транскрипцию, трансляцию и репликацию генома, а также последовательности упаковки вирусной ДНК (или РНК). Изменение также принимает форму сдвига рамки, вставок, перегруппировок, точечных мутаций или других типов нарушения функций генов. Сюда входит сдвиг рамки, который либо преждевременно прекращает продуцирование протеина, либо приводит к получению измененного нефункционирующего протеина. Вставка кодона терминации в участок гена, кодирующий протеин, и помещение гена для соответствующего супрессора тРНК в "хелперную" клеточную линию также входит в объем настоящего изобретения. Другие формы изменения включают способы, которое нарушают функции вируса, например, супрессия транскрипции или трансляции, использование антисмысловой РНК, включение дополнительного генетического элемента в вирусный геном, и обеспечение нужного регуляторного элемента в транс. Одним из примеров использования 5 42671 этого способа является применение дрожжевой активирующей в обратном направлении последовательности, зависящей от GAL 4 протеина (UASGAL). Помещение дрожжевой активирующей в обратном направлении последовательности (UASGAL), зависящей от СAL, перед целевым вирусным геном делает транскрипцию вирусного гена зависимой от присутствия GAL 4 протеина. "Хелперная" клеточная линия содержит кодирующий участок для GAL 4 гена под контролем одного из гетерологических промотеров,описываемых далее. Другие возможные UAS элементы входят в объем настоящего изобретения, как например, те, которые находятся в системе типа дрожжевого спаривания. Также включены сюда элементы регуляторной последовательности, которые требуют связывания и протеина для активации, например, стероидных рецепторов и их ДНК связующих сайтов. Включено также применение таких промотеров, которые функционируют только в присутствии специфических протеинов. Одним из примеров является Р7 промотор бактериофага Т7, который требует Т7 специфической РНК полимеразы для инициации транскрипции. Помещение Т7 промотора перед р74 геном вместо его природного промотора делает транскрипцию гена вируса зависящей от пpиcyтcтвия Т7 РНК полимеразы. "Хелперная" клеточная линия для этого вируса содержит Т7 РНК полимеразу под контролем гетерологического промотера, например, такого как IЕ-I вирусный промотер. В дополнении к р74 и его функциональным гомологам, существуют дополнительные функции гена, которые будучи изменены, приводят к сдерживанию рекомбинантного вируса (например, 14). Наиболее подходящими являются гены, включенные в функции, существенные для продуцирования интактных инфекционных ОВ. Примеры включают генетический элемент, включенный в регулятор переключения с продуцирования ЕС на продуцирование ОВ, ген, кодирующий функцию, необходимую для непосредственной сборки или вызревания вирусной частицы, и ген, кодирующий структурный протеин вирусной частицы. Дальнейшими примерами генов, которые изменены в соответствии со способом настоящего изобретения, являются гены, которые продуцируют FР (некоторые полиэдра) мутанты, такие как 25К ген [18], а также гены, функции которых ведут к целевому фенотипу, в результате разрушения, например, вирусные факторы транскрипции, специфичные для поздней и очень поздней функции гена, гены для полиэдронной оболочки протеинов (32-36,5 кД), ген для протеина, который взаимодействует с рецептором кишечника и ответственен за начало инфицирования клеток среднего кишечника, ген или генетический элемент, ответственный за сборку PDV нуклеокапсида, ген, который ответственен за организацию полиэдрона, и ген, кодирующий NPV функциональный эквивалент вирусного повышающего фактора [19], найденный в GV. Хотя ген полиэдрина также подвержен изменению, могут существовать существенные практические ограничения к его использованию. Высокая скорость транскрипции/трансляции гена полиэд рина наряду с высокой амплификацией вирусного генома, которая имеет место в репликации вируса, приводит к количеству протеина полиэдрина, достигающему 50-75% всего окрашиваемого протеина в инфицированных клетках. Столь высокое количество протеина может сделать невозможным, чтобы ограниченное количество экстравирусных копий гена полиэдрина смогло компенсировать ген вирусного полиэдрина с делецией. Однако, комплементация вируса без полиэдрина может быть достигнута за счет использования регуляторных элементов или факторов, которые должны присутствовать лишь в небольших количествах. Примеры включают создание вирусного гена полиэдрина для того, чтобы он содержал супрессорную тРНК или изменяющие регуляторные элементы гена полиэдрина и выращивание вируса в соответствующей "хелперной" клеточной линии или штамме насекомых, как было описано ранее. В противоположность гену полиэдрина, р74 протеин, по-видимому, требуется в гораздо меньших количествах. Хотя этот ген транскрибируют поздно в вирусную инфекцию, когда вирусный геном уже в значительной степени амплифицирован, количество р74-специфической иРНК относительно мало. Должно быть возможным конструирование р74 так, чтобы ограниченное число экстравирусных копий могло обеспечить достаточное р74 функционирование для комплементации вируса к оральной инфицируемости. Настоящее изобретение иллюстрируется на АсМNPV. Ген, осуществляющий гомологическую функцию для р74 гена, должен присутствовать во всех вирусах, принадлежащих NPV и GV группам бакуловирусов. В видах бакуловирусов, близко родственных AcMNPV, имеется возможность идентифицировать гомологи гена р74 путем гибридизации с АсМNPV р74 фрагментом в мягких условиях. Такой вариант наиболее осуществим, так как доступные данные показывают, что ген р74 является одним из наиболее устойчивых бакуловирусных генов [16]. Для вирусов, которые являются более дальними родственниками, таких как GV, такое приближение может не работать. Альтернативным подходом для идентификации генов, кодирующих гомологически функции для идентификации АсМNPV гена, является подход, описанный в примере 14. В этом сете экспериментов штамм АсМNPV с известным генетическим дефектом совместно трансфицируют с фрагментами представляющего интерес вирусного генома. Комплементация дефекта идентифицирует представляющий интерес ген. Такой подход с успехом использовали для идентификации гена вируса Суdia pomonella гранулеза с функцией, гомологичной р35 апоптозису, ингибирующему ген AcMNPV [20]. Для идентификации существенно поздних функций гена можно использовать и другие способы. Пассарелли и Миллер [21] недавно опубликовали способ идентификации факторов транскрипции для поздних/очень поздних генов. В этом способе фрагменты АсMNPV вирусного генома трансфектируют одновременно с конструкциями, которые используют для поздних и очень поздних промотеров для управления экспрессией CAT гена. Фрагменты генома АсМNPV которые содержат гены, включенные в нормальную транскрипцию 6 42671 довательности АсМNPV генома - вместе с Dр74 вирусом, регенерацию инфекционной формы вируса достигают на переходной основе. Образцы E. coli штамма НВ101, несущие эту плазмиду, обозначаемые АС0028.3, которые содержат р74 ген и фланкирующие последовательности, уже описанные, были депонированы 21 мая 1992 г. в Американскую коллекцию типовых культур под регистрационным номером АТСС 68987. Так как лишь 0,15,0% клеток в этом способе совместной трансфекции содержат как функциональный ген р74, так и Dр74 вирусный геном, этот способ неэффективен по своей природе. Более эффективным способом создания "хелперной" клеточной линии является включение копии р74 гена в клетку таким образом, чтобы этот ген был стабильно интегрирован в клеточный геном (см. пример 6). Эту процедуру использовали для вставки небакуловирусных генов в Sf 9 клеточную линию насекомых [22]. Эта клеточная линия насекомых Sf 9 (AТСС регистрационный номер CRL 1711) является производной Spodoptera frugiperda 21 (Sf 21). Плазмиду, содержащую копию представляющего интерес гена, трансфицируют совместно с плазмидой, содержащей селектируемый маркер. Селектируемый маркер представляет собой ген, экспрессия которого позволяет провести идентификацию клеток, которые были трансформированы вектором, содержащим маркерный ген, а также ген, представляющий интерес. Примеры общеизвестных селектируемых маркеров включают гены тимидинкиназы (ТК) и гипоксантин-гуанин фосфорибозил трансферазы (HGPRT), а также гены, придающие устойчивость к антибиотикам, например, неомицину и гигромицину. Используют двукратный до двадцатикратного молярный избыток, комплементирующей ДНК к ДНК, содержащей селектируемый маркер. Это максимизирует вероятность того, что клетки, которые экспрессируют селектируемый маркер, также содержат ген, представляющий интерес. Выбранная клеточная линия должна быть допустима для используемого вируса. В предпочтительном варианте с АсМNPV клеточной линией является Sf9 или Sf21. После тренсфекции клетки выращивают под селекцией, и клетки, которые экспрессируют селектируемый маркер, амплифицируют. Эти клеточные линии скринируют по их способности к комплементации р74 делеции в Dр74 вирусе. Этот способ используют для выделения клеточных линий Sf9, которые содержат копии плазмиды АС0028.3, р74, содержащие плазмиды, описанные ранее. Образцы клеточной линии, обозначаемые Sf9/28, 3/CL-2, которые содержат копии плазмиды АС0028.3 стабильно интегрированной в клеточный геном, которые были депонированы автором 7 апреля 1993 г. в Американской типовой коллекции культур, и им был приписан регистрационный номер АТСС CRL 11322. Автор подтверждает, как указано в примере 7 далее, что рост дефективного неинфекционного при оральном приеме Dр74 вируса в вышеуказанной клеточной линии приводит к получению инфекционного при оральном приеме вируса Dр74. вирусных поздних/очень поздних генов, идентифицируют по их стимуляции CAT активности выше ранее существовавших уровней. Инфекционную форму вируса насекомых получают, вводя измененную функцию гена за счет методики генной комплементации. Такая инфекционная для насекомых форма измененного вируса не легко передается от хозяина к хозяину. Генетическая комплементация означает способность гена превращать мутантный фенотип в фенотип дикого вида, если он присутствует в трансформе. Различные способы получения инфекционных для насекомых форм рекомбинантных вирусов насекомых включены в объем настоящего изобретения, а именно: (1) Получение клеточной культуры тканей насекомого,трансфицированной фрагментом ДНК, который обеспечивает получение продукта или функции, которые утрачены в или дефективны в измененных вирусах; (2) получение клеточных линий насекомых, которые были стабильно трансформированы фрагментом ДНК, который обеспечивает получение продукта или функции, которая утрачена или которая дефективна в измененном вирусе; и (3) получение трансгенных насекомых, которые содержат фрагмент ДНК, который обеспечивает получение продукта или функции, которые утрачены или дефективны в измененном вирусе. Клеточная линия, используемая в способе (1) или (2), обеспечивает утраченную функцию, и тем самым, служит в качество "хелперной" клеточной линии. Так например, ген р74 в АсМNPV исключен, как указано выше. Ген дикого типа р74 дополняет дефективность измененного вируса в специфических вариантах этих трех способов, описанных ранее, следующим образом: (1) Вирус выращивают в клетках насекомого, которые содержат внехромосомные копии функционального р74 гена. Эти внехромосомные копии могут быть ДНК фрагментами, плазмидами, содержащими р74 ген, или плазмидами, способными к репликации во время деления клеток или в ответ на вирусную инфекцию. (2) Вирус выращивают в клеточной линии насекомого с одной или более из функциональных копий гена р74, стабильно включенного в клеточный геном. (3) Вирус выращивают в трансгенном насекомом, которое содержит одну или более функциональных копий р74 гена в геноме насекомого. Во всех трех способах функциональный р74 ген можно получить из AcMNPV или из любого другого члена семейства Еubaculoviridae постольку, поскольку он сохраняет инфицируемость. Ключевая концепция состоит в том, что функциональный р74 ген присутствует в транс-форме и обеспечивает способное к диффузии вещество, которое регенерирует фенотип дикого вида. В одном из способов получения комплементированной формы вируса, вирус выращивают в клеточной линии, которая обеспечивает утрату функции. Так например, Dр74 вирус получают в клеточной линии, которая экспрессирует р74 генный продукт. За счет совместной трансфекции плазмиды, содержащей Hind III Фрагмент "Р" АсМNPV - главным образом р74 ген плюс небольшое количество нативной фланкирующей после 7 42671 ности, гетерологический ген вставляют непосредственно по сайту изменения генетического элемента вируса, что означает, что рекомбинация между генетически измененным вирусом и суперинфекционным вирусом дикого типа в большинстве случаев не приведет к созданию вируса с функциями дикого типа и включенного готерологического гена. Также в объем настоящего изобретения входит включение гетерологического гена рядом с сайтом изменения генетического элемента вируса, так что сегрегация гетерологического гена и измененного генетического элемента происходит менее чем в 10% потомства вируса. Сдерживание генетически сконструированного вируса сохраняется поэтому в обоих случаях. Такие токсины включают специфический к насекомому токсин AaIT из скорпиона Androctonus australis [25], токсин из клещей вида Pyemotes tritici [2], токсин Bacillus thuringiensis subsp. aizawai (BTK) [4], токсин, выделанный из яда паука [26], и токсин Bacillus thuringiensis CryIVD (BTI) [3]. Примеры таких нейропептидов или гормонов, которые могут быть изменены такой процедурой, включают эклозионовый гормон [6], проторапикотропный гормон (РТТН), адипокинетический гормон, диуретический гормон и проктолин [5]. Примеры таких ферментов включают эстеразу ювенильного гормона (JHE) [7]. Так например, рекомбинантные бакуловирусы, которые дефектны или в которых исключен р74 ген, а также имеют гетерологический ген, кодирующий токсин, включенный в сайт изменения гена р74, приводит к вирусу с повышенной эффективностью против целевого насекомого, но который не способен к легкой передаче от одного насекомого к другому в окружающую среду. АсMNPV вирус выделяют, как описано далее в примерах 11-12, где специфический к насекомому токсин скорпиона АаIТ под контролем вирусного ДА26 промотера включают в сайт делеции в Dр74 вируса А4000. Образцы такого вируса, обозначенные А4001 были депонированы поверенным автора 7 апреля 1933 г. в Американской коллекции типовых культур, и им был присвоен регистрационный номер АТСС VR 2405. Выращивание этого вируса в дикого типа Sf 9 клетках приводит в продуцированию неорально инфекционных РІВ (как и ожидалось). Если этот вирус выращивают в хелперной клеточной линии Sf 9(28.3) СL-2, описанной ранее, получаемые РІВ являются орально инфекционными, и инфицированные насекомые демонстрируют признаки паралича АаIТ токсина (см. пример 1 далее). Выращивание вируса в клеточной линии или трансгенном насекомом, которое поставляет функциональный р74 генный продукт, дает возможность этому вирусу инфицировать насекомое через кишечник. Однако, ввиду отсутствия дальнейшей комплементации, природная популяция насекомого продуцирует только вирус, дефективный для оральной инфекционности. Таким образом, в отсутствии ко-инфицирующего вируса дикого типа, жизненный цикл рекомбинантного вируса заканчивается на этой одной инфекции. Это противоположно опубликованным подходам с использованием бакуловирусов [2], где после гибели инфицированного насекомого ОВ высвобождаются в ок Компломентация не ограничена ростом вируса в клеточной культуре. Сразу после создания "халперной" клеточной линии, можно получить два "хелперных штамма насекомых. Так например, трансформация Р элемента Дрозофилы в настоящее время является обычной, и аналогичную систему можно сконструировать для любого насекомого. Кроме того безвекторная трансформация насекомых осуществляется с использованием методики, аналогичной той, которую используют для млекопитающих. Прямую инъекцию [23] или баллистическую трансформацию [24] нре-бластодермичных яиц металлическими нитями можно использовать для создания насекомых, несущих нужный ген. Относительно слабой эндогенности р74 промотера достаточно для продуцировения р74 генного продукта. Однако, может оказаться предпочтительным использовать более сильный или более ранний промотер для управления продуцированием р74 гена. Применение гетерологического промотера может повысить эффективность комплементации р74 вируса. Любое число вирусных промотеров пригодно для использования. Примеры включают 6,9К (основной протеин) промотер, ДА26 промотер, промотер полиэдрина, 35К промотер, 39К промотер, р10 промотер и ІЕ-І промотер. Использование гетерологических промотерных конструкций например, таких какие описаны в примерах 4 и 5, обладает дополнительным преимуществом. В этих конструциях почти все гомологические последовательности 5' до делеции в ген р74 в А4000 Dр74 вирусах, описанных в примере 1, удалены. Это сильно снижает вероятность гомологической рекомбинации возможной между Dр74 вирусом и р74 последовательностью, интегрированных в клеточном геноме. В противном случае такая гомологическая рекомбинация может привести к воссозданию р74 функции и фенотипа дикого типа у вируса (см. обсуждение в примере 7). Следующим шагом к снижению вероятности гомологической рекомбинации является увеличение размера делеции в р74 гене Dр74 вируса, так что не остается кодирующей последовательности. Это легко осуществить, модифицируя протокол в примере 1. Геторологический промотор не ограничивается вирусными промотерами. Подходят также и клеточные промотеры. Существует нелимитируемый выбор клеточных промотеров. Примеры их включают Bombyx mori актиновый промотер и Drosophilla melanogaster hsp 70 промотер. Хорошие промотеры экспрессируют с умеренным или высоким уровнем в соответствующие клетки насекомых во время вирусной инфекции. Эти характеристики не сводят к одному промотеры насекомых. Этим критериям могут удовлетворять различные вертебратные, дрожжевые или промотеры из других классов вирусов. Любые из вышеуказанных промотеров также управляют экспрессией селектируемых маркеров. В следующем варианте изобретения геторологический ген для контроля или модификации вещества насекомого включают в вирусный геном. Вещество, например, является токсином, нейропептидом или гормоном или ферментом. В част 8 42671 ружающую среду, где они перевариваются другими насекомыми и жизненный цикл вируса повторяется, и таким обраpом происходит передача от хозяина к хозяину. Вероятно наиболее важным в настоящем изобретении является помещение гормона или фермента рядом с или непосредственно в сайт изменения вирусного генетического элемента, что означает, что любая гомологическая рекомбинация между этим генетически созданным вирусом и вирусом дикого типа только восстанавливает исходный родительский генотип. Так например, включение гена токсина в участок делении р74 создает вирус, который представляет собой токсин+/инфекционный ОВ-. Рекомбинация с дикого типа (токсин-/инфекционный ОВ+) вирусом приведет только к получению токсин+/инфекционный ОВ- и токсин-/инфекционный OB+потомство. Акт рекомбинации за счет гомологической рекомбинации, которая должна давать потомство токсин+/инфекционный ОВ+, предотвращается, так как ген делеции и вставки имеет место в одном и том же сайте, а не двух различных местах вирусного генома. Поэтому ген токсина будет находиться в вирусах, которые генетически дефектны для продуцирования инфекционных ОВ. Такое сдерживание гетерологического гена для токсина будет поддерживаться, и инфекционный вирус исчезнет из экосистемы скорее, нежели вирус дикого типа за счет его пониженной способности создавать потомство вируса. Для того, чтобы настоящее изобретение стало более понятным, приводятся следующие примеры. Они приведены лишь для иллюстративных целей, и их не следует рассматривать как ограничивающие объем настоящего изобретения. Примеры Используют стандартные методики, принятые в молекулярной биологии в соответствии с протоколами, описанными Самбруком с сотр. [27]. Стандартные методики для выращивания бакуловируса используют в соответствии с протоколом, описанным Саммером и Смитом [28]. Кроме того, все ссылки на "именные" АсMNPV рестрикционные фрагменты основаны на физических картах Е2 штамма АсMNPV, опубликованных в работе Саммерса и Смита [28]. Пример 1 Конструирование вектора переноса Dр74-1 и рекомбинантного вируса А4000 Вектор переноса Dр74-1 конструируют для целей делеции генa р74 из Е2 штамма Autographa californica NPV приблизительно 90 единиц по карте бакуловирусного генома (см. фиг. 1). Bst ЕII фрагмент "Е", который содержит ДНК, кодирующую р74, выделяют из штамма Е2 вирусной ДНК. Этот фрагмент субклонируют в Bst ЕII сайт рSЕ280 плазмидного вектора (Инвитроген, СанДиего СА). Этот клон обозначен LBІО.2. Фрагмент, кодирующий участок 5' p74 плюс 5'фланкирующие последовательности выделяют из LB10.2, вырезая Nсо I, затупляя этот Nсо I сайт Т4 ДНК полимеразой, вырезают с помощью Xho I и очищают полученный фрагмент на геле. Этот Nсо I затупленный Xho 1 фрагмент субклонируют между Крn I сайтом, который был предварительно затуплен, и Хhо I сайтом плазмиды LВ9.6. Плазмида LВ9.6 является производной плазмиды Bluescript SK (Stratagene, La Jolla, CA), в которую вставлен полилинкер по Hinc II сайт. Этот линкер содержит дополнительные уникальные сайты рестрикционного энзима, пригодные для включения гетерологических генов в р74 участок делеции (см. далее). Полученная плазмида, содержащая 5' фланкирующую и 5' р74 последовательности, описанные ранее, обозначается как LВ 11.12. Фрагмент Нра 1 до Ваm НІ р74, кодирующий 3'треть гена и 3'фланкирующие последовательности выделяют и клонируют между Eco RV и Bam HI сайтами LВ 11.12. Полученный клон является вектором переноса Dр74-1 (см. фиг. 2). Этот вектор переноса кодирует 4750 пар оснований /bр/ 5' фланкирующей последовательности, р74 последовательности из bр 1-69, 64 bр описанного выше плазмидного полилинкера, р74 последовательности из bр 1287 до кодона терминации у 1937, и 1796 bр 3'фланкирующей последовательности [15]. На фиг. 3 изображена делеция в р74 кодирующем участке более подробно. Этот вектор переноса затем используют для конструирования штамма А400 вируса по стандартной процедуре контрансфекции (29)×2´106 клеток Sf засевают в 60 мм чашки тканевой культуры. После прикрепления клеток среду удаляют из клеток и заменяют 0,75 мл среды Grace с 10% сыворотки плода теленка (FCS плюс антибиотики. Один мкг AcMNPV ДНК плюс 2 мкг Dр74-1 ДНК добавляют к 0,75 мл трансфекционного буфера (25 мМ НЕРЕS рН 7,1 140 мМ NаСl, 126 мМ СаСl2). Затем к клеткам прикапывают ДНК, и клетки инкубируют в течение 4 часов при 27°С. Спустя 4 часа среду удаляют и клетки осторожно промывают свежим ТNMFH плюс 10% FCS и антибиотики. Затем клетки снова дополняют свежим ТNMFH плюс 10% FСS и антибиотики. Спустя 4-5 дней ЕСV собирают й отдельные бляшки выделяют анализом для бляшек, описанным Саммерсом и Смитом [28]. Затем отдельные бляшки используют для инфицирования отдельных ячеек на 48 ячеичной пластине для культур тканей, которую предварительно засевают 7,5´104 Sf 9 клеток в 0,5 мл свежей среды TNMFH. Спустя 5 дней собирают 10 мкл недосадочной жидкости, содержащей отпочкованный вирус из каждой ячейки в каждом ряду или колонке. Проводят реакцию PCR, используя 4 мкл собранной надосадочной жидкости, и олигомер А и С, как показано на фиг. 3. Так как Олиго С специфично к делеции р74, этот фрагмент амплифицирован только в таких реакциях, которые содержат рекомбинантный вирус. PCR реакцию ведут следующим образом: сорок мкл собранной надосадочной жидкости вначале переваривают в тeчение одного часа при 55°С 200 мкг/мл неспецифической протеазы из Streptomyces griseus (Boehringer Mannheim, Indianapolis, IN) в 25 мкл реакционной среды, содержащей IX буфер А (10 мМ Тris (рН 8,3), 50 мМ КСl, 0,1 мкг-мл желатина, 0,45% NonidetTM Р/40/ (Шелл Ойл Ко.) и 0,45% ТвинTM20 (IСI Америкас. Инк.). Затем неспецифическую протеазу инактивируют, нагревая до 95°С в течение 12 минут. PCR амплификация состоит в смешивании протеазой обработанного вируса 50 пикомолями каждого из указанных олигонуклео 9 42671 тидных праймеров в 50 мкл реакционной среды, содержащей 200 мкл четырех dNТР / dATP, dGTP, dСТР и dТТР), 1,5 мМ МgСl2, IX буфера А и 1,25 од. AmpliTaqTM ДНК полимеразы (ПеркинЭлмер) Петус, Норуолк, СТ). Образцы подвергают 30 циклам амплификации, каждый из которых длится 1 минуту при 94°С (стадия денатурирования), 1,5 минут при 55°С (стадия отжига) и 2,5 минуты при 72°С (стадия удлинения). После 25 циклов следует 7-минутная стадия удлинения при 72°С. 20 мкл реакционной смеси обрабатывают электрофоретически на 1,2% агарозном геле, для подтверждения присутствия рекомбинантного вируса. Так как образцы обрабатывают по рядам и колонкам, рекомбинантный вирус идентифицируют по ячейке, которая относится как к положительному ряду, так и к положительной колонке. Пример 2 Демонстрация фенотипа А4000 в анализе с использованием листового диска на Heliothis virescens Проводят стандартный анализ с диском листа на личинках Heliothis virescens третьей стадии развития для определения инфекционности вирусного штамма А4000. Один мкл капли, содержащие вирус (с определенной дозой РІВ) в ТЕТ буфере (50 мМ Тris-НСl, рН 7,5 / 10 мМ ЕДТА/0,1% ТritonTMХ-100 (Rohm and Haas, Philadelphia, PA) добавляют на 5 мм диск листа хлопка в отдельной кювете, содержащей предварительно увлажненный диск фильтровальной бумаги (приблизительно 4 мм в диаметре - 30 мкл воды). После того, как капли высыхают, одну личинку помещают в ячейку и ячейку закрывают. Личинке дают питаться в течение ночи. На следующее утро личинки, которые съели весь диск листа, переносят в отдельные ячейки, содержащие пищу насекомого. За личинками следят на предмет гибели до стадии окукливания. Эту процедуру повторяют с вирусным штаммом Е2 АсMNPV дикого типа, обозначенный А1000, который используют для контроля. Результаты двух отдельных тестов следующие: Вирус Тест 1 A4000 (Dр74) A1000 Дикий тип Тест 2 A4000 (Dр74) A1000 Дикий тип Доза (PIBs) Число погибших 2,5´105 5´104 5´103 5´102 5´102 5´101 1/31 0/32 0/31 0/32 16/18 14/31 5´106 5´105 5´104 5´103 5´102 5´101 Пример 3 Комплементация А4000 для получения неинфекционной формы вируса за счет выращивания клеточной линии, содержащей нестабильную интегрированную копию Нind III фрагмента "Р" АсМNРV Sf 9 длетки совместно трансфектируют по стандартному протоколу, описанному в примере 1. Один мкг А4000 геномной вирусной ДНК с и без 10 кратным молярным избытком АС0028.3 плазмидной ДНК используют в трансфекции, АС0028.3 состоит из Hind III фрагмента "Р" АсMNPV, вставленного в Нind III сайт Bluescript KS11 (Stratagene, La Jolla, CA). Фрагмент Hind III "Р" указан в верхней части фиг. 2 как часть Bst КII фрагмента "Е" АсМNPV. Этот фрагмент содержит всю р74 кодирующую последовательность с 221 bp 5' фланкирующей и 56 bp 3' фланкирующей последовательностью. Спустя 48 часов полиэдру собирают с инфицированных клеток низкоскоростным центрифугированием с последующим повторным суспендированием в ТЕТ буфере. SDS добавляют к повторно суспендированному вирусу до окончательной концентрации 1%. Клеточную ДНК гидродинамически фрагментируют, интенсивно перемешивая и отбирая пипеткой образцы. Ряд последовательных промывок РІВ в ТЕТ буфере без SDS с последующим низкоскоростным центрифугированием, используют для удаления клеточной ДНК. И наконец, РІВ повторно суспандированные в ТЕТ буфере и считают на гемоцитометре для анализа. Биоанализ ведут как описано в примере 2. В дозах 1´105 РІВ пелиэдра из клеток Sf 9 трансфектированных А4000 ДНК отдельно не приводят к гибели личинок. РІВ из Sf 9 клеток совместно трансфицируют А4000 и А00028.3 ДНК приводит к гибели личинок за счет инфицирующего вируса. Поэтому рост А4000 вируса в клетках обеспечивает функциональный р74 протеин (за счет наличия АС0028.3 плазмиды) приводит к продуцированию инфекционного для насекомых вируса А4000. Этот вирус способен устанавливать продуктивное инфицирование в личинке. Этот результат подтвержден сбором РІВ с умерших личинок. РІВ собирают, помещая кадавры в чашки, из которых дно было удалено и заменено NitexTM, торговая марка Tetko, Briarcliff Nytex Manor, NY. ТЕТ буфер промывают затем над кадаврами (1 мл/личинку) и то, что пролилось и содержит РІВ, собирают. Эти РІВ повторно суспендируют в ТЕТ буфере плюс 1% SDS смешивают и осаждают при низких скоростях. Затем эти РІВ промывают несколько раз ТЕТ буфером без SDS. Получают ДНК из этих РІВ, как описано нa с. 35 в работе Саммерса и Смита [28]. Используют PCR амплификацию, используя олигомеры, как указано в примере 1, для подтверждения наличия вируса Dр74 в этих погибших личинках. Пример 4 Конструирование векторов экспрессии, содержащих гетерологический промотер Использование готорологических промотеров для управления экспрессией гeна р74 может повысить эффективность комплементации вируса Dр74. Обычные векторы экспрессии для такого применения состоят из следующих модулей: (1) модуля готерологического промотера, который 0/20 0/21 0/24 0/20 22/32 5/32 Эти результаты показывают, что вирусы, содержащие делецию гена р74, не являются инфекционными даже в дозах в 10000 раз выше, нежели инфекционные вирусы, содержащие интактный ген р74. Гибель одной личинки, которая произошла для А4000, по-видимому, не связана с нормальным ходом инфицирования. 10 42671 Каждую реакцию заканчивают, добавляя ЕDТА к 10 мМ саркосила (натрий-N-лаурилсаркозин) до 0,2% (вес/объем). Затем продукты экстрагируют один раз хлорформом, один раз смесью фенол:хлороформ и осаждают этанолом. Образцы ДНК повторно растворяют в соответствующем буфере, а затем переваривают Рst 1 /который распознает центральные 6 пар оснований [CTGCA¯ G] Sse 83871 сайт/ и Хbа І. Затем каждый предполагаемый промотерный фрагмент очищают с помощью гель-электрофореза на 1,2% агарозном геле с низкой температурой плавления и лигируют до 3,2 kb Pst I/Хbа I векторным фрагментом, полученный из pMEV I. Этот фрагмент содержит полилинкерный модуль, 3' UTR модуль и Вluescript SK + рамка рМЕV I. Целевые рекомбинанты идентифицируют рестрикционным ферментным анализом и определением последовательности ДНК. Специалисты могут повторить этот процесс для любого промотерного участка, последовательность которого доступна, например, AcMNPV 6,9K промотер, промотер полиэдрина, или также клеточные промотеры, как Drosophila melanogaster hsp 70 промотер. Пример 5 Конструирование гетерологической конструкции, кодирующей участок промотера р74 Протеин, кодирующий участок р74, выделяют для включения в вектор экспрессии, содержащий гетерологические промотеры (как описано в примере 4) за счет РСR амплификации соответствующего участка А00028.3. В этой реакции используют 24 bр (+)-нитевой праймер, который содержит 5' конец у АТG трансляционного стартового сайта гена р74. (-)-нитевой праймер имеет 29 bр и состоит из 20 bр 3' р74 последовательности, оканчивающейся ТТА стоп-кодоном трансляции, с последующими 9 bр дополнительной последовательностью, которая включает сайт Ваm HI. Условия для PCR состоят в смешивании 250 пмолей АС0028.3 с 50 рмолями каждого из указанных олигонуклеотидных праймеров в 50 мкл реакционной смеси, содержащей 200 мкг каждого из dNTP (dАТР, dGТР, dCTP и dTTP), 1,5 мМ MgСІ2, 1´буфер А и 1,25 ед. АmpliTaqTM ДНК полимеразы (Перкин-Элмер/Цетус, Норфолк, СТ). Образец подвергают 5 циклам амплификации, каждый из которых состоит из 1 минуты при 94°С (стадия денатурирования), 1,5 минут при 45°С (стадия отжига) и 3 минут при 72°С (стадия удлинения), после чего проводят 25 циклов амплификации, каждый из которых состоит из 1 минуты при 94°С (стадия денатурирования), 1,5 минут при 55°С (стадия отжига) и 2,5 минут при 72°С (стадия удлинения). После этих циклов следует 7-минутное удлинение при 72°С. После очистки, продукт реакции обрабатывают фрагментом Кленова ДНК полимеразы 1 [27] в присутствии всех четырех dNТР для обеспечения того, чтобы PCR продукт имел тупые концы. 3' конец р74 кодирующего участка переваривают затем с Ваm HI, a полученный фрагмент очищают электрофорезом на 1% агарозном геле с низкой точкой плавления. Затем этот фрагмент клонируют в любой из нескольких векторов экспрессии, описанных в примере 4. Для получения векторов экспрессии для вставки гена р74, каждый вектор пе используют для управления транскрипцией; (2) модуля полилинкера, который облегчает включение ДНК последовательностей, экспрессия которых необходима; и (3) 3' UTR, которые обеспечивают сайт для процессинга первичной транскрипции и полиаденилировения (см. фиг. 4). Такой вектор экспрессии, который состоит из АсМNPV DA26 генного промотера, полилинкерa, и АсМNPV 6,9к оснований протеина 3' UTR, обозначают pMEV1. Образцы штамма Е. соli ДН5a содержащие специфический pMEV 1 изолят, обозначенный АС0064.1, были депонированы правопреемником автора в Американской коллекции типовых культур 7 апреля 1993 г. под регистрационным номером 69275. Дополнительные векторы можно легко получить, заменяя содержащий промотер фрагмент Pst I-Хbа l pMEV 1 на Pst I/Хbа l-І переваренные фрагменты, содержащие АсМNPV 6,9 К (pMEV 2), полиэдрин (рМЕV 3) и 35К (рМЕV 4) вирусные генные промотеры. Использованные при конструировании этих векторов фрагменты промотеров формируют за счет PCR амплификации клонированной вирусной ДНК, используя специфические для промотера пары олигонуклеотидных праймеров. Эти праймеры обозначают таким образом, чтобы амплифицированные сегменты промотера имели следующую общую структуру: (1) 5' терминальную 22 bр гетерополимерную синтетическую последовательность с сайтами узнавания для рестрикционных эндонуклеаз Sst I, Sse 83871 и Stu І в указанном порядке; (2) сегмент вирусной ДНК, который простирается от точки 100-350 bр в обратном порядке определенного транскрипционного стартого сайта гена до 3' конца 5' UTR (то есть, положение - 1 по отношению к кодону инициирования трансляции и (3) 3' конец 23 bр гетерополимерного участка с сайтами узнавания для рестрикционных эндонуклеаз Esp 31 и XbaI (в указанном порядке). Положение и ориентация Еsр 31 сайта узнавания располагает сайты расщепления между положениями -5 и -4 в (+) нити и между положениями -1 и +1 в /-/ нити. Матрица использованная для получения 35К промотеров, является АсМNPV Hind III Фрагмент "К". Последовательность (+) нити праймера содержит 22 bр гетерополимерную последовательность с сайтами для рострикционного энзима Sst I, Sse 83871; и StuI и 35 К 5' последовательность с -399 до -382. (-)-нитевой праймер содержит 35К 5' последовательность от -21 до -1, с последующим 23 bр гетерополимерным участком с сайтами для рестрикционных энзимов Еsp 31 и Xba I. Для каждой реакции амплификации 50 пикомолей соответствующих пар оснований смешивают с 250 пикомолей матричной ДНК в 50 мкл реакционной смеси, содержащей 10 мМ Tris-HCI (рН 8,3), 50 мм КСl, 1,5 мМ MgCl2, 200 мкМ dNTP, 100 мкг/мл желатина и 2,5 ед. AmpliTaqTM ДНК полимеразы (Перкин-Элмер/Цетус, Норфолк, СТ). Образец амплифицируют через 25 циклов по 1 минуте при 94°С) стадия денатурирования 1,5 минут при 55°С (стадия отжига) и 3,0 минут при 72°С (стадия удлинения). Как и в других реакциях добавляют 7 минут на последнюю стадию удлинения. 11 42671 реваривают с Еsр 31, и полученный 5' простирающийся конец заполняют под действием Е. соli ДНК полимеразы 1 (фрагмент Кленова) в присутствии всех четырех dNТР. Затем каждый препарат переваривают с Ваm НІ. Вектор выделяют из освобожденного полилинкерного фрагмента с помощью электрофореза на 1% агарозном геле с низкой точкой плавления, а затем лигируют в отдельной реакции с кодирующим р74 генным фрагментом. Пример 6 Выделение стабильных Sf9 клеточных линий, содержащих функциональную копию р74 гена, включенную в клеточный геном В этом примере производные Sf9 клеток, содержащие р74-ген-содержащие конструкции, стабильно включенные в клеточный геном, выделяют по способу, описанному Джарвис с сотр. [22]. Конкретно используют плазмиду, обозначаемую как АС0028.3 (АТСС 68987). Эта плазмида содержит АсМNРV Hind III фрагмент "Р", который охватывает р74 ген плюс небольшое количество нативной фланкирующей последовательности. Вначале клетки Sf 9 ко-трансфектируют со смесью 2 мкг АС0028.3 плазмидной ДНК и 1 мкг плазмидной IЕ-I Nео ДНК [22]. После трансфицирования клетки инкубируют в течение 2 часов при 28°С. После промывки клеток полной средой TNMFH [27] клетки снова снабжают питательной средой и инкубируют в течение 22 часов при 28°С. Затем клетки помещают на пластины при низкой плотности для создания слабо засеянной культуры и снова дополняют полной ТNMFH плюс 0,5 мг/мл (в расчете на активный ингредиент) аналогов неомицина G418 (GIBCO-BRL Гранд АЙленд, N.Y.). Затем эти клетки инкубируют в течение недели при 28°С. К концу одной недели среду заменяют на полную ТNМFН без G418. Для каждой из трех отдельных пластин используют следующую процедуру. Выжившие клетки собирают и амплифицируют. Три амплифицированных сета клеток представляют стабильные клеточные линии, обозначенные Sf 9/28.3/CL 1, Sf 9 (28.3)CL-2 (ATCC CRL 11322) и Sf 9 (28.3) CL-3. Эти смеси популяций выращивают, а затем проверяют на наличие р74 гена, используя PCR, как описано в примере 1, олигомером специфическим для (+) нити р74 (олигомер А) и олигомером специфическим для участка утраченного из р74 гена в А4000 вирусе (олигомер В), как показано на фиг. 3. Пример 7 Продунирование инфицирующего насекомых вируса А4000 за счет роста вышеуказанной клеточной линии и демонстрация фенотипа Для каждой из трех клеточных линий, выделенных как описано в примере 6, инфицируют при МОI более чем 1 вирусом А4000. Продуцирование можно вести при МОI в интервале от около 0,01 до 20. РІВ собирают с инфицированных клеток, как описано в примере 3. Осуществляют стандартный анализ с дисками листа (см. пример 2). Результаты трех отдельных тестов описаны ниже, где А1000 вирус является штаммом дикого типа Е2 АсМNPV: Вирус/Клеточная линия Тест 1 A4000/Sf9 A4000/CL-1(P3) A4000/CL-2(P2) A4000/CL-3(P2) A1000/Sf9 Необработано Тест 2 A4000/Sf9 A4000/CL-1(P3) A4000/CL-2(P2) A4000/CL-3(P2) A1000/Sf9 Необработано Тест 3 A4000/Sf9 A4000/CL-1(P7) A4000/CL-2(P6) A4000/CL-3(P6) A4000/CL-3(P2) A1000/Sf9 Необработано Доза (PIBs) Кол-во погибших на кол-во тестированных % гибели 1´105 1´105 1´105 1´105 1´103 0 0/16 7/16 9/15 6/16 30/32 0/30 0 44 60 38 94 0 1´105 1´105 1´105 1´105 1´103 0 0/15 1/15 4/16 6/16 21/28 0/32 0 6 25 38 75 0 1´105 1´105 1´105 1´105 1´105 1´103 0 0/16 5/16 5/16 0/16 3/15 17/31 0/15 0 31 31 0 20 55 0 Как видно из этих результатов, если клетки Sf9 стабильно трансформированные плазмидой АС0028.3 инфицируют вирусом А4000, полученные РІВ оказываются теперь орально инфекционными. Напротив, РІВ из А4000 инфицированных родительских, нетрансформированных клеток Sf 9 не приводят к гибели личинок. Это означает, что рост А4000 вируса в клетках, обеспечивающих функциональный р74 протеин (за счет стабильной интеграции конструкции функционального р74 гена как описано в примере 6) приводит к продуцированию инфекционного для насекомых вируса А4000. Причина, потери комплементации на участке 6 Sf9 (29.3)СL-3 клеточной линии не известна. ДНК затем получают (как описано в примере 3 на с. 35 у Саммерса и Смита [28]) из РІВ отдельно собранных с двадцати личинок убитых комплементирующим вирусом в вышеуказанном тесте PCR амплификацию с использованием праймеров А и С для анализа на присутствие вируса Dр74, и праймеров А и В для анализа на присутвие дикого типа вируса (см. фиг. 3 для праймеров) ведут по способу примера 1. Полученные результаты демонстрируют, что все двадцать личинок инфицированы вирусом Dр74. В дополнении к положительному сигналу для вируса Dр74, пять из двадцати личинок демонстрируют сильную полосу РСR, характерную для присутствия интактного p74 гeна. Анализ с диском листа (см. пример 2) осуществляют, используя РІВ, выделенный из 18 из 20 личинок для тeста 1. Дозу 1´105 РІВ/личинку для 32 тестируемых личинок используют для каждого образца. Только 4 из исследованных личинок имели положительный сигнал для присутствия интактного р74 гена, ведущего к гибели выше указанных фоновых уровней. Ни один из 14 исследованных, которые давали положительный тест на присутствие делеции р74 гена, не вызывал гибели личинок выше фонового уровня. 12 42671 анализируют с помощью PCR на наличие р74. Этот процесс повторяют до тех пор, пока месячная линия не устанавливается гомозиготной для р74 гена. Пример 9 Продуцирование инфекционного для насекомых А4000 вируса путем выращивания в штаммах вышеуказанных трансгенных насекомых и демонстрация фенотипа Вначале 5 мкл гемолимфатических инъекций 1´105 А4000 отпочкованных вирусов в среде тканевой культуры вводят небольшому количеству (10-20) трансгенных Trichoplusia ni личинок на четвертой стадии развития. После гибели из-за А4000 вируса, которая отмечалась для большинства личинок через 4-5 дней, РІВ собирают как описано в примере 3. Затем эти РІВ используют для дальнейшей амплификации. Трансгенные Trichoplusia ni личинки на третьей стадии развития, содержащие одну из р74 конструкций, описанных в примере 5, кормят на пищевых прямоугоульниках 1´1,5 дюйма (2,54´3,80 см), поверхность которых загрязнена 0,4 мкл 1´106 РIB /мл вируса А4000. После того, как отмечают гибель изза вируса А4000 большиявиа личинок (5-6 дней), РІВ собирают как описано ранее. Образец этих РІВ хранят в ТЕТ буфере, в качестве источника вируса, а полученные вирусы биоанализируют в стандартном анализе на дисках листьев на дикого типа личинках Trichoplusia ni второй стадии развития. Полученные результаты демонстрируют, что рост А4000 в трансгенных насекомых, содержащих функциональный р74 гeн, сохраняет инфицируемость насекомых вирусом с примерно нормальным уровнем. Однако, вирус, собранный с дикого типа личинок, умерщвленных этим комплементированным вирусом, обладает пониженной способностью к оральному инфицированию насекомых. Пример 10 Включение гена, кодирующего Токсин в Dp74-1 вектор переноса и выделение рекомбинантного вируса А4ТxР-1 ДНК фрагмент, кодирующий специфический к насекомому токсин клеща от Pyemotes tritici /ТхР1/, выделяют из кДНК клона Тох34 [2]. Eco RI фрагмент, содержащий полный протеин, кодирующий участок гена плюс некоторые 5' и 3' нетранслируемые участки, клонируют в AcMNPV pVL 1393 вектор (Invitrogen, San Diego, CA). Eco RV до Hind III (затупленный) фрагмент из этой конструкции включают в вектор переноса Dр74-1 по АfІ II сайту, который является внутренним к делеции (см. фиг. 2). Котрансфекция этой плазмиды, обозначенной LBI5.9 с А4000 вирусный гeномной ДНК на Sf 9 клетки, как указано в примере 1, приводит к получению рекомбинантного вируса, который кодирует ТхР-1 ген, но не может орально инфицировать личинку. Инъекция почкующейся формы этого вируса в гемолимфу личинок Неliothis virescens на четвертой стадии развития не приводит, однако, к характерному параличу, вызываемому экспрессией ТхР-1. Кроме того, рост этого вируса способами, описанными в примерах 3, 7 и 9, приводит к получению инфекционного для насекомых вируса А4ТхР-1. Эти инфекционное А4ТхР-1 вирусы могут орально инфицировать личинку и вы Не ограничиваясь нижеуказанным, эти результаты должны быть связаны с одной из двух причин. Наиболее прямой причиной может быть тот факт, что образцы комплементированного вируса загрязнены вирусом дикого типа, или что некоторые личинки из начального теста (тест 1) уже несли вирус дикого типа, и, что после суперинфицирования р74 вирусом, оба из них, вирус дикого типа и Dр74 могут присутствовать в РВI препаратах, полученных то из этих личинок. Альтернативным объяснением может быть то, что во время роста вируса Dр74 в комплементирующей клеточной линии, происходят гомологические рекомбинации между вирусом и последовательностью р74, заключенной в клеточный геном. Если это происходит в незначительной степени, тогда только некоторые из личинок, которые погибли от комплементированного вируса, должны также содержать вирус дикого типа. Этот дикого типа вирус будет орально инфекционным во втором цикле анализа. В рассматриваемых конструкциях, 284 bр гомолог существует между Db p74 вируса и р74 последовательности, интегрированной в клеточный геном 5' делеции, и 713 bp гомологи существуют 3' до делеции. Если альтернативное объяснение справедливо, тогда этот результат можно отнести за счет снижения, или, при необходимости, исключения количества гомологических последовательностей, присутствующих между вирусом и клеточной линией. Пример 8 Конструирование трансгенных насекомых, которые содержат функциональную копию р74 гена, стабильно интегрированного в геном насекомого В этом примере баллистическое введение ДНК через частицы вольфрама используют для конструирования тренсгенных штаммов насекомых [24]. 20-100 мкг ДНК для одной из р74 конструкций, описанных в примере 5, в эмбрио-инъектируемый буфер (0,1 мМ натрийфосфат, рН 6,8, 5 мМ КСl) осаждают на 1,2 мм диаметром промытые вольфрамовые частицы (Bio-Rad, Richmond, СA). Полный объем осажденной реакции составляет 65 мкл. После осаждения, 50 мкл надосадочной жидкости удаляют. Хлопья и 12-15 мкл надосадочной жидкости интенсивно перемешивают непосредственно перед внесением 8 мкл в макроинъeктор. Для бомбардировки дехорионированных зародышей Тrichoplusia используют систему подачи биочастиц Biolistics перед формированием бластодерма. Во время этой процедуры зародыши находятся на фильтровальной бумаге. Затем эмбрионы помещают под углеводородное масло серии 700 (Halocarbon Products Corp., Hackensack, N.Y.) до инкубирования. Когда выжившие насекомые инкубируют, группу из 25 насекомых помещают в клетки вместе. Яйца собирают из этих клеток и ДНК препарируют из эмбрионов как описано у Робертса [30]. РСR реакцию (см. пример 1), используя олигомеры А и В как показано на фиг. 3, проводят для определения того, в какой клетке продуцируют яйца, содержащие ген р74. После идентификации положительных групп, яйца из этой группы помещают на корм и дают возможность развиться во взрослые особи. Отдельные пары взрослых насекомых скрещивают и ДНК выделяют из яиц, которые они производят, снова 13 42671 звать паралич. Однако, вирус, продуцируемый этими инфицированными личинками, не сохраняет инфекционную способность для насекомых. Пример 11 Конструирование вектора экспрессии, содержащего колон, оптимизирующий АаIТ ген Специфический для насекомых токсин АаIТ найден в яде Севeро-Африканского скорпиона Androctonus australis Hector. Вектор переноса для включения АаIТ гена в участок гена полиэдрина АсMNPV конструируют. Этот вектор, обозначаемый АС0055.1, содержит АаIТ ген, включенный в ВаmНІ сайт pVL 985/30/, и состоит из кодона, оптимизирующего нуклеотидную последовательность для зрелого АаIТ токсина, связанного с сигнальным пептидом гена кутикулы Drosophila melanogaster. Образцы Е. соli штамма НВ101, сохраняющие этот вектор переноса АС0055.1, были депонированы правопреемником автора 17 декабря 1992 г. в Американскую коллекцию типовых культур, и им был представлен регистрационный номер АТСС 69166. Сегмент, кодирующий токсин этого вектора переноса, выделяют для последующего включения в векторы экспрессии примера 4 за счет РСR. Праймеp (+)-нити, используемый в реакции, является олигонуклеотидом из 27 оснований, у которого 5' конец соответствует АТС кодону инициирования трансляции кодона оптимизированного АаТ гена (в АС0055.1), подлежащего амплификации. Праймер (-)-нити гибридизуется с сайтом в АС0055.1, расположенным в около 35-40 bр после 3' конца АаIТ гена. Условия для PCR реакции описаны, в основном, в примере 1. После очистки продукты реакции обрабатывают, как описано в примере 5, за исключением того, что фрагмент очищают с помощью электрофореза на 1,8% агарозном геле с низкой точкой плавления. Для получения векторов экспрессии для вставки гена токсина каждый вектор переваривают с Esp 31, а полученный 5' простирающийся конец заполняют под действием E. coli ДНК полимеразы 1 (фрагмент Кленова) в присутствии всех четырех dNТР. Каждый из препаратов затем переваривают с Ваm HI. Вектор выделяют из освобожденного полилинкерного фрагмента путем электрофореза на 1% агарозном геле с низкой точкой плавления, а затем лигируют в отдельных реакциях с АаIТ кодирующим ген фрагментом. Пример 12 Выделение АаIТ токсин-кодирующего рекомбинантного А4001 вируса Для получения А4000 вирусной ДНК для генной вставки ДНК линеаризируют последовательными переварами с Ssе 83871 и Вsu 361. В типичных получениях 40 мкг А4000 вирусной ДНК переваривают в течение 2 часов при 37°С со 100 ед. Sse 83871 (Таkаrа Biochemical, Inc., Berkеley, CA) в 250 мкл реакции, содержащей 10 мМ Tris-НСl, рН 7,5, 10 мМ МgСl2, 1 мМ дитиотретиол (ДТТ), 50 мМ NaCl, и 0,01% ВSА. Затем реакционную смесь устанавливают до 100 мМ NaCl и 50 мМ Тris-НСl, рН 7,9 и ДНК переваривают в течение 2 часов при 37°С со 100 ед. Вsu 361 (New England Biolabs, Beverly, MA). Затем реакцию обрывают, добавляя SDS до финальной концентрации 1% (вес./объем), NaCl до финальной концентрации 0,3 М и ЕДТА до концентрации 10 мМ. После этого ДНК хроматографируют на "полупрепаративной" колонке (BioRad Laboratories, Richmond, CA), содержащей 2 мл слой объема Сефакрил-300 (Pharmacia, Piscataway, NJ), уравновешенный 10 мм Tris-HСІ (рН 8,0), 1 мМ ЕДТА, 0,1% SDS и 0,3 М NaCl; 12 150 мкл фракций собирают, 10 мкл каждой фракции анализируют с помощью электрофореза для идентификации фракций, содержащих вирусную ДНК. Эти фракции собирают, экстрагируют один раз смесью фенол:хлороформ, а вирусную ДНК осаждают затем этанолом. ДНК повторно суспендируют в ТЕ/10 мМ Tris-НСІ/рН 8,0) 1 мМ ЕДТА) в концентрации 0,2-1 мг/мл и хранят при 4°С. Для определения того, была ли линеаризирована ДНК полностью, аликвоту ее переваривают Eco RI и анализируют с помощью электрофореза. Вирусная ДНК с фрагментом 7 kb Eco RI не была переварена полностью Bsu 361 и Ssе 83871, и поэтому не использовалась. Содержащий АаIТ вектор экспрессии, описанный в примере 11, переваривают с Вsu 361 и Sse 83871. 12 нг токсин-кодирующего фрагмента лигируют с 0,5 мкг Bsu 361 / Sse 87831-линеаризированной и очищенной АсМNPV А4000 ДНК в 5 мкл реакционной среде, содержащей 25 мМ TrisНСІ (рН 7,6), 5 мМ MgСl2, 1 мМ АТР, 1 мМ ДТТ, 5% (вес/объем) полиэтиленгликоля-8000 и 0,5 ед. Т4 ДНК лигазы (Gibro-BRL, Gaithersburg, MD). После ночи инкубирования при 16°С полную реакцию дигирования используют для трансфекции Sf 9 клеток, как описано в примере 1. Через пять дней после трансфекции среду удаляют из трансфектированных Sf 9 клеток, 10-кратное серийное разбавление гранофекционной надосадочной жидкости приготавливают, и двух мл аликвоты 10-3, 10-4 и 10-5 разбавляют, используя для инфицирования 1,5´10' клеток в 6 см культуральных чашках. Спустя час после добавления вируса вирусный инокулюм удаляют, и клетки покрывают содержащей агарозу средой, как описано в предыдущем примере. Когда бляшки полностью развиваются, их используют для инокуляции отдельных ячеек 48 ячеечной пластины, и полученное потомство вирусов анализируют с помощью PCR, используя праймер А на фиг. 3 в качестве праймера (+)-нити, и (-)-нити кутикулы-AaIT праймер, описанный в примере 11. После одного иди двух дополнительных циклов очистка бляшек, получают РI источник (28), AaIT, содержащий рекомбинантный вирус, обозначают А4001. Биологическую активность этого вируса оценивают, проводя инъекционный анализ на ECV. ЕСV инъектируют в личинки Heliothis virescens на четвертой стадии развития (червь бутона табака). Вирус титруют способом анализа бляшек [28], а затем разбавляют до 2´107, 2´106 и 2´105 PFU /мл в TNM-FH среде, дополненной 0,5% (объем/объем) красным красителем номер 5. Каждую из личинок анестезируют двуокисью углерода в течение 2-5 минут, а затем инъектируют 0,5 мкл разбавленного вируса, используя шприц Гамильтона, снабженный 26 gauge иглой. Иглу вводят вдоль между последними двумя ложноножками, а затем двигают вдиль двух-трех сегментов тела перед инъекцией. После инъекции каждую личинку исследуют на предмет высвобождения окра 14 42671 плификации, используя (+) нить р74-специфического праймера, как описано в примере 5, и Блюскрипт-специфический праймер Т3 (Stratagene La Jolla, CA) до затравки (-) нити. Этот р74 фрагмент обрабатывают фрагментом Кленова ДНК полимеразы 1, как было описано ранее. После очистки фрагмента, его переваривают Bсl 1, который разрезает вблизи 3' конца гена р74, LВ 17.8 приготавливают аналогично за счет переваривания Esp 31, с последующим затуплением этого конца фрагментом Кленова. После очистки этого вектора, его также переваривают Всl 1. Затем полученный вектор и р74 генный фрагмент лигируют вместе в стандартных условиях. Этот клон обозначают рUASGAL-р74, и он cодeржит полный ген р74 под контролем hsp промотера, но зависит от наличия GАL 4 протеина. Рекомбинантный АсМNРV вирус, обозначаемый A4UAS, создают способом, описанным в примере 1. Дополненные вирусы получают, выращивая этот рекомбинантный вирус в клеточной линии, описанной в примере 6. Стандартный биоанализ, как описано в примере 2, проводят, а полученные результаты демонстрируют, что UASGAL-р74 является нeинфекционным для насекомых при оральном поглощении, но если этот вирус выращивают в GАL 4, комплементирующей клеточной линии, он является инфекционным для насекомых при оральном поглощении. Пример 14 Выделение функционального аналога АсМNРV р74 гена из генома вируса гранулоза Выделение гена, ответственного за оральную инфекционность вируса гранулоза, становится достижимым с использованием методики маркера спасения [21]. Геномную библиотеку клонов перекрывающихся космид вначале получают из вирусной ДНК Тrichoplusia ni вируса гранулоза (ТnGV) за счет лигирования частитичного SalI перевара TnGV ДНК в вектор коcмиды р VB102 [34]. 1 мкг аликвот одного из клонов CpGV космид котрансфектируют с 1 мкг AcMNPV A4000 вирусной ДHК по способу, описанному в примере 1. Спустя 5 дней проводят стандартный анализ бляшек [28]. Если бляшки полностью развились, используют отдельные бляшки для инфицирования отдельных ячеек в 48 ячеечной пластине для культуры тканей, как описано в примере 1. Потомство вируса из этих ячеек собирают в группы по 20 и скармливают личинкам Trichoplusia ni в третьей стадии развития в анализе дисков листьев, как описано в примере 2. Если Клон коcмид содержит функциональный аналог р74, он снимает оральную инфекционность у вируса A4000. Специфический гeн, ответственный за такое исключение идентифицирован в результате повтора ко-трансфицирования и протоколом анализа с плазмидными субклонами положительных космид. Источники информации 1. Granados, R.R., and Federici, B.A., The Biology of Baculoviruses, 1, 99 (1986). 2. Tomalski, M.D., and Miller, L.K., Nature. 352, 82-85 (1991). 3. Federici, В.A., In Vitro. 28., 50A (1992). 4. Martens, J.W.M., et al., App. & Envir. Microbiology, 56, 2764-2770 (1990). 5. Menn, J.J., and Borkovec, А. В., J. Agric. Food Chem., 37, 271-278 (1989). шенной красителем гемолимфы и удаляют, если недостатки образца очевидны и образец вызывает сомнение. Личинки хранят при 27°С в покрытых 4 см2 пищевыми клетками (одна личинка на клетка) и исследуются визуально раз в день на предмет выживания или гибели. Отдельные личинки оценивают как умирающие, (положительная реакция), если она не способна управлять собой через 0,5-2 минуты после того, как ее переворачивают на спину. Если Н. virescens личинку инъeктируют 6´103 1´104 PFU вируса, личинки, реагирующие на А4001 вирусную инфекцию демонстрируют паралич и пониженное время реакции по сравнению с дикого-типа АсМNPV характеристиками АаIТ-продуцирующий рекомбинантный вирус. Конкретно, рекомбинантный вирус имеет среднее время реакции (RT50) 50% (+/-4%) величины для дикого типа вируса в одном биоанализе, и (RT50) из 52 (+/-5%) величины для дикого типа вируса во втором биоанализе. Этот результат показывает, что включение АаIТ гена и сигнальной последовательности кутикулы в AcMNPV (A4001) увеличивает скорость умерщвления за счет экспрессии биологически активного токсина. В стандартном анализе дисков листа, как описано в примере 2 только личинки, которые питались с вирусом А4001 росли в клеточной линии Sf 9 (28.3) СL-2, демонстрировали контранционный паралич, характерный для АаIТ токсина. Напротив, личинки, которые питались с вирусом А4001, росли в дикого типа клетках Sf9, не демонстрировали контракционного паралича. Пример 13 Конструирование вектора переноса UASGAL р74 и вируса A4UAS В этом примере специфическою дрожжевую активирующую в обратном направлении последовательность, UASGAL плюс минимальное Drosophila melanogaster hsp 70 пpoмотер/-43 дo –1 bр/ вставляют по -1 bр в обратном направлении р74 кодирующего участка вируса. GAL 4 структурный ген выделяют из р LA плазмиды [32] в виде 2,9 кb Ваm HI до Нind III фрагмента, GAL 4 фрагмент включают в один из векторов, содержащих гетерологический промотор, как описано в примере 5. Стабильные Sf 9 клетки, которые содержат функциональные копии гетерологических промотерGAL 4 конструкций внделяют, как описано в примере 6. Для создания рекомбинантаого вируса UASGAL - р74, UASGAL - р74 вектор переноса конструируют. 17 - hsp 70/ lacZ конструкция [33] используется в качестве субстрата для РСR для создания 175 bp фрагмента. Этот фрагмент состоит из четырех экземпляров 29 bp повторов, которые содержат с высокой афинностью 17 мег GАL 4 сайт узнавания, сплавленный с минимальным Drosophila melanogaster hsp 70 промотером (-43 до -1 bр). Специфические праймeры используют, которые добавляют рестрикционные сайты, необходимые для последующих стадий клонирования к 5' (Smа I) и (Es р 31 и Nde I) концов этого фрагмента. Этот фрагмент включают в Dр74-I вектор переноса (см. фиг. 4) между 5' большинства Hind III, которые были затуплены, и Nde I сайтом гена р74. Этот плазмидный клон обозначают LВ 17.8. р 74 фрагмент, кодирующий участок, создают за счет ам 15 42671 6. Eldridge, R., et al., Insect Biochem., 21, 341351 (1992). 7. Hammock, В.D., et al., Nature, 344, 458-461 (1990). 8. Williamson, M., Nature, 353, 394 (1991). 9. Hammock, В., Nature, 355, 119 (1992). 10. Luckow, V.A., and Summers, M.D., Bio/Technology, 6, 47-53 (1988). 11. Miller, L.К., Ann. Rev. Microbiol., 42, 177-199 (1988). 12. Smith, G.E., and Summers, M.D., U.S. Patent Number 4,745,051. 13. Blissard, G.W., and Rohrmann, G.F., Ann. Rev. Entomol., 35, 127-155 (1990). 14. Partington, S., et al., Virology, 175, 91-102 (1990). 15. Kuzio, J., et al., Virology. 173, 759-763 (1989). 16. Hill, J.E., et al., Biochimica et Biophysica Acta, 1172, 1-2 (1993). 17. Leisy, D.J., et al., Virology, 153, 157-167 (1986). 18. Beames, В., and Summers, M.D., Virology, 168, 344-353 (1989). 19. Gallo, L.G., et al., J. Invertebrate Path., 58, 203-210 (1991). 20. Crook, N.E., et al., J. Virology, 67, 2168-2174 (1993). 21. Passarelli, A.L., and Miller, L.К., J. Virology. 67, 2149-2158 (1993). 22. Jarvis, D.L., et al., Biotechnology, 8, 950-955 (1990). 23. Presnail, J.К., and Hoy, M.A., Proc. Natl. Acad. Sci., 89, 7732-7736 (1992). 24. Baldarelli, R.M., and Lengyel, J.A., Nucleic Acids Res., 18, 5903-5904 (1991). 25. Zlotkin, E., et al., Toxicon, 9, 1-8 (1971). 26. Jackson, J.R. H., and Parks, T.N., United States Patent Number 4,925,664. 27. Sambrook, J., et al., Molecular Cloning: A Laboratory Manual. 2nd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989). 28. Summers, M.D., and Smith, G.E., A Manual of Methods For Baculovirus Vectors And Insect Cell Culture Procedures, Dept. of Entomology, Texas Agricultural Experiment Station and Texas A & M University, College Station, Texas 77843-2475, Texas Agricultural Experiment Station Bulletin No. 1555 (1987). 29. Webb, N.R., and Summers, M.D., J. Methods Cell & Molec. Biol., 2, 173-188 (1990). 30. Roberts, D.В., ed., Drosophila: A Practical Approach, p. 276, IRL Press, Oxford, England (1986). 31. Luckow, V.A., and Summers, M.D., Virology, 170, 31-39 (1989). 32. Johnston, S.A., et al., Proc. Natl. Acad. Sci., 81, 6553-6557 (1986). 33. Fischer, J.A., et al., Nature, 332, 853-856 (1988). 34. Knauf, V.С., and Nester, E.W., Plasmid, 8, 45-54 (1982). Фиг. 1 16 42671 Фиг. 2 17 42671 Фиг. 3 Фиг. 4 18 42671 __________________________________________________________ ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 __________________________________________________________ Підписано до друку ________ 2002 р. Формат 60х84 1/8. Обсяг ______ обл.-вид. арк. Тираж 50 прим. Зам._______ ____________________________________________________________ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22 ___________________________________________________________ 19
ДивитисяДодаткова інформація
Назва патенту англійськоюVirus of insects with decreased capability for transmission from host to host in the environment, method for obtaining thereof
Автори англійськоюBrennan Linn Ann
Назва патенту російськоюВирус насекомых со сниженной способностью трансмиссии от хозяина к хозяину в окружающей среде, способ его получения
Автори російськоюБреннан Линн Энн
МПК / Мітки
МПК: C12N 15/866, A01N 63/00, C12N 7/00, A01K 67/04, C12N 15/09
Мітки: трансмісії, комах, середовищі, спосіб, одержання, вірус, навколишньому, здатністю, хазяїна, зниженою
Код посилання
<a href="https://ua.patents.su/19-42671-virus-komakh-zi-znizhenoyu-zdatnistyu-transmisi-vid-khazyana-do-khazyana-v-navkolishnomu-seredovishhi-sposib-jjogo-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Вірус комах зі зниженою здатністю трансмісії від хазяїна до хазяїна в навколишньому середовищі, спосіб його одержання</a>
Попередній патент: Спосіб одержання електричної енергії з органічних речовин
Випадковий патент: Спосіб лікування хронічної нефропатії алотрансплантату