1-феніл-2-гетероарилзаміщені похідні бензимідазолу, їх застосування для одержання лікарських засобів, фармацевтичний засіб, який містить ці похідні
Номер патенту: 81243
Опубліковано: 25.12.2007
Автори: Ельгер Бернд, Мьоннінг Урсула, Блюме Торстен, Кунке Йоахім, ХАЛЬФБРОДТ Вольфганг, Шнайдер Херберт
Формула / Реферат
1. Похідні бензимідазолу загальної формули І
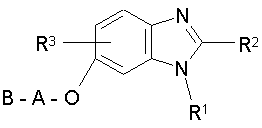 , (I)
, (I)
R1 означає фенільну групу, яка необов'язково містить до трьох замісників, незалежно один від одного вибраних із групи, яка включає F, Сl, Br, J, ОН, OR4, OCOR4, SR4, SOR4, SO2R4, R4, NH2, NHR4 і NR4R4', або два суміжні замісники при R1 спільно утворюють групу -О-СН2-О-, -О-СН2-СН2-О- або -СН2-СН2-СН2-,
R2 означає моноциклічну або біциклічну 5-10-членну гетероарильну групу, яка містить 1-2 гетероатоми, вибраних з N, S і О, і яка необов'язково містить до двох замісників, незалежно один від одного вибраних із групи, яка включає F, Сl, Br, J, OH, OR4, OCOR4, COR4, SR4, SOR4, SO2R4 і R4, або два суміжні замісники при R2 спільно утворюють групу -О-СН2-О-, -О-СН2-СН2-О- або -СН2-СН2-СН2-,
R3 означає Н, ОН або О-С1-6алкіл,
R4 і R4' незалежно один від одного означають С1-4перфторалкіл або С1-6алкіл,
А означає С2-6алкіленову групу, яка необов'язково заміщена =O, ОН, О-С1-3алкілом, NH2, NH-С1-3алкілом, NH-С1-3алканоїлом, N(С1-3алкілом)2 або N(С1-3алкіл)(С1-3алканоїлом),
В означає групу СООН, CONH2, CONHNH2, CONHR5 або CONR5R5', у кожному випадку приєднану до атома вуглецю групи А,
R5 і R5' незалежно один від одного означають залишок, вибраний із групи, яка включає С1-6алкіл, С2-6алкеніл, С2-6алкініл, де один С-атом може бути замінений на О, S, SO, SO2, NH, N-С1-3алкіл або N-С1-3алканоїл, (С0-3алкандіїл-С3-7циклоалкіл), де в пятичленному циклоалкільному кільці одним кільцевим членом може бути кільцевий N-атом або кільцевий О-атом, а в шести- або семичленному циклоалкільному кільці одним або двома кільцевими членами можуть бути відповідно кільцевий N- і/або кільцевий О-атоми, при цьому кільцеві N-атоми необов'язково можуть бути заміщені С1-3алкілом або С1-3алканоїлом, а також включає (С0-3алкандіїлфеніл) і (С0-3алкандіїлгетероарил), де гетероарильна група є п'яти- або шестичленною і містить один або два гетероатоми, вибрані із групи, яка включає N, S і О,
при цьому усі вищевказані алкільні і циклоалкільні залишки необов'язково можуть містити до двох замісників, вибраних із групи, яка включає CF3, C2F5, ОН, О-С1-3алкіл, NH2, NH-С1-3алкіл, NH-С1-3алканоїл, N(С1-3алкіл)2, N(С1-3алкіл)(С1-3алканоїл), СООН, CONH2 і СОО-С1-3алкіл, а усі вищевказані фенільні і гетероарильні групи необов'язково можуть містити до двох замісників, вибраних із групи, яка включає F, Сl, Вr, СН3, C2H5, OH, ОСН3, ОС2Н5, NO2, N(CH3)2, CF3, C2F5 i SO2NH2, або
R5 і R5' разом з N-атомом утворюють пяти-семичленне гетероциклічне кільце, яке може містити ще один N-, О- або S-атом і яке може бути заміщене С1-4алкілом, (С0-2алкандіїл-С1-4алкоксигрупою), С1-4алкоксикарбонілом, амінокарбонілом або фенілом,
а також їх оптичні або геометричні ізомери або таутомери або їх фармацевтично прийнятні солі,
за винятком наступних сполук:
6-[[1-феніл-2-(піридин-4-іл)-1H-бензимідазол-6-іл]окси]гексанової кислоти,
6-[[1-феніл-2-(бензотієн-2-іл)-1H-бензимідазол-6-іл]окси]гексанової кислоти.
2. Бензимідазоли за п. 1, які відрізняються тим, що R1 означає фенільну групу, яка необов'язково містить до двох замісників, незалежно один від одного вибраних із групи, яка включає F, Сl, ОН, OR4, OCOR4, SR4 і R4, або два суміжні замісники при R1 утворюють групу -О-СН2-О- або -СН2-СН2-СН2-.
3. Бензимідазоли за п. 1 або 2, які відрізняються тим, що R2 означає моноциклічну 5-6-членну гетероарильну групу, яка містить 1-2 гетероатоми, вибрані із групи, яка включає N, S і О, і яка необов'язково містить до двох замісників, незалежно один від одного вибраних з F, Сl, OR4, OCOR4, SR4, SOR4, SO2R4 і R4, або два суміжні замісники при R2 утворюють групу -О-СН2-О- або СН2-СН2-СН2-.
4. Бензимідазоли за будь-яким з пп. 1-3, які відрізняються тим, що R3 означає Н.
5. Бензимідазоли за будь-яким з пп. 1-4, які відрізняються тим, що R4 і R4' незалежно один від одного означають С1-2перфторалкіл або С1-4алкіл.
6. Бензимідазоли за будь-яким з пп. 1-5, які відрізняються тим, що R5 і R5' незалежно один від одного означають С1-6алкіл, де один атом вуглецю може бути замінений на О, S, SO або SO2, С3-5циклоалкіл-С0-3алкілен, де в 5-членному циклоалкільному кільці одним кільцевим членом може бути N-атом або О-атом, при цьому кільцевий атом азоту необов'язково заміщений С1-3алкілом або С1-3алканоїлом, або С0-2алкілен-(5-6-членний гетероарил з 1-2 гетероатомами з числа N, S і О), при цьому усі вищевказані алкільні і циклоалкільні залишки можуть бути заміщені групою CF3, групою ОН, групою NH2, NH-С1-3алкілом, NH-C1-3алканоїлом, N(С1-3алкілом)2, N(С1-3алкіл)(С1-3алканоїлом), групою СООН або групою CONH2, а усі вищевказані гетероарильні групи можуть бути заміщені одним або двома замісниками, вибраними з групи, яка включає F, Сl, СН3, С2Н5, ОСН3, ОС2Н5, CF3 і C2F5, або R5 і R5' разом з атомом азоту утворюють 5-7-членний гетероцикл, який може містити ще один атом кисню, азоту або сірки і може бути заміщений С1-4алкілом або С1-4алкоксі-С0-2алкілом.
7. Бензимідазоли за будь-яким з пп. 1-6, які відрізняються тим, що А означає нерозгалужений С3-6алкілен.
8. Бензимідазоли за будь-яким з пп. 1-5, 7, які відрізняються тим, що В означає групу СООН або групу CONH2, у кожному випадку приєднану до атома вуглецю групи А.
9. Сполука за п. 1, вибрана з групи, яка являє собою
6-[[1-(4-метилфеніл)-2-(3-піридиніл)-1H-бензимідазол-6-іл]окси]гексанову кислоту,
5-[[1-(4-метилфеніл)-2-(3-піридиніл)-1Н-бензимідазол-6-іл]окси]пентанову кислоту,
4-[[1-(4-метилфеніл)-2-(3-піридиніл)-1Н-бензимідазол-6-іл]окси]масляну кислоту,
6-[[1-(4-метилфеніл)-2-(4-піридиніл)-1Н-бензимідазол-6-іл]окси]гексанову кислоту,
6-[[1-(4-метилфеніл)-2-(3-тієніл)-1H-бензимідазол-6-іл]окси]гексанову кислоту,
5-[[1-(4-метилфеніл)-2-(3-тієніл)-1H-бензимідазол-6-іл]окси]пентанову кислоту,
4-[[1-(4-метилфеніл)-2-(3-тієніл)-1H-бензимідазол-6-іл]окси]масляну кислоту,
5-[[1-феніл-2-(3-тієніл)-1H-бензимідазол-6-іл]окси]пентанову кислоту,
4-[[1-феніл-2-(3-тієніл)-1Н-бензимідазол-6-іл]окси]масляну кислоту,
6-[[1-феніл-2-(3-тієніл)-1Н-бензимідазол-6-іл]окси]гексанову кислоту,
6-[[1-(4-фторфеніл)-2-(3-тієніл)-1H-бензимідазол-6-іл]окси]гексанову кислоту,
5-[[1-(4-фторфеніл)-2-(3-тієніл)-1H-бензимідазол-6-іл]окси]пентанову кислоту,
6-[[1-(4-фторфеніл)-2-(3-піридиніл)-1Н-бензимідазол-6-іл]окси]гексанову кислоту,
5-[[1-(4-фторфеніл)-2-(3-піридиніл)-1H-бензимідазол-6-іл]окси]пентанову кислоту,
5-[[1-феніл-2-(3-піридиніл)-1H-бензимідазол-6-іл]окси]пентанову кислоту,
4-[[1-феніл-2-(3-піридиніл)-1H-бензимідазол-6-іл]окси]масляну кислоту,
6-[[1-феніл-2-(3-піридиніл)-1Н-бензимідазол-6-іл]окси]гексанову кислоту,
N-(3-метоксипропіл)-6-[[1-(4-метилфеніл)-2-(3-піридиніл)-1H-бензимідазол-6-іл]окси]гексанамід,
6-[[1-(4-метилфеніл)-2-(3-піридиніл)-1H-бензимідазол-6-іл]окси]-1-морфолін-1-ілгексан-1-он,
N-метил-6-[[1-(4-метилфеніл)-2-(3-піридиніл)-1H-бензимідазол-6-іл]окси]гексанамід,
N,N-диметил-6-[[1-(4-метилфеніл)-2-(3-піридиніл)-1Н-бензимідазол-6-іл]окси]гексанамід,
6-[[1-(4-метилфеніл)-2-(3-піридиніл)-1H-бензимідазол-6-іл]окси]гексанамід,
N-циклопропіл-6-[[1-(4-метилфеніл)-2-(3-тієніл)-1Н-бензимідазол-6-іл]окси]гексанамід,
N-метил-6-[[1-(4-метилфеніл-2-(3-тієніл)-1H-бензимідазол-6-іл]окси]гексанамід,
N-(2-метоксіетил)-5-[[1-(4-метилфеніл)-2-(3-піридиніл)-1H-бензимідазол-6-іл]окси]пентанамід,
N,N-диметил-5-[[1-(4-метилфеніл)-2-(3-піридиніл)-1H-бензимідазол-6-іл]окси]пентанамід,
5-[[1-(4-метилфеніл)-2-(3-піридиніл)-1H-бензимідазол-6-іл]окси]пентанамід,
6-[[1-(4-метилфеніл)-2-(2-тієніл)-1H-бензимідазол-6-іл]окси]гексанову кислоту.
10. Застосування сполуки за будь-яким з пп. 1-9 для одержання лікарського засобу, призначеного для лікування або профілактики захворювань, пов'язаних з активацією мікроглії.
11. Застосування за п. 10 для лікування або профілактики запальних, алергічних, інфекційних або аутоімунних захворювань.
12. Фармацевтичний засіб, який відрізняється тим, що він містить одну або декілька сполук за будь-яким з пп. 1-9 і один або декілька носіїв і/або допоміжних речовин.
Текст
1. Похідні бензимідазолу загальної формули І C2 2 (19) 1 ДЛЯ 3 81243 замісників, вибраних із групи, яка включає CF3, C2F5, ОН, О-С1-3алкіл, NH2, NH-С1-3алкіл, NH-С13алканоїл, N(С 1-3алкіл)2, N(С 1-3алкіл)(С 1-3алканоїл), СООН, CONH2 і СОО-С 1-3алкіл, а усі ви щевказані фенільні і гетероарильні групи необов'язково можуть містити до двох замісників, вибраних із групи, яка включає F, Сl, Вr, СН3, C2H5, OH, ОСН3, ОС2Н5, NO 2, N(CH3)2 , CF3 , C2 F5 i SO2NH2, або R5 і R5' разом з N-атомом утворюють пятисемичленне гетероциклічне кільце, яке може містити ще один N-, О- або S-атом і яке може бути заміщене С 1-4алкілом, (С0-2алкандіїл-С 1С1-4алкоксикарбонілом, 4алкоксигрупою), амінокарбонілом або фенілом, а також їх оптичні або геометричні ізомери або таутомери або їх фармацевтично прийнятні солі, за винятком наступних сполук: 6-[[1-феніл-2-(піридин-4-іл)-1H-бензимідазол-6іл]окси]гексанової кислоти, 6-[[1-феніл-2-(бензотієн-2-іл)-1H-бензимідазол-6іл]окси]гексанової кислоти. 2. Бензимідазоли за п. 1, які відрізняються тим, що R1 означає фенільну гр упу, яка необов'язково містить до двох замісників, незалежно один від одного вибраних із групи, яка включає F, Сl, ОН, OR4, OCOR 4, SR4 і R4, або два суміжні замісники при R1 утворюють гр упу -О-СН2-О- або -СН2-СН2СН2-. 3. Бензимідазоли за п. 1 або 2, які відрізняються тим, що R2 означає моноциклічну 5-6-членну гетероарильну групу, яка містить 1-2 гетероатоми, вибрані із групи, яка включає N, S і О, і яка необов'язково містить до двох замісників, незалежно один від одного вибраних з F, Сl, OR4, OCOR4, SR4 , SOR4 , SO 2R4 і R4 , або два суміжні замісники при R2 утворюють груп у -О-СН2-О- або СН2-СН2-СН2-. 4. Бензимідазоли за будь-яким з пп. 1-3, які відрізняються тим, що R3 означає Н. 5. Бензимідазоли за будь-яким з пп. 1-4, які відрізняються тим, що R4 і R4' незалежно один від одного означають С 1-2перфторалкіл або С 14алкіл. 6. Бензимідазоли за будь-яким з пп. 1-5, які відрізняються тим, що R5 і R5' незалежно один від одного означають С1-6алкіл, де один атом вуглецю може бути замінений на О, S, SO або SO2, С3-5циклоалкіл-С 0-3алкілен, де в 5-членному циклоалкільному кільці одним кільцевим членом може бути N-атом або О-атом, при цьому кільцевий атом азоту необов'язково заміщений С 13алкілом або С 1-3алканоїлом, або С 0-2алкілен-(5-6членний гетероарил з 1-2 гетероатомами з числа N, S і О), при цьому усі ви щевказані алкільні і циклоалкільні залишки можуть бути заміщені групою CF3, гр упою ОН, гр упою NH2, NH-С13алкілом, NH-C 1-3алканоїлом, N(С 1-3алкілом)2, N(С 13алкіл)(С 1-3алканоїлом), групою СООН або групою CONH2, а усі вищевказані гетероарильні групи можуть бути заміщені одним або двома замісниками, вибраними з групи, яка включає F, Сl, СН3, С2Н5, ОСН3, ОС2Н5, CF3 і C2F5, або R5 і R5' разом з атомом азоту утворюють 5-7-членний гетероцикл, який може містити ще один атом 4 кисню, азоту або сірки і може бути заміщений С14алкілом або С 1-4алкоксі-С 0-2алкілом. 7. Бензимідазоли за будь-яким з пп. 1-6, які відрізняються тим, що А означає нерозгалужений С3-6алкілен. 8. Бензимідазоли за будь-яким з пп. 1-5, 7, які відрізняються тим, що В означає групу СООН або групу CONH 2, у кожному випадку приєднану до атома вуглецю гр упи А. 9. Сполука за п. 1, вибрана з групи, яка являє собою 6-[[1-(4-метилфеніл)-2-(3-піридиніл)-1Hбензимідазол-6-іл]окси]гексанову кислоту, 5-[[1-(4-метилфеніл)-2-(3-піридиніл)-1Нбензимідазол-6-іл]окси]пентанову кислоту, 4-[[1-(4-метилфеніл)-2-(3-піридиніл)-1Нбензимідазол-6-іл]окси]масляну кислоту, 6-[[1-(4-метилфеніл)-2-(4-піридиніл)-1Нбензимідазол-6-іл]окси]гексанову кислоту, 6-[[1-(4-метилфеніл)-2-(3-тієніл)-1H-бензимідазол6-іл]окси]гексанову кислоту, 5-[[1-(4-метилфеніл)-2-(3-тієніл)-1H-бензимідазол6-іл]окси]пентанову кислоту, 4-[[1-(4-метилфеніл)-2-(3-тієніл)-1H-бензимідазол6-іл]окси]масляну кислоту, 5-[[1-феніл-2-(3-тієніл)-1H-бензимідазол-6іл]окси]пентанову кислоту, 4-[[1-феніл-2-(3-тієніл)-1Н-бензимідазол-6іл]окси]масляну кислоту, 6-[[1-феніл-2-(3-тієніл)-1Н-бензимідазол-6іл]окси]гексанову кислоту, 6-[[1-(4-фторфеніл)-2-(3-тієніл)-1H-бензимідазол-6іл]окси]гексанову кислоту, 5-[[1-(4-фторфеніл)-2-(3-тієніл)-1H-бензимідазол-6іл]окси]пентанову кислоту, 6-[[1-(4-фторфеніл)-2-(3-піридиніл)-1Нбензимідазол-6-іл]окси]гексанову кислоту, 5-[[1-(4-фторфеніл)-2-(3-піридиніл)-1Hбензимідазол-6-іл]окси]пентанову кислоту, 5-[[1-феніл-2-(3-піридиніл)-1H-бензимідазол-6іл]окси]пентанову кислоту, 4-[[1-феніл-2-(3-піридиніл)-1H-бензимідазол-6іл]окси]масляну кислоту, 6-[[1-феніл-2-(3-піридиніл)-1Н-бензимідазол-6іл]окси]гексанову кислоту, N-(3-метоксипропіл)-6-[[1-(4-метилфеніл)-2-(3піридиніл)-1H-бензимідазол-6-іл]окси]гексанамід, 6-[[1-(4-метилфеніл)-2-(3-піридиніл)-1Hбензимідазол-6-іл]окси]-1-морфолін-1-ілгексан-1он, N-метил-6-[[1-(4-метилфеніл)-2-(3-піридиніл)-1Hбензимідазол-6-іл]окси]гексанамід, N,N-диметил-6-[[1-(4-метилфеніл)-2-(3-піридиніл)1Н-бензимідазол-6-іл]окси]гексанамід, 6-[[1-(4-метилфеніл)-2-(3-піридиніл)-1Hбензимідазол-6-іл]окси]гексанамід, N-циклопропіл-6-[[1-(4-метилфеніл)-2-(3-тієніл)-1Нбензимідазол-6-іл]окси]гексанамід, N-метил-6-[[1-(4-метилфеніл-2-(3-тієніл)-1Hбензимідазол-6-іл]окси]гексанамід, N-(2-метоксіетил)-5-[[1-(4-метилфеніл)-2-(3піридиніл)-1H-бензимідазол-6-іл]окси]пентанамід, N,N-диметил-5-[[1-(4-метилфеніл)-2-(3-піридиніл)1H-бензимідазол-6-іл]окси]пентанамід, 5 81243 6 5-[[1-(4-метилфеніл)-2-(3-піридиніл)-1Hбензимідазол-6-іл]окси]пентанамід, 6-[[1-(4-метилфеніл)-2-(2-тієніл)-1H-бензимідазол6-іл]окси]гексанову кислоту. 10. Застосування сполуки за будь-яким з пп. 1-9 для одержання лікарського засобу, призначеного для лікування або профілактики захворювань, пов'язаних з активацією мікроглії. 11. Застосування за п. 10 для лікування або профілактики запальних, алергічних, інфекційних або аутоімунних захворювань. 12. Фармацевтичний засіб, який відрізняється тим, що він містить одну або декілька сполук за будь-яким з пп. 1-9 і один або декілька носіїв і/або допоміжних речовин. Даний винахід стосується нових похідних бензимідазолу, способу їх одержання і їх застосування для одержання лікарських засобів, призначених для лікування і профілактики захворювань, зв'язаних з активацією мікроглії, і для лікування опосередковуваних Т-клітинами імунологічних захворювань, а також фармацевтичних препаратів, які містять ці нові похідні бензимідазолу. Імунна система охоплює багато різних клітин і складних тканинних структур, які взаємодіють між собою переважно за допомогою розчинних факторів. Відомо, що виникнення багатьох імунологічних захворювань зумовлено дисбалансом розчинних факторів імунітету, наприклад цитокінів [Mosmann і Coffiman, Ann. Rev. Immunol., 7, 1989, стор.145-173; Street і Mosmann, FASEB J., 5, 1991, стор.171-177; Lucey і ін., Clin. Microbiol. Rev., 4, 1996, стор.532-562; Powrie і Coffinan, Trends Pharmacol. Sci., 14, 1993, стор.164-168; Singh і ін., Immunolog. Res., 20, 1999, стор.164-168]. Так, наприклад, існує багато відомостей щодо тієї ролі, яку g-інтерферон і інтерлейкін 12 відіграють у патогенезі аутоімунних захворювань. Особливо в цьому відношенні слід назвати захворювання, для яких характерна опосередковувана Т-клітинами (Т-лімфоцитами) запальна реакція, наприклад множинний склероз, діабет, хронічні запальні захворювання кишечнику. Інтерлейкін 12 (IL-12), який є одним із представників цитокінів, продукується фагоцитами, наприклад макрофагами/моноцитами, дендритами, Вклітинами й іншими антиген-презентуючими клітинами (АПК), і впливає як на функцію природних клітин-кіллерів (NK-клітин), так і на функцію Т-лімфоцитів. IL-12 може стимулювати продукування g-інтерферону (IFNg) у клітинах обох вказаних типів. Т-лімфоцити можна в першому наближенні поділити на дві категорії, для яких характерна експресія певних поверхневих антигенів (CD4 і CD8), а саме, на СО4-позитивні Тклітини (Т-клітини-хелпери) і СО8-позитивні Тклітини (цитотоксичні Т-клітини). СО4-клітини у свою чергу можна поділити на Т-клітини-хелпери тину 1 (Тh1) і Т-клітини-хелпери тину 2 (Тh2). Саме опосередковувані Тh1-клітинами імунні відповіді зв'язані з патогенезом численних імунних, насамперед аутоімунних, захворювань, таких, наприклад, як інсулінозалежний цукровий діабет тину І (ІЗЦД), множинний склероз, алергічна контактна екзема, псоріаз, ревматоїдний артрит, хронічні запальні захворювання кишечнику (хвороба Крона, виразковий коліт), вовчакові захворювання й інші колагенози, а також гострі реакції відторгнення при алотрансплантації (реакція "хазяїн проти трансплантата", реакція "трансплантат проти хазяїна"). Щодо інтерлейкіну 12 відомо, що він відіграє найважливішу роль у регуляції відповіді Тh1клітин. Інтерлейкін 12 індукує у ци х клітинах продукування головним чином IL-2, IFNg, TNFα і TNFβ [Mosmann і Sad, Immunol. Today, 17, 1996, стор.138-146; Gately і ін., Annu. Rev. Immunol., 16, 1998, стор.495-521]. Саме IFNg є ефективним медіатором дії, яку здійснює IL-1. Надлишкове продукування g-інтерферону може відповідати, наприклад, за виникнення аутоімунних захворювань, зв'язаних з МНС II (від англ. "major histocompatibility complex", головний комплекс гістосуміності). Крім цього існує також досить велике число явних відомостей щодо тієї патологічної ролі, яку g-інтерферон відіграє при алергічних захворюваннях, а також при саркоїдозі і псоріазі [A. Billiau, Adv. Immunol., 62, 1996, стор.61130; Basham і ін., J. Immunol., 130, 1983, стор.14921494; Нu і ін., Immunology, 98, 1999, стор.379-385; J.P. Seery, Arthritis Res., 2, 2000, стор.437-440]. Крім того, інтерлейкін 12 і індукований інтерлейкіном 12/інтерлейкіном 18 g-інтерферон з NK-клітин відіграють важливу роль у патомеханізмі не опосередковуваних Т-клітинами запальних реакцій (таких, наприклад, як синдром токсичного шоку, ендотоксинемія, сепсис, септичний шок, гострий респіраторний дистрес-синдром (ГРДС), "відповідь на введення першої дози" ("first dose response") при терапії антитілами, наприклад після введення ОКТЗ при алотрансплантації) [Kum і ін., Infect Immun., 69, 2001, стор.7544-7549; Arad і ін., J. Leukoc. Biol. 69, 2001, стор.921-927; Hultgren і ін., Arthritis Res., 3, 2001, стор.41-47, Arndt і ін., Am. J. Respir. Cell. Моl. Biol., 22, 2000, стор.708-713; Grohmann і ін., J. Immunol., 164, 2000, стор.41974203; Muraille і ін., Int. Immunol., 11, 1999, стор.1403-1410]. IL-12 відіграє також певну роль при запаленнях, в основі яких лежать не виявлені в даний час патомеханізми (наприклад при еклампсії) [Hayakawa і ін., J. Reprod. Immunol., 47, 2000, стор.121-138; Daniel і ін., Am. J. Reprod. Immunol., 39,1998, стор.376-380]. Поряд з інтерлейкіном 12 і IFNg певна роль у патогенезі імунних захворювань і системних запальних реакцій приписується й іншим цитокінам, таким, наприклад, як TNFα (α-фактор некрозу пухлини). TNFα відіграє важливу патологічну роль при інфекційних захворюваннях 7 81243 (таких як сепсис, синдром токсичного шоку [Тrасеу і ін., Nature, 330, 1987, стор.662-664; Basger і ін., Сіrс. Shock, 27, 1989, стор.51-61; Hinshaw і ін., Сіrс. Shock, 30, 1990, стор.279-292; А. Waage, Lancet, 351, 1998, стор.603; Cohen і ін., Lancet, 351, 1998, стор.1731]), але також і при численних інших імуноопосредкованих захворюваннях. Для лікування опосередковуваних IL-12 захворювань і для ослаблення гострих симптомів таких захворювань часто використовують кортикостероїди, побічні дії, які проявляються при їх застосуванні, і насамперед при тривалій терапії часто є причиною припинення курсу лікування. Ключовою фазою запального процесу практично всіх дегенеративних захворювань центральної нервової системи є активація гліальних макрофагів, або мікроглії. Гліальні макрофаги протягом тривалого періоду часу можуть залишатися в активованому стані, у якому вони продукують і секретують різні запальні фактори, наприклад реакційноздатні кисень/азотвмісні проміжні продукти, протеази, цитокіни, фактори комплементу і нейротоксини. Такі фактори у свою чергу приведуть до дисфункції і переродження нервових клітин. Активацію мікроглії можуть викликати різні стимули, такі, наприклад, як Αβ-петид (β-амілоїд, [D.M. Araujo і CM. Cotman, Brain Res. 569, 1992, стор.141-145 (1992)]), пріон-протеїн, цитокіни або клітинні фрагменти [С.К. Combs і ін., J. Neurosci. 19, 1999, стор.928-939, P.L. Wood, Neuroinflammation: Mechanisms and Management, вид-во Humana Press, 1998]. Бензимідазоли, які інгібують активацію мікроглії після стимуляції Αβ-пептидом, описані [в заявці WO 01/51473]. З цієї заявки відомо також, що бензимідазоли, які інгібують активацію мікроглії, використовуються для лікування нейрозапальних захворювань, наприклад СНІДдеменції, бічного аміотрофічного склерозу, хвороби Крейтцфельда-Якоба, хвороби Дауна, хвороби дифузійних тілець Леві, хвороби Хантінгтона, лейкодистрофії, множинного склерозу, хвороби Паркінсона, хвороби Піка, хвороби Альцгеймера, апоплексії, скроневої епілепсії і різних пухлин. [У ЕР 0104727 А1] описані похідні бензимідазолу, які не заміщені в положенні 1, а в положенні 2 містять алкільну групу. Замісниками в бензольному кільці цих похідних є, зокрема, піридилоксизалишок, піридилалкільний залишок, піридилалкілоксизалишок і піридилоксіалкандіільні залишки. [У заявці WO 01/21634 А1] описані також похідні бензимідазолу, які у положенні 1 містять алкандііламідогрупу, а в положенні 2 містять, зокрема, заміщений фенільний або гетероарильний залишок і які в анельованому бензольному кільці можуть бути заміщені, зокрема, принаймні одним заміщеним алкоксизалишком, алкіламінозалишком, алкілсульфонільним залишком або алкілсульфоксидним залишком. У вказаній заявці зазначається, що ці сполуки можуть як діюча речовина в складі лікарських засобів 8 використовува тися при багатьох різних показаннях. [У патенті US 5552426] описані заміщені бензимідазоли, які у положенні 1 містять, зокрема, фенільний або нафтильний залишок, а в положенні 2 містять, зокрема, фенільний або гетероциклічний залишок. Анельоване бензольне кільце таких бензимідазолів переважно заміщене алкокси- або аміноалкоксизалишком. Відповідно до наведеної у вказаному патенті інформації подібні сполуки ефективні при захворюваннях, в основі яких лежить зв'язана з β-амілоїдним пептидом нейротоксичність. [У заявці WO 97/12613 А1] описані різні засоби, які пригнічують запальний процес і перешкоджають розвитку артеріосклерозу. Як приклад діючих речовин, які мають подібні властивості, у цій заявці вказані похідні бензимідазолу, які у положенні 1 заміщені, зокрема, фенільним або заміщеним фенільним залишком, а в положенні 2 заміщені алкоксизалишком. Замісниками в бензольному кільці в таких біологічно активних сполук можуть служити, зокрема, алкільні залишки, нітрозалишки, атоми галогену, алкоксизалишки, амінозалишки, складноефірні залишки, амідні залишки, алкандііл алкоксизалишки й алкандііламінозалишки. [У заявці ЕР 0520200 А2] описані похідні бензимідазолу, які у положенні 1 містять заміщені арильні залишки, а в положенні 2 містять одноабо двозаміщені або незаміщені аміногрупи. Бензольне кільце бензимідазольного скелету може бути заміщено галогеном, трифторметилом і/або ціаногрупою. Такі сполуки призначені для лікування захворювань, зв'язаних з підвищеною активацією Са-каналів. [У заявці WO 97/33873 А1] також описані похідні бензимідазолу, які використовуються для лікування циститу. Ці сполуки можуть містити в положенні 1, зокрема, фенільні, нафтильні і ненасичені гетероциклічні залишки. У положенні 2 такі похідні можуть бути заміщені алкоксизалишком, фенілалкоксизалишком, нафтилалкоксизалишком, гетероциклалкоксизалишком або ненасиченими гетероциклалкоксизалишком. Бензольне кільце скелету цих похідних може бути заміщене нітрозалишками, алканоїльними залишками, амінозалишками, алкільними залишками, алкоксизалишками, циклоалкільними залишками, гетероциклічними залишками, ненасиченими гетероциклічними залишками, атомами галогену, алкілтіозалишками, гідроксіалкіліденільними залишками, гідроксіалкіліденіламінозалишками, аміноалкіліденільними залишками, аміноалкоксизалишками, гідроксіалкільними залишками, гетероциклалкоксизалишками, аміноалкіліденільними залишками або трифторметильними залишками. [У заявці ЕР 0531883 А1] описані конденсовані 5-членні гетероцикли, наприклад заміщені похідні бензимідазолу, при цьому такі сполуки відповідно до загального їх опису в положенні 1 переважно заміщені заміщеним алкільним залишком, а в положенні 2 заміщені, наприклад, О 9 81243 алкандіільним, S-алкандіільним, NHалкандіільним, N(алкіл)алкандіільним, SOалкандіільним або SО2-алкандіілльним залишком. Описані в цій заявці сполуки повинні, як передбачають, мати антитромбічну активність. Один з можливих, описаних у літературі підходів з терапії запальних захворювань нервової системи полягає в даний час у застосуванні нестероїдних інгібіторів, які пригнічують запальний процес (інгібіторів СОХ II) [P.L. McGeer, Roger, Neurology, 42, 1992, стор.447-449; J. Rogers, L.C. Kirby, S.R. Hempleman, D.L. Berry, P.L. McGeer, A.W. Kaszniak, J. Zalinski, M. Cofield, L. Mansukhani, P. Wilson, F. Kogan, Neurology, 43, 1993, стор.16091611; K. Andersen, L.J. Launer, A. Ott, A.W. Hoes, M.M.B. Breteler, A. Hofman, Neurology, 45, 1995, стор.1441-1445; J.C.S. Breitner, B.A. Gau, K.A. Welsh, B.L. Plassman, W.M. McDonald, M.J. Helms, J.C. Anthony, Neurology 44, 1994, стор.227-232; The Canadian Study of Health and Aging, Neurology, 44, 1994, стор.2073-2079), модуляторів цитокінів (P.L. McGeer, E.G. McGeer, Brain Res. Rev. 21, 1995, стор.195-218; E.G. McGeer, P.L. McGeer, CNS Drugs, 7, 1997, стор.214-228; F.C. Barone і G.Z. Feuerstein, J. Cerebral Blood Flow and Metabolism, 19, 1999, стор.819-834] і інгібіторів шляху активації комплементу [S. Chen., R.C.A. Frederickson і K.R. Brunden, Neurobiol. Aging, 1996; E.G. McGeer, P.L. McGeer, Drugs, 55,1998, стор.739-746]. Відомі сполуки, які застосовуються для терапії імунологічних захворювань, такі, наприклад, як стероїди, часто впливають на декілька факторів в імунній системі й у результаті викликають численні побічні дії. Виходячи з цього, в основу даного винаходу була покладена задача запропонувати речовини, які завдяки їх активності у відношенні мікроглії мали б здатність інгібувати активність цитокінів, не викликаючи при цьому серйозних токсичних побічних дій. Вказана задача вирішується за допомогою запропонованих у винаході нових похідних бензимідазолу згідно із п.1 формули винаходу, а також за рахунок застосування запропонованого у винаході похідного бензимідазолу для одержання лікарського засобу, призначеного для переривання продукування IL-12 і IFNγ у клітинах моноцитарного походження, відповідно Т-клітинах і NK-клітинах. Інгібітори мікроглії завдяки їх здатності переривати продукування IL-12 і TNFα у моноцитах/макрофагах/дендритах і продукування IFNg у Т-клітинах і NK-клітинах придатні для лікування різноманітних захворювань, викликаних підвищеним продукуванням цитокінів, таких як TNFα і -β, IFN γ, IL-2 і IL-12, наприклад запальних захворювань, не заснованих на нейрозапаленні, аутоімунних захворювань, алергічних і інфекційних захворювань, викликаних токсинами запалень, фармакологічно спровокованих запальних реакцій, а також патофізіологічно релевантних запальних реакцій не виявленого в даний час генезу. Відповідно до цього у винаході пропонуються похідні бензимідазолу наступної загальної структурної формули І 10 (I) у якій R1 означає фенільну груп у, яка необов'язково містить до трьох замісників, незалежно один від одного вибраних із групи, яка включає F, СІ, Br, J, ОН, OR4 , OCOR 4, SR 4, SOR4, SO2R 4, R4 , NH2, NHR4 і NR4R4' , або два суміжні замісники при R 1 спільно утворюють групу -О-СН2-О-, -О-СН2-СН2-О-або СН2-СН2-СН2-, R2 означає моноциклічну або біциклічну 5-10членну гетероарильну груп у, яка містить 1-2 гетероатоми, вибраних з N, S і О, і яка необов'язково містить до двох замісників, незалежно один від одного вибраних із групи, яка включає F, СІ, Br, J, OH, OR4, OCOR 4 , COR4, SR4, SOR4, SO2R4 і R4, або два суміжні замісники при R2 спільно утворюють групу -О-СН2-О-, -О-СН2-СН2О- або -СН2-СН2-СН2-, R3 означає Н, ОН або О-С 1-6алкіл, R4 і R4 незалежно один від одного означають С1-4перфторалкіл або С1-6алкіл, А означає С 2-6алкіленову гр упу, яка необов'язково заміщена =О, ОН, О-С1-3алкілом, NH2, NH-С1-3алкілом, NH-С1-3алканоїлом, N(С13алкілом)2 або N(С 1-3алкіл)(С 1-3алканоїлом), В означає групу СООН, CONH2, CONHNH2, CONHR5 або CONR5R5' , у кожному випадку приєднану до атома вуглецю гр упи А, R5 і R5' незалежно один від одного означають залишок, вибраний із групи, яка включає С1-6алкіл, С2-6алкеніл, С2-6алкініл, де один С-атом може бути замінений на О, S, SO, SO2, NH, N-С1-3алкіл або NС1-3алканоїл, (С0-3алкандііл-С 3-7циклоалкіл), де в пятичленному циклоалкільному кільці одним кільцевим членом може бути кільцевий N-атом або кільцевий О-атом, а в шести- або семичленному циклоалкільному кільці одним або двома кільцевими членами можуть бути відповідно кільцевий N- і/або кільцевий О-атоми, при цьому кільцеві N-атоми необов'язково можуть бути заміщені С 1-3алкілом або С 1-3алканоїлом, а також включає (С0-3алкандіілфеніл) і (С03алкандіілгетероарил), де гетероарильна група є п'яти-або шестичленною і містить один або два гетероатоми, вибраних із групи, яка включає N, S і О, при цьому усі вище вказані алкільні і циклоалкільні залишки необов'язково можуть містити до двох замісників, вибраних із групи, яка включає CF3, C2F5, ОН, О-С1-3алкіл, NH2, NH-С1NH-С1-3алканоїл, Ν(С1-3алкіл)2, N(С13алкіл, 3алкіл)(С 1-3алканоїл), СООН, CONH 2 і СОО-С 13алкіл, а усі вищевказані фенільні і гетероарильні групи необов'язково можуть містити до двох замісників, вибраних із групи, яка включає F, СІ, Вr, СН3, С2Н5 , ОН, ОСН3, ОС2Н5, NO2 , N(CH3)2, CF3, C2F5 i SO2NH2, або R5 і R5' разом з N-атомом утворюють пятисемичленне гетероциклічне кільце, яке може містити ще один N-, О-або S-атом і яке може бути заміщене С 1-4алкілом, (С0-2алкандііл-С 1 11 4алкоксигрупою), 81243 С1-4алкоксикарбонілом, амінокарбонілом або фенілом, а також їх оптичні або геометричні ізомери або таутомери або їх фармацевтично прийнятні солі, за винятком наступних сполук: 6-[[1-феніл-2-(піридин-4-іл)-1H-бензимідазол6-іл]окси]гексанової кислоти і 6-[[1-феніл-2-(бензотієн-2-іл)-1Нбензимідазол-6-іл]окси]гексанової кислоти. Переважними є сполуки, у яких R1 означає фенільну групу, яка необов'язково містить до двох замісників, незалежно один від одного вибраних із групи, яка включає F, СІ, ОН, OR4 , OCOR 4, SR4 і R4, або два суміжні замісники при R 1 утворюють груп у -О-СН2-О- або -СН2-СН2-СН2-. Переважні також похідні бензимідазолу, у яких R2 означає моноциклічну 5-6-членну гетероарильну групу, яка містить 1-2 гетероатоми, вибраних із групи, яка включає N, S і О, і яка необов'язково містить до двох замісників, незалежно один від одного вибраних з F, СІ, OR4, OCOR4, SR4 , SOR4 , SO 2R4 і R4 , або два суміжні замісники при R2 утворюють груп у -О-СН2-О- або СНг-СН2-СН2-. Переважні також похідні бензимідазолу, у яких R3 означає Н. До переважних належать і похідні бензимідазолу, у яких R4 і R4' незалежно один від одного означають С1-2перфторалкіл або С1-4алкіл. Переважні також похідні бензимідазолу, у яких R5 і R5' незалежно один від одного означають С 16алкіл, де один атом вуглецю може бути замінений на О, S, SO або SO2, С 3-5циклоалкіл-С 0-3алкілен, де в 5-членному циклоалкільному кільці одним кільцевим членом може бути N-атом або О-атом, при цьому кільцевий атом азоту необов'язково заміщений С1-3алкілом або С 1-3алканоїлом, або С0гетероарил з 1-2 2алкілен-(5-6-членний гетероатомами з числа N, S і О), при цьому усі вищевказані алкільні і циклоалкільні залишки можуть бути заміщені групою CF3, гр упою ОН, групою NH2, NH-С1-3алкілом, NH-С1-3алканоїлом, N(С1-3алкілом)2, N(С1-3алкіл)(С1-3алканоїлом), групою СООН або групою CONH2, а усі вищевказані гетероарильні групи можуть бути заміщені одним або двома замісниками, вибраними з групи, яка включає F, СІ, СН3, С2Н5, ОСН3, ОС2Н5 , CF 3 і C2 F5, або R5 і R5 разом з атомом азоту утворюють 5-7-членний гетероцикл, який може містити ще один атом кисню, азоту або сірки і може бути заміщений С1-4алкілом або С14алкокси-С 0-2алкілом. Переважні також похідні бензимідазолу, у яких А означає нерозгалужений С3-6алкілен. Переважні також похідні бензимідазолу, у яких В означає групу СООН або CONH2, у кожному випадку приєднану до атома вуглецю гр упи А. До особливо переважного належать наступні конкретні бензимідазоли: 6-[[1-(4-метилфеніл)-2-(3-піридиніл)-1Нбензимідазол-6-іл]окси]гексанова кислота, 5-[[1-(4-метилфеніл)-2-(3-піридиніл)-1Нбензимідазол-6-іл]окси]пентанова кислота, 4-[[1-(4-метилфеніл)-2-(3-піридиніл)-1Hбензимідазол-6-іл]окси]масляна кислота, 12 6-[[1-(4-метилфеніл)-2-(4-піридиніл)-1Нбензимідазол-6-іл]окси]гексанова кислота, 6-[[1-(4-метилфеніл)-2-(3-тієніл)-1Hбензимідазол-6-іл]окси]гексанова кислота, 5-[[1-(4-метил феніл )-2-(3-тієніл)-1Нбензимідазол-6-іл]окси]пентанова кислота, 4-[[1-(4-метилфеніл)-2-(3-тієніл)-1Нбензимідазол-6-іл]окси]масляна кислота, 5-[[1-феніл-2-(3-тієніл)-1Н-бензимідазол-6іл]окси]пентанова кислота, 4-[[1-феніл-2-(3-тієніл)-1Н-бензимідазол-6іл]окси]масляна кислота, 6-[[1-феніл-2-(3-тієніл)-1Н-бензимідазол-6іл]окси]гексанова кислота, 6-[[1-(4-фторфеніл)-2-(3-тієніл)-1Нбензимідазол-6-іл]окси]гексанові кислота, 5-[[1-(4-фторфеніл)-2-(3-тієніл)-1Нбензимідазол-6-іл]окси]пентанова кислота, 6-[[1-(4-фторфеніл)-2-(3-піридиніл)-1Нбензимідазол-6-іл]окси]гексанові кислота, 5-[[1-(4-фторфеніл)-2-(3-піридиніл)-1Нбензимідазол-6-іл]окси]пентанова кислота, 5-[[1-феніл-2-(3-пiридиніл)-1Н-бензимідазол-6іл]окси]пентанова кислота, 4-[[1-феніл-2-(3-піридиніл)-1H-бензимідазол-6іл]окси]масляна кислота, 6-[[1-феніл-2-(3-піридиніл)-1Н-бензимідазол-6іл]окси]гексанова кислота, N-(3-метоксипропіл)-6-[[1-(4-метилфеніл)-2-(3піридиніл)-1H-бензимідазол-6-іл]окси]гексанамід, 6-[[1-(4-метилфеніл)-2-(3-піридиніл)-1Нбензимідазол-6-іл]окси]-1-морфолін-1-ілгексан-1он, N-метил-6-[[1-(4-метилфеніл)-2-(3-піридиніл)1Н-бензимідазол-6-іл]окси]гексанамід, N,N-диметил-6-[[1-(4-метилфеніл)-2-(3піридиніл)-1Н-бензимідазол-6-іл]окси]гексанамід, 6-[[1-(4-метилфеніл)-2-(3-піридиніл)-1Нбензимідазол-6-іл]окси]гексанамід, N-циклопропіл-6-[[1-(4-метилфеніл)-2-(3тієніл)-1Н-бензимідазол-6-іл]окси]гексанамід, N-метил-6-[[1-(4-метилфеніл-2-(3-тієніл)-1Hбензимідазол-6-іл]окси]гексанамід, 6-[[1-(4-метилфеніл)-2-феніл-1Нбензимідазол-6-іл]окси]-1-(тіазолідин-3-ил)гексан1-он, N-(2-метоксіетил)-5-[[1-(4-метилфеніл)-2-(3піридиніл)-1Н-бензимідазол-6-іл]окси]пентанамід, N,N-диметил-5-[[1-(4-метилфеніл)-2-(3піридиніл)-1H-бензимідазол-6-іл]окси]пентанамід, 5-[[1-(4-метилфеніл)-2-(3-піридиніл)-1Hбензимідазол-6-іл]окси]пентанамід і 6-[[1-(4-метилфеніл)-2-(2-тієніл)-1Hбензимідазол-6-іл]окси]гексанова кислота. В обсяг даного винаходу включені також фізіологічно сумісні солі вказаних вище сполук, насамперед кислі солі запропонованих у винаході похідних бензимідазолу, коли вони представлені у вигляді азотистих основ, а також основні солі запропонованих у винаході похідних, коли вони представлені у ви гляді карбонових кислот. Запропоновані у винаході похідні бензимідазолу можуть мати один або декілька асиметричних центрів, і тому такі сполуки можуть існувати в декількох ізомерних формах. Сполуки 13 81243 формули І можуть бути також представлені у вигляді таутомерів, стереоізомерів або геометричних ізомерів. До обсягу винаходу відповідно до цього включені також усі можливі ізомери, такі як Е- і Z-ізомери, S- і R-енантіомери, діастереомери, рацемати і їх суміші, у тому числі таутомерних сполук. Усі такі ізомерні сполуки, навіть якщо в кожному конкретному випадку це і не зазначено особливо, є складовою частиною даного винаходу. Суміші ізомерів можна за звичайними методами, таким, наприклад, як кристалізація, хроматографія або солеутворення, розділяти на енантіомери, відповідно на E/Z-ізомери. Гетероарильні групи, які містяться в запропонованих у винаході бензимідазольних сполуках, складаються з 5-10 скелетних атомів і можуть містити 1 або 2 гетероатоми. Такими гетероатомами є кисень (О), азот (N) і сірка (S). Як приклади моноциклічних гетероарильних груп можна назвати піроліл, тієніл, фураніл, імідазоліл, тіазоліл, ізотіазоліл, оксазоліл, ізоксазоліл, піразоліл, піридил, піримідиніл, піримідиніл і піридазиніл. Прикладами біциклічної гетероарильної групи є індоліл, ізоіндоліл, бензотіофеніл, бензофураніл, бензимідазоліл, індазоліл, хіноліл, ізохіноліл, фталазиніл, хіназолініл, цинолініл, хіноксалініл і нафтиридиніл. Коли гетероарильна група утворює частину замісника R1, зв'язок з атомом N бензимідазолу здійснюється через атом вуглецю. Гетероарильні залишки можуть бути будьяким чином приєднані до бензимідазольнго скелету або до іншої гр упи, наприклад у вигляді 2-, 3- або 4-піридинілу, у ви гляді 2- або 3-тієнілу або у вигляді 1-імідазолілу. Алкільні групи можуть мати прямий або розгалужений ланцюг. Як приклад таких алкільних груп можна назвати метил, етил, «-пропіл, ізопропіл, н-бутил, втор-бутл, трет-бутп, н-пентил, втор-пентил, трет-пентил, неопентил, н-гексил і втор-гексил. Перфторованими алкільними залишками є переважно CF3 і С2F5. Під циклоалкільними групами в кожному випадку маються на увазі циклопропіл, циклобутил, циклопентил, циклогексил або циклогептил. Як приклади насиченого гетероциклічного кільця, відповідно як приклади циклоалкілу з одним або декількома гетероатомами можна назвати піперидин, піролідин, тетрагідрофуран, морфолін, піперазин, гексагідроазепін, а також 2,6диметилморфолін, N-фенілпіперазин, 2метоксиметилпіролідин, піперидин-4-карбонамід, тіоморфолін і тіазолідин, при цьому зв'язок може здійснюватися через присутні за певних умов кільцеві N-атоми. Прикладами нерозгалуженого або розгалуженого алкілену, який містить до шести Сатомів, як значення замісника А є етилен, пропілен, бутилен, пентилен, гексилен, а також 1метилетилен, 1-етилетилен, 1-метилпропілен, 2метилпропілен, 1-метилбутилен, 2-метилбутилен, 1-етилбутилен, 2-етилбутилен, 1-метилпентилен, 14 2-метилпентилен, 3-метилпентилен і аналогічні сполук. А може бути двозаміщений, переважно однозаміщений, групою ОН, групою NH2, NH-С13алкілом або NH-С 1-3алканоїлом. Для утворення фізіологічно сумісних кислих солей запропонованих у винаході похідних бензимідазолу, коли вони представлені у вигляді азотистих основ, придатні неорганічні й органічні кислоти, такі, наприклад, як щавлева кислота,молочна кислота, лимонна кислота, фумарова кислота, оцтова кислота, малеїнова кислота, винна кислота, фосфорна кислота, соляна кислота, бромистоводнева кислота, сірчана кислота, п-толуолсульфонова кислота і метансульфонова кислота. При наявності в запропонованих у винаході сполуках кислотних груп, насамперед груп карбонових кислот, можливо також утворення солей з неорганічними або органічними основами, які відомі за їх застосуванням для утворення фізіологічно сумісних солей і як приклад яких можна назвати гідроксиди лужних металів, насамперед гідроксид натрію і гідроксид калію, гідроксиди лужноземельних металів, такі як гідроксид кальцію, а також аміак і аміни, такі як етаноламін, діетаноламін, триетаноламін, Nметилглюкамін і трис(гідроксиметил)метиламін. Сполуки формули І інгібують активацію мікроглії і продукування інтерлейкіну 12 (IL-12) і gінтерферону (IFNg). Відповідно до цього винахід стосується також застосування сполуки формули І, а також її оптичних або геометричних ізомерів або її таутомерів або фізіологічно прийнятної солі для одержання лікарського засобу, призначеного для лікування або профілактики зв'язаного з активацією мікроглії захворювання, насамперед викликаного надлишковим продукуванням IL-12 і IFNγ захворювання, і для індукції продукування інтерлейкіну 10 (IL-10). В одному з переважних варіантів запропоновані у винаході сполуки використовуються для лікування опосередковуваного Т-клітинами, зокрема опосередковуваного клітинами Th-1, імунологічного захворювання і не опосередковуваних Т-клітинами запальних реакцій. Запропоновані у винаході сполуки використовуються насамперед для одержання лікарського засобу, призначеного для переривання продукування IL-12 і IFNγ у клітинах моноцитарного походження, відповідно Т-клітинах і ΝΚ-клітинах. Запропоновані у винаході сполуки завдяки їх здатності переривати продукування IL-12 і TNFα у моноцитах/макрофагах і продукування IFNγ у Тклітинах придатні для лікування різноманітних захворювань, викликаних підвищеним продукуванням цитокінів, таких як TNFα і -β, IFNγ, IL-2 і IL-12, наприклад запальних захворювань, не заснованих на нейрозапаленні, аутоімунних захворювань, алергічних і інфекційних захворювань, викликаних токсинами запалень, фармакологічно спровокованих запальних реакцій, 15 81243 а також патофізіологічно релевантних запальних реакцій не виявленого в даний час генезу. Як приклад запальних і аутоімунних захворювань можна назвати хронічні запальні захворювання кишечнику (хвороба Крона, виразковий коліт), артрит, алергічну контактну екзему, псоріаз, пемфігус, астм у, множинний склероз, діабет, інсулінозалежний цукровий діабет тину І, ревматоїдний артрит, вовчакові захворювання й інші колагенози, хвороба Грейвса, зоб Хасімото, реакцію "трансплантат проти хазяїна" і відторгнення трансплантата. Прикладами алергічними, інфекційними, викликаними токсинами і викликаних ішемією захворювань є саркоїдоз, астма, гіперчутливий пневмоніт, сепсис, септичний шок, ендотоксиновий бактеріально-токсичний шок, синдром токсичного шоку, токсична печінкова недостатність, ГРДС (гострий респіраторний дистрес-синдром), еклампсія, кахексія, гострі вірусні інфекції (наприклад інфекційний мононуклеоз, блискавичний гепатит), пошкодження органів після реперфузії. Прикладом фармакологічно спровокованого запалення з патофізіологічної релевантністю служить "відповідь на введення першої дози" ("first dose response") після введення в організм Тклітинних антитіл, таких як ОКТЗ. Як приклад системних запальних реакцій не виявленого в даний час генезу можна назвати еклампсію. До переліку нейрозапальних захворювань, зв'язаних з активацією мікроглії, належать, наприклад, СНІД-деменція, бічний аміотрофічний склероз, хвороба Крейтцфельда-Якоба, хвороба Дауна, хвороба дифузійних тілець Леві, хвороба Хантінгтона, лейкодистрофія, множинний склероз, хвороба Паркінсона, хвороба Піка, хвороба Альцгеймера, апоплексія, скронева епілепсія і різні пухлини. Відповідно до цього винахід стосується також застосування запропонованих у ньому похідних бензимідазолу для лікування цих захворювань, а також для їх профілактики. Відповідно до винаходу до ефективних інгібіторів мікроглії належать сполуки, які інгібують активність мікроглії при стимуляції Αβ-пептидом принаймні на 20%, а активність цитокінів інгібують принаймні на 30%. Біологічні властивості інгібіторів мікроглії можна досліджувати відомими фа хівцям у даній галузі методами, наприклад розглянутими нижче й [описаними в WO 01/51473] методами дослідження. У прикладі 29 описана методика, відповідно до якої можна оцінити інгібування активації мікроглії. При цьому для активації мікроглії можна використовува ти різні стимули, наприклад Αβпетид (β-амілоїд, [D.M. Araujo і C.M. Cotman, Brain Res. 569, 1992, стор.141-145 (1992)]), пріонпротеїн, цитокіни або клітинні фрагменти [С.K. Combs і ін., J. Neurosci. 19, 1999, стор.928-939, P.L. Wood, Neuroinflammation: Mechanisms and Management, вид-во Humana Press, 1998]. Стимуляція за допомогою Αβ-пептиду відповідає патофізіологічній ситуації при хворобі Альцгеймера. У цьому дослідженні при стимуляції 16 за допомогою Αβ-пептиду запропоновані у винаході сполуки виявляють інгібуючу дію на активацію мікроглії. Інгібуюча дія запропонованих у винаході сполук на активацію мікроглії виявляється в значному зниженні продукування і секреції цитокінів, наприклад інтерлейкіну 1β (111β) і α-фактора некрозу пухлини (TNFα) (за результатами твердофазного імуноферментного аналізу (ELISA) і аналізу експресії мРНК), і в зниженій секреції реакційноздатних кисень/азотвмісних проміжних продуктів. Відповідно до цього забезпенується одночасне інгібування декількох запальних факторів. Ефективність запропонованих у винаході сполук in vivo визначали за допомогою МСАОмоделі на щурах. Подібна модель дозволяє зімітувати стан, який відповідає апоплексії. Запропоновані у винаході сполуки знижують активацію мікроглії, яка відбувається при гострих патологічних змінах у головному мозку тварин. Інгібуючу дію на продукування цитокінів оцінюють, наприклад, визначаючи кількість TNFα і інтерлейкіну 12 у стимульованих ліпополісахаридом (ЛПС) клітинах ТНР-1. Запропоновані у винаході сполуки інгібують продукування TNFα і інтерлейкіну 12 у стимульованих ліпополісахаридом (ЛПС) клітинах ТНР-1. Для визначення впливу, який запропоновані у винаході сполуки виявляють на активацію Т-клітин, досліджують, наприклад, секрецію IFNg. Запропоновані у винаході сполук інгібують продукування IFNg периферичними одноядерними клітинами крові. Даний винахід стосується також фармацевтичних засобів, які містять одну або декілька запропонованих у винаході сполук загальної формули І, а також один або декілька носіїв. Такі запропоновані у винаході фармацевтичні засоби, відповідно склади одержують залежно від передбачуваного шляху їх введення в організм у необхідному дозуванні за відомими методами з використанням звичайних твердих або рідких носіїв або розріджувачів, а також звичайних фармацевтичних і те хнологічних допоміжних речовин. Переважні композиції представлені у вигляді лікарської форми, придатної для перорального, ентерального або парентерального, наприклад внутрішньоочеревинного, внутрішньовенного, внутрішньом'язового або черезшкірного, введення. Прикладами подібних лікарських форм є таблетки, філм-таблетки, драже, пілюлі, капсули, порошки, пасти, мазі, примочки, рідкі препарати, такі як сиропи, гелі, рідкі препарати для ін'єкцій, наприклад для внутрішньоочеревинних, внутрішньовенних, вн утрішньом'язових або черезшкірних ін'єкцій, і інші лікарські форми. До переліку інших лікарських форм належать також депо-форми, зокрема імплантовані форми застосування, а також супозиторії. При цьому з подібних окремих лікарських форм запропоновані у винаході похідні залежно від їх тину вивільняються в організм поступово або у всій кількості за короткий проміжок часу. 17 81243 Для перорального застосування як фармацевтичні препарати можуть використовува тися капсули, пілюлі, таблетки, драже і рідкі препарати або інші відомі лікарські форми для перорального введення. У цьому випадку лікарські засоби можна готува ти у вигляді препаратів, які або за короткий проміжок часу вивільняють діючі речовини і виділяють їх в організм, або мають пролонговану дію, яка забезпечує більш тривале, повільне надходження діючої речовини в організм. До складу подібних разових дозованих лікарських форм разом принаймні з одним похідним бензимідазолу може входити один або декілька фармацевтично прийнятних носіїв, наприклад речовини для регулювання реологічних властивостей лікарського засобу, поверхнево-активні речовини, гідротропні солюбілізатори, мікрокапсули, мікрочастинки, грануляти, розріджувачі, в'яжучі, такі як крохмаль, цукор, сорбіт і желатин, а також наповнювачі, такі як кремнієва кислота і тальк, змащувальні речовини, барвники, ароматизатори й інші речовини. Відповідні таблетки можна готувати, наприклад, змішуванням діючої речовини з відомими допоміжними речовинами, наприклад з інертними розріджувачами, такими як декстроза, цукор, сорбіт, маніт, полівінілпіролідон, розпушувачами, такими як кукурудзяний крохмаль або альгінова кислота, в'яжучими, такими як крохмаль або желатин, змащувальними речовинами, такими як карбоксиполіметилен, карбоксиметилцелюлоза, фталат ацетилцелюлози або полівінілацетат. Таблетки можуть також мати багатошарову структур у. Відповідним чином можна також одержувати драже нанесенням на виготовлені аналогічно до таблеток ядра покрить зі звичайно застосовуваних як оболонки драже матеріалів, таких, наприклад, як полівінілпіролідон або шелак, гуміарабік, тальк, оксид титану або цукор. При цьому оболонка драже також може мати багатошарову стр уктур у, для одержання якої можна використовувати допоміжні речовини, вказані вище для таблеток. Капсули, які містять діючі речовини, можна виготовляти, наприклад, змішуванням діючої речовини з інертним носієм, таким як лактоза або сорбіт, і розфасовуванням отриманої суміші в желатинові капсули. Запропоновані у винаході похідні бензимідазолу можна також використовувати в лікарській формі у вигляді розчину, який призначений для перорального прийому і який разом з біологічно активним похідним бензимідазолу містить як інгредієнти фармацевтично прийнятне масло і/або фармацевтично прийнятну ліпофільну поверхнево-активну речовину і/або фармацевтично прийнятну гідрофільну поверхнево-активну речовину і/або фармацевтично прийнятний розчинник, який змішується з водою. Для підвищення біодоступності запропонованих у винаході діючих речовин такі сполуки можна також використовувати у вигляді 18 клатратів з циклодекстриновим каркасом. Для цього запропоновані у винаході сполуки піддають взаємодії з α-, β- або γ-циклодекстрином або з його похідними. Використання паст, мазей, примочок і призначених для зовнішнього застосування рідких препаратів припускає наявність у них таких властивостей, які забезпечують надходження запропонованих у винаході сполук в організм у достатній кількості. До складу подібних лікарських форм входять допоміжні речовини, наприклад речовини для регулювання реологічних властивостей лікарських засобів, поверхневоактивні речовини, консерванти, гідротропні солюбілізатори, розріджувачі, речовини для поліпшення проникності запропонованих у винаході похідних бензимідазолу через шкіру, барвники, ароматизатори і захисні засоби для шкіри, такі як кондиціонери і регулятори вологості. У лікарському засобі разом із запропонованими у винаході сполуками можуть також міститися й інші діючі речовини [Ullmanns Enzyklopadie der technischen Chemie, 1953, т.4, стор.1-39; J. Pharm. Sci., 52, 1963, стор.918 і далі; Η. ν. CzetschLindenwald, Hilfsstoffe flir Pharmazie und angrenzende Gebiete, Pharm. Ind., 2, 1961, стор.72 і далі; Dr. H.P. Fiedler, Lexikon der Hilfsstoffe fur Pharmazie, Kosmetik und angrenzende Gebiete, видво Cantor AG, Aulendorf/Wiirtt., 1971]. Запропоновані у винаході сполуки можна також застосовувати у вигляді відповідних розчинів, наприклад у вигляді фізіологічного розчину кухонної солі, як розчини для інфузії або ін'єкцій. Для парентерального введення діючі речовини можуть бути присутніми у розчиненому або суспендованому у фізіологічно сумісному розріджувачі вигляді. Як такі розріджувачі придатні насамперед олійні розчини, наприклад розчини в кунжутній олії, рицинові олії і бавовняній олії. Для підвищення розчинності можна додавати гідротропні солюбілізатори, такі, наприклад, як бензилбензоат або бензиловий спирт. Для приготування препарату для ін'єкції може використовува тися будь-який рідкий носій, у якому запропоновані у винаході сполуки присутні в розчиненому або емульгованому вигляді. До складу подібних рідких препаратів часто включають також речовини для регулювання в'язкості, поверхнево-активні речовини, консерванти, гідротропні солюбілізатори, розріджувачі й інші добавки, які надають розчину ізотонічність. Разом з похідними бензимідазолу в складі таких препаратів в організм можна вводити й інші діючі речовини. Запропоновані у винаході сполуки можна також занурювати у відповідний матеріал з одержанням трансдермальної системи і тим самим вводити їх в організм черезшірно. У цьому випадку похідні бензимідазолу вводять в організм, наприклад підшкірно, у вигляді депо-ін'єкції або препарату-імплантату. Подібним препаратам можна надавати такі властивості, які забезпечують уповільнене вивільнення діючої речовини. Для цього можуть використовуватися відомі рішення, наприклад, депо-форми, які розчиняються або 19 81243 обладнані мембраною. Як інертні матеріали імплантати можуть також містити, наприклад, біорозкладні полімери або синтетичні силікони, наприклад кремнійорганічний каучук. Для черезшкірного введення похідні бензимідазолу можна також занурювати, наприклад, у пластир. Доза запропонованих у винаході сполук загальної формули І, яка призначається пацієнту, визначається лікуючим лікарем і залежить, зокрема, від конкретної сполуки, яка вводиться в організм, від шляху введення, від захворювання, яке піддається лікуванню, і від ступеня його тяжкості. Добова доза діючої речовини не перевищує 1000мг, переважно не перевищує 100мг, і може бути розрахована на однократне введення в день у вигляді разової дози або розділена на декілька менших доз з розрахунку на два або більше прийоми на день. Бензимідазоли формули І можна одержувати різними шляхами за відомими з відповідної літератури методами. Як можливі методи одержання запропонованих у винаході сполук разом з іншими слід згадати розглянуті нижче. 1. Відновленням заміщених в орто-положенні групами, які вилучаються, (переважно галогензаміщених) нітробензольних похідних (А) ариламінами (В) при різних реакційних умовах, наприклад шляхом нагрівання реагентів за відсутності або в присутності прийнятного інертного розчинника, зокрема алкілбензолів, можна одержувати N-арил-2-нітробензоли (С). Розчинником може також служити використовуваний як реагент амін при його застосуванні в надлишку. Реакції проводять без або ж у присутності основ (наприклад карбонату калію, гідриду натрію). У реакціях можна також використовува ти інші допоміжні речовини, наприклад мідні солі. Приклади щодо проведення реакцій відповідно до розглянутої ви ще методики можна знайти в численних присвячених цій тематиці роботах, [наприклад у D. Jerchel, Η. Fischer, M. Graft, Ann. Chem., 575, 1952, стор.162; у CAS, 53 (2138); у R.-A. Abramovitch, Can. J. Chem., 38, 1960, стор.2273]. 20 Нітрогрупу (С) переважно відновлювати шляхом гідрування в полярних розчинниках, таких як оцтова кислота, нижчі спирти або ефіри оцтової кислоти, з додаванням каталізаторів, таких як нікель Ренея або паладій на вугіллі, або шляхом хімічного відновлення, наприклад оловом у соляній кислоті, SnCl2 (F.D. Bellamy, Tet. Lett., 1984] або Fe в оцтовій кислоті (D.C. Owslly, JJ. Bloomfield, Synthesis, 118, 1977, стор.150). З діамінів (D) їх взаємодією з похідними карбонових кислот, такими як ортоефіри, іміноефіри, ангідриди кислот, альдегіди, або ж з вільними карбоновими кислотами при кислотному каталізі або без нього і/або в присутності або за відсутності зневоднювальних засобів можна одержати бензимідазоли (Е). Як приклад при цьому можна назвати одержання 1,2дифенілбензимідазолу з бензойної кислоти і Nфеніл-о-фенілендіаміну з застосуванням трифенілфосфіноксиду й ангідриду трифторметансульфонової кислоти [J.B. Hendrickson, M.S. Hussoin, J. Org. Chem., 52, 1987, стор.4137]. При використанні ароматичних альдегідів як розчинник застосовують, наприклад, нітробензол з метою забезпечити можливість окислення бензимідазоліну, який спочатку утворюється in situ. Циклізація до бензимідазолів можлива також у тому випадку, коли ароматичні альдегіди у вигляді бісульфітних аддуктів піддають взаємодії з діамінами (D). 2. Інший метод одержання бензимідазолів (Е) [описаний у Т.Benincori і F.Sannicolo у J.Heterocyclic Chem. 25, 1988, стор.1029], який дозволяє реалізувати найрізноманітніші схеми заміщення обома арильними замісниками, а також заміщення в бензольному кільці бензимідазолу. Для фа хівця в даній галузі очевидно, що такі замісники повинні бути сумісні з використовуваними на різних стадіях у послідовності синтезу реагентами і реакційними умовами. При необхідності замісники можна в наступному модифікувати. В одержуваному продукті в цьому випадку завжди присутня функціональна гідроксигрупа, яка знаходиться в положенні 6 бензимідазолу (див. структурну формулу F): (F) Отримані таким шляхом N-арилнітроанілінові похідні (С) можна різними методами переводити в 1,2-дизаміщені бензимідазоли (Е): 3. Наприкінці слід згадати, що в деяких випадках існує можливість прямого N-арилювання попередньо отриманих бензимідазолів, наприклад за методом, описаним в M.J. Sansone, M.S. Kwiatek у US 4933397, або за методом, [описаним в D.M.T. Chan, K.L. Monaco, R.-P. Wang, M. P. Winters у Tet. Lett. 39, 1998, стор.2933, або в А.Р. Combs, S. Saubern, M. Rafalski, P.Y.S. Lam, Tet. Lett. 40, 1999, стор.1623]. Для фа хівця в даній галузі очевидно, що замісники R повинні бути сумісні з використовуваними на різних стадіях у послідовності синтезу реагентами і реакційними 21 81243 умовами. За певних умов замісники можна в наступному модифікувати. Якщо структурний елемент В-А-О (формула І) у за хищеному або незахищеному вигляді через несумісність з реакційними умовами, які переважають у процесі синтезу відповідного бензимідазолу, або у зв'язку з іншими, зв'язаними із процесом його синтезу причинами, вбудовують лише після завершенні синтезу бензимідазолу, то залежно від присутніх замісників R3 у бензольному кільці бензимідазолу можливі різні підходи для вбудовування структурного елемента В-А-О (формула І), при цьому, як очевидно для фахівців у даній галузі, необхідно враховува ти сполучуваність використовуваних методів з арильними замісниками і конкретними залишками, значення яких має R3. Нижче розглянуті деякі можливі методи вбудовування структурного елемента В-А-О. Кисень може у вільному вигляді (наприклад R означає ОН у формулі (А)) або ж у захищеному вигляді, наприклад у вигляді алкілового ефіру [див., наприклад, B.D. Jerchel, Η. Fischer, M. Graft, Ann. Chem., 575, 1952, стор.162], початково бути присутнім як замісник в процесі синтезу бензимідазолу. Гідроксильну групу можна вивільняти шляхом відщеплення алкілового ефіру, наприклад, обробкою концентрованою бромистоводневою кислотою, за певних умов за допомогою гідротропних солюбілізаторів, таких як галогеновані вугле водні, або ж трибромідом бору в інертних розчинниках, наприклад у дихлорметані. Гідроксильну функціональну групу можна за відомими методами взаємодією з алкілгалогенідами, які необов'язково містять кінцеву гр упу В (формула І) або її попередник, перетворювати в прості ефіри, при цьому взаємодію з алкілувальними агентами переважно проводити при температурі в інтервалі від 0 до 120°С у полярних розчинниках, наприклад у диметилформаміді, диметилсульфоксиді, простих ефірах, таких як тетрагідрофуран, або ж у нижчих кетонах, таких як ацетон або метилетилкетон, з додаванням основ, таких як гідриди лужних і лужноземельних металів, переважно, однак, гідрид натрію, або з додаванням карбонатів лужних металів, таких як карбонат калію або цезію. Крім цього реакцію можна проводити в двофазній системі при міжфазному каталізі з розчиненням при цьому реагентів у прийнятному інертному органічному розчиннику, наприклад у галогеналканах, переважно, однак, у дихлорметані. Іншою фазою служить твердий гідроксид лужного металу, переважно гідроксид натрію або калію, або ж концентрований водний розчин відповідного гідроксиду. Як міжфазні каталізатори використовують, наприклад, четвертинні амонієві солі. Реакції при міжфазному каталізі переважно проводити при кімнатній температурі. Так, наприклад, в одному з можливих методів сполуку формули А (де R означає ОН) розчиняють у диметилформаміді і при додаванні карбонату цезію піддають взаємодії з метиловим ефіром 6бромгексанової кислоти при температурі в 22 інтервалі від 0 до 50°С. Розщеплювати складний ефір шляхом кислотного або основного гідролізу можна відомими фахівцям методами, наприклад у присутності основних каталізаторів, таких як карбонати або гідроксиди лужних або лужноземельних металів у воді або у водному розчині спирту. Як спирти при цьому використовуються аліфатичні спирти, наприклад метанол, етанол, бутанол і інші, переважно, однак, метанол. Крім цього можна використовувати і водні розчини простих ефірів, наприклад тетрагідрофурану. Як приклад карбонатів і гідроксидів лужних металів можна назвати літієві, натрієві і калієві солі. Переважні при цьому літієві і натрієві солі. Для застосування як карбонати і гідроксиди лужноземельних металів придатні, наприклад, карбонат кальцію, гідроксид кальцію і карбонат барію. Реакцію звичайно проводять в інтервалі температур від -10 до 70°С, переважно, однак, при 25°С. Складний ефір можна, однак, розщеплювати й у кислих умовах, наприклад у водній соляній кислоті, необов'язково за допомогою гідротропного солюбілізатора, наприклад нижчого спирту, переважно метанолу. З присутнього в алкілувальному агенті або ж утвореного в наступному нітрилу можна шляхом гідролізу утворити функціональну карбоксильну груп у. Алкілувальні агенти можуть також містити функціональні групи, такі, наприклад, як функціональна гідроксильна група, у вільному або захищеному вигляді, які після переведення в групи, які вилучаються, такі, наприклад, як тозилат, мезилат, бромід або йодид, можна замінювати, наприклад, на аміногрупу або алкільні групи. Алкілувальні агенти можуть містити і такі функціональні групи, як, наприклад, атоми галогену або необов'язково захищені аміногрупи, які у цьому випадку можна піддавати подальшій модифікації. Залежно від потрібної схеми заміщення замісники R3 можуть початково бути присутніми у використовуваних у процесі синтезу стр уктурних фрагментах або їх у міру необхідності вбудовують, відповідно утворюють із присутніх прийнятних попередників у придатний момент у процесі синтезу відповідної сполуки. Похідні формули І у вигляді вільних кислот або їх попередники у вигляді складних ефірів можна різними, відомими з літератури методами переводити в амідні похідні формули І. Похідні формули І у вигляді вільних кислот можна також з використанням прийнятних кількостей відповідних неорганічних основ при нейтралізації переводити в солі. Так, наприклад, при розчиненні відповідних кислот у воді, яка містить стехіометричні кількості основи, після випарювання води або після додавання розчинника, який змішується з водою, наприклад спирту або ацетону, можна одержати тверду сіль. Солі з амінами можна одержувати традиційними методами. Для цього відповідну кислоту розчиняють у прийнятному розчиннику, наприклад у етанолі, ацетоні, діетиловому ефірі або бензолі, і до цього розчину додають від одного до п'яти еквівалентів відповідного аміну. Сіль, яка 23 81243 утворюється при цьому, звичайно випадає в осад у твердому вигляді або її звичайним способом виділяють після випарювання розчинника. Клатрати з α-, β- або g-циклодекстрином одержують аналогічно до методу, описаного в WO 87/05294. Переважно при цьому використовувати β-циклодекстрин. Ліпосоми одержують за методом, [описаним в журналі "Pharmazie in unserer Zeit", 11, 1982, стор.98]. Нижче як приклад описане одержання деяких сполук-попередників, проміжних продуктів і кінцевих продуктів. Якщо в наступному описі одержання тих чи інших вихідних сполук не розглядається, то мається на увазі, що такі вихідні сполуки або є відомими і наявними в продажі сполуками, або їх одержують аналогічно до представлених у даному описі методів. Запропоновані у винаході сполуки одержують, наприклад, такими методами. Загальна методика 1: Відновлення нітрогруп Відновлювану сполуку розчиняють у етилацетаті, тетрагідрофурані, метанолі або етанолі або в суміші вказаних розчинників і гідрують при нормальному тиску в присутності 25% (у перерахунку на нітросполуку) паладію на вугіллі (10%-ного). Після завершенні процесу поглинання водню суміш піддають вакуумфільтрації, залишок промивають етилацетатом, метанолом або етанолом і фільтрат концентрують у вакуумі. Отриманий сирий продукт, як правило, без додаткового очищення використовують у наступній реакції. Загальна методика 2: Відщеплення простого ефіру за допомогою бромистоводневої кислоти 5г арилметилового ефіру змішують з 160мл 48%-ної водної НВr і протягом 1-5год. кип'ятять із зворотним холодильником. Після охолодження суміш фільтрують. Залишок розчиняють у етилацетаті і тричі екстрагують насиченим розчином гідрокарбонату натрію. Після сушіння над сульфатом натрію концентрують у вакуумі. Залишок при необхідності очищають кристалізацією або колонковою хроматографією на силікагелі. Загальна методика 3: Алкілування гідроксибензимідазольних похідних і фенольних похідних алкілгалогенідами Розчин 1,85ммоля гідроксибензимідазольного похідного в 12мл Ν,Ν-диметилформаміду змішують з 1,85ммолями карбонату цезію і 2,24ммолями алкілброміду або алкілйодиду. При використанні алкілброміду необов'язково додають 1,85ммоля йодиду натрію. Суміш перемішують протягом 12-96год., після чого зливають у воду, розчиняють у етилацетаті, органічну фазу чотири рази промивають водою, сушать над сульфатом натрію і концентрують у вакуумі. Альтернативно до такої водної переробки реакційну суміш можна змішува ти з дихлорметаном, відокремлювати фільтрацією солі, які випали в осад, і концентрувати фільтрат у вакуумі. Незалежно від вибраного методу переробки залишок очищають кристалізацією або колонковою хроматографією на силікагелі. 24 Загальна методика 4: Омилення алкілових ефірів карбонових кислот 0,77ммоля алкілового ефіру карбонової кислоти розчиняють у 5мл метанолу і 5мл тетрагідрофурану і змішують з 5мл 0,5н. водного розчину гідроксиду літію або натрію. Після перемішування протягом 2-12год. суміш практично насухо концентрують у вакуумі, нейтралізують додаванням водної соляної кислоти й екстрагують етилацетатом. Потім сушать над сульфатом натрію і концентрують у вакуумі. Залишок при необхідності очищають колонковою хроматографією на силікагелі. Загальна методика 5: Циклізація до бензимідазолів за допомогою альдегідів 1ммоль 1,2-діамінобензольного похідного розчиняють у 3мл нітробензолу. До цього розчину додають 1ммоль арил-, відповідно гетероарилальдегіду. Потім нагрівають до 150°С, витримуючи при цій температурі протягом 2-6год., а потім суміші дають охолонути. Залишок без додаткової переробки безпосередньо очищають колонковою хроматографією на силікагелі. Загальна методика 6: Переведення ефірів карбонових кислот в аміди карбонових кислот 0,36ммоля аміну розчиняють у 3мл толуолу і при охолодженні на льодяній бані змішують з 0,18мл 2-молярного розчину триметилалюмінію в толуолі, який додається по краплях. Потім змішують з розчином з 0,33ммолів метилового ефіру карбонової кислоти в 3мл толуолу і перемішують протягом 2-8год. при 95°С. Для переробки після охолодження додають воду, тричі екстрагують етилацетатом, об'єднані органічні фази промивають насиченим розчином хлориду натрію, сушать над сульфатом натрію і концентрують у вакуумі. Залишок очищають колонковою хроматографією на силікагелі. Приклад 1 6-[[1-(4-метилфеніл)-2-(3-піридиніл)-1Нбензимідазол-6-іл]окси]гексанова кислота а) 3-(4-метилфеніл)аміно-4-нітрофенол 5,4г 3-фтор-4-нітрофенолу змішували з 4,8мл 4-метиланіліну і перемішували протягом 6год. при 120°С. Після охолодження розчиняли в етилацетаті і воді і тричі екстрагували 1н. водною соляною кислотою. Об'єднані водні фази тричі екстрагували етилацетатом. Об'єднані органічні фази сушили над сульфа том натрію, концентрували у вакуумі і кристалізували залишок. MS (EI): 244 (пік молекулярного іона). б) Метиловий ефір 6-[3-(4-метилфеніл)аміно4-нітрофеніл]оксигексанової кислоти Вказану сполуку одержували взаємодією 3-(4метилфеніл)аміно-4-нітрофенолу з метиловим ефіром 6-бромгексанової кислоти відповідно до загальної методики 3. MS (EI): 372 (пік молекулярного іона). в) Метиловий ефір 6-[[4-аміно-3-((4метилфеніл)аміно)феніл]окси]гексанової кислоти Вказану сполуку одержували з метилового ефіру 6-[3-(4-метилфеніл)аміно-4нітрофеніл]оксигексанової кислоти відповідно до загальної методики 1. MS (EI): 342 (пік молекулярного іона). 25 81243 г) Метиловий ефір 6-[[1-(4-метилфеніл)-2-(3піридиніл)-1H-бензимідазол-6-іл]окси]гексанової кислоти Вказану сполуку одержували взаємодією метилового ефіру 6-[[4-аміно-3-((4метилфеніл)аміно)феніл]окси]гексанової кислоти з 3-піридилкарбальдегідом відповідно до загальної методики 5. MS (EI): 429 (пік молекулярного іона). д) 6-[[1-(4-метилфеніл)-2-(3-піридиніл)-1Нбензимідазол-6-іл]окси]гексанова кислота Вказану сполуку одержували з метилового ефіру 6-[[1-(4-метилфеніл)-2-(3-піридиніл)-1Hбензимідазол-6-іл]окси]гексанової кислоти відповідно до загальної методики 4. MS (EI): 415 (пік молекулярного іона). Приклад 2 5-[[1-(4-метилфеніл)-2-(3-піридиніл)-1Hбензимідазол-6-іл]окси]пентанова кислота а) Метиловий ефір 5-[3-(4-метилфеніл)аміно4-нітрофеніл]оксипентанової кислоти Вказану сполуку одержували взаємодією 3-(4метилфеніл)аміно-4-нітрофенолу з метиловим ефіром 5-бромпентанової кислоти відповідно до загальної методики 3. MS (EI): 358 (пік молекулярного іона). б) Метиловий е фір 5-[[4-аміно-3-((4метилфеніл)аміно)феніл]окси]пентанової кислоти Вказану сполуку одержували з метилового ефіру 5-[3-(4-метилфеніл)аміно-4нітрофеніл]оксипентанової кислоти відповідно до загальної методики 1. MS (EI): 328 (пік молекулярного іона). в) Метиловий ефір 5-[[1-(4-метилфеніл)-2-(3піридиніл)-1Н-бензимідазол-6-іл]окси]пентанової кислоти Вказану сполуку одержували взаємодією метилового ефіру 5-[[4-аміно-3-((4метилфеніл)аміно)феніл]окси]пентанової кислоти з 3-піридилкарбальдегідом відповідно до загальної методики 5. MS (EI): 415 (пік молекулярного іона). г) 5-[[1-(4-метилфеніл)-2-(3-піридиніл)-1Нбензимідазол-6-іл]окси]пентанова кислота Вказану сполуку одержували з метилового ефіру 5-[[1-(4-метилфеніл)-2-(3-піридиніл)-1Нбензимідазол-6-іл]окси]пентанової кислоти відповідно до загальної методики 4. MS (ΕΙ): 401 (пік молекулярного іона). Приклад 3 4-[[1-(4-метилфеніл)-2-(3-піридиніл)-1Нбензимідазол-6-іл]окси]масляна кислота а) Метиловий ефір 4-[3-(4-метилфеніл)аміно4-нітрофеніл]окси]масляної кислоти Вказану сполуку одержували взаємодією 3-(4метилфеніл)аміно-4-нітрофенолу з метиловим ефіром 4-броммасляної кислоти відповідно до загальної методики 3. MS (EI): 344 (пік молекулярного іона). б) Метиловий е фір 4-[[4-аміно-3-((4метилфеніл)аміно)феніл]окси]масляної кислоти Вказану сполуку одержували з метилового ефіру 4-[3-(4-метилфеніл)аміно-4нітрофеніл]оксимасляної кислоти відповідно до загальної методики 1. 26 MS (EI): 314 (пік молекулярного іона). в) Метиловий ефір 4-[[1-(4-метилфеніл)-2-(3піридиніл)-1Н-бензимідазол-6-іл]окси]масляної кислоти Вказану сполуку одержували взаємодією метилового ефіру 4-[[4-аміно-3-((4метилфеніл)аміно)феніл]окси]масляної кислоти з 3-піридилкарбальдегідом відповідно до загальної методики 5. MS (EI): 401 (пік молекулярного іона). г) 4-[[1-(4-метилфенІл)-2-(3-піридиніл)-1Нбензимідазол-6-іл]окси]масляна кислота Вказану сполуку одержували з метилового ефіру 4-[[1-(4-метилфеніл)-2-(3-піридиніл)-1Hбензимідазол-6-іл]окси]масляної кислоти відповідно до загальної методики 4. MS (EI): 387 (пік молекулярного іона). Приклад 4 6-[[1-(4-метилфеніл)-2-(4-піридиніл)-1Нбензимідазол-6-іл]окси]гексанова кислота а) Метиловий ефір 6-[[1-(4-метилфеніл)-2-(4піридиніл)-1Н-бензимідазол-6-іл]окси]гексанової кислоти Вказану сполуку одержували взаємодією метилового ефіру 6-[[4-аміно-3-((4метилфеніл)аміно)феніл]окси]гексанової кислоти з 4-піридилкарбальдегідом відповідно до загальної методики 5. MS (EI): 429 (пік молекулярного іона). б) 6-[[1-(4-метилфеніл)-2-(4-піридиніл)-1Нбензимідазол-6-іл]окси]гексанова кислота Вказану сполуку одержували з метилового ефіру 6-[[1-(4-метилфеніл)-2-(4-піридиніл)-1Hбензимідазол-6-іл]окси]гексанової кислоти відповідно до загальної методики 4. MS (EI): 415 (пік молекулярного іона). Приклад 5 6-[[1-(4-метилфеніл)-2-(3-тієніл)-1Hбензимідазол-6-іл]окси]гексанова кислота а) Метиловий ефір 6-[[1-(4-метилфеніл)-2-(3тієніл)-1Н-бензимідазол-6-іл]окси]гексанової кислоти Вказану сполуку одержували взаємодією метилового ефіру 6-[[4-аміно-3-((4метилфеніл)аміно)феніл]окси]гексанової кислоти з 3-тієнілкарбальдегідом відповідно до загальної методики 5. MS (EI): 434 (пік молекулярного іона). б) 6-[[1-(4-метилфеніл)-2-(3-тієніл)-1Нбензимідазол-6-іл]окси]гексанова кислота Вказану сполуку одержували їх метилового ефіру 6-[[1-(4-метилфеніл)-2-(3-тієніл)-1Нбеюимідазол-6-іл]окси]гексанової кислоти відповідно до загальної методики 4. MS (EI): 420 (пік молекулярного іона). Приклад 6 5-[[1-(4-метилфеніл)-2-(3-тієніл)-1Нбензимідазол-6-іл]окси]пентанова кислота а) Метиловий ефір 5-[[1-(4-метилфеніл)-2-(3тієніл)-1Н-бензимідазол-6-іл]окси]пентанової кислоти Вказану сполуку одержували взаємодією метилового ефіру 5-[[4-аміно-3-((4метилфеніл)аміно)феніл]окси]пентанової кислоти 27 81243 з 3-тієнілкарбальдегідом відповідно до загальної методики 5. MS (EI): 420 (пік молекулярного іона). б) 5-[[1-(4-метилфеніл)-2-(3-тієніл)-1Hбензимідазол-6-іл]окси]пентанова кислота Вказану сполуку одержували з метилового ефіру 5-[[1-(4-метилфеніл)-2-(3-тієніл)-1Нбензимідазол-6-іл]окси]пентанової кислоти відповідно до загальної методики 4. MS (EI): 406 (пік молекулярного іона). Приклад 7 4-[[1-(4-метилфеніл)-2-(3-тієніл)-1Нбензимідазол-6-іл]окси]масляна кислота а) Метиловий ефір 4-[[1-(4-метилфеніл)-2-(3тієніл)-1H-бензимідазол-6-іл]окси]масляної кислоти Вказану сполуку одержували взаємодією метилового ефіру 4-[[4-аміно-3-((4-метилфеніл)аміно)феніл]окси]масляної кислоти з 3тіофенкарбальдегідом відповідно до загальної методики 5. MS (EI): 406 (пік молекулярного іона). б) 4-[[1-(4-металфеніл)-2-(3-тієніл)-1Нбензимідазол-6-іл]окси]масляна кислота Вказану сполуку одержували взаємодією з метилового ефіру 4-[[1-(4-метилфеніл)-2-(3-тієніл)1H-бензимідазол-6-іл]окси]масляної кислоти відповідно до загальної методики 4. MS (EI): 392 (пік молекулярного іона). Приклад 8 5-[[1-феніл-2-(3-тієніл)-1Н-бензимідазол-6іл]окси]пентанова кислота а) 4-метокси-N2-феніл-о-фенілендіамін Вказану сполуку одержували з (5-метокси-2нітрофеніл)феніламіну [Kottenhahn і ін., J. Org. Chem., 28; 1963; стор.3114-3118; Banthorpe, Cooper, J. Chem. Soc. B, 1968, стор.605] відповідно до загальної методики 1. 1 Н-ЯМР (CDCI3): δ (у част./млн)=3,42 s (широкий) (2Н); 3,72 s (3Н); 5,33 s (широкий) (1Н); 6,56 dd (J=10, 2Гц, 1H); 6,76 d (J=10Гц, 1Н); 6,79 d (J=2Гц, 1H); 6,82-6,90 m (3H); 7,25 dd (J=8, 8Гц, 2Н). б) 6-метокси-1-феніл-2-(3-тієніл)-1Нбензимідазол Вказану сполуку одержували взаємодією 4метокси-N2-феніл-о-фенілендіаміну з тіофен-3карбальдегідом відповідно до загальної методики 5. MS (EI): 306 (пік молекулярного іона). в) 6-гідрокси-1-феніл-2-(3-тієніл)-1Hбензимідазол Вказану сполуку одержували з 6-метокси-1феніл-2-(3-тієніл)-1H-бензимідазолу відповідно до загальної методики 2. MS (EI): 292 (пік молекулярного іона). г) Метиловий ефір 5-[[1-феніл-2-(3-тієніл)-1Hбензимідазол-6-іл]окси]пентанової кислоти Вказану сполуку одержували взаємодією 6гідрокси-1-феніл-2-(3-тієніл)-1Н-бензимідазолу з метиловим ефіром 5-бромпентанової кислоти відповідно до загальної методики 3. MS (EI): 406 (пік молекулярного іона). д) 5-[[1-феніл-2-(3-тієніл)-1Н-бензимідазол-6іл]окси]пентанова кислота 28 Вказану сполуку одержували з метилового ефіру 5-[[1-феніл-2-(3-тієніл)-1Н-бензимідазол-6іл]окси]пентанової кислоти відповідно до загальної методики 4. MS (EI): 392 (пік молекулярного іона). Приклад 9 4-[[1-феніл-2-(3-тієніл)-1H-бензимідазол-6іл]окси]масляна кислота а) Метиловий ефір 4-[[1-феніл-2-(3-тієніл)-1Нбензимідазол-6-іл]окси]масляної кислоти Вказану сполуку одержували взаємодією 6гідрокси-1-феніл-2-(3-тієніл)-1H-бензимідазолу з метиловим ефіром 4-броммасляної кислоти відповідно до загальної методики 3. MS (EI): 392 (пік молекулярного іона). б) 4-[[1-феніл-2-(3-тієніл)-1Н-бензимідазол-6іл]окси]масляна кислота Вказану сполуку одержували з метилового ефіру 4-[[1-феніл-2-(3-тієніл)-1Н-бензимідазол-6іл]окси]масляної кислоти відповідно до загальної методики 4. MS (EI): 378 (пік молекулярного іона). Приклад 10 6-[[1-феніл-2-(3-тієніл)-1Н-бензимідазол-6іл]окси]гексанова кислота а) Метиловий ефір 6-[[1-феніл-2-(3-тієніл)-1Нбензимідазол-6-іл]окси]гексанової кислоти Вказану сполуку одержували взаємодією 6гідрокси-1-феніл-2-(3-тієніл)-1Н-бензимідазолу з метиловим ефіром 6-бромгексанової кислоти відповідно до загальної методики 3. MS (EI): 420 (пік молекулярного іона). б) 6-[[1-феніл-2-(3-тієніл)-1Н-бензимідазол-6іл]окси]гексанова кислота Вказану сполуку одержували з метилового ефіру 6-[[1-феніл-2-(3-тієніл)-1H-бензимідазол-6іл]окси]гексанової кислоти відповідно до загальної методики 4. MS (EI): 406 (пік молекулярного іона). Приклад 11 6-[[1-(4-фторфеніл)-2-(3-тієніл)-1Нбензимідазол-6-іл]окси]гексанова кислота а) (5-хлор-2-нітрофеніл)-(4-фторфеніл)амін 50г 1-хлор-3,4-динітробензолу в 250мл етанолу змішували з 50мл 4-фтораніліну і перемішували протягом 35год. при 60°С. Після концентрування до половини об'єму суміш розподіляли між водою і дихлорметаном. Після промивання органічної фази 1н. водною соляною кислотою її сушили над сульфатом натрію, фільтрували і концентрували. Після хроматографії залишку на силікагелі одержали 62,33г (5-хлор-2нітрофеніл)-(4-фторфеніл)аміну. 1 H-ЯМР (CDCI3): δ=6,71 dd (J=9, 2Гц, 1Н); 6,97 d (J=2Гц, 1Н); 7,13 dd (J=9, 9Гц, 2Н); 7,22 dd (J=9, 6Гц, 2Н); 8,15 d (J=10Гц, 1Н); 9,45 s (шир.) (1Н). б) (5-метокси-2-нітрофенш)-(4-фторфеніл)амін До розчину 6,6г натрію в 450мл метанолу додавали 36,44г (5-хлор-2-нітрофеніл)-(4фтор феніл)аміну і реакційну суміш протягом 16год. кип'ятили зі зворотним холодильником. Після перемішування протягом наступних 30год. при 60°С реакційну суміш охолоджували і кристалічний продукт відокремлювали вакуум 29 81243 фільтрацією. Таким шляхом одержали 34г (5метокси-2-нітрофеніл)-(4-фторфеніл)аміну. 1 Н-ЯМР (CDCI3): δ=3,72 s (3Н); 6,44 dd (J=9, 2Гц, 1H); 6,48 d (J=2Гц, 1H); 7,13 dd (J=9, 9Гц, 2Н); 7,27 dd (9, 6Гц, 2Н); 8,20 d (J=9Гц, 1H); 9,65 s (шир.) (1H). в) ^-(4-фтор феніл)-4-метоксибензол-1,2-діамін 33,5г (0,128мл) (5-метокси-2-нітрофеніл)-(4фтор феніл)аміну піддавали хімічному перетворенню відповідно до загальної методики 1. Сирий продукт без очищення використовували в наступній реакції. 1 Н-ЯМР (CDCI3): δ (у част./млн)=3,70 s (3Н); 6,49 d (шир.) (J=9Гц, 1Н); 6,68 d (J=2Гц, 1H); 6,786,97 m (5H). г) 6-метокси-1-(4-фторфеніл)-2-(3-тієніл)-1Нбензимідазол 7,48г тіофен-3-альдегіду протягом двох годин перемішували в 65мл 40%-ного розчину NaHSO3. Після додавання 15г N2-(4-фторфеніл)-4метоксибензол-1,2-діаміну в 50мл етанолу суміш кип'ятили протягом 4год. і потім перемішували протягом ночі. Потім суміш розподіляли між водою і етилацетатом і органічну фазу промивали водою. Після сушіння над сульфатом натрію і концентрування фільтрату одержали 18,1г сирого 6-метокси-1-(4-фторфеніл)-2-(3-тієніл)-1Нбензимідазолу. tпл 154-158°C. д) 6-гідрокси-1-(4-фторфеніл)-2-(3-тієніл)-1Hбензимідазол 18г (55,5ммоля) 6-метокси-1-(4-фторфеніл)-2(3-тієніл)-1Н-бензимідазолу піддавали хімічному перетворенню аналогічно до загальної методики 2. У результаті одержали 12,65г (40ммолів) сирого 6гідрокси-1-(4-фторфеніл)-2-(3-тієніл)-1Нбензимідазолу. tпл 212-218°C. е) Метиловий ефір 6-[[1-(4-фторфеніл)-2-(3тієніл)-1Н-бензимідазол-6-іл]окси]гексанової кислоти Вказану сполуку одержували взаємодією 6гідрокси-1-(4-фторфеніл)-2-(3-тієніл)-1Нбензимідазолу з метиловим ефіром 6бромгексанової кислоти відповідно до загальної методики 3. tпл 131-134°C. є) 6-[[1-(4-фторфеніл)-2-(3-тієніл)-1Нбензимідазол-6-іл]окси]гексанова кислота Вказану сполуку одержували з метилового ефіру 6-[[1-(4-фторфеніл)-2-(3-тієніл)-1Нбензимідазол-6-іл]окси]гексанової кислоти відповідно до загальної методики 4. tпл 170-175°С. Приклад 12 5-[[1-(4-фторфеніл)-2-(3-тієніл)-1Нбензимідазол-6-іл]окси]пентанова кислота а) Метиловий ефір 5-[[1-(4-фторфеніл-2-(3тієніл)-1Н-бензимідазол-6-іл]окси]пентанової кислоти Вказану сполуку одержували взаємодією 6гідрокси-1-(4-фторфеніл)-2-(3-тієніл)-1Hбензимідазолу з метиловим ефіром 5бромпентанової кислоти відповідно до загальної методики 3. 30 tпл 90,5-92,5°С. б) 5-[[1-(4-фторфеніл)-2-(3-тієніл)-1Нбензимідазол-6-іл]окси]пентанова кислота Вказану сполуку одержували з метилового ефіру 5-[[1-(4-фторфеніл-2-(3-тієніл)-1Нбензимідазол-6-іл]окси]пентанової кислоти відповідно до загальної методики 4. tпл 184-189°С. Приклад 13 6-[[1-(4-фторфеніл)-2-(3-піридиніл)-1Нбензимідазол-6-іл]окси]гексанова кислота а) 6-метокси-1-(4-фторфеніл)-2-(3-піридиніл)1Н-бензимідазол Вказану сполуку одержували взаємодією N-(4фтор феніл)-4-метоксибензол-1,2-діаміну з піридин-3-карбальдегідом аналогічно до прикладу 11г. tпл 132,5-134°C. б) 6-гідрокси-1-(4-фторфеніл)-2-(3-піридиніл)1Н-бензимідазол Вказану сполуку одержували з 6-метокси-1-(4фтор феніл)-2-(3-піридиніл)-1Н-бензимідазолу відповідно до загальної методики 2. в) Метиловий ефір 6-[[1-(4-фторфеніл)-2-(3піридиніл)-1Н-бензимідазол-6-іл]окси]гексанової кислоти Вказану сполуку одержували взаємодією 6гідрокси-1-(4-фторфеніл)-2-(3-піридиніл)-1Hбензимідазолу з метиловим ефіром 6бромгексанової кислоти відповідно до загальної методики 3. tпл 105,5-111,5°С. г) 6-[[1-(4-фторфеніл)-2-(3-піридиніл)-1Нбензимідазол-6-іл]окси]гексанова кислота Вказану сполуку одержували з метилового ефіру 6-[[1-(4-фторфеніл)-2-(3-піридиніл)-1Hбензимідазол-6-іл]окси]гексанової кислоти відповідно до загальної методики 4. tпл 127,5-129°С. Приклад 14 5-[[1-(4-фторфеніл)-2-(3-піридиніл)-1Нбензимідазол-6-іл]окси]пентанова кислота а) Метиловий ефір 5-[[1-(4-фторфеніл)-2-(3піридиніл)-1Н-бензимідазол-6-іл]окси]пентанової кислоти Вказану сполуку одержували взаємодією 6гідрокси-1-(4-фторфеніл)-2-(3-піридиніл)-1Нбензимідазолу з метиловим ефіром 5бромпентанової кислоти відповідно до загальної методики 3. tпл 52-55°С. б) 5-[[1-(4-фторфеніл)-2-(3-піридиніл)-1Нбензимідазол-6-іл]окси]пентанова кислота Вказану сполуку одержували з метилового ефіру 5-[[1-(4-фторфеніл)-2-(3-піридиніл)-1Нбензимідазол-6-іл]окси]пентанової кислоти відповідно до загальної методики 4. tпл 181,5-183°C. Приклад 15 5-[[1-феніл-2-(3-піридиніл)-1Н-бензимідазол-6іл]окси]пентанова кислота а) 6-метокси-1-феніл-2-(3-піридиніл)-1Нбензимідазол Вказану сполуку одержували взаємодією 4метокси-N2-феніл-о-фенілендіаміну з піридин-3 31 81243 карбальдегідом відповідно до загальної методики 5. MS (ΕΙ): 301 (пік молекулярного іона). б) 6-гідрокси-1-феніл-2-(3-піридиніл)-1Нбензимідазол Вказану сполуку одержували з 6-метокси-1феніл-2-(3-піридиніл)-1Н-бензимідазолу відповідно до загальної методики 2. 1 Н-ЯМР (D6-ДМСО): δ (у част./млн)=6,52 d (J=2Гц, 1H); 6,81 dd (J=8, 2Гц, 1Н); 7,34-7,48 m (3Н); 7,53- 7,68 m (4H); 7,80 (ddd, J=8, 2, 1Гц, 1Н); 8,53 dd (J=2, 1Гц, 1H); 8,67 d (J=1Гц, 1H); 9,42 (s, 1H). в) Ме тиловий ефір 5-[[1-феніл-2-(3-піридиніл)1H-бензимідазол-6-іл]окси]пентанової кислоти Вказану сполуку одержували взаємодією 6гідрокси-1-феніл-2-(3-піридиніл)-1H-бензимідазолу з метиловим ефіром 5-бромпентанової кислоти відповідно до загальної методики 3. MS (EI): 401 (пік молекулярного іона). г) 5-[[1-феніл-2-(3-піридиніл)-1Н-бензимідазол6-іл]окси]пентанова кислота Вказану сполуку одержували з метилового ефіру 5-[[1-феніл-2-(3-піридиніл)-1Н-бензимідазол6-іл]окси]пентанової кислоти відповідно до загальної методики 4. 1 H-ЯМР (CD3OD): δ (у част./млн)=1,72-1,88 m (4H); 2,30 t (J=8Гц, 2Н); 3,98 t (J=8Гц, 2Н); 6,72 d (J=2Гц, 1Н); 7,03 dd (J=8, 2Гц, 1Н); 7,40-7,48 m (3H); 7,55-7,65 m (3H); 7,70 (d, J=8Гц, 1Н); 7,92 ddd (J=8, 2, 1Гц, 1H); 8,53 dd (J=8, 2Гц, 1Н); 8,70 dd (J=2, 1Гц, 1Н). Приклад 16 4-[[1-феніл-2-(3-піридиніл)-1Н-бензимідазол-6іл]окси]масляна кислота а) Метиловий ефір 4-[[1-феніл-2-(3-піридиніл)1Н-бензимідазол-6-іл]окси]масляної кислоти Вказану сполуку одержували взаємодією 6гідрокси-1-феніл-2-(3-піридиніл)-1H-бензимідазолу з метиловим ефіром 4-броммасляної кислоти відповідно до загальної методики 3. MS (EI): 387 (пік молекулярного іона). б) 4-[[1-феніл-2-(3-піридиніл)-1H-бензимідазол6-іл]окси]масляна кислота Вказану сполуку одержували з метилового ефіру 4-[[1-феніл-2-(3-піридиніл)-1Н-бензимідазол6-іл]окси]масляної кислоти відповідно до загальної методики 4. MS (EI): 373 (пік молекулярного іона). Приклад 17 6-[[1-феніл-2-(3-піридиніл)-1Н-бензимідазол-6іл]окси]гексанова кислота а) Метиловий ефір 6-[[1-феніл-2-(3-піридиніл)1Н-бензимідазол-6-іл]окси]гексанової кислоти Вказану сполуку одержували взаємодією 6гідрокси-1-феніл-2-(3-піридиніл)-1H-бензимідазолу з метиловим ефіром 6-бромгексанової кислоти відповідно до загальної методики 3. MS (EI): 415 (пік молекулярного іона). б) 6-[[1-фетл-2-(3-піридиніл)-1H-бензимідазол6-іл]oкси]гексанова кислота Вказану сполуку одержували з метилового ефіру 6-[[1-феніл-2-(3піридиніл)-1H-бензимідазол-6-іл]окси]гексанової кислоти відповідно до загальної методики 4. MS (EI): 401 (пік молекулярного іона). 32 Приклад 18 N-(3-метоксипропіл)-6-[[1-(4-метилфеніл)-2-(3піридиніл)-1Н-бензимідазол-6-іл]окси]гексанамід Вказану сполуку одержували взаємодією метилового ефіру 6-[[1-(4-метилфеніл)-2-(3піридиніл)-1H-бензимідазол-6-іл]окси]гексанової кислоти з 3-метоксипропіламіном відповідно до загальної методики 6. MS (EI): 486 (пік молекулярного іона). Приклад 19 6-[[1-(4-метилфеніл)-2-(3-піридиніл)-1Нбензимідазол-6-іл]окси]-1-морфолін-1-ілгексан-1он Вказану сполуку одержували взаємодією метилового ефіру 6-[[1-(4-метилфеніл)-2-(3піридиніл)-1Н-бензимідазол-6-іл]окси]гексанової кислоти з морфоліном відповідно до загальної методики 6. MS (EI): 442 (пік молекулярного іона). Приклад 20 N-метил-6-[[1-(4-метилфеніл)-2-(3-піридиніл)1Н-бензимідазол-6-іл]окси]гексанамід Вказану сполуку одержували взаємодією метилового ефіру 6-[[1-(4-метилфеніл)-2-(3піридиніл)-1Н-бензимідазол-6-іл]окси]гексанової кислоти з гідрохлоридом N-метиламіну відповідно до загальної методики 6. MS (EI): 428 (пік молекулярного іона). Приклад 21 N,N-диметил-6-[[1-(4-метилфеніл)-2-(3піридиніл)-1Н-бензимідазол-6-іл]окси]гексанамід Вказану сполуку одержували взаємодією метилового ефіру 6-[[1-(4-метилфеніл)-2-(3піридиніл)-1Н-бензимідазол-6-іл]окси]гексанової кислоти з гідрохлоридом диметиламіну відповідно до загальної методики 6. MS (EI): 442 (пік молекулярного іона). Приклад 22 6-[[1-(4-метилфеніл)-2-(3-піридиніл)-1Hбензимідазол-6-іл]окси]гексанамід Вказану сполуку одержували взаємодією метилового ефіру 6-[[1-(4-метилфеніл)-2-(3піридиніл)-1H-бензимідазол-6-іл]окси]гексанової кислоти з хлоридом амонію відповідно до загальної методики 6. MS (EI): 414 (пік молекулярного іона). Приклад 23 N-циклопропіл-6-[[1-(4-метилфеніл)-2-(-3тієніл)-1H-бензимідазол-6-іл]окси]гексанамід Вказану сполуку одержували взаємодією метилового ефіру 6-[[1-(4-метилфеніл)-2-(3-тієніл)1Н-бензимідазол-6-іл]окси]гексанової кислоти з циклопропіламіном відповідно до загальної методики 6. MS (EI): 459 (пік молекулярного іона). Приклад 24 N-метил-6-[[1-(4-метилфеніл)-2-(-3-тієніл)-1Нбензимідазол-6-іл]окси]гексанамід Вказану сполуку одержували взаємодією метилового ефіру 6-[[1-(4-метилфеніл)-2-(3-тієніл)1Н-бензимідазол-6-іл]окси]гексанової кислоти з гідрохлоридом N-метиламіну відповідно до загальної методики 6. MS (EI): 433 (пік молекулярного іона). Приклад 25 33 81243 N-(2-метоксіетил)-5-[[1-(4-метилфеніл)-2-(3піридиніл)-1Н-бензимідазол-6-іл]окси]пентанамід Вказану сполуку одержували взаємодією метилового ефіру 5-[[1-(4-метилфеніл)-2-(3піридиніл)-1Н-бензимідазол-6-іл]окси]пентанової кислоти з 2-метоксіетиламіном відповідно до загальної методики 6. MS (EI): 458 (пік молекулярного іона). Приклад 26 N,N-диметил-5-[[1-(4-метилфеніл)-2-(3піридиніл)-1Н-бензимідазол-6-іл]окси]пентанамід Вказану сполуку одержували взаємодією метилового ефіру 5-[[1-(4-метилфеніл)-2-(3піридиніл)-1Н-бензимідазол-6-іл]окси]пентанової кислоти (приклад 56в) з диметиламіном відповідно до загальної методики 6. MS (EI): 428 (пік молекулярного іона). Приклад 27 5-[[1-(4-метилфеніл)-2-(3-піридиніл)-1Нбензимідазол-6-іл]окси]пентанамід Вказану сполуку одержували взаємодією метилового ефіру 5-[[1-(4-метилфеніл)-2-(3піридиніл)-1Н-бензимідазол-6-іл]окси]пентанової кислоти з хлоридом амонію відповідно до загальної методики 6. MS (EI): 400 (пік молекулярного іона). Приклад 28 6-[[1-(4-метилфеніл)-2-(2-тієніл)-1Нбензимідазол-6-іл]окси]гексанова кислота а) Метиловий ефір 6-[[1-(4-метилфеніл)-2-(2тієніл)-1H-бензимідазол-6-іл]окси]гексанової кислоти Вказану сполуку одержували взаємодією метилового ефіру 6-[[4-аміно-3-((4метилфеніл)аміно)феніл]окси]гексанової кислоти з 2-тієнілкарбальдегідом відповідно до загальної методики 5. MS (EI): 434 (пік молекулярного іона). б) 6-[[1-(4-метилфеніл)-2-(2-тієніл)-1Нбензимідазол-6-іл]окси]гексанова кислота Вказану сполуку одержували з метилового ефіру 6-[[1-(4-метилфеніл)-2-(2-тієніл)-1Hбензимідазол-6-іл]окси]гексанової кислоти відповідно до загальної методики 4. MS (EI): 420 (пік молекулярного іона). Приклад 29: Інгібування активації мікроглії Для одержання активованої Αβ-пептидом мікроглії in vitro первинні клітини мікроглії (гліальні макрофаги) щурів інкубували із синтетичним Αβпептидом. Для імітації відкладень Αβ-пептиду синтетичний Αβ-пептид висушували на 96лунковому планшеті для вирощування культур тканини. З цією метою маточний розчин пептиду з його концентрацією 2мг/мл Н 2О розбавляли Н2О у пропорції 1:50. Для покриття 96-лункових планшетів використовували по 30мкл цього розведеного розчину пептиду з розрахунку на одну лунку і залишали на ніч для висихання при кімнатній температурі. Первинні клітини мікроглії щурів виділяли із змішаних культур гліальних клітин, отриманих з головного мозку щурів РЗ. Для одержання змішаних культур гліальних клітин у 3-денних щурів виділяли головний мозок і видаляли мозкову 34 оболонку. Розділення клітин на окремі клітини здійснювали шляхом обробки трипсином (0,25%ний розчин трипсину, 15хв. при 37°С). Після відділення фрагментів тканини, які не розклалися, за допомогою найлонової сітки з розміром комірок 40мкм виділені клітини відокремлювали центрифугуванням (800об./хв. протягом 10хв.). Клітинний дебрис ресуспендували в культуральному середовищі і переносили в 100мілілітрові чашки для вирощування культур тканини (1 головний мозок на одну чашку). Клітини культивували при 37°С і 5% СО2 протягом 5-7 днів у середовищі D MEM (середовище Ігла, модифіковане за способом Дульбекко, із глутаміном), доповненому пеніциліном (50од./мл), стрептоміцином (40мкг/мл) і 10об.% фетальної телячої сироватки (ФТС). Під час цієї інкубації утворювався адгезивний клітинний покрив, який складався в основному з астроцитів. Гліальні макрофаги, які проліферували на цьому покриві у вигляді не- або слабоадгезивних клітин, збирали шляхом інкубації на шейкері (420об./хв. протягом 1год.). Для активації мікроглії Αβ-пептидом гліальні макрофаги висівали на покриті Αβ-пептидом планшети для вирощування культур тканини в кількості 2,5´104 клітин на лунку і інкубували при 37°С і 5% СО2 протягом 7 днів у середовищі DMEM (із глутаміном), доповненому пеніциліном (50од./мл), стрептоміцином (40мкг/мл) і 10об.% ФТС. На 5-ий день додавали одну з запропонованих у винаході сполук у різних концентраціях (0,1, 0,3, 1,3 і 10мкМ). Для кількісної оцінки реакційної здатності мікроглії на 7-й день культивування визначали метаболічну активність за ступенем відновлення МТС [3-(4,5-диметилтіазол-2-іл)-5-(3карбоксиметоксифеніл)-2-(сульфофеніл)-2Нтетразолій, реактив Оуена, J.A. Baltrop і ін., Bioorg. & Med. Chem. Lett. 1, 1991, стор.6111]. Дані про ступінь інгібування виражали у відсотках по відношенню до контролю, обробленому тільки ДМСО. Результати цього досліду свідчать про те, що запропоновані у винаході сполуки інгібують активацію мікроглії. Приклад 30: Інфаркт головного мозку в щурів (МС АО-модель) Активність запропонованих у винаході сполук in vivo досліджували моделюванням мозкової ішемії (апоплексії) на тваринах, тобто з використанням так званої МСАО-моделі (від англ. "permanent middle cerebral artery occlusion", постійна оклюзія середньої мозкової артерії). При використанні подібної моделі однобічна закупорка середньої мозкової артерії (МСА) ініціює інфаркт головного мозку, зумовлений недостатнім постачанням відповідної ділянки або відділу головного мозку киснем і живильними речовинами. Таке недостатнє постачання киснем і живильними речовинами приводить до яскраво вираженої загибелі клітин, а також до наступної інтенсивної активації мікроглії. Однак подібна активація мікроглії досягає максимального ступеня лише через декілька днів і може зберігатися протягом декількох тижнів. Запропоновані у винаході сполуки для дослідження їх ефективності 35 81243 інгібувати активацію мікроглії вводили внутрішньоочеревинно через 1-6 днів після оклюзії середньої мозкової артерії. На 7-й день тварин піддавали перфузії й умертвляли. Ступінь активації мікроглії визначали модифікованим імуногістохімічним методом. З цією метою отримані за допомогою мікротома тину Vibratom зрізи зафіксованого головного мозку інкубували з антитілами, які розпізнають рецептор CR3 для комплементу, відповідно комплекс МНС II на активованій мікроглії. Зв'язування первинних антитіл кількісно оцінювали за допомогою детекторної системи для імуноферментного аналізу. У цьому досліді обробка запропонованими у винаході сполуками приводила до зниження активації мікроглії в ураженій інфарктом півкулі головного мозку. Приклад 31: Інгібуюча дія на продукування TNFα і IL-12 у клітинах ТНР-1 Інгібуючу дію запропонованих у винаході сполук на продукування цитокінів можна досліджувати, наприклад, визначенням кількості TNFα і інтерлейкіну 12 у стимульованих ліпополісахаридом (ЛПС) клітинах ТНР-1. З цією метою клітини ТНР-1 (отримані з Американської колекції типових культур (American Type Culture Company, Роквіль, шт. Меріленд)) у кількості 2,5´106 клітин з розрахунку на мл середовища RPMI 1640 (фірма Life Technologies), доповнене 10% ФТС (Life Technologies, кат. №10270-106), висівали на 96-лункові плоскодонні культуральні планшети (фірма ТРР, продукт №9296) (у кількості 100мкл на лунку). Потім до клітин додавали запропоновані у винаході сполуки в різних концентраціях і попередньо інкубували протягом 30хв. Тестовані речовини попередньо розводили в інкубаційному середовищі. Тестовані речовини додавали у вигляді їх розчину подвійної концентрації (у кількості 100мкл на лунку). Клітини стимулювали протягом ночі при 37°С ліпополісахаридом (фірма Sigma, кат. №L2630, із серотипу Е. Coli 0111.B4), який використовували в кількості 0,1мкг/мл. Після цього середовище збирали і кількісно оцінювали вміст у ньому TNFα, відповідно інтерлейкіну 12. Вміст TNFα визначали з використанням наявного в продажі набору для визначення TNFα фірми CIS bio international (продукт №62TNFPEB). Вміст інтерлейкіну 12 визначали за допомогою технології "ORIGEN" (розробленої фірмою IGEN International, Inc., Гайзерсбург, шт. Меріленд). Розраховане значення ІС50 відповідає тій концентрації тестованої речовини, яка необхідна для інгібування рівня продукування TNFα, відповідно інтерлейкіну 12 на 50% від максимального рівня їх продукування. За результатами цього експерименту було встановлено, що запропоновані у винаході сполуки інгібують продукування TNFα і інтерлейкіну 12 у стимульованих ліпополісахаридом (ЛПС) клітинах ТНР-1. Приклад 32: Інгібуюча дія на продукування IFNg периферичними одноядерними клітинами крові 36 Вплив запропонованих у винаході сполук на активацію Т-клітин можна досліджувати, наприклад, аналізом секреції IFNg. Для виділення периферичних одноядерних клітин крові використовували людську цільну кров (для відбору крові використовували систему SMonovette "Coagulation 9 NC/10ml" з цитратом натрію, фірма Sarstedt). Клітини крові збагачували шляхом центрифугування з градієнтом густини. З цією метою в пробірки LEUCOSEP (фірма Greiner, кат. №227290) попередньо вносили по 15мл Histopaque-1077 (фірма Sigma, кат. №Н8880) і центрифугували протягом 30с при 1000g. Після цього додавали по 15мл цільної крові і центрифугували протягом 10хв. при 1000g. Потім верхній шар плазми видаляли за допомогою піпетки, а розташований під ним шар клітин (периферичні одноядерні клітини крові) переносили в 15-мілілітрові пробірки (фірма Falcon) і декілька разів промивали 10мл збалансованого сольового розчину Хенкса (без Mg2+ і Са2+, кат. №14175-53). На завершення клітинний дебрис ресуспендували в культуральному середовищі RPMI 1640, доповнененому 25мМ Hepes (2-Nгідроксіеталпіперазин-N'-2гідроксипропансульфонова кислота, фірма Life Technologies, кат. №52400-041), 10% ФТС (фірма Life Technologies, кат. №10270-106) і 0,4% розчину пеніциліну і стрептоміцину (фірма Life Technologies, кат. №15140-106) (1´106клітин/мл). По 100мкл суспензії клітин розподіляли по 96лунковим плоскодонним культуральним планшетах (фірма ТРР, продукт №9296) і стимулювали антитілами до CD3, які використовували в концентрації 2,5мкг/мл. Потім додавали запропоновані у винаході сполуки в різних концентраціях і попередньо інкубували протягом 30хв. Клітини стимулювали протягом 24год. Після цього середовище збирали і кількісно оцінювали вміст у ньому IFNg. Вміст IFNg визначали за допомогою технології "ORIGEN" (розробленою фірмою IGEN International, Inc., Гайзерсбург, шт. Меріленд). Розраховане значення ІС50 відповідає тій концентрації тестованої речовини, яка необхідна для інгібування рівня продукування IFNg на 50% від максимального рівня його продукування. За результатами цього експерименту було встановлено, що запропоновані у винаході сполуки інгібують продукування IFNg периферичними одноядерними клітинами крові. Приклад 33: Інгібуюча дія на продукування TNFα і IL-12HD периферичними одноядерними клітинами крові Інгібуючу дію запропонованих у винаході сполук на продукування TNFα і IL-12 HD р70 можна досліджувати, наприклад, визначенням кількості TNFα і IL-12 HD р70 у стимульованих ліпополісахаридом (ЛПС) і g-інтерфероном (IFNg) периферичних одноядерних клітинах крові. Для виділення периферичних одноядерних клітин крові використовували людську цільну кров (для відбору крові використовували систему SMonovette "Coagulation 9 NC/10ml" з цитратом 37 81243 натрію, фірма Sarstedt). Лімфоцити і моноцити збагачували шля хом центрифугування з градієнтом густини. З цією метою в 50-мілілітрові пробірки LEUCOSEP (фірма Greiner, кат. №227290) попередньо вносили по 15мл Histopaque-1077 (фірма Sigma, кат. №Н8880) і центрифугуванням протягом 30с при 250g витісняли вниз через фриту, яка знаходиться в пробірках. Після цього додавали 20мл цільної крові і центрифугували протягом 15хв. при 800g і кімнатній температурі. Після центрифугування надосадову рідину (плазму і тромбоцити) видаляли за допомогою піпетки і відкидали, а розташований під нею шар клітин (лімфоцити і моноцити) переносили в 50-мілілітрові центрифужні пробірки (фірма Falcon) і потім тричі промивали в культуральному середовищі VLE RPMI 1640 (фірма Seromed, №FG1415) (центрифугування циклами по 10хв. при 250g і кімнатній температурі). На завершення клітинний дебрис ресуспендували в культуральному середовищі VLE RPMI 1640 (фірма Seromed, №FG1415), доповненому 10% ФТС (фірма Life Technologies, кат. №16000-044, з низьким вмістом ендотоксину, інактивоване нагріванням протягом 1год. при 56°С) і розчином пеніциліну і стрептоміцину в концентрації 50мкг/мл (фірма Life Technologies, кат. №15140-106), і після підрахунку клітин за допомогою фарбування трипановим синім їх концентрацію доводили до 3´106клітин на мл. Потім по 100мкл суспензії клітин розподіляли по 96-лунковим плоскодонним культуральним планшетах (фірма Costar, продукт №3599). Після цього до клітин, які знаходяться на планшетах, додавали по 100мкл розчину для стимуляції потрійної концентрації (3 ЛПС/мл ЛПС із серотину Е. соlі 0127:В8, фірма Sigma, кат. №L-4516, і 30нг/мл ΓΡΝg lb, Imukin, фірма Boehringer Ingelheim). Після цього додавали запропоновані у винаході сполуки в різних концентраціях у вигляді їх розчину потрійної концентрації (100мкл на лунку). Клітини стимулювали при 37°С і 5% СО2 протягом 24год. Потім збирали надосадову рідину культури клітин і за допомогою комерційно доступних наборів для ELISA-аналізу фірм BioSource International (TNF-α EASIA, кат. №КАС1752) і R&D Systems (Quantikine™ HS IL-12, кат. №HS 120) визначали концентрацію в ній TNFα і IL-12 HD р70. Розраховане значення ІС 50 відповідає тій концентрації тестованої речовини, яка необхідна для інгібування рівня продукування TNFα, відповідно інтерлейкіну 12 HD р70 на 50% від максимального рівня їх продукування. За результатами цього експерименту було встановлено, що запропоновані у винаході сполуки інгібують продукування TNFα і IL-12 HD p70 периферичними одноядерними клітинами крові. Приклад 34: Індукція продукування IL-10 периферичними одноядерними клітинами крові Здатність запропонованих у винаході сполук індукувати продукування IL-10 можна досліджувати, наприклад, визначенням кількості IL-10 у стимульованих фітогемаглютиніном (ФГА) 38 або ліпополісахаридом (ЛПС) периферичних одноядерних клітинах крові. Для виділення периферичних одноядерних клітин крові використовували людську цільну кров (для відбору крові використовували систему SMonovette "Coagulation 9 NC/10ml" з цитратом натрію, фірма Sarstedt). Лімфоцити і моноцити збагачували шля хом центрифугування з градієнтом густини. З цією метою в 50-мілілітрові пробірки LEUCOSEP (фірма Greiner, кат. №227290) попередньо вносили по 15мл Histopaque-1077 (фірма Sigma, кат. №Н8880) і центрифугуванням протягом 30с при 250g витісняли вниз через фриту, яка знаходиться в пробірках. Після цього додавали 20мл цільної крові і центрифугували протягом 15хв. при 800g і кімнатній температурі. Після центрифугування надосадову рідину (плазму і тромбоцити) видаляли за допомогою піпетки і відкидали, а розташований під нею шар клітин (лімфоцити і моноцити) переносили в 50-мілілітрові центрифужні пробірки (фірма Falcon) і потім тричі промивали в культуральному середовищі VLE RPMI 1640 (фірма Seromed, №FG1415) (центрифугування циклами по 10хв. при 250g і кімнатній температурі). На завершення клітинний дебрис ресуспендували в культуральному середовищі VLE RPMI 1640 (фірма Seromed, №FG1415), доповненому 10% ФТС (фірма Life Technologies, кат. №16000-044, з низьким вмістом ендотоксину, інактивоване нагріванням протягом 1год. при 56°С) і розчином пеніциліну і стрептоміцину в концентрації 50мкг/мл (фірма Life Technologies, кат. №15140-106), і після підрахунку клітин за допомогою фарбування трипановим синім їх концентрацію доводили до 3´106клітин на мл. Потім по 100мкл суспензії клітин розподіляли по 96-лунковим плоскодонним культуральним планшетам (фірма Costar, продукт №3599). Після цього до клітин, які знаходяться на планшетах, додавали по 100мкл розчину для стимуляції потрійної концентрації (3 ЛПС/мл ЛПС із серотипу Е. соlі 0127:В8, фірма Sigma, кат. №L-4516, відповідно 300мкг/мл фітогемаглютиніну PHA-L, фірма Biochrom KG, кат. №М5030). Після цього додавали запропоновані у винаході сполуки в різних концентраціях у вигляді їх розчину потрійної концентрації (100мкл на лунку). Клітини стимулювали при 37°С і 5% СО2 протягом 24год. Потім збирали надосадову рідину культури клітин і кількісно оцінювали вміст у ній IL-10. Концентрацію IL-10 визначали за допомогою комерційно доступного набору для ELISA-аналізу фірми BioSource International (Human IL-10, кат. №KHC0101C). Розраховане значення ЕС 50 відповідає тій концентрації тестованої речовини, яка необхідна для підвищення рівня секреції IL-10 на 50% від максимального ступеня збільшення їх секреції. За результатами цього експерименту було встановлено, що запропоновані у винаході сполуки підвищують продукування IL-10 периферичними одноядерними клітинами крові.
ДивитисяДодаткова інформація
Назва патенту англійською1-phenyl-2-heteroaryl-substituted benzimidazole derivatives, the use thereof for producing drugs, pharmaceutical preparation containing such derivatives
Автори англійськоюBlume Thorsten, Halfbrodt Wolfgang, Kuhnke Joachim, Moenning Ursula, Elger Bernd, Schneider Herbert
Назва патенту російською1-фенил-2-гетероарилзамещенные производные бензимидазола, их применение для получения лекарственных средств, фармацевтическое средство, которое содержит эти производные
Автори російськоюБлюме Торстен, Хальфбродт Вольфганг, Кунке Йоахим, Мённинг Урсула, Эльгер Бернд, Шнайдер Херберт
МПК / Мітки
МПК: C07D 417/14, A61P 29/00, A61P 37/08, A61P 37/02, A61K 31/4439, A61P 43/00, C07D 413/14, C07D 409/04, C07D 401/04, A61K 31/5377, A61K 31/4184
Мітки: лікарських, 1-феніл-2-гетероарилзаміщені, засіб, містить, засобів, похідні, бензимідазолу, одержання, застосування, фармацевтичний
Код посилання
<a href="https://ua.patents.su/19-81243-1-fenil-2-geteroarilzamishheni-pokhidni-benzimidazolu-kh-zastosuvannya-dlya-oderzhannya-likarskikh-zasobiv-farmacevtichnijj-zasib-yakijj-mistit-ci-pokhidni.html" target="_blank" rel="follow" title="База патентів України">1-феніл-2-гетероарилзаміщені похідні бензимідазолу, їх застосування для одержання лікарських засобів, фармацевтичний засіб, який містить ці похідні</a>
Попередній патент: Пристрій для лікування запальних захворювань вуха і придаткових пазух носа
Наступний патент: Спосіб обробки мінеральної речовини
Випадковий патент: Спосіб регулювання режиму теплового агрегату












