Похідні фенілімідазолідинів, спосіб їх одержання (варіанти), фармацевтична композиція і їх застосування як лікарських засобів
Формула / Реферат
1. Производные фенилимидазолидинов общей формулы (I):
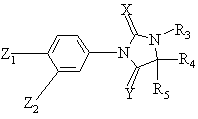 , (I)
, (I)
в которой:
Y означает атом кислорода или радикал NH, Z2 означает трифторметил и Z1 означает циано или нитро,
Х означает атом кислорода или серы,
R3 означает атом водорода или алкил, содержащий не более 4 атомов углерода, возможно замещенный одним или несколькими радикалами, выбранными из атомов галогена или циано,
R4 и R5 такие, что один из радикалов означает метил, а другой выбран из значений R4 и R5,
либо R4 и R5, одинаковые или разные, означают алкил, линейный или разветвленный, содержащий не более 4 атомов углерода, замещенный гидрокси, возможно замещенным фенилом, алкилом, содержащим не более 5 атомов углерода, или ацилом, содержащим не более 7 атомов углерода; галогеном или фенилтио, возможно замещенным атомом галогена или гидрокси,
причем R4 и R5 не обозначают один метил, а другой гидроксиметил, если Z1 означает нитрогруппу, Z2 означает нитрогруппу CF3, R3 означает водород, Х означает кислород и Y означает кислород или NH,
причем соединения формулы (I) находятся в любых возможных изомерных, рацемических, энантиомерных и диастереоизомерных формах,
а также их соли присоединения с минеральными или органическими кислотами или минеральными или органическими основаниями.
2. Соединения формулы (I) по пункту 1, отличающиеся тем, что они представляют собой следующие соединения:
2-(трифторметил)-4-[4-(гидроксиметил)-4-метил-2,5-диоксо-1-имидазолидинил]бензонитрил;
4-[3,4-диметил-4-(гидроксиметил)-5-оксо-2-тиоксо-1-имидазолидинил]-2-(трифторметил)бензонитрил;
2-(трифторметил)-4-[4-(гидроксиметил)-3,4-диметил-2,5-диоксо-1-имидазолидинил]бензонитрил;
4-[2,5-диоксо-3-(2-фторэтил)-4-(гидроксиметил)-4-метил-1-имидазолидинил]-2-(трифторметил)бензонитрил;
1,5-диметил-5-(гидроксиметил)-3-(4-нитро-3-(трифторметил)фенил)имидазолидин-2,4-дион;
4-[4,4-бис(гидроксиметил)-2,5-диоксо-1-имидазолидинил]-2-(трифторметил)бензонитрил;
причем соединения формулы (I) находятся в любых возможных изомерных, рацемических, энантиомерных и диастереоизомерных формах, а также их соли присоединения с минеральными или органическими кислотами или минеральными или органическими основаниями.
3. Соединения формулы (I) по пункту 1, отличающиеся тем, что они представляют собой следующие соединения:
4-[4-(фторметил)-3,4-диметил-2,5-диоксо-1-имидазолидинил]-2-(трифторметил)бензонитрил;
4-[3,4-диметил-4-(фторметил)-5-оксо-2-тиоксоимидазолидинил]-2-(трифторметил)бензонитрил;
4-[2,5-диоксо-3-(2-фторэтил)-4-(фторметил)-4-метил-1-имидазолидинил]-2-(трифторметил)бензонитрил;
1,5-диметил-5-(фторметил)-3-[4-нитро-3-(трифторметил)фенил]имиазолидин-2,4-дион;
3-[4-циано-3-(трифторметил)фенил]-2,4-диоксо-5-(фторметил)-5-метил-1-имидазолидинацетонитрил;
4-[4,4-бис(фторметил)-3-метил-5-оксо-2-тиоксо-1-имилазолидинил]-2-(трифторметил)бензонитрил;
причем соединения формулы (I) находятся в любых возможных изомерных, рацемических, энантиомерных и диастереоизомерных формах, а также их соли присоединения с минеральными или органическими кислотами или минеральными или органическими основаниями.
4. Производные фенилимидазолидинов формулы (I) по пп. 1-3, фармацевтически приемлемые в качестве лекарственных средств.
5. Способ получения фенилимидазолидинов формулы (I) по пп. 1-3, отличающийся тем, что соединение формулы (II):
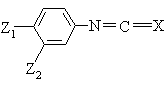 , (II)
, (II)
в которой Z1, Z2 и Х имеют указанные в п. 1 значения,
в присутствии третичного основания вводят во взаимодействие с соединением формулы (III):
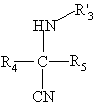 , (III)
, (III)
в которой R4 и R5 имеют указанные в п. 1 значения, и R'3 имеет значения, указанные в п. 1 для R3,
в котором возможные реакционноспособные группы в случае необходимости защищены, при условии, что R4 и R5 одновременно не означают метильный радикал и что, если Z1 означает NO2 в положении 4, Z2 означает радикал СF3 в положении 3, Х означает атом кислорода и R'3 означает атом водорода, тогда один из R4 и R5 не означает радикал СН3 и другой - радикал CH2OH;
с получением соединения формулы (IV):
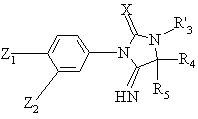 , (IV)
, (IV)
в которой Z1, Z2, X, R'3, R4 и R5 имеют вышеуказанные значения, которое при желании или необходимости подвергают одной или нескольким следующим реакциям в любом порядке:
а) реакции удаления защитных групп, которые может нести R'3;
б) реакции гидролиза группы >C=NH до карбонильной группы и при необходимости превращению группы >C=S в группу >С=O;
в) реакции превращения группы или групп >С=O в группу >C=S;
г) воздействию на соединение формулы (IV), в которой R'3 означает атом водорода, и после гидролиза группы >C=NH до карбонильной, реактивом формулы Гал-R"3, в которой R"3 имеет значения R'3, за исключением водорода, а Гал означает атом галогена, для получения продукта формулы (I), затем, при желании, воздействию на полученный продукт агентом удаления возможных защитных групп, которые может нести R"3, или при желании, агентом этерификации, агентом аминирования или агентом солеобразования, причем полученные соединения формулы (I) находятся во всех возможных изомерных, рацемических, энантиомерных и диастереоизомерных формах.
6. Способ получения фенилимидазолидинов формулы (I) по п. 1, 2 или 3, отличающийся тем, что соединение формулы (II):
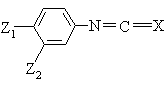 , (II)
, (II)
в которой Z1, Z2 и Х имеют указанные в п. 1 значения,
в присутствии третичного основания вводят во взаимодействие с соединением формулы (VII):
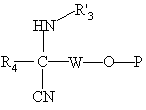 , (VII)
, (VII)
в которой W имеет указанное выше для R5 значение, за исключением алкильного радикала, замещенного свободным, этерифицированным до сложного или простого эфира или защищенным гидроксилом,
Р означает защитную группу для ОН-функции или радикал, такой, что -O-Р означает этерифицированный до простого эфира гидроксил; и
R'3 и R4 имеют вышеуказанные значения, с получением соединения формулы (VIII):
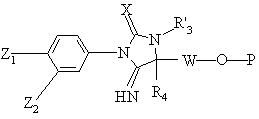 , (VIII)
, (VIII)
в которой X, Z1, Z2, R'3, R4, W и Р имеют указанные выше значения, в котором при желании или при необходимости, высвобождают из группы ОР радикал ОН, который при необходимости или при желании этерифицируют до сложного эфира или заменяют на галоид; затем при желании или при необходимости продукт формулы (VIII) подвергают одной или нескольким следующим реакциям в любом порядке:
а) реакции удаления возможных защитных групп, которые может нести радикал R'3;
б) реакции гидролиза группы >C=NH до карбонильной группы и, при необходимости, превращения группы >C=S в группу >С=O;
в) реакции превращения группы или групп >С=O в группу >C=S;
г) воздействию на продукт формулы (VIII), в которой R'3 означает атом водорода, и после гидролиза группы >С=NН до карбонильной группы, реактивом формулы Гал-R"3, в которой R"3 имеет значения радикала R'3, за исключением водорода, и Гал означает атом галогена, с получением продукта формулы (I) по п. 1-3,
затем, при желании, воздействию на полученный продукт агентом удаления возможных защитных групп, которые может нести R"3, или при желании, агентом этерификации до сложного эфира, аминирования или солеобразования, причем полученные продукты формулы (I) находятся во всех возможных изомерных, рацемических, энантиомерных или диастереоизомерных формах.
7. Способ получения фенилимидазолидинов формулы (I) по пп. 1, 2 или 3, отличающийся тем, что соединение формулы (II):
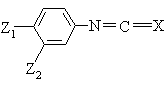 , (II)
, (II)
в которой Z1, Z2 и Х имеют указанные в п. 1 значения,
в присутствии третичного основания вводят во взаимодействие с соединением формулы (III'):
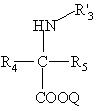 , (III')
, (III')
в которой R'3, R4 и R5 имеют вышеуказанные значения, и
Q означает либо атом щелочного металла, либо алкильный радикал с 1-6 атомами углерода, с получением продукта формулы (IVa):
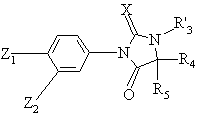 , (IVa)
, (IVa)
в которой X, Z1, Z2, R'3, R4 и R5 имеют вышеуказанные значения, который при желании подвергают одной или нескольким реакциям в любом порядке:
а) реакции удаления возможных защитных групп, которые может нести радикал R'3;
б) реакции превращения группы или групп >С=O в группу >C=S или, при желании,
группы >C=S в группу >С=O;
г) воздействию на продукт формулы (IVa), в которой R'3 означает атом водорода, реактивом формулы Гал-R"3, в которой R"3 имеет значения радикала R'3, за исключением водорода, и Гал означает атом галогена, с получением продукта формулы (I), затем, при желании, воздействию на продукт агентом удаления возможных защитных групп, которые может нести R"3, или при желании, действию агента этерификации, аминирования или солеобразования, причем полученные продукты формулы (I) находятся во всех возможных изомерных, рацемических, энантиомерных или диастереоизомерных формах.
8. Способ получения фенилимидазолидинов формулы (I) по пп. 1, 2 или 3, отличающийся тем, что соединение формулы Гал-R"3, в которой Гал и R" имеют указанные выше значения, подвергают взаимодействию с соединением формулы (IV');
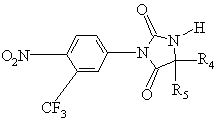 , (IV')
, (IV')
с получением соединения формулы (IV"):
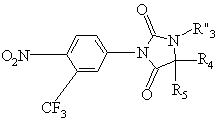 , (IV")
, (IV")
соединение формулы (IV) или (IV"), которое означает или не означает продукт формулы (I), при желании или при необходимости, подвергают одной или нескольким следующим реакциям в любом порядке с получением продукта формулы (I):
а) реакции удаления возможных защитных групп, которые может нести радикал R"3, затем, возможно, действию агента этерификации, аминирования или солеобразования,
б) реакции превращения группы или групп >С=O в группы >C=S, причем полученные продукты находятся во всех возможных изомерных, рацемических, энантиомерных и диастереоизомерных формах.
9. Фармацевтическая композиция, обладающая антиандрогенной активностью, содержащая действующее начало и экципиент, отличающаяся тем, что в качестве действующего начала она содержит, по крайней мере, одно из соединений по любому из пп. 1-3.
10. Производные фенилимидазолидинов формулы (I):
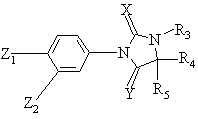 , (I)
, (I)
в которой Z1, Z2, X, Y, R3, R4 и R5 указаны в пункте 1, выбранные из следующих соединений:
4-(4,4-диметил-2,5-диоксо-3-(2-фторэтил)-1-имидазолидинил)-2-(трифторметил)бензонитрил;
4-(4,4-диметил-2,5-диоксо-3-(2,2,2-трифторэтил)-1-имидазолидинил)-2-(трифторметил)бензонитрил;
4-(4,4-диметил-3-(2-фторэтил)-5-оксо-2-тиоксо-1-имидазолидинил)-2-(трифторметил)бензонитрил;
4-(4,4-диметил-2,5-диоксо-3-(2-(2-гидроксиэтокси)этил-1-имидазолидинил)-2-(трифторметил)бензонитрил;
в качестве лекарственных средств, обладающих антиандрогенной активностью.
11. Производные фенилимидазолидинов формулы (I):
 , (I)
, (I)
в которой Z1, Z2, X, Y, R3, R4 и R5 указаны в пункте 1, выбранные из следующих соединений:
2-(трифторметил)-4-(4-(гидроксиметил)-4-метил-2,5-диоксо-1-имидазолидинил)бензонитрил;
4-(3,4-диметил-4-(гидроксиметил)-5-оксо-2-тиоксо-1-имидазолидинил)-2-(трифторметил)бензонитрил;
2-(трифторметил)-4-(4-(гидроксиметил)-3,4-диметил-2,5-диоксо-1-имидазолидинил)бензонитрил;
4-(2,5-диоксо-3-(2-фторэтил)-4-(гидроксиметил)-4-метил-1-имидазолидинил)-2-(трифторметил)бензонитрил;
1,5-диметил-5-(гидроксиметил)-3-(4-нитро-3-(трифторметил)фенил)имидазолидин-2,4-дион;
4-(4,4-бис(гидроксиметил)-2,5-диоксо-1-имидазолидинил)-2-(трифторметил)бензонитрил,
в качестве лекарственных средств, обладающих антиандрогенной активностью.
12. Производные фенилимидазолидинов формулы (I):
 , (I)
, (I)
в которой Z1, Z2, X, Y, R3, R4 и R5 указаны в пункте 1, выбранные из следующих соединений:
4-[4-(фторметил)-3,4-диметил-2,5-диоксо-1-имидазолидинил]-2-(трифторметил)бензонитрил;
4-[3,4-диметил-4-(фторметил)-5-оксо-2-тиоксо-1-имидазолидинил]-2-(трифторметил)бензонитрил;
4-[2,5-диоксо-3-(2-фторэтил)-4-(фторметил)-4-метил-1-имидазолидинил]-2-(трифторметил)бензонитрил;
4-(2,4-диоксо-1,3-диазаспиро(4,4)нонан-3-ил)-2-(трифторметил)бензонитрил;
4-(2,4-диоксо-1-(2-фторэтил)-1,3-диазаспиро(4,4)нонан-3-ил)-2-(трифторметил)бензонитрил;
1,5-диметил-5-(фторметил)-3-(4-нитро-3-(трифторметил)фенил)имидазолидин-2,4-
дион;
3-(4-циано-3-(трифторметил)фенил)-2,4-диоксо-5-(фторметил)-5-метил-1-имидазолидинацетонитрил;
4-[4,4-бис(фторметил)-3-метил-5-оксо-2-тиоксо-1-имидазолидинил]-2-(трифторметил)бензонитрил.
в качестве лекарственных средств, обладающих антиандрогенной активностью.
Текст
Настоящее изобретение относится к новым фенилимидазоли-динам, в случае необходимости замещенным; способу их получения и получения промежуточных соединений; их применению в качестве лекарственных средств и содержащим их фармацевтическим композициям. В заявке Японии J 48087030 описываются 3-фенил-2-тио-гидантоины, которые предлагаются в качестве ингибиторов прорастания некоторых растений. В европейских заявках на патенты №№0494819 и 0578516 описываются имидазолидины, которые предлагаются в качестве соединений, обладающих антиандрогенной активностью. Продукты этого патента, однако, отличаются от продуктов настоящей заявки на патент. Предметом настоящего изобретения, следовательно, являются продукты общей формулы (l): в которой: Z1 и Z2 одинаковые или разные, обозначают циано-, нитро-радикал, атом галогена, трифтор-метильный радикал или свободный, этерифици-рованный до сложного эфира, аминированный или превращенный в соль карбоксильный радикал; группу -А-В- выбирают среди радикалов в которых X обозначает атом кислорода или серы; R3j имеет такое же значение, что и R3, за исключением значения атома водорода; и R3 выбирают среди следующи х радикалов: атом водорода; алкильные, алкенильные, алкинильные, арильные или арилалкильные радикалы, самое большее с 12 атомамиуглерода, причем эти радикалы вслучае необходимости замещены однимили несколькими заместителями, выбираемыми среди атомов галогенов, и вслучае необходимости этерифицирован-ных до сложных эфиров, простых эфи-ров или защищенных гидроксильныхрадикалов; алкоксильных, гидроксиал-кильных, алкенилокси-, алкинилокси-,трифторметильных, меркапто-, циано-,ацильных, ацилокси-, арильных радикалов; S -алкильных, S -арильныхрадикалов, в случае необходимостизамещенных, в которых атом серы в случае необходимости окислен в форме сульфоксида или сульфона; свободных, этерифицированных до сложных эфиров, аминированных или превращенных в соль карбоксильных радикалов; амино-, моно- или диал-киламино-радикалов; циклического 3-6-членного радикала, содержащего в случае необходимости один или несколько гетероатомов, выбираемых среди атомов серы, кислорода или азота, и радикала в котором R7 означает алкильный, гидроксильный, алкоксильный, арильный или арилокси-радикал; причем алкильные, алкенильные или алкинильные радикалы, кроме того, в случае необходимости прерываются одним или несколькими атомами кислорода, азота или серы, в случае необходимости окисленной в форме сульфоксида или сульфона, и причем атомы азота в случае необходимости окислены; кроме того, арильные и аралкильные радикалы в случае необходимости замещены алкильным, алкенильным или алкинильным, алкоксильным, алкенил-окси-, алкинилокси- или трифторме-тильным радикалом; Y обозначает атом кислорода или серы, или радикал NН; R4 и R5, одинаковые или разные, обозначают атом водорода или алкильный радикал с 1-12 атомами углерода, в случае необходимости замещенный одним или несколькими заместителями, выбираемыми среди атомов галогенов; радикала , такого, как указанный выше; гидроксильного радикала, в случае необходимости этерифицированного до сложного эфира, простого эфира или защищенного; линейных или разветвленных фенилтио- и алкилтио-радикалов, со-держащих самое большее 8 атомов углерода, фенилтио- и алкилтио-радикалов, в которых атом серы может быть окислен до сульфоксида или сульфона, причем сами по себе они в случае необходимости замещены одним или несколькими радикалами, выбираемыми среди атомов галогенов, в случае необходимости этерифицированного до сложного, простого эфира или защищенного гидроксильного радикала; свободного, этерифицированного до сложного эфира, аминированного или превращенного в соль карбоксильного радикала; амино-, моно- или диалкиламино-радикалов; за исключением продуктов, в которых R4 и R5 одинаковые или разные, обозначают атом водорода или алкильный радикал с 1-12 атомами углерода, незамещенный или замещенный одним или несколькими атомами галогена; а также продуктов, в которых один из R4 или R5 обозначает метильный радикал, а другой обозначает гидроксиметильный радинал, Y обозначает атом кислорода или радикал NH. группа –А-В обозначает радикал Z1 в положении 4 обозначает нитро-радикал и Z2 в положении 3 обозначает трифторметильный радикал; за исключением продуктов, в которых Z 1 и Z 2 оба обозначают атом галогена; и продуктов, в которых один из Z1 и Z2 обозначает атом галогена, один из R4 и R5 обозначает алкильный радикал, замещенный группой –S-СН3, и R3 обозначает атом водорода или алкильный радикал; продукты формулы (lа): в которой Z3 обозначает циано- или нитро-радикал; R3a обозначает атом водорода или линейный или разветвленный алкильный радикал, самое большее с 4 атомами углерода, в случае необходимости замещенный атомом фтора, циано-радикалом; R4а и R5a являются такими, что один обозначает метильный радикал, а другой обозначает замещенный атомом фтора метильный радикал, или еще R4а и R5a являются одинаковыми и обозначают замещенный атомом фтора метильный радикал, или еще R4а и R5a вместе в атомом углерода, с которым они связаны, образуют циклопентильный радикал; Ха обозначает атом серы или кислорода; за исключением продукта, в котором Z3 обозначает циано-радикал, Ха обозначает атом серы, R3a обозначает метильный радикал и R4а и R5a вместе с атомом углерода, с которым они связаны, образуют циклопентильный радикал, и следующие продукты: -4-(4,4-диметил-2,5-диоксо-3-(2-фторэтил)-1-имидазолидинил)-2-(трифторметил) бензонитрил; -4-(4,4-диметил-2,5-диоксо-3-/2,2,2-трифторэтил/-1-имидазолиди-нил)-2-(трифторметил) бензонитрил; -4-(4,4-диметил-3-(2-фторэтил)-5-оксо-2-тиоксо-1-имидазолиди-нил)-2-(трифторметил) бензонитрил; -4-(4,4-диметил-2,5-диоксо-3-(2-(2-гидроксиэтокси)этил)-1-имидазолидинил)-2-(трифторметил) бензонитрил; причем вышеуказанные продукты формул (l), (lа) и указанные продукты находятся в любых возможных изомерных рацемических, энантиомерных и диастереоизомерных формах; также, как соли присоединения неорганических и органических кислот, или соли присоединения неорганических или органических оснований вышеуказанных продуктов. В том, что касается определения вышеуказанных и последующи х заместителей, то используемые определения могут иметь следующие значения. Термин "алкил" обозначает линейный или разветвленный радикал, самое большее с 12 атомами углерода, такой как, например, метил, этил, пропил, изопропил, бутил, изобутил, втор.-бутил, трет.бутил, пентил, изопентил, втор.-пентил, трет.-пентил, неопентил, гексил, изогексил, втор.-гексил, трет.гексил, гептил, октил, децил, ундецил, додецил. Предпочтительны алкильные радикалы, самое большее с 4 атомами углерода, и особенно метильный, этильный, пропильный, изопропильный и н-бутильный радикалы. Термин "алкенил" обозначает линейный или разветвленный радикал, самое большее с 12 атомами углерода, такой как, например, винил, аллил, пропен-1-ил, бутенил, пентенил, гексенил. Из алкенильных радикалов предпочтительны радикалы самое большее с 4 атомами углерода и особенно аллильный или бутенильный радикал. Термин "алкинил" обозначает линейный или разветвленный радикал, самое большее с 12 атомами углерода, такой как, например, этинил, пропаргил, бутинил, пентинил или гексинил. Из алкинильных радикалов предпочтительны радикалы самое большее с 4 атомами углерода и особенно пропаргильный радикал. Под арилом понимают карбоциклические арильные радикалы, такие как фенил или нафтил, или арильные гетероциклические моноциклические 5- или 6-членные радикалы, или образованные конденсированными циклами арильные гетероциклические радикалы, содержащие один или несколько гетероатомов, выбираемых предпочтительно среди кислорода, серы и азота. Из пятичленных гетероциклических арильных радикалов можно назвать фурильный, тиенильный, пирролильный, тиазолильный, оксазолильный,имида-золильный, тиадиазолильный, пиразолильный, изоксазолильный, тетразолильный радикалы. Из шестичленных гетероциклических арильных радикалов можно назвать пиридильный, пиримидинильный, пиридиазинильный, пиразинильный радикалы. Из конденсированных арильных радикалов можно назвать индолильный, бензофуранильный, бензотиенильный, хинолильный радикалы. Предпочтительны фенильный, тетразолильный и пиридильный радикалы. Под арилалкилом понимают радикалы, образующиеся за счет комбинации вышеуказанных алкильных радикалов с арильными радикалами. Предпочтительны бензильный, фенилэтильный, пиридилме-тильный, пиридилэтильный или тетразолилметильный радикалы. Под галогеном понимают, само собой разумеется, атомы фтора, хлора, брома или иода. Предпочтительны атомы фтора, хлора или брома. В качестве отдельных примеров замещенных одним или несколькими атомами галогенов радикалов можно назвать монофтор- -хлор-, -бром- или иодметильный, дифтор-, дихлор или дибромметильный и трифторметильный радикалы. В качестве отдельных примеров замещенных арильных или аралкильных радикалов можно назвать радикалы, в которых фенильный радикал замещен в пара-положении атомом фтора или метокси- или трифторметильным радикалом. Под ацильным радикалом понимают предпочтительно радикал самое большее с 7 атомами углерода, такой как ацетильный, пропионильный, бутирильный или бензоильный радикал, но он может также представлять собой валерильный, гексаноильный, акрилоильный, кротоноильный или карбамоильный радикал; также можно назвать формильный радикал. Под ацилокси-радикалом понимают радикалы, в которых ацильные радикалы имеют вышеуказанное значение и обозначают, например, ацетокси- или пропионилокси-радикалы. Под этерифицированным до сложноэфирного карбоксильным радикалом понимают, например, такие радикалы, как алкилокси-карбонильные радикалы, например метоксикарбонил, этоксикар-бонил, пропоксикарбонил, бутил или трет.-бутоксикарбонил. Также можно назвать радикалы, образованные с легко расщепляемыми сложноэфирными остатками, такие как метоксиметиль-ный, этоксиметильный радикалы; ацилоксиалкильные радикалы, такие как пивалоилоксиметильный, пивалоилоксиэтильный, ацет-оксиметильный или ацетоксиэтильный радикалы; алкилоксикарбо-нилоксиалкильные радикалы, такие как метоксикарбонилоксимети-льный или метоксикарбонилоксиэтильный радикалы; изопропил-карбонилоксиметильный или изопропилоксикарбонилоксиэтильный радикалы. Перечень таких сложноэфирных радикалов можно найти, например, в европейском патенте №ЕР0034536. Под аминокарбоксильным радикалом понимают группы типа , в которых радикалы R8 и R9 одинаковые или разные, обозначают атом водорода или алкильный радикал с 1-4 атомами углерода, такие как метильный, этильный, пропильный, изопропильный, бутильный, изобутильный, втор.-бутильный или трет.-бутильный радикалы. Из вышеуказанных групп предпочтительны такие, в которых радикал обозначает амино-, моно- или диметиламино-радикал. Радикал также может обозначать гетероцикл, который может содержать дополнительный гетероатом. Можно назвать пирролильный, имидазолильный, индолильный, пиперидино-, морфолино-, пиперазинильный радикалы. Предпочтительны пиперидино- или морфолинорадикалы. Под превращенным в соль карбоксильным радикалом понимают соли, образованные, например, с эквивалентом натрия, калия, лития, кальция, магния или аммония. Также можно назвать соли, образованные с органическими основаниями, такими как метиламин, пропиламин, триметиламин, диэтиламин, триэтиламин. Предпочтительна натриевая соль. Под алкиламино-радикалами предпочтительно понимают радикалы, в которых алкил содержит самое большее 4 атома углерода. Можно назвать метиламино-, этиламино-, пропиламино- или бутил(линейный или разветвленный)-амино-радикалы. Также, под диалкиламино-радикалом понимают предпочтительно радикалы, в которых алкил содержит самое большее 4 атома углерода. Можно назвать, например, диметиламино-, диэтиламино-, метилэтиламино-радикалы. Под гетероциклическим радикалом, содержащим один или несколько гетероатомов, понимают, например, моноциклические, гетероциклические насыщенные радикалы, такие как оксиранильный, оксоланильный, диоксоланильный, пирролидинильный, имидазолидинильный, пиразолидинильный, пиперидильный, пиперазинильный или морфолинильный радикалы. Под алкильными, алкенильными или алкинильными радикалами, в случае необходимости прерываемыми гетероатомами, выбираемыми среди атомов серы, кислорода или азота, понимают радикалы, содержащие один или несколько из этих атомов, одинаковых или разных по своему строению, причем эти гетероатомы очевидно не могут находиться на конце радикала. Можно назвать, например, алкоксиалкильные радикалы, такие как метокси-метил или метоксиэтил, или еще алкоксиалкоксиалкильные радикалы, такие как метоксиэтоксиметил. Под этерифицированным до сложного или простого эфира или защищенным гидроксильным радикалом понимают, соответственно, радикалы -O-C-a 1, a 2-О-a 3 или -О-Р, образованные из гидроксильного радикала обычными, известными специалисту, методами, и в которых Р обозначает защитную группу; a 1, a 2, a 3 , обозначают в особенности алкильный, алкенильный, алкинильный, арильный или арилалкильный радикал самое большее с 12 атомами углерода, и в случае необходимости замещенные таким же образом, как указано выше в особенности для R3. Примеры (защищающей) защитной группы Р, также как образование защищенного гидроксильного радикала, особенно указываются в общеизвестной специалисту книге: Protective Groups IN Organic Synthesis (Защитные группы в органическом синтезе), Theodora W. Greene, Harvard University напечатанной в 1981г. ,Wiley - Interscience Publishers, John Wiley and Sons. Группа для защиты гидроксильного радикала, которую может представлять собой Р, может быть выбрана в нижеприведенном перечне: например, формил, ацетил, хлорацетил, бромацетил, дихлорацетил, трихлорацетил, трифторацетил, метоксиацетил, феноксиацетил, бензоил, бензоилформил, п-нитробензоил. Также можно назвать такие группы, как этоксикарбонил, метоксикарбонил, пропоксикарбонил, bbb-трихлорэтоксикарбонил, бензилоксикарбонил, трет.бутоксикарбонил, 1-цикло-пропилэтокси-карбонил, тетрагидропиранил, тетрагидротиопиранил, метокситетрагидропиранил, тритил, бензил, 4-метоксибензил, бензгидрил, трихлорэтил, 1-метил-1метоксиэтил, фталоил, пропионил, бутирил, изобутирил, валерил, изовалерил, оксалил, сукцинил и пивалоил, фенилацетил, фенилпропионил, мезил, хлорбензоил, пара-нитробензоил, пара-трет.бутилбензоил, каприлил, акрилоил, метилкарбамоил, фенилкарбамоил, нафтилкарбамоил. Р особенно может обозначать радикал или еще производное кремния, такое как триметилсилил. Когда продукты формул (l) и (lа), таких, как указанные выше, содержат амино-радикал, образующий соль с кислотой, само собой разумеется, что эти соли кислот также составляют часть изобретения. Можно назвать соли, образованные, например, с соляной кислотой или метансульфокислотой. Предметом изобретения особенно являются продукты формулы (l), такой, как указанная выше, в которой Z1 и Z2 обозначают трифторметильный, нитро- или циано-радикал; Y обозначает атом кислорода или радикал NН; группа -А-В- обозначает радикал: в котором X обозначает атом кислорода или серы, R3 обозначает атом водорода, линейный или разветвленный алкильный радикал, содержащий самое большее б атомов углерода, в случае необходимости прерываемой одним или несколькими атомами кислорода или серы; фенильный или пиридильный радикал; причем эти радикалы в случае необходимости замещены одним или несколькими радикалами, выбираемыми среди атомов галогенов; фенильного, в случае необходимости этерифицированного до сложного или простого эфира или защищенного гидроксильно-го, алкоксильного, циано-, трифтор-метильного, гидроксиалкильного; свободного, этерифицированного до сложного эфира, аминированного или превращенного в соль карбоксильного; амино-, моно- или диалкиламинорадикала, причем атом азота пиридильного радикала в случае необходимости окислен; R4 и R5 обозначают линейный или разветвленный алкильный радикал самое большее с 6 атомами углерода, в случае необходимости замещенный одним или несколькими радикалами, выбираемыми среди в случае необходимости этерифицированных до сложного или простого эфира, или защищенных гидроксильных радикалов, атомов галогенов, радикала , в котором R7 обозначает линейный или разветвленный алкильный или алкоксильный радикал, и алкилтио-и фенилтио-радикалов, которые сами в случае необходимости замещены одним или несколькими радикалами, выбираемыми среди атомов галогенов и свободного, этерифицированного до сложного эфира или простого эфира, или защищенного гидроксильного радикала; причем указанные продукты формулы (l) находятся в любы х возможных изомерных рацемических, энантиомерных и диастерео-изомерных формах; также как соли присоединения неорганических и органических кислот или соли присоединения неорганических и органических оснований вышеуказанных продуктов формулы (l). Из этих продуктов предметом изобретения в особенности являются продукты формулы (l), такой как указанная выше, в которой Z1 и Z2 обозначают трифторметильный, нитро- или циано-радикал; Y обозначает атом кислорода или радикал NН: группа -А-В- обозначает группу в которой X обозначает атом кислорода или серы; R3 обозначает атом водорода или алкильный радикал с 1-6 атомами углерода, в случае необходимости замещенный одним или несколькими радикалами, выбираемыми среди атомов галогенов и в случае необходимости этерифицированного до сложного или простого эфира или защищенного гидроксильного радикала; свободного, этерифицированного до сложного эфира, аминированного или превращенного в соль карбоксильного радикала и циано-радикала, причем алкильный радикал в случае необходимости прерывается одним или несколькими атомами кислорода или серы; R4 и R5 обозначают алкильный радикал самое большее с 6 атомами углерода, в случае необходимости замещенный одним или несколькими радикалами, выбираемыми среди в случае необходимости этерифицированного до сложного или простого эфира или защищенного гидроксильного радикала, атомов галогенов и алкилтио- и фенилтио-радикалов, которые сами в случае необходимости замещены одним или несколькими радикалами, выбираемыми среди атомов галогенов и гидроксильного радикала; причем указанные продукты формулы (l) находятся в любых возможных изомерных рацемических, энантиомерных и диастерео-изомерных формах; также как соли присоединения неорганических и органических кислот или соли присоединения неорганических или органических оснований вышеуказанных продуктов формулы (l). Из этих продуктов предметом изобретения преимущественно являются продукты формулы (l), такие, как указанные выше, в которой Y обозначает атом кислорода или радикал NH; Z2 в положении 3 обозначает трифторметильный радикал, и Z1 в положении 4 обозначает циано- или нитро-группу; X обозначает атом кислорода или серы; R3 обозначает атом водорода или алкильный радикал самое большее с 4 атомами углерода, в случае необходимости замещенный одним или несколькими радикалами, выбираемыми среди атомов галогенов или циаио-радикала; R4 и R5 одинаковые или разные, обозначают линейный или разветвленный алкильный радикал самое большее с 4 атомами углерода, в случае необходимости замещенный свободным, этерифицированным до сложного или простого эфира или защищенным гидроксильным радикалом, атомом галогена или фенилтио-радикалом, в случае необходимости замещенным атомом галогена или свободным, этерифицированным до сложного или простого эфира или защищенным гидроксильным радикалом; причем вышеуказанные продукты формулы (l) находятся в любых возможных изомерных рацемических, энантиомерных и диастереоизомерных формах; также, как соли присоединения неорганических и органических кислот или соли присоединения неорганических и органических оснований вышеуказанных продуктов формулы (l). Из предпочтительных продуктов изобретения более конкретно можно назвать продукты формулы (l), такой как указанная выше, названия которых следующие: -2-(трифторметил)-4-(4-(гидроксиметил)-4-метил-2,5-диоксо-1-имидазолидинил)бензонитрил; -4-(3,4-диметил-4-(гидроксиметил)-5-оксо-2-тиоксо-1-имидазоли-динил)-2(трифторметил)бензонитрил; 2-(трифторметил)-4-(4-(гидроксиметил)-3,4-диметил-2,5-диоксо-1-имидазолидинил)бензонитрил; -4-(2,5-диоксо-3-(2-фторэтил)-4-(гидроксиметил)-4-метил-1-имид-азолидинил)-2(трифторметил)бензонитрил; -1,5-диметил-5-(гидроксиметил)-3-(4-нитро-3-(трифторметил)-фенил)-имидазолидин-2,4-дион; 4-(4,4-бис(гидроксиметил)-2,5-диоксо-1-имилазолидинил)-2-(трифторметил) бензонитрил; причем вышеуказанные продукты формулы (l) находятся в любых возможных изомерных рацемических, энантиомерных и диастерео-изомерных формах; также, как соли присоединения неорганических и органических кислот или соли присоединения неорганических и органических оснований вышеуказанных продуктов формулы (l). Также совершенно особенно предметом изобретения являются продукты формулы (lа), такой, как указанная выше, названия которых следующие: -4-(4-(фторметил)-3,4-диметил-2,5-диоксо-1-имидазолидинил)-2-(трифторметил)-бензонитрил; -4-(3,4-диметил-4-(фторметил)-5-оксо-2-тиоксо-1-имидазолидин-ил)-2-(трифторметил)-бензонитрил; -4-(2,5-диоксо-3-(2-фторэтил)-4-(фторметил)-4-метил-1-имидазо-лидинил)-2(трифторметил)бензонитрил; -4-(2,4-диоксо-1,3-диазаспиро(4,4)нонан-3-ил)-2-(трифторметил)-бензонитрил; -4-(2,4-диоксо-1-(2-фторэтил)-1,3-диазаспиро(4,4)нонан-3-ил)-2-(трифторметил)бензонитрил; -1,5-диметил-5-(фторметил)-3-(4-нитро-3-(трифторметил)фенил)-имидазолидин-2,4-дион; -3-(4-циано-3-(трифторметил)фенил)-2,4-диоксо-5-(фторметил)-5-метил-1имидазолидинацетонитрил; -4-(4,4-бис-(фторметил)-3-метил-5-оксо-2-тиоксо-1-имидазолиди-нил-2-(трифторметил)бензонитрил; причем вышеназванные продукты формулы (lа) находятся в любых возможных рацемических, энантиомерных и диастереоизомерных формах; также как соли присоединения неорганических и органических кислот или соли присоединения неорганических и органических оснований вышеуказанных продуктов формулы (lа). Предметом изобретения также является способ получения продуктов формул (l), (lа) и вышеуказанных продуктов, отличающийся тем, что либо продукт формулы (ІІ): в которой Z1, Z2 и X имеют выше указанное значение, в присутствии третичного основания вводят во взаимодействие с продуктом формулы (ІІІ): в которой R4 и R5 имеют вышеуказанное значение, и R’3 имеет значения, указанные выше для R3, в котором возможные реакционноспособные функции в случае необходимости защищены, и имея в виду, что R4 и R5 одновременно не обозначают метильный радикал, и если Z1 обозначает радикал NO2 в положении 4, Z2 обозначает радикал CF3 в положении 3, X обозначает атом кислорода, и R'3 обозначает атом водорода, тогда один из R4 или R5 не обозначает радикал СН3, а другой - радикал СН 2ОН, с целью получения продукта формулы (lV): в которой Z1, Z2 , X, R'3, R4 и R5 имеют выше указанное значение; либо продукт формулы (ll), такой, как указанная выше, в присутствии третичного основания вводят во взаимодействие с продуктом формулы (Vll): в которой W имеет значение, указанное выше для R5, за исключением атома водорода, алкильного радикала, замещенного свободным, этерифицированным до сложного или простого эфира или защищенным гидроксильным радикалом, и значения такого, как указанное выше; и Р обозначает защищающую гидроксил-группу или радикал, такой, что -O-Р обозначает этерифицированный до простого эфира гидроксильный радикал; и R'3 и R4 имеют выше указанное значение, для получения продукта формулы (Vlll): в которой X, Z 1, Z2, R'3 , R4, W и P имеют выше указанное значение; в продукте формулы (Vlll), если необходимо и если желательно, можно высвобождать из ОР ОНрадикал, который затем, если необходимо и если желательно, можно этерифицировать до сложного эфира или превращать в галоидный радикал; продукты формул (lV) и (Vlll), если необходимо или если желательно, подвергают любой одной или нескольким следующим реакциям, в любом порядке: реакция удаления возможных защитных (защи щающи х) гр упп, которые могут нести R'3; реакция гидролиза группы _>С=NH до карбонильной функции и в желательном случае превращение группы >С=S в гр уппу >С=O; реакция превращения группы или групп >С=O в группу >С=S; г) воздействие на продукты формулы (lV) или (Vlll), в которой R'3 обозначает атом водорода, и после гидролиза группы >C=NH до карбонильной функции, реагента формулы Гал-R”3, в которой R”3 имеет значения R'3, за исключением водорода, и Гал обозначает атом галогена, с целью получения продуктов формул (l), (lа) и цитированных продуктов, таких как указано выше, где гр уппа -А-В- обозначает группу в которых R”3 имеет вышеуказанное значение, затем, если желательно, воздействие на эти продукты агента удаления возможных защитных групп, которые могут нести R”3 или, в случае необходимости, воздействие агента этерификации до сложного эфира, агента аминирования или агента солеобразования; либо продукт формулы (ll), такой, как указанный выше, в присутствии третичного основания вводят во взаимодействие с продуктом формулы (lll'): в которой R’3, R4 и R5 имеют вышеуказанное значение; и Q обозначает либо атом щелочного металла, либо алкильный радикал с 1-6 атомами углеводорода, для получения продукта формулы (lVа): в которой X, Z 1, Z2, R'3 , R4, и R5 имеют выше указанное значение, который, если желательно, подвергают любой одной или нескольким следующим реакциям, в любом порядке: реакция удаления возможных защитных групп, которыемогут нести R'3 ; реакция превращения группы или групп >С=O в гр уппу>С=S, или, в желательном случае, гр уппы >C=S в гр уппу>С=O; воздействие на продукты формулы (lVа), в которой R'3 обозначает атом водорода, реагента формулы Гал- R”3 которой R”3 имеет значения R’3 за исключением значения водорода, и Гал обозначает атом галогена, для получения продуктов формул (l), (lа) и цитированных продуктов, таких, как указанные выше, в которых гр уппа -А-В- обозначает группу: в которой R”3 имеет вышеуказанное значение; затем, если желательно, воздействие на эти продукты агента удаления возможных защитных групп, которые могут нести R”3, или, в желательном случае, воздействие агента этерификации до сложного эфира, аминирования или солеобразования; либо введение во взаимодействие реагента формулы Гал- R”3 в которой Гал и R”3 имеют вышеуказанные значения, с продуктом формулы (lV'): для получения продукта формулы (lV") причем продукт формулы (lV), (l Vа), (IV’), (lV") или (Vlll), который обозначает или не обозначает продукта формулы (l), для получения, если необходимо или если желательно, продукта формулы (l) подвергают любой одной или нескольким реакциям в любом порядке: реакция удаления возможных защитных гр упп, которые может нести R”3, затем, в случае необходимости, воздействие агента этерификации до сложного эфира, агента аминирования или агента солеобразования; реакция превращения группы или групп >С=O в группы >C=S; причем вышеуказанные продукты формулы (l), таким образом полученные, находятся в любых возможных изомерных рацемических, энантиомерных и диастереоизомерных формах. Взаимодействие продуктов формулы (ll) с продуктами формулы (lll) осуществляют предпочтительно в органическом растворителе, таком как тетрагидрофуран или дихлорэтан, но можно также использовать диэтиловый эфир или диизопропиловый эфир. Работают в присутствии третичного основания, такого как триэтиламин или еще пиридин или метилэтилпиридин. Возможные реакционноспособные функции, которые может включать R3 и которые в случае необходимости являются защищенными, представляют собой гидроксильные или аминные функции. Для защиты этих функций используют обычные защитные группы. Можно назвать, например, следующие защитные группы для амино-радикала: трет.-бутил, трет.-амил, трихлорацетил, хлорацетил, бензгидрил, тритил, формил, бензилоксикарбонил. В качестве защищающей гидроксильный радикал группы можно назвать такие радикалы, как формил, хлорацетил, тетрагид-ропиранил, триметилсилил, трет.-бутил-диметилсилил. Само собой разумеется, что вышеприведенный перечень не является ограничительным (ограничивающим объем охраны изобретения) и что другие защитные группы, например известные в химии пептидов, могут быть использованы. Перечень таких защитных групп имеется, например, во французском патенте №2499995, содержание которого включено здесь в качестве ссылки. Возможные реакции удаления защитных групп осуществляют, как указывается в вышеуказанном французском патенте №2499995. Предпочтительным способом удаления является кислотный гидролиз с помощью кислот, выбираемых из группы, состоящей из соляной кислоты, бензолсульфокислоты или пара-толуолсульфо-кислоты, муравьиной кислоты или трифторуксусной кислоты. Предпочтительна соляная кислота. Возможную реакцию гидролиза группы >С=NН до кетонной группы также предпочтительно осуществляют с помощью кислоты, такой как водная соляная кислота, например, при кипячении с обратным холодильником. Когда гидролиз группы >С=NH до карбонильной группы осуществляют в случае молекулы, содержащей также группу >C=S, то она также может быть превращена в группу >С=O Свободный ОНрадикал, который в случае необходимости может нести R 3в таком случае может быть превращен в радикал SH Реакцию превращения группы или групп >С=O в группу >C=S осуществляют с помощью так называемого реагента Лавессона формулы: который является продажным продуктом, выпускаемым, например, фирмой FLUKA и применение которого описывается, например, в публикации: Bull Sос, Chim, Belg, 87, №3 (1987), с.229. Когда хотят превратить две функции >C=O в две функции >С=S, то работают в присутствии избытка реагента Лавессона. То же самое имеет место, когда исходят из молекулы, содержащей функцию >C=S и функцию >С=O, и хо тят превратить вышеуказанную функцию >C=O в функцию >С=S. Напротив, когда исходят из молекулы, содрежащей две функции >C=O и хотят получить продукт, содержащий только одну функцию >С=S, то работают в присутствии недостатка реагента Лавессона. В таком случае обычно получают смесь трех продуктов: два продукта, каждый из которых содержит функцию >С=O и функцию >С=S, и продукт, содержащий две функции >С=S. Эти продукты затем можно разделять обычными способами, такими как хроматография. Воздействие на продукт формулы (lV), (lVа), (l V’) или (Vlll) реагента формулы Гал- R”3 осуществляют в присутствии сильного основания, такого как гидрид натрия или калия. Можно работать с помощью реакции переноса фаз в присутствии четвертичных аммониевых солей, таких как трет.-бутиламмоний. Защитными группами, которые может нести заместитель Я , могут быть, например, одна из вышеуказанных для R3 групп. Реакции удаления защитных групп осуществляют в вы шеуказанных условиях. В примерах ниже приводится пример удаления трет.-бутилдиметилсилильной группы с помощью соляной кислоты. Возможную этерификацию до сложного эфира продуктов формулы (l), (lа) и таких, которые указаны выше, где R”3 несет свободный радикал ОН, осуществляют в классических условиях. Можно использовать, например, кислоту или ее функциональное производное, например ангидрид, такой как уксусный ангидрид, в присутствии основания, такого как пиридин. Возможную этерификацию до сложного эфира или возможное превращение в соль продуктов формул (l), (lа) и цитированных продуктов, таких, как указанные выше, где R3 обозначает группу СООН, осуществляют в классических условиях, известных специалисту. Возможное аминирование продуктов формул (l), (lа) и таких, как указанные выше, где R3 содержит радикал СООН, осуществляют в классических условиях. Можно использовать первичный или вторичный амин для функционального производного кислоты, например как симметричный или смешанный ангидрид. Реакцию продукта формулы (ll), такой, как указанная выше, с продуктом формулы (Vll), такой, как указанная выше, для получения продукта формулы (Vlll), такой, как указанная выше, можно осуществлять особенно в присутствии метиленхлорида при температуре около -30°С. Предметом настоящего изобретения также является способ получения продуктов формулы (l"): в которой R4 и R5 имеют вышеуказанное значение; и R”1, R”2, -A”-B”- имеют значения, указанные выше для Z1, Z 2, и -А-В-, имея в виду, что когда –А”-В”обозначает группу -CO-N(R””3), где R””3 означает атом водорода или линейный или разветвленный алкильный радикал самое большее с 7 атомами углерода, и Y обозначает атом кислорода, R”1 обозначает циано-радикал; отличающийся тем, что продукт формулы (V): вышеуказанные значения, и Гал обозначает атом галогена, в которой R”1 и R”2 имеют вводят во взаимодействие с продуктом формулы (Vl): в которой –А”-В”-, R4, R5 и y имеют вышеуказанное значение, причем реакцию осуществляют в присутствии катализатора и, в случае необходимости, растворителя. В том, что касается продуктов формулы (V), термин Гал предпочтительно обозначает атом хлора, но также может обозначать атом брома или иода. Роль катализатора, очевидно, заключается в улавливании галогеноводорода, который выделяется, и таким образом облегчении протекания реакции конденсации продукта формулы (V) с продуктом формулы (Vl) для получения целевого продукта. Более конкретно, предметом изобретения является способ, такой, как указано выше, при котором катализатором является металл в нативной или окисленной или основной форме. Когда используемым катализатором является металл, то этим металлом может быть медь или никель. Металл может быть в нативной форме, в форме оксида металла или еще в виде металлических солей. Металлическими солями могут быть хлорид или ацетат. Когда катализатором является основание, то этим основанием может быть, например, гидроксид натрия или калия и, если желательно, можно добавлять в реакционную среду диметил-сульфоксид. Более конкретно, предметом изобретения является способ, такой, как указанный выше, при котором катализатор выбирают из группы, состоящей из оксида меди(l), оксида меди(ll), меди в нативной форме и основания, такого, как гидроксид натрия или калия. Медь в нативной форме, используемая в качестве катализатора, предпочтительно находится в виде порошка. Предметом изобретения особенно является способ, такой, как указанный выше, при котором катализатором является оксид меди(l). Используемый растворитель предпочтительно выбирают среди простых эфиров с высокой температурой кипения, таких как, например, дифениловый эфир, диглим, триглим и диметилсульфоксид, но также можно добавлять, например, масло с высокой температурой кипения, такое как парафин или вазелин. Предметом изобретения преимущественно является способ, такой, как указанный выше, отличающийся тем, что работают в присутствии растворителя типа простого эфира, такого как дифениловый эфир, диглим, триглим или диметилсульфоксид. В особенности предметом изобретения является способ, такой, как указанный выше, при котором используемым растворителем является дифениловый эфир или триглим. Вышеуказанный способ получения целевого продукта можно осуществлять под давлением или при атмосферном давлении, при предпочтительно повышенной температуре. Таким образом, предметом изобретения является способ, такой, как указанный выше, отличающийся тем, что реакцию осуществляют при температуре выше 100°С и предпочтительно выше 150°С. Более конкретно, предметом изобретения является способ, такой как указанный выше, отличающийся тем, что реакцию осуществляют в течение времени более 2-х часов. Еще более конкретно, предметом изобретения является способ, такой как указанный выше, отличающийся тем, что реакцию проводят в присутствии оксида меди(l), в триглиме, при температуре выше или равной 200°С и в течение времени более 3-х часов. Продукты, составляющие предмет настоящего изобретения, обладают интересными фармакологическими свойствами, особенно они фиксируются на рецепторе андрогенов и они обладают антиандрогенной активностью. Приведенные в экспериментальной части испытания иллюстрируют эти свойства. Эти свойства позволяют использовать продукты формулы (l), такие как указанные выше, настоящего изобретения в качестве лекарственных средств, особенно для лечения аденом и новообразований простаты, такие как доброкачественной гипертрофии простаты, используемые индивидуально или в комбинации с аналогами LHRH. Их можно также использовать для лечения доброкачественных или злокачественных опухолей, обладающих рецепторами к андрогенам, и преимущественно для лечения рака женской груди, кожи, женских половых желез, мочевого пузыря, лимфатической системы, почек и печени; для лечения кожных заболеваний, таких как акне, гиперсеборея, алопеция (облысение) или гирсутизм. Эти продукты, следовательно, могут быть использованы в дерматологии индивидуально или в комбинации с антибиотиками, такими как производные азелаиновой и фузидиевой кислот, эритромицин, также как производные ретиноевой кислоты или ингибитор (5a-редукта-зы, такой как (5a, 17b) -1,1-диметилэтил-3-оксо-4-аза-андрост-1-ен-17-карбоксамид (или финастерид, Merck, 11-ое издание), для лечения акне, алопеции или гирсутизма. Их можно также сочетать с продуктом, стимулирующим рост волос, таким как миноксидил, для лечения алопеции. Продукт формул (l), (lа) и цитированные продукты, такие как указанные выше, в радиоактивной форме (тритий, углерод 14, иод 125 или фтор 18) еще могут быть использованы в качестве специфических маркеров рецепторов к андрогенам. Их можно также применять в диагностике при медицинской визуализации. Продукты формул (l), (lа) и цитированные продукты, такие как указанные выше, также могут быть использованы в области ветеринарии для лечения расстройств поведения, как агрессивность, зависящего от андрогена болезненного состояния, такого как circum analum) у собаки, и опухолей, включающих рецепторы к андрогенам. Их можно также использовать для того, чтобы вызвать химическую кастрацию у животного. Следовательно, предметом изобретения является применение в качестве лекарственных средств продуктов формул (l), (lа), таких как указанные выше, которые фармацевтически приемлемы. Предметом изобретения также является применение в качестве лекарственных средств следующи х продуктов: -4-(4,4-диметил-2,5-диоксо-3-(2-фторэтил)-1-имидазолидинил)-2-(трифторметил)бензонитрил; -4-(4,4-диметил-2,5-диоксо-3-(2,2,2-трифторэтил)-1-имидазолидинил)-2(трифторметил)бензонитрил; -4-(4,4-диметил-3-(2-фторэтил)-5-оксо-2-тиоксо-1-имидазолидинил)-2-(трифторметил)бензонитрил; -4-(4,4-диметил-2,5-диоксо-3-(2-(2-гидроксиэтокси)этил)-1-имидазолидинил-2(трифторметил)бензонитрил; Предметом изобретения особенно является применение в качестве лекарственных средств следующих продуктов: -2-(трифторметил)-4-(4-(гидроксиметил)-4-метил-2,5-диокси-1-имидазолидинил)бензонитрил; -4-(3,4-диметил-4-(гидроксиметил)-Б-оксо-г-тиоксо-і-имидазоли-динил)-2(трифторметил)бензонитрил; -2-(трифторметил)-4-(4-(гидроксиметил)-3,4-диметил-2,5-диоксо-1-имидазолидинил)бензонитрил; -4-(2,5-диоксо-3-(2-фторэтил)-4-(гидроксиметил)-4-метил-1-имидазолидинил)-2(трифторметил)бензонитрил; -1,5-диметил-5-(гидроксиметил)-3-(4-нитро-3-(трифторметил)-фенил)-имидазолидин-2,4-дион; -4-(4,4-бис-(гидроксиметил)-2,5-диоксо-1-имидазолидинил)-2-(трифторметил)бензонитрил; Предметом изобретения также в особенности является применение в качестве лекарственных средств следующи х продуктов формулы (lа): -4-(4-(фторметил)-3,4-диметил)-2,5-диоксо-1-имидазолидинил)-2-(трифторметил)бензонитрил; 4-(3,4-диметил-4-(фторметил)-5-оксо-2-тиоксо-1-имидазолидинил)-2-(трифторметил)бензонитрил; -4-(2,5-диоксо-3-(2-фторэтил)-4-(4-фторметил)-4-метил-1-имид-азолидинил)-2(трифторметил)бензонитрил; -4-(2,4-диоксо-1,3-диаздспиро(4,4)нонан-3-ил)-2-(трифторметил)-бензонитрил; 4-(2,4-диоксо-1-(2-фторэтил)-1,3-диазаспиро(4,4)нонан-3-ил)-2-(трифторметил)бензонитрил; 1,5-диметил-5-(фторметил)-3-(4-нитро-3-(трифторметил)фенил)-имидазолидин-2,4-дион; 3-(4-циано-3-(трифторметил)фенил)-2,4-диоксо-5-(фторметил)-5-метил-1имидазолидинацетонитрил; -4-(4,4-бис-(фторметил)-3-метил-5-оксо-2-тиоксо-1-имидазоли-динил-2-(трифторметил)бензонитрил. Продукты можно вводить парентерально, орально, чрезязычно, ректально или топически. Предметом изобретения также являются фармацевтические композиции, отличающиеся тем, что они содержат в качестве действующего начала по крайней мере одно из лекарственных средств формул (l), (lа) и цитированных продуктов, таких как указанные выше. Эти композиции могут находиться в форме инъецируемых растворов или суспензий, таблеток, покрытых оболочкой таблеток, капсул, сиропов, свечей, кремов, мазей и лосьонов. Эти фармацевтические формы получают обычными способами. Действующее начало может быть включено в обычно используемые в этих композициях эксципиенты, такие как водные или нет основы для приготовления лекарственных средств, тальк, гуммиарабик, лактоза, крахмал, стеарат магния, масло какао, жировые вещества животного или растительного происхождения, парафиновые производные, гликоли, различные смачиватели, диспергаторы или эмульгаторы, консерванты. Обычная доза, изменяемая в зависимости от излечиваемого субъекта и причины заболевания, может составлять, например, 10-500мг в день для человека при пероральном введении. Используемые согласно изобретению исходные продукты формулы (ll) могут быть получены путем воздействия фосгена, когда X обозначает атом кислорода, или тиофосгена, когда X обозначает атом серы, на амин, соответствующий формуле (А): Пример такого получения приводится ниже в экспериментальной части. Продукт этого типа также описывается в патенте Франции №2329276. Амины формулы (А) описываются в европейском патенте ЕР 0002892 или во французском патенте №2142804. Продукты формулы (lll) или (lll') известны или могут быть получены из соответствующего циангидрина согласно способу, описанному в п убликации: J. Am., Chem. Soс. (1953), 75, 4841; Бейльштейн, 1, 4 526; или J. Оrg, Chem. 27, 2901 (1962). Продукты формулы (lll), в которых R'3 является отличным от атома водорода, можно получать путем воздействия продукта формулы R”3Гал на 2-циано-2-аминопропан в условиях, описанных выше для воздействия R”'3Гал на продукты формулы (lV). Пример получения такого типа описывается в ссылке: Jilek и сотрудники, Соllесt, Czech. Сhеm. Comm., 54 (8), 2248 (1989). Продукты формулы (lV') описываются в патенте Франции №2329276. Продукты формул (V) и (Vl), используемые в качестве исходных в способе, являющемся предметом изобретения, для получения продуктов формул (l), (lа), таких как указанные выше, известны и имеются в продаже или могут быть получены известными специалисту методами. Получение продуктов формулы (Vl) особенно описывается в следующи х п убликациях: Журнал прикладной химии, 28, 969-975 (1955); (С.А., 5.0,4881а, 1956); Tetrahedron, 42, 1753 (1987); J. Org. Chem. 52, 2407 (1987); Журнал органической химии (ЖОХ), 21, 2006 (1985); J.Tluor. Chem., 17, 345 (1981); или в патентах: германский патент 637318 (1935); европейский патент 0130875; патент Японии 81.121.524. Продукты формулы (Vl), которые являются производными гидантоина, широко используются и описываются в литературе, как например в следующи х статьях: J. Pharm. Pharmacol, 67, т.19 (4), с.209-216 (1967); Химический фармацевтический журнал, 67, т.1 (5), с.51-52; германский патент 2217914; европейский патент 0.091.596; J. Chem, Soc, Perkin. Trans, 1, c.219-221 (1974). Предметом изобретения также являются, в качестве новых промышленных продуктов и особенно в качестве новых промышленных продуктов, используемых в качестве промежуточных для получения продуктов формул (l), (lа) и цитированных продуктов, таких как указаные выше, продукты формулы (lVі): в которой X, Z1, Z2 , R4, R5, и Y имеют вышеуказанные значения, а группу среди радикалов выбирают в которых X обозначает атом кислорода или серы, и R3i выбирают среди указанных для R3 значений, включающих защи щенную реакционноспособную функцию, за исключением продуктов, в которых R4 и R5, одинаковые или разные, обозначают атом водорода или алкильный радикал с 1-12 атомами углерода, в случае необходимости замещенный одним или несколькими атомами галогена. Из реакционноспособных функций, которые могут быть защищены, можно назвать гидроксильную и амино- функции. Эти функции могут быть защищены как указано выше для заместителя R3. Нижеследующие примеры иллюстрируют изобретение, не ограничивая никоим образом его объема охраны. Пример 1. 2-(Трифторметил)-4-(4-(гидроксиметил)-4-метил-2,5-диоксо-1-имидазолидинил)-бензонитрил Стадия А: /(Тетрагидро-2Н-пиран-2-ил)окси/пропан-2-он Вводят (в колбу) 50г гидроксиацетона, 100см 3 метилен-хлорида и 0,5г 1%-ной моногидратированной пара-толуолсульфо-кислоты. После этого добавляют в течение 5 часов и при 20°С 62,44г 3,4-дигидро-24-пирана. Спустя 2,5 часа после введения добавляют 0,5г пара-толуолсульфокислоты, затем перемешивают 1,5 часа и добавляют 100см 3 насыщенной бикарбонатом натрия воды. Перемешивают в течение 5 минут при щелочном значении pH, затем декантируют и экстрагируют метиленхлоридом, затем промывают водой, сушат органические фазы, отфильтровывают и доводят досуха. Получают 101,8г целевого продукта (бледно-желтое масло). Стадия Б; 2-Амино-2-метил-3-/(тетрагидро-2Н-пиран-2-ил) окси/-пропаннитрил 77,3г цианида калия, 178,1г оксида алюминия и 70г хлорида аммония віл ацетонитрила перемешивают с помощью ультразвука в течение 1 часа, поддерживая температур у 40°С. Затем добавляют 95г полученного выше в стадии А продукта, после чего промывают с помощью 0,2л ацетонитрила и перемешивают примерно 21 час. Отфильтровывают, промывают ацетонитрилом и высушивают. Очищают на диоксиде кремния (элюирующее средство: циклогексан /этилацетат в соотношении 1:1) и рекуперируют целевой продукт (желтого цвета масло). ИК-спектр (СНСl3): (CºN) 2230; (NH) 3393, 3330см -1. Стадия В: 2-(Трифторметил)-4-(4-(гидроксиметил)-4-метил-2,5-диоксо-1имидазолидинил)бензонитрил Конденсация 2-(трифторметил)-4-{5-имино-4-метил-2-оксо-4-[/(тетрагидро-2Н-пиран-2ил)окси/метил]-1-имидазоли-динил}бензонитрила При 20°С±2°С 12,77г полученного в вышеуказанной стадии Б продукта вводят в 127,7мл метиленхлорида. Затем примерно за 1,5 часа при перемешивании и при температуре -30°С±3°С добавляют предварительно профильтрованный раствор 11,4г продукта, получаемого в Приготовлении примера 7 европейской заявки на патент № 0494819, в 171мл метиленхлорида и перемешивают примерно 1 час при -30°С±3°С, затем растворитель выпаривают при пониженном давлении при 40°С. Получают 24,7г целевого продукта конденсации, используемого таким, какой есть, для гидролиза в метаноле. Гидролиз 2-(трифторметил)-4-(4-(гидроксиметил)-4-метил-2,5-диоксо-1имидазолидинил)бензонитрила При перемешивании и при температуре 20°С±2°С 21,3г полученного выше в п.а) продукта вводят в 213мл метанола. Затем в течение 2 минут добавляют 67мл 2н соляной кислоты. Кипятят в течение 1 часа с обратным холодильником, после чего оставляют охлаждаться при перемешивании. Концентрируют, отгоняя примерно 100мл метанола, реакционную среду перемешивают с помощью магнитной мешалки в течение примерно 1 часа при температуре 0°С¸+5°C, затем отсасывают. Полученные кристаллы очищают, добавляют 3 объема метанола, в течение 15 минут кипятят с обратным холодильником, после чего оставляют охлаждаться при перемешивании до температуры 20°25°С и отсасывают. Получают 10,7г целевого продукта (кристаллы белого цвета). Т.пл.=218°С. Микроанализ: теоретически рассчитано, %: С 49.85, N 13.4, F 18.9, Н 3.22 продукт, высушенный при 60°: 49.7, 13.4, 18.0, 3.2 ИК-спектр: комплексная абсорбция в области ОН/NН; -СºN 2230см-1; >=O 1780-1735см -1; ароматические 1604-1575-1503см -1. Пример 2. 2-(Трифторметил)-4-(4-(гидроксиметил)-3,4-диметил-2,5-диоксо-1-имидазолиди-нил)бензонитрил 1) Получение тетрагидропиранового простого эфира Вводят (в колбу) 626мг продукта примера 1,10мл тетра-гидрофурана, 30мг паратолуолсульфокислоты в виде моногидрата и 2мл дигидропирана. По истечении примерно 30 минут смесь выливают на 10мл (раствора) бикарбоната натрия и 1мл триэтиламина и экстрагируют хлороформом. Органическую фаз у промывают соленой водой, сушат и растворитель выпаривают. Очищают на диоксиде кремния (элюирующее средство: CH2Cl2, метанол), Получают 830мг целевого простого эфира. 2) Метилирование азота Вводят (в колбу) 103мг 50%-ного гидрида натрия и примерно за 40 минут добавляют 830мг полученного выше в п.1) простого эфира в 7мл диметилформамида, затем, спустя 10 минут после окончания прекращения выделения водорода, (колбу с реакционной смесью) помещают на водяную баню и добавляют 0,18мл метилиодида и 0,5мл диметилформамида. После реакции в течение 30 минут смесь выливают в 40мл воды, содержащей около 0,5г монокалийфосфата, и экстрагируют эфиром, затем органическую фазу промывают соленой водой, сушат и растворитель выпаривают при пониженном давлении. Очищают на диоксиде кремния (элюирующее средство СН2СІ2-ацетон в соотношении 95:5). Получают 770мг продукта, используемого таким, какой есть, в последующей стадии. 3) Гидролиз простого тетрагидропиранового эфира Вводят 770мг полученного выше в п. 2) простого N-метилированного эфира в 10мл метанола, 1,5мл 2н соляной кислоты и нагревают примерно при 40°С. Спустя 30 минут доводят до комнатной температуры, смесь выливают в 20мл (раствора) бикарбоната натрия, экстрагируют хлороформом, экстракт промывают соленой водой, сушат и растворитель выпаривают при пониженном давлении. Очищают на диоксиде кремния (элюирующее средство СН2СІ2-ацетон в соотношении 3:1). 111мг вышеполученного сырого продукта перекристаллизовывают из 5мл изопропанола при нагревании, концентрируют примерно до 1мл и в течение 16 часов охлаждают. Полученные кристаллы отфильтровывают, сушат и получают 90мг целевого продукта (кристаллы белого цвета). Т.пл.=178°179°С. Микроанализ: рассчитано, %: С 51.38, Н 3.70, F 17.41, N 12.84 найдено, %: 51,5, 3.7, 17.5, 12.8 ИК-спектр (СНСl3): 3620см-1 (ОН); 1781-1728см -1 (>=O); 2235см-1 (CºN); 1615-1576-1505см -1 (ароматические) УФ-спектр (этанол): максимум 262нм S=13900 плечо (Infl.) 278нм S=7200 плечо (Infl.) 286нм S=3800 Пример 3: 4-(2,5-Диоксо-3-(2-фторэтил)-4-(гидроксиметил)-4-метил-1-имидазолидинил)-2(трифторметил)бензонитрил а). Алкилирование с помощью 1,2-бромфторэтана Вводят (в колбу) 104мг 5%-ного гидрида натрия и в течение 30 минут прикапывают 830мг полученного в стадии 1) примера 2 простого эфира и 7,5мл диметилсульфоксида. Спустя примерно 20 минут после прекращения выделения водорода сразу добавляют 0,22мл 1,2-бромфторэтана. После протекания реакции примерно в течение 1 часа смесь выливают в 5мл воды, содержащей 500мг монокалийфосфата, и экстрагируют эфиром. Органическую фазу промывают водой, затем соленой водой, сушат и растворитель выпаривают при пониженном давлении. Очищают на диоксиде кремния (элюирующее средство СН 2СІ 2-ацетон в соотношении 97,5:2,5) и получают 743мг целевого продукта. б). Гидролиз простого тетрагидропиранового эфира Вводят (в колбу) 743мг полученного выше в п.4) продукта в 10мл метанола, 1,5мл 2 н соляной кислоты и доводят до 40°С, затем, по истечении 45 минут, смесь выливают в 20мл (раствора) бикарбоната калия и экстрагируют хлороформом. Органическую фазу промывают соленой водой, сушат и растворитель выпаривают при пониженном давлении. Очищают на диоксиде кремния (элюирующее средство СН2СІ2-ацетон в соотношении 9:1), затем полученные кристаллы растворяют в 20мл изопропанола при 60°С, отфильтровывают, промывают и концентрируют примерно до объема 5 мл, охлаждают примерно в течение 1 часа и отсасывают. Получают 466мг целевого продукта (кристаллы белого цвета). Т.пл.=146°-147°С. Микроанализ: рассчитано, %: С 50.15, Н 3.65, F 21.15, N 11.70 найдено, %: 50,1 3.50 20.9 11.7 ИК-спектр (СНСl3): 3612см -1 (ОН); 1782 (m)-1121 (f) см -1 (>=O); 2235см -1 (CºN). УФ-спектр (этанол): максимум 260нм S=15500 плечо 278нм S=6700 плечо 286нм S=3300 Пример 4: 4-(3,4-Диметил)-4-(гидроксиметил)-5-оксо-2-тиоксо-1-имидазолидинил)-2(трифторметил)бензонитрил Стадия А: (±)-2-Ме тил-2-(метиламино-3-/(тетрагидро-2Н-пиран-2-ил)окси/пропаннитрил Вводят (в колбу) 1,54г метиламинхлоргидрата в виде раствора в 10см 3 воды и 3,35г кетона, полученного в стадии А примера 1, и полученную суспензию перемешивают в течение примерно 10 минут. В течение 10 минут приливают раствор 1,06г NaCN в 5см 3 воды и смесь перемешивают в течение ночи при комнатной температуре. Экстрагируют метиленхлоридом, экстракт промывают насыщенным раствором хлорида натрия, сушат и растворитель выпаривают при пониженном давлении. Получают 3,72г целевого продукта (масло желтого цвета), используемого таким, какой есть, в последующей стадии. ИК-спектр (СНСl3): 3345см -1 (NН); 2230см-1 (CºN). Стадия Б; 2- (Трифторметил) -4-{5-имино-3, 4-диметил-4-[/(тетра-гидро-2Н-пиран-2-ил)окси/метил]2-тиоксо-1-имид-азолидинил}бензонитрил Вводят (в колбу) 2,38г аминонитрила в виде раствора в 8см 3 1,2-дихлорэтана и добавляют 0,5см 3 триэтиламина, охлаждают до температуры -5°С¸0°С и в течение 20 минут при температуре ниже 0°С приливают раствор 2,75г изотиоцианата, полученного в Приготовлении примера 11 европейской заявки на патент 0494819, в 17см 3 1,2-дихлорэтана. Оставляют температуру повышаться до комнатной, поддерживая перемешивание в течение примерно 2 часов, суша т и растворитель удаляют при пониженном давлении. После очистки на диоксиде кремния (элюирующее средство СН 2СІ2-ацетон в соотношении 92:8) получают 3,31г целевого продукта. ИК-спектр (СНСl3): 3308см-1 (>C=NH); 2236см -1 (CºN); 1679см-1 (>C=N); 1614см -1 (>С=S); 1575, 1505, 1496см -1 (ароматические). Стадия В: 4-(3,4-Диметил)-4-(гидроксиметил)-5-оксо-2-тиоксо-1-имидазолидинил)-2(трифторметил)бензонитрил К 3,25г полученного в выше указанной стадии Б продукта в виде раствора в 35см 3 метанола прикапывают 19см 3 2н соляной кислоты и кипятят с обратным холодильником в течение 35 минут. Нейтрализуют с помощью раствора бикарбоната натрия, экстрагируют хлороформом, органическую фазу промывают насыщенным раствором хлорида натрия, сушат и растворитель выпаривают при пониженном давлении. После очистки на диоксиде кремния (элюирующее средство СH2Сl2-этилацетат в соотношении 85:15), затем перекристаллизации из 10см 3 изопропанола получают 1,90г целевого продукта (кристаллы белого цвета). Т.пл.=167°-168°С. Микроанализ: рассчитано, %: С 48.98, Н 3.52, N 12.24, F 16.60, S 9.34 найдено, %: 48.9 3.6 12.1 16.7 9.1 ИК-спектр (СНСІ3): отсутствие полосы, характерной для С=NН; 3620см -1 (ОН); 1759см-1 (>С=O); 2238см -1 (CºN); 1610-1576-1505-1494см -1 (ароматические + конъюгированная система). Пример 5: 1,5-Диметил-5-(гидроксиметил)-3-(4-нитро-3-(трифторметил)фенил)-имид-азолидин-2,4-дион Стадия А: Образование простого тетрагидропиранового эфира Поступают согласно методике п.1) вышеприведенного примера 2, заменяя в этом приготовлении продукт примера 1на 870мг продукта, полученного как в примере 2 европейской заявки на патент 0305270, в 13мл тетрагидрофурана, используя 40мг моногидрата пара-толуолсульфокислоты и 2,6мл дигидропирана. По истечении примерно 15 минут реакционную смесь выливают в 10мл насыщенного раствора бикарбоната натрия и 1мл триэтиламина и экстрагируют хлороформом. Органическую фазу промывают соленой водой, сушат, растворитель выпаривают при пониженном давлении и остаток очищают на диоксиде кремния (элюирующее средство СН 2СІ2-метанол в соотношении 95:5) и получают целевой продукт. Стадия Б; Метилирование азота Поступают как в п.2) вышеуказанного примера 2, исходя из продукта, полученного выше в п.1), и получают целевой продукт. Стадия В; Гидролиз простого тетрагидропиранового эфира Поступают как в п.3) вышеприведенного примера 2, исходя из 955мг продукта, полученного в п. 2) выше, и получают 698мг целевого продукта (кристаллы белого цвета). Т.пл.=153°-154°С. Микроанализ: рассчитано, %: С 44.96, Н 3.48, F 16.41, N 12.10 найдено, %: 45.0 3.50, 16.3 12.1 ИК-спектр (СНСl3): 3620см-1 (ОН); 1782-1727см -1 (>С=O); 1618-1596-1545-1498см -1 (ароматические и полоса NО2). УФ-спектр (этанол): плечо при 214нм S=13000 максимум при 271нм S=6100 плечо при 320нм Пример 6: 4-(4-(Фторметил)-3,4-диметил-2,5-диоксо-1-имидазолидинил)-2-(три-фторметил)бензонитрил К 1мл тетрагидрофурана, охлажденному примерно до -60°С, добавляют 0,2мл диэтиламиносульфид-трифторида, затем прикапывают охлажденный до -60°С раствор 0,2г продукта примера 2 в 6,5мл тетрагидрофурана. Оставляют температур у повышаться до комнатной, затем нагревают до 30°С. Спустя 1 час при этой температуре, смесь выливают в 18мл раствора бикарбоната натрия и экстрагируют эфиром. Органическую фазу промывают соленой водой, сушат и растворители выпаривают при пониженном давлении. Очищают остаток на диоксиде кремния (элюирующее средство СН2СІ2-циклогексан в соотношении 9:1), затем полученные кристаллы растворяют в 30мл изопропанола при 60°С, отфильтровывают, промывают с помощью 2мл изопропанола, концентрируют до объема примерно 5мл и охлаждают в течение ночи. Кристаллы отсасывают, сушат и получают 136мг целевого продукта (кристаллы белого цвета). Т.пл.=153°-154°С. Микроанализ: рассчитано, %: С 51.07, Н 3.37, F 23.08, N 12.76 найдено, %: 50.8 3.2 25.0 12.7 ИК-спектр (СНСl3): 2240см -1 (CºN); 1785-1733см -1 (>С=O); 1616-1575-1505см-1 (ароматические). УФ-спектр (этанол): максимум при 259нм S=15200 плечо при 278нм S=5800 плечо при 286нм S=2900 Пример 7: 4-(3,4-Диметил-4-(трифторметил)-5-оксо-2-тиоксо-1-имидазолидинил)-2-(трифторметил) бензонитрил 2см 3 безводного тетрагидрофурана охлаждают до -60°С и в течение примерно 15 минут при температуре в пределах -60°С - -53°С прикапывают 0,88см 3 диэтиламиносульфид-трифторида, затем 0,930г продукта примера 4 в виде раствора в 7см 3 безводного тетрагидрофурана. После возврата температуры к комнатной выдерживают примерно 30 минут при температуре около 30°С. После этого реакционную смесь выливают в 25см 3 раствора бикарбоната натрия со льдом. Экстрагируют эфиром, эфирную фазу промывают насыщенным раствором хлорида натрия, сушат и растворители выпаривают при пониженном давлении. После очистки на диоксиде кремния (элюирующее средство СН2СІ2циклогексан в соотношении 9:1) и перекристаллизации из изопропанола, после высушивания получают 1,010г целевого продукта (кристаллы белого цвета). Т.пл. 163°С. Микроанализ: рассчитано, %: С 48.69, Н 3.21, F 22.01, N 12.17, S 9.28 найдено,%: 48.6 3.10 22.2 12.1 9.5 ИК-спектр (СНСІ3): отсутствие полосы, характерной для ОН; 2238см -1 (CºN); 1762см -1 (>С=O); 16151580см -1 -1505-1491см -1 (конъюгированная система + ароматические) УФ-спектр (этанол): максимум при 235нм S=19200 максимум при 253нм S=23000 плечо при 265нм S=18300 Пример 8: 4-(2,5-Диокси-3-(2-фторэтил)-4-(фтор-метил) -4-метил-1-имидазолидинил)-2(трифторметил)бензонитрил 1мл тетрагидрофурана охлаждают до -50°С и добавляют 0,33мл диэтиламиносульфид-трифторида, затем прикапывают предварительно охлажденные до температуры около -50°С 360мг продукта примера 3 в 4мл тетрагидрофурана. Промывают с помощью 0,5мл тетрагидрофурана и оставляют температуру повышаться до комнатной, после чего доводят примерно до 30°С. Тогда смесь выливают в 30мл раствора бикарбоната натрия с 10г льда и экстрагируют хлороформом, органическую фаз у затем промывают соленой водой и высушивают. Очищают на диоксиде кремния (элюирующее средство СН2СІ2-зтилацетат в соотношении 99:1), затем полученные кристаллы растворяют в 30мл изопропанола при температуре кипения с обратным холодильником, полученный раствор промывают с помощью 1мл изопропанола, концентрируют до объема примерно 7мл и оставляют стоять в течение 16 часов при 0°С. Отсасывают, и после высушивания получают 307мг целевого продукта (кристаллы белого цвета). Т.пл.=137°-138°С. Микроанализ: рассчитано, %: С 49.87, Н 3.35, F 26.29, N 11.63 найдено, %: 49.8 3.4 26.2 11.6 ИК-спектр (СНСl3): 2235см -1 (CºN); 1786-1730см -1 (>=O); 1616-1575-1505см -1 (ароматические). УФ-спектр (этанол): максимум при 258нм S=16000 плечо при 211нм S=5300 плечо при 285нм S=2700 Пример 9: 4-(2,4-Диоксо-1,3-диазаспиро(4,4)нонан-3-ил)-2-(трифторметил)бензонитрил Стадия А: 1-Амино-циклопентанкарбонитрил Вводят (в колбу) 40мл аммиака, 1,9г хлорида амония и 6,14г цианида натрия, затем перемешивают вплоть до полного растворения на ледяной бане при температуре -8°С. После этого при температуре около -9°С прикапывают 8,8мл циклопентанона, оставляют повышаться температуру до комнатной и перемешивают в течение ночи. После этого декантируют органическую фазу, водную фазу экстрагируют метиленхлоридом, затем органические фазы промывают соленой водой и сушат. После дистилляции при 55°С±2°С получают 1,2г целевого продукта. ИК-спектр (СНСl3): 3381-3330см -1 (NН2); 2226см -1 (CºN), отсутствие полосы, характерной для С=O. Стадия Б: 2-(Трифторметил)-4-[4-имино-2-оксо-1,3-диазаспиро (4,4) нонан-3-ил] бензонитрил Вводят (в колбу) 550мл продукта, полученного выше в стадии А, 4мл 1,2-дихлорэтана и 0,2мл триэтиламина, затем доводят до 0°С и в течение 5 минут при температуре -4°С добавляют 3,1мл продукта, полученного в Приготовлении примера 7 европейской заявкі;. на патент 0494819, и оставляют стоять до повышения температуры до комнатной. После протекания реакции в течение примерно 40 минут, концентрируют досуха, остаток растворяют в 40мл ацетона, растворитель выпаривают и остаток очищают на диоксиде кремния (элюирующее средство СН 2СІ2-ацетон в соотношении 90:10). Получают 1,24г целевого продукта (кристаллы белого цвета). Т.пл.=212°-213°С. ИК-спектр (вазелиновое масло): 3350-3280см -1 (ОН/NН); 2240см-1 (CºN); 1744см-1 (>С=O); 1670см -1 (>=N); 1610-1574-1510см-1 (ароматические). Стадия В: 4-(2,4-Диоксо-1,3-диазаспиро(4,4)нонан-3-ил)-2-(трифторметил)бензонитрил Вводят (в колбу) 1,17г продукта, полученного в стадии Б выше, в 20мл метанола, 3мл хлороформа и 5мл 2н соляной кислоты, затем нагревают при температуре около 50°С в течение примерно 2 часов. Доводят до комнатной температуры, затем реакционную смесь выливают в 40мл воды и экстрагируют 3 раза метиленхлоридом. Органическую фазу промывают соленой водой, сушат и растворитель выпаривают при пониженном давлении, после чего остаток очищают на диоксиде кремния (элюирующее средство СН 2СІ 2-ацетон в соотношении 9:1). Получают 1,108г целевого продукта (кристаллы белого цвета). Т.пл.=184°-185°С. Микроанализ: рассчитано, %: С 55.73, Н 3.74, F 17.63, N 13.00 найдено, %: 55.6 3.7 17.4 12.8 ИК-спектр (СНСl3): 3444см-1 (=C-NH); 2236см -1 (CºN); 1786-1731см -1 (>=O); 1616-1505см -1 (ароматические). УФ-спектр (этанол): максимум при 258нм S=15600 плечо при 286нм S=3500 Пример 10; 4-(2,4-Диоксо-1-(2-фторэтил)-1,3-диазаспиро(4,4)нонан-3-ил)-2-(три-фторметил)бензонитрил К 0,050г 50%-ного в масле гидрида натрия прикапывают примерно в течение 20 минут 0,323г продукта примера 9 в виде раствора в 2,5см 3 диметилсульфоксида. Перемешивают в течение примерно 1 часа 20 минут, затем прикапывают 0,09см 3 1-бром-2-фторэтана в виде раствора в 0,2см 3 диметилсульфоксида. После выдерживания примерно 2 часа при комнатной температуре, в течение 10 минут нагревают при 30°-35°С, после чего реакционную смесь выливают в 12см 3 воды, содержащей 0,2г мононатрийфосфата и экстрагируют эфиром. Эфирную фазу промывают насыщенным раствором хлорида натрия, сушат и выпаривают досуха. Остаток очищают на диоксиде кремния (элюирую-щее средство СН2СІ2-этилацетат в соотношении 99:1) и получают 0,249мг целевого продукта. Т.пл.=115°С. Микроанализ: рассчитано, %: С 55.29, Н 4.09, F 20.58, N 11.38 найдено, %: 55.3 4.1 20.25 11.3 ИК-спектр (СНСl3): 2238см -1 (-CºN); 1776-1723см -1 (-С=O); 1616-1575-1505см-1 (ароматические). УФ-спектр (этанол): максимум при 260нм S=15600 плечо при 287нм Пример 11: 1,5-Диметил-5-(трифторметил)-3-(4-нитро-3-(трифторметил)-фенил)-имид-азолидин-2,4-дион Вводят (в колбу) 1мл тетрагидрофурана, охлаждают примерно до -60°С, добавляют 0,09мл диэтиламиносульфид-трифторида и прикапывают охлажденный примерно до -60°С раствор 210мг продукта примера 5 в 2,5мл тетрагидрофурана. Смесь промывают с помощью 0,5мл тетрагидрофурана, оставляют температуру повышаться до комнатной, доводят температуру примерно до -60°С и добавляют 0,1мл диэтиламиносульфид-трифторида. По истечении 1 часа 20 минут реакционную смесь выливают в 8мл раствора бикарбоната натрия и экстрагируют эфиром. Органическую фазу промывают соленой водой, сушат, растворитель выпаривают при пониженном давлении и остаток очищают на диоксиде кремния, используя в качестве элюирующего средства СН2СІ2-ацетон (99:1). Получают 152мг целевого продукта (кристаллы белого цвета). Т.пл.=118°-119°С. Микроанализ: рассчитано, %: С 44.71, Н 3.17, F 21.76, N 12.03 найдено, %: 44.9 3.1 21.42 11.9 ИК-спектр (СНСl3): 1786-1732см -1 (>С=О); 1618-1597-1546-1498см -1 (ароматические). УФ-спектр (этанол): плечо при 214нм S=13400 максимум при 267нм S=6200 плечо при 320 нм Пример 12: 4-(4,4-Диметил-2,5-диоксо-3-(2-(2-гидроксиэтокси)этил)-1-имидазолиди-нил-2(трифторметил)бензонитрил Стадия 1: 4-(4,4-диметил-2,5-диоксо-3-/2-(/(1,1-диметилэтил)-диметилсилил/окси) этокси/этил-1имидазолидинил-2-(трифторметил)бензонитрил Вводят (в колбу) 0,101г 50%-ного в масле гидрида натрия и в течение 15 минут прикапывают раствор 0,594г продукта примера 8 европейского патента 0494819 в 4,5мл диметил-сульфоксида и перемешивают в течение 30 минут после прекращения выделения водорода. В течение 5 минут прикапывают раствор 0,594г (2-/2-бромэтокси/этокси)-диметил-(1,1диметилсилил)силана в 1мл диметилсульфоксида. Перемешивают в течение часа при комнатной температуре, затем добавляют 0,056г (2-/2бромэтокси/этокси)-диметил-(1,1диметилэтил)силана и выдерживают 2,5 часа при температуре 30°40°С. Реакционную смесь выливают в раствор 0,6г мононатрий-фосфата в 30мл ледяной воды и экстрагируют эфиром. Эфирную фазу промывают раствором NаСl, сушат и растворитель выпаривают. После хроматографии на диоксиде кремния (элюирующее средство: метиленхлорид/этилацетат в соотношении 99:1), выделяют 0,776г целевого продукта (масло). ИК-спектр (CHCI3), см -1: отсутствие полосы, характерной для =С-NН; 2235 (-CN); 1778-1724 (>С=О); 838 (-O-Si-); 1616-1577-1505 (ароматические). Стадия 2: 4-(4,4-Диметил-2,5-диоксо-3-(2-/2-гидроксиэтокси/-этил)-1-имидазолидинил)-2(трифторметил)бензонитрил Вводят (в колбу) 0,759г полученного в стадии 1 выше продукта, растворенного в 7,5мл метанола и прикапывают 2мл 2н соляной кислоты. Перемешивают в течение 40 минут при комнатной температуре, выливают в ледяную воду и экстрагируют хлороформом. Органическую фазу промывают раствором хлорида натрия и высушивают; растворитель выпаривают, остаток хроматографируют на диоксиде кремния (элюирующее средство метиленхлорид/ацетон в соотношении 9:1), выделяют 0,549г целевого продукти. Т.пл. С=О ); 16161575-1505 (ароматические) Пример 13: 4-(4,4-Диметил)-2,5-диоксо-3-(2-фтор-этил)-1-имидазолидинил)-2-(трифторметил) бензонитрил Вводят (в колбу) 104мл 50%-ного гидрида натрия, в течение примерно 20 минут прикапывают раствор 600мг продукта примера 8 европейской заявки на патент 0494819 в 5мл диметилформамида. Промывают с помощью 0,5мл диметилформамида и после прекращения выделения водорода добавляют 0,16мл 1-бром-2-фторэтана. Тогда добавляют 98мл 50%-ного гидрида натрия, затем, спустя примерно 10 минут, добавляют 0,1мл 1-бром-2-фторэтана и нагревают при 50°С. Реакционную смесь доводят до комнатной температуры, выливают в 20мл воды, содержащей 200мг монокалийфосфата,и экстрагируют эфиром. Органическую фазу промывают водой, затем соленой водой, сушат, растворитель выпаривают при пониженном давлении, остаток растворяют в 20мл ацетона и очищают на диоксиде кремния (элюирующее средство СН 2СІ2-этилацетат в соотношении 99:1). Получают 200мг целевого продукта (кристаллы белого цвета). Т.пл.=108°-109°С. Микроанализ: рассчитано, %: С 52.48, Н 3.82, F 22.14, N 12.24 найдено, %: 52.4 3.7 22.0 12.4 ИК-спектр (СНСl3), см -1: 2236 (CºN); 1780-1728 (>С=О); 1618-1580-1504 (ароматические). Пример 14: 4-(4,4-Диметил-2,5-диоксо-3-(2,2,2-трифторэтил)-1-имидазолидинил)-2-(трифторметил)бензонитрил Вводят (в колбу) 0,125г 50%-ного в масле гидрида натрия и в течение 20 минут раствор 0,742г продукта примера 8 европейской заявки на патент 0494819 в 7,5см 3 диметилсульфоксида и промывают с помощью 1см 3 диметилсульфоксида. По окончании выделения водорода выдерживают при перемешивании примерно 20 минут и приливают 0,5см 3 иодтрифторметана и добавляют 0,5см 3 простого эфира 15-краун-5. Выдерживают в течение 16 часов при 60°С. После добавления 0,25см 3 иодтрифторметана продолжают нагревание в течение примерно 19 часов при 80°С. После этого смесь выливают в 30мл воды, содержащей 0,5г мононатрийфосфата, и экстрагируют эфиром. Эфирную фазу промывают насыщенным раствором хлорида натрия, сушат и выпаривают досуха. Остаток очищают на диоксиде кремния (элюирующее средство СН2СІ2--этилацетат в соотношении 99:1), затем перекристаллизуют из 10 см 3 изопропанола и получают 0,262г целевого продукта (кристаллы белого цвета). Т.пл.=110°С. Микроанализ: рассчитано, %: С 47.5, Н 2.92, F 30.05, N 11.08 найдено, %: 47.3 2.8 30.0 11.0 ИК-спектр (СНСІ3)/ см -1: отсутствие полосы, характерной для N-Н; 1790-1732 (>С=О ); 1616-15781505 (ароматические); 2235 (CºN); УФ-спектр (этанол): максимум при 255нм S=16400 плечо при 276нм S=4400 плечо при 285нм S=2400 Пример 15: 4-(4,4-Диметил-3-(2-фторэтил)-5-оксо-2-тиоксо-3-имидазолидинил)-2-(трифторметил)бензонитрил Стадия А: 4-/3-(2-Фторэтил)-5-имино-4,4-диметил-2-тиоксо-1-имидазолидинил/-2(трифторметил)бензонитрил Вводят 1,86г 2-/(2-фторэтил)амино/-2-метил-пропаннитри-ла и 0,55см 3 триэтиламина в 12см 3 1,2дихлорэтана. Охлаждают до 0°С и в течение примерно 25 минут при температуре около 0°С приливают раствор 2,97г изотиоцианата, полученного как в Приготовлении примера 11 европейской заявки на патент 0494819, в 22см 3 1,2-дихлорэтана. Продолжают перемешивание в течение 7 часов при комнатной температуре, затем растворитель выпаривают при пониженном давлении. Остаток очищают на диоксиде кремния (элюирующее средство СН2СІ2-ацетон в соотношении 95:5, затем 97:3), обрабатывают с помощью нескольких см 3 эфира, отсасывают, сушат и получают 1,84г целевого продукта. Т.пл.=160°С. ИК-спектр (СНСl3), см -1: 3308 (С=NН); 2236 (CºN); 1677 и 1604+1576-1504 (конъюгированная система + ароматические). Стадия Б: 4-(4,4-Диметил-3-(2-фторэтил)-5-оксо-2-тиоксо-1-имидазолидинил)-2(трифторметил)бензонитрил К раствору 1,65г продукта, полученного в стадии А выше, в 60см 3 метанола прикапывают 6,9см 3 2н соляной кислоты. Спустя примерно 1,5 часа при 50°С, реакционную смесь нейтрализуют бикарбонатом натрия и метанол отгоняют. Обрабатывают водой, экстрагируют эфиром, эфирную фазу промывают раствором хлорида натрия и сушат. После очистки на диоксиде кремния с помощью СН 2СІ2 в качестве элюирующего средства и перекристаллизации из 15см 3 изопропанола получают 2,99г целевого продукта (кристаллы белого цвета). Т.пл.=135°С. Микроанализ: рассчитано, %: С 50.14, Н 3.65, F 21.15, N 11.69, S 8.92 найдено, %: 50.1 3.60 21.0 11.7 9.2 ИК-спектр (CHCI3), см -1: отсутствие полосы, характерной для =С-NH; 1758 (>С=О ); 2236 (>С=O); 1610 и 1576+1504 (конъюгированная система + ароматические). УФ-спектр (этанол): максимум при 233нм S=17700 максимум при 253нм S=21600 Пример 16: 3-(4-Циано-3-(трифторметил)фенил)-2,4-диоксо-5-(гидроксиметил)-5-метил-1-имидазолидинацетонитрил Поступают как в примере 2, исходя из продукта примера 1, но заменяя в п.2) примера 2 метилиодид на цианометилбромид, и таким образом получают целевой продукт. Т.пл.=171°С. Пример 17: 3-(4-Циано-3-(трифторметил)фенил)-2,4-диоксо-5-(трифторметил)-5-метил-1-имидазолидинацетонитрил Поступают согласно методике получения примера 6, заменяя там продукт примера 2 на продукт примера 16, и получают таким образом целевой продукт. Т.пл.=175°С. Пример 18: (±)-4-{2-Оксо-5-имино-/[(4-фторфенил)-тио]метил/-4-метил-1-имидазолидинил}-2(трифторметил)бензонитрил Стадия А: (±)-3-/(4-Фторфенил)тио/-2-амино-2-метил-пропан-нитрил К 2,21г цианида натрия в 45мл воды добавляют последовательно раствор 4,81г хлорида аммония в 12мл воды и 24,6мл аммиака (25°Боме), затем раствор 8,32г 1-(4-фторфенилтио) пропан-2-она, полученного как указано в патенте 8246399 Е, в 21мл 96,2%-ного этанола. Выдерживают при 60°С и перемешивают в течение примерно 22 часов. Охлаждают до температуры 0°С¸+4°С, промывают этанолом, дистиллируют, декантируют, водную фазу экстрагируют с помощью СН 2СІ2, промывают экстракт насыщенным раствором хлорида натрия, сушат и растворитель выпаривают при пониженном давлении. Остаток очищают путем хроматографии на диоксиде кремния при использовании в качестве элюирующего средства смеси циклогексана с этилацетатом (50:50) и получают 14,50г целевого продукта. ИК-спектр (СНСl3), см -1: 3382-3327 (абсорбция NH); 1591-1491 (ароматические); 2228 (-C=N). Стадия Б: (±) 4-{2-Оксо-5-имино[/(4-фторфенил)тио/метил]-4-метил-1-имидазолидинил}-2(трифторметил)бензонитрил Вводят (в колбу) 9,8г продукта, полученного в стадии А выше, 35мл 1,2-дихлорэтана и добавляют 0,2мл триэтиламина. Охлаждают до 5°С и в течение 12 минут при температуре 5°-10°С вводят раствор 7,7г продукта, полученного в Приготовлении примера 7 европейской заявки на патент 0494819, в 40мл 1,2-дихлорэтана. Промывают с помощью 5мл дихлорэтана и оставляют на 16 часов при комнатной температуре. Растворитель выпаривают при пониженном давлении, остаток очищают на диоксиде кремния (элюирующее средство СН2СІ2-ацетон в соотношении 93:7), затем растворяют в 100мл изопропанола примерно при 60°С, отфильтровывают, промывают с помощью 20мл нагретого изопропанола, концентрируют, о хлаждают в течение примерно 3 часов, отсасывают, промывают холодным изопропанолом и высушивают. Получают 2,815г целевого продукта (кристаллы белого цвета). Т.пл.=150°С. Микроанализ: рассчитано, %: С 54.03, Н 3.34, F 17.99, N 13.26, S 7.59 найдено, %: 54.1 3.30 17.9 13.1 7.7 ИК-спектр (СНСl3), см -1: 1756 (>С=O); 1669 (CºN); 3444 (NН); 1614-1591-1505-1491 (ароматические); CºN присутствует. Пример 19: 4-{2,5-Диоксо-4-[/(4-фторфенил)-тио/метил]-4-метил-1-имидазолидинил}-2-трифторметилбензонитрил Вводят (в колбу) 3,95г продукта, полученного в примере 18, 14мл соляной кислоты (22°Боме) и 14мл воды и суспензию кипятят с обратным холодильником. По истечении 1,5 часов реакционную смесь возвращают к комнатной температуре, выливают на лед с водой в количестве 100г (1:1) и экстрагируют этилацетатом. Органическую фазу промывают водой, затем насыщенным раствором бикарбоната натрия, наконец насыщенным раствором хлорида натрия и растворитель выпаривают. Остаток очищают путем хроматографии на диоксиде кремния (элюирующее средство СН2СІ2-ацетон в соотношении 95:5). Обрабатывают с помощью 50мл 100%-ного этанола при температуре 50°С, отфильтровывают, промывают с помощью 5мл нагретого этанола, концентрируют и оставляют на 16 часов в холодильнике при температуре около 0°¸+4°C. Затем отсасывают, промывают охлажденным этанолом и высушивают. Получают 3,55г целевого продукта (кристаллы белого цвета). Т.пл.=153°С. Микроанализ: рассчитано, %: С 53.9, Н 3.09, F 17.95, N 9.92, S 7.57 найдено, %: 53.9 3.1 18.3 9.8 7.8 ИК-спектр (СНСl3), см -1: 1791-1734 (С=О ); 3439 (NH); 2236 (C=N); 1615-1591-1505-1492 (ароматические). Пример 20: 4(2,5-Диоксо-3-(2-фторэтил)-4-/(4-фторфенил)тиометил/-4-метил-1-имидазо-лидинил)-2(трифторметил)бензонитрил К 0,031г 50%-ного в масле гидрида натрия в течение примерно 10 минут прикапывают раствор 0,254г продукта, полученного как в примере19, в 2,2см 3 диметилсульфоксида. Перемешивание поддерживают примерно 40 минут. Затем в течение примерно 5 минут прикапывают раствор 0,54см 3 1бром-2-фторэтана в 0,7см 3 диметилсульфоксида. После перемешивания в течение 30 минут смесь выливают в смесь воды со льдом, содержащую 0,4г мононатрийфосфата. Экстрагируют эфиром, органическую фаз у промывают насыщенным раствором хлорида натрия, сушат и растворитель выпаривают при пониженном давлении. После очистки на диоксиде кремния (элюирующее средство СН2СІ2-зтилацетат в соотношении 100:0,5), затем перекристаллизации из 15см 3 изопропанола получают 0,175г целевого продукта (кристаллы белого цвета). Т.пл.=155°С. Микроанализ: рассчитано, %: С 53.73, Н 3.43, F 20.23, N 8.95, S 6.83 найдено, %: 53.5 3.2 20.5 9.0 7.1 ИК-спектр (СНСІ3), см -1: отсутствие полосы, характерной для =С-NН; 2235 (CºN); 1780-1727 (>С=О); 1616-1591-1505-1492 (ароматические). УФ-спектр (этанол): максимум при 255нм S=18600 плечо при 278нм S=8000 плечо при 287нм S=4400 Пример 21: 4-(4,4-Бис(гидроксиметил)-3-метил-5-оксо-2-тиоксо-1-имидазолидинил)-2(трифторметил)бензонитрил Стадия А: 2-(Метиламино)-2-[/(тетрагидро-2Н-пиран-2-ил)окси/-метил]-3- /(тетрагидро-2Н-пиран-2ил)окси/пропаннитрил Вводят (в колбу) 2,7г 1,3-бис /(тетрагидро-2Н-пиран-2-ил)окси/пропан-2-она, полученного так, как указано ниже, 5мл воды и 0,77г метиламин-хлоргидрата, затем в течение 5 минут добавляют 503мг цианида натрия и 3мл воды. Спустя 2,5 часа времени протекания реакции, экстрагируют метиленхлоридом, органическую фаз у промывают соленой водой, растворитель выпаривают при пониженном давлении. Получают 3,3г целевого продукта, используемого таким, какой есть, в следующей стадии. ИК-спектр (СНСl3), см -1: 3346 (NН); 2230 (CºN); 1732 (>С=О). Получение 1,3-бис- /(тетрагидро-2Н-пиран-2-ил)окси/-2-пропан-2-она, используемого в качестве исходного вещества примера 21. При 70°С нагревают 9г димерного 1,3-дигидроксиацетона в виде суспензии в 60мл диоксана и доводят до комнатной температуры. Добавляют 20мл 3,4-дигидро-2,4-пирана, затем 300мг моногидрата пара-толуолсульфокислоты, поддерживая температур у ниже 40°С. Выдерживают в течение 16 часов при перемешивании, выливают в 300мл насыщенного раствора бикарбоната натрия, органическую фазу промывают соленой водой, сушат и растворитель выпаривают при пониженном давлении. После хроматографии остатка на диоксиде кремния (элюирующее средство циклогексан-этилацетаттриэтиламин в соотношении 8:2:0,5) получают 17г целевого продукта. Rf=0,2. Стадия Б: 2-(Трифторметил)-4-{4,4-бис[/(тетрагидро-2Н-пиран-2-ил)окси/метил]-5-имино-3-метил-2тиоксо-2-имид-азолидинил}-бензонитрил Вводят (в колбу) 2,39г изотиоцианата, полученного в Приготовлении примера 11 европейской заявки на патент 0494819, и 10мл 1,2-дихлорэтана. Затем к охлажденному до +5°С раствору прикапывают раствор 3,2г продукта, полученного в стадии А выше, 0,4мл триэтиламина и 10мл 1,2дихлорэтана. Спустя примерно 1 час 20 минут нагревания, растворитель выпаривают и остаток очищают на диоксиде кремния (элюирующее средство этилацетат-циклогексан в соотношении 7:3). Получают 3,82г целевого продукта. ИК-спектр (СНСl3), см -1: 3314 (>C=NH); 2230 (CºN); 1678-1670-1876 (С=N); 1505-1495 (С=S; ароматические). Стадия В: 4-(4,4-Бис(гидроксиметил)-3-метил-5-оксо-2-тиоксо-1-имидазолидинил)-2(трифторметил)бензонитрил Вводят 3,8г продукта, полученного в стадии Б выше, в 38мл метанола и 19мл 2н соляной кислоты, затем кипятят с обратным холодильником. По истечении примерно 2 часов реакционную смесь выливают в 200мл воды и экстрагируют эфиром, затем этилацетатом. Органические фазы объединяют и промывают их водой, содержащей хлорид натрия, затем растворитель выпаривают. Остаток очищают на диоксиде кремния (элюирующее средство СН2СІ2-метанол в соотношении 95:5), затем растворяют в 30мл диизопропилового эфира при температуре кипения с обратным холодильником, отфильтровывают и частично концентрируют. Охлаждают в течение примерно 1 часа и продукт отсасывают. Получают 282мг целевого продукта (кристаллы белого цвета). Т.пл.=1б9°-170°С. Микроанализ; рассчитано, %: С 46.80, Н 3.37, Р 15.86, N 11.69, S 8.92 найдено, %: 46.8 3.3 15.9 11.5 9.0 ИК-спектр (вазелиновое масло), см -1: 3410-3385 (ОН/NН); 2240 (CºN); 1720 (С=О); 1608-1580-1568 (ароматические). УФ-спектр (этанол): максимум при 234нм S=17600 максимум при 256нм S=23200 Пример 22: 4-(4,4-Бис(1-оксопропоксиметил)-3-метил-5-оксо-2-тиоксо-1-имидазоли-динил)-2(трифторметил)бензонитрил Вводят 200мг продукта примера 21 в 2мл пиридина и 25мг 4-диметиламино-пиридина, затем добавляют 16мл пропионового ангидрида. После протекания реакции в течение 25 минут, реакционную смесь выливают в 20мл раствора бикарбоната натрия и экстрагируют метиленхлоридом, органическую фазу промывают соленой водой (водный раствор хлорида натрия), сушат, растворитель выпаривают и остаток перегоняют 3 раза с 30мл толуола. Очи щают на диоксиде кремния (элюирующее средство СН2СІ2), затем кристаллизуют из эфира и получают 239мг целевого продукта (кристаллы белого цвета). Т.пл.=117°-118°С. Микроанализ: рассчитано, %: С 50.95, Н 4.27, F 12.09, N 8.91, S 6.80 найдено, %: 51.2 4.5 12.1 8.8 6.9 ИК-спектр (СНСl3), см -1: 1755-1762 (>С=O); 2235 (CºN); 1615-1580-1504-1488 (ароматические и С=S). УФ-спектр (этанол): плечо при 236нм S=18800 максимум при 253нм S=22600 плечо при 265нм S=18200 Пример 23: 4-(4,4-Бис(фторметил)-3-метил-5-оксо-2-тиоксо-1-имидазолидинил)-2-(трифторметил)бензонитрил 1мл тетрагидрофурана охлаждают до -50°С и добавляют 0,66мл диэтиламинсульфид-трифторида, затем прикапывают охлажденный до температуры примерно -50°С раствор 360мг продукта примера 21 в 4мл тетрагидрофурана. Нагревают при температуре примерно 30°С. По истечении примерно 30 минут реакционную смесь выливают по каплям в 50мл водного насыщенного раствора бикарбоната натрия, экстрагируют хлороформом, органическую фазу промывают соленой водой (водным раствором хлорида натрия) и растворитель выпаривают. Остаток очищают на диоксиде кремния, используя в качестве элюирующего средства смесь СН 2СІ2 с циклогексаном (9:1), затем растворяют в 20мл изопропанола при температуре около 60°С. Отфильтровывают, промывают с помощью 1мл изопропанола и концентрируют, о хлаждают в течение 1 часа и продукт отсасывают. Получают 314мг целевого продукта (кристаллы белого цвета). Т.пл.=122°123°С. Микроанализ: рассчитано, %: С 46.28, Н 2.77, F 26.15, N 11.56, S 8.82 найдено, %: 46.3 2.7 25.7 11.25, 8.8 ИК-спектр (СНСl3), см -1: 2236 (CºN); 1763 (С=О); 1615-1580-1504-1487 (ароматические). УФ-спектр (этанол): плечо при 247нм S=20300 максимум при 250нм S=22000 плечо при 266нм S=17100 Пример 24: 4-(4,4-Бис(гидроксиметил)-3-метил-2,5-диоксо-1-имидазолидинил)-2-(трифторметил)бензонитрил 1) Образование простых тетрагидропирановых эфиров Вводят (в колбу) 360мг продукта примера 21 в 5мл тетрагидрофурана, 1мл 3,4-дигидро-2н-пирана и 15мг моногидрата пара-толуолсульфокислоты. Спустя примерно 40 минут приливают 10мл водного насыщенного раствора бикарбоната натрия и 1мл триэтиламина, экстрагируют хлороформом, промывают соленой водой, сушат и растворитель выпаривают. Остаток очищают на диоксиде кремния (элюирующее средство СН2СІ 2-метанол в соотношении 93:7) и получают 600мг целевого продукта, используемого таким, какой есть, в следующей стадии. 2) Переход к гидантоину Вводят 600мг полученного в п.1) простого диэфира в 4мл диметилформамида и добавляют 55мг 50%-ного гидрида натрия, затем, после прекращения выделения водорода, 0,09мл метилиодида. Спустя примерно 40 минут добавляют последовательно 110мг 50%-ного гидрида натрия, затем, спустя 10 минут, 0,18мл метилиодида. Реакционную смесь выливают в 10мл холодной воды, содержащей 1,3г монокалийфосфата, и экстрагируют эфиром. Органическую фазу промывают водным раствором хлорида натрия, сушат и растворитель выпаривают. Остаток очищают на диоксиде кремния (элюирующее средство СН 2СІ 2-этилацетат в соотношении 92,5:7,5) и получают 370мг целевого продукта, используемого таким, какой есть, в следующей стадии. 3). Удаление защитных гр упп от простых пирановых эфиров Вводят 370мг полученного выше в п.2) продукта в 4мл метанола и 2мл 2 н соляной кислоты, затем выдерживают раствор при 60°С в течение примерно 2 часов. После этого выливают в 15мл водного раствора хлорида натрия, сушат, растворитель выпаривают, затем остаток растворяют в 20мл ацетона и выпаривают досуха. Остаток очищают на диоксиде кремния (элюирующее средство СН 2СІ 2-метанол в соотношении 92,5:7,5), затем перекристаллизуют из ацетона и получают 197мг целевого продукта (кристаллы белого цвета). Т.пл.=217°-218°С. УФ-спектр (этанол): максимум при 263нм S=14600 плечо при 237, 278, 287нм Пример 25: 4-(4,4-Бис-(гидроксиметил)-3-метил-5-имино-2-тиоксо-1-имид-азолидинил)-2(трифторметил)бензонитрил Поступают как в примере 21 ив стадии В Приготовления примера 21, получают 421мг целевого продукта. ИК-спектр см-1: 2230 (CºN); 1680-1614-1580-1510 (C=N, С=S, ароматические). Пример 26: 4-(4,4-Бис-(гидроксиметил)-2,5-диоксо-1-имидазолидинил)-2-(трифторметил)бензонитрил Стадия 1: 1,3-Бис-/(тетрагидро-2Н-пиран-2-ил)окси/пропан-2-он Вводят 9г 2,5-дигидрокси-1,4-диоксан-2,5-диметанола в 60мл диоксана и суспензию нагревают в течение 15 минут при 70°С, затем доводят до комнатной температуры. После этого добавляют 20мл 3,4-дигидро-2Н-пирана и 300мг моногидрата пара-толуолсульфокислоты и поддерживают температуру около 40°С, затем оставляют на 16 часов при комнатной температуре. Тогда реакционную смесь выливают в смесь 3 00мл насыщенного раствора бикарбоната натрия + 10мл триэтиламина и экстрагируют метиленхлоридом. Органическую фазу промывают соленой водой, сушат и растворитель выпаривают. После хроматографии на диоксиде кремния (элюирующее средство этилацетат-триэтиламин в соотношении 8:2) получают 17г целевого продукта (бледно-желтого цвета сироп). ИК-спектр (СНСІ3), см -1: отсутствие полосы, характерной для ОН; 1736 (О=С). Стадия 2: 2-Амино-3-/(тетрагидро-2Н-пиран-2-ил)окси/-2-[/(тетрагидро-2Н-пиран-2ил)окси/метил]пропан-нитрил 5,6г полученного в стадии 1 выше продукта вводят в 8мл аммиака, доводят до температуры около 5°С и последовательно добавляют 1,58г хлорида аммония и 1,23г цианида натрия и в течение примерно 40 минут оставляют температур у повышаться до комнатной, затем нагревают в течение 16 часов и при перемешивании при температуре 40°С±5°С, органическую фазу промывают соленой водой, сушат и растворитель выпаривают. После хроматографии на диоксиде кремния (элюирующее средство этилацетат-триэтиламин в соотношении 3:7) получают 4,41г целевого продукта (бледно-желтого цвета сироп). ИК-спектр (СНСl3), см -1: 2235 (-CN); 3390-3317 (NH2). Стадия 3: 4- (5-Имино-2-оксо-4,4-бис-[/(тетрагидро-2Н-пиран-2-ил)окси/метил]-1-имидазолидинил)-2(трифторметил)-бензонитрил 570мг продукта, полученного в стадии 2 выше, вводят в 5мл диизопропилового эфира и 0,28мл триэтиламина и доводят до температуры -30°С, затем в течение часа добавляют 2,32г 18,4%-ного раствора продукта, полученного в Приготовлении примера 7 европейской заявки на патент 0494819, в 1,2-дихлорэтане. Добавляют 4мл метиленхлорида, затем оставляют температуру повышаться до комнатной, выдерживают около 2 часов и растворитель выпаривают. После очистки на диоксиде кремния (элюирующее средство метиленхлорид-ацетон в соотношении 9:1) получают 700мг целевого продукта. ИК-спектр (СНСl3): см -1: 3442-3317 (NН); 2235 (-СN); 1757 (С=О ); 1670 (C=N); 1614-1575-1505 (ароматические). Стадия 4: 4-(4,4-Бис-(гидроксиметил)-2,5-диоксо-1-имидазолиди-нил)-2-(трифторметил)бензонитрил 300мг продукта, полученного в стадии 3 выше, вводят в 3мл метанола и 1,5мл 2 н соляной кислоты и кипятят с обратным холодильником в течение 1,5 часов. Доводят температуру до комнатной, выливают в водный раствор бикарбоната натрия, экстрагируют этилацетатом, затем промывают водным раствором хлорида натрия, сушат и растворитель выпаривают. Добавляют 5мл метанола и очищают на диоксиде кремния (элюирующее средство метиленхлорид-метанол в соотношении 9:1). Обрабатывают в 20мл изопропанола при температуре кипения с обратным холодильником, затем концентрируют и получают 225мг целевого продукта (кристаллы белого цвета). Т.пл.=207°-208°С. ИК-спектр (вазелиновое масло), см -1: 3525-3365-3250 (ОН/NH); 2240 (СN); 1778-1738 (С=О); 16181578-1506 (ароматические). Пример 27: 4-(4,4-Бис-(фторметил)-2,5-диоксо-3-метил-1-имидазолидинил)-2-(трифторметил)бензонитрил Поступают согласно методике примера 23, используя 120мг полученного в примере 24 продукта. После хроматографии на диоксиде кремния (элюирующее средство СН2СІ2-этилацетат в соотношении 99:1) получают 111мг целевого продукта. Т.пл.=137°-138°С. ИК-спектр (СНСl3), см -1: 2235 (CºN); 1790-1735 (С=О); 1617-1580-1505 (ароматические). Пример 28: 4-(2,5-Диоксо-3-этил-4-(гидроксиметил)-4-метил-1-имидазолидинил)-2- (трифторметил)бензонитрил Поступают согласно методике примера 2, стадии 2 и 3, используя 1,033г приготовленного в стадии 1 простого тетра-гидропиранoвого эфира и 0,24мл этилиодида. После хроматографии на диоксиде кремния (элюирующее средство метиленхлоридэтилацетат) получают 0,796г целевого продукта, который перекристаллизуют из изопропанола. Т.пл.=138°С. ИК-спектр (СНСl3), см -1: 3616 (ОН); 2236 (CºN); 1779 (m) -1725 (F) (С=O); 1617-1506 (ароматические). Пример 29: 3-(2,5-Диоксо-3-этил-4-метил-4-(2-метил-1-оксопропокси)метил-1-имидазолидинил)-2(трифторметил)-бензонитрил Поступают как в примере 22, используя 280мг полученного в примере 28 продукта, 2,5мл пиридина, 23мг диметиламинопиридина и 0,16мл изомасляного ангидрида. После экстракции эфиром, удаления растворителей и хроматографии на диоксиде кремния (элюирующее средство метиленхлоридэтилацетат в соотношении 100:1), получают 321мг целевого продукта. Т.пл.=85°С. ИК-спектр (СНСl3), см -1: 2235 (CºN); 1781 (m)-1728 (F) (С=О); 1615-1575-1505 (ароматические). Пример 30: Метили 1-метилэтил-(1-(4-циано-3-(трифторметил)фенил)-2,5-диоксо-3-этил-4-метил-4имидазолидинил)-карбонат Поступают как в примере 22, используя 376мг полученного в примере 28 продукта, 3,8мл пиридина, 25мг диметиламинопиридина, добавляют при 0°С 2,2мл толуольного раствора изопропилхлорформиата (1 моль/л). После перемешивания в течение 30 минут при 0°С, затем в течение 3 часов при комнатной температуре, добавляют 0,4мл раствора изопропилхлорформиата и продолжают перемешивание при комнатной температуре в течение 2,5 часов. Выливают в 20г холодной (ледяной) воды, экстрагируют эфиром, органический раствор промывают с помощью соленой воды, сушат и растворители удаляют при пониженном давлении. Обрабатывают толуолом, концентрируют досуха, образовавшееся масло оставляют кристаллизоваться и получают 422мг сырого продукта, который хроматографируют на диоксиде кремния (элюирующее средство метиленхлорид-этилацетат в соотношении 100:2). Получают 270мг целевого продукта. Т.пл.=123°С. ИК-спектр (СНСl3), см -1: 2235 (CºN); 1782-1744-1729 (С=О); 1616-1578-1505 (ароматические). Пример 31: 4-(4,4-Бис-(гидроксиметил)-2,5-диоксо-3-(4-гидроксибутил)-1-имидазолидинил)-2-(трифторметил)бензонитрил 1). Образование простых те трагидропирановых эфиров Поступают как в примере 24, стадия 1, используя 331мг полученного в примере 26 продукта. Экстрагируют метиленхлоридом, промывают соленой водой, растворитель выпаривают и получают после хроматографии на диоксиде кремния (элюирующее средство СН2СІ2-метанол в соотношении 9:1), 500мг целевого продукта, используемого таким, какой есть, в следующей стадии. 2). Гидроксиалкилирование К 52мг гидрида натрия в течение 20 минут прикапывают 456мг вышеполученного простого диэфира в 3мл диметилсульфоксида, затем, спустя 20 минут после прекращения выделения водорода, добавляют 374мг триметилсилил-4-иод-бутанола. После протекания реакции в течение 40 минут, реакционную смесь выливают в 20мл воды, экстрагируют эфиром, органическую фазу промывают соленой водой, сушат и растворитель выпаривают. Получают 650мг сырого продукта, который используют таким, какой есть, в следующей стадии. 3). Гидролиз защитных групп 650мг вышеполученного продукта вводят в 7мл метанола и 3мл 2н соляной кислоты, затем примерно в течение 40 минут раствор выдерживают при 40°С. Смесь выливают в 20мл водного раствора бикарбоната натрия, экстрагируют этилацетатом, промывают соленой водой, сушат, растворитель выпаривают. Очищают остаток на диоксиде кремния (элюирующее средство СН2СІ2метанол в соотношении 9:1) и получают 950мг целевого продукта. УФ-спектр (этанол): максимум при 237нм S=8600 максимум при 263нм S=14000 плечо при 278нм S=8400 плечо при 287нм S=4200 Пример 32: 4-(4,4-Бис-(гидроксиметил)-2,5-диоксо-3-(2-фторэтил)-1-имидазоли-динил)-2(трифторметил)бензонитрил 1). Фторалкилирование Поступают как в примере 3, стадия а), используя в качестве исходного соединения 5г простого тетрагидропиранозого диэфира, полученного, как указано в примере 31, стадия 1), и 1,1мл 2-бром-1фторэтана. Получают 5,31г целевого продукта. 2). Гидролиз простого тетрагидропиранового эфира Поступают как в примере 3, стадия б), используя в качестве исходного вещества 550мг вышеполученного продукта, 6мл метанола и 2мл 2н соляной кислоты. После хроматографии на диоксиде кремния (элюирующее средство СН2СІ2-ацетон в соотношении 8:2) получают 351мг целевого продукта. Т.пл.=138°-139°С. ИК-спектр (вазелиновое масло), см -1: 3580-3505 (ОН/NH); 2245 (CºN); 1778-1716 (С=О); 1616-15801512 (ароматические). УФ-спектр (этанол): максимум при 260нм S=15300 плечо при 280нм S=3400 Пример 33: 4-(4,4-Бис-(фторметил)-2,5-диоксо-3-(2-фторэтил)-1-имидазолидинил)-2(трифторметил)бензонитрил 1мл тетрагидрофурана в инертной атмосфере охлаждают до -50°С и прикапывают 0,66мл диэтиламиносульфид-трифторида, затем в течение 5 минут добавляют 375мл полученного в примере 32 продукта в 4мл тетрагидрофурана. Оставляют температуру повышаться до комнатной, в течение часа выдерживают при перемешивании, выливают в водный холодный раствор бикарбоната натрия, экстрагируют хлороформом, органическую фаз у промывают соленой водой, сушат, растворитель выпаривают, хроматографи-руют остаток на диоксиде кремния (элюирующее средство СН2СІ2циклогексан в соотношении 9:1) и получают 337мг целевого продукта. Т.пл.=136°-137°С. ИК-спектр (СНСl3), см -1: 2235 ((CºN); 1787-1736 (С=О); 1617-1577-1505 (ароматические). Пример 34: 4-(4,4-Бис-(2-метил-1-оксипропокси-метил)-2,5-диоксо-3-(2-фторэтил)-1-имидазолидинил)-2(трифторметил)-бензонитрил 0,5мл изомасляного ангидрида в инертной атмосфере добавляют к раствору, содержащему 375мг полученного в примере 32 продукта, 4мл пиридина и 122мг диметиламинопиридина. Перемешивают в течение 30 минут, выливают в 20мл 50%-ного водного раствора бикарбоната натрия, сушат и растворитель выпаривают при пониженном давлении. Остаток хроматографируют на диоксиде кремния (элюирующее средство С С -этилацетат в соотношении 95:5) и получают 457мг целевого продукта. Т.пл.=71°-72°С. ИК-спектр (СНСl3), см -1: 2236 (CºN); 1789-1733 (С=О); 1616-1505 (ароматические). УФ-спектр (этанол): максимум при 257нм S=17000 плечо при 285нм S=2600 Пример 35: Бис-(1-метилэтил)- и бис-(метилен)-(3-(4-циано-3-(трифторметил)фенил)-2,4-диоксо-1-(2-фторэтил)5-имидазолидинил)-карбонат и (±)-рацемический метили 1-метилэтил-(3-(4-циано-3(трифторметил)фенил)-2,4-диоксо-1-(2-фторэтил)-5-(гидроксиметил)-5-имидазолидинил)-карбонат В атмосфере аргона 375мг полученного в примере 32 продукта в 4мл пиридина и 122мг 4диметиламинопиридина охлаждают до -4°С. При -4°С прикапывают 550мг изопропилхлорформиата. Оставляют температуру повышаться до комнатной, продолжают перемешивание в течение 2 часов. Так как реакция прошла не полностью, добавляют 122мг диметиламинопиридина и 2мл изопропилхлорформиата и нагревают в течение 18 часов при 50°С. Доводят температуру до комнатной, выливают в соленую воду, экстрагируют этилацетатом, экстракт сушат, растворители удаляют и получают 570мг сырого продукта, который очищают путем хроматографии на диоксиде кремния (элюирующее средство СН2СІ2-этилацетат в соотношении 95:5) с получением 275мг дикарбоната (т.пл.=122°-123°С), затем (элюирующее средство СН2СІ2-ацетон в соотношении 9:1) с получением 156мг монокарбоната (т.пл.=154°-155°С). Анализы Дикарбонат ИК-спектр (СНСl3), см -1: 2238 (CºN); 1789-1749-1734 (С=O); 1615-1578-1505 (ароматические). УФ-спектр (этанол): максимум при 256нм S=15400 плечо при 285нм S=2500 Монокарбонат ИК-спектр (вазелиновое масло), см -1: 3450 (ОН/NН); 2250 (CºN); 1789-1736 (С=О); 1616-1576-1506 (ароматические). Пример 36: Бис-(2-метилпропил)и бис-(метилен)-(3-(4-циано-3-(трифторметил)фенил)-2,4-диоксо-1-(2фторэтил)-5-имидазоли-динил)карбонат В атмосфере аргона 375мг полученного в примере 32 продукта в 4мл пиридина и 122мг 4диметиламинопиридина охлаждают до -4°С. При -4°С прикапывают 50мг изобутилхлорформиата. Оставляют температуру повышаться до комнатной. Спустя 40 минут реакционную среду выливают в воду, промывают водным раствором хлорида натрия, суша т и растворители удаляют, хроматографируют остаток на диоксиде кремния (элюирующее средство СН2СІ2--зтилацетат в соотношении 92,5:7,5) и получают 476мг целевого продукта. Т.пл.=109°-110°С. ИК-спектр (СНСl3), см -1: 2236 (CºN); 1790-1754-1734 (С=О); 1615-1578-1505 (ароматические). УФ-спектр (этанол): максимум при 256нм S=15500 плечо при 285нм S=2700 Пример 37. Получают таблетки, имеющие следующий состав: продукт примера 3 100мг эксципиент, достаточное количество для окончательного веса таблетки 300мг (Перечень эксципиентов: лактоза, крахмал, тальк, стеарат магния). Пример 38. Получают таблетки, имеющие следующий состав: продукт примера 26 100мг эксципиент, достаточное количество для окончательного веса таблетки 300мг (Перечень эксципиентов: лактоза, крахмал, тальк, стеарат магния). Фармакологическое изучение продуктов изобретения 1). Изучение сродства продуктов изобретения к андрогенному рецептору Самцов крыс Sprague Dawley EOPS весом 180-200г, кастрированных за 24 часа, умерщвляют, извлекают простаты, взвешивают и гомогенизируют при 0°С с помощью стеклянного гомогенизатора (un potte verre-verre), в буферном растворе (ТРИС, 10ммоль; сахароза, 0,25моль; фенилметансульфонилфторид (PMSF), 0,1моль; молибдат натрия, 20ммоль; НСl до рН=7,4;) к ним добавляют 2ммоля приготовленного перед самым употреблением DL - дитиотреитола (DTT); по 1г ткани на 8мл буфера. Гомогенизат затем ультрацентрифугир уют при 0°С в течение 30 минут при 209000g. Аликвоты полученной надосадочной жидкости (=цитозол) инкубируют в течение 30 минут и 24 часов при 0°С с постоянной концентрацией (Т) содержащего тритий тестостерона и в присутствии возрастающих концентраций (0-2500•10-9моль) либо "холодного" (нерадиоактивного) тестостерона, либо испытуемых продуктов. Концентрацию связанного, содержащего тритий тестостерона (В) затем измеряют в каждом инкубате с помощью метода адсорбции в комбинации уголь-декстран. Расчет относительного сродства к связыванию (ARL): Вычерчивают 2 следующие кривые: содержание в процентах связанного, содержащего тритий, гормона В/Т в зависимости от логарифма концентрации "холодного" стандартного гормона и В/Т в зависимости от логарифма концентрации испытуемого ч "холодного продукта. Определяют прямую уравнения: I50=(B/Tмакс.+B/Tмин.)/2, где В/Тмакс.=% содержащего тритий гормона, связанного за счет инкубации этого содержащего тритий гормона с концентрацией (Т); В/Тмин.=% содержащего тритий гормона, связанного за счет инкубации этого содержащего тритий гормона с концентрацией (Т) в присутствии большого избытка "холодного" гормона (2500×10-9моль). Пересечения прямой I50 с кривыми позволяют оценить концентрации стандартного "холодного" гормона (СН) и испытуемого "холодного" продукта (СХ), которые ингибируют 50% связывания содержащего тритий гормона с рецептором. Относительное сродство к связыванию (ARL) испытуемого продукта определяют по уравнению: ASL=100(СН)/(СХ) Получают следующие результаты, выраженные в ARL: Стандартный продукт (тестостерон): 100 Продукт примеров 3 6 26 Инкубация 24 часа 6 16 4 2). Определение андрогеннойили антиандрогенной активности продуктов изобретения с помощью количественного определения орнитин-декарбоксилазы (ОDС) Протокол обработки Самцы мышей SWISS в возрасте б недель и кастрированные за 24 часа получают перорально или подкожно испытуемые продукты (суспензия 0,5%-ная в метилцеллюлозе или в виде раствора в этаноле) одновременно с подкожной инъекцией тестостеронпропионата в количестве 3мг/кг (раствор в кукурузном масле) для определения антиандрогенной активности. Агонистическую активность определяют в отсутствие тестостеронпропионата. Тестостеронпропионат вводят в объеме 10мг/кг. Спустя 20 часов после обработок животных умерщвляют, извлекают у них почки, затем гомогенизируют при 0°С с помощью тефлоново-стеклянной дробилки в 10 объемах 50ммоль буфера ТРИС-НСl (рН=7,4), содержащего 250uМ пиридоксалфосфата, 0,1ммоль ЭДТК и 5ммоль дитиотреягола. Гомогенизат затем центрифугируют в течение 30 минут при 209000g. Принцип количественного определения При 37°С реальная орнитиндекарбоксилаза превращает изотопную смесь "холодного" орнитина и содержащего тритий орнитина в "холодный" путресцин и содержащий тритий путресцин. Путресцин затем собирают на селективные, ионообменные бумаги. После высушивания избыток содержащего тритий орнитина и "холодного", непревращенного орнитина удаляют путем 3-х промывок 0,1М раствором аммиака. Бумаги высушивают, затем, после добавления сцинтиллирующего Аквалита, подсчитывают радиоактивность. Результаты выражают в f молях (10-15моль) образовавшегося тритиированного путресцина в час и на мг протеинов. Результаты выражают в % ингибирования ОDС контрольных животных, получающих только тестостеронпропионат. Тест; продукты вводят подкожно в концентрации 1,5мг/кг в объеме 10мкл. Продукты примеров 3 6 Тест 47 84 Вывод: Вышеуказанные испытания (тесты) показывают, что подвергнутые испытаниям продукты изобретения обладают сильной антиандрогенной активностью.
ДивитисяДодаткова інформація
Назва патенту англійськоюPhenylimidasolidin derivatives, method for their synthesis (variants), pharmaceutical composition and therapeutic application
Автори англійськоюGoubet Francois
Назва патенту російськоюПроизводные фенилимидазолидинов, способ их получения (варианты), фармацевтическая композиция и ее применение в качестве лекарственного средства
Автори російськоюГубе Франсуа
МПК / Мітки
МПК: C07D 235/02, C07D 233/78, A61K 31/415
Мітки: фенілімідазолідинів, варіанти, похідні, композиція, засобів, застосування, спосіб, одержання, лікарських, фармацевтична
Код посилання
<a href="https://ua.patents.su/24-64691-pokhidni-fenilimidazolidiniv-sposib-kh-oderzhannya-varianti-farmacevtichna-kompoziciya-i-kh-zastosuvannya-yak-likarskikh-zasobiv.html" target="_blank" rel="follow" title="База патентів України">Похідні фенілімідазолідинів, спосіб їх одержання (варіанти), фармацевтична композиція і їх застосування як лікарських засобів</a>
Попередній патент: Водний розчин полімеризованого гемоглобіну (варіанти), спосіб його одержання (варіанти) та спосіб переливання
Наступний патент: Мікрохвильова інтегрована телерадіоінформаційна система (мітріс)
Випадковий патент: Установка для вакуумування рідкого металу