Адипонектин для лікування захворювань легенів
Номер патенту: 100296
Опубліковано: 10.12.2012
Автори: Охмото Ясукадзу, Кіріма Кадзуесі, Котосаі Коунорі, Ябууті Йоіті, Карасутані Кейко
Формула / Реферат
1. Засіб для інгібування збільшення повітряного простору альвеол, що включає адипонектин.
2. Засіб за п. 1, де адипонектин міститься в кількості від 0,01 до 70 % мас.
3. Засіб для інгібування деструкції стінок альвеол, що включає адипонектин.
4. Засіб за п. 3, де адипонектин міститься в кількості від 0,01 до 70 % мас.
Текст
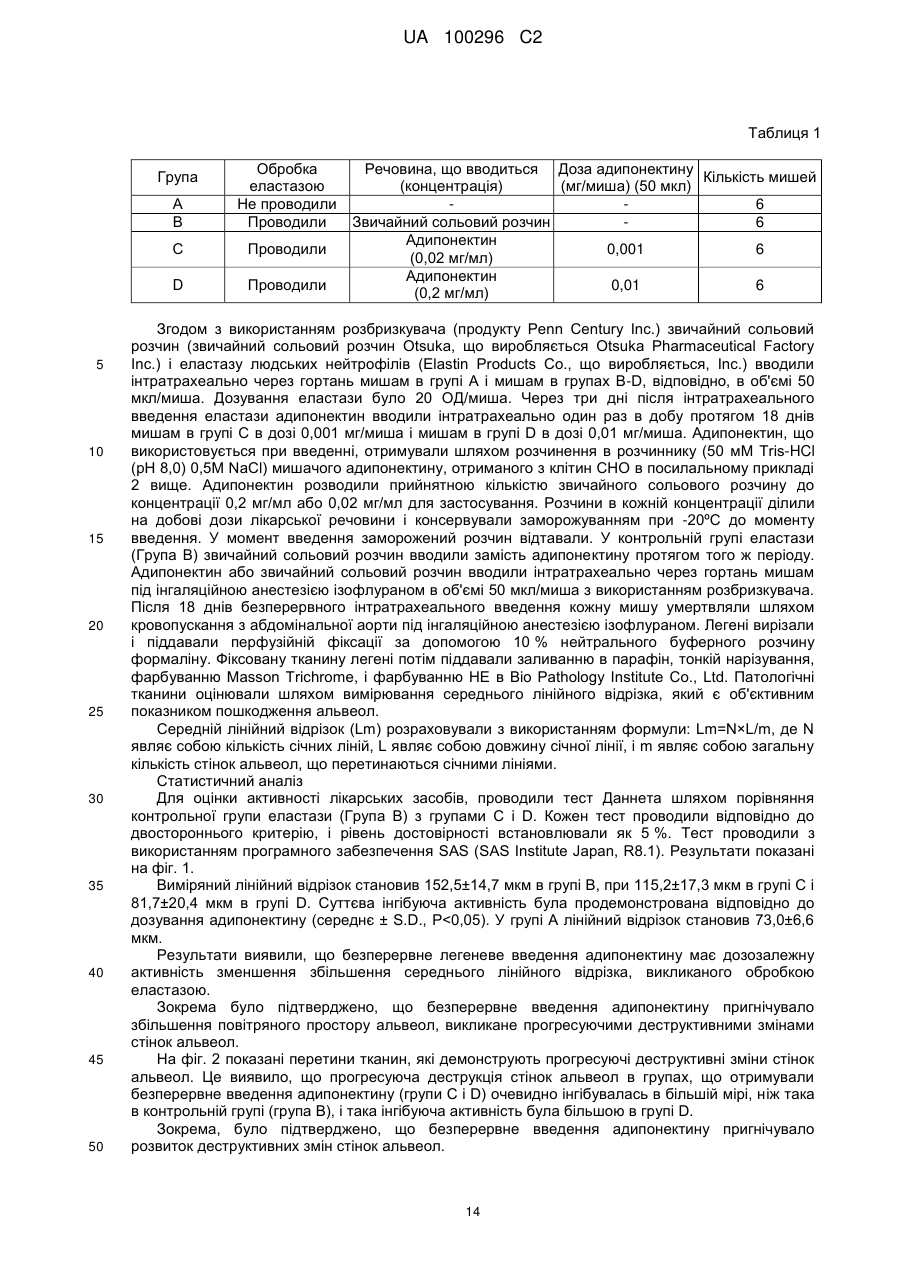
Реферат: Винахід стосується засобу для інгібування збільшення повітряного простору альвеол, що включає адипонектин, або засобу для інгібування деструкції стінок альвеол, що включає адипонектин. UA 100296 C2 (12) UA 100296 C2 UA 100296 C2 5 10 15 20 25 30 35 40 45 50 55 60 Опис Галузь техніки Даний винахід належить до засобу для лікування захворювань легенів, який інгібує патологічне збільшення повітряного простору альвеол, асоційоване з деструктивними змінами стінок альвеол, викликаними їх хронічним пошкодженням, і/або який інгібує деструктивні зміни стінок альвеол. Попередній рівень техніки винаходу Різні відомі хвороби легенів (ХЛ (PD)) включають гострий бронхіт через гостре запалення, викликане вірусами або бактеріями; бронхіальну астму, переважно, викликану запальною відповіддю дихальних шляхів через еозинофіли; інтерстиціальну пневмонію, викликану запаленням епітелію альвеол; рак легенів, викликаний раковими клітинами; і хронічні обструктивні хвороби легенів (ХОХЛ (COPD)), які відомі як захворювання, що характеризуються хронічним запаленням легенів, викликаним різними чинниками, особливо курінням, що приводять до деструкції стінок альвеол і гіпертрофії слизових залоз бронхів, що приводять до задишки, збільшення кашлю і мокроти і ін. Зокрема, захворювання, що раніше називалось емфіземою, часто ускладнює захворювання, що раніше називалося хронічним бронхітом, в різній мірі. У цей час обструктивні хвороби легенів, відносно таких двох захворювань, називають ХОХЛ. Відомо, що ХОХЛ характеризуються прогресуючим розвитком обмеження повітряного потоку (обструкції повітряного потоку) (Непатентний документ 1). На відміну від хронічного бронхіту, при якому гіперсекреція і інфекція дихальних шляхів не включають обмеження повітряного потоку, незворотне обмеження повітряного потоку розцінюють як результат патологічних змін периферичних дихальних шляхів. Такі захворювання легенів включають, на додаток до вищезазначених обструктивних хвороб легенів, що включає емфізему і хронічний бронхіт, муковісцидоз, бронхоектаз, туберкульоз, пневмоконіоз і подібні. До теперішнього часу відносно лікарської терапії захворювань легенів, включаючи ХОХЛ, що супроводжуються незворотним обмеженням повітряного потоку, лікарські препарати, такі як стимулятори β2, антихолінергічні засоби і подібні, що мають бронхорозширювальну активність, використовують для тимчасового попередження або пригнічення симптомів. Однак, такі лікарські засоби, що мають бронхорозширювальну активність, не можуть зменшувати протягом тривалого періоду часу погіршення функції легенів, що є найбільш важливим клінічним показником. У множині великих клінічних досліджень вивчали ефекти терапії з використанням як інгаляторів стероїдів, що мають сильний інгібуючий ефект на продукцію цитокінів; однак, в деяких документах повідомляють, що стероїди можуть не знижувати погіршення функції легенів протягом тривалого періоду часу (див. Непатентні документи 2-4). Відносно ефектів терапії ХЛ з використанням лікарських засобів, що мають інгібуючі ефекти на продукцію активного кисню, не було проведено надійних клінічних досліджень. Відповідно до клінічного дослідження, N-ацетилцистеїн, антиоксидант, який розцінюється як такий, що має механізм дії, схожий з таким засобів для інгібування продукції активного кисню, може знижувати частоту загострень ХОХЛ (Непатентний документ 5). Однак, ні в одному документі не повідомляють про те, що N-ацетилцистеїн виявляє ефект зменшення погіршення функції легенів протягом тривалого періоду часу. Крім того, для лікування ХЛ обговорювалося застосування лікарських засобів, інгібуючих активність фосфодіестерази IV. Однак, повідомляють, що такі лікарські засоби мають небажані побічні ефекти, такі як нудота, блювання і секреція шлункової кислоти (Непатентний документ 6). Як описано вище, не було розроблено лікарських засобів, які мають задовільний ефект як лікарський засіб для лікування хронічних хвороб легенів і які зменшують незворотне погіршення функції легенів, тобто, які інгібують патологічне збільшення повітряного простору альвеол, асоційоване з деструктивними змінами стінок альвеол через їх хронічне пошкодження і/або які інгібують деструктивні зміни стінок альвеол. Список посилань Патентна Джерела інформації: PTL 1: WO1996/39429 PTL 2: WO1999/21577 PTL 3: Японський патент № 3018186 PTL 4: Японський патент № 4147220 PTL 5: Японський нерозглянутий патент № 2004-16074 1 UA 100296 C2 5 10 15 20 25 30 35 40 45 50 55 Непатентна література NPL 1: Pauwell, R.A. et.al., Am. J. Respir. Crit. Care Med., 2001(163), 1256-1276 NPL 2: Pauwels R.A., Lodahl C.G., Laitinen L.A., Schouten J.P., Postma D.S., Pride N.B., et al. N. Engl. J. Med., l999(340), 1948-1953 NPL 3: Vestbo J., Sorensen Т., Lange Р., Brix А., Torre Р., Viskum K., Lancet, 1999(353)18191823 NPL 4: Burge PS, Calverley PM, Jones PW, Spencer S, Anderson JA, Maslen TK, BMJ, 2000(320), 1297-1303 NPL 5: З. Stey, J. Steurer, S. Bachmann, T.C. Medici, M.R. Tramer, Eur. Respir. J., 2000(16), 253-262 NPL 6: Peter J. Barnes, N. Engl. J. Med., 2000(343) No. 4, 269-280 NPL 7: Maeda, K. et al., Biocjem. Biophys. Res. Commun., 1996(221), 286-289 Суть винаходу Технічна проблема Задачею даного винаходу є забезпечення високобезпечного лікарського засоби, який є застосовним для лікування пацієнта із захворюванням легенів, чия функція легенів незворотно порушена. Розв'язання проблеми Автори даного винаходу отримали тваринну модель, яка відображає патогенетичні характеристики, клінічно дуже схожі з ХОХЛ, що супроводжуються незворотним погіршенням функції легенів, і провели обширні дослідження з використанням такої моделі на тваринах. У результаті автори виявили, що адипонектин, який відомий як колагеноподібний секреторний білок, що специфічно секретується жировими клітинами, інгібує емфізему легенів і розлади функції легенів, викликані обробкою еластазою, і виявили високобезпечний новий терапевтичний засіб, який виявляє дуже виражений ефект лікування захворювань легенів, що супроводжуються незворотним погіршенням функції легенів, з невеликою кількістю небажаних побічних ефектів, таких як нудота, блювання і секреція шлункової кислоти. Даний винахід був здійснений на основі таких відкриттів. Даний винахід забезпечує адипонектинвмісний засіб для інгібування збільшення повітряного простору альвеол і адипонектинвмісний засіб для інгібування стінок альвеол. Пункт 1. Засіб для інгібування збільшення повітряного простору альвеол, що включає адипонектин. Пункт 2. Засіб за п. 1, де адипонектин міститься в кількості, ефективній для інгібування збільшення повітряного простору альвеол, асоційованого з деструктивними змінами стінок альвеол. Пункт 3. Засіб за п. 1 або 2, де адипонектин міститься в кількості від 0,01 до 70 % мас. Пункт 4. Засіб за будь-яким з пп. 1-3, для застосування в лікуванні емфіземи, хронічного бронхіту, муковісцидозу, бронхоектазу, туберкульозу, пневмоконіозу або хронічних обструктивних хвороб легенів. Пункт 5. Засіб для інгібування деструкції стінок альвеол, що включає адипонектин. Пункт 6. Засіб за п. 5, де адипонектин міститься в кількості, ефективній для інгібування деструктивних змін стінок альвеол. Пункт 7. Засіб за будь-яким з п. 5 або 6, де адипонектин міститься в кількості від 0,01 до 70 % мас. Пункт 8. Засіб за будь-яким з пп. 5-7, для застосування для лікування емфіземи, хронічного бронхіту, муковісцидозу, бронхоектазу, туберкульозу, пневмоконіозу або хронічних обструктивних хвороб легенів. Засіб для інгібування збільшення повітряного простору альвеол за даним винаходом, що містить адипонектин в кількості, ефективній для інгібування збільшення повітряного простору альвеол, асоційованого з деструктивними змінами стінок альвеол, і засіб для інгібування деструкції стінок альвеол за даним винаходом містить адипонектин в кількості, ефективній для інгібування деструкції стінок альвеол. Адипонектин, який є активним інгредієнтом засоби для інгібування збільшення повітряного простору альвеол або засоби для інгібування деструкції стінок альвеол за даним винаходом, являє собою колагеноподібний білок, що секретується жировими клітинами. Адипонектин, який є інгредієнтом засоби для інгібування збільшення повітряного простору альвеол або засоби для інгібування деструкції стінок альвеол (що далі в даному описі скорочується як "засоби для лікування хвороб легенів") за даним винаходом, є легко доступною і добре відомою речовиною. Комерційно доступний адипонектин або адипонектин, отриманий 2 UA 100296 C2 5 10 15 20 25 30 35 40 45 50 55 відомим способом, показаним в довідковому прикладі, описаному пізніше, може бути звичайно використаний у винаході. Гени адипонектину людини і миші описані в Патентному документі 1, як людський Acrp30 і мишачий Acrp30, і людський адипонектин описаний як apM1 в непатентному документі 7 і Патентному документі 2. Передбачуваний послідовність амінокислот поліпептиду адипонектину, що використовується в засобах для лікування хвороб легенів за даним винаходом як активний інгредієнт, описана в Патентному документі 2; однак, Патентний документ 2 належить єдино до інгібуючого ефекту поліпептиду на ріст гладком'язових клітин і його доступність як засібу для запобігання або поліпшення атеросклерозу, засоби для запобігання або лікування рестенозу після ангіопластики і протизапального засоби. Крім того, Патентний документ 3 показує застосовність адипонектину, який пригнічує, без макрофагів або лімфоцитів, клональний росту відносно зрілих моноцитарних клітинпопередників в стадії диференціювання, як протизапальний засіб і супресор відтворювання моноцитарних клітин. Більше того, Патентний документ 4 вказує, що С-кінцевий бічний сферичний домен адипонектину (що відповідає послідовності амінокислот SEQ ID NO: 114-239 людського адипонектину, і послідовностям амінокислот SEQ ID NO: 111-242 мишачого адипонектину) має ефект зниження експресії фагоцитарного рецептора А і може бути використаний як профілактичний і терапевтичний засіб при атеросклерозі. Схожим чином Патентний документ 5 належить до доступності С-кінцевого бічного сферичного домену адипонектину як активатора АМФ-активованої протеїнкінази. Наступний адипонектин є комерційно доступним від Bio Vendor (Czechoslovakia; http://www.biovendor.com/products/proteins): глобулярний рекомбінантний адипонектин (Adiponectine Globular Human (E. coli)), рекомбінантний адипонектин, продукований Е. coli (Adiponectine Human E. coli His), рекомбінантний адипонектин, продукований людськими ембріональними клітинами нирок (Adiponectine Human HEK293 Flag), тримірний рекомбінантний адипонектин, продукований людськими ембріональними клітинами нирок (Adiponectine Human Trimeric form (HEK)), низько- і високомолекулярний адипонектин, продукований людськими ембріональними клітинами нирок (Adiponectine LMW і MMW oligomer-rich Human (HEK)), середньо- і високомолекулярний адипонектин, продукований людськими ембріональними клітинами нирок (Adiponectine MMW і HMW oligomer-rich Human (HEK)), і ін. Специфічним прикладом поліпептиду, що використовується в засобах для лікування хвороб легенів за даним винаходом як активний інгредієнт, є поліпептид, відомий як "адипонектин", що кодується продуктом ПЛР і показаний в прикладах, описаних пізніше. Повнорозмірна послідовність ДНК людського адипонектину має 4517 п. н. в довжину, і послідовність ДНК, що кодує відкриту рамку зчитування (ORF), має 732 п. н. в довжину, як показано в SEQ ID NO: 2. Послідовність амінокислот, що кодує ORF, складається з послідовності 244 амінокислот, як показано в SEQ ID NO: 1, і послідовність гена зареєстрована як GenBank номер по каталогу NM_004797. Крім того, повнорозмірна послідовність ДНК мишачого адипонектину має 1276 п. н. в довжину, як показано в SEQ ID NO: 5, і послідовність ДНК, що кодує ORF, має 741 п. н. в довжину, як показано в SEQ ID NO: 4. Послідовність амінокислот, що кодує ORF, складається з послідовності 247 амінокислот, як показано в SEQ ID NO: 3, і послідовність гена зареєстрована як GenBank номер по каталогу AF304466. Більше того, була встановлена експресія гена людського і мишачого адипонектину, специфічна для жирової тканини. Гомологія послідовності амінокислот між людським адипонектином і мишачим адипонектином становить 83,61 %, і гомологія послідовності ДНК ORF становить 79,78 %. Такий помітно високий рівень гомології вказує, що обидва мають однакову активність. Автори даного винаходу виявили, що адипонектин інгібує патологічне збільшення повітряного простору альвеол, асоційоване з деструктивними змінами стінок альвеол через хронічне пошкодження або виявляє поліпшення функції легенів, що досягаються шляхом інгібування деструктивних змін стінок альвеол, і автори зробили висновок, що адипонектин може, переважно, використовуватися як лікарський засіб. Як описано вище, оскільки адипонектин може інгібувати патологічне збільшення повітряного простору альвеол, асоційоване з деструктивними змінами стінок альвеол через хронічне пошкодження, він може бути використаний для лікування хвороб легенів, таких як емфізема, хронічний бронхіт, муковісцидоз, бронхоектази, туберкульоз, пневмоконіоз і ХОХЛ. Патентний документ 1: WO1996/39429 Патентний документ 2: WO1999/21577 Непатентний документ 7: Maeda, K. et al., B.B.R.C., (1996) Vol. 221 No.2, pp286-289 3 UA 100296 C2 5 10 15 20 25 30 35 40 45 50 55 Далі описане отримання адипонектину для використання як активного інгредієнта засобів для лікування хвороб легенів по винаходу, отримання засобів для лікування хвороб легенів з використанням адипонектину як активного інгредієнта, і ін. Позначення амінокислот, пептидів, послідовностей нуклеотидів, нуклеїнових кислот і ін. за допомогою скорочень в даний специфікації відповідають правилам номенклатури, рекомендованої IUPAC-IUB (IUPAC-IUB Communication on Biological Nomenclature, Eur. J. Biochem., 138, 9(1984)), "The Guidelines for Drafting of Specifications Etc. Containing Nucleotide Sequence or Amino Acid Sequence Information" (Edited by the Japanese Patent Office, (July, 1998) і конвенціям у відповідній галузі техніки.) Адипонектин може бути представлений в формі рекомбінантного білка, отриманого шляхом встановлених генно-інженерних методик [наприклад, Science, 224, 1431(1984): Biochem. Biophys. Res. Comm., 130, 692(1985); Proc. Natl. Acad. Sci., USA., 80, 5990 (1983)]. У такому випадку як ген адипонектину (apM1) може бути використаний ген, який був раніше встановлений авторами даного винаходу [Biochem. Biophys. Res. Commun., 221, 286-289 (1996)]. Як альтернатива, адипонектин може бути отриманий звичайним способом хімічного синтезу відповідно до інформації про послідовність амінокислот, що кодується вказаним геном. Отримання адипонектину за допомогою генно-інженерних методик може бути проведене відповідно до способу, описаному в посилальному прикладі 1 нижче. Зокрема, отримання включає створення рекомбінантної ДНК, з якою ген, що кодує білок по винаходу, може бути експресований в клітині-хазяї, введення ДНК в клітину-хазяя для отримання трансформанту і культивування трансформанту. У описі полінуклеотид (молекула ДНК) охоплює не тільки дволанцюжкову ДНК, але також одноланцюжкову ДНК, включаючи смислові послідовності або антисмислові послідовності, які їх складають, і не обмежується їх довжиною. Отже, полінуклеотид, що кодує адипонектин, включає дволанцюжкову ДНК і одноланцюжкову ДНК (смисловий ланцюг), включаючи кДНК, і одноланцюжкову ДНК (антисмисловий ланцюг), що має послідовність, комплементарну смисловому ланцюгу, і синтетичні фрагменти ДНК, якщо не згадано інакше. Полінуклеотид (молекула ДНК) в даному описі не визначається функціональною ділянкою і може включати щонайменше одну ділянку пригнічення експресії, кодуючу ділянку, лідерпослідовність, екзон і інтрон. Полінуклеотид також включає РНК і ДНК. Полінуклеотид, що включає певну послідовність амінокислот, і полінуклеотид, що включає певну послідовність ДНК, включає її фрагменти, гомологи, похідні і мутації. Мутанти полінуклеотиду (мутантні ДНК) включають природні алельні мутанти, неприродні мутанти і мутанти, що мають делеції, заміни, додавання і вставки. Але такі мутанти кодують поліпептид, що має по суті ту ж функцію, як функція поліпептиду, що кодується полінуклеотидом до мутації. Мутація поліпептиду (модифікація послідовності амінокислот) необов'язково виникає природно, наприклад, мутація або посттрансляційна модифікація, і можуть бути такими, штучно зробленими шляхом використання натурального білка (наприклад, людського адипонектину). Вищезгадані мутанти поліпептиду включають алельні варіанти, гомологи і натуральні мутанти, що мають щонайменше 80 %, переважно, 95 % і, більш переважно, 99 % гомологію з поліпептидом до мутації. Гомологія поліпептиду або полінуклеотиду може бути проаналізована шляхом оцінки з використанням програми FASTA (Clustal, V., Methods MoI. Biol., 25, 307-318 (1994)). Як найбільш переважний і простий метод для аналізу гомології можливо проілюструвати метод, в якому послідовність зберігається на носії (наприклад, гнучкому диску, CD-ROM, жорсткому диску, зовнішньому диску, DVD, і ін.), здатному до зчитування комп'ютером, і потім її шукають у відомій базі даних послідовностей відповідно до добре відомої методики пошуку з використанням послідовності, що зберігається. Специфічні приклади відомих баз даних послідовностей включають наступні: база даних ДНК Японії (DDBJ) (http://www.ddbj.nig.ac.jp/); Genebank (http://www.ncbi.nlm.nih.gov/web/Genebank/Index.htlm); і - База даних послідовностей нуклеїнових кислот Європейської лабораторії молекулярної біології (EMBL) (http://www.ebi.ac.uk/ebi docs/embl db.html). Множина алгоритмів пошуку для аналізу гомології доступні фахівцеві в галузі техніки. Один приклад включає програму, що називається програмою BLAST. Існує 5 методик BLAST в цій програмі. Серед них три (BLASTN, BLASTX і TBLASTX) були створені для перевірки послідовності нуклеотидів. Дві, що залишилися, були створені для перевірки послідовності білка 4 UA 100296 C2 5 (Coulson, Trends in Biotechnology, 12:76-80(1994); Birren, et al., Genome Analysis, 1:543559(1997)). Крім того, додаткові програми, наприклад, програма вирівнювання послідовності і програма для ідентифікації послідовностей, більш дистанційно розділених, доступні в галузі техніки для аналізу ідентифікованої послідовності. Мутантна ДНК є такою, що мовчить, (відсутність змін залишків амінокислот, що кодуються мутантною послідовністю амінокислот) або консервативною для амінокислот, що кодуються нею. Приклади консервативних замін амінокислот показані нижче. Вихідний залишок амінокислоти Ala Arg Asn Asp Cys Gln Glu Gly His Ile Leu Lys Met Phe Ser Thr Trp Tyr Val Консервативно заміщений залишок амінокислоти Ser Lys Gln або His Glu Ser Asn Asp Pro Asn або Gln Leu або Val Ile або Val Arg, Asn або Glu Leu або Ile Met, Leu або Tyr Thr Ser Tyr Trp або Phe Ile або Leu 10 15 20 25 30 35 Звичайно один або більше кодонів, що кодують залишок Cys, впливає на дисульфідний зв'язок певного поліпептиду. Звичайно вважають, що заміна залишку амінокислоти, що впливає на характеристики білка, включає наступні: a) заміна гідрофобного залишку гідрофільним залишком, наприклад, заміна Leu, Ile, Phe, Val або Ala за допомогою Ser або Thr; b) заміна залишку амінокислоти, інших ніж Cys і Pro, за допомогою Cys або Pro; c) заміна залишку, що має електрично позитивний бічний ланцюг, наприклад, Lys, Arg або His, за допомогою електрично негативного залишку, наприклад, Glu або Asp; і d) заміна залишку амінокислот, що має надто великий бічний ланцюг, наприклад, Phe, за допомогою залишку амінокислоти, що не має бічного ланцюга, наприклад, Gly. Адипонектин включає послідовність амінокислот SEQ ID NO:1 або 3 або послідовність амінокислот, що має одну або більше делецій, вставок, замін або додавань амінокислот в послідовності амінокислот SEQ ID NO:1 або 3, і має активність інгібування збільшення повітряного простору альвеол і/або ефект поліпшення функції легенів. Адипонектин може бути поліпептидом, експресованим в системі експресії білка з використанням Escherichia coli або системі експресії білка з використанням бакуловіруса (AcNPV), показаній в прикладах, описаних пізніше за допомогою генно-рекомбінантної методики, або поліпептидом, отриманим хімічним синтезом. Як один специфічний приклад послідовності амінокислот адипонектину можливо проілюструвати одну з SEQ ID NO:1 або 3. Послідовність амінокислот адипонектину не обмежена однією з SEQ ID NO:1 або 3 і може бути такою (гомологічною), маючої певну гомологію з нею. Гомологічні послідовності можуть включати поліпептиди, що включають послідовність амінокислот, що мають одну або більше делецій, вставок, замін або додавань амінокислот в послідовності амінокислот SEQ ID NO:1 або 3 і що мають активність інгібування збільшення повітряного простору альвеол і/або активність інгібування деструкції стінок альвеол і ефект поліпшення функції легенів (активність інгібування патологічного збільшення повітряного простору альвеол, асоційованого з деструктивними змінами стінок альвеол через хронічне пошкодження, і/або активність інгібування деструктивних змін стінок альвеол). 5 UA 100296 C2 5 10 15 20 25 30 35 40 45 50 55 Специфічно, ефекти поліпшення функції легенів адипонектину включають ефект поліпшення або зменшення зниження дихальної здатності легенів, або збільшення опору диханню в дихальному тракті (особливо бронхоальвеолярному тракті) ссавців, таких як людина. Як клітини-хазяї можуть бути використані клітини, отримані від еукаріот і прокаріот. Еукаріотні клітини включають клітини хребетних і клітини еукаріотних мікроорганізмів. Як клітини хребетних часто використовують клітинну лінію мавп COS (Cell, 23, 175 (1981)), клітинну лінію клітин яєчника китайського хом'ячка і відповідну клітинну лінію, дефіцитну по дигідрофолатредуктазі (Proc. Natl. Acad. Sci., USA., 77, 4216 (1980)) і подібні, але вони не є єдиним вибором. Як вектор експресії хребетного походження звичайно може використовуватися вектор, що має послідовність промотору, розташовану нижче в експресованому гені, ділянка сплайсингу РНК (попередник), ділянка поліаденілування і послідовність термінування транскрипції. Якщо необхідно, вектор може додатково мати реплікаційне походження. Як приклад такого вектора експресії може бути згаданий pSV2dhfr, що містить ранній промотор SV40 (Mol. Cell. Biol., 1, 854 (1981)). Як еукаріотніх мікроорганізми звичайно використовують дріжджі. З них з перевагою можуть бути використані дріжджі роду Saccharomyces. Як вектор експресії, отриманий від еукаріотних мікроорганізмів, таких як дріжджі, може бути використаний pAM82, що має промотор для гена кислої фосфатази (Proc. Natl. Acad. Sci., USA., 80, 1 (1983)). Як прокаріотний організм-хазяїн звичайно використовують Escherichia coli і Bacillus subtilis. Коли їх використовують як організми-хазяї з використанням плазмідного вектора, здатного реплікуватися в мікроорганізмі-хазяї, можливо прийнятним чином використати плазміду експресії, отриману шляхом включення послідовності промотору і SD (Shain і Dalgarano) і кодона ініціація (наприклад, ATG), необхідного для ініціація синтезу білка вище за ген, так, що ген може експресуватися в такому векторі. Як указано, Escherichia coli як організм-хазяїн звичайно використовують Е. coli K12, і як вектор звичайно використовують pBR322 або його модифікований продукт. Однак вони не є єдиним вибором, а також можуть використовуватися різні відомі бактерійні штами і вектори. Прикладами промотору, які можуть бути використані, є триптофановий промотор (trp), lpp промотор, lac промотор і PL/PR промотор. Як вектор для клітин комах можливо проілюструвати бакуловірусний вектор (Takara), в який включена кДНК адипонектину. Зокрема, продукт експресії за даним винаходом може бути отриманий шляхом введення бакуловірусного вектора експресії, в який включена кДНК адипонектину, в культивовані клітини BmN4 або гусениці шовкопряда (Bombyx mori) з використанням ядерного вірусу полігедрозу (BmNPV) шовкопряда для експресії і виділення з культурального середовища або рідини тіла шовкопряда шляхом хроматографії. Експресований продукт за даним винаходом також може бути отриманий шляхом включення кДНК адипонектину в ядерний вірус полігедрозу (AcNPV) Autographa californica, експресований в клітинах Sf9 Spodoptera frugiperda або клітинах Tn5 Trichoplusia ni, і іншим чином очищення з надосадової культуральної рідини шляхом хроматографії. Введення отриманої рекомбінантної ДНК в клітину-хазяїна для трансформації може провестися відповідно до відомого способу. Отриманий трансформант може культивуватися відповідно до стандартних методів, за допомогою чого рекомбінантний білок по винаходу експресується і продукується (нагромаджується і секретується) внутрішньоклітинно, позаклітинно або на мембрані клітин. Як середовище, що використовується для культивування, різні середовища, що звичайно використовуються, можуть бути відповідним чином вибрані і використані відповідно до тієї, що використовується клітиною-хазяїнем. Культивування також може провестися в інших умовах, прийнятних для росту клітин-хазяїв. Якщо необхідно, адипонектин, отриманий вищезгаданим способом, може бути виділений і очищений різними процедурами розділення з використанням його фізичних, хімічних і інших характеристик (Biochemical Data Book II, 1175-1259, First Edition, 1st impression, Jun. 23, 1980, published by Tokyo Kagaku Dojin, K.K.; Biochemistry, 25 (25), 8274 (1986); Eur. J. Biochem., 163, 313 (1987), etc.). Зокрема, вказане виділення і очищення можуть бути досягнуті шляхом звичайного відновлення, обробки за допомогою засоби, осаджувального білка (висолювання), центрифугування, методу шоку осмотичного тиску, обробки ультразвуком, ультрафільтрації, різними типами рідинної хроматографії, такими як хроматографія з молекулярним ситом (гельфільтрація), адсорбційна хроматографія, іонообмінна хроматографія, афінна хроматографія, високоефективна рідинна хроматографія (ВЕРХ), і ін., і діалізом, при використанні окремо або в комбінації. 6 UA 100296 C2 5 10 15 20 25 30 35 40 45 50 55 60 Альтернативно адипонектин, згаданий вище, також може бути отриманий звичайним методом хімічного синтезу, основаним на інформації про послідовність амінокислот. Спосіб включає звичайні рідкофазні і твердофазні методи пептидного синтезу. Більш детально, кожен з таких способів включає так звану методику покрокової елонгації, яка включає конденсацію компонентів амінокислот одна після іншого для подовження ланцюга відповідно до інформації про послідовність амінокислот, і методику конденсації фрагмента, яка включає попередній синтез фрагментів пептидів, що кожен складається з декількох залишків амінокислот і зв'язування їх разом один з одним відповідно до вказаної інформації. Метод конденсації, що використовується для пептидного синтезу, також може проводитися відповідно до стандартних методів. Приклади стандартних методів включають азидний метод, метод змішаного кислого ангідриду, метод DCC, метод активного ефіру, метод окиснення і відновлення, метод DPPA (дифенілфосфорилазиду), метод DDC + добавки (1гідроксибензотриазол, N-гідроксисукцинамід, N-гідрокси-5-норборнен-2,3-дикарбоксіімід) і метод Вудворта. Розчинник, який може бути використаний в таких методах, може бути відповідно вибраний з розчинників, які добре відомі як конденсації, що використовуються в реакціях з утворенням пептидів. Їх приклади включають N, N-диметилформамід (DMF), диметилсульфоксид (DMSO), гексафосфорамід, діоксан, тетрагідрофуран (THF), етилацетат, і ін., і їх суміші. Під час вищезгаданої реакції пептидного синтезу амінокислота не включається в реакцію або карбоксильна група в пептиді може бути захищена як складний ефір нижчого алкілу, такий як метиловий ефір, етиловий ефір і трет-бутиловий ефір, і складний аралкіловий ефір, такий як бензиловий ефір, п-метоксибензиловий ефір і п-нітробензиловий ефір, звичайно шляхом етерифікації. Гідроксильна група в амінокислоті, такій як залишок тирозину, що має функціональну групу в бічному ланцюгу, може бути захищена ацетилом, бензилом, бензилоксикарбонілом, третбутилом або подібним, хоча такий захист не є обов'язково необхідним. Більше того, гуанідинова група аргінінового залишку може бути захищена відповідною групою, такою як нітро, тозил, п-метоксибензолсульфоніл, метилен-2-сульфоніл, бензилоксикарбоніл, ізоборнілоксикарбоніл або адамантилоксикарбоніл. Реакції для видалення таких захисних груп із захищених амінокислот або пептидів або з кінцевого білка можуть проводитися відповідно до способів, що звичайно використовуються, таких як метод каталізованої реакції або метод з використанням рідкого амонію/металу натрію, фтороводню, бромоводню, соляної кислоти, трифтороцтової кислоти, оцтової кислоти, мурашиної кислоти або метансульфонової кислоти і подібного. Отриманим таким чином адипонектин може бути обчищений різними методами, такими як методи з використанням іонообмінної смоли, розподільна хроматографія і гель-хроматографія, і метод протиточного розподілу, що звичайно використовується в галузі пептидної хімії. Засоби для лікування хвороб легенів за даним винаходом включають адипонектин або його фармацевтично прийнятну сіль як активний інгредієнт. Солі включають такі з лужними металами, лужноземельними металами і амонієм, такі як солі натрію, калію, літію, кальцію, магнію, барію і амонію. Такі солі можуть бути отримані способами, добре відомими в галузі техніки. Вищезазначені солі включають адитивні солі кислот, які можуть бути отримані шляхом реакції адипонектину з прийнятною органічною або неорганічною кислотою звичайним відомим методом. Прикладами адитивних солей кислот є гідрохлорид, гідробромід, сульфат, бісульфат, ацетат, оксалат, валерат, олеат, лаурат, борат, бензоат, лактат, фосфат, п-толуолсульфонат (тозилат), цитрат, малеат, фумарат, сукцинат, тартрат, сульфонат, гліколат, аскорбат, бензолсульфонат, напсилат і подібні солі. Засоби для лікування хвороб легенів по винаходу звичайно забезпечують і застосовують в формі фармацевтичного препарату, що містить фармакологічно ефективну кількість активного інгредієнта разом з відповідним фармацевтичним носієм. Носій, який може бути використаний в таких фармацевтичних препаратах, включає різні розріджувачі і/або допоміжні речовини, такі як наповнювачі, розріджувачі, в'яжучі засоби, зволожувачі, дезінтегруючі засоби, поверхнево-активні речовини, змащувальні засоби і подібні. Такі носії необов'язково використовують відповідно до стандартної лікарської форми кінцевої композиції. Стандартні лікарські форми фармацевтичних препаратів можуть бути вибрані з різних форм відповідно до мети терапії. Типові приклади включають тверді форми, такі як таблетки, пілюлі, порошки, тонкоподрібнені порошки, гранули і капсул, і рідких форм, такі як розчини, суспензії, емульсії, сиропи і еліксири. Такі препарати класифікують по шляху введення на пероральні препарати, парентеральні препарати, трансназальні препарати, вагінальні препарати, ректальні 7 UA 100296 C2 5 10 15 20 25 30 35 40 45 50 55 препарати, сублінгвальні таблетки, мазі і подібні, і кожна може бути рецептована і пресована або іншим чином оброблена за допомогою встановлених фармацевтичних методик. Більше того, такі фармацевтичні препарати можуть містити різні добавки, які можуть бути рецептовані в звичайних фармацевтичних препаратах, такі як стабілізатори, антибактеріальні засоби, буферні речовини, ізотонічні засоби, комплексоутворювальні засоби, засоби, регулюючі рН, і поверхнево-активні речовини. Стабілізатор включає людський альбумін сироватки і L-амінокислоти, сахариди і похідні целюлози. Вони можуть бути використані кожен окремо або в комбінації з поверхнево-активною речовиною або подібними. Зокрема, така комбінація може брати участь в посиленні стабільності активного інгредієнта. L-амінокислоти особливо не обмежені і включають гліцин, цистеїн, глютамінову кислоту і ін. Сахариди особливо не обмежені, але включають моносахариди, такі як глюкоза, маноза, галактоза і фруктоза; цукрові спирти, такі як маніт, інозит і ксиліт; дисахариди, такі як сахароза, мальтоза і лактоза; і полісахариди, такі як декстран, гідроксипропілкрохмаль, хондроїтинсульфат і гіалуронова кислота і їх похідні. Поверхнево-активні речовини особливо не обмежені і можуть бути використані і іонні і неіонні поверхнево-активні речовини. Прикладами поверхнево-активних речовин є алкільні ефіри поліоксіетиленглікольсорбітану, алкільні ефіри поліоксіетилену, моноацилові ефіри сорбітану і гліцериди жирних кислот. Похідні целюлози особливо не обмежується, але включає метилцелюлозу, етилцелюлозу, гідроксіетилцелюлозу, гідроксипропілцелюлозу, гідроксипропілметилцелюлозу, карбоксиметилцелюлозу натрію і ін. Сахариди можуть бути використані в кількості щонайменше близько 0,0001 мг, і, переважно, в діапазоні від близько 0,01 до близько 10 мг на 1 мкг активного інгредієнта. Поверхнево-активні речовини можуть бути використані в кількості щонайменше близько 0,00001 мг, і, переважно, в діапазоні від близько 0,0001 до близько 0,01 мг на 1 мкг активного інгредієнта. Людський альбумін сироватки може бути використаний в кількості щонайменше близько 0,0001 мг, і, переважно, в діапазоні від близько 0,001 до близько 0,1 мг на 1 мкг активного інгредієнта. Амінокислоти можуть бути використані в кількості в діапазоні від близько 0,001 до близько 10 мг на 1 мкг активного інгредієнта. Похідні целюлози можуть бути використані в кількості щонайменше близько 0,00001 мг, і, переважно, в діапазоні від близько 0,001 до близько 0,1 мг на 1 мкг активного інгредієнта. Кількість активного інгредієнта, що міститься в фармацевтичних препаратах за даним винаходом, може бути відповідним чином вибрана з широкого діапазону. Прийнятно, коли кількість активного інгредієнта складає звичайно від близько 0,00001 до близько 70 % мас, і, переважно, від близько 0,0001 до близько 5 % мас. Буферна речовина, яка може бути необов'язково включене в фармацевтичні препарати, включає борну кислоту, фосфорну кислоту, оцтову кислоту, лимонну кислоту, -амінокапронову кислоту, глутамінову кислоту і відповідні солі (наприклад, солі з лужними металами або лужноземельними металами, такі як солі натрію, калію, кальцію і магнію). Ізотонічні засоби включають хлорид натрію, хлорид калію, цукор і гліцерин. Комплексоутворювальні засоби включають едетат натрію і лимонну кислоту. Фармацевтичні препарати по винаходу можуть бути отримані як рідкі препарати і додатково можуть бути перетворені в ліофілізовані лікарські форми, отримані ліофілізацією фармацевтичної композиції, яку отримують у відповідній концентрації для використання шляхом розчинення в сольовому розчині, що містить буферну речовину. При пресуванні фармацевтичної композиції по винаходу в форму таблетки можуть бути використані як носій різні допоміжні речовини, такі як лактоза, сахароза, хлорид натрію, глюкоза, сечовина, крохмаль, карбонат кальцію, каолін, кристалічна целюлоза, кремнієва кислота і фосфат калію; в'яжучі речовини, такі як вода, етанол, пропанол, простий сироп, розчин глюкози, розчин крохмалю, розчин желатину, карбоксиметилцелюлоза, гідроксипропілцелюлоза, метилцелюлоза і полівінілпіролідон; дезінтегруючі засоби, такі як натрійкарбоксиметилцелюлоза, кальцій-карбоксиметилцелюлоза, гідроксипропілцелююлоза з низьким ступенем заміщення, сухий крохмаль, альгінат натрію, порошок агару, порошок ламінарії, гідрокарбонат натрію і карбонат кальцію; поверхнево-активні речовини, такі як складний ефір поліоксіетиленсорбітану і жирних кислот, лаурилсульфат натрію і стеарилмоногліцерид; інгібітори дезінтеграції, такі як сахароза, стеарин, олія какао і гідрогенізована олія; підсилювачі абсорбції, такі як четвертинні основи амонію і лаурилсульфат натрію; зволожувачі, такі як гліцерин і крохмаль; адсорбенти, такі як крохмаль, лактоза, каолін, бентоніт і колоїдна кремнієва 8 UA 100296 C2 5 10 15 20 25 30 35 40 45 50 55 60 кислота; і змащувальні засоби, такі як очищений тальк, солі стеаринової кислоти, порошок борної кислоти і поліетиленгліколь. Більше того, якщо необхідно, отримані таблетки можуть бути покриті оболонкою за допомогою звичайних матеріалів оболонки для отримання таблеток, покритих цукром, таблеток, покритих желатином, кишковорозчинних таблеток, таблеток, покритих плівкою, або дво- або багатошарових таблеток. Пілюлі можуть бути отримані з використанням як носія допоміжних речовин, таких як глюкоза, лактоза, крохмаль, олія какао, гідрогенізована рослинна олія, каолін і тальк; в'яжучих речовин, таких як порошок гуміарабік, порошок трагакантової камеді, желатин і етанол, і дезінтегруючих засобів, таких як ламінарія і агар. Загалом, капсули можуть бути отримані шляхом змішування активного інгредієнта з вищезазначеними носіями відповідно до звичайного способу для вміщення останнього в тверді желатинові капсули або подібні. Рідкі препарати для перорального введення включають розчини, емульсії, суспензії, сиропи і еліксири. Кожен може бути отриманий з використанням звичайного інертного розріджувача, наприклад, фармакологічно прийнятного носія, що включає воду. Рідкий препарат може також бути доповнений різними допоміжними засобами, такими як зволожуючий засіб, емульгатор і/або суспендуючий засіб, і може бути отриманий встановленою методикою. Рідкий препарат для парентерального введення, наприклад, стерильний водний або неводний розчин, емульсія або суспензія, може бути отриманий з використанням розріджувача, такого як вода, етиловий спирт, пропіленгліколь, поліетиленгліколь, етоксилований ізостеариловий спирт, поліоксилований ізостеариловий спирт, поліетоксиловані складні ефіри сорбітану і жирних кислот і рослинні олії, такі як оливкова олія. Рідкий препарат може бути доповнений органічним ефіром, який може бути введений за допомогою ін'єкції або інфузії, такого як етилолеат. Такі препарати можуть бути також доповнені розчинником, буферною речовиною, зволожуючим засобом, емульгатором, суспендуючим засобом, консервантом, диспергуючим засобом і іншими добавками. Такі фармацевтичні препарати можуть бути стерилізовані шляхом фільтрації через бактеріальний фільтр, включенням бактерициду, променевою обробкою, тепловою обробкою або подібним. Більше того, такі фармацевтичні препарати можуть, кожен, бути забезпечені в формі стерильної твердої композиції, яка може бути розчинена в стерилізованій воді або прийнятному середовищі, що стерилізується для безпосередньої стерилізації перед застосуванням. Ректальні супозиторії і вагінальні препарати можуть бути отримані з використанням носіїв, таких як поліетиленгліколь, олія какао, вищі спирти, складні ефіри вищих спиртів, желатин і напівсинтетичний гліцерид. Мазі, такі як пасти, креми і гелі, можуть бути отримані з використанням такого розріджувача або розріджувачів, як білий вазелін, парафін, гліцерин, похідні целюлози, пропіленгліколь, поліетиленгліколь, кремнійорганічні речовини, бентоніт і рослинні олії, такі як оливкова олія. Фармацевтичні препарати для трансназального або сублінгвального введення можуть бути отримані з використанням добре відомої допоміжної речовини або речовин звичайним чином. Більше того, якщо необхідно, фармацевтичні препарати по винаходу можуть бути доповнені барвниками, консервантами, ароматизаторами, підсолоджувачами або іншими фармацевтичними композиціями. Спосіб введення фармацевтичного препарату не обмежений, але його вибирають відповідно до лікарської форми, віку, статі і інших станів пацієнта і стану захворювання. Наприклад, таблетки, пілюлі, розчини, суспензії, емульсії, гранули і капсули вводять перорально. Ін'єкції вводять внутрішньовенно або окремо або в суміші із звичайним інфузійним розчином, таким як глюкоза і амінокислота, і якщо необхідно, вводять окремо внутрішньом'язово, внутрішньошкірно, підшкірно або інтраперитонеально. Супозиторії вводять інтраректально. Вагінальні препарати вводять у піхву, назальні препарати вводять в ніс, сублінгвальні препарати вводять в порожнину рота і мазі наносять місцево на шкіру. Для перетворення активного інгредієнта за даним винаходом в порошкоподібну форму інгредієнт може бути розпилений відповідно до звичайних способів. Наприклад, активний інгредієнт може бути розпилений з використанням лактози, крохмалю або подібного і потім перемішаний для отримання однорідної суміші. З методів введення легеневе введення (інгаляція) є найбільш переважним, ніж пероральне введення, оскільки альвеоли легенів є органами-мішенями лікування, і можливий безпосередній вплив на пошкоджену ділянку тканини альвеол, що запобігає генералізованим побічним ефектам. 9 UA 100296 C2 5 10 15 20 25 30 35 40 45 50 55 Кількість адипонектину, що міститься в терапевтичному засобі за даним винаходом, не обмежується і може бути відповідним чином вибрана з широкого діапазону. Адипонектин звичайно міститься в кількості від близько 0,01 до близько 70 % мас, переважно, від близько 0,1 до близько 50 % мас, і, більш переважно, від близько 0,3 до близько 30 % мас фармацевтичної композиції. Кількість активного інгредієнта, що міститься в фармацевтичному препараті і дозування особливо не обмежуються, але можуть бути вибрані з широкого діапазону відповідно до бажаного терапевтичного ефекту, способу введення, періоду лікування і віку, статі і інших станів пацієнта. Дозування звичайно вибирають так, що концентрація активного інгредієнта в крові складає, переважно, від близько 0,1 до близько 500 мкг/мл, і, більш переважно, від близько 1 до близько 50 мкг/мл. Такий препарат можна вводити один раз або в декілька окремих доз на добу. Дозування терапевтичного засобу по винаходу відповідним чином вибирають відповідно до способу застосування, віку, статі і інших станів пацієнта і тяжкості захворювання. Кількість адипонектину звичайно складає від близько 0,1 мкг до близько 20 мг. Переважні ефекти винаходу Адипонектинвмісний засіб для інгібування збільшення повітряного простору альвеол або адипонектинвмісний засіб для інгібування деструкції стінок альвеол за даним винаходом має чудовий ефект зниження погіршення функції легенів, таких як обструкція дихальних шляхів, і є високо ефективним для лікування хвороб легенів, що супроводжуються незворотним погіршенням функції легенів. Адипонектинвмісний засіб для інгібування збільшення повітряного простору альвеол або адипонектинвмісний засіб для інгібування деструкції стінок альвеол за даним винаходом є високо безпечним лікарським препаратом з декількома побічними ефектами, такими як нудота, блювання, секреція шлункової кислоти і ін. Короткий опис креслень Фіг. 1 являє собою графік, який показує, що адипонектин має дозозалежну інгібуючу дію на збільшення повітряного простору альвеол, викликане прогресуючими деструктивними змінами стінок альвеол. На фіг. 2 показані перетини тканин, що представляють прогресуючі деструктивні зміни стінок альвеол і інгібуючу активність адипонектину на прогресуючу деструкцію стінок альвеол. Опис варіантів здійснення винаходу Приклад отримання 1 Фармацевтичну композицію за даним винаходом в ін'єкційній композиції отримували шляхом додавання і змішування 100 мкг/мл людського адипонектину (що має послідовність амінокислот SEQ ID NO:1), 0,01 мг/мл Tween 80 (моноолеат поліоксіетилен (20) сорбіту; Полісорбат 80), 15 мг/мл декстрану 40, 0,1 мг/мл цистеїну, і 1,0 мг/мл HSA (людського альбуміну сироватки) в 0,01 M буфері лимонної кислоти-цитрату натрію (pH 6,0), фільтрації суміші (з використанням мембранного фільтра 0,22 мкм), потім стерильного введення фільтрату по 1 мл у флаконі, і його ліофілізації. Композиція може бути використана при застосуванні шляхом розчинення в 1 мл сольового розчину. Приклад отримання 2 Фармацевтичну композицію за даним винаходом в ін'єкційному препараті отримували шляхом додавання 10 мкг/0,1 мл людського адипонектину (що має послідовність амінокислот SEQ ID NO: 1), 5 мг цистеїнової кислоти, і 1 мг людського альбуміну сироватки (HSA) на флакон в дистильованій воді для ін'єкції, заповнення отриманого розчину в один флакон по 1 мл і його ліофілізації. Приклад отримання 3 Фармацевтичну композицію за даним винаходом в ін'єкційній композиції отримували шляхом додавання 0,5 мг адипонектину, 80 мг хлориду натрію, 20 мг маніту, 34,5 мг фосфату натрію, і 45 мг PEG в 10 мл дистильованої води для ін'єкцій, заповнення фільтрату по 1 мл в асептичний флакон і його ліофілізації. Посилальний приклад 1 Отримання рекомбінантного людського адипонектину (1) Експресія людського адипонектину в Escherichia coli 1) ПЛР людського адипонектину Ген людського адипонектину і послідовність амінокислот, що кодується ним, зберігаються в GenBank під номером по каталогу NM_004797 і D45371, відповідно. Кодуюча ділянка (CDS) показана у вигляді послідовності від 27-го до 761-го послідовності нуклеотидів. Його встановлена послідовність амінокислот показана в SEQ ID NO:1. У вказаній послідовності 1 14-й 10 UA 100296 C2 5 10 15 20 25 30 35 40 45 50 55 60 залишки складають сигнальний пептид і 15 244-й залишки являють собою зрілий людський адипонектин. Ген людського адипонектину ампліфікували за допомогою ПЛР з використанням плазміди, даної Dr. Funahashi, the Second Department of Internal medicine, Osaka University School of Medicine як матриці. Створюючи так, що послідовність 693 п. н. від 69-го до 761-го послідовності нуклеотидів людського адипонектину ампліфікували з NdeI сайтом на 5'-кінці і BamHI сайтом на 3'-кінці, отримували праймери ПЛР з використанням автоматичного синтезатора ДНК. Послідовності праймерів ПЛР показані в SEQ ID NO:6 (пряма) і NO:7 (зворотна). 2) Субклонування гена людського адипонектину (apM1) Продукт ПЛР, отриманий на вищезгаданій стадії 1), субклонували у вектор pT7 Blue Т (Novagen) і підтверджували, що в його послідовності нуклеотидів не було мутацій (pT7-apM1). 3) Створення вектора експресії Вектор експресії pET3c (Novagen) переробляли з NdeI і BamHI для відновлення фрагмента приблизно 4600 п. н. З іншої сторони, pT7-apM1, отриманий на вищезгаданій стадії 1), переробляли з NdeI і BamHI для відновлення фрагмента приблизно 700 п. н. Такі фрагменти лігували, і отриманий таким чином вектор експресії називали pET3c-apM1. 4) Експресія в Escherichia coli Штам хазяїн Е. coli BL21(DE3)pLysS трансформували за допомогою pET3c-apM1, створеного на вищезгаданій стадії 3), і культивували в 2xT.Y.Amp. (триптон 16 г, екстракт дріжджів 10 г і NaCl 5 г). Коли організм вводили в логарифмічну фазу росту, IPTG (ізопропіл β-Dтіогалактопіранозид) додавали для індукції продукції рекомбінантного людського адипонектину (apM1). Клітини E. coli до і після такої індукції IPTG і вірусні включення (нерозчинна фракція Е.)coli) після вказаної індукції IPTG забирали і піддавали SDS-PAGE і вестерн-блоттингу для підтвердження експресії людського адипонектину. 5) Результати і обговорення Продуктом експресії в Е. coli, отриманим вищезгаданим способом, був білок із 230 залишків, 15 244 що відповідає Gly- Asn, виключно сигнальної послідовності, послідовності амінокислот людського адипонектину, з додаванням Met, отриманого з кодона ініціація на N-кінці. Е. coli, отримані вищезгаданою методикою, аналізували за допомогою SDS-PAGE. У результаті після індукції IPTG була підтверджена смуга приблизна 30 кДа в клітинах Е. coli і вірусні включення. Потім проводили вестерн-блоттинг з використанням двох типів антитіл (поліклональні антитіла (синтетичні пептиди). Обидва антитіла реагували зі вказаною смугою приблизно 30 кДа, тоді як абсолютно не визначали реакції з організмом-хазяїном Е. coli. Вищезгадану смугу приблизно 30 кДа видаляли для вивчення послідовності її 10 амінокислот на N-кінці. Послідовність була такою ж, як очікувана послідовність з виявленої делецій Met на N-кінці в мінімальній популяції. Стало очевидно з вищезгаданих результатів, що рекомбінантний людський адипонектин експресувався як білок приблизно 30 кДа. Велика частина експресованого рекомбінантного людського адипонектину нагромаджувалася внутрішньоклітинно у вигляді вірусних частинок. (2) Очищення рекомбінантного людського адипонектину (apM1) з Е. coli Очищення рекомбінантного людського адипонектину з Е. coli проводили, слідуючи 5стадійній методиці. 1) Культура E. coli Е. coli BL21(DE3)pLysS (Novagen), трансформовані за допомогою вектора експресії pET3capM1, заздалегідь культивували в 2xT.Y.Amp.Cm. (триптон 16 г, екстракт дріжджів 10 г, хлорамфенікол 25 мкг/мл, і NaCl 5 г) (37 °C, культивування з використанням перемішування). На наступний день культуру розводили 100 об'ємами 2xT.Y.Amp. і додатково інкубували. Після 2-3 часів інкубації, коли OD550 культуральної рідини ставала 0,3 0,5, IPTG додавали до остаточної концентрації 0,4 мМ для індукції продукції рекомбінантного людського адипонектину (apM1). Через приблизно 3-5 годин після додавання IPTG культуральну рідина центрифугували (5000 об./хв., 20 хв, 4 °C) і осад Е. coli, отриманий таким чином, консервували заморожуванням. 2) Отримання вірусних включень з Е. coli Осад E. coli суспендували в 50 мМ Tris-HCl (pH 8,0) і обробляли лізозимом при 37 °C протягом 1 години. Потім додавали Тритон X-100 (Katayama Kagaku) до остаточної концентрації 0,2 %. Отриманий розчин обробляли ультразвуком (Branson Sonifier, керування виходом 5, 30 сек) і центрифугували (12000 об./хв., 30 хв, 4ºC) і осад відновлювали. Отриманий осад суспендували в 25 мл 0,2 % Тритон X-100-доповненого 50 мМ Tris-HCl (pH 8,0) і суспензію обробляли ультразвуком (в таких же умовах, як указано вище). 11 UA 100296 C2 5 10 15 20 25 30 35 40 45 50 55 Отриманий розчин центрифугували і осад промивали такою ж методикою, як указано вище. Отриманим таким чином осад брали як вірусні включення. 3) Рефолдинг вірусних включень Вірусні включення розчиняли з невеликою кількістю 7 M гуанідину HCl, 100 мМ Tris-HCl (pH 8,0) і 1 % 2ME. Отриманий розчин додавали по краплях в 200-кратний об'єм 2 M сечовини, 20 мМ Tris-HCl (pH 8,0), розводили і дозволяли стояти при 4 °C протягом 3 ночей. 4) Концентрація складного розчину Розчин після вищезгаданого рефолдингу центрифугували (9000 об./хв., 30 хв, 4ºС і надосадову рідину концентрували до близько 1/100 шляхом ультрафільтрації з використанням мембрани Amicon YM-10. Отриманий концентрат діалізували відносно 20 мМ Tris-HCl (pH 8,0) і діалізат фільтрували через фільтр 0,45 мкм. 5) DEAE-5PW аніонообмінна ВЕРХ Зразок, отриманий на вищезгаданій стадії 4), виділяли і очищали аніонообмінною високоефективною рідинною хроматографією (ВЕРХ) з DEAE-5PW (Tosoh Corporation). Як початковий буфер використали 20 мМ Tris-HCl (pH 7,2) і елюцію проводили з градієнтом NaCl (0→1M NaCl/60 мл) при моніторингу поглинання при 280 нм. Елюат збирали в фракції по 1 мл і кожну фракцію аналізували за допомогою SDS-PAGE. 6) Результати і обговорення Оскільки рекомбінантний людський адипонектин (apM1) виражали як вірусне включення в Е. coli, його очищення проводили шляхом солюбілізації і рефолдингу вірусних частинок. У результаті, рекомбінантний людський адипонектин розчиняли і відділяли на аніонообмінній колонці. Пікові фракції (фракції № 30-37) аналізували SDS-PAGE. У результаті спостерігали смугу приблизно 30 кДа. У такому аналізі на підкладці визначали слабку розмиту смужку, але оскільки більшу частину білка розцінювали як рекомбінантний людський адипонектин (apM1), таку смугу приблизно 30 кДа (рекомбінантний людський адипонектин) використали як антиген в подальшій імунізації кроликів і мишей і активного інгредієнта засобів для лікування хвороб легенів по винаходу. (3) Отримання антилюдських поліклональних і моноклональних антитіл 1) Отримання поліклонального антитіла Рекомбінантний людський адипонектин, 100 мкг/організм, змішували з повним ад'ювантом в співвідношенні 1:1 і 5 кроликів імунізували сумішшю 8 разів з 2-тижневими інтервалами для отримання антилюдського поліклонального антитіла до адипонектину (коди ідентифікації: OCT9101-OCT9105). 2) Отримання моноклонального антитіла Рекомбінантний людський адипонектин, 20 мкг/організм, змішували з повним ад'ювантом в співвідношенні 1:1, і мишей імунізували сумішшю 3 рази з 2-тижневими інтервалами. Потім проводили остаточну імунізацію без ад'юванта за 3 дні до злиття клітин. Злиття клітин між мишачими клітинами селезінки і клітинами мієломи проводили методом PEG, і гібридому відбирали в HAT середовищі. Скринінг відносно клітинної лінії, що продукує антитіла до людському адипонектину, проводили шляхом ELISA з використанням імунопланшета, покритого антигенами (рекомбінантним людським адипонектином), і гібридому клонували шляхом методу обмеженого розведення. Вищезгаданим чином отримували 11 ліній гібридоми, що продукує антитіла до людського адипонектину, що називаються KOCO9101-KOCO9111. Одну гібридому, серед них, зберігали в National Institute of Bioscience і Human Technology, the Ministry of International Trade and Industry, Japan (NIBH, Higashi 1-1-3, Tsukuba-shi, Ibaraki, Japan) за даними на 8 червня 1998 (дата первинного зберігання) (код ідентифікації, призначений депозитором: KOCO9108) і запит на зміну на зберігання під Budapest Treaty подавали за даними на 7 жовтня 1998. Номер по каталогу остаточного зберігання був FERM BP-6542. Гібридоми у вигляді окремих клонів відповідно вводили інтраперитонеально мишам, що отримували заздалегідь пристан, і збирали асцитичну рідину (коди ідентифікації: ANOC91019111). 3) Очищення антитіл Кролячу антисироватку (поліклональні антитіла) і мишачу асцитичну рідину (моноклональне антитіло) відповідно очищали з використанням колонки білка А. 4) Експресія людського адипонектину в клітинах тваринних кДНК адипонектину вирізали за допомогою EcoRI і вставляли в сайт EcoRI вектора експресії pCIneo (Promega Corp.). Клітини COS-1 (ATCC CRL1650) трансфікували вищезгаданим pCIneo 12 UA 100296 C2 5 10 15 20 25 30 35 40 45 50 людським адипонектином з використанням LlipofectAMINE (GIBCO BRL), і надосадову рідину культури і клітини збирали через 72 години. 5) Вестерн-блоттинг людського адипонектину Спочатку екстракт жирової тканини, клітини COS-1, надосадову рідину культури клітин COS1, здорову людську плазму і рекомбінантний людський адипонектин піддавали впливу 2 ME(+) SDS-PAGE і переносили на нітроцелюлозну мембрану. Отримана мембрана реагувала з антилюдським моноклональним антитілом до людському адипонектину (ANOC9104) і, потім, з HRP-міченим антитілом, і визначення проводили за допомогою ECL (реагент, що визначає Вестерн-блот, Amersham). У результаті, смугу приблизно 35 кДа визначали для екстракту жирової тканини, pCIneoлюдського адипонектину/COS-1 клітин, і здорової людської плазми, але не спостерігали для клітин pCIneo/COS-1 або надосадової рідини культури клітин pCIneo/COS-1. З надосадової рідиною культури клітин pCIneo-людського адипонектину/COS-1, підтверджували смугу 35 кДа, хоча вона була дуже слабкою по інтенсивності для легкого розрізнення. Посилальний приклад 2 Клітини CHO, які експресують N кінцевий His-Tag злитий мишачий адипонектин (клон № 5), культивували у великому масштабі і збирали отриману надосадову рідину. З використанням смоли Ni-NTA очищали His-мічений адипонектин. Посилальний приклад 3 Повнорозмірну ДНК, як показано в SEQ NO:5, мишачого адипонектину вбудовували у вектор експресії і експресували в Е. coli, забезпечуючи велику кількість експресованого мишачого адипонектину. Надосадову рідину зруйнованих Е. coli наносили на відкриту колонку з DEAEсефарози і проводили елюцію з використанням градієнта від 0M до 1M NaCl. Елюйовані фракції потім збирали і піддавали фракціонуванню з 30 % насиченим сульфатом амонію. Надосадову рідину наносили на відкриту колонку Butyl-Toyopearl і елюцію проводили з градієнтом від 30 % до 0 % насиченого сульфату амонію. Нарешті проводили гель-фільтрацію для чищення мишачого адипонектину. Приклад 1 З використанням моделі на мишах (C57BL/6J), у яких розвивалися хвороби легенів в результаті лікування еластазою, адипонектин досліджували відносно терапевтичних ефектів при хронічних обструктивних хворобах легенів, що характеризуються незворотним обмеженням повітряного потоку. Коли стінки альвеол моделі на мишах руйнували за допомогою однократного інтратрахеального введення еластази, деструкція стінок альвеол хронічно продовжувалася після цього, посилюючи емфизематозні ураження (контроль на фіг. 2). Такі зміни вказані середнім лінійним відрізком, який є індексом оцінки, що звичайно використовується (Dunnill. M.S. Thorax (1962) 17, p320-328). Ступінь деструкції стінок альвеол оцінювали шляхом вимірювання розміру окремих альвеол. Отже, в моделі на мишах обробка еластазою викликала деструкцію стінок альвеол, таким чином приводячи до збільшення діаметра альвеол, що є еквівалентом емфізематозних пошкоджень і порушення функції легенів. Однократне інтратрахеальне введення еластази мишам приводило до деструкції стінок альвеол і подальшого руйнування кровоносних судин, викликаючи скороминущу кровотечу і інфільтрацію нейтрофілів в альвеоли; однак, таке запалення зникало за три дні. Отже, в експерименті може бути підтверджено, що ефект адипонектину не є результатом ефекту інгібування еластази. Самок мишей 6 або 7-тижневого віку (C57BL/6L, Japan Charles River Co., Ltd.) розподіляли на 4 групи (A-D, 6 мишей на групу) на основі маси тіла з використанням стратифікованої рандомізації (SAS Institute Japan, R8.1), як показано в таблиці 1. Кожну мишу піддавали пентобарбіталовій анестезії. 13 UA 100296 C2 Таблиця 1 А В Обробка еластазою Не проводили Проводили С Проводили D Проводили Група 5 10 15 20 25 30 35 40 45 50 Речовина, що вводиться Доза адипонектину Кількість мишей (концентрація) (мг/миша) (50 мкл) 6 Звичайний сольовий розчин 6 Адипонектин 0,001 6 (0,02 мг/мл) Адипонектин 0,01 6 (0,2 мг/мл) Згодом з використанням розбризкувача (продукту Penn Century Inc.) звичайний сольовий розчин (звичайний сольовий розчин Otsuka, що виробляється Otsuka Pharmaceutical Factory Inc.) і еластазу людських нейтрофілів (Elastin Products Co., що виробляється, Inc.) вводили інтратрахеально через гортань мишам в групі А і мишам в групах B-D, відповідно, в об'ємі 50 мкл/миша. Дозування еластази було 20 ОД/миша. Через три дні після інтратрахеального введення еластази адипонектин вводили інтратрахеально один раз в добу протягом 18 днів мишам в групі С в дозі 0,001 мг/миша і мишам в групі D в дозі 0,01 мг/миша. Адипонектин, що використовується при введенні, отримували шляхом розчинення в розчиннику (50 мМ Tris-HCl (pH 8,0) 0,5M NaCl) мишачого адипонектину, отриманого з клітин CHO в посилальному прикладі 2 вище. Адипонектин розводили прийнятною кількістю звичайного сольового розчину до концентрації 0,2 мг/мл або 0,02 мг/мл для застосування. Розчини в кожній концентрації ділили на добові дози лікарської речовини і консервували заморожуванням при -20ºС до моменту введення. У момент введення заморожений розчин відтавали. У контрольній групі еластази (Група В) звичайний сольовий розчин вводили замість адипонектину протягом того ж періоду. Адипонектин або звичайний сольовий розчин вводили інтратрахеально через гортань мишам під інгаляційною анестезією ізофлураном в об'ємі 50 мкл/миша з використанням розбризкувача. Після 18 днів безперервного інтратрахеального введення кожну мишу умертвляли шляхом кровопускання з абдомінальної аорти під інгаляційною анестезією ізофлураном. Легені вирізали і піддавали перфузійній фіксації за допомогою 10 % нейтрального буферного розчину формаліну. Фіксовану тканину легені потім піддавали заливанню в парафін, тонкій нарізування, фарбуванню Masson Trichrome, і фарбуванню HE в Bio Pathology Institute Co., Ltd. Патологічні тканини оцінювали шляхом вимірювання середнього лінійного відрізка, який є об'єктивним показником пошкодження альвеол. Середній лінійний відрізок (Lm) розраховували з використанням формули: Lm=N×L/m, де N являє собою кількість січних ліній, L являє собою довжину січної лінії, і m являє собою загальну кількість стінок альвеол, що перетинаються січними лініями. Статистичний аналіз Для оцінки активності лікарських засобів, проводили тест Даннета шляхом порівняння контрольної групи еластази (Група В) з групами С і D. Кожен тест проводили відповідно до двостороннього критерію, і рівень достовірності встановлювали як 5 %. Тест проводили з використанням програмного забезпечення SAS (SAS Institute Japan, R8.1). Результати показані на фіг. 1. Виміряний лінійний відрізок становив 152,5±14,7 мкм в групі В, при 115,2±17,3 мкм в групі С і 81,7±20,4 мкм в групі D. Суттєва інгібуюча активність була продемонстрована відповідно до дозування адипонектину (середнє ± S.D., Р
ДивитисяДодаткова інформація
Назва патенту англійськоюAdiponectin for treating pulmonary disease
Автори англійськоюKotosai, Kounori, Kirima, Kazuyoshi, Karasutani, Keiko, Ohmoto, Yasukazu, Yabuuchi, Yoichi
Назва патенту російськоюАдипонектин для лечения заболеваний легких
Автори російськоюКотосаи Коунори, Кирима Кадзуэси, Карасутани Кейко, Охмото Ясукадзу, Ябуути Йоити
МПК / Мітки
МПК: A61P 11/00, A61K 38/17
Мітки: лікування, адипонектин, захворювань, легенів
Код посилання
<a href="https://ua.patents.su/20-100296-adiponektin-dlya-likuvannya-zakhvoryuvan-legeniv.html" target="_blank" rel="follow" title="База патентів України">Адипонектин для лікування захворювань легенів</a>
Попередній патент: Спосіб плавлення сталі в дуговій електропечі
Наступний патент: Пристрій для заглушення засобів передачі, реєстрації та приймання інформації
Випадковий патент: Ротор електричної машини