Системні лікарські форми з контрольованим вивільненням і покращеною стабільністю
Формула / Реферат
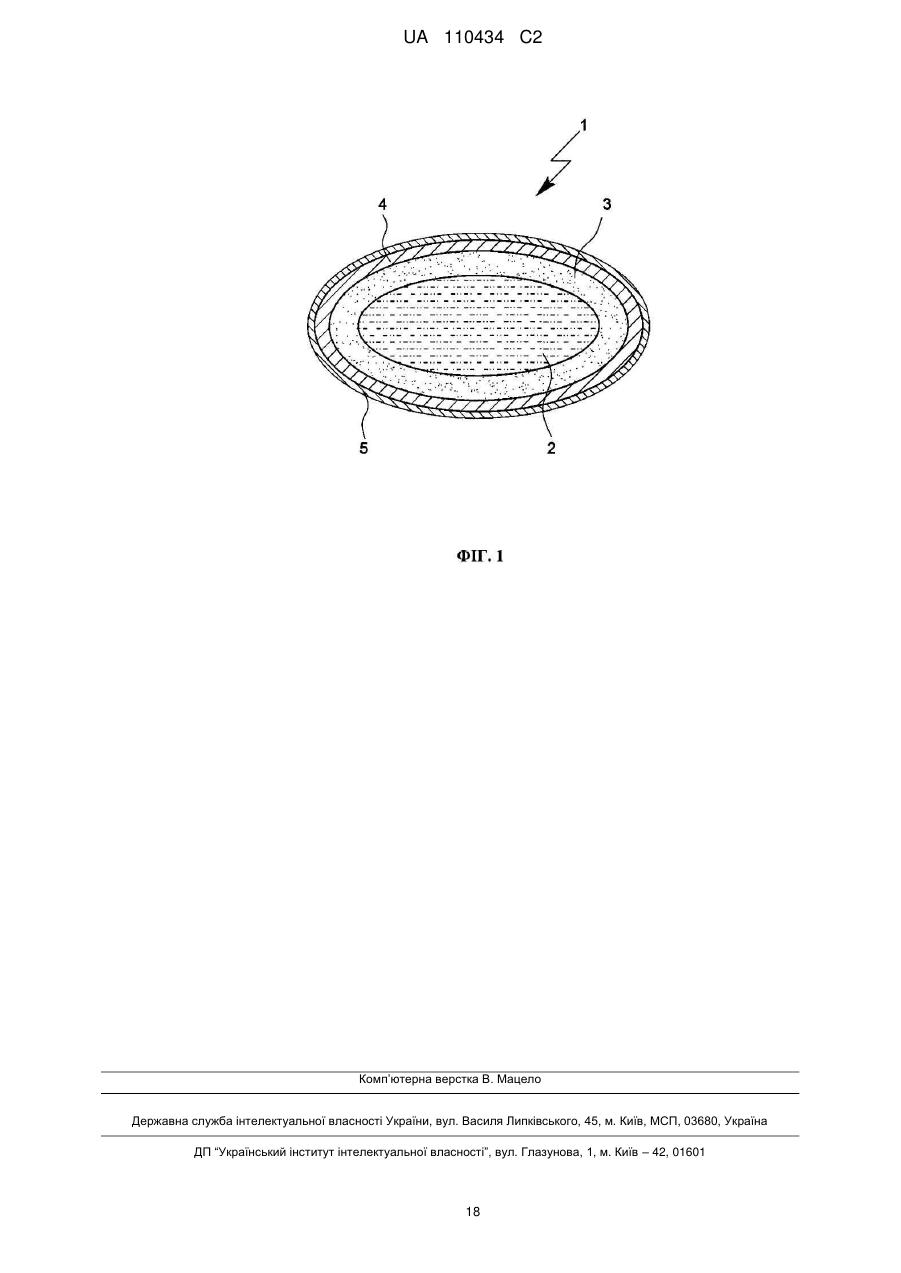
1. Лікарська форма, що містить монотерпен, для перорального застосування у вигляді капсули, зокрема у вигляді капсули зі структурою ядро/оболонка з багатошаровою оболонкою, причому капсула зсередини назовні має наступну будову:
(а) ядро капсули, що містить щонайменше одну діючу речовину, що містить монотерпен,
(б) перша оболонка капсули, яка оточує ядро капсули, надає структуру і/або форму, і
(в) друга оболонка капсули, яка оточує першу оболонку капсули, причому друга оболонка капсули містить щонайменше два компоненти, причому перший компонент ("компонент 1") виконаний на основі альгінової кислоти або її фізіологічно прийнятних солей або складних ефірів і другий компонент ("компонент 2") виконаний на основі целюлози, причому лікарська форма має віднесену до ваги частку другої оболонки капсули, в перерахунку на лікарську форму, в межах від 0,5 до 4 мас. %.
2. Лікарська форма за п. 1, причому лікарська форма, зокрема ядро капсули як єдину діючу речовину містить 1,8-цінеол.
3. Лікарська форма за одним з попередніх пунктів, причому лікарська форма, зокрема ядро капсули, містить діючу речовину, що містить монотерпен, зокрема 1,8-цінеол, разом зі щонайменше одним змішуваним з діючою речовиною, що містить монотерпен, і/або монотерпеном, зокрема 1,8 цінеолом, і/або розчинним в ній, зокрема при 20 °C і атмосферному тиску рідким, фізіологічно прийнятними носієм (наповнювачем), причому носій вибраний з групи жирних олій, переважно тригліцеридів, особливо переважно тригліцеридів з ланцюжками середньої довжини (МСТ), найбільш переважно тригліцеридів з залишками С6-С12-жирних кислот.
4. Лікарська форма за одним з попередніх пунктів, причому лікарська форма містить діючу речовину, що містить монотерпен в абсолютних кількостях від 10 до 1,000 мг, в перерахунку на одиницю застосування, зокрема капсулу; і причому лікарська форма містить діючу речовину, що містить монотерпен у відносних кількостях від 0,01 до 95 мас. %, в перерахунку на лікарську форму.
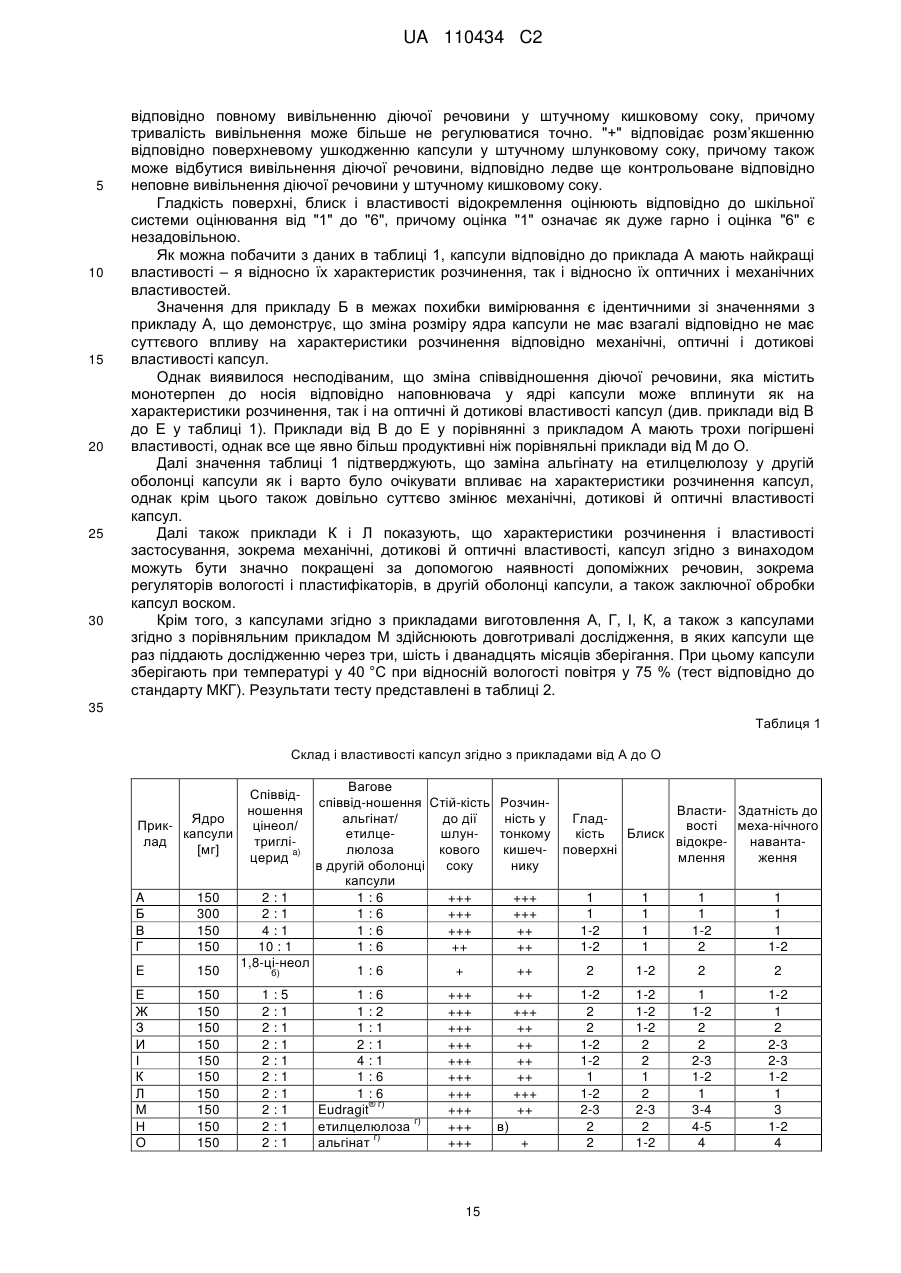
5. Лікарська форма за одним з попередніх пунктів, причому друга оболонка капсули як перший компонент містить щонайменше один альгінат, вибраний з альгінатів лужних металів, альгінатів лужноземельних металів, альгінатів амонію і складних ефірів альгінової кислоти; і причому друга оболонка капсули як другий компонент містить целюлозу або похідне целюлози, вибране з простих ефірів целюлози або складних ефірів целюлози.
6. Лікарська форма за одним з попередніх пунктів, причому лікарська форма містить другу оболонку капсули в кількостях від 0,5 до 100 мг і причому лікарська форма має віднесену до ваги частку другої оболонки капсули, в перерахунку на лікарську форму, в межах від 2 до 4 мас. %.
7. Лікарська форма за одним з попередніх пунктів, причому лікарська форма забезпечена зовнішнім, оточуваним другу оболонку капсули, покриттям на основі лаків або восків, а також їх сумішей і комбінацій.
8. Лікарська форма за одним з попередніх пунктів для застосування при профілактичному і/або терапевтичному лікуванні організмів людей або тварин.
9. Лікарський засіб або медичний продукт, що містить лікарську форму, яка містить монотерпен, зокрема цінеол, за одним з попередніх пунктів.
10. Спосіб одержання лікарської форми, що містить монотерпен для перорального застосування у вигляді капсули, зокрема у вигляді капсули зі структурою ядро/оболонка з багатошаровою оболонкою, як визначено за одним з попередніх пунктів, причому
(і) в першій стадії способу ядро капсули, яке містить щонайменше одну діючу речовину, що містить монотерпен, забезпечують першою, оточуваною ядро капсули оболонкою капсули, яка надає структуру і/або форму, і
іі) в наступній другій стадії способу першу оболонку капсули забезпечують другою, оточуваною першу оболонку капсули оболонкою капсули, причому для одержання другої оболонки капсули застосовують щонайменше два компоненти, причому перший компонент ("компонент 1") виконаний на основі альгінової кислоти або її фізіологічно прийнятних солей або складних ефірів і другий компонент ("компонент 2") виконаний на основі целюлози, причому перший і другий компоненти для одержання другої оболонки капсули наносять сумісно у вигляді водного розчину і/або дисперсії, причому розчин і/або дисперсію підлуговують і причому одержана лікарська форма має віднесену до ваги частку другої оболонки капсули, в перерахунку на лікарську форму, в межах від 0,5 до 4 мас. %.
11. Застосування лікарської форми, що містить монотерпен за одним з пунктів від 1 до 8 для одержання лікарського засобу для профілактичного і/або терапевтичного лікування організмів людей або тварин.
12. Застосування за п. 11 для одержання лікарського засобу для профілактичного і/або терапевтичного лікування запальних, загострених внаслідок інфекції або алергійних захворювань організмів людей або тварин, або для одержання лікарського засобу для профілактичного і/або терапевтичного лікування застудних захворювань і грипозних інфекцій і пов'язаних з ними захворювань й інфекцій, зокрема інфекцій верхніх і нижніх дихальних шляхів, зокрема риніту, синуситу і бронхопульмональних захворювань.
Текст
Реферат: Винахід належить до лікарської форми, що містить монотерпен, для перорального застосування у вигляді капсули, зокрема у вигляді капсули зі структурою ядро/оболонка з багатошаровою оболонкою, причому капсула зсередини назовні має наступну будову: (а) ядро капсули, що містить щонайменше одну діючу речовину, що містить монотерпен, (б) перша оболонка капсули, яка оточує ядро капсули, надає структуру і/або форму, і (в) друга оболонка капсули, яка оточує першу оболонку капсули, причому друга оболонка капсули містить щонайменше два компоненти, причому перший компонент ("компонент 1") виконаний на основі альгінової кислоти або її фізіологічно прийнятних солей або складних ефірів і другий компонент ("компонент 2") виконаний на основі целюлози, причому лікарська UA 110434 C2 (12) UA 110434 C2 форма має віднесену до ваги частку другої оболонки капсули, в перерахунку на лікарську форму, в межах від 0,5 до 4 мас. %. UA 110434 C2 5 10 15 20 25 30 35 40 45 50 55 Даний винахід відноситься до технічної галузі системних форм застосування, зокрема системних форм застосування з контрольованим вивільненням діючих речовин. Зокрема даний винахід відноситься до лікарської форми, що містить монотерпен для перорального застосування у вигляді капсули, зокрема у вигляді капсули зі структурою ядро/оболонка з багатошаровою оболонкою. Крім того, винахід відноситься до способу одержання лікарської форми згідно з винаходом, а також до її застосування, зокрема в медичних цілях і як лікарський засіб. Загалом, терпени представляють собою природні речовини, які можуть бути виділені як складова частина так званих ефірних олій у вигляді рідин з рослин або їх складових частин. Часто вони представляють собою ароматичні й смакові речовини, які застосовують в галузях харчової промисловості або косметичної промисловості. Однак поряд з цим також набуває все більшого значення застосування терпенів у медичних цілях, тому що для цілої низки терпенів можна підтвердити фармакологічні дії. Формально терпени представляють собою продукти полімеризації ізопрену, причому за кількістю ізопренових залишків їх розрізняють як монотерпени (C 10-одиниць), сесквітерпени (C15одиниць), дитепреноїди (C20-одиниць), сестертерпени (C25-одиниць), тритерпени (C30-одиниць), тетратерпени (C40-одиниць) і політерпени (див. RÖMPP-Chemielexikon, 10-е видання, Georg Thieme Verlag, Stuttgart/New York, 1999, сс. 4449 і 4450, ключове слово "Терпен(оїд)и"). Крім того, терпени можна застосовувати як фармакологічно діючі речовини, вихідні речовини для одержання лікарських засобів або вітамінних препаратів, а також у сільському господарстві, виходячи з їх часто бактерицидної відповідно пестицидної дії. Особливо для низки монотерпенів підтверджені фармакологічні дії в боротьбі з захворюваннями при здійснених системних лікуваннях, причому зокрема слід назвати ментол і 1,8-цінеол. 1,8-цінеол відноситься до біциклічних епокси-монотерпенів, точніше до оксидів лімонену. Синонімічні позначення для 1,8-цінеолу з хімічною сумарною формулою C10H18O є евкаліптол, оксид лімонену-1,8, 1,8-епокси-п-ментан або 1,3,3-триметил-2-оксабіцикло[2.2.2]октан. Він являє собою безбарвну рідину з пряним, схожим на камфору запахом з точкою плавлення у +1,5 °C і точкою кипіння від 176 до 177 °C, яка є нерозчинною у воді, але змішується з більшою частиною органічних розчинників. Звичайно, 1,8-цінеол як основний компонент евкаліптової олії (евкаліптова олія містить до 85 мас. % 1,8-цінеолу), також може зустрічатися і в інших рослинах, так, наприклад у м’яті, лікарської шавлії, чебреці, базиліку і в чайному кущі. Крім того, 1,8-цінеол міститься наприклад в олії найолі, ялівцевій олії, перцевій олії, конопляній олії, каєпутовій олії, шавлій ній олії, миртовій олії й інших ефірних оліях. Технічний 1,8-цінеол, який в цілому є 99,6- до 99,8-%-им, загалом одержують шляхом фракційного дистиляції евкаліптової олії. 1,8-цінеол застосовують зокрема як відхаркувальний засіб при бронхітах і інших захворюваннях дихальних шляхів, головним чином у ветеринарній медицині, але крім того як ароматична речовина у парфумерній промисловості. Крім того, 1,8-цінеол застосовують у стоматології під час огляду пломб кореневих каналів. З фізіологічної точки зору 1,8-цінеол має муколітичну і бактерицидну дію у верхніх і нижніх дихальних шляхах, зокрема в легенях і навколоносових придаткових пазухах. Крім того, він інгібує певні нейромедіатори, які відповідають за звуження бронхів. При хронічних обструктивних захворюваннях легенів і бронхіальній астмі внаслідок прийому чистого 1,8цінеолу можна покращити функцію легенів. Виходячи з його кортикостероїдноподібної дії, у випадку важких захворювань дихальних шляхів його застосовують як замінник або у сумісному медикаментозному лікуванні з кортикостероїдами при системному застосуванні. В принципі, 1,8цінеол можна застосовувати як місцево, наприклад, шляхом інгаляцій, або ж системно, зокрема у формі капсул. Отже як діюча речовина 1,8-цінеол має як муколітичну, так і протизапальну дію. При системному застосуванні 1,8-цінеол легко всмоктується і через кровоносне русло з метою дії потрапляє в органи дихання. Таким способом 1,8-цінеол може розріджувати, наприклад запальні виділення, а також густий слиз у дихальних шляхах і протидіяти запальним процесам в органах дихання. Застій виділень запобігається внаслідок того, що полегшується відкашлювання, підтримується функція відповідальних за очищення війок миготливого епітелію у бронхах і носі й тим самим покращується аерація дихальних шляхів. В області верхніх дихальних шляхів зникає ускладнення носового дихання при нежиті й потьмарення свідомості в голові. 1 UA 110434 C2 5 10 15 20 25 30 35 40 45 50 55 Стосовно інших подробиць щодо діючої речовини 1,8-цінеол можна звернутися, наприклад, до RÖMPP Chemielexikon, Georg Thieme Verlag, Stuttgart/New York, 10-е видання, том 1, 1996, стор. 752, ключове слово: "Цінеол", а також до процитованих там літературних джерел. В описах, що відносяться до тієї ж самої патентної родини DE 43 19 554 C2, DE 43 19 556 C2 і WO 94/28895 A2 описана комбінаційна терапія сполуками терпену для перорального введення, зокрема 1,8-цінеолом або ментолом, з одного боку і рівним чином кортикостероїдами для системного, зокрема перорального введення з іншого боку для протизапального лікування системної хронічної бронхіальної астми, яку лікують стероїдами, причому застосування терпенових сполук для перорального введення в контексті тривалої терапії повинно знизити потребу в системних кортикостероїдах. Переважно застосовують стійкі до дії шлункового соку, однак розчинні у тонкому кишечнику капсули з діючою речовиною на основі терпену. Для системного застосування 1,8-цінеолу й інших терпенів у продажу є наявними різні препарати, зокрема на основі загалом стійких до дії шлункового соку, але розчинних у тонкому кишечнику капсул. Однак системне лікування терпенами, зокрема монотерпенами, є коштовним і складним, тому що часто терпени представляють собою реакційноздатні сполуки, які під дією світла відповідно в присутності кисню вступають в реакцію і втрачають їх позитивні фармакологічні властивості. Крім того, з причин реакційної здатності монотерпенів також можливо отримати небажану взаємодію з матеріалом оболонки капсул, в яких містяться монотерпени. Крім цього проблемою є те, що терпени часто є речовинами з дуже сильним запахом і ароматом, які не можна застосовувати у нерозведеній формі, внаслідок чого ускладнюється точне дозування. Більшості наявних у продажу капсул з діючими речовинами, що містять монотерпен, зокрема з 1,8-цінеолом як діючою речовиною, в цілому не завжди надається оптимальна довготривала стабільність або оптимальній захист від впливу навколишнього середовища, зокрема від окиснення киснем повітря. Хоча такої довготривалої стабільності можна досягти шляхом застосування мікрокапсул в так званих системах капсула-в-капсулі; однак виготовлення подібних систем капсула-в-капсулі є надзвичайно коштовним і збитковим і може бути здійснене тільки декількома спеціалізованими виробниками. Системне застосування монотерпенів внаслідок реакційної здатності монотерпенів також ускладнюється в тому відношенні, що вони повинні неушкодженими подолати агресивне, сильно кисле середовище шлунку, щоб бути всмоктаними тонким кишечником і потім викликати системну дію. З цієї причини часто застосовують дозовані форми, зокрема капсули, які постачені стійким до дії шлункового соку, але розчинним у тонкому кишечнику покриттям, так званим покриттям уповільненого вивільнення. Як покриття уповільненого вивільнення зокрема застосовують лакові системи, такі як, наприклад шелак, або синтетичні полімери, такі як наприклад (мет-)акрилова кислота відповідно (мет-)акрилати. Однак застосовні в рівні техніки системи з покриттям уповільненого вивільнення часто потребують застосування небажаних пластифікаторів, таких як наприклад, фталати, і забезпечують тільки покриття з незначною здатністю до механічного навантаження і не завжди оптично привабливі. Зокрема звичайно застосовні в даний час покриття на основі (мет)акрилових кислот відповідно (мет-)акрилати мають тенденцію до відокремлення від капсули, що проявляється у матових плямах на поверхні капсул. Хоча помутніння поверхні капсул, як правило, не впливає на можливість застосування капсул, однак часто призводить до претензій з боку торгівельних мереж і кінцевих споживачів, які вважають, що вони придбали неякісний продукт. Крім того, виготовлення покриття уповільненого вивільнення стандартними способами покриття і вихідною сировиною може здійснюватися тільки при високих витратах на обладнання та за умови високої норми дефектів, так що частина виготовлених капсул не надходить у продаж, а відсортовується. Зокрема покриття на основі (мет-)акрилатів відповідно (мет)акрилової кислоти повинні оброблятися при підвищених температурах (наприклад 80 °C), що є дорого стосовно обладнання (рівним чином як і гомогенізація і постійне перемішування перед нанесенням). Внаслідок цього при виготовленні продуктивність є відносно низькою. Крім того, у відомих з рівні техніки капсульних системах, зокрема для інкапсуляції монотерпенів, зокрема 1,8-цінеолу, контрольоване або уповільнене відповідно затримане вивільнення часто не завжди відбувається оптимально або ж іноді є не завжди можливим. Рівним чином у відомих з рівня техніки капсулах з діючою речовиною часто також не завжди можливою є оптимальне дозування діючої речовини. Крім того, з відомими з рівня техніки капсульним системами часто не можливо отримати оптимального маскування смаку і/або запаху. 2 UA 110434 C2 5 10 15 20 25 30 35 40 45 50 55 60 Тому в основі даного винаходу лежить задача забезпечити ефективну, призначену для перорального застосування, лікарську форму для діючих речовин, що містять монотерпен, зокрема для 1,8-цінеолу, і представити відповідний спосіб одержання цієї лікарської форми, за допомогою якої представлені вище, пов’язані з попереднім рівнем техніки недоліки й побічні ефекти щонайменше частково повинні усуватися або ж щонайменше частково послаблюватися. Зокрема в основі даного винаходу лежить задача, забезпечити ефективну, призначену для перорального застосування лікарську форму для діючих речовин, що містять монотерпен, яка уможливлює покращений профіль вивільнення і/або покращену довготривалу стабільність відносно діючої речовини. Зокрема при цьому також повинний бути покращений захист діючої речовини від навколишнього середовища, зокрема від окиснення киснем повітря, і до того ж гарантуватися покращене дозування і/або оброблюваність діючої речовини, зокрема також в межах способу одержання для цієї лікарської форми. Крім того, в основі даного винаходу лежить задача, надати спрощений спосіб одержання ефективної, призначеної для перорального застосування лікарської форми для діючих речовин, що містять монотерпени, який на відміну від існуючого донині способу є менш дорогим відносно обладнання і здійснюється з оптимальними витратами відповідно більш ефективно. Для рішення представленої вище задачі у даному винаході – згідно з першим аспектом винаходу – пропонується лікарська форма, що містить монотерпен для перорального застосування у вигляді капсули згідно з п. 1 формули винаходу; інші, зокрема переважні і/або вигідні варіанти здійснення цього аспекту винаходу є об’єктами відповідних залежних пунктів формули винаходу. Іншим об’єктом даного винаходу – згідно з другим аспектом винаходу – є спосіб одержання лікарської форми, що містить монотерпен для перорального застосування у вигляді капсули за п. 38; інші, зокрема переважні і/або вигідні варіанти здійснення цього аспекту винаходу є об’єктами відповідних залежних пунктів формули винаходу. У свою чергу іншим об’єктом даного винаходу є застосування лікарської форми, що містить монотерпен відповідно до даного винаходу згідно з п. 44; інші, зокрема переважні і/або вигідні варіанти здійснення цього аспекту винаходу є об’єктами відповідних залежних пунктів формули винаходу. Насамкінець іншим об’єктом даного винаходу – згідно з четвертим аспектом винаходу – є лікарський засіб або медичний продукт згідно з п. 56; інші, зокрема переважні і/або вигідні варіанти здійснення цього аспекту винаходу є об’єктами відповідних залежних пунктів формули винаходу. Само собою зрозуміло, що варіанти здійснення, форми виконання, переваги або тому подібне, які надалі – з метою уникнення непотрібних повторень – наводяться тільки для одного аспекту винаходу, звичайно також відповідним чином відносяться до інших аспектів винаходу. Далі, само собою зрозуміло, що при подальших зазначеннях значень, даних і діапазонів відповідні зазначення значень, даних й діапазонів не повинно розумітися як обмежувальне; для спеціаліста в даній галузі техніки звичайно зрозуміло, що у випадку необхідності, зокрема обумовленому поодинокими випадками або практично направленому, можна відхилятися від зазначених діапазонів і зазначень, не виходячи за межі даного винаходу. До того ж має місце, що всі наведені надалі зазначення величин відповідно параметрів або тому подібного в принципі можуть бути встановлені відповідно визначені за допомогою нормованих відповідно стандартизованих або чітко зазначених способів визначення або ж добре відомими спеціалісту в даній галузі техніки методами визначення. Далі у всіх перерахованих нижче відносних або процентних, особливо віднесених до ваги зазначеннях кількості слід також відзначити, що ці данні в контексті складу відповідно до винаходу вибираються відповідно комбінуються спеціалістом в даній галузі техніки таким чином, що в сумі - при необхідності з включенням додаткових компонентів або інгредієнтів або добавок складових частин інгредієнти, зокрема таких як визначено нижче - завжди виходить 100% і 100 мас. %. Для спеціаліста в даній галузі техніки це є цілком очевидно. Враховуючи вищевикладене, надалі даний винахід описується більш докладно. Таким чином об’єктом даного винаходу – згідно з першим аспектом даного винаходу – є лікарська форма, що містить монотерпен для перорального застосування у вигляді капсули, зокрема у вигляді капсули зі структурою ядро/оболонка з багатошаровою оболонкою, причому капсула зсередини назовні має наступну будову: (a) всередині ядро капсули, яке містить щонайменше одну діючу речовину, що містить монотерпен, зокрема щонайменше один монотерпен, (б) перша оболонка капсули, яка оточує ядро капсули, зокрема оточує безпосередньо ядро капсули, яка надає структуру і/або яка надає форму і 3 UA 110434 C2 5 10 15 20 25 30 35 40 45 50 55 60 (в) друга оболонку капсули, яка оточує першу оболонку капсули, зокрема оточує безпосередньо першу оболонку капсули, переважно у формі покриття, зокрема у формі стійкого до дії шлункового соку, але розчинного у тонкому кишечнику покриття, причому друга оболонка капсули містить щонайменше два компоненти відповідно інгредієнти відповідно складові частини, причому перший компонент ("компонент 1") виконаний на основі альгінової кислоти або її фізіологічно прийнятних солей або складних ефірів і другий компонент («компонент 2») виконаний на основі целюлози. Іншими словами принцип даного винаходу полягає в тому, щоб забезпечити лікарську форму у вигляді капсули зі структурою ядро/оболонка, яка має внутрішнє ядро, яке містить одну діючу речовину, що містить монотерпен. Ядро капсули оточує перша оболонка капсули – або опосередковано або переважно безпосередньо – , причому ця перша оболонка надає структуру - відповідно форму для всієї лікарської форми, тобто перша оболонка капсули з одного боку визначає форму і тим самим зовнішній вигляд капсули і з іншого боку основні механічні властивості лікарської форми. Перша оболонка капсули знову оточена щонайменше однією, другою оболонкою капсули – опосередковано або переважно безпосередньо –, яка також може бути виконана у формі покриття і захищає ядро капсули, а також першу оболонку капсули від впливів навколишнього середовища; при цьому друга оболонка капсули може зокрема механічні властивості першої оболонки капсули і лікарської форми у цілому модифікувати відповідно покращувати; зокрема другий шар капсули уможливлює цілеспрямоване встановлення механічних властивостей всієї лікарської форми. При цьому друга оболонка капсули – як вже було наведено вище – містить щонайменше два компоненти відповідно інгредієнти відповідно складові частини, причому перший компонент ("компонент 1") виконаний на основі альгінової кислоти або її фізіологічно прийнятних солей або складних ефірів і інший, другий компонент ("компонент 2") виконаний на основі целюлози. В цілому в межах даного винаходу передбачено, що перша оболонка капсули є як розчинною у шлунку, так і розчинною у тонкому кишечнику і зокрема загалом є розчинною у водних системах. Таким чином можливо виключно відповідно в першу чергу регулювати відповідно встановлювати вивільнення діючої речовини, що містить монотерпен за допомогою відповідного виконання або модифікації другої оболонки капсули. В контексті даного винаходу є переважним, якщо друга оболонка капсули виконана стійкою до дії шлункового соку, але розчинною у тонкому кишечнику, тобто представлена у вигляді так званого покриття уповільненого вивільнення. Подібне стійке до дії шлункового соку, але розчинне у тонкому кишечнику покриття відповідно покриття уповільненого вивільнення має перевагу в тому, що поміщена в ядро капсули лікарської форми діюча речовина, що містить монотерпен, може без ушкодження витримувати агресивне, сильно кислотне середовище шлунку, однак вивільнятися і всмоктуватися у тонкому кишечнику. Під поняттям "стійкі до дії шлункового соку" при цьому в межах даного винаходу зокрема слід розуміти, що капсули можна зберігати щонайменше протягом двох годин в 0,1 N соляній кислоті, яку нагрівають до температур від 35 до 39 °C, при постійному перемішуванні, зокрема струшуванні, без того, що капсули проявляють ознаки розкладання або тріщин або інших ушкоджень. Зокрема під поняттям "розчинні у тонкому кишечнику" в межах даного винаходу напроти слід розуміти, що капсули у водному розчині фосфатного буфера, який встановлений до значення pH приблизно у 6,8, при перемішуванні при температурах в межах від 35 до 39 °C протягом однієї години загалом розпадаються відповідно руйнуються, так що діюча речовина вивільняється. Застосовне в межах даного винаходу визначення для понять "стійкі до дії шлункового соку" відповідно "розчинні у тонкому кишечнику", а також відповідні методи тестування представлені в European Pharmacopoeia 7.0, 04/2010: 1502, сс. від 707 до 709, ключове слово "Capsules", підрозділ "Gastro-Resistant Capsules", а також European Pharmacopoeia 7.1, 04/2011: 20901, сс. 3331 і 3332, ключове слово "2.9.1 Disintegration of Tablets and Capsules". Тим самим в межах даного винаходу вдалося забезпечити ефективну, явно покращену у порівнянні з рівнем техніки лікарську форму для перорального застосування діючих речовин, що містять монотерпен. Завдяки лікарській формі згідно з винаходом у вигляді капсули зі структурою ядро/оболонка забезпечують лікарську форму, яка з одного боку захищає діючу речовину, що містить монотерпен від впливів навколишнього середовища і з іншого боку гарантує, що діюча речовина вивільняється у тонкому кишечнику при контрольованих умовах. Зокрема друга оболонка капсули на основі альгінової кислоти відповідно її фізіологічно прийнятних солей або складних ефірів з одного боку, а також целюлоза відповідно похідні 4 UA 110434 C2 5 10 15 20 25 30 35 40 45 50 55 60 целюлози з іншого боку на відміну від рівня техніки уможливлюють явно простіше, зокрема стосовно обладнання менш коштовне, а також прискорене у часі й сприятливе в економічному відношенні виготовлення лікарських форм, що містять монотерпени для системного застосування. Так, наприклад тривалість обробки (часовий процес) для утворення оболонки капсули, зокрема другої оболонки капсули, тобто тривалість процесу для безпосереднього нанесення плівки, у порівнянні з капсульними оболонками з відомого рівня техніки, зокрема на основі (мет-)акрилової кислоти відповідно (мет-)акрилату, суттєво зменшується, зокрема щонайменше приблизно на 25 %. Застосована в межах даного винаходу друга оболонка капсули прилипає явно краще до першої оболонки капсули, ніж спостерігається з оболонкою порівняної капсули з відомого рівня техніки, так що капсули з одного боку є більш стійкими механічно, а з іншого боку також не спостерігається відокремлення другої оболонки капсули від першої оболонки капсули, яке в рівні техніки приводить до помутніння оболонки капсули відповідно до утворення матових плям, на які в свою чергу скаржаться торговельні мережі, а також кінцеві споживачі. Завдяки двокомпонентній будові другої оболонки капсули з першим компонентом на основі альгінової кислоти відповідно її фізіологічно прийнятних солей або складних ефірів з одного боку і другим компонентом на основі целюлози з іншого боку досягається особливо оптимальний профіль вивільнення, тому що друга оболонка капсули так би мовити здатна переключатися: в кислотному середовищі шлункового соку друга оболонка капсули є нерозчинною, зокрема тому що компонент альгінової кислоти представлений у вигляді вільної кислоти і тому є нерозчинним; у порівнянні з цим у середовищі від нейтрального до лужного напроти, зокрема у середовищі тонкого кишечнику, напроти, частка альгінової кислоти другої оболонки капсули перетворюється на альгінат, який у свою чергу виконаний розчинним, зокрема розчинним у воді, так що потім друга оболонка капсули розчиняється і наприкінці діюча речовина вивільняється. Відповідно завдяки цій двокомпонентній будові другої оболонки капсули досягається оптимальний профіль вивільнення. Іншу перевагу особливого оформлення другої оболонки капсули можна побачити в тому, що завдяки зміні товщини другої оболонки капсули, зокрема завдяки зміні кількості накладеного шару при виготовленні, можна точно розробити відповідно прицільно регулювати руйнування капсули і тим самим вивільнення діючої речовини. Також завдяки зміні співвідношення кількості обох компонентів другої оболонки капсули (тобто альгінової кислоти відповідно альгінату з одного боку і целюлози відповідно похідного целюлози з іншого боку) в кінцевому рахунку можна прицільно регулювати відповідно точно розробити профіль вивільнення лікарської форми згідно з винаходом. Окрім цього дослідження стабільності, проведені заявником показують, що в межах даного винаходу, зокрема внаслідок особливо виконаній другій оболонці капсули, не відбуваються ніякі взаємодії з інкапсульованою діючою речовиною, тобто ядро капсули з одного боку і капсульні оболонки з іншого боку виконані повністю сумісними одне з іншими. Лікарська форма відповідно до винаходу на відміну від капсул з відомого рівня техніки має явно покращену довготривалу стабільність, зокрема стійкість при зберіганні, яка з одного боку зводиться до покращеного захищення ядра капсули, а також діючої речовини, що містить монотерпен від впливів навколишнього середовища, таких як вплив світла або кисню, і з іншого боку також базується на покращеній сумісності між складовими частинами ядра капсули, а також оболонок капсули, що оточують ядро капсули. Крім того, лікарська форма згідно з винаходом має покращений профіль вивільнення. Що стосується діючої речовини, що містить монотерпен, яку застосовують в межах даного винаходу, то вона може бути вибрана з множини монотерпенів. Однак в контексті даного винаходу є переважним, коли діюча речовина, що містить монотерпен, зокрема монотерпен, вибрана з групи цінеолу, ментолу, камфори, лімонену, карвону, карвеолу або їх комбінацій. Наведені вище монотерпени можна чудово застосовувати в лікарських формах відповідно до винаходу і крім того всі разом мають системну фармакологічну дію. Особливо гарні результати в межах даного винаходу одержують, коли монотерпен представляє собою 1,8-цінеол і/або ментол, особливо переважно 1,8-цінеол. В контексті даного винаходу може бути передбачено, що лікарська форма, зокрема ядро капсули як єдину діючу речовину містить 1,8-цінеол або ж лікарська форма, зокрема ядро капсули, капсули містить 1,8-цінеол з щонайменше однією іншою діючою речовиною, переважно вибраною з терпенів. Тим самим застосовний в межах даного винаходу монотерпен, зокрема 1,8-цінеол, може використовуватися як єдина діюча речовина або ж як суміш з іншими речовинами, зокрема як суміш, що зустрічається в природі, така як наприклад евкаліптова олія відповідно її дистиляти. 5 UA 110434 C2 5 10 15 20 25 30 35 40 45 50 55 Таким чином в контексті даного винаходу безпосередньо можуть застосовуватися суміші природних речовин відповідно їх очищені або хімічно перетворені продукти і похідні. Однак переважно, якщо відповідну монотерпенвмісну діючу речовину, зокрема монотерпен, переважно 1,8-цінеол, застосовують у формі чистої речовини, тобто як єдину виділену діючу речовину. Таким чином можливо гарантувати, наприклад завжди постійне дозування відповідно завжди однаковий вміст діючої речовини в лікарській формі згідно з винаходом. Що стосується діючої речовини, що містить терпен відповідно базується на терпені, зокрема особливо діючої речовини 1,8-цінеол, то лікарська форма згідно з винаходом відповідно внутрішні капсули можуть містити 1,8-цінеол як єдину діючу речовину або ж – згідно з однім альтернативним, менш переважним варіантом здійснення – містити діючу речовину 1,8-цінеол принаймні з щонайменше однією іншою діючою речовиною, переважно вибраною з терпенів. Переважно відповідно до винаходу, якщо лікарська форма згідно з винаходом відповідно внутрішні капсули містять 1,8-цінеол як єдину діючу речовину. При цьому в межах даного винаходу може бути передбачено, що монотепренвмісна діюча речовина, зокрема монотерпен, сама утворює ядро капсули або ж переважно з іншими допоміжними речовинами відповідно добавками утворює ядро капсули. Згідно з одним особливим варіантом здійснення лікарська форма, зокрема ядро капсули, містить монотерпенвмісну діючу речовину і/або монотерпен, зокрема 1,8-цінеол, разом з щонайменше одним з діючою речовиною, що містить монотерпен і/або монотерпеном, зокрема 1,8 цінеолом, змішуваним і/або розчинним в ній, зокрема при 20 °C і атмосферному тиску рідким, фізіологічно прийнятними носієм (наповнювачем). Носій відповідно наповнювач сам по собі не повинний мати фармакологічну дію, але з діючою речовиною, що містить монотерпен і/або монотерпеном, зокрема діючою речовиною 1,8-цінеол, утворювати переважно гомогенну суміш або розчин. Згідно з одним переважним відповідно до винаходу варіантом здійснення носій відповідно наповнювач може бути вибраний з групи жирних олій, переважно тригліцеридів, особливо переважно тригліцеридів з ланцюжками середньої довжини (MCT), найбільш переважно тригліцеридів з залишками C6-C12-жирних кислот. Згідно з винаходом переважно, якщо носій відповідно наповнювач застосовують у кількісному співвідношенні діюча речовина, що містить/носій в межах від 1.000 : 1 до 1 : 1.000, зокрема від 100 : 1 до 1 : 100, переважно від 50 : 1 до 1 : 50, особливо переважно від 10 : 1 до 1 : 10, найбільш переважно від 5 : 1 до 1 : 2, ще більш переважно від 3 : 1 до 1 : 1. Завдяки суміші діючої речовини, що містить монотерпен з наповнювачами досягають явно покращеної сумісності діючої речовини, що містить монотерпен з іншими матеріалами капсули і покращеної стабільності, зокрема стійкість при зберіганні. Поняття олій, так як його застосовують відповідно до винаходу для наведених вище носіїв відповідно наповнювачів, представляє собою збірну назву для рідин, які не можуть бути змішані з водою. Поняття жирних олій, так як його застосовують в цьому зв’язку відповідно до винаходу позначає спеціальні жири, тобто суміші тригліцеридів кислот жирного ряду, які є рідкими при кімнатній температурі (зокрема у 20 °C) і атмосферному тиску; зокрема це поняття означає складні ефіри триатомного спирту гліцерин (пропан-1,2-3-триол) з трьома, у більшості випадків різними, переважно парними і нерозгалуженими аліфатичними монокарбоновими кислотами, так званими кислотами жирного ряду. Сполуки цього виду також називають тригліцеридами (згідно з рекомендацією ІЮПАК: триацилгліцерин). Тригліцериди, синонімічно також позначаються як триефіри гліцерину, відповідно представляють собою потрійні складні ефіри трьохатомного спирту гліцерин з трьома молекулами кислоти, причому префікс "три" вказує на три ацильні кислотні залишки, які етерифіковані гліцерином. Особливо тригліцериди з ланцюжками середньої довжини, такі як їх застосовують відповідно до винаходу переважно як носії відповідно наповнювачі для діючої речовини, що містить монотерпен, представляють собою зокрема напівсинтетичні нейтральні складні ефіри гліцерину і насичених, в цілому нерозгалужених моно карбонових кислот з ланцюжками середньої довжини (тобто C6-C12). Зокрема поняття тригліцеридів з ланцюжками середньої довжини позначає суміші тригліцеридів насичених кислот жирного ряду, головним чином каприлової кислоти (октанової кислоти) і капринової кислоти (деканової кислоти). Тригліцериди з ланцюжками середньої довжини в цілому можна одержати з олії, яку екстрагують з твердої і висушеної частини ендосперму з Cocos nucifera L. і/або з висушеного ендосперму з Elaeis guineenses Jacq. Стосовно більш суттєвих подробиць щодо поняття тригліцеридів з ланцюжками середньої довжини можна зробити посилання, наприклад, на монографію Ph. Eur., 6-е видання, видання 2008, сс. від 4224 до 4226, а також на Журнал науки про харчування, том 6 UA 110434 C2 5 10 15 20 25 30 35 40 45 50 55 13, випуск 1/2, 1973, сс. 6 і на інш. стор., D. Sailer et al. " Mittelkettige Triglyceride – Klinische Physiologie і Anwendung "). Рівним чином вміст діючої речовини, яка містить монотерпен в лікарських формах згідно з винаходом може варіюватися в широких межах: зазвичай лікарська форма згідно з винаходом містить діючу речовину, зокрема 1,8-цінеол, в абсолютних кількостях від 10 до 1.000 мг, зокрема від 25 до 750 мг, переважно від 50 до 500 мг, особливо переважно від 75 до 300 мг, в перерахунку на одиницю застосування, зокрема капсулу. При цьому під одиницею застосування в межах даного винаходу слід розуміти зокрема нормовану дозу діючої речовини, яку приготовляють для безпосереднього приймання. Одиниця застосування в сенсі даного винаходу представляє собою, наприклад драже, таблетку або капсулу. В цілому лікарська форма згідно з винаходом містить діючу речовину, зокрема 1,8-цінеол, у відносних кількостях від 0,01 до 99 мас. %, зокрема від 0,1 до 95 мас. %, переважно від 1 до 90 мас. %, особливо переважно від 5 до 80 мас. %, в перерахунку на лікарську форму. В межах даного винаходу одержують особливо гарні результати, коли лікарська форма містить ядро капсули в кількостях від 10 до 1.500 мг, зокрема від 50 до 1.250 мг, переважно від 75 до 1.000 мг, переважно від 100 до 750 мг, особливо переважно від 125 до 500 мг, на капсулу відповідно лікарську форму. Так само може бути передбачено, що лікарська форма має віднесену до ваги частку ядра капсули, в перерахунку на лікарську форму, в межах від 10 до 90 мас. %, зокрема від 20 до 85 мас. %, переважно від 40 до 80 мас. %, переважно від 50 до 75 мас. %, особливо переважно від 60 до 70 мас. %,. Далі що стосується першої оболонки капсули лікарської форми згідно з винаходом, то вона може складатися з великої кількості матеріалів. Однак в межах даного винаходу одержують особливо гарні результати, коли перша оболонка капсули виконана як м’яка капсула відповідно м’яка капсульна оболонка. З цією метою може бути передбачено, що матеріал капсульної оболонки першої оболонки капсули містить щонайменше один фармакологічно прийнятний полімер або складається з нього. При цьому переважно фармакологічно прийнятний полімер вибраний з синтетичних, природних або ідентичних натуральним полімерів і полімеризатів. Крім того в межах даного винаходу переважно, коли щонайменше один фармакологічно прийнятний полімер вибирають з групи білків, переважно желатину і/або казеїнатів, переважно желатину, а також їх сумішей і комбінацій. В межах даного винаходу одержують особливо гарні результати, коли матеріал капсульної оболонки першої оболонки капсули містить желатин, зокрема твердий або м’який желатин, переважно м’який желатин, або складається з нього. У зв’язку з цим може бути передбачено, що желатин застосовують разом з щонайменше однією іншою добавкою або допоміжною речовиною. Якщо желатин застосовують разом з щонайменше однією іншою добавкою або допоміжною речовиною, то виявилося придатним, коли іншу добавку або іншу допоміжну речовину вибирають з пластифікаторів, регуляторів вологості й змащувальних речовин, а також їх сумішей і комбінацій. Переважно у цьому випадку кількість добавки або допоміжної речовини у цілому складає від 0,01 до 40 мас. %, зокрема від 0,1 до 35 мас. %, переважно від 1 до 30 мас. %, в перерахунку на першу оболонку капсули. Вибір м’якого желатину як першого матеріалу для капсульної оболонки має ту перевагу, що при належному виборі наповнювача відповідно носія для ядра капсули не слід очікувати взаємодію між діючою речовиною і желатином відповідно вона не спостерігалася заявником. Крім того, желатин дозволений як харчовий продукт і є фізіологічно сумісним, безпечним для здоров’я і має прекрасні механічні властивості, зокрема коли інкапсулюють рідкі не водні речовини. Крім того, м’які желатинові капсули справляють приємне враження на дотик у порівнянні з твердими капсулами і з причини високої гладкості поверхні, а також здатності до деформування будуть краще сприйматися споживачем, ніж тверді капсули. В цілому лікарська форма згідно з винаходом містить першу оболонку капсули в кількостях від 40 до 500 мг, зокрема від 50 до 400 мг, переважно від 60 до 300 мг, переважно від 70 до 250 мг, особливо переважно від 80 до 200 мг, на лікарську форму відповідно капсулу. Далі може бути передбачено, що лікарська форма має віднесену до ваги частку першої оболонки капсули, в перерахунку на лікарську форму, в межах від 15 до 75 мас. %, зокрема від 20 до 65 мас. %, переважно від 25 до 55 мас. %, переважно від 30 до 50 мас. %, особливо переважно від 35 до 45 мас. %. 7 UA 110434 C2 5 10 15 20 25 30 35 40 45 50 55 60 При вищезгаданих абсолютних кількостях відповідно відносних частках кількості для першої оболонки капсули забезпечується, що перша оболонка капсули в цілому має чудові механічні властивості й захищає ядро капсули від небажаних механічних і хімічних впливів, причому одночасно може бути досягнуто контрольоване відтворюване вивільнення діючої речовини. Що стосується матеріалів другої оболонки капсули, то в межах обсягу даного винаходу вони також можуть варіюватися в широкому діапазоні. Були отримані особливо хороші результати, коли друга оболонка капсули як перший компонент ("компонент 1") містить щонайменше один альгінат, зокрема вибраний з альгінатів лужних металів, альгінатів лужноземельних металів, альгінатів амонію і складних ефірів альгінової кислоти, переважно вибраний з альгінату натрію, альгінату калію, альгінату амонію, альгінату кальцію і альгінату пропіленгліколю, переважно вибраний з альгінату натрію, альгінату калію, альгінату амонію і альгінату кальцію, особливо переважно альгінату натрію. Як вже було наведено вище, друга оболонка капсули поряд з першим компонентом на основі альгінової кислоти відповідно її фізіологічно прийнятних солей або складних ефірів також містить ще один другий компонент на основі целюлози("компонент 2"). При цьому в контексті даного винаходу переважно, якщо друга оболонка капсули як другий компонент містить целюлозу або похідне целюлози, зокрема простий ефір целюлози або складний ефір целюлози. В цьому контексті, виявилося особливо корисним, якщо другий компонент вибраний з простих ефірів целюлози, переважно з групи метилцелюлози, етилцелюлози, етилметилцелюлози, гідроксипропілцелюлози, гідроксипропілметилцелюлози, карбоксиметилцелюлози або їх комбінацій, переважно етилцелюлози. Як виявилося в контексті даного винаходу, властивості другої оболонки капсули визначаються відповідно піддаються впливу не тільки за рахунок вибору матеріалів (альгінової кислоти відповідно альгінату з одного боку і целюлози відповідно похідних целюлози з іншого боку), але й також внаслідок їх кількісного співвідношення. Відповідно до однієї переважної форми виконання даного винаходу друга оболонка капсули має перший і другий компонент у віднесеному до ваги співвідношенні першого компонента до другого компонента (вагове співвідношення компонент1/компонент 2), переважно вагове співвідношення альгінової кислоти відповідно альгінат/целюлоза відповідно похідного целюлози, від 1 : 99 до 50 : 50, зокрема від 5 : 95 до 40 : 60, переважно від 8 : 92 до 30 : 70, переважно від 10 : 90 до 25 : 75, особливо переважно від 12 : 88 до 20 : 80. Застосовану в межах даного винаходу другу оболонку капсули наносять явно простіше, тобто зі значно меншими витратами на обладнання, також менше вихідних речовин, ніж до нині в рівні техніки звичайні капсульні оболонки відповідно покриття; крім того друга оболонка капсули є значно дешевшою і економічною і її наносять з більш високою пропускною здатністю на капсули, ніж це можливо для подібних капсул з рівня техніки. Зокрема комбінація альгінової кислоти відповідно солей або складних ефірів альгінової кислоти з одного боку і целюлози відповідно похідних целюлози з іншого боку забезпечує другу оболонку капсули відповідно покриття, яке виключним чином придатне як покриття уповільненого вивільнення для контрольованого і уповільненого вивільнення діючої речовини, що містить монотерпен. Друга оболонка капсули надійно захищає першу оболонку капсули, а також ядро капсули від впливів навколишнього середовища, зокрема від впливу кисню повітря, а також від водних кислот, внаслідок чого можна досягти стійкості до дії шлункового соку лікарської форми згідно з винаходом відповідно капсули. З іншого боку лікарська форма згідно з винаходом – зокрема внаслідок наявності альгінової кислоти відповідно альгінатів – може контрольовано розчинятися відповідно розкладатися у слабо лужних або нейтральних водних середовищах (тобто в середовищі тонкого кишечнику), завдяки чому можна досягти контрольованого уповільненого вивільнення діючої речовини, що містить монотерпен. Зокрема у наведених раніше віднесених до ваги співвідношеннях альгінової кислоти (похідного) до целюлози (похідного) можна отримати особливо ефективне покриття уповільненого вивільнення. Крім того, застосована відповідно до винаходу друга оболонка капсули прилипає значно краще до першої оболонки капсули, ніж порівняні капсульні оболонки відповідно покриття з відомого рівня техніки, які в цілому виконані на основі похідних (мет-)акрилової кислоти ® відповідно (мет-)акрилатів (наприклад Eudragit ). В контексті даного винаходу також може буде передбачено, що друга оболонка капсули поряд з альгіновою кислотою(похідними) і целюлозою(похідними) містить ще інші складові частини. Зокрема може бути передбачено, що друга оболонка капсули має щонайменше одну іншу складову частину або інгредієнт, зокрема вибрані з добавок або допоміжних речовин, переважно з жирних олій і/або кислот жирного ряду, особливо переважно вибраних з групи 8 UA 110434 C2 5 10 15 20 25 30 35 40 45 50 55 стеаринової кислоти, олеїнової кислоти і тригліцеридів, а також їх сумішей і комбінацій. В цьому зв’язку є переважним, коли тригліцериди вибрані з тригліцеридів з ланцюжками середньої довжини (MCT), переважно з тригліцеридів з залишками C 6-C12-жирних кислот. Так само ж одержують особливо гарні результати, якщо кількість іншої складової частини або інгредієнту у цілому складає від 0,01 до 35 мас. %, зокрема від 0,1 до 30 мас. %, переважно від 1 до 25 мас. %, в перерахунку на другу оболонку капсули. Наведені раніше допоміжні речовини і добавки застосовують головним чином і зокрема як пластифікатори, завдяки чому друга оболонка капсули лікарської форми згідно з винаходом і тим самим лікарська форма у цілому набуває більш високої еластичності й може краще протидіяти механічним навантаженням. Крім того, добавки і допоміжні речовини ще раз підвищують сумісність другої оболонки капсули з першою оболонкою капсули, зокрема якщо вони виконані на основі желатину. Таким чином підвищується довготривала стабільність лікарської форми згідно з винаходом. Щоб підвищити сумісність між першою і другою оболонкою капсули допоміжні речовини або добавки, додані до другої оболонки капсули, в значній мірі відповідають допоміжним речовинам відповідно добавкам ядра капсули. В межах одержання лікарської форми відповідно до винаходу, крім того, виявилося сприятливим, якщо другу оболонку капсули підлуговують, тобто друга оболонка капсули має лужне значення pH (pH > 7). Лужне значення pH уможливлює нанесення застосовної згідно з винаходом другої оболонки капсули на першу оболонку капсули у формі дисперсії або розчину. Що стосується кількостей відповідно віднесених до ваги часток другої оболонки капсули щодо лікарської форми, то виявилося сприятливим, якщо лікарська форма містить другу оболонку капсули в кількостях від 0,5 до 100 мг, зокрема від 1 до 75 мг, переважно від 1 до 50 мг, переважно від 2 до 40 мг, особливо переважно від 3 до 35 мг, найбільш переважно від 5 до 30 мг, в перерахунку на лікарську форму. Так само одержують особливо гарні результати, якщо лікарська форма має віднесену до ваги частку другої оболонки капсули, в перерахунку на лікарську форму, в межах від 0,5 до 25 мас. %, зокрема від 1 до 20 мас. %, переважно від 1 до 15 мас. %, переважно від 1,5 до 8 мас. %, особливо переважно від 2 до 4 мас. %. Що стосується розмірів лікарської форми відповідно капсули відповідно товщини окремих шарів відповідно капсульних оболонок, то в межах даного винаходу вони можуть варіюватися в широкому діапазоні. Однак одержують особливо гарні результати, якщо діаметр, зокрема середній діаметр, лікарської форми варіюється в межах від 50 мкм до 100 мм, зокрема в межах від 100 мкм до 75 мм, переважно в межах від 250 мкм до 60 мм, особливо переважно в межах від 500 мкм до 50 мм, найбільш переважно в межах від 750 мкм до 30 мм, ще більш переважно в межах від 1.000 мкм до 25 мм. В цих діапазонах в контексті даного винаходу можна одержати механічно стійкі капсули, які ефективно захищають діючу речовину, що містить монотерпен, від впливів навколишнього середовища, причому може бути досягнуто контрольоване вивільнення діючої речовини, зокрема уповільнене вивільнення діючої речовини при контрольованих умовах. Крім того, в межах даного винаходу може бути передбачено, що перша оболонка капсули має товщину, зокрема середню товщину, в межах від 0,01 до 8 мм, зокрема від 0,05 до 7 мм, переважно від 0,1 до 6 мм, переважно від 0,2 до 5 мм, особливо переважно від 0,5 до 4 мм, найбільш переважно від 1 до 3 мм. У випадку першої оболонки капсули з середньою товщиною у наведеному вище діапазоні можна одержати від гарних до виключних механічних властивостей капсули, а також контрольоване вивільнення діючої речовини. Далі в межах даного винаходу може бути передбачено, що друга оболонка капсули має товщину, зокрема середню товщину, в межах від 0,01 до 3 мм, зокрема від 0,05 до 2,5 мм, переважно від 0,07 до 2 мм, переважно від 0,08 до 1,5 мм, особливо переважно від 0,1 до 1 мм, найбільш переважно від 0,2 до 0,5 мм. Друга оболонка капсули з товщиною у наведеному вище діапазоні може так само як посилювати механічні властивості лікарської форми у цілому, так і гарантувати контрольоване відповідно уповільнене вивільнення діючої речовини. В контексті даного винаходу одержують особливо гарні результати, якщо співвідношення товщини першої оболонки капсули до товщини другої оболонки капсули складає від 500 : 1 до 1 : 1, зокрема від 100 : 1 до 2 : 1, переважно від 50 : 1 до 5 : 1. Крім того, може бути передбачено, що віднесене до ваги співвідношення першої оболонки капсули до другої оболонки капсули складає від 1 : 1 до 50 : 1, зокрема від 2 : 1 до 30 : 1, переважно від 3 : 1 до 25 : 1, переважно від 5 : 1 до 20 : 1. Таким чином, в контексті даного винаходу можливо прицільно припасовувати товщину і властивості першої і другої оболонки капсули до відповідного випадку застосування або до 9 UA 110434 C2 5 10 15 20 25 30 35 40 45 50 55 відповідних потреб застосування і лікарську форму згідно з винаходом пристосовувати до нових діючих речовин відповідно нових комбінацій діючих речовин. Крім того, якщо поверхня другої оболонки капсули є більш гладкою, ніж поверхня порівняних капсульних оболонок відповідно покриття з відомого рівня техніки, то внаслідок цього лікарська форма згідно з винаходом здається м’якішою і більш гладкою і тим самим є приємною на дотик. Окрім цього, завдяки більш гладкій поверхні другої оболонки капсули лікарська форма згідно з винаходом є краще придатною, тому що її простіше застосовувати перорально відповідно приймати і при ковтанні у споживача створюється приємне відчуття. Далі, в контексті даного винаходу може бути передбачено, що лікарська форма згідно з винаходом має зовнішнє, оточуване другу оболонку капсули, зокрема оточуване безпосередньо другу оболонку, покриття, зокрема на основі лаків або восків, а також їх сумішей і комбінацій. Подібне додаткове покриття ще раз значно підвищує довготривалу стабільність лікарської форми згідно з винаходом і крім того, покращує властивості уповільнення; також зокрема підвищуються однак оптичні властивості, такі як наприклад блиск, а також сприйняття на дотик, внаслідок чого лікарська форма згідно з винаходом в цілому отримує приємний зовнішній вигляд. Завдяки такому додатковому покриттю, зокрема воском, крім того, ще раз покращується гладкість поверхні лікарської форми згідно з винаходом, внаслідок чого лікарську форму згідно з винаходом можна простіше розфасовувати у більш великі одиниці упаковки, такі як наприклад блістерні упаковки і уникати неправильного упаковування, тобто це покриття зокрема на основі лаків або восків має не тільки оптичні переваги, але й у значній мірі також покращує здатність до ковзання лікарської форми згідно з винаходом (наприклад, при заповненні блістерних заглиблень в блістерних упаковках), так що уникають можливих ушкоджень при розфасуванні відповідно закочуванні. В межах даного винаходу одержують особливо гарні результати, коли лікарська форма має необов’язково наявне покриття в кількостях від 0,001 до 20 мг, зокрема від 0,01 до 10 мг, переважно від 0,1 до 1 мг, переважно від 0,2 до 0,5 мг. Так само може бути передбачено, що лікарська форма має віднесену до ваги частку необов’язкового зовнішнього покриття, в перерахунку на лікарську форму, від 0,01 до 1 мас. %, зокрема від 0,01 до 0,5 мас. %, переважно від 0,02 до 0,3 мас. %, переважно від 0,05 до 0,15 мас. %. Відповідно до однієї переважної форми виконання даного винаходу зовнішнє покриття може бути виконане зокрема на основі восків, зокрема на основі канделільського воску, карнаубського воску або бджолиного воску. При цьому особливо переважним в межах даного винаходу, якщо зовнішнє покриття складається з канделільського воску. Як вже згадувалося вище, лікарська форма згідно з винаходом відрізняється виключною довготривалою стабільністю відповідно стійкістю при зберіганні. В контексті даного винаходу може при цьому бути передбачено, що лікарська форма при температурі в межах від 25 °C до 40 °C і при відносній вологості повітря від 50 % до 80 % є стабільною при зберіганні щонайменше 6 місяців, зокрема щонайменше 12 місяців, переважно щонайменше 18 місяців, переважно щонайменше 24 місяців, особливо переважно щонайменше 36 місяців, зокрема є стабільною при зберіганні відповідно до стандарту МКГ (Міжнародна конференція з гармонізації технічних вимог до реєстрації фармацевтичних продуктів, призначених для застосування людиною). В цьому зв’язку зокрема може бути передбачено, що лікарська форма при температурі у 40 °C і при відносній вологості повітря у 75 % є стабільною при зберіганні щонайменше 6 місяців. Зокрема може бути передбачено, що лікарська форма при температурі у 30 °C і при відносній вологості повітря у 65 % є стабільною при зберіганні щонайменше 12 місяців. Переважно може бути передбачено, що лікарська форма при температурі у 25 °C і при відносній вологості повітря у 60 % є стабільною при зберіганні щонайменше 36 місяців. Крім того, в межах даного винаходу переважно, якщо лікарська форма під впливом 0,1 N соляної кислоти при 37 °C і при постійному перемішуванні, зокрема при перемішуванні, по суті щонайменше залишається нерозкладеною, зокрема залишається структурно неушкодженою протягом періоду часу у 2 години. Так само є переважним, якщо лікарська форма під впливом фосфатного буферу зі значенням pH приблизно у 6,8 при 37 °C і при постійному ворошінні відповідно промішуванні, зокрема при перемішуванні, принаймні в основному розкладається, зокрема повністю розкладається протягом періоду часу в одну годину. Лікарська форма відповідно до винаходу придатна для великої кількості застосувань, зокрема для одержання лікарських засобів, таких як будуть представлені надалі. Інші переважні властивості, аспекти і ознаки даного винаходу виходять з наступного опису представленого на фігурі приклада виконання. Показано: 10 UA 110434 C2 5 10 15 20 25 30 35 40 45 50 55 Фіг.1 схематичне зображення у розрізі лікарської форми згідно з винаходом, що містить монотерпен згідно з одним варіантом здійснення даного винаходу. На єдиній фігурі представлена лікарська форма згідно з винаходом, призначена для перорального застосування, виконана у вигляді капсули, що містить монотерпен 1 згідно з одним варіантом здійснення даного винаходу. Як видно з зображення фігури, лікарська форма 1 сконструйована у вигляді капсули зі структурою ядро/оболонка, причому лікарська форма 1 має ядро капсули 2, що містить монотерпен і оточувану це ядро капсули 2 першу оболонку капсули 3. Перша оболонка капсули 3 у свою чергу оточується другою оболонкою капсули відповідно покриттям 4, причому на другу оболонку капсули відповідно покриття 4 може бути нанесене додаткове зовнішнє покриття 5 (наприклад віск). Для більш докладних подробиць стосовно представленого на фігурному зображенні варіанта виконання з метою уникнення зайвих повторень можна посилатися на зазначені вище форми виконання, які застосовуються відповідним чином щодо фігурного зображення. Іншим об’єктом даного винаходу – згідно з другим аспектом даного винаходу – є спосіб одержання лікарської форми, що містить монотерпен для перорального застосування у вигляді капсули, зокрема у вигляді капсули зі структурою ядро/оболонка з багатошаровою оболонкою, зокрема такі як були описані вище у зв’язку з лікарською формою згідно з винаходом, причому (i) в першій стадії способу ядро капсули, яке містить щонайменше одну монотерпенвмісну діючу речовину, зокрема щонайменше один монотерпен, забезпечують першою оточуваною ядро капсули, зокрема безпосередньо оточуваною ядро капсули, оболонкою капсули, яка надає структуру і/або форму і (ii) в наступній другій стадії способу першу оболонку капсули забезпечують другою оболонкою капсули, яка оточує першу оболонку капсули, зокрема оточує безпосередньо першу оболонку капсули, переважно у формі покриття, зокрема у формі стійкого до дії шлункового соку, але розчинного у тонкому кишечнику покриття, причому для одержання другої оболонки капсули застосовують щонайменше два компоненти, причому перший компонент ("компонент 1") виконаний на основі альгінової кислоти або її фізіологічно прийнятних солей або складних ефірів і другий компонент («компонент 2») виконаний на основі целюлози. Стадію процесу (i) при цьому здійснюють відомим в рівні техніки способом. Так наприклад при застосування м’якого желатину як першої оболонки капсули, перша оболонка капсули з поміщеним в неї ядром капсули може бути виготовлена відповідно до ротаційно-матричного способу (rotary die), який сам по собі відомий спеціалісту в даній галузі техніки і не потребує подальшого пояснення. В контексті способу згідно з винаходом крім того, виявилося придатним, якщо перший і другий компонент для одержання другої оболонки капсули наносять сумісно, переважно у вигляді сумісного розчину і/або дисперсії, зокрема у вигляді водного розчину і/або дисперсії. Таким чином досягають особливо гомогенного і гарного перемішування обох компонентів і тим самим одержують рівномірне покриття, яке сприяє контрольованому вивільненню діючої речовини, що містить монотерпен. Крім того, в межах даного винаходу може бути передбачено, що розчин і/або дисперсію підлуговують, зокрема водним розчином аміаку. Цей спосіб дії є переважним зокрема при застосуванні альгінату як першого компонента другої оболонки капсули, тому що таким чином досягається гарна розчинність відповідно здатність до диспергування альгінату у водному середовищі. Що стосується нанесення розчину відповідно дисперсії для одержання другої оболонки капсули, то його можна здійснювати різними способами і при різноманітних умовах способу. Однак в межах даного винаходу одержують особливо гарні результати, якщо розчин і/або дисперсію наносять при температурах в межах від 10 до 70 °C, зокрема від 15 до 60 °C, переважно від 20 до 50 °C, переважно від 25 до 40 °C. Однією особливістю способу згідно з винаходом є те, що нанесення розчину і/або дисперсії, що містить обидва компоненти для одержання другої оболонки капсули, також можна здійснювати при кімнатній температурі і при цьому одержують стабільну, зокрема довготривало стабільну і придатну для механічних навантажень другу оболонку капсули відповідно покриття. При нанесенні розчину і/або дисперсії для одержання другої оболонки капсули крім того, є переважним, якщо розчин відповідно дисперсія має вміст твердої речовини від 10 до 25 мас. %. В цілому розчин і/або дисперсію наносять за допомогою способу занурювання і/або розпилення, зокрема за допомогою способу розпилення. Таке нанесення покриття розпиленням можна здійснювати наприклад за допомогою так званого дражувального котла (pan coater), в якому при постійному ворошінні безперервно розчином для нанесення покриття звичайно 11 UA 110434 C2 5 10 15 20 25 30 35 40 45 50 55 обприскують декілька тисяч капсул і при одержанні в промисловому масштабі до декількох сотень тисяч і навіть до декількох мільйонів капсул. Крім того, може в контексті даного винаходу бути передбачено, що в межах способу згідно з винаходом ще передбачена заключна стадія процесу (iii). Зокрема у цьому зв’язку може бути передбачено, що в заключній стадії (iii) наносять щонайменше одне покриття, зокрема на основі лаків або восків, а також їх сумішей і комбінацій, на другу оболонку капсули, зокрема наносять безпосередньо на другу оболонку капсули. Нанесення додаткового покриття в стадії способу (iii) ще раз значно покращує зокрема поверхневі властивості лікарської форми згідно з винаходом. Для більш докладної інформації щодо способу згідно з винаходом може бути зроблене посилання на зазначені вище варіанти виконання лікарської форми згідно з винаходом, які застосовуються відповідним чином відносно способу згідно з винаходом. Іншим об’єктом даного винаходу – згідно з третім аспектом даного винаходу – є застосування описаної вище лікарської форми, що містить монотерпен, відповідно до винаходу в медицині або ветеринарії відповідно для профілактичного і/або терапевтичного лікування організмів людей або тварин. Таким чином лікарська форма згідно з винаходом, що містить монотерпен може бути застосована, наприклад, для профілактичного і/або терапевтичного лікування запальних, загострених внаслідок інфекції або алергійних захворювань організмів людей або тварин відповідно для одержання лікарського засобу для профілактичного і/або терапевтичного лікування запальних, загострених внаслідок інфекції або алергійних захворювань організмів людей або тварин. Рівним чином лікарська форма згідно з винаходом, що містить монотерпен може бути застосована, наприклад, для профілактичного і/або терапевтичного лікування відповідно для одержання лікарського засобу для профілактичного і/або терапевтичного лікування аутоімунних захворювань організмів людей або тварин. Далі лікарська форма згідно з винаходом, що містить монотерпен може застосовуватися для профілактичного і/або терапевтичного лікування відповідно для одержання лікарського засобу для профілактичного і/або терапевтичного лікування застудних хвороб і грипозних інфекцій і разом з ними пов’язаних інфекцій і захворювань, зокрема інфекцій верхніх і нижніх дихальних шляхів, зокрема риніту, синуситу і бронхопульмональних захворювань. Далі згідно з винаходом лікарська форма, що містить монотерпен може застосовуватися для профілактичного і/або терапевтичного лікування відповідно для одержання лікарського засобу для профілактичного і/або терапевтичного лікування захворювань дихальних шляхів, зокрема бронхопульмональних захворювань, зокрема бронхіту, бронхіальної астми і хронічних обструктивних захворювань легенів (ХОЗЛ). В цьому зв’язку також можливе сумісне медикаментозне лікування з іншими терапевтичними відповідно лікарськими засобами, зокрема кортикостероїдами. Рівним чином лікарська форма згідно з винаходом, що містить монотерпен може бути також застосована для профілактичного і/або терапевтичного лікування відповідно для одержання лікарського засобу для профілактичного і/або терапевтичного лікування запальних захворювань жовчних шляхів, зокрема холециститу і холангіту. Крім того, лікарська форма, що містить монотерпен відповідно до даного винаходу може також застосовуватися для профілактичного і/або терапевтичного лікування відповідно для одержання лікарського засобу для профілактичного і/або терапевтичного лікування запальних захворювань сечовивідних шляхів, зокрема гломерулонефриту, пієлонефриту, циститу і уретриту. Рівним чином лікарська форма згідно з винаходом, що містить монотерпен може застосовуватися для профілактичного і/або терапевтичного лікування відповідно для одержання лікарського засобу для профілактичного і/або терапевтичного лікування запальних захворювань кишечнику, зокрема хвороби Крона і виразкового коліту. Крім того, також можливо, що лікарську форму згідно з винаходом, що містить монотерпен застосовують при профілактичному і/або терапевтичному лікуванні відповідно для одержання лікарського засобу для профілактичного і/або терапевтичного лікування запальних або алергійних захворювань шкіри, зокрема екзем і дерматитів. Рівним чином лікарська форма згідно з винаходом, що містить монотерпен може застосовуватися для профілактичного і/або терапевтичного лікування відповідно для одержання лікарського засобу для профілактичного і/або терапевтичного лікування ревматоїдних захворювань, зокрема артриту і/або ревматизму, а також захворювань ревматичної клініко-морфологічної групи. 12 UA 110434 C2 5 10 15 20 25 30 35 40 45 50 55 Насамкінець лікарська форма згідно з винаходом, що містить монотерпен може також застосовуватися для профілактичного і/або терапевтичного лікування відповідно для одержання лікарського засобу для профілактичного і/або терапевтичного лікування системних захворювань, що підлягають лікуванню кортикостероїдами, зокрема захворювань, які лікують шляхом системного введення кортикостероїдів. Це зокрема є придатним при застосуванні 1,8цінеолу як діючої речовини, яка містить монотерпен, тому що 1,8-цінеол має подібний до кортикостероїдів фармакологічний профіль дії. У всіх наведених вище застосуваннях можливе сумісне медикаментозне лікування з щонайменше одним іншим терапевтичним засобом і/або лікарським засобом. В контексті застосування згідно з винаходом діючу речовину, що містить монотерпен, зокрема 1,8-цінеол, вводять в добовій дозі від 50 до 3.000 мг/добу, зокрема від 100 до 2.000 мг/добу, переважно від 200 до 1.000 мг/добу, відповідно діючу речовину, що містить монотерпен, зокрема 1,8-цінеол, готують для введення в добовій дозі від 50 до 3.000 мг/добу, зокрема від 100 до 2.000 мг/добу, переважно від 200 до 1.000 мг/добу. Для більш докладної інформації щодо застосування згідно з винаходом, щоб уникнути непотрібних повторень вищевикладеного, можуть бути зроблені посилання на варіанти виконання лікарської формі згідно з винаходом, і способу одержання згідно з винаходом, які відповідним чином мають силу у відношенні застосування відповідно до винаходу. Насамкінець об’єктом даного винаходу – згідно з четвертим аспектом даного винаходу – є лікарський засіб або медичний продукт, який містить лікарську форму, що містить монотерпен, зокрема цінеол, яка була описана вище. В контексті лікарського засобу або медичного продукту згідно з винаходом лікарський засіб або медичний продукт зокрема готують для введення діючої речовини, яка містить монотерпен, зокрема 1,8-цінеол, в добовій дозі від 50 до 3.000 мг/добу, зокрема від 100 до 2.000 мг/добу, переважно від 200 до 1.000 мг/добу. Для більш докладної інформації щодо лікарського засобу або медичного продукту згідно з винаходом, щоб уникнути непотрібних повторень вищевикладеного, можуть бути зроблені посилання на варіанти виконання лікарської формі згідно з винаходом, способу одержання згідно з винаходом і застосування згідно з винаходом які відповідним чином мають силу у відношенні лікарського засобу або медичного продукту відповідно до винаходу. Інші варіанти здійснення, зміни і варіації, а також переваги даного винаходу є без ускладнень очевидними для спеціаліста в даній галузі техніки при ознайомленні з описом і можуть бути реалізовані ним, при цьому не виходячи за межі даного винаходу. Даний винахід наочно пояснюється за допомогою наведених нижче прикладів здійснення, однак які ні в якому разі не обмежують даний винахід. Приклади здійснення 1. Приклади виготовлення: Приклад A: Лікарську форму згідно з винаходом виготовляють у вигляді капсули зі структурою ядро/оболонка наступним чином: спочатку одержують гомогенну суміш на основі 1,8-цінеолу з одного боку і тригліцеридів з ланцюжками середньої довжини з іншого боку у ваговому співвідношенні приблизно у 2 : 1 і відповідно до так званого ротаційно-матричного способу (синонімічно також позначається як "спосіб Шерера") відомим спеціалісту в даній галузі техніки способом поміщають у м’які желатинові капсули відповідно обробляють до одержання м’яких желатинових капсул. Суміш із 1,8-цінеолу й тригліцеридів з ланцюжками середньої довжини утворює ядро капсули лікарської форми згідно з винаходом, і м’який желатин представляє собою першу оболонку капсули. Ядро капсули має вагу у прибл. 150 мг. Матеріал першої оболонки капсули поряд з желатином містить приблизно 12 мас. % сорбітолу, а також приблизно 15 мас. % гліцерину. Потім одержані таким чином м’які желатинові капсули у так званому дражувальному котлі за допомогою нанесення покриття розпиленням забезпечують другою оболонкою капсули. З цією метою капсули при кімнатній температурі обприскують водною дисперсією етилцелюлози і альгінату натрію, окремі складові частини яких є комерційно доступними, у віднесеному до ваги співвідношенні етилцелюлози/альгінату натрію у 6 : 1. Перед цим дисперсію підлуговують аміаком і до того ж вміст твердої речовини складає прибл. 10 мас. %. Далі дисперсія поряд з етилцелюлозою і альгінатом натрію містить ще незначні кількості олеїнової кислоти, стеаринової кислоти і тригліцеридів з ланцюжками середньої довжини. Для нанесення покриття на 1 мільйон капсул необхідно прибл. 10 годин, щоб одержати капсули зі стабільною другою капсульною оболонкою бажаної товщини шару. 13 UA 110434 C2 5 10 15 20 25 30 35 40 45 50 55 60 У заключній стадії способу поверхню капсули обробляють невеликими кількостями канделільского воску. Одержують лікарську форму згідно з винаходом у формі капсули ядро/оболонка з описаною віще будовою. Приклад Б: Приклад Б здійснюють аналогічно до прикладу A, однак при цьому ядро капсули має вагу приблизно у 300 мг. Приклади від В до Е: Далі одержують чотири наступні лікарські форми згідно з винаходом відповідно до прикладу A, однак при цьому співвідношення компонентів суміші 1,8-цінеолу до тригліцеридів варіюється в межах від 10 : 1 до 1 : 5 і крім того, в лікарській формі (Приклад E) 1,8-цінеол застосовують як чисту речовину. Точні співвідношення компонентів суміші представлені в таблиці 1. Приклади від Ж до І: Крім того, здійснюють чотири в свою чергу додаткові приклади виготовлення для лікарських форм згідно з винаходом відповідно до прикладу A, однак при цьому співвідношення альгінату натрію до етилцелюлози в другій оболонці капсули варіюється в межах від 1 : 2 до 4 : 1. Точні співвідношення представлені в таблиці 1. Приклади від К і Л: Наприкінці здійснюють ще два інших приклади виготовлення згідно з винаходом для лікарських форм згідно з винаходом відповідно до прикладу A, однак при цьому в прикладі К друга оболонка капсули не має ні стеаринової кислоти, ні кислоти жирного ряду або тригліцеридів. Приклад Л відповідає прикладу A, однак в ньому відмовляються від заключного покриття відповідно обробки канделільским воском. Приклади від M до O (порівняння): За зразком прикладу виготовлення A здійснюють три порівняльних приклади, однак в яких кожного разу варіюється матеріал другої оболонки капсули, який відрізняється від лікарської форми згідно з винаходом. У прикладі M застосовують покриття з поліметакрилату, яке є наявним у продажу під ® торговельною назвою Eudragit . Для нанесення цього покриття відповідну дисперсію при 80 °C розбризкують на капсули, причому для покриття від 1 мільйона капсули потрібний час складає від 15 годин. Для одержання потрібно апаратурне дороге обладнання для виготовлення з системою нагрівання і гомогенізаторами. Приклад виготовлення Н відповідає прикладу A, однак при цьому матеріал другої оболонки капсули не містить альгінат. Приклад виготовлення O відповідає прикладу виготовлення A, однак при цьому матеріал другої оболонки капсули не містить етилцелюлози. 2. Дослідження і спостерігання за застосуванням: Виготовлені згідно з прикладами від A до O капсули досліджують і оцінюють відносно їх дотикових і оптичних властивостей (гладкість поверхні й блиск), властивостей відокремлення другої оболонки капсули від першої оболонки капсули, а також їх характеристик розчинення у штучно створеному шлунковому соку відповідно штучно створеному кишковому соку. Крім того, досліджували здатність витримувати механічні навантаження за допомогою навантаження тиском ("випробування вдавлюванням") при визначеному впливі тиском. Відповідні результати зібрані в таблиці 1. Стійкість до дії шлункового соку відповідно розчинність у тонкому кишечнику капсул визначають відповідно до стандартів згідно з European Pharmacopoeia 7.0, 04/2010: 1502, сс. від 707 до 709, ключове слово "Capsules", підрозділ "Gastro-Resistant Capsules", а також European Pharmacopoeia 7.1, 04/2011: 20901, сс. 3331 і 3332, ключове слово "2.9.1 Disintergration of Tablets and Capsules". Капсули повинні зберігатися неушкодженими при обробці протягом щонайменше 2 годин у штучно створеній рідині шлункового соку, яка складається з 0,1 N соляної кислоти, при температурах в межах від 35 до 39 °C і при постійному перемішуванні так, щоб діюча речовина не вивільнялась, щоб відносити їх до стійких до дії шлункового соку. Для тестування розчинності у тонкому кишечнику потім капсули перемішували у розчині фосфатного буферу, який встановлювали до значення pH у 6,8, при перемішуванні при температурах в межах від 35 до 39 °C. У цьому тесті капсули повинні були руйнуватися протягом однієї години щонайменше у цілому, щоб вміст капсули вивільнився. Стійкість до дії шлункового соку і розчинність у тонкому кишечнику оцінюють якісно за допомогою шкалі оцінювання від "+" до "+++": "+++" відповідає повній стійкості до дії штучного шлункового соку відповідно контрольованому, уповільненому вивільненню діючих речовин у штучному кишковому соку. "++" відповідає розм’якшенню відповідно поверхневому ушкодженню капсули у штучному шлунковому соку, однак при цьому діюча речовина не вивільняється, 14 UA 110434 C2 5 10 15 20 25 30 відповідно повному вивільненню діючої речовини у штучному кишковому соку, причому тривалість вивільнення може більше не регулюватися точно. "+" відповідає розм’якшенню відповідно поверхневому ушкодженню капсули у штучному шлунковому соку, причому також може відбутися вивільнення діючої речовини, відповідно ледве ще контрольоване відповідно неповне вивільнення діючої речовини у штучному кишковому соку. Гладкість поверхні, блиск і властивості відокремлення оцінюють відповідно до шкільної системи оцінювання від "1" до "6", причому оцінка "1" означає як дуже гарно і оцінка "6" є незадовільною. Як можна побачити з даних в таблиці 1, капсули відповідно до приклада A мають найкращі властивості – я відносно їх характеристик розчинення, так і відносно їх оптичних і механічних властивостей. Значення для прикладу Б в межах похибки вимірювання є ідентичними зі значеннями з прикладу A, що демонструє, що зміна розміру ядра капсули не має взагалі відповідно не має суттєвого впливу на характеристики розчинення відповідно механічні, оптичні і дотикові властивості капсул. Однак виявилося несподіваним, що зміна співвідношення діючої речовини, яка містить монотерпен до носія відповідно наповнювача у ядрі капсули може вплинути як на характеристики розчинення, так і на оптичні й дотикові властивості капсул (див. приклади від В до Е у таблиці 1). Приклади від В до Е у порівнянні з прикладом A мають трохи погіршені властивості, однак все ще явно більш продуктивні ніж порівняльні приклади від M до O. Далі значення таблиці 1 підтверджують, що заміна альгінату на етилцелюлозу у другій оболонці капсули як і варто було очікувати впливає на характеристики розчинення капсул, однак крім цього також довільно суттєво змінює механічні, дотикові й оптичні властивості капсул. Далі також приклади К і Л показують, що характеристики розчинення і властивості застосування, зокрема механічні, дотикові й оптичні властивості, капсул згідно з винаходом можуть бути значно покращені за допомогою наявності допоміжних речовин, зокрема регуляторів вологості і пластифікаторів, в другій оболонці капсули, а також заключної обробки капсул воском. Крім того, з капсулами згідно з прикладами виготовлення A, Г, І, К, а також з капсулами згідно з порівняльним прикладом M здійснюють довготривалі дослідження, в яких капсули ще раз піддають дослідженню через три, шість і дванадцять місяців зберігання. При цьому капсули зберігають при температурі у 40 °C при відносній вологості повітря у 75 % (тест відповідно до стандарту МКГ). Результати тесту представлені в таблиці 2. 35 Таблиця 1 Склад і властивості капсул згідно з прикладами від A до O Ядро Приккапсули лад [мг] A Б В Г 150 300 150 150 E 150 Е Ж З И І К Л M Н O 150 150 150 150 150 150 150 150 150 150 Співвідношення цінеол/ тригліa) церид 2:1 2:1 4:1 10 : 1 1,8-ці-неол Вагове співвід-ношення Стій-кість РозчинВласти- Здатність до альгінат/ до дії ність у Гладвості меха-нічного етилцешлунтонкому кість Блиск відокренаванталюлоза кового кишеч- поверхні млення ження в другій оболонці соку нику капсули 1:6 +++ +++ 1 1 1 1 1:6 +++ +++ 1 1 1 1 1:6 +++ ++ 1-2 1 1-2 1 1:6 ++ ++ 1-2 1 2 1-2 б) 1:6 + ++ 2 1-2 2 2 1:5 2:1 2:1 2:1 2:1 2:1 2:1 2:1 2:1 2:1 1:6 1:2 1:1 2:1 4:1 1:6 1:6 ® г) Eudragit г) етилцелюлоза г) альгінат +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ ++ +++ ++ ++ ++ ++ +++ ++ 1-2 2 2 1-2 1-2 1 1-2 2-3 2 2 1-2 1-2 1-2 2 2 1 2 2-3 2 1-2 1 1-2 2 2 2-3 1-2 1 3-4 4-5 4 1-2 1 2 2-3 2-3 1-2 1 3 1-2 4 15 в) + UA 110434 C2 5 a) вагове співвідношення 1,8-цінеолу до тригліцеридів з ланцюжками середньої довжини в ядрі капсули б) 1,8-цінеол як чиста речовина в ядрі капсули в) не розчинна (спостерігають поодиноке набухання і розривання капсули, однак яке не є відтворюваним) г) друга оболонка капсули із зазначеного матеріалу Таблиця 2 Тривале спостерігання за вибраними системами Приклади A Г І К M 3 місяці Стійкість до дії шлункового соку Розчинність у тонкому кишечнику Властивості відокремлення +++ +++ 1 ++ ++ 2 +++ ++ 2-3 +++ ++ 1-2 +++ ++ 3-4 6 місяців Стійкість до дії шлункового соку Розчинність у тонкому кишечнику Властивості відокремлення +++ +++ 1 ++ ++ 2-3 ++ ++ 3 ++ ++ 2 +++ ++ 4 12 місяців Стійкість до дії шлункового соку Розчинність у тонкому кишечнику Властивості відокремлення +++ +++ 1 ++ ++ 3 ++ + 3 ++ ++ 2 ++ ++ 4 10 ФОРМУЛА ВИНАХОДУ 15 20 25 30 35 40 1. Лікарська форма, що містить монотерпен, для перорального застосування у вигляді капсули, зокрема у вигляді капсули зі структурою ядро/оболонка з багатошаровою оболонкою, причому капсула зсередини назовні має наступну будову: (а) ядро капсули, що містить щонайменше одну діючу речовину, що містить монотерпен, (б) перша оболонка капсули, яка оточує ядро капсули, надає структуру і/або форму, і (в) друга оболонка капсули, яка оточує першу оболонку капсули, причому друга оболонка капсули містить щонайменше два компоненти, причому перший компонент ("компонент 1") виконаний на основі альгінової кислоти або її фізіологічно прийнятних солей або складних ефірів і другий компонент ("компонент 2") виконаний на основі целюлози, причому лікарська форма має віднесену до ваги частку другої оболонки капсули, в перерахунку на лікарську форму, в межах від 0,5 до 4 мас. %. 2. Лікарська форма за п. 1, причому лікарська форма, зокрема ядро капсули як єдину діючу речовину містить 1,8-цінеол. 3. Лікарська форма за одним з попередніх пунктів, причому лікарська форма, зокрема ядро капсули, містить діючу речовину, що містить монотерпен, зокрема 1,8-цінеол, разом зі щонайменше одним змішуваним з діючою речовиною, що містить монотерпен, і/або монотерпеном, зокрема 1,8 цінеолом, і/або розчинним в ній, зокрема при 20 °C і атмосферному тиску рідким, фізіологічно прийнятними носієм (наповнювачем), причому носій вибраний з групи жирних олій, переважно тригліцеридів, особливо переважно тригліцеридів з ланцюжками середньої довжини (МСТ), найбільш переважно тригліцеридів з залишками С 6-С12-жирних кислот. 4. Лікарська форма за одним з попередніх пунктів, причому лікарська форма містить діючу речовину, що містить монотерпен в абсолютних кількостях від 10 до 1,000 мг, в перерахунку на одиницю застосування, зокрема капсулу; і причому лікарська форма містить діючу речовину, що містить монотерпен у відносних кількостях від 0,01 до 95 мас. %, в перерахунку на лікарську форму. 5. Лікарська форма за одним з попередніх пунктів, причому друга оболонка капсули як перший компонент містить щонайменше один альгінат, вибраний з альгінатів лужних металів, альгінатів 16 UA 110434 C2 5 10 15 20 25 30 35 лужноземельних металів, альгінатів амонію і складних ефірів альгінової кислоти; і причому друга оболонка капсули як другий компонент містить целюлозу або похідне целюлози, вибране з простих ефірів целюлози або складних ефірів целюлози. 6. Лікарська форма за одним з попередніх пунктів, причому лікарська форма містить другу оболонку капсули в кількостях від 0,5 до 100 мг і причому лікарська форма має віднесену до ваги частку другої оболонки капсули, в перерахунку на лікарську форму, в межах від 2 до 4 мас. %. 7. Лікарська форма за одним з попередніх пунктів, причому лікарська форма забезпечена зовнішнім, оточуваним другу оболонку капсули, покриттям на основі лаків або восків, а також їх сумішей і комбінацій. 8. Лікарська форма за одним з попередніх пунктів для застосування при профілактичному і/або терапевтичному лікуванні організмів людей або тварин. 9. Лікарський засіб або медичний продукт, що містить лікарську форму, яка містить монотерпен, зокрема цінеол, за одним з попередніх пунктів. 10. Спосіб одержання лікарської форми, що містить монотерпен для перорального застосування у вигляді капсули, зокрема у вигляді капсули зі структурою ядро/оболонка з багатошаровою оболонкою, як визначено за одним з попередніх пунктів, причому (і) в першій стадії способу ядро капсули, яке містить щонайменше одну діючу речовину, що містить монотерпен, забезпечують першою, оточуваною ядро капсули оболонкою капсули, яка надає структуру і/або форму, і іі) в наступній другій стадії способу першу оболонку капсули забезпечують другою, оточуваною першу оболонку капсули оболонкою капсули, причому для одержання другої оболонки капсули застосовують щонайменше два компоненти, причому перший компонент ("компонент 1") виконаний на основі альгінової кислоти або її фізіологічно прийнятних солей або складних ефірів і другий компонент ("компонент 2") виконаний на основі целюлози, причому перший і другий компоненти для одержання другої оболонки капсули наносять сумісно у вигляді водного розчину і/або дисперсії, причому розчин і/або дисперсію підлуговують і причому одержана лікарська форма має віднесену до ваги частку другої оболонки капсули, в перерахунку на лікарську форму, в межах від 0,5 до 4 мас. %. 11. Застосування лікарської форми, що містить монотерпен за одним з пунктів від 1 до 8 для одержання лікарського засобу для профілактичного і/або терапевтичного лікування організмів людей або тварин. 12. Застосування за п. 11 для одержання лікарського засобу для профілактичного і/або терапевтичного лікування запальних, загострених внаслідок інфекції або алергійних захворювань організмів людей або тварин, або для одержання лікарського засобу для профілактичного і/або терапевтичного лікування застудних захворювань і грипозних інфекцій і пов'язаних з ними захворювань й інфекцій, зокрема інфекцій верхніх і нижніх дихальних шляхів, зокрема риніту, синуситу і бронхопульмональних захворювань. 17 UA 110434 C2 Комп’ютерна верстка В. Мацело Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 18
ДивитисяДодаткова інформація
Назва патенту англійськоюSystemic administration forms with controlled release and improved stability
Автори англійськоюMiething, Holger, Greve, Harald
Автори російськоюМитинг Хольгер, Грэвэ Харальд
МПК / Мітки
МПК: A61K 31/35, A61P 37/00, A61P 13/00, A61K 9/48, A61P 11/06, A61P 29/00, A61P 11/08, A61P 31/16, A61P 17/00, A61P 1/16
Мітки: системні, форми, контрольованим, вивільненням, покращеною, лікарські, стабільністю
Код посилання
<a href="https://ua.patents.su/20-110434-sistemni-likarski-formi-z-kontrolovanim-vivilnennyam-i-pokrashhenoyu-stabilnistyu.html" target="_blank" rel="follow" title="База патентів України">Системні лікарські форми з контрольованим вивільненням і покращеною стабільністю</a>
Попередній патент: Багатофазна машина
Наступний патент: Спосіб ведення доменної плавки
Випадковий патент: Відкривальний пристрій пакувального контейнера для рідких продуктів