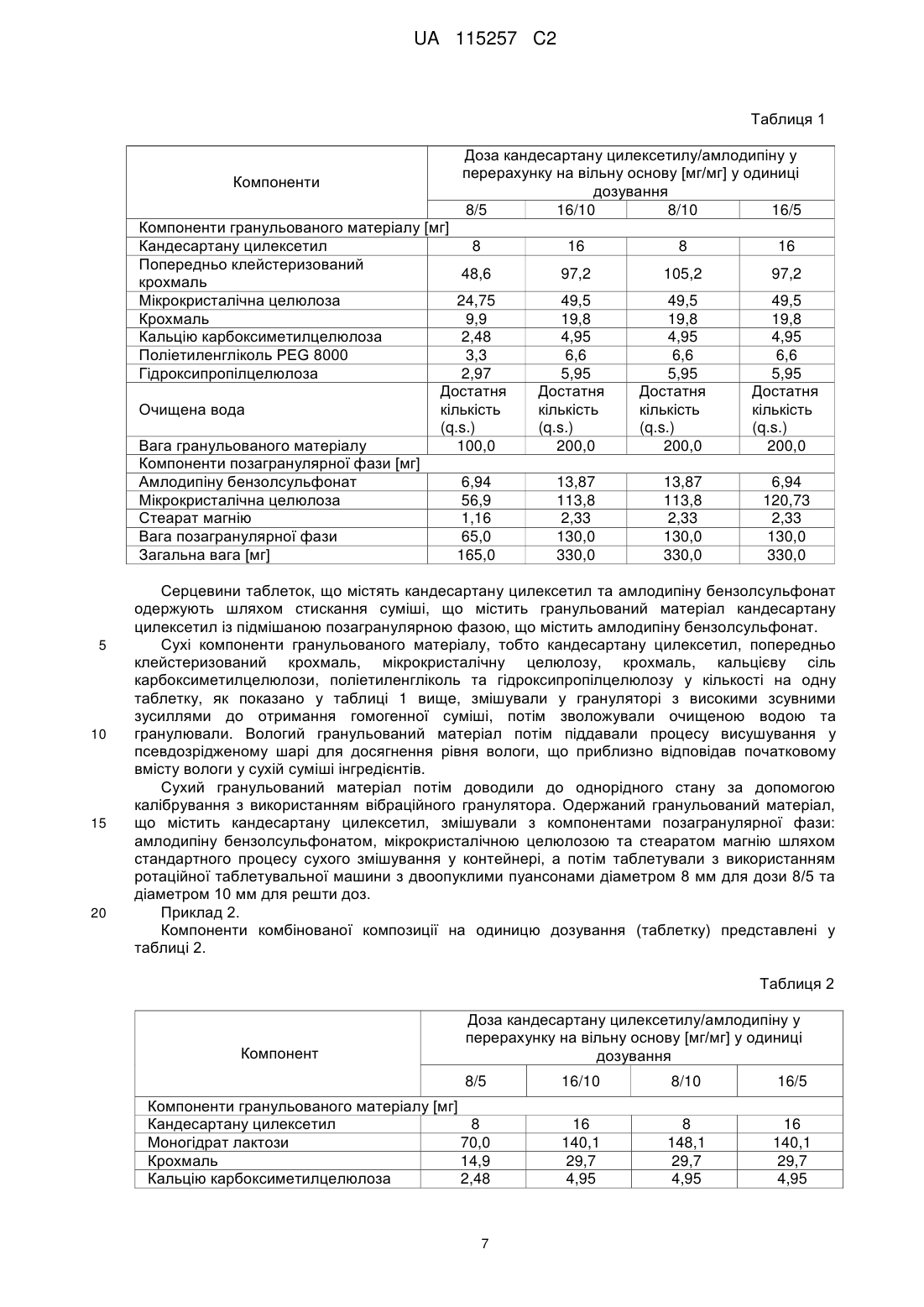
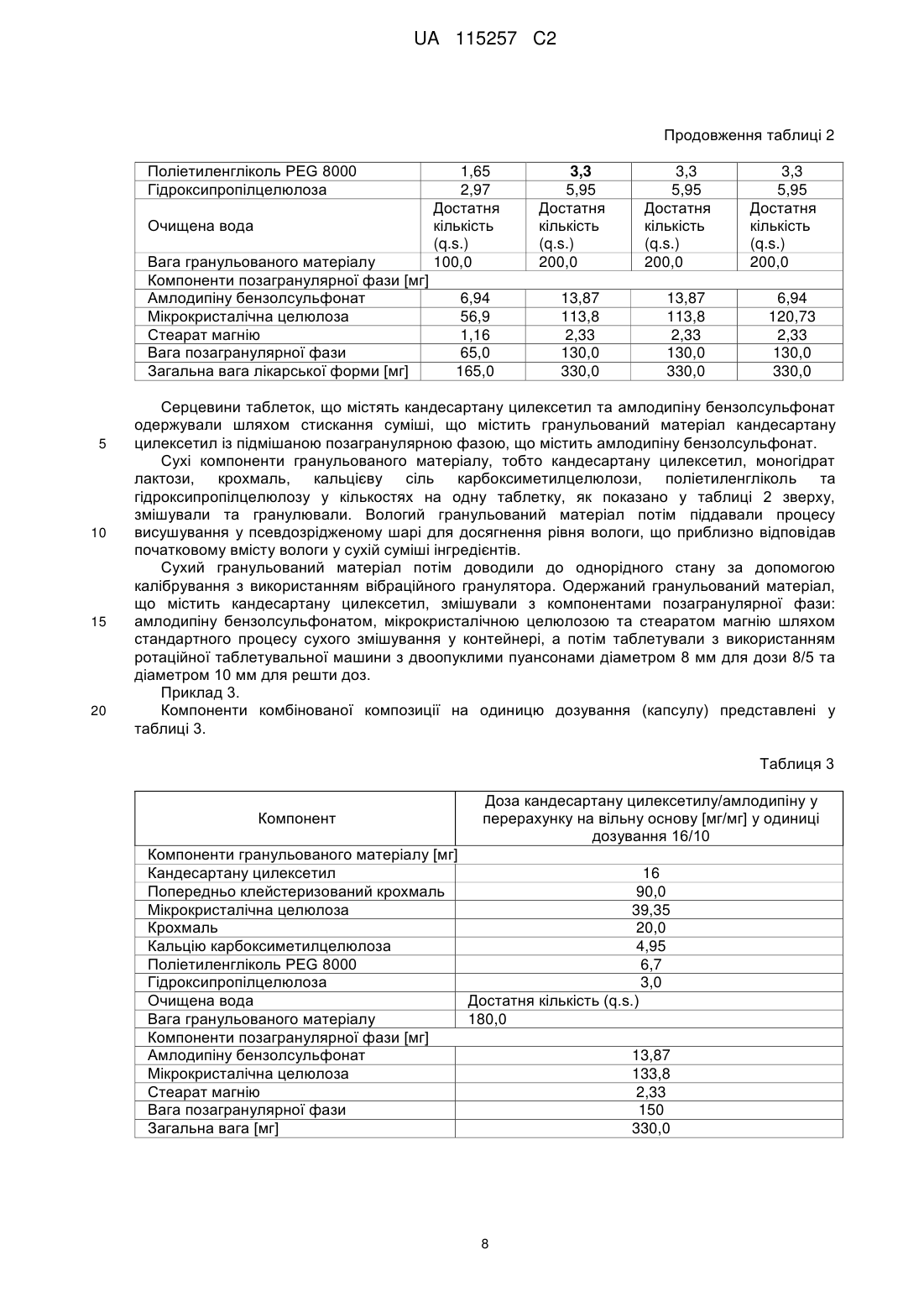
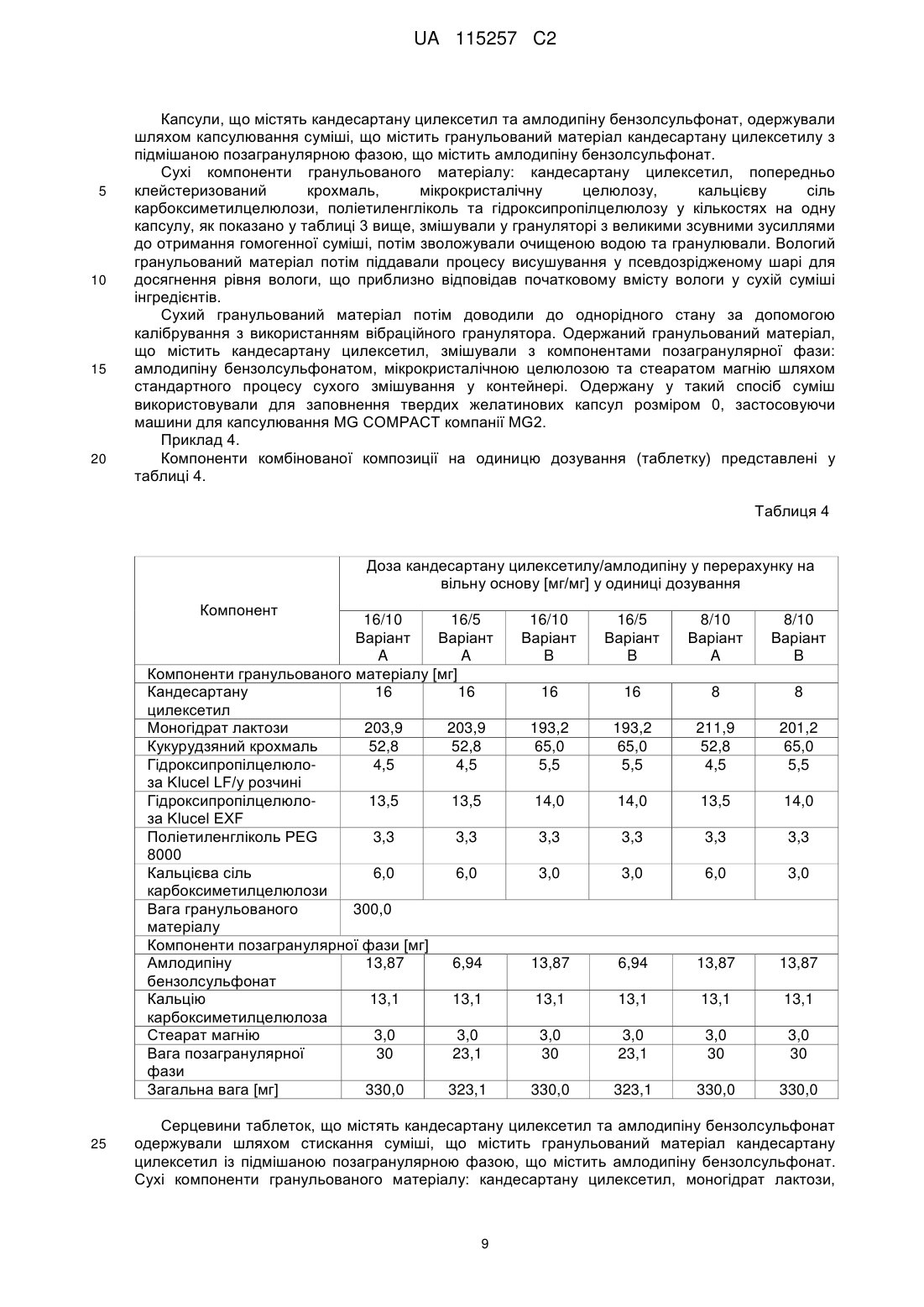
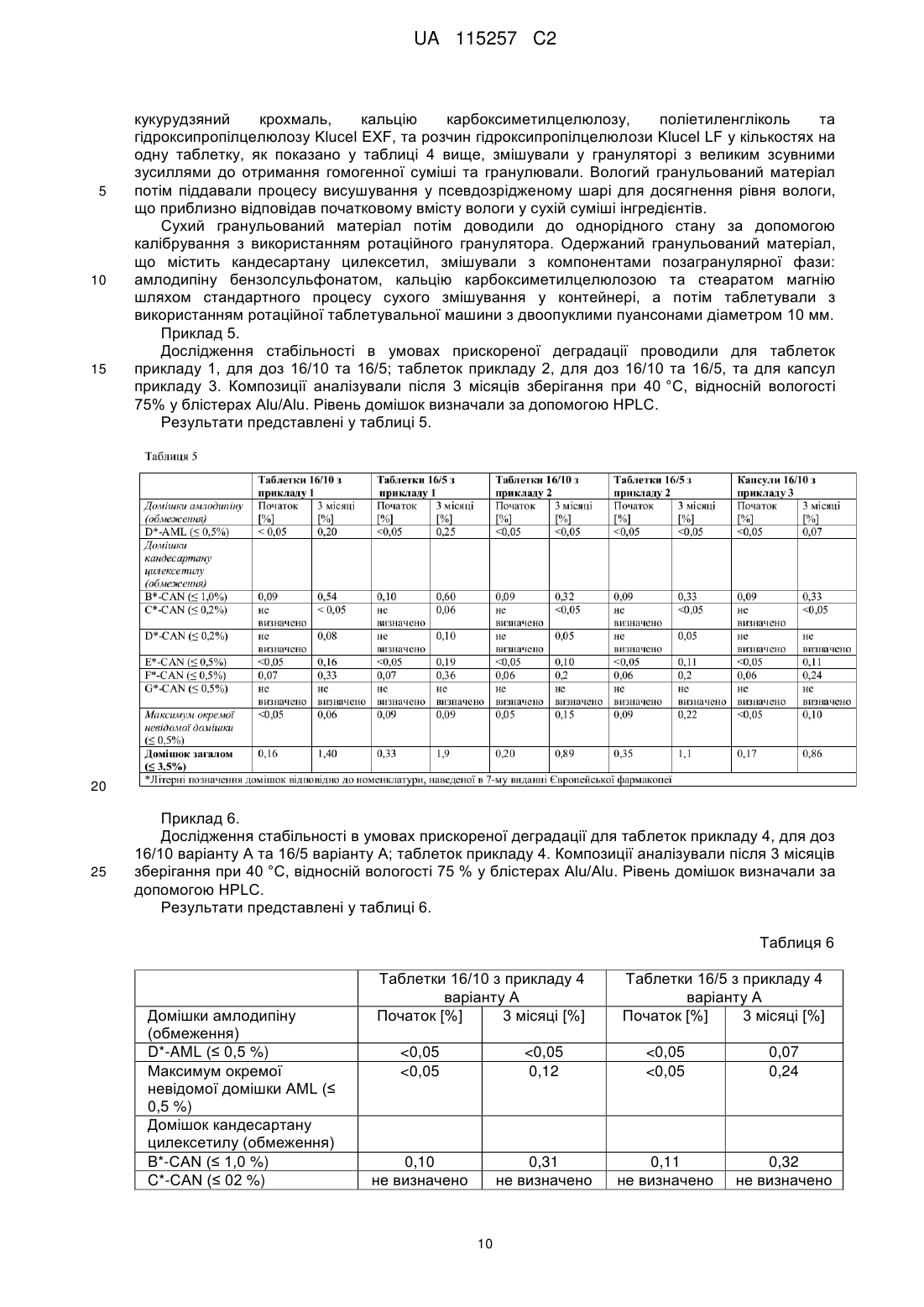
Фармацевтична композиція у формі твердої суміші, що містить кандесартану цилексетил та амлодипін
Формула / Реферат
1. Комбінована фармацевтична композиція у формі твердої суміші, що складається з:
a) гранульованого матеріалу, що містить кандесартану цилексетил, поліетиленгліколь та допоміжні засоби, вибрані з групи, що складається з наповнювача, розпушувача, зв'язувальної речовини та їх сумішей, де вагове співвідношення кандесартану цилексетилу та поліетиленгліколю знаходиться у діапазоні від 4,8:1,0, і
b) позагранулярної фази, що являє собою порошкову суміш, що містить амлодипін або його фармацевтично прийнятну сіль та допоміжні засоби, вибрані з групи, що складається з наповнювача, змащувального засобу та їх сумішей, або з групи, що складається з розпушувача, змащувального засобу та їх сумішей.
2. Фармацевтична композиція за п. 1, де допоміжні засоби у гранульованому матеріалі а) являють собою суміш, що містить 80,0-90,0 % за вагою наповнювача, 0,0-3,0 % за вагою розпушувача та 2,5-12,0 % за вагою зв'язувальної речовини у перерахунку на загальну вагу гранульованого матеріалу а).
3. Фармацевтична композиція за п. 2, де допоміжні засоби у гранульованому матеріалі а) являють собою суміш, що містить 83,0-89,0 %, переважно 85,0-90,0 % за вагою наповнювача, 0,5-2,5 %, переважно 1,0 % або 2,0 % за вагою розпушувача та 5,0-8,0 %, переважно 6,0-6,5 % за вагою зв'язувальної речовини.
4. Фармацевтична композиція за будь-яким з попередніх пунктів, де наповнювач у гранульованому матеріалі а) вибраний з групи, що складається з безводної лактози, моногідрату лактози, мікрокристалічної целюлози, крохмалю, попередньо клейстеризованого крохмалю та їх сумішей.
5. Фармацевтична композиція за п. 4, де наповнювач являє собою суміш моногідрату лактози та крохмалю.
6. Фармацевтична композиція за п. 4, де наповнювач являє собою суміш крохмалю, попередньо клейстеризованого крохмалю та мікрокристалічної целюлози.
7. Фармацевтична композиція за будь-яким з попередніх пунктів, де розпушувач у гранульованому матеріалі а) являє собою натрієву сіль карбоксиметилцелюлози, натрієву сіль карбоксиметилкрохмалю або кальцієву сіль карбоксиметилцелюлози, переважно кальцієву сіль карбоксиметилцелюлози.
8. Фармацевтична композиція за будь-яким з попередніх пунктів, де зв'язувальна речовина у гранульованому матеріалі а) являє собою гідроксипропілцелюлозу.
9. Фармацевтична композиція за п. 8, де гідроксипропілцелюлоза являє собою суміш гідроксипропілцелюлози у формі розчину та гідроксипропілцелюлози у формі порошку.
10. Фармацевтична композиція за будь-яким з попередніх пунктів, де допоміжні засоби у позагранулярній фазі b) вибрані з групи, що включає наповнювач, змащувальний засіб та їх сумішей.
11. Фармацевтична композиція за п. 10, де допоміжні засоби у позагранулярній фазі b) являють собою суміш з 80,0-95,0 % за вагою наповнювача та 1,0-3,0 % за вагою змащувального засобу.
12. Фармацевтична композиція за п. 11, де допоміжні засоби у позагранулярній фазі b) являють собою суміш з 88,0 або 93 % за вагою наповнювача та 1,0-3,0 %, переважно 1,8 % за вагою змащувального засобу.
13. Фармацевтична композиція за будь-яким з п. 1-9, де допоміжні засоби у позагранулярній фазі b) вибрані з групи, що складається з розпушувача, змащувального засобу та їх сумішей.
14. Фармацевтична композиція за п. 13, де допоміжні засоби у позагранулярній фазі b) являють собою суміш з 22,0-66,0 %, переважно 42,0-44,0 % за вагою розпушувача та 5,0-15,0 %, переважно 10,0-13,0 % за вагою змащувального засобу.
15. Фармацевтична композиція за будь-яким з пп. 10-12, де наповнювач у позагранулярній фазі b) являє собою мікрокристалічну целюлозу.
16. Фармацевтична композиція за будь-яким з пп. 13-14, де розпушувач у позагранулярній фазі b) являє собою кальцієву сіль карбоксиметилцелюлози.
17. Фармацевтична композиція за будь-яким з пп. 10-16 де змащувальний засіб у позагранулярній фазі b) являє собою стеарилфумарат натрію або стеарат магнію, переважно стеарат магнію.
18. Фармацевтична композиція за будь-яким з попередніх пунктів, де вагове співвідношення гранульованого матеріалу а) та позагранулярної фази b) знаходиться у діапазоні від 1,0:1,0 до 2,0:1,0 або від 13,0:1,0 до 10,0:1,0.
19. Фармацевтична композиція за п. 18, де вагове співвідношення гранульованого матеріалу а) та позагранулярної фази b) становить 1,5:1,0, або 10,0:1,0, або 13,0:1,0.
20. Фармацевтична композиція за будь-яким з попередніх пунктів, де фармацевтично прийнятна сіль амлодипіну у позагранулярній фазі b) являє собою амлодипіну бензолсульфонат.
21. Спосіб одержання композиції за будь-яким з пп. 1-20, що включає наступні стадії:
- змішування компонентів гранульованого матеріалу а) для отримання однорідної порошкової суміші,
- вологе гранулювання однорідної суміші,
- висушування отриманого гранульованого матеріалу,
- доведення до однорідного стану гранульованого матеріалу з утворенням гранульованого матеріалу а),
- змішування отриманого гранульованого матеріалу а) з компонентами позагранулярної фази b).
22. Стандартна лікарська форма, що містить складну фармацевтичну композицію за будь-яким з пп. 1-20 або одержану за п. 21.
23. Стандартна лікарська форма за п. 22, вибрана з таблетки, капсули, саше, саше типу "стік" та ампули.
24. Стандартна лікарська форма за п. 23 у формі таблетки.
25. Стандартна лікарська форма за пп. 22-24, що містить кандесартану цилексетил у кількості 8 або 16 міліграмів та амлодипін у кількості, що відповідає 5 або 10 міліграмам вільної основи амлодипіну на стандартну лікарську форму.
Текст
Реферат: Винахід стосується комбінованої фармацевтичної композиції, у формі твердої суміші, що складається з гранульованого матеріалу, що містить кандесартану цилексетил, поліетиленгліколь та інші допоміжні засоби, де вагове співвідношення кандесартану цилексетилу та поліетиленгліколю становить 4,8:1, та позагранулярної фази, що являє собою порошкову суміш, що містить амлодипін або його фармацевтично прийнятну сіль та допоміжні засоби, способу одержання такої композиції та стандартної лікарської форми, що містить таку композицію. UA 115257 C2 (12) UA 115257 C2 UA 115257 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь винаходу Даний винахід відноситься до комбінованої фармацевтичної композиції, що містить кандесартану цилексетил та амлодипін або його фармацевтично прийнятну сіль, способу одержання зазначеної композиції, стандартної лікарської форми, що містить зазначену композицію, та до застосування зазначеної композиції у різновидах терапії, що стосуються гіпертензії. Кандесартану цилексетил являє собой INN (міжнародну непатентовану назву) для 2{[(циклогексилокси)карбоніл]окси}етил-2-етокси-1-{[2'-(1H-тетразол-5-іл)біфеніл-4-іл]метил}-1Hбензимідазол-7-карбоксилату. Кандесартан являє собою атиповий антагоніст рецептора ангіотензину II зі специфічної селективністю до рецепторів AT1, та перше його розкриття можна знайти у EP459136A. Цілексетиловий естер кандесартану у формі пролікарського засобу при усмоктуванні в кишковошлунковому тракті гідролізується до кандесартану. Кандесартану цилексетил призначають для лікування гіпертонічної хвороби у дорослих і для лікування дорослих хворих на серцеву недостатність та з порушеною систолічною функцією лівого шлуночка (доля викиду лівого шлуночка 40%) як допоміжну терапію при лікуванні інгібіторами ангіотензинперетворюючого ферменту (інгібіторами ACE), або якщо їх погано переносять. Амлодипін являє собою INN для 3-етил-5-метил-(4RS)-2-[(2-аміноетокси)метил]-6-метил-1,4дигідропіридин-3,5-дикарбоксилат. Він являє собою блокатор тривалої дії кальцієвих каналів, перше розкриття якого можна знайти у EP89167A, та його застосовують у комерційних препаратах у формі солі з бензолсульфоновою кислотою (EP244944B1). Схваленими терапевтичними призначеннями для амлодипіну є гіпертензія, хронічна стабільна стенокардія та вазоспастична стенокардія (Принцметала). Амлодипіну бензолсульфонат погано розчиняється у воді, а його абсолютна біодоступність варіює в діапазоні 64-90%. Гіпертензія є одним з найсерйозніших патологічних станів у світі. Її вважають основним фактором ризику смертності та найбільш відомим фактором ризику серцево-судинних захворювань. Клінічні випробування продемонстрували обмежену ефективність традиційно застосовуваної монотерапії. Застосування комбінації двох медичних речовин з різних терапевтичних груп, що діють за різними патофізіологічними механізмами, надає можливість досягнути кращого антигіпертензивного ефекту та більш ефективного захисту від пошкодження органів, яке спостерігають при гіпертензії. Крім того, застосування комбінованих продуктів є більш ефективним, ніж монотерапія через можливість спрощення схем лікування та покращення дотримання хворим схеми лікування, а також зменшення загальних витрат на терапію та дотримання хворими схеми лікування. Проте, одержання комбінованих композицій з діючими речовинами пов'язано с істотними проблемами через необхідність забезпечувати стабільність таких композицій та відповідного розміру стандартних лікарських форм, зберігаючи у той же час необхідні характеристики композиції, такі як однорідність складу, твердість (таблетки), розміри лікарської форми та інше. Як кандесартану цилексетил, так і амлодипін та його фармацевтично прийнятні солі через фізичні та хімічні властивості потребують специфічних умов для одержання складу та застосування стабілізуючих допоміжних засобів або принаймні допоміжних засобів, які не спричиняють розпад цих діючих речовин. Однією з головних проблем, пов'язаних з пероральним введенням кандесартану цилексетилу, є низька біодоступність та погана розчинність даної діючої речовини. За оцінками, лише 15-40% кандесартану, включеному у комерційні склади, є фізіологічно доступними та, отже, діючими. Інша проблема полягає у чутливості молекули, яка може бути піддана гідролізу та деалкілюванню. З рівня техніки відомо, що було запропоновано декілька рішень наведених вище проблем. Наприклад, у EP546358A1 для стабілізації композиції кандесартану цилексетилу застосовують маслянисті сполуки, такі як поліетиленгліколь. У WO2009/121871 описана композиція, що містить кандесартану цилексетил і співполімер полівінилового спирту та поліетиленгліколю, що забезпечує необхідну стабільність та біодоступність кандесартану. У WO2008/065097 описано стабілізуючий ефект таких речовин, як моноетиловий етер діетиленгліколю, DL-пантенол і пальмітат калію, у EP1985287A вплив оліїстих домішок, а у EP2050440A застосування певних пластифікаторів для стабілізації кандесартану цилексетилу. Амлодипін, зокрема у формі солі з бензолсульфоновою кислотою, описано як "високогігроскопічний", що може призвести до його розпаду (WO2004075825). У молекулі амлодипіну може відбуватися гідроліз/переетерифікація естерних груп або окиснення дигідропіридинового кільця. Крім того, амлодипін як аміносполука демонструє несумісність з 1 UA 115257 C2 5 10 15 20 25 30 35 40 45 50 55 деякими традиційно застосовуваними допоміжними засобами, такими як лактоза та поліетиленгліколь. Композиція з амлодипіном, стабілізована колоїдним діоксидом кремнію, розкрита у WO/0351364. Крім того, під час випробувань складів спостерігали, що порошки як кандесартану цилексетилу, так і амлодипіну бензолсульфонату чутливі до статичної електрики та демонструють погані властивості плинності. Такі фізичні властивості зазвичай викликають проблеми з однорідністю вмісту діючої речовини у композиції та технологічні проблеми під час таблетування або капсулюванні. Окрім стабільності необхідна біоеквівалентність комбінованої композиції з відповідними композиціями, що містять окремі діючі речовини. З рівня техніки відомі певні комбіновані композиції, що містять кандесартану цилексетил та амлодипіну бензолсульфонат. У EP2165702A розкрита композиція з кандесартану цилексетилом та амлодипіну бензолсульфонатом, одержана за допомогою способу вологого гранулювання з водою як рідиною для гранулювання. Амлодипін можна додавати або до рідини для гранулювання, або до порошкової суміші та піддавати вологому гранулюванню, або додавати до гранульованого продукту. Композиція містить докузат натрію як поверхнево-активну речовину. У EP2106789A розкрита композиція кандесартану цилексетилу та амлодипіну бензолсульфонату, що містить прищеплений співполімер полівінілового спирту з поліетиленгліколем. Співполімер застосовують для хімічної та фізичної стабілізації композиції. У WO2010/126168 розкрита комбінована композиція з кандесартаном та амлодипіном, у якій обидві діючі речовини піддані вологому гранулюванню окремо одна від іншої, а потім обидва гранульовані матеріали змішані один з одним і таблетовані. У CN102764258 розкрита комбінована композиція, що містить кандесартан та амлодипін, де співвідношення кандесартану та PEG 6000 варіює в діапазоні від 1:0,5 до 1:0,8. Проте, дану композицію отримують у формі простої суміші, а кількості поліетиленгліколю не достатньо для стабілізації діючих інгредієнтів, які не відділені один від іншого. У CN102670603 розкрита комбінована композиція, що містить кандесартан та амлодипін, де кандесартан підданний вологому гранулюванню перед стисканням з амлодипіном. Проте, у даній композиції відсутні стабілізуючі гліколі. У CN102688236 розкрита комбінована композиція, що містить кандесартан, амлодипін та PEG 6000 у кількості 2-4% відносно загальної ваги композиції. У даній композиції кандесартан та амлодипін перед таблетуванням мають форму порошкової суміші. Контакт між діючими інгредієнтами, а також між певними допоміжними засобами є необмеженим. Внаслідок цього, амлодипін піддається безпосередньому контакту з факторами, які можуть призвести до його розпаду, тобто контакту з поліетиленгліколем, що призводить до підвищення домішки D, та контакту з лактозою, що призводить до утворення кольорових домішок (реакція Майяра). Крім того, діапазон вмісту поліетиленгліколю значно та негативно впливає на біодоступність композиції, та, як наслідок, важко досягнути біоеквівалентність з діючими інгредієнтами, особливо з кандесартаном. Як згадано вище, через властивості діючих речовин, а також терапевтичне призначення комбінованої композиції, що містить кандесартану цилексетил та амлодипін, під час процесу одержання бажано уникати умов (вологості, температури), а також застосувань допоміжний засобів, природа та величина яких може мати негативний вплив на композицію через стимулювання розпаду діючих речовин, або які за інших причин будуть небажані у композиції, такі як, наприклад, допоміжні засобі у формі натрієвих солей, які спричиняють пагубну дію на препарати для лікування гіпертензії. Метою даноговинаходу є забезпечення комбінованої фармацевтичної композиції, що містить кандесартану цилексетил і амлодипін або його фармацевтично прийнятну сіль, де обидві діючі речовини залишаються стабільними як в процесі одержання, так і під час зберігання, де забезпечення технологічно простого способу одержання зазначеної композиції, при якому діючі речовини не піддаються впливу факторів, які викликають їх розпад. Більш того, метою даного винаходу є забезпечення комбінованої композиції з придатною біодоступністю, настільки близькою, наскільки це можливо відносно біодоступності окремих складів, що містять окремі діючі інгредієнти. Мети даного винаходу досягають за допомогою описаного у даному документі винаходу. Отже, метою даного винаходу є комбінована фармацевтична композиція, у склад якої входить кандесартану цилексетил та амлодипін та яка містить: 2 UA 115257 C2 5 10 15 20 25 30 35 40 45 50 55 60 a) гранульований матеріал, що містить кандесартану цилексетил, поліетиленгліколь та допоміжні засобі, де вагове співвідношення кандесартану цилексетил та поліетиленгліколю знаходиться у діапазоні від 5:1 до 2:1, і b) позагранулярну фазу, яка являє собою порошкову суміш, що містить амлодипін або його фармацевтично прийнятну сіль і допоміжні засоби. Вираз "комбінована фармацевтична композиція", що застосовується у даному документі, стосується фармацевтичної композиції, що містить комбінацію з двох діючих інгредієнтів, що містяться у окремій лікарській формі. Вираз "порошкова суміш", що застосовується у даному винаході, стосується порошкової суміші, отриманої шляхом простого перемішування без будь-яких дій гранулювання, пресування, грудкування тощо або перед простим перемішуванням, або після простого перемішування. У переважному варіанті здійснення фармацевтичної композиції за даним винаходом допоміжні засоби у гранульованому матеріалі a) вибрані з групи, що включає наповнювач, розпушувач, зв'язувальну речовину та їх суміші. Більш переважно, допоміжні засоби у гранульованому матеріалі a) являють собою суміш, що містить 80,0-90,0% за вагою наповнювача, 0-3,0% за вагою розпушувача та 2,5-12,0% за вагою зв'язувальної речовини у перерахунку на загальну вагу гранульованого матеріалу a). Ще більш переважно, допоміжні засоби у гранульованому матеріалі a) являють собою суміш, що містить 83,0-90,0% за вагою наповнювача, найбільш переважно 85,0-90,0%; 0,5-2,5% за вагою розпушувача, найбільш переважно 1,0% або 2,0%; і 5,0-8,0% за вагою зв'язувальної речовини, найбільш переважно 6,0% - 6,5%. Наповнювач у гранульованому матеріалі a) та у позагранулярній фазі b) композиції за даним винаходом можна, наприклад, вибрати з групи, що містить олігосахариди, такі як безводна лактоза або моногідрат лактози, цукроза, полісахариди, такі як мікрокристалічна целюлоза, крохмаль, попередньо клейстеризований крохмаль та їх суміші, а також їх сумісно оброблені суміші, такі як мікрокристалічна целюлоза з покриттям з колоїдного діоксиду кремнію. У переважному варіанті здійснення фармацевтичної композиції за даним винаходом наповнювач у гранульованому матеріалі a) вибраний з групи, що включає безводну лактозу, моногідрат лактози, мікрокристалічну целюлозу, крохмаль, попередньо клейстеризований крохмаль та їх суміші. У переважному варіанті з наведених вище варіантів здійснення фармацевтичної композиції за даним винаходом наповнювач у гранульованому матеріалі a) являє собою суміш моногідрату лактози та крохмалю, а вагове співвідношення кандесартану цилексетилу та поліетиленгліколю становить 4,8:1,0 або 2,4:1,0. У іншому переважному варіанті з наведених вище варіантів здійснення фармацевтичної композиції за даним винаходом наповнювач у гранульованому матеріалі a) являє собою суміш крохмалю, попередньо клейстеризованого крохмалю та мікрокристалічної целюлози, а вагове співвідношення кандесартану цилексетилу та поліетиленгліколю становить 4,8:1,0 або 2,4:1,0. Розпушувач у гранульованому матеріалі a) композиції за даним винаходом можна вибрати з групи, що включає кальцієву сіль карбоксиметилцелюлози, натрієву сіль карбоксиметилцелюлози, натрієву сіль карбоксиметилкрохмалю, мікрокристалічну целюлозу, колоїдний безводний діоксид кремнію, кросповідон, наприклад, кросповідон типу А (Polyplasdone XL ®), та маїсовий крохмаль. У переважному варіанті здійснення фармацевтичної композиції за даним винаходом розпушувач у гранульованому матеріалі a) являє собою кальцієву сіль карбоксиметилцелюлози. Зв'язувальну речовину у гранульованому матеріалі a) композиції за даним винаходом можна вибрати з групи, що включає похідні целюлози, такі як гідроксипропілцелюлоза, гідроксипропілметилцелюлоза, метилцелюлоза, карбоксиметилцелюлоза, гідроксицелюлоза та гідроксиетилцелюлоза, полівіниловий спирт, полівінилпіролідон та їх суміші. У переважному варіанті здійснення фармацевтичної композиції за даним винаходом зв'язувальна речовина у гранульованому матеріалі a) являє собою гідроксипропілцелюлозу. У особливо переважному варіанті здійснення фармацевтичної композиції за даним винаходом зв'язувальна речовина у гранульованому матеріалі a) являє собою суміш гідроксипропілцелюлоз, переважно щонайменше двох типів гідроксипропілцелюлоз, де щонайменше один з цих типів гідроксипропілцелюлоз перебуває у формі водного розчину. Прикладами похідних гідроксипропілцелюлози, які придатні для застосування у формі водного розчину, є такі, що характеризуються низькою динамічною в'язкістю у водних середовищах, наприклад у воді, тобто в'язкістю, що становить приблизно 400 мПа * с або менше 150 мПа * с, при вимірюванні при 25 °C для 2% водного розчину. 3 UA 115257 C2 5 10 15 20 25 30 35 40 45 50 55 Більш того, похідні гідроксипропілцелюлози, які придатні для застосування у формі розчину, характеризуються низькою молекулярною вагою, переважно у діапазоні 50000-150000. Прикладами таких похідних гідроксипропілцелюлози є продукти Aqualon, такі як Klucel LF, Klucel EF або Klucel JF, та продукти Nippon Soda, такі як Nisso HPC-L. Прикладами похідних гідроксипропілцелюлози, які придатні для застосування у переважному варіанті здійснення фармацевтичної композиції за даним винаходом у суміші з похідним гідроксипропілцелюлози у формі розчину, є гідроксипропілцелюлози з маленьким розміром частинок. Прикладами таких гідроксипропілцелюлоз є Klucel класу EF зі стандартним розміром частинок або, альтернативно, класів EXF або EXAF, які постачаються на ринок компанією Aqualon. Переважними є гідроксипропілцелюлози з низькими показниками в'язкості у водних середовищах, тобто показниками в'язкості у діапазоні 300-600 мПа*с, найбільш переважно з показниками в'язкості нижче 100 мПа*с, при вимірюванні при 25 °C для 2% водного розчину. Найбільш переважною як зв'язувальна речовина є суміш гідроксипропілцелюлози Klucel LF у формі водного розчину та гідроксипропілцелюлози Klucel EXF у формі сухого порошку. Застосування суміші гідроксипропілцелюлоз забезпечує необхідну біодоступність і стабільність складної композиції, та додавання додаткової рідини для гранулювання на окремому етапі не є необхідним. Гідроксипропілцелюлозу у формі розчину можна додати до суміші сухих інгредієнтів, а потім можна здійснити процес вологого гранулювання. У такому випадку не додають додаткову рідину для гранулювання, таку як вода або інший розчинник. Вміст розпушувача та наповнювача у гранульованому матеріалі a) залежить від кількості/відсотка діючого інгредієнта кандесартану цилексетил. Відсоток кандесартану цилексетил, у свою чергу, варіює в залежності від необхідної кількості діючого інгредієнта на одиницю дозування (активність). Позагранулярна фаза b) являє собою порошкову суміш, що містить амлодипін або його фармацевтично прийнятну сіль і допоміжні засоби. У одному варіанті допоміжні засоби у позагранулярній фазі b) вибрані з групи, що включає наповнювач, змащувальний засіб та їх суміші. У переважному варіанті здійснення такого першого варіанта допоміжні засоби у позагранулярній фазі b) являють собою суміш з 80,0-95,0% за вагою наповнювача та 1,0-3,0% за вагою змащувального засобу. У більш переважному варіанті здійснення першого варіанта допоміжні засоби у позагранулярній фазі b) являють собою суміш з 88,0% за вагою наповнювача та 1,8% за вагою змащувального засобу. У іншому переважному варіанті здійснення першого варіанта допоміжні засоби у позагранулярній фазі b) являють собою суміш з 93,0% за вагою наповнювача та 1,8% за вагою змащувального засобу. У другому варіанті допоміжні засоби у позагранулярній фазі b) являють собою суміш розпушувача та змащувального матеріалу. У переважному варіанті здійснення такого другого варіанта допоміжні засоби у позагранулярній фазі b) являють собою суміш з 22,0-66,0% за вагою розпушувача та 5,0-15,0% за вагою змащувального засобу. Найбільш переважно у другому варіанті позагранулярна фаза b) містить 42,0-44,0% за вагою розпушувача та 10-13% змащувального засобу. Вміст змащувального засобу та наповнювача у позагранулярній фазі b) залежить від кількості/відсотка діючого інгредієнта амлодипіну або його фармацевтично прийнятної солі. Даний відсоток, у свою чергу, варіює в залежності від необхідної кількості амлодипіну на одиницю дозування. Таким чином, у одному варіанті здійснення першого варіанта для одержання одиниці дозування, що містить дозу 10 мг амлодипіну, особливо у формі бензолсульфонатної солі, допоміжні засоби у позагранулярній фазі b) переважно являють собою суміш з 88% за вагою наповнювача та 1,8% за вагою змащувального засобу. У свою чергу, для одержання одиниці дозування, що містить дозу 5 мг амлодипіну, особливо у формі бензолсульфонатної солі, допоміжні засоби у позагранулярній фазі b) переважно являють собою суміш з 93,0% за вагою наповнювача та 1,8% за вагою змащувального засобу. Наповнювач у позагранулярній фазі b) у даному варіанті здійснення першого варіанта вибирають з групи, яка описана раніше для гранульованого матеріалу a). Переважно, наповнювач у позагранулярній фазі b) у даному варіанті здійснення першого варіанта являє собою мікрокристалічну целюлозу. 4 UA 115257 C2 5 10 15 20 25 30 35 40 45 50 55 60 Змащувальний засіб у позагранулярній фазі b) композиції за даним винаходом у даному варіанті здійснення першого варіанта можна вибрати з групи, що включає стеарат магнію, стеарилфумарат натрію, стеарат кальцію та гідрогенізовану рослинну олію, наприклад, гідрогенізовану рицинову олію. Переважно, змащувальний засіб у позагранулярній фазі b) являє собою стеарат магнію. У даному переважному варіанті здійснення першого варіанта фармацевтичної композиції за даним винаходом вагове співвідношення гранульованого матеріалу a) і позагранулярної фази b) знаходиться у діапазоні від 1,0:1,0 до 2,0:1,0. Більш переважно, у даному переважному варіанті здійснення першого варіанта вагове співвідношення гранульованого матеріалу a) і позагранулярної фази b) становить 1,5:1,0. У ще більш переважному варіанті здійснення другого варіанта фармацевтичної композиції за даним винаходом для одержання одиниці дозування, що містить 10 мг амлодипіну, особливо у формі бензолсульфонату, допоміжні засоби у позагранулярній фазі b) переважно являють собою суміш з 43,7% за вагою розпушувача та 10,0% за вагою змащувального засобу. У фармацевтичній композиції за даним винаходом для одержання одиниці дозування, що містить 5 мг амлодипіну, особливо у формі бензолсульфонату, допоміжні засоби у позагранулярній фазі b) переважно являють собою суміш з 56,9% за вагою розпушувача та 13,0% за вагою змащувального засобу. Розпушувач у позагранулярній фазі b) у даному ще біль переважному варіанті здійснення другого варіанта можна вибрати з групи, яка описана раніше для гранульованого матеріалу a). Переважний розпушувач у позагранулярній фазі b) являє собою кальцієву сіль карбоксиметилцелюлози. Змащувальний засіб у позагранулярній фазі b) у такому ще більш переважному варіанті здійснення другого варіанта можна вибрати з групи, що включає стеарат магнію, стеарилфумарат натрію, стеарат кальцію та гідрогенізовану рослинну олію, наприклад, гідрогенізовану рицинову олію. Найбільш переважно змащувальний засіб у позагранулярній фазі b) у такому ще більш переважному варіанті здійснення другого варіанта являє собою стеарат магнію. У даному ще більш переважному варіанті здійснення другого варіанта фармацевтичної композиції за даним винаходом вагове співвідношення гранульованого матеріалу a) і позагранулярної фази b) знаходиться у діапазоні від 13,0:1,0 до 10,0:1,0. Більш переважно у даному варіанті здійснення другого варіанта фармацевтичної композиції за даним винаходом вагове співвідношення гранульованого матеріалу a) і позагранулярної фази b) становить 10,0:1,0 або 13,0:1,0. Для числових значень, що виражають співвідношення процента гранульованого матеріалу a) та позагранулярної фази b), вагове співвідношення кандесартану цилексетилу та поліетиленгліколю та процент окремих допоміжних засобів у композиції за даним винаходом, потрібно застосовувати звичайні правила округлювання. Наприклад, якщо у фармацевтичній композиції за даним винаходом вагове співвідношення гранульованого матеріалу a) і позагранулярної фази b) становить 1,48:1,0 або 1,54:1,0, то його округляють і представляють як 1,5:1,0. Переважно, фармацевтично прийнятна сіль амлодипіну у позагранулярній фазі b) являє собою амлодипіну бензолсульфонат. Способи одержання обох діючих речовин відомі з рівня техніки. Амлодипіну бензолсульфонат можна одержати, наприклад, за допомогою способу, який розкрито у EP0993447B1, а кандесартану цилексетил – за допомогою способу, який розкрито у EP459136B1. Даний винахід також відноситься до способу одержання описаної вище комбінованої фармацевтичної композиції, що включає наступні стадії: - змішування компонентів гранульованого матеріалу a) для отримання однорідної порошкової суміші, - вологе гранулювання однорідної суміші, - висушування одержаного гранульованого матеріалу, - доведення до однорідного стану гранульованого матеріалу з утворенням гранульованого матеріалу a), - змішування одержаного гранульованого матеріалу a) з компонентами позагранулярної фази b). Змішування компонентів гранульованого матеріалу a) з одержанням однорідної суміші можна здійснити за допомогою стандартних способів, відомих фахівцям в даній галузі, наприклад, у ємності гранулятора з високими зсувними зусиллями. Одержану таким чином 5 UA 115257 C2 5 10 15 20 25 30 35 40 45 50 55 суміш гранулюють. Рідиною для гранулювання може бути водний розчин зв'язувальної речовини, або водний розчин зв'язувальної речовини та поліетиленгліколю, або однорідна суспензія діючої речовини кандесартану цилексетилу у водному розчині зв'язувальної речовини, або однорідна суспензія діючої речовини кандесартану цилексетил у водному розчині зв'язувальної речовини та поліетиленгліколю. Усі наведені вище варіанти рідини для гранулювання будуть забезпечувати практично однаковий ефект зв'язування компонентів порошкової суміші. Фахівці в даній галузі зрозуміють, що, як альтернатива, рідиною для гранулювання може бути вода, але цей варіант є технологічно більш складним через необхідність забезпечення наявності джерела води певної якості та через необхідність здійснення додаткової технологічної стадії додавання води та перемішування її з рештою компонентів. Вологий гранульований матеріал потім піддавали процесу висушування, переважно процесу висушування у псевдозрідженому шарі для отримання сухого гранульованого матеріалу. Вираз "сухий гранульований матеріал" стосується гранульованого матеріалу, в якому вміст води приблизно дорівнює вмісту води у вихідній суміші компонентів перед гранулюванням. Доведення до однорідного стану сухого гранульованого матеріалу з утворенням кінцевого гранульованого матеріалу a) можна здійснювати з використанням традиційних засобів, відомих фахівцям в даній галузі. Переважно доведення до однорідного стану сухого гранульованого матеріалу здійснюють шляхом калібрування у вібраційному або ротаційному грануляторі. Кінцеву композицію за даним винаходом отримують шляхом змішування гранульованого матеріалу a) з компонентами позагранулярної фази b) з використанням обладнання та параметрів способу, що дозволяють одержання кінцевої доведеної до однорідного стану суміші усіх компонентів, які, наприклад, можуть бути підтверджені шляхом аналізу однорідності складу окремих діючих речовин. Комбінована фармацевтична композиція за даним винаходом являє собою тверду суміш, що містить гранульований матеріал a) та позагранулярну фазу b). Композицію за даним винаходом після її одержання використовують для одержання стандартних лікарських форм. Отже, наступною метою даного винаходу є стандартна лікарська форма, що містить фармацевтичну композицію за даним винаходом, або одержана за допомогою способу за даним винаходом. Фармацевтичну композицію за даним винаходом включають у таку стандартну лікарську форму. Зокрема, стандартну лікарську форму вибирають з таблеток, капсул, саше, саше типу "стік" та ампул. Переважними стандартними лікарськими формами є таблетки та тверді капсули, наприклад, желатинові або гідроксипропілметилцелюлозні капсули. У найбільш переважному варіанті здійснення стандартними лікарськими формами є таблетки. Таблетки можуть бути без покриття або з покриттям. Для фахівця в даній галузі є очевидним, що кількість композиції за даним винаходом, яку спресовують у таблетку або капсулюють, має бути достатньою для забезпечення адекватних доз діючого інгредієнту на одиницю дозування. Розмір лікарської форми, переважно таблетки, залежить від дози діючого інгредієнту та кількості фармацевтичної композиції за даним винаходом, що містить цю дозу. Кількість кандесартану цилексетилу становить 8 або 16 мг на одиницю дозування комбінованої фармацевтичної композиції за даним винаходом, а кількість амлодипіну (на основі вільної основи) становить 5 або 10 мг на одиницю дозування комбінованої фармацевтичної композиції за даним винаходом. Переважно амлодипін представлений у формі бензолсульфонатної солі, і кількості зазначеної солі на одиницю дозування становлять 13,87 г та 6,94 г, відповідно. Одержання таблеток та заповнення капсул композицією за даним винаходом є відомими технологічними операціями в галузі фармацевтичної технології і можуть виконуватися з використанням стандартного обладнання. Наприклад, таблетування фармацевтичної композиції за даним винаходом можна виконувати з використанням ротаційного таблеткового пресу. Наприклад, капсули можна заповнювати з використанням гравітаційного дозатора або завантажувальних пристроїв різного типу, в залежності від типу машини для капсулювання. Наступні приклади ілюструють даний винахід без обмеження його обсягу. Приклад 1. Компоненти комбінованої композиції на одиницю дозування (таблетку) представлені у таблиці 1. 60 6 UA 115257 C2 Таблиця 1 Компоненти Доза кандесартану цилексетилу/амлодипіну у перерахунку на вільну основу [мг/мг] у одиниці дозування 8/5 16/10 8/10 16/5 Компоненти гранульованого матеріалу [мг] Кандесартану цилексетил 8 Попередньо клейстеризований 48,6 крохмаль Мікрокристалічна целюлоза 24,75 Крохмаль 9,9 Кальцію карбоксиметилцелюлоза 2,48 Поліетиленгліколь PEG 8000 3,3 Гідроксипропілцелюлоза 2,97 Достатня Очищена вода кількість (q.s.) Вага гранульованого матеріалу 100,0 Компоненти позагранулярної фази [мг] Амлодипіну бензолсульфонат 6,94 Мікрокристалічна целюлоза 56,9 Стеарат магнію 1,16 Вага позагранулярної фази 65,0 Загальна вага [мг] 165,0 5 10 15 20 16 8 16 97,2 105,2 97,2 49,5 19,8 4,95 6,6 5,95 Достатня кількість (q.s.) 200,0 13,87 113,8 2,33 130,0 330,0 49,5 19,8 4,95 6,6 5,95 Достатня кількість (q.s.) 200,0 13,87 113,8 2,33 130,0 330,0 49,5 19,8 4,95 6,6 5,95 Достатня кількість (q.s.) 200,0 6,94 120,73 2,33 130,0 330,0 Серцевини таблеток, що містять кандесартану цилексетил та амлодипіну бензолсульфонат одержують шляхом стискання суміші, що містить гранульований матеріал кандесартану цилексетил із підмішаною позагранулярною фазою, що містить амлодипіну бензолсульфонат. Сухі компоненти гранульованого матеріалу, тобто кандесартану цилексетил, попередньо клейстеризований крохмаль, мікрокристалічну целюлозу, крохмаль, кальцієву сіль карбоксиметилцелюлози, поліетиленгліколь та гідроксипропілцелюлозу у кількості на одну таблетку, як показано у таблиці 1 вище, змішували у грануляторі з високими зсувними зусиллями до отримання гомогенної суміші, потім зволожували очищеною водою та гранулювали. Вологий гранульований матеріал потім піддавали процесу висушування у псевдозрідженому шарі для досягнення рівня вологи, що приблизно відповідав початковому вмісту вологи у сухій суміші інгредієнтів. Сухий гранульований матеріал потім доводили до однорідного стану за допомогою калібрування з використанням вібраційного гранулятора. Одержаний гранульований матеріал, що містить кандесартану цилексетил, змішували з компонентами позагранулярної фази: амлодипіну бензолсульфонатом, мікрокристалічною целюлозою та стеаратом магнію шляхом стандартного процесу сухого змішування у контейнері, а потім таблетували з використанням ротаційної таблетувальної машини з двоопуклими пуансонами діаметром 8 мм для дози 8/5 та діаметром 10 мм для решти доз. Приклад 2. Компоненти комбінованої композиції на одиницю дозування (таблетку) представлені у таблиці 2. Таблиця 2 Компонент Доза кандесартану цилексетилу/амлодипіну у перерахунку на вільну основу [мг/мг] у одиниці дозування 8/5 16/10 8/10 16/5 Компоненти гранульованого матеріалу [мг] Кандесартану цилексетил 8 Моногідрат лактози 70,0 Крохмаль 14,9 Кальцію карбоксиметилцелюлоза 2,48 16 140,1 29,7 4,95 8 148,1 29,7 4,95 16 140,1 29,7 4,95 7 UA 115257 C2 Продовження таблиці 2 Поліетиленгліколь PEG 8000 Гідроксипропілцелюлоза Очищена вода Вага гранульованого матеріалу Компоненти позагранулярної фази [мг] Амлодипіну бензолсульфонат Мікрокристалічна целюлоза Стеарат магнію Вага позагранулярної фази Загальна вага лікарської форми [мг] 5 10 15 20 1,65 2,97 Достатня кількість (q.s.) 100,0 6,94 56,9 1,16 65,0 165,0 3,3 5,95 Достатня кількість (q.s.) 200,0 13,87 113,8 2,33 130,0 330,0 3,3 5,95 Достатня кількість (q.s.) 200,0 13,87 113,8 2,33 130,0 330,0 3,3 5,95 Достатня кількість (q.s.) 200,0 6,94 120,73 2,33 130,0 330,0 Серцевини таблеток, що містять кандесартану цилексетил та амлодипіну бензолсульфонат одержували шляхом стискання суміші, що містить гранульований матеріал кандесартану цилексетил із підмішаною позагранулярною фазою, що містить амлодипіну бензолсульфонат. Сухі компоненти гранульованого матеріалу, тобто кандесартану цилексетил, моногідрат лактози, крохмаль, кальцієву сіль карбоксиметилцелюлози, поліетиленгліколь та гідроксипропілцелюлозу у кількостях на одну таблетку, як показано у таблиці 2 зверху, змішували та гранулювали. Вологий гранульований матеріал потім піддавали процесу висушування у псевдозрідженому шарі для досягнення рівня вологи, що приблизно відповідав початковому вмісту вологи у сухій суміші інгредієнтів. Сухий гранульований матеріал потім доводили до однорідного стану за допомогою калібрування з використанням вібраційного гранулятора. Одержаний гранульований матеріал, що містить кандесартану цилексетил, змішували з компонентами позагранулярної фази: амлодипіну бензолсульфонатом, мікрокристалічною целюлозою та стеаратом магнію шляхом стандартного процесу сухого змішування у контейнері, а потім таблетували з використанням ротаційної таблетувальної машини з двоопуклими пуансонами діаметром 8 мм для дози 8/5 та діаметром 10 мм для решти доз. Приклад 3. Компоненти комбінованої композиції на одиницю дозування (капсулу) представлені у таблиці 3. Таблиця 3 Компонент Доза кандесартану цилексетилу/амлодипіну у перерахунку на вільну основу [мг/мг] у одиниці дозування 16/10 Компоненти гранульованого матеріалу [мг] Кандесартану цилексетил 16 Попередньо клейстеризований крохмаль 90,0 Мікрокристалічна целюлоза 39,35 Крохмаль 20,0 Кальцію карбоксиметилцелюлоза 4,95 Поліетиленгліколь PEG 8000 6,7 Гідроксипропілцелюлоза 3,0 Очищена вода Достатня кількість (q.s.) Вага гранульованого матеріалу 180,0 Компоненти позагранулярної фази [мг] Амлодипіну бензолсульфонат 13,87 Мікрокристалічна целюлоза 133,8 Стеарат магнію 2,33 Вага позагранулярної фази 150 Загальна вага [мг] 330,0 8 UA 115257 C2 5 10 15 20 Капсули, що містять кандесартану цилексетил та амлодипіну бензолсульфонат, одержували шляхом капсулювання суміші, що містить гранульований матеріал кандесартану цилексетилу з підмішаною позагранулярною фазою, що містить амлодипіну бензолсульфонат. Сухі компоненти гранульованого матеріалу: кандесартану цилексетил, попередньо клейстеризований крохмаль, мікрокристалічну целюлозу, кальцієву сіль карбоксиметилцелюлози, поліетиленгліколь та гідроксипропілцелюлозу у кількостях на одну капсулу, як показано у таблиці 3 вище, змішували у грануляторі з великими зсувними зусиллями до отримання гомогенної суміші, потім зволожували очищеною водою та гранулювали. Вологий гранульований матеріал потім піддавали процесу висушування у псевдозрідженому шарі для досягнення рівня вологи, що приблизно відповідав початковому вмісту вологи у сухій суміші інгредієнтів. Сухий гранульований матеріал потім доводили до однорідного стану за допомогою калібрування з використанням вібраційного гранулятора. Одержаний гранульований матеріал, що містить кандесартану цилексетил, змішували з компонентами позагранулярної фази: амлодипіну бензолсульфонатом, мікрокристалічною целюлозою та стеаратом магнію шляхом стандартного процесу сухого змішування у контейнері. Одержану у такий спосіб суміш використовували для заповнення твердих желатинових капсул розміром 0, застосовуючи машини для капсулювання MG COMPACT компанії MG2. Приклад 4. Компоненти комбінованої композиції на одиницю дозування (таблетку) представлені у таблиці 4. Таблиця 4 Доза кандесартану цилексетилу/амлодипіну у перерахунку на вільну основу [мг/мг] у одиниці дозування Компонент 16/10 16/5 Варіант Варіант A A Компоненти гранульованого матеріалу [мг] Кандесартану 16 16 цилексетил Моногідрат лактози 203,9 203,9 Кукурудзяний крохмаль 52,8 52,8 Гідроксипропілцелюло4,5 4,5 за Klucel LF/у розчині Гідроксипропілцелюло13,5 13,5 за Klucel EXF Поліетиленгліколь PEG 3,3 3,3 8000 Кальцієва сіль 6,0 6,0 карбоксиметилцелюлози Вага гранульованого 300,0 матеріалу Компоненти позагранулярної фази [мг] Амлодипіну 13,87 6,94 бензолсульфонат Кальцію 13,1 13,1 карбоксиметилцелюлоза Стеарат магнію 3,0 3,0 Вага позагранулярної 30 23,1 фази Загальна вага [мг] 330,0 323,1 25 16/10 Варіант B 16/5 Варіант B 8/10 Варіант A 8/10 Варіант B 16 16 8 8 193,2 65,0 5,5 193,2 65,0 5,5 211,9 52,8 4,5 201,2 65,0 5,5 14,0 14,0 13,5 14,0 3,3 3,3 3,3 3,3 3,0 3,0 6,0 3,0 13,87 6,94 13,87 13,87 13,1 13,1 13,1 13,1 3,0 30 3,0 23,1 3,0 30 3,0 30 330,0 323,1 330,0 330,0 Серцевини таблеток, що містять кандесартану цилексетил та амлодипіну бензолсульфонат одержували шляхом стискання суміші, що містить гранульований матеріал кандесартану цилексетил із підмішаною позагранулярною фазою, що містить амлодипіну бензолсульфонат. Сухі компоненти гранульованого матеріалу: кандесартану цилексетил, моногідрат лактози, 9 UA 115257 C2 5 10 15 кукурудзяний крохмаль, кальцію карбоксиметилцелюлозу, поліетиленгліколь та гідроксипропілцелюлозу Klucel EXF, та розчин гідроксипропілцелюлози Klucel LF у кількостях на одну таблетку, як показано у таблиці 4 вище, змішували у грануляторі з великим зсувними зусиллями до отримання гомогенної суміші та гранулювали. Вологий гранульований матеріал потім піддавали процесу висушування у псевдозрідженому шарі для досягнення рівня вологи, що приблизно відповідав початковому вмісту вологи у сухій суміші інгредієнтів. Сухий гранульований матеріал потім доводили до однорідного стану за допомогою калібрування з використанням ротаційного гранулятора. Одержаний гранульований матеріал, що містить кандесартану цилексетил, змішували з компонентами позагранулярної фази: амлодипіну бензолсульфонатом, кальцію карбоксиметилцелюлозою та стеаратом магнію шляхом стандартного процесу сухого змішування у контейнері, а потім таблетували з використанням ротаційної таблетувальної машини з двоопуклими пуансонами діаметром 10 мм. Приклад 5. Дослідження стабільності в умовах прискореної деградації проводили для таблеток прикладу 1, для доз 16/10 та 16/5; таблеток прикладу 2, для доз 16/10 та 16/5, та для капсул прикладу 3. Композиції аналізували після 3 місяців зберігання при 40 °C, відносній вологості 75% у блістерах Alu/Alu. Рівень домішок визначали за допомогою HPLC. Результати представлені у таблиці 5. 20 25 Приклад 6. Дослідження стабільності в умовах прискореної деградації для таблеток прикладу 4, для доз 16/10 варіанту A та 16/5 варіанту A; таблеток прикладу 4. Композиції аналізували після 3 місяців зберігання при 40 °C, відносній вологості 75 % у блістерах Alu/Alu. Рівень домішок визначали за допомогою HPLC. Результати представлені у таблиці 6. Таблиця 6 Домішки амлодипіну (обмеження) D*-AML (≤ 0,5 %) Максимум окремої невідомої домішки AML (≤ 0,5 %) Домішок кандесартану цилексетилу (обмеження) B*-CAN (≤ 1,0 %) C*-CAN (≤ 02 %) Таблетки 16/10 з прикладу 4 варіанту A Початок [%] 3 місяці [%] Таблетки 16/5 з прикладу 4 варіанту A Початок [%] 3 місяці [%]
ДивитисяДодаткова інформація
Назва патенту англійськоюA pharmaceutical composition containing candesartan cilexetil and amlodipine
Автори англійськоюCieplucha, Agnieszka
Автори російськоюЦэплуха Агнэшка
МПК / Мітки
МПК: A61K 31/4184, A61K 9/16, A61K 31/4422, A61K 9/20
Мітки: кандесартану, амлодипін, суміші, цилексетил, композиція, твердої, фармацевтична, форми, містить
Код посилання
<a href="https://ua.patents.su/20-115257-farmacevtichna-kompoziciya-u-formi-tverdo-sumishi-shho-mistit-kandesartanu-cileksetil-ta-amlodipin.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція у формі твердої суміші, що містить кандесартану цилексетил та амлодипін</a>
Попередній патент: Будівельна панель
Наступний патент: Крісло-коляска
Випадковий патент: Спосіб подвійного дренування жовчного міхура і внутрішньопечінкових жовчних проток