Виділений та очищений днк фрагмент, що кодує оксалат-декарбоксилазу
Номер патенту: 34467
Опубліковано: 15.03.2001
Автори: Данвелл Джеймс Мартін, Мехта Анурадха, Датта Азіс, Натараджан К.
Текст
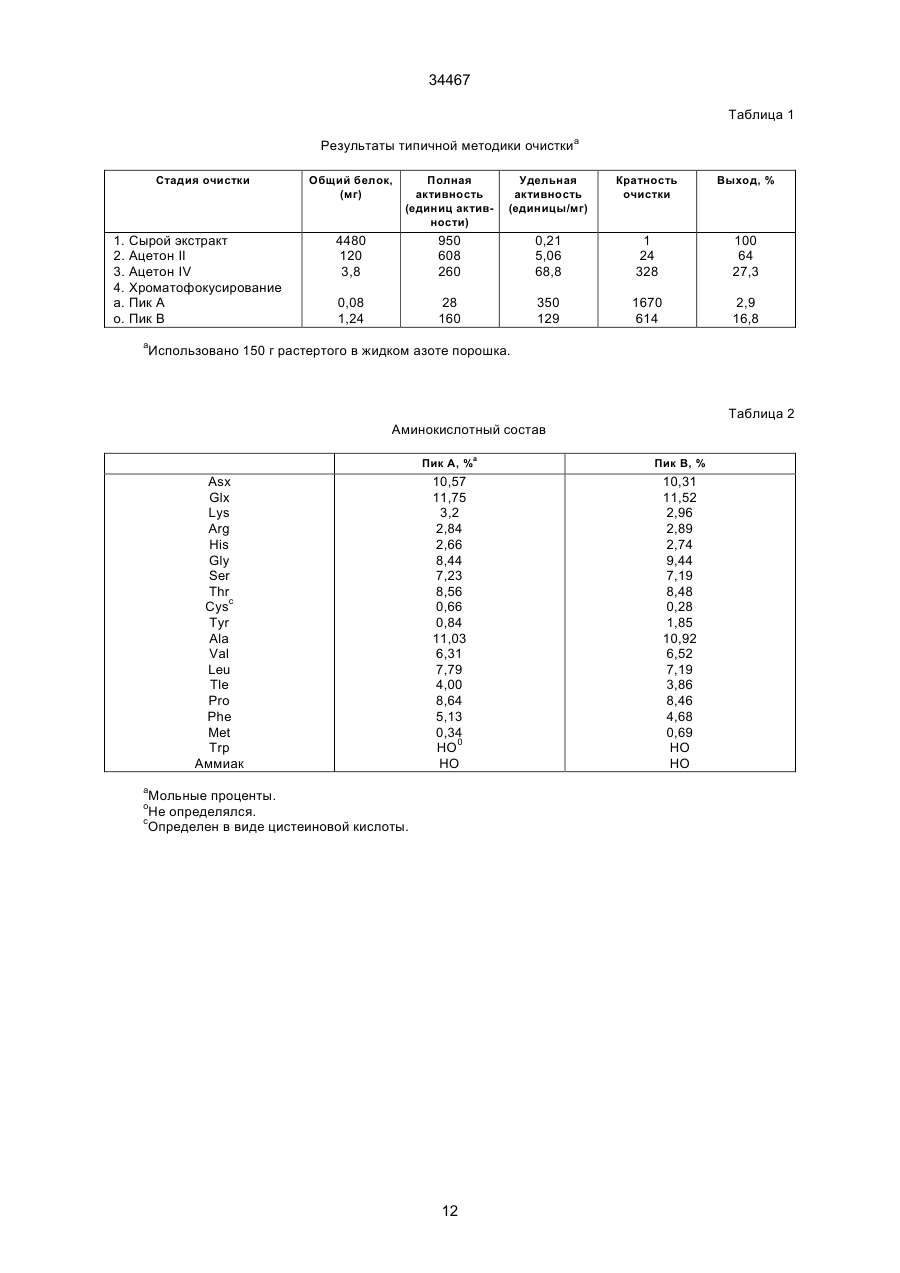
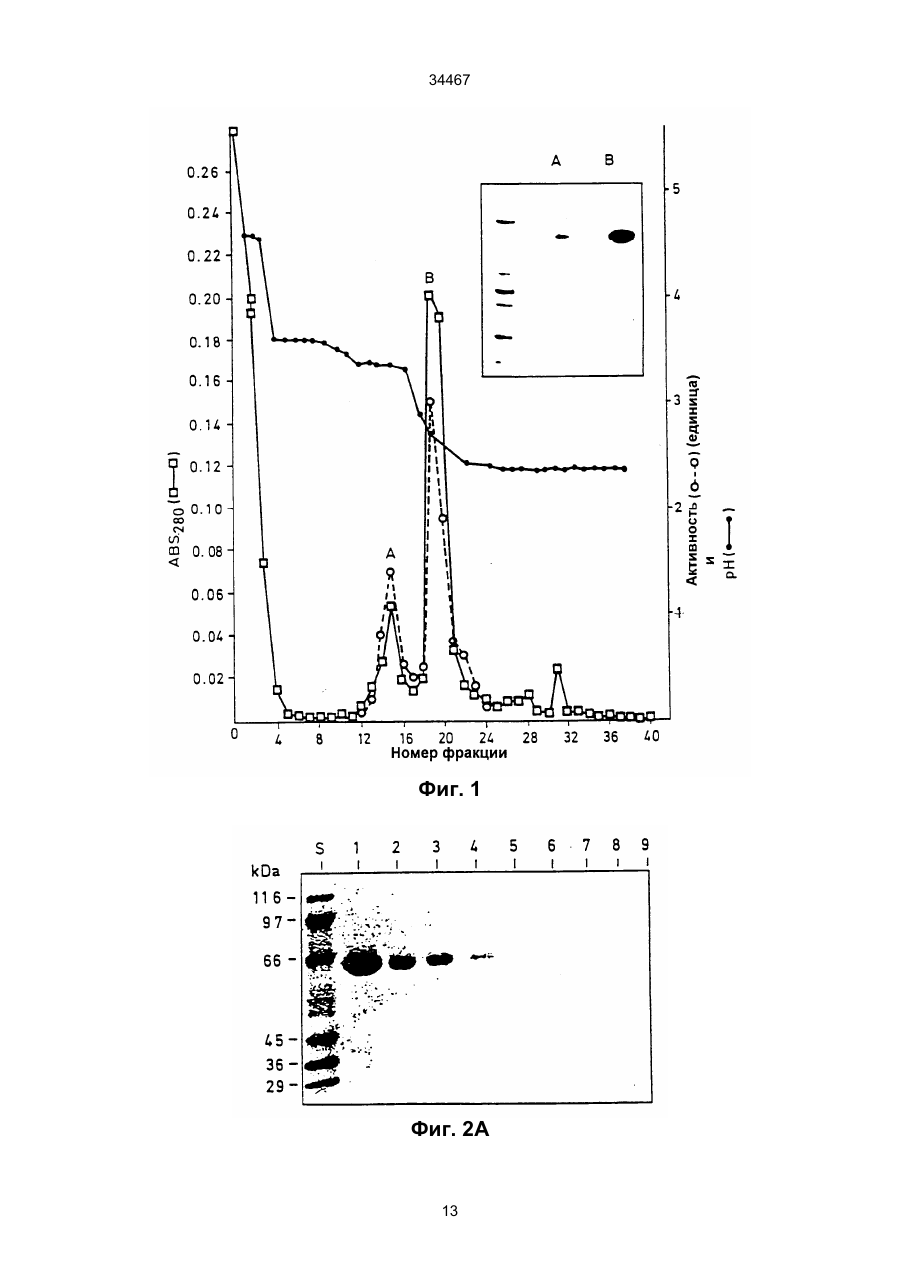
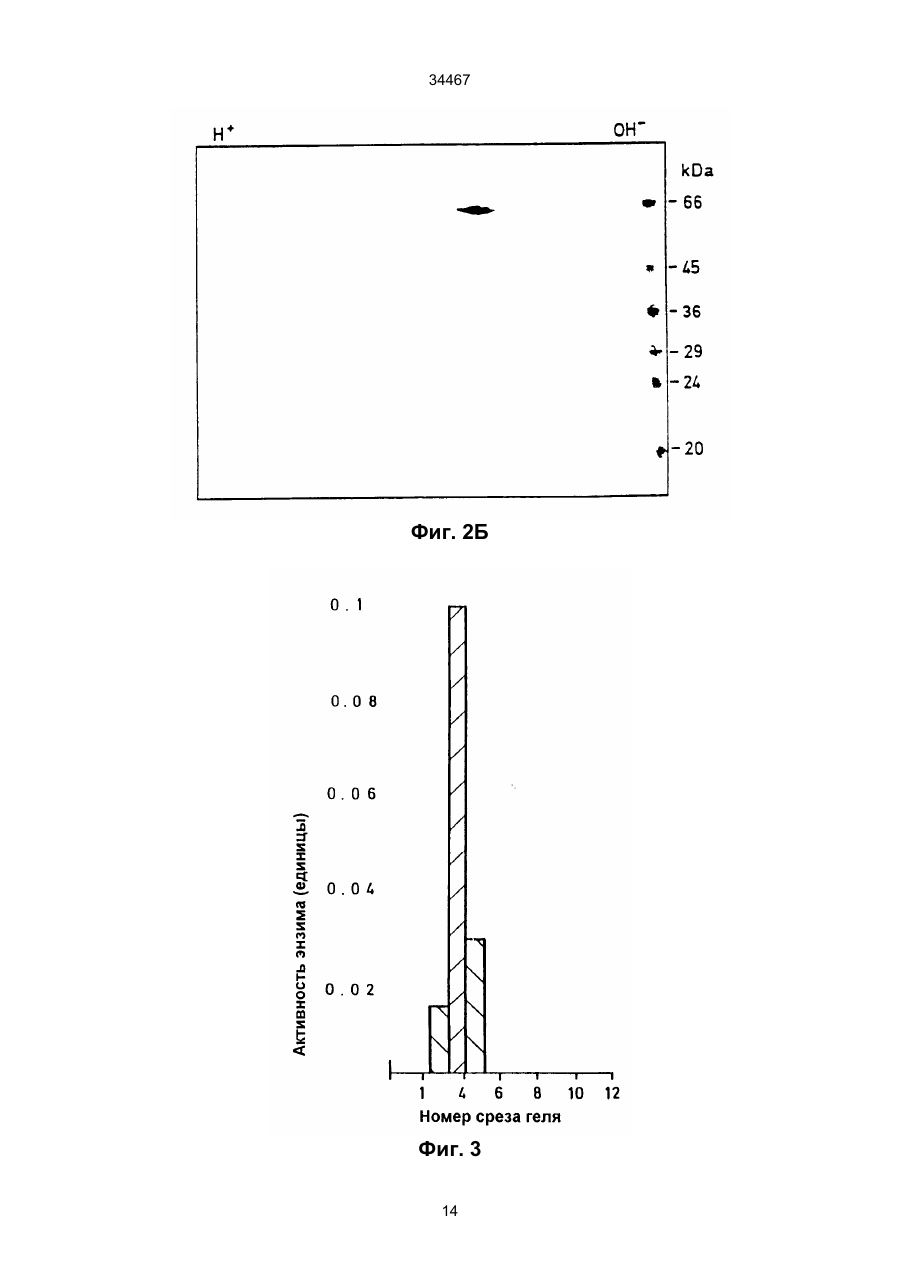
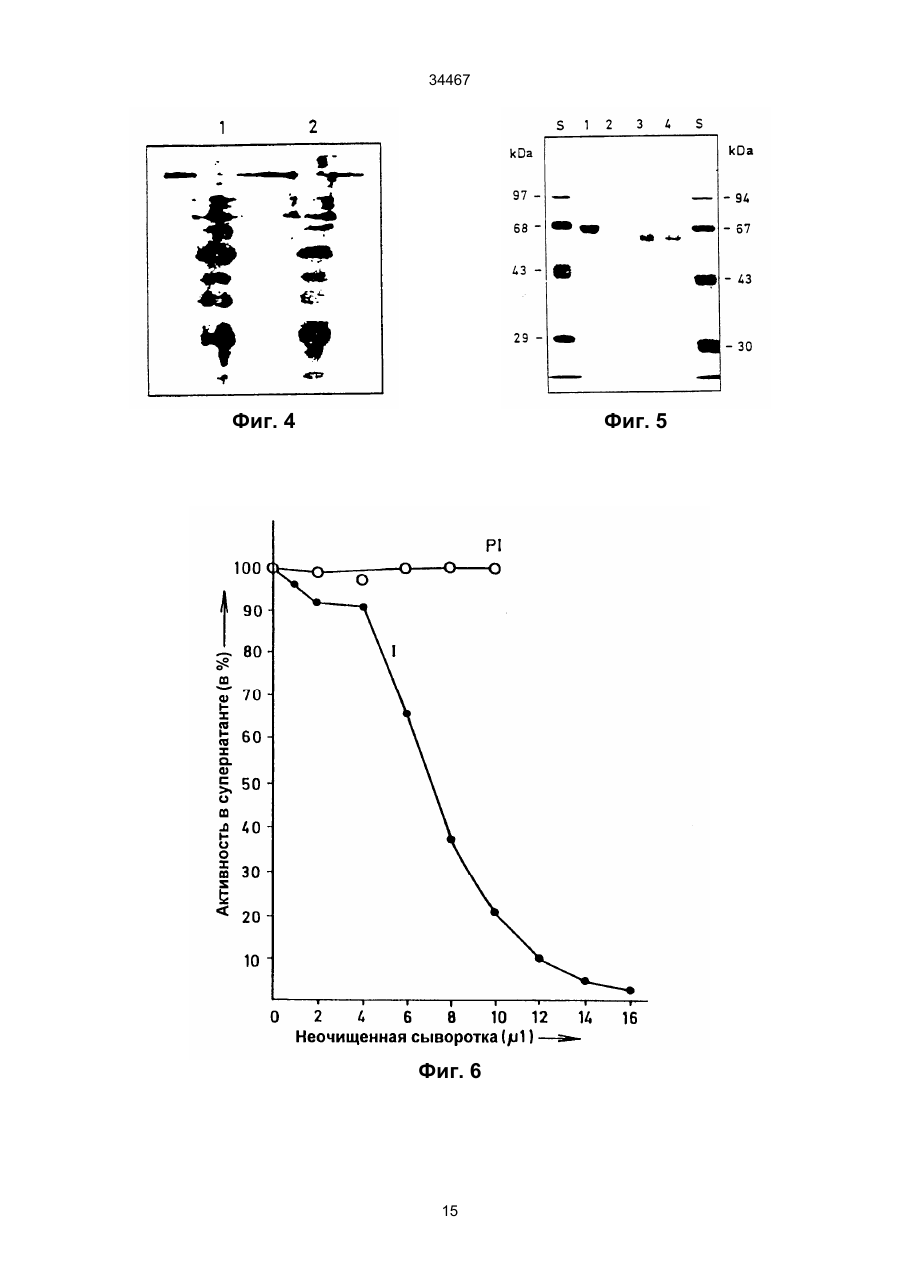
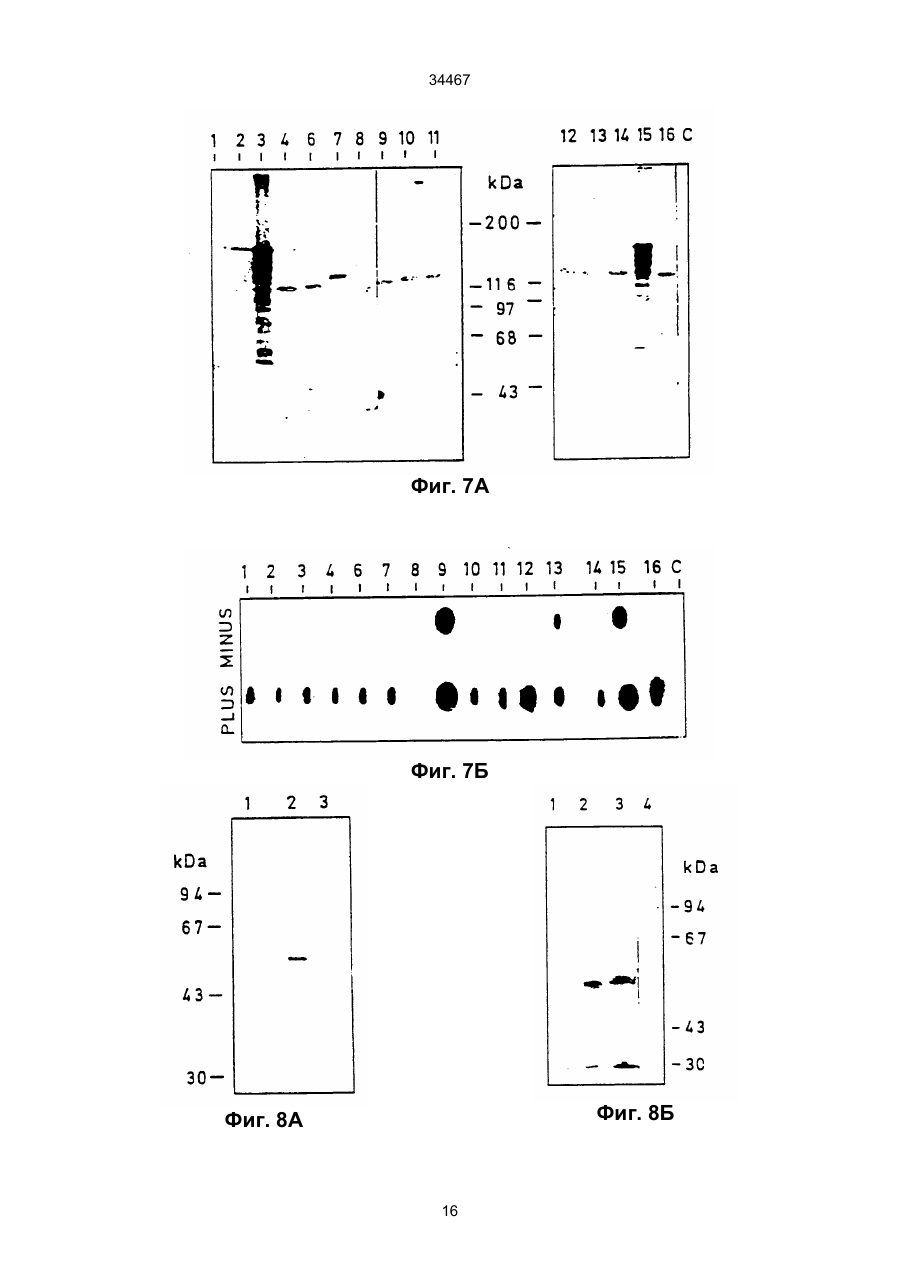
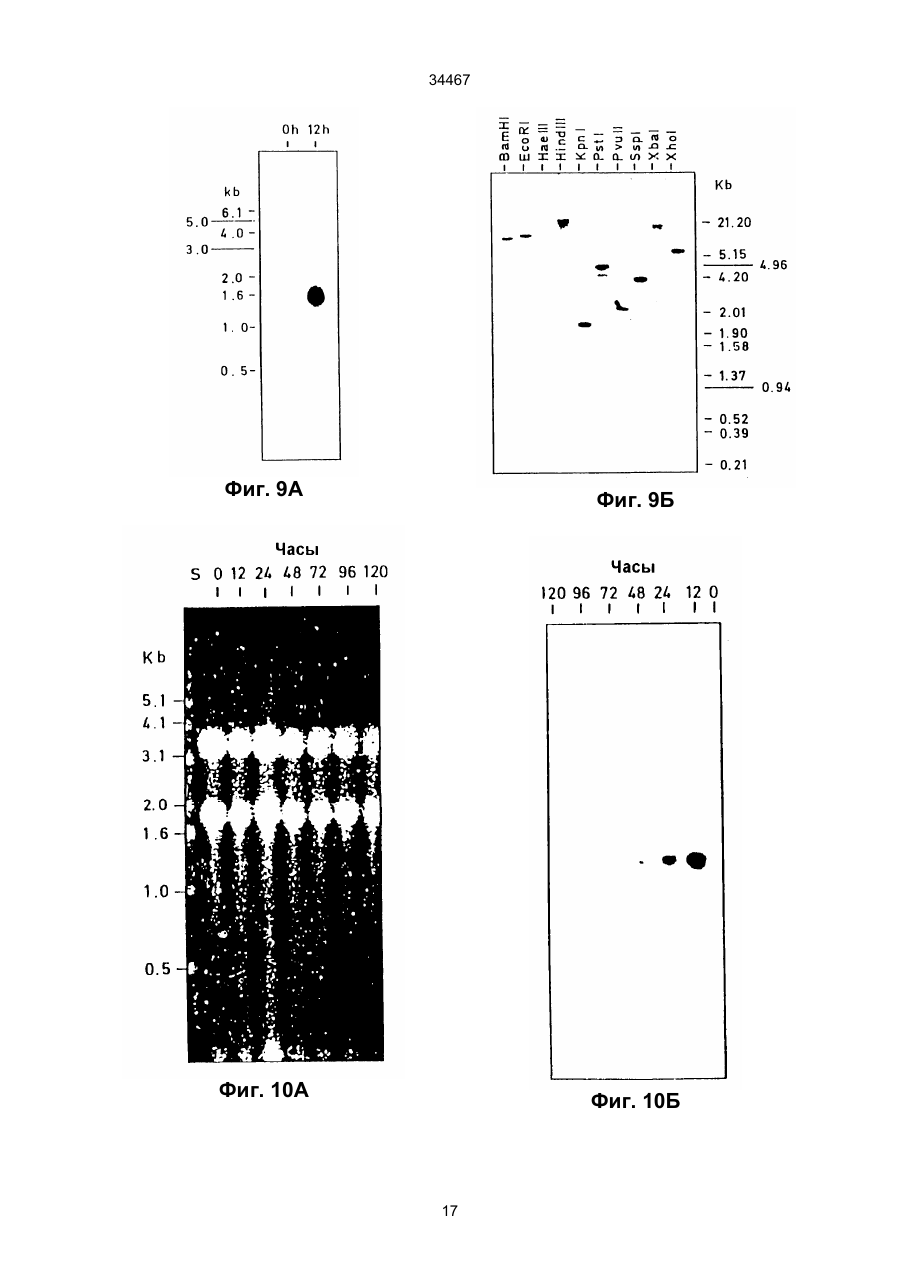
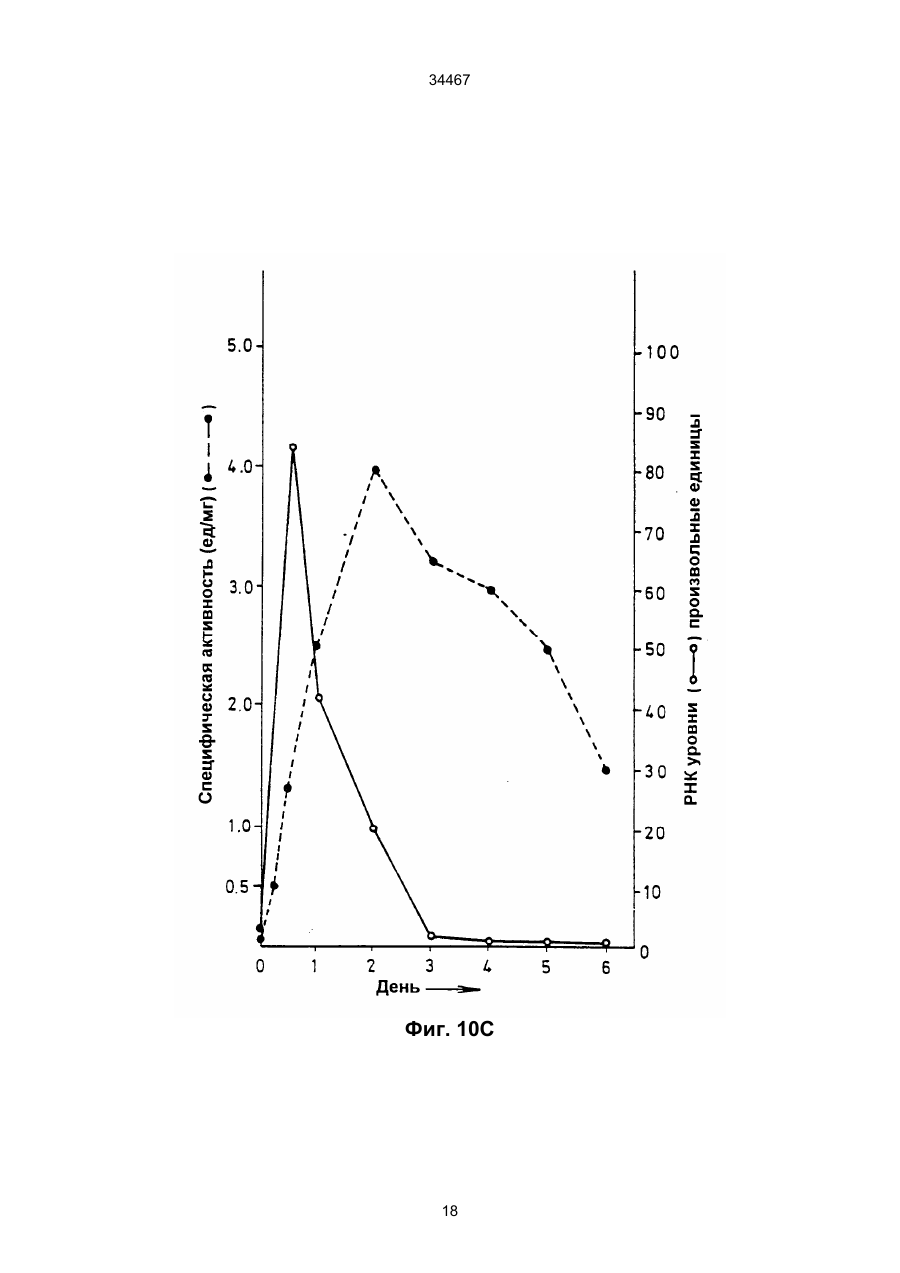
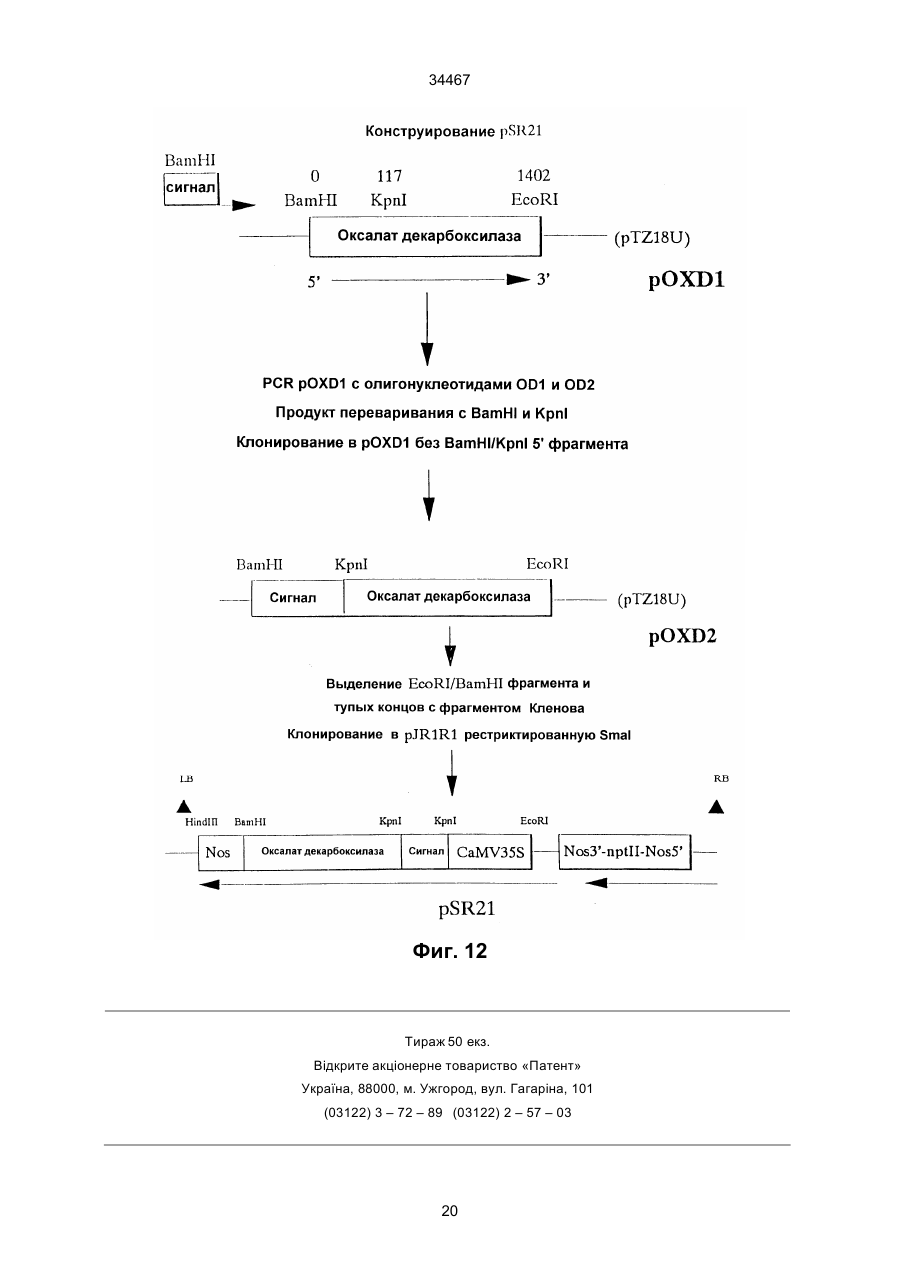
1. Выделенный и очищенный ДНК фрагмент, кодирующий оксалат-декарбоксилазу, имеющий последовательность, представленную в ПОСЛЕД. № 1. (19) UA (11) 34467 (13) C2 (21) 95058456 (22) 30.11.1993 (24) 15.03.2001 (31) 07/985.695 (32) 30.11.1992 (33) US (86) РСТ/GB93/02462, 30.11.1993 (46) 15.03.2001, Бюл. № 2, 2001 р. Ю 34467 2. Фрагмент по п.1, отличающийся тем, что кодирует грибковую оксалат-декарбоксилазу. 3. Фрагмент по п.1, отличающийся тем, что кодирует оксалат-декарбоксилазу и выделяется из грибков Collybia velutipes. ______________________________ Настоящее изобретение относится к ферменту, разрушающему щавелевую кислоту. В частности, изобретение относится к ферменту, названному оксалат-декарбоксилазой, и к кодирующей этот фрагмент ДНК последовательности. Изобретение кроме того относится к рекомбинантной молекуле, включающей кодирующую оксалатдекарбоксилазу последовательность, и к клеткехозяину, трансформированной такой молекулой. Изобретение относится также к способу защиты растений от неблагоприятного воздействия на них щавелевой кислоты и к способу снижения в растениях содержания щавелевой кислоты. Известно, что большая часть оксалатов, попадающая в пищу животным, и человеку в том числе, имеет растительное происхождение. Некоторые овощные культуры в виде зеленых листьев (напр., амарантус, шпинат, ревень) являются богатыми источниками витаминов и минералов, но одновременно содержат щавелевую кислоту, являющуюся вызывающим стресс пищевым фактором. Указанные растения при их потреблении в больших количествах становятся для человека ядовитыми, что связано с образованием оксалатных хелатов кальция и осаждением оксалата кальция в почках с последующей гипероксалурией и разрушением почечных тканей (Decastro, I. Pharm, Biomed. Anal 6, 1(1988); Hodgkinson, Clin. Chem 16, 547 (1970)). Помимо приведенных ссылок можно указать на, по меньшей мере, два обстоятельства, в которых щавелевая кислота участвует косвенным путем. В одном из случаев образование щавелевой кислоты является важным элементом механизма нападения, выбранного грибком Whetziinia sclerotiorium, наносящего серьезный урон таким культурным растениям, как подсолнечник. Щавелевая кислота накапливается в инфицированных тканях на ранних этапах патогенеза, и ее концентрация повышается в ходе колонизации патогеном клеток-хозяев. Накопление щавелевой кислоты в листьях приводит к их увяданию, и в конечном итоге гибели. Таким образом, щавелевая кислота действует, как подвижный токсин, перемещающийся из основания стебля и листьев вместе с соком (Maxwell, Physiol Plant Pathol 3, 279 (1973)). В другом случае потребление Lathyrus sativus (вика) приводит к нейролатиризму, проявляющемуся в мышечной спастичности ног, параличе нижних конечностей, судорогах и смерти. L. sativus относится к богатым белком твердым сортам бобовых, произрастающих в экстремальных условиях, например: в условиях сильных ветров и повышенного увлажнения, вследствие чего эта культура не требует за собой особо сложного ухода. В различных частях растений присутствует нейротоксин b-N-оксалил-L-a, b-диаминопропионовая кислота (ОДАП). Синтез ОДАП происходит по двухстадийной реакции, в которой щавелевая кислота является важным исходным соединением. ОДАП выступает в роли метаболического антаго ниста глутаминовой кислоты, участвующей в передаче нервных импульсов в головном мозгу. Соответственно, данный вид бобовых, несмотря на высокое содержание в нем белка, не может быть рекомендован в качестве источника пищи (Mickelson и др. (1973)) в издании "Влияние современного питания на здоровье и заболевания, диэтотерапия (ред. Goodhart R.S. Shils M.E.) 5-ое изд. стр. 412– 433, Ли и Фебижер, Филадельфия). Исследования роли щавелевой кислоты в вышеупомянутых системах подчеркивает ее значение в качестве важного стрессового фактора. Ценность выделенного гена, кодирующего белковый продукт, разрушающий щавелевую кислоту, очевидна. Подобный ген может быть использован в качестве инструмента эффективного разрушения щавелевой кислоты в растениях, в которых кислота накапливается в чистом виде или является субстратом в синтезе нейротоксина, или является средой для патогенеза. И все это может быть осуществлено переносом единственного гена в такого рода растения. Из известных ферментативных разрушающих щавелевую кислоту систем особый интерес представляет оксалат-декарбоксилаза из базидиомицетовых грибков Collybia velutipes, поскольку имеются сообщения о частично очищенном ферменте, в присутствии которого происходит одностадийное разложение щавелевой кислоты в диоксид углерода и муравьиную кислоту (неядовитую органическую кислоту) без необходимости присутствия какого-либо кофактора (Shimarono и др. I. Biol. Chem 227, 151 (1957)). Настоящим изобретением получают очищенную оксалат-декарбоксилазу и кодирующую ее ДНК последовательность. Изобретение кроме того включает способы применения кодирующей последовательности для создания трансгенных растений с низким содержанием щавелевой кислоты. В результате, настоящее изобретение позволяет исключить стрессовые ситуации, создаваемые щавелевой кислотой в вышеупомянутых случаях. Кроме того изобретение делает возможным создание аналитических систем для определения содержания оксалата в моче и сыворотке. Целью изобретения является выделение в чистом виде и полная характеристика оксалат-декарбоксилазы. Целью изобретения также является выделение, характеристика и конструирование гена, который может быть использован для экспрессии оксалат-декарбоксилазы в микробах и растениях. И еще одна цель изобретения состоит во введении экспрессирующего оксалат-декарбоксилазу гена в растения (в том числе полевые культуры, например: подсолнечник, соевые бобы, бобы в целом, рапс, люцерна, лен, сафлор, земляной орех и клевер, овощные культуры, например: салат, томаты, огурцы, картофель, морковь, редис, горох, чечевицу, капусту, брокколи и брюссельскую капусту, цветы, например: петунию и ромашки и садовые 2 34467 растения, например: персик) с приданием в результате таким растениям устойчивости к заболеваниям, особенно грибковым заболеваниям, в которых основную роль играет щавелевая кислота, например, заболеваний, вызываемых грибками рода Sclerotinia, Sclerotium, Aspergillus, Streptomyces, Penicillium, Pythium, Paxillus, Mycena, Leucostoma, Rhizoctonia, и Schizophyllum. Настоящее изобретение в широком смысле направлено на применение разрушающего оксалат фермента, примером которого может служить оксалат-декарбоксилаза, в промышленных масштабах, например: в пивоваренной промышленности или в сельском хозяйстве, в частности, для уменьшения подверженности растения к действию щавелевой кислоты или для уменьшения в растении концентрации эндогенной щавелевой кислоты. Разрушающий оксалат фермент (оксалат-декарбоксилаза) может быть использован для снижения гибели или разрушения растений от заболеваний или иных явлений, в которых щавелевая кислота играет решающую инвазивную роль. Подобные заболевания вызываются, в частности, среди прочих грибками вышеотмеченных специфичных родов. В данном описании раскрывается изобретение, относящееся по существу к очищенной и охарактеризованной оксалат-декарбоксилазе. Фермент имеет кислотное значение р1, устойчив в широком интервале значений рН и умеренно термостабилен. Молекулярная масса фермента при определении методом НДС–ПАГЭ (электрофорез в полиакриламидном геле с натрийдиоктилсебацинатом) равна 64 кДа в гликозилированной форме и 55 кДа в дегликозилированной форме. Кроме того, в настоящем описании раскрывается изобретение, относящееся к полному чистому гену, кодирующему фермент оксалат-декарбоксилазу, с характерной ДНК последовательностью, представленной ПОСЛЕД. № 1. Ген кодирует фермент, характеризующийся активностью оксалат-декарбоксилазы с молекулярной массой (дегликозилированная форма) примерно 55 кДа при определении методом НДС–ПАГЭ. Изобретение относится также к композициям, предназначенным для борьбы с патогенезом растений, и такие препараты включают химические вещества, отличающиеся способностью разрушать щавелевую кислоту, в частности, активностью оксалат-декарбоксилазы. В частности, соединение с активностью оксалат-декарбоксилазы присутствует в количестве, достаточном для разрушения продуцируемой патогенной щавелевой кислоты. Необходимо указать, что в другом варианте применения в сельском хозяйстве такое соединение будет смешано с соответствующим агрономически приемлемым носителем, способным обеспечить доставку активного соединения к растению или в почву. В данном описании раскрыта трансформированная клетка растения, и такая клетка трансформирована геном, кодирующим оксалат-декарбоксилазу. Ген, кодирующий указанный фермент, может включать ДНК последовательность, представленную ПОСЛЕД. № 1. Предложен способ защиты растения от действия щавелевой кислоты, если растение нуждается в такой защите. Способ состоит в обеспе чении нуждающегося в защите растения разрушающего щавелевую кислоту фермента в необходимом для защиты растения количестве. Рекомендуется, чтобы разрушающим щавелевую кислоту ферментом была оксалат-декарбоксилаза, кодируемая геном с последовательностью, представленной ПОСЛЕД. № 1. Способы такой защиты могут быть самыми различными, в том числе и трансформация растения геном, кодирующим разрушающий щавелевую кислоту фермент, в частности, оксалат-декарбоксилазу. Или способ защиты может заключаться в применении разрушающего щавелевую кислоту фермента в сочетании с агрономически приемлемым носителем для непосредственной обработки растения или почвы, на которой растение произрастает. Краткие пояснения к диаграммам. Другие цели и преимущества настоящего изобретения станут понятными из последующего описания изобретения. Рис. 1. Характер элюирования оксалат-декарбоксилазы с хроматофокусирующей колонки. Белок со стадии, обозначенной как Ацетон–IV, наносят на колонку с DEAE–Сефарозой CL–6В (1 х 13 см), уравновешенную калийацетатным буфером (рН 4,5). Связанные белки элюируют понижающимся градиентом рН. Активность связана с пиком А, элюирующимся при рН 3,3, и пиком В, элюирующимся при рН 2,5. Там же показаны белковые полосы, соответствующие обоим пикам. Пики А (вертикальная полоса А) и В (вертикальная полоса В) разделены с помощью 11% НДС–ПАГЭ и окрашиваются Кумасси голубым. Вертикальной полосой S представлены маркеры молекулярной массы фирмы Сигма (SDS–7). Рис. 2. Оценка чистоты. (А) Двукратные последовательные разбавления (вертикальные полосы 1–7) оксалат-декарбоксилазы, начиная с 3 мкг (вертикальная полоса 1) белка, разделяют на 7– 15% градиента НДС–ПАГЭ. (В) Оксалат–декарбоксилазу (10 мкг, пик А) разделяют изоэлектрическим фокусированием (рН 2,5–5, амфолиты, Франция) в первом приближении и с помощью 12% НДС–ПАГЭ во втором приближении. Полосой S представлены SDS–7 (Сигма) калибровочные стандарты молекулярной массы. На рис. 2 (А) и (В) гели окрашены Кумасси голубым. Рис. 3. Корреляция активность - вертикальная полоса. Белок (500 нг) подвергнут электрофорезу в двух вертикальных полосах 6% неденатурированного полиакриламидного геля; одна из полос окрашена Кумасси голубым, а другая разрезана на двенадцать кусочков величиной 4 мм. Кусочки геля инкубируют в 200 мкл 0,1 М калийацетатного буфера (рН 4,5). Акриламид измельчают и вымачивают в течение примерно суток при 4оС. Определяют ферментативную активность и коррелируют с полосой в вертикальной окрашенной полосе. Расстояние миграции (Rf = 0,35, кусочек геля № 4), соответствующее ферментативной активности (0,2 единицы), коррелируется с активностью единственной окрашенной полосы (500 нг). Никакой другой белковой полосы и никакой ферментативной активности не обнаруживается в какой-либо другой части геля. Рис. 4. Сравнение продуктов расщепления по Кливленду двух форм оксалат-декарбоксилазы. 3 34467 Пептидные карты созданы непосредственно в 4,5 % слоистом геле из 15 % разделяющего геля. Полипептиды (10 мкг) пика А и пика В вырезают из 11 % НДС-полиакриламидного геля и гидролизуют в присутствии 100 мкг/мл протеазы V8 (S. aureus Сигма). Пептиды электроблотируют на нитроцеллюлозную мембрану и иммунодетектируют антителами к оксалат-декарбоксилазе в разбавлении 1:5000. Вертикальные полосы: 1 – белок пика А и 2 – белок пика В. Рис. 5. Дегликозилирование оксалат-декарббоксилазы. Фермент (1 мкг) пика А обрабатывают 1 мЕ (вертикальная полоса 3) и 10 мЕ (вертикальная полоса 4) Эндо Н (в течение 22 часов) и разделяют в 11% НДС–ПАГЭ. Полосы 1 и 2 содержат неподвергавшиеся обработке контрольные образцы пика А. Полосой S (справа) представлены маркеры молекулярной массы фирмы фармация и полосой S (слева представлены предварительно окрашенные высокомолекулярные маркеры фирмы БРЛ. Рис. 6. Иммунотитрование ферментативной активности. Фермент (1,5 мкг) в 0,02 М калийацетатном буфере (рН 4,5) инкубируют 2 часа при 25оС с различными объемами сыворотки (1). Иммунокомплексы центрифугируют при 12000 х g и стандартными анализами определяют остаточную активность. Контрольное инкубирование проводят с предиммунной сывороткой (Р1). Рис. 7 (А) Слитые белки оксалат-декарбоксилаза-b-галактозидаза. IPTG – индуцируемые макробляшки лизируют 1% буфером Лаэммли, разделяют на 10% НАДС–ПАГЭ, переносят на нитроцеллюлозу и зондируют антителами к оксалатдекарбоксилазе. Цифры над вертикальными полосами соответствуют номерам клонов, буквой "С" указана контрольная вертикальная полоса с макробляшкой из нерекомбинантного продукта (В) Дифференцированная гибридизация РНК из иммуноположительных бляшек. Фаговую ДНК (500 нг), выделенную из клонов, связывают с мембраной Ген Скрин Плюс в дублях и гибридизируют с оксалат-неиндуцированными (минус) и оксалатиндуцированными (плюс) кДНК зондами (2,5 х 108 срm/мг кДНК. Буква "С" относится к контрольной нерекомбинантной лямбда-gt 11 ДНК. Рис.8. Трансляция in vitro. Продукты трансляции транслируемой in vitro полной оли-(А+) РНК из неиндуцированных (0 ч, вертикальная полоса 1) и оксалат-индуцированных (12 ч, вертикальная полоса 2) этапов иммуноосаждают и разделяют с помощью 10% НДС–ПАГЭ. Гель подвергают флюорографии и авторадиографии. Вертикальная полоса 3 показывает исчезновение линии в 55 кДа в случае присутствия очищенной оксалат-декарбоксилазы в качестве конкурирующего за связывание с антителами вещества в ходе иммуноосаждения. (В) Трансляция с отбором гибрида, Поли(А+) РНК (20 мкг/мл), выделенная из 12 ч оксалат-индуцированного C. Velutipes, гибридизируют с плазмидной ДНК (1,2 к.о. кДНК вставка в рТ Z 18 U), связанной с мембраной Ген Скрин Плюс. РНК элюируют и транслируют в лизате ретикулоцитов кролика и продукты трансляции иммуноосаждают и разделяют с помощью 10% НДС–ПАГЭ. Вертикальная полоса 1 – отсутствие мРНК, полоса 2 – отобранная гибридизацией мРНК из вставки в 1,2 к.о., полоса 3 –12 ч полная поли (А+) РНК и верти кальная полоса 4 – нерекомбинантные векторные последовательности. Указаны маркеры молекулярной массы. Рис. 9. (А) Нозерн блотирование, показывающее 1,5 к.о. мРНК для оксалат-декарбоксилазы из C.Velutipes Поли(А+) РНК (1 мкг) с неиндуцированного (0 ч) и оксалат-индуцированного (12 ч) этапов денатурируют глиоксалем, разделяют на 1,2% агарозном геле, блотируют на мембрану Ген Скрин Плюс и зондируют (a32Р)-меченной кДНК (9 х 107 срm/мг) на присутствие оксалат-декарбоксилазы. В качестве стандарта размера применяют леддер в 1 к.о. фирмы БРЛ. (В) Саузерн блотирование геномной ДНК из C. velutipes. Геномную ДНК (4 мкг) гидролизуют в присутствии ферментов рестрикции, разделяют на 1,2% агарозном геле, переносят блотингом на мембрану Ген Скрин Плюс и гибридизируют с (a32Р)-меченной кДНК вставкой. В качестве стандартов молекулярного размера применялись лябда-HindIII/Eco R., и pU C19Hinf 1 продукты гидролиза. Рис. 10. Регулирование экспрессии гена оксалат-декарбоксилазы. Показана полная РНК (10 мкг), выделенная из культур С. Velutipes в различные моменты времени после добавления щавелевой кислоты. (А) Окрашенный этидийбромидом 1,2% агарозный гель, демонстрирующий сравнительное содержание денатурированной глиоксалем РНК. (В) Полная РНК, перенесенная на мембрану Ген Скрин Плюс и гибридизированная с a32Р-меченной кДНК вставкой в 1,2 к.о. (С) Относительное количество поли (А+) РНК, кодирующей оксалат-декарбоксилазу (О) на основании интегрирования площадей денситометрического следа в авторадиографии (В). Показана также удельная активность фермента, выделенного из той же культуры . Подробное описание изобретения Очищенная оксалат-декарбоксилаза настоящего изобретения, ее применение в качестве средства борьбы с патогенезом и ее применение для трансформации растений суммарно дают способ борьбы с заболеваниями растений, в которых решающую роль играет щавелевая кислота, как в ходе патогенеза, так и на инвазивном этапе. Настоящее изобретение особенно перспективно в связи с тем, что настоящим бедствием промышленного выращивания важнейших сельскохозяйственных растений, например, таких культур, как подсолнечник являются некоторые виды грибков, таких как Sclerotinia, секретирующих щавелевую кислоту. Преимущества настоящего изобретения могут быть использованы либо трансформацией растений, либо применением оксалат-декарбоксилазы в качестве традиционного пестицида, наиболее вероятно в сочетании с соответствующим агрономически приемлемым носителем. Одно из важнейших преимуществ применения оксалат-декарбоксилазы в качестве пестицида заключается в ее экологической чистоте, т.е. в отсутствии загрязнения окружающей среды и безвредности для растений. В случае внешнего применения фермента для защиты растения или его части от патогенов фермент может быть разбавлен с образованием раствора или суспензии или может быть смешан с твердым разбавителем для использования в виде дуста. Конкретный характер применения фермента частично будет определяться целевым патоге 4 34467 ном-(ами) и растением-(ями). Подробные методики подбора общих способов защиты характерных культурных растений и борьбы с патогенами можно найти в издании "Способы выявления пестицидов для борьбы с патогенами растений", под ред. K.D. Hickey Американское фитопатологическое Общество, 1986. Вспомогательные вещества, которые могут быть добавлены в препарат, включают средства, способствующие солюбилизации, смачивающие средства и стабилизаторы или средства, дающие микрокапсулированный продукт. Такие вспомогательные вещества хорошо известны специалистам. Для внешней обработки могут быть также использованы рекомбинантные микроорганизмы, как в жизнеспособной форме, так и после превращения в нежизнеспособную форму с применением способа, не дезактивирующего фермент. Выделение чистой оксалат-декарбоксилазы из C. Velutipes описано в последующих примерах, также как и характеристика выделенного фермента. При хроматофокусировании разделяют две формы фермента. Два изозима, как показано, родственны по аминокислотному составу, пептидному картированию и иммунологической перекрестной реакционной способности. Пик А, элюирующийся при рН 3,3, подвергнут дополнительным исследованиям: Km, как найдено, равен 4,5 мМ и величина Vmax ровна 166 мкмоля/мин/мг. Субъединичная молекулярная масса гликозилированного фермента 64 кДа в то время как масса дегликозилированного белка равна 55 кДа. Фермент показывает кислотное значение р1, очень стабилен в широком интервале значений рН и умеренно термостабилен. Ген, кодирующий происходящую из грибков оксалат-декарбоксилазу, имеет последовательность, соответствующую ПОСЛЕД. № 1, и его клонируют способом, описанным в нижеследующих примерах. Если вкратце, то кодирующую фермент кДНК получают иммуноскринингом lgt 11 экспрессионной библиотеки. Трансляция in vitro отобранной гибридизацией мРНК дает белок в 55 кДа. Геномная Саузерн гибридизация указывает на кодирование оксалат-декарбоксилазы единственным геном. кДНК зонд гибридизируется только с теми видами мРНК, которые содержат 1,5 килопар оснований (к.о.). Показано, что мРНК индуцируется щавелевой кислотой. Наблюдается временная связь между ферментативной активностью и содержанием мРНК, указывающая на то, что экспрессия оксалат-декарбоксилазы регулируется на транскрипционном уровне. Ген со строением, соответствующим ПОСЛЕД. № 1, содержащей кодирующую последовательность зрелого фермента оксалат-декарбоксилазы, может быть связан с генетическими регуляторными элементами, необходимыми для экспрессии структурального гена в определенной клеткехозяине. К первому типу необходимого регуляторного элемента относится область генного промотора, содержащая ДНК последовательности, распознаваемые по биологическому механизму клеткой растения и индуцирующие транскрипцию ДНК последовательности в матричную РНК (мРНК). Затем мРНК транслируется в белковый продукт, кодируемый областью структурального гена. Промо тор присоединяют впереди или у 5'-конца гена оксалат-декарбоксилазы, что может быть осуществлено стандартными известными специалистам методами. См. например, Maniatis и др. (1982), "Молекулярное клонирование", Коулд Спринг Харбор Лаборатори, Нью–Йорк, стр. 104–106. Области промотора, которые могут быть использованы для экспрессии гена оксалат-декарбоксилазы в клетках растения, включают промоторы, проявляющие активность в широком спектре разнообразных растительных тканей. К примеру, 35S промотор из мозаичного вируса цветной капусты может оказаться пригодным для этой цели. К промоторам другого типа, которые могут быть использованы в клетках растения, относятся промоторы, экспрессирующие в более жестких условиях. Этот класс включает промоторы, проявляющие активность только в определенной ткани-(ях) растения, и/или активность которых индуцируется определенными стимулами, например, повреждением. Примером промотора этого типа является регуляторная 5'-область из гена фенилаланин-аммиак-лиаза (PAL). Промоторы данного типа обсуждаются в работе Liang и др., (1989) PNAS США, 86, 9284–9288. Экспрессия гена оксалат-декарбоксилазы в микробных хозяевах может быть достигнута применением промоторов, получаемых из микробиальных источников. Примеры подобных промоторов включают trp промотор для экспрессии в бактериях, таких как E. coli (пример применения этого промотора дается в работе: Amann и др. (1983) Cene 25, 167–178) или глицеральдегидфосфат-дегидрогеназный (САРD) промотор для экспрессии в дрожжах (пример применения этого промотора дается в работе: Edens и др. (1984) Cell, 37, 629–633). Последовательности генного промотора могут частично или полностью происходить из промоторных последовательностей, которые могут быть обнаружены в клетках, отличных от клеток-хозяев, если только такие промоторы отвечают вышеуказанным требованиям для транскрипции и трансляции. Вторым генетическим регуляторным элементом, присутствие которого возможно, но необязательно, присоединяемым к гену оксалат-декарбоксилазы, является терминатор или последовательность полиаденилирования, эффективно промотирующий прекращение транскрипции гена, а в эукариотах, кроме того, промотирующий полиаденилирование, т.е. присоединение любого числа аденозиновых нуклеотидов к 3'-концу мРНК. Для присоединения области терминатора позади или 3'-конца гена используют стандартные известные специалистам методы (Maniatis и др., стр. 104–106, см. выше). Примером такой последовательности терминатора полиаденилирования может служить последовательность из гена октопинсинтетазы из Agrоbacterium tumefaciens Ti плазмиды, о чем сообщают в работе: Decreve и др. (1982) I. Mol. Appl. Cenet 1, 499–511. Примером такого же терминатора для экспрессии в микробиальном хозяине является последовательность Yho-независимого терминатора транскрипции из Salmonella typhimurium, См., например, M.E. Winkler (1987) "Escherichia coli и Salmonella typhimurium, Клеточная и молекулярная биология", гл. ред. F.C. Neidhardt, Американское общество микробиоло 5 34467 гов. Генные последовательности терминатора могут также частично или полностью происходить из последовательностей терминатора, которые можно обнаружить в клетках, отличных от клеток-хозяев, если только такие последовательности отвечают вышеприведенным требованиям для превращения транскрипции и полиаденилирования, предъявляемым к клеткам хозяевам. К еще одному типу регуляторного элемента, который может быть присоединен к гену оксалатдекарбоксилазы, принадлежит ДНК последовательность, кодирующая сигнальный пептид. Сигнальный пептид присоединяется к аминоокончанию белка и и осуществляет локализацию белка на клеточной стенке или его секретирование из клетки-хозяина. В ходе процесса локализации сигнальный пептид отщепляется с образованием белкового продукта, имеющего последовательность зрелого белка. ДНК последовательность для сигнального пептида вставляется между промотором и областью кодирования. Для присоединения ДНК последовательности сигнального пептида могут применяться стандартные, известные специалистам методы (Maniatis и др., стр. 104– 106, см. выше). Примеры подобных сигнальных последовательностей включают сигнальный пептид из гена экстенсина растений (Chen и Varner 1985, ЕМВО I, 4, 2145–2151), из бактериального peIB (пектат-лиаз) гена Erwinia carotovora (Lei и др. (1987) I. Bacteriol 169, 4379) и из препрофактора дрожжей (Smith и др., 1985, Science, 229, 1219– 1229). Последовательности сигнального пептида могут кроме того частично или полностью происходить из сигнальных последовательностей, обнаруживаемых в клетках, отличных от клеток-хозяев, если только такие последовательности отвечают вышеуказанным требованиям к обработке и локализации белка в клетке-хозяине. Для вставки гена оксалат-декарбоксилазы в растение-хозяин используют любой из разнообразных способов, применяемых для введения в растение чужеродного гена. Методика, выбранная для проведения трансформации растения геном оксалат-декарбоксилазы, меняется в зависимости от растения-хозяина. В виде примера одной, хорошо разработанной методики, которая могла бы оказаться полезной для трансформации растения геном оксалат-декарбоксилазы, можно указать осуществляемую через Agrobacterium трансформацию. Осуществляемую через Agrobacterium трансформацию с применением гена оксалат-декарбоксилазы проводят по методикам, хорошо известным для этого способа. Вначале в штамм с перетрихальными жгутиками Agrobacterium tumefaciens в качестве промежуточного хозяина вводят генную каcсету, пригодную для экспрессии в растениях. Генную каcсету оксалат-декарбоксилазы вводят в Т–ДНК область рекомбинантной плазмиды, содержащей поддающийся отбору маркерный ген, например, ген, кодирующий неомицин-фосфотрансферазу 11, фосфинотрицин-ацетилтрансферазу и т.п. Такие методы освещены в литературных ссылках, в том числе в работе: Horsch и др. (1985) Science 227, 1229–1231. Кусочки растительной ткани, например: листьев, семядоли или гипокотиля совместно инкубируют 2–3 дня с бактериями, после чего бактерии убивают антибиотиком, например, карбенициллином. В культурную среду растительной ткани включены дополнительные антибиотики, соответствующие применяемому поддающемуся отбору маркерному гену, поэтому растут только трансформированные клетки растения. Выросшие из трансформированных клеток растения затем анализируют на присутствие и экспрессию гена оксалат-декарбоксилазы. Для идентификации отдельных трансформантов могут применяться иммуноанализы и анализы на определение активности оксалат-декарбоксилазы. Толерантность к экзогенной щавелевой кислоте также может быть использована в качестве функционального теста на интактные клетки. Как уже отмечалось, для трансформации растения помимо трансформации через Agrobacterium имеются и некоторые другие методы. Примерами таких других способов переноса ДНК является электропорация, т.е. индуцированная химически доставка в протопласты, микроинъектирование, биолистирование, а также и другие методы. Примерами тех типов растений, которые не особенно склонны к трансформации, осуществляемой через Agrobacterium, представляют собой сою, а также некоторые зерновые, в том числе кукурузу. Указанные растения только выигрывают от попыток их трансформации другими методами, отличными от трансформации, осуществляемой через Agrobacterium. Некоторые аспекты настоящего изобретения будут более подробно раскрыты в следующих неограничивающих изобретение примерах. Пример 1. Очистка и характеристика оксалат-декарбоксилазы Методика эксперимента Микроорганизм и условия выращивания С. Velutipes (штамм S АТСС 13547) выращивают на поверхности среды, содержащей 5% декстрозы, 1% пептона, 0,1% КН2РО4, 0,05% MgSO4 x x 7H2O и 1% солодового экстракта Дифко (рН 5,2). Микроорганизм выращивают при 25оС из мицелиального инокулята в стационарных культурах в объеме среды, составляющей одну пятую объема сосудов для культивирования. Через 25 дней после инокулирования добавлением в каждый сосуд для культивирования 12,5 мМ щавелевой кислоты индуцируют образование фермента оксалат-декарбоксилазы. Спустя 2–3 дня после добавления щавелевой кислоты мицелий собирают, мицелиальный слой промывают холодной дистиллированной водой и хранят при -20оС. С. Velutipes выдерживают на скошенном агаре той же среды (Jakoby, Methods' in Enzymology 5, 637 (1962)). Очистка. Стадия 1. Получение сырого экстракта. Замороженный мицелий растирают 10 минут в смесителе Уоринга либо с сухим льдом, либо с жидким азотом. Порошок экстрагируют 10 минут при 4оС тремя объемами калийцитратного буфера (рН 3) и суспензию центрифугируют 30 минут при 10000 х g и 4оС. Надосадочную жидкость фильтруют через двойной слой сырного полотна. Стадия 2. Осаждение ацетоном. Методика концентрирования ацетоном взята из работы: Shimarono и Hayaishi (I. Biol. Chem. 227, 151 6 34467 (1957)) за исключением того, что две последние стадии не проводились. Указанные проценты даны в об./об. с учетом складываемых объемов. (а) Низкую температуру (-10оС) для осаждения ацетоном создают применением бани соли со льдом. Образец охлаждают до 0оС и первое осаждение ацетоном проводят добавлением по каплям при постоянном перемешивании охлажденного 33,3% ацетона к надосадочной жидкости (Ацетон–I). Смесь приводят в равновесное состояние в течение 15 минут и образовавшийся осадок удаляют центрифугированием в течение 20 минут при 2оС в предварительно охлажденном роторе при 10000 х g. Осадок, полученный из 33,33 – 50% фракций, растворяют в одной пятой начального объема холодного калийацетатного буфера (0,1 М, рН 4,5). Раствор фермента диализуют 16 часов при 4оС относительно двух перемен 0,02 М калийацетатного буфера (рН 4,5) и образовавшийся в ходе диализа небольшой осадок центрифугируют (Ацетон–II). (b) Надосадочную жидкость переносят в 40% ацетон (Ацетон–III) и полученный осадок отбрасывают. Осадок от дальнейшего добавления к 50% ацетону (Ацетон–IV) растворяют в небольшом объеме 0,02 М раствора ацетата калия (рН 4,5). Стадия 3. Хроматофокусирование. D EAE– Сефарозу CL–6B (фармация) уравновешивают в 0,02 М калийацетатного буфера (рН 4,5) и используют для заполнения колонки на 10 мл (слой 1 х 13 см). Полученный при последнем осаждении ацетоном осадок пропускают со скоростью потока 10 мл/ч. Колонку промывают двумя колоночными объемами 0,02 М ацетата калия (рН 4,5) и элюирование осуществляют созданием внутреннего градиента рН с помощью 4 мМ кислотной буферной смеси (DL-аспартиновая кислота, L-глутаминовая кислота и глицин, по 4 мМ каждой, рН 2,3). Элюирование проводят при скорости потока 10 мл/ч и отборе фракций по 2 мл; белки регистрируют по поглощению света при 280 нм; фракции анализируют на ферментативную активность и в каждой фракции определяют рН. Фракции, проявляющие ферментативную активность, объединяют, диализуют относительно воды и концентрируют в микроконцентратора Амикон (отсечка 30000). Хранят фермент при 4оС. Ферментативный анализ. Активность оксалат-декарбоксилазы определяют измерением выделившейся из /14С/-щавелевой кислоты (Амерсхам, 4,1 мСi (ммоль) 14СО2. Ферментативный анализ проводят в небольших стеклянных пробирках, создающих 1 мл следующей реакционной смеси: 0,2 М цитрата калия (рН 3), 0,005 М оксалата калия (рН 3), 5,6 нмоля (0,0227 мкСi)/14C/-щавелевой кислоты и 0,2 мл раствора фермента. Перед добавлением фермента пробирки инкубируют 5 минут. Пробирки закрывают резиновыми пробками и инкубируют 30 минут при 37оС во встряхиваемой водяной бане. Реакцию прекращают инъектированием через резиновые пробки 0,2 мл 50% (об./об.) трихлоруксусной кислоты и пробирки встряхиваютеще 60 минут с целью поглощения выделившегося 14СО2 в 0,2 мл метилбензэтоний гидроксида (Сигма), помещенного внутрь стеклянной пробирки в пластиковом сосуде. Пластиковые сосудики извлекают и их содержимое переносят в 5 мл сцинтилляционной жидкости на основе толуола и в жидкостном сцинтилляционном счетчике определяют радиоактивность. В холостые пробирки перед добавлением фермента либо добавляют 0,2 мл ТХУК (50%), либо фермент вообще не добавляют. В кинетических опытах величины корректируют по радиоактивности, полученной для термически денатурированного фермента. Определение единицы активности. Однако единица активности определяется, как количество фермента, выделившего 1 мкмоль 14 СО2 в минуту при 37оС в стандартных условиях анализа. Общая эффективность анализа обычно находится в интервале 60–70%. Белок определяют микроаналитическим методом Lowry (Peterson, Anal Biochem 83, 346 (1977)). Значения Vmax и К определяют построением кривой Лайнуивера-Бурка (Lineweaver и Burk, I. Am. Chem. Soc. 56, 658–666 (1934)). Определение молекулярной массы. Молекулярную массу оксалат-декарбоксилазы определяют гель-фильтрационной хроматографией. Очищенный фермент (100 мкг в 100 мл) пропускают при комнатной температуре через FPLC колонку для гель-проникающей хроматографии (Супероза 12, 10 х 300 нм) при скорости потока 0,5 мл/мин и применением 0,02 М калийацетатного буфера, 0,1 М КСl (рН 4,5). Применяют следующие стандартные белки: триоглобулин (660 кДа, Фармация), ферритин (440 кДа, Фармация), каталазу (230 кДа, Фармация), альдолазу (158 кДа, Фармация), алкоголь дегидрогеназу (150 кДа, Сигма) и карбоновую ангидразу (29 кДа, Сигма). Состав субъединицы определяют электрофорезом на пластинках полиакриламидного геля с додецилсульфатом натрия и применением буферной системы Лаэммли (Laemmli, Nature 227, 680 (1970)). Оценка чистоты. Однородность очищенной оксалат-декарбоксилазы определяют разделением 10 мкг белка (пик А) электрофорезом на двумерном геле по методике 0'Farrell, I. Biol. Chem 250, 4007 (1975)). Аминокислотный состав. Образцы гидролизуют 6 М НСl в течение 22 часов при 110оС в эвакуированных и запаянных пробирках. Продукты гидролиза анализируют на аминокислотном анализаторе (ЛКБ 4151, Альфа Плюс). Цистеин и цистин определяют в виде цистеиновой кислоты после окисления надмуравьиной кислотой. Триптофан не определялся. Гидролиз VB протеазой осуществляют по известной методике (Cleveland, Methods in Enzymol 96, 222 (1983)). Углеводный анализ. Окрашивание гликопротеинов осуществляют применением реактива периодат-Шиффово основание. Содержание природного сахара определяют фенол-сернокислотным методом (Mekelvy и др., Arch. Biochem Biophys 132, 99 (1969)) с глюкозой в качестве стандарта. Фермент дегликозилируют эндо-b. N-ацетилглюкозаминидазой Н из S. plicatus (Боэрингеp Маннхейм, 40 мЕ/мкг) по методике Тримбля (Trimble и др., Anal. Biochem 141, 515 (1984)). Приготовление антисыворотки. 7 34467 Оксалат-декарбоксилазу (1 мг/мл) денатурируют кипячением 10 минут в ФБС в присутствии 0,5% НДС. Белковый антиген (150 мкг) в ФБС эмульгируют с полным адъювантом Фройнда и инъектируют подкожно Ново-Зеландскому белому кролику. Последующие бустерные инъекции делают в неполном адъюванте Фройнда подкожно спустя три недели. Четвертую инъекцию делают внутривенно. Титр антитела определяют иммунодиффузией методом Оустерлоуни (Garvey и др. 1977), Методы Иммунол.", 3-тье изд. В.А. Бенджамин Инк., Н.–Й.). Аффинную очистку антитела проводят по методике (Iwaki и др., Cell 57, 71 (1989)). Вестерн блоттинг и иммунодетектирование. Белки переносят на нитроцеллюлозную мембрану (Шлейхер энд Шуэлл), через которую 3 часа при 15оС пропускают постоянный ток в 150 мА по методике Тоубина (Towbin и др., Proc. Natl. Acad. Sci США, 76, 4350 (1979)). Иммунодетектирование проводят с использованием антител к оксалат-декарбоксилазе в разбавлении 1:5000 и детектированием реакцией с щелочной фосфатазой (Амерсхам, Супер-скрин система иммуноскрининга). Результаты. Максимальную активность оксалат-декарбоксилазы получают спустя 2 или 3 дня после добавления щавелевой кислоты. Результаты типичной методики очистки приведены в таблице 1. На хроматофокусирующей колонке фермент разделен на два пика: пик А, элюирующийся при рН 3,3, и пик В, элюирующийся при рН 2,5 (рис. 1). Пик А очищен 1670-тикратно с выходом 2,9%, а пик В, элюирующийся совместно с двумя незначительными примесями, очищен 614-тикратно с выходом 15% (таблица 1). Примеси могут быть удалены пропусканием через колонку Сафарозы 4В для гель-фильтрующей хроматографии, и полученный белок использован для определения аминокислотного состава. Вследствие высокой чистоты пика А соответствующий ему белок используют для последующей работы. Соответствующий пику А продукт элюируется единственным пиком на колонке Суперозы 12 для быстрого определения белков жидкостной хроматографией и 10 мкг белка дают единственное пятно при электрофорезе на двумерном геле (рис. 2В). Последовательные двухкратные разбавления фермента показывают, что, по меньшей мере, 45 мг белка могут быть обнаружены окрашиванием Кумасси голубым (рис. 4А). Расстояние миграции ферментативной активности (Rf = 0,35, кусочек геля 4) коррелируется с присутствием единственной окрашенной полосы на неденатурированном ПАГЭ (рис. 3). Никаких белковых полос и никакой ферментативной активности не обнаружено в каких-либо других частях геля. Таким образом, соответствующая пику А белковая полоса характеризуется активностью оксалат-декарбоксилазы. Препараты фермента стабильны при 4 или -20оС. При хранении при 4оС в концентрации 1 мг/мл в 0,02 М ацетате калия через 4 месяца определяют > 70 % первоначальной активности. Данные аминокислотного состава для двух пиков указывают на присутствие в очень больших количествах (22%) кислых аминокислотных остатков (таблица 2). Этим могут объясняться очень низкие величины р1 для них, хотя количество амидированных фрагментов в нативном белке не оп ределялось. Двум пикам соответствует очень близкий аминокислотный состав, за исключением в два раза более высокого содержания метионина и тирозина для пика В и в два раза более высокого содержания цистеиновой кислоты для пика А. На сходство дополнительно указывают пептидные карты, полученные для двух пиков применением V8 протеазы из Staphylococcus' aures (рис. 4). Аффинно очищенные антитела, направленные против белка пика А, перекрестно реагировали с белком пика В. Аминокислотный состав, пептидные карты и иммунологическая перекрестная реакционноспособность все это указывает на то, что два пика, разделенные хроматофокусированием, родственным друг другу. Две формы с различными значениями р1 могли возникнуть в результате различной степени амидирования или различного содержания кислотных аминокислот, или вследствие микрогетерогенности в составе олигосахаридных цепей. Молекулярная масса нативного фермента, определенная гель-фильтрацией, равна 560 кДа. Электрофорез на 7–15% градиенте НДС-полиакриламидного геля показал присутствие единственного пептида в 64 кДа (рис. 2А). Именно такой молекулярный размер устойчиво получался со всеми различными процентами применяемого геля и буферной системы Лаэммли. При обработке фермента эндо-b, N-ацетилглюкозаминидазой Н размер основной полосы дегликозилированного продукта составляет 55 кДа (рис. 5). Найдено, что фермент гликозилирован, а высокий кажущийся молекулярный размер, полученный гель-фильтрацией, может быть связан с тенденцией определенных гликопротеинов нековалентно взаимодействовать в растворе (Farach–Carson и др., Biotechnigues 7, 482 (1989)); Kleinman и др., Biochemistry 25, 312 (1986)). На основании кривых Лайиуивера-Бурка рассчитана кажущаяся величина Km, равная 4,5 мМ в случае оксалата калия в качестве субстрата. Это дает Vmax 166 мкмоль/-мин/мг. Фермент конкурентно ингибируется фосфат-ионами, и при добавлении в реакционную смесь 90 мМ РО42- для Ki получено значение в 9 мМ. Фермент отличается специфичностью к оксалату в качестве субстрата, но лимонная кислота, уксусная кислота, оксальуксусная кислота, янтарная кислота и муравьиная кислота в качестве субстратов не использовались. Фермент не дезактивируется в широком интервале значений рН, и оптимальное значение рН для декарбоксилирования равно 3. После нагревания 20 минут при 80оС фермент сохраняет 78% начальной активности. Почти полная дезактивация происходит после нагревания 10 минут при 96оС. На активность фермента не влияют реагенты сульфгидрильной группой: так фермент сохраняет 95% своей активности в присутствии 50 мМ п-хлорртутьбензолсульфокислоты или 50 мМ йодацетата. Оксалат-декарбоксилаза сохраняет 45% своей активности после выдерживания с 10% НДС 30 минут при комнатной температуре. Однако при нагревании до 60оС с 10% НДС почти вся активность исчезает. На гликопротеиновую природу белка указывает положительное окрашивание реактивом периодат-Шиффово основание. Фермент связывается с конканвалин-А-Сефарозой и 8 34467 элюируется a-метилманнозидом. Фенол-сернокислотным методом установлено, что содержание нейтральных сахаров составляет 15%. Иммунотитрование фермента 8 мкл сырой антисыворотки к оксалат-декарбоксилазе снизило начальную активность надосадочной жидкости на > 60% (рис. 6). Антисыворотка к оксалат-декарбоксилазе в разбавлении 1:5000 позволяет обнаружить минимум 1 нг белка пика А. Антисыворотка перекрестно реагирует со всеми пептидами, полученными в результате гидролиза протеазой V8 (рис. 4), и с дегликозилированными формами пиков А и В фермента. Антисыворотка, подвергнутая аффинной очистке и созданная против белка пика А, перекрестно реагировала с оксалат-декарбоксилазой пика В и оксами-СоА-декарбоксилазой из Oxalobacter formigenes, штамм ОхВ. Антисыворотка не реагирует с оксалат-оксидазой из Hordeum Vulgare (ячмень). Пример 2. Молекулярное клонирование и экспрессия ДНК, кодирующей оксалат-декарбоксилазу. Методика эксперимента. Молекулярное клонирование. Полная РНК извлечена из порошка C. Velutipes полученного растиранием в жидком азоте, по методике Chomczynski и Sacchi (Anal. Biochem. 162, 156 (1987) и поли (А+) РНК отобрана в процессе двух циклов хроматографии на олиго(a, Т-целлюлозе). Синтез кДНК, клонирование и иммуноскрининг библиотеки осуществлены согласно инструкциям фирмы Амерсхам. кДНК синтезирована из мРНК-культуры, индуцируемой 12 ч оксалатом, путем олиго(dT) праймирования 5 мкг поли (А+) РНК и клонирована в EcoP1 сайт рестрикции лямбда-gf11. Для иммуноскрининга упакованные фаги выращивают в E. Coli VI090 r в качестве хозяина. Антитела к оксалат-декарбоксилазе для удаления фоновой реакционноспособности предварительно адсорбируют 1 мг/мл клеточного лизата E. Coli VI090, после чего используют в иммуноскрининге. Для обнаружения положительных клонов применяют конъюгат козьего антикроличьего 1 gG с щелочной фосфатазой. ДНК получена из иммуноположительных фагов по методике Del Sal (Biotechnigues 7, 514 (1989)), в которых был определен размер вставок. Слитые белки охарактеризованы по методике (Anal Biochem 156, 354 (1986)); связь между вставками исследована применением одной из вставок в качестве зонда. Вставки в 1,2 к.о. из клона номер 3 субклонирована в рТz18 (ЮСБ) и использована в других экспериментах в качестве зонда. Дифференцированная гибридизация. Дифференцированная гибридизация иммуноположительных клонов изучена путем получения одноцепочечных кДНК зондов, синтезированных из мРНК, выделенной из мицелия, индуцированного оксалатом 0 и 12 часов. Рекомбинантную фаговую ДНК (0,5 мкг) связывают с мембраной Ген Скрин Плюс в дубликатном Найбрислот ТМфильтрующем устройстве согласно инструкции, содержащейся в руководстве фирмы Ген Скрин Плюс, и гибридизируют с кДНК зондами, индуцированными и неиндуцированными оксалатом. Удельная активность зонда составляет 2 х 108 срm/мкг кДНК. Гибридизация. Гибридизацию ДНК и РНК блотов проводят при 42оС формамидным методом, указанным в руководстве фирмы Ген Скрин Плюс. Предварительную гибридизацию в течение примерно суток осуществляют в 50% деионизированном формамиде, 1% НДС, 1 М хлориде натрия, 10% сульфата декстрана. Блоты гибридизируют с денатурированным зондом (1–4 х 105 ор/мл) 24 часа при 40оС. Мембраны последовательно промывают по 2 промывки каждым: 2ХSSC при комнатной температуре, 2ХSSC плюс 1% НДС при 65оС 30 минут, 0,IX.SSC при комнатной температуре 30 минут. В настоящем случае для интенсификации скрининга увлажненные мембраны в пластиковых упаковках подвергают воздействию пленок Кодак ХАР. Приготовление зонда. Субклонированную в рТZ18U ДНК гидролизуют в присутствии ЕсоR1 и разделяют на 2% низкоплавком агарозном геле. Вставку ДНК обрезают и метят (a–32Р)дАТФ методом хаотичного мечения праймера (Teinberg, Vogelstein, Anal Biochem, 137, 226 (1984)). Выделение геномной ДНК и Саузерн анализ. Геномная ДНК выделена из лиофилизованных C. Velutipes по методике Zolan и Pukkila (Mol. Cell. Biol 6, 195 (1986)). ДНК дважды расслоена на СeCl градиенте с целью получения ДНК, способной гидролизоваться ферментом рестрикции. Четыре микрограмма геномной ДНК гидролизуют различными эндонуклеазами и разделяют на 1,2% агарознoм геле. ДНК переносят на мембрану Ген Скрин Плюс по методике щелочного блоттинга (Reed, Mann, Nucleic Acids Res 13, 7207 (1985)). Трансляция in vitro. Поли (А+) РНК транслируют применением лизата ретикулоцитов кролика согласно инструкциям изготовителя (Промега). Транслированные белки осаждают особой антисывороткой и анализируют электрофорезом на НДС-полиакриламидном геле. Гибридный отбор. Гибридный отбор мРНК оксалат-декарбоксилазы осуществляют гибридизацией в течение 4 часов при 50оС поли (А+) РНК (20 мкг в 200 мкл 65% формамида, 10 мМ РIРЕS (рН 6,4), 0,4 М NaCl, 8 мМ ЭДТА, 0,5 % НДС, 100 мкг/мл тРНК дрожжей) с мембраной Ген Скрин Плюс, с которой связана денатурированная кДНК (4 мкг). Фильтры подготавливают согласно руководству фирмы Ген Скрин Плюс, а гибридизацию, промывку и элюирование гибридизованной РНК осуществляют по следующим методикам: Jaqus, Methods in Enzymol 152, 567 (1987)); Parnes и др., Proc. Natl. Acad Sci США 78, 2253 (1981). Элюирование РНК экстрагируют смесью фенол-хлороформ (1:1), осаждают в этаноле, переводят непосредственно в смесь для трансляции in vitro и иммуноосаждают по методике Anderson и Biobel (Methods in Enzymology 96, 111 (1983)). Нозерн блот анализ. Один мкг (поли(А+) РНК или 10 мкг полной РНК денатурируют глиоксалем и разделяют на 1,2% агарозном геле по методике Самбрука (Sambrook и др., (1989) "Молекулярное клонирование. Лабораторное руководство", Коулд Спринг Харбор Лаборатори, Коулд Спринг Харбор, Н.–Й.), после чего капиллярно блотируют на мембране Ген Скрин Плюс согласно инструкциям, приведенным в 9 34467 руководстве фирмы Ген Скрин Плюс. Фильтры зондируют 32Р-меченной вставкой кДНК в 1,2 к.о. Результаты. Как отмечалось выше, кДНК экспрессионная библиотека сконструирована из мРНК, индуцированной 12 ч оксалатом, в lgt 11. Примерно 47000 рекомбинантов подвергнуто скринигу антителами, предварительно обработанными лизатом E. coli. Получено и очищено пятнадцать иммуноположительных бляшек, из них 12 перекрестно гибридизированы. Эти кодированные слитые белки имеют размеры, сравнимые с размерами вставки (рис. 7А). Фаговая ДНК из иммуноположительных клонов иммобилизована на мембране Ген Скрин Плюс в дублях и зондирована индуцированными и неиндуцированными оксалатом ДНК зондами. Дифференцированная гибридизация 15 иммуноположительных клонов показала, что 12 из них гибридизируются с кДНК зондом из оксалата плюс мРНК и не дают никакого сигнала с оксалатом минус мРНК (рис. 7В). Таким образом, экспрессия 12 клонов индуцируется оксалатом. pTZ18U субклон вставки в 1,2 к.о. из l клона 3 использован для отбора гибридизацией мРНК. Трансляция in vitro отобранной гибридизацией РНК и иммуноосаждение продукта трансляции дает линию для 55 кДа (рис. 8В, вертикальная полоса 2), что совпадает с размером продукта, полученного с полной поли(А+) РНК (полоса 3), и соответствует размеру дегликозилированного белка. Белок в 55 кДа не был получен в отсутствие мРНК (рис. 8В, вертикальная полоса 1) или применением нерекомбинантных векторных последовательностей (полоса 4). Продукт в 55 кДа получен с 12 ч индуцируемой мРНК (рис. 8А, полоса 2), но не в случае неиндуцируемой (0 ч) мРНК (полоса 1). Показано,что 55 кДа линия относится к оксалат-декарбоксилазе, поскольку очищенная оксалат-декарбоксилаза конкурирует за области связывания антигена и вызывает снижение интенсивности 55 кДа линии (вертикальная полоса 3) в опытах с трансляцией in vitro и иммуноосаждением. Геномный Саузерн блоттинг с применением в качестве зонда вставки в 2,2 к.о. показал при5'–GAAGACCATAGGATCCATTТGTTTCAAAG BamH1 ¬ некодирующая ДНК ® сутствие единственной линии для продуктов гидролиза эндонуклеазами BamH1, Eco R1, Hind111, Pvu11, Ssp1, Xba1 и xho1, что указывает на наличие единственной копии гена (рис. 9В). Две линии разной интенсивности, полученные применением Kpn1 и Psf1, вызваны наличием внутренних сайтов (каждому ферменту свой единственный сайт) в 1,2 к.о. кДНК вставке для этих ферментов. Можно видеть (полосы на рис. 9А), что зонд в 1,2 к.о. гибридизируется с единственными видами мРНК в 1,5 к.о. из индуцированной 12 ч оксалатом поли(А+) РНК, в то же время при отсутствии индуцирования гибридизация не происходит. Из той же партии культур с различных этапов после индуцирования отобраны образцы, которые анализируют на содержание РНК, ферментативную активность и на полный белок. Нозерн блоттинг полной РНК показал, что линия для 1,5 к.о. отсутствует в 0 ч и достигает пика в 12 ч. Через 3 дня после индуцирования обнаружить РНК не удается (рис. 10В). Ферментативную активность можно обнаружить через 12 ч после добавления оксалата, пик активности наблюдается во 2ой день, после чего происходит устойчивое снижение активности. Какой-либо связи с увеличением или снижением полного белка не наблюдается (рис. 10С). Таким образом, наблюдается временная зависимость между появлением ферментативной активности и содержанием мРНК, поскольку уровень мРНК достигает пика через 12 ч после индуцирования, а максимальная ферментативная активность наблюдается через 48 ч после добавления щавелевой кислоты. Пример 3. Клонирование оксалат-декарбоксилазы. Для присоединения ДНК, кодирующей транзитный пепти, к гену оксалат-декарбоксилазы из рОХD1 применена ПЦР (полимеразно-цепная реакция). Выбранным транзитным пептидом служит ген экстенсина из Nicotiana plumba-sicifolia. Целиковый транзитный пептид плюс две аминокислоты зрелого белка экстенсина подвергают слияния в восходящем направлении от АТС декарбоксилазы. В ПЦР 5'-олигонуклеотидом служит ЕХТОХD–5; *ATG GGA AAA ATG GCT TCT CTA *Met Cly Lys Met Ala Ser Leu TTT GCC ACA TTT TTA GTG GTT TTA GTG TCA CTT AGC TTA GCT/TCT Phe Ala Thr Phe Leu Val Val Leu Val Ser Leu Ser Leu Ala Ser GAA [ATG TTC AAC AAC TTC CAA] Glu [Met Phe Trp Trp Phe Gln] [–] Перекрывание с началом гена оксалат-декарбоксилазы * Начало трансляции у начала транзитного пептида / Сайт процессинга в трансляционном продукте В ПЦР 3'-олигонуклеотидом служит ЕХТОХD-3, предусмотренный относительно последовательности в положениях 210–190 в исходной рОХD1 последовательности (в нисходящем направлении от Крn1 сайта): Применением указанных праймеров в ПЦР с применением в качестве матрицы плазмидной ДНК рОХD1 получены только смазанные продукты. Для получения продуктов полной длины эти первичные продукты подвергнуты повторной амплификации с применением того же 3', но но 5'–TGGGTCACTGGTCTCATT–3'. 10 34467 вого 5'-праймера, а именно ЕХТОХR–6, (5'GAAGACGATAGGATCCATTTG–3'), представляющего отдаленную 5'-последовательность вышеприведенного ЕХТОХD–5. После второго круга ПЦР появляется линия для ожидаемого размера молекулы (прим. 290 п.о.). Ее выделяют, гидролизуют в присутствии BamH1–Kpn1 и клонируют в рОХD1 в пределах бывшего пребывания BamH1–Kpn1 фрагмента (125 п.о.). В общей сложности вдоль вставки секвенируют семнадцать клонов, содержащих более крупный фрагмент. Для одного клона подтверждено содержание необходимой последовательности в пределах BamH1–Kpn1 вставки. Комплекс транзитный пептид-ген оксалат-декарбоксилазы удаляют из этого клона в виде BamH1–EcoR1 фрагмента, в котором полимеразой Кленова создают тупые концы, после чего вставляют в Smal сайт плазмиды pIR, Ri. Рекомбинанты идентифицированы гибридизацией и их строение подтверждено/ориентировано диагностическим гидролизом (Hind111–EcoR1, Kpn1, Hino111 и Psf1). Клон, содержащий ОХ–D кассету в той же ориентации, что и пр11 кассета, назван рSR21=OX–D кассете, вставленной в Smal сайт. На рис. 11 показана нуклеотидная последовательность 1402 п.о. кДНК вставки в рОХD1. Рис. 12 иллюстрирует конструирование плазмиды pSR21. Пример 4. Трансформация табака применением вышеописанных векторов. (а) Перенос векторов в Agrobacterium Конструкты введены в A. tumefaciens LBA4404 прямой трансформацией по опубликованным методикам. Для проверки отсутствия рекомбинации в ходе переноса вектора в Agrobacterium рестрикционным гидролизом и Саузерн блоттингом установлено присутствие и целостность конструктов. (о) Трансформация дисков из табачных листьев. Листья табака (N. tabacum), сорт Самсун) в виде дисков трансформируют по хорошо разработанным ранее опубликованным методикам. Содержащие конструкты идентифицированы методом ПЦР и отобраны для последующего анализа. Пример 5. Определение в трансгенных растениях активности оксалат-декарбоксилазы. Ферментативную активность определяют анализом любого из двух продуктов распада, образующихся при декарбоксилировании оксалата (диоксид углерода и формат). Выделение 14СО2 из 14С-щавелевой кислоты определяют по следующей методике (Mehta и Datta, 1991). Содержащие реакционную смесь (см. ниже) стеклянные пробирки перед добавлением экстракта/фермента выдерживают пять минут. Пробирки герметизируют и выдерживают 30 минут при 37оС во встряхиваемой водяной бане. Реакцию прекращают инъектированием 0,2 мл 50% (об./об.) трихлоруксусной кислоты (через пробку). Пробирки встряхивают с метилбензэтоний гидроксидом (0,2 мл), со держащемся в пластиковом сосудике, помещенном внутри стеклянной пробирки. Пластиковые сосудики извлекают, их содержимое переносят в 5 мл сцинтилляционную жидкость и жидкостным сцинтилляционным счетчиком определяют радиоактивность. Реакционная смесь 0,2 М нитрат калия, рН 3 0,005 М оксалат калия, рН 3 5,6 нмоля (0,027 мкС)/14С/-щавелевой кислоты Образование формата определяют по методике Magro и др. (1988), видоизмененной с учетом различий в биохимических свойствах оксалат-декарбоксилазы, выделенной из Collybia Velutipes, а не из Selerotinia. Применяют двухэтапную методику. Вначале готовят реакционную смесь, содержащую 20 мкл 40 мкМ щавелевую кислоту (добавлением гидроксида калия рН доводят до 3,5), 15 мМ о-фенилендиамина и 0,1 М альбумина бычьей сыворотки в цитратном буфере (0,2 М). Добавляют экстракт/фермент (конечный объем 0,5 мл) и реакционную смесь выдерживают 20 минут при 25оС. Декарбоксилирование прекращают добавлением К2НРО4 (до конечного значения рН 7,5). Добавляют и смешивают половину объема 45 мМ литиевой соли никотинамидадениндинуклеотида (НАД). Через 3 минуты добавляют 15 мкл формат-дегидрогеназы (ФДГ, 80 Е/мл). Концентрацию образовавшегося формата устанавливают определением повышения поглощения при 340 нм реакционной смеси до и спустя 20 минут после добавления ФДГ. Для каждого экстракта проводят контрольный анализ без щавелевой кислоты и затем рассчитывают активность в пересчете на белок. Пример 6. Олигонуклеотиды для ПЦР и саузерн анализа. Для диагностических ПЦР, подтверждающих присутствие гена оксалат-декарбоксилазы в регенерированных ростках, из генной последовательности выбран олигонуклеотид (олиго) DEC1. В сочетании с 35S олигонуклеотидом (43) этот олиго дает диагностическую линию, соответствующую прим. 280 п.о. Указанные олигонуклеотиды используют для подтверждения трансгенного статуса укоренившихся ростков. Две других олигонуклеотидных последовательности (DEC2 и DEC3) применяют для создания 5'-оксалат-декарбоксилазу зондирующего фрагмента в примере 450 п.о., предназначенного для применения в Саузерн анализе трансгенных растений и их потомства. Олиго DEC1 – 5' в кодирующей оксалат-декарбоксилазу последовательности, предназначен для применения вместе с олигонуклеотидом в диагностической ПЦР. 5'–GAG AAG GAT GAC AGT GAG CAG ACG TTG – 3' Олигонуклеотиды DEC2 и DEC1 – посреди и 3' в области кодирования оксалат-декарбоксилазу, применяют совместно для создания зондов для Саузерн анализа. DEC2: 5'– ССA TGA CGA CGG TAC ATT CTT GCT CAC – 3' DEC3: 5' – TGC AGG AAC ATA AGG GAT ATC ACC ACC – 3' 11 34467 Таблица 1 Результаты типичной методики очисткиa Стадия очистки 1. Сырой экстракт 2. Ацетон II 3. Ацетон IV 4. Хроматофокусирование а. Пик А о. Пик В а Общий белок, (мг) Полная активность (единиц активности) Удельная активность (единицы/мг) Кратность очистки Выход, % 4480 120 3,8 950 608 260 0,21 5,06 68,8 1 24 328 100 64 27,3 0,08 1,24 28 160 350 129 1670 614 2,9 16,8 Использовано 150 г растертого в жидком азоте порошка. Таблица 2 Аминокислотный состав а Пик А, % Asx Glx Lys Arg His Gly Ser Thr Cysc Tyr Ala Val Leu Tle Pro Phe Met Trp Аммиак Пик В, % 10,57 11,75 3,2 2,84 2,66 8,44 7,23 8,56 0,66 0,84 11,03 6,31 7,79 4,00 8,64 5,13 0,34 HO0 HO 10,31 11,52 2,96 2,89 2,74 9,44 7,19 8,48 0,28 1,85 10,92 6,52 7,19 3,86 8,46 4,68 0,69 HO HO а Мольные проценты. Не определялся. с Определен в виде цистеиновой кислоты. о 12 34467 Фиг. 1 Фиг. 2А 13 34467 Фиг. 2Б Фиг. 3 14 34467 Фиг. 4 Фиг. 5 Фиг. 6 15 34467 Фиг. 7А Фиг. 7Б Фиг. 8Б Фиг. 8А 16 34467 Фиг. 9А Фиг. 9Б Фиг. 10А Фиг. 10Б 17 34467 Фиг. 10С 18 34467 Фиг. 11 19 34467 Фиг. 12 Тираж 50 екз. Відкрите акціонерне товариство «Патент» Україна, 88000, м. Ужгород, вул. Гагаріна, 101 (03122) 3 – 72 – 89 (03122) 2 – 57 – 03 20
ДивитисяДодаткова інформація
Назва патенту англійськоюIsolated and purified dna fragment encoding oxalatedecarboxylase
Автори англійськоюDatta Asis, Dunwell James Martin, Mehta Anuradha, Natarajan K.
Назва патенту російськоюВыделенный и очищенный днк фрагмент, который кодирует оксалат-декарбоксилазу
Автори російськоюДатта Азис, Данвелл Джеймс Мартин, Мехта Анурадха, Натараджан К.
МПК / Мітки
МПК: C12N 15/60, C12N 5/10, C12N 15/82, A01N 63/00, C12N 9/88, A01H 5/00, C12N 15/09
Мітки: оксалат-декарбоксилазу, днк, кодує, фрагмент, виділений, очищений
Код посилання
<a href="https://ua.patents.su/20-34467-vidilenijj-ta-ochishhenijj-dnk-fragment-shho-kodueh-oksalat-dekarboksilazu.html" target="_blank" rel="follow" title="База патентів України">Виділений та очищений днк фрагмент, що кодує оксалат-декарбоксилазу</a>
Попередній патент: Спосіб одержання фосфорвмісного добрива
Наступний патент: Спосіб заміни окремої машини і знімний блок
Випадковий патент: Електронна пушка для електроно-променевого нагріву