Сполука, що є похідним 2-амінобіцикло[3.1.0]гексан-2,6-дикарбонової кислоти, спосіб одержання цієї сполуки, фармацевтична композиція, що містить цю сполуку, проміжна сполука
Номер патенту: 43332
Опубліковано: 17.12.2001
Автори: Монн Джеймс Аллен, Хелтон Девід Рід, Роубі Роджер Льюіс, ШЕПП Дарріл Дарвін, Тіззано Джозеф Патрік
Формула / Реферат
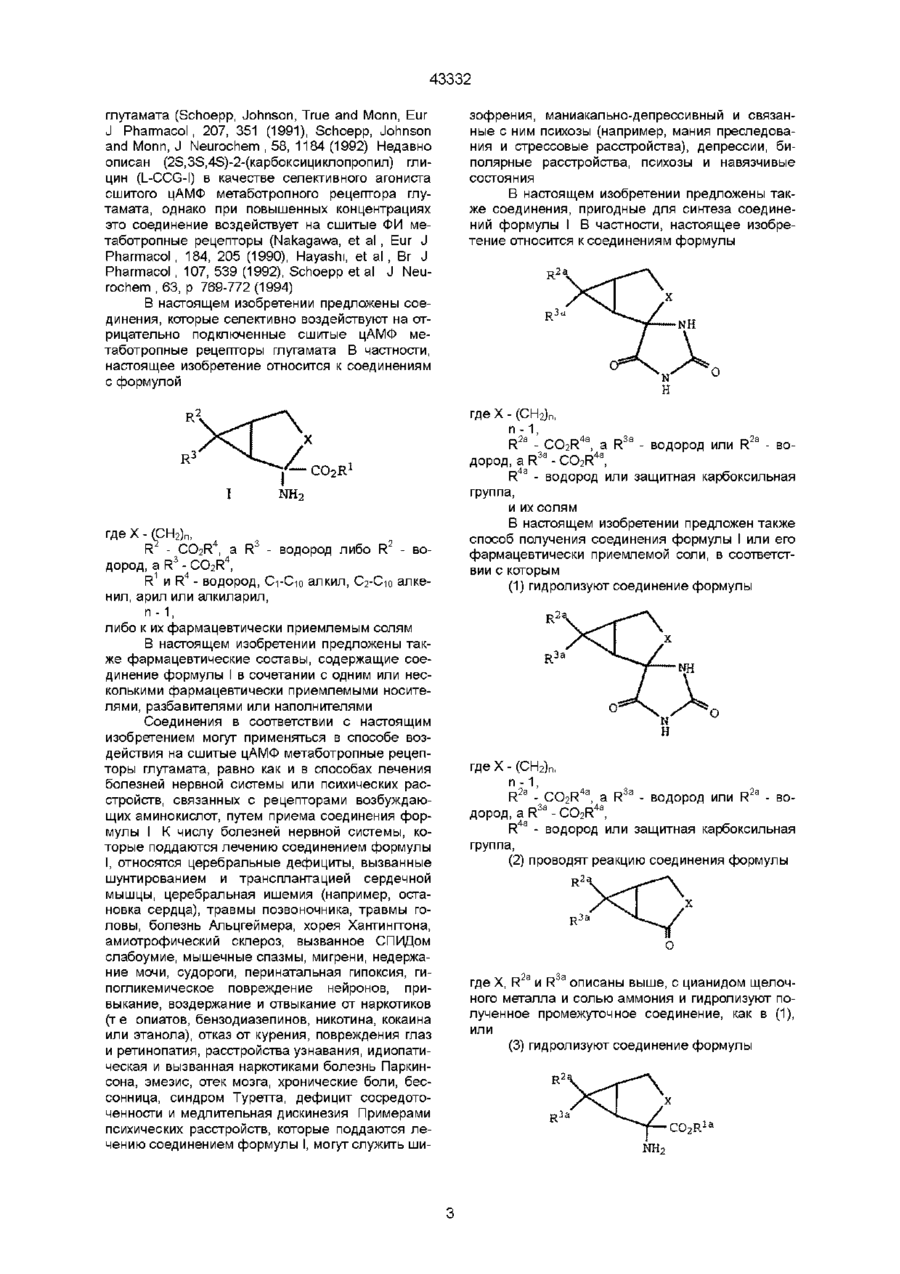
1. Соединение, являющееся производным 2-аминобицикло[3.1.0]гексан-2,6-дикарбоновой кислоты, формулы (1)
где
Х-(СН2)n,
R2- CO2R4 и R3 - водород или R2 - водород и R3 - CO2R4,
R1 и R4, независимо друг от друга - водород, алкил С1-С10, алкенил С2-С10, арил или арилалкил,
n -1,
или его фармацевтически приемлемая соль,
предназначенное для использования в качестве фармацевтического препарата.
2. Соединение по п. 1 или его фармацевтически приемлемая соль, имеющее следующую относительную стереохимическую конфигурацию:
3. Соединение по п. 1 или 2, в котором R1 и R4, независимо друг от друга - водород, алкил С1-С4, алкиларил или арил, или его фармацевтически приемлемая соль.
4. Соединение по п. 3, в котором R1 и R4, независимо друг от друга- водород, алкил С1-С4, или его фармацевтически приемлемая соль.
5. Стереоизомерное соединение по п. 2, представляющее собой (+)-2-аминобицикло[3.1.0]гексан-2,6-дикарбоновую кислоту, ее С1-С4-алкиловьій, аралкиловый или ариловый эфир или фармацевтически приемлемую соль.
6. Стереоизомерное соединение по п. 5, представляющее собой (+)-2-аминобицикло[3.1.0]гексан-2,6-дикарбоновую кислоту, ее С1-С4-алкиловый эфир или фармацевтически приемлемую соль.
7. Стереоизомерное соединение по п. 6, представляющее собой (+)-2-аминобицикло[3.1.0]гексан-2,6-дикарбоновую кислоту или фармацевтически приемлемую соль.
8. Стереоизомерное соединение по п. 7, представляющее собой (+)-2-аминобицикло[3.1.0]гексан-2,6-дикарбоновую кислоту.
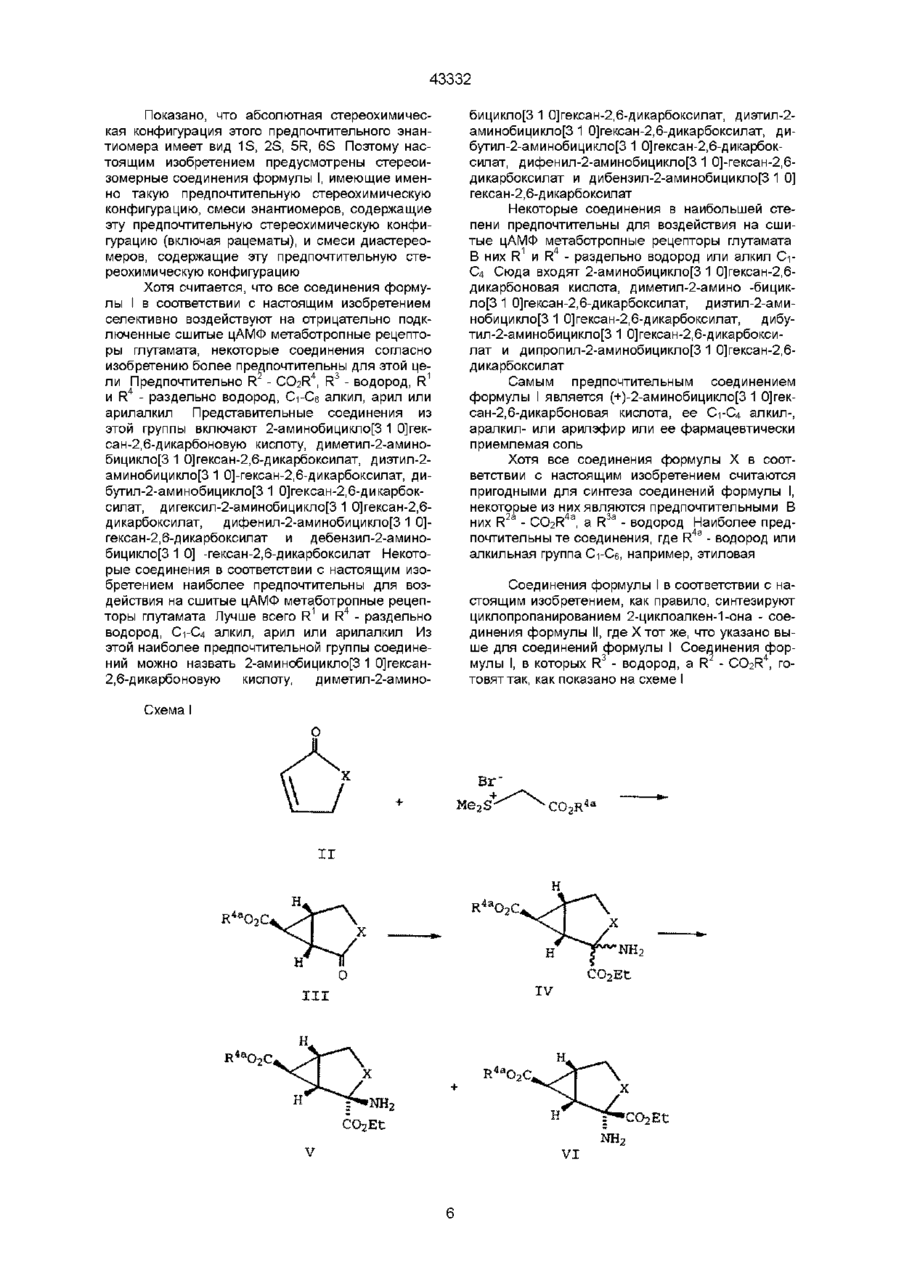
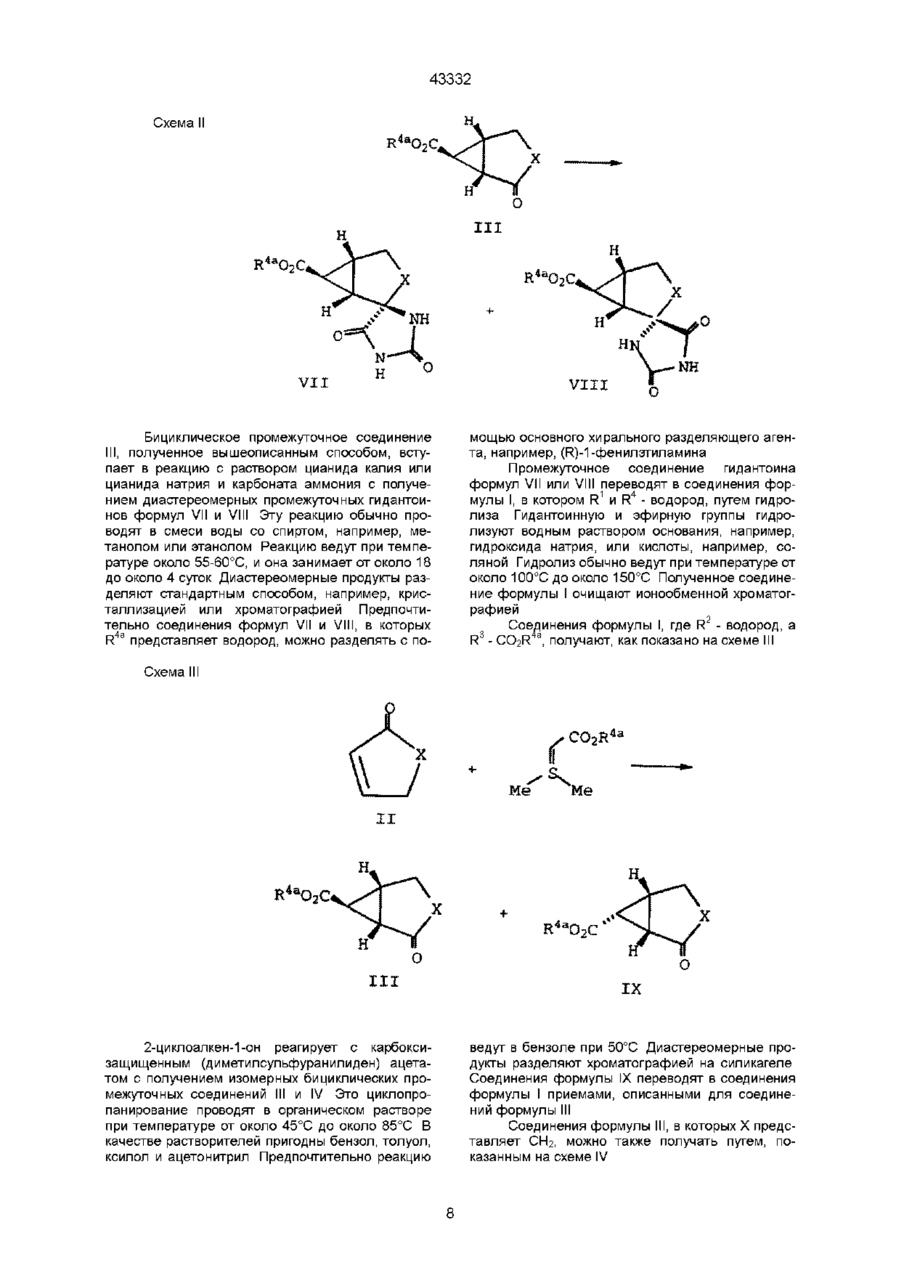
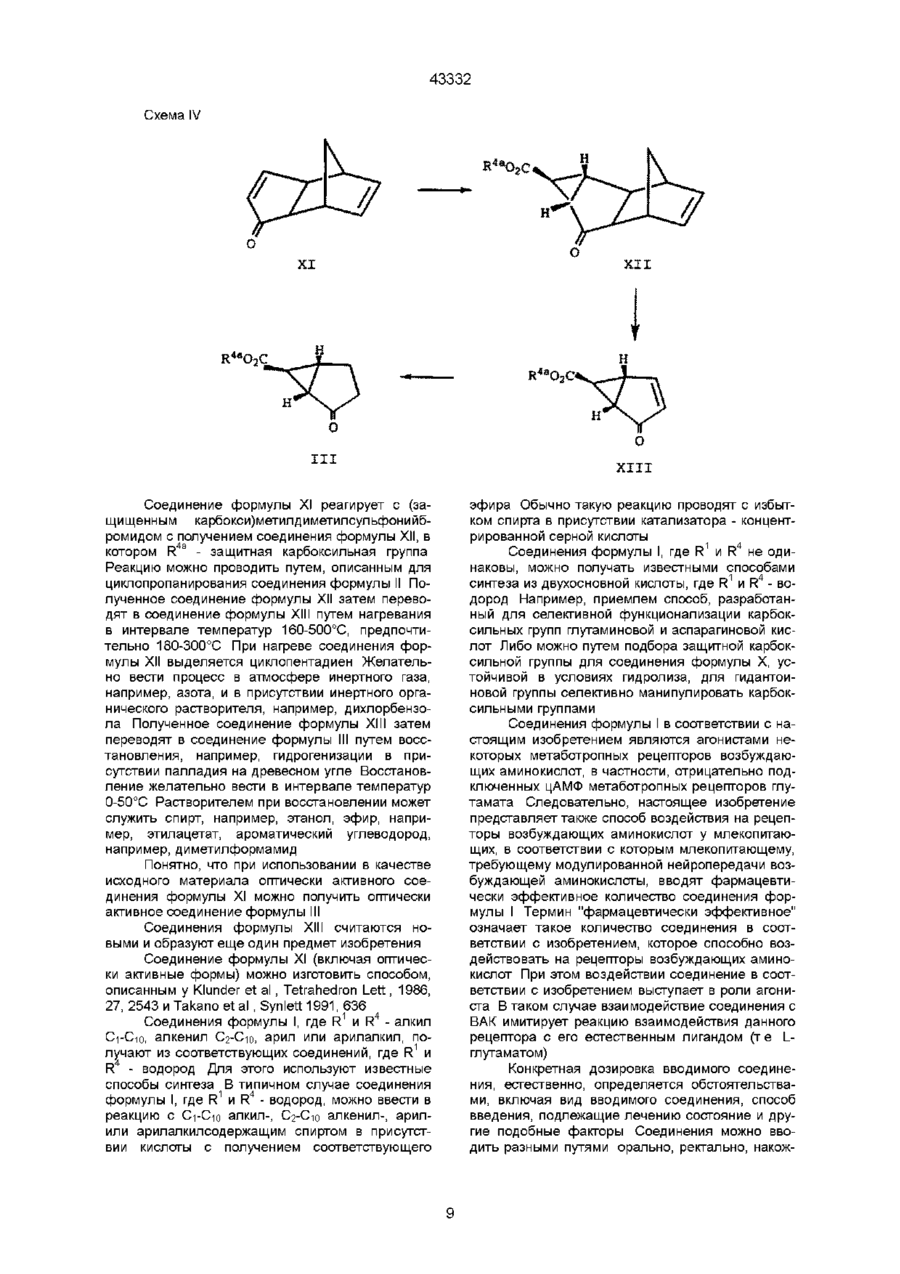
9. Способ получения соединения по п. 1, в соответствии с которым гидролизуют соединения формулы
где
X-(CH2)n,
R2a - CO2R4a, a R3a - водород или R2a - водород, a R3a - CO2R4a, R4a - группа защиты карбоксила,
n -1,
факультативно удаляют группу защиты карбоксила,
факультативно этерифицируют карбоксильную группу,
факультативно отделяют диастереомеры и/или разделяют энантиомеры,
факультативно получают фармацевтически приемлемую соль соединения формулы 1.
10. Фармацевтическая композиция, содержащая активный ингредиент в сочетании с одним или несколькими фармацевтически приемлемыми носителями, разбавителями или наполнителями, отличающаяся тем, что активным ингредиентом является соединение формулы (1)
где
Х-(СН2)n.
R2 - CO2R4 и R3 - водород или R2 - водород и R3 - CO2R4,
R1 и R4, независимо друг от друга - водород, алкил С1-С10, алкенил С2-С10, арил или арилалкил,
n -1,
или его фармацевтически приемлемая соль.
11. Соединение, являющееся производным 2-аминобицикло[3.1.0]гексан-2,6-дикарбоновой кислоты, формулы
где
Х-(СН2)n,
n -1,
r2a - CO2R4a, a R3a - водород или R2a - водород, a R3a - CO2R4a,
R4a - группа защиты карбоксила,
предназначенное для использования в качестве промежуточного соединения.
12. Соединение по п. 11, в котором R4a - алкил С1-С6.
Текст
1 Соединение, являющееся производным 2аминобицикло[3 1 0]гексан-2,6-дикарбоновой кислоты, формулы (1) Z CO-.R 1 где X - (СН2)п, R - CO2R4 и R3 - водород или R2 - водород и R3 4 CO2R , 1 R и R4, независимо друг от друга - водород, алкил C-i-C-io, алкенил Сг-С-ю, арил или арилалкил, п-1, или его фармацевтически приемлемая соль, предназначенное для использования в качестве фармацевтического препарата 2 Соединение по п 1 или его фармацевтически приемлемая соль, имеющее следующую относительную стереохимическую конфигурацию 3 Соединение по п 1 или 2, в котором R1 и R4, независимо друг от друга - водород, алкил С1-С4, алкиларил или арил, или его фармацевтически приемлемая соль ВШ 4 Соединение по п 3, в котором R1 и R4, независимо друг от друга - водород, алкил С1-С4, или его фармацевтически приемлемая соль 5 Стереоизомерное соединение по п 2, представляющее собой (+)-2-аминобицикло[3 1 0]гексан2,6-дикарбоновую кислоту, ее СгС4-алкиловый, аралкиловый или ариловый эфир или фармацевтически приемлемую соль 6 Стереоизомерное соединение по п 5, представляющее собой (+)-2-аминобицикло[3 1 0]гексан-2,6дикарбоновую кислоту, ее СгС4-алкиловый эфир или фармацевтически приемлемую соль 7 Стереоизомерное соединение по п 6, представляющее собой (+)-2-аминобицикло[3 1 0]гексан-2,6-дикарбоновую кислоту или фармацевтически приемлемую соль 8 Стереоизомерное соединение по п 7, представляющее собой (+)-2-аминобицикло[3 1 0]гексан-2,6-дикарбоновую кислоту 9 Способ получения соединения по п 1, в соответствии с которым гидролизуют соединения формулы о го гдеХ-(СН|)п, R - CO2R , a R - водород или R - водород, а R3a - CO2R4a, R4a- группа защиты карбоксила, п-1, факультативно удаляют группу защиты карбоксила, факультативно этерифицируют карбоксильную группу, факультативно отделяют диастереомеры и/или разделяют энантиомеры, факультативно получают фармацевтически приемлемую соль соединения формулы 1 10 Фармацевтическая композиция, содержащая активный ингредиент в сочетании с одним или несколькими фармацевтически приемлемыми носителями, разбавителями или наполнителями, отличающаяся тем, что активным ингредиентом является соединение формулы (1) ГО ГО 43332 гдеХ-(СН2)п R - CO2R и R - водород или R - водород и R CO2R4, R1 и R4, независимо друг от друга - водород, алкил C-i-C-io, алкенил С2-Сю, арил или арилалкил, п-1, или его фармацевтически приемлемая соль 11 Соединение, являющееся производным 2аминобицикло[3 1 0]гексан-2,6-дикарбоновой кислоты, формулы В центральной нервной системе (ЦНС) млекопитающих передачей нервных импульсов управляет взаимодействие между нейропередатчиком на передающем нейроне и приемником на поверхности приемного нейрона, который возбуждается импульсом L-глутомат, самый распространенный нейропередатчик в ЦНС, служит посредником на главном пути возбуждения у млекопитающих и называется возбуждающей аминокислотой (ВАК) Рецепторы, реагирующие на глутомат, называются рецепторами возбуждающей аминокислоты (рецепторами ВАК) См Watkms & Evans, Ann Rev Pharmacol Toxicol , 21, 165 (1981), Monaghan Bridges and Cotman, Ann Rev Pharmacol Toxicol , 29, 365 (1989), Watkms, Krogsgaard-Larsen and Honore, Trans Pharm Sci , 11, 25 (1990) Возбуждающие аминокислоты играют огромную роль в различных физиологических процессах, в т ч долгосрочной потенциации (обучение и память), выработке пластичности синапсов, управлении движениями, дыханием, сердечно-сосудистом регулировании, эмоциональных состояниях и чувственном восприятии Чрезмерное или несоответствующее стимулирование рецепторов возбуждающих аминокислот ведет к повреждению или гибели нейронных клеток за счет механизма так называемой экститотоксичности Считается, что в ряде случаев этот процесс способствует дегенерации нейронов Медицинские последствия такой дегенерации делают подавление процессов дегенерации нейронов важной терапевтической задачей В целом рецепторы возбуждающих аминокислот делятся на два типа Рецепторы, прямо подключенные к отверстию катионных каналов в клеточной мембране нейронов, называется "ионотропными" Этот тип рецепторов делится на, по крайней мере, три подтипа, называемых по поляризующему действию селективных агонистов N-метил-О-аспариата (NMDA), а-амино-3-гидрокси-5-метил-изооксадол-4-пропионовой кислоты (АМРА) и каиновой кислоты (КА) Вторым типом являются сшитые G-протеином или вторичным мессенджером "метаботропные" рецепторы воз где X - (СН2)п, п-1, R2a - CO2R4a, a R3a - водород или R2a - водород, а R3a - CO2R4a, R4a- группа защиты карбоксила, предназначенное для использования в качестве промежуточного соединения 12 Соединение по п 11, в котором R4a - алкил С-і-Сє буждающих аминокислот Рецепторы второго типа подключены к множественным системамвторичных мессенжеров, что ведет к усиленному гидролизу фосфоионозитида, активации фосфолипазы D, увеличению или уменьшению образования цАМФ и изменениям функции ионных каналов (Schoepp and Conn, Trends and Pharmacol Sci , 14, 13 (1993) Оба типа рецепторов не только переносят нормальную синаптическую передачу по путям возбуждения, но и участвуют в модификации синапгических соединений при их образовании и на протяжении всего существования (Schoepp, Bockaert and Sladeczek, Trends in Pharmacol Sci , 11, 508 (1990), McDonald and Jonson, Brain Research Reviews, 15, 41 (1990) Метаботропные рецепторы глутамата чрезвычайно разнородное семейство рецепторов глутамата, подключенные к множественным путям вторичных мессенджеров В целом роль этих рецепторов состоит в модулировании досинаптического выделения глутамата и послесинаптической чувствительности нейронной клетки к возбуждению глутаматом Метаботропные рецепторы глутамата (МРГ) фармакологически делятся на два подтипа Одна группа рецепторов положительно подключена к фосфолипазе С, вызывая гидролиз клеточных фосфоионозитидов (ФИ) Эту группу называют ФИ-сшитыми метаботропными рецепторами глутамата Вторая группа рецепторов отрицательно подключена к аденилциклазе, что препятствует стимулируемому форсколином накоплению циклического аденозинфосфата (цАМФ) (Schoepp and Conn, Trends Pharmacol Sci , 14, 13 (1993)) Рецепторы этой второй группы называются сшитыми цАМФ метаботропными рецепторами глутамата Агонисты сшитых цАМФ метаботропных рецепторов глутамата должны быть эффективны при лечении острых и хронических болезней нервной системы и психических состояний Недавно открыты соединения, воздействующие на метаботропные рецепторы глутамата, но не затрагивающие ионотропных рецепторов глутамата (13^)-1-аминоциклопентан-1,3-дикарбоновая кислота (1S.3R-ACPD) является агонистом сшитых ФИ и цАМФ метаботропных рецепторов 43332 глутамата (Schoepp, Johnson, True and Monn, Eur J Pharmacol, 207, 351 (1991), Schoepp, Johnson and Monn, J Neurochem , 58, 1184 (1992) Недавно описан (23,33,43)-2-(карбоксициклопропил) глицин (L-CCG-I) в качестве селективного агониста сшитого цАМФ метаботропного рецептора глутамата, однако при повышенных концентрациях это соединение воздействует на сшитые ФИ метаботропные рецепторы (Nakagawa, et al , Eur J Pharmacol , 184, 205 (1990), Hayashi, et al , Br J Pharmacol , 107, 539 (1992), Schoepp et al J Neurochem , 63, p 769-772 (1994) зофрения, маниакально-депрессивный и связанные с ним психозы (например, мания преследования и стрессовые расстройства), депрессии, биполярные расстройства, психозы и навязчивые состояния В настоящем изобретении предложены также соединения, пригодные для синтеза соединений формулы І В частности, настоящее изобретение относится к соединениям формулы R В настоящем изобретении предложены соединения, которые селективно воздействуют на отрицательно подключенные сшитые цАМФ метаботропные рецепторы глутамата В частности, настоящее изобретение относится к соединениям с формулой CO 2 R J NH 2 где X - (СН2)п, R - CO2R4, a R3 - водород либо R2 - водород, a R3 - CO2R4, R1 и R4 - водород, C-i-C-io алкил, С2-Сю алкенил, арил или алкиларил, п-1, либо к их фармацевтически приемлемым солям В настоящем изобретении предложены также фармацевтические составы, содержащие соединение формулы І в сочетании с одним или несколькими фармацевтически приемлемыми носителями, разбавителями или наполнителями Соединения в соответствии с настоящим изобретением могут применяться в способе воздействия на сшитые цАМФ метаботропные рецепторы глутамата, равно как и в способах лечения болезней нервной системы или психических расстройств, связанных с рецепторами возбуждающих аминокислот, путем приема соединения формулы I К числу болезней нервной системы, которые поддаются лечению соединением формулы I, относятся церебральные дефициты, вызванные шунтированием и трансплантацией сердечной мышцы, церебральная ишемия (например, остановка сердца), травмы позвоночника, травмы головы, болезнь Альцгеймера, хорея Хантингтона, амиотрофический склероз, вызванное СПИДом слабоумие, мышечные спазмы, мигрени, недержание мочи, судороги, перинатальная гипоксия, гипогликемическое повреждение нейронов, привыкание, воздержание и отвыкание от наркотиков (те опиатов, бензодиазепинов, никотина, кокаина или этанола), отказ от курения, повреждения глаз и ретинопатия, расстройства узнавания, идиопатическая и вызванная наркотиками болезнь Паркинсона, эмезис, отек мозга, хронические боли, бессонница, синдром Туретта, дефицит сосредоточенности и медлительная дискинезия Примерами психических расстройств, которые поддаются лечению соединением формулы I, могут служить ши где X - (СН2)п, п-1, R2a - CO2R4a, a R3a - водород или R2a - водород, a R3a - CO2R4a, R4a - водород или защитная карбоксильная группа, и их солям В настоящем изобретении предложен также способ получения соединения формулы I или его фармацевтически приемлемой соли, в соответствии с которым (1) гидролизуют соединение формулы ,2а где X - (СН2)п, п-1, R2a - CO2R4a, a R3a - водород или R2a - во3a 4a дород, a R - CO2R , 4a R - водород или защитная карбоксильная группа, (2) проводят реакцию соединения формулы где X, R2a и R3a описаны выше, с цианидом щелочного металла и солью аммония и гидролизуют полученное промежуточное соединение, как в (1), или (3) гидролизуют соединение формулы RJa CO 2 R l a NH 2 43332 где R1a - защитная карбоксильная группа, а X, R2a и R3a описаны выше, (4) при желании удаляют защитную карбоксильную группу, (5) при желании этерифицируют одну или обе карбоксильные группы, (6) при желании отделяют диастереомеры и/или разделяют энантиомеры, (7) при желании приготовляют фармацевтически приемлемую соль соединения формулы I Термин "алкил С-і-Сю" означает прямую, разветвленную или циклическую алкильную цепочку, имеющую от одного до десяти атомов углерода Типичные прямые или разветвленные С-і-С-ю алкильные группы включают метил, этил, п-пропил, изопропил, п-бутил, изобутил, втор-бутил, tбутил, n-пентил, изопентил, неопентил, п-гексил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 2,2-д и метил бутил, 2,3-диметилбутил, 3,3-диметилбутил, гегттил, п-октил, 2,2-диметилгексил, 2,5-диметилгексил, 2-метилгегттил, 4-метилгегттил, 2,2,4триметилпентил, 2,3,4-триметилпентил, нонил, 3,5,5-триметилгексил, децил, 3,7-диметилоктил и т п Термин "алкил С-і-Сю" охватывает "алкил d Сб" и "алкил С1-С4" Типичные циклические алкильные группы включают циклопропил, циклобутил, циклопентил, циклогексил, циклогегттил и т п Типичные алкильные группы С-і-Сє включают метил, этил, n-пропил, изопропил, п-бутил, изобутил, втор-бутил, t-бутил, п-пентил, изопентил, неопентил и п-гексил Термин "алкенил Сг-С-ю" представляет прямые или разветвленные ненасыщенные алкильные цепочки, имеющие от двух до десяти атомов углерода и одну или более двойную углерод-углеродную связь, например, диены и триены Группа также включает Е- и Z- изомеры Примеры радикалов этой группы винил, аллил, алленил, 1-бутенил, 2-бутенил, 2-метил-1-пропенил, 3-бутенил, 2-метил-2-пропенил, бутадиенил, 1-пентил, 2-пентенил, 2-метил-2-бутенил, 4-пентенил, З-метил-2бутенил, 3-метил-1,2-бутадиенил, 3-гексенил, 2гексенил, 4-метил-З-пентил, 4-гексенил, 5-гексенил, З-метил-1-пентен-З-ил, 4-метил-З-пентинил, 6-метил-5-гептен-2-ил, 7-октенил, 1-октен-З-ил, 3ноненил, 2,4-диметил-2,6-гептадиенил, 3,7-диметил-6-октенил, 5-деценил, 9-деценил, 2,6-диметил-7-октенил и т п Термин "алкенил Сг-С-ю" охватывает также "алкенил Сг-Сб" Под "стереоизомерным соединением" понимается оптический изомер соединения формулы I Представительными стереосоединениями являются изомер 1S, 2S, 5R, 6S, изомер 1R, 2R, 5S, 6R, изомер 1S, 2R, 5R, 6S, изомер 1R, 2S, 5S, 6R, изомер 1S, 2S, 5R, 6R, изомер 1R, 2R, 5S, 6S, изомер 1S, 2R, 5R, 6R и изомер 1R, 2S, 5S, 6S Под "диастереомерным соединением" понимается смесь двух не налагающихся стереоизомеров соединения формулы I Представители диастереомерных соединений смесь 1SR, 2SR, 5RS, 6SR, смесь 1SR, 2RS, 5RS, 6SR, смесь 1SR, 2SR, 5RS, 6RS и смесь 1SR, 2RS, 5RS, 6RS Предпочтительным диастереомерным соединением служит 1SR, 2SR, 5RS, 6SR, энантиомером -1S, 2S, 5R, 6S Под "защитной карбоксильной группой" здесь понимается одно из эфирных производных группы карбоновои кислоты, обычно используемое для блокирования или защиты группы карбоновои кислоты при проведении реакций на других функциональных группах Защита групп карбоновых кислот описана в книгах McOmie, Protecting Groups in Organic Chemistry, Plenum Press, NY, 1973, и Greene and Wuts, Protecting Groups in Organic Synthesis, 2nd Ed , John Wiley & Sons, NY, 1991 Примерами защитных карбоксильных групп могут служить метил, этил, метоксиметил, метилтеометил, трифенилметил, бензил, 4-нитробензил, 4-метоксибензил, 3,4-диметоксибензил, 2,4-диметоксибензил, 2,4,6-триметоксибензил, бензгидрил, t-бутил, t-амил, тритил, триметилсилил, t-бутилдиметилсилил, аллил, 1-(триметилсилилметил)-проп-1-ен-З-ил и т п Наиболее предпочтительны из защитных карбоксильных (С-і-Сє) алкильные группы, например, метил и этил Термин "защищенная карбоксильная" относится к группе карбоновои кислоты, имеющей карбоксильную защитную группу Термин "защитная азотная группа" здесь относится к заместителям на аминогруппах, обычно применяемым для блокирования или защиты функциональности аминогруппы при проведении реакций на других аминогруппах Защита аминогрупп описана в книгах McOmie, Protecting Groups in Organic Chemistry, Plenum Press' NY, 1973 и Greene and Wuts, Protecting Groups in Organic Synthesis, 2nd Ed , John Wiley & Sons, NY, 1991 Примеры защитных азотных групп, бензил, t-бутил, аллил, трифенилметил, t-бутилдиметилсилил, трифенилсилил, формил, тритил, фталилимид, трихлорацетил, хлорацетил, фталоил, 2-нитрофе но кс и ацетил, бензилоксикарбонил, метоксикарбонил, 2-метилбензилоксикарбонил, t-бутоксикарбонил, аллилоксикарбонил, 2,2,2-трихлорэтоксикарбонил и т п Термин "защищенная аминогруппа" относится к первичному или вторичному амину, имеющему защитную азотную группу Под "С1-С4 алкокси-" понимаются такие группы, как метокси-, этокси-, n-пропокси-, изопропокси-, п-бутокси-, втор-бутокси- и t-бутокси- "Галоген" означает фтор, хлор, бром и йод Термин "алкоксикарбонил" относится к карбонильной группе, в которой С-і-Сб алкильная группа соединена с углеродом карбонила через атом кислорода Сюда входят метоксикарбонил, этоксикарбонил, n-пропоксикарбонил, п-бутоксикарбонил, t-бутоксикарбонил и т п Предпочтительной алкоксикарбонильной группой является метоксикарбонил Под "замещенным фенилом" здесь понимается фенильная группа, замещенная одной или двумя составляющими, выбранными из группы, включающей галоген, гидрокси-, циано-, нитро-, С-і-Сб алкильную, С1-С4 алкокси-, алкоксикарбонил ьную, защищенную карбокси-, карбоксиметильную, гид роксиметил ьную, амино-, защищенную амино-, аминометильную или трифгорметильную группу Примерами защищенной фенильной группы могут служить 4-хлорфенил, 2,6дихлорфенил, 2,5-дихлорфенил, 3,4-дихлорфенил, 3-хлорфенил, 3-трибромфенил, 4-бромфенил, 3,4-дибромфенил, З-хлор-4-фторфенил, 2-фторфенил, 4-гидроксифенил, 3-гидроксифенил, 43332 2,4-дигидроксифенил, 3-нитрофенил, 4-нитрофенил, 4-цианофенил, 4-метилфенил, 4-этилфенил, 4-этоксифенил, 4-карбоксифенил, 4-(гидроксиметил)фенил, 4-аминофенил, 4-пропилфенил, 4-бутилфенил, 4-1:-бутилфенил, З-фгор-2-метилфенил, 2,3-дифгорфенил, 2,6-дифгорфенил, 2,6диметилфенил, 2-фгор-5-метилфенил, 2,4,6-трифторфенил, 2-трифторметилфенил, 2-хлор-5-трифторметилфенил, 2,4-бис(трифгорметил)фенил, 3,5-бис(трифгорметил)фенил, 2-метоксифенил, 3метоксифенил, 3,5-диметоксифенил, 4-гидрокси-Зметилфенил, 3,5-диметил-4-гидроксифенил, 4-гидрокси-3-(гидроксиметил)фенил, 2-амино-5-метилфенил, 4-амино-З-трифгорметилфенил, 3-амино4-гидроксифенил, 2-метил-4-нитрофенил, 4-метокси-2-нитрофенил, 2,4-динитрофенил, З-циан-4нитрофенил и т п Термин "арил" охватывает такие группы, как фенил, замещенный фенил и нафгил "Арилалкил" означает С1-С4 алкильную группу, включающую одну или несколько арильных групп К последним принадлежат бензил, 2-нитробензил, 4нитробензил, 1-фенилэтил, 2-фенилэтил, 3-фенилпропил, 4-фенилбутил, 2-метил-2-фенилпропил, (4-хлорфенил)метил, (2,6-дихлорфенил)метил, бис(2,6-дихлорфенил)метил, (4-гидрофенил)метил, (2,4-динитрофенил)метил, трифенилметил, (4-метоксифенил)дифенилметил, бис(4-метоксифенил)метил, со-нафтилдифенилметил, бис(2-нитрофенил)метил и т п Термин "воздействующее" относится к соединению формулы I, действующему как агонист на рецептор возбуждающей аминокислоты "Рецептор возбуждающей аминокислоты" - это метаботропный рецептор глутамата, подключенный к клеточным эффекторам через связывающие ГТФ белки "Сшитый цАМФ метаботропный рецептор глутамата" - это метаботропный рецептор, подключенный для ингибирования активности аденилатциклазы Термин "болезни нервной системы" относится как к острым, так и к хроническим нейродегенеративным состояниям, включая церебральные дефициты, вызванные шунтированием и трансплантацией сердечной мышцы, церебральную ишемию (например, инсульт вследствие остановки сердца), травмы позвоночника, травмы головы, болезнь Альцгеймера, хорею Хантингтона, амиотрофический склероз, вызванное СПИДом слабоумие, перинатальную гипоксию, гипогликемическое повреждение нейронов, повреждения глаз и ретинопатию, расстройства узнавания, идиопатическую и вызванную наркотиками болезнь Паркинсона Этот термин охватывает и другие болезни нервной системы, вызванные дисфункцией глутамата, в том числе мышечные спазмы, мигрени, недержание мочи, привыкание, воздержание и отвыкание от наркотиков (те опиатов, бензодиазепинов, никотина, кокаина или этанола), отказ от курения, эмезис, отек мозга, хронические боли, бессонницу, синдром Туретта, дефицит сосредоточенности и медлительную дискинезию Термин "психическое расстройство" относится к острым и хроническим психическим состояниям, включая шизофрению, маниакально-депрессивный и связанный с ним психозы (например, манию преследования и стрессовые расстройст ва), депрессию, биполярные расстройства, психозы и навязчивые состояния В настоящем изобретении предложены фармацевтически приемлемые соли соединений формулы I Эти соли могут существовать в сочетании с кислой или основной частью молекулы или в виде кислотной добавки как соли первичного, вторичного, третичного или четвертичного аммония, щелочного или щелочноземельного металла Как правило, кислые соли готовят реакцией кислоты с соединением формулы I Соли щелочных и щелочноземельных металлов готовят реакцией гидролиза нужного металла с соединением формулы I, где R1 и/или R4 - водород Для получения таких солей обычно используют неорганические (соляную, бромистоводородную, йодистоводородную, серную, фосфорную) и органические (паратолуолсульфоновую, метансульфоновую, щавелевую, парабромфенилсульфоновую, угольную, янтарную, лимонную, бензойную и уксусную) и др Следовательно, к числу фармацевтически приемлемых солей относятся сульфат, пиросульфат, бисульфат, фосфат, кислый монофосфат, кислый дифосфат, метафосфат, пирофосфат, хлорид, бромид, йодид, ацетат, пропионат, деканоат, каприлат, акрилат, формиат, изобутират, капрат, гептаноат, пропионат, оксалат, малонат, сукцинат, суберат, себацинат, фумарат, гиппурат, малеат, бутин-1,4-диолат, гексин-1,6-диолат, бензоат, хлорбензоат, мето кс и бензоат, фталат, сульфонат, ксилосульфонат, фенилацетат, фенилпропионат, фенилбутерат, цитрат, лактат, а-гидроксибутират, гмеколят, малеат, тартрат, метансульфонат, пропансульфонат, нафтален-1-сульфонат, нафгален2-сульфонат, манделят, соли аммония, магния, тетраметиламмония, калия, триметиламмония, натрия, метиламмония, кальция и т п Соединения формулы І в соответствии с настоящим изобретением обладают четырьмя асимметричными атомами углерода Центрами асимметрии являются замещенный атом углерода, несущий амино и карбоксильные группы, атом угле2 3 рода, к которому присоединены R и R , и два скрепляющих кольцо атома углерода Асимметричные атомы углерода находятся в положениях 2, 6, 1 и 5 соответственно Поэтому соединения в соответствии с настоящим изобретением могут существовать как по существу чистые оптические изомеры, смесь двух энантиомеров (включая рацемические модификации) и смесь двух диастереомеров Когда R2 - CO2R4, a R1, R и R4 - водород, биологически активный и наиболее предпочтительный стереоизомер, как показывают опыты по связыванию рецепторов, имеет положительное оптическое вращение (ао) Решение рентгеноструктуры монокристалла этого предпочтительного энантиомера дает относительную стереохимическую конфигурацию, как показано ниже НО2С. со 2 н 43332 Показано, что абсолютная стереохимическая конфигурация этого предпочтительного энантиомера имеет вид 1S, 2S, 5R, 6S Поэтому настоящим изобретением предусмотрены стереоизомерные соединения формулы I, имеющие именно такую предпочтительную стереохимическую конфигурацию, смеси энантиомеров, содержащие эту предпочтительную стереохимическую конфигурацию (включая рацематы), и смеси диастереомеров, содержащие эту предпочтительную стереохимическую конфигурацию Хотя считается, что все соединения формулы І в соответствии с настоящим изобретением селективно воздействуют на отрицательно подключенные сшитые цАМФ метаботропные рецепторы глутамата, некоторые соединения согласно изобретению более предпочтительны для этой це4 3 1 ли Предпочтительно R - CO2R , R - водород, R и R4 - раздельно водород, С-і-Сє алкил, арил или арилалкил Представительные соединения из этой группы включают 2-аминобицикло[3 1 0]гексан-2,6-дикарбоновую кислоту, диметил-2-аминобицикло[3 1 0]гексан-2,6-дикарбоксилат, диэтил-2аминобицикло[3 1 0]-гексан-2,6-дикарбоксилат, дибутил-2-аминобицикло[3 1 0]гексан-2,6-дикарбоксилат, дигексил-2-аминобицикло[3 1 0]гексан-2,6дикарбоксилат, дифенил-2-аминобицикло[3 1 0]гексан-2,6-дикарбоксилат и дебензил-2-аминобицикло[3 1 0] -гексан-2,6-дикарбоксилат Некоторые соединения в соответствии с настоящим изобретением наиболее предпочтительны для воздействия на сшитые цАМФ метаботропные рецепторы глутамата Лучше всего R1 и R4 - раздельно водород, С1-С4 алкил, арил или арилалкил Из этой наиболее предпочтительной группы соединений можно назвать 2-аминобицикло[3 1 0]гексан2,6-дикарбоновую кислоту, диметил-2-амино бицикло[3 1 0]гексан-2,6-дикарбоксилат, диэтил-2аминобицикло[3 1 0]гексан-2,6-дикарбоксилат, дибутил-2-аминобицикло[3 1 0]гексан-2,6-дикарбоксилат, дифенил-2-аминобицикло[3 1 0]-гексан-2,6дикарбоксилат и дибензил-2-аминобицикло[3 1 0] гексан-2,6-дикарбоксилат Некоторые соединения в наибольшей степени предпочтительны для воздействия на сшитые цАМФ метаботропные рецепторы глутамата 1 4 В них R и R - раздельно водород или алкил d С4 Сюда входят 2-аминобицикло[3 1 0]гексан-2,6дикарбоновая кислота, диметил-2-амино -бицикл о в 1 0]гексан-2,6-дикарбоксилат, диэтил-2-аминобицикло[3 1 0]гексан-2,6-дикарбоксилат, дибутил-2-аминобицикло[3 1 0]гексан-2,6-дикарбоксилат и дипропил-2-аминобицикло[3 1 0]гексан-2,6дикарбоксилат Самым предпочтительным соединением формулы I является (+)-2-аминобицикло[3 1 0]гексан-2,6-дикарбоновая кислота, ее С1-С4 алкил-, аралкил- или арилэфир или ее фармацевтически приемлемая соль Хотя все соединения формулы X в соответствии с настоящим изобретением считаются пригодными для синтеза соединений формулы I, некоторые из них являются предпочтительными В них R2a - CO2R4a, a R3a - водород Наиболее предпочтительны те соединения, где R4a - водород или алкильная группа С-і-Сє, например, этиловая Соединения формулы І в соответствии с настоящим изобретением, как правило, синтезируют циклопропанированием 2-циклоалкен-1-она - соединения формулы II, где Хтот же, что указано выше для соединений формулы I Соединения формулы I, в которых R3 - водород, a R - CO2R4, готовят так, как показано на схеме I Схема I II R4aO2C III ,4а R 4 a O 2 C, H VI T4*CO2Et NH 2 43332 Как правило, соединение формулы II реагирует с (защищенным карбокси)метилдиметилсульфонийбромидом с получением бициклического соединения формулы III, где R4a - защищенная карбоксигруппа Это соединение переводят в аминокислоту реакцией Штрекера или Бухерера-Бергса с последующим гидролизом и этерифицируют, получая соединения формулы IV в виде смеси изомеров Разделяя эту смесь, получают соединения формулы V и формулы VI Затем эти соединения гидролизуют и получают соединения формулы I, где R - CO2R4, a R1 и R4 - водород В частности, 2-циклоалкен-1-он реагирует с (замещенным карбокси)метилдиметилсульфонийбромидом с получением бициклического промежуточного соединения III Циклопропанирование обычно проводят в органическом растворителе в присутствии аминного основания В качестве растворителей для этой цели пригодны ацетонитрил, дихлорметан, бензол, толуол и ксилол, лучше всего ацетонитрил или дихлорметан Аминными основаниями в этой реакции служат ненуклеофильные основания, например, 1,8-диазобицикл о в 4 0]ундец-7-ен, пиридин и коллидин Предпочтительное аминное основание для этой реакции 1,8-диазобицикло[5 4 0]ундец-7-ен Предпочтительно карбоэтоксиметилдиметилсульфонийбромид реагирует с аминным основанием с получением этил(диметилсульфуранилиден)ацетата Полученную смесь обрабатывают 2-циклоалкен-1-оном, например, 2-ЦИКЛОПЄНТЄН-1-ОНОМ, 2-циклогек сан-1 -оном или 2-циклооктен-1 -оном Реакцию обычно проводят в интервале температур от около 25°С до около 50°С, предпочтительно при температуре 25-30°С Реакция полностью завершается в срок от 18 часов до трех суток Бициклическое промежуточное соединение III преобразуют в бициклическую аминокислоту по реакции Штрекера или Бухерера-Бергса с последующим гидролизом промежуточных продуктов (Krauch and Kunz, Organic Name Reactions, 76 (1964) (см ССЫЛКИ В ЭТОЙ работе) Предпочтитель но бициклический кетон III обрабатывают водным раствором цианида калия или цианида натрия и карбоната аммония с получением промежуточных соединений гидантоина Реакцию проводят в спиртовом растворителе, например, этаноле или метаноле, при температуре от около 25°С до температуры перегонки растворителя, предпочтительно около 50°С Реакция обычно завершается по истечении 18 часов Изомерные гидантоины можно выделять и очищать, как описано ниже Предпочтительно смесь изомерных гидантоинов гидролизуют с помощью гидроксида натрия, после чего этерифицируют без выделения или очистки до получения соединения формулы V или формулы VI Гидролиз обычно проводят при температуре перегонки растворителя около 15-20 часов Продукты гидролиза - смесь изомерных соединений формулы I, где R1 - водород, - предпочтительно этерифицируют до разделения диастереомеров и энантиомеров После удаления защитной карбоксильной группы при гидролизе готовят диэфир Раствор карбоновой или дикарбоновой кислоты в спирте, например, метаноле, этаноле, i пропаноле или п-бутаноле, обрабатывают тионилхлоридом и нагревают до перегонки Обычно раствор продукта гидролиза перед добавлением тионилхлорида охлаждают до около 0°С Этерификация занимает около 48 часов Диастереомерные продукты - соединения формулы V и формулы VI - разделяют стандартным способом Предпочтительные способы разделения - кристаллизация и/или хроматография Соединения формулы V и VI можно селективно кристаллизовать путем образования присоединенной кислой соли, например, оксалата Эту соль получают обработкой раствора этилацетата, содержащего смесь соединений формулы V и VI, щавелевой кислотой и этанолом Для содействия кристаллизации одного из диастереомеров можно дополнительно вводить этанол При этом получают кристаллический продукт, обогащенный одним изомером, и фильтрат (маточник), обогащенный другим изомером Затем эти соединения можно очистить с помощью хроматографии, например, с силикагелем Соединения формулы V и VI при необходимости гидролизуют и удаляют защитную карбоксильную группу для получения соединений формулы I, где R1 и R4 - это водород Обычно их гидролизуют путем обработки раствора соединения формулы V и VI в органическом растворителе, например, тетрагидрофуране, водном растворе основания, например, гидроксиде натрия Такой гидролиз обычно ведут при комнатной температуре в течение примерно 18 часов Защитную карбоксильную группу удаляют стандартными приемами синтеза (см McOmie и Greene and Wuts) Энантиомеры каждой диастереомерной пары промежуточных соединений V и VI разделяют стандартными приемами (см Jacques, Collet, and Wilen, Enantiomers, Racemaces and Resolutions (1981)) Предпочтительно энантиомеры разделяют путем образования диастереомерных солей между рацемическими модификациями и оптически активными (хиральными) разделяющими агентами (Jacques, Collet and Wilem, глава 5) Соединения формулы V и VI, в которых R4a представляет защитную карбоксильную группу, можно разделять с помощью кислых хиральных разделяющих агентов, как (+)-камфарная кислота, (+) и (-)-дибензоилвинная кислота, диацетонкетогулоновая кислота, лазалоцид, (+) и (-)-миндальная кислота, (+) и (-)-яблочная кислота, (+) и (-)-хинная кислота, (+) и (-)-винная кислота, (+)-ди-р-толуоил-О-винная кислота и (-)-ди-р-толуоил-І_-винная кислота Предпочтительными кислыми разделяющими агентами для соединений формул V и VI, в которых R4a представляет защитную карбоксильную группу, служат (+)-ди-р-толуоил-О-винная и (-)-дир-толуоил-І_-винная кислоты Соединения формулы V и VI, в которых R4a представляет водород, можно разделять с помощью основных хиральных разделяющих агентов, например, (SJ-1-фенилэтиламина Либо можно перевести бициклическое соединение формулы III в смесь диастереомерных гидантоинов, как показано на схеме II 43332 Схема .4а R 4a O 2 C, III ,4а R"O2C VII VIII Бициклическое промежуточное соединение III, полученное вышеописанным способом, вступает в реакцию с раствором цианида калия или цианида натрия и карбоната аммония с получением диастереомерных промежуточных гидантоинов формул VII и VIII Эту реакцию обычно проводят в смеси воды со спиртом, например, метанолом или этанолом Реакцию ведут при температуре около 55-60°С, и она занимает от около 18 до около 4 суток Диастереомерные продукты разделяют стандартным способом, например, кристаллизацией или хроматографией Предпочтительно соединения формул VII и VIII, в которых R4a представляет водород, можно разделять с по мощью основного хирального разделяющего агента, например, (Р)-1-фенилэтиламина Промежуточное соединение гидантоина формул VII или VIII переводят в соединения формулы І, в котором R1 и R4 - водород, путем гидролиза Гидантоинную и эфирную группы гидролизуют водным раствором основания, например, гидроксида натрия, или кислоты, например, соляной Гидролиз обычно ведут при температуре от около 100°С до около 150°С Полученное соединение формулы I очищают ионообменной хроматографией Соединения формулы I, где R2 - водород, а 3 R - CO2R а, получают, как показано на схеме III Схема III / CO 2 R 4a I Me Me II R4aO2C •£> О III 2-циклоалкен-1-он реагирует с карбоксизащищенным (диметилсульфуранилиден) ацетатом с получением изомерных бициклических промежуточных соединений III и IV Это циклопропанирование проводят в органическом растворе при температуре от около 45°С до около 85°С В качестве растворителей пригодны бензол, толуол, ксилол и ацетонитрил Предпочтительно реакцию IX ведут в бензоле при 50°С Диастереомерные продукты разделяют хроматографией на силикагеле Соединения формулы IX переводят в соединения формулы I приемами, описанными для соединений формулы III Соединения формулы III, в которых X представляет СЬІ2, можно также получать путем, показанным на схеме IV 43332 Схема IV XI XII »4а R4eO2C >4а R4a02O о III Соединение формулы XI реагирует с (защищенным карбокси)метилдиметилсульфонийбромидом с получением соединения формулы XII, в котором R4a - защитная карбоксильная группа Реакцию можно проводить путем, описанным для циклопропанирования соединения формулы II Полученное соединение формулы XII затем переводят в соединение формулы XIII путем нагревания в интервале температур 160-500°С, предпочтительно 180-300°С При нагреве соединения формулы XII выделяется циклопентадиен Желательно вести процесс в атмосфере инертного газа, например, азота, и в присутствии инертного органического растворителя, например, дихлорбензола Полученное соединение формулы XIII затем переводят в соединение формулы III путем восстановления, например, гидрогенизации в присутствии палладия на древесном угле Восстановление желательно вести в интервале температур 0-50°С Растворителем при восстановлении может служить спирт, например, этанол, эфир, например, этилацетат, ароматический углеводород, например, диметилформамид Понятно, что при использовании в качестве исходного материала оптически активного соединения формулы XI можно получить оптически активное соединение формулы III Соединения формулы XIII считаются новыми и образуют еще один предмет изобретения Соединение формулы XI (включая оптически активные формы) можно изготовить способом, описанным у Klunder et al , Tetrahedron Lett, 1986, 27, 2543 и Takano et al , Synlett 1991, 636 Соединения формулы I, где R1 и R4 - алкил C-i-C-io, алкенил Сг-С-ю, арил или арилалкил, получают из соответствующих соединений, где R1 и R4 - водород Для этого используют известные способы синтеза В типичном случае соединения формулы I, где R1 и R4 - водород, можно ввести в реакцию с С-І-С-ІО алкил-, Сг-С-ю алкенил-, арилили арилалкилсодержащим спиртом в присутствии кислоты с получением соответствующего эфира Обычно такую реакцию проводят с избытком спирта в присутствии катализатора - концентрированной серной кислоты Соединения формулы I, где R1 и R4 не одинаковы, можно получать известными способами синтеза из двухосновной кислоты, где R1 и R4 - водород Например, приемлем способ, разработанный для селективной функционализации карбоксильных групп глутаминовой и аспарагиновой кислот Либо можно путем подбора защитной карбоксильной группы для соединения формулы X, устойчивой в условиях гидролиза, для гидантоиновой группы селективно манипулировать карбоксильными группами Соединения формулы І в соответствии с настоящим изобретением являются агонистами некоторых метаботропных рецепторов возбуждающих аминокислот, в частности, отрицательно подключенных цАМФ метаботропных рецепторов глутамата Следовательно, настоящее изобретение представляет также способ воздействия на рецепторы возбуждающих аминокислот у млекопитающих, в соответствии с которым млекопитающему, требующему модулированной неиропередачи возбуждающей аминокислоты, вводят фармацевтически эффективное количество соединения формулы I Термин "фармацевтически эффективное" означает такое количество соединения в соответствии с изобретением, которое способно воздействовать на рецепторы возбуждающих аминокислот При этом воздействии соединение в соответствии с изобретением выступает в роли агониста В таком случае взаимодействие соединения с ВАК имитирует реакцию взаимодействия данного рецептора с его естественным лигандом (те Lглута матом) Конкретная дозировка вводимого соединения, естественно, определяется обстоятельствами, включая вид вводимого соединения, способ введения, подлежащие лечению состояние и другие подобные факторы Соединения можно вводить разными путями орально, ректально, накож 43332 но, подкожно, внутривенно, внутримышечно или через нос, либо же путем непрерывной инфузии Обычная суточная доза составляет от около 0,001 до около 100 мг/кг активного соединения в соответствии с настоящим изобретением, предпочтительно 0,05-50 мг/кг, наиболее предпочтительно 0,1-20 мг/кг Показано, что множество физиологических функций подвергается воздействию избыточного или несоответствующего стимулирования при передаче возбуждающих аминокислот Считается, что соединения формулы І в соответствии с настоящим изобретением способны излечивать различные болезни нервной системы у млекопитающих, связанные с подобными состояниями, включая острые болезни нервной системы, например, церебральные дефициты, вызванные шунтированием и трансплантацией сердечной мышцы, церебральную ишемию (например, инсульт вследствие остановки сердца), травмы позвоночника, травмы головы, перинатальную гипоксию и гипогликемическое повреждение нейронов Соединения формулы I, как считается, способны излечивать ряд хронических болезней нервной системы, в том числе болезнь Альцгеймера, хорею Хантингтона, аминотрофный склероз, вызванное СПИДом слабоумие, повреждение глаз и ретинопатию, расстройства узнавания, идиопатическую и вызванную наркотиками болезнь Паркинсона маниакально-депрессивный и связанные с ним психозы (например, манию преследования и стрессовые расстройства), эмезис, отек мозга, хронические боли, бессонницу, синдром Туретта, дефицит сосредоточенности и медлительную дискинезию Соединения в соответствии с настоящим изобретением являются агонистами сшитых цАМФ метаботропных рецепторов глутамата Эти соединения отрицательно подключаются через рецепторы к аденилциклазе, ингибируя образование циклического аденозинмонофосфата Поэтому считается, что соединения формулы І в соответствии с настоящим изобретением способны излечивать различные психические расстройства, как то шизофрению, маниакально-депрессивный и связанные с ним психозы (например, манию преследования и стрессовые расстройства), депрессии, биполярные расстройства, психозы и навязчивые состояния Были поставлены опыты, демонстрирующие способность соединений формулы I воздействовать на рецепторы возбуждающих аминокислот Сродство указанных соединений к мегаботропным рецепторам глутамата доказывается селективным смещением фиксации чувствительного к (1S.3R)1 -аминоциклопентан-1,3-дикарбоновой кислоте [3Н] глутамата к мембранам мозговых клеток крыс Фиксация [3Н] глутамата ([3H]Glu) к грубым мембранам переднего мозга крыс выполнялось согласно Schoepp and True, Neuroscience Lett, 145, 100104 (1992), Wright, McDonald and Scoepp, J Neurochem , 63, 938-945 (1994) Концентрации соединения формулы I, которые ингибировали 50% фиксации (IC50), или процент смещения [3H]Glu при концентрации 10 мкМ или 100 мкМ соединения формулы I, показаны в таблице 1 Соединения формулы І в соответствии с настоящим изобретением способны также, как считается, излечивать некоторые другие болезни нервной системы у млекопитающих, связанные с дисфункцией глутамата, в том числе мышечные спазмы, судороги, мигрени, недержание мочи, психозы, привыкание, воздержание и отвыкание от наркотиков (т е опиатов, бензодиазепинов, никотина, кокаина или этанола), отказ от курения, Таблица 1 Связывание рецепторов соединения формулы № соединения 3 ' IC50 (мкМ) ы 0,32 З 6 С| 0,18 7О 160,78 d) 8 3,2 a) номера соединений из экспериментальной части b) испытывалось как смесь энантиомеров c) испытывалось как чистый энантиомер d) испытывалось как смесь диастереомеров Соединения 3, 6, 7 и 8 - это дикарбоновые кислоты В целом установлено, что эфирные производные (те соединения формулы І, в которых один или оба R1 и R4 не являются водородом) не воздействуют на фиксацию рецептора Однако считается, что in vivo эти соединения гидролизуются до соответствующих кислот и могут оказывать лечебное действие Следует иметь в виду, что в настоящем изобретении предложены активные дикарбоновые кислоты, а также предлекарственные формы, которые способны вырабатывать действующую кислоту in vivo Соединения формулы I эффективно воздействуют на сшитые цАМФ метаботропные рецепторы глутамата Представительные соединения испытывались на способность уменьшать образование стимулируемого форсколином цАМФ в гиппокампе и коре головного мозга у крыс по методике Шеппа и Джонсона (Scoepp and Johnson, Neurochem Int, 22, 277-283 (1993) Результаты этих опытов представлены в таблице 2 10 43332 Таблица 2 Ингибирование стимулируемого форсколином образования цАМФ ЕС50 (мкМ) Соединение, № 6 7 Кора головного мозга крыс 0,055±0,017 22,0±3,4 Гиппокамп крыс 0,036±0,015 29,4±3,04 Способность соединений формулы I излечивать мании и связанные с ними расстройства можно продемонстрировать с помощью известных моделей вызванной страхом дрожи и каскадного лабиринта, описанных соответственно в работах Davis, Psych о pharmacology, 62 1, 1979 и Lister, Psychopharmacol , 92 180-185,1987 риод составлял 12 часов света и 12 часов тьмы, свет выключали около 18 00 часов Испытуемые соединения растворяли в сосуде с очищенной водой и перед употреблением нейтрализовали 5N NaOH до рН 7-8 Диазепам фирмы Сигма Кемикал, Сент-Луис, штат Миссури, суспендировали по каплям в очищенной воде Контрольным животным давали воду в таких же сосудах Вызванная страхом дрожь Выработку рефлексов и создание и запись дрожевых реакций проводили в камерах типа SL-LAB фирмы СанДиего Инструменте, Сан-Диего, штат Калифорния Дрожевые реакции вызывали по классической методике Вкратце, первые два дня крыс держали в темных камерах запугивания со встроенными электроударными решетками После 5 минут привыкания каждую крысу стегали током в 1 мА (500 мс), включая за 5 секунд до этого 15 Вт лампочку, которая продолжала светить во время удара После десяти циклов ударов с включением света крысам давали водный раствор испытуемого соединения и, выработав рефлекс, начинали опыты с дрожью В начале опыта 10 раз подряд повторяли звуковой пугающий раздражитель (110 дБ), не зажигая света, чтобы устранить эффект начальной быстрой фазы привыкания к раздражителю Затем 20 раз повторяли шумовое воздействие, поочередно зажигая и не зажигая свет Исключив начальную серию воздействий, усредняли амплитуду дрожевых реакций для каждого вида воздействий (только шум и шум+свет) на протяжении всего опыта Данные представлялись как разность между только шумом и шумом+светом Результаты представлены в таблице 3 В модели, вызванной страхом дрожи, на животных воздействуют нейтральным раздражителем, например, светом (условный раздражитель) и вызывающим отрицательную реакцию раздражителем, например, ударом (безусловный раздражитель) После выработки условного рефлекса, когда животное подвергают сильному звуковому раздражителю, дрожь оказывается сильнее, если раздражителю предшествует свет Модель каскадного лабиринта основана на естественной боязни высоты и открытых пространств у грызунов Диазепам и бусперон гидрохлорид - клинически проверенные анксиолитики - эффективно уменьшают страх (усиленную дрожь) при появлении света в модели вызванной страхом дрожи и боязнь открытых пространств в модели каскадного лабиринта Самцы крыс Лонг-Эванс (180-400 г) или самцы мышей NIH Swiss (18-35 г) были получены от фирмы Харлан Спрейг-Доули, Камберленд, штат Индиана, США, и акклиматизировались не менее трех суток перед опытом Животных держали в помещении при температуре 23±2°С, относительной влажности 30-70% и давали корм для грызунов фирмы Пурина и воду без ограничений Фотопе Таблица 3 Дрожь, вызванная страхом Испытуемое соединение ED50 (мг/кг) Соединение 6 0,3 Соединение 7 не действует* Диазепам 0,4 * при максимальной испытанной дозе 10 мг/кг Автоматизированный каскадный лабиринт Каскадный лабиринт был изготовлен согласно конструкции, разработанной для мышей Листером (1987) Он был выполнен из плексигласа и состоял из двух открытых (30x5x0,25 см) и двух закрытых (30x5x15 см) секций Полы в лабиринтах гофрированные для обеспечения текстуры Секции отходят от центральной платформы под углом 90° друг к другу Лабиринт приподнят на 45 см над полом и освещается крас ным светом В каждой секции лабиринта установлены инфракрасные фотоэлементы для слежения за перемещением в закрытых, открытых пространствах и выглядыванием Мышей поодиночке помещали на центральную платформу лабиринта и подсчитывали, сколько раз они появятся в закрытых секциях, открытых секциях и выглянут (высунут голову из закрытой секции в открытую) и сколько это займет времени за 5 минут опыта 11 43332 Оральное введение соединения 6 дозами в 1, 3 и 10 мг/кг значительно продлевает пребывание в открытых секциях Мыши выглядывают значительно чаще при 3 мг/кг Пребывание в закрытых секциях существенно не изменяется при любых дозах соединения 6 Способность соединений формулы I защищать теплокровных млекопитающих от воздействия воздержания или прекращения приема наркотиков можно показать с помощью модели звукового испуга При этой модели животным вводят наркотик (никотин или диазепам), затем прекращают введение При прекращении приема наркотиков дрожь при испуге звуковыми раздражителями выражена сильнее Затем животным вводят испытуемое соединение, чтобы определить, способно ли оно ослаблять реакцию испуга Крыс линии Лонг-Эванс (200-400 г, от фирмы Харлан Спрейг Доули, Колумбус, штат Индиана) поодиночке помещали в контролируемую среду с чередованием света и тьмы по 12 часов и не ограничивали в пище (корм Пурина) и воде Крыс анестезировали изофлураном и подкожно вставляли осмотические насосы фирмы Алза Корпорэйшн Испытуемое вещество растворяли в сосуде с очищенной водой и нейтрализовали 5N NaOH до рН 7-8 перед введением Диазепам фирмы Сигма Кемикл, Сент-Луис, штат Миссури, суспендировали в растворе, содержащем 40% полиэтиленгликоля-300, 10% EtOH, 2% бензилового спирта, 1% "Твин-80" и 47% очищенной воды Никотин фирмы Рисерч Байокемиклз инк, Натик, штат Минессота, растворяли в солевом растворе Контрольным животным давали носитель в таких же сосудах Воздержание от никотина Насосы подавали никотин (6 мг/кг/сутки подкожно), диазепам (10 мг/кг/сутки подкожно), испытуемое соединение (0, 1, 3, 10 мг/кг подкожно) или носитель После 12 дней подкожного введения веществ насосом крыс анестезировали изофлураном и удаляли насосы При воздержании после удаления насосов реакция испуга от звукового раздражителя (пиковые амплитуды Vmax) отдельных крыс фиксировалась с помощью камер запугивания фирмы Сан-Диего Инструменте, Сан-Диего, штат Калифорния Запугивание состояло из 5-минутного периода адаптации к фоновому уровню шума 70±2 дБА, после чего сразу следовали 25 ударов шумовым раздражителем (120±2 дБА по 50 мс) с 8-секундными интервалами Затем усреднялись пиковые амплитуды реакции испуга для всех 25 ударов раздражителя в каждом опыте и все данные представлены здесь как суммарные по опыту Реакция на звуковой испуг определялась ежедневно на 1-й, 2-й, 3-й, 4-й или 5-й день воздержания Базовая реакция на испуг измерялась перед отъемом насоса на 12-й день на При введении соединения 6 вызванная воздержанием усиленная дрожевая реакция также блокируется в зависимости от дозы Заметное ослабление дрожи наблюдалось при дозах соединения 6, начиная от 3 мг/кг орально, по сравнению с контрольными животными, получавшими никотин (ЕДбо = 0,7 мг/кг внутрилегочно) Воздержание от диазепама Реакция звукового испуга серьезно повышалась в первые четыре дня после прекращения введения диазепама по сравнению с контрольными крысами, получавшими носитель Ослабленные дозы диазепама в 3 и 10 мг/кг внутрилегочно не блокируют усиление реакции испуга, а в некоторых случаях дополнительно увеличивают ее Крысы, получавшие 30 мг/кг диазепама внутрилегочно в сутки за 60 минут до измерения реакции на испуг, не показали усиления реактивности на 1-й - 4-й день после прекращения введения диазепама по сравнению с контрольными Предварительное введение соединения 6 блокирует ожидаемый рост дрожевой реакции после прекращения введения диазепама Дозы соединения 6 в 0,1 и 0,3 мг/кг орально заметно ослабили повышенную реакцию по сравнению с контролем (ED50 - 0,1 мг/кг орально) Соединения в соответствии с настоящим изобретением предпочтительно смешивают в фармацевтические композиции перед употреблением Поэтому еще одним предметом настоящего изобретения является фармацевтический состав, содержащий соединения формулы І в сочетании с одним или несколькими фармацевтически приемлемыми носителями, разбавителями или наполнителями Фармацевтические составы в соответствии с настоящим изобретением получают известными способами с использованием известных и доступных компонентов При изготовлении составов в соответствии с настоящим изобретением активный компонент обычно смешивают с носителем, или разбавляют носителем, или заключают в носитель и помещают в капсулу, саше, сверток или иную емкость Когда носитель служит разбавителем, он может быть в твердом, полутвердом или жидком виде и служит носителем, наполнителем или средой для активного начала Выпускной формой состава могут быть таблетки, пилюли, порошки, лепешки, саше, облатки, эликсиры, суспензии, эмульсии, растворы, сиропы, аэрозоли, мази, содержащие, например, до 10 мае % активного начала, мягкие и твердые желатиновые капсулы, суппозитории, стерильные растворы для инъекций, липкие пластыри, подкожные имплантаты и стерильные расфасованные порошки В качестве примеров приемлемых носителей, наполнителей и разбавителей можно назвать лактозу, десктрозу, сахарозу, сорбитол, маннитол, крахмалы, смолы, смолу акации, фосфат кальция, альгинаты, трагакант, желатин, силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, водный сироп, метилцеллюлозу, метил- и пропилгидроксибензоат, тальк, стеарат магния, стеариновую кислоту и минеральные масла Составы могут дополнительно включать смазывающие агенты, смачиватели (ПАВ), эмульгаторы и суспендирующие агенты, консерванты, подслащивающие и вкусовые добавки Составы в соответствии с изобретением могут расс Реакция на звуковой испуг существенно возрастает в течение первых трех дней после прекращения хронического введения никотина по сравнению с контрольными крысами, получавшими воду Крысы, получавшие ослабленную дозу никотина в 0,03 мг/кг и выше внутрилегочно, проявляли менее заметную дрожевую реакцию по сравнению с животными, которым совсем не давали никоти 12 43332 ки дискретная единица, содержащая разовую дозу для человека и других млекопитающих, каждая единица содержит заданное количество активного начала, дающего требуемый лечебный эффект, в сочетании с соответствующим фармацевтически приемлемым носителем, разбавителем или наполнителем Приведенные ниже примеры носят сугубо иллюстративный характер и никоим образом не ограничивают объем изобретения читываться на ускоренное, нормальное или замедленное действие активного компонента после введения больному с использованием известных приемов Составы предпочтительно готовятся в расчете на разовую дозу, содержащую от около 1 до около 500 мг, предпочтительно 5-200 мг, активного начала Под "разовой дозой" понимается физичес Состав 1 Твердые желатиновые капсулы готовят из следующих компонентов м г/кап сул у 2-аминобицикло[3 1 0 ]гексан-2,6-дикарбоновая кислота 250 Крахмал сухой 200 Стеарат магния 10 Итого 460 мг Компоненты смешивают и наполняют твердые желатиновые капсулы массой 460 мг Состав 2 Готовят таблетку из следующих компонентов мг^аб летку 2-аминобицикло[3 1 0 ]гексан-2,6-дикарбоновая кислота 250 Микрокристаллическая целлюлоза 400 Пирогенный диоксид кремния 10 Стеариновая кислота 5 Итого 665 мг Компоненты перемешивают и прессуют в таблетки массой 665 мг Состав 3 Готовят раствор аэрозоля из следующих компонентов мае % 2-аминобицикло[3 1 0 ]гексан-2,6-дикарбоновая кислота 0,25 Этанол 29,75 Хладон 22 70,00 Итого 100,00 Активное начало смешивают с этанолом, смесь добавляют к части хладона 22, охлаждают до -30°С и подают в фасовочное устройство, за тем в емкость из нержавеющей стали вместе с остальным носителем, после чего к емкости приделывают распылительные клапаны Состав 4 Таблетки, содержащие по 60 мг активного начала, готовят следующим образом мг 2-аминобицикло [3 1 0 ]гексан-2,6-дикарбоновая кислота 60 Крахмал 45 Микрокристаллическая целлюлоза 35 13 43332 Продолжение 4 Поливинилпирролидон Крахмал с карбоксиметилнатрием 4,5 Стеарат магния 0,5 Тальк 1 Итого 150 мг Активное начало, крахмал и целлюлозу пропускают через сито 45 меш (0,35 мм) и тщательно перемешивают Раствор поливинилпирролидона смешивают с полученным порошком и просеивают через сито 14 меш (1,41 мм) Полученные гранулы сушат при 50°С и пропус кают через сито 18 меш (1,00 мм) Крахмал с карбоксиметилнатрием, стеарат магния и тальк просеивают через сито 60 меш (0,25 мм) и добавляют к гранулам, полученную смесь прессуют на таблетировочной машине и получают таблетки массой по 150 мг Состав 5 Капсулы, содержащие по 80 мг активного начала, готовят следующим образом мг 2-аминобицикло[3 1 0 ]гексан-2,6-дикарбоновая кислота 80 Крахмал 59 Микрокристаллическая целлюлоза 59 Стеарат магния 2 Итого 200 мг Активное начало, целлюлозу, крахмал и стеарат магния тонко перемешивают, просеивают через сито 45 меш (0,35 мм) и наполняют твердые желатиновые капсулы по 200 мг Состав 6 Суппозитории, содержащие по 225 мг активного начала, готовят следующим образом мг 2-аминобицикло[3 1 0 ]гексан-2,6-дикарбоновая кислота 225 Глицерины насыщенных жирных кислот 2000 Итого 2225 Активное начало пропускают через сито 60 меш (0,25 мм) и суспендируют в глицеридах насыщенных жирных кислот, предварительно расп лавленных при минимально необходимом расходе тепла Смесь разливают в суппозиторные формы номинальной емкостью 2 г и дают остыть Состав 7 Суспензии, содержащие по 50 мг активного начала на 5-мл дозу, готовят следующим образом мг 2-аминобицикло[3 1 0 ]гексан-2,6-дикарбоновая кислота 50 Натрий-карбоксиметил целлюлоза 50 Сироп 1,25 Раствор бензойной кислоты 0,10 Отдушка см Краситель см Очищенная вода до 5 мл Медикамент пропускают через сито 45 меш (0,35) и смешивают с Na-КМЦ и сиропом до однородной пасты С частью воды при перемешивании добавляют раствор бензойной кислоты, отдушку и краситель, затем доливают воду до нужного объема 14 43332 Состав 8 Раствор внутривенных инъекций можно приготовить следующим образом мг 2-аминобицикло[3 1 0 ]гексан-2,6-дикарбоновая кислота 100 Дикарбоновая кислота 100 Маннитол 200 мкл 5N гидроксид натрия 5 мл Очищенная вода до 5 мл Нижеследующие примеры более подробно показывают соединения в соответствии с настоящим изобретением и способы их синтеза Примеры никоим образом не ограничивают объем изобретения, и их не следует понимать в таком смысле Все опыты проводились под избыточным давлением сухого азота или аргона Все растворители и реактивы приобретались коммерческим путем и использовались в неизмененном виде, если не оговорено иное Сухой тетрагидрофуран (ТГФ) получали дистилляцией из кетила натрия или натрийбензофенола непосредственно перед употреблением 265 гбромацетата и 114 г диметилсульфида растворяют в 500 мл ацетона при комнатной температуре и перемешивают Через трое суток указанное соединение отфильтровывают из реакционной смеси Точка плавления 88-90°С Пример 1. (1SR,5RS,6SR)3™>2-OKCH6H4HM-IO[3 1 0 Гек сан-6-карбоксил ат Суспензию 45,5 г карбоэтоксиметилдиметилсульфонийбромида в 350 мл толуола обрабатывают 30,2 г 1,8-диазобицикло[5 4 0]ундец-7ена Смесь перемешивают при комнатной температуре Через час реакционную смесь обрабатывают 19,57 г 2-циклопентен-1-она Еще через 18 часов реакционную смесь вводят в раствор 1N соляной кислоты и хлорида натрия Полученную смесь экстрагируют диэтилэфиром Эфирные вытяжки сушат над сульфатом магния, фильтруют и концентрируют в вакууме Осадок очищают с помощью хроматографии на силикагеле, элюируя с линейным градиентом от 10 до 50% этилацетата/гексанов,и получают 22,81 г целевого соединения Точка плавления 36-38°С Протонные спектры ядерного магнитного резонанса (1Н ЯМР) получали на спектрометре Дженерал Электрик QE-300 на частоте 300,15 МГц, спектрометре АМ-500 фирмы Брукер АМ-500Р на 500 МГц или Брукер АС-200Р на 200 МГц Масс-спектрометрия с бомбардировкой свободными атомами (МСБСА) проводилась на приборе VG ZAB-2SE Автодесорбционная масс-спектрометрия (АДМС) проводилась на приборе VG-70 SE либо Вариан МАТ 731 Оптическое вращение измерялось поляриметром Перкин-Эмлер 241 Хроматограф и ческое разделение на приборе Уотерс Преп-500 LC, как правило, осуществлялось с использованием линейного градиента растворителей, указанных в тексте Завершение реакций обычно контролировалось с применением тонкослойной хроматографии (ТСХ), для чего служили пластины фирмы Е Мерк "Силикагель-60" F254, пластины 5x10 см толщиной 0,25 мм Пятна обнаруживались комбинированным ультрафиолетовым и химическим методом (пластины погружали в церийаммониймолибдатный раствор [75 г молибдата аммония и 4 г сульфата церия (IV) в 500 мл 10%ного водяного раствора серной кислоты] и затем нагревали на горячей пластине) Пламенная хроматография выполнялась по Стиллу и др (Still, Kahn and Mitra, J Org Chem , 43, 2923 (1978)) Анализ на углерод, водород или азот производился на анализаторе элементов модели 440 фирмы Контрол Иквипмент Корпорэйшн или в аналитическом центре фармацевтического университета Комплутенсе (Мадрид, Испания) Точки плавления определялись в открытых стеклянных капиллярах на горячей воздушной ванне в аппарате Галлекампа или Бюхи для определения точки плавления и не корректировались Цифра в скобках после названия соединения означает его АДМС m/z = 168(M+) Расчетный состав для С9Н12О3 С - 64,27, Н-7,19% Фактический состав С-64,54, Н - 7 , 1 1 % Пример 2. [3 1 0]гексан-2,6-дикарбоксилат (1) и (1SR, 2SR, 5RS, 6SR)диэтил-2-aминoбициклo[3 1 0]гексан-2,6дикарбоксилат (2) 22,81 г соединения из примера 1 растворяют в 200 мл этанола и обрабатывают раствором 9,71 г цианида калия и 21,2 г карбоната аммония в 200 мл воды Полученную смесь нагревают до около 50°С Через 18 часов реакционной смеси дают остыть до комнатной температуры и обрабатывают ее 16,2 г гидроксида натрия Полученную смесь нагревают до флегмы, через 18 часов дают остыть до комнатной температуры, затем охлаждают до 0°С рН холодной смеси доводят до 1 концентрированной соляной кислотой Смесь концентрируют досуха в вакууме Осадок растворяют в этаноле, нагревают до 0°С и обрабатывают 80,6 гтионилхлорида Полученную смесь нагревают до флегмы Через 48 часов продукт реакции досуха концентрируют в вакууме Осадок обрабатывают 1N гидроксидом натрия и полученную смесь экстрагируют диэтилэфиром Эфирные вытяжки сушат над карбонатом калия, фильтруют и концентрируют в вакууме, получая 24,6 смеси целевых соединений номер Препарат 1 Карбоэтоксиметилдиметилсульфонийбромид 15 43332 Пример 3. (1SR, 2SR, 5RS, 63^диэтил-2-аминобицикло [3 1 0]-гексан-2,6-дикарбоксилат (2) 20,71 г соединений, полученных в примере 2, растворяют в 200 мл этилацетата и обрабатывают раствором 15,46 г щавелевой кислоты в 50 мл этанола Полученную смесь перемешивают при комнатной температуре и через час обрабатывают еще 50 мл этанола Через 18 часов смесь фильтруют и фильтрат упаривают досуха в вакууме Осадок обрабатывают IN гидроксидом натрия и полученную смесь экстрагируют диэтилэфиром Эфирные вытяжки промывают рассолом, сушат над карбонатом натрия, фильтруют и концентрируют в вакууме Осадок очищают хроматографией на силикагеле, элюируют смесью метиленхлорида - 5% и гидроксида аммония с метанолом (97 3) и получают 15,41 г целевого соединения после сушки получают 14,7 г продукта Охлаждением фильтра до 0°С получают дополнительные кристаллы Всю кристаллическую твердую фазу растворяют в горячем этилацетате, содержащем достаточно 2-пропанола для полного растворения После охлаждения до 0°С отфильтровывают 2,3 г кристаллической твердой фазы имеющей энантиомерный избыток > 95% Форму свободного основания получают, разделяя соль между водным раствором бикарбоната натрия и этилацетатом Органическую фазу отделяют, сушат над карбонатом калия, фильтруют и концентрируют в вакууме, получая 0,77 г целевого соединения ЕЮН) АДМС m/z = 242 (М+Н) Оптическое вращение ар = - 5,15°(с = 1, Расчетный состав для C12H19NO4 С - 59,74, Н-7,94, N-5,81% Фактический состав С - 59,68, Н - 8,13, N 5,58% Пример 7. (+)-Диэтил-2-аминобицикло[3 1 0]гексан-2,6дикарбоксилат(5) Маточники из примера 6 сливают и концентрируют в вакууме Кислую присоединенную соль переводят в свободное основание, разделяя ее между водным раствором бикарбоната натрия и этилацетатом Органическую фазу отделяют, сушат над карбонатом калия и концентрируют в вакууме, получая 3,7 г масла Это масло обрабатывают (-)ди-р-толуоил-І_-винной кислотой (раствором 7,14 г в 100 мл этилацетата) Выстояв ночь при комнатной температуре, кристаллы отфильтровывают и сушат Кристаллическую твердую фазу растворяют в горячем этилацетате, содержащем достаточно 2-пропанола для полного растворения После охлаждения до 0°С кристаллы отфильтровывают и получают 2,25 г целевого соединения с энантиомерным избытком > 95% Форму свободного основания целевого соединения получают по существу, как описано выше, в количестве 0,74 г АДМС m/z = 242 (М+Н) Расчетный состав для C12H19NO4 С - 59,74, Н - 7,94, N-5,81% Фактический состав С - 59,78, Н - 8,13, N 5,77% Пример 4. (1SR, 2SR, 5RS, 6SR)2-aMHHo6H4Hmo[3 1 0]гексан-2,6-дикарбоновая кислота (3) 3,1 г соединения, полученного в примере 3, растворяют в 25 мл 2N гидроксида натрия и 25 мл тетрагидрофурана перемешивают при комнатной температуре Через 18 часов удаляют под вакуумом тетрагидрофуран, а рН оставшегося раствора корректируют до 9 Целевое соединение очищают ионообменной хроматографией, элюируют 50%ным водным раствором уксусной кислоты и получают 2,12 г конечного продукта Точка плавления >250°С (разложения) АДМС m/z = 186 (М+Н) Расчетный состав для C8H11NO4 С - 51,89, Н - 5,99, N - 7,56% Фактический состав С - 51,74, Н - 6,15, N 7,45% Пример 5. (1SR, 2SR, 5RS, 6SR)flH3THn-2-aMHHo6HqHKло[3 1 0]гексан-2,6-дикарбокислат(2)гидрохлорид 2,41 г соединения полученного в примере 3, растворяют в 75 мл диэтилэфира, помешивая при комнатной температуре, и пропускают над поверхностью раствора газообразную соляную кислоту, пока не прекратится образование соли Еще через пять минут соль отфильтровывают, промывают холодным диэтилэфиром и сушат в вакууме при 60°С около 18 часов, получая 2,75 г целевого соединения Точка плавления 189-191 °С АДМС m/z = 242 (М+Н) Расчетный состав для C12H20CINO4 С 51,89, Н-7,26, N-5,04% Фактический состав С - 52,03, Н - 7,48, N 5,06% Пример 6. (-)-Диэтил-2-аминобицикло[3 1 0]гексан-2,6дикарбоксилат(4) Раствор 6,56 г рацемической смеси соединений, полученных в примере 3, в 100 мл этилацетата обрабатывают раствором 12,0 г (+)-ди-ртолуоил-О-винной кислоты в 100 мл этилацетата Выстояв ночь при комнатной температуре, отфильтровывают кристаллическую твердую фазу и ЕЮН) АДМС m/z = 242 (М+Н) Оптическое вращение ар =7,22° (с = 1, Расчетный состав для C12H19NO4 С - 59,74, Н-7,94, N-5,81% Фактический состав С - 59,81, Н - 7,88, N 5,76% Пример 8. (+)-2-аминобицикло[3 1 0]гексан-2,6-дикарбоновая кислота (6) 0,69 г раствора соединения, полученного в примере 6, в 10 мл тетрагидрофурана обрабатывают 10 мл 1N гидроксида натрия, полученную смесь энергично перемешивают при комнатной температуре Через несколько дней целевое соединение выделяют анионообменной хроматографией (Вю-Rad AG1-x8), элюируют 50%-ным водным раствором уксусной кислоты и получают 0,53 г целевого соединения АДМС m/z = 186 (М+Н) Оптическое вращение ар = 21,32° (с = 1,1 N HCI) Расчетный состав для C8H11NO4 1.25H2O С - 46,26, Н - 6,55, N -6,74% Фактический состав С - 46,68, Н - 6,47, N 6,49% 16 43332 Пример 9. (-)-2-аминобицикло[3 1 0]гексан-2,6-дикарбоновая кислота (7) Указанное соединение готовят по существу, как описано в примере 8, из соединения, полученного в примере 7 (0,59 г) Через несколько дней целевое соединение выделяют анионообменной хроматографией (Вю-Rad AG1-x8), элюируют50%ным водным раствором уксусной кислоты и получают 0,45 г целевого соединения АДМС m/z = 186 (М+Н) Оптическое вращение ао=-22,72° (с =1,1 N HCI) Расчетный состав для C8H11NO4 H2O С 47,29, Н - 6,45, N - 6,89% Фактический состав С - 47,50, Н - 6,62, N 6,31% Пример 10. (1SR, 2SR, 5RS, 6RS) 2-аминобицикпо[3 1 0]гексан-2,6-дикарбоновая кислота (8) Указанное соединение готовят из (1SR, 2SR, 5RS, 6RS) 2-аминобицикло[3 1 0]гексан-2,6-дикарбоксилата по существу, как в примере 3 и 4 Пример 11. (+)-диэтил-2-аминобицикло[3 1 0]гексан-2,6дикарбоксилат гидрохлорид Над поверхностью раствора соединения по примеру 6 в 75 мл безводного диэтилэфира пропускают безводный HCI - газ при 0°С, пока не завершится образование белого осадка Полученную суспензию перемешивают 2 часа при комнатной температуре Затем реакционную смесь разбавляют 100 мл диэтилэфира и фильтруют под вакуумом Осадок промывают 250 мл Et20 и сушат в вакууме 4 часа при 70°С, получая 2,32 г (8,4 ммоля) целевого соединения (выход 77%) Точка плавления 138-140°С АДМС = 242 М++1 Оптическое вращение [а]о = +35,52° (с = =0,09, Н2О) Расчетный состав для C12H20NCIO4 С 51,89, Н - 7,26, N-5,04% Фактический состав С - 51,61, Н - 7,32, N 4,99% Пример 12. (+)-[1R-(1a, 1aa, 1bp, 2b, 5a, 5ар, 6аа)]-1,1а, 1Ь, 2, 5, 5а, 6, 6а-астагидро-6-оксо-2,5-метанциклопроп[а]инден-1-карбоновая кислота, этилэфир Суспензию 8,46 г (36,9 ммоля) карбоксиметилдиметилсульфонийбромида в 27 мл ацетонитрила в атмосфере азота при комнатной температуре обрабатывают 5,52 мл (36,3 ммоля) 1,8диазобицикло[5 4 0]ундец-7-ена После перемешивания 1 час полученную желтую смесь обрабатывают 3,60 г (24,6 ммоля) (3aR)-3a ,4,7,7aaтетрагидро-4а,7а метан-1 Н-инден-1 -она в твердом виде порциями в течение 3 минут Коричневой реакционной смеси дают перемешиваться 15 часов при комнатной температуре Реакцию гасят 13 мл 5%-ной HCI, разбавляют 50 мл рассола и промывают трижды по 50 мл метил+бутилэфира Все органические выдержки сушат над MgSO4, фильтруют и концентрируют в вакууме, получая 5,98 г коричневого масла Хроматография (100 г силикагеля, элюат - гексаны этилацетат 8 1, затем 2 1) сырого масла дает 5,0 г (выход 88%) целевого соединения в виде бесцветного масла, которое жидкостная хроматография высокого разрешения определяет как одиночный диастереомер [a] D + 112° (с = 1,39, МеОН), Rf 0,55 (гексаны этилацетат 2 1), ИК (СНСІз) 2982 (w), 2938 (w), 1720 (s), 1276 (m), 1185 (m), 1048 (w) см 1 , 1Н ЯМР (CDCI3) 5 6,18 (dd, 1H, J = 5,6, 2,9 Гц), 4,14 (q, 2H, J = 7,1 Гц), 3,24 (br s, 1H), 3,13 (br s, 1H), 2,86 (dd, 1H, J = 6,9, 4,1 Гц), 2,64 (dd, 1H, J = 6,9, 5,1 Гц), 2,21-2,16 (m, 2H), 1,88 (t, 1H, J = 3,0 Гц), 1,57 и 1,37 (AB квартет, 2Н, J = 8,5 Гц), 1,26 (t, 3H, J = 7,1 Гц), hC ЯМР (CDCI3) 5 213,31, 170,78, 135,59, 134,16, 61,56, 51,47, 51,17, 46,45 (2 атома углерода), 44,20, 39,76, 32,75, 25,76, 14,56 Расчетный состав для СиНібОз С - 72,39, Н - 6,94% Фактический состав С - 72,63, Н - 7,08% Пример 13. (+)-[1(R),5(S),6(R)]-6H4Himo[3 1 0]гексан-3-ен2-он-6-карбоновая кислота, этилэфир Раствор 4,89 г (21,1 ммоля) продукта по примеру 12 в 14 мл сухого диметилсульфоксида нагревают до флегмы при одновременном перемешивании и продувке азотом (с помощью подповерхностной иглы) с целью отгонки выделяющегося циклопентадиена в течение 24 часов Реакционную смесь охлаждают до комнатной температуры, разбавляют 100 мл метил-1:-бутилэфира и промывают один раз 50 мл воды Водяной слой промывают один раз 25 мл метил-1:-этилэфира и сушат все органические вытяжки над MgSO4, фильтруют и концентрируют в вакууме до светложелтой твердой фазы Из смеси гексанов и метилt-бутилэфира кристаллизуют сырой циклопентенон, выход целевого соединения 1,91 г (55%), точка плавления 96-98°С, [a] 2 5 D + 251° (с = 1,12, МеОН), Rf 0,49 (гексаны этилацетат 2 1), ИК (КВг) 2997 (w), 1728 (s), 1747 (s), 1696 (s), 1292 (m), 1266 (s), 1190 (s), 1177 (s) см \ 1Н ЯМР (CDCI3) 5 7,61 (dd, 1H, J = 5,6, 2,5 Гц), 5,74 (d, 1H, J = 5,6 Гц), 4,15 (q, 2H, J = 7,1 Гц), 2,96-2,94 (m, 1H), 2,62 (br t, 1H, J = 3,9 Гц), 2,26 (t, 1H, J = 2,8 Гц), 1,27 (t, 3H, J = =7,1 Гц), ^3С ЯМР (CDCI3) 5 203,56, 168,28, 159,96, 129,99, 61,70, 46,19, 30,39, 29,28, 14,49 Расчетный состав для СдНюОз С - 65,05, Н - 6,07% Фактический состав С - 64,78, Н - 6,24% Пример 14. (-)-[1(R),5(S),6(R)]-6H4HKno[3 1 0]гексан-3-ен2-он-6-карбоновая кислота, этилэфир 1,73 г (10,4 ммоля) продукта из примера 13 растворяют в 35 мл 95%-ного этанола в атмосфере азота и обрабатывают 10% Pd/C (87 мг, 5 мае %) Колбу продувают азотом и непрерывно перемешивают в атмосфере водорода (давление в баллоне) 5 часов, добавляя тем временем еще 35 мг (2 мае %) 10% Pd/C Смеси дают перемешиваться в атмосфере водорода еще 50 мин Колбу продувают азотом и отфильтровывают катализатор через целит и промывают этилацетатом Фильтрат и отмывки концентрируют в вакууме до желтой твердой фазы (1,75 г) Сырую твердую фазу кристаллизуют из смеси гексанов и метил+бутилэфира, получая 1,38 г целевого продукта (выход 79%) точка плавления 63-65°С, [а]25р -60° (с = =1,34, МеОН), Rf 0,49 (гексаны этилацетат 2 1), ИК (КВг) 2987 (w), 1722 (s), 1410 (m), 1193 (s), 1009 (m), 827 (m) см \ 1H ЯМР (CDCI3) 5 4,16 (q, 2H, J = =7,1 Гц), 2,52 (q, 1H, J = 4,9 Гц), 2,29-2,22 (m, 2H), 17 43332 2,17-2,00 (m, 4H), 1,28 (t, 3H, J = 7,1 Гц), "С ЯМР (CDCI3) 5 212,07, 170,80, 61,64, 36,17, 32,30, 29,59, 26,91, 22,87, 14,56 Расчетный состав для С9Н12О3 С - 64,27, Н 7,19% Фактический состав С - 64,10, Н - 7,31% слота Пример 17. 2-оксибицикло[3 1 0]гексан-6-карбоновая ки Смесь 60 г этил-2-оксибицикло[3 1 0]гексан6-карбоксилата и 300 мл 1N гидроксида натрия перемешивают при 25-30°С Через 2,5 часа добавляют концентрированную соляную кислоту для корректировки рН до 0,8-1,2 Полученный раствор экстрагируют этилацетатом Вытяжки сушат над сульфатом магния, фильтруют и концентрируют с получением 49,1 сырого материала (выход 98%) Перекристаллизация из 100 мл этилацетата дает целевое соединение с точкой плавления 123,5128°С АДМС m/z = 140 (М+) Расчетный состав для СуНвОз С - 60,00, Н 5,75% Фактический состав С - 60,14, Н - 5,79% Пример 18 2-оксобицикло[3 1 0]гексан-6-карбоновая кислота, соль с (3)-1-фенилэтиленамином Раствор 14 г соединения, полученного в примере 17, в 140 мл 25%-ного этанола в этилацетате сливают с 1 г-экв (3)-1-фенилэтиленамина После перемешивания за ночь осадок соли отфильтровывают и сушат, получая 11,87 г целевой соли (выход 45,4%) Соль переводят в частично разделенную 2-оксибицикло[3 1 0]гексан-6-карбоновую кислоту, как описано в примере 17, и анализ показывает, что соль на 68% ее Энантиомерный избыток определяют конверсией диазометаном в метилэфир и хиральной высокоточной жидкостной хроматографией в колонке Хиральпак AS при 40°С, элюированием смесью 10% изопропана и 90% гексана со скоростью 1 мл/мин, обнаружение ведут на 210 нм Пример 15. (+)-[1(R), 2(R), 5(S), 6(R), 5'(Р)]-2-спиро-5'-гидантоинбицикло[3 1 0]гексан-6-карбоновая кислота, этилэфир Смесь 1,20 г (7,13 ммоля) продукта из примера 14, 511 мг (7,85 ммоля) цианида калия и 1,37 г (7,13 ммоля) карбоната аммония в 7,1 мл 95%ного этанола и 2,9 мл воды перемешивают 10 часов при 36°С и 13 часов при комнатной температуре Хлопьевидную желтую реакционную смесь охлаждают до 0°С и разбавляют 7,8 мл холодной воды После 1,5 часов перемешивания собирают белый осадок и дважды промывают 5 мл холодной воды Твердую фазу сушат в вакууме и получают 1,17 г (выход 69%) целевого соединения в виде одиночного диастереомера по данным высокоточной жидкостной хроматографии точка плавления 247-249°С [a] 2 5 D + 23° (с = 1,05, МеОН), ИК (КВг) 3504 (т), 3262 (т), 2983 (w), 2766 (w), 1771 (т), 1723 (s), 1415 (т), 1182 (w) см \ 1Н ЯМР (flMCO-d6) 5 10,58 (s, 1H), 7,93 (s, 1H), 4,06 (q, 2H, J = 7,1 Гц), 2,08-2,01 ( т , 1Н), 1,94-1,83 ( т , 4Н), 1,79 (dd, 1H, J = 13,9, 8,5 Гц), 1,40-1,33 ( т , 1Н), 1,20 (t, ЗН, J = =7,1 Гц), 13С ЯМР (ДМСО-de) 5 178,30, 172,62, 157,01, 69,52, 61,04, 33,86, 30,37, 28,27, 26,49, 20,95, 14,93 Расчетный состав для C11H14N2C4 С - 55,46, Н - 5,92, N-1,76% Фактический состав С - 55,76, Н - 5,95, N 11,84% Пример 19 (+)-2-оксобицикло[3 1 0]гексан-6-карбоновая кислота Смесь 1,31 г продукта из примера 18 и 10 мл 1N соляной кислоты перемешивают 5 минут, и экстрагируют этилацетатом Вытяжки сушат над сульфатом натрия, фильтруют и концентрируют, получая 0,61 г целевого соединения, точка плавления 110-115°С Продукт на 68% ее по данным высокоточной хиральной жидкостной хроматографии (методика по примеру 18) АДМС m/z = 141(M+) Оптическое вращение ар = 49,85° Пример 20. (-)-2-спиро-5'-гидантионбицикло[3 1 0]гексан6-карбоновая кислота Растворы 1 мг-экв вещества, полученного в примере 19 (68% ее), 1,25 мг-экв цианида калия и 2,5 мг-экв карбоната аммония сливают и перемешивают 40 часов, при 25°С в смеси этанола с водой Смесь подкисляют 6N соляной кислотой, концентрируют, разбавляют водой и фильтруют, получая выход 79% смеси 90 10 диастереомеров с точкой плавления 286-290°С Смесь диастереомеров перекристаллизуют из смеси изопропанола с водой и получают выход 48% целевого соединения с чистотой 100% по диастереомерам и 100% по энантиомерам (энантиомерное отношение определяется высокоточной хиральной жидкостной хроматографией в колонке Хиральсел OD-H 4,6x150 мм, элюирование смесью 15% изопро Пример 16. (-)-[1(R), 2(R), 5(S), 6^)]-2-аминобицикло[3 1 0]гексан-2,6-дикарбоновая кислота Раствор 976 мг (4,10 ммоля) продукта из примера 15 в 8,2 мл 3N NaOH нагревают 24 часа до флегмы с перемешиванием После охлаждения до комнатной температуры реакцию переводят непосредственно в ионообменную колонку, (приготовленную из 50 г ацетатной смолы Bio Rad AG1-x8, промытой 50 мл 1N NaOH и затем 50 мл воды, а после контакта с реакционной смесью ее вновь промывают 50 мл 1N NaOH), элюируют смесью 1 1 воды и уксусной кислоты и собирают 50 мл фракций Фракции 2 и 3, содержащие целевой продукт, сливают и концентрируют в вакууме, получая 770 мг белого осадка Его суспендируют в 4 мл воды и фильтруют, промывают один раз 4 мл воды Твердую фазу сушат в вакууме при 40°С, получая 634 мг целевого соединения в виде белого порошка (выход 76%) ИК (КВг), 3235 (br, s), 2971 (m), 2016 (br, w), 1694 (m), 1613 (s), 1509 (m), 1237 (m) см 1 , 1Н ЯМР (трифторуксусная кислотаd) 5 2,76-2,74 (m, 1H), 2,65-2,52 (m, ЗН), 2,38-2,31 (m, 2H), 1,96-1,88 (m, 1H), 13C ЯМР (три фтору ксусная кислота-d) 5 179,43, 175,63, 69,53, 34,92, 31,75, 31,66, 27,63, 23,04 Кристаллизацией из воды получают образец для анализа точка плавления 277-280°С (разложение), [a] 2 5 D -23° (с = 1,35, 1N HCI) 18 43332 Пример 23 2-спиро-5'-гидантоинбицикло[3 1 0]гексан-6-карбоновая кислота, (3)-1-фенилэтиламиновая соль Смесь 1,05 г продукта из примера 22 и 16,6 мл раствора 1,61 ацетона воды перемешивают при 25°С, добавляя 1,53 г Р-(+)-фенилэтиламина Смесь перемешивают 2 часа при комнатной температуре Кристаллы отфильтровывают, промывают ацетоном и сушат, получая 0,74 г целевого соединения (выход 45%) с точкой плавления 205-212°С Оптическое вращение ар = -31,88° (с = 1, метанол) Пример 24 (-)-2-спиро-5'-гидантоинбицикло[3 1 0]гексан6-карбоновая кислота Смесь 0,74 г продукта из примера 23 и 10 мл воды перемешивают при 25°С, корректируя рН от 6,81 до 1,0 1N HCI Смесь перемешивают 1 час, продукт отфильтровывают и сушат, получая 0,35 г (выход 75%) целевого соединения с точкой плавления 310°С (разложение) АДМС 210,1 (М+) Оптическое вращение ар = -24,22° (с = 1, метанол) Расчетный состав для C9H10N2O4, С - 51,43, Н-4,80, N-13,33% Фактический состав С - 51,67, Н - 4,87, N 13,61% панола и 85% гексана на скорости 1 мл/мин при 40°С, обнаружение на 220 нм, диастереомерное отношение определялось высокоточной жидкостной хроматографией в колонке Зорбакс SB-фенил при 40°С, элюирование смесью 90 10 буфера с ацетонитрилом со скоростью 2 мл/мин, обнаружение на 220 нм (буфером служил раствор 0,1 М двухосновного моногидрата фосфата натрия с рН, скорректированным фосфорной кислотой до 2,1) АДМС m/z = 211 (M+H) Оптическое вращение ар = -25,98° Расчетный состав для C9H10N2O4, С - 51,43, Н - 4,79, N-13,33% Фактический состав С - 51,38, Н - 4,80, N 13,26% Пример 21. Этил-2-спиро-5'-гидантоинбицикло[3 1 Олекса н-6-карбоксил ат Смесь 5,05 г этил-2-оксобицикло[3 1 Олекса н-6-карбоксил ата, 2,15 г цианида калия, 5,77 г карбоната аммония, 30 мл этанола 2В-3 и 12 мл воды перемешивают при 35°С до завершения реакции по данным высокоточной хроматографии Через 15 часов реакционную смесь охлаждают до 0°С и добавляют к ней 33 мл воды После 2 часов при 0°С осадок отфильтровывают и сушат, получая 5,23 г (выход 73%) целевого соединения с точкой плавления 217-220°С АДМС m/z = 238 (М+) Расчетный состав для C11H14N2C4, С - 55,46, Н-5,92, N-11,76% Фактический состав С - 55,74, Н - 5,88, N 11,50% Пример 22 2-спиро-5'-гидантоинбицикло [3 1 0] гексан6-карбоновая кислота Смесь 16,32 г продукта из примера 21 и 137 мл 2N NaOH перемешивают при 25°С Через 1 час концентрированной соляной кислотой корректируют рН до 1,0 Выпавший осадок отфильтровывают и сушат, получая 13,70 г целевого соединения (выход 95%) с точкой плавления 277279°С АДМС m/z = 210,1 (М+) Расчетный состав для C9H10N2O4, С - 51,43, Н-4,79, N-13,33% Фактический состав С - 51,70, Н - 4,93, N 13,43% Пример 25 (+)-2-аминобицикло[3 1 0]гексан-2,6-дикарбоновая кислота Раствор 184 г (-)-2-спиро-5'-гидантоинбицикло[3 1 0]гексан-6-карбоновой кислоты в 1750 мл 3N NaOH нагревают до флегмы, завершение реакции устанавливают высокоточной хроматографией Через 28 часов раствор охлаждают до комнатной температуры и фильтруют через бумагу из стекловолокна для удаления следов нерастворимых примесей рН раствора корректируют концентрированной HCI до 3,0 Смесь перемешивают 1 час при комнатной температуре и 2 часа при 0°С Осадок отфильтровывают, промывают 170 мл холодной воды и сушат, получая 152,5 г (выход 86%) целевого соединения АДМС m/z = 186,1 (М+1) Оптическое вращение ар = -23,18° (с = 1,1 N HCI) Тираж 50 екз Відкрите акціонерне товариство «Патент» Україна, 88000, м Ужгород, вул Гагаріна, 101 (03122) 3 - 7 2 - 8 9 (03122) 2 - 5 7 - 0 3 19 43332 Зам № 28 Зам № 28 Зам № 28 Зам № 28 20
ДивитисяДодаткова інформація
Автори англійськоюMonn James Allen
Автори російськоюМонн Джеймс Аллен
МПК / Мітки
МПК: A61K 31/00, C07D 235/02, A61K 31/198, C07C 62/00, A61K 31/195, A61P 25/18, C07C 229/50, C07C 69/757, A61K 31/215, C07D 233/78
Мітки: містить, композиція, фармацевтична, сполуки, 2-амінобіцикло[3.1.0]гексан-2,6-дикарбонової, одержання, спосіб, цієї, проміжна, похідним, сполука, сполуку, кислоти
Код посилання
<a href="https://ua.patents.su/20-43332-spoluka-shho-eh-pokhidnim-2-aminobiciklo310geksan-26-dikarbonovo-kisloti-sposib-oderzhannya-cieh-spoluki-farmacevtichna-kompoziciya-shho-mistit-cyu-spoluku-promizhna-spoluka.html" target="_blank" rel="follow" title="База патентів України">Сполука, що є похідним 2-амінобіцикло[3.1.0]гексан-2,6-дикарбонової кислоти, спосіб одержання цієї сполуки, фармацевтична композиція, що містить цю сполуку, проміжна сполука</a>
Попередній патент: Пристрій для тренування дихання
Наступний патент: Спосіб одержання карбамідформальдегідних смол
Випадковий патент: Рідинно-краплинний радіатор