Штам mva-bn модифікованого вірусу коров’ячої віспи ankara, фармацевтична композиція, вакцина, застосування mva-bn для приготування лікарського препарату та для приготування вакцини, спосіб введення гомологічної
Формула / Реферат
1. Штам MVA-BN модифікованого вірусу коров'ячої віспи Ankara, депонований в Європейській колекції клітинних культур (ЕСАСС), Солсбері (UK), під номером V00083008, та його похідні, що мають принаймні одну з таких властивостей:
(і) здатність до репродукції шляхом реплікації у фібробластах ембріонів курчат (CEF) і в лінії клітин нирок дитинчат хом'яка ВНК, але нездатність до репродукції шляхом реплікації у клітинних лініях людини,
(іі) нездатність до реплікації in vivo в моделі миші з істотно порушеним імунітетом,
(ііі) індукцію більш сильного імунітету в порівнянні з відомим штамом MVA 575 у моделі летального зараження, і/або
(iv) індукцію, принаймні за вмістом, того самого рівня імунітету при режимах первинної імунізації вірусом коров'ячої віспи/повторної імунізації вірусом коров'ячої віспи у порівнянні з режимами первинної імунізації ДНК/повторної імунізації вірусом коров'ячої віспи.
2. Штам MVA-BN модифікованого вірусу коров'ячої віспи Ankara та його похідні за п. 1, який (і) здатний до репродукції шляхом реплікації у фібробластах ембріонів курчат (CEF) і в лінії клітин нирок дитинчат хом'яка ВНК, але не здатний до репродукції шляхом реплікації у клітинних лініях людини та (іі) не здатний до реплікації in vivo в моделі миші з істотно порушеним імунітетом.
3. MVA-BN або його похідна за пп. 1 або 2, де клітинні лінії людини являють собою клітинну лінію остеосаркоми кістки людини 143В, клітинну лінію кератиноцитів людини HaCat і клітинну лінію аденокарциноми шийки матки людини HeLa.
4. MVA-BN або його похідна за будь-яким з пп. 1-3, де миші з істотно порушеним імунітетом не здатні продукувати зрілі В і Т клітини.
5. MVA-BN або його похідна за будь-яким з пп. 1-4, що піддані очищенню клона.
6. MVA-BN або його похідна за будь-яким з пп. 1-5, що включає принаймні одну послідовність гетерологічної нуклеїнової кислоти.
7. MVA-BN або його похідна за п. 6, де послідовність гетерологічної нуклеїнової кислоти вибрана з послідовності, що кодує принаймні один антиген, антигенний епітоп і/або терапевтичну сполуку.
8. MVA-BN або його похідна за п. 7, де антигенні епітопи вибрані з вірусів сімейства Influenza virus, Flaviviruses, Paramyxoviruses, вірусів гепатиту, вірусів імунодефіциту людини або з вірусів, що викликають геморагічну лихоманку.
9. MVA-BN за будь-яким з пп. 6-8, де послідовність гетерологічної нуклеїнової кислоти є геном nef.
10. MVA-BN або його похідна за будь-яким з пп. 1-9 для впливу на імунну відповідь, переважно для її індукції, у живій тварині, включаючи людину.
11. MVA-BN або його похідна за будь-яким з пп. 1-9 для вакцинації живої тварини, включаючи людину, проти віспи людини.
12. MVA-BN або його похідна за п. 11, де віспа людини являє собою натуральну віспу.
13. MVA-BN або його похідна за будь-яким з пп. 10-12, де тварина, включаючи людину, має порушений імунітет.
14. MVA-BN або його похідна за будь-яким з пп. 10-13, де тварина, включаючи людину, має вже існуючий імунітет до вірусів віспи.
15. MVA-BN або його похідна за будь-яким з пп. 10-14, де тварина, включаючи людину, піддається противірусній терапії.
16. MVA-BN або його похідна за п. 15, де противірусна терапія являє собою терапію проти ретровірусів.
17. Геном MVA-BN або його похідна за будь-яким з пп. 1-9.
18. Геном за п. 17 для впливу на імунну відповідь, переважно її індукцію, у живій тварині, включаючи людину.
19. Геном за п. 17 для вакцинації живої тварини, включаючи людину, проти віспи людини.
20. Геном за п. 19, який відрізняється тим, що віспа людини являє собою натуральну віспу.
21. Геном за будь-яким з пп. 17-20, де тварина, включаючи людину, має порушений імунітет.
22. Геном за будь-яким з пп. 17-21, де тварина, включаючи людину, має вже існуючий імунітет стосовно вірусів віспи.
23. Геном за будь-яким з пп. 17-22, де тварина, включаючи людину, піддається противірусній терапії.
24. Геном за п. 23, де противірусна терапія являє собою терапію проти ретровірусів.
25. Фармацевтична композиція, що включає MVA-BN або його похідну за будь-яким з пп. 1-9 та фармацевтично прийнятний носій, розріджувач і/або добавку.
26. Фармацевтична композиція за п. 25, яка містить принаймні 102 TCID50 MVA-BN або його похідної.
27. Композиція за п. 25 або 26 для впливу на імунну відповідь, переважно для її індукції, в живій тварині, включаючи людину.
28. Композиція за пп. 25-27 для вакцинації живої тварини, включаючи людину, проти віспи людини.
29. Композиція за п. 28, де віспа людини являє собою натуральну віспу.
30. Композиція за будь-яким з пп. 25-29, де тварина, включаючи людину, має порушений імунітет.
31. Композиція за будь-яким з пп. 25-30, де тварина, включаючи людину, має вже існуючий імунітет стосовно вірусів віспи.
32. Композиція за будь-яким з пп. 25-31, де тварина, включаючи людину, піддається противірусній терапії.
33. Композиція за п. 32, де противірусна терапія являє собою терапію проти ретровірусів.
34. Фармацевтична композиція, що включає геном за п. 17 та фармацевтично прийнятний носій, розріджувач і/або добавку.
35. Композиція за п. 34 для впливу на імунну відповідь, переважно її індукцію, в живій тварині, включаючи людину.
36. Композиція за будь-яким з пп. 34, 35 для вакцинації живої тварини, включаючи людину, проти віспи людини.
37. Композиція за п. 36, де віспа людини являє собою натуральну віспу.
38. Композиція за будь-яким з пп. 34-37, де тварина, включаючи людину, має порушений імунітет.
39. Композиція за будь-яким з пп. 34-38, де тварина, включаючи людину, має вже існуючий імунітет до вірусів віспи.
40. Композиція за будь-яким з пп. 34-39, де тварина, включаючи людину, піддається противірусній терапії.
41. Композиція за п. 40, де противірусна терапія являє собою терапію проти ретровірусів.
42. Вакцина, що містить MVA-BN або його похідну за будь-яким з пп. 1-9.
43. Вакцина за п. 42, яка містить принаймні 102 TCID50 MVA-BN або його похідної.
44. Вакцина за будь-яким з пп. 42 або 43 для впливу на імунну відповідь, переважно її індукцію, в живій тварині, включаючи людину.
45. Вакцина за будь-яким з пп. 42-44 для вакцинації живої тварини, включаючи людину, проти віспи людини.
46. Вакцина за п. 45, де віспа людини являє собою натуральну віспу.
47. Вакцина за будь-яким з пп. 42-46, де тварина, включаючи людину, має порушений імунітет.
48. Вакцина за будь-яким з пп. 42-47, де тварина, включаючи людину, має вже існуючий імунітет до вірусів віспи.
49. Вакцина за будь-яким з пп. 42-48, де тварина, включаючи людину, піддається противірусній терапії.
50. Вакцина за п. 49, де противірусна терапія являє собою терапію проти ретровірусів.
51. Вакцина, що містить геном за п. 17.
52. Вакцина за п. 51 для впливу на імунну відповідь, переважно її індукцію, у живій тварині, включаючи людину.
53. Вакцина за будь-яким з пп. 51, 52 для вакцинації живої тварини, включаючи людину, проти віспи людини.
54. Вакцина за п. 53, де віспа людини являє собою натуральну віспу.
55. Вакцина за будь-яким з пп. 51-54, де тварина, включаючи людину, має порушений імунітет.
56. Вакцина за будь-яким з пп. 51-55, де тварина, включаючи людину, має вже існуючий імунітет стосовно вірусів віспи.
57. Вакцина за будь-яким з пп. 51-56, де тварина, включаючи людину, піддається противірусній терапії.
58. Композиція за п. 57, де противірусна терапія являє собою терапію проти ретровірусів.
59. MVA-BN або його похідна за будь-яким з пп. 6-9 для введення гомологічної і/або гетерологічної послідовності нуклеїнової кислоти в клітини-мішені.
60. Геном за п. 17 для введення гомологічної і/або гетерологічної послідовності нуклеїнової кислоти в клітини-мішені.
61. Застосування MVA-BN або його похідної за будь-яким з пп. 1-9 для приготування лікарського препарату.
62. Застосування за п. 61, де лікарський препарат вводять для індукування імунологічної відповіді в живій тварині, включаючи людину.
63. Застосування за будь-яким з пп. 61, 62, де лікарський препарат призначений проти віспи людини.
64. Застосування за п. 63, де віспа людини являє собою натуральну віспу.
65. Застосування за будь-яким з пп. 61-64, де лікарський препарат містить принаймні 102 TCID50 MVA-BN або його похідної.
66. Застосування за будь-яким з пп. 61-65, де MVA-BN або його похідну вводять у терапевтично ефективних кількостях при першій інокуляції ("основна (priming) інокуляція") і при другій інокуляції ("бустерна інокуляція").
67. Застосування за будь-яким з пп. 61-66, коли тварина має порушений імунітет.
68. Застосування за будь-яким з пп. 61-67, коли тварина, включаючи людину, має вже існуючий імунітет стосовно вірусів віспи.
69. Застосування за будь-яким з пп. 61-68, коли тварина, включаючи людину, піддається противірусній терапії.
70. Застосування за п. 69, коли противірусна терапія являє собою терапію проти ретровірусів.
71. Застосування MVA-BN або його похідної за будь-яким з пп. 1-9 для приготування вакцини.
72. Застосування за п. 71, де вакцину вводять для індукування імунологічної відповіді в живій тварині, включаючи людину.
73. Застосування за будь-яким з пп. 71, 72, де вакцина призначена проти віспи людини.
74. Застосування за п. 73, де віспа людини являє собою натуральну віспу.
75. Застосування за будь-яким з пп. 71-74, де вакцина містить принаймні 102 TCID50 MVA-BN або його похідної.
76. Застосування за будь-яким з пп. 71-75, де MVA-BN або його похідну вводять у терапевтично ефективних кількостях при першій інокуляції (основна інокуляція) і при другій інокуляції (бустерна інокуляція).
77. Застосування за будь-яким з пп. 71-76, коли тварина має порушений імунітет.
78. Застосування за будь-яким з пп. 71-77, коли тварина, включаючи людину, має вже існуючий імунітет до вірусів віспи.
79. Застосування за будь-яким з пп. 71-78, коли тварина, включаючи людину, піддається противірусній терапії.
80. Застосування за п. 79, коли противірусна терапія являє собою терапію проти ретровірусів.
81. MVA-BN або його похідні за будь-яким з пп. 1-9 як ад'ювант.
82. Застосування MVA-BN або його похідної за будь-яким з пп. 1-9 як ад'юванта.
83. Спосіб введення гомологічної і/або гетерологічної послідовності нуклеїнової кислоти в клітини-мішені in vitro, що включає інфікування клітин-мішеней MVA-BN або його похідною за будь-яким з пп. 6-9.
84. Спосіб введення гомологічної і/або гетерологічної послідовності нуклеїнової кислоти в клітини-мішені in vitro, що включає трансфекцію клітини-мішені геномом за п. 17.
85. Спосіб одержання пептиду або білка, що включає
a) інфікування клітини-хазяїна MVA-BN або його похідною за будь-яким з пп.1-9,
b) культивування інфікованої клітини-хазяїна в придатних умовах, і
c) виділення і/або підвищення концентрації пептиду та/або білка, що продукуються зазначеною клітиною-хазяїном.
86. Спосіб одержання MVA-BN або його похідної, що включає
a) інфікування клітини-хазяїна MVA-BN або його похідною за будь-яким з пп.1-9,
b) культивування інфікованої клітини-хазяїна в придатних умовах, і
c) виділення і/або підвищення концентрації MVA-BN або його похідної, що продукуються зазначеною клітиною-хазяїном.
87. Клітина, що містить MVA-BN або його похідну за будь-яким з пп. 1-9.
88. Клітина за п. 87, зокрема клітина людини.
89. Клітина, що містить геном за п. 17.
90. Клітина за п. 89, зокрема клітина людини.
91. Набір для основної/бустерної імунізації, що включає MVA-BN або його похідну за будь-яким з пп. 1-9, для першої інокуляції (основна інокуляція) у першому флаконі/контейнері і для другої інокуляції (бустерна інокуляція) у другому флаконі/контейнері.
92. Набір для основної/бустерної імунізації, що включає композицію за пп.25-41, для першої інокуляції (основна інокуляція) у першому флаконі/контейнері і для другої інокуляції (бустерна інокуляція) у другому флаконі/контейнері.
93. Набір для основної/бустерної імунізації, що включає вакцину за пп. 42-58, для першої інокуляції (основна інокуляція) у першому флаконі/контейнері і для другої інокуляції (бустерна інокуляція) у другому флаконі/контейнері.
Текст
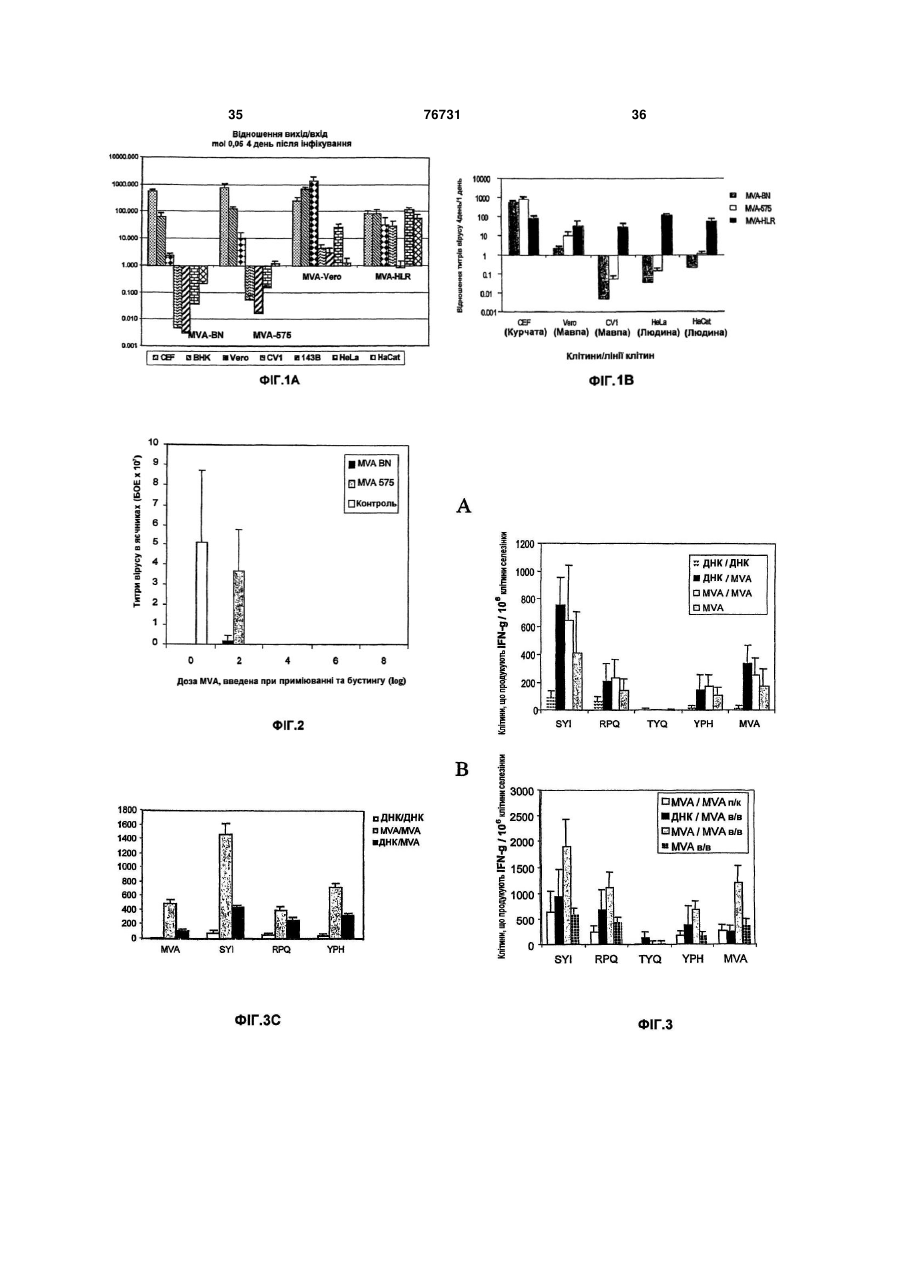
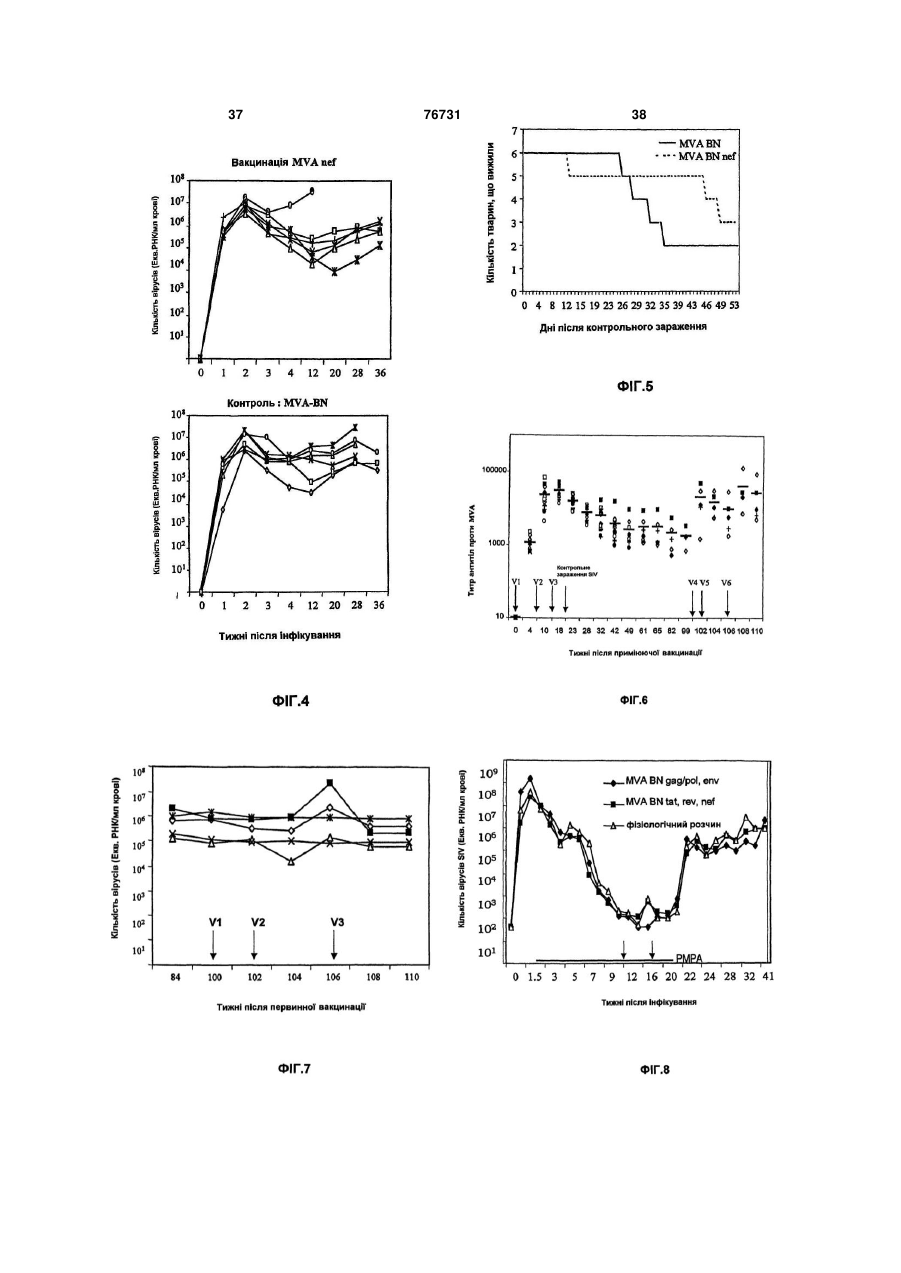
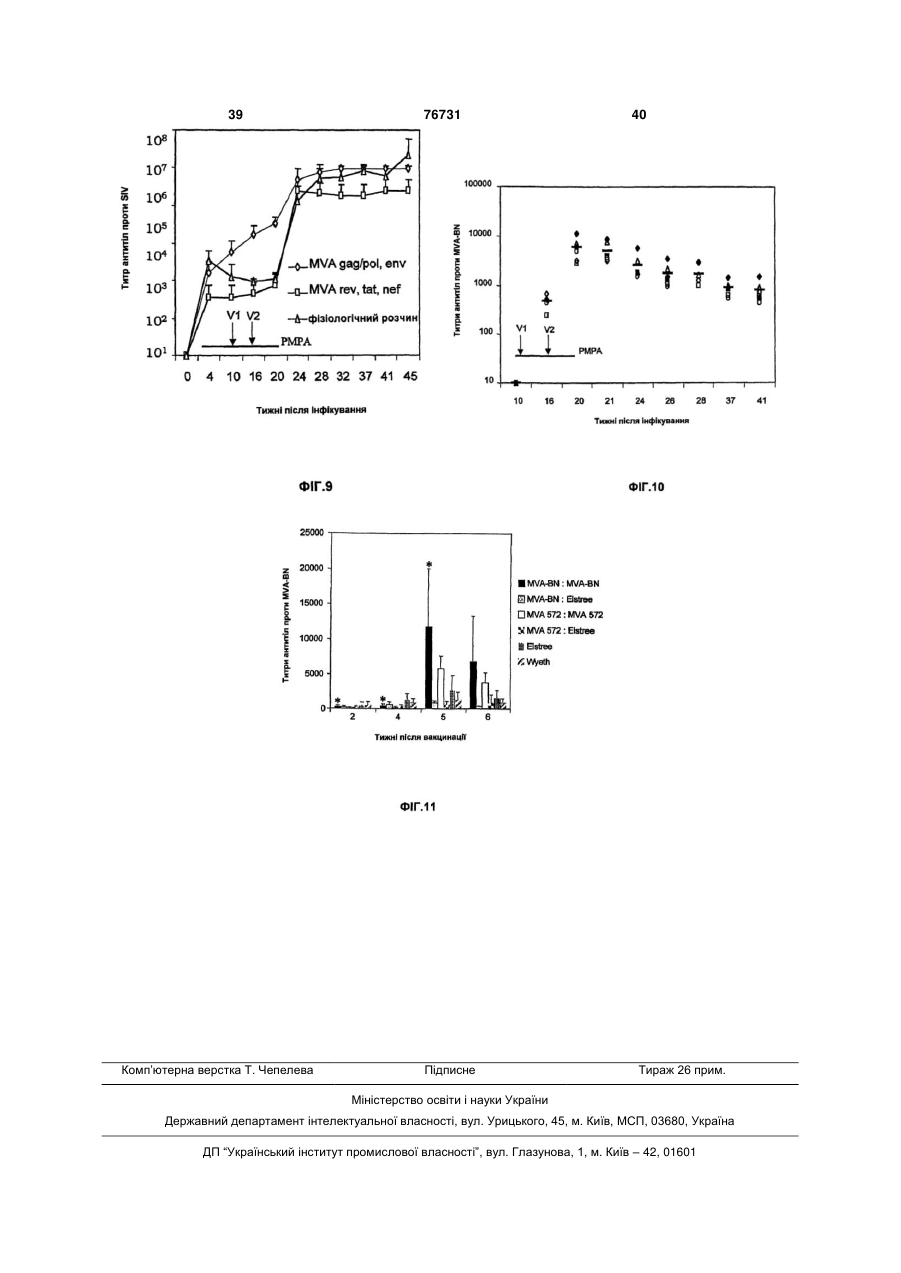
1. Штам MVA-BN модифікованого вірусу коров'ячої віспи Ankara, депонований в Європейській колекції клітинних культур (ЕСАСС), Солсбері (UK), під номером V00083008, та його похідні, що мають принаймні одну з таких властивостей: (і) здатність до репродукції шляхом реплікації у фібробластах ембріонів курчат (CEF) і в лінії клітин нирок дитинчат хом'яка ВНК, але нездатність до репродукції шляхом реплікації у клітинних лініях людини, (іі) нездатність до реплікації in vivo в моделі миші з істотно порушеним імунітетом, (ііі) індукцію більш сильного імунітету в порівнянні з відомим штамом MVA 575 у моделі летального зараження, і/або (iv) індукцію, принаймні за вмістом, того самого рівня імунітету при режимах первинної імунізації вірусом коров'ячої віспи/повторної імунізації вірусом коров'ячої віспи у порівнянні з режимами пер 2 (19) 1 3 76731 4 12. MVA-BN або його похідна за п.11, де віспа лю37. Композиція за п.36, де віспа людини являє содини являє собою натуральну віспу. бою натуральну віспу. 13. MVA-BN або його похідна за будь-яким з пп.1038. Композиція за будь-яким з пп.34-37, де твари12, де тварина, включаючи людину, має порушена, включаючи людину, має порушений імунітет. ний імунітет. 39. Композиція за будь-яким з пп.34-38, де твари14. MVA-BN або його похідна за будь-яким з пп.10на, включаючи людину, має вже існуючий імунітет 13, де тварина, включаючи людину, має вже існудо вірусів віспи. ючий імунітет до вірусів віспи. 40. Композиція за будь-яким з пп.34-39, де твари15. MVA-BN або його похідна за будь-яким з пп.10на, включаючи людину, піддається противірусній 14, де тварина, включаючи людину, піддається терапії. противірусній терапії. 41. Композиція за п.40, де противірусна терапія 16. MVA-BN або його похідна за п.15, де противіявляє собою терапію проти ретровірусів. русна терапія являє собою терапію проти ретрові42. Вакцина, що містить MVA-BN або його похідну русів. за будь-яким з пп.1-9. 17. Геном MVA-BN або його похідна за будь-яким з 43. Вакцина за п.42, яка містить принаймні 102 пп.1-9. TCID50 MVA-BN або його похідної. 18. Геном за п.17 для впливу на імунну відповідь, 44. Вакцина за будь-яким з пп.42 або 43 для вплипереважно її індукцію, у живій тварині, включаючи ву на імунну відповідь, переважно її індукцію, в людину. живій тварині, включаючи людину. 19. Геном за п.17 для вакцинації живої тварини, 45. Вакцина за будь-яким з пп.42-44 для вакцинації включаючи людину, проти віспи людини. живої тварини, включаючи людину, проти віспи 20. Геном за п.19, який відрізняється тим, що людини. віспа людини являє собою натуральну віспу. 46. Вакцина за п.45, де віспа людини являє собою 21. Геном за будь-яким з пп.17-20, де тварина, натуральну віспу. включаючи людину, має порушений імунітет. 47. Вакцина за будь-яким з пп.42-46, де тварина, 22. Геном за будь-яким з пп.17-21, де тварина, включаючи людину, має порушений імунітет. включаючи людину, має вже існуючий імунітет 48. Вакцина за будь-яким з пп.42-47, де тварина, стосовно вірусів віспи. включаючи людину, має вже існуючий імунітет до 23. Геном за будь-яким з пп.17-22, де тварина, вірусів віспи. включаючи людину, піддається противірусній те49. Вакцина за будь-яким з пп.42-48, де тварина, рапії. включаючи людину, піддається противірусній те24. Геном за п.23, де противірусна терапія являє рапії. собою терапію проти ретровірусів. 50. Вакцина за п.49, де противірусна терапія являє 25. Фармацевтична композиція, що включає MVAсобою терапію проти ретровірусів. BN або його похідну за будь-яким з пп.1-9 та фар51. Вакцина, що містить геном за п.17. мацевтично прийнятний носій, розріджувач і/або 52. Вакцина за п.51 для впливу на імунну відподобавку. відь, переважно її індукцію, у живій тварині, вклю26. Фармацевтична композиція за п.25, яка містить чаючи людину. принаймні 102 TCID50 MVA-BN або його похідної. 53. Вакцина за будь-яким з пп.51, 52 для вакцина27. Композиція за п.25 або 26 для впливу на імунції живої тварини, включаючи людину, проти віспи ну відповідь, переважно для її індукції, в живій людини. тварині, включаючи людину. 54. Вакцина за п.53, де віспа людини являє собою 28. Композиція за пп.25-27 для вакцинації живої натуральну віспу. тварини, включаючи людину, проти віспи людини. 55. Вакцина за будь-яким з пп.51-54, де тварина, 29. Композиція за п.28, де віспа людини являє совключаючи людину, має порушений імунітет. бою натуральну віспу. 56. Вакцина за будь-яким з пп.51-55, де тварина, 30. Композиція за будь-яким з пп.25-29, де тваривключаючи людину, має вже існуючий імунітет на, включаючи людину, має порушений імунітет. стосовно вірусів віспи. 31. Композиція за будь-яким з пп.25-30, де твари57. Вакцина за будь-яким з пп.51-56, де тварина, на, включаючи людину, має вже існуючий імунітет включаючи людину, піддається противірусній тестосовно вірусів віспи. рапії. 32. Композиція за будь-яким з пп.25-31, де твари58. Композиція за п.57, де противірусна терапія на, включаючи людину, піддається противірусній являє собою терапію проти ретровірусів. терапії. 59. MVA-BN або його похідна за будь-яким з пп.6-9 33. Композиція за п.32, де противірусна терапія для введення гомологічної і/або гетерологічної являє собою терапію проти ретровірусів. послідовності нуклеїнової кислоти в клітини34. Фармацевтична композиція, що включає геном мішені. за п.17 та фармацевтично прийнятний носій, роз60. Геном за п.17 для введення гомологічної і/або ріджувач і/або добавку. гетерологічної послідовності нуклеїнової кислоти в 35. Композиція за п.34 для впливу на імунну відпоклітини-мішені. відь, переважно її індукцію, в живій тварині, вклю61. Застосування MVA-BN або його похідної за чаючи людину. будь-яким з пп.1-9 для приготування лікарського 36. Композиція за будь-яким з пп.34, 35 для вакципрепарату. нації живої тварини, включаючи людину, проти 62. Застосування за п.61, де лікарський препарат віспи людини. вводять для індукування імунологічної відповіді в живій тварині, включаючи людину. 5 76731 6 63. Застосування за будь-яким з пп.61, 62, де лі82. Застосування MVA-BN або його похідної за карський препарат призначений проти віспи людибудь-яким з пп.1-9 як ад'юванта. ни. 83. Спосіб введення гомологічної і/або гетерологі64. Застосування за п.63, де віспа людини являє чної послідовності нуклеїнової кислоти в клітинисобою натуральну віспу. мішені in vitro, що включає інфікування клітин65. Застосування за будь-яким з пп.61-64, де лімішеней MVA-BN або його похідною за будь-яким карський препарат містить принаймні 102 TCID50 з пп.6-9. MVA-BN або його похідної. 84. Спосіб введення гомологічної і/або гетерологі66. Застосування за будь-яким з пп.61-65, де MVAчної послідовності нуклеїнової кислоти в клітиниBN або його похідну вводять у терапевтично ефемішені in vitro, що включає трансфекцію клітиниктивних кількостях при першій інокуляції ("основна мішені геномом за п.17. (priming) інокуляція") і при другій інокуляції ("бус85. Спосіб одержання пептиду або білка, що вклютерна інокуляція"). чає 67. Застосування за будь-яким з пп.61-66, коли a) інфікування клітини-хазяїна MVA-BN або його тварина має порушений імунітет. похідною за будь-яким з пп.1-9, 68. Застосування за будь-яким з пп.61-67, коли b) культивування інфікованої клітини-хазяїна в тварина, включаючи людину, має вже існуючий придатних умовах, і імунітет стосовно вірусів віспи. c) виділення і/або підвищення концентрації пепти69. Застосування за будь-яким з пп.61-68, коли ду та/або білка, що продукуються зазначеною клітварина, включаючи людину, піддається противітиною-хазяїном. русній терапії. 86. Спосіб одержання MVA-BN або його похідної, 70. Застосування за п.69, коли противірусна теращо включає пія являє собою терапію проти ретровірусів. a) інфікування клітини-хазяїна MVA-BN або його 71. Застосування MVA-BN або його похідної за похідною за будь-яким з пп.1-9, будь-яким з пп.1-9 для приготування вакцини. b) культивування інфікованої клітини-хазяїна в 72. Застосування за п.71, де вакцину вводять для придатних умовах, і індукування імунологічної відповіді в живій тварині, c) виділення і/або підвищення концентрації MVAвключаючи людину. BN або його похідної, що продукуються зазначе73. Застосування за будь-яким з пп.71, 72, де вакною клітиною-хазяїном. цина призначена проти віспи людини. 87. Клітина, що містить MVA-BN або його похідну 74. Застосування за п.73, де віспа людини являє за будь-яким з пп.1-9. собою натуральну віспу. 88. Клітина за п.87, зокрема клітина людини. 75. Застосування за будь-яким з пп.71-74, де вак89. Клітина, що містить геном за п.17. цина містить принаймні 102 TCID50 MVA-BN або 90. Клітина за п.89, зокрема клітина людини. його похідної. 91. Набір для основної/бустерної імунізації, що 76. Застосування за будь-яким з пп.71-75, де MVAвключає MVA-BN або його похідну за будь-яким з BN або його похідну вводять у терапевтично ефепп.1-9, для першої інокуляції (основна інокуляція) у ктивних кількостях при першій інокуляції (основна першому флаконі/контейнері і для другої інокуляції інокуляція) і при другій інокуляції (бустерна іноку(бустерна інокуляція) у другому флаколяція). ні/контейнері. 77. Застосування за будь-яким з пп.71-76, коли 92. Набір для основної/бустерної імунізації, що тварина має порушений імунітет. включає композицію за пп.25-41, для першої іно78. Застосування за будь-яким з пп.71-77, коли куляції (основна інокуляція) у першому флакотварина, включаючи людину, має вже існуючий ні/контейнері і для другої інокуляції (бустерна іноімунітет до вірусів віспи. куляція) у другому флаконі/контейнері. 79. Застосування за будь-яким з пп.71-78, коли 93. Набір для основної/бустерної імунізації, що тварина, включаючи людину, піддається противівключає вакцину за пп.42-58, для першої інокулярусній терапії. ції (основна інокуляція) у першому флако80. Застосування за п.79, коли противірусна терані/контейнері і для другої інокуляції (бустерна інопія являє собою терапію проти ретровірусів. куляція) у другому флаконі/контейнері. 81. MVA-BN або його похідні за будь-яким з пп.1-9 як ад'ювант. У даному винаході пропонується ослаблений вірус, що походить від модифікованого вірусу коров'ячої віспи Ankara і який характеризується втратою здатності до своєї репродукції шляхом реплікації в клітинних лініях людини. У ньому додатково описуються рекомбінантні віруси, що походять від даного вірусу, і застосування вірусу або його рекомбінантних варіантів у якості ліків або вакцини. Додатково пропонується засіб індукції імунної відповіді навіть у хворих із порушеним імунітетом, хворих із природно існуючим імунітетом до вірусу вакцини або хворих у процесі проведення противірусної терапії. Модифікований вірус коров'ячої віспи Ankara (MVA) відноситься до вірусу коров'ячої віспи, члену роду Orthopoxvirus сімейства Poxiviridae. MVA був створений у результаті 516 серійних пасажів вірусу коров'ячої віспи (CVA) в ембріональних фі 7 76731 8 бробластах курчат лінії Ankara [у якості огляду тні до репродукції шляхом реплікації в клітинах і в дивись Mayr, A., et al. Infection 3, 6-14 (1975)]. Внаклітинних лініях тварин, які не є людиною, особлислідок даних численних пасажів отриманий вірус во у фібробластах ембріонів курчат (CEF) і в лінії MVA загубив приблизно 31 тисячу основ своєї геклітин нирки дитинчат хом'ячка ВПК (ЕСАСС номної послідовності і, отже, був описаний як вірус 85011433), але не здатні до репродукції шляхом із вкрай обмеженими клітинами-хазяїнами, що реплікації в клітинних лініях людини. відносяться до клітин птахів [Meyer, Η. et al., J. Відомі штами вірусів коров'ячої віспи здатні до Gen. Virol. 72, 1031-1038 (1991)]. На різноманітних репродукції шляхом реплікації в, принаймні, детваринних моделях було показано, що отриманий яких клітинних лініях людини, зокрема в клітинній MVA був практично авірулентним (Мауr, А. & лінії кератиноцитів людини HaCat [Boukamp et al. Danner, K. (1978) Dev. Biol. Stand. 41:225-34]. Крім 1988, J Cell Biol 106(3): 761-71]. Реплікація в клітого, даний штам MVA був протестований при клітинній лінії HaCat припускає реплікацію in vivo, нічних дослідженнях у якості вакцини для імунізазокрема реплікацію in vivo у людини. Звичайно, в ції проти віспи людини [Mayr et al., Zbl. Bakt. Hyg. I, розділі прикладів показано, що всі протестовані Abt. Org. У 167, 375-390 (1987), Stickl et al., Dtsch. відомі штами вірусу коров'ячої віспи, що виявляmed. Wschr. 99, 2386-2392 (1974)]. У даному досють здатність до залишкового відтворення шляхом лідженні було використано більше 120000 людей, реплікації в HaCat, також реплікуються in vivo. Тавключаючи пацієнтів із високим ризиком захворюким чином, винахід переважно відноситься до вівання, і було доведено, що в порівнянні з вакцирусів коров'ячої віспи, що не здатні до репродукції нами, що засновані на вірусі коров'ячої віспи, MVA шляхом реплікації в клітинній лінії HaCat людини. має ослаблену вірулентність або інфекційність, Найбільш переважно винахід стосується штамів зберігаючи в той же час гарну імуногенність. вірусу коров'ячої віспи, що не здатні до репродукції У наступні десятиріччя були створені генношляхом реплікації в будь-якій із таких клітинних інженерні конструкції MVA для застосування їх у ліній людини: клітинної лінії аденокарциноми шийякості вірусного вектора для експресії рекомбінанки матки людини HeLa [ATCC No.CCL-2], лінії клітних генів або в якості рекомбінантної вакцини тин нирки ембріона людини 293 [ЕСАСС [Sutter, G. et al. (1994), Vaccine 12:1032-40]. No.85120602], клітинної лінії остеосаркоми кістки У даному відношенні найбільш надзвичайним людини 143В [ЕСАСС No.91112502] і клітинної лінії є те, що навіть незважаючи на те, що Мауr et al. у HaCat. 1970-і роки показали, що MVA є вкрай ослабленим Характер росту або ампліфікації/реплікації віі авірулентним у людини і ссавців, у даний час у русу звичайно виражається відношенням кількості деяких поданих роботах [Blandchard et al., 1998, J вірусів, що продукуються інфікованою клітиною Gen Virol 79, 1159-1167; Can-oil & Moss, 1997, (вихід), до кількості, яка спочатку використовуєтьVirology 238, 198-211; Altenberger, патент США ся для вихідного інфікування клітин (вхід) ("амплі5185146; Ambrosini et al. 1999, J Neurosci Res фікаційне відношення"). Відношенням між виходом 55(5), 569] показано, що в клітинних лініях людини і входом, що дорівнює "1", визначається такий амі ссавців MVA не є цілком ослабленим, тому що в пліфікаційний статус, при якому кількість вірусу, даних клітинах може відбуватися залишкова репщо продукується інфікованими клітинами, є тією ж лікація. Передбачається, що результати, які подані самою, що і кількість, що вихідно використовуєтьв даних публікаціях, отримані з різноманітними ся для інфікування клітин. Даний статус вказує на штамами MVA, тому що використані віруси істотно той факт, що інфіковані клітини є пермісивними відрізняються за своїми властивостями, особливо для вірусної інфекції і репродукції вірусу. за характером свого росту в різноманітних клітинАмпліфікаційне відношення, що складає менних лініях. ше 1, тобто зниження ампліфікації нижче рівня Характер росту розглядається в якості індикавходу є індикатором недостатності реплікації і, тора ослаблення вірусу. Звичайно штам вірусу таким чином, індикатором ослаблення вірусу. Отрахується ослабленим, якщо він загубив свою здаже, для винахідників особливий інтерес подає ідетність або тільки знизив свою здатність до своєї нтифікація і, в загальному підсумку, виділення репродукції шляхом реплікації в клітинах-хазяїнах. штаму, що характеризується ампліфікаційним відЗазначений вище факт, що MVA не є цілком не ношенням менше 1 у декількох клітинних лініях здатним до реплікації в клітинах людини і ссавців, людини, зокрема у всіх клітинних лініях людини порушує питання про те, наскільки абсолютна без143В, HeLa, 293 і HaCat. пека MVA як вакцини для людини або вектора для Таким чином, термін "не здатний до репродукрекомбінантних вакцин. ції шляхом реплікації" позначає, що вірус відповідОсобливо для вакцини, а також для рекомбіно до винаходу характеризується ампліфікаційним нантної вакцини баланс між ефективністю і безпевідношенням менше 1 у клітинних лініях людини, кою вірусного вектора вакцини є вкрай важливим. таких як клітинні лінії 293 [ЕСАСС No.85120602], Таким чином, задачею винаходу є забезпе143В [ЕСАСС No.91112502], HeLa [ATCC No.CCLчення новими штамами, що характеризуються 2] і HaCat [Boukamp et al. 1988, J Cell Biol 106(3): підвищеною безпекою, для розробки більш безпе761-71], в умовах, що описані у прикладі 1 даного чних продуктів, таких як вакцини або ліки. Більш опису для деяких конкретних штамів MVA. Перетого, додатковою метою є забезпечення засобами важно, щоб ампліфікаційне відношення для вірусу для поліпшення існуючого режиму вакцинації. відповідно до винаходу складало 0,8 або менше в Для досягнення перерахованих вище цілей вікожній із перерахованих вище лініях HeLa, HaCat і дповідно до кращого здійснення даного винаходу, 143В. пропонуються нові віруси коров'ячої віспи, що здаУ прикладі 1 і в таблиці 1 показано, що віруси 9 76731 10 відповідно до даного винаходу не здатні до репростю здатності реплікуватися in vivo. У контексті дукції шляхом реплікації в жодній із клітинних ліній даного винаходу "відсутність здатності реплікува143В, HeLa і HaCat. 'Особливий штам відповідно тись in vivo" відноситься до вірусів, що не реплікудо даного винаходу, що був використаний у прикються в клітинах людини і мишиної моделі, що ладах, був призначений на збереження в Євроописана нижче. "Відсутність здатності реплікувапейську колекцію клітинних культур під номером тись in vivo" може бути визначене переважно на V00083008. Даний штам позначається у всьому мишах, що не здатні продукувати зрілі В і Τ клітиописі як "MVA-BN". ни. Прикладом таких мишей є трансгенні миші моВідомі штами MVA виявляють здатність до заделі AGR129 (отримані від Mark Sutler, Institute of лишковій реплікації в, принаймні, однієї з протесVirology, University of Zurich, Швейцарія). Дана лінія тованих клітинних ліній людини (Фіг.1, приклад 1). мишей характеризується спрямованими генетичВсі відомі штами вірусів коров'ячої віспи виявляними ушкодженнями в генах рецептора IFN типу І ють здатність до, принаймні, деякої реплікації в (IFN-a/P) і типу II (IFN-y) і в RAG. Через дані ушкоклітинній лінії HaCat, у той час як штами MVA віддження миші не мають системи IFN і не здатні повідно до даного винаходу, зокрема MVA-BN, не продукувати зрілі В і Τ клітини й в результаті цього виявляють здатності до відтворення шляхом репхарактеризуються істотно порушеним імунітетом і лікації в клітинах HaCat. У більш докладному вивисокою сприйнятливістю до реплікації вірусів. кладі MVA-BN характеризуються ампліфікаційним Замість мишей AGR129 може бути використана відношенням від 0,05 до 0,2 у лінії клітин нирки будь-яка інша лінія мишей, що не спроможна проембріона людини 293 [ЕСАСС No.85120602]. У дукувати зрілі В і Τ клітини й в результаті цього клітинній лінії остеосаркоми кістки людини 143В характеризується істотно порушеним імунітетом і [ЕСАСС No.91112502] відношення знаходиться в 1 високою сприйнятливістю до реплікації вірусів. діапазоні від 0,0 до 0,6. Для клітинної лінії аденоЗокрема, віруси відповідно до даного винаходу не карциноми шийки матки людини HeLa [ATCC вбивають мишей AGR129 протягом періоду часу, No.CCL-2] і клітинної лінії кератиноцитів людини принаймні, 45 днів, більш переважно протягом, HaCat [Boukamp et al. 1988, J Cell Biol 106(3): 761щонайменше, 60 днів, найбільше переважно про71] ампліфікаційне відношення знаходиться в діатягом 90 днів після інфікування мишей шляхом пазоні від 0,04 до 0,8 і від 0,02 до 0,8, відповідно. внутрішньо очеревинного введення 107 БОЕ віруMVA-BN характеризується ампліфікаційним відсу. Переважно, щоб віруси, що виявляють "відсутношенням від 0,01 до 0,06 у клітинах нирки африність здатності реплікуватися in vivo", додатково канської зеленої мартишки [CV1: ATCC No.CCLхарактеризувалися тим, що жодного вірусу не мо70]. Таким чином, MVA-BN, що є зразком штаму гло виявлятися в органах або тканинах мишей відповідно до даного винаходу, не здатний до відAGR129 через 45 днів, переважно через 60 днів і творення шляхом реплікації в жодній із протестонайбільше переважно через 90 днів після інфікуваних клітинних ліній. вання мишей шляхом внутрішньо очеревинного Ампліфікаційне відношення MVA-BN дорівнює введення 107 БОЕ вірусу. Докладна інформація величині, безсумнівно, вище 1 у фібробластах про дослідження по інфікуванню мишей AGR129 і ембріонів курчат (CEF: первинні культури) або в тестах, що застосовуються для визначення того, лінії клітин нирки дитинчат хом'ячка ВНК [ATCC чи може вірус виявлятися в органах або тканинах No.CRL-1632]. Як відзначалося вище, відношення, інфікованих мишей, може бути знайдена в розділі що складає більше "І", вказує на репродукцію прикладів. шляхом реплікації, тому що кількість вірусів, що У кращому здійсненні штами вірусу коров'ячої продукується інфікованими клітинами, збільшуєтьвіспи відповідно до даного винаходу, зокрема ся в порівнянні з кількістю вірусів, що використовуMVA-BN і його похідні, характеризуються більш валась для інфікування клітин. Отже, вірус може високою імуногенністю в порівнянні з відомим легко розмножуватися й ампліфікуватися в перштамом MVA 575 при визначенні на моделі мишей винних культурах CEF із відношенням вже 500 або із летальним інфікуванням. Подробиці даного ексв клітинах ВНК із відношенням вище 50. перименту описані в прикладі 2 поданому нижче. У конкретному здійсненні даного винаходу виКоротенько, у такій моделі невакциновані миші нахід стосується похідних вірусу, що депонований вмирають після інфікування реплікативними компід № ЕСАСС V0083008. "Похідні" вірусів, що депонентами штамів вірусів коров'ячої віспи, такими поновані під № ЕСАСС V00083008, позначають як штам L929 ТК+ Western Reserve або IHD-J. У віруси, що виявляють за змістом ті ж самі реплікаконтексті описи моделі з летальним зараженням, ційні характеристики, що і депонований штам, але "зараженням" позначається інфікування реплікатакі, що мають відмінності, в однієї або більш частивними компонентами вірусів коров'ячої віспи. тин свого генома. Віруси, що мають ті ж самі "репЧерез чотири дні після зараження мишей звичайно лікаційні характеристики", що і депонований вірус, забивають і визначають титр вірусів у яєчниках за являють собою віруси, що реплікуються з подібдопомогою стандартних тестів утворення бляшок ними ампліфікаційними відношеннями, що і депоіз застосуванням клітин VERO (для більш докладнований штам, у клітинах CEF і клітинних лініях ного опису дивися поділ прикладів). Титр вірусів ВНК, HeLa, HaCat і 143В, і який виявляють подібну визначають у невакцинованих мишей і в мишей, реплікацію in vivo при визначенні на моделі трансвакцинованих вірусною вакциною відповідно до генної миші AGR129 (дивися нижче). даного винаходу. Більш конкретно, віруси відповіУ кращому здійсненні штами вірусу коров'ячої дно до даного винаходу характеризуються тим, що віспи відповідно до даного винаходу, зокрема в даному тесті після вакцинації 102 ТСID50/мл віруMVA-BN і його похідні, характеризуються відсутнісами відповідно до даного винаходу титри вірусів у 11 76731 12 яєчнику знижені, щонайменше, на 70%, переважкоров'ячої віспи. Більш переважно, щоб CTL відно, щонайменше, на 80%, більш переважно, щоповідь після первинної імунізації вірусом коров'янайменше, на 90% у порівнянні з невакцинованичої віспи/повторної імунізації вірусом коров'ячої ми мишами. віспи був вище, принаймні, в одному із тестів у У кращому здійсненні віруси коров'ячої віспи порівнянні з режимами первинної імунізації відповідно до даного винаходу, зокрема MVA-BN і ДНК/повторної імунізації вірусом коров'ячої віспи. його похідні, придатні для імунізації шляхом перНайбільш переважно, щоб CTL відповідь була вивинного/повторного введення вакцини. Існують ще в обох з наступних тестів. численні повідомлення, що припускають, що реТест 1: для первинного введення вірусу корожими первинної/повторної імунізації з застосуванв'ячої віспи/повторного введення вірусу коров'ячої ням MVA у якості вектора для доставки індукують віспи проводять первинну імуніацію 6-8 тижневих слабкі імунні відповіді і поступаються режиму пермишей BALB/c (H-2d) шляхом внутрішньовенного винної імунізації за допомогою ДНК і повторної введення 107 TCID50 вірусу коров'ячої віспи відпоімунізації MVA [Schneider et al., 1998, Nat. Med. 4; відно до даного винаходу, що експресують миша397-402]. В усіх даних дослідженнях застосовувачий політоп, [як описано в Thomson et al., 1988, J. лися штами MVA, що відрізняються від вірусів коImmunol. 160, 1717], і повторно імунізують тією ж ров'ячої віспи відповідно до даного винаходу. Для кількістю того ж вірусу, що вводиться тим же шляпояснення слабкої імунної відповіді при застосухом через три тижня. Для даної цілі необхідно ванні MVA для первинного і повторного введення створити конструкцію рекомбінантного вірусу кобула висунута гіпотеза про те, що антитіла, що ров'ячої віспи, що експресує зазначений полівироблені проти MVA при первинному введенні, топ.Способи створення конструкцій таких рекомбінейтралізують MVA, які вводяться при повторній нантних вірусів відомі спеціалісту в даній області імунізації, запобігаючи ефективне підвищення імутехніки й описуються більш докладно нижче. У нної відповіді. На противагу цьому, режими з первипадку режимів первинної імунізації винною імунізацією ДНК і повторною імунізацією ДНК/повторної імунізації вірусом коров'ячої віспи MVA, як повідомляється, є прекрасними в плані первинну вакцинацію проводять шляхом внутрішгенерації антитіл із високою авідністю, тому що ньо м'язового введення мишам 50мкг ДНК, що при даному режимі здатність ДНК ефективно приекспресують той же самий антиген, що і вірус коміювали імунну відповідь сполучається з властиров'ячої віспи; при повторному введенні уводять востями MVA посилювати дану відповідь при повірус коров'ячої віспи точно тим же шляхом, що й у вторній імунізації у відсутність раніше існуючого випадку первинної імунізації вірусом коров'ячої імунітету по відношенню до MVA. Ясно, що, якщо віспи/повторної імунізації вірусом коров'ячої віспи. раніше існуючий імунітет до MVA і/або вірусу коПлазмідна ДНК, що експресує політоп, описана ров'ячої віспи запобігає посиленню імунної відпотакож у зазначеній вище публікації Thomson et al. віді після повторної імунізації, то застосування У випадку обох режимів розвиток CTL відповіді MVA у якості вакцини або ліків повинно мати обпроти епітопів SYIPSAEKI, RPQASGVYM імунізації межену силу, особливо в хворих, що були вакцивірусом коров'ячої віспи/повторної імунізації віруновані проти віспи. Проте, відповідно до додаткосом коров'ячої віспи. Плазмідна ДНК, що експревого здійснення вірус коров'ячої віспи відповідно сує політоп, описана також у зазначеній вище пубдо даного винаходу, зокрема MVA-BN і його похідлікації Thomson et al. У випадку обох режимів ні, також як відповідні рекомбінантні віруси, що розвиток CTL відповіді проти епітопів SYIPSAEKI, включають гетерологічні послідовності, можуть RPQASGVYM і/або YPHFMPTNL визначають через бути використані для ефективних первинної предва тижні після повторного введення. Визначення мійованої і наступної посилюючої імунних відповіCTL відповіді переважно здійснюють шляхом видей у інтактних тварин, а також у тварин з імунітекористання аналізу ELISPOT, [як описано том, що предіснує, стосовно вірусів віспи. Таким Schneider et al., 1998, Nat. Med. 4, 397-402], і подачином, вірус коров'ячої віспи відповідно до даного но в розділі прикладів нижче для одного конкретвинаходу індукує, принаймні, за змістом той же ного вірусу відповідно до даного винаходу. Вірус рівень імунітету при режимах первинної імунізації відповідно до даного винаходу характеризується в вірусом коров'ячої віспи/повторної імунізації віруданому експерименті тим, що імунний CTL відпосом коров'ячої віспи в порівнянні з режимами первідь проти зазначених вище епітопів, що індукувинної імунізації ДНК/повторної імунізації вірусом ються первинним введенням вірусу коров'ячої віскоров'ячої віспи. пи/повторним уведенням вірусу коров'ячої віспи, є Вірус коров'ячої віспи розглядається як такий, за змістом тим же самим, переважно, принаймні, що індукує, принаймні, за змістом той же рівень тим же самим, що і індукує первинним введенням імунітету при режимах первинної імунізації вірусом ДНК/повторним введенням вірусу коров'ячої віспи коров'ячої віспи/повторної імунізації вірусом коропри оцінці по числу клітин, що продукують IFNв'ячої віспи в порівнянні з режимами первинної /106 клітин селезінки (дивися також експерименімунізації ДНК/повторної імунізації вірусом коротальний розділ). в'ячої віспи, якщо CTL (ЦТЛ) відповідь при вимірі в Тест 2: даний тест в основному відповідає тесодному із таких двох тестів ("тест 1" і "тест 2"), ту 1. Проте замість використання в/в введення 107 переважно в обох тестах, є, принаймні за змістом ТСID50 вірусу коров'ячої віспи, як у випадку тест 1, тим же самим при режимах первинної імунізації у даному тесті 108 ТСID50 вірусу коров'ячої віспи вірусом коров'ячої віспи/повторної імунізації вірувідповідно до даного винаходу вводять підшкірно сом коров'ячої віспи в порівнянні з режимами пердля первинної імунізації і для повторної імунізації. винної імунізації ДНК/повторної імунізації вірусом Вірус відповідно до даного винаходу характеризу 13 76731 14 ється в даному експерименті тим, що імунна CTL фібробластах ембріонів курчат (CEF) і в лінії клівідповідь проти епітопів, що зазначені вище, що тин нирок дитинчат хом'ячка ВНК, але відсутність індукується первинним введенням вірусу коров'яздатності до репродукції шляхом реплікації в клічої віспи/повторним введенням вірусу коров'ячої тинній лінії кератиноцитів людини HaCat, віспи, є за змістом тим же самим, переважно, при- відсутність здатності до реплікації in vivo, наймні, тим же самим, що і індукує первинним - індукція більш високого імунітету в порівнянні введенням ДНК/повторним введенням вірусу коз відомим штамом MVA - 575 у моделі летального ров'ячої віспи при оцінці по числу клітин, що прозараження і/або - індукція, принаймні, за змістом того ж самого дукують IFN- /106 клітин селезінки (дивися також рівня імунітету при режимах первинної імунізації експериментальний поділ). вірусом коров'ячої віспи/повторної імунізації віруСила CTL відповіді, що виміряна в одному із сом коров'ячої віспи в порівнянні з режимами пертестів, поданих вище, відповідає рівню захисту. винної імунізації ДНК/повторної імунізації вірусом Таким чином, віруси відповідно до даного викоров'ячої віспи. находу особливо підходять для цілей вакцинації. Спосіб одержання такого вірусу може включаУ цілому вірус відповідно до даного винаходу ти такі стадії: характеризується наявністю, принаймні, однієї з (і) введення відомого штаму вірусу коров'ячої таких властивостей: віспи, переважно MVA 574 або MVA 575 (ЕСАСС (і) здатністю до репродукції шляхом реплікації V00120707) у клітини, відмінні від клітин людини, у у фібробластах ембріонів курчат (CEF) і в клітиняких вірус здатний до репродукції шляхом репліній лінії ВНК, але відсутністю здатності до репрокації, де клітини, відмінні від клітин людини, передукції шляхом реплікації в клітинній лінії HaCat важно обрані з клітин CEF і клітинної лінії ВНК, людини, (іі) виділення/підвищення концентрації вірус(іі) відсутністю здатності до реплікації in vivo, них часток із даних клітин і (ііі) аналіз того, чи буде (ііі) індукцією більш високого імунітету в порівотриманий вірус мати, принаймні, одну з бажаних нянні з відомим штамом MVA 575 (ЕСАСС VOO біологічних властивостей, як зазначено вище, де 120707) у моделі летального зараження і/або зазначені вище стадії можуть необов'язково по(iv) індукцією, принаймні, за змістом того ж савторюватися доти, поки не буде отриманий вірус із мого рівня імунітету при режимах первинної імунібажаними реплікативними характеристиками. Визації вірусом коров'ячої віспи/повторної імунізації нахід додатково відноситься до вірусів, які отривірусом коров'ячої віспи в порівнянні з режимами мані даним способом відповідно до даного винапервинної імунізації ДНК/повторної імунізації віруходу. Способи того, як можуть бути визначені сом коров'ячої віспи. бажані біологічні властивості, пояснені в інших Переважно вірус коров'ячої віспи відповідно частинах даного опису. до даного винаходу має, принаймні, дві з зазначеЗастосовуючи даний засіб, винахідники іденних вище властивостей, більш переважно, притифікували і виділили в результаті декількох цикнаймні, три з зазначених вище властивостей. Найлів очищення клона штам відповідно до даного більш кращими є віруси коров'ячої віспи, що мають винаходу, починаючи з пасажу 575 ізолята MVA усі зазначені вище властивості. (MVA 575). Даний новий штам відповідає штаму з У додатковому здійсненні винахід стосується депонентним номером ЕСАСС V00883008, що набору для вакцинації, що включає вірус відповідзазначений вище. но до даного винаходу для первинної вакцинації Характер росту вірусів коров'ячої віспи відпо("приміювання") в одному флаконі/контейнері і для відно до даного винаходу, зокрема характер росту повторної вакцинації ("бустинга") у другому флаMVA-BN, вказує на те, що штами відповідно до коні/контейнері. Вірус може являти собою нерекоданого винаходу істотно випереджають будь-який мбінантний вірус коров'ячої віспи, тобто вірус коінший схарактеризований до даного часу ізолят ров'ячої віспи, що не містить гетерологічних MVA у відношенні ослаблення дії в клітинних лінінуклеотидних послідовностей. Прикладом такого ях людини і відсутності здатності до реплікації in вірусу коров'ячої віспи є MVA-BN і його похідні. У vivo. Штами відповідно до даного винаходу є, отальтернативному варіанті вірус може являти соже, ідеальними кандидатами для розробки більш бою рекомбінантний вірус коров'ячої віспи, що безпечних продуктів, таких як вакцини або ліків, як містить додаткові нуклеотидні послідовності, що є буде описано нижче. гетерологічними стосовно вірусу коров'ячої віспи. У однім здійсненні вірус відповідно до даного Як зазначено в інших розділах опису, гетерологічні винаходу, зокрема MVA-BN і його похідні, застосопослідовності можуть кодувати епітопи, що індувують у якості вакцини проти вірусних захворюкують відповідь імунної системи. Таким чином, вань людини, що супроводжуються висипкою, таможна застосовувати рекомбінантний вірус короких як віспа. У додатковому здійсненні вірус в'ячої віспи для вакцинації проти білків або агентів, відповідно до даного винаходу може бути рекомбіщо включають зазначений епітоп.Віруси можуть нантним, тобто може експресувати гетерологічні бути включені до складів, як більш докладно покагени, такі як, наприклад, антигени або епітопи, зано нижче. гетерологічні стосовно вірусу, і може, таким чином, Кількість вірусу, що може бути використане бути придатним у якості вакцини для індукції імундля кожної вакцинації, зазначено вище. ної відповіді проти гетерологічних антигенів або Спеціалісту в даній області техніки відомо як епітопів. можна одержати віруси коров'ячої віспи, що маТермін "імунна відповідь" позначає реакцію ють, щонайменше, одну з таких властивостей: імунної системи при надходженні в організм чужо- здатність до репродукції шляхом реплікації у 15 76731 16 рідної речовини або мікроорганізму. По визначенщо у звичайних умовах не знаходять у близькому ню імунна відповідь підрозділяють на специфічну і зв'язку з вірусом у природі, такий вірус називають неспецифічну реакції, хоча обидві вони тісно петакож "рекомбінантний вірус". реплітаються. Неспецифічна імунна відповідь явВідповідно до додаткового здійснення даного ляє собою негайний захист від широкої розмаїтості винаходу гетерологічні послідовності являють сочужорідних речовин і інфекційних агентів. Специбою переважно антигенні епітопи, що обрані з фічна імунна відповідь являє собою захист, що будь-якого джерела, що не є вірусом коров'ячої виникає після лаг-періоду після першого зараженвіспи. Найбільш переважно, щоб зазначений реня організму речовиною. Специфічна імунна відкомбінантний вірус експресував один або більше повідь є високоефективним і визначає той факт, антигенних епітопів від Plasmodium falciparum, що індивідуум, що перехворів конкретною інфекціMycobacteria, Influenza virus, від вірусів, що обрані єю, стає захищеним проти даної конкретної інфекіз сімейства Flaviviruses, Paramyxovimses, вірусів ції. Таким чином, повторне інфікування тим же гепатиту, вірусів імунодефіците людини, або від самим або дуже близьким інфекційним агентом вірусів, що викликають геморагічну лихоманку, викликає набагато більше згладжені симптоми або таких як Hantaviruses або Filoviruses, тобто вірусу зовсім не викликає симптомів, тому що вже є " Ебола або Марбург. імунітет, що предіснує," у відношенні даного агенВідповідно до ще одного здійснення, але тата. Такий імунітет і імунологічна пам'ять, відповідкож на додаток до зазначеного вище вибору антино, зберігається протягом тривалого часу, у деяких генних епітопів, гетерологічні послідовності можуть випадках навіть напротязі усього життя. Відповідбути обрані з інших джерел віспи і коров'ячої віспи. но, індукція імунологічної пам'яті може бути викоДані вірусні послідовності можуть бути застосовані ристана при вакцинації. для модифікації спектра хазяїв або імуногенності "Імунна система" позначає комплекс органів, вірусу. що беруть участь у захисті організму від чужорідУ додатковому здійсненні вірус відповідно до них речовин і мікроорганізмів. Імунна система даного винаходу може кодувати гетерологічний включає клітинну складову, що включає декілька ген/нуклеїнову кислоту, що експресують терапевтипів клітин, таких як, наприклад, лімфоцити й інші тичну сполуку. "Терапевтична сполука", яка кодуклітини, що відбуваються від білих клітин крові, і ється гетерологічною нуклеїновою кислотою у вігуморальну складову, що включає невеличкі пепрусі, може являти собою, наприклад, терапевтичну тиди і чинники комплемента. нуклеїнову кислоту, таку як антизмістова нуклеїно"Вакцинація" означає те, що організм наванва кислота, або пептид, або білок з бажаною біотажують інфекційним агентом, наприклад, ослаблогічною активністю. леною або інактивованою формою зазначеного Відповідно до додаткового кращого здійснення інфекційного агента, для індукції специфічного експресія гетерологічної послідовності нуклеїнової імунітету. Термін вакцинація також охоплює заракислоти знаходиться переважно, але не виняткоження організму рекомбінантними вірусами корово, під транскрипційним контролем промотору вів'ячої віспи відповідно до даного винаходу, зокрерусу віспи, більш переважно промотору вірусу кома, рекомбінантним MVA-BN і його похідними, що ров'ячої віспи. експресують антигени або епітопи, що є гетеролоВідповідно до ще одного здійснення вставка гічними стосовно вірусу. Приклади таких епітопів гетерологічної послідовності нуклеїнової кислоти даються в інших частинах опису й охоплюють, наздійснюється в область вірусного генома, що не приклад, епітопи білків, що походять від інших віявляється необхідною. У іншому переважному русів, таких як вірус Денге, вірус гепатиту С, ВІЛ здійсненні винаходу гетерологічну послідовність або епітопи, що походять від білків, що асоційовані нуклеїнової кислоти вставляють у природно існуюз розвитком пухлин і раку. Після введення рекомчий сайт делеції генома MVA [розкритий у патенті бінантного вірусу коров'ячої віспи в організм епітоРСТ/ЕР96/02926]. Методи вставки гетерологічних пи експресуються і презентуються імунній системі і послідовностей у геном вірусу віспи відомі спеціаможе індукуватись специфічна імунна відповідь лістам уданій області техніки. проти даних епітопів. Організм, таким чином, є Відповідно до іншого додаткового кращого імунізованим проти агента/білка, що містить епіздійснення винахід включає також геном вірусу, топ, що кодується рекомбінантним вірусом коройого рекомбінантні варіанти або його функціонав'ячої віспи. льні частини. Такі вірусні послідовності можуть "Імунітет" означає частковий або повний забути використані для ідентифікації або виділення хист організму від захворювань, що викликаються вірусу або його рекомбінантних варіантів, наприінфекційним агентом, що обумовлений успішною клад, із застосуванням ПЦР, методів гібридизації ліквідацією попереднього інфікування зазначеним або за допомогою традиційних тестів ELISA. Більш інфекційним агентом або його характерною частитого, такі вірусні послідовності можуть експресуваною. Імунітет заснований на існуванні, індукції й тись експресійним вектором з одержанням білка, активації спеціалізованих клітин імунної системи. що кодує або пептида, що потім можуть доповнюЯк підкреслювалося вище, в одному здійсненні вати делеційні мутанти вірусу, у яких відсутня вівинаходу рекомбінантні віруси відповідно до данорусна послідовність, що утримується в експресійго винаходу, зокрема, рекомбінантний MVA-BN і ному векторі. його похідні, містять, принаймні, одну гетерологіч"Функціональна частина" вірусного генома пону послідовність нуклеїнової кислоти. Термін "гезначає частину повної геномної послідовності, що терологічна" застосовують тут далі для будь-якого кодує фізичний об'єкт, такий як білок, домен білка, сполучення послідовностей нуклеїнової кислоти, епітоп білка. Функціональна частина вірусного ге 17 76731 18 нома також описує частини повної геномної послі100мл забуференого фосфатом фізіологічного довності, що кодує регуляторні елементи або часрозчину (PBS) при 2% пептона і 1% альбуміну лютини таких елементів з індивідуалізованою активдини в ампулі, переважно в скляній ампулі. Альтеністю, такі як промотор, енхансер, цис- або трансрнативно, вакцина для уколів може бути отримана діючі елементи. за допомогою поетапної ліофілізації вірусу в комРекомбінантний вірус відповідно до даного випозиції. Дана композиція може містити додаткові находу може бути застосований для введення гедобавки, такі як маніт, декстран, цукор, гліцин, терологічної послідовності нуклеїнової кислоти в лактозу або полівінілпііролідон, або інші добавки, клітину-мішень, причому зазначена послідовність є такі як антиоксиданти або інертний газ, стабілізаабо гомологічною, або гетерологічною стосовно тори або рекомбінантні білка (наприклад, сироватклітини-мішені. Введення гетерологічної послідовковий альбумін людини), що підходять для ввеності нуклеїнової кислоти в клітину-мішень може дення in vivo. Скляну ампулу потім запоюють і її бути застосоване для одержання in vitro гетероломожна берегти при температурі між 4°С і кімнатної гічних пептидів або поліпептидів і/або повних вірупротягом декількох місяців. Проте коли відсутня сів, кодує зазначеною послідовністю. Даний спосіб необхідність використання ампули її бережуть певключає інфікування клітини-хазяїна рекомбінантреважно при температурі нижче -20°С. ним MVA, культивування інфікованої клітиниДля вакцинації або терапії ліофілізат може бухазяїна в підхожих умовах і виділення і/або підвити розчинений у від 0,1 до 0,5мл водяного розчину, щення концентрації пептиду, білка і/або вірусу, що переважно фізіологічного розчину або Трис буфепродукуються зазначеною клітиною-хазяїном. ра і введений або системно, або місцево, тобто за Більш того, спосіб введення гомологічної або допомогою парентерального, внутрішньо м'язово гетерологічної послідовності в клітини може бути або будь-якого іншого шляху введення, що відозастосований для терапії in vitro і переважно in мий спеціалісту в даній області техніки. Шлях ввеvivo. Для терапії in vitro виділені клітини, що попедення, доза і кількість введень може бути оптиміредньо (ex vivo) інфікували вірусом, вводять в орзовано спеціалістом уданій області техніки ганізм живої тварини для індукції імунної відповіді. відомим засобом. Для терапії in vivo вірус або його рекомбінантні Додатково у відповідності до іншого здійсненваріанти прямо вводять в організм живої тварини ня вірус відповідно до даного винаходу особливо для індукції імунної відповіді. У даному випадку корисний для індукції імунних відповідей у тварин клітини навколо місця інокуляції стають інфіковаіз порушеним імунітетом, наприклад, у мавп, інфіними вірусом або його рекомбінантними варіантакованих SIV (CD4
ДивитисяДодаткова інформація
Назва патенту англійськоюMva-bn strain of modified vaccinia ankara virus, pharmaceutical composition, vaccine, use of mva-bn strain for vaccine preparation, method for transfer of homologous and/or heterologous nucleic acid sequence into the target cells in vitro, method for preparing peptide or protein, method for obtaining mva-bn strain, host cell, set for primary/buster immunization
Автори англійськоюCHAPLIN PAUL, LEYRER SONJA, MEISINGER, Christine
Назва патенту російськоюШтамм mva-bn модифицированного вируса коровьей оспы ankara, фармацевтическая композиция, вакцина, применение mva-bn для приготовления лекарственного препарата и для приготовления вакцины, способ введения гомологичной и/или гетерологичной последовательности нуклеиновой кислоты в клетки-мишени in vitro, способ получения пептида или белка, способ получения mva-bn, клетки, набор для основной/бустерной иммунизации
Автори російськоюЧаплин Пол, Хаули Пол
МПК / Мітки
МПК: A61K 48/00, C12N 7/02, C12N 5/10, A61K 39/285, C12N 15/39, C12P 21/02, A61K 39/39, C12N 7/01, C12N 15/09, C12N 7/04, C12N 15/863, A61K 39/275, A61P 37/04
Мітки: віспи, композиція, застосування, фармацевтична, лікарського, вірусу, препарату, приготування, mva-bn, ankara, спосіб, модифікованого, штам, вакцина, коров'ячої, гомологічної, введення, вакцини
Код посилання
<a href="https://ua.patents.su/20-76731-shtam-mva-bn-modifikovanogo-virusu-korovyacho-vispi-ankara-farmacevtichna-kompoziciya-vakcina-zastosuvannya-mva-bn-dlya-prigotuvannya-likarskogo-preparatu-ta-dlya-prigotuvannya-vak.html" target="_blank" rel="follow" title="База патентів України">Штам mva-bn модифікованого вірусу коров’ячої віспи ankara, фармацевтична композиція, вакцина, застосування mva-bn для приготування лікарського препарату та для приготування вакцини, спосіб введення гомологічної</a>