Застосування гена регулювання висоти рослин
Формула / Реферат
1. Застосування поліпептиду регулювання висоти рослини, або полінуклеотиду, що кодує поліпептид регулювання висоти рослини, у покращенні агрономічних характеристик рослини шляхом регулювання висоти рослини, розміру, кущіння, врожайності, розміру квіткового органа або розміру насіння рослини, де поліпептид регулювання висоти рослини вибраний з групи, яка включає:
(a) поліпептид, що має амінокислотну послідовність, викладену у SEQ ID NO: 3; та
(b) поліпептид, що походить від (a), що має заміщення 1-3 амінокислотних залишків в амінокислотній послідовності, викладеній у SEQ ID NO: 3, і має функцію регулювання висоти рослини;
при цьому регулювання здійснюють шляхом введення зазначеного полінуклеотиду, що кодує поліпептид регулювання висоти рослини, у рослину, або шляхом введення вектора РНКi, який містить послідовність, що спрямовує полінуклеотид, що кодує поліпептид регулювання висоти рослини, у рослину, і
при цьому вказане введення включає наступні етапи:
(1) забезпечують Agrobacterium, що несуть вектор експресії, який містить зазначений полінуклеотид, що кодує поліпептид регулювання висоти рослини, або вектор РНКi;
(2) приводять у контакт клітину, тканину або орган рослини з Agrobacterium, відповідно до етапу (1), для введення зазначеного полінуклеотиду, що кодує поліпептид регулювання висоти рослини, або вектор РНКi в клітину, тканину або орган рослини та дозволяють зазначеному полінуклеотиду, що кодує поліпептид регулювання висоти рослини, або вектору РНКi інтегруватись в хромосому клітини, тканини або органа рослини;
(3) вибирають клітину, тканину або орган рослини, що містить зазначений полінуклеотид, що кодує поліпептид регулювання висоти рослини, або вектор РНКi; та
(4) дозволяють клітині, тканині або органу рослини, відповідно до етапу (3), регенерувати нову рослину.
2. Застосування за п. 1, у якому покращення агрономічних характеристик рослини здійснюють шляхом регулювання експресії або активності зазначеного поліпептиду.
3. Застосування за п. 1, у якому зазначений поліпептид має амінокислотну послідовність, викладену у SEQ ID NO: 3.
4. Застосування за п. 1, у якому зазначений полінуклеотид включає:
(i) нуклеотидну послідовність, викладену у SEQ ID NO: 2; або
(ii) нуклеотидну послідовність, викладену у SEQ ID NO: 1.
5. Застосування за п. 1, у якому додатково здійснюють гібридизацію регенерованої нової рослини з нетрансгенною рослиною з одержанням гібридного потомства, яке містить зазначений полінуклеотид.
6. Застосування за п. 1, у якому рослина вибрана з групи, що складається зі злакових та хрестоцвітих рослин.
7. Застосування за п. 1, у якому рослина вибрана з групи, що складається з сої, кукурудзи (маїсу), бавовни, каноли, цукрового буряку, люцерни, рису, пшениці, ячменю, жита, сорго, цукрової тростини, соняшнику, ріпаку.
8. Спосіб регулювання висоти рослини, розміру, кущіння, врожайності, розміру квіткового органа або розміру насіння рослини, де спосіб включає регулювання експресії або активності гена регулювання висоти рослини у рослині,
причому ген регулювання висоти рослини кодує поліпептид, вибраний з групи, що включає:
(a) поліпептид, що має амінокислотну послідовність, викладену у SEQ ID NO: 3; та
(b) варіант поліпептидів з (a), які мають заміщення 1-3 амінокислотних залишків в амінокислотній послідовності, викладеній у SEQ ID NO: 3, і має функцію регулювання висоти рослини;
при цьому регулювання здійснюють шляхом введення зазначеного полінуклеотиду, що кодує поліпептид регулювання висоти рослини, у рослину, або шляхом введення вектора РНКi, який містить послідовність, що спрямовує полінуклеотид, що кодує поліпептид регулювання висоти рослини, у рослину, і
при цьому вказане введення включає наступні етапи:
(1) забезпечують Agrobacterium, що несуть вектор експресії, який містить зазначений полінуклеотид, що кодує поліпептид регулювання висоти рослини, або вектор РНКi;
(2) приводять у контакт клітину, тканину або орган рослини з Agrobacterium, відповідно до етапу (1), для введення зазначеного полінуклеотиду, що кодує поліпептид регулювання висоти рослини, або вектор РНКi в клітину, тканину або орган рослини та дозволяють зазначеному полінуклеотиду, що кодує поліпептид регулювання висоти рослини, або вектору РНКi інтегруватись в хромосому клітини, тканини або органа рослини;
(3) вибирають клітину, тканину або орган рослини, що містить зазначений полінуклеотид, що кодує поліпептид регулювання висоти рослини, або вектор РНКi; та
(4) дозволяють клітині, тканині або органу рослини, відповідно до етапу (3), регенерувати нову рослину.
9. Спосіб за п. 8, у якому зазначений поліпептид являє собою поліпептид, що має амінокислотну послідовність, викладену у SEQ ID NO: 3.
10. Спосіб за п. 8, у якому ген регулювання висоти рослини включає нуклеотидну послідовність, викладену у SEQ ID NO: 1.
11. Трансгенна рослина, або її потомство, отримана відповідно до способу за будь-яким з пп. 8-10, при цьому трансгенна рослина, або її потомство, включає копію зазначеного полінуклеотиду, що кодує поліпептид регулювання висоти рослини, де поліпептид регулювання висоти рослини вибраний з групи, яка включає:
(a) поліпептид, що має амінокислотну послідовність, викладену у SEQ ID NO: 3; та
(b) поліпептид, який походить від (a), що має заміщення 1-3 амінокислотних залишків в амінокислотній послідовності, викладеній у SEQ ID NO: 3, і має функцію регулювання висоти рослини, введеного за допомогою Agrobacterium.
12. Трансгенна рослина, або її потомство, за п. 11, причому рослина вибрана з групи, що складається зі злакових та хрестоцвітих рослин.
13. Трансгенна рослина, або її потомство, за п. 11, причому рослина вибрана з групи, що складається з сої, кукурудзи (маїсу), бавовни, каноли, цукрового буряку, люцерни, рису, пшениці, ячменю, жита, сорго, цукрової тростини, соняшнику, ріпаку.
Текст
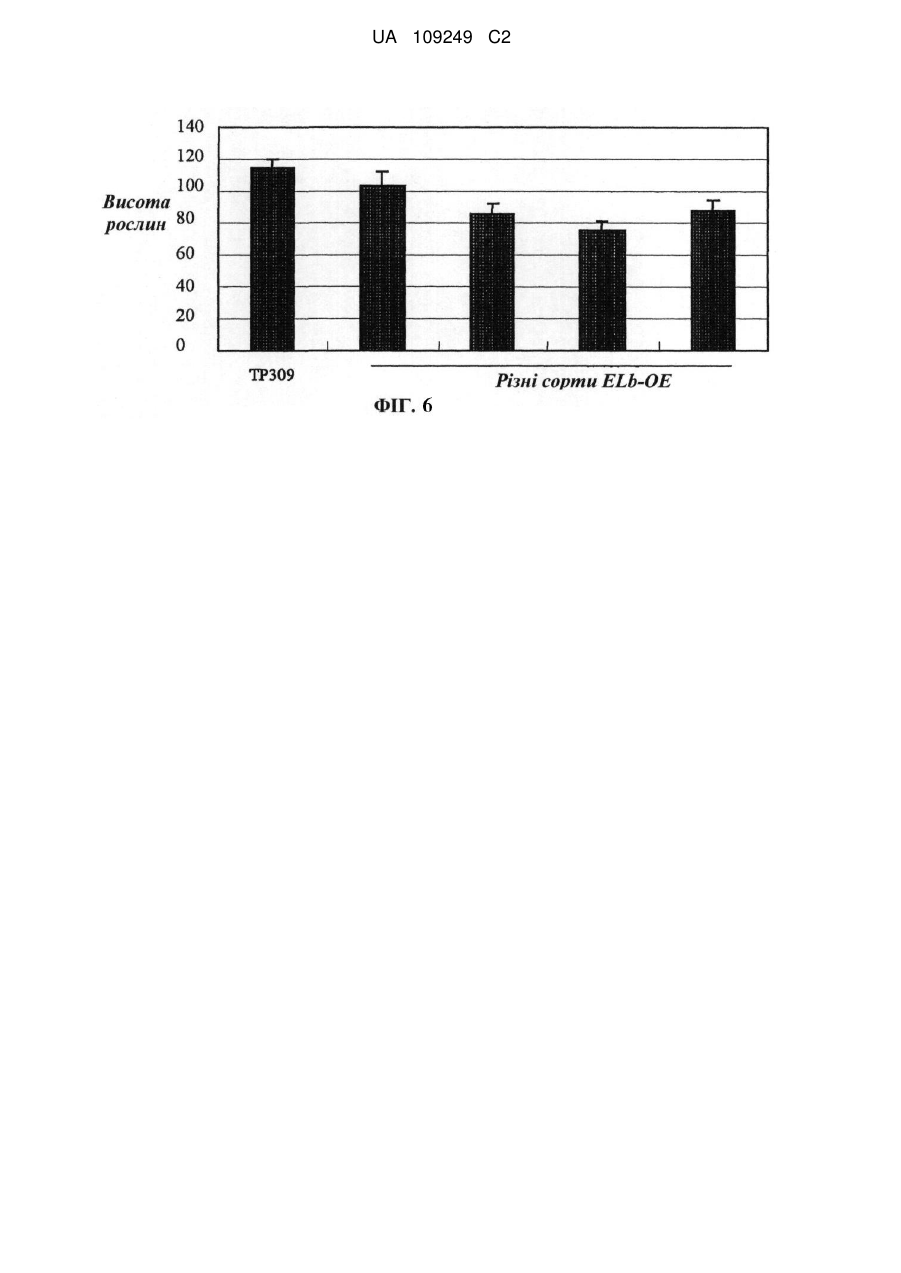
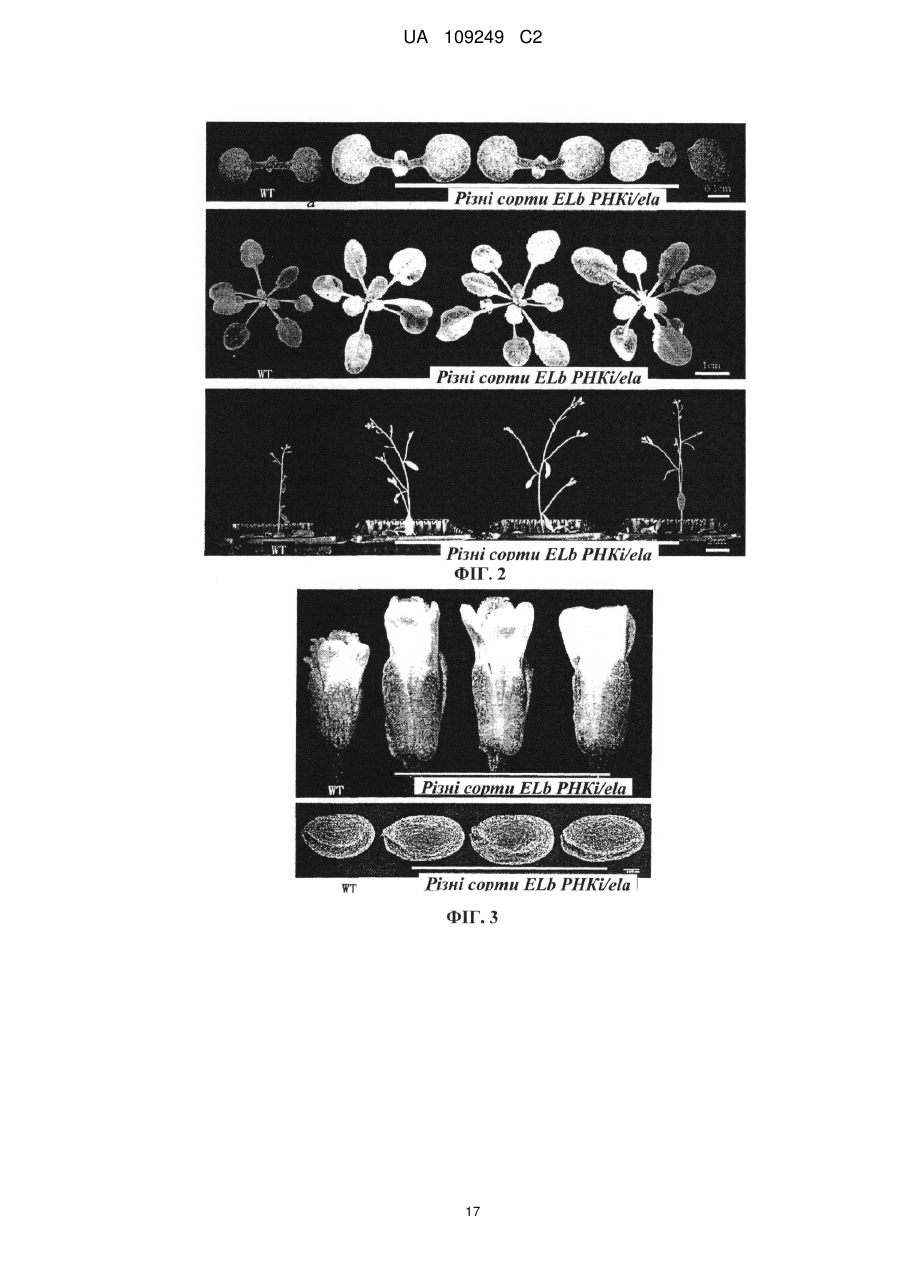
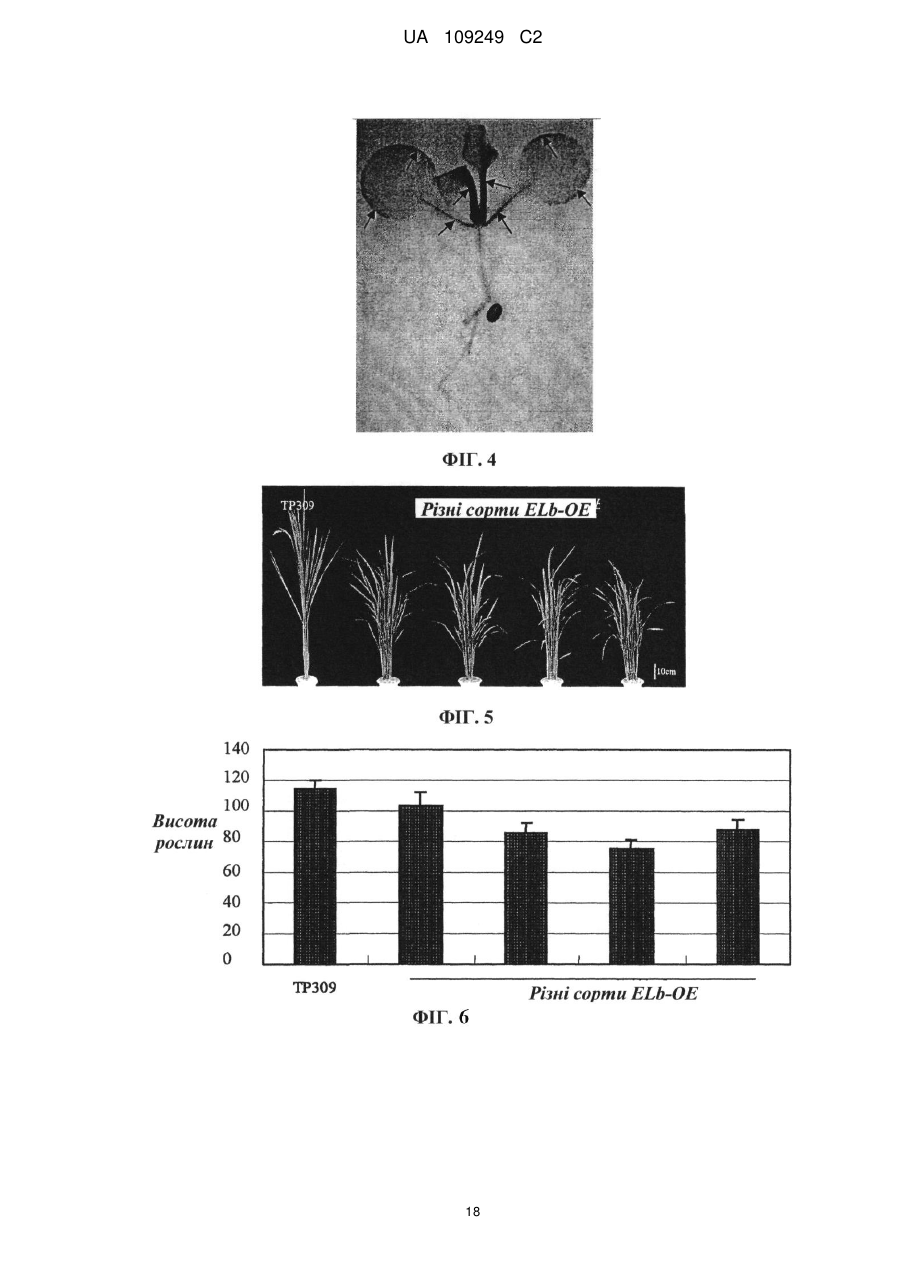
Реферат: Винахід належить до застосування поліпептиду регулювання висоти рослин, або полінуклеотиду, що кодує поліпептид регулювання висоти рослин, у покращенні агрономічних характеристик культури шляхом регулювання висоти, об'єму, кущіння, врожайності, розміру квіток або розміру насіння культур. Регулювання здійснюють шляхом введення зазначеного полінуклеотиду, що кодує поліпептид регулювання висоти рослини, у рослину, або шляхом введення у рослину вектора РНКi, який містить послідовність, що спрямовує полінуклеотид, що кодує поліпептид регулювання висоти рослини. UA 109249 C2 (12) UA 109249 C2 UA 109249 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь винаходу Даний винахід стосується галузей генетичної технології та ботаніки. Зокрема, даний винахід стосується гена регулювання висоти рослин та його застосування. Рівень техніки У даний час дослідження розведення високоврожайних культур зосереджується, головним чином, на поліпшенні типу рослини та особливостей волотей. На даний час було виведено багато високоврожайних сортів культур завдяки прогресові у поліпшенні культурних сортів. Однак значною проблемою яка існує для багатьох високоврожайних культур, таких, як високоврожайні культурні сорти рису (зокрема, супергібридні сорти рису), є надмірна висота рослин. Надмірна висота може призводити до високої схильності до вилягання (прибивання до землі) та обмеження потенціалу високої врожайності. Ця проблема значною мірою впливає на подальше збільшення врожайності та широке запровадження високоврожайних сортів. Відповідним чином, у галузі існує необхідність розробки способу регулювання висоти культурних рослин з метою подальшого поліпшення характеристик культур та підвищення врожайності культур. Короткий опис винаходу Метою даного винаходу є забезпечення гена регулювання висоти рослин та його застосування. У першому аспекті винахід забезпечує поліпептиди, які регулюють висоту окремих рослин, вибрані з групи, до якої належать: (a) поліпептид, який має амінокислотну послідовність, викладену у SEQ ID NO: 3; та (b) поліпептид, який походить від (a), який включає заміщення, делецію або додавання одного або кількох амінокислотних залишків в амінокислотній послідовності, викладеній у SEQ ID NO:3, і має функцію регулювання висоти рослини. В оптимальному варіанті втілення вищезгаданий поліпептид є поліпептидом, який має амінокислотну послідовність, викладену у SEQ ID NO: 3. У другому аспекті винахід забезпечує виділені полінуклеотиди, кожен з яких має нуклеотидну послідовність, вибрану з групи, до якої належать: (a) полінуклеотид, який кодує описаний вище поліпептид; та (b) полінуклеотид, який є комплементарним полінуклеотидові (a). В оптимальному варіанті втілення полінуклеотид кодує поліпептид, який має амінокислотну послідовність, викладену у SEQ ID NO:3. В іншому оптимальному варіанті втілення послідовність полінуклеотиду має нуклеотидну послідовність, викладену у SEQ ID NO: 2; або нуклеотидну послідовність, викладену у SEQ ID NO: 1. У третьому аспекті винахід забезпечує вектори, кожен з яких включає описаний вище полінуклеотид. У четвертому аспекті винахід забезпечує піддані генній інженерії клітини-хазяї, кожна з яких включає описаний вище вектор. У п’ятому аспекті винахід забезпечує рослини, кожна з яких включає описаний вище полінуклеотид. У шостому аспекті винахід забезпечує способи забезпечення описаних вище рослин, причому спосіб включає включення описаного вище полінуклеотиду у рослину. В оптимальному варіанті втілення описаний вище спосіб включає: (1) забезпечення клітин Agrobacterium, які несуть вектор експресії, який містить описаний вище полінуклеотид; (2) контактування клітин, тканин або органів рослини з клітинами Agrobacterium, описаними на етапі (1), для включення вищезгаданого полінуклеотиду у рослинні клітини та забезпечення об’єднання полінуклеотиду з хромосомами рослинних клітин; (3) вибір рослинної клітини, тканини або органа, що містить вищезгаданий полінуклеотид; та (4) забезпечення переродження нової рослини з рослинної клітини, тканини або органа, описаних на етапі (3). У сьомому аспекті винахід забезпечує способи утворення рослини. Кожен спосіб включає гібридизацію рослини з включеним полінуклеотидом з нетрансгенною рослиною, з одержанням, таким чином, гібридного потомства, яке містить вищезгаданий полінуклеотид. У восьмому аспекті винахід забезпечує способи утворення описаних вище поліпептидів. Спосіб включає: (a) культивування клітини-хазяїна, яка містить вищезгаданий полінуклеотид, в умовах, прийнятних для експресії; (b) виділення вищезгаданого поліпептиду з культури. 1 UA 109249 C2 5 10 15 20 25 30 35 40 45 50 55 60 У дев’ятому аспекті винахід забезпечує застосування поліпептиду або описаного вище полінуклеотиду, який його кодує, для: регулювання висоти рослини, об’єму, кущіння, врожайності, розміру квіток або розміру насіння культур; або одержання матеріалу для регулювання висоти рослини, об’єму, кущіння, врожайності, розміру квіток або розміру насіння культур. У десятому аспекті винахід забезпечує способи регулювання висоти рослини, об’єму, кущіння, врожайності, розміру квіток або розміру насіння культур. Спосіб включає регулювання експресії або активності гена регулювання висоти рослин у культурах. В іншому оптимальному варіанті втілення зменшення висоти та об’єму рослин і збільшення кущіння та врожайності досягають шляхом посилення експресії або активності регулюючого висоту рослини гена у культурах; і збільшення розміру квіток, розміру насіння, висоти або об’єму рослин досягають шляхом пригнічення експресії або активності регулюючого висоту рослини гена у культурах; В одинадцятому аспекті винахід забезпечує агоністи або антагоністи для описаного вище регулюючого висоту рослини поліпептиду або гена, який його кодує. У дванадцятому аспекті винахід забезпечує промотори для специфічної експресії у стеблах або листі рослин. Промотор вибирають із групи, до якої належать: (1) полінуклеотид, який має нуклеотидну послідовність, викладену у SEQ ID NO: 13; (2) полінуклеотид, здатний до гібридизації з полінуклеотидною послідовністю, описаною у (1), за жорстких умов, і здатний до спрямування специфічної експресії гена-мішені у стеблах або листі рослин; та (3) полінуклеотид, який має більше, ніж 70% (в оптимальному варіанті - більше, ніж 80%, у ще кращому варіанті - більше, ніж 90%, у найкращому варіанті - більше, ніж 95%, наприклад, 98%, 99%) ідентичності з нуклеотидною послідовністю, викладеною у SEQ ID NO:13, і здатний до спрямування специфічної експресії гена-мішені у стеблах або листі рослин. У тринадцятому аспекті винахід стосується застосування вищезгаданих промоторів для спрямування специфічної експресії гена-мішені у стеблах або листі рослин. У чотирнадцятому аспекті винахід забезпечує послідовності, кожна з яких включає описаний вище промотор для специфічної експресії у стеблах або листі рослин. В іншому оптимальному варіанті втілення описана вище послідовність включає принаймні один поліклональний сайт (наприклад, сайти рестрикції) для вставлення гена-мішені, який знаходиться за промотором для специфічної експресії у стеблах або листі рослин і функціонально з’єднується з ним. В іншому оптимальному варіанті втілення вищезгадана послідовність є вектором експресії. В іншому оптимальному варіанті втілення вищезгадана послідовність включає такі елементи, функціонально з’єднані один з одним: вищезгаданий промотор та ген-мішень. В іншому оптимальному варіанті втілення вищезгаданий ген-мішень є екзогенним геном. В іншому оптимальному варіанті втілення вищезгаданий ген-мішень є структурним геном. В іншому оптимальному варіанті втілення вищезгаданий ген-мішень може кодувати білок зі специфічною функцією. В іншому оптимальному варіанті втілення вищезгаданий ген-мішень знаходиться менше, ніж через 2000 п. о. (в оптимальному варіанті - менше, ніж 1000 п. о., у ще кращому варіанті менше, ніж 500 п. о., у найкращому варіанті - менше, ніж 300 п. о.) після вищезгаданого промотора. З огляду на представлений опис інші аспекти винаходу мають бути очевидними для спеціалістів у даній галузі. Короткий опис фігур Фігура 1 показує вид згори рослини Arabidopsis дикого типу (Wt) та надекспресуючої ELb (Eui-like b) трансгенної рослини Arabidopsis (ELb-OE). Надекспресуюча ELa (Eui-like a) трансгенна рослина Arabidopsis (ELa-OE) надекспресуюча OsEui рису трансгенна рослина Arabidopsis (OsEui-OE) служать контрольними зразками. Фігура 2 показує порівняння профілів росту між рослиною Arabidopsis дикого типу (Wt) та рослинами Arabidopsis ELb РНКi/ela. Фігура 3 показує порівняння профілів росту квіток та насіння між рослинами Arabidopsis Elb РНКi/ela та рослиною Arabidopsis дикого типу (Wt). Фігура 4 показує тканинно-специфічну експресію гена-репортера GUS, викликану ELb промотором. Стрілками показано ділянки, які мають синій колір. Фігура 5 показує порівняння профілів росту між рослиною рису дикого типу (TP309) та надекспресуючими Elb рослинами рису (ELb-OE). 2 UA 109249 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фігура 6 показує статистичний аналіз висоти рослин рису дикого типу (TP309) та надекспресуючих Elb рослин рису (ELb-OE). Фігура 7 показує статистичний аналіз ефективної кількості паростків рослини рису дикого типу (TP309) та надекспресуючих Elb рослин рису (ELb-OE). Фігура 8 показує порівняння маси зерен з окремої рослини між рослиною рису дикого типу (TP309) та надекспресуючими Elb рослинами рису (ELb-OE). Конкретні варіанти втілення Шляхом широких досліджень автори винаходу виявили ген Elb, який може бути застосований для регулювання висоти рослини, об’єму, кущіння, врожайності, розміру квіток та розміру насіння у культурах. Існує можливість зменшення висоти та об’єму рослин і збільшення ефективної кількості паростків та врожайності культур шляхом підвищення експресії цього гена. Також існує можливість збільшення розміру квіток та розмір насіння шляхом зниження експресії цього гена. Даний винахід ґрунтується на цих виявлених відомостях. У контексті даного опису термін “культура” або “культури” включає, крім іншого: злакові, хрестоцвітні та дерев’янисті рослини і т. ін. У ще кращому варіанті до злакових, крім інших, належать: рис, пшениця, ячмінь, кукурудза, сорго і т. ін.; або до хрестоцвітних, крім інших, належить Arabidopsis. У контексті даного опису термін “виділений” стосується матеріалу, виділеного з його первісних середовищ (первісними середовищами є природні середовища для природного матеріалу). Наприклад, природні полінуклеотиди та поліпептиди у живих клітинах не є виділеними і очищеними, але полінуклеотиди та поліпептиди є виділеними або очищеними після відокремлення від інших матеріалів, які зазвичай супроводжують їх у природному стані. У контексті даного опису термін “виділений регулюючий висоту рослини поліпептид”, “виділений білок ELb” або “виділений поліпептид ELb” стосується білка Elb, який є практично вільним від інших білків, ліпідів, сахаридів або інших матеріалів, які супроводжують білок ELb у природному стані. Спеціалісти у даній галузі зможуть очистити білок Elb з застосуванням стандартних способів очищення білка. Практично чистий поліпептид утворює єдину головну смугу у невідновному поліакриламідному гелі. У контексті даного опису термін “містить”, “має” або “включає” охоплює значення “здебільшого складається з” “по суті складається з” та “складається з”; “здебільшого складається з”, “по суті складається з” та “складається з” є певними формами термінів “містить”, “має” або “включає”. Поліпептид ELb та його застосування Поліпептиди згідно з винаходом можуть бути рекомбінантними поліпептидами, природними поліпептидами або синтетичними поліпептидами, в оптимальному варіанті - рекомбінантними поліпептидами. Поліпептиди згідно з винаходом можуть бути очищеними природними продуктами або хімічно синтезованими продуктами або продуктами, які одержують від прокаріотних або еукаріотних хазяїв (таких, як клітини бактерій, дріжджів, вищих рослин, комах та ссавців) з застосуванням рекомбінантних технологій. Поліпептиди згідно з винаходом можуть бути глікозилованими або неглікозилованими, залежно від клітин-хазяїв, які застосовують для рекомбінантного продукування. Поліпептиди згідно з винаходом можуть включати або не включати метіоніновий залишок у сайті ініціації. Винахід також охоплює фрагменти, похідні та аналоги білків ELb. У контексті даного опису термін “фрагмент”, “похідна” та “аналог” означає поліпептид, який зберігає по суті такі самі біологічні функції або активність, що й у поліпептидів ELb згідно з винаходом. Фрагменти, похідні та аналоги згідно з винаходом можуть бути (i) поліпептидами з одним або кількома заміщеними консервативними або неконсервативними амінокислотними залишками (в оптимальному варіанті - консервативним залишком), причому вищезгадані заміщені залишки можуть бути або не бути кодованими генетичними кодами, або (ii) поліпептидами з заміщувальною(ими) групою(ами) в одному або кількох амінокислотних залишках, або (iii) поліпептид, який походить від зрілого поліпептиду, з’єднаного з іншою сполукою (такою, як сполука, здатна подовжувати півперіод поліпептиду, наприклад, поліетиленгліколь), або (iv) поліпептид, який походить від вищезгаданого поліпептиду, з’єднаного з додатковою амінокислотною послідовністю (наприклад, лідерною послідовністю, секретуючою послідовністю, послідовністю, яку застосовують для очищення вищезгаданого поліпептиду, протеїногенною послідовністю або злитим білком). Як зазначено авторами, ці фрагменти, похідні та аналоги є добре відомими спеціалістам у даній галузі. Згідно з винаходом, термін “білок ELb” означає поліпептид, викладений у SEQ ID NO: 3, який має активність білка ELb. Цей термін також охоплює варіанти поліпептиду SEQ ID NO: 3, який має таку саму функцію, що й білок ELb. Ці варіанти включають (крім інших) делецію, інсерцію 3 UA 109249 C2 5 10 15 20 25 30 35 40 та/або заміщення кількох (як правило, 1-50, в оптимальному варіанті - 1-30, у ще кращому варіанті - 1-20, у найкращому варіанті - 1-10, у ще кращому варіанті - 1-8 або 1-5) амінокислота, а також додавання однієї або кількох (як правило, менше, ніж 20, в оптимальному варіанті менше, ніж 10, у ще кращому варіанті - менше, ніж 5) амінокислот до C-кінця та/або N-кінця. Наприклад, функції білків зазвичай не змінюються через заміщення однієї амінокислоти іншою амінокислотою, яка має таку саму або подібну властивість. Як ще один приклад, функції білків зазвичай також не змінюються через додавання однієї або кількох амінокислот до C-кінця та/або N-кінця. Цей термін, білок ELb, також охоплює активні фрагменти та похідні білка ELb. Варіанти поліпептиду включають: гомологічні послідовності, консервативні варіанти, алельні варіанти, природні мутанти, індуковані мутанти, білки, кодовані послідовністю ДНК, яка гібридизується з ELb-білком, який кодує послідовність ДНК в умовах високої або низької жорсткості, і поліпептиди або білки, одержані з застосуванням антитіл проти білка ELb. Винахід також забезпечує інші поліпептиди, такі, як злиті білки, які включають білок ELb або його фрагмент. Крім поліпептиду майже повної довжини, винахід також включає розчинні фрагменти білка ELb. Ці фрагменти зазвичай включають принаймні приблизно 20 суміжних амінокислот, як правило, принаймні приблизно 30 суміжних амінокислот, в оптимальному варіанті - принаймні приблизно 50 суміжних амінокислот, у ще кращому варіанті - принаймні приблизно 80 суміжних амінокислот, у найкращому варіанті - принаймні приблизно 100 суміжних амінокислот у послідовності білка ELb. Винахід також забезпечує аналоги білків ELb або поліпептидів. Різниця між цими аналогами та природним білком ELb може бути різницею в амінокислотній послідовності, різницею у моделях модифікації, які не ведуть до будь-якої зміни послідовності, або включає і ту, й іншу. Ці поліпептиди включають природні або індуковані генетичні варіанти. Індуковані варіанти можуть бути одержані різними способами, такими, як неспецифічний мутагенез шляхом піддавання дії опромінення або мутагену, а також сайт-специфічний мутагенез або інші відомі технології молекулярної біології. Ці аналоги також включають аналоги, які містять залишок (наприклад, Dамінокислоту), відмінний від природних L-амінокислотних залишків, та аналоги, які містять неприродну або синтетичну амінокислоту (наприклад, β, γ-амінокислоту). Слід розуміти, що поліпептиди згідно з винаходом не обмежуються типовими поліпептидами, описаними вище. До модифікованих (як правило, таких, що не ведуть до зміни у первинній структурі) форм належать: хімічно похідна форма, наприклад, ацетилована або карбоксилована форма пептиду in vivo або in vitro. Модифікації також включають глікозилування. Модифіковані форми також включають послідовність, яка містить фосфориловану амінокислоту (наприклад, фосфотирозин, фосфосерин, фосфотреонін), або поліпептид, модифікований таким чином, щоб підвищувалася стійкість до протеолізу або забезпечувалася оптимальна розчинність. Згідно з даним винаходом, “консервативний варіантний поліпептид білка ELb” означає поліпептиди, які містять до 20, в оптимальному варіанті - щонайбільше 10, у ще кращому варіанті - щонайбільше 5, у найкращому варіанті - щонайбільше 3 амінокислоти, заміщені іншими амінокислотами з подібними або порівнянними властивостями порівняно з амінокислотною послідовністю, викладеною у SEQ ID NO:3. В оптимальному варіанті ці консервативні варіантні пептиди одержують шляхом заміщення амінокислот згідно з Таблицею 1. Таблиця 1 Амінокислотний залишок Ala (A) Arg (R) Asn (N) Asp (D) Cys (C) Gln (Q) Glu (E) Gly (G) His (H) Ile (I) Leu (L) Lys (K) Met (M) Типове заміщення Val; Leu; Ile Lys; Gln; Asn Gln; His; Lys; Arg Glu Ser Asn Asp Pro; Ala Asn; Gln; Lys; Arg Leu; Val; Met; Ala; Phe Ile; Val; Met; Ala; Phe Arg; Gln; Asn Leu; Phe; Ile 4 Оптимальне заміщення Val Lys Gln Glu Ser Asn Asp Ala Arg Leu Ile Arg Leu UA 109249 C2 Таблиця 1 Амінокислотний залишок Phe (F) Pro (P) Ser (S) Thr (T) Trp (W) Tyr (Y) Val (V) 5 10 15 20 25 30 35 40 45 50 Типове заміщення Leu; Val; Ile; Ala; Tyr Ala Thr Ser Tyr; Phe Trp; Phe; Thr; Ser Ile; Leu; Met; Phe; Ala Оптимальне заміщення Leu Ala Thr Ser Tyr Phe Leu Винахід також забезпечує полінуклеотидні послідовності, які кодують білки ELb згідно з винаходом, або їх консервативні варіантні поліпептиди. Полінуклеотидами згідно з винаходом можуть бути ДНК або РНК. До ДНК належать кДНК, геномні ДНК або штучні синтетичні ДНК. ДНК може бути одноланцюговою або дволанцюговою. ДНК може бутикодуючим ланцюгом або некодуючим ланцюгом. Послідовність кодуючої ділянки, яка кодує зрілий поліпептид, може бути такою самою, як послідовність кодуючої ділянки, викладена у SEQ ID NO: 2, або її виродженим варіантом. У контексті даного опису термін “вироджений варіант” означає полінуклеотидну послідовність, яка кодує білок з послідовністю, викладеною у SEQ ID NO: 3, але відмінну від кодуючої ділянки послідовності, викладеної у SEQ ID NO:2. Полінуклеотиди, які кодують зрілий поліпептид, викладений у SEQ ID NO:3, включають: кодуючу послідовність, яка кодує лише зрілий поліпептид; послідовність, яка кодує зрілий поліпептид, та різні додаткові кодуючі послідовності; послідовність, яка кодує зрілий поліпептид (та будь-яку додаткову кодуючу послідовність) та некодуючу послідовність. Термін “полінуклеотид, який кодує поліпептид”, означає полінуклеотид, який кодує поліпептид, або полінуклеотид, який також містить додаткові кодуючі та/або некодуючі послідовності. Винахід також стосується варіантів вищезгаданих полінуклеотидів, які кодують поліпептиди з такими самими амінокислотними послідовностями, як описано вище, або їх фрагменти, аналоги та похідні. Варіанти полінуклеотидів можуть бути природними алельними варіантами або неприродними варіантами. Ці нуклеотидні варіанти включають заміщення, делеції та інсерції. Як відомо спеціалістам у даній галузі, алельний варіант є альтернативою полінуклеотидові, який може включати один або кілька заміщених, делетованих або вставлених нуклеотидів, які не ведуть суттєвої зміни функції у поліпептиді, який кодується варіантом. Винахід також стосується полінуклеотидів, які гібридизуються з описаними вище послідовностями, і мають принаймні 50%, в оптимальному варіанті - принаймні 70%, у ще кращому варіанті - принаймні 80% ідентичності з описаними вище послідовностями. Зокрема, винахід стосується полінуклеотидів, які гібридизуються з описаними авторами полінуклеотидами, за жорстких умов. Згідно з винаходом, “жорсткі умови” стосуються (1) гібридизації та промивання при низькій іонній силі та високій температурі, наприклад, 0,2x SSC, 0,1%SDS, 60°C; або (2) гібридизації у присутності денатуруючого засобу, такого, як 50% (об’єм/об’єм) формаміду, 0,1% сироватки великої рогатої худоби/0,1% Ficoll, 42°C, і т. ін.; або (3) гібридизації, яка відбувається лише між двома послідовностями, які мають принаймні 80%, в оптимальному варіанті - принаймні 90%, у ще кращому варіанті - більше, ніж 95% ідентичності. Крім того, біологічні функції та активність поліпептидів, кодованих полінуклеотидами, які піддаються гібридизації, є такими самими, що й у зрілого поліпептиду, викладеного у SEQ ID NO:3. Винахід також стосується фрагментів полінуклеотидів, які гібридизуються з описаними вище послідовностями. У контексті даного опису термін “фрагмент полінуклеотиду” має довжину принаймні 15, в оптимальному варіанті - принаймні 30, у ще кращому варіанті - принаймні 50, у найкращому варіанті - принаймні 100 або більше нуклеотидів. Фрагменти полінуклеотидів можуть застосовуватися зі способами ампліфікації нуклеїнових кислот (наприклад, ПЛР) для визначення та/або виділення полінуклеотидів, які кодують білок ELb. Слід розуміти, що, згідно з варіантами втілення винаходу, ген ELb в оптимальному варіанті походить з рослини Arabidopsis. Однак варіанти втілення винаходу також охоплюють інші гени, які мають високу гомологію (наприклад, більше, ніж 60%, наприклад, 70%, 80%, 85%, 90%, 95%, навіть 98% ідентичності послідовності) з геном ELb Arabidopsis і походять з інших рослин. Способи вирівнювання та способи визначення ідентичності або гомології послідовності (такі, як BLAST) є добре відомими спеціалістам у даній галузі. 5 UA 109249 C2 5 10 15 20 25 30 35 40 45 50 55 Нуклеотидні послідовності повної довжини, які кодують білок ELb згідно з винаходом, або їх фрагменти можуть бути утворені з застосуванням ПЛР-ампліфікації, рекомбінантної технології або хімічного синтезу. Для ПЛР-ампліфікації праймери можуть бути побудовані згідно з відповідними нуклеотидними послідовностями, зокрема, послідовності відкритих рамок зчитування, описана бібліотека кДНК промислового виробництва та бібліотека кДНК, одержана традиційними способами, відомими спеціалістам у даній галузі, можуть застосовуватись як матриці. При застосуванні цих праймерів та бібліотек здійснюють ПЛР-ампліфікацію для одержання потрібних послідовностей. Якщо послідовності є довгими, зазвичай буває необхідним здійснення ПЛР двічі або кілька разів, з наступним лігуванням ампліфікованих фрагментів у правильному порядку. Відразу після одержання потрібної послідовності велика кількість потрібної послідовності може бути одержана рекомбінантними способами. Зазвичай потрібну послідовність клонують у вектор і вектор включають у клітини, а потім потрібні послідовності виділяють з розмножених клітин-хазяїв традиційними способами. Крім того, потрібні послідовності, зокрема, коротші фрагменти, можуть бути одержані шляхом хімічного синтезу. Як правило, спочатку синтезують багато малих фрагментів, а потім їх піддають лігуванню для утворення довгого фрагмента. У даний час існує можливість одержання послідовності ДНК, яка кодує білок згідно з даним винаходом (або його фрагмент або похідну) виключно шляхом хімічного синтезу. Потім цю ДНК включають у різні існуючі молекули ДНК (наприклад, вектори) та клітини, відомі спеціалістам у даній галузі. Крім того, деякі мутації також можуть бути включені у білок згідно з даним винаходом шляхом хімічного синтезу. Винахід також стосується векторів, які містять полінуклеотиди згідно з винаходом, клітинихазяї, одержані в результаті генної інженерії з застосуванням цих векторів або послідовностей, які кодують білок ELb, а також способів одержання поліпептидів згідно з винаходом за допомогою рекомбінантних технологій. З застосуванням традиційних технологій рекомбінантних ДНК (Science, 1984; 224:1431) можуть бути одержані полінуклеотидні послідовності згідно з винаходом, які експресують або виробляють рекомбінантні білки ELb. Цей спосіб зазвичай включає такі етапи: (1) трансформацію або трансдукцію відповідних клітин-хазяїв полінуклеотидом (або його варіантами), який кодує білок ELb, або рекомбінантним вектором експресії, який містить вищезгаданий полінуклеотид; (2) культивування клітин-хазяїв у відповідному середовищі; (3) виділення та очищення білка від середовища або клітин. Згідно з винаходом, полінуклеотидна послідовність, яка кодує білок Elb, може бути включена у рекомбінантний вектор експресії. Термін “рекомбінантний вектор експресії” означає бактеріальну плазміду, фаг, дріжджову плазміду, вірус рослинної клітини, вірус клітини ссавця або інші вектори. Взагалі, можуть застосовуватися будь-яка плазміда та вектор, якщо вони є здатними до реплікації та стабілізації в організмі-хазяїні. Важливою особливістю вектора експресії є те, що він має реплікаційне походження, промотор, організуючий ген та контрольний елемент трансляції. Вектор експресії, який містить послідовність ДНК, яка кодує білок ELb, та відповідний контрольні сигнали транскрипції/трансляції, може бути побудований з застосуванням способів, добре відомих спеціалістам у даній галузі. До цих способів належать in vitro технології рекомбінантних ДНК, технології синтезу ДНК, in vivo рекомбінантні технології і т. ін. Вищезгадані послідовності ДНК можуть бути ефективно зв’язані з відповідним промотором у векторі експресії з метою спрямування синтезу мРНК. Вектор експресії також може включати сайт зв’язування рибосом як сайт ініціації трансляції та термінатор транскрипції. Крім того, вектор експресії в оптимальному варіанті включає один або кілька селектованих маркерних генів, таких, як дигідрофолатредуктаза, білок, який забезпечує стійкість до неоміцину, або зелений флуоресцентний білок (GFP), який використовують у культурі еукаріотних клітин, або білок, який забезпечує стійкість до канаміцину або стійкість до ампіциліну, які використовують у культурі E. coli, для забезпечення фенотипів, придатних для відбору трансформованих клітин-хазяїв. Вектор, який містить відповідну описану вище послідовність ДНК та відповідну описану вище промоторну або контрольну послідовність, може застосовуватися для трансформації відповідних клітин-хазяїв для експресії білків. Клітини-хазяї можуть бути прокаріотними клітинами, такими, як бактеріальні клітини; або нижчими еукаріотними клітинами, такими, к дріжджові клітини; або вищими еукаріотними 6 UA 109249 C2 5 10 15 20 25 30 35 40 45 50 55 клітинами, такими, як рослинні клітини. Типовими прикладами є E. coli, Streptomyces, Agrobacterium; грибкові клітини, наприклад, дріжджі; рослинні клітини і т. ін. Включена енхансерна послідовність у векторі має підвищувати транскрипцію, коли полінуклеотид згідно з винаходом експресується у вищих еукаріотних клітинах. Енхансер, діючий у цис-позиції фактор ДНК, як правило, включає приблизно 10-300 пар основ і діє на промотор для підвищення транскрипції генів. Спеціалістам у даній галузі стане зрозуміло, яким чином вибрати відповідні вектори, промотори, енхансери та клітини-хазяї. Трансформація клітин-хазяїв рекомбінантною ДНК може здійснюватися з застосуванням традиційних способів, добре відомих спеціалістам у даній галузі. Для прокаріотних хазяїв, таких, як E. coli, компетентні клітини, здатні поглинати ДНК, можуть бути одержані шляхом збирання клітин після фази експоненційного росту та обробки клітин CaCl2. Ці способи одержання є добре відомими спеціалістам у даній галузі. Згідно з іншим способом, застосовують обробку MgCl 2. Трансформація у разі необхідності також може здійснюватися шляхом електропорації. Для еукаріотних хазяїв можна застосовувати відповідні способи трансфекції ДНК, наприклад, співосадження з фосфатом кальцію, традиційні механічні способи, такі, як мікроін’єкція, електропорація, інкапсуляція у ліпосоми і т. ін. Рослинні клітини можуть бути трансформовані з застосуванням таких способів, як опосередкована Agrobacterium трансформація або трансформація генною гарматою, та інші способи, такі, як спосіб leaf dish, трансформація недозрілого зародка рису і т. ін. З трансформованих рослинних клітин, тканин або органів відновлюють нові рослини традиційними способами для одержання рослин зі зміненими ознаками. Одержані в результаті трансформанти вирощують традиційним способом для експресії поліпептиду, який кодується генами згідно з винаходом. Культуральне середовище може бути вибране з-поміж різних традиційних середовищ, залежно від використовуваних клітин-хазяїв. Культивування здійснюють в умовах, прийнятних для вирощування клітини-хазяїна. Вибраний промотор може бути індукований з застосуванням відповідного способу (наприклад, змін температури або хімічної індукції), коли клітини-хазяї вирощують до відповідної густини, а потім клітини культивують протягом додаткового періоду. Описані вище рекомбінантні поліпептиди можуть бути експресовані внутрішньоклітинно або на клітинній мембрані, або можуть бути секретовані клітинами. У разі необхідності рекомбінантні білки можуть бути виділені й очищені різними способами з використанням переваг їх фізичних, хімічних та інших властивостей. Ці способи є добре відомими спеціалістам у даній галузі. Прикладами таких способів, крім інших, є традиційна ренатурація, обробка осаджувачем білка (висолювання), центрифугування, руйнування бактерій шляхом осмосу, ультразвукова обробка, ультрацентрифугування, хроматографія на молекулярних ситах (гельфільтрація), адсорбційна хроматографія, іонообмінна хроматографія, високоефективна рідинна хроматографія (HPLC) та інша рідинна хроматографія, а також їх комбінації. Рекомбінантні білки Elb можуть застосовуватися, наприклад, для відбору антитіл, поліпептидів або інших лігандів, здатних посилювати або пригнічувати функції білка ELb. Відбір у бібліотеці поліпептидів з експресованим рекомбінантним білком ELb застосовують для пошуку потрібних молекул поліпептидів, які пригнічують або стимулюють функції білка ELb. Частина цілих полінуклеотидів згідно з винаходом може бути іммобілізована на мікроматриці або ДНК-чіпі (“генному чіпі”) як зонди для аналізу диференційної експресії генів у тканинах. Транскрипти білка Elb можуть бути виявлені шляхом in vitro ампліфікації з застосуванням полімеразної ланцюгової реакції РНК (RT-PCR) та специфічних праймерів для білка ELb. Винахід також стосується способів поліпшення культур, які включають регулювання експресії або активності гена ELb або його гомологічного гена у рослинах. Посилення або пригнічення експресії або активності ELb залежить від характеристик рослини, які підлягають поліпшенню. Необхідність у зменшенні висоти та об’єму рослин або збільшенні кущіння та врожайності може задовольнятися шляхом посилення експресії або активності ELb у культурах; в альтернативному варіанті необхідність у збільшенні розміру квіток, розміру насіння, висоти або об’єму рослин може задовольнятися шляхом пригнічення експресії або активності регулюючих висоту рослини генів у культурах. Способи посилення експресії гена ELb або гомологічного гена є добре відомими спеціалістам у даній галузі. Наприклад, експресійна послідовність, яка містить кодуючий ELb ген, може бути включена у рослину для надекспресії ELb; або посилення експресії гена ELb або гомологічного гена може бути викликане сильним промотором; або експресія гена ELb може бути посилена енхансером (наприклад, першим інтроном waxy-гена рису, першим інтроном гена 7 UA 109249 C2 5 10 15 20 25 30 35 40 45 50 55 60 актину і т. ін.). До сильних промоторів, придатних для цих способів, крім інших, належать: 35sпромотор, Ubi-промотори рису та кукурудзи і т. ін. Способи пригнічення експресії гена ELb або гомологічного гена є добре відомими спеціалістам у даній галузі. Наприклад, інгібування може здійснюватися шляхом РНКінтерференції (РНКi) або за допомогою сайленсингу (нокауту) генів. В оптимальному варіанті втілення винаходу спосіб одержання рослини з високою експресією ELb включає такі етапи: (1) забезпечення клітин Agrobacterium, які несуть вектор експресії, який містить кодуючу послідовність ДНК білка ELb; (2) контактування клітин, тканин або органів рослини з клітинами Agrobacterium, описаними на етапі (1), для включення вищезгаданої кодуючої послідовності ДНК білка ELb у рослинні клітини, тканини або органи та забезпечення їх включення у хромосоми рослинних клітин; (3) відбір рослинних клітин, тканин або органів, які містять вищезгадану кодуючу послідовність ДНК білка ELb; та (4) відновлення нової рослини з рослинних клітин, тканин або органів, описаних на етапі (3). Для практичного втілення цього способу можуть застосовуватися будь-які традиційні засоби, включаючи реагент, температуру, тиск і т. ін. Даний винахід також стосується агоністів або антагоністів білка ELb або його кодуючого гена. Агоністи або антагоністи можуть регулювати активність або експресію ELb, а отже, можуть застосовуватися для регулювання висоти, об’єму, кущіння, врожайності рослин, розміру квіток або розміру насіння та інших характеристик у культурах через їх вплив на функції Elb з метою досягнення потрібного поліпшення характеристик. Антагоніст ELb означає агент, здатний знижувати активність та стійкість ELb, знижуючи експресію ELb, скорочуючи час ефективної дії Elb або пригнічуючи транскрипцію або трансляцію ELb. Ці агенти можуть застосовуватися, згідно з даним винаходом, як корисні агенти для збільшення розміру квіток, розміру насіння, висоти рослин або об’єму рослин. Агоніст ELb означає агент, здатний підвищувати активність ELb, підтримувати стійкість ELb, сприяти експресії ELb, подовжувати час ефективної дії Elb або сприяти транскрипції або трансляції ELb. Ці агенти можуть застосовуватися, згідно з даним винаходом, як корисні агенти для зменшення висоти та об’єму рослин і збільшення кущіння та врожайності культур. В одному варіанті втілення винахід стосується гена Elb, який має геномну послідовність, викладену у SEQ ID NO:1, у якій відкрита рамка зчитування (ORF) розташовується у ділянках 61-353, 1363-1585, 1690-1943, 2028-2414, 2559-2979, і кДНК повної довжини (SEQ ID NO:1) має 1578 п. о., які кодують білок, який включає 525 амінокислот (SEQ ID NO:3). Ген ELb забезпечує новий засіб поліпшення висоти, об’єму, врожайності, кущіння рослин і т. ін., а отже, є перспективним. Промотор для специфічної експресії у стеблах або листі рослин та спрямування експресії гена У контексті даного опису термін “промотор” або “промоторна ділянка” означає нуклеотидну послідовність, яка зазвичай знаходиться перед (5’) кодуючою послідовністю гена-мішені, що започатковує полінуклеотидну послідовність транскрипції у мРНК. Я правило, промотор або промоторна ділянка може забезпечувати сайт розпізнавання для РНК-полімераз та інших факторів, необхідних для належного започаткування транскрипції. У даному разі промотор або промоторна ділянка включає варіант промотора, тобто, природний алельний варіант або неприродний варіант, включаючи заміщення, делецію та інсерцію. У контексті даного опису термін “тканинно-специфічний промотор” або “органоспецифічний промотор” означає, що експресія гена зазвичай відбувається лише у певних органах або тканинах під контролем цих промоторів. У контексті даного опису термін “функціонально зв’язаний” означає функціональне просторове розташування двох або більшої кількості нуклеїновокислотних ділянок або нуклеїновокислотних послідовностей. Наприклад, промоторна ділянка розташовується у певній позиції відносно нуклеїновокислотної послідовності гена-мішені таким чином, що транскрипція нуклеїновокислотної послідовності перебуває під контролем промоторної ділянки, і, відповідно, промоторна ділянка може бути “функціонально зв’язаною” з нуклеїновокислотною послідовністю. Як правило, промотор вважається тканинно-специфічним або органоспецифічним, якщо експресія мРНК у тканині або органі є принаймні вдвічі, в оптимальному варіанті - принаймні у 5 разів, у ще кращому варіанті - принаймні у 10 разів, у ще кращому варіанті - принаймні у 25 разів, у ще кращому варіанті - принаймні у 50 разів, у ще кращому варіанті - принаймні у 100 разів, у найкращому варіанті - принаймні у 1000 разів вищою, ніж в інших тканинах або органах. 8 UA 109249 C2 5 10 15 20 25 30 35 40 45 50 55 Винахід стосується промотора, вибраного з групи, до якої належать: (1) полінуклеотид, який має нуклеотидну послідовність, викладену у SEQ ID NO:13; або (2) полінуклеотид, який гібридизується з полінуклеотидною послідовністю, описаною у п. (1), за жорстких умов і спрямовує специфічну експресію гена-мішені у стеблах або листі рослин. Згідно з винаходом, термін “жорсткі умови” означає (1) гібридизацію та промивання при низькій іонній силі та високій температурі, наприклад, 0,2x SSC, 0,1%SDS та 60°C; або (2) гібридизацію у присутності денатуруючого засобу, такого, як 50% (об’єм/об’єм) формаміду, 0,1% сироватки великої рогатої худоби/0,1% Ficoll та 42°C і т. ін.; або (3) гібридизацію, яка відбувається лише між двома послідовностями, які мають принаймні 80%, в оптимальному варіанті - принаймні 90%, у ще кращому варіанті - більше, ніж 95% ідентичності. Крім того, полінуклеотид, який піддається гібридизації, може спрямовувати специфічну експресію генамішені у стеблах або листі рослин. Гібридизація полінуклеотиду є способом, добре відомим спеціалістам у даній галузі, і профіль гібридизації для пари певних полінуклеотидів вказує на їхню подібність або ідентичність. Таким чином, винахід також стосується полінуклеотиду, який гібридизується з нуклеотидною послідовністю, яка є викладеною у SEQ ID NO: 13, і має принаймні 50%, в оптимальному варіанті - принаймні 60%, у ще кращому варіанті - принаймні 70%, у ще кращому варіанті - принаймні 80%, у ще кращому варіанті - принаймні 85%, у ще кращому варіанті принаймні 90% (наприклад, 95%, 96%, 97%, 98% або 99%) ідентичності з нуклеотидною послідовністю, викладеною у SEQ ID NO: 13. Промотор згідно з винаходом є специфічним для тканини або органа рослини, зокрема, для стебел або листя рослин. У деяких варіантах втілення винаходу авторами було виявлено, що ген ELb або ген GUS може специфічно експресуватися у стеблах або листі рослин, але практично не експресується в інших тканинах або органах під контролем промотора згідно з винаходом. Промотор згідно з винаходом може бути функціонально зв’язаним з геном-мішенню, який може бути екзогенним (гетерогенним) з промотором. Ген-мішень зазвичай є нуклеотидною послідовністю (в оптимальному варіанті - структурною нуклеотидною послідовністю), в оптимальному варіанті - кодує білок зі специфічною функцією, такий, як певні білки, які регулюють ріст стебел та листя рослин, зокрема, білки, пов’язані з висотою рослин, згідно з варіантами втілення винаходу. Промотор згідно з винаходом також може бути функціонально зв’язаним з поліпшеним геном-мішенню, який є екзогенним (гетерогенним) з промотором. Ген-мішень може бути поліпшений таким чином, щоб мати різні потрібні властивості, такі, як посилена експресія, змінена посттрансляційна модифікація (наприклад, сайт фосфорилування), перенесення продукту трансляції з клітини, поліпшена стійкість, інсерція або делеція клітинного сигналу і т. ін. Крім того, промотор та ген-мішень можуть бути призначені для знижувальної регуляції певного гена, яка зазвичай досягається шляхом зв’язування промотора з послідовністю генамішені, і спрямування послідовності у зворотному напрямку і в антисмисловий спосіб. Спеціалістам у даній галузі є відомими антисмислові технології. Будь-які нуклеотидні послідовності можуть регулюватись у такий спосіб. Будь-яка описана вище послідовність промотора та гена-мішені може бути включена у конструкцію, зокрема, рекомбінантний вектор. Рекомбінантний вектор зазвичай включає функціонально зв’язаний (як правило, 5’→3’) промотор для започаткування транскрипції гена-мішені та ген-мішень. У разі необхідності рекомбінантний вектор також може включати 3’ термінатор транскрипції, 3’ сигнал поліаденілування, інші нетрансляційні нуклеотидні послідовності, транспортну або спрямовуючу нуклеотидну послідовність, маркер вибору резистентності, енхансер, або оперон. Як правило, ген-мішень знаходиться менше, ніж через 2000 п. о. (в оптимальному варіанті менше, ніж 1000 п. о., у ще кращому варіанті - менше, ніж 500 п. о., у найкращому варіанті менше, ніж 300 п. о.) після промотора для специфічної експресії у стеблах або листі рослин. Крім промотора згідно з винаходом, рекомбінантний вектор також може включати один або кілька інших промоторів, таких, як тканинно-специфічні, конститутивні або індуцибельні промотори. Вектор, який містить відповідний описаний вище промотор та ген-мішень, може застосовуватися для трансформації відповідних клітин-хазяїв для експресії білка. Перевагами винаходу є: 9 UA 109249 C2 5 10 15 20 25 30 35 40 45 50 55 60 (1) забезпечення нових виділених регулюючих висоту рослин генів, які є здатними регулювати висоту, об’єм, кущіння, врожайність рослин, розмір квіток або розмір насіння культур; таким чином, вони можуть застосовуватися для поліпшення культурних сортів. (2) регуляторний ген згідно з винаходом може бути трансформований у культури для зменшення висоти рослини, що може бути корисним для розведення карликових типів рослин, оскільки помірно зменшена висота рослин та збільшена ефективна кількість паростків є ідеотипами високоврожайного розведення. Наприклад, різні рівні експресії у злакових культурах можуть використовуватися для зменшення висоти рослин різною мірою для збільшення ефективної кількості паростків та врожаїв. (3) вперше виділено промотор регулюючого висоту рослини гена, який спрямовує специфічну експресію у стеблах або листі рослин і може застосовуватися для регулювання специфічної експресії гена-мішені у стеблах або листі рослин. Винахід далі описується більш детально у комбінації з представленими нижче прикладами. Слід розуміти, що ці приклади представлено лише для пояснення без обмеження обсягу винаходу. Аналізи, які конкретно не описуються у представлених нижче прикладах, можуть виконуватися згідно з традиційними процедурами, як описано у публікаціях Sambrook et al, Molecular Cloning: Laboratory Manual (Cold Spring Harbor Laboratory Press, New York, 2001) або PCR праймер: Laboratory Manual (Carl W. Dieffenbach and Gabriela S. Devksler eds., Cold Spring Harbor Laboratory Press, 1995), або згідно з рекомендаціями виробників. Матеріали 1.1 Рослинні матеріали Arabidopsis thaliana, етотипом є Columbia (Col-0). Мутант з інсерцією Т-ДНК: ELa (SALK_016089) Сорт рису: Taipei 309 (Oryza sativa L.ssp Japonica. cv Taipei309, TP309). 1.2 Штами бактерій та плазмідні вектори Agrobacterium tumefaciens: GV3101 (див. Narasimhulu, S.B, et al, Gelvin. 1996. Early transcription of Agrobacterium t-DNA genes in tobacco and maize. Plant Cell 8:873-886), EHA105 (див. Hood, E.E. et al, 1993, New Agrobacterium helper plasmids for gene transfer to plants. Transgen. Res. 2:208-218). Плазмідні вектори: pBluescript SK (pSK): придбаний у Invitrogen Inc. pCambia1300S: pCambia1300RS, придбаний у CAMBIA. pBI101.1: придбаний у Invitrogen Inc. pGEM-T Easy вектор: придбаний у Promega Inc. РНКi-вектор 1300RS: отриманий від Arkansas State University, USA. 1.3 Реагенти та ферменти T4 ДНК-лігаза, різні рестриктивні ендонуклеази та Taq ДНК-полімеразу придбавали у MBI Ferment, TaKaRa, New England Biolabs або Promega. Відновний комплект для фрагмента ДНК у гелі придбавали у Omega Inc. Систему зворотної транскрипції придбавали у GIBCOBRL. Маркери молекулярної маси нуклеїнових кислот є продуктами MBI. Вектор pGEM-Teasy 32 придбавали у Promega Inc. (Madison, USA). (α- P)dCTP придбавали у YaHui Bioengineering Inc. (Beijing, China). Застосовували комплект для зворотної транскрипції з використанням SuperScript First-Strand Synthesis System для ЗТ-ПЛР (#11904-018, Invitrogen). Інші традиційні хімічні реагенти є аналітично чистими продуктами, привезені з Китаю або вироблені у Китаї. Різні дезоксинуклеотидні праймери були синтезовані компанією Sangon Inc, Shanghai, China. Послідовності ДНК визначалися компанією JiKang Inc., Shanghai; або Invitrogen Inc., Shanghai. Аналіз послідовностей здійснювали за допомогою програми Genedoc, DNAStar і т. ін. Способи 1. Культивування та трансформація Arabidopsis thaliana Для стерильного культивування Arabidopsis thaliana насіння поверхнево (з застосуванням 70% етанолу протягом 30 сек, з наступним промиванням 4X стерильною водою) та внутрішньо (з застосуванням 7% гіпохлориту натрію протягом 10 хв, з наступним промиванням 3X стерильною водою) стерилізували, а потім висівали на 1/2 MS (1/2 базального середовища Мурасіге та Скуга, 0,8% агару, pH 5,8) тверде середовище, тримали при 4°C протягом 72 год, а потім переносили до 22°C. Через один тиждень паростки пересаджували у штучний ґрунт (вермікуліт: чорнозем: перліт = 3:1:0,5) просочений живильним розчином (HuaWuQue 3 г / 10 л, YongTong Chemical Ltd, Shanghai, China), а потім переносили до штучної кліматичної камери з добовим циклом 14/10 (світло/темрява). Для трансформації Arabidopsis thaliana рослини, які тримали протягом 4-5 тижнів у сприятливому стані росту (з відрізанням основної стеблини за 1 тиждень до трансформації для 10 UA 109249 C2 5 10 15 20 25 30 35 40 45 50 55 60 сприяння розвиткові бокових стебел та більшої кількості квіток і збільшення таким чином ефективності трансформації) обробляли обприскуванням. Клітини Agrobacterium tumefaciens, які містили трансгенні вектори, вирощували до OD600 ~ 2,0 при 28°C, а потім центрифугували при 4 000 об./хв протягом 10 хв, осад ресуспендували у щойно приготовленому трансформаційному розчині (1/2 MS рідкого середовища, яке містило 5% цукрози та 0,02% Silwet L-77) і вирощували до кінцевої концентрації як OD600 ~ 0,6-0,8. Запилені квітки та плоди видаляли перед трансформацією, а потім ґрунтові давали увібрати достатню кількість води. Під час трансформації суспензію бактерій розбризкували на рослини Arabidopsis thaliana доти, доки кілька крапель суспензії не спадали з листів. Рослини вкривали чорними мішками для підтримання вологості протягом доби у темряві. Через 24 год рослини переносили до нормальних умов. Через 7 днів трансформацію повторювали ще один раз згідно з процедурою, описаною вище. Рослини збирали і змішували у паперовому мішку після дозрівання насіння. Зібрані рослини поміщали в ексикатор на 7 днів, а потім молотили. Стерилізоване насіння покоління T1 висівали на середовище 1/2 × MS, яке містило 50 мкг/мл Kan або гігроміцину, піддавали 4°C протягом 72 год, а потім поміщали у нормальні світлові умови. 2. Генетична трансформація калюсу зрілих ембріонів рису, опосередкована Agrobacterium tumefaciens (1) Утворення калюсу зрілих ембріонів рису Насіння рису 307T очищали від лушпиння, потім просочували 70% етанолом протягом 1 хв та 20% (об’єм/об’єм) гіпохлориту натрію протягом 20-30 хв з безперервним збовтуванням. Насіння промивали стерильною водою 5-6 разів. Після промокання стерильним фільтрувальним папером рисове насіння висівали на середовище MSD і вирощували при 26°C у темряві до утворення калюсу. Через один тиждень ендосперм, первинну листову бруньку та первинний корінець видаляли для одержання калюсу і утворений в результаті калюс переносили на MSD у темряву. Пересівали кожні 2-3 тижні. Для калюсу насіння TP309 застосовували середовище NBD. (2) Приготування суспензії бактерій, корисної для трансформації Вранці 1-го дня: невелику частину бактерій, які зберігали при -70°C, інокулювали у 5 мл рідкого середовища YEB (Rif, 20 мг/л + Kan, 50 мг/л) і культивували зі збовтуванням при 28°C до наступного дня. Вранці 2-го дня: 1-2 мл середовища YEB, яке містило бактерії, збирали й переносили у 2550 мл рідкого середовища AB (20 мг/л Rif + 50 мг/л Kan), а потім вирощували при 28°C протягом приблизно 4 год до OD600 ~ 0,5. (3) Кокультивування У другій половині 2-го дня: після виявлення значення OD600 суспензію бактерій центрифугували при 5 000 об./хв протягом 15 хв, осад ресуспендували в AAM (з вмістом AS100) і культивували до OD600 = 0,4-0,6. Суспензію бактерій виливали у трикутну колбу, яка містила калюс рису, і калюс просочували протягом 20 хв зі збовтуванням, яке здійснювали час від часу; після промакування суспензії бактерій стерильним фільтрувальним папером (або відсмоктуванням рідини за допомогою піпетки) просочений калюс переносили до середовища NBD (AS100), яке містило 2,5% Phytagel з шаром стерильного фільтрувального паперу на ньому і піддавали кокультивуванню протягом 2-3 днів, а потім у кожну посудину додавали 1 мл середовища AAM (+AS100) для достатнього зволоження стерильного фільтрувального паперу. (4) Відбір Після промакування стерильним фільтрувальним папером (іншим фільтрувальним папером) калюс переносили на відбірне середовище, яке містило гігроміцин (Hyg) для відбору резистентного калюсу. Калюс культивували у темряві протягом приблизно 30 днів, протягом яких відбірне середовище один раз замінювали. Застосовували такі відбірні середовища: Середовище для першого відбору, яке містило 0,26% Phytagel MS + Timentin, 100 мг/л + Hyg, 30 мг/л; середовище для другого відбору, яке містило 0,26% Phytagel NBD + Timentin, 100 мг/л + Hyg, 50 мг/л; середовище для третього відбору, яке містило 0,26% Phytagel MS + Timentin, 100 мг/л + Hyg, 50 мг/л. (5) Попередня диференціація Відібраний калюс рису переносили до середовища для попередньої диференціації і вирощували протягом 10 днів. Середовище для попередньої диференціації: містить 0,45% Phytagel MS + BAP, 2 мг/л + NAA, 1 мг/л + ABA, 5 мг/л + Hyg, 50 мг/л, pH 5,7, без 2,4-дихлорофеноксіоцтової кислоти (2,4-D). 11 UA 109249 C2 5 10 15 20 25 30 35 40 45 50 55 60 (6) Диференціація Попередньо диференційований калюс рису переносили до середовища диференціації і культивували для диференціації у молоду рослину (світло, 15-30 днів). Середовище диференціації: містить 0,45% Phytagel NB + BAP, 3 мг/л + NAA, 0,5 мг/л, pH 5,7, без 2,4-D. (7) Укорінення Зелену молоду рослину переносили до середовища для укорінення. Середовище для укорінення: містить 0,45% Phytagel 1/2 MS + Hyg, 50 мг/л, pH 5,7, без 2,4-D. 3. Побудова вектора Побудова вектора p35S::ELb Послідовність кДНК кодуючої ділянки білка ELb ампліфікували шляхом ЗТ-ПЛР. Етапи є такими: повну РНК рослини Arabidopsis thaliana видобували за допомогою комплекту RNeasy Plant Mini kit (Qiagen) згідно з наданою виробником інструкцією, а потім одержану в результаті повну РНК піддавали зворотній транскрипції для утворення кДНК ELb з застосуванням зворотної транскриптази M-MLV (Promega). Послідовність кДНК кодуючої ділянки білка ELb ампліфікували шляхом ПЛР з застосуванням ДНК-полімерази Takara perobest, і вищезгадану кДНК застосовували як матрицю. Застосовували такі праймери: Розташований вище праймер (SEQ ID NO: 7): 5’-TGAGGATCCAAATAAAATAAAAAG-3’ (підкреслено: сайт BamHI); Розташований нижче праймер (SEQ ID NO: 8): 5’-AAAGTCGACCACACACAAAGCAAA-3’ (підкреслено: сайт ClaI). Умови ПЛР: 94°C протягом 3 хв; 35 циклів 94°C протягом 30 сек, 58°C протягом 30 сек і 72°C протягом 2 хв; 72°C протягом 10 хв. Продукт зберігали при 16°C. Продукт ПЛР видобували і гідролізували за допомогою BamH1 та ClaI. Продукт видобували, а потім зшивали з вектором pSK, який також було піддано гідролізові й видобуто, як зазначено вище. Одержаний в результаті вектор застосовували для трансформації клітин DH5α. Правильний клон, підтверджений рестрикційним розщепленням, відбирали для секвенування. Для клона з правильною послідовністю, підтвердженою шляхом секвенування, кодуючу ділянку кДНК Elb розщеплювали за допомогою BamHI/ClaI і зшивали з подвійним вектором експресії pCambia1300S, розщепленим за допомогою BamHI/ClaI, і трансформували у клітини DH5α для одержання трансгенних клонів. Після виділення правильну плазміду, підтверджену шляхом рестрикційного розщеплення, трансформували у клітини Agrobacterium tumefaciens GV3101 та EHA105. Плазміну виділяли з клітин Agrobacterium tumefaciens і повторно трансформували у клітини DH5α. Плазміду виділяли з DH5α і розщеплювали рестрикційними ферментами для перевірки клітин Agrobacterium tumefaciens, трансформованих правильною плазмідою. Трансгенні рослини Arabidopsis thaliana одержували шляхом трансформації клітин Arabidopsis thaliana шляхом обприскування і трансгенні рослини рису одержували шляхом опосередкованої Agrobacterium tumefaciens генетичної трансформації калюсу зрілих ембріонів рису. Промотор pELb: побудова вектора GUS Розташовані вище та нижче праймери розраховували на основі послідовностей (GeneID: 832559), отриманих від GenBank, і праймери знаходились у межах 1,4 т.п.н. перед сайтом ініціації трансляції гена ELb. Геномну ДНК, виділену з молодої рослини (віком 7 днів) Arabidopsis thaliana Columbia дикого типу, застосовували як матрицю для втілення ПЛР. Вищезгадані праймери є такими: Розташований вище праймер (SEQ ID NO: 9): 5’-CTGCTGCAGACTCTATTTCCA-3’ (підкреслено: сайт PstI); Розташований нижче праймер (SEQ ID NO: 10): 5’-TTCAGGATCCTTTACTTTTTATTTT-3’ (підкреслено: сайт BamHI); Умова ампліфікації: 94°C протягом 3 хв; 35 циклів 94°C протягом 30 сек, 58°C протягом 30 сек, 72°C протягом 2 хв; 72°C протягом 10 хв. Продукт зберігали при 16°C. Продукт ПЛР розщеплювали ферментами PstI/BamHI, а потім зшивали з відповідним сайтом PstI/BamHI у векторі pSK. Правильний клон, підтверджений рестрикційним розщепленням, відбирали для секвенування. Для клона з правильною послідовністю, підтвердженою секвенуванням, промоторну ділянку ELb (як викладено у SEQ ID NO:13) розщеплювали за допомогою PstI/BamHI і зшивали з подвійним вектором експресії pBI101.1, розщепленим за допомогою PstI/BamHI, і трансформували у клітини E. coli. DH5α. Після виділення правильну плазміду, підтверджену шляхом рестрикційного розщеплення, трансформували у клітини Agrobacterium tumefaciens GV3101. Плазміду виділяли з клітин Agrobacterium tumefaciens і повторно трансформували у клітини DH5α. Плазміду виділяли з DH5α і розщеплювали за допомогою рестрикційних ферментів для перевірки клітин Agrobacterium tumefaciens, 12 UA 109249 C2 5 10 15 20 25 30 35 40 45 50 55 60 трансформованих правильною плазмідою. Тим часом вектори pBI101.1 трансформували у клітини GV3101 як негативний та позитивний контроль, відповідно. Одержання трансгенної рослини ELb РНКi на фоні мутанта з інсерцією ELa T-ДНК Трансгенний клон будували, застосовуючи вектор РНКi 1300RS таким чином: геномну ДНК молодої рослини (віком 7 днів) Arabidopsis thaliana Columbia дикого типу застосовували як матрицю для здійснення ПЛР з метою ампліфікації послідовності приблизно 500 п. о. у четвертому екзоні гена ELb. Вищезгадані праймери є такими: Розташований вище праймер (SEQ ID NO: 11): 5’-AATGGTACCACAAGAAACAA-3’ (підкреслено: сайт KpnI); Розташований нижче праймер (SEQ ID NO: 12): 5’-TCTAGATTTGAGCTGAAAAAA-3’ (підкреслено: сайт XbaI). Умова ампліфікації: 94°C протягом 3 хв; 35 циклів 94°C протягом 30 сек, 50°C протягом 30 сек, 72°C протягом 30 сек; 72°C протягом 10 хв. Продукт зберігали при 16°C. Продукт ПЛР розщеплювали ферментами KpnI/XbaI, а потім зшивали з відповідним сайтом KpnI/XbaI у векторі pSK. Правильний клон, підтверджений рестрикційним розщепленням, відбирали для секвенування. Для клона з правильною послідовністю, підтвердженою секвенуванням, частковий фрагмент ELb розщеплювали за допомогою KpnI/XbaI і зшивали з подвійним вектором експресії 1300RS, розщепленим за допомогою KpnI/XbaI, і трансформували у клітини E. coli. DH5α. Після виділення правильну плазміду, підтверджену шляхом рестрикційного розщеплення, трансформували у клітини Agrobacterium tumefaciens GV3101. Плазміду виділяли з клітин Agrobacterium tumefaciens і повторно трансформували у клітини DH5α. Плазміду виділяли з DH5α і розщеплювали за допомогою рестрикційних ферментів для перевірки клітин Agrobacterium tumefaciens, трансформованих правильною плазмідою. Мутант з інсерцією ELa T-ДНК трансформували шляхом обприскування для одержання трансгенної рослини ELb РНКi (ELb РНКi/eLa) Arabidopsis thaliana на фоні мутанта з інсерцією ELa T-ДНК. Приклад 1: Клонування гена ELb Автором винаходу було виявлено 2 гени p450-залежної монооксигенази, тобто, 714A1 та 714A2, шляхом пошуку у геномних послідовностях Arabidopsis thaliana та здійснення біоінформаційного дослідження. Спочатку передбачалося, що вони беруть участь у рості та розвитку рослин під контролем гібереліну, і були позначені автором винаходу як ELa (або AtEuila) та ELb (або AtEui1b). Послідовність геномної ДНК кодуючої ділянки гена ELb було викладено у SEQ ID NO:1; послідовність кДНК кодуючої ділянки гена ELb було викладено у SEQ ID NO:2; білкову послідовність ELb було викладено у SEQ ID NO:3. Геномну послідовність Кодуючої ділянки гена ELa було викладено у SEQ ID NO:4; послідовність кДНК кодуючої ділянки гена ELa було викладено у SEQ ID NO:5; білкову послідовність ELа було викладено у SEQ ID NO:6. Приклад 2: Зменшені висота та об’єм рослини у трансгенних рослинах Arabidopsis thaliana, які надекспресують ген ELb У цьому прикладі автор винаходу одержував трансгенні рослини Arabidopsis thaliana, які надекспресували ELb, Ela або OsEui, відповідно. Рослину дикого типу (WT), трансгенну рослину, яка надекспресує Arabidopsis ELa (ELa-OE), та трансгенну рослину, яка надекспресує OsEui рису, використовували як контрольні зразки. Профілі росту спостерігали через 4 тижні росту, і результати показуються на Фігурі 1. Як показано на фігурі, рослина дикого типу Arabidopsis thaliana була найбільшою, надекспресуюча Elb рослина була суттєво меншою за рослину дикого типу, і надекспресуюча ELa рослина та надекспресуюча OsEui рослина були найменшими. Після 7 тижнів росту автор винаходу визначав висоту рослини дикого типу та рослин, які надекспресують ELb, ELa та OsEui рису, і середні значення висоти рослин становили 26,2 см, 14,2 см, 9,63 см та 3,7 см, відповідно. Таким чином, висота трансгенної рослини Arabidopsis thaliana, яка надекспресує Elb, була суттєво меншою, ніж у рослини дикого типу. Приклад 3: ELb РНКi або нокаут-мутація збільшують висоту та об’єм рослин У цьому прикладі автори винаходу одержували, з вихідним варіантом рослини, який є мутантом з інсерцією ELa T-ДНК, трансгенні рослини Arabidopsis thaliana ELb РНКi (ELb РНКi /eLa) та варіанти рослин Arabidopsis thaliana з нокаутом гена ELb. Після 10 днів росту обох рослин спостерігали вплив ELb РНКi або нокаут-мутацій на висоту та об’єм рослин і порівнювали з рослиною дикого типу, яку культивували за таких самих умов як контрольну рослину. Профілі росту рослин ELb РНКi/eLa та рослини дикого типу показано на Фігурі 2. Порівняно з рослиною дикого типу, площа листя, висота та об’єм рослин ELb РНКi/eLa помітно збільшилися. 13 UA 109249 C2 5 10 15 20 25 30 35 40 45 50 55 60 Крім того, порівняно з рослиною дикого типу, площа листя, висота та об’єм рослин з нокаутмутацією ELb (на фоні інсерції ELa T-ДНК) також помітно збільшилися. Відповідно, можна зробити висновок, що знижена або пригнічена експресія ELb веде до збільшення висоти та об’єму рослин, тобто, ELb є геном, пов’язаним зі зменшенням висоти та об’єму рослин. Приклад 4: ELb РНКi/ela або нокаут-мутація збільшують розмір квіток та розмір насіння. У цьому прикладі автори винаходу спостерігали профілі росту для квіток та насіння рослин ELb РНКi/eLa Arabidopsis thaliana або рослин Arabidopsis thaliana з нокаутом ELb (одержаним у Прикладі 3) і порівнювали з квітками та насінням рослини Arabidopsis thaliana дикого типу як контрольної рослини. Профілі росту для квіток та насіння рослин ELb РНКi/eLa Arabidopsis thaliana та рослини Arabidopsis thaliana дикого типу показано на Фігурі 3. Квітки та насіння рослини ELb РНКi/eLa Arabidopsis thaliana були значно більшими, ніж у рослини дикого типу. Крім того, квітки та насіння мутанта з нокаутом ELb також були значно більшими, ніж у рослини дикого типу. Відповідно, можна зробити висновок, що знижена або пригнічена експресія ELb веде до збільшення розміру квіток та розміру насіння рослин, тобто, ELb є геном, пов’язаним зі зменшенням розміру квіток та розміру насіння. Приклад 5: Тканинно-специфічна експресія гена-репортера GUS, викликана промотором ELb У цьому прикладі автори винаходу будували вектор p ELb промотор::GUS, який може бути трансформований у клітини Agrobacterium tumefaciens для одержання трансгенних рослин Arabidopsis thaliana. Експресію гена-репортера GUS у рослинах спостерігали шляхом традиційного аналізу для виявлення гена-репортера GUS. Ген-репортер GUS експресувався у ділянках активного росту стебел та листя рослин, але по суті не експресувався у корінні. Таким чином, ген ELb є тканинно-специфічним геном. Приклад 6: Зменшена висота рослини у надекспресуючому Elb трансгенному рисі У цьому прикладі автор винаходу одержував надекспресуючі Elb трансгенні рослини рису (ELb-OE) і спостерігав вплив надекспресії Elb на рослини рису. Рослину рису TP309 дикого типу, яку культивували за таких самих умов росту, застосовували як контрольну рослину. Після 110 днів росту профілі росту рослин було показано на Фігурі 5. Як можна побачити, висота надекспресуючих Elb трансгенних рослин рису була помітно меншою, ніж у рослини дикого типу. Фігура 6 є статистичною гістограмою, яка показує висоту надекспресуючих Elb рослин та рослини дикого типу. Приклад 7: Збільшення ефективної кількості паростків та врожайності надекспресуючих Elb трансгенних рослин рису У цьому прикладі автор винаходу визначав кількість паростків та врожайність надекспресуючих Elb трансгенних рослин рису (ELb-OE) та рослини рису дикого типу TP309 з метою демонстрації впливу надекспресії ELb на кущіння та врожайність рослин рису. Ефективну кількість паростків підраховували після утворення у культивованих рослин волотей, і статистичні результати показано на Фігурі 7. Кількість паростків рослини дикого типу становила приблизно 10, тоді, як кількість паростків у надекспресуючих Elb рослин складала приблизно 20-22. Можна зробити висновок, що надекспресія ELb може суттєво збільшувати ефективну кількість паростків у рослин. Врожайність надекспресуючих Elb рослин та рослини дикого типу аналізували після дозрівання рослин. Результати показано на Фігурі 8. Можна зробити висновок, що маса зерен окремої рослини у надекспресуючих Elb трансгенних рослин рису була суттєво збільшена. Приклад 8: Функція варіантів ELb Кодуючу ділянку кДНК ELb у векторі p35S::ELb було заміщено кодуючою послідовністю, яка кодує білок, який має послідовність, подібну до SEQ ID NO:3, і єдиною розбіжністю є Leu у позиції 522 послідовності порівняно з Ile у цій позиції у білку ELb рослини дикого типу. Цей вектор трансформували у клітини Agrobacterium tumefaciens, як описано вище, для одержання трансгенних рослин. Результат показав, що висота трансгенних рослин була меншою, ніж у рослини дикого типу. Усі наведені авторами публікації, патенти та патентні заявки є включеними шляхом посилання у повному обсязі так само, як це було б, якби кожна окрема публікація, патент або патентна заявка були окремо зазначені як такі, що є включеними шляхом посилання. Крім того, слід розуміти, що спеціалісти у даній галузі зможуть здійснювати різні модифікації або зміни на основі змісту даного опису, і ці рівноцінні варіанти також охоплюються обсягом, який визначається представленою нижче формулою винаходу. 14 UA 109249 C2 ФОРМУЛА ВИНАХОДУ 5 10 15 20 25 30 35 40 45 50 55 60 1. Застосування поліпептиду регулювання висоти рослини, або полінуклеотиду, що кодує поліпептид регулювання висоти рослини, у покращенні агрономічних характеристик рослини шляхом регулювання висоти рослини, розміру, кущіння, врожайності, розміру квіткового органа або розміру насіння рослини, де поліпептид регулювання висоти рослини вибраний з групи, яка включає: (a) поліпептид, що має амінокислотну послідовність, викладену у SEQ ID NO: 3; та (b) поліпептид, що походить від (a), що має заміщення 1-3 амінокислотних залишків в амінокислотній послідовності, викладеній у SEQ ID NO: 3, і має функцію регулювання висоти рослини; при цьому регулювання здійснюють шляхом введення зазначеного полінуклеотиду, що кодує поліпептид регулювання висоти рослини, у рослину, або шляхом введення вектора РНКi, який містить послідовність, що спрямовує полінуклеотид, що кодує поліпептид регулювання висоти рослини, у рослину, і при цьому вказане введення включає наступні етапи: (1) забезпечують Agrobacterium, що несуть вектор експресії, який містить зазначений полінуклеотид, що кодує поліпептид регулювання висоти рослини, або вектор РНКi; (2) приводять у контакт клітину, тканину або орган рослини з Agrobacterium, відповідно до етапу (1), для введення зазначеного полінуклеотиду, що кодує поліпептид регулювання висоти рослини, або вектор РНКi в клітину, тканину або орган рослини та дозволяють зазначеному полінуклеотиду, що кодує поліпептид регулювання висоти рослини, або вектору РНКi інтегруватись в хромосому клітини, тканини або органа рослини; (3) вибирають клітину, тканину або орган рослини, що містить зазначений полінуклеотид, що кодує поліпептид регулювання висоти рослини, або вектор РНКi; та (4) дозволяють клітині, тканині або органу рослини, відповідно до етапу (3), регенерувати нову рослину. 2. Застосування за п. 1, у якому покращення агрономічних характеристик рослини здійснюють шляхом регулювання експресії або активності зазначеного поліпептиду. 3. Застосування за п. 1, у якому зазначений поліпептид має амінокислотну послідовність, викладену у SEQ ID NO: 3. 4. Застосування за п. 1, у якому зазначений полінуклеотид включає: (i) нуклеотидну послідовність, викладену у SEQ ID NO: 2; або (ii) нуклеотидну послідовність, викладену у SEQ ID NO: 1. 5. Застосування за п. 1, у якому додатково здійснюють гібридизацію регенерованої нової рослини з нетрансгенною рослиною з одержанням гібридного потомства, яке містить зазначений полінуклеотид. 6. Застосування за п. 1, у якому рослина вибрана з групи, що складається зі злакових та хрестоцвітих рослин. 7. Застосування за п. 1, у якому рослина вибрана з групи, що складається з сої, кукурудзи (маїсу), бавовни, каноли, цукрового буряку, люцерни, рису, пшениці, ячменю, жита, сорго, цукрової тростини, соняшнику, ріпаку. 8. Спосіб регулювання висоти рослини, розміру, кущіння, врожайності, розміру квіткового органа або розміру насіння рослини, де спосіб включає регулювання експресії або активності гена регулювання висоти рослини у рослині, причому ген регулювання висоти рослини кодує поліпептид, вибраний з групи, що включає: (a) поліпептид, що має амінокислотну послідовність, викладену у SEQ ID NO: 3; та (b) варіант поліпептидів з (a), які мають заміщення 1-3 амінокислотних залишків в амінокислотній послідовності, викладеній у SEQ ID NO: 3, і має функцію регулювання висоти рослини; при цьому регулювання здійснюють шляхом введення зазначеного полінуклеотиду, що кодує поліпептид регулювання висоти рослини, у рослину, або шляхом введення вектора РНКi, який містить послідовність, що спрямовує полінуклеотид, що кодує поліпептид регулювання висоти рослини, у рослину, і при цьому вказане введення включає наступні етапи: (1) забезпечують Agrobacterium, що несуть вектор експресії, який містить зазначений полінуклеотид, що кодує поліпептид регулювання висоти рослини, або вектор РНКi; (2) приводять у контакт клітину, тканину або орган рослини з Agrobacterium, відповідно до етапу (1), для введення зазначеного полінуклеотиду, що кодує поліпептид регулювання висоти 15 UA 109249 C2 5 10 15 20 рослини, або вектор РНКi в клітину, тканину або орган рослини та дозволяють зазначеному полінуклеотиду, що кодує поліпептид регулювання висоти рослини, або вектору РНКi інтегруватись в хромосому клітини, тканини або органа рослини; (3) вибирають клітину, тканину або орган рослини, що містить зазначений полінуклеотид, що кодує поліпептид регулювання висоти рослини, або вектор РНКi; та (4) дозволяють клітині, тканині або органу рослини, відповідно до етапу (3), регенерувати нову рослину. 9. Спосіб за п. 8, у якому зазначений поліпептид являє собою поліпептид, що має амінокислотну послідовність, викладену у SEQ ID NO: 3. 10. Спосіб за п. 8, у якому ген регулювання висоти рослини включає нуклеотидну послідовність, викладену у SEQ ID NO: 1. 11. Трансгенна рослина, або її потомство, отримана відповідно до способу за будь-яким з пп. 810, при цьому трансгенна рослина, або її потомство, включає копію зазначеного полінуклеотиду, що кодує поліпептид регулювання висоти рослини, де поліпептид регулювання висоти рослини вибраний з групи, яка включає: (a) поліпептид, що має амінокислотну послідовність, викладену у SEQ ID NO: 3; та (b) поліпептид, який походить від (a), що має заміщення 1-3 амінокислотних залишків в амінокислотній послідовності, викладеній у SEQ ID NO: 3, і має функцію регулювання висоти рослини, введеного за допомогою Agrobacterium. 12. Трансгенна рослина, або її потомство, за п. 11, причому рослина вибрана з групи, що складається зі злакових та хрестоцвітих рослин. 13. Трансгенна рослина, або її потомство, за п. 11, причому рослина вибрана з групи, що складається з сої, кукурудзи (маїсу), бавовни, каноли, цукрового буряку, люцерни, рису, пшениці, ячменю, жита, сорго, цукрової тростини, соняшнику, ріпаку. 16 UA 109249 C2 17 UA 109249 C2 18 UA 109249 C2 Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 19
ДивитисяДодаткова інформація
Назва патенту англійськоюA plant height regulatory gene and uses thereof
Автори російськоюHe, Zuhua, Zhang, Yingying, Li, Qun
МПК / Мітки
МПК: C12N 15/29, C12N 15/82, C07K 14/415, A01H 5/00
Мітки: гена, застосування, висоті, рослин, регулювання
Код посилання
<a href="https://ua.patents.su/21-109249-zastosuvannya-gena-regulyuvannya-visoti-roslin.html" target="_blank" rel="follow" title="База патентів України">Застосування гена регулювання висоти рослин</a>
Попередній патент: Рюкзак
Випадковий патент: Спосіб діагностики когнітивних порушень у хворих на гіпертензивну енцефалопатію з використанням змін перфузії