Похідні тропану, корисні в терапії, спосіб їх одержання та проміжні сполуки
Номер патенту: 73170
Опубліковано: 15.06.2005
Автори: Прайс Девід Ентоні, Штаммен Бланда Луція Кріста, Перрос Мануссос, Вуд Ентоні
Формула / Реферат
1. Похідне тропану формули:
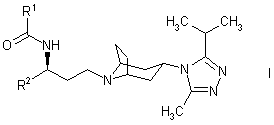 ,
,
в якій R1 є C3-6 циклоалкілом, необов’язково, заміщеним одним або більшою кількістю атомів фтору, або C1-6 алкілом, необов’язково, заміщеним одним або більшою кількістю атомів фтору, або C3-6 циклоалкілметилом, необов’язково, заміщеним по кільцю одним або більшою кількістю атомів фтору; і
R2 є фенілом, необов’язково, заміщеним одним або більшою кількістю атомів фтору;
або його фармацевтично прийнятна сіль або сольват.
2. Похідне тропану згідно з пунктом 1 формули:
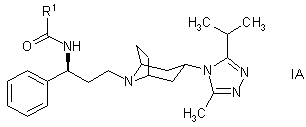 ,
,
в якій R1 є або C3-6 циклоалкілом, необов’язково, заміщеним одним або більшою кількістю атомів фтору, або C1-6 алкілом, необов’язково, заміщеним одним або більшою кількістю атомів фтору, або його фармацевтично прийнятна сіль або сольват.
3. Похідне тропану згідно з пунктом 1, де R1 є або C4-6 циклоалкілом, необов’язково, заміщеним одним або двома атомами фтору, або C1-4 алкілом, необов’язково, заміщеним від одного до трьох атомів фтору.
4. Похідне тропану згідно з пунктом 3, де R1 є циклобутилом, циклопентилом, 4,4-дифторциклогексилом або 3,3,3-трифторпропілом.
5. Похідне тропану згідно з пунктом 1, 3 або 4, де R2 є фенілом, необов’язково, заміщеним 1 або 2 атомами фтору.
6. Похідне тропану згідно з пунктом 5, де R2 є фенілом або монофторфенілом.
7. Похідне тропану згідно з пунктом 6, де R2 є фенілом або 3-фторфенілом.
8. Похідне тропану згідно з пунктом 1, яке вибирають з групи, що включає:
N-{(1S)-3-[3-(3-ізопропіл-5-метил-4H-1,2,4-триазол-4-іл)-екзо-8-азабіцикло[3.2.1]окт-8-ил]-1-фенілпропіл}циклобутанкарбоксамід;
N-(1S)-3-[3-(3-ізопропіл-5-метил-4H-1,2,4-триазол-4-іл)-екзо-8-азабіцикло[3.2.1]окт-8-ил]-1-фенілпропіл}циклопентанкарбоксамід;
N-{(1S)-3-[3-(3-ізопропіл-5-метил-4H-1,2,4-триазол-4-іл)-екзо-8-азабіцикло[3.2.1]окт-8-ил]-1-фенілпропіл}-4,4,4-трифторбутанамід;
N-{(1S)-3-[3-(3-ізопропіл-5-метил-4H-1,2,4-триазол-4-іл)-екзо-8-азабіцикло[3.2.1]окт-8-ил]-1-фенілпропіл}-4,4-дифторциклогексанкарбоксамід і
N-{(1S)-3-[3-(3-ізопропіл-5-метил-4H-1,2,4-триазол-4-іл)-екзо-8-азабіцикло[3.2.1]окт-8-ил]-1-(3-фторфеніл)пропіл}-4,4-дифторциклогексанкарбоксамід;
або будь-яка його фармацевтично прийнятна сіль або сольват.
9. Фармацевтична композиція, що містить похідне тропану формули (I) або його фармацевтично прийнятну сіль або сольват, як вказано в будь-якому з попередніх пунктів, разом з фармацевтично прийнятним наповнювачем, розріджувачем або носієм.
10. Похідне тропану формули (I) або його фармацевтично прийнятна сіль, сольват або композиція, як зазначено в одному з пунктів 1 - 8 і 9, відповідно, для використання як лікарського засобу.
11. Похідне тропану формули (I) або його фармацевтично прийнятна сіль, сольват або композиція, як зазначено в одному з пунктів 1 - 8 і 9, відповідно, для лікування розладу, який пов‘язаний з модулюванням CCR5 рецепторів.
12. Похідне тропану формули (I) або його фармацевтично прийнятна сіль, сольват або композиція, як зазначено в одному з пунктів 1 - 8 і 9, відповідно, для лікування ВІЛ, ретровірусної інфекції, що генетично обумовлює ВІЛ, СНІДу або запального захворювання.
13. Похідне тропану формули (I) або його фармацевтично прийнятна сіль, сольват або композиція, як зазначено в одному з пунктів 1 - 8 і 9, відповідно, для лікування респіраторного розладу, включаючи гострий респіраторний дистрес-синдром (ARDS), бронхіт, хронічний бронхіт, хронічне обструктивне легеневе захворювання, кістозний фіброз, астму, емфізему, риніт або хронічний синусит.
14. Похідне тропану формули (I) або його фармацевтично прийнятна сіль, сольват або композиція, як зазначено в одному з пунктів 1 - 8 і 9, відповідно, для лікування запалення внутрішніх органів, включаючи хворобу Крона або виразковий коліт, розсіяного склерозу, ревматоїдного артриту, відторгнення трансплантата, включаючи відторгнення нирки або легені, ендометріозу, діабету типу І, захворювання нирки, хронічного панкреатиту, стану запалення легені або хронічної серцевої недостатності.
15. Спосіб лікування розладу у ссавця, який пов‘язаний з модулюванням CCR5 рецепторів, що полягає у введенні згаданому ссавцю ефективної кількості похідного тропану формули (I) або його фармацевтично прийнятної солі, сольвату або композиції, як зазначено в одному з пунктів 1 - 8 і 9, відповідно.
16. Спосіб лікування у ссавця ВІЛ, ретровірусної інфекції, що генетично обумовлює ВІЛ, СНІДу або запального захворювання, що полягає у введені згаданому ссавцю ефективної кількості похідного тропану формули (I) або його фармацевтично прийнятної солі, сольвату або композиції, як зазначено в одному з пунктів 1 - 8 і 9, відповідно.
17. Спосіб лікування у ссавця респіраторного розладу, включаючи гострий респіраторний дистрес-синдром (ARDS), бронхіт, хронічний бронхіт, хронічне обструктивне легеневе захворювання, кістозний фіброз, астму, емфізему, риніт або хронічний синусит, що полягає у введені згаданому ссавцю ефективної кількості похідного тропану формули (I) або його фармацевтично прийнятної солі, сольвату або композиції, як зазначено в одному з пунктів 1 - 8 і 9, відповідно.
18. Спосіб лікування у ссавця запалення внутрішніх органів, включаючи хворобу Крона або виразковий коліт, розсіяного склерозу, ревматоїдного артриту, відторгнення трансплантата, включаючи відторгнення нирки або легені, ендометріозу, діабету типу І, захворювання нирки, хронічного панкреатиту, стану запалення легені або хронічної серцевої недостатності, що полягає у введені згаданому ссавцю ефективної кількості похідного тропану формули (I) або його фармацевтично прийнятної солі, сольвату або композиції, як зазначено в одному з пунктів 1 - 8 і 9, відповідно.
19. Похідне тропану згідно з однією з формул:
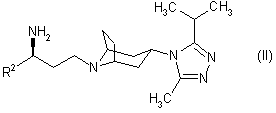 ,
, 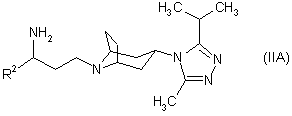 ,
,
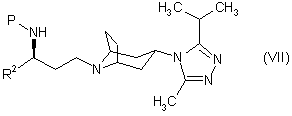 ,
,
в яких R2 є таким, як визначено в пункті 1, а Р являє собою захисну групу.
20. Похідне тропану згідно з пунктом 19, де R2 є фенілом.
21. Похідне тропану згідно з пунктом 19 або 20, де Ρ є т-бутилоксикарбонілом або бензилоксикарбонілом.
22. Похідне тропану згідно з однією з формул:
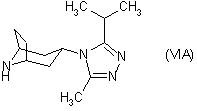 ,
, ,
,
в яких P1 є захисною групою, або сіль сполуки формули (VIA), переважно п-толуолсульфонатна сіль.
23. Похідне тропану згідно з пунктом 22, де P1 є бензилом.
24. Похідне тропану формули:
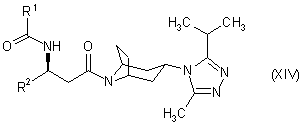 ,
,
в якій R1 і R2 є такими, як визначено в пункті 1.
25. Похідне тропану формули:
 ,
,
в якій R2 є такими, як визначено в пункті 1.
26. Похідне тропану згідно з пунктом 25, де R2 є фенілом.
27. Похідне тропану формули:
 ,
,
в якій R1 та R2 є такими, як визначено в пункті 1.
28. Похідне тропану згідно з пунктом 27, де R2 є фенілом.
29. Спосіб одержання похідного тропану формули (I) згідно з пунктом 1, у відповідності до якого:
(a) піддають конденсації сполуки формули:
 ,
,
зі сполукою формули:
R1CO2H, (III)
в яких R1 і R2 є такими, як визначено для похідного тропану формули (I); або
(б) проводять реакцію сполуки формули (II) зі сполукою формули:
R1COZ, (VIB)
в якій Ζ є групою, що активує карбоксильну групу; або
(в) проводять реакцію сполуки формули (II) або її солі металу зі сполукою формули:
R1CO2R5, (XXIV)
в якій R1 є таким, як визначено для похідного тропану формули (I), а R5 є естерутворюючою групою; або
(г) проводять реакцію сполуки формули:
 ,
,
або зі сполукою формули (III) за умов конденсування, або зі сполукою формули (VIB), в присутності хірального каталізатора;
при цьому будь-який зі згаданих процесів необов‘язково завершують перетворенням похідного тропану формули (I) у його фармацевтично прийнятну сіль.
30. Спосіб одержання похідного тропану формули (I) згідно з пунктом 1, у відповідності до якого:
(а) відновлюють сполуки формули:
 ,
,
в якій R1 і R2 є такими, як визначено для похідного тропану формули (I);
(б) проводять асиметричне відновлення сполуки формули:
 ,
,
в якій R1 і R2 є такими, як визначено для похідного тропану формули (I);
при цьому будь-який зі згаданих процесів необов‘язково завершують перетворенням похідного тропану формули (I) у її фармацевтично прийнятну сіль.
31. Спосіб одержання похідного тропану формули (I) згідно з пунктом 1, у відповідності до якого:
(а) проводять відновне амінування сполукою формули:
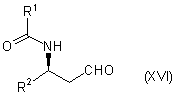 ,
,
в якій R1 і R2 є такими, як визначено для похідного тропану формули (I), сполуки формули:
 ,
,
або його солі; або
(б) проводять відновне амінування сполукою формули:
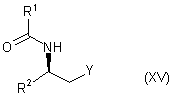 ,
,
в якій Y є CN і R1 і R2 є такими, як визначено для похідного тропану формули (I), сполуки формули (VIA) або його солі;
при цьому будь-який зі згаданих процесів необов‘язково завершують перетворенням похідного тропану формули (I) у його фармацевтично прийнятну сіль.
32. Спосіб одержання похідного тропану формули (I) згідно з пунктом 1, у відповідності до якого:
проводять алкілування сполуки формули (VIA) або її солі сполукою формули:
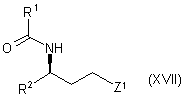 ,
,
в якій Z1 є групою, що відходить, а R1 і R2 є такими, як визначено для похідного тропану формули (І);
при цьому процес необов‘язково завершують перетворенням похідного тропану формули (I) у його фармацевтично прийнятну сіль.
Текст
Цей винахід стосується похідних тропану корисних при лікуванні різних розладів, включаючи розлади в які включене модулювання CCR5 рецепторів. Більш особливо, представлений винахід стосується похідних 3-(3ізопропіл-5-метил-4Н-1,2,4-триазол-4-іл)-екзо-8-азабіцикло[3.2.1]октану і способів їх одержання, проміжних сполук, що використовуються при їх одержанні, композицій, що їх містять, і використання таких похідних. Розладами, що можуть лікуватись або попереджатись представленими похідними є ВІЛ і генетично обумовлюючі ретровірусні інфекції (і як результат синдром набутого імунодефіциту, СНІД), і запальні захворювання. Сполуки представленого винаходу є модуляторами, особливо антагоністами, активності хемокінових CCR5 рецепторів. Модулятори CCR5 рецептору можуть бути корисні при лікуванні різних запальних захворювань і станів, і при лікуванні ВІЛ-1 і генетично обумовлених ретровірусів. Назва "хемокін", є скороченням терміну "хемотактичні цитокіни". Хемокіни є великою родиною протеїнів, які мають важливі структурні особливості і які мають здатність притягувати лейкоцити. Як лейкоцитхемотактичні фактори, хемокіни відіграють важливу роль у притягувані лейкоцитів до різних тканин тіла, процес, який є найважливішим як при запаленні, так і при відповіді тіла на інфекцію. Оскільки хемокіни і їх рецептори є центральними у патофізіології запалення і інфекційних захворювань, агенти, які є активними у модулюванні, переважно антагонізуванні, активності хемокінів і їх рецепторів, є корисними при терапевтичному лікуванні таких запальних і інфекційних захворювань. Хемокіновий CCR5 рецептор є особливо важливими в контексті лікування запальних і інфекційних захворювань. CCR5 є рецептором хемокінів, особливо протеїнів макрофагального запалення (МІР), що позначаються МІР-1a і MIP-1b, і протеїнів, які регулюються активацію та експресію і секретування нормальних Т-клітин (RANTES). Важливі дослідження різних класів модуляторів активності хемокінового рецептору, особливо CCR5 хемокінового рецептору, наприклад, WO 98/25617 стосується заміщених арилпіперазинів, що проявляють активність модуляторів хемокінового рецептору. Дані сполуки в загальних рисах описані в WO 00/38680, але не є особливо приведеними тут. Згідно з першим аспектом представленого винаходу, забезпечується сполука формули (І), в якій R1 є С3-6 циклоалкілом, необов'язково, заміщеним одним або більшою кількістю атомів фтору, або С1-6 алкілом, необов'язково, заміщеним одним або більшою кількістю атомів фтору, або С3-6 циклоалкілметилом, необов’язково, заміщеним по кільцю одним або більшою кількістю атомів фтору; і R2 є фенілом, необов'язково, заміщеним одним або більшою кількістю атомів фтору; або її фрамацевтично прийнятна сіль або сольват. Згідно з другим аспектом представленого винаходу забезпечується сполука формули (ІА), в якій R1 представляє або С3-6 циклоалкіл, необов'язково, заміщений одним або більшою кількістю атомів фтору, або С1-6 алкіл, необов'язково, заміщений одним або більшою кількістю атомів фтору, або її фрамацевтично прийнятна сіль або сольват. "C1-6 алкіл" є визначенням R1, що включає розгалужені або нерозгалужені групи. Прикладами алкілів є метил, етил, н-пропіл, і-пропіл, н-бутил, і-бутил, втор-бутил і т-бутил. "С3-6 циклоалкіл" означає циклопропіл, циклобутил, циклопентил і циклогексил. Сполуки формули (І), що містять основні центри, утворюють з кислотами нетоксичні кислотноадитивні солі. Прикладами таких солей є гідрохлоридна, гідробромідна, гідройодидна, сульфатна, бісульфатна, нітратна, фосфатна, гідрофосфатна, ацетатна, малеатна, фумаратна, лактатна, тартратна, цитратна, глюконатна, камсилатна, сукцинатна, сахаратна, бензоатна, метансульфонатна, етансульфонатна, бензолсульфонатна, п-толуолсульфонатна і памоатна. Для ознайомлення з придатними солями дивіться Berge et al, J. Pharm. Sei., 66, 1-19, 1977. Фармацевтично прийнятними сольватами сполук формули (І) або їх солей є їх гідрати. Поліморфи сполук формули (І) також включені в межі рамок представленого винаходу. Сполуки формули (І) містять один або більшу кількість асиметричних атомів вуглецю і тому існують в двох або більшій кількості їх стереоізомерних форм. Представлений винахід стосується окремих стереоізомерів сполук формули (І) і, коли це можливо, їх індивідуальних таутомерних форм, разом з їх сумішами. Розділення діастереомерів можна здійснити використовуючи загальновідомі методики, наприклад, шляхом фракційної кристалізації, хроматографії ВЕРХ стереоізомерної суміші сполуки формули (І) або її придатної солі або похідної. Індивідуальні енантіомери сполуки формули (І) також можна одержати з відповідного чистого інтермедіату або розділенням, таким як ВЕРХ, відповідного рацемату використовуючи придатні хіральні носії, або фракційною кристалізацією діастереомерних солей одержаних після реакції відповідного рацемату з придатною оптичноактивною кислотою або основою, в залежності від обставин. Винахід також включає сполуки формули (І) мічені ізотопами. Переважно, R1 є або С4-6 циклоалкілом, необов'язково, заміщеним одним або двома атомами фтору, або С1-4 алкілом, необов'язково, заміщеним від одного до трьох атомів фтору. Переважно, R1 є або циклобутилом, циклопентилом, 4,4-дифторциклогексилом, або 3,3,3трифторпропілом. Переважно, R2 є фенілом, необов'язково, заміщеним 1 або 2 атомами фтору. Переважно, R2 є фенілом або монофторфенілом. Переважно, R2 є фенілом або 3-фторфеніл. Переважними сполуками формули (І) є N-{(1S)-3-[3-{3-ізопропіл-5-метил-4Н-1,2,4-триазол-4-іл)-екзо-8-азабіцикло[3.2.1]окт-8-ил]-1фенілпропіл}циклобутанкарбоксамід; N-{(1S)-3-[3-(3-ізопропіл-5-метил-4Н-1,2,4-триазол-4-іл)-екзо-8-азабіцикло[3.2.1]окт-8-ил]-1фенілпропіл}циклопентанкарбоксамід; N-{(1S)-3-[3-(3-ізопропіл-5-метил-4Н-1,2,4-триазол-4-іл)-екзо-8-азабіцикло[3.2.1]окт-8-ил]-1-фенілпропіл}4,4,4-трифторбутанамід; N-{(1S)-3-[3-(3-ізопропіл-5-метил-4Н-1,2,4-триазол-4-іл)-екзо-8-азабіцикло[3.2.1]окт-8-ил]-1-фенілпропіл}4,4-дифторциклогексанкарбоксамід; і N-{(1S)-3-[3-(3-ізопропіл-5-метил-4Н-1,2,4-триазол-4-іл)-екзо-8-азабіцикло[3.2.1]окт-8-ил]-1-(3фторфеніл)пропіл}-4,4-дифторциклогексанкарбоксамід; або будь-яка їх фармацевтично прийнятна сіль або сольват. Сполуки формули (І) можна одержати використовуючи наступні загальні методики, в яких R1 і R2 є такими як зазначено вище для сполуки формули (І), якщо не вказано інше 1. Сполуку формули (І) можна одержати реакцією сполуки формули. з сполукою формули: R1CO2H (III) за умов звичайного конденсування. Реакцію переважно проводять в присутності придатного конденсуючого агенту (наприклад, N-бензил-N'циклогексилкарбодіімід (який може бути закріпленим на полімері), або гідрат гідроксибензтриазолу і метилйодиду 1-(3-диметиламінопропіл)-3-етилкарбодііміду), приблизно при кімнатній температурі, в розчиннику, який несприятливо не діє на реакцію, наприклад, дихлорметан. Наступні придатні умови конденсування описані в Способі 2, нижче. Сполуки формули (III) або відомі або одержуються використовуючи загальновідомі методики. Сполуки формули (II) можна одержати, як показано на Схемі 1, нижче. 2. Сполуки формули (І) можна одержати, як показано на Схемі 1. де Р є придатною захисною групою, такою як т-бутилоксикарбоніл, бензил або бензилоксикарбоніл і сполуки формули (II) і (VII) існують у екзо формі. В типовій методиці, коли Р є т-бутилоксикарбонілом, амін формули (IV) реагує з ди-трет-бутилдикарбонатом в присутності акцептора основи, такого як водний розчин гідроксиду натрію і в придатному розчиннику, такому як тетрагідрофуран. Захищений амін формули (V) можна відновити у альдегід формули (VI) використовуючи придатний відновлюючий агент, наприклад, використовуючи діізобутилалюмогідрид в дихлорметані при температурі нижче -70°С. Реакція відновного амінування альдегіду формули (VI) аміном формули (в екзо формі): дає сполуку формули (VII). Реакцію проводять в присутності надлишку придатного відновлюючого агенту, наприклад триацетоксиборгідрид натрію або ціаноборгідрид натрію, в протонному розчиннику, наприклад, оцтова кислота в або дихлорметані, або 1,1,1-трихлоретані, при кімнатній температурі. Знаття захисту з сполуки формули (VII) можна здійснити використовуючи загальновідомі умови. Коли Р є т-бутилоксикарбонілом це можна здійснити використовуючи трифтороцтову кислоту або водний розчин хлорводневої кислоти в розчиннику, такому як дихлорметан або метанол при кімнатній температурі. Сполуку формули (II) одержують перетворюючи сполуку формули (І) за допомогою реакції з сполукою формули: R1COZ (VIB) в якій Z є групою, що активує карбоксильну групу, такою як хлор або 1Н-імідазол-1-іл, використовуючи загальновідомі умови, наприклад, використовуючи N,N'-карбонілдіімідазол, триетиламін і дихлорметан. Переважно, сполуку формули (VIB) одержують in situ з сполуки формули (III) використовуючи карбодіімід, такий як 3-(3-диметиламіно-1-пропіл)-1-етилкарбодіімід або N-бензил-N¢-циклогексилкарбодіімід на полімері, необов'язково, в присутності гідрату 1-гідроксибензтриазолу, і реакції з сполукою формули (II). Реакцію проводять в придатному розчиннику, такому як дихлорметан, тетрагідрофуран або етилацетат, необов'язково в присутності основи, такої як третинний амін, наприклад, триетиламін або N-етилдіізопропіламін, приблизно при кімнатній температурі. Альтернативно, кислоту формули (III) можна спочатку активувати гексафторфосфатом бензтриазол-1ілокси-тріс(диметиламіно)фосфонію (ВОР), гексафторфосфат бром-тріс-піролідинофосфонію (PYBrOP) або птолуолсульфонатом 2-фтор-1-метилпіридинію (реагент Мукайяма) в присутності надлишку Nметилморфоліну, триетиламіну або N-етилдіізопропіламіну в придатному розчиннику, такому як тетрагідрофуран, дихлорметан або етилацетат, при кімнатній температурі одержуючи сполуку формули (VIB) і яка реагує з сполукою формули (II). Альтернативно, хлорангідрид кислоти формули (VIB), де Z є хлором, може реагувати з сполукою формули (II), необов'язково, в присутності придатної основи, наприклад, триетиламін, N-етилдіізопропіламін, карбонат натрію, карбонат калію або бікарбонат натрію, і в придатному розчиннику, такому як дихлорметан, етилацетат, ТГФ або толуол, при кімнатній температурі. Повинно бути зрозуміло, що перетворення сполуки формули (VII) у сполуку формули (І) через сполуку формули (II) можна провести в "одному реакторі" шляхом зняття захисту/конденсування використовуючи методи подібні описаним раніше. Сполуку формули (VIA) можна одержати, як показано на Схемі 2. де Р1 є придатною захисною групою, такою як т-бутилоксикарбоніл або бензил і сполуки формул (X), (XI) і (XII) існують в екзо формі. Оксим формули (IX) можна одержати шляхом конденсування кетону формули (VIII) з гідрохлоридом гідроксиламіну в присутності основи, наприклад, піридин, і в придатному розчиннику, зазвичай етанолі. Реакцію зазвичай проводять при температурі кипіння розчинника. Коли Р1 є т-бутилоксикарбонілом або бензилом, відновлення оксиму формули (IX) можна здійснити використовуючи натрій в присутності спирту, зазвичай пентанолу, або шляхом електрохімічного відновлення, одержуючи в результаті амін формули (X). Амід формули (XI) можна одержати конденсуючи захищений амін формули (X) з 2-метилпропановою кислотою або її активованим похідним. Конденсування проводять використовуючи загальновідомі методики утворення амідного зв'язку, такі що описані в Способах 1 і 2, вище. Зазвичай, кислоту можна спочатку активувати використовуючи карбодіімід, такий як 1-(3-диметиламінопропіл)-3-етилкарбодіімід, необов'язково, в присутності 1-гідроксибензтриазолу, в придатному розчиннику, такому як дихлорметан, і в присутності основи, наприклад третинного аміну, такого як триетиламін або діізопропіламін, і потім піддати взаємодії з аміном формули (X). Альтернативно, реакцію проводять використовуючи 2-метилпропаноїлхлорид в присутності основи, такої як карбонат натрію, і придатному розчиннику, наприклад, дихлорметані. Триазол формули (XII) можна одержати в "одному реакторі" використовуючи двостадійну методику, спочатку конденсуючи амід формули (XI) з гідразидом оцтової кислоти з наступним in situ циклоконденсуванням. Зазвичай, амід спочатку активують оксихлоридом фосфору в розчиннику, такому як хлороформ і в присутності основи, наприклад піридину, при 0°С, потім обробляють гідразидом оцтової кислоти в придатному розчиннику, наприклад, хлороформ, і реакційну суміш нагрівають із зворотнім холодильником. Реакція повністю завершується в присутності кислоти, наприклад п-толуолсульфонової кислоти, і в придатному розчиннику, такому як толуол при підвищеній температурі (наприклад, 110°С). Зняття захисту з сполуки формули (XII) використовуючи стандартні методики дає амін формули (VIA) Зазвичай, коли Р1 є бензилом, зняття захисту проводять використовуючи каталітичне гідрування, таке як гідроксид паладію (II) як каталізатор в придатному розчиннику, наприклад, етанол, в присутності форміату амонію при 70°С. Альтернативно, зняття захисту проводять використовуючи каталітичне гідрування за допомогою паладію на вугіллі як каталізатору в придатному розчиннику, такому як метанол, необов'язково, в присутності придатної кислоти, такої як п-толуолсульфонова кислота. 3. Сполуки формули (І) можна одержати, як показано на Схемі 3. де R3 є Н або С1-С6 алкілом. Амід формули (XIV) можна одержати використовуючи загальновідомі методики утворення амідного зв'язку, такі як активування кислоти формули (XIII) (в якій R3 є Н) або у хлорид кислоти або використовуючи інші методики, як описано вище в Способі 1 і 2, з наступною реакцією з аміном формули (VIA). Альтернативно естер формули (XIII) (в якій R3 є С1-С6 алкілом) реагує безпосередньо з аміном або його сіллю металу. Таким чином хлорид кислоти і амін, або його сіль, реагують в присутності надлишку придатної основи, наприклад, Na2CO3, NaHCO3, K2CO3, триетиламіну або N,N-діізопропілетиламіну, і в придатному розчиннику, наприклад, дихлорметані, етилацетаті, ТГФ або толуол, з або без води як спів розчинника. Альтернативно, кислоту можна активувати гідрохлоридом 1-[3-(диметиламіно)пропіл]-3-етилкарбодііміду (WCDI), КДІ (1,1'-карбонілдіімідазол) або ДЦК (1,3-дициклогексилкарбодіімід) і ГОАТ (1-гідрокси-7-азабензтриазол) або ГОБТ (гідрат 1гідроксибензтриазол), і піддати реакції з аміном в присутності основи, наприклад триетиламіну, в розчиннику, такому як ТГФ, дихлорметан або толуол. Також, естер і амін або його сіль металу, можуть реагувати в присутності основи, наприклад, триетиламіну, і, необов'язково, каталізатору в розчиннику, такому як дихлорметан, етилацетат, ТГФ або толуол, з або без води як співрозчинника. Альтернативно, естер, амін і фермент-каталізатор можуть реагувати в розчиннику, такому як дихлорметан, етилацетат, ТГФ або толуол, з або без води як співрозчинника. Переважно, хлорид кислоти, амін і Na2CO3 реагують в дихлорметані і воді, або кислоту обробляють N,N'-карбонілдіімідазолом з утворенням імідазоліду, який потім реагує з аміном в дихлорметані в присутності триетиламіну. Амід формули (XIV) можна відновити, наприклад, використовуючи нуклеофільний гідридний реагент або електрофільний гідридний реагент, або шляхом каталітичного гідрування, або використовуючи алкіл або арил-силан з придатним перехідним металом каталізатором, одержуючи сполуку формули (І). Типовими умовами є використання Red-Al® (біс(2метоксиетокси)алюмогідриднатрію) в ТГФ або толуол, або боран в ТГФ. 4. Сполуки формули (І) можна одержати, як показано на Схемі 4. де Y є -CO2R4, -CN або -C(O)NHR4, де R4 є Н або С1-С6 алкілом. Реакцію, що дає альдегід формули (XVI), можна проводити шляхом відновлення естеру, нітрилу, аміду або кислоти (наприклад, активованої придатним реагентом) формули (XV), гідридним відновлюючим агентом в придатному розчиннику. Альтернативно, відновлення естеру, нітрилу або кислоти (активованої придатним реагентом) формули (XV) можна проводити за допомогою придатного перехідного металу каталізатору, джерела водню і в придатному розчиннику. Типовими умовами є відновлення естеру, нітрилу або аміду алюмо- або боргідридом, таким як ДІБАЛ (діізобутилалюмогідрид), Red-Al®, LiAI(O(t-Bu))3 або (Ме2СНСН(Ме))2ВН в розчиннику, такому як ТГФ, дихлорметан або толуол, або відновлюючи хлорид кислоти використовуючи перехідний метал-каталізатор, такий як Pd/C або Pd/BaSO4, в атмосфері азоту в присутності модифікатору, такого як 2,4-диметилпіридин і розчинника, такого як ТГФ або толуол. Переважними умовами є відновлення естеру ДІБАЛ в дихлорметані або толуолі. Сполуку формули (І) можна одержати шляхом відновного амінування використовуючи альдегід формули (XVI) і амін формули (VIA) або його сіль. Зазвичай реакцію проводять шляхом взаємодії альдегіду з 0,81,5моль ек. аміну або його солі, необов'язково, в присутності 0,1-3моль ек. протонної кислоти, з або відновлюючим агентом, таким як триацетоксиборгідрид натрію або ціаноборгідрид натрію, або використовуючи перехідний метал як каталізатор, такий як паладій, платина або родій і джерело водню, таке як молекулярний водень або форміат амонію, в придатному розчиннику, такому як дихлорметан, ацетонітрил, толуол, етанол або 2-пропанол. Переважно альдегід реагує з тозилатною сіллю аміну в присутності триацетоксиборгідриду натрію і слідів оцтової кислоти в дихлорметані при кімнатній температурі. Альдегід формули (XVI) також можна одержати з спирту формули: шляхом стандартного окислення, наприклад, використовуючи окислюючий агент, такий як ДМСО/комплекс триоксид сірки-піридин, ДМСО з (СОСІ)2, МnО2 або СrО3, з або без основи, в придатному розчиннику, такому як дихлорметан, толуол, ацетон або ацетонітрил; використовуючи перехідний метал як каталізатор, такий як Rh або Ru, з або без основи, і гідридний акцептор, такий як кетон, в придатному розчиннику, такому як дихлорметан, ацетон, толуол або ацетонітрил; або використовуючи каталітичний окисник, такий як TRAP (тетрапропіламоній перутенат) або ТЕМПО (2,2,6,6-тетраметил-1-піперидинілокси, вільний радикал), з або без твердого носія, з стехіометричним окисником для каталізатору, таким як NMO (4-метилморфолін N-оксид), кисень або гіпохлорид натрію або гіпоброміт натрію, і в придатному розчиннику, такому як дихлорметан, ацетон, толуол або ацетонітрил. Переважними умовами є використання ДМСО, комплексу триоксиду сіркипіридину і триетиламіну в дихлорметані, або TEMPO, KBr, NaOCI, вода і дихлорметан. 5. Сполуки формули (І) можна одержати відновним амінуванням сполуки формули (XV), в якій Y є -CN, аміну формули (VIA) або його солі. Відновлення можна проводити використовуючи перехідний метал як каталізатор, необов'язково, в присутності кислоти, і джерела водню, в придатному розчиннику. В типовій методиці використовують паладій на вугіллі або оксид платини (IV) і розчинник, такий як метанол, оцтова кислота або 2-пропанол. 6. Сполуки формули (І) можна одержати шляхом алкілування аміну формули (VIA) або його солі (кислотноадитивної або солі металу), використовуючи сполуку формули: в якій Z1 є групою, що відходить, такою як галоген, С1-С4 алкансульфонілокси, бензолсульфонілокси або птолуолсульфонілокси, необов'язково, в присутності основи і/або міжфазового каталізатору. Реакцію зазвичай проводять в присутності основи, такої як триетиламін або N,N-діізопропілетиламін; ДБУ (1,8-діазабіцикло[5,4,0]ундец-7-ен; або неорганічної основи, такої як Na2CO3, NaHCO3, К2СО3 або Cs2CO3, необов'язково, в присутності міжфазового каталізатору, і в розчиннику, такому як ацетонітрил, ДМФА (диметилформамід), ДМСО (диметилсульфоксид), 1,4-діоксан, ТГФ або толуол. Альтернативно, сіль металу амін (тобто, депротонована форма) може реагувати з сполукою формули (XVII) в придатному розчиннику, такому як ТГФ, ДМФА або 1,4-діоксан. Переважно реакцію проводять за допомогою реакції аміну і сполуки формули (XVII) з або ДБУ в ацетонітрилі або К2СО3 і 18-краун-6 (1,4,7,10,13,16-гексаоксациклооктадекан) в ТГФ. 7. Сполуки формули (І) можна одержати, як показано на Схемі 5. Сполуку формули (XVIII) можна одержати за допомогою реакції Маніха сполуки формули: R2COCH3 (XX) з сполукою формули (VIA) або її сіллю, формальдегідом або його еквівалентом, з або без кислоти, в придатному розчиннику. Типовими умовами є реакція аміну і кетону з кислотою, такою як хлорводнева кислота, сірчана кислота, п-толуолсульфонова кислота або оцтова кислота, і параформальдегідом в придатному розчиннику, такому як етанол, метанол, 2-пропанол або ДМФА: або реакція солі аміну (такої як гідрохлорид, сульфат або тозилат) з кетоном і параформальдегідом в придатному розчиннику, такому як етанол, метанол, 2-пропанол або ДМФА. Альтернативно сполуку формули (XVIII) можна одержати за допомогою реакції сполуки формули (VIA) або її солі, з сполукою формули: R2COCH2CH2Z2 (XXI) в якій Z2 є групою, що відходить, такою як було визначено для Z1, використовуючи стандартні умови алкілування, такі як описані для Способу 6, вище. Єнамід формули (XIX) можна одержати за допомогою реакції сполуки формули (XVIII) з амідом формули: R1CONH2 (XXII) за умов дегідратації, з або без кислотного каталізатору, і в придатному розчиннику; або шляхом відновлення сполуки формули (XVIII) спочатку гідроксиламіном або його сіллю, і потім реакції проміжного продукту з ангідридом кислоти формули: (R1CO)2O (XXIII) перехідним металом, як каталізатор, і кислотою в придатному розчиннику; або шляхом реакції сполуки формули (XVIII) спочатку з аміаком або його сіллю, і потім реакції проміжного продукту з кислотою формули (III) або її активованим похідним, за стандартних умов. Зазвичай сполука формули (XVIII) реагує з амідом формули (XXII) в присутності каталітичної кількості кислоти з азеотропним видаленням води або видаленням води використовуючи дегідтратуючі агенти, такі як молекулярні сита. Сполуку формули (І) можна одержати за допомогою асиметричого відновлення єнаміду формули (XIX) використовуючи 0,001-0,1моль ек. перехідного металу, такого як Rh, Ru, Pd, Pt, Ir або Ті, 0,001-0,2моль ек. хірального ліганду, такого як BINAP (2,2-біс(дифенілфосфіно)-1,1'-бінафтил), tol-BINAP (2,2-біс(ди-птолілфосфіно)-1,1'-бінафтил), Du-PHOS (1,2-біс(2,5-диметилфосфолано)бензол) або Penn-Phos (P,P'-1,2феніленбіс(ендо-2,5-диметил-7-фосфабіцикло[2,2,1]гептан), донор водню, такий як молекулярний водень, фенілсілан, 2-пропанол або форміатамонію, і придатний розчинник, такий як метанол, етанол, ацетонітрил, толуол, етилацетат, 2-пропанол або ТГФ, при температурі від 0°С до температури кипіння і, необов'язково, при підвищеному тиску. 8. Сполуку формули (І) можна одержати, як показано на Схемі 6. Кетон формули (XVIII) можна перетворити у рацемічний амін формули (ІІА) шляхом відновного амінування використовуючи загальновідомі методики, наприклад, аміак або його еквівалент, і відновлюючий агент в придатному розчиннику. Рацемічний амін формули (ІІА) можна розділити одержуючи амін формули (II) використовуючи стандартні методики, такі як класичні, кінетичні або динамічні методики розділення. Амін формули (II) можна перетворити у сполуку формули (І) шляхами описаними в Способах 1 і 2. Альтернативно, рацемічний амін формули (ІІА) можна перетворити у сполуку формули (І) використовуючи сполуку формули (III), або придатні її активовані похідні, хіральний каталізатор, необов'язково, використовуючи каталізатор для рацемізації присутнього небажаного ізомеру, і придатний розчинник. Амін формули (II) або його сіль металу (тобто, депротоновану форму) також можна перетворити у сполуку формули (І) за допомогою реакції з естером формули: R1CO2R5 (XXIV) в якій R5 є естерутворюючою групою, такою як С1-С6 алкіл. Зазвичай реакцію проводять шляхом взаємодії естеру і аміну або його солі металу, з надлишком основи, такої як триетиламін і, необов'язково, каталізатору в розчиннику, такому як дихлорметан, етилацетат, ТГФ або толуол, з або без води як співрозчинника; або шляхом обробки естеру і аміну в присутності ферменту каталізатору в розчиннику, такому як дихлорметан, етилацетат, ТГФ або толуол, з або без води як співрозчинника. Всі приведені вище реакції і приготування нових вихідних сполук, що використовуються в приведених вище способах є загальновідомими і прийнятні реагенти і умови реакцій для їх здійснення або приготування, також як методики виділення продуктів будуть добре відомі спеціалістам в цій галузі з посиланням на попередню літературу і їх Приклади і Приготування. Фармацевтично прийнятну сіль сполуки формули (І) можна легко одержати шляхом змішування розчинів сполуки формули (І) і бажаної кислоти. Сіль можна висадити з розчину і зібрати фільтруванням або можна виділити шляхом випарювання розчинника. Сполуки формули (І), і їх фармацевтично прийнятні солі, є корисними оскільки вони мають фармакологічну активність у тварин, включаючи людей. Більш особливо, вони корисні при лікуванні розладів, які модулюються втягуванням CCR5 рецепторів. Хворобливими станами, що можуть бути згадані, є ВІЛ, ретровірусна інфекція, що генетично обумовлює ВІЛ, СНІД, або запальне захворювання. Сполуки формули (І), і їх фармацевтично прийнятні солі, можна вводити самостійно або як частину комбінаційної терапії. Сполуки цього винаходу можуть бути використані при лікуванні респіраторних захворювань, включаючи гострий респіраторний дистрессиндром (ARDS), бронхіт, хронічний бронхіт, хронічне обструктивне пульмональне захворювання, кістозний фіброз, астма, емфізема, риніт і хронічний синусит. Іншими станами, що можуть бути вилікувані є захворювання, які ініціюються, уражаються або будь-яким іншим чином обумовлені Т-клітинном трафіком в різних органах. Очевидно, що сполуки цього винаходу можуть бути корисні при лікуванні таких станів і особливо, але не обмежується наступними для яких кореляція з CCR5 або визначений CCR5 хемокінез: запалення внутрішніх органів, включаючи хворобу Крона і виразковий коліт, розсіяний склероз, ревматоїдний артрит, відторгнення трансплантату, зокрема, але не обмежується відторгненням нирки і легені, ендометріоз, діабет типу І, захворювання нирок, хронічний панкреатит, стани запалення легені або хронічна серцева недостатність. Для ознайомлення з останнім оглядом можливих застосувань хемокінів і блокаторів хемокінових рецепторів дивіться Cascieri, М.А., і Springer, M.S., 'The chemokine/chemokine receptor family: potential and progress for therapeutic intervention". Curr. Opin. Cherti. Biol., 4(4), 420-7 (August 2000). Здатність сполук формули (І), і їх фармацевтично прийнятних солей, інгібувати ВІЛ інфекцію можна продемонструвати використовуючи одну або більшу кількість методик відомих з літератури, наприклад, використовуючи ВІЛ мікрокультуральне дослідження описане Dimitrov et al., J. Clin. Microbiol., 28, 734-737 (1990), і дослідження псевдотипованого ВІЛ репортеру Connor et al., Virology, 206 (2) 935-44 (1995). Здатність сполук формули (І), і їх фармацевтично прийнятних солей, модулювати активність хемокінового рецептору демонструється методиками відомими в цій галузі, наприклад, використовуючи дослідження зв'язування CCR5 за методикою описаною Combadiere et al., J. Leukoc. Biol., 60, 147-52 (1996); і/або використовуючи дослідження внутрішньоклітинну каліцієву мобілізацію, як описано тими ж самими авторами. Цікавими лініями клітин, що експресують, рецептор є такі, що експресують природний рецептор, такий як РМ1, або IL-2 стимулюємі периферійні лімфоцити крові (PBL), або розроблені клітини, що експресують рекомбінантний рецептор, такий як СНО, 300,19, 1.1,2 або НЕК-293. Сполуки формули (І) можна призначати самостійно, але зазвичай вони призначаються у суміші з придатним фармацевтичним носієм, розріджувачем або носієм, що вибирають в залежності від плануємого шляху введення і стандартної фармацевтичної практики. Наприклад, сполуки формули (І) можна вводити орально, букально або сублінгвально у формі таблеток, капсул, форм, що містять велику кількість частинок, гелів, плівок, овул, еліксирів, розчинів або суспензій, які місить смакові або забарвлюючі агенти, для негайного-, затриманого-, модифікованого-, довготривалого-, пульсуючого або контрольованого-вивільнення. Сполуки формули (І) також можна вводити у формі дозованих форм з швидким диспергуванням або розчиненням або у формі високоенергічної дисперсії або частинок з покриттям. При бажанні придатні рецептури сполуки формули (І) можуть мати покриття або не мати. Такі тверді фармацевтичні композиції, наприклад, таблетки, можуть містити екципієнти, такі як мікрокстилічна целюлоза, лактоза, цитрат нітрію, карбонат кальцію, дигідрофосфат кальцію, гліцин і крохмаль (переважно кукурудзяний, картопляний або тапіоковий крохмаль), дезінтегратори, такі як натрій крохмальгліколят, кроскармелоза натрію і деякі комплекси силікатів, і зв'язуючі, такі як полівінілпіролідон, гідроксипропілметилцелюлоза (ГПМЦ), гідроксипропілцелюлоза (ГПЦ), цукор, желатин і акація. Крім того, композиції можуть містити змащуючи агенти, такі як стеарат магнію, стеаринова кислота, гліцирилбехенат і тальк. Загальний Приклад Рецептура таблетки зазвичай містить від 0,01мг до 500мг активної сполуки в той час як вага таблетки знаходиться в інтервалі від 50мг до 1000мг. Приклад рецептури для 10мг таблетки приведений нижче: Інгредієнт % ваг./ваг. Сполука формули (І) або сіль 10,000* Лактоза 64,125 Крохмаль 21,375 Кроскармелоза натрію 3,000 Стеарат магнію 1,500 * Кількість встановлювали у відповідності з активність лікарського засобу. Таблетки виготовляють за стандартними методиками, наприклад, безпосереднім пресуванням або за допомогою вологого або сухого гранулювання. Ядра таблеток можуть мати покриття з прийнятного покривного матеріалу. Твердими композиціями подібного типу також можна наповнювати желатинові капсули або капсули з ГПМЦ. Переважними екципієнтами в цьому відношенні є лактоза, крохмаль, целюлоза, молочний цукор або високомолекулярні поліетиленгліколі. Наприклад суспензії і/або еліксири, сполуки формули (І) можуть бути об'єднані з різними підсолоджувачами або смаковими агентами, барвниками або пігментами, з емульсифікаторами і/або суспендуючими агентами і з розріджувачами, таким як вода, етанол, пропіленгліколь і гліцерин, і їх комбінації. Сполуки формули (і) також можуть вводитись парентерально, наприклад, внутрішньовенно, внутрішньоартеріально, внутрішньобрюшинно, інтратекально, інтравентрикулярно, інтрауретринально, інтрастернально, внутрішньочерепно, внутрішньом'язово або підшкірно, або вони можуть вводитись за допомогою інфузії або за допомогою безгольного ін'єкційного пристрою. Для такого парентерального введення їх краще використовувати у формі стерильного водного розчину, який може містити інші речовини, наприклад, достатню кількість солі або глюкози для одержання розчину ізотонічного з кров'ю. Водні розчини повинні бути придатним чином забуферені (переважно до pH від 3 до 9), якщо це необхідно. Одержання придатних парентеральних рецептур за стерильних умов легко здійснити за допомогою стандартних фармацевтичних методик добре відомих спеціалісту в цій галузі. Для орального або парентерального введення людині рівень добової дози сполук формули (І), і їх фармацевтично прийнятних солей, буде знаходитись в інтервалі від 0,01 до 30мг/кг (в одиничній або розподіленій дозах) і переважно буде знаходитись в інтервалі від 0,01 до 15 мг/кг. Таким чином таблетки будуть містити від 1мг до 0,5г сполуки для введення один раз або двічі або більшу кількість разів, в залежності від обставин. Лікар в будь-якому випадку визначить потрібну дозу, яка буде найбільш прийнятною для будь якого окремого пацієнту і буде залежати від віку, ваги і відповіді кожного пацієнту. Приведені вище дози є середньо статистичним прикладом. Зрозуміло, що в кожному окрему випадку можливі вищі або менші інтервали доз і такі інтервали підпадають під рамки цього винаходу. Пероральний шлях введення є переважним. Переважно, введення має місце безпосередньо перед потрібним ефектом. Сполуки формули (І) також можна вводити інтраназально або за допомогою інгаляції і є легко вивільнюваним у формі сухого порошку з інгалятору або аерозольного спрею, що міститься в контейнері під тиском, насосі, спреї, пульверизаторі або розпилювачі, з або без використання придатного пропеланту, наприклад, дихлордифторметан, трихлорфторметан, дихлортетрафторетан, гідрофторалкану, такого як 1,1,1,2-тетрафторетан (HFA 134A [торгова марка]) або 1,1,1,2,3,3,3-гептафторпропан (HFA 227EA [торгова марка]), діоксид вуглецю або інші придатні гази. У випадку стиснутого аерозолю, дозовану одиницю можна визначити за допомогою забезпечення клапану, що вивільнює дозовану кількість. Контейнер під тиском, нанос, спрей, пульверизатор або розпилювач може містити розчин або суспензію активної сполуки, наприклад, використовуючи як розчинник суміш етанолу і пропеланту, яка додатково може містити змащуючи агенти, наприклад триолеату сорбіт. Капсули і картриджі (виготовляють, наприклад, з желатину) для використання в інгаляторі або вдувачі можна сформувати так, що вони будуть містити порошкоподібну суміш сполуки формули (І) і придатної основи порошку, такої як лактоза або крохмаль. Аерозоль або рецептури сухого порошку переважно улагоджені так, що кожна відмірювана доза або "пшик" містить від 1мкг до 10мг сполуки формули (І) для введення в пацієнта. Загальна добова доза аерозолю буде знаходитись в інтервалі від 1мкг до 20мг і яка може призначатись в одиничній дозі або, що більш звичайно, в розподілених дозах протягом дня. Альтернативно, сполуки формули (І) можна призначати у формі супозиторію або песарію, або вони можуть використовуватись місцево у формі гелю, гідрогелю, лосьйону, розчину, крему, мазі або порошку. Сполуки формули (І) також можна вводити дермально або трансдермально, наприклад, використовуючи пластир на шкіру. Вони також можуть вводитись пулмонарним або ректальним шляхом. Вони також можуть вводитись окулярним шляхом, особливо при лікуванні запальних станів очей. Для офтальмологічного використання, сполуки можна сформувати у вигляді мікронізованої суспензії в ізотонічному, з заданим pH стерильним розчині солі або, переважно, як розчини в ізотонічному, з заданим pH, стерильним розчині солі, необов'язково, в комбінації з консервантом, таким як бензилалконійхлорид. Альтернативно, вони можуть бути сформовані у мазь на основі вазеліну. Для місцевого використання через шкіру, сполуки формули (І) можна сформувати у вигляді мазі, що містить активну сполуку, суспендовану або розчинену в, наприклад, суміші одного або більшої кількості наступних носіїв: мінеральне масло, рідкий вазелін, білий вазелін, пропіленгліколь, поліоксиетилен, поліоксипропілен, емульсифікований віск і вода. Альтернативно, вони можуть бути сформовані у вигляді придатного лосьйону або крему, суспендованого або розчиненого в, наприклад, суміші одного або більшої кількості наступних розчинників: мінеральне масло, моностеарат сорбіту, поліетиленгліколь, рідкий парафін, полісорбат 60, цетилові естери воску, цетеариловий спирт, 2-октилдодеканол, бензиловий спирт і вода. Сполуки формули (І) також можна використовувати в комбінації з циклодекстрином. Циклодекстрини відомі по утворенню комплексів включення і просто комплексів з молекулами лікарських засобів. Утворенням комплексу лікарський засіб-циклодекстрин можна модифікувати розчинність, швидкість розчинення, біодоступность і/або стабільність молекули лікарського засобу Комплекси лікарський засіб-циклодекстрин зазвичай корисні для більшості дозованих форм і шляхів призначення. Як альтернатива безпосереднього комплексування з лікарським засобом, циклодекстрин можна використовувати як допоміжний наповнювач, наприклад, як носій, розріджувач або солюбілізатор. Найбільш часто використовуються альфа-, бета- і гаммациклодекстрини і придатні приклади описані в WО-A-91/11172, WO-A-94/02518 і WO-A-98/55148. Сполуки формули (І), і їх фармацевтично прийнятні солі, мають перевагу, оскільки вони є більш селективними, мають більш швидкий початок дії, є більш активними, є більш стабільними, є більш стійкими до метаболізму або мають інші більш бажані властивості, ніж сполуки попереднього рівня техніки. В межі представленого винаходу включені втілення, що стосуються спільного призначення композицій, які містять на додаток до сполуки представленого винаходу, як активного інгредієнту, додаткові терапевтичні агенти і активні інгредієнти. Такі багатофункціональні режими, часто стосується комбінаційної терапії, можуть бути використані при лікуванні і запобіганні будь-яких захворювань або станів обумовлених або пов'язаних модуляцією хемокінового CCR5 рецептору, зокрема, зокрема, інфікуванням людини вірусом імунодефіциту, ВІЛ. Використання таких комбінацій терапевтичних агентів є особливо доречним у відношенні лікування і запобігання інфекції і розмноження вірусу імунодефіциту людини, ВІЛ, і стосується патогенних ретровірусів у пацієнтів, що потребують лікування або які стають ризикованими для таких пацієнтів. Здатність таких ретровірусних патогенів проявляти себе у відносно короткий період часу в штамах стійких до будь-якою монотерапії, яка призначається згаданому пацієнту, добре відома з літератури. На додаток до вимоги терапевтичної ефективності, яка може потребувати використання активних агентів на доповнення до сполук формули (І) і їх фармацевтично активних солей, що модулюють хемокіновий CCR5 рецептор, існують додаткові пояснення, які заставляють або строго рекомендують використовувати комбінації лікарських засобів, що містять активні інгредієнти, які представляють допоміжну терапію, тобто, які доповняють і поповнюють функцію, що здійснюється сполуками представленого винаходу, що модулюють хемокіновий CCR5 рецептор. Такі доповнюючи терапевтичні агенти використовуються для цілей допоміжного лікування включаючи лікарські засоби, які замість безпосереднього лікування або запобігання захворювання опосередкованого або обумовленого хемокіновим CCR5 рецептором, лікують захворювання або стани, які безпосередньо витікають або непрямо супроводжуються основним або підосновним захворюванням або станом, що опосередковується хемокіновим CCR5 рецептором. Наприклад, коли основним опосередкованим хемокіновим CCR5 рецептором захворюванням або станом є ВІЧ інфекція і розмноження, може бути необхідно або, принаймні, бажано лікувати опортуністичні інфекції, новоутворення і інші стани, які зустрічаються як наслідок імунокомпрометованого стану пацієнту, що лікується. Інші активні агенти можуть використовуватись з сполуками формули (І) і їх фармацевтично прийнятними солями, наприклад, для того щоб забезпечити імунну стимуляцію або лікування болю і запалення, яке супроводжує початкову і основну стадію ВІЛ інфекції. Таким чином, способи лікування і фармацевтичні композиції представленого винаходу можуть використовувати сполуки формули (І) і їх фармацевтично прийнятні солі, у формі монотерапії, але згадані способи і композиції також можуть бути використані у формі багатоскладової терапії в якій одна або більша кількість сполук формули (І) або їх фармацевтично прийнятних солей призначається у комбінацію з одним або більшій кількості терапевтичних агентів, що описані більш детально далі. Переважними комбінаціями представленого винаходу є одночасне або послідовне введення сполуки формули (І) або її фармацевтично прийнятної солі і одного або більшої кількості інгібіторів ВІЛ протеази і/або інгібіторів ВІЛ зворотної транскриптази, що переважно вибирають з класу ненуклеозидинх інгібіторів зворотної транскриптази (NNRTI), включаючи але не обмежується, невірапин, делавірдин і ефавіренц; з нуклеозид/нуклеотидних інгібіторів, включаючи але не обмежується, зидовудин, диданозин, залцитабін, ставудин, ламівудин, абакавір, аднфовір і дипівоксил і з інгібіторів протеаз, включаючи але не обмежується, індинавір, ритонавір, сакуінавір, нелфінавір, лопінавір і ампренавір. Іншими агентами корисними в описаних вище переважних втіленнях комбінацій представленого винаходу є широко розповсюджені і досліджувані і розроблювані лікарські засоби з будь-яких згаданих вище класів інгібіторів, включаючи але не обмежується, FTC, РМРА, фозивудин тидоксил, талвіралін, S-1153, MKCM42, MSC-204, MSH-372, DMP450, PNU-140690, АВТ-378 і KNI-764. Також в межі переважних втілень представленого винаходу включені комбінації сполуки формули (І) або її фармацевтично прийнятної солі разом з додатковими терапевтичним агентами, що використовуються для цілей додаткового лікування, в яких згаданими додатковими терапевтичним агентами є один або більша кількість членів, що незалежно вибирають з групи, яка містить інгібітори проліферації, наприклад, гідроксисечовина; імуномодулятори, наприклад, сарграмостин, і різні форми інтерферону або похідні інтерферону; інгібітори злиття, наприклад, AMD3100, Т-20, PRO-542, AD-349, ВВ-10010 і інші агоністи/антагоністи хемокінового рецептору; модулятори тахікінінового рецептору, наприклад антагоністи NK1; інгібітори інтегрази, наприклад, AR177; інгібітори РНазиН; інгібітори віральної транскрипції і реплікації РНК; і інші агенти, що інгібують вірусну інфекцію або покращують стан або наслідки ВІЛ-інфікування осіб через різні механізми. Переважними способами лікування представленого винаходу для запобігання ВІЛ інфекції, або лікування авіремічного і асимптоматичного суб'єктів потенційно або дійсно інфікованих ВІЛ, включаючи але не обмежується, є введення члену, що незалежно вибирають з групи, яка містить: (і) сполуку в межах формули (І), як тут описано; (іі) один NNRTI на додаток до сполуки (і); (ііі) два NRTI на додаток до сполуки (і); (iv) один NRTI на додаток до комбінації (ii), і (v) сполуку, яку вибирають з класу інгібіторів протеаз, що використовують замість NRTI у комбінаціях (iiі) і (iv). Переважні способи представленого винаходу для терапії ВІЛ-інфікуваних осіб з встановленою віремією або ненормально низьким рівнем CD4, в подальшому включають член, що вибирають з: (vi) лікування згідно з (i), вище, на додаток до стандартного рекомендованих початкових режимів лікування встановлених ВІЛ інфекцій, наприклад, дивіться http://hivatis.org/trtgdlns.html. Такі стандартні режими включають, але не обмежуються, агентами з класу інгібіторів протеаз в комбінації з двома NRTI; і (vii) стандартно рекомендовані початкові режими лікування встановлених ВІЛ інфекцій, наприклад, see http://hivatis.org/trtgdlns.html, в яких або інгібітор протеази, або один або обидва NRTI замінені сполукою в межах формули (І), як тут описано. Переважні способи представленого винаходу для терапії ВІЛ-інфікованих осіб з невдалою антивірусною терапією в подальшому включають член, що вибирають з: (viii) лікування згідно (i), вище, на додаток до стандартно рекомендованих режимів терапії таких пацієнтів, наприклад, дивіться http://hivatis.org/trtgdlns.html; і (iх) стандартно рекомендовані початкові режими лікування пацієнтів, які зазнали невдачі при антивірусному лікуванні, наприклад, see http://hivatis.org/trtgdlns.html, де або один компонент інгібітор протеази, або один або обидва NRTI заміщені сполукою в межах сполуки (І), як тут описано. В описаних вище переважних втілень комбінацій представленого винаходу, сполука формули (І) і інші терапевтичні агенти можуть вводитись на основі дозованих форм або роздільно або в комбінації з кожним іншим, і на основі їх часу введення, або серіями або одночасно. Таким чином, введення одного компоненту може бути пріоритетним, конкурентним або більш пізнім введенню іншого компоненту(ів). Слід звернути увагу, що всі приведені тут посилання на лікування стосуються зцілюючого, пом'якшуючого і профілактичного лікування. Таким чином винахід забезпечує: сполуку формули (І) або її фармацевтично прийнятну сіль або сольват; спосіб одержання сполуки формули (І) або її фрамацевтично прийнятної солі або сольвату; фармацевтичну композицію, що містить сполуку формули (І) або її фрамацевтично прийнятну сіль або сольват, разом з фармацевтично прийнятним екципієнтом, розріджувачем або носієм, сполуку формули (І) або її фармацевтично прийнятну сіль, сольват або композицію, для використання як медикаменту; сполуку формули (І) або її фармацевтично прийнятну сіль, сольват або композицію, для лікування розладу, в який втягнуто модулювання CCR5 рецепторів; сполуку формули (І) або її фармацевтично прийнятну сіль, сольват або композицію, для лікування ВІЛ, ретровірусної інфекції, що генетично обумовлює ВІЛ, СНІДу або запального захворювання; сполуку формули (І) або її фармацевтично прийнятну сіль, сольват або композицію, для лікування респіраторного розладу включаючи гострий респіраторний дистрессиндром (ARDS), бронхіт, хронічний бронхіт, хронічне обструктивне пульмональне захворювання, кістозний фіброз, астму, емфізему, риніт або хронічний синусит; сполуку формули (І) або її фармацевтично прийнятну сіль, сольват або композицію, для лікування запалення внутрішніх органів, включаючи хворобу Крона або виразковий коліт, розсіяного склерозу, ревматоїдного артриту, відторгнення трансплантату, включаючи відторгнення нирки або легені, ендометріозу, діабету типу І, хвороби нирок, хронічного панкреатиту, стану запалення легені або хронічної серцевої недостатності; використання сполуки формули (І) або її фармацевтично прийнятної солі, сольвату або композиції, для виготовлення медикаменту для лікування розладу, в який втягнуто модулювання CCR5 рецепторів; використання сполуки формули (І) або її фармацевтично прийнятної солі, сольвату або композиції, для виготовлення медикаменту для лікування ВІЛ, ретровірусної інфекції, що генетично обумовлює ВІЛ, СНІДу або запального захворювання; використання сполуки формули (І) або її фармацевтично прийнятної солі, сольвату або композиції, для виготовлення медикаменту для лікування респіраторного розладу включаючи гострий респіраторний дистрессиндром (ARDS), бронхіт, хронічний бронхіт, хронічне обструктивне пульмональне захворювання, кістозний фіброз, астму, емфізему, риніт або хронічний синусит; використання сполуки формули (І) або її фармацевтично прийнятної солі, сольвату або композиції, для виготовлення медикаменту для лікування запалення внутрішніх органів, включаючи хворобу Крона або виразковий коліт, розсіяного склерозу, ревматоїдного артриту, відторгнення трансплантату, включаючи відторгнення нирки або легені, ендометріозу, діабету типу І, хвороби нирок, хронічного панкреатиту, стану запалення легені або хронічної серцевої недостатності; спосіб лікування у ссавця розладу, в який втягнуто модулювання CCR5 рецепторів, що полягає у призначенні згаданому ссавцю ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі, сольвату або композиції; спосіб лікування у ссавця ВІЛ, ретровірусної інфекції, що генетично обумовлює ВІЛ, СНІДу або запального захворювання, що полягає у призначенні згаданому ссавцю ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі, сольвату або композиції; спосіб лікування у ссавця респіраторного розладу включаючи гострий респіраторний дистрессиндром (ARDS), бронхіт, хронічний бронхіт, хронічне обструктивне пульмональне захворювання, кістозний фіброз, астму, емфізему, риніт або хронічний синусит, що полягає у призначенні згаданому ссавцю ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі, сольвату або композиції; спосіб лікування у ссавця запалення внутрішніх органів, включаючи хворобу Крона або виразковий коліт, розсіяного склерозу, ревматоїдного артриту, відторгнення трансплантату, включаючи відторгнення нирки або легені, ендометріозу, діабету типу І, хвороби нирок, хронічного панкреатиту, стану запалення легені або хронічної серцевої недостатності, що полягає у призначенні згаданому ссавцю ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі, сольвату або композиції; і проміжні сполуки формул (II), (llА), (VII), (VIA), (XII), (XIV), (XVIII) і (XIX). Винахід ілюструється Прикладами, в яких можуть бути використані наступні абревіатури: 0,88 аміак = концентрований розчин гідроксиду амонію, 0,88 ВС г = година хв = хвилина MC = масспектр ЯМР = ядерний магнітний резонанс Me = метил Приклад 1 N-{(1S)-3-[3-(3-ізопропіл-5-метил-4Н-1,2,4-триазол-4-іл)-екзо-8-азабіцикло[3.2.1]окт-8-ил-1фенілпропіл)циклобутанкарбоксамід N-Бензил-N'-циклогексилкарбодіімід на полімері (1,15г, 0,88ммоль) додавали до розчину вказаної в заголовку Приготування 11 сполуки (250мг, 0,68ммоль) і циклобутанкарбонової кислоти (130мкл, 1,37ммоль) в дихлорметані (10мл) і суміш перемішували при кімнатній температурі протягом 16 годин. Суміш фільтрували крізь Целіт® (фільтруючий матеріал) і випарювали при пониженому тиску. Залишок очищали за допомогою колоночної хроматографії на силікагелі, використовуючи як елюент градієнт дихлорметан:метанол:0,88 аміак (1:0:0 до 95:5:0,5, за об'ємом) одержуючи вказану в заголовку сполуку у вигляді білої піни, 200мг. Знайдено С, 69,98; Н, 8,67; N, 14,89% C27H39N5O; 0,2 СН2СІ2; потрібно С, 70,01; Н, 8,51; N, 15,01% 1 Н-ЯМР (400МГц, CDCI3): d [м.ч.] 1,40 (6Н, д), 1,63 (4Н, м), 1,85-2,45 (14Н, м), 2,52 (3Н, с), 3,00 (2Н, м), 3,39 (2Н, м), 4,30 (1Н, м), 5,15 (1Н, м), 6,35 (1Н, м), 7,15-7,40 (5Н, м). НРМС: m/z 450,3 (МН+) [a]D-34,0° (с = 0,10, МеОН) Приклад 2 N-{(1S)-3-[3-(3-ізопропіл-5-метил-4Н-1,2,4-триазол-4-іл)-екзо-8-азабицікло[3.2.1]окт-8-ил]-1фенілпропіл)циклопентанкарбоксамід Циклопентанкарбонову кислоту (115мкл, 1,06ммоль) додавали до розчину вказаної в заголовку Приготування 11 сполуки (300мг, 0,82ммоль), гидрату гідроксибензтриазолу (10мг, 74мкмоль) і метил йодиду 1-(3-диметиламінопропіл)-3-етилкарбодііміду (300мг, 1,07ммоль) в дихлорметані (10мл) і суміш перемішували при кімнатній температурі протягом 3 годин. До суміші додавали насичений водний розчин карбонату натрію (50мл) і продукт екстрагували дихлорметаном (2х). Об'єднані органічні шари промивали насиченим водним розчином хлориду натрію, сушили (MgSO4), фільтрували і випарювали при пониженому тиску. Залишок очищали за допомогою колоночної хроматографії на силікагелі використовуючи як елюент градієнт дихлорметан:метанол:0,88 аміак (1:0:0 до 96:4:0,4, за об'ємом) одержуючи вказану в заголовку сполуку у вигляді білої піни, 330мг. Знайдено С, 69,73; Н, 9,00; N, 14,09% C28H41N5O; 0,25 СН2СІ2; потрібно С, 69,98; Н, 8,63; N, 14,44%. 1 Н-ЯМР (400МГц, CDCI3): d [м.ч.] 1,35 (6Н, д), 1,51-2,04 (16Н, м), 2,17 (2Н, м), 2,39 (2Н, м), 2,45 (4Н, м), 2,95 (1Н, м), 3,36 (2Н, с), 4,25 (1Н, м), 5,09 (1Н, м), 6,12 (1Н, м), 7,20-7,33 (5Н, м). НРМС: m/z 464,8 (МН+) [a]D-29,21е (с = 0,10, МеОН) Температура плавлення [°С]: 68-70 Приклад 3 N-{(13)-3-[3-(3-ізопропіл-5-метил-4Н-1,2,4-триазол-4-іл)-екзо-8-азабицікло[3.2.1]окт-8-ил]-1-фенілпропіл)4,4,4-трифторбутанамід N-Бензил-N'-циклогексилкарбодіімід на полімері (370мг, 0,336 ммоль) додавали до розчину вказаної в заголовку Приготування 11 сполуки (100мг, 0,27ммоль) і 4,4,4-трифторбутанкарбонової кислоти (45мг, 0,32ммоль) в дихлорметані (4мл) і суміш перемішували при кімнатній температурі протягом 1,5 годин. Суміш фільтрували крізь Целіт® і випарювали при пониженому тиску. Залишок очищали за допомогою колоночної хроматографії на силікагелі використовуючи як елюент градієнт дихлорметан:метанол:0,88 аміак (1:0:0 до 95:5:0,5, за об'ємом) одержуючи вказану в заголовку сполуку як білу піну, 75мг. Знайдено С, 61,55; Н, 7,46; N, 13,62% C26H36N5OF3;0,25 СН2СІ2; потрібно С, 61,48; Н, 7,17; N, 13,66% 1 Н-ЯМР (400МГц. CDCI3): d [м.ч.] 1,39 (6Н, д), 1,65 (5Н, м), 1,98 (2Н, м) 2,07 (2Н, м), 2,15-2,29 (2Н, м), 2,43 (5Н, м), 2,52 (3Н, с), 3,00 (1Н, м), 3,40 (2Н, с), 4,30 (1Н, м), 5,15 (1Н, м), 6,94 (1Н, м), 7,28 (3Н, м), 7,36 (2Н, м) НРМС: m/z 492,3 (МН+) [a]D-32,41° (с = 0,10, МеОН) Приклад 4 N-{(1S)-3-[3-(3-ізопропіл-5-метил-4Н-1,2,4-триазол-4-іл)-екзо-8-азабіцикло[3.2.1]окт-8-ил]-і-фенілпропіл}4,4-дифторциклогексанкарбоксамід N-Бензил-N'-циклогексилкарбодіімід на полімері (300мг, 0,545ммоль) додавали до розчину вказаної в заголовку Приготування 11 сполуки (100мг, 0,27ммоль) і 4,4-дифторциклогексанкарбонової кислоти (50мг, 0,30ммоль) в дихлорметані (4мл) і суміш перемішували при кімнатній температурі протягом 1,5 годин. Суміш фільтрували крізь Целіт® і випарювали при пониженому тиску. Залишок очищали за допомогою колоночної хроматографії на силікагелі використовуючи як елюент градієнт дихлорметан:метанол:0,88 аміак (1:0:0 до 95:5:0,5, за об'ємом) одержуючи вказану в заголовку сполуку як білу піну, 67мг. Знайдено С, 64,68; Н, 7,88; N, 12,65% C29H41N5OF2;1,36 Н2О; потрібно С, 64,72; Н, 8,19; N, 13,01% 1 Н-ЯМР (400МГц, CDCI3): d [м.ч.] 1,39 (6Н, д), 1,61-2,18 (19Н, м), 2,28 (2Н, м), 2,48 (3Н, с), 2,85 (1 Н, м), 3,36 (2Н, ш д), 4,28 (1Н, м), 5,15 (1Н, м), 6,48-6,61 (1Н, ш м), 7,23 (3Н, м), 7,36 (2Н, м). НРМС: m/z 514,4 (МН+) ДРВП аналіз показав, що продукт є сумішшю поліморфів позначених як "Форма А" і "Форма Б". З суміші було виділено і ідентифіковано окремі кристали чистої Форми А і Форми Б. Дані ДРВП для Форм А і Б приведені в Додатку 1. Приклад 5 N-{(1S)-3-[3-(3-Ізопропіл-5-метил-4Н-1,2,4-триазол-4-іл)-екзо-8-азабіцикло[3.2.1]окт-8-ил]-1-(3фторфеніл)пропіл)-4,4-дифторциклогексанкарбоксамід Вказану в заголовку сполуку одержували з вказаної в заголовку Приготування 13 сполуки (200мг, 0,52ммоль) і 4,4,-дифторциклогексанкарбонової кислоти (128мг, 0,79ммоль) використовуючи методику подібну описаній в Прикладі 4,160мг. Знайдено С, 64,25; Н, 7,67; N, 12,53% C29H40N5OF3; 0,7 Н2О; потрібно С, 64,00; Н, 7,67; N, 12,87% 1 Н-ЯМР (400МГц, CDCI3): d [м.ч.] 1,39 (6Н, д), 1,60-2,35 (19Н, м), 2,42-2,60 (2Н, м), 2,55 (3Н, с), 2,98 (1Н, м), 3,40 (2Н, ш д), 4,32 (1Н, м), 5,14 (1Н, м), 6,79 (1Н, ш м), 6,97 (2Н, м), 7,05 (1Н, м), 7,31 (1Н, м). НРМС: m/z 532 (МН+). Приклад 6 N-{(1S)-3-[3-(3-ізопропіл-5-метил-4Н-1,2,4-триазол-4-іл)-екзо-8-азабіцикло[3.2.1]окт-8-ил]-1-фенілпропіл)4,4-дифторциклогексанкарбоксамід Вказану в заголовку Приготування 20 сполуку (176г, 0,48моль) розчиняли в дихлорметані (1,76л). Додавали розчин насиченого водного карбонату натрію (1,76л) і воді (1,76л). Спостерігалось виділення тепла і суміш охолоджували до 15°С. До реакційної суміші додавали розчин вказаної в заголовку Приготування 14 сполуки (131, г, 0,72моль) в толуолі (500мл) і спостерігали виділення тепла. Одержану суміш перемішували протягом 12г при кімнатній температурі. ВЕРХ аналіз реакційної суміші показав, що реакція закінчилась. Додавали воду (1л) і дихлорметан (1л) для полегшення розділення фаз. Фази розділяли і pH водної фази була рН=11. Водну фазу промивали дихлорметаном (1,76л). Об'єднані органічні фази промивали 0,5М водним гідроксидом натрію (1,76л) і потім водою (1,76л). Органічну фазу концентрували і додавали етилацетат (700мл). Суміш залишали для гранулювання при кімнатній температурі на ніч. Білу тверду речовину фільтрували і продукт промивали етилацетатом (60мл) і сушили у вакуумі протягом 12г при 40°С одержуючи вказану в заголовку сполуку як білу тверду речовину 146г (59%). 1 Н-ЯМР було ідентичним вказаній в заголовку сполуки в Прикладі 4. ДРВП аналіз показав, що продукт є індивідуальною поліморфною формою позначеною "Форма Б". Дані ДРВП для Форми Б приведені в Додатку 1. Визначена температура плавлення Форми Б 197°С (пікова температура) використовуючи прилад Т. А. Instruments 2100 DSC. Сканування проводили з швидкістю 20°С/хвилину, (до 300°С) в потоці азоту. Приклад 7 N-((1S)-3-[3-(3-ізопропіл-5-метил)-4Н-1,2,4-триазол-4-іл)-екзо-8-азабіцикло[3.2.1]окт-8-ил]-1-фенілпропіл}4,4-дифторциклогексанкарбоксамід Вказану в заголовку Приготування 9 сполуку суспендували в дихлорметані (9мл) і розчин вказаної в заголовку Приготування 17 сполуки (1,58г, 5,35ммоль) в толуолі (3,2мл) додавали до реакційної суміші після чого додавали оцтову кислота (0,3мл). До одержаного розчину порціями додавали триацетоксиборгідрид натрію (1,36г, 6,24ммоль). Одержану суспензію перемішували при кімнатній температурі протягом 30 хвилин. Зразок аналізували за допомогою ВЕРХ і ТШХ і реакція була завершена. Додавали воду (10мл) після чого додавали 2М водний розчин гідроксиду калію (10мл) і шари розділяли. Водну фазу промивали дихлорметаном (10мл) і об'єднані органічні шари промивали 1М водним розчином гідроксидом калію (10мл). Органічний шар концентрували при пониженому тиску одержуючи блідо-коричневу піну, яку суспендували в етилацетаті (10мл) протягом 12 годин при кімнатній температурі. Білу тверду речовину відфільтровували і сушили при пониженому тиску і температурі 40°С протягом 4 годин одержуючи вказану в заголовку сполуку, яку ідентифікували як вказану в заголовку Прикладу 4 сполуку, 2,05г, вихід 75%. Наступні приготування ілюструють одержання деяких проміжних сполук, що використовуються в приведених вище Прикладах. Приготування 1 Метил (3S)-3-аміно-3-фенілпропаноат Розчин трет-бутил (3S)-3-аміно-3-фенілпропаноату (5,04г, 22,9ммоль) в 2,25М метанольному хлороводні (100мл) нагрівали із зворотнім холодильником протягом 2 ½ годин. Суміш охолоджували до кімнатної температури, підлуговували насиченим водним розчином карбонату натрію до pH 8 і фази розділяли. Водний шар екстрагували дихлорметаном (4х). Об'єднані органічні розчини промивали насиченим водним розчином хлориду натрію, сушили (MgSO4), фільтрували і випарювали при пониженому тиску одержуючи вказану в заголовку сполуку, 3,97г. 1 Н-ЯМР (400МГц, CDCI3): d [м.ч.] 1,70 (2Н, с), 2,66 (2Н, д), 3,68 (3Н, с), 4,43 (1Н, т), 7,25-7,40 (5Н, м). НРМС: m/z 180,3 (МН+). Приготування 2 Метил (3S)-3-[(трет-бутоксикарбоніл)аміно]-3-фенілпропаноату Суміш вказаної в заголовку Приготування 1 сполуки (5,38г, 30ммоль), ди-трет-бутил дикарбонат (8,72г, 40ммоль), тетрагідрофуран (50мл) і 2N водний розчин гідроксиду натрію (25мл) перемішували при кімнатній температурі протягом 2 годин. Реакційну суміш розводили етилацетатом, шари розділяли і водну фазу екстрагували етилацетатом (2х). Об'єднані органічні розчини промивали водою, насиченим водним розчином хлориду натрію, сушили (MgSO4), фільтрували і випарювали при пониженому тиску одержуючи вказану в заголовку сполуку як білу тверду речовину, 8,39г. 1 Н ЯМР (400МГц, CDCI3): d [м.ч.] 1,41 (9Н, с), 2,84 (2Н, м), 3,61 (3Н, с), 5,10 (1Н, ш с), 5,41 (1Н, ш с), 7,227,36 (5Н, м). НРМС: m/z 279,7 (МН+) Приготування 3 трет-Бутил (1S)-3-оксо-1-фенілпропілкарбамат Діізобутилалюмогідрид (1M в дихлорметані, 60мл, 60ммоль) охолоджували до -78°С і по краплям додавали до розчину вказаної в заголовку Приготування 2 сполуки (8,39г, 30ммоль) в дихлорметані (150мл) при -78°С. Реакційну суміш перемішували протягом 90 хвилин потім додавали метанол (охолоджений до 78°С, 40мл). Суміш залишали нагріватись до кімнатної температури і виливали у 2М водний розчин хлорводневої кислоти (200мл). Шари розділяли і водну фазу екстрагували дихлорметаном (2х). Об'єднані органічні шари сушили (MgSO4), фільтрували і випарювали при пониженому тиску одержуючи вказану в заголовку сполуку як білу тверду речовину, 6,72г. 1 Н ЯМР (400МГц, CDCI3): d [м.ч.] 1,42 (9Н, с), 2,86-3,00 (2Н, м), 5,06 (1Н, ш с), 5,20 (1Н, ш с), 7,22-7,38 (5Н, м), 9,75 (1Н, с). НРМС: m/z 250,1 (МН+). Приготування 4 8-Бензил-8-азабіцикло[3.2.1]октан-3-он Розчин 2,5-диметокситетрагідрофуран (50г, 378ммоль) в 0,025М водному розчині хлорводневої кислоти (160мл) охолоджували до 0°С і перемішували протягом 16 годин. Додавали гідрохлорид бензиламіну (65г, 453ммоль), кетомалонову кислоту (55г, 377ммоль) і водний розчин ацетату натрію (300мл, 0,69М) і реакційну суміш перемішували при кімнатній температурі протягом 1 години. Суміш нагрівали при 50°С протягом ще 90 хвилин потім охолоджували на льодяній бані і підлуговували до рН12 2N водним розчином гідроксиду натрію. Шари розділяли, і водну фазу екстрагували етилацетатом (3х). Об'єднані органічні розчини промивали водою, сушили (MgSO4), фільтрували і випарювали при пониженому тиску. Коричневе масло що залишилось, переганяли при пониженому тиску (126°С/0,4кПа) одержуючи вказану в заголовку сполуку як майже-білу тверду речовину, 37,81г. 1 Н ЯМР (400МГц, CDCI3): d [м.ч.] 1,64 (2Н, м), 2,06-2,14 (2Н, м), 2,18 (1Н, с), 2,23 (1Н, с), 2,68 (1Н, м), 2,72 (1Н, м), 3,48 (2Н, с), 3,73 (2Н, с), 7,20-7,29 (1Н, м), 7,32 (2Н, м), 7,42 (2Н, д). НРМС: m/z 216,3 (МН+). Приготування 5 8-Бензил-8-азабіцикло[3.2.1]октан-3-ону оксим Суміш вказаної в заголовку Приготування 4 сполуки (17,72г, 82ммоль), гідрохлорид гідроксиламіну (5,72г, 82ммоль) і піридин (7,2мл, 89ммоль), нагрівали із зворотнім холодильником в етанолі (500мл) протягом 20 годин. Реакційну суміш залишали охолоджуватись до кімнатної температури і розводили насиченим водним розчином карбонату натрію. Суміш фільтрували і фільтрат випарювали при пониженому тиску. Залишок розділяли між дихлорметаном і водою, шари розділяли і водний шар екстрагували дихлорметаном (2х). Об'єднані органічні екстракти промивали насиченим водним розчином хлориду натрію, сушили (MgSO4), фільтрували і випарювали при пониженому тиску одержуючи вказану в заголовку сполуку як блідо-коричневу тверду речовину, 18,10г. 1 Н ЯМР (400МГц. CDCI3): d [м.ч.] 1,45-1,56 (1Н, м), 1,60-1,67 (1Н, м), 1,96-2,07 (2Н, ш м), 2,12 (1Н, м), 2,21 (1Н, м), 2,57 (1Н, м), 2,97 (1Н, м), 3,32 (2Н, м), 3,64 (2Н, с), 7,06 (1Н, с), 7,21-7,28 (1Н, м), 7,32 (2Н, м), 7,38 (2Н, д). НРМС: m/z 231,2 (МН+) Приготування 6 8-Бензил-8-азабіцикло[3.2.1]октан-3-екзо-амін Розчин вказаної в заголовку Приготування 5 сполуки (18,10г, 79ммоль) в пентанолі (500мл) нагрівали із зворотнім холодильником. Порціями протягом 2,5 годин додавали натрій (22,0г, 957ммоль). Реакційну суміш нагрівали із зворотнім холодильником протягом 2 годин потім охолоджували до 0°С на льодяній бані. Додавали воду доки не переставав виділятися водень. Суміш підкислювали використовуючи 6N водний розчин хлорводневої кислоти і фази розділяли. Органічний шар екстрагували 6N водним розчином хлорводневої кислоти (3х), об'єднані водні екстракти підлуговували до pH 12 таблетками гідроксиду натрію (400г) і водний розчин екстрагували етилацетатом (3х). Об'єднані органічні розчини сушили (MgSO4), фільтрували і випарювали при пониженому тиску одержуючи вказану в заголовку сполуку, 15,65г. 1 Н ЯМР (400МГц, CDCI3): d [м.ч.] 1,20-1,40 (2Н, ш м), 1,48 (2Н, м), 1,58 (2Н, д), 1,64-1,76 (2H, ш м), 2,00 (2Н, ш м), 2,95 (1Н, м), 3,19 (2Н, ш с), 3,57 (2Н, с), 7,18-7,26 (1Н, м), 7,30 (2Н, м), 7,37 (2Н, д). НРМС- m/z 217,3 (МН+). Приготування 7 N-(8-Бензил-8-азабіцикло[3.2.1]окт-3-ил-окзо)-2-метилпропанамід Триетиламін (9мл, 66,8ммоль) додавали до розчину вказаної в заголовку Приготування 6 сполуки (13г, 60,1ммоль), ізомасляної кислоти (5,6мл, 60,5ммоль) і гідрохлориду 1-(3-диметиламінопропіл)-3етилкарбодііміду (11,6г, 60,4ммоль) в дихлорметані (150мл). Реакційну суміш перемішували при кімнатній температурі протягом 3 годин після чого додавали ізомасляну кислоту (1,4мл, 15ммоль) і гідрохлорид 1-(3диметиламінопропіл)-3-етилкарбодііміду (2,9г, 15,1ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 2 днів після чого додавали ізомасляну кислоту (2,6мл, 28ммоль), гідрохлорид 1-(3диметиламінопропіл)-3-етилкарбодііміду (5г, 26ммоль) і триетиламін (3мл, 22,3ммоль). Реакційну суміш перемішували протягом 24 годин. До суміші додавали насичений водний розчин карбонату натрію (300мл) і продукт екстрагували дихлорметаном (2х). Об'єднані органічні шари промивали насиченим водним розчином хлориду натрію, сушили (MgSO4), фільтрували і випарювали при пониженому тиску Залишок очищали за допомогою колоночної хроматографії на силікагелі використовуючи як елюент градієнт дихлорметан:метанол:0,88 аміак (1:0:0 до 97 3:0,3, за об'ємом) одержуючи вказану в заголовку сполуку як білий порошок, 9,2г. Знайдено С, 75,43, Н, 9,30; N, 9,82% C18H26N2O потрібно С, 75,48; Н, 9,15, N, 9,78% 1 Н-ЯМР (400МГц, CDCI3): d [м.ч.] 1,10 (6Н, д), 1,47 (2Н, тр), 1,60 (2Н, с), 1,70 (2Н, м), 1,80 (2Н, м), 2,02 (2Н, м), 2,27 (1Н, м), 3,20 (2Н, с), 4,10 (1Н, м), 5,15 (1Н, м), 7,20-7,40 (5Н, м). HPMC: m/z 287,4 (МН+) Температура плавлення [°С]: 138-140 Приготування 8 8-Бензил-3-(3-ізопропіл-5-метил-4Н-1,2,4-триазол-4-іл)-екзо-8-азабіцикло[3.2.1]октан Оксихлорид фосфору (9мл, 96,9ммоль) додавали до розчин вказаної в заголовку Приготування 7 сполуки (9,2г, 32ммоль) і піридину (16мл, 196ммоль) в хлороформі (20мл) при 0°С. Реакційну суміш залишали нагріватись до кімнатної температури і перемішували при кімнатній температурі протягом 5 годин. Суміш випарювали при пониженому тиску. Залишок розчиняли в хлороформі (40мл) і додавали оцтовий гідразид (3,6г, 48,6ммоль). Суміш нагрівали із зворотнім холодильником протягом 3 годин. До суміші додавали насичений водний розчин карбонату натрію (250мл) і продукт екстрагували дихлорметаном (2х). Об'єднані органічні шари промивали насиченим водним розчином хлориду натрію, сушили (MgSO4), фільтрували і випарювали при пониженому тиску. До залишку додавали толуол (200мл) і моногідрат п-толуолсульфонової кислоти (100мг, 0,53ммоль). Реакційну суміш нагрівали із зворотнім холодильником протягом 2 годин. Реакційну суміш випарювали при пониженому тиску. Залишок очищали за допомогою колоночної хроматографії на силікагелі використовуючи як елюент градієнт дихлорметан:метанол:0,88 аміак (1:0:0 до 95:5:0,5, за об'ємом) одержуючи неочищений продукт. Неочищений матеріал суспендували в 6N водному розчині хлорводневої кислоти (40мл) і нагрівали із зворотнім холодильником протягом 12 годин після чого додавали 12N водний розчин хлорводневої кислоти (4мл). Реакційну суміш нагрівали із зворотнім холодильником протягом 2 годин. Суміш випарювали при пониженому тиску. Залишок підлуговували додаванням насиченого водного розчину карбонату калію (200мл) і продукт екстрагували дихлорметаном (3х). Об'єднані органічні шари промивали насиченим водним розчином хлориду натрію, сушили (MgSO4), фільтрували і випарювали при пониженому тиску. Залишок очищали за допомогою колоночної хроматографії на силікагелі використовуючи як елюент градієнт дихлорметан:метанол:0,88 аміак (1:0:0 до 96:4:0,4, за об'ємом) одержуючи вказану в заголовку сполуку як білий порошок, 3,12г. 1 Н-ЯМР (300МГц, CDCI3): d [м.ч.] 1,40 (6Н, д), 1,70 (4Н, м), 2,15-2,40 (4Н, м), 2,60 (3Н, с), 3,07 (1Н, м), 3,37 (2Н, с), 3,60 (2Н, с), 4,30 (1Н, м), 7,25-7,40 (5Н, м). НРМС: m/z 325,3 (МН+) Приготування 9 3-(3-Ізопропіл-5-метил-4Н-1,2,4-триазол-4-іл)-екзо-8-азабіцикло[3.2.1]октан Форміат амонію (6г, 92ммоль) додавали до розчину вказаної в заголовку Приготування 8 сполуки (3,12г, 9,6ммоль) і гідроксиду паладію (II) (500мг) в етанолі (400мл). Суміш нагрівали із зворотнім холодильником протягом 2 годин після чого додавали 0,88 розчин аміаку (2мл). Суміш нагрівали із зворотнім холодильником протягом 1 години і реакційну суміш залишали охолоджуватись до кімнатної температури і фільтрували через Арбоцель™ (фільтруючий матеріал). Розчинник випарювали при пониженому тиску одержуючи вказану в заголовку сполуку як білу тверду речовину, 1,91г. 1 Н-ЯМР (300МГц, CDCl3): d [м.ч.] 1,37 (6Н, д), 1,70-2,25 (8Н, м), 2,50 (3Н, с), 3,05 (1Н, м), 3,70 (2Н, м), 4,32 (1Н, м). НРМС: m/z 235,0 (МН+) Температура плавлення [°С]: 150-154 Приготування 10 трет-Бутил (1S)-3-[3-(3-ізопропіл-5-метил-4Н-1,2,4-триазол-4-іл)-екзо-8-азабіцикло[3.2.1]окт-8-ил]-1фенілпропілкарбамату Триацетоксиборгідрид натрію (1,7г, 8,02ммоль) і льодяну оцтову кислоту (1мл, 17,5ммоль) додавали до розчину вказаної в заголовку Приготування 9 сполуки (1,6г, 6,84ммоль) і вказаної в заголовку Приготування 3 сполуки (2г, 8,03ммоль) в дихлорметані (40мл) і реакційну суміш перемішували при кімнатній температурі протягом 2 годин. Суміш підлуговували 10% ваг/ваг водним розчином карбонату калію і екстрагували дихлорметаном (2х). Об'єднані органічні екстракти промивали насиченим водним розчином хлориду натрію, сушили (MgSO4), фільтрували і випарювали при пониженому тиску. Залишок очищали за допомогою колоночної хроматографії на силікагелі використовуючи як елюент градієнт дихлорметан:метанол:0,88 аміак (1:0:0 до 97,5:2,5:0,25, за об'ємом) одержуючи вказану в заголовку сполуку у вигляді білої піни, 2,5г. 1 Н-ЯМР (300МГц, CDCI3): d [м.ч.] 1,40 (15Н, м), 1,70 (4Н, м), 1,80-2,15 (4Н, м), 2,30 (2Н, м), 2,40 (2Н, м), 2,58 (3Н, с), 3,00 (1Н, м), 3,40 (2Н, м), 4,30 (1Н, м), 4,85 (1Н, м), 6,20 (1Н, м), 7,20-7,40 (5Н, м). НРМС: m/z 468,4 (МН+) Приготування 11 (1S)-3-[3-(3-Ізопропіл-5-метил-4Н-1,2,4-триазол-4-іл)-екзо-8-азабіцикло[3.2.1]окт-8-ил]-1-феніл-1пропанамін Суміш вказаної в заголовку Приготування 10 сполуки (2,5г, 5,35ммоль), 2,25М водний розчин хлорводневої кислоти і метанолу (70мл) нагрівали із зворотнім холодильником протягом 5 хвилин і перемішували при кімнатній температурі протягом 1,5 годин. Реакційну суміш залишали охолоджуватись до кімнатної температури і випарювали при пониженому тиску. Залишок підлуговували додаючи насичений водний розчин карбонат натрію (150мл) і екстрагували дихлорметан (2х). Об'єднані органічні шари промивали насиченим водним розчином хлориду натрію, сушили (MgSO4), фільтрували і випарювали при пониженому тиску одержуючи вказану в заголовку сполуку у вигляді білої піни, 1,80г. 1 Н-ЯМР (400МГц, CDCI3): d [м.ч.] 1,37 (6Н, м), 1,42 (4Н, м), 1,85 (2Н, м), 2,05 (2Н, м), 2,20 (2Н, м), 2,42 (5Н, м), 3,00 (1Н, м), 3,37 (2Н, м), 4,10 (1Н, м). 4,30 (1Н, м), 7,30 (5Н, м). [a]D +15,0° (с = 0,10, МеОН) Приготування 12 трет-Бутил (1S)-3-[3-(3-Ізопропіл-5-метил-4Н-1,2,4-триазол-4-іл)-екзо-8-азабіцикло[3.2.1]окт-8-ил]-1-(3фторфеніл)пропілкарбамату Вказану в заголовку сполуку одержували з вказаної в заголовку Приготування 9 сполуки (1,0г, 4,27ммоль) і трет-бутил (1S)-3-оксо-1-(3-фторфеніл)пропілкарбамату (ЕР-А-1013276) (2,2г, 8,23ммоль) використовуючи методику подібну описаній в Приготуванні 10, 0,76г. НРМС: m/z486 (MH+). Приготування 13 (1S)-3-[3-(3-Ізопропіл-5-метил-4Н-1,2,4-триазол-4-іл)-екзо-8-азабіцикло[3.2.1]окт-8-ил]-1-(3-фторфеніл)-1пропанамін Вказану в заголовку сполуку одержували з вказаної в заголовку Приготування 12 сполуки (760мг, 1,57ммоль) використовуючи методику подібну описаній в Приготуванні 11, 200мг. НРМС: m/z 386,2 (МН+). Приготування 14 4,4-Дифторциклогексанкарбонілхлорид 4,4-Дифторциклогексанкарбонову кислоту (118,2г, 0,72моль) розчиняли в толуолі (296мл). До прозорого розчину додавали тіонілхлорид (261мл, 3,6моль) і одержаний розчин нагрівали із зворотнім холодильником протягом 1,5 годин. Відбирали зразок і концентрували і 1Н-ЯМР показав завершення реакції з утворенням вказаної в заголовку сполуки. Реакційну суміш охолоджували до кімнатної температури і тіонілхлорид видаляли при пониженому тиску і заміняли толуолом одержуючи вказану в заголовку сполуку як концентрат в толуолі з загальним об'ємом 591мл. 1 Н-ЯМР (300МГц, CDCI3): d [м.ч.] 2,29 (1Н, м), 2,20-1,70 (8Н, м). Приготування 15 Етил (3S)-3-{[(4,4-дифторциклогексил)карбоніл]аміно}-3-фенілпропаноат Гідрохлорид етил (3S)-3-аміно-3-фенілпропаноату (10г, 43,6ммоль) суспендували в дихлорметані (100мл) і додавали насичений водний розчин карбонату натрію (100мл) і воду (100мл). Суміш охолоджували до 0°С і до реакційної суміші додавали розчин вказаної в заголовку Приготування 14 сполуки (7,96г, 43,6ммоль) в толуолі (38мл). Одержану суміш перемішували протягом 1 години при кімнатній температурі. ВЕРХ аналіз реакційної суміші показав що реакція завершилась. Шари розділяли. pH Водної фази робили рН=9. Водний шар промивали дихлорметаном (100мл). Об'єднані органічні шари промивали водою (100мл) і потім 1М водним розчином хлорводневої кислоти (100мл) після чого промивали водою (100мл). Органічний шар концентрували до коричневого масла і масло гранулювали в етилацетат:гептан 1:2, за об'ємом, (50мл) протягом 4 годин. Білу тверду речовину відфільтровували і сушили при пониженому тиску протягом 12 годин при 40°С одержуючи вказану в заголовку сполуку як білу тверду речовину, 10,9г, вихід 66%. 1 Н-ЯМР (300МГц, CDCI3): d [м.ч.] 7,30 (5Н, м), 6,76 (1Н, ш д), 5,40 (1Н, м), 4,08 (2Н, к), 2,95-2,75 (2Н, м), 2,30-165 (9Н, м), 1,15 (3Н, т). НРМС: m/z = 338 (М+) Приготування 16 (1S)-4,4-Дифтор-N-(3-гідрокси-1-фенілпропіл)циклогексанкарбоксамід (3S)-3-Аміно-3-фенілпропанол (30,9г, 0,20моль) розчиняли в дихлорметані (300мл) і додавали водний насичений розчин карбонату натрію (300мл). Одержану біфазну суміш охолоджували до 5°С і додавали толуольний концентрат вказаної в заголовку Приготування 14 сполуки (37,3г, 0,20моль, 224мл), підтримуючи температуру нижче 10°С. Одержану суспензію перемішували протягом 15 хвилин при 5°С. ВЕРХ аналіз зразка показав, що реакція завершилась. Додавали воду (310мл) і одержували біфазну суміш. Шари розділяли, водний шар промивали дихлорметаном (300мл) і об'єднані органічні шари промивали 1М водним розчином гідроксиду натрію (300мл). Об'єднані органічні шари концентрували при пониженому тиску до коричневої твердої речовини Тверду речовину суспендували в толуолі (120мл) одержуючи тонкодисперсну білу суспензію. Додавали метил-трет-бутиловий етер (240мл) одержуючи рухливу білу суспензію. Суспензію перемішували при 0°С протягом 1 години і відфільтровували білу тверду речовину. Тверду речовину сушили при пониженому тиску протягом 12 годин при 40сС одержуючи вказану в заголовку сполуку, 53,9г, вихід 89%. 1 Н-ЯМР (300МГц, CDCI3): d [м.ч.] 7,30 (5Н, м), 6,18 (1Н, ш д), 5,20 (1Н, м), 3,75-3,50 (2Н, м), 3,05 (1 Н, шс), 2,18 (4Н, м), 2,00-1,62 (7Н, м). НРМС m/z = 297 (М+) Приготування 17 (1S)-4,4-Дифтор-N-(3-оксо-1-фенілпропіл)циклогексанкарбоксамід Комплекс триоксиду сірки:піридин (80,3г, 0,50моль) суспендували в дихлорметані (175мл) в атмосфері азоту. Додавали диметилсульфоксид (175мл) і одержаний розчин охолоджували до 0°С. Повільно підтримуючи температуру нижче 10°С до реакційної суміші додавали розчин сполуки Приготування 16, триетиламіну (70мл, 0,50моль) і диметилсульфоксиду (88мл) в дихлорметані (88мл). Одержаний жовтий розчин перемішували при 0°С протягом 2 годин доку ТШХ зразка не показала, що всі вихідні матеріали було використано. Додавали воду (750мл) і одержували біфазну суміш. Суміш розводили толуолом (750мл) і шари розділяли. Органічний шар промивали 0,5М водним розчином хлорводневої кислоти (750мл) і насиченим водним розчином хлориду натрію (750мл). Органічний шар концентрували при пониженому тиску до коричневої твердої речовини, яку використовували в Прикладі 7 без подальшої очистки. Зразок твердої речовини очищали гранулюванням в етилацетат: метил-трет-бутиловий етер (1:5, 4мл/г). 1 Н-ЯМР (300МГц, CDCI3): d [м.ч.] 9,78(1Н, с) 7,30 (5Н, м), 6,15 (1Н, ш д), 5,50 (1Н, м), 3,05 (2Н, м), 2,18 (3Н, м), 2,00-1,55 (6Н, м). НРМС: m/z =295 (М+) приготування 18 Бензил (1S)-3-оксо-1-фенілпропілкарбамат Комплекс триоксид сірки:піридин (965г, 6,1моль) суспендували в дихлорметані (2л) в атмосфері азоту. Додавали диметилсульфоксид (2л) і одержаний розчин охолоджували до 0°С. Повільно підтримуючи температуру нижче 10°С до реакційної суміші додавали розчин бензил (1S)-3-гідрокси-1фенілпропілкарбамату (577г, 2,0моль), триетиламіну (845мл, 6,1моль) і диметилсульфоксиду (1л) в дихлорметані (1мл). Одержаний жовтий розчин перемішували при 0°С протягом 2,5 годин. Зразок аналізували за допомогою ТШХ, яка показала що всі вихідні матеріали було використано. Додавали воду (8,6л) і одержували біфазну суміш. Суміш розводили толуолом (8,6л) і шари розділяли. Органічний шар концентрували при пониженому тиску одержуючи коричневу піну, яку використовували в Приготуванні 19 без подальшої очистки. 1 Н-ЯМР (300МГц, CDCI3): 5 [м.ч.] 9,78(1 Н, с) 7,30 (5Н, м), 6,15 (1Н, ш д), 5,50 (1Н, м), 3,05 (2Н, м), 2,18 (ЗН, м), 2,00-1,55 (6Н, м). НРМС: m/z 283 Приготування 19 Бензил (1S)-3-[3-(3-ізопропіл-5-метил-4Н-1,2,4-триазол-4-іл)-екзо-8-азабіцикло[3.2.1]окт-8-ил]-1фенілпропілкарбамат Вказану в заголовку Приготування 9 сполуку (13,5г, 32 ммоль) суспендували в дихлорметані (27мл) і до реакційної суміші додавали розчин сполуки Приготування 18 (9,93г, 35ммоль) в толуолі (50мл) і дихлорметан (50мл) і потім додавали оцтову кислоту (2,7мл). До одержаного розчину порціями додавали триацетоксиборгідрид натрію (8,1г, 38ммоль). Одержану суспензію перемішували при кімнатній температурі протягом 1,5 годин. Зразок аналізували ВЕРХ і ТШХ і визначали завершення реакції. Додавали воду (27мл) після чого 2М водний розчин гідроксиду натрію (27мл). Водний шар підлуговували до pH 11-12 додаючи 10М водний розчин гідроксиду натрію і шари розділяли. Органічний шар промивали 1М водним гідроксидом натрію (27мл) і насиченим водним розчином хлориду натрію (27мл). Органічний шар концентрували при пониженому тиску одержуючи блідо-коричневу піну, 13,3г, 76 %. 1 Н-ЯМР (300МГц, CDCI3): d [м.ч.] 1,39 (6Н, д), 1,55-1,75 (4Н, м), 1,84 (2Н, м), 2,05 (2Н, м), 2,15-2,45 (6Н, м), 2,97 (1Н, м), 3,36 (1Н, ш с), 3,45 (1Н, ш с), 4,25 (1Н, м), 4,93 (1Н, ш с), 5,10 (2Н, м), 7,10-7,40 (10Н, м). НРМС: m/z 502 Приготування 20 (1S)-3-[3-(3-Ізопропіл-5-метил-4Н-1,2,4-триазол-4-іл)-екзо-8-азабіцикло[3.2.1]окт-8-ил]-1-феніл-1пропанамін Вказану в заголовку Приготування 19 сполуку (309г, 0,62моль) розчиняли в метанолі (3,11). Додавали гідроксид паладію (II) (31г) і одержану суспензію перемішували в атмосфері водню при 345кПа (50 псі) протягом 12 годин. Відбирали зразок і аналізували за допомогою ТШХ і ВЕРХ і визначали завершення реакції. Реакційну суміш фільтрували крізь Арбоцель™ (фільтруючий матеріал) і фільтр промивали метанолом (500мл). Метанольний розчин концентрували одержуючи вказану в заголовку сполуку у вигляді білої піни, 176г, 78%. 1 Н-ЯМР ідентичний вказаній в заголовку Приготування 11 сполуки. Приготування 21 8-Бензил-8-азабіцикло[3.2.1]октан-3-ону оксим Суміш вказану в заголовку Приготування 4 сполуки (50г, 0,23моль) розчиняли в промислово метильованому спирті (250мл). До одержаного розчину екзотермінчо додавали розчин гідрохлориду гідроксиламіну (17,8г, 0,26моль) у воді (250мл). З малою ендотермією додавали бікарбонат натрію (23,4г, 0,28моль) і спостерігали спінення. Одержаний розчин перемішували протягом 12г. Білу тверду речовину, що утворилась, збирали фільтруванням і сушили в печі при пониженому тиску протягом 4 годин при 50°С одержуючи вказану в заголовку сполуку як білу тверду речовину, 43,1г, вихід 81%. Приготування 22 Бензил-8-азабіцикло[3.2.1]октан-3-екзо-амін Чистий натрій (24,3г, 1,06моль) шматочками додавали до толуолу (300мл) при кімнатній температурі і суміш нагрівали із зворотнім холодильником. Повільно протягом 15 хвилин до киплячої реакційної суміші додавали розчин вказаної в заголовку Приготування 5 сполуки (20,0г, 87ммоль) в толуолі (200мл) і пентанолі (120мл). Протягом цього часу спостерігали виділення газу. Одержану суміш нагрівали із зворотнім холодильником протягом 2 годин для гарантування повного використання натрію. Утворювалась тонкодисперсна біла суспензія. Реакційну суміш охолоджували до 80°С і додавали ізопропіловий спирт (200мл). Реакційну суміш залишали охолоджуватись до кімнатної температури і додавали воду (700мл). Водний шар доводили до pH 1 додаючи концентровану хлорводневу кислоту (140мл), (спостерігалось виділення тепла). Реакційну суміш перемішували протягом 15 хвилин і шари розділяли. Додавали етилацетат (700мл) до водного шару з pH 12, яке робили додаючи 10М водний розчин гідроксиду натрію (40мл). Шари розділяли і органічний шар концентрували при пониженому тиску одержуючи а блідо-жовте масло. Пентанол, що утримується маслом, видаляли азеотропною дистиляцією з водою (200мл) і воду, що залишилась, видаляли азеотропною дистиляцією з толуолом (200мл) одержуючи вказану в заголовку сполуку як блідожовте масло, що містить сліди толуолу, 18,0г, вихід 95%. Приготування 23 Екзо-N-(8-бензил-8-азабіцикло[3,2.1]окт-3-ил)-2-метилпропанамід У 20л зафіксований реактор завантажували дихлорметан (5л), карбонат натрію (900г), воду (8,7л) і вказану в заголовку Приготування 6 сполуку (1200г, 5,56моль). Одержану суміш охолоджували до 0°С. Протягом 30 хвилин підтримуючи температуру нижче 10°С додавали хлорид ізомасляної кислоти (700мл, 6,67моль). Одержану суміш перемішували при температурі від 0°С до кімнатної температури протягом 2 годин. Реакція завершувалась через 2 годин, що визначали за допомогою ВЕРХ аналізу. Шари розділяли і водний шар промивали дихлорметаном (1,5л). Водний шар мав pH 8. Об'єднані органічні шари промивали 1М водним розчином гідроксиду натрію (1,5л) і дихлорметан відганяли і додавали етилацетат одержуючи кінцевий об'єм 3 л. Одержану суміш нагрівали із зворотнім холодильником одержуючи прозорий коричневий розчин. Розчин охолоджували до 25°С протягом 1,5 годин і потім до 2°С протягом 1 годни і витримували при цій температурі протягом 30 хвилин. Білу тверду речовину, що утворилась відокремлювали фільтруванням і фільтрат додавали до реактору з вм'ятиною на дні. Температуру підтримували близько 2°С. Одержану суспензію додавали до фільтрату До реактору додавали етилацетат (0,6л) відокремлюючи тверду речовину, що залишилась, і суспензію додавали до фільтрату. Тверду речовину сушили в печі при пониженому тиску одержуючи вказану в заголовку сполуку, 936г, вихід 59%. Рідину випарювали при пониженому тиску до загального об'єму 1,5л і одержаний коричневий розчин охолоджували до 10°С одержуючи суспензію. Білу тверду речовину відфільтровували і сушили в печі при пониженому тиску одержуючи другий частину вказаної в заголовку сполуки, 144г, 9%. Загальний вихід: 1080г, 68%. приготування 24 8-Бензил-3-(3-ізопропіл-5-метил-4Н-1,2,4-триазол-4-іл)-екзо-8-азабіцикло[3.2.1]октан У зафіксований реактор завантажували дихлорметан (7л) і РСІ5 (719г, 3,45моль). Одержану суспензію охолоджували до 0°С. Протягом 30 хвилин підтримуючи температуру нижче 10°С додавали розчин вказаної в заголовку Приготування 7 сполуки (760г, 2,66моль) в дихлорметані (2,5л). Одержаний розчин перемішували при температурі від 0°С до кімнатної температури протягом 2 годин. Одержаний блідо-жовтий розчин охолоджували до 0°С. Повільно підтримуючи температуру нижче 10°С додавали розчин оцтового гідразиду (315г, 4,27моль) в 2-метил-2-бутанолі (пр. 1,5л) (одержали розчиненням оцтового гідразиду в ацетонітрилі (1л) і 2-метил-2-бутанолу (2л) і відгонкою ацетонітрилу і 500мл 2-метил-2-бутанолу). Одержаний розчин перемішували при кімнатній температурі протягом 15 годин. Визначали завершення реакції за допомогою ВЕРХ аналізу через 30 хвилин після її початку, але залишали ще на всяк випадок. Суміш охолоджували до 0°С і додавали 2М водний розчин гідроксиду натрію (7,5л) підтримуючи температуру нижче 20°С. Водний шар доводили до pH 9 використовуючи 10М водний розчин гідроксиду натрію (пр. 0,5л). Шари розділяли і водний шар промивали дихлорметаном (1л). Об'єднані органічні шари випарювали при пониженому тиску одержуючи концентрат 2-метил-2-бутанолу (пр. 2,5л). Додавали етилацетат (1,5л) і оцтову кислоту (200мл). Одержаний розчин нагрівали при 80°С протягом 30 хвилин. Розчин охолоджували до кімнатної температури протягом ночі. Розчин охолоджували до 0°С і суміш підлуговували до pH 12 2М водним розчином гідроксиду натрію (2л). Шари розділяли і водний шар промивали етилацетатом (1л). Об'єднані органічні шари концентрували до пр. 2л при пониженому тиску і додавали гептан (2л) і суміш випарювали до пр. 3л при пониженому тиску. Додавали гептан (1,5л) і етилацетат (300мл) і суміш нагрівали із зворотнім холодильником. Розчин охолоджували до 20°С протягом 1 години і до 0°С протягом 2 годин. Білу тверду речовину, що утворилась, відфільтровували і сушили в печі при пониженому тиску при 40° протягом ночі одержуючи вказану в заголовку сполуку, 622г, вихід 72%. Приготування 25 пара-Толуолсульфонова сіль 3-(3-ізопропіл-5-метил-4Н-1,2,4-триазол-4-іл)-екзо-8-азабіцикло[3.2.1]октану Вказану в заголовку Приготування 8 сполуку (600г, 1,85моль) і моногідрат пара-толуолсульфонової кислоти (351г, 1,85моль) розчиняли в метанолі (3л). Додавали 10% ваг/ваг паладій на вугіллі (60г). Суміш перемішували в атмосфері водню при 345кПа (50псі) і кімнатній температурі протягом 12 годин. Відбирали зразок і ВЕРХ аналіз показав, що реакція завершилась. Реакційну суміш фільтрували крізь Арбоцель™ (фільтруючий матеріал) і залишок промивали метанолом (500мл). Метанол випарювали при пониженому тиску і одержане коричневе масло розчиняли в гарячому ізопропіловому спирті (1,8л). Розчин залишали для гранулювання при кімнатній температурі на 12 годин і потім при 0°С на 2 години. Білу тверду речовину відфільтровували і сушили у вакуумній печі протягом 12 годин одержуючи вказану в заголовку сполуку, 623г, вихід 83%. Біологічна активність Сполуки Прикладів 1-5 було тестовано використовуючи дослідження по зв'язуванню CCR5, що було описане Combadiere et al., J. Leukoc. Biol. 60, 147-52 (1996) (згадувалось вище). Було встановлено, що всі протестовані сполуки мають значення ІС50 менше ніж 10нМ. Додаток 1 Дані ДРВП для поліморфів Форми А і Форми Б виділених в Прикладах 4 і 6 N-{(1S)-3-[3-(3-ізопропіл-5-метил-4Н-1,2,4-триазол-4-іл)-екзо-8-азабіцикло[3.2.1]окт-8-ил]-1-фенілпропіл}4,4-дифторциклогексанкарбоксамід, одержали за методиками Прикладів 4 і 6, і було встановлено, що він існує в 2 поліморфних формах позначених Форма А і Форма Б. ДРВП (Дифракція рентгенівського випромінювання на порошку) аналіз моделювання включає d-відстань і відносна інтенсивність розраховано на окремій кристалічній структурі використовуючи Cerius2 Diffraction-Crystal Module. Параметри модулювання були наступні: Довжина хвилі = 1,54178 Å. Фактор пояризації = 0,5 Розміри кристалу = 500х500х500 Å Лоренцева форма піків Основні піки (в градусах 2-тета) одержані в ДРВП рентгенограмі приведені в наступних таблицях. Середньому спеціалісту в цій галузі повинно бути зрозуміло, що відносна інтенсивність різних піків приведених в таблицях може змінюватись, що залежить від ряду факторів, включаючи, орієнтаційні ефекти кристалів в рентгенівському промені, чистота зразка, що досліджується, або ступінь кристалічності зразка, розташування піку буде залишатись таким, як вказано в таблицях. Спеціаліст в цій галузі повинен також розуміти, що вимірювання з використанням рентгенівське випромінювання з різними довжинами хвиль буде давати різні зсуви позицій піків відносно рівняння Брагга. Такі ДРВП рентгенограми одержують використовуючи різні довжини хвиль розглядаються як альтернатива представленим ДРВП рентгенограм кристалічних матеріалів представленого винаходу і таким чином підпадають під рамки цього винаходу. Перелік піків Форми А Кут 2-тета 7,926 8,350 9,497 10,743 10,852 11,652 13,457 13,705 14,116 14,249 15,194 15,959 16,536 16,658 17,125 17,637 Інтенсивність % 12,8 100,0 18,6 9,2 12,6 20,3 29,4 26,7 25,8 50,5 6,7 14,5 33,4 21,0 22,7 36,9 Кут 2-тета 18,081 18,410 18,866 20,052 20,368 20,675 21,301 21,998 22,439 22,724 23,268 23,718 23,903 24,051 25,003 25,280 Інтенсивність % 87,7 26,1 24,6 14,1 37,9 7,8 5,2 45,4 57,0 12,9 16,9 10,2 8,3 6,2 11,2 7,0 Кут 2-тета 25,420 27,152 27,689 27,827 28,492 28,788 29,562 30,018 30,390 30,638 31,262 31,454 32,280 33,052 33,315 33,680 Інтенсивність % 7,4 18,7 13,0 10,2 3,2 5,2 8,6 6,6 9,5 6,9 5,1 4,6 5,2 2,9 3,6 4,2 Кут 2-тета 34,133 35,210 35,712 36,363 36,584 37,112 37,552 38,777 40,755 41,480 42,142 42,916 43,888 44,260 44,779 Інтенсивність % 2,9 2,8 2,3 3,7 3,3 6,6 4,5 3,8 4,1 4,6 4,4 2,7 4,8 5,0 4,8 Кут 2-тета 20,712 21,697 22,406 23,037 23,138 23,826 23,983 24,484 24,691 25,181 25,358 25,928 26,390 Інтенсивність % 13,1 8,5 23,8 27,3 27,5 4,4 4,1 5,3 6,4 10,3 8,7 10,6 7,2 Кут 2-тета 29,009 29,588 30,137 30,373 30,726 31,338 31,824 32,351 33,105 33,470 33,685 34,032 34,447 Інтенсивність % 9,6 3,2 6,6 6,3 9,2 8,9 14,2 4,5 2,4 2,5 2,5 6,7 2,5 Кут 2-тета 36,634 36,986 37,635 38,255 38,442 39,064 39,39139,792 40,540 40,985 42,126 42,397 42,983 Інтенсивність % 8,0 4,0 2,9 4,5 4,8 5,1 3,4 3,9 2,1 6,5 3,7 4,3 2,5 Перелік піків Форми Б Кут 2-тета 7,622 9,561 9,992 11,194 11,528 12,619 14,156 15,052 15,28 16,041 16,371 17,070 17,360 Інтенсивність % 1,4 5,0 43,3 47,6 24,0 47,9 44,8 51,2 27,0 64,8 40,6 36,1 78,0 18,046 18,946 19,202 20,088 66,6 23,9 16,1 100,0 26,696 27,301 27,864 28,498 13,2 3,5 5,1 10,8 35,131 35,643 35,812 36,239 9,0 3,9 4,0 4,0 43,328 44,219 44,690 3,4 3,6 5,5
ДивитисяДодаткова інформація
Назва патенту англійськоюTropan derivatives useful in therapy, method for obtaining thereof and intermediate compounds
Автори англійськоюPrice David Anthony, Wood Anthony
Назва патенту російськоюПроизводные тропана, полезные в терапии, способ их получения и промежуточные соединения
Автори російськоюПрайс Девид Энтони, Вуд Энтони
МПК / Мітки
МПК: C07B 53/00, A61P 13/12, A61P 15/00, A61P 37/06, C07D 451/04, A61P 31/18, C07C 233/60, A61P 27/16, A61P 37/00, A61P 11/00, A61P 1/18, A61K 31/46, A61P 11/06, A61P 1/04, A61P 29/00, C07B 61/00, A61P 43/00, A61P 1/12, A61P 25/28, A61P 11/08, A61P 9/04, A61P 25/00, C07C 233/61, A61K 31/4196, A61P 3/10, C07C 233/63
Мітки: похідні, одержання, проміжні, сполуки, корисні, терапії, спосіб, тропану
Код посилання
<a href="https://ua.patents.su/21-73170-pokhidni-tropanu-korisni-v-terapi-sposib-kh-oderzhannya-ta-promizhni-spoluki.html" target="_blank" rel="follow" title="База патентів України">Похідні тропану, корисні в терапії, спосіб їх одержання та проміжні сполуки</a>
Попередній патент: Контейнер для зберігання щонайменше однієї гіподермічної голки
Наступний патент: Пристрій для вивантаження пилу із сухого пилозбірника доменної печі
Випадковий патент: Барабан для намотки гнучких довгомірних виробів












