Способи великомасштабного виробництва з рекомбінантної днк молекул tpa або k2s
Номер патенту: 75102
Опубліковано: 15.03.2006
Автори: Тайапіватана Чатчай, Маносрой Джирадей, Маносрой Аран'я, Вернер Рольф-Гюнтер, Гьотц Фрідріх
Формула / Реферат
1. Спосіб одержання з рекомбінантної ДНК тканинного активатора плазміногена (tPA), варіанта tPA, молекули, яка несе домен kringle 2 і серинпротеазу (K2S), або варіанта K2S у прокаріотичних клітинах, де tPA, варіант tPA, молекула K2S або варіант K2S секретується позаклітинно у вигляді активного протеїну з правильною складчастістю, який відрізняється тим, що прокаріотична клітина містить і експресує вектор, який включає ДНК, яка кодує tPA, варіант tPA, молекулу K2S або варіант K2S, функціонально зв'язану з ДНК, яка кодує сигнальний пептид OmpA.
2. Спосіб за п. 1, який відрізняється тим, що прокаріотична клітина містить і експресує вектор, який включає ДНК, яка кодує tPA, варіант tPA, молекулу K2S або варіант K2S, функціонально зв'язану з ДНК, яка кодує сигнальний пептид ОmpА, функціонально зв'язаний з молекулою нуклеїнової кислоти, яка має послідовність
,
або її функціонально активним похідним.
3. Спосіб за п. 1 або 2, який відрізняється тим, що прокаріотична клітина являє собою Е. colі.
4. Спосіб за будь-яким з пп. 1-3, який відрізняється тим, що здійснюють наступні стадії:
а) ампліфікують за допомогою ПЛР ДНК, яка кодує tPA, варіант tPA, молекулу K2S або варіант K2S;
б) очищають ПЛР-продукт;
в) вбудовують зазначений ПЛР-продукт у вектор, який включає ДНК, яка кодує сигнальний пептид ОmpА, і ДНК, яка кодує gpIII, таким чином, щоб ПЛР-продукт у цьому векторі був функціонально зв'язаний проти ходу транскрипції з ДНК, яка кодує сигнальну послідовність ОmpА, і зв'язаний по ходу транскрипції з ДНК, яка кодує gpIII;
г) вбудовують стоп-кодон між tPA, варіантом tPA, молекулою K2S або варіантом K2S і gpIII;
д) експресують вектор за допомогою прокаріотичної клітини;
е) очищають tPA, варіант tPA, молекулу K2S або варіант K2S.
5. Спосіб за будь-яким з пп. 1-4, який відрізняється тим, що вектор являє собою фагмідний вектор, який включає ДНК, яка кодує сигнальний пептид ОmpА, і ДНК, яка кодує gpIII.
6. Спосіб за будь-яким з пп. 1-5, який відрізняється тим, що вектор являє собою фагмідний вектор pComb3HSS.
7. Спосіб за будь-яким з пп. 1-6, який відрізняється тим, що послідовність ДНК OmpA, яка пов'язана проти ходу транскрипції з K2S, включає наступну послідовність або її варіант, отриманий внаслідок виродженості нуклеотидного коду:
8. Спосіб за будь-яким з пп. 1-7, який відрізняється тим, що послідовність ДНК OmpA включає наступну послідовність:
9. Спосіб за будь-яким з пп. 1-8, який відрізняється тим, що послідовність ДНК OmpA містить наступну послідовність:
10. Спосіб за будь-яким з пп. 1-9, який відрізняється тим, що перед ДНК, яка кодує tPA, варіант tPA, молекулу K2S або варіант K2S, розташований промотор lac та/або сайт зв'язування рибосоми.
11. Спосіб за будь-яким з пп. 1-10, який відрізняється тим, що ДНК, яка кодує tPA, варіант tPA, молекулу K2S або варіант K2S, вибирають із групи, яка включає молекули ДНК, які кодують щонайменше 90 % амінокислот 87-527, 174-527, 180-527 або 220-527 протеїну людського тканинного активатора плазміногена.
12. Спосіб за будь-яким з пп. 5-11, який відрізняється тим, що послідовність ДНК K2S включає наступну послідовність або її варіант, отриманий внаслідок виродженості нуклеотидного коду:
13. Спосіб за будь-яким з пп. 5-12, який відрізняється тим, що послідовність ДНК K2S містить наступну послідовність:
Текст
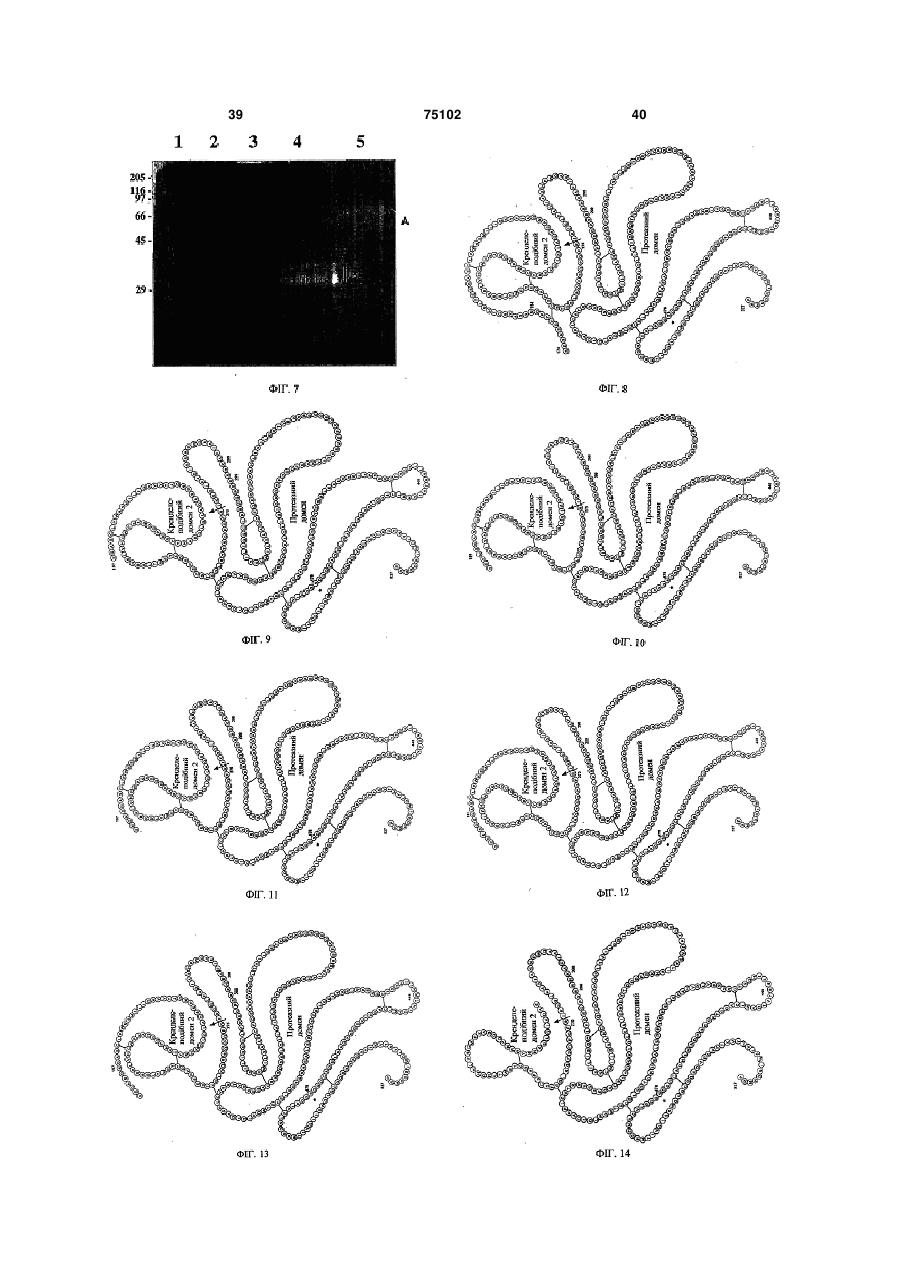
1. Спосіб одержання з рекомбінантної ДНК тканинного активатора плазміногена (tPA), варіанта tPA, молекули, яка несе домен kringle 2 і серинпротеазу (K2S), або варіанта K2S у прокаріотичних клітинах, де tPA, варіант tPA, молекула K2S або варіант K2S секретується позаклітинно у вигляді активного протеїну з правильною складчастістю, який відрізняється тим, що прокаріотична клітина містить і експресує вектор, який включає ДНК, яка кодує tPA, варіант tPA, молекулу K2S або варіант K2S, функціонально зв'язану з ДНК, яка кодує сигнальний пептид OmpA. 2. Спосіб за п.1, який відрізняється тим, що прокаріотична клітина містить і експресує вектор, який включає ДНК, яка кодує tPA, варіант tPA, молекулу K2S або варіант K2S, функціонально зв'язану з ДНК, яка кодує сигнальний пептид ОmpА, функціонально зв'язаний з молекулою нуклеїнової кислоти, яка має послідовність 2 (19) 1 8. Спосіб за будь-яким з пп.1-7, який відрізняється тим, що послідовність ДНК OmpA включає наступну послідовність: 3 75102 4 9. Спосіб за будь-яким з пп.1-8, який відрізняється тим, що послідовність ДНК OmpA містить наступну послідовність: 10. Спосіб за будь-яким з пп.1-9, який відрізняється тим, що перед ДНК, яка кодує tPA, варіант tPA, молекулу K2S або варіант K2S, розташований промотор lac та/або сайт зв'язування рибосоми. 11. Спосіб за будь-яким з пп.1-10, який відрізняється тим, що ДНК, яка кодує tPA, варіант tPA, молекулу K2S або варіант K2S, вибирають із групи, яка включає молекули ДНК, які кодують щонайменше 90 % амінокислот 87-527, 174-527, 180527 або 220-527 протеїну людського тканинного активатора плазміногена. 12. Спосіб за будь-яким з пп.5-11, який відрізняється тим, що послідовність ДНК K2S включає наступну послідовність або її варіант, отриманий внаслідок виродженості нуклеотидного коду: Винахід відноситься до тромболізу й одержання похідного тканинного активатора плазміногену (tPA) у прокаріотичних клітинах. Винахід відноситься до способів одержання виведених з рекомбінантної ДНК тканинного активатора плазміногену (tPA), його варіанта, молекули K2S (яка несе «кренделеподібний» домен 2 і серіновий домен) (K2S) або її варіанта у прокаріотичних клітинах, де tPA або K2S або варіант секретуються позаклітинно у вигляді активного протеїну з правильною складчастістю, і до прокаріотичної клітини, яка містить і експресує вектор, який несе ДНК, яка кодує tPA або K2S або варіант, яка функціонально зв'язана із ДНК, яка кодує сигнальний пептид ОmрА. Винахід відноситься також до специфічних похідних K2S, які можна одержувати зазначеним способом. Крім того, винахід відноситься до молекул ДНК і до застосування цих молекул ДНК відповідно до зазначених способів. Тканинний активатор плазміногену (tPA) являє собою поліпептид, який містить 527 амінокислотних залишків (27), молекулярна маса якого складає 72кДа. Молекула містить 5 структурних доменів. Поблизу N-кінцевої області розташований «пальцеподібний» («finger») домен, який утворює петлю, за яким розташований домен фактора росту. За ними знаходяться два аналогічних домени «кренделеподібний» домен 1 («kringle 1») і «кренделеподібний» домен 2 («kringle 2»). Як «пальцеподібний» домен, так і «кренделеподібний» домен 13. Спосіб за будь-яким з пп.5-12, який відрізняється тим, що послідовність ДНК K2S містить наступну послідовність: 2, специфічно зв'язуються з фібриновими згустками, підсилюючи тим самим активацію зв'язаного плазміногену протеїном tPA. Далі по ходу транскрипції відносно «кренделеподібного» домену 2 розташована серінова протеаза, каталітичний сайт якої локалізований на С-кінці. Серінова протеаза відповідальна за перетворення плазміногену в плазмін, тобто за реакцію, яка відіграє важливу роль у гомеостазі утворення фібрину та розсмоктуванні згустку. Для правильної складчастості tPA необхідно правильне спарювання 17 дисульфідних містків у молекулі (1). У клінічних умовах tPA використовують у якості тромболітичного агента для лікування гострого інфаркту міокарда, легеневої емболії, «удару», периферичних артеріальних оклюзій та інших тромбоемболічних захворювань. Його перевагою є відсутність побічних впливів, пов'язаних із системною кровотечею і виснаженням фібриногену (7). Спочатку для одержання tPA у терапевтичних цілях використовували клітини бичачої меланоми (12). Оскільки для клінічних цілей необхідно мати стабільний процес, який забезпечує ефективне одержання високоочищеного протеїну з достатнім виходом, була створена повнорозмірна рекомбінантна молекула tPA (r-tPA), яка експресується у клітинах ссавців. Клітини яєчника китайського хом'ячка трансфектували геном tPA для 8 синтезу rtPA (8, 22). Виведений з рекомбінантної ДНК продукт, отриманий за допомогою ферментаційної системи з використанням культур клітин ссавців, 5 75102 6 збирали та очищали від культурального середоприродних умовах, з неправильною складчастістю вища. Приймаючи в увагу простоту та економічне можна застосовувати для терапевтичних цілей. ність виробництва, були початі численні спроби Вона не має ферментативної активності у відноодержання r-tPA з мікроорганізмів, насамперед з шенні зв'язування фібрину / протеазної активності. бактерій, і більш переважно з Escherichia coli (10, Послідовність, яка не зустрічається в природних 13, 30). Для рішення проблем, пов'язаних з низьумовах може навіть активувати людську імунну ким виходом і утворенням внутрішньоклітинних систему. тілець, що привело до неправильної складчастості Таким чином, в основу даного винаходу була та інактивації ферменту, був запропонований ціпокладена задача розробити прийнятний з комерлий ряд стратегій. ційної точки зору спосіб великомасштабного вироБуло запропоновано кілька варіантів деляційбництва молекул tPA та їхніх похідних, наприклад, них мутантів, які містять «кренделеподібний» доK2S, який передбачає секрецію молекули K2S у мен 2 і серінову протеазу (K2S). Однак прояв фебіологічно активній формі в супернатант культури. рментативної активності рекомбінантної молекули Шляхи вирішення поставленої задачі предстаK2S (r-K2S) досягався тільки після процесів повтовлені у формулі та описі даного винаходу. рного утворення складчастості виділених з цитоВинахід не обмежений застосуванням одного плазматичного компартменту внутрішньоклітинних або декількох пунктів формули винаходу або опитілець (16, 29). Для того, щоб уникнути складності су, а включає також їхні модифікації. Винахід відпроцесів повторного утворення складчастості, заноситься до способу одержання виведених з ребруднення протеїнами з неправильною складчаскомбінантної ДНК тканинного активатора тістю і переносу протеїнів у периплазму, застосоплазміногену (tPA), варіанта tPA, молекули, яка вували спеціальні бактеріальні системи експресії містить «кренделеподібний» домен 2 і домен сері(6, 31). Незважаючи на периплазматичну експренової протеази (K2S), або варіанта K2S у прокарісію tPA, понадекспресія приводила до одержання отичних клітинах, де tPA, варіант tPA, молекула неактивних агрегатів навіть в умовах відносно виK2S або варіант K2S секретуються позаклітинно у сокого окислювання у периплазмі. вигляді активного протеїну з правильною складчаЗ прототипів відомо кілька описів методів одестістю, і прокаріотична клітина містить і експресує ржання рекомбінантної молекули K2S у Е. coli. вектор, який несе ДНК, яка кодує tPA, варіант tPA, Однак відсутній опис методу, який забезпечує молекулу K2S або варіант K2S, функціонально ефективне з погляду вартості великомасштабне зв'язану з ДНК, яка кодує сигнальний пептид виробництво біологічно активної молекули K2S. ОmрА або його функціонально активне похідне. У Obukowicz зі співавторами (25) запропоноПри створенні винаходу раптово було встанований метод експресії та очищення r-K2S з перипвлено, що сигнальний пептид ОmрА індивідуально лазматичного простору. Очевидним недоліком та/або в сполученні з N-кінцевими амінокислотами цього методу є додаткова стадія екстракції з периSEGN (SEQ ID N0:9)/SEGNSD (SEQ ID N0:10) пеплазми, непридатна для великомасштабного виреносить виведені з рекомбінантної ДНК tPA, варіробництва. ант tPA, молекулу K2S або варіант K2S до зовнішУ Saito зі співавторами (29) описана експресія ньої поверхні і полегшує вивільнення r-K2S у цитоплазмі. Для експресії молекули r-K2S, функціональної та активної молекули в культураяку виділяли з цитоплазматичного простору Е. coli льне середовище в більшому ступені, чим це доу вигляді внутрішньоклітинного тільця, автори висягається при використанні будь-якого іншого вікористовували процеси ренатурації in vivo. Дослідомого з існуючого рівня техніки методу. дники фірми Boehringer Mannheim застосовували Відповідно до способу згідно із винаходом перед аналогічний складний процес денатураперетинанням зовнішньої мембрани виведений з ції/повторного утворення складчастості, який рекомбінантної ДНК протеїн набуває правильної включає стадії розщеплення клітин, солюбілізації у складчастості. Сигнальний пептид відщеплюється і денатурувальних та відновлювальних умовах, і утворює зрілу молекулу. Раптово було встановлереактивації в окислювальних умовах у присутності но, що ефективність видалення сигнального пепGSH/GSSG (відновлений глутатіон/окислений глутиду є дуже високою і приводить до правильної татіон), який є не ефективним з погляду вартості складчастості виведеного з рекомбінантної ДНК (24) і для якого необхідна мутація амінокислотної протеїну. послідовності, що може супроводжуватися появою Сигнальний пептид ОmрА взаємодіє з SecE і антигенних властивостей. його перенос через внутрішню мембрану здійснюУ 1991p. Waldenstrom зі співавторами (34) скоється за допомогою енергії, яка генерується SecA нструювали вектор (pEZZK2P) для секреції конспри зв'язуванні з компонентами Sec (SecE-SecY). трукції «кренделеподібного» домену 2 плюс домен SecY утворює пори для секреції, призначені для серінової протеази в супернатант культури Е. соlі. переносу виведеного з рекомбінантної ДНК протеДля видалення злитого протеїну ZZ з очищеної за їну відповідно до винаходу. Простір між зовнішдопомогою IgG-Сефарози фракції використовуваньою мембраною і внутрішньою мембраною грамли гідроксиламін. Для агента, що розщеплює, гіднегативних бактерій, тобто периплазма, має більш рокисламіну необхідна модифікація сайтів розщевисокі окисні умови в порівнянні з цитоплазматичплення конструкції «кренделеподібний» домен 2 ним простором. Це сприяє утворенню дисульфідних містків і правильній складчастості виведеного плюс серінова протеаза (Asn177 Ser та з рекомбінантної ДНК протеїну (наприклад, K2S) у Asn184 Gin), яка забезпечує захист її від розщеппериплазмі, що приводить до одержання активної лення гідроксиламіном. Однак отриману в резульмолекули. Згідно із представленим винаходом таті цього молекулу K2S, яка не зустрічається в 7 75102 8 сигнальний пептид повинний відщеплюватися з активним похідним. утворенням зрілої молекули. Комплекс, який вклюСпосіб згідно із винаходом передбачає засточає секретин GspD і ліпопротеїн GspS на зовнішсування прокаріотичних клітин-хазяїнів, таких як ній мембрані служить у якості ворітного механізму (але не обмежується ними) Escherichia соlі (E. соlі), іонного каналу для секреції виведеного з рекомбіBacillus subtilis, Streptomyces, Pseudomonas, нанантної ДНК протеїну відповідно до винаходу в приклад, Pseudomonas putida, Proteus mirabilis, позаклітинне середовище. Для цього процесу секSaccharomyces, Pichia або Staphylococcus, наприреції потрібна енергія, яка утворюється в цитоплаклад, Staphylococcus carnosus. Переважно клітиназмі за допомогою GspE протеїну, який зв'язує нукхазяїн відповідно до винаходу являє собою грамлеотид, і потім переноситься на протеїн негативну бактерію. внутрішньої мембрани (Gsp G-J, F і K-N). GspC Переважно спосіб відповідно до винаходу відпереносить енергію на GspD шляхом утворення різняється також тим, що прокаріотична клітина поперечного зв'язку між рядками протеїнів внутріявляє собою Е. соlі. Придатні штами включають шньої мембрани (Gsp G-J, F і K-N) і GspD. Перед (але не обмежуються ними) штами Е. coil XL-1 успішним перетинанням зовнішньої мембрани виblue, BL21(DE3), JM109, DH-серії, ТОРЮ та НВ101. ведений з рекомбінантної ДНК протеїн набуває Переважно спосіб відповідно до винаходу відправильної складчастості. різняється також тим, що здійснюють наступні стаВідповідно до винаходу поняття «функціонадії: льно зв'язаний» означає, що ДНК, яка кодує tPA, а) ампліфікують за допомогою ПЛР ДНК, яка варіант tPA, молекулу K2S або варіант K2S (яка кодує tPA, варіант tPA, молекулу K2S або варіант переважно містить нуклеїнову кислоту, яка кодує K2S; SEGN або SEGNSD на N-кінці), клонують у векторі б) очищають ПЛР-продукт; в безпосередній близькості з ДНК OmpA для досяв) вбудовують зазначений ПЛР-продукт у векгнення експресії злитого протеїну OmpA і tPA, ватор, який містить ДНК, яка кодує сигнальний пепріанта tPA, молекули K2S або варіанта K2Sn і для тид ОmрА, і ДНК, яка кодує gpIII, таким чином, щоб напрямку секреції назовні з прокаріотичної клітиПЛР-продукт у цьому векторі був функціонально ни-хазяїна. Як правило, секретується велика часзв'язаний проти ходу транскрипції з ДНК, яка кодує тина tPA, варіантів tPA, молекул K2S або варіантів сигнальну послідовність ОmрА, і зв'язаний по ходу K2S, і їх можна потім очищати за допомогою притранскрипції з ДНК, яка кодує gpIII; йнятних методів, таких як осадження сульфатом г) вбудовують стоп-кодон між tPA, варіантом амонію та/або афінною хроматографією, та за tPA, молекулою K2S або варіантом K2S і gpIII; допомогою додаткових стадій очищення. Під обсяг д) експресують вектор за допомогою прокаріовинаходу підпадає також застосування індукторів, тичної клітини; таких як ІПТГ (ізопропілтіогалактозид) або ІПТГ у e) очищають tPA, варіант tPA, молекулу K2S поєднанні з гліцерином, поліпшення умов інкубації або варіант K2S. і періоду збору з метою максимального підвищенПри здійсненні стадії а) способу відповідно до ня кількості активного протеїну. винаходу вибір / створення праймерів є важливим Відповідно до кращого варіанта здійснення для клонування в експресійному векторі ДНК у винаходу ДНК, яка кодує сигнальний пептид правильній локалізації і напрямку (див. приклад 1). OmpA, можна зливати з коротким пептидом, який Так, праймери, яки приведені як приклад у приквідрізняється наявністю амінокислотної послідовладі 1 і на Фіг.4, є важливим об'єктом даного винаності SEGN або SEGNSD яка кодує нуклеотидні ходу. Зазначений на стадії в) gpIII, тобто ген пропослідовності TCTGAGGGAAAC(SEQ ID N0:20) теїну III, являє собою ген, який є присутнім або TCTGAGGGAAACAGTGAC (SEQ ID N0:1), і головним чином у фагмідних векторах. Стоп-кодон локалізований у N-кінцевій області або поблизу Nвбудовують для того, щоб уникнути транскрипції кінцевої області tPA, варіанта tPA, молекули K2S gpIII, що зрештою приводить до секреції tPA, варіабо варіанта K2S. Так, переважно цей злитий проанта tPA, молекули K2S або варіанта K2S які витеїн містить ОmрА-SEGNSD-tPA, -tPA-варіант, кликають інтерес. Для вбудовування стоп-кодона K2S-MoneKyna або -K2S-BapnaHT. можна застосовувати будь-який придатний метод, Ще більш переважно ці амінокислотні послідотакий як сайтнаправлений мутагенез (див., напривності, які характеризуються наявністю SEGN або клад, у Weiner MP, Costa GL (1994) PCR Methods SEGNSD, можуть мати точкову мутацію або моAppi 4(3):S131-136; Weiner MP, Costa GL, Schoettlin жуть бути замінені на амінокислоти, які не зустріW, Cline J, Mathur E, BauerJC (1994) Gene 151(1-2): чаються в природних умовах. І ще більш переваж119-123; див. також приклад 1). но між OmpA і SEGN або SEGNSD і tPA, варіантом Відповідно до винаходу можна застосовувати tPA, молекулою K2S або варіантом K2S може знабудь-який вектор, переважно вектор являє собою ходитися амінокислотний або неамінокислотний фагмідний вектор (див. нижче). спейсер. Переважно спосіб відповідно до винаходу відТаким чином, відповідно до кращого способу різняється також тим, що tPA, варіант tPA, молезгідно із винаходом прокаріотична клітина містить і кулу K2S або варіант K2S вибирають з ряду, який експресує вектор, який містить ДНК, яка кодує tPA, включає людський тканинний активатор плазміноваріант tPA, молекулу K2S або варіант K2S, функгену (tPA, Фіг.16) або його фрагмент, функціональціонально зв'язаний із ДНК, що кодує сигнальний но активний варіант, аллельний варіант, субодипептид ОmрА, функціонально зв'язаний з молекуницю, хімічне похідне, злитий протеїн або їх лою нуклеїнової кислоти, яка має послідовність глікозильовані варіанти. Такі фрагменти, алельні TCTGAGGGAAACAGTGAC, або з її функціонально варіанти, функціонально активні варіанти, варіан 9 75102 10 ти, отримані завдяки виродженості нуклеотидного Зазначена ДНК кодує приведену нижче амінокоду, злиті протеши з протеїном tPA відповідно до кислотну послідовність OmpA. Таким чином, OmpA винаходу, хімічні похідні або глікозильований варімістить або являє собою протеїн, який відрізняєтьант протеїнів tPA відповідно до винаходу можуть ся тим, що приведена нижче амінокислотна послімістити один, або кілька всіх перерахованих нижче довність MKKTAIAIAVALAGFATVAQAA (SEQ ID доменів або субодиниць або варіантів: N0:21) або її фрагмент, функціонально активний 1. «Пальцеподібний» домен (4-50) варіант, алельний варіант, субодиниця, хімічне 2. Домен фактора росту (50-87) похідне або глікозильований варіант підпадають 3. «Кренделеподібний» домен 1 (87-176) під обсяг винаходу. 4. «Кренделеподібний» домен 2 (176-262) Нетрансльована область може містити регу5. Протеазний домен (276-527) ляторний елемент, такий, наприклад, як ініціатор Нумерація/назва доменів відповідає нумератранскрипції (промотор) або енхансер. Промотор ції/назві, приведених для протеїну, який має реможе, наприклад, являти собою конститутивний, єстраційний номер Genbank GI 137119, або вони індуцибельний або контрольований стадією розвиописані в Nature 301 (5897), 214-221 (1983). тку промотор. Переважно (але не крім інших відоБільш переважно спосіб відповідно до винахомих промоторів) використовувати конститутивні ду відрізняється також тим, що 5 tPA, варіант tPA, промотори людського цитомегаловірусу (ЦМВ) і молекулу K2S або варіант K2S вибирають з ряду, вірусу саркоми Рауса (РСВ), а також мавпячого який включає «кренделеподібний» домен 2 (4.) вірусу 40 (ОВ-40) і промотор вірусу герпеса просплюс домен серінової протеази (5.), варіант K2S того. Відповідно до винаходу індуцибельні промолюдського тканинного активатора плазміногену тори являють собою промотори, яки забезпечують або його фрагмент, функціонально активний варістійкість до антибіотиків, промотори, індукуємі теант, алельний варіант, субодиницю, хімічне похідпловим шоком, індукуємий гормонами «промотор не, злитий протеїн або їхні глікозильовані вавірусу рака молочної залози» і промотор металтіоріанти. неїну. Кращі промотори включають промотор фага Більш переважно спосіб відповідно до винахоТЗ, промотор фага Т7, Lac/aral і LtetO-1. ду відрізняється також тим, що вектор являє соБільш переважно спосіб відповідно до винахобою фагмідний вектор, який містить ДНК, яка коду відрізняється також тим, що ДНК, яка кодує tPA, дує сигнальний пептид ОmрА, і ДНК, яка кодує варіант tPA, молекулу K2S або варіант K2S, поміgpIII. щають під контроль промотору lac та/або сайту Більш переважно спосіб відповідно до винахозв'язування рибосоми, такого як послідовність ду відрізняється також тим, що вектор являє соШайна-Дальгарно (див. також приклад). бою фагмідний вектор pComb3HSS (див. також Більш переважно спосіб відповідно до винахоприклад 1). ду відрізняється також тим, що ДНК, яка кодує tPA, Більш переважно спосіб відповідно до винаховаріант tPA, молекулу K2S або варіант K2S, вибиду відрізняється також тим, що послідовність ДНК рають із групи молекул ДНК, які кодують щонаймістить або являє собою приведену нижче посліменше 90% амінокислот 87-527, 174-527, 180-527 довність ДНК, яка кодує ОmрА і K2S або її функціабо 220-527 протеїну людського тканинного актионально активний варіант або варіант, отриманий ватора плазміногену. завдяки виродженості нуклеотидного коду: Більш переважно спосіб відповідно до винаходу відрізняється також тим, що послідовність ДНК K2S містить або являє собою наступну послідовність: Більш переважно спосіб відповідно до винаходу відрізняється також тим, що послідовність ДНК OmpA містить або являє собою приведену нижче послідовність або її функціонально активний варіант або варіант, отриманий завдяки виродженості нуклеотидного коду: Даний винахід відноситься також до варіантів описаних вище молекул нуклеїнових кислот, отриманим завдяки виродженості нуклеотидного коду, або до їхніх фрагментів, до нуклеїнових кислот, які гібридизуються із зазначеними нуклеїновими кис 11 75102 12 лотами в строгих умовах, до їх алельних і функцімістить N-кінцеві амінокислоти SEGN або SEGNSD онально активних варіантів. Винахід відноситься для поліпшення продуктивності та/або правильної також до нуклеїнових кислот, які містять нуклеїноскладчастості молекули. ву кислоту K2S, злиту з нуклеїнової кислотою, яка Важливо, що протеїн K2S відповідно до винакодує молекулу іншого протеїну. ходу містить на N-кінці пептид, який має амінокисСтрогі умови, як повинно бути очевидно фахілотну послідовність SEGN, яка дозволяє здійснювцям у даній галузі, являють собою умови, які довати промислове виробництво за допомогою зволяють відбирати нуклеїнові кислоти, гомологічописаного вище способу протеїну K2S, який секрені більш ніж на 85%, переважно більш ніж на 90% тується, із правильною складчастістю. Зазначені 4 [Sambrook та ін., 1989; Molecular Cloning: A амінокислоти, позначені як SEGN, можуть містити Laboratory Manual, 2-е вид., Cold Spring Harbor на N-кінці ще одну або кілька амінокислот, однак Laboratory Press, Cold Spring Harbor, New York]. зазначені амінокислоти повинні бути локалізовані Гібридизацію варто здійснювати, наприклад, у в N-кінцевій області, а не в С-кінцевій області. Більш переважно зазначені амінокислоти локалісуміші: 6 SSC/5 розчин Денхардта/0,1% ДСН зовані в N-кінцевій області. Переважно амінокис(ДСН позначає додецилсульфат натрію) при 65°С. лоти, позначені як SEGN, можуть нести точкову Ступінь строгості визначається на стадії відмиванмутацію або можуть мати заміни на амінокислоти, ня. Так, наприклад, для добору послідовностей які не зустрічається в природних умовах. ДНК, гомологія яких складає приблизно 85% або Таким чином, ще одним важливим об'єктом більше, придатні наступні умови: 0,2 SSC/0,01% винаходу є протеїн K2S, який відрізняється тим, ДСН/65°С, а для добору послідовностей ДНК, гощо він містить амінокислоти, послідовність яких мологія яких складає приблизно 90% або більше, позначена як SEGN, або його варіант або фрагпридатні наступні умови: 0,1 SSC/0,01% мент, функціонально активний варіант, алельний ДСН/65°С. Склад зазначених реагентів описаний у варіант, субодиницю, хімічне похідне, злитий проSambrook і ін. (1989, вище). теїн або їхні глікозильовані варіанти. Іншим важливим об'єктом даного винаходу є Приклади таких фрагментів, яки простираютьваріант людського тканинного активатора плазміся від амінокислоти 193 до амінокислоти 527 приногену, який містить або представляє собою проведені, наприклад, на Фіг.10 (структура Б-1) і на теїн: «кренделеподібний» домен 2 (4.) плюс серіФіг.11 (структура Б-2). У структурі Б-1 присутня нова протеаза (5.) (скорочено K2S) або його нативна амінокислота Cys у положенні 261, а в варіант або фрагмент, функціонально активний структурі Б-2 ця амінокислота замінена Ser. Інші варіант, алельний варіант, субодиницю, хімічне фрагменти відповідно до винаходу, яки включають похідне або їх глікозильовані варіанти. амінокислоти 220-527 (Фіг.14, структура В) або Нумерація/назва доменів відповідає нумераамінокислоти 260-527 (Фіг.15, структура Г), можна ції/назві, приведеним для протеїну, який має ремодифікувати відповідно до винаходу шляхом доєстраційний номер Genbank GI 137119, або вони давання амінокислот SEGN та/або заміни Cys-261 описані у Nature 301 (5897), 214-221 (1983), прина Ser. Фахівець у даній галузі може визначити чому «кренделеподібний» домен 2 простирається мінімальну довжину молекули K2S відповідно до від амінокислоти 176 до 262, а протеазний домен винаходу, необхідну для збереження її біологічної від амінокислоти 276 до 527. Таким чином, відпофункції, і одержати молекулу K2S, яка володіє відно до винаходу краща молекула K2S може міспідвищеною продуктивністю та/або правильною тити амінокислоти 176-527, включаючи амінокисскладчастістю, шляхом додавання амінокислот лоти між «кренделеподібним» доменом 2 і SEGN у N-кінцеву область. Таким чином, ще оддоменом протеази (амінокислоти 263-275; див. ним кращим варіантом здійснення винаходу є заприклад, приведений на кресленні (структура А)). значена мінімальна за розміром молекула K2S, Молекула K2S відповідно до винаходу містить міяка несе SEGN у N-кінцевій області. німальний фрагмент «кренделеподібного» домену Наступним важливим об'єктом винаходу є 2 і домен протеази, який ще зберігає протеазну протеїн K2S, який відрізняється тим, що він місактивність і активність у відношенні зв'язування з тить амінокислоти, послідовність яких позначена фібрином (зазначені активності оцінювали, наприяк SEGNSD, або його варіант або фрагмент, функлад, відповідно до методів, приведених в опикціонально активний варіант, алельний варіант, сі/прикладах). Молекула K2S відповідно до винасубодиницю, хімічне похідне, злитий протеїн або ходу містить амінокислоти SEGN або SEGNSD на їхні глікозильовані варіанти. Приклади таких фраN-кінці (див. вище). Краща молекула А не містить гментів, яки простираються від амінокислоти 191 амінокислоти 1-3 або 1-5 молекули tPA. Переваждо амінокислоти 527 приведені, наприклад, на но молекула K2S відповідно до винаходу містить Фіг.12 (структура Б-3) і на Фіг.13 (структура Б-4). У амінокислоту Asn у положеннях 177 і 184, тобто не структурі Б-3 присутня нативна амінокислота Cys у вимагаються описані в Waldenstrom модифікації положенні 261, а в структурі Б-4 ця амінокислота для поліпшення продуктивності відповідно до спозамінена Ser. Інші фрагменти відповідно до винасобу згідно із винаходом. Таким чином, краща моходу, яки включають амінокислоти 220-527 (Фіг.14, лекула K2S відповідно до винаходу має нативну структура В) або амінокислоти 260-527 (Фіг.15, амінокислотну послідовність (без мутації) на відміструктура Г), можна модифікувати відповідно до ну від відомих із прототипів молекул. Найбільш винаходу шляхом додавання амінокислот краща молекула K2S відповідно до винаходу явSEGNSD та/або заміни Cys-261 на Ser. Фахівець у ляє собою молекулу, яка відрізняється наявністю даній галузі може визначити мінімальну довжину нативної амінокислотної послідовності або її фрамолекули K2S відповідно до винаходу, необхідну гмента, не містить ні амінокислот 1-3, ні 1-5 tPA і 13 75102 14 для збереження її біологічної функції, і одержати молекулу K2S, яка володіє підвищеною продуктивністю та/або правильною складчастістю, шляхом додавання амінокислот SEGNSD у N-кінцеву область. Таким чином, ще одним кращим варіантом здійснення винаходу є зазначена мінімальна за розміром молекула K2S, яка несе SEGNSD у Nкінцевій області. Ще одним кращим варіантом здійснення даного винаходу є протеїн K2S, який містить протеїн, Зазначена молекула ДНК кодує наступний який відрізняється наявністю наступної амінокисзлитий протеїн ОmрА і K2S. Цей злитий протеїн лотної послідовності або її варіанта або фрагменОmрА і K2S, який відрізняється тим, що він містить та, функціонально активного варіанта, алельного або являє собою протеїн, який має приведену ниваріанта, субодиниці, хімічного похідного або гліжче амінокислотну послідовність або його фрагкозильованого варіанта: мент, функціонально активний варіант, алельний варіант, субодиницю, хімічне похідне або їхні глікозильовані варіанти, є важливим об'єктом даного винаходу: У даному описі зірочкою (*) позначений STOP (тобто амінокислота, яка кодується стоп-кодоном). Приклад такої молекули K2S приведений на Фіг.8. Одним з варіантів молекули K2S відповідно до винаходу є злитий протеїн K2S, який злитий з молекулою іншого протеїну. Наступним кращим варіантом здійснення даного винаходу є протеїн K2S, який представляє собою протеїн, який має наступну амінокислотну послідовність: Зазначені молекули K2S можуть кодуватися описаною вище молекулою ДНК. Ще одним важливим об'єктом винаходу є молекула ДНК, яка відрізняється тим, що вона кодує: а) протеїн ОmрА або його функціонально активне похідне, функціонально зв'язані з б) молекулою ДНК, яка кодує поліпептид, який містить «кренделеподібний» домен 2 і домен серінової протеази протеїну тканинного активатора плазміногену. Більш переважно молекула ДНК відповідно до винаходу відрізняється також тим, що послідовність ДНК містить або являє собою приведену нижче послідовність ДНК, яка кодує ОmрА і K2S, або її функціонально активний варіант або варіант, отриманий внаслідок виродженості нуклеотидного коду: Наступним переважним об'єктом винаходу є молекула ДНК відповідно до винаходу, яка відрізняється тим, що зазначена в розділі б) послідовність ДНК кодує щонайменше 90% амінокислот 87527 протеїну людського тканинного активатора плазміногену (у даному описі використана нумерація, запропонована для GI 137119 або описана в Nature 301 (5897), 214-221 (1983)). Ще одним кращим об'єктом винаходу є молекула ДНК відповідно до винаходу, яка відрізняється тим, що зазначена в розділі б) послідовність ДНК кодує щонайменше 90% амінокислот 174-527 протеїну людського тканинного активатора плазміногену. Наступним кращим об'єктом винаходу є молекула ДНК відповідно до винаходу, яка відрізняється тим, що зазначена в розділі б) послідовність ДНК кодує щонайменше 90% амінокислот 180-527 протеїну людського тканинного активатора плазміногену. Ще одним кращим об'єктом винаходу є молекула ДНК відповідно до винаходу, яка відрізняється тим, що зазначена в розділі б) послідовність ДНК кодує щонайменше 90% амінокислот 220-527 протешу людського тканинного активатора плазміногену. Наступним кращим об'єктом винаходу є молекула ДНК відповідно до винаходу, яка відрізняється тим, що зазначена в розділі а) послідовність ДНК гібридизується у строгих умовах з наступною послідовністю: Ще одним кращим об'єктом винаходу є молекула ДНК відповідно до винаходу, яка відрізняється тим, що зазначена в розділі а) послідовність ДНК має наступну послідовність: Наступним кращим об'єктом винаходу є молекула ДНК відповідно до винаходу, яка відрізняєть 15 75102 16 ся тим, що зазначена в розділі б) послідовність мен 2 і домен серінової протеази протеїну тканинДНК гібридизується у строгих умовах з наступною ного активатора плазміногену, і геном протеїну III. послідовністю: Наступним важливим об'єктом даного винаходу є прокаріотична клітина-хазяїн, яка містить молекулу ДНК відповідно до винаходу. Ще одним важливим об'єктом даного винаходу є прокаріотична клітина-хазяїн, яка містить вектор відповідно до винаходу. Наступним важливим об'єктом даного винаходу є клітина-хазяїн Е. соlі, яка містить молекулу ДНК відповідно до винаходу. Ще одним важливим об'єктом даного винаходу є клітина-хазяїн Е. соlі, яка містить вектор відповідно до винаходу. І ще одним важливим об'єктом даного винаходу є застосування молекули ДНК відповідно до винаходу або вектора відповідно до винаходу або клітини-хазяїна відповідно до винаходу відповідно до методу одержання поліпептиду, який володіє активністю тканинного активатора плазміногену. І ще одним важливим об'єктом даного винаходу є застосування відповідно до винаходу, як опиНаступним кращим об'єктом винаходу є молесано вище, де зазначений спосіб являє собою кула ДНК відповідно до винаходу, яка відрізняєтьспосіб відповідно до винаходу. ся тим, що зазначена в розділі б) послідовність Ще одним дуже важливим об'єктом є фармаДНК має наступну послідовність: цевтична композиція, яка містить субстанцію, яку одержують за допомогою способу відповідно до винаходу, і фармацевтично прийнятні ексципієнти і носії. Прикладом такої субстанції є описана вище молекула K2S. Поняття «фармацевтично прийнятний носій» у контексті даного опису відноситься до загальноприйнятих фармацевтичних ексципієнтів або добавок, які застосовують у галузі приготування фармацевтичних препаратів. Такі фізіологічно прийнятні сполуки включають, наприклад, вуглеводи, такі як глюкоза, сахароза або декстрани, антиоксиданти, такі як аскорбінова кислота або глутатіон, хелатувальні агенти, низькомолекулярні протеши або інші стабілізатори або ексципієнти (див., наприклад, також Remington's Pharmaceutical Sciences (1990, 18-е вид., вид-во Mack Publ., Easton.)). Зазначену фармацевтичну композицію відповідно до винаходу доцільно вводити внутрівенно у вигляді болюса, наприклад, у Ще одним кращим варіантом здійснення винавигляді однократного швидкого внутрішньовенного ходу є вектор, який містить послідовність ДНК відвведення великих обсягів рідини протягом 5-10с. повідно до винаходу. Винахід відноситься також до застосування Наступним кращим варіантом здійснення висубстанцій, які одержують способом відповідно до находу є вектор відповідно до винаходу, де зазнавинаходу, для приготування лікарського засобу, чена послідовність ДНК знаходиться під контропризначеного для лікування «удару», інфаркту лем промотору lac і сайту зв'язування рибосоми. серця, гострого інфаркту міокарда, легеневої емПрийнятні вектори відповідно до винаходу вклюболії, будь-якої артеріальної оклюзії, такої як чають (але не обмежуються ними) вірусні вектори, оклюзія коронарної артерії, оклюзія внутрішньочетакі, наприклад, як вірус коров'ячої віспи, вірус репної артерії (наприклад, артерій головного мозСемлікі-Фореста (Semliki-Forest) і аденовірусу, ку), оклюзія периферичних артерій, глибокий трофагмідні вектори і т.п.Кращими є вектори, яки домбоз вен, або родинних захворювань, які пов'язані цільно використовувати у Е. соlі, а також в іншому з небажаним коагулюванням крові. прокаріотичному хазяїні, такі як pPROTet.E, Нижче винахід проілюстрований на прикладах, pPROLar.A, представники сімейства pBAD, сімейсяки не обмежують його обсяг. тва pSE, сімейства pQE і pCAL. Приклад 1 Ще одним кращим варіантом здійснення винаМатеріали і методи ходу є вектор pComb3HSS, який містить ДНК відКонструювання праймерів. Для ампліфікації повідно до винаходу, де експресію протеїну gpIII визначеного фрагмента гену tPA синтезували пари пригнічують або інгібують шляхом поділу молекули праймерів SK2/174 ДНК, яка кодує протеїн gpIII, або за допомогою стоп-кодона, розташованого між геном, який кодує поліпептид, який містить «кренделеподібний» до [5GAGGAGGAGGTGGCCCAGGCGGCCTCTGAGGGAAA CAGTGAC 3'] (SEQ ID N0:22) і ASSP [5' 17 75102 18 GAGGAGGAGCTGGCCGGCCTGGCCCGGTCGCA нія) трансформували з використанням 70нг лігіруTGTTGTCACG 3'] (SEQ ID N0: 23) (фірма Life ваного або мутантного продукту. Трансформовані Technologies, Гранд Айленд, штат Нью-Йорк). Ці клітини розмножували, розподіляючи на LB-arapi, праймери конструювали на основі гену людського який містить 100мкг/мл ампіциліну і 10мкг/мл тетtPA, отриманого з бази даних 30 NCBI (gl37119). їх рацикліну (фірма Sigma, Сент Луїс, штат Міссурі). синтезували за допомогою кінцевих сайтів клонуПісля культивування при 37°С протягом 18год. вання Sfll (підкреслені) таким чином, щоб рамка відбирали з використанням методу лужного лізису зчитування, яка починається з кодона ATG гена кілька стійких до антибіотиків колоній для одерgpIII, зберігалася в послідовності, яка вбудована у жання мініпрепаратів плазмід. Кожну очищену фагмідний вектор pComb3HSS. плазміду піддавали аналізу у відношенні сайтів Конструювали інший набір праймерів для сайрестрикції Sfil. Потім плазміду, яка несе трансфотспрямованого мутагеназу, призначений для «відрмант, з правильним(ними) сайтом(ами) рестрикції палу» послідовності, розташованої між геном K2S і Sfil розмножували протягом 18год. при 37°С в геном III у pComb3H-K2S. Послідовності праймерів 100мл LB-бульйону, доповненого ампіциліном із заміненими в результаті мутації основами (підк(100мкг/мл) і тетрацикліном (10мкг/мл). реслені) з метою одержання нового стоп-кодона Максипрепарати плазмід одержували за доявляють собою MSTPA помогою набору QIAGEN Plasmid Maxi (фірма [5' ACATGCGACCGTGACAGGCCGGCCAG 3'] QIAGEN, Гільден, Німеччина). Очищену плазміду (SEQ ID N0:24) та MASTPA [5' повторно оцінювали у відношенні специфічних CTGGCCGGCCTGTCACGGTCGCATGT З'] (SEQ ID сайтів рестрикції за допомогою Sfil і секвенували з N0:25). використанням набору AmpliTaq DNA Polymerase Ампліфікація гена K2S за допомогою ПЛР. Terminator Cycle Sequencing (фірма The Perkin1мкг праймерів SK2/174 і ASSP разом з 50нг матElmer Corporation, Форстер Сіті, штат Каліфорнія). риці р51-3 (отриманої від Др. Hiroshi Sasaki, фірма Сайтспрямований мутагенез pComb3H-K2S. Fujisawa Pharmaceutical, Японія) суспендували у 10нг матриці рСоmb3Н-K2S змішували з 125нг 100мкл суміші для ПЛР. Потім до розчину додавапраймерів MSTPA і MASTPA. До суміші додавали ли 2,5од. полімерази Taq (фірма Roche Molecular 2,5од. ДНК-полімерази PfuTurbo (фірма Biochemicals, Індіанаполіс, штат Індіана). ЗдійсStratagene, Лa Джолла, штат Каліфорнія) для здійнення ампліфікації в заданих умовах ініціювали снення циклічної ампліфікації. Реакцію починали з різким початком при 85°С протягом 4хв., з наступодного циклу при 95°С протягом 30с. Потім здійсною денатурацією при 95°С протягом 50с, відпанювали 16 циклів, яки включають: 95°С протягом лом при 42°С протягом 50с, подовженням при 30с, 55°С протягом 1хв. та 68°С протягом 9хв. По72°С протягом 1,5хв. Реакцію здійснювали з викотім реакційну пробірку розміщали на льоді на 2хв. ристанням 35 циклів, яки повторювали. Суміш доДля розщеплення ланцюгів матриці в реакційну датково інкубували при 72°С протягом 10хв. Ампсуміш для ампліфікації додавали 10од. рестрикталіфікований продукт довжиною 1110 пар основ зи Dpnl (фірма Stratagene, Лa Джолла, штат Каліпотім очищували за допомогою набору QIAquick форнія) і інкубували протягом 1год. при 37°С. Цей PCR Purification (фірма QIAGEN, Гільден, Німечсинтезований продукт (MpComb3H-K2S) потім зачина). Правильність очищеного продукту підтверстосовували для трансформації штаму Е. соlі ΧΕ-1 джували за допомогою рестриктаз. Blue. Конструкція для експресії K2S у фагмідному Одержання рекомбінантної молекули K2S, яка векторі. Очищений ПЛР-продукт K2S і фагмідний виявляється за допомогою фага. Після трансфорвектор pComb3HSS (люб'язно наданий Др. Carlos мації штаму XL-1 Blue за допомогою pComb3HF. Barbas, Scripps Institute, США) розщеплювали за K2S використовували методику виявлення за додопомогою Sfil (фірма Roche Molecular помогою фага. Клон pComb3H-K2S, яким трансBiochemicals, Індіанаполіс, штат Індіана), одержуформували штам Е. соlі XL-1 Blue, розмножували ючи специфічні «липкі» сайти клонування. 4мкг в 10мл "cyпep''-бульйону, який містить ампіцилін очищеного ПЛР-продукту розщеплювали за допо(100мкг/мл) і тетрациклін (10мкг/мл), при 37°С до могою 60од. Sfil при 50°С протягом 18год. Для родосягнення оптичної щільності (ОП) [при 600нм], зщеплення pComb3HSS 20мкг фагмідних векторів яка дорівнювала 1,5. Потім бактеріальну культуру обробляли 100од. Sfil. Потім розщеплені продукти розмножували в 100мл такого ж середовища і куочищеного ПЛР-продукту K2S і pComb3HSS (-3300 льтивували протягом 2год. Для зараження транспар основ), очищали на гелі за допомогою набору формованого штаму Е. соlі XL-1 Blue використовуQIAquick Gel Extraction (фірма QIAGEN, Гільден, вали 10 БУО (бляшкоутворювальних одиниць) Німеччина). У суміш, яка містить 0,7мкг очищеного фага- хелпера VCSM13 (фірма Stratagene, Ла розщепленого за допомогою Sfil pComb3HSS і Джолла, штат Каліфорнія). Після інкубації протя0,9мкг очищеного, розщепленого за допомогою Sfil гом 3год. у культуру додавали канаміцин у кінцевій ПЛР-продукту, інтродукували 5од. лігази фага Т4 концентрації 70мкг/мл. Культуру витримували при (фірма Roche Molecular Biochemicals, Індіанаполіс, струшуванні (200об/хв.) протягом 18год. при 37°С. штат Індіана). Реакційну суміш для лігірування Потім збирали бактеріофаги, яки несуть K2S на інкубували при 30°С протягом 18год. Знову сконсgp3 (K2S-(|)), додаючи 4% (мас./об.) ПЕГ з молекутруйований фагмідний вектор позначили як лярною масою 8000 (фірма Sigma, Сент Луїс, штат pComb3H-K2S. Міссурі) і 3% (мас./об.) NaCl. І, нарешті, зібраний Трансформація штаму Е. coli XL-1 Blue. фаг ресуспендували в 2мл ЗФР, рН7,4. Кількість 200мкл СаСЧз-компетентного штаму Е. coli XL-1 фага визначали, заражаючи штам Е. соlі XL-1 Blue. Blue (фірма Stratagene, Ла Джолла, штат КаліфорКількість колонієутворювальних одиниць на один 19 75102 20 мілілітр (КУО/мл) розраховували відповідно до 15%-вого фільтруючого гелю у буфері, який відноописаного раніше методу (21). влює, з наступним електроблоттінгом на нітроцеЕкспресія отриманої рекомбінантним шляхом люлозу. Потім нітроцелюлозу блокували за допомолекули K2S у колбах, які струшуються. Трансмогою 4%-вого знятого молока протягом 2год. Для формований MpComb3H-K2S штам Е. соlі XL-1 виявлення r-K2S нітроцелюлозу обробляли відпоBlue культивували в 100мл "супер"-бульйону (3% відним чином розведеним овечим антитілом до (маc./об.) триптон, 2%(мас./об.) дріжджовий екстtPA, кон'югованим з HRP. Імунореактивну смугу ракт, 1%(мас./об.) MOPS [3-(Nвізуалізували за допомогою чуттєвої системи виморфоліно)пропансульфонова кислота]) при рН7,0 явлення, набору Amplified Opti-4CN (фірма у присутності ампіциліну (100мкг/мл) при 37°С до BIORAD, Геркулес, штат Каліфорнія). досягнення ОГ [600нм], яка дорівнює 0,8. Електрофорез у сополімеризованому із плазПотім синтез протеїну індукували за допомоміногеном поліакриламідному гелі. 11%-вий фільгою 1мМ ІПТГ (фірма Promega, Мэдисон, штат труючий поліакриламідний гель піддавали сополіВисконсин). Потім бактерії культивували при меризації з плазміногеном і желатином відповідно струшуванні (200об./хв.) протягом 6год. при 30°С. до описаного раніше методу (Heussen і ін.) (14). Супернатант культури збирали і осаджували 55%4%-вий гель, що концентрує, готували без плазмівим насиченим розчином сульфату амонію (32). ногену і желатину. Електрофорез здійснювали при Осад відновлювали за допомогою ЗФР, рН7,2 і 4°С при постійній силі струму 8мА. ДСН, який запіддавали діалізу у протитоку такого ж буферного лишився в смузі гелю, видаляли після обережного розчину при 4 градусах С протягом 18 годин. Пеструшування при кімнатній температурі протягом риплазматичні протеїни з бактеріальних клітин 1год. у 2,5%-вому Triton X-100. Потім смугу гелю екстрагували, з використанням хлороформного інкубували в 0,1Μ гліцині-NaOH, рН8,3 протягом шоку відповідно до описаного раніше методу 5год. при 37°С. І, нарешті, смугу гелю фарбували і (Ames і ін.). (2). знебарвлювали за допомогою стандартної систеКількісний імуноаналіз отриманої рекомбінантми для фарбування гелів на основі кумассі брильним шляхом молекули K2S. Для виявлення r-K2S янтового блакитного (R-250). Область, у якій була тверду фазу сенсибілізували моноклональним локалізована ферментативна активність, яка власантитілом до «кренделеподібного» домену 2 (16/В) тива пептиду, не фарбувалася барвником на про(люб'язно наданим Др. Ute Zacharias, Central тивагу пофарбованому в блакитний колір фону. Institute of Molecular Biology, Бух, Німеччина). ЗдійРезультати снювали відмивання і блокування відповідно до Конструювання вектора, який несе ген K2S. З стандартного методу ELISA. У кожну лунку, сенсивектора р51-3 ампліфікували «кренделеподібний» білізовану антитілом до «кренделеподібного» додомен 2 плюс домен серінової протеази tPA (від мену 2, додавали по 50мкл 10КУО/мл К28-ф або Ser174 у «кренделеподібному» домені 2 до Pro527 у секреторного r-K2S. Оцінку комплексу антигенсері новій протеазі) за допомогою праймерів антитіло здійснювали відповідно до описаного SK2/174 і ASSP. Отриманий у результаті ампліфінижче процесу. У кожну реакційну лунку після стакації продукт довжиною 1110 пар основ виявляли дії відмивання додавали або овече антитіло до за допомогою електрофорезу в агарозному гелі М13, кон'юговане з пероксидазою із хрону (HRP) (Фіг.1, смуга 2) і вбудовували у фагмідний вектор (фірма Pharmacia Biotech, Упсала, Швеція), або pComb3HSS з використанням двох сайтів розщеповече антитіло до tPA, кон'юговане з HRP (фірма лення Sfil на 5'- і 3'-кінцях у правильній рамці зчиCedarlane, Онтаріо, Канада). У кожну лунку вноситування. У такий спосіб одержували новий вектор ли субстрат ТМБ (тетраметилбензидин) і, нарешті, pComb3H-K2S, який несе K2S. У цьому векторі ген після інкубації протягом 30хв. реакцію припиняли, K2S фланкований проти ходу транскрипції сигнадодаючи розчин H2SO4. Як позитивний контроль льною послідовністю ОmрА і по ходу транскрипції використовували стандартний отриманий з мелагеном gp3. Правильність вставки K2S підтверджуноми tPA 86/670 (National Institute for Biological вали рестрикційним аналізом з використанням Sfil Standards і Control, Хертфордшин, Великобрита(Фіг.2, смуга 3), ПЛР-аналізом (продемонстрована нія). наявність однієї смуги, що відповідає 1110 парам Аналіз амідолітичної активності. Для оцінки основ) і секвенуванням ДНК. Схематична діаграма амідолітичної активності tPA використовували накарти pComb3H-K2S приведена на Фіг.3. бір, який поставляється фірмою Chromogenix (МоМолекула r-K2S, яка виявляється за допомолндал, Швеція). Для визначення ферментативної гою фага. Для зараження трансформованого активності сері нової протеази як субстрат викориpComb3H-K2S штами Е. coli XL-1 Blue, X[K2S] вистовували суміш, яка містить плазміноген і S-2251. користовували нитчастий фаг VCSM13. VCSM13 Активність кожного осадженого амонієм і розведерозмножували і вбудовували в нього злитий протеного в 100 разів зразка оцінювали з додаванням у їн K2S-gp3 під час процесу упакування вірусу. Зібякості стимулятора фрагментів людського фібрираний рекомбінантний фаг (К28-ф) мав концентногену або без стимулятора. Аналіз виконували рацію 5,4 10КУО/мл, яку визначали шляхом відповідно до керівництва COASET t-PA. повторного зараження штаму Е. coli XL-1 Blue осаДСН-ПААГ і імуноблоттінг. Підданий діалізу дженими за допомогою ПЕГ фагами. У цих рекомосаджений із супернатанту культури продукт додабінантних фагових частках за допомогою сендвічтково концентрували в 10 разів за допомогою ELISA підтверджували наявність експресії r-K2S. центрикону 10 (фірма AMICON, Беверлі, штат МіЗв'язаний з фагом гетерологічний протеїн K2S несота). Протеїни сконцентрованого зразка роздівиявляли за допомогою моноклонального антитіла ляли за допомогою ДСН-ПААГ, з використанням до «кренделеподібного» домену 2 (16/В), з вико 21 75102 22 ристанням у якості системи для виявлення овече ген перетворюється в плазмін. Отриманий плазмін антитіло до tPA, кон'юговане з HRP. У цьому анадалі розщеплює субстрат S-2251 з утворенням лізі коефіцієнт абсорбції склав 1,12±0,03 (таблиця пофарбованого продукту, пара-нітроаніліну, який 1). Кількість K2S, виявленого на 10 у 12 ступені має максимум абсорбції при 405нм. Питома активфагових частинках, відповідало 336нг протешу при ність рекомбінантного продукту корелює з коефіціперерахуванні на стандартний отриманий з мелаєнтом абсорбції. Оцінювали і порівнювали залежноми tРА. Для підтвердження того, що злитий прону від фібриногену ферментативну активність теїн K2S-gp3 зв'язаний з фаговими частками, овекожного зразка, тобто К2Б-Ф, периплазматичного че антитіло до tPA, кон'юговане з HRP, заміняли r-K2S або виділеного із супернатанту культури rовечим антитілом до М13, кон'югованим з HRP. K2S. Для обох таких зразків, як К2Б-ф і периплазДля цієї імунологічної реакції коефіцієнт абсорбції матичний r-K2S, виявлений дуже низький рівень складав 1,89±0,07 (таблиця 1). На відміну від цьоферментативної активності, який виявився нижче го, якщо імобілізоване антитіло являло собою оверівня чутливості методу (0,25од./мл). Виділений із че антитіло до М13, то був виявлений дуже низьсупернатанту культури r-K2S мав залежну від фібкий рівень K2S при використанні овечого антитіла риногену ферментативну активність, яка складає до tPA, кон'югованого з HRP; коефіцієнт абсорбції 7од./мл. Таким чином, з 100мл культури одержускладав тільки 0,17±0,01 (таблиця 1). Це дозволяє вали всього 700од. ферментативної активності. припустити наявність лише невеликої кількості Без фібриногену ніякої ферментативної активності очищених фагових частинок, які несуть злитий r-K2S, очищеного із супернатанту культури, не протеїн K2S-gp3. Як негативний контроль викорисбуло виявлено, у той час як стандартний отриматовували VCSM13, отриманий з нетрансформований з меланоми tPA мав деяку активність. ного штаму XL-1 Blue. Демонстрація наявності рекомбінантного проКонструкція MpComb3H-K2S. Стоп-кодон потеїну за допомогою імуноблоттінгу. З використанміщали між K2S і gp3 у pComb3H-K2S за допомоням овечих антитіл до tPA встановлено, що молегою мутагенних праймерів (MSTPA і MASTPA) кулярна маса частково очищеного K2S, (Фіг.4). Для підвищення кількості знову синтезоваотриманого із супернатанту XM[K2S], складає ного і мутантного MpComb3H-K2S, суміш для цик39кДа (Фіг.6). Негативний контроль, тобто частково лічної ампліфікації навмисно розщеплювали за очищений супернатант культури не трансформодопомогою Dpnl з метою розщеплення старої damваного штаму XL-1 Blue, не мав ніякої реактивної метильованої матриці pComb3H-K2S (Dpnl має смуги, яка відповідає зазначеному розміру. специфічність у відношенні dam-метильованої Локалізація активного ферменту за допомогою ДНК). Після трансформації штаму Е. coli XL-1 Blue ПААГ. Плазміноген піддавали сополімеризації та за допомогою MpComb3H-K2S для подальших імобілізовували за допомогою желатину в поліакдосліджень був обраний трансформант XM[K2S]. У риламідному гелі до здійснення електрофорезу. результаті заміни пар основ один із сайтів розщеАналізували осаджені амонієм супернатанти кульплення Sfil, який прилягає до 3'-кінця гена K2S, був тур штаму Е. coli XL-1 Blue, штаму Е. соlі XL-1 видалений після сайтспрямованого мутагенезу. Blue, трансформованого pComb3HSS та XM[K2S] Була виявлена лінійна версія довжиною 4319 пар (Фіг.7). Всі зразки розганяли в умовах, що невіднооснов розщепленого за допомогою Sfil влюють, для збереження правильної конформації MpComb3H-K2S, у якій не виявлений вбудований та активності домену серінової протеази. Прозорі фрагмент гена K2S (Фіг.5, смуга 3). Таким чином, області, отримані в результаті розщеплення плазген K2S, який кодується MpComb3H-K2S, експреміногену серіновою протеазою, були виявлені сувався у XM[K2S] у не злитій з gp3 формі. тільки в осаджених амонієм супернатантах культуЕкспресія й очищення K2S. Експресію K2S у ри XM[K2S] у положеннях, які відповідають 34 і XM[K2S] індукували за допомогою ІПТГ. За допо37кДа. При використанні інших зразків не виявлемогою ELISA r-K2S був виявлений як у периплазно очищених зон. На відповідній позитивному конматичному просторі, так і в супернатанті культури. тролю смузі стандартного отриманого з меланоми Кількість гетерологічного протеїну визначали в tPA також продемонстрована ферментативна аккожному препараті за допомогою сендвіч-ELISA і тивність у положеннях, які відповідають 66 і 72кДа. зіставляли зі стандартним tРА. З 100мл бактеріаПосилання льної культури в колбах, які струшуються, при ОГ 1. Alien S., Η.Υ.Nairn та N.J.Bulleid. 1995. [600нм], що дорівнює 50, у периплазматичній фраIntracellular folding of tissue-type plasminogen кції виявлено 1,38мкг r-K2S (приблизно 32%), у той activator. Effects of disulfide bond formation on Nчас як в осадженому амонієм супернатанті культуlinked glycosylation та secretion. J.Biol. Chem. ри виявлено 2,96мкг г-K2S (приблизно 68%). Ме270:4797-4804. тод сендвіч-ELISA застосовували для оцінки оса2. Ames G.F., С.Prody та S.Kustu. 1984. Simple, дженого ПЕГ фага із зараженого VCSM13 rapid, та quantitative release ofperiplasmic proteins XM[K2S]. Ніякого r-K2S, імобілізованого за допомоby chloroform. J. Bacteriol. 160:1181-1183. гою моноклонального антитіла до «кренделеподі3. S. Barbas С.F. Ill, A.S.Kang, R.A.Lerner та бного» домену 2, не було виявлено при виявленні S.J.Benkovic. 1991. Assembly of combinatorial за допомогою антитіла до М13, кон'югованого з antibody libraries on phage surfaces: the gene III site. HRP, ці результати свідчать про те, що K2S не був Proc. Natl. Acad. Sci. U. S. A. 88:7978-7982. присутній на фагових частинках, у тому випадку, 4. Barbas C.F. Ill та J.Wagner. 1995. Synthetic якщо був відсутній gp3. human antibodies: selecting and evolving functional Оцінка амідолітичної активності. Якщо в зразку proteins. A. Companion to Methods in Enzymology присутній домен серінової протеази, то плазміно8:94-103. 23 75102 24 5. Bennett W.F., N.F.Paoni, B.A.Keyt, D.Botstein, The tissue-type plasminogen activator inhibitor ETIa A.J.Jones, L.Presta, F.M.Wurm та Μ.J.Zoller. 1991. from Erythrina variegata: structural basis for the High resolution analysis of functional determinants on inhibitory activity by cloning, expression and human tissue-type plasminogen activator. J. Biol mutagenesis of the cDNA encoding ETIa. J. Biochem. Chem. 266:5191-5201. (Tokyo) 121:456-463. 6. Betton J.M., N.Sassoon, M.Hofnung, та 20. Lasters I., N.Van Herzeele, H.R.Lijnen, М.Laurent. 1998. Degradation versus aggregation of D.Collen та L.Jespers. 1997. Enzymatic properties misfolded maltose-binding protein in the periplasm of ofphage-displayed fragments of human plasminogen. Escherichia coli. J.Biol. Chem. 273:8897-8902. Eur. J.Biochem. 244:946-952. 7. Camiolo S.M., S.Thorsen та Т.Astrup. 1971. 21. Lobel L.I., P.Rausch, I.Trakht, S.Pollak та J. Fibrinogenolysis and fibrinolysis with tissue W. Lustbader. 1997. Filamentous phage displaying plasminogen activator, urokinase, streptokinasethe extracellular domain of the hLH/CG receptor bind activated human globulin and plasmin. Proc. Soc. hCG specifically. Endocrinology. 138:1232-1239. Exp. Biol. Med. 38:277-280. 22. Lubiniecki Α., R.Arathoon, G.Polastri, 8. Cartwright T, 1992. Production oft-PA from J.Thomas, M.Wiebe, R.Garnick, A.Jones, R. van Reis animal cell culture, с.217-245. В R.Ε.Spier та та S. Builder. Selected strategies for manufacture and J.В.Griffiths (ред.), Animal Cell Biotechnology, том 5. control of recombinant tissue plasminogen activator Academic Press, N.Y. prepared from cell culture, с.442-451. В R.Ε.Spier, 9. Curry ΚΑ., A.W.Yem, Μ.R.Deibel, Jr., J.B.Griffiths, J.Stephenne та P.J.Crooy (ред.). N.T.Hatzenbuhler, J.G.Hoogerheide та С.S.Tomich. Advances in animal cell biology and technology for 1990. Escherichia coli expression and processing of bioprocesses. Butterworths, London. human interleukin-1 beta fused to signal peptides. 23. Lucic M.R., B.E.Forbes, S.E.Grosvenor, J.M. DNA Cell Biol. 9:167-175. Carr, J.С.Wallace та G.Forsberg. 1998. Secretion in 10. Datar R. V., T. Cartwright та C.-G. Rosen. Escherichia coli and phage-display of recombinant 1993. Process economics of animal cell and bacterial insulin-like growth factor binding protein-2. J. fermentations: a case study analysis of tissue Biotechnol. 61:95-108. plasminogen activator. Biotechnology 11:349-357. 24. Martin U., S.Fischer, U.Kohnert, H.Lill, 11. Denefle P., S.Kovarik, T.Ciora, N.Gosselet, R.Rudolph, G.Sponer, A.Stern та К.Strein. 1990. J.С.Benichou, M.Latta, F.Guinet, A.Ryter та Properties of a novel plasminogen activator (BM J.F.Mayaux. 1989. Heterologous protein export in 06.022) produced in Escherichia coli. Z. Kardiol. Escherichia coli: influence of bacterial signal peptides 79:167-170. on the export of human interleukin 1 beta. Gene 25. Obukowicz M.G., M.E.Gustafson, K.D.Junger, 85:499-510. R.M.Leimgruber, A.J.Wittwer, Т.С.Wun, T.G.Warren, 12. Griffiths J. В., A. Electricwala. 1987. B.F.Bishop, K.J.Mathis, D.T.McPherson, N.R.Siegel, Production of tissue plasminogen activators from M.G.Jenning, В.В.Brightwell, J.A.Diaz-Cllier, L.D.Bell, animal cells. Adv. Biochem. Eng. Biotechnol. 34:147C.S.Craik та W.С.Tacon. 1990. Secretion of active 166. kringle-2-serine protease in Escherichia coli. 13. Harris T.J., T.Patel, F.A.Marston, S.Little, Biochemistry 29:9737-9745. J.S.Emtage, G.Opdenakker, G.Volckaert , 26. Parmley S.F. та G.P.Smith. 1988. AntibodyW.Rombauts , A.Billiau та Р.De Somer. 1986. selectable filamentous fd phage vectors: affinity Cloning of cDNA coding for human tissue-type purification of target genes. Gene 73:305-318. plasminogen activator and its экспрессия in 27. Pennica D., W.E.Holmes, W.J.Kohr, Escherichia coli. Моl. Biol. Med. 3:279-292. R.N.Harkins, G.A.Vehar, С.A.Ward, W.F.Bennett, 14. Heussen С, та Ε.Β.Dowdle. 1980. E.Yelverton, P.H.Seeburg, H.I.Heyneker, Electrophoretic analysis of plasminogen activators in D.V.Goeddel та D.Collen. 1983. Cloning and polyacrylamide gels containing sodium dodecyi expression of human tissue-type plasminogen sulfate and copolymerized substrates. Anal. Biochem. activator cDNA in E. coli. Nature 301:214-221. 102:196-202. 28. Rippmann J.F., M.Klein, С.Hoischen, 15. Heussen C, F. Joubert та Ε. Β. Dowdle. B.Brocks, W.J.Rettig, J.Gumpert, K.Pfizenmaier, 1984. Purification of human tissue plasminogen R.Mattes та D.Moosmayer. 1998. Procaryotic экспactivator with Erythrina trypsin inhibitor. J. Biol. Chem. рессия of single- chain variable-fragment (scFv) 259:11635-11638. antibodies: secretion in L-form cells of Proteus 16. Ни С.К., U.Kohnert, О.Wilhelm, S.Fischer та mirabilis leads to active product та overcomes the М. Llinas. 1994. Tissue- type plasminogen activator limitations ofperiplasmic expression in Escherichia domain-deletion mutant BM 06.022: modular stability, coli. Appl. Environ. Microbiol. 64:4862-4869. inhibitor binding, and activation cleavage. 29. Saito Y., Y.Ishii, H.Sasaki, M.Hayashi, Biochemistry 33:11760-11766. T.Fujimura, Y.Imai, S.Nakamura,. S.Suzuki, J. Notani, 17. Kipriyanov S.M., G.Moldenhauer та М.Little. T.Asada, H.Horiai, K.Masakazu та N.Mineo. 1994. 1997. High level production of soluble single chain Production and characterization of a novel tissue-type antibodies in small-scale Escherichia coli cultures. J. plasminogen activator derivative in Escherichia coli. Immunol. Methods 200:69-77. Biotechnol. Prog. 10:472-479. 18. Ко J.H., D.K.Park, I.C.Kirn, S.H.Lee та 30. Sarmientos P., M.Duchesne, P.Denefle, S.M.Byun. 1995. High-level expression and secretion J.Boiziau, N.Fromage, N.Delporte, F.Parker, of streptokinase in Excherichia coli. Biotechnol. Lett. Y.Leiievre, J.-F.Mayaux та Т.Cartwright. 1989. 17:1019-1024. Synthesis and purification of active human tissue 19. Kouzuma Y., N.Yamasaki та М.Kimura. 1997. plasminogen activator from Escherichia coli. 25 75102 26 Biotechnology 7:495-501. MpComb3H-K2S. В області, яка відповідає 1110 31. Scherrer S., N.Robas, H.Zouheiry, G. ranlant парам основ, не вдалося візуалізувати вбудований та С. Branlant. 1994. Periplasmic aggregation limits ген K2S. Ряд 1 відповідає маркеру розміром 1т.п.н. the proteolytic maturation of the Escherichia coli Ряд 2 відповідає нерозщепленому вектору penicillin G amidase precursor polypeptide. Appl. MpComb3H-K2S. Електрофорез здійснювали в 1%Microbiol. Biotechnol. 42:85-89. вому агарозному гелі; 32. Soeda S., M.Kakiki, H.Shimeno та на Фіг.6 - ідентифікація імунологічно реактивA.Nagamatsu. 1986. Rapid and high-yield purification ної смуги, яка відповідає виведеному з рекомбінаof porcine heart tissue-type plasminogen activator by нтної ДНК протеїну, отриманому із супернатанта heparin-sepharose choromatography. Life Sci. культури XM[K2S], за допомогою овечого антитіла 39:1317-1324. до tPA, кон'югованого з HRP. У ряд 1 вносили 40нг 33. Szarka S.J., E.G.Sihota, H.R.Habibi. та S.стандартного отриманого з меланоми tPA (86/670), L.Wong. 1999. Staphylokinase as a plasminogen для якого виявлена реактивна смуга, яка відповіactivator component in recombinant fusion proteins. дає 70кДа. У ряд 2 та 3 відповідно вносили очиAppl. Environ. Microbiol. 65:506-513. щені і сконцентровані супернатанти культур не34. Waldenstrom M., E. Holmgren, A. Attersand, трансформованих штамів Е. coli XL-1 Blue та C.Kalderen, B.Lowenadler, B.Raden, L.Hansson та XM[K2S]. Індивідуальна реактивна смуга, що відG.Pohl. 1991. Synthesis and secretion of a повідає 39кДа, особливо добре видна в ряді 3; fibrinolytically active tissue-type plasminogen на Фіг.7 - визначення молекулярної маси позаactivator variant in Escherichia coli. Gene 99:243клітинного r-K2S, який несе активний домен сері248. нової протеази, шляхом електрофорезу у поліак35. Wan E. W.-M. та F.Baneyx. 1998. TolAIII Сориламідному гелі сополїмеризованого оуегэкспрессия Facilitates the Recovery плазміногену. У ряд 1 внесені стандарти молекуofPeriplasmic Recombinant Proteins into the Growth лярної маси (510' ), ДСН-6Н (фірма Sigma, Сент Medium of Escherichia coli. Protein Expr. Purif 14:13Луїс, штат Міссурі). У ряди 2, 3 та 4 відповідно 22. вносили по 50мкг осадженого насиченим 55%-вим 36. Zacharias U., B.Fischer, F.Noll та Н.Will. розчином сульфату амонію супернатанту культури 1992. Characterization of human tissue-type ΧL-1 Blue, XI-1 Blue, трансформованого plasminogen activator with monoclonal antibodies: pComb3HSS, і XM[K2S]. У смугу 5 вносили 5 мед. mapping of epitopes and binding sites for fibrin and стандартного отриманого з мієломи tPA (86/670). lysine. Thromb. Haemost. 67:88-94. Прозорі зони розщепленого плазміногену в поліакНа кресленнях показано: риламідному гелі виявлені тільки в ряді 4 в обласна Фіг.1 - підтвердження характеристик продутях, які відповідають молекулярним масам 34 та кту ПЛР-ампліфікації гена K2S з вектора р51-3 за 37кДа (Б) і в ряді 5 в області, яка відповідає моледопомогою праймерів SK2/174 і ASSP. Ряд 1 відкулярним масам 66 та 72кДа (А); повідає маркеру розміром 1т.п.н. (фірма Roche на Фіг.8 - структура A (SEQ ID NO:11) Нативна Molecular Biochemicals, Індіанаполіс, штат Іллімолекула K2S від амінокислоти 174 до 527 без нойс). Ряд 2 відповідає продукту ампліфікації, внемодифікації; сеному в кількості 1мкл. Позначено індивідуальну на Фіг.9 - структура В-0 (SEQ ID NO:12) Нативсмугу, яка відповідає 1110 парам основ. Електрона молекула K2S від амінокислоти 197 до 527 без форез здійснювали у 1%-вому агарозному гелі; модифікації; на Фіг.2 - ряд 1 відповідає вбудованому гену на Фіг.10 - структура Б-1 (SEQ ID NO:13) МоK2S на смузі, яка відповідає 1110 парам основ (*), лекула K2S від амінокислоти 193 до 527, де до після розщеплення за допомогою Sfil вектора структури В-0, приведеної на Фіг.9, до N-кінцевої pComb3H-K2S. Ряд 1 відповідає маркеру розміром області додані амінокислоти SEGN; 1т.п.н. Ряд 2 відповідає нерозщепленому вектору на Фіг.11 - структура Б-2 (SEQ ID NO:14) МоpComb3H-K2S. Електрофорез здійснювали в 1%лекула K2S від амінокислоти 193 до 527, яка відвому агарозному гелі; повідає молекулі, приведеній на Фіг.10, де Cys-261 на Фіг.3. - схематичне зображення pComb3Hзамінений на Ser; K2S із вказівкою двох сайтів клонування Sfil, у які на Фіг.12 - структура Б-3 (SEQ ID NO:15) Мовбудовували ген K2S. Також позначені сигнальна лекула K2S від амінокислоти 191 до 527, де до послідовність (ОтрА), сайт зв'язування рибосоми структури В-0, приведеної на Фіг.9, до N-кінцевої (RIBS), промотор lac і ген gpIII; області додані амінокислоти SEGNSD; на Фіг.4. - схематична діаграма сайта мутації на Фіг.13 - структура Б-4 (SEQ ID NO:16) Мона стику між генами K2S і gpIII у векторі pComb3Hлекула K2S від амінокислоти 191 до 527, яка відK2S. Сайтренатурації pComb3H-K2S зв'язували з повідає молекулі, приведеній на Фіг.12, де Cys-261 набором праймерів для мутації (MSTPA і замінений на Ser; MASTPA), яки містили модифіковані олігонуклеона Фіг.14 - структура В (SEQ ID NO:17) Нативзиди (підкреслені). Після здійснення циклу ампліна молекула K2S від амінокислоти 220 до 527 без фікації сайт 1 Sfil (виділений жирним шрифтом) модифікації. Цю молекулу можна додатково момодифікували і видаляли зі знову синтезованого дифікувати аналогічно тому, як описано для струкланцюга; тури Б на Фіг.10-13; на Фіг.5. - характеристика знову синтезованого на Фіг.15 - структура D (SEQ ID NO:18) Нативвектора МрСоmb3Н-K2S за допомогою рестриктана молекула K2S від амінокислоти 260 до 527 без зи Sfil. Ряд 3 відповідає смузі розміром 4319 пар модифікації. Цю молекулу можна додатково мооснов, яка відповідає одному сайту розщеплення дифікувати аналогічно тому, як описано для 27 75102 структури Б на Фіг.10-13;на Фіг.16 - молекула tPA (SEQ ID NO:19). 28 Таблиця 1 Виявлення молекули r-K2S у препараті фага за допомогою сенвіч- ELISA Імобілізоване антитіло Антитіло до «кренделеподібного» домену 2б Антитіло до Μ13 Антитіло-мітка (кон'юговане з HRP) Антитіло до tPA Антитіло до М13 К28-ф VCSMISa К28-ф VCSM13 1,12±0,04в 0,12±0,03 1,89±0,02 0,16±0,02 0,17±0,01 0,14±0,05 1,91±0,02 1,88±0,03 а VCSM13 одержували зі штаму XL-1 Blue, трансформованого pComb3HSS. Застосовували мишаче моноклональне антитіло до «кренделеподібного» домену 2 (16/В). Інші антитіла одержували із овечого імуноглобуліну. в Данні є середніми величинами абсорбції кожного зразку, яки одержували шляхом трьох повторів. б Перелік послідовностей 29 75102 Продовження переліку послідовностей 30 31 75102 Продовження переліку послідовностей 32 33 75102 Продовження переліку послідовностей 34 35 75102 Продовження переліку послідовностей 36 37 75102 Продовження переліку послідовностей 38 39 75102 40 41 Комп’ютерна верстка Т. Чепелева 75102 Підписне 42 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethods for the mass production of a recombinant dna-derived molecules of tpa or k2s
Назва патенту російськоюСпособы крупномасштабного производства из рекомбинантной днк молекулы tpa или k2s
МПК / Мітки
МПК: A61P 9/00, C12N 9/64, C12N 9/72, C12N 1/21, C12N 15/58, A61P 9/10, A61K 38/48, A61K 38/46, C12P 21/02, A61P 11/00, C12N 15/09, C07K 19/00
Мітки: способи, рекомбінантної, виробництва, днк, молекул, великомасштабного
Код посилання
<a href="https://ua.patents.su/21-75102-sposobi-velikomasshtabnogo-virobnictva-z-rekombinantno-dnk-molekul-tpa-abo-k2s.html" target="_blank" rel="follow" title="База патентів України">Способи великомасштабного виробництва з рекомбінантної днк молекул tpa або k2s</a>
Попередній патент: Спосіб товарного вирощування гігантської прісноводної креветки розенберга (macrobrachium rozenbergii)
Наступний патент: Рейкове стикове ізолююче з’єднання
Випадковий патент: Засіб для боротьби з колорадським жуком